Стратегии ограничения жидкости при лечении пациентов с сепсисом в ОИТ: ретроспективный причинно-следственный анализ
Shahn et al. Critical Care (2020) 24:62
Исследование
Стратегии ограничения жидкости при лечении пациентов с сепсисом в ОИТ: ретроспективный причинно-следственный анализ
Перевод оригинальной статьи «Fluid-limiting treatment strategies among sepsis patients in the ICU: a retrospective causal analysis»
Авторы: Zach Shahn, Nathan I. Shapiro, Patrick D. Tyler, Daniel Talmor, Li-wei H. Lehman
IBM Research, Yorktown Heights, NY, USA.
MIT-IBM Watson AI Lab, Cambridge, USA.
Department of Emergency Medicine, Beth Israel Deaconess Medical Center, Boston, MA, USA.
Department of Anesthesia, Critical Care and Pain Medicine, Beth Israel Deaconess Medical Center and Harvard Medical School, Boston, MA, USA.
Institute for Medical Engineering and Science, Massachusetts Institute of Technology, Cambridge, MA, USA.
Keywords: Sepsis, Intravenous fluids, Resuscitation, Causal inference, Intensive care medicine, Emergency medicine
Ключевые слова: сепсис, растворы для инфузий, интенсивная терапия, причинно-следственные связи
Введение
Сепсис остается основной причиной высокой заболеваемости и летальности в отделениях неотложной помощи (ED) и отделениях интенсивной терапии (ОИТ) [1, 2]. Одним из важнейших элементов лечения сепсиса является коррекция гиповолемии и аномалий перфузии для чего применяются инфузионные растворы и вазопрессоры. Однако оптимальные режимы дозирования и длительность проведения интенсивной инфузионной терапии у пациентов с сепсисом остаются неизвестными.
В настоящее время все еще продолжаются дискуссии среди клиницистов и проводятся исследования относительно того, какой стратегии введения жидкости, либеральной или ограничительной, следует придерживаться [3]. Важное исследование ранней целенаправленной терапии (EGDT), проведенное Rivers et al., привело нас в эру либерального введения жидкости [3], особенно после того, как последующие исследования показали улучшение выживаемости при сепсисе в больницах, где терапия при сепсисе проводилась на основании принципов EGDT [4–6]. Тем не менее, результаты многочисленных обсервационных исследований [7–13] и нескольких рандомизированных исследований (два в развивающихся странах, одно пилотное, неослепленное, исследование в Европе) [14–16], в которых оценивалась взаимосвязь между введением жидкости и летальностью, свидетельствуют о том, что введение большого объема жидкости может нести вред пациенту. Но эти результаты не могут помочь нам в определении адекватности проводимой терапии, поскольку в обсервационных исследованиях нет убедительного контроля за путаницей в результатах, а обобщению результатов рандомизированного исследования пациентов с сепсисом, что проведено в развитых странах, мешают некоторые препятствия [17].
Для лучшего понимания о влиянии различных стратегий интенсивной инфузионной терапии на результаты лечения пациентов, в настоящее время проводится многоцентровое рандомизированное исследование III фазы (исследование CLOVERS), вот только результаты этого исследования в течение нескольких лет не будут доступны [17, 18]. Мы полагаем, что причинно-следственный анализ большого набора данных наблюдений мог бы помочь при обсуждении решений об интенсивной инфузионной терапии, а также и в интерпретации результатов исследования CLOVERS тогда, когда они появятся. С этой целью мы провели ретроспективное когортное исследование пациентов ОИТ с сепсисом в третичном центре, в котором, для получения смешанных скорректированных оценок результатов летальности, которые могли бы возникнуть в результате введения различных ограничений на введение объема жидкости в первые 24 часа терапии в отделении интенсивной терапии, мы использовали методы причинно-следственной связи. Мы выдвинули гипотезу о том, что определенные ограничения на введение жидкости могут привести к снижению 30-дневной летальности для нашей популяции пациентов по сравнению с текущей практикой.
Методы
Селекция выборки
Данные были получены из Медицинского информационного центра интенсивной терапии III (MIMIC-III) [19]. База данных содержит записи о 38 597 взрослых пациентах, поступивших в отделения интенсивной терапии в the Beth Israel Deaconess Medical Center. База данных содержит подробную информацию о жизненно важных показателях, назначении лекарств, настройках аппарата искусственной вентиляции легких и другие подробные данные, которые обычно отсутствуют в ретроспективных наборах данных.
В это исследование были включены пациенты в возрасте > 18 лет с сепсисом, поступившие в ОИТ из ED в период между 2008 и 2012 годами (годы, когда начала провалится регистрация инфузионной терапии). Мы выбирали пациентов с сепсисом, применяя определение сепсиса и септического шока SEPSIS-3, которое включает в себя подозрение на инфекцию (определяемую как проведение посевов крови и введение антибиотиков), так и последовательную оценку недостаточности органов (SOFA) ≥ 2 [20]. Извлечение данных соответствовало первоначальному протоколу Sepsis-3 [20] и предварительному исследованию по выявлению когорты Sepsis-3 в MIMIC-III [21]. Пациенты с подозрением на инфекцию более чем через 24 ч после поступления в ОИТ были исключены, также, как и пациенты, которым не вводились антибиотики и не брались посевы крови [21]. Пациенты с вторичным (и более) поступлением в ОИТ были исключены, чтобы избежать повторных измерений.
Мы исключили пациентов, которые уже получали более 4 л внутривенных растворов до поступления в ОИТ, так как эти пациенты уже нарушили бы некоторые из наших стратегий лечения, представляющих интерес на исходном уровне. Мы исключили пациентов, которые в ED получили 0 л жидкости. Как упомянуто выше, в исследование были включены пациенты, переведенные из ED. Пациенты, переведенные в отделение интенсивной терапии из другой больницы или из операционной или больничной палаты, были исключены. Даты внебольничной смертности в MIMIC-III были получены из основной документации по смерти администрации социального обеспечения.
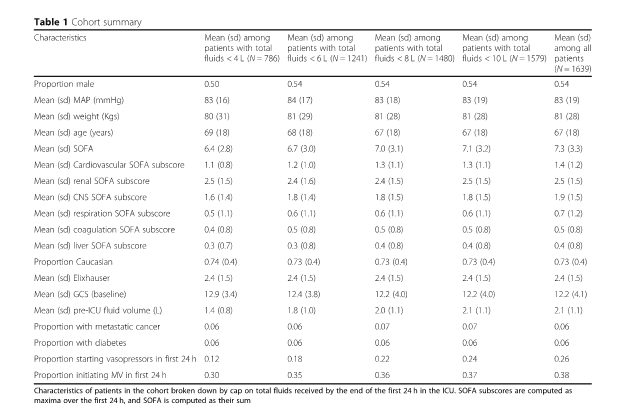
Мы извлекли следующие переменные из базы данных MIMIC для всех пациентов: исходная демографическая информация (возраст, пол, раса), детали терапии в ОИТ (непрерывный мониторинг показателей жизнедеятельности, баланс жидкости, тип вводимых жидкостей и лекарств, лабораторные показатели и респираторная поддержка), все дополнительные переменные, необходимые для расчета показателя SOFA, и компоненты индекса сопутствующей патологии Elixhauser (англ.the Elixhauser comorbidity index).
Общая стратегия анализа: эмуляция рандомизированного клинического исследования
Это было ретроспективное причинно следственное когортное исследование пациентов ОИТ с сепсисом в большом третичном центре. Целью причинно-следственного вывода обычно является эмуляция гипотетического (и не обязательно практического) рандомизированного контролируемого исследования (РКИ) с использованием данных наблюдений [22]. У гипотетического РКИ, которому мы стремились подражать в этом исследовании, есть много направлений терапии. В одном лечебном отделении РКИ врачам будет предписано оказывать «обычную помощь» или «текущую практику» и не вносить изменений в решения о виде терапии, которые они будут принимать, если они не участвуют в РКИ.
Терапия осуществлялась в соответствии с клиническими рекомендациями the Surviving Sepsis Campaign [23]. Тем не менее, поскольку данные рекомендации не являются строгими в отношении введения жидкости, на практике было много изменений. Каждое другое направление терапии будет соответствовать другому отсечению или ограничению общего объема жидкости, полученному к концу первых 24 ч после поступления в отделение интенсивной терапии и такие отсечения варьируются от 4 л до 12 л. Пациенты, случайно назначенные группу лечения, будут проходить лечение в соответствии с обычной практикой до тех пор, пока они не приблизятся ограничению объема в каждом отсечении, и в этот момент врачам будет запрещено назначать какие-либо дополнительные жидкости. Пример - когда пациент, назначенный, например, в группу с отсечением по объему жидкости 5 л, не будет превышать 5 л жидкости при обычном лечении, то его лечение не изменится из-за участия в РКИ.
«Базовым показателем» для нашего гипотетического РКИ является поступление пациента в ОИТ, а критерии включения и исключения описаны в разделе «Селекция выборки». Наше исследование оценивает 30-дневную летальность, которая наблюдалась бы в каждой группе этого гипотетического РКИ.
Нескорректированный наблюдаемый уровень летальности в когорте является непредвзятой оценкой уровня летальности, который наблюдался бы в обычном медицинском подразделении нашего идеального РКИ. Основная проблема оценки показателей летальности в других контрфактивных (англ.counterfactual) группах РКИ по данным наблюдений - это смешивание, то есть тенденция к тому, что пациенты получают различные количества жидкости, потому что у них были разные клинические характеристики или сопутствующие заболевания, которые были связаны с исходом. Поэтому наша цель состояла в том, чтобы получить, с поправкой на смешанные оценки коэффициенты смертности, результаты, которые могли бы наблюдаться в случае, когда в популяции было установлено ограничение объема жидкости между 4 и 12 л.
Смешанная скорректированная оценка уровня летальности
Мы подбираем динамическую маргинальную структурную модель (англ.dynamic Marginal Structural Model или dynMSM) для оценки наших причинных количеств, представляющих интерес [24, 25]. Мы учли путаницу, то есть учли тот факт, что пациенты, которые следуют различным стратегиям лечения, как правило, имеют разные характеристики из-за обратной вероятности взвешивания лечения [25–27]. Здесь мы даем краткое интуитивное описание метода, которое мы описываем более подробно в дополнительном файле 1. Оценка причинно-следственных эффектов и количественная оценка неопределенности выполняются в три этапа.
1 этап: отдельная оценка уровня летальности под каждым ограничением. Чтобы оценить контрфактическую летальность под определенным пределом объемом жидкости, мы берем средневзвешенную летальность среди пациентов, объемы жидкости которых фактически были ниже предела, взвешивая каждого пациента соответствующим образом, чтобы они представляли не только себя, но и всех аналогичных пациентов, которые превысили ограничение. Подходящее взвешивание требует прогнозной модели для вероятности оставаться ниже предела в каждый раз, учитывая историю пациентов. В этом случае вес каждого пациента является обратным произведением этих вероятностей на всех временных этапах. Мы использовали boosted trees model для генерации вероятностей [28].
2 этап: сгладить отдельные контрфакторные оценки уровня летальности. Получив отдельные оценки контрфактических показателей летальности в популяции, соответствующих диапазону пределов объема жидкости, мы теперь включаем предположение, что уровень летальности плавно изменяется как функция предела объема жидкости. Это позволяет нам «заимствовать силу» в оценках летальности при разных предельных значениях, тем самым повышать точность наших оценок для всех предельных значений. Мы указываем, что контрфактическая летальность, как функция ограничения объема, описывается функцией сплайн-регрессии. Детали оценки коэффициентов сплайна оставлены в дополнительном файле 1.
3 этап: количественная оценка неопределенности. Мы повторяем шаги 1 и 2 на 500 загрузочных выборках данных, чтобы получить доверительные интервалы для предполагаемого эффекта каждого ограничения. Мы получаем одновременный доверительный интервал для всех пределов в диапазоне, используя метод из Приложения C [29].
Для того, чтобы наши результаты имели причинно-следственную интерпретацию, важно, чтобы входной сигнал ковариатной истории в прогностическую модель на шаге 1 содержал все переменные, которые (1) являются важными факторами, влияющими на принятие решений о лечении, и (2) связаны с летальностью. Поскольку практически каждая переменная в нашем наборе данных связана с летальностью, наша цель при ковариационном отборе заключалась в том, чтобы включить все факторы лечения. Мы включили как базовые переменные, так и переменные, изменяющиеся во времени. Базовыми переменными были возраст, пол, этническая принадлежность, вес, индекс массы тела, сопутствующие заболевания Elixhauser и объем жидкости, вводимый до поступления в ОИТ. Изменяющиеся во времени переменные включали показатели жизнедеятельности, лабораторные показатели (тромбоциты, креатинин, лактат), объем жидкости, введенный в предыдущий час, общий объем жидкости за предыдущий час, объем мочи, шкала комы Глазго (GCS; как комбинированный балл, так и отдельные компоненты), баллы SOFA (комбинированный балл и отдельные компоненты), предполагаемая 30-дневная летальность (на основе прогностической модели boosted trees model, подходящей для переменных до лечения) и респираторные вмешательства (кислородная терапия, неинвазивная и инвазивная искусственная вентиляция легких).
Наш построенный набор данных содержал ряд для каждого часа после поступления каждого пациента. В каждый час регистрировалось самое последнее измерение каждой переменной, так как это значение, которое знает врач, может повлиять на решения о лечении. Для каждой переменной временные точки перед любыми измерениями были введены как «NA», чтобы указать «недоступно», также отражая знания врача об этих переменных в то время. В качестве входных данных «boosted trees model» принимают NAs и оценивают вероятности, обусловленные отсутствием. Ковариатные измерения, выполненные в тот же час, до и после лечебного воздействия (то есть сдвиг скорости введения жидкости), были перенесены на следующий час, чтобы не корректировать переменные после обработки.
Результаты
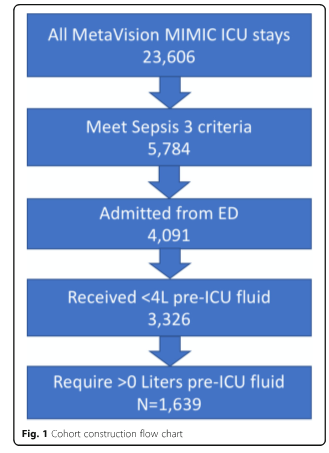
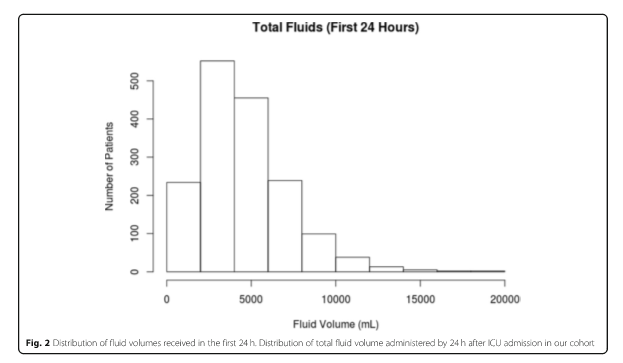
База данных MIMIC-III содержала 5784 взрослых пациента, соответствующих критериям SEPSIS-3 при поступлении в ОИТ в период между 2008 и 2012 годами [21]. Среди этих пациентов с сепсисом 4091 пациент поступил в ОРИТ из ED. Было 765 пациентов, которые были исключены из-за получения более 4 л жидкости для внутривенного вливания до поступления в ОИТ, и 1687 пациентов были зарегистрированы как получившие 0 л жидкости до поступления в ОИТ, также были исключены. Остальные 1639 пациентов, включенных в нашу когорту (см. Рис. 1), получали медиану внутривенно введенной жидкости в 3,5 л (межквартильный диапазон, 1,6–6,7); распределение объемов жидкости показано на рис. 2. Пациенты получали широкий спектр жидкостей для внутривенного вливания в течение первых 24 часов, в основном традиционные растворы кристаллоидов (0,9% хлорид натрия, лактат Рингера или их вариации). Характеристики популяции пациентов с разбивкой по объему жидкости приведены в таблице 1. Наблюдаемая летальность в нашей группе составила 17%.
Мы также сообщаем о предполагаемой летальности в диапазоне ограничений объема жидкости. Для каждого объема от 4 до 12 л (ось X) на рис. 3 показано оценочное влияние на 30-дневную летальность по сравнению с существующей практикой (ось Y), в которой общее количество жидкости в течение первых 24 ч после поступления в отделение интенсивной терапии было ограничено. Отрицательные значения на оси Y соответствуют снижению летальности. Предполагается, что ограничение между приблизительно 6 и 10 л снижает летальность приблизительно на 1%, а 30-дневная летальность в современной практике составляет приблизительно 17%. Предполагается, что объемы около 8 л снижают летальность больше всего (Таблица 2). Вредные эффекты наименее совместимы с данными объемов от 8 л до 10 л. Однако данные согласуются с незначительными величинами полезного эффекта даже в этом диапазоне.
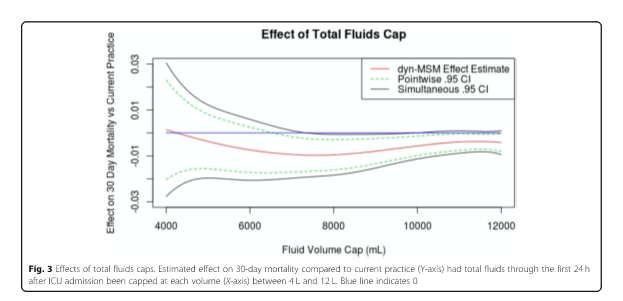
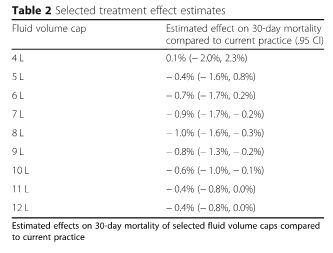
После 12 л вводимые объемы, по оценкам, практически не имеют никакого эффекта по сравнению с текущей практикой, что является естественным, учитывая тот факт, что немногие пациенты получали столько жидкости в текущей практике (см. гистограмму на рис. 1), и, следовательно, немногие пациенты имели бы лечение такими большими объемами. Эффекты от более низких объемов имеют более высокую связанную неопределенность, потому что относительно немного больных пациентов фактически лечились в соответствии с этим, делая более неопределенным вероятность того, что произойдет, при условии их наличия.
Обсуждение
В этом когортном исследовании причинно-следственных связей в большой базе данных интенсивной терапии мы обнаружили, что 30-дневная летальность, вероятно, снизилась бы относительно наблюдаемой летальности в современной практике в случае, если бы пациенты в нашей когорте подвергались «ограничениям» на общий объем жидкости, вводимой на конец первых 24 ч в ОИТ. В частности, мы обнаружили, что ограничение от 6 до 10 л приведет к наиболее выраженному снижению 30-дневной леталности, причем наибольшее снижение составит 8 л (- 1,0% летальности, 95% ДИ - 1,6–0,3%). Важная сила этого исследования по сравнению с прошлой работой заключалась в использовании методов причинно-следственного вывода для строгой адаптации к изменяющимся во времени данным наблюдений.
Как мы и предполагали, мы обнаружили положительный эффект от применения инфузионнных растворов на 30-дневную летальность. Мы полагаем, что это связано с вредными эффектами от чрезмерного введения жидкости при интенсивной терапии пациентов с сепсисом и наше исследование добавляет все больше доказательств того, что большой положительный баланс жидкости вреден. Потенциальные механизмы этого вреда включают в себя отек мягких тканей и органов, усугубляемый эндоваскулярной утечкой и все это приводит к дыхательной, сердечной и почечной недостаточности [32–34]. Кроме того, инфузионная терапия кристаллоидами может непосредственно повредить гликокаликс, что также может приводить к повреждению органов [35].
Наши результаты прелдоставляют дополнительные данные к ретроспективным исследованиям, что позволяет предположить о вреде больших положительных балансов жидкости [7–13]. Несколько авторов ретроспективно рассматривают связь между воздействием положительного баланса жидкости через 24 часа и летальностью. В ретроспективном анализе интенсивной инфузионной терапии у 325 пациентов с септическим шоком Micek et al. обнаружили, что у пациентов в самом высоком квартиле положительного баланса жидкости через 24 ч после распознавания шока была повышенная внутрибольничная летальность по сравнению с пациентами первого и второго квартилей [8].
Sadaka et al.[9] ретроспективно изучили 350 взрослых с септическим шоком и обнаружили, что у пациентов с положительным жидкостным балансом жидкости 6–12, 12–18 и 18–24 л в течение 24 часов была повышенная летальность по сравнению с пациентами с балансом менее 6 л. de Oliveira et al.[11] ретроспективно исследовали баланс жидкости между 24 и 48 часами после первого выявления дисфункции органов у пациентов с сепсисом в отделении интенсивной терапии и обнаружили, что баланс жидкости > 3 л был связан с повышенной госпитальной летальностью.
Несколько других исследований рассматривали немного другие воздействия или результаты, чем наше исследование. Boyd et al. [7] ретроспективно исследовали 12-часовой баланс жидкости (пациенты ОИТ с септическим шоком, n = 778) и обнаружили, что у людей в нижних квартилях баланса жидкости была более низкая летальность. Acheampong and Vincent ретроспективно исследовали воздействие баланса жидкости в первые 7 дней (пациенты отделения интенсивной терапии с сепсисом и, по крайней мере, недостаточностью одного из органов, n = 173) и обнаружили связь между увеличением баланса жидкости и летальностью [10]. Kelm et al. [12] ретроспективно оценивали признаки перегрузки жидкостью при обследовании в день 1-й день госпитализации (пациенты отделения интенсивной терапии с сепсисом и, по крайней мере, с недостаточностью одного из органов, n = 405) и обнаружили, что, по крайней мере, один признак перегрузки жидкостью был связан с повышенной внутрибольничной летальностью [12]. Наконец, Sakr et al. [13] проспективно исследовали связь между чистым балансом жидкости через 24 и 72 часа (пациенты отделения интенсивной терапии с сепсисом и, по крайней мере, с недостаточностью одного из органов, n = 1808) и обнаружили, что более высокий баланс жидкости через 72, но не через 24 часа был связан с повышением 28-ми дневной детальности [13].
Наше исследование основано использовании методов причинно-следственного вывода для явной оценки причинных эффектов стратегий лечения с ограничением жидкости. Все обсервационные исследования подвержены путанице благодаря рискам смещения. Наше исследование было менее восприимчивым к смещению, чем обсервационные исследования по введению жидкости по двум причинам. Во-первых, набор данных MIMIC, который мы использовали в нашем анализе, содержал детальные временные параметры по большому количеству клинических переменных, что позволило нам приспособиться к более смешанным переменным, чем в предыдущих исследованиях. Во-вторых, используя временную детализацию данных MIMIC, мы применили методы причинно-следственного вывода, которые надлежащим образом обрабатывали изменяющийся во времени характер проблемы. Даже там, где предыдущие ретроспективные исследования пытаются контролировать переменные, полученные от пациента, с помощью логистической регрессии [11, 12] или моделей пропорциональной опасности [7–10], эти методы контролируют только исходные факторы, а не факторы, которые развиваются по мере развития болезни в ОИТ.
Например, пациенты A и B с септическим шоком могут иметь похожие исходные характеристики, но на 12 час состояние пациента A могло улучшиться, в то время как состояние пациента B могло ухудшиться. Такое изменение в клиническом состоянии влияет на склонность к назначению этим пациентам дополнительные объемы жидкости между 12 и 24 часами, что также явно связано с летальностью. Используя методы, изложенные выше, мы учли такое изменяющееся во времени смешивание. Наличие факта, что наше исследование дает результаты, согласующиеся с предыдущими ретроспективными исследованиями относительно баланса жидкости, должно стимулировать дальнейший интерес к оценке в РКИ различных стратегий проведения интенсивной инфузионной терапии. В ожидании данных РКИ наше исследование предоставляет данные тщательного причинно-следственного анализа ретроспективных данных о том, что летальность снижается при сохранении уровня объема жидкости в 6-10 л, причем наибольшее снижение составляет около 8 л. Это в целом согласуется с объемами инфузии, полученных из других ретроспективных исследований, которые показывают относительно более низкую летальность.
Как и в любом другом наблюдательном исследовании, нет никакой гарантии, что нам удалось скорректировать все смешанные переменные. Тем не менее, мы считаем, что мы учли наиболее важные факторы, влияющие на принятие решений относительно введения жидкостей. Полезным является сравнение результатов нашего анализа с тем, что мы ожидаем увидеть, если не сможем приспособиться к препятствиям. Мы ожидаем, что незаметное смешивание приведет к монотонному снижению оценочных показателей летальности при снижении пределов объема жидкости, поскольку менее тяжелые пациенты, как правило, получают меньшие объемы жидкости. В самом деле, нескорректированный анализ показывает, что ограничение объема жидкости в 4 л приводит к значительному снижению летальности. Тем не менее, рис. 3 иллюстрирует, что наш скорректированный анализ оценил самую высокую летальность для наименьших ограничений объема жидкости, что является обнадеживающим (хотя и не окончательным) признаком того, что мы успешно приспособились к смешиванию.
Другие ограничения нашего исследования относятся к обобщаемости полученных нами результатов. Во-первых, это было исследование базы данных ОИТ одного центра и его следует повторить в многоцентровом исследовании. Во-вторых, для того, чтобы избежать предвзятости, нам пришлось исключить пациентов, у которых была нарушена любая из наших стратегий лечения, представляющих интерес (то есть тех, кто получил более 4 л жидкости) до поступления в ОИТ. Таким образом, наши результаты применимы только к популяции пациентов, которые поступают в ОИТ без получения больших объемов жидкости. Вполне возможно, что влияние ограничений для жидкости будет различным у пациентов, которых мы исключили из нашей когорты. В-третьих, з нашего основного анализа мы исключили пациентов с 0 л зарегистрированной жидкости до поступления ОИТ для того, чтобы предотвратить смещение, которое может быть вызвано отсутствием данных о жидкости до ОИТ в этой подгруппе. В качестве анализа чувствительности мы переделали анализ с включением этих пациентов и получили качественно аналогичные результаты (см. Приложение E Дополнительного файла 1). В-четвертых, в идеале мы хотели бы оценить стратегии, регулирующие лечение, начиная с сепсиса, но, поскольку у нас были только подробные данные, начиная с момента поступления в ОИТ, мы сосредоточились на принятии решения о лечении именно с этого момента. Мы снизили этот недостаток, ограничив нашу когорту пациентами, направленными из ED, что обеспечило то, что лечение не началось слишком задолго до поступления в ОИТ для большинства пациентов в нашей выборке. Наконец, наши данные были собраны с 2008 по 2012 год, и эффект от введения ограничений на введение жидкости мог бы со временем измениться, так как стратегии лечения за этот период развивались.
Мы также должны подчеркнуть, что наши результаты не обязательно являются оценками воздействия, которое наблюдалось бы, если бы в качестве руководящих указаний использовались ограничения для жидкости. Это связано с тем, что мы оценили эффект от внезапного прекращения введения жидкости тогда, когда врачи достигли порогового значения (диапазона) при проведении обычной медицинской помощи. Если руководство заблаговременно информировало врачей об ограничении жидкости, то они могли изменить свои стратегии лечения для достижения объема множеством способов (например, раньше начинать введение вазопрессоров, применять болюсы меньшего объема при поступлении, проводить инфузию с меньшей скоростью). Таким образом, хотя наши результаты, безусловно, свидетельствуют о преимуществах стратегий с ограничением применения жидкости, они не служат непосредственно конкретными рекомендациями.
Выводы
В этом когортном исследовании большой базы данных пациентов интенсивной терапии с использованием методов причинно-следственной связи мы обнаружили, что 30-дневная летальность, вероятно, снизилась бы относительно наблюдаемой летальности в современной практике тогда, когда этим пациентам применялись «ограничения» на общий объем вводимой жидкости между 6 и 10 л, с наибольшим снижением летальности при ограничении в 8 л. Будущие многоцентровые ретроспективные исследования, проспективные исследования и РКИ необходимы для дальнейшего уточнения соответствующей дозы и сроков внутривенного введения жидкостей у септических пациентов, которым проводится интенсивная инфузионная терапия.
Shahn et al. Critical Care (2020) 24:62