Array
(
[NAME] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
[~NAME] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
[PREVIEW_PICTURE] => Array
(
[ID] => 5464
[TIMESTAMP_X] => 20.12.2023 13:00:34
[MODULE_ID] => iblock
[HEIGHT] => 632
[WIDTH] => 1000
[FILE_SIZE] => 104394
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/0bf/mhs3d9p47km4b0inon0dmddrey8osxfi
[FILE_NAME] => close-up-people-wearing-lab-coats.jpg
[ORIGINAL_NAME] => close-up-people-wearing-lab-coats.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 45cd2485e3bcd158c7c9c454537071ba
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/0bf/mhs3d9p47km4b0inon0dmddrey8osxfi/close-up-people-wearing-lab-coats.jpg
[UNSAFE_SRC] => /upload/iblock/0bf/mhs3d9p47km4b0inon0dmddrey8osxfi/close-up-people-wearing-lab-coats.jpg
[SAFE_SRC] => /upload/iblock/0bf/mhs3d9p47km4b0inon0dmddrey8osxfi/close-up-people-wearing-lab-coats.jpg
[ALT] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
[TITLE] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
)
[~PREVIEW_PICTURE] => 5464
[DETAIL_TEXT] =>
Georgios Papathanakos , Ioannis Andrianopoulos , Menelaos Xenikakis , Athanasios Papathanasiou , Despoina Koulenti , Stijn Blot and Vasilios Koulouras
Clinical Sepsis Phenotypes in Critically Ill Patients
Microorganisms 2023, 11, 2165. doi.org/10.3390/ microorganisms11092165
Аннотация: Сепсис, определяемый как опасная для жизни нерегулируемая реакция организма на инфекцию, приводящая к органной дисфункции, считается одной из ведущих причин смертности во всем мире, особенно в отделениях интенсивной терапии (ОРИТ). Более того, сепсис остается загадочным клиническим синдромом со сложной патофизиологией, до конца не изученной и значительной гетерогенностью как с точки зрения клинического проявления, реакции пациентов на доступные в настоящее время методы лечения, так и с точки зрения результатов. Эта неоднородность оказывается основным препятствием в нашем стремлении обеспечить улучшение результатов лечение пациентов с сепсисом в критическом состоянии; таким образом, идентификация клинических фенотипов абсолютно необходима. Хотя это может показаться чрезвычайно сложной задачей, в настоящее время методы искусственного интеллекта и машинного обучения могут быть использованы для количественной оценки сходства между людьми в популяции сепсиса и дифференциации их по отдельным фенотипам в отношении не только температуры, гемодинамики или типа органной дисфункции, но и волемического статуса\реакции на инфузию, траектории пребывания в ОРИТ и исхода. Остается надеяться, что в конечном итоге нам удастся определить как подгруппу пациентов с сепсисом, которым будет полезно то или иное терапевтическое вмешательство, так и правильное время его проведения в ходе заболевания.
Ключевые слова: сепсис; неоднородность; фенотип; машинное обучение; прецизионная медицина
1. Введение
Древние греки использовали слово «сепсис» (ση´ψη) для описания гниения. Первоначально сепсис использовался для обозначения последствий процесса, а не причины [1]. Лишь в XIXвеке, когда были идентифицированы микроорганизмы как причина инфекции, термин «сепсис» стал использоваться для описания клинического заболевания, вызванного тяжелой инфекцией. В настоящее время сепсис определяют как опасную для жизни нерегулируемую реакцию организма на инфекцию, приводящую к дисфункции нескольких органов [2]. Несмотря на важные медицинские достижения, сепсис даже сейчас представляет собой серьезную проблему как для клиницистов, так и для исследователей, поскольку его лечение по-прежнему ограничивается антибиотиками, инфузионной терапией и поддержкой функции органов. Поскольку в течение многих лет новые методы лечения не были доступны сепсис продолжает оставаться основной причиной смертности во всем мире, затрагивая как страны, богатые ресурсами, так и страны с ограниченными ресурсами [3,4] и встречается во всех возрастных группах [5–11]. По оценкам недавнего исследования, в 2017 году сепсис возник у 48,9 миллионов человек во всем мире и стал причиной 11 миллионов смертей [12]. Поэтому ВОЗобъявила сепсис глобальным приоритетом здравоохранения [13].
В частности, в ОРИТ, сепсис также остается ведущей причиной смертности, независимо от того, вызван ли он внебольничными или внутрибольничными инфекциями [14–16]. Хотя общества интенсивной терапии разработали согласованные определения сепсиса и септического шока с целью гармонизации критериев диагностики, лечения и включения в клинические исследования, показатели смертности в различных исследованиях по-прежнему сильно различаются. Более конкретно, в метаанализе обсервационных исследований смертность от септического шока составила 46%; однако в двух важных клинических исследованиях пациентов с септическим шоком, проведенных почти в один и тот же период, смертность в контрольной группе была крайне контрастной: 18,8% против 80% [2,17–21]. С другой стороны, при систематическом анализе 65 рандомизированных контрольных исследований (РКИ) септического шока, опубликованных в период с 2006 по 2018 г., средняя смертность в контрольных группах составила 38,6% при очень широкой вариабельности (оценка 95%, интервалы прогнозирования 13,5-71,7%) [22]. Вышеизложенное можно, по крайней мере частично, объяснить значительной гетерогенностью клинических исследований.
Для того чтобы полученные результаты были воспроизводимы и могли быть экстраполированы, необходима единая феноменологическая структура в отношении диагностических критериев и критериев включения, набора случаев и характеристик пациентов. Однако в случае сепсиса это невозможно из-за значительной внутренней и внешней гетерогенности [23].
Если гетерогенную группу пациентов с сепсисом можно разделить на отдельные фенотипы, и эти фенотипы характеризуются дискретной патофизиологией, то они также могут различаться по реакции на терапию; следовательно, будущие исследования методов лечения сепсиса могут использовать определение фенотипов для стратификации пациентов с сепсисом в клинических испытаниях и разработки стратегий лечения, более точно ориентированных на конкретные фенотипы сепсиса. Основная цель этого обзора — предоставить обзор различных клинических фенотипов, существующих у пациентов с сепсисом в критическом состоянии. Описательный обзор был признан наиболее подходящим подходом. Поиск литературы проводился в библиографической базе данных PubMed с момента ее создания по май 2023 г.; поисковые термины, связанные с «фенотипированием сепсиса», были объединены с терминами, касающимися «реанимации и интенсивной терапии». Два автора осуществляли поиск в базе данных независимо. Третий рецензент урегулировал любые разногласия в результатах двух проверяющих. К включению подлежала рецензируемая опубликованная литература, в том числе описательные обзоры. Дополнительные статьи были включены на основе мнения экспертов. В итоге в обзор были включены исследования, опубликованные на английском языке, в которых использовались данные о фенотипировании сепсиса у больных в критическом состоянии..
2. Сепсис: очень гетерогенное заболевание
2.1 Причины неоднородности, специфичные для пациента
Сепсис не прогрессирует и не проявляется одинаково у всех пациентов из-за значительной гетерогенности между людьми, патофизиологических различий и иммунологических реакций [24,25].
Показательные, но не исключительные, причины гетерогенности включают специфические характеристики пациента, такие как возраст, пол, сопутствующие заболевания, ожирение, употребление алкоголя, курение, прием лекарств, состояние питания, источник инфекции, природа инфекционного агента и другие клинические и неклинические факторы, такие как нарушения, которые подавляют врожденный и адаптивный иммунитет, включая цирроз печени, рак и аутоиммунные заболевания, генетическую предрасположенность (например, полиморфизмы Toll-подобного рецептора 4), взаимодействия хозяина и патогена, реактивацию бессимптомных вирусных инфекций, основные механизмы острого заболевания, реакции иммунной системы, проводимое лечение и связанное со временем направление прогрессирования заболевания [25,26].
Эта гетерогенность оказывает существенное влияние на результаты клинических исследований. Например, это может произойти с клиническим испытанием, начатым для революционного препарата для лечения сепсиса или септического шока, вызванного грамотрицательным микробом; согласно строгому протоколу исследования, это лечение будет применяться только у пациентов в критическом состоянии, поступивших в ОРИТ в течение 4 часов после начала сепсиса/септического шока. Хотя вначале группа пациентов, которую нужно набрать, кажется очень специфичной, в конечном итоге в нее должны быть включены пациенты со значительными различиями в бесчисленных биологических характеристиках, которые могут скрыть потенциальную пользу нашего исследования. Например, одно дело лечить 19-летнюю девушку-спортсменку, которая двумя часами ранее поступила в отделение неотложной помощи с менингококковым сепсисом, и совсем другое дело лечить 80-летнего, прикованного к постели. мужчине с деменцией, постоянным мочевым катетером, бактериемией, вызванной Escherichiacoli, и аспирационной пневмонией, осложненной острым респираторным дистресс-синдромом (ОРДС), или 60-летнего мужчину с дивертикулитом и внутрибрюшным абсцессом, но без явной бактериемии.
2.2.Гетерогенность, связанная с клинической экспрессией
Несмотря на возросшую осведомленность и особое внимание к сепсису в последние десятилетия, среди врачей интенсивной терапии все еще существуют значительные различия в подходах к диагностике сепсиса. Даже сегодня сепсис в его полном проявлении не может быть определен с уверенностью, и если читателю это покажется странным, результаты исследования, проведенного несколько лет назад, подчеркивают эту неопределенность: пять случаев предполагаемой или подтвержденной инфекции и органной дисфункции были розданы выборка из 94 интенсивистов, практикующих в академических учреждениях; диагнозы, поставленные в каждом случае, имели очень широкую вариабельность, хотя врачи отделения интенсивной терапии обычно считаются специалистами, имеющими самый высокий опыт в диагностике и лечении сепсиса [27]. Сама идентификация септического пациента в полной клинической картине иногда оказывается трудной даже для опытного врача, поскольку даже лабораторные данные могут отсутствовать, и диагноз может основываться только на клинических ощущениях. Его особенности также искажаются сопутствующими заболеваниями, а дисфункция органов может быть неочевидной [28].
Ухудшение может быть постепенным и незаметным или внезапным. С другой стороны, ухудшение состояния пациента в 20% случаев можно ошибочно объяснить сепсисом. [29]. Кроме того, до сих пор не выявлено четкой связи между тяжестью сепсиса и количеством пораженных органов. Хотя оценка по шкале SOFA связана с тяжестью и прогнозом у пациентов с сепсисом [30], в клинических условиях отмечается большая гетерогенность типов пораженных органов. Например, пациент с сепсисом может быть гемодинамически нестабильным, и ему требуются два разных вазопрессора в сочетании с кортикостероидами, при этом шкала комы Глазго и функция почек остаются неизмененными, в то время как у других пациентов развивается тяжелое острое повреждение почек вместе с тяжелой неврологической дисфункцией, при стабильной гемодинамике. Что касается влияния возраста, сепсис поражает пожилых пациентов неодинаково, и у значительного процента из них уже может быть основная органная дисфункция. Что еще хуже, дисфункция органов может быть частично вызвана лечением сепсиса, а не самим сепсисом [29].
2.3. Определение сепсиса как причины гетерогенности
В 1970-е годы, несмотря на применение антибиотиков и эрадикацию возбудителя, больные сепсисом продолжали умирать. Это привело к гипотезе о том, что основной проблемой является не только патоген сам по себе, но, возможно, в большей степени, воспалительная реакция пациента, причем в последующие годы врачи решительно защищали такую точку зрения относительно патофизиологии сепсиса. В 1992 году сепсис был определен как клинический синдром при наличии как инфекции, так и синдрома системной воспалительной реакции (ССВО), определяемого по температуре, частоте сердечных сокращений, учащенному дыханию и количеству лейкоцитов в крови [17]. Эти критерии были настолько общими, что практически любой пациент с гастроэнтеритом или даже простудой в конечном итоге подпадал под определение сепсиса. Именно высокая смертность от сепсиса заставила научное сообщество действовать таким образом, чтобы врачам было легче заранее задуматься о сепсисе и своевременно поставить клинический диагноз. Однако низкая специфичность диагностических критериев ССВО привела к чрезвычайно большой популяции пациентов, соответствующих диагностическим критериям сепсиса, что вызвало огромные трудности как в клинической практике, так и в научных исследованиях. В 2001 г. последовало второе определение сепсиса, которое практически не отличалось от предыдущего, но в основном расширило перечень клинических и параклинических критериев и улучшило чувствительность за счет специфичности; к сожалению, ни один из критериев не был специфичен для сепсиса [18].
Как уже убедились многие врачи отделений интенсивной терапии в повседневной клинической практике, у многих тяжелобольных пациентов с SIRS нет сепсиса, а у некоторых септических пациентов нет SIRS.
Винсент и др. утверждал, что SIRS более чувствителен, но неспецифичен и что сепсис — это не просто реакция хозяина на инфекцию, но воспалительная реакция хозяина на инфекцию, приводящая к дисфункции органов, и подчеркнул, что реакция, которая преобладает в клиническом фенотипе, варьирует у разных пациентов и с течением времени у каждого пациента [31]. Хотя в 2016 г. последовало третье определение сепсиса (определение Sepsis-3), в котором подчеркивается, что сепсис - это угрожающая жизни дисфункция органов в результате дисрегулярного ответа хозяина на инфекцию, к сожалению, до сих пор очень сложно детально описать этот ответ, поскольку ни один из существующих клинических показателей не может точно определить, что подразумевается под дисрегулярным ответом хозяина, и, кроме того, предсуществующие заболевания, сопутствующие заболевания, лекарства или вмешательства могут изменять клинический и биологический фенотип сепсиса [2]. Более того, в медицинской литературе встречаются даже возражения и реакции на нынешнее определение сепсиса [32], поскольку определение «Сепсис-3» по-прежнему опирается на мнение клиницистов о наличии инфекции, а также о том, действительно ли наблюдаемая органная дисфункция является действительно развившейся вследствие инфекции [27].
2.4. Сепсис и прецизионная (или персонализированная) медицина
Именно эта неоднородность делает повседневную реальность сложной и проблематичной при работе с пациентами с сепсисом или септическим шоком. Ответ на вопрос, как эту большую разнородную группу пациентов с сепсисом можно разделить на более мелкие группы с различными клиническими характеристиками, может в то же время направить врачей отделения интенсивной терапии к «точной медицине», а для наиболее оптимистичных врачей — к «персонализированному» лечению. Хотя термины «прецизионная медицина» и «персонализированная (или индивидуализированная) медицина» часто используются как взаимозаменяемые, они не идентичны.
В центре внимания прецизионной медицины находится выявление подходов, которые, как ожидается, будут эффективны для конкретной группы пациентов на основе их общих характеристик. Конечной целью является возможность предложить индивидуальный уход для каждого человека (персонализированная медицина), но прогнозирование реакции на лечение на уровне отдельного пациента по-прежнему является довольно сложной задачей, поэтому в настоящее время усилия сосредоточены на медицине прецизионной [33]. Что определенно хорошо известно, так это то, что сепсис до сих пор остается загадочным клиническим синдромом со сложной патофизиологией, до конца не изученной, который может поражать практически все системы органов, приводя в конечном итоге к смерти у очень значительной части больных, хотя вовлеченные органы и степень поражения дисфункция может существенно различаться у разных пациентов [29,34]. Основная задача заключается не в определении того, получат ли большинство пациентов, которые соответствуют общим критериям сепсиса, какую-либо пользу от конкретной терапевтической стратегии, а в определении подгруппы пациентов, которая получит пользу, а также в правильном выборе времени использования того или иного метода лечения в процессе развития заболевания [1].
3. Больные сепсисом в отделениях интенсивной терапии.
Пациентов в критическом состоянии можно легко охарактеризовать как наиболее гетерогенную популяцию в больнице, с устойчивыми показателями мультиморбидности, как острой, так и рецидивирующей. Но у пациентов в критическом состоянии с сепсисом, поступивших в то же ОРИТ, вполне могут быть противоположные результаты, несмотря на продолжение соответствующего лечения [35].
За последние несколько лет появились новые рекомендации, которые требуют протокольного лечения пациентов с сепсисом и септическим шоком. Surviving Sepsis Campaign – современная инициатива Society of Critical Care Medicine (SCCM) и European Society of Intensive CareMedicine (ESICM), в настоящее время представляет собой наилучшее доступное доказательство эффективности лечения сепсиса, направленного на снижение смертности от сепсиса по всему миру. Однако высказывалась критика в отношении того, что не все пациенты должны получать одинаковое лечение и что не следует применять принцип «один размер подходит всем» [36–38].
Более того, как уже упоминалось, большинство рандомизированных контролируемых исследований фармакологической терапии по-прежнему не улучшают результаты. По этой причине лучшее определение закономерностей гетерогенности при сепсисе может стать первым шагом на пути к пониманию эффективности у различных групп пациентов ОРИТ использования доступных в настоящее время методов лечения. Хотя существование гетерогенности при сепсисе широко признано и ее наличие оказывает большое влияние на медицинскую литературу, до недавнего времени было проведено очень мало исследований, пытающихся сгруппировать ее характеристики. Таким образом, гетерогенность при сепсисе представляется непреодолимой проблемой для развития методов лечения пациента в критическом состоянии с сепсисом [23].
4. Фенотипирование сепсиса у пациентов ОРИТ
Что следует предпринять? Чтобы идентифицировать конкретные группы пациентов, которые могли бы ответить на конкретные вмешательства, идентификация клинических фенотипов абсолютно необходима [24]. Слово «феномен» происходит от греческой основы «φαι´νoμαι(феном)», глагола, означающего «появляться» или «казаться». Johannsen в своем определении «фенотип» в 1909 году описал его как характеристику типа внешности [39]. Хотя фенотип пациента представляет собой сумму всех выраженных характеристик, т. е. клиническое выражение, «фенотип» также может использоваться для описания траектории и исхода состояния или для клинического исследователя для описания набора представленных признаков, реализованных как критерии включения в экспериментальное исследование [40]. Кроме того, под сепсисом понимают процесс, но только до определенного момента. Например, какие гены участвуют в патогенезе сепсиса? Gregor Mendel, пионер современной генетики, начал с фенотипических признаков и закончил генами. Ответ на вопрос о том, как развивается сепсис у каждого отдельного пациента, требует решения фенотипических загадок, но фенотипы также могут быть решением для выбора лечения [41]. Связывая генную и фенотипическую экспрессию, потенциально можно открыть новые механизмы или терапевтические мишени для лечения сепсиса, а также различные биомаркеры для прогнозирования исхода у разных пациентов с сепсисом или даже для разных подклассов сепсиса, основанных на экспрессии генов, которые могут потребовать уникальных терапевтических подходов [42]. Учитывая все вышесказанное, идентификация различных фенотипов у пациентов с сепсисом кажется чрезвычайно сложной задачей, поскольку отсутствует эмпирические данные о том, как индивидуализировать лечение пациентов с сепсисом исключительно на основе клинических переменных.
5. Искусственный интеллект и машинное обучение
В последние годы искусственный интеллект и машинное обучение все чаще используются в медицине. Искусственный интеллект — это область, которая объединяет опыт из разных областей, включая алгоритмы, статистику, теорию информации и когнитивную науку, обучая компьютеры тому, как учиться и действовать разумно, используя данные и выполняя сложные задачи. Одной из отраслей искусственного интеллекта является машинное обучение; благодаря доступу к большим объемам данных и использованию алгоритмов машинное обучение имитирует работу человеческого мозга, постепенно и постоянно повышая точность [43]. Основная идея заключается в том, что неконтролируемые компьютеры учатся на собираемых ими данных, обычно на основе электронных медицинских записей, показателей жизнедеятельности и/или результатов лабораторных исследований, и распознают закономерности из больших наборов данных; доказано, что этот тип подхода превосходит традиционные аналитические и балльные модели [44]. Если искусственный интеллект рассматривать как мозг, то машинное обучение можно представить как способ завершения умственного процесса путем приобретения новых когнитивных способностей. Следовательно, алгоритм может быть создан на основе очень большого количества данных, что в конечном итоге приводит к созданию кластеров (или фенотипов).
Кластерный анализ — это тип неуправляемого машинного обучения , который был использован для исследования и выявления различных типов проявления заболеваний, включая рак и астму среди разных групп пациентов. В частности, кластерный анализ с использованием передовых математических алгоритмов, основанных на нескольких заданных переменных, может количественно оценить сходство между разными людьми в популяции пациентов. В конце концов, с помощью этого подхода могут быть созданы отдельные новые подгруппы, и эти новые подгруппы, которые не основаны на каких-либо априорных гипотезах, являются фенотипами [35,45]. Несмотря на эти многообещающие результаты, следует иметь в виду, что существуют некоторые ограничения, которые следует учитывать при использовании методов искусственного интеллекта. Например, оптимальное количество кластеров, которые можно получить из любого заданного набора данных, часто не может быть определено самим искусственным интеллектом. Кроме того, кластеры, полученные на основе наборов данных, определенных с использованием старых критериев сепсиса, могут значительно отличаться от тех, которые используются при использовании текущих критериев сепсиса. Более того, методы машинного обучения могут закреплять предвзятости, присутствующие в наборах обучающих данных; таким образом, полученные фенотипы должны быть подвергнуты внутренней и внешней оценке, а также должно быть применено клиническое правдоподобие. Если для внешней проверки не используется отдельная когорта, может быть трудно решить, являются ли данные кластеры «артефактами» или «настоящими», поскольку методы кластеризации могут находить потенциальные кластеры, даже если естественных кластеров не существует. Кроме того, может быть неясно, как согласовать различные наборы подгрупп пациентов, определенные с помощью методов машинного обучения и эмпирических подходов [46–50].
6. Температурное фенотипирование и корреляция с иммунологическим профилем
Основным отличительным клиническим признаком, используемым у пациентов с сепсисом, является температура. Хотя основным симптомом инфекции часто считают лихорадку, у некоторых больных (10–20%) при сепсисе сохраняется гипотермия. Начиная с 2016 года, было проведено более 10 исследований, которые показали, что гипотермия в контексте инфекции связана с увеличением смертности, тогда как лихорадка связана со снижением летального исхода (Table 1) [51–63].
Совсем недавно Baek et al. в многоцентровом ретроспективном исследовании с использованием подхода машинного обучения у 15 574 пациентов с сепсисом были выделили три различные группы пациентов: гипотермические, нормотермические и гипертермические, у которых 90-дневная смертность составила 27,4%, 19,6% и 11,9% соответственно. Кластерный анализ возраста и температуры тела (ТТ) выявил следующие отдельные кластеры пациентов: «кластер А» (>75 лет и <36 ◦C), «кластер Б» (относительно молодой возраст с широким диапазоном температуры тела -ТТ) и кластер C (относительно более высокая ТТ, чем в кластере A). Каждый кластер имел разные 90-дневные показатели смертности: 24,2%, 17,1% и 17,0% для кластера A, B и C соответственно. Смертность и ТТ имели отрицательную корреляцию даже в экстремальных возрастах, то есть в возрастных группах <75 лет и 75 лет [51]. Одинаково ли влияние гипотермии на смертность во всех возрастных группах, все еще изучается. Эта фенотипическая дихотомия между гипотермией и лихорадкой, а также связь гипотермии со смертностью была продемонстрирована и проанализирована в недавних крупных когортах пациентов, у которых выделялись дополнительные фенотипические характеристики и ассоциации.
Например, Thomas-Ruedell et al. у 6542 больных сепсисом подтверждили, что у больных с сепсисом существует бимодальное распределение температуры тела, при этом лихорадка и гипотермия являются двумя основными реакциями человека при сепсисе , а нормотермия является довольно редким состоянием. Факторами, независимо связанными с гипотермией, были внебольничный сепсис, абдоминальная инфекция, более низкий ИМТ, больший возраст и более низкие температуры окружающей среды. Напротив, факторами, независимо связанными с высокой температурой, были не только внебольничный, но и внутрибольничный сепсис, наличие возбудителя в культуре крови и высокие значения прокальцитонина. В этом исследовании гипотермия в целом была связана с более высокой смертностью, но эта связь уменьшилась после поправки на другие факторы риска [52].
Wu et al. изучили 862 пациента отделения интенсивной терапии с септическим шоком и пришли к выводу, что температура ниже 36 ◦C или выше 38 ◦C связана с увеличением смертности за 21 день [53]. С другой стороны, Shimazui et al. в ретроспективном многоцентровом исследовании с использованием когорты сепсиса (1148 пациентов) и двух проверочных групп сепсиса (1628 пациентов) пришли к выводу, что, хотя у более молодых пациентов с сепсисом смертность повышалась при гипотермии и снижалась при лихорадке, у пожилых пациентов смертность не была связана с ТТ. Эти результаты могут означать, что молодые и пожилые пациенты с сепсисом демонстрируют разные воспалительные реакции [54,61].
Bhavani et al. использовали групповое моделирование траекторий для выявления субфенотипов на основе температурных траекторий. Групповое моделирование траекторий характеризуется расширением кластерного анализа и используется для выявления групп среди пациентов, которые имеют схожие траектории в отношении конкретной интересующей переменной [86,87].
Авторы включили в депривационную когорту 12 413 пациентов и 19 053 в группу валидации пациентов с инфекцией, которые получали антибиотики в течение 24 часов с момента обращения. Они выделили в обеих когортах четыре группы температурных траекторий: «гипертермические, медленно разрешающиеся» (14,9%), «гипертермические, быстро разрешающиеся» (23,2%), «нормотермические» (32,8%) и «гипотермические» (29,1%).
Пациенты в «гипотермической» группе были самыми старшими, имели наибольшее количество сопутствующих заболеваний и самые низкие уровни маркеров воспаления. С другой стороны, самые молодые пациенты с наименьшим количеством сопутствующих заболеваний и самым высоким уровнем воспалительных маркеров попали в группу «гипертермических, медленно разрешающиеся». В депривационной когорте у «гипотермических» пациентов был самый высокий уровень внутрибольничной смертности (9,5%), тогда как у «гипертермических, быстро разрешающихся» - самый низкий (2,9%). В когорте валидации «гипертермические, медленно разрешающиеся» имели самый высокий уровень внутрибольничной смертности (10,2%), за ними следовали «гипотермические» 9,0%, тогда как «гипертермические, быстро разрешающиеся» снова имели самый низкий уровень больничной летальности (3,0%). Авторы предположили, что три различных субфенотипа представляют собой гипервоспалительный («гипертермический, медленно разрешающийся»), гиповоспалительный («гипотермический») и хорошо сбалансированный воспалительный субфенотип («гипертермический, быстро разрешающийся»), о чем свидетельствует низкий уровень смертности [55]. Хотя эти субфенотипы и обнаруженные более низкие показатели смертности, относятся к пациентам с инфекцией, т.е. к более многочисленной когорте, включающей как больных с сепсисом, так и без сепсиса, они все же могут отражать различные иммунологические реакции.
Что касается последнего, та же группа авторов обнаружила в другом исследовании, что две когорты пациентов (120 с септическим шоком и 88 с бактериемией, вызванной Staphylococcus aureus), можно снова отнести к одной из четырех ранее подтвержденных температурных субфенотипов. Среди пациентов с септическим шоком смертность составила 51,7%, 36,8%, 29,6% и 22,2% для «гипотермических», «гипертермических, медленно разрещающихся», «нормотермических» и «гипертермических, быстро разрешающихся» соответственно. Более того, когда сравнивались концентрации 44 цитокинов в плазме, только уровни 4 цитокинов: гранулоцитарный колониестимулирующий фактор (G-CSF_, хемокиновый лиганд 2 (CCL2), IL-7 и IL-10) статистически различались. среди четырех субфенотипов; у «гипотермических» пациентов были самые низкие средние значения. Несмотря на обнаружение того, что у «гипертермических, быстро разрешающихся» наблюдалось наиболее значительное снижение уровней пяти цитокинов: антагониста рецептора интерлейкина 1 (IL-1RA), IL-6 и IL-8, G-CSF и макрофаг-колониестимулирующего фактора (M-CSF) в течение 24 часов, еще предстоит ответить на вопрос, существует ли какая-либо корреляция между иммунологическим профилем и температурными траекториями [62,88].
Интересно, что Bhavani et al. в двух ретроспективных исследованиях среди пациентов с COVID-19 выявлено четыре фенотипа, сходных с сепсисом [60,64]. В частности, в своем последнем исследовании они определили 5903 пациента с COVID-19 как «гипертермические медленно разрешающиеся» (25%), «гипертермические быстро разрешающиеся» (25%), «нормотермические» (36%) и «гипотермические» (15%) с различными клиническими характеристиками и смертностью. Хотя было обнаружено, что «гипотермический» фенотип имеет выраженные нарушения свертываемости крови и наибольшую распространенность венозных тромбоэмболий и нарушений мозгового кровообращения, именно группа «гипертермических медленных разрешающихся» в отличие от «гипертермических быстро разрешающихся» имела самые высокие уровни воспалительных маркеров, наибольшую гемодинамическую нестабильность, требующую вазопрессоров, дыхательную недостаточность, требующую ИВЛ и значительно более высокую смертность. Интересно, что распространенность фенотипа «гипертермических медленно разрешающихся» по каким-то причинам резко снизилась за время пандемии [64].
Harmon et al. получили образцы крови у 168 пациентов с сепсисом в течение первых 24 часов после их поступления в ОРИТ. Они заметили, что 30-дневная смертность была значительно увеличена у пациентов с гипотермией (38% против 18%). Это соответствует вышеупомянутым исследованиям, но Harmon et al. также подтвердили, что пациенты с гипотермическим или «холодным» сепсисом имеют уникальный профиль экспрессии генов, что обеспечивает возможную связь с температурой тела и ранней иммуносупрессией [89]. Подтверждение вышеуказанных результатов будущими исследованиями может свидетельствовать о том, что пациентам с гипотермией и сепсисом могут быть полезны иммуностимулирующие препараты, в то время как пациентам с лихорадкой может быть полезна терапия иммунодепрессантами.
Все больше и больше исследований касается других аспектов фенотипической связи между температурой и смертностью у пациентов с сепсисом. Например, Ito et al. в проспективном когортном исследовании с участием 1184 пациентов с сепсисом, поступивших в 59 ОРИТ в Японии, оценивали, существует ли какая-либо связь между гипотермией и смертностью пациентов с сепсисом в соответствии с индексом массы тела (ИМТ). Они пришли к выводу, что пациенты с сепсисом, гипотермией и нормальным ИМТ могут иметь более высокий риск смертности, чем пациенты с низким или высоким ИМТ [63]. Однако, как показывают другие существующие исследования, гипотермия у пациентов с сепсисом независимо связана со смертностью или даже что отсутствие лихорадки связано с более высокой смертностью [56,57,59], и существует метаанализ, делающий вывод о том, что наличие лихорадки снижает смертность у пациентов с сепсисом по сравнению с пациентами с нормотермией [58]. Следующим шагом является рассмотрение возможности применения терапевтической гипертермии у пациентов с гипотермическим или «холодным» сепсисом [90]. Насколько нам известно, есть два клинических исследования, в которых было показано, что согревание пациентов с гипотермией и сепсисом связано с лучшим прогнозом [91,92].
7. Гемодинамическое фенотипирование и сепсис
Гемодинамика — еще один клинический признак, который может помочь в фенотипировании пациентов с сепсисом в критическом состоянии. Септический шок определяется стойкой гипотензией, требующей вазопрессоров для поддержания среднего артериального давления 65 мм рт. ст. и уровня лактата в сыворотке более 2 ммоль/л, несмотря на адекватную инфузионную терапию [2]. Принимая во внимание, что систолическое артериальное давление (САД) регулярно измеряется в ОРИТ, можно предложить использовать САД для быстрой и точной идентификации различных фенотипов.
Zhu et al. извлекли из большой медицинской базы данных информацию о 3034 пациентах с сепсисом, поступивших в ОРИТ, и после проведения траекторного анализа определили семь различных траекторий САД: у некоторых пациентов (36,9%) САД изменялось стабильно, но без явной тенденции к увеличению или снижению ( фенотип 1, среднее САД 100 мм рт. ст.); при фенотипе 2 (7,5%) тенденция САД была стабильной (среднее САД 82 мм рт.ст.), а при фенотипе 3 (8,4%) и фенотипе 4 (21,3%) в целом стабильна, при этом САД постепенно повышалось до 140 мм рт.ст. от 110–120 мм рт.ст. мм рт. ст. и 120–130 мм рт. ст. соответственно. С другой стороны, при фенотипе 5 (15,3%) и фенотипе 6 (8,2%) САД быстро снижалось примерно с 130 мм рт. ст. до 100 мм рт. ст. и примерно с 150–160 мм рт. ст. до 110–120 мм рт. ст. соответственно, тогда как при фенотипе 7 (2,8%) САД сначала демонстрировало тенденцию к увеличению, а затем к снижению. Внутрибольничная смертность составила 25,5%, 40,5%, 11,8%, 18,3%, 23,5%, 13,8% и 10,5% для 1-7 фенотипа пациентов соответственно. Как и в многомерном анализе, фенотип 3 имел самый низкий риск смертности, и авторы предполагают, что траектория САД, представленная в фенотипе 3, может использоваться в качестве идеальной гемодинамической цели для пациентов с сепсисом в течение 10 часов после госпитализации с целью улучшения результатов.
Кроме того, тот факт, что при сравнении фенотипов 2 и 6 было обнаружено, что фенотип 6 имел лучший прогноз, позволяет предположить, что, т.е. что стойкая гипотензия имеет худший прогноз по сравнению со значительным снижением САД. Таким образом, наблюдая за тенденцией САД, врачи могут легко выявить пациентов с высоким риском как можно раньше и тем самым обеспечить своевременное лечение. Стоит отметить, что в том же исследовании при анализе подгрупп возраст для фенотипа 2 был независимым предиктором внутрибольничной смертности: пациенты < 65 лет имели более высокий риск смертности, чем пациенты > 65 лет [65].
В другом исследовании с участием 127 пациентов с сепсисом, поступивших в отделение неотложной помощи, которым проводили неинвазивный непрерывный гемодинамический мониторинг: среди прочего, сердечный индекс (CI) и индекс системного сосудистого сопротивления (SVRI), применение подхода машинного обучения привело к выявление трех разных кластеров со значимо различной выраженностью гемодинамических показателей: фенотип 1 (56,7%) с высоким CI и нормальным SVRI , фенотип 2 (39,4%) с низким CI и повышенным SVRI и фенотип 3 (3,9%) с очень низким CI и очень высоким SVRI.
Пациенты как с фенотипом 2, так и с 3 могут получить пользу от терапии, направленной на индивидуальное реагирование на инфузионную терапию, тогда как пациенты с фенотипом 3 могут получить больше пользы использования вазодилататоров. Интересно, что эти три фенотипа значительно отличались друг от друга с точки зрения 30-дневной смертности, причем большинство смертей (20%) приходится на фенотипы 2 и 3, тогда как у пациентов с фенотипом 1 смертность составила только 5,6% [93]. Эти данные согласуются с классическими знаниями, полученными несколько десятилетий назад, о том, что у пациентов с сепсисом, которые не способны увеличить сердечный выброс, развивается метаболический ацидоз и в конечном итоге они умирают. Хотя в 1981 г. Hess и коллеги предложили модель сепсиса, в которой состояние гемодинамики рассматривалось как последовательность различных событий [94]; стоит отметить, что в настоящее время этот подход подвергается сомнению, поскольку современная литература предполагает, что септический шок не обязательно следует линейной естественной истории с четко определенными фенотипами, сменяющими друг друга; разные авторы предполагают, что сепсис и септический шок — это совершенно разные фенотипы, возникающие независимо друг от друга, а не последовательно и во временном континууме [66].
Недавно Geri et al. идентифицировали пять различных гемодинамических фенотипов у 360 пациентов с септическим шоком на основании клинических и эхокардиографических параметров: «кластер 1», «well- resuscitated» (16,9%), «кластер 2», у которых наблюдалась систолическая дисфункция левого желудочка (ЛЖ) (17,7%). ), «кластер 3», характеризующийся гиперкинезией ЛЖ (23,3%), «кластер 4», характеризующийся правожелудочковой недостаточностью (22,5%) и «кластер 5», характеризующийся устойчивой гиповолемией (19,4%). Смертность в ОРИТ в кластерах 1, 2, 3, 4 и 5 составила 21,3%, 50,0%, 23,8%, 42% и 38,6%, соответственно [67]. Оказывается, что, распознавая и дифференцируя пациентов на ранней стадии развития сепсиса по различным гемодинамическим фенотипам, можно каким-то образом индивидуализировать гемодинамическую поддержку, например с помощью вазопрессоров, и адаптировать инфузию инотропов и инфузию к потребностям каждого конкретного фенотипа.
В настоящее время проводится по крайней мере одно клиническое исследование, в котором изучается, существует ли связь между фенотипом септической кардиомиопатии, основанным на ультразвуковых характеристиках, и исходом сепсиса [95]. Кроме того, авторы исследования ANDROMEDA-2 стремятся определить, может ли при раннем септическом шоке, т.е. менее чем через 4 ч от момента постановки диагноза, стратегия периферической перфузии по сравнению со стандартным лечением, применяемая к различным фенотипам пациентов, определяемым по различным клиническим и гемодинамическим показателям, улучшить их исход (смертность, длительность органной поддержки и продолжительность пребывания в стационаре) [96].
Bhavani et al., чтобы разработать и подтвердить фенотипы траекторий жизненно важных функций, применили групповое моделирование траекторий к жизненно важным показателям с первых 8 часов госпитализации у пациентов с подозрением на инфекцию, как в обучающей, так и в проверочной когорте (12 473 и 8 256 пациентов соответственно). С помощью этого подхода в конечном итоге были идентифицированы четыре фенотипа: «Группа А» (28%) - пациенты с гипертермией, тахикардией, тахипноэ и с более низким систолическим и диастолическим артериальным давлением; «группа В» (13%) - пациенты также были с гипертермией, тахикардией, тахипноэ (но не в такой степени, как в «группе А») и с гипертонией; «группа С» (32%) и «группа D» (27%). Несмотря на то, что у пациентов как «группы С», так и «группы D» были более низкие температура тела, частота сердечных сокращений и дыхания, в «группе С» пациенты были нормотензивными, а в «группе D» было самое низкое артериальное давление. Что касается других особенностей четырех фенотипических групп, стоит отметить, что более молодые пациенты находились в группах А и В, тогда как пожилые пациенты были в группах С и D, что в «группе В» была самая высокая распространенность застойной сердечной недостаточности, гипертонии, сахарного диабета и хронической болезни почек. В группах А и D наблюдалось как самое высокое использование вазопрессоров, так и самая высокая 30-дневная смертность, «Группа D» имела значительно меньший риск - 30 -дневной смертности при сравнении введения сбалансированных кристаллоидов с физиологическим раствором [97].
Помимо температуры и гемодинамического статуса, дисфункция органов также может быть использована для фенотипирования пациентов с сепсисом в критическом состоянии.
8. Фенотипирование мультиорганной дисфункции при сепсисе
Вероятно, первое исследование мультиорганной дисфункции и фенотипирования сепсиса было проведено Knox et al. в 2015 году. В этом исследовании с использованием методов машинного обучения 2533 пациента с сепсисом, поступивших из отделения неотложной помощи в отделение интенсивной терапии, были сгруппированы по четырем различным фенотипам; В «кластер 1» вошли пациенты с шоком и повышенным креатинином, в «кластер 2» — пациенты с синдромом минимальной полиорганной дисфункции, в «кластер 3» — пациенты с шоком с гипоксемией и измененным психическим статусом, а в «кластер 4» — пациенты с заболеваниями печени. Смертность для этих кластеров составила 11%, 12%, 28% и 21% соответственно. Регрессионный анализ показал, что эти фенотипические кластеры в значительной степени не зависят от возраста, причины сепсиса, ожирения и других сопутствующих заболеваний и что они значительно различаются по связи между клиническими исходами и предикторами, такими как оценка по шкале APACHE II [68].
Пять лет спустя Ibrahim et al., используя данные пациентов с сепсисом, поступивших в ОИТ (13728 записей), подсчитав 63 жизненно важных параметров и лабораторных анализов, собранных в течение первых 24 часов после поступления, и следуя методологии машинного обучения Нокса, также выявили четыре клинически значимых субпопуляции сепсиса с отчетливыми паттернами органной дисфункции, представляющими либо заболевание печени (фенотип 1), либо кардиогенную дисфункцию с повышенным креатинином (фенотип 2) или минимальной органной дисфункцией (фенотип 3), либо кардиогенную дисфункцию с гипоксемией и измененным психическим статусом (фенотип 4). Выявленные популяции в основном не зависели от происхождения сепсиса, а 30-дневная смертность для этих кластеров составила 28%, 55%, 25% и 37% соответственно [69].
Zhang et al. в 2018 году опубликовали результаты ретроспективного исследования с участием 14 993 пациентов с сепсисом, в котором с помощью методов машинного обучения также были выявлены четыре фенотипа: исходным считался фенотип 1 (69%); фенотип 2 (9%) характеризовался респираторной дисфункцией; фенотип 3 (11%) — полиорганной дисфункцией (например, почек, системы свертывания крови, печени и шоке) и фенотип 4 (11%) — неврологической дисфункцией. Фенотип 3 показал самый высокий уровень смертности (45,4%), за ним следовали фенотип 4 (27,4%), фенотип 2 (18,2%) и фенотип 1 (16,9%) [70].
Seymour et al. в революционном исследовании проанализировали ретроспективно данные 63 858 пациентов с сепсисом, которые соответствовали критериям сепсиса-3 в течение 6 часов после поступления в больницу в трех различных когортах, используя инструменты статистики, машинного обучения и моделирования. Исследователи идентифицировали четыре фенотипа сепсиса (обозначенные α, β, γ и δ). Фенотипы варьировали по размеру (от 13% до 33% когорты), каждый из них отличался по демографическим, лабораторным показателям и характеру органной дисфункции, и каждый из них коррелировал с биомаркерами и смертностью. «α-фенотип» (33%) имел мало аномальных лабораторных показателей и меньшую дисфункцию систем органов; Пациенты с «β-фенотипом» (27%) были старше, с повышенной сопутствующей патологией и заболеваниями почек; У пациентов с «γ-фенотипом» (27%) наблюдались повышенные уровни маркеров воспаления, снижение уровня альбумина и повышение температуры, тогда как у пациентов с «δ-фенотипом» (13%) наблюдались высокие уровни лактата в сыворотке, повышенные уровни трансаминаз и гипотония. 28-дневная смертность для фенотипов α, β, γ и δ составила 5%, 13%, 24% и 40% соответственно [71]. Хотя эти четыре фенотипа имели некоторую значимость для традиционных оценок тяжести заболевания (APACHE, SOFA), было ясно, что они представляют собой отдельные клинические группы [98]. Стоит также отметить, что в том же исследовании в имитационных моделях изменения в распределении среди пациентов фенотипов α и δ имели существенные последствия. Это оказалось очень важным открытием, поскольку оно предположило, что эффективность клинического исследования, по-видимому, зависит от фенотипа, к которому оно будет применяться, и это, безусловно, то, что нам необходимо учитывать при планировании каждого нового клинического исследования. 71,98].
Этот последний вывод, а именно то, что на результат РКИ может влиять доля участия каждой фенотипической группы в исследуемой популяции, подчеркивает исследование Seymour et al. как знаковое и эпохальное исследование. Разумно полагать, что для проведения хорошо спланированных РКИ очень важно найти и отобрать соответствующую фенотипическую популяцию и провести соответствующее лечение в наиболее подходящее время. Даже если терапевтическое вмешательство действительно полезно для части популяции пациентов, но если оно не приносит пользы или даже вреда остальным пациентам, то это вмешательство в целом можно рассматривать как неэффективное. Основываясь на результатах Seymour et al., если бы мы могли на ранних стадиях распознать у пациента с сепсисом конкретный паттерн развития полиорганной недостаточности, мы могли бы действовать профилактически или терапевтически, как врачи, на более раннем этапе в пользу пациента или, в случае, когда мы хотим провести клиническое исследование, мы могли бы выборочно применить к пациенту то вмешательство, которое действительно принесет ему/ей пользу. Также представляется, что существует большая возможность повторения клинических исследований, которые уже были проведены и не показали в целом каких-либо положительных результатов, в конкретных группах населения с конкретными фенотипическими характеристиками, что может оказаться полезным; это может быть особенно верно для тех исследований, которые показали пользу только в некоторых конкретных подгруппах [99].
Xu et al. исследовали, могут ли 72-часовые траектории оценки SOFA помочь в фенотипировании пациентов с сепсисом; всего было набрано 4678, 3665, 12 282 и 4804 уникальных пациентов с сепсисом (одна группа разработки и три группы валидации), и были идентифицированы четыре различных кластера/фенотипа: «быстро ухудшающиеся» (13,1%), при котором показатель SOFA постоянно увеличивался от 4,5 при поступлении до более 7 через 72 ч; «отсроченное ухудшение» (20,5%), при котором показатель SOFA снизился в течение первых 2 дней с 5,2 до 3,7, а затем увеличился в течение последних 24 часов; «быстрое улучшение» (41,3%), при котором оценка SOFA постоянно снижается с 5,54 до менее 3, и фенотип «отсроченное улучшение» (25,1%), при котором оценка SOFA первоначально увеличивается, а затем постепенно снижается в течение 72 часов. Каждый фенотип имел разные исходные характеристики. Например, пациенты с «быстрым ухудшением» имели большую сопутствующую патологию, ацидоз и дисфункцию органов, в то время как пациенты с «быстрым улучшением» нуждались в вазопрессорах, но не имели ацидоза. Более того, несмотря на то, что «быстро ухудшающийся» фенотип имел более низкий балл SOFA (в среднем 4,5) по сравнению с «быстро улучшающимся» (средний 5,5), этот фенотип имел самую высокую внутрибольничную смертность (28,3% против 5,5% соответственно). Основным выводом этого исследования было то, что авторы смогли выявить зависящие от времени причины прогрессирования, которые могут быть связаны с дифференциальной реакцией дисфункции конкретного органа на стандартные вмешательства. Как уже предполагалось ранее на основе результатов Seymour et al., при проведении РКИ, оценивающего терапевтическое вмешательство, направленное на сокращение продолжительности органной дисфункции, если бы мы набрали пациентов, принадлежащих к фенотипу «быстрого улучшения», РКИ вряд ли выявило бы какие-либо положительный результат [72].
Sharafoddini et al., основываясь на демографических данных, жизненно важных показателях, лабораторных тестах и дисфункции органов, также применили методы машинного обучения среди 5539 взрослых пациентов с сепсисом, выявив не четыре, а 12 фенотипов. Авторы предполагают, что используемая методология могла бы уделять больше внимания деталям при оценке сходства между пациентами. Смертность в ОИТ, внутрибольничная смертность и 30-дневная смертность значительно различались между кластерами: показатели смертности были ниже в кластерах 10, 11 и 8, а в кластерах 9 и 2 были самыми высокими [73]. Прочитав их статью более внимательно, кто-то может предположить, что было идентифицировано 12 субфенотипов из пяти основных фенотипов, что подчеркивает вышеупомянутые ограничения методов машинного обучения, такие как отсутствие прозрачности и относительно низкая воспроизводимость между исследованиями в настоящее время.
Пять также было числом фенотипов, которые Aldewereld et al. описали в их исследовании. Авторы ретроспективно применили методы машинного обучения к когорте из 1023 человек с ранним септическим шоком. Они охарактеризовали два фенотипа «низкого риска» (L), один «умеренный риск» (M) и два фенотипа «высокого риска» (H). Это были пациенты с септическим шоком, характеризующиеся как «чувствительные к инфузии» (фенотип L2), «рефрактерные к инфузии» пациенты без полиорганной недостаточности (фенотип L1), пациенты с септическим шоком и дыхательной недостаточностью (фенотип М), пациенты с полиорганной дисфункцией (фенотип H1) и пациентов с септическим шоком с гепатобилиарной дисфункцией и коагулопатией (фенотип H2). Фенотипы H1 и H2, хотя и имели разные демографические данные, исходную оценку тяжести заболевания, лабораторные показатели и характер органной недостаточности, имели одинаково высокую смертность. Интересно, что это исследование предоставило уникальные доказательства того, что разные группы пациентов с разными фенотипическими особенностями, развивающиеся по-разному во времени, могут в конечном итоге сохранять одни и те же признаки органной дисфункции [74].
Ding et al. проанализировали когорту из 5782 септических пациентов с госпитализацией в отделение интенсивной терапии и вывели три клинических фенотипа из многомерной панели физиологических данных, используя субграфовую неотрицательную матричную факторизацию с дополнением. Поиск частых подграфов - это метод, используемый для выявления закономерностей в виде подграфов в наборе графов на основе определенного порогового значения частоты. Этот метод позволяет выявлять частые паттерны в графах временных рядов и успешно проводить фенотипирование популяций пациентов и прогнозировать исходы при различных заболеваниях. В этом исследовании пациенты с «фенотипом 1» были старше (73,1 года), имели избыточный вес, были мужчинами, и имели 17,0% 30-дневную и 12,0% внутрибольничную смертность. Пациенты с «фенотипом 2» были моложе (67,9 лет), с меньшим избыточным весом, мужского пола, с 28,4% 30-дневной и 24,8% внутрибольничной смертностью, в то время как пациенты с «фенотипом 3» были самыми молодыми (59,9 лет), с наименьшим избыточным весом, соотношение мужчин и женщин составляло 1:1, а смертность была самой низкой (10,1% 30-дневная и 7,3% внутрибольничная). Опять же, эти фенотипы характеризовались различными демографическими особенностями и сопутствующими заболеваниями, характером дисфункции органов и траекториями заболевания, при этом очевидна четкая связь между фенотипами и клиническим исходом [75].
Papin et al ретроспективно проанализировали 6046 пациентов с сепсисом, поступивших в ОРИТ с акцентом на очаг инфекции [76]. Эти исследователи выделили шесть фенотипических кластеров: фенотип 1 (40%) и фенотип 2 (4%) представляли молодых пациентов без каких-либо сопутствующих заболеваний, госпитализированных по поводу внебольничной пневмонии или менингита/энцефалита соответственно, «фенотип 3» (6%) и «Фенотип 4» (27%) представлял собой пожилых людей с хронической обструктивной болезнью легких, бронхиальной инфекцией и незначительной органной недостаточностью, «фенотип 5» (15%) представлял пациентов, госпитализированных после операции с нозокомиальной инфекцией, и «фенотип 6» (8%) представлял молодых пациентов с иммуносупрессией (например, СПИД, хроническая стероидная терапия или гематологические злокачественные новообразования). Смертность через 28 дней, 90 дней и один год значительно различалась для разных фенотипов, независимо от исходной органной недостаточности [76].
9. Фенотипы сепсиса, волемический статус и исход
Во время сепсиса и септического шока адекватная инфузионная терапия остается критически важной стратегией, направленной на поддержание гемодинамической стабильности пациента, перфузии органов и идеальной доставки кислорода. Перегрузка жидкостью имеет пагубное воздействие, и применение прецизионной медицины к пациентам с сепсисом в ОРИТ предполагает отход от хорошо известного подхода инфузионной реанимации как «стандарта медицинской помощи», который широко применялся в течение последних двух десятилетий. В настоящее время имеется достаточно доказательств того, что различия в балансе жидкости между разными фенотипами тесно связаны с разными исходами и что выявление подгруппы пациентов, особенно склонных к перегрузке жидкостью, может быть важным шагом для оптимизации управления водным балансом.
Например, Shald et al среди 320 больных с сепсисом, поступивших в ОРИТ, выявили четыре фенотипа: «Фенотип 1» (9,7%) - пациенты с полиорганной недостаточностью, «Фенотип 2» (15%) - пациенты с респираторной дисфункцией, «Фенотип 3» (18,1%) -пациенты с неврологической дисфункцией и «фенотип 4» (57,2%)- пациенты с другими проблемами. Уровень смертности между разными фенотипами также был разным; 48,4%, 20,8%, 39,7% и 13,7% для фенотипа 1, 2, 3 и 4 соответственно. Интересно, что балансы жидкости на 1, 2 и 3 дни также были разными: фенотипы 1 и 3 имели наибольший объемный баланс в эти моменты времени [77].
Wang и соавт. в проспективном многоцентровом обсервационном исследовании, в котором приняли участие 986 пациентов с сепсисом, исследовали влияние латентных траекторий баланса жидкости на клинические исходы и выявили три различных траектории/фенотипа: «Фенотип 1» (6,5%), при котором первоначально высокий баланс жидкости быстро снижается, поддерживая более низкий уровень; «фенотип 2» (85,3%), при котором баланс жидкости в целом был стабильным; и «фенотип 3» (8,2%), при котором баланс жидкости изначально был высоким и стабильным, но позже умеренно снижался. При сравнении фенотипов 2 и 3 «фенотип 3» демонстрировал более высокую внутрибольничную смертность (71,6% против 46,9%), органную дисфункцию (79,0% против 46,9%) и тяжелые респираторные нежелательные явления (58,0% против 29,7%). в то время как «фенотип 1» вызывал меньше неблагоприятных событий со стороны почек, чем «фенотип 2» (47,4% против 51,6%) [78].
В ранее упомянутом исследовании Zhang et al. каждый фенотип также показал различную реакцию на инфузионную терапию; «Фенотип 2» получал меньше жидкости, чем все остальные, тогда как «фенотип 3» получал наибольшее количество жидкости в течение первых 24 часов. Влияние более высокого баланса жидкости в первые 48 часов было непропорционально связано с исходом между различными фенотипами: «фенотип 3» снижал риск госпитальной смертности, а «фенотип 4» повышал [70].
Более того, Ma et al., применяя методы машинного обучения у 1437 пациентов с сепсисом, попытались разработать правило последовательного лечения, касающееся идеальной дозы инфузионной терапии и использования вазопрессоров. В конечном итоге были идентифицированы пять фенотипов: «Фенотип 1» (исходный уровень) включал большинство пациентов за все дни; «фенотип 2» включал пациентов с самой высокой тяжестью заболевания; «фенотип 3» включал пациентов с почечной дисфункцией; «фенотип 4» включал лиц с дыхательной недостаточностью; а к «фенотипу 5» относились пациенты с легкой степенью тяжести заболевания, у которых также наблюдался самый низкий уровень смертности (21%). Оптимальная инфузия жидкости следовала за фазами реанимации/дереанимации с начальной инфузией большого объема и поздней инфузией ограниченного объема. В то время как «фенотип 1» перешел в фазу дереанимации на третий день, «фенотип 3» - на первый день, и хотя фенотипы 1 и 3, по-видимому, получили пользу от раннего применения норадреналина, «фенотип 2», по-видимому, выиграл от отсроченного его использования. Это открытие подтверждает существующую гетерогенность сепсиса и еще раз дает понять, что раннее лечение может быть полезным у большинства пациентов с септическим шоком, но отсроченное лечение может быть полезным для других [79].
10. Фенотипирование траекторий ОРИТ: смертность и не только
Как уже объяснялось, сепсис сам по себе представляет собой смесь нескольких фенотипов с разными клиническими проявлениями, разным оптимальным лечением и разным исходом. Используя методы машинного обучения, мы также можем детально фенотипически исследовать и дифференцировать другие аспекты состояния пациентов интенсивной терапии во время госпитализации в отделение интенсивной терапии.
Например, Zhang et al., в ретроспективном многоцентровом когортном исследовании с участием 22 868 пациентов с сепсисом, поступивших в ОРИТ, исследовали, когда они стабилизировались, когда они переходили в состояние стойкого критического заболевания и различалось ли время такого перехода между подклассами этих пациентов. Они обнаружили, что, хотя только у 2,8% пациентов, принимавших участие в исследовании, развилось стойкое критическое заболевание, они составили 19% и 10% от общего числа койко-дней в ОРИТ и больнице соответственно, при этом повышенное соотношение мочевины и креатинина является хорошим биохимическим признаком персистирующего критического состояния. Авторы выделили пять латентных классов: 1-й (22,8%) и 2-й (3,5%) классы, при которых показатель SOFA непрерывно увеличивался и переход к стойкому критическому заболеванию происходил на 16 и 27 день соответственно, и 3-й (51,7%), 4-й (11,2%) и 5 (10,8%) классы, в которых показатель SOFA непрерывно снижался и переход к стойкому критическому заболеванию происходил между 6 и 8 днями. У пациентов как 2-го, так и 5-го класса наблюдался высокий уровень смертности (70% и 41,2% соответственно). У пациентов, у которых развилось стойкое критическое состояние, также наблюдалась в целом более высокая смертность, чем у пациентов без такового (25% против 16%).
Тот факт, что у пациентов с уменьшением балла по шкале SOFA в конечном итоге стойкое критическое заболевание развилось в более ранние сроки, чем у пациентов с увеличением балла по шкале SOFA, несмотря на лечение в ОРИТ, позволяет предположить, что реакция пациента с сепсисом на первоначальное лечение в отделении интенсивной терапии оказывает влияние на то, когда его можно стабилизировать [80].
Yang et al. провели ретроспективный анализ 16 743 пациентов с сепсисом и, применив групповое моделирование траекторий, выделили среди этих пациентов пять отдельных траекторий оценок SOFA через 72 часа: в «группе 1» (32,8%) пациенты имели самый низкий показатель SOFA, который первоначально увеличивался, затем уменьшался и позже увеличивался в течение 72 часов; в «группе 2» (30,0%) пациенты имели более высокий показатель SOFA, который первоначально увеличивался, а затем стабилизировался; в «группе 3» (17,6%). у пациентов были умеренные показатели SOFA (значения между показателями в группах 1 и 2), которые сначала увеличивались, затем резко снижались в течение 72 часов и, наконец, непрерывно увеличивались; а в «группе 4» (14,0%) и «группе 5» (5,7%) пациенты имели относительно высокие показатели SOFA со схожими тенденциями изменений. В группах 2–5 кумулятивный риск постепенно увеличивался, тогда как в «группе 1» риск оставался низким. Похоже, что раннее эффективное лечение сопровождалось снижением показателя SOFA, тогда как неадекватный инфекционный контроль сопровождался стабилизацией показателя SOFA. Более высокий риск смерти наблюдался у пациентов с сепсисом в возрасте < 65 лет и у тех, кто не находился на ИВЛ [81].
Soussi et al. снова с использованием методов машинного обучения проанализировали клинические и лабораторные данные, собранные у пациентов во французских и европейских регистрах ОРИТ; анализ латентного класса выявил два различных фенотипа выживших после сепсиса среди 467 пациентов: фенотипы А и В. Пациенты с «фенотипом В» (48%) имели более выраженную сердечно-сосудистую и почечную дисфункцию, гематологические нарушения и более высокие уровни воспалительных маркеров при выписке из ОРИТ и значительно более высокую смертность в течение года (34% против 16%). «Фенотип B» также был независимо связан с повышенной смертностью в течение года. Похоже, что если бы мы могли распознавать различные группы людей, переживших сепсис, при выписке из ОРИТ, мы могли бы также распознавать пациентов с более высоким риском плохих долгосрочных результатов и могли бы оптимизировать их лечение после переводя из ОРИТ [82].
Аналогичными были результаты были получены Taylor et al., которые пытались изучить смертность после выписки и частоту повторных госпитализаций среди 20 745 пациентов с сепсисом. Они использовали анализ латентных классов и разделили выживших после сепсиса на пять различных фенотипов: «Группа 1» (24,3%), т. е. пациенты, которые не нуждались в медицинской помощи (смертность 0,1%, повторная госпитализация 8,6%); «группа 2» (13,7%), ранее здоровые пациенты с тяжелым заболеванием и сложными потребностями после выписки и препятствиями для оказания медицинской помощи (смертность 2,1%, повторная госпитализация 20,1%); «3-я группа» (27,6%), пациенты с мультиморбидностью (смертность 2,1%, повторная госпитализация 26%); «4-я группа» (13,7%) — пациенты с плохим функциональным статусом (смертность 6,9%, повторная госпитализация 21,6%); и «группа 5» (20,7%) — пациенты с тяжелым заболеванием и сложными потребностями после выписки (смертность 7,9%, повторная госпитализация 35,1%). Результаты этого исследования убедительно подтверждают гипотезу о том, что выжившие после сепсиса представляют собой отдельные клинические фенотипы с различными потребностями в дополнительной поддержке после выписки и указывают на необходимость классификации перед выпиской, что в конечном итоге направлено на более индивидуализированный подход к лечению пациентов, переживших сепсис сепсиса [83].
Boede и соавт., используя латентно-классовый анализ, исследовали депрессивные симптомы у 224 человек, перенесших сепсис, в течение года наблюдения и определили три различные траектории: в одной группе пациентов (68%) наблюдалась легкая траектория выздоровления, при которой симптомы легкой депрессии регрессировали в течение 6 месяцев, у другой группы пациентов (12%) наблюдалась тяжелая персистирующая траектория, при которой депрессивные симптомы от умеренной до тяжелой степени сохранялись в течение 1 года, а у третьей группы пациентов (20%) симптомы тяжелой депрессии присутствовали через 1 месяц после выписки из ОРИТ, однако полностью исчезли через 6 месяцев [84].
Puthucheary и соавт., также используя латентно-классовый анализ, обследовали 159 человек, переживших сепсис, в течение двухлетнего периода наблюдения и выделили две отдельные группы: в одной группе наблюдалось более быстрое и полное выздоровление (38,4%), а в другой наблюдалось более устойчивые функциональные нарушения (61,6%), причем независимыми факторами риска плохой реабилитации являются пожилой возраст, низкий уровень образования и высокая коморбидность. Была также третья группа, которую нельзя было отнести ни к одной траектории, что иллюстрирует широкий спектр исходов сепсиса среди выживших [85].
11. Сепсис и фенотипы: это еще не все
Число исследований по фенотипированию сепсиса продолжает расти, принимая во внимание локализацию инфекции [100, 101], тип органной дисфункции, например, печени [102], почек [103–106], легких [107, 108] или системы свертывания крови [109–112] и тип заболевания, например, COVID-19 [113–128] или ОРДС, не связанный с COVID-19 [129–153]; они пытаются соотнести фенотипы и связанный с ними вред, связанный с отсроченным применением антибиотиков [154,155], и даже предсказать ответ на лечение или его результат [156–159]. Различные фенотипы были также идентифицированы у детей с сепсисом [160–172]. Полный обзор этих тем выходит за рамки данного обзора, и за более подробной информацией читатель отсылается к литературе.
12. Выводы
Сепсису всегда давалось широкое определение, чтобы охватить наибольшее количество пациентов из группы риска, ценой значительных трудностей, создаваемых гетерогенностью как для клинической практики, так и для исследований [173]. Такая значительная гетерогенность среди пациентов и принятие единой стратегии ведения пациентов могут привести к весьма разным и даже противоречивым результатам [174].
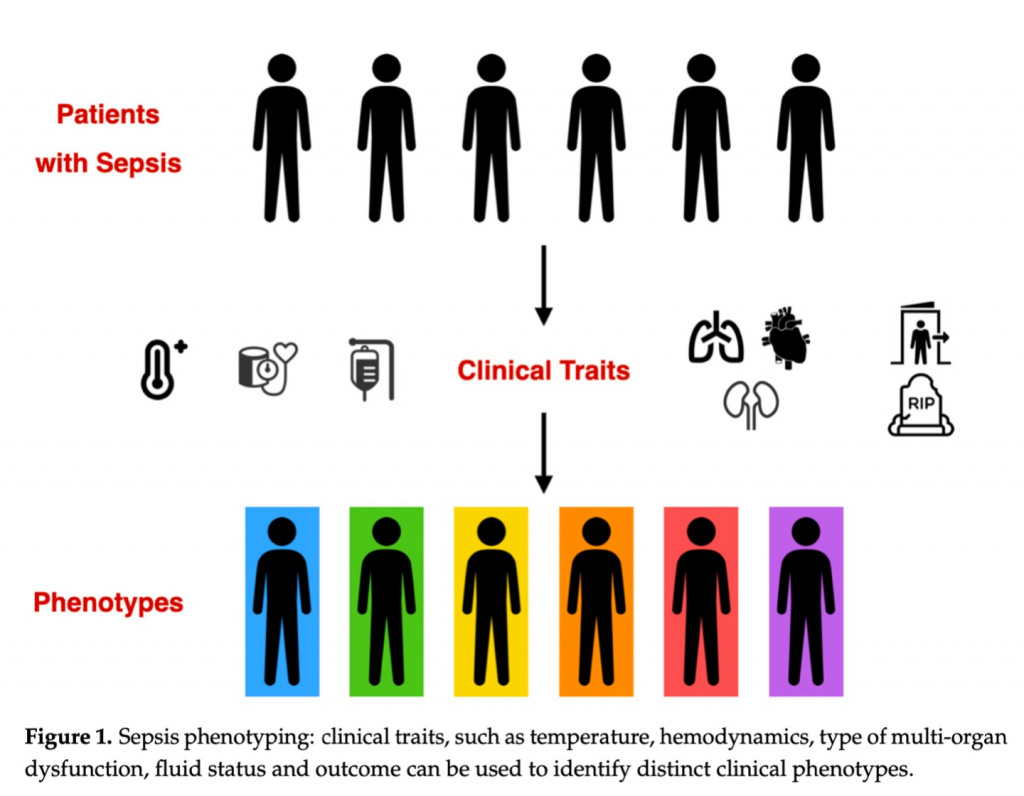
В течение многих лет не было новых методов лечения, и существует более чем когда-либо потребность в индивидуальном подходе к лечению сепсиса. Хотя в настоящее время может показаться невозможным включить фенотипирование в нашу повседневную клиническую практику и, следовательно, предложить персонализированные подходы к оказанию помощи пациентов с сепсисом, небольшие шаги в этом направлении уже сделаны, поскольку все более гибкие и сложные методы кластеризации позволяют анализировать большие выборки данных и помогают идентифицировать отдельные клинические фенотипы (Figure 1); разные фенотипы могут по-разному реагировать на стратегии лечения. Более точное определение клинических характеристик гетерогенности при сепсисе может стать первым шагом в наших усилиях по пониманию потенциальной реакции различных групп пациентов интенсивной терапии на доступные в настоящее время терапевтические подходы. Таким образом, перспектива прецизионной медицины заключается в том, что лучшее понимание индивидуальных клинических проявлений сепсиса, механизмов заболевания и гетерогенных моделей ответа на лечение приведет к переходу от «плохо охарактеризованной» к «персонализированной» медицине и улучшению результатов.
References
1. Vincent, J.L.; van der Poll, T.; Marshall, J.C. The End of “One Size Fits All” Sepsis Therapies:Toward an Individualized Approach.
Biomedicines 2022, 10, 2260. [CrossRef]
2. Singer, M.; Deutschman, C.S.; Seymour, C.W.; Shankar-Hari, M.; Annane, D.; Bauer, M.; Bellomo, R.; Bernard, G.R.; Chiche, J.D.; Coopersmith, C.M.; et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315, 801–810. [CrossRef]
3. Hussain, H.; Vutipongsatorn, K.; Jimenez, B.; Antcliffe, D.B. Patient Stratification in Sepsis:Using Metabolomics to Detect Clinical Phenotypes, Sub-Phenotypes and Therapeutic Response.Metabolites 2022, 12, 376. [CrossRef] [PubMed]
4. Taj, M.; Brenner, M.; Sulaiman, Z.; Pandian, V. Sepsis protocols to reduce mortality inresource-restricted settings: A systematic review. Intensive Crit. Care Nurs. 2022, 72, 103255.[CrossRef]
5. Afonso, E.; Smets, K.; Deschepper, M.; Verstraete, E.; Blot, S. The effect of late-onset sepsis onmortality across different gestational ages in a neonatal intensive care unit: A historical study. IntensiveCrit. Care Nurs. 2023, 77, 103421. [CrossRef]
6. Verstraete, E.H.; Mahieu, L.; De Coen, K.; Vogelaers, D.; Blot, S. Impact of healthcare-associated sepsis on mortality in critically ill infants. Eur. J. Pediatr. 2016, 175, 943–952. [CrossRef][PubMed]
7. Verstraete, E.; Boelens, J.; De Coen, K.; Claeys, G.; Vogelaers, D.; Vanhaesebrouck, P.; Blot, S.Healthcare-associated bloodstream infections in a neonatal intensive care unit over a 20-year period(1992–2011): Trends in incidence, pathogens, and mortality. Infect. Control Hosp. Epidemiol. 2014,35, 511–518. [CrossRef]
8. Arvaniti, K.; Dimopoulos, G.; Antonelli, M.; Blot, K.; Creagh-Brown, B.; Deschepper, M.; de Lange, D.; De Waele, J.; Dikmen, Y.; Eckmann, C.; et al. Epidemiology and age-related mortality incritically ill patients with intra-abdominal infection or sepsis: An international cohort study. Int. J.Antimicrob. Agents 2022, 60, 106591. [CrossRef] [PubMed]
9. Dimopoulos, G.; Koulenti, D.; Blot, S.; Sakr, Y.; Anzueto, A.; Spies, C.; Sole-Violan, J.; Kett, D.; Armaganidis, A.; Martin, C.; et al. Critically ill elderly adults with infection: Analysis of the extended prevalence of infection in intensive care study. J. Am. Geriatr. Soc. 2013, 61, 2065–2071. [CrossRef]
10. Blot, S.; Cankurtaran, M.; Petrovic, M.; Vandijck, D.; Lizy, C.; Decruyenaere, J.; Danneels, C.;Vandewoude, K.; Piette, A.; Vershraegen, G.; et al. Epidemiology and outcome of nosocomial bloodstream infection in elderly critically ill patients: A comparison between middle-aged, old, andvery old patients. Crit. Care Med. 2009, 37, 1634–1641. [CrossRef] [PubMed]
11. Blot, S.; Koulenti, D.; Dimopoulos, G.; Martin, C.; Komnos, A.; Krueger, W.A.; Spina, G.; Armaganidis, A.; Rello, J.; EU-VAP Study Investigators. Prevalence, risk factors, and mortality for ventilator-associated pneumonia in middle-aged, old, and very old critically ill patients. Crit. CareMed. 2014, 42, 601–609. [CrossRef]
12. Rudd, K.E.; Johnson, S.C.; Agesa, K.M.; Shackelford, K.A.; Tsoi, D.; Kievlan, D.R.; Colombara, D.V.; Ikuta, K.S.; Kissoon, N.; Finfer, S.; et al. Global, regional, and national sepsis incidence and mortality, 1990–2017: Analysis for the Global Burden of Disease Study. Lancet 2020, 395, 200–211.[CrossRef]
13. Cavaillon, J.M.; Singer, M.; Skirecki, T. Sepsis therapies: Learning from 30 years of failure of translational research to propose new leads. EMBO Mol. Med. 2020, 12, e10128. [CrossRef]
14. Sakr, Y.; Jaschinski, U.; Wittebole, X.; Szakmany, T.; Lipman, J.; Namendys-Silva, S.A.; Martin-Loeches, I.; Leone, M.; Lupu, M.N.; Vincent, J.L.; et al. Sepsis in Intensive Care Unit Patients: Worldwide Data From the Intensive Care over Nations Audit. Open Forum Infect. Dis. 2018, 5,ofy313. [CrossRef]
15. Karvouniaris, M.; Papadopoulos, D.; Koulenti, D.; Chatzimichail, M.; Papamichalis, P.; Ntafoulis, N.; Valsamaki, A.; Katsiafyl- loudis, P.; Vaitsi, E.; Oikonomou, K.; et al. Impact of secondary sepsis on mortality in adult intensive care unit patients. Intensive Crit. Care Nurs. 2023, 75, 103345.[CrossRef]
16. Blot, S.; Ruppe, E.; Harbarth, S.; Asehnoune, K.; Poulakou, G.; Luyt, C.E.; Rello, J.; Klompas, M.; Depuydt, P.; Eckmann, C.; et al. Healthcare-associated infections in adult intensive care unit patients: Changes in epidemiology, diagnosis, prevention and contributions of new technologies.Intensive Crit. Care Nurs. 2022, 70, 103227. [CrossRef] [PubMed]
17. Bone, R.C.; Balk, R.A.; Cerra, F.B.; Dellinger, R.P.; Fein, A.M.; Knaus, W.A.; Schein, R.M.; Sibbald, W.J. Definitions for sepsis and organ failure and guidelines for the use of innovativetherapies in sepsis. Chest 1992, 101, 1644–1655. [CrossRef] [PubMed]
18. Levy, M.M.; Fink, M.P.; Marshall, J.C.; Abraham, E.; Angus, D.; Cook, D.; Cohen, J.; Opal,S.M.; Vincent, J.L.; Ramsay, G.; et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International SepsisDefinitions Conference. Crit. Care Med. 2003, 31, 1250–1256. [CrossRef]
19. Investigators, A.; Group, A.C.T.; Peake, S.L.; Delaney, A.; Bailey, M.; Bellomo, R.; Cameron, P.A.; Cooper, D.J.; Higgins, A.M.; Holdgate, A.; et al. Goal-directed resuscitation for patients with early septic shock. N. Engl. J. Med. 2014, 371, 1496–1506. [CrossRef]
20. Morelli, A.; Ertmer, C.; Westphal, M.; Rehberg, S.; Kampmeier, T.; Ligges, S.; Orecchioni, A.; D’Egidio, A.; D’Ippoliti, F.; Raffone, C.; et al. Effect of heart rate control with esmolol onhemodynamic and clinical outcomes in patients with septic shock: A randomized clinical trial. JAMA2013, 310, 1683–1691. [CrossRef]
21. Shankar-Hari, M.; Phillips, G.S.; Levy, M.L.; Seymour, C.W.; Liu, V.X.; Deutschman, C.S.;Angus, D.C.; Rubenfeld, G.D.; Singer, M.; Sepsis Definitions Task, F. Developing a New Definitionand Assessing New Clinical Criteria for Septic Shock: For the Third International ConsensusDefinitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315, 775–787. [CrossRef]
22. de Grooth, H.J.; Postema, J.; Loer, S.A.; Parienti, J.J.; Oudemans-van Straaten, H.M.; Girbes, A.R. Unexplained mortality differences between septic shock trials: A systematic analysis of population characteristics and control-group mortality rates. Intensive Care Med. 2018, 44, 311–322.[CrossRef]
23. Fohner, A.E.; Greene, J.D.; Lawson, B.L.; Chen, J.H.; Kipnis, P.; Escobar, G.J.; Liu, V.X. Assessing clinical heterogeneity in sepsis through treatment patterns and machine learning. J. Am.Med. Inform. Assoc. 2019, 26, 1466–1477. [CrossRef] [PubMed]
24. Suarez-de-la-Rica, A.; Maseda, E. Precision Medicine in Sepsis and Septic Shock. J. Clin. Med.2022, 11, 5332. [CrossRef]
25. Gotts, J.E.; Matthay, M.A. Sepsis: Pathophysiology and clinical management. BMJ 2016, 353,i1585. [CrossRef]
26. Wong, H.R. Personalized medicine, endotypes, and intensive care medicine. Intensive Care Med.2015, 41, 1138–1140. [CrossRef]
27. Rhee, C.; Kadri, S.S.; Danner, R.L.; Suffredini, A.F.; Massaro, A.F.; Kitch, B.T.; Lee, G.;Klompas, M. Diagnosing sepsis is subjective and highly variable: A survey of intensivists using case vignettes. Crit. Care 2016, 20, 89. [CrossRef] [PubMed]
28. Vincent, J.L. The Clinical Challenge of Sepsis Identification and Monitoring. PLoS Med. 2016,13, e1002022. [CrossRef] [PubMed]
29. Kellum, J.A.; Formeck, C.L.; Kernan, K.F.; Gomez, H.; Carcillo, J.A. Subtypes and Mimics ofSepsis. Crit. Care Clin. 2022, 38, 195–211. [CrossRef]
30. Liu, C.; Suo, S.; Luo, L.; Chen, X.; Ling, C.; Cao, S. SOFA Score in relation to Sepsis: Clinical Implications in Diagnosis, Treatment, and Prognostic Assessment. Comput. Math. Methods Med. 2022,2022, 7870434. [CrossRef]
31. Vincent, J.L.; Opal, S.M.; Marshall, J.C.; Tracey, K.J. Sepsis definitions: Time for change. Lancet2013, 381, 774–775. [CrossRef]
32. Simpson, S.Q. New Sepsis Criteria: A Change We Should Not Make. Chest 2016, 149, 1117–1118. [CrossRef]
33. Shah, F.A.; Meyer, N.J.; Angus, D.C.; Awdish, R.; Azoulay, E.; Calfee, C.S.; Clermont, G.;Gordon, A.C.; Kwizera, A.; Leligdowicz, A.; et al. A Research Agenda for Precision Medicine in Sepsis and Acute Respiratory Distress Syndrome: An Official American Thoracic Society ResearchStatement. Am. J. Respir. Crit. Care Med. 2021, 204, 891–901. [CrossRef]
34. Wiersinga, W.J.; Seymour, C.W. (Eds.) Handbook of Sepsis; Springer: Cham, Switzerland, 2018.
35. Castela Forte, J.; Perner, A.; van der Horst, I.C.C. The use of clustering algorithms in critical care research to unravel patient heterogeneity. Intensive Care Med. 2019, 45, 1025–1028. [CrossRef]
36. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado,F.R.; McIntyre, L.; Ostermann, M.; Prescott, H.C.; et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 2021, 47, 1181–1247. [CrossRef] [PubMed]
37. Vincent, J.L.; Singer, M.; Einav, S.; Moreno, R.; Wendon, J.; Teboul, J.L.; Bakker, J.; Hernandez,G.; Annane, D.; de Man, A.M.E.; et al. Equilibrating SSC guidelines with individualized care. Crit.Care 2021, 25, 397. [CrossRef] [PubMed]
38. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado, F.R.; McIntyre, L.; Ostermann, M.; Prescott, H.C.; et al. Executive Summary: Surviving Sepsis Campaign: International Guidelines for the Management of Sepsis and Septic Shock 2021. Crit. CareMed. 2021, 49, 1974–1982. [CrossRef] [PubMed]
39. Nachtomy, O.; Shavit, A.; Yakhini, Z. Gene expression and the concept of the phenotype. Stud.Hist. Philos. Biol. Biomed. Sci. 2007,
38, 238–254. [CrossRef] [PubMed]
40. Seymour, C.W.; Gomez, H.; Chang, C.H.; Clermont, G.; Kellum, J.A.; Kennedy, J.; Yende, S.;Angus, D.C. Precision medicine for all? Challenges and opportunities for a precision medicineapproach to critical illness. Crit. Care 2017, 21, 257. [CrossRef]
41. Beutler, B.; Du, X.; Hoebe, K. From phenomenon to phenotype and from phenotype to gene: Forward genetics and the problem of sepsis. J. Infect. Dis. 2003, 187 (Suppl. S2), S321–S326.[CrossRef]
42. Ward, N.S.; Levy, M.M. (Eds.) Sepsis, Definitions, Pathophysiology and the Challenge ofBedside Management; Springer Nature: Cham,Switzerland, 2017.
43. Available online: https://www.ibm.com/topics/machine-learning (accessed on 12 May 2023).
44. Ke, X.; Zhang, F.; Huang, G.; Wang, A. Interpretable Machine Learning to Optimize Early In-Hospital Mortality Prediction for Elderly Patients with Sepsis: A Discovery Study. Comput. Math.Methods Med. 2022, 2022, 4820464. [CrossRef]
45. Vranas, K.C.; Jopling, J.K.; Sweeney, T.E.; Ramsey, M.C.; Milstein, A.S.; Slatore, C.G.;Escobar, G.J.; Liu, V.X. Identifying Distinct Subgroups of ICU Patients: A Machine Learning Approach. Crit. Care Med. 2017, 45, 1607–1615. [CrossRef]
46. Qin, Y.; Caldino Bohn, R.I.; Sriram, A.; Kernan, K.F.; Carcillo, J.A.; Kim, S.; Park, H.J.Refining empiric subgroups of pediatric sepsis using machine-learning techniques on observationaldata. Front. Pediatr. 2023, 11, 1035576. [CrossRef] [PubMed]
47. Komorowski, M.; Green, A.; Tatham, K.C.; Seymour, C.; Antcliffe, D. Sepsis biomarkers anddiagnostic tools with a focus on machine learning. eBioMedicine 2022, 86, 104394. [CrossRef]
48. Li, H.; Markal, A.; Balch, J.A.; Loftus, T.J.; Efron, P.A.; Ozrazgat-Baslanti, T.; Bihorac, A.Methods for Phenotyping Adult Patients in Sepsis and Septic Shock: A Scoping Review. Crit. CareExplor. 2022, 4, e0672. [CrossRef] [PubMed]
49. Sharma, M.; Taweesedt, P.T.; Surani, S. Utilizing Artificial Intelligence in Critical Care: AddingA Handy Tool to Our Armamen- tarium. Cureus 2021, 13, e15531. [CrossRef]
50. Loftus, T.J.; Shickel, B.; Balch, J.A.; Tighe, P.J.; Abbott, K.L.; Fazzone, B.; Anderson, E.M.; Rozowsky, J.; Ozrazgat-Baslanti, T.; Ren, Y.; et al. Phenotype clustering in health care: A narrative review for clinicians. Front. Artif. Intell. 2022, 5, 842306. [CrossRef] [PubMed]
51. Baek, M.S.; Kim, J.H.; Kwon, Y.S. Cluster analysis integrating age and body temperature for mortality in patients with sepsis: A multicenter retrospective study. Sci. Rep. 2022, 12, 1090.[CrossRef]
52. Thomas-Ruddel, D.O.; Hoffmann, P.; Schwarzkopf, D.; Scheer, C.; Bach, F.; Komann, M.; Gerlach, H.; Weiss, M.; Lindner, M.; Ruddel, H.; et al. Fever and hypothermia represent two populations of sepsis patients and are associated with outside temperature. Crit. Care 2021, 25, 368.[CrossRef]
53. Wu, D.Y.; Lu, S.Q. The Effects of Abnormal Body Temperature on the Prognosis of Patientswith Septic Shock. Ther. Hypothermia
Temp. Manag. 2020, 10, 148–152. [CrossRef]
54. Honore, P.M.; Barreto Gutierrez, L.; Kugener, L.; Redant, S.; Attou, R.; Gallerani, A.; De Bels, D. Mortality in non-elderly septic patients was increased with hypothermia and decreased with fever whilemortality in elderly patients was not associated with body temperature: Beware of some confounders!Crit. Care 2020, 24, 606. [CrossRef] [PubMed]
55. Bhavani, S.V.; Carey, K.A.; Gilbert, E.R.; Afshar, M.; Verhoef, P.A.; Churpek, M.M. Identifying Novel Sepsis Subphenotypes Using Temperature Trajectories. Am. J. Respir. Crit. Care Med. 2019,200, 327–335. [CrossRef]
56. Henning, D.J.; Carey, J.R.; Oedorf, K.; Day, D.E.; Redfield, C.S.; Huguenel, C.J.; Roberts, J.C.;Sanchez, L.D.; Wolfe, R.E.; Shapiro,
N.I. The Absence of Fever Is Associated with Higher Mortality and Decreased Antibiotic and IV Fluid Administration in Emergency Department Patients with Suspected Septic Shock. Crit. Care Med.2017, 45, e575–e582. [CrossRef] [PubMed]
57. Sunden-Cullberg, J.; Rylance, R.; Svefors, J.; Norrby-Teglund, A.; Bjork, J.; Inghammar, M. Fever in the Emergency Department Predicts Survival of Patients with Severe Sepsis and Septic Shock Admitted to the ICU. Crit. Care Med. 2017, 45, 591–599. [CrossRef] [PubMed]
58. Rumbus, Z.; Matics, R.; Hegyi, P.; Zsiboras, C.; Szabo, I.; Illes, A.; Petervari, E.; Balasko, M.; Marta, K.; Miko, A.; et al. Fever Is Associated with Reduced, Hypothermia with Increased Mortality in Septic Patients: A Meta-Analysis of Clinical Trials. PLoS ONE 2017, 12, e0170152. [CrossRef]
59. Wiewel, M.A.; Harmon, M.B.; van Vught, L.A.; Scicluna, B.P.; Hoogendijk, A.J.; Horn, J.; Zwinderman, A.H.; Cremer, O.L.; Bonten, M.J.; Schultz, M.J.; et al. Risk factors, host response andoutcome of hypothermic sepsis. Crit. Care 2016, 20, 328. [CrossRef]
60. Bhavani, S.V.; Huang, E.S.; Verhoef, P.A.; Churpek, M.M. Novel Temperature TrajectorySubphenotypes in COVID-19. Chest 2020,158, 2436–2439. [CrossRef]
61. Shimazui, T.; Nakada, T.A.; Walley, K.R.; Oshima, T.; Abe, T.; Ogura, H.; Shiraishi, A.;Kushimoto, S.; Saitoh, D.; Fujishima, S.; et al. Significance of body temperature in elderly patients with sepsis. Crit. Care 2020, 24, 387. [CrossRef]
62. Bhavani, S.V.; Wolfe, K.S.; Hrusch, C.L.; Greenberg, J.A.; Krishack, P.A.; Lin, J.; Lecompte-Osorio, P.; Carey, K.A.; Kress, J.P.; Coopersmith, C.M.; et al. Temperature Trajectory Subphenotypes Correlate with Immune Responses in Patients with Sepsis. Crit. Care Med. 2020, 48, 1645–1653.[CrossRef]
63. Ito, Y.; Kudo, D.; Kushimoto, S. Association between low body temperature on admission and in-hospital mortality according to body mass index categories of patients with sepsis. Medicine 2022,101, e31657. [CrossRef]
64. Bhavani, S.V.; Verhoef, P.A.; Maier, C.L.; Robichaux, C.; Parker, W.F.; Holder, A.; Kamaleswaran, R.; Wang, M.D.; Churpek, M.M.; Coopersmith, C.M. Coronavirus Disease 2019 Temperature Trajectories Correlate with Hyperinflammatory and Hypercoagulable Subphenotypes.Crit. Care Med. 2022, 50, 212–223. [CrossRef]
65. Zhu, J.L.; Yuan, S.Q.; Huang, T.; Zhang, L.M.; Xu, X.M.; Yin, H.Y.; Wei, J.R.; Lyu, J. Influence of systolic blood pressure trajectory on in-hospital mortality in patients with sepsis. BMC Infect. Dis.2023, 23, 90. [CrossRef]
66. Daulasim, A.; Vieillard-Baron, A.; Geri, G. Hemodynamic clinical phenotyping in septic shock.Curr. Opin. Crit. Care 2021, 27,290–297. [CrossRef] [PubMed]
67. Geri, G.; Vignon, P.; Aubry, A.; Fedou, A.L.; Charron, C.; Silva, S.; Repesse, X.; Vieillard-Baron, A. Cardiovascular clusters in septic shock combining clinical and echocardiographic parameters: Apost hoc analysis. Intensive Care Med. 2019, 45, 657–667. [CrossRef] [PubMed]
68. Knox, D.B.; Lanspa, M.J.; Kuttler, K.G.; Brewer, S.C.; Brown, S.M. Phenotypic clusters withinsepsis-associated multiple organ dysfunction syndrome. Intensive Care Med. 2015, 41, 814–822.[CrossRef] [PubMed]
69. Ibrahim, Z.M.; Wu, H.; Hamoud, A.; Stappen, L.; Dobson, R.J.B.; Agarossi, A. On classifyingsepsis heterogeneity in the ICU: Insight using machine learning. J. Am. Med. Inform. Assoc. 2020, 27,437–443. [CrossRef]
70. Zhang, Z.; Zhang, G.; Goyal, H.; Mo, L.; Hong, Y. Identification of subclasses of sepsis thatshowed different clinical outcomes and responses to amount of fluid resuscitation: A latent profileanalysis. Crit. Care 2018, 22, 347. [CrossRef]
71. Seymour, C.W.; Kennedy, J.N.; Wang, S.; Chang, C.H.; Elliott, C.F.; Xu, Z.; Berry, S.; Clermont, G.; Cooper, G.; Gomez, H.; et al. Derivation, Validation, and Potential Treatment Implications of Novel Clinical Phenotypes for Sepsis. JAMA 2019, 321, 2003–2017. [CrossRef]
72. Xu, Z.; Mao, C.; Su, C.; Zhang, H.; Siempos, I.; Torres, L.K.; Pan, D.; Luo, Y.; Schenck, E.J.; Wang, F. Sepsis subphenotyping based on organ dysfunction trajectory. Crit. Care 2022, 26, 197.[CrossRef]
73. Sharafoddini, A.; Dubin, J.A.; Lee, J. Identifying subpopulations of septic patients: A temporal data-driven approach. Comput. Biol. Med. 2021, 130, 104182. [CrossRef]
74. Aldewereld, Z.T.; Zhang, L.A.; Urbano, A.; Parker, R.S.; Swigon, D.; Banerjee, I.; Gomez, H.;Clermont, G. Identification of Clinical Phenotypes in Septic Patients Presenting with Hypotension orElevated Lactate. Front. Med. 2022, 9, 794423. [CrossRef] [PubMed]
75. Ding, M.; Luo, Y. Unsupervised phenotyping of sepsis using nonnegative matrix factorizationof temporal trends from a multivariate panel of physiological measurements. BMC Med. Inform. Decis. Mak. 2021, 21, 95. [CrossRef] [PubMed]
76. Papin, G.; Bailly, S.; Dupuis, C.; Ruckly, S.; Gainnier, M.; Argaud, L.; Azoulay, E.; Adrie, C.;Souweine, B.; Goldgran-Toledano, D.; et al. Clinical and biological clusters of sepsis patients usinghierarchical clustering. PLoS ONE 2021, 16, e0252793. [CrossRef]
77. Shald, E.A.; Erdman, M.J.; Ferreira, J.A. Impact of Clinical Sepsis Phenotypes on Mortalityand Fluid Status in Critically Ill Patients. Shock 2022, 57, 57–62. [CrossRef] [PubMed]
78. Wang, M.; Zhu, B.; Jiang, L.; Luo, X.; Wang, N.; Zhu, Y.; Xi, X. Association between Latent Trajectories of Fluid Balance and Clinical Outcomes in Critically Ill Patients with Acute Kidney Injury: A Prospective Multicenter Observational Study. Kidney Dis. 2022, 8, 82–92. [CrossRef]
79. Ma, P.; Liu, J.; Shen, F.; Liao, X.; Xiu, M.; Zhao, H.; Zhao, M.; Xie, J.; Wang, P.; Huang, M.; et al. Individualized resuscitation strategy for septic shock formalized by finite mixture modeling and dynamic treatment regimen. Crit. Care 2021, 25, 243. [CrossRef]
80. Zhang, Z.; Ho, K.M.; Gu, H.; Hong, Y.; Yu, Y. Defining persistent critical illness based on growth trajectories in patients with sepsis. Crit. Care 2020, 24, 57. [CrossRef]
81. Yang, R.; Han, D.; Zhang, L.; Huang, T.; Xu, F.; Zheng, S.; Yin, H.; Lyu, J. Analysis of the correlation between the longitudinal trajectory of SOFA scores and prognosis in patients with sepsis at72 hour after admission based on group trajectory modeling.
J. Intensive Med. 2022, 2, 39–49. [CrossRef]
82. Soussi, S.; Sharma, D.; Juni, P.; Lebovic, G.; Brochard, L.; Marshall, J.C.; Lawler, P.R.; Herridge, M.; Ferguson, N.; Del Sorbo, L.; et al. Identifying clinical subtypes in sepsis-survivors with different one-year outcomes: A secondary latent class analysis of the FROG-ICU cohort. Crit. Care 2022, 26,114. [CrossRef]
83. Taylor, S.P.; Bray, B.C.; Chou, S.H.; Burns, R.; Kowalkowski, M.A. Clinical Subtypes of SepsisSurvivors Predict Readmission and Mortality after Hospital Discharge. Ann. Am. Thorac. Soc. 2022,19, 1355–1363. [CrossRef]
84. Boede, M.; Gensichen, J.S.; Jackson, J.C.; Eissler, F.; Lehmann, T.; Schulz, S.; Petersen, J.J.; Wolf, F.P.; Dreischulte, T.; Schmidt, K.F.R. Trajectories of depression in sepsis survivors: Anobservational cohort study. Crit. Care 2021, 25, 161. [CrossRef] [PubMed]
85. Puthucheary, Z.A.; Gensichen, J.S.; Cakiroglu, A.S.; Cashmore, R.; Edbrooke, L.; Heintze, C.; Neumann, K.; Wollersheim, T.; Denehy, L.; Schmidt, K.F.R. Implications for post critical illness trial design: Sub-phenotyping trajectories of functional recovery among sepsis survivors. Crit. Care 2020,24, 577. [CrossRef] [PubMed]
86. Prescott, H.C. Identifying Sepsis Subtypes from Routine Clinical Data. Am. J. Respir. Crit. CareMed. 2019, 200, 272–273. [CrossRef][PubMed]
87. Nagin, D.S.; Jones, B.L.; Passos, V.L.; Tremblay, R.E. Group-based multi-trajectory modeling. Stat. Methods Med. Res. 2018, 27, 2015–2023. [CrossRef]
88. Leijte, G.P.; Kox, M.; Pickkers, P. Fever in Sepsis: Still a Hot Topic. Am. J. Respir. Crit. CareMed. 2019, 200, 263–264. [CrossRef]
89. Harmon, M.B.A.; Scicluna, B.P.; Wiewel, M.A.; Schultz, M.J.; Horn, J.; Cremer, O.L.; van der Poll, T.; Joost Wiersinga, W.; Juffermans, N.P.; The MARS Consortium. Patients with hypothermicsepsis have a unique gene expression profile compared to patients with fever and sepsis. J. Cell. Mol.Med. 2022, 26, 1896–1904. [CrossRef]
90. Young, P.J.; Bellomo, R. Fever in sepsis: Is it cool to be hot? Crit. Care 2014, 18, 109. [CrossRef]
91. Drewry, A.M.; Mohr, N.M.; Ablordeppey, E.A.; Dalton, C.M.; Doctor, R.J.; Fuller, B.M.; Kollef, M.H.; Hotchkiss, R.S. Therapeutic Hyperthermia Is Associated with Improved Survival in Afebrile Critically Ill Patients with Sepsis: A Pilot Randomized Trial. Crit. Care Med. 2022, 50, 924–934.[CrossRef]
92. Kula, R. Therapeutic Hyperthermia Is Associated with Improved Survival in Afebrile Critically Ill Patients with Sepsis: A Pilot Randomized Trial. Crit. Care Med. 2022, 50, e693–e694. [CrossRef]
93. Nowak, R.M.; Reed, B.P.; Nanayakkara, P.; DiSomma, S.; Moyer, M.L.; Millis, S.; Levy, P.Presenting hemodynamic phenotypes in ED patients with confirmed sepsis. Am. J. Emerg. Med. 2016, 34, 2291–2297. [CrossRef]
94. Hess, M.L.; Hastillo, A.; Greenfield, L.J. Spectrum of cardiovascular function during gram-negative sepsis. Prog. Cardiovasc. Dis.1981, 23, 279–298. [CrossRef] [PubMed]
95. Zhang, H.; Wang, X.; Yin, W.; Zhang, H.; Liu, L.; Pan, P.; Zhu, Y.; Huang, W.; Xing, Z.; Yao, B.; et al. A multicenter prospective cohort study of cardiac ultrasound phenotypes in patients with sepsis: Study protocol for a multicenter prospective cohort trial. Front. Med. 2022, 9, 938536. [CrossRef][PubMed]
96. Kattan, E.; Bakker, J.; Estenssoro, E.; Ospina-Tascon, G.A.; Cavalcanti, A.B.; Backer, D.; Vieillard-Baron, A.; Teboul, J.L.; Castro, R.; Hernandez, G. Hemodynamic phenotype-based, capillary refill time-targeted resuscitation in early septic shock: The ANDROMEDA-SHOCK-2 Randomized Clinical Trial study protocol. Rev. Bras. Ter. Intensiva 2022, 34, 96–106. [CrossRef] [PubMed]
97. Bhavani, S.V.; Semler, M.; Qian, E.T.; Verhoef, P.A.; Robichaux, C.; Churpek, M.M.;Coopersmith, C.M. Development and validation of novel sepsis subphenotypes using trajectories ofvital signs. Intensive Care Med. 2022, 48, 1582–1592. [CrossRef]
98. Knaus, W.A.; Marks, R.D. New Phenotypes for Sepsis: The Promise and Problem of ApplyingMachine Learning and Artificial Intelligence in Clinical Research. JAMA 2019, 321, 1981–1982.[CrossRef]
99. Hasegawa, D.; Nishida, O. Patient selection in sepsis: Precision medicine using phenotypes andits implications for future clinical trial design. J. Thorac. Dis. 2019, 11, 3672–3675. [CrossRef]
100. Stortz, J.A.; Cox, M.C.; Hawkins, R.B.; Ghita, G.L.; Brumback, B.A.; Mohr, A.M.; Moldawer,L.L.; Efron, P.A.; Brakenridge, S.C.; Moore, F.A. Phenotypic heterogeneity by site of infection in surgical sepsis: A prospective longitudinal study. Crit. Care 2020, 24, 203. [CrossRef]
101. Blot, S.; Antonelli, M.; Arvaniti, K.; Blot, K.; Creagh-Brown, B.; de Lange, D.; De Waele, J.;Deschepper, M.; Dikmen, Y.; Dimopoulos, G.; et al. Epidemiology of intra-abdominal infection and sepsis in critically ill patients: “AbSeS”, a multinational observational cohort study and ESICM TrialsGroup Project. Intensive Care Med. 2019, 45, 1703–1717. [CrossRef]
102. Miao, H.; Cui, Z.; Guo, Z.; Chen, Q.; Su, W.; Sun, Y.; Sun, M.; Ma, X.; Ding, R. Identification of Subphenotypes of Sepsis-Associated Liver Dysfunction Using Cluster Analysis. Shock 2023, 59, 368–374. [CrossRef]
103. Wiersema, R.; Jukarainen, S.; Vaara, S.T.; Poukkanen, M.; Lakkisto, P.; Wong, H.; Linder, A.; van der Horst, I.C.C.; Pettila, V. Two subphenotypes of septic acute kidney injury are associated withdifferent 90-day mortality and renal recovery. Crit. Care 2020, 24, 150. [CrossRef]
104. Thau, M.R.; Bhatraju, P.K. Sub-Phenotypes of Acute Kidney Injury: Do We Have Progress forPersonalizing Care? Nephron 2020,144, 677–679. [CrossRef]
105. Luo, X.Q.; Yan, P.; Zhang, N.Y.; Luo, B.; Wang, M.; Deng, Y.H.; Wu, T.; Wu, X.; Liu, Q.;Wang, H.S.; et al. Machine learning for early discrimination between transient and persistent acutekidney injury in critically ill patients with sepsis. Sci. Rep. 2021, 11, 20269. [CrossRef] [PubMed]
106. Ozrazgat-Baslanti, T.; Loftus, T.J.; Mohandas, R.; Wu, Q.; Brakenridge, S.; Brumback, B.; Efron, P.A.; Anton, S.; Moore, F.A.; Moldawer, L.L.; et al. Clinical Trajectories of Acute Kidney Injury in Surgical Sepsis: A Prospective Observational Study. Ann. Surg. 2022, 275, 1184–1193. [CrossRef]
107. Chen, X.; Li, J.; Liu, G.; Chen, X.; Huang, S.; Li, H.; Liu, S.; Li, D.; Yang, H.; Zheng, H.; et al.Identification of Distinct Clinical Phenotypes of Heterogeneous Mechanically Ventilated ICU Patients Using Cluster Analysis. J. Clin. Med. 2023, 12, 1499. [CrossRef] [PubMed]
108. Su, L.; Zhang, Z.; Zheng, F.; Pan, P.; Hong, N.; Liu, C.; He, J.; Zhu, W.; Long, Y.; Liu, D. Five novel clinical phenotypes for critically ill patients with mechanical ventilation in intensive care units: A retrospective and multi database study. Respir. Res. 2020, 21, 325. [CrossRef]
109. Yu, S.; Ma, X.; Li, X. Phenotype-oriented anticoagulant therapy for sepsis: Still a work in progress. Int. J. Hematol. 2022, 116, 48–54. [CrossRef] [PubMed]
110. Kudo, D.; Goto, T.; Uchimido, R.; Hayakawa, M.; Yamakawa, K.; Abe, T.; Shiraishi, A.; Kushimoto, S. Coagulation phenotypes in sepsis and effects of recombinant human thrombomodulin: An analysis of three multicentre observational studies. Crit. Care 2021, 25, 114. [CrossRef]
111. Helms, J.; Iba, T.; Connors, J.M.; Gando, S.; Levi, M.; Meziani, F.; Levy, J.H. How to managecoagulopathies in critically ill patients.
Intensive Care Med. 2023, 49, 273–290. [CrossRef]
112. Guo, F.; Zhu, X.; Wu, Z.; Zhu, L.; Wu, J.; Zhang, F. Clinical applications of machine learning in the survival prediction and classification of sepsis: Coagulation and heparin usage matter. J. Transl.Med. 2022, 20, 265. [CrossRef]
113. Dong, M.; Chen, S.; Lin, S.; Han, F.; Zhong, M. Insights into COVID-19-associated criticalillness: A narrative review. Ann. Transl. Med. 2023, 11, 220. [CrossRef]
114. Dubowski, K.; Braganza, G.T.; Bozack, A.; Colicino, E.; DeFelice, N.; McGuinn, L.; Maru, D.;Lee, A.G. COVID-19 subphenotypes at hospital admission are associated with mortality: A cross-sectional study. Ann. Med. 2023, 55, 12–23. [CrossRef] [PubMed]
115. Oh, W.; Jayaraman, P.; Sawant, A.S.; Chan, L.; Levin, M.A.; Charney, A.W.; Kovatch, P.; Glicksberg, B.S.; Nadkarni, G.N. Using sequence clustering to identify clinically relevantsubphenotypes in patients with COVID-19 admitted to the intensive care unit.J. Am. Med. Inform.Assoc. 2022, 29, 489–499. [CrossRef] [PubMed]
116. Fish, M.; Rynne, J.; Jennings, A.; Lam, C.; Lamikanra, A.A.; Ratcliff, J.; Cellone-Trevelin, S.; Timms, E.; Jiriha, J.; Tosi, I.; et al. Coronavirus disease 2019 subphenotypes and differential treatment response to convalescent plasma in critically ill adults: Secondary analyses of a randomized clinicaltrial. Intensive Care Med. 2022, 48, 1525–1538. [CrossRef] [PubMed]
117. Bruse, N.; Kooistra, E.J.; Jansen, A.; van Amstel, R.B.E.; de Keizer, N.F.; Kennedy, J.N.; Seymour, C.; van Vught, L.A.; Pickkers, P.; Kox, M. Clinical sepsis phenotypes in critically illCOVID-19 patients. Crit. Care 2022, 26, 244. [CrossRef]
118. de Prost, N.; Audureau, E.; Heming, N.; Gault, E.; Pham, T.; Chaghouri, A.; de Montmollin, N.; Voiriot, G.; Morand-Joubert, L.; Joseph, A.; et al. Clinical phenotypes and outcomes associated withSARS-CoV-2 variant Omicron in critically ill French patients with COVID-19. Nat. Commun. 2022,13, 6025. [CrossRef]
119. Morales Chacon, L.M.; Galan Garcia, L.; Cruz Hernandez, T.M.; Pavon Fuentes, N.; MaragotoRizo, C.; Morales Suarez, I.; Morales Chacon, O.; Abad Molina, E.; Rocha Arrieta, L. Clinical Phenotypes and Mortality Biomarkers: A Study Focused on COVID-19 Patients with NeurologicalDiseases in Intensive Care Units. Behav. Sci. 2022, 12, 234. [CrossRef]
120. Wang, X.; Jehi, L.; Ji, X.; Mazzone, P.J. Phenotypes and Subphenotypes of Patients with COVID-19: A Latent Class Modeling Analysis. Chest 2021, 159, 2191–2204. [CrossRef]
121. Bos, L.D.J.; Sjoding, M.; Sinha, P.; Bhavani, S.V.; Lyons, P.G.; Bewley, A.F.; Botta, M.; Tsonas, A.M.; Serpa Neto, A.; Schultz, M.J.; et al. Longitudinal respiratory subphenotypes in patients with COVID-19-related acute respiratory distress syndrome: Results from three observationalcohorts. Lancet Respir. Med. 2021, 9, 1377–1386. [CrossRef]
122. Su, C.; Xu, Z.; Hoffman, K.; Goyal, P.; Safford, M.M.; Lee, J.; Alvarez-Mulett, S.; Gomez-Escobar, L.; Price, D.R.; Harrington, J.S.; et al. Identifying organ dysfunction trajectory-based subphenotypes in critically ill patients with COVID-19. Sci. Rep. 2021, 11, 15872. [CrossRef]
123. Ranjeva, S.; Pinciroli, R.; Hodell, E.; Mueller, A.; Hardin, C.C.; Thompson, B.T.; Berra, L. Identifying clinical and biochemical phenotypes in acute respiratory distress syndrome secondary to coronavirus disease-2019. eClinicalMedicine 2021, 34, 100829. [CrossRef]
124. Vasquez, C.R.; Gupta, S.; Miano, T.A.; Roche, M.; Hsu, J.; Yang, W.; Holena, D.N.; Reilly, J.P.; Schrauben, S.J.; Leaf, D.E.; et al. Identification of Distinct Clinical Subphenotypes in Critically IllPatients with COVID-19. Chest 2021, 160, 929–943. [CrossRef]
125. Gutierrez-Gutierrez, B.; Del Toro, M.D.; Borobia, A.M.; Carcas, A.; Jarrin, I.; Yllescas, M.; Ryan, P.; Pachon, J.; Carratala, J.; Berenguer, J.; et al. Identification and validation of clinical phenotypes with prognostic implications in patients admitted to hospital with COVID-19: A multicentre cohortstudy. Lancet Infect. Dis. 2021, 21, 783–792. [CrossRef] [PubMed]
126. Chen, H.; Zhu, Z.; Su, N.; Wang, J.; Gu, J.; Lu, S.; Zhang, L.; Chen, X.; Xu, L.; Shao, X.; et al. Identification and Prediction of Novel Clinical Phenotypes for Intensive Care Patients with SARS-CoV-2 Pneumonia: An Observational Cohort Study. Front. Med. 2021, 8, 681336. [CrossRef][PubMed]
127. Osuchowski, M.F.; Rosengart, M.R. Change Is the Only Constant: How to Adopt the New Trends in Sepsis Modeling? Crit. Care Med. 2019, 47, 1673–1675. [CrossRef] [PubMed]
128. Sinha, P.; Calfee, C.S.; Cherian, S.; Brealey, D.; Cutler, S.; King, C.; Killick, C.; Richards, O.; Cheema, Y.; Bailey, C.; et al. Prevalence of phenotypes of acute respiratory distress syndrome in critically ill patients with COVID-19: A prospective observational study. Lancet Respir. Med. 2020, 8,1209–1218. [CrossRef]
129. Blanchard, F.; James, A.; Assefi, M.; Kapandji, N.; Constantin, J.M. Personalized medicine targeting different ARDS phenotypes: The future of pharmacotherapy for ARDS? Expert. Rev. Respir.Med. 2023, 17, 41–52. [CrossRef]
130. Sinha, P.; Meyer, N.J.; Calfee, C.S. Biological Phenotyping in Sepsis and Acute Respiratory Distress Syndrome. Annu. Rev. Med.
2023, 74, 457–471. [CrossRef]
131. Maddali, M.V.; Churpek, M.; Pham, T.; Rezoagli, E.; Zhuo, H.; Zhao, W.; He, J.; Delucchi, K.L.; Wang, C.; Wickersham, N.; et al. Validation and utility of ARDS subphenotypes identified by machine-learning models using clinical data: An observational, multicohort, retrospective analysis.Lancet Respir. Med. 2022, 10, 367–377. [CrossRef]
132. Bai, Y.; Xia, J.; Huang, X.; Chen, S.; Zhan, Q. Using machine learning for the early prediction of sepsis-associated ARDS in the ICU and identification of clinical phenotypes with differentialresponses to treatment. Front. Physiol. 2022, 13, 1050849. [CrossRef]
133. Hashem, M.D.; Hopkins, R.O.; Colantuoni, E.; Dinglas, V.D.; Sinha, P.; Aronson Friedman, L.; Morris, P.E.; Jackson, J.C.; Hough, C.L.; Calfee, C.S.; et al. Six-month and 12-month patient outcomes based on inflammatory subphenotypes in sepsis-associated ARDS: Secondary analysis of SAILS-ALTOS trial. Thorax 2022, 77, 22–30. [CrossRef]
134. Zhang, H.; Li, Z.; Zheng, W.; Zhang, L.; Yang, T.; Xie, K.; Yu, Y. Risk stratification of patients with acute respiratory distress syndrome complicated with sepsis using lactate trajectories. BMC Pulm. Med. 2022, 22, 339. [CrossRef] [PubMed]
135. Wu, L.; Lei, Q.; Gao, Z.; Zhang, W. Research Progress on Phenotypic Classification of Acute Respiratory Distress Syndrome: A Narrative Review. Int. J. Gen. Med. 2022, 15, 8767–8774.[CrossRef]
136. Alipanah, N.; Calfee, C.S. Phenotyping in acute respiratory distress syndrome: State of the art and clinical implications. Curr. Opin. Crit. Care 2022, 28, 1–8. [CrossRef] [PubMed]
137. Martin, T.R.; Zemans, R.L.; Ware, L.B.; Schmidt, E.P.; Riches, D.W.H.; Bastarache, L.; Calfee, C.S.; Desai, T.J.; Herold, S.; Hough, C.L.; et al. New Insights into Clinical and Mechanistic Heterogeneity of the Acute Respiratory Distress Syndrome: Summary of the Aspen Lung Conference2021. Am. J. Respir. Cell Mol. Biol. 2022, 67, 284–308. [CrossRef] [PubMed]
138. Chen, H.; Yu, Q.; Xie, J.; Liu, S.; Pan, C.; Liu, L.; Huang, Y.; Guo, F.; Qiu, H.; Yang, Y. Longitudinal phenotypes in patients with acute respiratory distress syndrome: A multi-database study.Crit. Care 2022, 26, 340. [CrossRef]
139. Duggal, A.; Kast, R.; Van Ark, E.; Bulgarelli, L.; Siuba, M.T.; Osborn, J.; Rey, D.A.; Zampieri, F.G.; Cavalcanti, A.B.; Maia, I.; et al. Identification of acute respiratory distress syndromesubphenotypes de novo using routine clinical data: A retrospective analysis of ARDS clinical trials.BMJ Open 2022, 12, e053297. [CrossRef]
140. Whebell, S.; Zhang, J. Bringing biological ARDS phenotypes to the bedside with machine-learning-based classifiers. Lancet Respir.Med. 2022, 10, 319–320. [CrossRef]
141. Bos, L.D.J.; Ware, L.B. Acute respiratory distress syndrome: Causes, pathophysiology, and phenotypes. Lancet 2022, 400, 1145–1156. [CrossRef]
142. Wendel Garcia, P.D.; Caccioppola, A.; Coppola, S.; Pozzi, T.; Ciabattoni, A.; Cenci, S.; Chiumello, D. Latent class analysis to predict intensive care outcomes in Acute Respiratory DistressSyndrome: A proposal of two pulmonary phenotypes. Crit. Care 2021, 25, 154. [CrossRef]
143. Sinha, P.; Furfaro, D.; Cummings, M.J.; Abrams, D.; Delucchi, K.; Maddali, M.V.; He, J.; Thompson, A.; Murn, M.; Fountain, J.; et al. Latent Class Analysis Reveals COVID-19-related Acute Respiratory Distress Syndrome Subgroups with Differential Responses to Corticosteroids. Am. J.Respir. Crit. Care Med. 2021, 204, 1274–1285. [CrossRef]
144. Sathe, N.A.; Zelnick, L.R.; Mikacenic, C.; Morrell, E.D.; Bhatraju, P.K.; McNeil, J.B.; Kosamo,S.; Hough, C.L.; Liles, W.C.; Ware, L.B.; et al. Identification of persistent and resolvingsubphenotypes of acute hypoxemic respiratory failure in two independent cohorts. Crit. Care 2021, 25,336. [CrossRef]
145. Liu, X.; Jiang, Y.; Jia, X.; Ma, X.; Han, C.; Guo, N.; Peng, Y.; Liu, H.; Ju, Y.; Luo, X.; et al.Identification of distinct clinical phenotypes of acute respiratory distress syndrome with differentialresponses to treatment. Crit. Care 2021, 25, 320. [CrossRef]
146. Millar, J.E.; Wildi, K.; Bartnikowski, N.; Bouquet, M.; Hyslop, K.; Passmore, M.R.; Ki, K.K.; See Hoe, L.E.; Obonyo, N.G.; Neyton, L.; et al. Characterizing preclinical sub-phenotypic models of acute respiratory distress syndrome: An experimental ovine study. Physiol. Rep. 2021, 9, e15048. [CrossRef][PubMed]
147. Heijnen, N.F.L.; Hagens, L.A.; Smit, M.R.; Cremer, O.L.; Ong, D.S.Y.; van der Poll, T.; vanVught, L.A.; Scicluna, B.P.; Schnabel, R.M.; van der Horst, I.C.C.; et al. Biological Subphenotypes of Acute Respiratory Distress Syndrome Show Prognostic Enrichment in Mechanically Ventilated Patients without Acute Respiratory Distress Syndrome. Am. J. Respir. Crit. Care Med. 2021, 203,1503–1511. [CrossRef] [PubMed]
148. Matthay, M.A.; Arabi, Y.M.; Siegel, E.R.; Ware, L.B.; Bos, L.D.J.; Sinha, P.; Beitler, J.R.;Wick, K.D.; Curley, M.A.Q.; Constantin, J.M.; et al. Phenotypes and personalized medicine in the acute respiratory distress syndrome. Intensive Care Med. 2020, 46, 2136–2152. [CrossRef]
149. McNicholas, B.; Madden, M.G.; Laffey, J.G. Machine Learning Classifier Models: The Future for Acute Respiratory Distress Syndrome Phenotyping? Am. J. Respir. Crit. Care Med. 2020, 202, 919–920. [CrossRef]
150. Sinha, P.; Churpek, M.M.; Calfee, C.S. Machine Learning Classifier Models Can Identify Acute Respiratory Distress Syndrome Phenotypes Using Readily Available Clinical Data. Am. J. Respir. Crit.Care Med. 2020, 202, 996–1004. [CrossRef]
151. Sinha, P.; Delucchi, K.L.; McAuley, D.F.; O’Kane, C.M.; Matthay, M.A.; Calfee, C.S. Development and validation of parsimonious algorithms to classify acute respiratory distress syndrome phenotypes: A secondary analysis of randomised controlled trials. Lancet Respir. Med.2020, 8, 247–257. [CrossRef] [PubMed]
152. Sinha, P.; Delucchi, K.L.; Thompson, B.T.; McAuley, D.F.; Matthay, M.A.; Calfee, C.S.; Network, N.A. Latent class analysis of ARDS subphenotypes: A secondary analysis of the statins for acutely injured lungs from sepsis (SAILS) study. Intensive Care Med. 2018, 44, 1859–1869.[CrossRef]
153. Levine, A.R.; Shanholtz, C.B. I, DOCTOR: The role of machine learning in phenotyping ARDS.eBioMedicine 2022, 75, 103770.[CrossRef]
154. Hu, W.; Chen, H.; Wang, H.; Peng, Q.; Wang, J.; Huang, W.; Liu, A.; Xu, J.; Li, Q.; Pan, C.; et al. Identifying high-risk phenotypes and associated harms of delayed time-to-antibiotics in patients with ICU onset sepsis: A retrospective cohort study. J. Crit. Care 2023, 74, 154221. [CrossRef] [PubMed]
155. Han, X.; Spicer, A.; Carey, K.A.; Gilbert, E.R.; Laiteerapong, N.; Shah, N.S.; Winslow, C.; Afshar,M.; Kashiouris, M.G.; Churpek,M.M. Identifying High-Risk Subphenotypes and Associated HarmsFrom Delayed Antibiotic Orders and Delivery. Crit. Care Med.2021, 49, 1694–1705. [CrossRef]
156. Qi, J.; Lei, J.; Li, N.; Huang, D.; Liu, H.; Zhou, K.; Dai, Z.; Sun, C. Machine learning modelsto predict in-hospital mortality in septic patients with diabetes. Front. Endocrinol. 2022, 13, 1034251.[CrossRef] [PubMed]
157. Bao, C.; Deng, F.; Zhao, S. Machine-learning models for prediction of sepsis patients mortality. Med. Intensiva 2022, 47, 315–325. [CrossRef]
158. Yu, H.; Zhang, H.; Lang, Y.; Li, S.; Wan, X. Identifying the Phenotypes of Sepsis that will Benefitfrom Red Blood Cell Transfusion Using Unsupervised Cluster Analysis. Clin. Lab. 2022, 68, 210619.[CrossRef] [PubMed]
159. Liu, R.; Greenstein, J.L.; Granite, S.J.; Fackler, J.C.; Bembea, M.M.; Sarma, S.V.; Winslow, R.L. Data-driven discovery of a novel sepsis pre-shock state predicts impending septic shock in the ICU.Sci. Rep. 2019, 9, 6145. [CrossRef]
160. Carcillo, J.A.; Halstead, E.S.; Hall, M.W.; Nguyen, T.C.; Reeder, R.; Aneja, R.; Shakoory, B.; Simon, D.; on behalf of the Eunice Kennedy Shriver National Institute of Child Health and Human Development Collaborative Pediatric Critical Care Research Network investigators. Three Hypothetical Inflammation Pathobiology Phenotypes and Pediatric Sepsis-Induced Multiple OrganFailure Outcome. Pediatr. Crit. Care Med. 2017, 18, 513–523. [CrossRef]
161. Carcillo, J.A.; Berg, R.A.; Wessel, D.; Pollack, M.; Meert, K.; Hall, M.; Newth, C.; Lin, J.C.; Doctor, A.; Shanley, T.; et al. A Multicenter Network Assessment of Three Inflammation Phenotypes in Pediatric Sepsis-Induced Multiple Organ Failure. Pediatr. Crit. Care Med. 2019, 20, 1137–1146.[CrossRef]
162. Stroup, E.K.; Luo, Y.; Sanchez-Pinto, L.N. Phenotyping Multiple Organ Dysfunction Syndrome Using Temporal Trends in Critically Ill Children. In Proceedings of the 2019 IEEE International Conference on Bioinformatics and Biomedicine (BIBM), San Diego, CA, USA, 18–21 November2019; pp. 968–972. [CrossRef]
163. Sanchez-Pinto, L.N.; Stroup, E.K.; Pendergrast, T.; Pinto, N.; Luo, Y. Derivation and Validation of Novel Phenotypes of Multiple Organ Dysfunction Syndrome in Critically Ill Children. JAMA Netw.Open 2020, 3, e209271. [CrossRef]
164. Atreya, M.R.; Sanchez-Pinto, L.N.; Kamaleswaran, R. Commentary: ‘Critical illness subclasses:All roads lead to Rome’. Crit. Care2022, 26, 387. [CrossRef]
165. Dahmer, M.K.; Yang, G.; Zhang, M.; Quasney, M.W.; Sapru, A.; Weeks, H.M.; Sinha, P.;Curley, M.A.Q.; Delucchi, K.L.; Calfee, C.S.; et al. Identification of phenotypes in paediatric patients with acute respiratory distress syndrome: A latent class analysis. Lancet Respir. Med. 2022, 10, 289–297. [CrossRef] [PubMed]
166. Wong, H.R.; Sweeney, T.E.; Hart, K.W.; Khatri, P.; Lindsell, C.J. Pediatric Sepsis EndotypesAmong Adults with Sepsis. Crit. Care
Med. 2017, 45, e1289–e1291. [CrossRef] [PubMed]
167. Qin, Y.; Kernan, K.F.; Fan, Z.; Park, H.J.; Kim, S.; Canna, S.W.; Kellum, J.A.; Berg, R.A.; Wessel, D.; Pollack, M.M.; et al. Machine learning derivation of four computable 24-h pediatricsepsis phenotypes to facilitate enrollment in early personalized anti-inflammatory clinical trials. Crit.Care 2022, 26, 128. [CrossRef] [PubMed]
168. Wong, H.R. Searching for a Pediatric Severe Sepsis Phenotype: We Might Indeed Be There.Pediatr. Crit. Care Med. 2017, 18,
502–503. [CrossRef] [PubMed]
169. Workman, J.K.; Larsen, G.Y. Searching for a Pediatric Severe Sepsis Phenotype: Are We ThereYet? Pediatr. Crit. Care Med. 2017,
18, 82–83. [CrossRef]
170. Jacobs, L.; Wong, H.R. Sepsis Subclasses: Be Careful of What You Wish for. Pediatr. Crit. CareMed. 2017, 18, 591–592. [CrossRef]
171. Martin, B.; Bennett, T.D. Sepsis Computable Phenotypes in the Service of Observational Research. Crit. Care Med. 2019, 47, 303–305. [CrossRef]
172. Koutroulis, I.; Velez, T.; Wang, T.; Yohannes, S.; Galarraga, J.E.; Morales, J.A.; Freishtat, R.J.; Chamberlain, J.M. Pediatric sepsis phenotypes for enhanced therapeutics: An application of clusteringto electronic health records. J. Am. Coll. Emerg. Physicians Open 2022, 3, e12660. [CrossRef]
173. Mehta, S.; Gill, S.E. Improving clinical outcomes in sepsis and multiple organ dysfunction throughprecision medicine. J. Thorac. Dis. 2019, 11, 21–28. [CrossRef]
174. Maslove, D.M.; Lamontagne, F.; Marshall, J.C.; Heyland, D.K. A path to precision in the ICU.Crit. Care 2017, 21, 79. [CrossRef]
[~DETAIL_TEXT] =>
Georgios Papathanakos , Ioannis Andrianopoulos , Menelaos Xenikakis , Athanasios Papathanasiou , Despoina Koulenti , Stijn Blot and Vasilios Koulouras
Clinical Sepsis Phenotypes in Critically Ill Patients
Microorganisms 2023, 11, 2165. doi.org/10.3390/ microorganisms11092165
Аннотация: Сепсис, определяемый как опасная для жизни нерегулируемая реакция организма на инфекцию, приводящая к органной дисфункции, считается одной из ведущих причин смертности во всем мире, особенно в отделениях интенсивной терапии (ОРИТ). Более того, сепсис остается загадочным клиническим синдромом со сложной патофизиологией, до конца не изученной и значительной гетерогенностью как с точки зрения клинического проявления, реакции пациентов на доступные в настоящее время методы лечения, так и с точки зрения результатов. Эта неоднородность оказывается основным препятствием в нашем стремлении обеспечить улучшение результатов лечение пациентов с сепсисом в критическом состоянии; таким образом, идентификация клинических фенотипов абсолютно необходима. Хотя это может показаться чрезвычайно сложной задачей, в настоящее время методы искусственного интеллекта и машинного обучения могут быть использованы для количественной оценки сходства между людьми в популяции сепсиса и дифференциации их по отдельным фенотипам в отношении не только температуры, гемодинамики или типа органной дисфункции, но и волемического статуса\реакции на инфузию, траектории пребывания в ОРИТ и исхода. Остается надеяться, что в конечном итоге нам удастся определить как подгруппу пациентов с сепсисом, которым будет полезно то или иное терапевтическое вмешательство, так и правильное время его проведения в ходе заболевания.
Ключевые слова: сепсис; неоднородность; фенотип; машинное обучение; прецизионная медицина
1. Введение
Древние греки использовали слово «сепсис» (ση´ψη) для описания гниения. Первоначально сепсис использовался для обозначения последствий процесса, а не причины [1]. Лишь в XIXвеке, когда были идентифицированы микроорганизмы как причина инфекции, термин «сепсис» стал использоваться для описания клинического заболевания, вызванного тяжелой инфекцией. В настоящее время сепсис определяют как опасную для жизни нерегулируемую реакцию организма на инфекцию, приводящую к дисфункции нескольких органов [2]. Несмотря на важные медицинские достижения, сепсис даже сейчас представляет собой серьезную проблему как для клиницистов, так и для исследователей, поскольку его лечение по-прежнему ограничивается антибиотиками, инфузионной терапией и поддержкой функции органов. Поскольку в течение многих лет новые методы лечения не были доступны сепсис продолжает оставаться основной причиной смертности во всем мире, затрагивая как страны, богатые ресурсами, так и страны с ограниченными ресурсами [3,4] и встречается во всех возрастных группах [5–11]. По оценкам недавнего исследования, в 2017 году сепсис возник у 48,9 миллионов человек во всем мире и стал причиной 11 миллионов смертей [12]. Поэтому ВОЗобъявила сепсис глобальным приоритетом здравоохранения [13].
В частности, в ОРИТ, сепсис также остается ведущей причиной смертности, независимо от того, вызван ли он внебольничными или внутрибольничными инфекциями [14–16]. Хотя общества интенсивной терапии разработали согласованные определения сепсиса и септического шока с целью гармонизации критериев диагностики, лечения и включения в клинические исследования, показатели смертности в различных исследованиях по-прежнему сильно различаются. Более конкретно, в метаанализе обсервационных исследований смертность от септического шока составила 46%; однако в двух важных клинических исследованиях пациентов с септическим шоком, проведенных почти в один и тот же период, смертность в контрольной группе была крайне контрастной: 18,8% против 80% [2,17–21]. С другой стороны, при систематическом анализе 65 рандомизированных контрольных исследований (РКИ) септического шока, опубликованных в период с 2006 по 2018 г., средняя смертность в контрольных группах составила 38,6% при очень широкой вариабельности (оценка 95%, интервалы прогнозирования 13,5-71,7%) [22]. Вышеизложенное можно, по крайней мере частично, объяснить значительной гетерогенностью клинических исследований.
Для того чтобы полученные результаты были воспроизводимы и могли быть экстраполированы, необходима единая феноменологическая структура в отношении диагностических критериев и критериев включения, набора случаев и характеристик пациентов. Однако в случае сепсиса это невозможно из-за значительной внутренней и внешней гетерогенности [23].
Если гетерогенную группу пациентов с сепсисом можно разделить на отдельные фенотипы, и эти фенотипы характеризуются дискретной патофизиологией, то они также могут различаться по реакции на терапию; следовательно, будущие исследования методов лечения сепсиса могут использовать определение фенотипов для стратификации пациентов с сепсисом в клинических испытаниях и разработки стратегий лечения, более точно ориентированных на конкретные фенотипы сепсиса. Основная цель этого обзора — предоставить обзор различных клинических фенотипов, существующих у пациентов с сепсисом в критическом состоянии. Описательный обзор был признан наиболее подходящим подходом. Поиск литературы проводился в библиографической базе данных PubMed с момента ее создания по май 2023 г.; поисковые термины, связанные с «фенотипированием сепсиса», были объединены с терминами, касающимися «реанимации и интенсивной терапии». Два автора осуществляли поиск в базе данных независимо. Третий рецензент урегулировал любые разногласия в результатах двух проверяющих. К включению подлежала рецензируемая опубликованная литература, в том числе описательные обзоры. Дополнительные статьи были включены на основе мнения экспертов. В итоге в обзор были включены исследования, опубликованные на английском языке, в которых использовались данные о фенотипировании сепсиса у больных в критическом состоянии..
2. Сепсис: очень гетерогенное заболевание
2.1 Причины неоднородности, специфичные для пациента
Сепсис не прогрессирует и не проявляется одинаково у всех пациентов из-за значительной гетерогенности между людьми, патофизиологических различий и иммунологических реакций [24,25].
Показательные, но не исключительные, причины гетерогенности включают специфические характеристики пациента, такие как возраст, пол, сопутствующие заболевания, ожирение, употребление алкоголя, курение, прием лекарств, состояние питания, источник инфекции, природа инфекционного агента и другие клинические и неклинические факторы, такие как нарушения, которые подавляют врожденный и адаптивный иммунитет, включая цирроз печени, рак и аутоиммунные заболевания, генетическую предрасположенность (например, полиморфизмы Toll-подобного рецептора 4), взаимодействия хозяина и патогена, реактивацию бессимптомных вирусных инфекций, основные механизмы острого заболевания, реакции иммунной системы, проводимое лечение и связанное со временем направление прогрессирования заболевания [25,26].
Эта гетерогенность оказывает существенное влияние на результаты клинических исследований. Например, это может произойти с клиническим испытанием, начатым для революционного препарата для лечения сепсиса или септического шока, вызванного грамотрицательным микробом; согласно строгому протоколу исследования, это лечение будет применяться только у пациентов в критическом состоянии, поступивших в ОРИТ в течение 4 часов после начала сепсиса/септического шока. Хотя вначале группа пациентов, которую нужно набрать, кажется очень специфичной, в конечном итоге в нее должны быть включены пациенты со значительными различиями в бесчисленных биологических характеристиках, которые могут скрыть потенциальную пользу нашего исследования. Например, одно дело лечить 19-летнюю девушку-спортсменку, которая двумя часами ранее поступила в отделение неотложной помощи с менингококковым сепсисом, и совсем другое дело лечить 80-летнего, прикованного к постели. мужчине с деменцией, постоянным мочевым катетером, бактериемией, вызванной Escherichiacoli, и аспирационной пневмонией, осложненной острым респираторным дистресс-синдромом (ОРДС), или 60-летнего мужчину с дивертикулитом и внутрибрюшным абсцессом, но без явной бактериемии.
2.2.Гетерогенность, связанная с клинической экспрессией
Несмотря на возросшую осведомленность и особое внимание к сепсису в последние десятилетия, среди врачей интенсивной терапии все еще существуют значительные различия в подходах к диагностике сепсиса. Даже сегодня сепсис в его полном проявлении не может быть определен с уверенностью, и если читателю это покажется странным, результаты исследования, проведенного несколько лет назад, подчеркивают эту неопределенность: пять случаев предполагаемой или подтвержденной инфекции и органной дисфункции были розданы выборка из 94 интенсивистов, практикующих в академических учреждениях; диагнозы, поставленные в каждом случае, имели очень широкую вариабельность, хотя врачи отделения интенсивной терапии обычно считаются специалистами, имеющими самый высокий опыт в диагностике и лечении сепсиса [27]. Сама идентификация септического пациента в полной клинической картине иногда оказывается трудной даже для опытного врача, поскольку даже лабораторные данные могут отсутствовать, и диагноз может основываться только на клинических ощущениях. Его особенности также искажаются сопутствующими заболеваниями, а дисфункция органов может быть неочевидной [28].
Ухудшение может быть постепенным и незаметным или внезапным. С другой стороны, ухудшение состояния пациента в 20% случаев можно ошибочно объяснить сепсисом. [29]. Кроме того, до сих пор не выявлено четкой связи между тяжестью сепсиса и количеством пораженных органов. Хотя оценка по шкале SOFA связана с тяжестью и прогнозом у пациентов с сепсисом [30], в клинических условиях отмечается большая гетерогенность типов пораженных органов. Например, пациент с сепсисом может быть гемодинамически нестабильным, и ему требуются два разных вазопрессора в сочетании с кортикостероидами, при этом шкала комы Глазго и функция почек остаются неизмененными, в то время как у других пациентов развивается тяжелое острое повреждение почек вместе с тяжелой неврологической дисфункцией, при стабильной гемодинамике. Что касается влияния возраста, сепсис поражает пожилых пациентов неодинаково, и у значительного процента из них уже может быть основная органная дисфункция. Что еще хуже, дисфункция органов может быть частично вызвана лечением сепсиса, а не самим сепсисом [29].
2.3. Определение сепсиса как причины гетерогенности
В 1970-е годы, несмотря на применение антибиотиков и эрадикацию возбудителя, больные сепсисом продолжали умирать. Это привело к гипотезе о том, что основной проблемой является не только патоген сам по себе, но, возможно, в большей степени, воспалительная реакция пациента, причем в последующие годы врачи решительно защищали такую точку зрения относительно патофизиологии сепсиса. В 1992 году сепсис был определен как клинический синдром при наличии как инфекции, так и синдрома системной воспалительной реакции (ССВО), определяемого по температуре, частоте сердечных сокращений, учащенному дыханию и количеству лейкоцитов в крови [17]. Эти критерии были настолько общими, что практически любой пациент с гастроэнтеритом или даже простудой в конечном итоге подпадал под определение сепсиса. Именно высокая смертность от сепсиса заставила научное сообщество действовать таким образом, чтобы врачам было легче заранее задуматься о сепсисе и своевременно поставить клинический диагноз. Однако низкая специфичность диагностических критериев ССВО привела к чрезвычайно большой популяции пациентов, соответствующих диагностическим критериям сепсиса, что вызвало огромные трудности как в клинической практике, так и в научных исследованиях. В 2001 г. последовало второе определение сепсиса, которое практически не отличалось от предыдущего, но в основном расширило перечень клинических и параклинических критериев и улучшило чувствительность за счет специфичности; к сожалению, ни один из критериев не был специфичен для сепсиса [18].
Как уже убедились многие врачи отделений интенсивной терапии в повседневной клинической практике, у многих тяжелобольных пациентов с SIRS нет сепсиса, а у некоторых септических пациентов нет SIRS.
Винсент и др. утверждал, что SIRS более чувствителен, но неспецифичен и что сепсис — это не просто реакция хозяина на инфекцию, но воспалительная реакция хозяина на инфекцию, приводящая к дисфункции органов, и подчеркнул, что реакция, которая преобладает в клиническом фенотипе, варьирует у разных пациентов и с течением времени у каждого пациента [31]. Хотя в 2016 г. последовало третье определение сепсиса (определение Sepsis-3), в котором подчеркивается, что сепсис - это угрожающая жизни дисфункция органов в результате дисрегулярного ответа хозяина на инфекцию, к сожалению, до сих пор очень сложно детально описать этот ответ, поскольку ни один из существующих клинических показателей не может точно определить, что подразумевается под дисрегулярным ответом хозяина, и, кроме того, предсуществующие заболевания, сопутствующие заболевания, лекарства или вмешательства могут изменять клинический и биологический фенотип сепсиса [2]. Более того, в медицинской литературе встречаются даже возражения и реакции на нынешнее определение сепсиса [32], поскольку определение «Сепсис-3» по-прежнему опирается на мнение клиницистов о наличии инфекции, а также о том, действительно ли наблюдаемая органная дисфункция является действительно развившейся вследствие инфекции [27].
2.4. Сепсис и прецизионная (или персонализированная) медицина
Именно эта неоднородность делает повседневную реальность сложной и проблематичной при работе с пациентами с сепсисом или септическим шоком. Ответ на вопрос, как эту большую разнородную группу пациентов с сепсисом можно разделить на более мелкие группы с различными клиническими характеристиками, может в то же время направить врачей отделения интенсивной терапии к «точной медицине», а для наиболее оптимистичных врачей — к «персонализированному» лечению. Хотя термины «прецизионная медицина» и «персонализированная (или индивидуализированная) медицина» часто используются как взаимозаменяемые, они не идентичны.
В центре внимания прецизионной медицины находится выявление подходов, которые, как ожидается, будут эффективны для конкретной группы пациентов на основе их общих характеристик. Конечной целью является возможность предложить индивидуальный уход для каждого человека (персонализированная медицина), но прогнозирование реакции на лечение на уровне отдельного пациента по-прежнему является довольно сложной задачей, поэтому в настоящее время усилия сосредоточены на медицине прецизионной [33]. Что определенно хорошо известно, так это то, что сепсис до сих пор остается загадочным клиническим синдромом со сложной патофизиологией, до конца не изученной, который может поражать практически все системы органов, приводя в конечном итоге к смерти у очень значительной части больных, хотя вовлеченные органы и степень поражения дисфункция может существенно различаться у разных пациентов [29,34]. Основная задача заключается не в определении того, получат ли большинство пациентов, которые соответствуют общим критериям сепсиса, какую-либо пользу от конкретной терапевтической стратегии, а в определении подгруппы пациентов, которая получит пользу, а также в правильном выборе времени использования того или иного метода лечения в процессе развития заболевания [1].
3. Больные сепсисом в отделениях интенсивной терапии.
Пациентов в критическом состоянии можно легко охарактеризовать как наиболее гетерогенную популяцию в больнице, с устойчивыми показателями мультиморбидности, как острой, так и рецидивирующей. Но у пациентов в критическом состоянии с сепсисом, поступивших в то же ОРИТ, вполне могут быть противоположные результаты, несмотря на продолжение соответствующего лечения [35].
За последние несколько лет появились новые рекомендации, которые требуют протокольного лечения пациентов с сепсисом и септическим шоком. Surviving Sepsis Campaign – современная инициатива Society of Critical Care Medicine (SCCM) и European Society of Intensive CareMedicine (ESICM), в настоящее время представляет собой наилучшее доступное доказательство эффективности лечения сепсиса, направленного на снижение смертности от сепсиса по всему миру. Однако высказывалась критика в отношении того, что не все пациенты должны получать одинаковое лечение и что не следует применять принцип «один размер подходит всем» [36–38].
Более того, как уже упоминалось, большинство рандомизированных контролируемых исследований фармакологической терапии по-прежнему не улучшают результаты. По этой причине лучшее определение закономерностей гетерогенности при сепсисе может стать первым шагом на пути к пониманию эффективности у различных групп пациентов ОРИТ использования доступных в настоящее время методов лечения. Хотя существование гетерогенности при сепсисе широко признано и ее наличие оказывает большое влияние на медицинскую литературу, до недавнего времени было проведено очень мало исследований, пытающихся сгруппировать ее характеристики. Таким образом, гетерогенность при сепсисе представляется непреодолимой проблемой для развития методов лечения пациента в критическом состоянии с сепсисом [23].
4. Фенотипирование сепсиса у пациентов ОРИТ
Что следует предпринять? Чтобы идентифицировать конкретные группы пациентов, которые могли бы ответить на конкретные вмешательства, идентификация клинических фенотипов абсолютно необходима [24]. Слово «феномен» происходит от греческой основы «φαι´νoμαι(феном)», глагола, означающего «появляться» или «казаться». Johannsen в своем определении «фенотип» в 1909 году описал его как характеристику типа внешности [39]. Хотя фенотип пациента представляет собой сумму всех выраженных характеристик, т. е. клиническое выражение, «фенотип» также может использоваться для описания траектории и исхода состояния или для клинического исследователя для описания набора представленных признаков, реализованных как критерии включения в экспериментальное исследование [40]. Кроме того, под сепсисом понимают процесс, но только до определенного момента. Например, какие гены участвуют в патогенезе сепсиса? Gregor Mendel, пионер современной генетики, начал с фенотипических признаков и закончил генами. Ответ на вопрос о том, как развивается сепсис у каждого отдельного пациента, требует решения фенотипических загадок, но фенотипы также могут быть решением для выбора лечения [41]. Связывая генную и фенотипическую экспрессию, потенциально можно открыть новые механизмы или терапевтические мишени для лечения сепсиса, а также различные биомаркеры для прогнозирования исхода у разных пациентов с сепсисом или даже для разных подклассов сепсиса, основанных на экспрессии генов, которые могут потребовать уникальных терапевтических подходов [42]. Учитывая все вышесказанное, идентификация различных фенотипов у пациентов с сепсисом кажется чрезвычайно сложной задачей, поскольку отсутствует эмпирические данные о том, как индивидуализировать лечение пациентов с сепсисом исключительно на основе клинических переменных.
5. Искусственный интеллект и машинное обучение
В последние годы искусственный интеллект и машинное обучение все чаще используются в медицине. Искусственный интеллект — это область, которая объединяет опыт из разных областей, включая алгоритмы, статистику, теорию информации и когнитивную науку, обучая компьютеры тому, как учиться и действовать разумно, используя данные и выполняя сложные задачи. Одной из отраслей искусственного интеллекта является машинное обучение; благодаря доступу к большим объемам данных и использованию алгоритмов машинное обучение имитирует работу человеческого мозга, постепенно и постоянно повышая точность [43]. Основная идея заключается в том, что неконтролируемые компьютеры учатся на собираемых ими данных, обычно на основе электронных медицинских записей, показателей жизнедеятельности и/или результатов лабораторных исследований, и распознают закономерности из больших наборов данных; доказано, что этот тип подхода превосходит традиционные аналитические и балльные модели [44]. Если искусственный интеллект рассматривать как мозг, то машинное обучение можно представить как способ завершения умственного процесса путем приобретения новых когнитивных способностей. Следовательно, алгоритм может быть создан на основе очень большого количества данных, что в конечном итоге приводит к созданию кластеров (или фенотипов).
Кластерный анализ — это тип неуправляемого машинного обучения , который был использован для исследования и выявления различных типов проявления заболеваний, включая рак и астму среди разных групп пациентов. В частности, кластерный анализ с использованием передовых математических алгоритмов, основанных на нескольких заданных переменных, может количественно оценить сходство между разными людьми в популяции пациентов. В конце концов, с помощью этого подхода могут быть созданы отдельные новые подгруппы, и эти новые подгруппы, которые не основаны на каких-либо априорных гипотезах, являются фенотипами [35,45]. Несмотря на эти многообещающие результаты, следует иметь в виду, что существуют некоторые ограничения, которые следует учитывать при использовании методов искусственного интеллекта. Например, оптимальное количество кластеров, которые можно получить из любого заданного набора данных, часто не может быть определено самим искусственным интеллектом. Кроме того, кластеры, полученные на основе наборов данных, определенных с использованием старых критериев сепсиса, могут значительно отличаться от тех, которые используются при использовании текущих критериев сепсиса. Более того, методы машинного обучения могут закреплять предвзятости, присутствующие в наборах обучающих данных; таким образом, полученные фенотипы должны быть подвергнуты внутренней и внешней оценке, а также должно быть применено клиническое правдоподобие. Если для внешней проверки не используется отдельная когорта, может быть трудно решить, являются ли данные кластеры «артефактами» или «настоящими», поскольку методы кластеризации могут находить потенциальные кластеры, даже если естественных кластеров не существует. Кроме того, может быть неясно, как согласовать различные наборы подгрупп пациентов, определенные с помощью методов машинного обучения и эмпирических подходов [46–50].
6. Температурное фенотипирование и корреляция с иммунологическим профилем
Основным отличительным клиническим признаком, используемым у пациентов с сепсисом, является температура. Хотя основным симптомом инфекции часто считают лихорадку, у некоторых больных (10–20%) при сепсисе сохраняется гипотермия. Начиная с 2016 года, было проведено более 10 исследований, которые показали, что гипотермия в контексте инфекции связана с увеличением смертности, тогда как лихорадка связана со снижением летального исхода (Table 1) [51–63].

Совсем недавно Baek et al. в многоцентровом ретроспективном исследовании с использованием подхода машинного обучения у 15 574 пациентов с сепсисом были выделили три различные группы пациентов: гипотермические, нормотермические и гипертермические, у которых 90-дневная смертность составила 27,4%, 19,6% и 11,9% соответственно. Кластерный анализ возраста и температуры тела (ТТ) выявил следующие отдельные кластеры пациентов: «кластер А» (>75 лет и <36 ◦C), «кластер Б» (относительно молодой возраст с широким диапазоном температуры тела -ТТ) и кластер C (относительно более высокая ТТ, чем в кластере A). Каждый кластер имел разные 90-дневные показатели смертности: 24,2%, 17,1% и 17,0% для кластера A, B и C соответственно. Смертность и ТТ имели отрицательную корреляцию даже в экстремальных возрастах, то есть в возрастных группах <75 лет и 75 лет [51]. Одинаково ли влияние гипотермии на смертность во всех возрастных группах, все еще изучается. Эта фенотипическая дихотомия между гипотермией и лихорадкой, а также связь гипотермии со смертностью была продемонстрирована и проанализирована в недавних крупных когортах пациентов, у которых выделялись дополнительные фенотипические характеристики и ассоциации.
Например, Thomas-Ruedell et al. у 6542 больных сепсисом подтверждили, что у больных с сепсисом существует бимодальное распределение температуры тела, при этом лихорадка и гипотермия являются двумя основными реакциями человека при сепсисе , а нормотермия является довольно редким состоянием. Факторами, независимо связанными с гипотермией, были внебольничный сепсис, абдоминальная инфекция, более низкий ИМТ, больший возраст и более низкие температуры окружающей среды. Напротив, факторами, независимо связанными с высокой температурой, были не только внебольничный, но и внутрибольничный сепсис, наличие возбудителя в культуре крови и высокие значения прокальцитонина. В этом исследовании гипотермия в целом была связана с более высокой смертностью, но эта связь уменьшилась после поправки на другие факторы риска [52].
Wu et al. изучили 862 пациента отделения интенсивной терапии с септическим шоком и пришли к выводу, что температура ниже 36 ◦C или выше 38 ◦C связана с увеличением смертности за 21 день [53]. С другой стороны, Shimazui et al. в ретроспективном многоцентровом исследовании с использованием когорты сепсиса (1148 пациентов) и двух проверочных групп сепсиса (1628 пациентов) пришли к выводу, что, хотя у более молодых пациентов с сепсисом смертность повышалась при гипотермии и снижалась при лихорадке, у пожилых пациентов смертность не была связана с ТТ. Эти результаты могут означать, что молодые и пожилые пациенты с сепсисом демонстрируют разные воспалительные реакции [54,61].
Bhavani et al. использовали групповое моделирование траекторий для выявления субфенотипов на основе температурных траекторий. Групповое моделирование траекторий характеризуется расширением кластерного анализа и используется для выявления групп среди пациентов, которые имеют схожие траектории в отношении конкретной интересующей переменной [86,87].
Авторы включили в депривационную когорту 12 413 пациентов и 19 053 в группу валидации пациентов с инфекцией, которые получали антибиотики в течение 24 часов с момента обращения. Они выделили в обеих когортах четыре группы температурных траекторий: «гипертермические, медленно разрешающиеся» (14,9%), «гипертермические, быстро разрешающиеся» (23,2%), «нормотермические» (32,8%) и «гипотермические» (29,1%).
Пациенты в «гипотермической» группе были самыми старшими, имели наибольшее количество сопутствующих заболеваний и самые низкие уровни маркеров воспаления. С другой стороны, самые молодые пациенты с наименьшим количеством сопутствующих заболеваний и самым высоким уровнем воспалительных маркеров попали в группу «гипертермических, медленно разрешающиеся». В депривационной когорте у «гипотермических» пациентов был самый высокий уровень внутрибольничной смертности (9,5%), тогда как у «гипертермических, быстро разрешающихся» - самый низкий (2,9%). В когорте валидации «гипертермические, медленно разрешающиеся» имели самый высокий уровень внутрибольничной смертности (10,2%), за ними следовали «гипотермические» 9,0%, тогда как «гипертермические, быстро разрешающиеся» снова имели самый низкий уровень больничной летальности (3,0%). Авторы предположили, что три различных субфенотипа представляют собой гипервоспалительный («гипертермический, медленно разрешающийся»), гиповоспалительный («гипотермический») и хорошо сбалансированный воспалительный субфенотип («гипертермический, быстро разрешающийся»), о чем свидетельствует низкий уровень смертности [55]. Хотя эти субфенотипы и обнаруженные более низкие показатели смертности, относятся к пациентам с инфекцией, т.е. к более многочисленной когорте, включающей как больных с сепсисом, так и без сепсиса, они все же могут отражать различные иммунологические реакции.
Что касается последнего, та же группа авторов обнаружила в другом исследовании, что две когорты пациентов (120 с септическим шоком и 88 с бактериемией, вызванной Staphylococcus aureus), можно снова отнести к одной из четырех ранее подтвержденных температурных субфенотипов. Среди пациентов с септическим шоком смертность составила 51,7%, 36,8%, 29,6% и 22,2% для «гипотермических», «гипертермических, медленно разрещающихся», «нормотермических» и «гипертермических, быстро разрешающихся» соответственно. Более того, когда сравнивались концентрации 44 цитокинов в плазме, только уровни 4 цитокинов: гранулоцитарный колониестимулирующий фактор (G-CSF_, хемокиновый лиганд 2 (CCL2), IL-7 и IL-10) статистически различались. среди четырех субфенотипов; у «гипотермических» пациентов были самые низкие средние значения. Несмотря на обнаружение того, что у «гипертермических, быстро разрешающихся» наблюдалось наиболее значительное снижение уровней пяти цитокинов: антагониста рецептора интерлейкина 1 (IL-1RA), IL-6 и IL-8, G-CSF и макрофаг-колониестимулирующего фактора (M-CSF) в течение 24 часов, еще предстоит ответить на вопрос, существует ли какая-либо корреляция между иммунологическим профилем и температурными траекториями [62,88].
Интересно, что Bhavani et al. в двух ретроспективных исследованиях среди пациентов с COVID-19 выявлено четыре фенотипа, сходных с сепсисом [60,64]. В частности, в своем последнем исследовании они определили 5903 пациента с COVID-19 как «гипертермические медленно разрешающиеся» (25%), «гипертермические быстро разрешающиеся» (25%), «нормотермические» (36%) и «гипотермические» (15%) с различными клиническими характеристиками и смертностью. Хотя было обнаружено, что «гипотермический» фенотип имеет выраженные нарушения свертываемости крови и наибольшую распространенность венозных тромбоэмболий и нарушений мозгового кровообращения, именно группа «гипертермических медленных разрешающихся» в отличие от «гипертермических быстро разрешающихся» имела самые высокие уровни воспалительных маркеров, наибольшую гемодинамическую нестабильность, требующую вазопрессоров, дыхательную недостаточность, требующую ИВЛ и значительно более высокую смертность. Интересно, что распространенность фенотипа «гипертермических медленно разрешающихся» по каким-то причинам резко снизилась за время пандемии [64].
Harmon et al. получили образцы крови у 168 пациентов с сепсисом в течение первых 24 часов после их поступления в ОРИТ. Они заметили, что 30-дневная смертность была значительно увеличена у пациентов с гипотермией (38% против 18%). Это соответствует вышеупомянутым исследованиям, но Harmon et al. также подтвердили, что пациенты с гипотермическим или «холодным» сепсисом имеют уникальный профиль экспрессии генов, что обеспечивает возможную связь с температурой тела и ранней иммуносупрессией [89]. Подтверждение вышеуказанных результатов будущими исследованиями может свидетельствовать о том, что пациентам с гипотермией и сепсисом могут быть полезны иммуностимулирующие препараты, в то время как пациентам с лихорадкой может быть полезна терапия иммунодепрессантами.
Все больше и больше исследований касается других аспектов фенотипической связи между температурой и смертностью у пациентов с сепсисом. Например, Ito et al. в проспективном когортном исследовании с участием 1184 пациентов с сепсисом, поступивших в 59 ОРИТ в Японии, оценивали, существует ли какая-либо связь между гипотермией и смертностью пациентов с сепсисом в соответствии с индексом массы тела (ИМТ). Они пришли к выводу, что пациенты с сепсисом, гипотермией и нормальным ИМТ могут иметь более высокий риск смертности, чем пациенты с низким или высоким ИМТ [63]. Однако, как показывают другие существующие исследования, гипотермия у пациентов с сепсисом независимо связана со смертностью или даже что отсутствие лихорадки связано с более высокой смертностью [56,57,59], и существует метаанализ, делающий вывод о том, что наличие лихорадки снижает смертность у пациентов с сепсисом по сравнению с пациентами с нормотермией [58]. Следующим шагом является рассмотрение возможности применения терапевтической гипертермии у пациентов с гипотермическим или «холодным» сепсисом [90]. Насколько нам известно, есть два клинических исследования, в которых было показано, что согревание пациентов с гипотермией и сепсисом связано с лучшим прогнозом [91,92].
7. Гемодинамическое фенотипирование и сепсис
Гемодинамика — еще один клинический признак, который может помочь в фенотипировании пациентов с сепсисом в критическом состоянии. Септический шок определяется стойкой гипотензией, требующей вазопрессоров для поддержания среднего артериального давления 65 мм рт. ст. и уровня лактата в сыворотке более 2 ммоль/л, несмотря на адекватную инфузионную терапию [2]. Принимая во внимание, что систолическое артериальное давление (САД) регулярно измеряется в ОРИТ, можно предложить использовать САД для быстрой и точной идентификации различных фенотипов.
Zhu et al. извлекли из большой медицинской базы данных информацию о 3034 пациентах с сепсисом, поступивших в ОРИТ, и после проведения траекторного анализа определили семь различных траекторий САД: у некоторых пациентов (36,9%) САД изменялось стабильно, но без явной тенденции к увеличению или снижению ( фенотип 1, среднее САД 100 мм рт. ст.); при фенотипе 2 (7,5%) тенденция САД была стабильной (среднее САД 82 мм рт.ст.), а при фенотипе 3 (8,4%) и фенотипе 4 (21,3%) в целом стабильна, при этом САД постепенно повышалось до 140 мм рт.ст. от 110–120 мм рт.ст. мм рт. ст. и 120–130 мм рт. ст. соответственно. С другой стороны, при фенотипе 5 (15,3%) и фенотипе 6 (8,2%) САД быстро снижалось примерно с 130 мм рт. ст. до 100 мм рт. ст. и примерно с 150–160 мм рт. ст. до 110–120 мм рт. ст. соответственно, тогда как при фенотипе 7 (2,8%) САД сначала демонстрировало тенденцию к увеличению, а затем к снижению. Внутрибольничная смертность составила 25,5%, 40,5%, 11,8%, 18,3%, 23,5%, 13,8% и 10,5% для 1-7 фенотипа пациентов соответственно. Как и в многомерном анализе, фенотип 3 имел самый низкий риск смертности, и авторы предполагают, что траектория САД, представленная в фенотипе 3, может использоваться в качестве идеальной гемодинамической цели для пациентов с сепсисом в течение 10 часов после госпитализации с целью улучшения результатов.
Кроме того, тот факт, что при сравнении фенотипов 2 и 6 было обнаружено, что фенотип 6 имел лучший прогноз, позволяет предположить, что, т.е. что стойкая гипотензия имеет худший прогноз по сравнению со значительным снижением САД. Таким образом, наблюдая за тенденцией САД, врачи могут легко выявить пациентов с высоким риском как можно раньше и тем самым обеспечить своевременное лечение. Стоит отметить, что в том же исследовании при анализе подгрупп возраст для фенотипа 2 был независимым предиктором внутрибольничной смертности: пациенты < 65 лет имели более высокий риск смертности, чем пациенты > 65 лет [65].
В другом исследовании с участием 127 пациентов с сепсисом, поступивших в отделение неотложной помощи, которым проводили неинвазивный непрерывный гемодинамический мониторинг: среди прочего, сердечный индекс (CI) и индекс системного сосудистого сопротивления (SVRI), применение подхода машинного обучения привело к выявление трех разных кластеров со значимо различной выраженностью гемодинамических показателей: фенотип 1 (56,7%) с высоким CI и нормальным SVRI , фенотип 2 (39,4%) с низким CI и повышенным SVRI и фенотип 3 (3,9%) с очень низким CI и очень высоким SVRI.
Пациенты как с фенотипом 2, так и с 3 могут получить пользу от терапии, направленной на индивидуальное реагирование на инфузионную терапию, тогда как пациенты с фенотипом 3 могут получить больше пользы использования вазодилататоров. Интересно, что эти три фенотипа значительно отличались друг от друга с точки зрения 30-дневной смертности, причем большинство смертей (20%) приходится на фенотипы 2 и 3, тогда как у пациентов с фенотипом 1 смертность составила только 5,6% [93]. Эти данные согласуются с классическими знаниями, полученными несколько десятилетий назад, о том, что у пациентов с сепсисом, которые не способны увеличить сердечный выброс, развивается метаболический ацидоз и в конечном итоге они умирают. Хотя в 1981 г. Hess и коллеги предложили модель сепсиса, в которой состояние гемодинамики рассматривалось как последовательность различных событий [94]; стоит отметить, что в настоящее время этот подход подвергается сомнению, поскольку современная литература предполагает, что септический шок не обязательно следует линейной естественной истории с четко определенными фенотипами, сменяющими друг друга; разные авторы предполагают, что сепсис и септический шок — это совершенно разные фенотипы, возникающие независимо друг от друга, а не последовательно и во временном континууме [66].
Недавно Geri et al. идентифицировали пять различных гемодинамических фенотипов у 360 пациентов с септическим шоком на основании клинических и эхокардиографических параметров: «кластер 1», «well- resuscitated» (16,9%), «кластер 2», у которых наблюдалась систолическая дисфункция левого желудочка (ЛЖ) (17,7%). ), «кластер 3», характеризующийся гиперкинезией ЛЖ (23,3%), «кластер 4», характеризующийся правожелудочковой недостаточностью (22,5%) и «кластер 5», характеризующийся устойчивой гиповолемией (19,4%). Смертность в ОРИТ в кластерах 1, 2, 3, 4 и 5 составила 21,3%, 50,0%, 23,8%, 42% и 38,6%, соответственно [67]. Оказывается, что, распознавая и дифференцируя пациентов на ранней стадии развития сепсиса по различным гемодинамическим фенотипам, можно каким-то образом индивидуализировать гемодинамическую поддержку, например с помощью вазопрессоров, и адаптировать инфузию инотропов и инфузию к потребностям каждого конкретного фенотипа.
В настоящее время проводится по крайней мере одно клиническое исследование, в котором изучается, существует ли связь между фенотипом септической кардиомиопатии, основанным на ультразвуковых характеристиках, и исходом сепсиса [95]. Кроме того, авторы исследования ANDROMEDA-2 стремятся определить, может ли при раннем септическом шоке, т.е. менее чем через 4 ч от момента постановки диагноза, стратегия периферической перфузии по сравнению со стандартным лечением, применяемая к различным фенотипам пациентов, определяемым по различным клиническим и гемодинамическим показателям, улучшить их исход (смертность, длительность органной поддержки и продолжительность пребывания в стационаре) [96].
Bhavani et al., чтобы разработать и подтвердить фенотипы траекторий жизненно важных функций, применили групповое моделирование траекторий к жизненно важным показателям с первых 8 часов госпитализации у пациентов с подозрением на инфекцию, как в обучающей, так и в проверочной когорте (12 473 и 8 256 пациентов соответственно). С помощью этого подхода в конечном итоге были идентифицированы четыре фенотипа: «Группа А» (28%) - пациенты с гипертермией, тахикардией, тахипноэ и с более низким систолическим и диастолическим артериальным давлением; «группа В» (13%) - пациенты также были с гипертермией, тахикардией, тахипноэ (но не в такой степени, как в «группе А») и с гипертонией; «группа С» (32%) и «группа D» (27%). Несмотря на то, что у пациентов как «группы С», так и «группы D» были более низкие температура тела, частота сердечных сокращений и дыхания, в «группе С» пациенты были нормотензивными, а в «группе D» было самое низкое артериальное давление. Что касается других особенностей четырех фенотипических групп, стоит отметить, что более молодые пациенты находились в группах А и В, тогда как пожилые пациенты были в группах С и D, что в «группе В» была самая высокая распространенность застойной сердечной недостаточности, гипертонии, сахарного диабета и хронической болезни почек. В группах А и D наблюдалось как самое высокое использование вазопрессоров, так и самая высокая 30-дневная смертность, «Группа D» имела значительно меньший риск - 30 -дневной смертности при сравнении введения сбалансированных кристаллоидов с физиологическим раствором [97].
Помимо температуры и гемодинамического статуса, дисфункция органов также может быть использована для фенотипирования пациентов с сепсисом в критическом состоянии.
8. Фенотипирование мультиорганной дисфункции при сепсисе
Вероятно, первое исследование мультиорганной дисфункции и фенотипирования сепсиса было проведено Knox et al. в 2015 году. В этом исследовании с использованием методов машинного обучения 2533 пациента с сепсисом, поступивших из отделения неотложной помощи в отделение интенсивной терапии, были сгруппированы по четырем различным фенотипам; В «кластер 1» вошли пациенты с шоком и повышенным креатинином, в «кластер 2» — пациенты с синдромом минимальной полиорганной дисфункции, в «кластер 3» — пациенты с шоком с гипоксемией и измененным психическим статусом, а в «кластер 4» — пациенты с заболеваниями печени. Смертность для этих кластеров составила 11%, 12%, 28% и 21% соответственно. Регрессионный анализ показал, что эти фенотипические кластеры в значительной степени не зависят от возраста, причины сепсиса, ожирения и других сопутствующих заболеваний и что они значительно различаются по связи между клиническими исходами и предикторами, такими как оценка по шкале APACHE II [68].
Пять лет спустя Ibrahim et al., используя данные пациентов с сепсисом, поступивших в ОИТ (13728 записей), подсчитав 63 жизненно важных параметров и лабораторных анализов, собранных в течение первых 24 часов после поступления, и следуя методологии машинного обучения Нокса, также выявили четыре клинически значимых субпопуляции сепсиса с отчетливыми паттернами органной дисфункции, представляющими либо заболевание печени (фенотип 1), либо кардиогенную дисфункцию с повышенным креатинином (фенотип 2) или минимальной органной дисфункцией (фенотип 3), либо кардиогенную дисфункцию с гипоксемией и измененным психическим статусом (фенотип 4). Выявленные популяции в основном не зависели от происхождения сепсиса, а 30-дневная смертность для этих кластеров составила 28%, 55%, 25% и 37% соответственно [69].
Zhang et al. в 2018 году опубликовали результаты ретроспективного исследования с участием 14 993 пациентов с сепсисом, в котором с помощью методов машинного обучения также были выявлены четыре фенотипа: исходным считался фенотип 1 (69%); фенотип 2 (9%) характеризовался респираторной дисфункцией; фенотип 3 (11%) — полиорганной дисфункцией (например, почек, системы свертывания крови, печени и шоке) и фенотип 4 (11%) — неврологической дисфункцией. Фенотип 3 показал самый высокий уровень смертности (45,4%), за ним следовали фенотип 4 (27,4%), фенотип 2 (18,2%) и фенотип 1 (16,9%) [70].
Seymour et al. в революционном исследовании проанализировали ретроспективно данные 63 858 пациентов с сепсисом, которые соответствовали критериям сепсиса-3 в течение 6 часов после поступления в больницу в трех различных когортах, используя инструменты статистики, машинного обучения и моделирования. Исследователи идентифицировали четыре фенотипа сепсиса (обозначенные α, β, γ и δ). Фенотипы варьировали по размеру (от 13% до 33% когорты), каждый из них отличался по демографическим, лабораторным показателям и характеру органной дисфункции, и каждый из них коррелировал с биомаркерами и смертностью. «α-фенотип» (33%) имел мало аномальных лабораторных показателей и меньшую дисфункцию систем органов; Пациенты с «β-фенотипом» (27%) были старше, с повышенной сопутствующей патологией и заболеваниями почек; У пациентов с «γ-фенотипом» (27%) наблюдались повышенные уровни маркеров воспаления, снижение уровня альбумина и повышение температуры, тогда как у пациентов с «δ-фенотипом» (13%) наблюдались высокие уровни лактата в сыворотке, повышенные уровни трансаминаз и гипотония. 28-дневная смертность для фенотипов α, β, γ и δ составила 5%, 13%, 24% и 40% соответственно [71]. Хотя эти четыре фенотипа имели некоторую значимость для традиционных оценок тяжести заболевания (APACHE, SOFA), было ясно, что они представляют собой отдельные клинические группы [98]. Стоит также отметить, что в том же исследовании в имитационных моделях изменения в распределении среди пациентов фенотипов α и δ имели существенные последствия. Это оказалось очень важным открытием, поскольку оно предположило, что эффективность клинического исследования, по-видимому, зависит от фенотипа, к которому оно будет применяться, и это, безусловно, то, что нам необходимо учитывать при планировании каждого нового клинического исследования. 71,98].
Этот последний вывод, а именно то, что на результат РКИ может влиять доля участия каждой фенотипической группы в исследуемой популяции, подчеркивает исследование Seymour et al. как знаковое и эпохальное исследование. Разумно полагать, что для проведения хорошо спланированных РКИ очень важно найти и отобрать соответствующую фенотипическую популяцию и провести соответствующее лечение в наиболее подходящее время. Даже если терапевтическое вмешательство действительно полезно для части популяции пациентов, но если оно не приносит пользы или даже вреда остальным пациентам, то это вмешательство в целом можно рассматривать как неэффективное. Основываясь на результатах Seymour et al., если бы мы могли на ранних стадиях распознать у пациента с сепсисом конкретный паттерн развития полиорганной недостаточности, мы могли бы действовать профилактически или терапевтически, как врачи, на более раннем этапе в пользу пациента или, в случае, когда мы хотим провести клиническое исследование, мы могли бы выборочно применить к пациенту то вмешательство, которое действительно принесет ему/ей пользу. Также представляется, что существует большая возможность повторения клинических исследований, которые уже были проведены и не показали в целом каких-либо положительных результатов, в конкретных группах населения с конкретными фенотипическими характеристиками, что может оказаться полезным; это может быть особенно верно для тех исследований, которые показали пользу только в некоторых конкретных подгруппах [99].
Xu et al. исследовали, могут ли 72-часовые траектории оценки SOFA помочь в фенотипировании пациентов с сепсисом; всего было набрано 4678, 3665, 12 282 и 4804 уникальных пациентов с сепсисом (одна группа разработки и три группы валидации), и были идентифицированы четыре различных кластера/фенотипа: «быстро ухудшающиеся» (13,1%), при котором показатель SOFA постоянно увеличивался от 4,5 при поступлении до более 7 через 72 ч; «отсроченное ухудшение» (20,5%), при котором показатель SOFA снизился в течение первых 2 дней с 5,2 до 3,7, а затем увеличился в течение последних 24 часов; «быстрое улучшение» (41,3%), при котором оценка SOFA постоянно снижается с 5,54 до менее 3, и фенотип «отсроченное улучшение» (25,1%), при котором оценка SOFA первоначально увеличивается, а затем постепенно снижается в течение 72 часов. Каждый фенотип имел разные исходные характеристики. Например, пациенты с «быстрым ухудшением» имели большую сопутствующую патологию, ацидоз и дисфункцию органов, в то время как пациенты с «быстрым улучшением» нуждались в вазопрессорах, но не имели ацидоза. Более того, несмотря на то, что «быстро ухудшающийся» фенотип имел более низкий балл SOFA (в среднем 4,5) по сравнению с «быстро улучшающимся» (средний 5,5), этот фенотип имел самую высокую внутрибольничную смертность (28,3% против 5,5% соответственно). Основным выводом этого исследования было то, что авторы смогли выявить зависящие от времени причины прогрессирования, которые могут быть связаны с дифференциальной реакцией дисфункции конкретного органа на стандартные вмешательства. Как уже предполагалось ранее на основе результатов Seymour et al., при проведении РКИ, оценивающего терапевтическое вмешательство, направленное на сокращение продолжительности органной дисфункции, если бы мы набрали пациентов, принадлежащих к фенотипу «быстрого улучшения», РКИ вряд ли выявило бы какие-либо положительный результат [72].
Sharafoddini et al., основываясь на демографических данных, жизненно важных показателях, лабораторных тестах и дисфункции органов, также применили методы машинного обучения среди 5539 взрослых пациентов с сепсисом, выявив не четыре, а 12 фенотипов. Авторы предполагают, что используемая методология могла бы уделять больше внимания деталям при оценке сходства между пациентами. Смертность в ОИТ, внутрибольничная смертность и 30-дневная смертность значительно различались между кластерами: показатели смертности были ниже в кластерах 10, 11 и 8, а в кластерах 9 и 2 были самыми высокими [73]. Прочитав их статью более внимательно, кто-то может предположить, что было идентифицировано 12 субфенотипов из пяти основных фенотипов, что подчеркивает вышеупомянутые ограничения методов машинного обучения, такие как отсутствие прозрачности и относительно низкая воспроизводимость между исследованиями в настоящее время.
Пять также было числом фенотипов, которые Aldewereld et al. описали в их исследовании. Авторы ретроспективно применили методы машинного обучения к когорте из 1023 человек с ранним септическим шоком. Они охарактеризовали два фенотипа «низкого риска» (L), один «умеренный риск» (M) и два фенотипа «высокого риска» (H). Это были пациенты с септическим шоком, характеризующиеся как «чувствительные к инфузии» (фенотип L2), «рефрактерные к инфузии» пациенты без полиорганной недостаточности (фенотип L1), пациенты с септическим шоком и дыхательной недостаточностью (фенотип М), пациенты с полиорганной дисфункцией (фенотип H1) и пациентов с септическим шоком с гепатобилиарной дисфункцией и коагулопатией (фенотип H2). Фенотипы H1 и H2, хотя и имели разные демографические данные, исходную оценку тяжести заболевания, лабораторные показатели и характер органной недостаточности, имели одинаково высокую смертность. Интересно, что это исследование предоставило уникальные доказательства того, что разные группы пациентов с разными фенотипическими особенностями, развивающиеся по-разному во времени, могут в конечном итоге сохранять одни и те же признаки органной дисфункции [74].
Ding et al. проанализировали когорту из 5782 септических пациентов с госпитализацией в отделение интенсивной терапии и вывели три клинических фенотипа из многомерной панели физиологических данных, используя субграфовую неотрицательную матричную факторизацию с дополнением. Поиск частых подграфов - это метод, используемый для выявления закономерностей в виде подграфов в наборе графов на основе определенного порогового значения частоты. Этот метод позволяет выявлять частые паттерны в графах временных рядов и успешно проводить фенотипирование популяций пациентов и прогнозировать исходы при различных заболеваниях. В этом исследовании пациенты с «фенотипом 1» были старше (73,1 года), имели избыточный вес, были мужчинами, и имели 17,0% 30-дневную и 12,0% внутрибольничную смертность. Пациенты с «фенотипом 2» были моложе (67,9 лет), с меньшим избыточным весом, мужского пола, с 28,4% 30-дневной и 24,8% внутрибольничной смертностью, в то время как пациенты с «фенотипом 3» были самыми молодыми (59,9 лет), с наименьшим избыточным весом, соотношение мужчин и женщин составляло 1:1, а смертность была самой низкой (10,1% 30-дневная и 7,3% внутрибольничная). Опять же, эти фенотипы характеризовались различными демографическими особенностями и сопутствующими заболеваниями, характером дисфункции органов и траекториями заболевания, при этом очевидна четкая связь между фенотипами и клиническим исходом [75].
Papin et al ретроспективно проанализировали 6046 пациентов с сепсисом, поступивших в ОРИТ с акцентом на очаг инфекции [76]. Эти исследователи выделили шесть фенотипических кластеров: фенотип 1 (40%) и фенотип 2 (4%) представляли молодых пациентов без каких-либо сопутствующих заболеваний, госпитализированных по поводу внебольничной пневмонии или менингита/энцефалита соответственно, «фенотип 3» (6%) и «Фенотип 4» (27%) представлял собой пожилых людей с хронической обструктивной болезнью легких, бронхиальной инфекцией и незначительной органной недостаточностью, «фенотип 5» (15%) представлял пациентов, госпитализированных после операции с нозокомиальной инфекцией, и «фенотип 6» (8%) представлял молодых пациентов с иммуносупрессией (например, СПИД, хроническая стероидная терапия или гематологические злокачественные новообразования). Смертность через 28 дней, 90 дней и один год значительно различалась для разных фенотипов, независимо от исходной органной недостаточности [76].
9. Фенотипы сепсиса, волемический статус и исход
Во время сепсиса и септического шока адекватная инфузионная терапия остается критически важной стратегией, направленной на поддержание гемодинамической стабильности пациента, перфузии органов и идеальной доставки кислорода. Перегрузка жидкостью имеет пагубное воздействие, и применение прецизионной медицины к пациентам с сепсисом в ОРИТ предполагает отход от хорошо известного подхода инфузионной реанимации как «стандарта медицинской помощи», который широко применялся в течение последних двух десятилетий. В настоящее время имеется достаточно доказательств того, что различия в балансе жидкости между разными фенотипами тесно связаны с разными исходами и что выявление подгруппы пациентов, особенно склонных к перегрузке жидкостью, может быть важным шагом для оптимизации управления водным балансом.
Например, Shald et al среди 320 больных с сепсисом, поступивших в ОРИТ, выявили четыре фенотипа: «Фенотип 1» (9,7%) - пациенты с полиорганной недостаточностью, «Фенотип 2» (15%) - пациенты с респираторной дисфункцией, «Фенотип 3» (18,1%) -пациенты с неврологической дисфункцией и «фенотип 4» (57,2%)- пациенты с другими проблемами. Уровень смертности между разными фенотипами также был разным; 48,4%, 20,8%, 39,7% и 13,7% для фенотипа 1, 2, 3 и 4 соответственно. Интересно, что балансы жидкости на 1, 2 и 3 дни также были разными: фенотипы 1 и 3 имели наибольший объемный баланс в эти моменты времени [77].
Wang и соавт. в проспективном многоцентровом обсервационном исследовании, в котором приняли участие 986 пациентов с сепсисом, исследовали влияние латентных траекторий баланса жидкости на клинические исходы и выявили три различных траектории/фенотипа: «Фенотип 1» (6,5%), при котором первоначально высокий баланс жидкости быстро снижается, поддерживая более низкий уровень; «фенотип 2» (85,3%), при котором баланс жидкости в целом был стабильным; и «фенотип 3» (8,2%), при котором баланс жидкости изначально был высоким и стабильным, но позже умеренно снижался. При сравнении фенотипов 2 и 3 «фенотип 3» демонстрировал более высокую внутрибольничную смертность (71,6% против 46,9%), органную дисфункцию (79,0% против 46,9%) и тяжелые респираторные нежелательные явления (58,0% против 29,7%). в то время как «фенотип 1» вызывал меньше неблагоприятных событий со стороны почек, чем «фенотип 2» (47,4% против 51,6%) [78].
В ранее упомянутом исследовании Zhang et al. каждый фенотип также показал различную реакцию на инфузионную терапию; «Фенотип 2» получал меньше жидкости, чем все остальные, тогда как «фенотип 3» получал наибольшее количество жидкости в течение первых 24 часов. Влияние более высокого баланса жидкости в первые 48 часов было непропорционально связано с исходом между различными фенотипами: «фенотип 3» снижал риск госпитальной смертности, а «фенотип 4» повышал [70].
Более того, Ma et al., применяя методы машинного обучения у 1437 пациентов с сепсисом, попытались разработать правило последовательного лечения, касающееся идеальной дозы инфузионной терапии и использования вазопрессоров. В конечном итоге были идентифицированы пять фенотипов: «Фенотип 1» (исходный уровень) включал большинство пациентов за все дни; «фенотип 2» включал пациентов с самой высокой тяжестью заболевания; «фенотип 3» включал пациентов с почечной дисфункцией; «фенотип 4» включал лиц с дыхательной недостаточностью; а к «фенотипу 5» относились пациенты с легкой степенью тяжести заболевания, у которых также наблюдался самый низкий уровень смертности (21%). Оптимальная инфузия жидкости следовала за фазами реанимации/дереанимации с начальной инфузией большого объема и поздней инфузией ограниченного объема. В то время как «фенотип 1» перешел в фазу дереанимации на третий день, «фенотип 3» - на первый день, и хотя фенотипы 1 и 3, по-видимому, получили пользу от раннего применения норадреналина, «фенотип 2», по-видимому, выиграл от отсроченного его использования. Это открытие подтверждает существующую гетерогенность сепсиса и еще раз дает понять, что раннее лечение может быть полезным у большинства пациентов с септическим шоком, но отсроченное лечение может быть полезным для других [79].
10. Фенотипирование траекторий ОРИТ: смертность и не только
Как уже объяснялось, сепсис сам по себе представляет собой смесь нескольких фенотипов с разными клиническими проявлениями, разным оптимальным лечением и разным исходом. Используя методы машинного обучения, мы также можем детально фенотипически исследовать и дифференцировать другие аспекты состояния пациентов интенсивной терапии во время госпитализации в отделение интенсивной терапии.
Например, Zhang et al., в ретроспективном многоцентровом когортном исследовании с участием 22 868 пациентов с сепсисом, поступивших в ОРИТ, исследовали, когда они стабилизировались, когда они переходили в состояние стойкого критического заболевания и различалось ли время такого перехода между подклассами этих пациентов. Они обнаружили, что, хотя только у 2,8% пациентов, принимавших участие в исследовании, развилось стойкое критическое заболевание, они составили 19% и 10% от общего числа койко-дней в ОРИТ и больнице соответственно, при этом повышенное соотношение мочевины и креатинина является хорошим биохимическим признаком персистирующего критического состояния. Авторы выделили пять латентных классов: 1-й (22,8%) и 2-й (3,5%) классы, при которых показатель SOFA непрерывно увеличивался и переход к стойкому критическому заболеванию происходил на 16 и 27 день соответственно, и 3-й (51,7%), 4-й (11,2%) и 5 (10,8%) классы, в которых показатель SOFA непрерывно снижался и переход к стойкому критическому заболеванию происходил между 6 и 8 днями. У пациентов как 2-го, так и 5-го класса наблюдался высокий уровень смертности (70% и 41,2% соответственно). У пациентов, у которых развилось стойкое критическое состояние, также наблюдалась в целом более высокая смертность, чем у пациентов без такового (25% против 16%).
Тот факт, что у пациентов с уменьшением балла по шкале SOFA в конечном итоге стойкое критическое заболевание развилось в более ранние сроки, чем у пациентов с увеличением балла по шкале SOFA, несмотря на лечение в ОРИТ, позволяет предположить, что реакция пациента с сепсисом на первоначальное лечение в отделении интенсивной терапии оказывает влияние на то, когда его можно стабилизировать [80].
Yang et al. провели ретроспективный анализ 16 743 пациентов с сепсисом и, применив групповое моделирование траекторий, выделили среди этих пациентов пять отдельных траекторий оценок SOFA через 72 часа: в «группе 1» (32,8%) пациенты имели самый низкий показатель SOFA, который первоначально увеличивался, затем уменьшался и позже увеличивался в течение 72 часов; в «группе 2» (30,0%) пациенты имели более высокий показатель SOFA, который первоначально увеличивался, а затем стабилизировался; в «группе 3» (17,6%). у пациентов были умеренные показатели SOFA (значения между показателями в группах 1 и 2), которые сначала увеличивались, затем резко снижались в течение 72 часов и, наконец, непрерывно увеличивались; а в «группе 4» (14,0%) и «группе 5» (5,7%) пациенты имели относительно высокие показатели SOFA со схожими тенденциями изменений. В группах 2–5 кумулятивный риск постепенно увеличивался, тогда как в «группе 1» риск оставался низким. Похоже, что раннее эффективное лечение сопровождалось снижением показателя SOFA, тогда как неадекватный инфекционный контроль сопровождался стабилизацией показателя SOFA. Более высокий риск смерти наблюдался у пациентов с сепсисом в возрасте < 65 лет и у тех, кто не находился на ИВЛ [81].
Soussi et al. снова с использованием методов машинного обучения проанализировали клинические и лабораторные данные, собранные у пациентов во французских и европейских регистрах ОРИТ; анализ латентного класса выявил два различных фенотипа выживших после сепсиса среди 467 пациентов: фенотипы А и В. Пациенты с «фенотипом В» (48%) имели более выраженную сердечно-сосудистую и почечную дисфункцию, гематологические нарушения и более высокие уровни воспалительных маркеров при выписке из ОРИТ и значительно более высокую смертность в течение года (34% против 16%). «Фенотип B» также был независимо связан с повышенной смертностью в течение года. Похоже, что если бы мы могли распознавать различные группы людей, переживших сепсис, при выписке из ОРИТ, мы могли бы также распознавать пациентов с более высоким риском плохих долгосрочных результатов и могли бы оптимизировать их лечение после переводя из ОРИТ [82].
Аналогичными были результаты были получены Taylor et al., которые пытались изучить смертность после выписки и частоту повторных госпитализаций среди 20 745 пациентов с сепсисом. Они использовали анализ латентных классов и разделили выживших после сепсиса на пять различных фенотипов: «Группа 1» (24,3%), т. е. пациенты, которые не нуждались в медицинской помощи (смертность 0,1%, повторная госпитализация 8,6%); «группа 2» (13,7%), ранее здоровые пациенты с тяжелым заболеванием и сложными потребностями после выписки и препятствиями для оказания медицинской помощи (смертность 2,1%, повторная госпитализация 20,1%); «3-я группа» (27,6%), пациенты с мультиморбидностью (смертность 2,1%, повторная госпитализация 26%); «4-я группа» (13,7%) — пациенты с плохим функциональным статусом (смертность 6,9%, повторная госпитализация 21,6%); и «группа 5» (20,7%) — пациенты с тяжелым заболеванием и сложными потребностями после выписки (смертность 7,9%, повторная госпитализация 35,1%). Результаты этого исследования убедительно подтверждают гипотезу о том, что выжившие после сепсиса представляют собой отдельные клинические фенотипы с различными потребностями в дополнительной поддержке после выписки и указывают на необходимость классификации перед выпиской, что в конечном итоге направлено на более индивидуализированный подход к лечению пациентов, переживших сепсис сепсиса [83].
Boede и соавт., используя латентно-классовый анализ, исследовали депрессивные симптомы у 224 человек, перенесших сепсис, в течение года наблюдения и определили три различные траектории: в одной группе пациентов (68%) наблюдалась легкая траектория выздоровления, при которой симптомы легкой депрессии регрессировали в течение 6 месяцев, у другой группы пациентов (12%) наблюдалась тяжелая персистирующая траектория, при которой депрессивные симптомы от умеренной до тяжелой степени сохранялись в течение 1 года, а у третьей группы пациентов (20%) симптомы тяжелой депрессии присутствовали через 1 месяц после выписки из ОРИТ, однако полностью исчезли через 6 месяцев [84].
Puthucheary и соавт., также используя латентно-классовый анализ, обследовали 159 человек, переживших сепсис, в течение двухлетнего периода наблюдения и выделили две отдельные группы: в одной группе наблюдалось более быстрое и полное выздоровление (38,4%), а в другой наблюдалось более устойчивые функциональные нарушения (61,6%), причем независимыми факторами риска плохой реабилитации являются пожилой возраст, низкий уровень образования и высокая коморбидность. Была также третья группа, которую нельзя было отнести ни к одной траектории, что иллюстрирует широкий спектр исходов сепсиса среди выживших [85].
11. Сепсис и фенотипы: это еще не все
Число исследований по фенотипированию сепсиса продолжает расти, принимая во внимание локализацию инфекции [100, 101], тип органной дисфункции, например, печени [102], почек [103–106], легких [107, 108] или системы свертывания крови [109–112] и тип заболевания, например, COVID-19 [113–128] или ОРДС, не связанный с COVID-19 [129–153]; они пытаются соотнести фенотипы и связанный с ними вред, связанный с отсроченным применением антибиотиков [154,155], и даже предсказать ответ на лечение или его результат [156–159]. Различные фенотипы были также идентифицированы у детей с сепсисом [160–172]. Полный обзор этих тем выходит за рамки данного обзора, и за более подробной информацией читатель отсылается к литературе.
12. Выводы
Сепсису всегда давалось широкое определение, чтобы охватить наибольшее количество пациентов из группы риска, ценой значительных трудностей, создаваемых гетерогенностью как для клинической практики, так и для исследований [173]. Такая значительная гетерогенность среди пациентов и принятие единой стратегии ведения пациентов могут привести к весьма разным и даже противоречивым результатам [174].
В течение многих лет не было новых методов лечения, и существует более чем когда-либо потребность в индивидуальном подходе к лечению сепсиса. Хотя в настоящее время может показаться невозможным включить фенотипирование в нашу повседневную клиническую практику и, следовательно, предложить персонализированные подходы к оказанию помощи пациентов с сепсисом, небольшие шаги в этом направлении уже сделаны, поскольку все более гибкие и сложные методы кластеризации позволяют анализировать большие выборки данных и помогают идентифицировать отдельные клинические фенотипы (Figure 1); разные фенотипы могут по-разному реагировать на стратегии лечения. Более точное определение клинических характеристик гетерогенности при сепсисе может стать первым шагом в наших усилиях по пониманию потенциальной реакции различных групп пациентов интенсивной терапии на доступные в настоящее время терапевтические подходы. Таким образом, перспектива прецизионной медицины заключается в том, что лучшее понимание индивидуальных клинических проявлений сепсиса, механизмов заболевания и гетерогенных моделей ответа на лечение приведет к переходу от «плохо охарактеризованной» к «персонализированной» медицине и улучшению результатов.

References
1. Vincent, J.L.; van der Poll, T.; Marshall, J.C. The End of “One Size Fits All” Sepsis Therapies:Toward an Individualized Approach.
Biomedicines 2022, 10, 2260. [CrossRef]
2. Singer, M.; Deutschman, C.S.; Seymour, C.W.; Shankar-Hari, M.; Annane, D.; Bauer, M.; Bellomo, R.; Bernard, G.R.; Chiche, J.D.; Coopersmith, C.M.; et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315, 801–810. [CrossRef]
3. Hussain, H.; Vutipongsatorn, K.; Jimenez, B.; Antcliffe, D.B. Patient Stratification in Sepsis:Using Metabolomics to Detect Clinical Phenotypes, Sub-Phenotypes and Therapeutic Response.Metabolites 2022, 12, 376. [CrossRef] [PubMed]
4. Taj, M.; Brenner, M.; Sulaiman, Z.; Pandian, V. Sepsis protocols to reduce mortality inresource-restricted settings: A systematic review. Intensive Crit. Care Nurs. 2022, 72, 103255.[CrossRef]
5. Afonso, E.; Smets, K.; Deschepper, M.; Verstraete, E.; Blot, S. The effect of late-onset sepsis onmortality across different gestational ages in a neonatal intensive care unit: A historical study. IntensiveCrit. Care Nurs. 2023, 77, 103421. [CrossRef]
6. Verstraete, E.H.; Mahieu, L.; De Coen, K.; Vogelaers, D.; Blot, S. Impact of healthcare-associated sepsis on mortality in critically ill infants. Eur. J. Pediatr. 2016, 175, 943–952. [CrossRef][PubMed]
7. Verstraete, E.; Boelens, J.; De Coen, K.; Claeys, G.; Vogelaers, D.; Vanhaesebrouck, P.; Blot, S.Healthcare-associated bloodstream infections in a neonatal intensive care unit over a 20-year period(1992–2011): Trends in incidence, pathogens, and mortality. Infect. Control Hosp. Epidemiol. 2014,35, 511–518. [CrossRef]
8. Arvaniti, K.; Dimopoulos, G.; Antonelli, M.; Blot, K.; Creagh-Brown, B.; Deschepper, M.; de Lange, D.; De Waele, J.; Dikmen, Y.; Eckmann, C.; et al. Epidemiology and age-related mortality incritically ill patients with intra-abdominal infection or sepsis: An international cohort study. Int. J.Antimicrob. Agents 2022, 60, 106591. [CrossRef] [PubMed]
9. Dimopoulos, G.; Koulenti, D.; Blot, S.; Sakr, Y.; Anzueto, A.; Spies, C.; Sole-Violan, J.; Kett, D.; Armaganidis, A.; Martin, C.; et al. Critically ill elderly adults with infection: Analysis of the extended prevalence of infection in intensive care study. J. Am. Geriatr. Soc. 2013, 61, 2065–2071. [CrossRef]
10. Blot, S.; Cankurtaran, M.; Petrovic, M.; Vandijck, D.; Lizy, C.; Decruyenaere, J.; Danneels, C.;Vandewoude, K.; Piette, A.; Vershraegen, G.; et al. Epidemiology and outcome of nosocomial bloodstream infection in elderly critically ill patients: A comparison between middle-aged, old, andvery old patients. Crit. Care Med. 2009, 37, 1634–1641. [CrossRef] [PubMed]
11. Blot, S.; Koulenti, D.; Dimopoulos, G.; Martin, C.; Komnos, A.; Krueger, W.A.; Spina, G.; Armaganidis, A.; Rello, J.; EU-VAP Study Investigators. Prevalence, risk factors, and mortality for ventilator-associated pneumonia in middle-aged, old, and very old critically ill patients. Crit. CareMed. 2014, 42, 601–609. [CrossRef]
12. Rudd, K.E.; Johnson, S.C.; Agesa, K.M.; Shackelford, K.A.; Tsoi, D.; Kievlan, D.R.; Colombara, D.V.; Ikuta, K.S.; Kissoon, N.; Finfer, S.; et al. Global, regional, and national sepsis incidence and mortality, 1990–2017: Analysis for the Global Burden of Disease Study. Lancet 2020, 395, 200–211.[CrossRef]
13. Cavaillon, J.M.; Singer, M.; Skirecki, T. Sepsis therapies: Learning from 30 years of failure of translational research to propose new leads. EMBO Mol. Med. 2020, 12, e10128. [CrossRef]
14. Sakr, Y.; Jaschinski, U.; Wittebole, X.; Szakmany, T.; Lipman, J.; Namendys-Silva, S.A.; Martin-Loeches, I.; Leone, M.; Lupu, M.N.; Vincent, J.L.; et al. Sepsis in Intensive Care Unit Patients: Worldwide Data From the Intensive Care over Nations Audit. Open Forum Infect. Dis. 2018, 5,ofy313. [CrossRef]
15. Karvouniaris, M.; Papadopoulos, D.; Koulenti, D.; Chatzimichail, M.; Papamichalis, P.; Ntafoulis, N.; Valsamaki, A.; Katsiafyl- loudis, P.; Vaitsi, E.; Oikonomou, K.; et al. Impact of secondary sepsis on mortality in adult intensive care unit patients. Intensive Crit. Care Nurs. 2023, 75, 103345.[CrossRef]
16. Blot, S.; Ruppe, E.; Harbarth, S.; Asehnoune, K.; Poulakou, G.; Luyt, C.E.; Rello, J.; Klompas, M.; Depuydt, P.; Eckmann, C.; et al. Healthcare-associated infections in adult intensive care unit patients: Changes in epidemiology, diagnosis, prevention and contributions of new technologies.Intensive Crit. Care Nurs. 2022, 70, 103227. [CrossRef] [PubMed]
17. Bone, R.C.; Balk, R.A.; Cerra, F.B.; Dellinger, R.P.; Fein, A.M.; Knaus, W.A.; Schein, R.M.; Sibbald, W.J. Definitions for sepsis and organ failure and guidelines for the use of innovativetherapies in sepsis. Chest 1992, 101, 1644–1655. [CrossRef] [PubMed]
18. Levy, M.M.; Fink, M.P.; Marshall, J.C.; Abraham, E.; Angus, D.; Cook, D.; Cohen, J.; Opal,S.M.; Vincent, J.L.; Ramsay, G.; et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International SepsisDefinitions Conference. Crit. Care Med. 2003, 31, 1250–1256. [CrossRef]
19. Investigators, A.; Group, A.C.T.; Peake, S.L.; Delaney, A.; Bailey, M.; Bellomo, R.; Cameron, P.A.; Cooper, D.J.; Higgins, A.M.; Holdgate, A.; et al. Goal-directed resuscitation for patients with early septic shock. N. Engl. J. Med. 2014, 371, 1496–1506. [CrossRef]
20. Morelli, A.; Ertmer, C.; Westphal, M.; Rehberg, S.; Kampmeier, T.; Ligges, S.; Orecchioni, A.; D’Egidio, A.; D’Ippoliti, F.; Raffone, C.; et al. Effect of heart rate control with esmolol onhemodynamic and clinical outcomes in patients with septic shock: A randomized clinical trial. JAMA2013, 310, 1683–1691. [CrossRef]
21. Shankar-Hari, M.; Phillips, G.S.; Levy, M.L.; Seymour, C.W.; Liu, V.X.; Deutschman, C.S.;Angus, D.C.; Rubenfeld, G.D.; Singer, M.; Sepsis Definitions Task, F. Developing a New Definitionand Assessing New Clinical Criteria for Septic Shock: For the Third International ConsensusDefinitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315, 775–787. [CrossRef]
22. de Grooth, H.J.; Postema, J.; Loer, S.A.; Parienti, J.J.; Oudemans-van Straaten, H.M.; Girbes, A.R. Unexplained mortality differences between septic shock trials: A systematic analysis of population characteristics and control-group mortality rates. Intensive Care Med. 2018, 44, 311–322.[CrossRef]
23. Fohner, A.E.; Greene, J.D.; Lawson, B.L.; Chen, J.H.; Kipnis, P.; Escobar, G.J.; Liu, V.X. Assessing clinical heterogeneity in sepsis through treatment patterns and machine learning. J. Am.Med. Inform. Assoc. 2019, 26, 1466–1477. [CrossRef] [PubMed]
24. Suarez-de-la-Rica, A.; Maseda, E. Precision Medicine in Sepsis and Septic Shock. J. Clin. Med.2022, 11, 5332. [CrossRef]
25. Gotts, J.E.; Matthay, M.A. Sepsis: Pathophysiology and clinical management. BMJ 2016, 353,i1585. [CrossRef]
26. Wong, H.R. Personalized medicine, endotypes, and intensive care medicine. Intensive Care Med.2015, 41, 1138–1140. [CrossRef]
27. Rhee, C.; Kadri, S.S.; Danner, R.L.; Suffredini, A.F.; Massaro, A.F.; Kitch, B.T.; Lee, G.;Klompas, M. Diagnosing sepsis is subjective and highly variable: A survey of intensivists using case vignettes. Crit. Care 2016, 20, 89. [CrossRef] [PubMed]
28. Vincent, J.L. The Clinical Challenge of Sepsis Identification and Monitoring. PLoS Med. 2016,13, e1002022. [CrossRef] [PubMed]
29. Kellum, J.A.; Formeck, C.L.; Kernan, K.F.; Gomez, H.; Carcillo, J.A. Subtypes and Mimics ofSepsis. Crit. Care Clin. 2022, 38, 195–211. [CrossRef]
30. Liu, C.; Suo, S.; Luo, L.; Chen, X.; Ling, C.; Cao, S. SOFA Score in relation to Sepsis: Clinical Implications in Diagnosis, Treatment, and Prognostic Assessment. Comput. Math. Methods Med. 2022,2022, 7870434. [CrossRef]
31. Vincent, J.L.; Opal, S.M.; Marshall, J.C.; Tracey, K.J. Sepsis definitions: Time for change. Lancet2013, 381, 774–775. [CrossRef]
32. Simpson, S.Q. New Sepsis Criteria: A Change We Should Not Make. Chest 2016, 149, 1117–1118. [CrossRef]
33. Shah, F.A.; Meyer, N.J.; Angus, D.C.; Awdish, R.; Azoulay, E.; Calfee, C.S.; Clermont, G.;Gordon, A.C.; Kwizera, A.; Leligdowicz, A.; et al. A Research Agenda for Precision Medicine in Sepsis and Acute Respiratory Distress Syndrome: An Official American Thoracic Society ResearchStatement. Am. J. Respir. Crit. Care Med. 2021, 204, 891–901. [CrossRef]
34. Wiersinga, W.J.; Seymour, C.W. (Eds.) Handbook of Sepsis; Springer: Cham, Switzerland, 2018.
35. Castela Forte, J.; Perner, A.; van der Horst, I.C.C. The use of clustering algorithms in critical care research to unravel patient heterogeneity. Intensive Care Med. 2019, 45, 1025–1028. [CrossRef]
36. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado,F.R.; McIntyre, L.; Ostermann, M.; Prescott, H.C.; et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 2021, 47, 1181–1247. [CrossRef] [PubMed]
37. Vincent, J.L.; Singer, M.; Einav, S.; Moreno, R.; Wendon, J.; Teboul, J.L.; Bakker, J.; Hernandez,G.; Annane, D.; de Man, A.M.E.; et al. Equilibrating SSC guidelines with individualized care. Crit.Care 2021, 25, 397. [CrossRef] [PubMed]
38. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado, F.R.; McIntyre, L.; Ostermann, M.; Prescott, H.C.; et al. Executive Summary: Surviving Sepsis Campaign: International Guidelines for the Management of Sepsis and Septic Shock 2021. Crit. CareMed. 2021, 49, 1974–1982. [CrossRef] [PubMed]
39. Nachtomy, O.; Shavit, A.; Yakhini, Z. Gene expression and the concept of the phenotype. Stud.Hist. Philos. Biol. Biomed. Sci. 2007,
38, 238–254. [CrossRef] [PubMed]
40. Seymour, C.W.; Gomez, H.; Chang, C.H.; Clermont, G.; Kellum, J.A.; Kennedy, J.; Yende, S.;Angus, D.C. Precision medicine for all? Challenges and opportunities for a precision medicineapproach to critical illness. Crit. Care 2017, 21, 257. [CrossRef]
41. Beutler, B.; Du, X.; Hoebe, K. From phenomenon to phenotype and from phenotype to gene: Forward genetics and the problem of sepsis. J. Infect. Dis. 2003, 187 (Suppl. S2), S321–S326.[CrossRef]
42. Ward, N.S.; Levy, M.M. (Eds.) Sepsis, Definitions, Pathophysiology and the Challenge ofBedside Management; Springer Nature: Cham,Switzerland, 2017.
43. Available online: https://www.ibm.com/topics/machine-learning (accessed on 12 May 2023).
44. Ke, X.; Zhang, F.; Huang, G.; Wang, A. Interpretable Machine Learning to Optimize Early In-Hospital Mortality Prediction for Elderly Patients with Sepsis: A Discovery Study. Comput. Math.Methods Med. 2022, 2022, 4820464. [CrossRef]
45. Vranas, K.C.; Jopling, J.K.; Sweeney, T.E.; Ramsey, M.C.; Milstein, A.S.; Slatore, C.G.;Escobar, G.J.; Liu, V.X. Identifying Distinct Subgroups of ICU Patients: A Machine Learning Approach. Crit. Care Med. 2017, 45, 1607–1615. [CrossRef]
46. Qin, Y.; Caldino Bohn, R.I.; Sriram, A.; Kernan, K.F.; Carcillo, J.A.; Kim, S.; Park, H.J.Refining empiric subgroups of pediatric sepsis using machine-learning techniques on observationaldata. Front. Pediatr. 2023, 11, 1035576. [CrossRef] [PubMed]
47. Komorowski, M.; Green, A.; Tatham, K.C.; Seymour, C.; Antcliffe, D. Sepsis biomarkers anddiagnostic tools with a focus on machine learning. eBioMedicine 2022, 86, 104394. [CrossRef]
48. Li, H.; Markal, A.; Balch, J.A.; Loftus, T.J.; Efron, P.A.; Ozrazgat-Baslanti, T.; Bihorac, A.Methods for Phenotyping Adult Patients in Sepsis and Septic Shock: A Scoping Review. Crit. CareExplor. 2022, 4, e0672. [CrossRef] [PubMed]
49. Sharma, M.; Taweesedt, P.T.; Surani, S. Utilizing Artificial Intelligence in Critical Care: AddingA Handy Tool to Our Armamen- tarium. Cureus 2021, 13, e15531. [CrossRef]
50. Loftus, T.J.; Shickel, B.; Balch, J.A.; Tighe, P.J.; Abbott, K.L.; Fazzone, B.; Anderson, E.M.; Rozowsky, J.; Ozrazgat-Baslanti, T.; Ren, Y.; et al. Phenotype clustering in health care: A narrative review for clinicians. Front. Artif. Intell. 2022, 5, 842306. [CrossRef] [PubMed]
51. Baek, M.S.; Kim, J.H.; Kwon, Y.S. Cluster analysis integrating age and body temperature for mortality in patients with sepsis: A multicenter retrospective study. Sci. Rep. 2022, 12, 1090.[CrossRef]
52. Thomas-Ruddel, D.O.; Hoffmann, P.; Schwarzkopf, D.; Scheer, C.; Bach, F.; Komann, M.; Gerlach, H.; Weiss, M.; Lindner, M.; Ruddel, H.; et al. Fever and hypothermia represent two populations of sepsis patients and are associated with outside temperature. Crit. Care 2021, 25, 368.[CrossRef]
53. Wu, D.Y.; Lu, S.Q. The Effects of Abnormal Body Temperature on the Prognosis of Patientswith Septic Shock. Ther. Hypothermia
Temp. Manag. 2020, 10, 148–152. [CrossRef]
54. Honore, P.M.; Barreto Gutierrez, L.; Kugener, L.; Redant, S.; Attou, R.; Gallerani, A.; De Bels, D. Mortality in non-elderly septic patients was increased with hypothermia and decreased with fever whilemortality in elderly patients was not associated with body temperature: Beware of some confounders!Crit. Care 2020, 24, 606. [CrossRef] [PubMed]
55. Bhavani, S.V.; Carey, K.A.; Gilbert, E.R.; Afshar, M.; Verhoef, P.A.; Churpek, M.M. Identifying Novel Sepsis Subphenotypes Using Temperature Trajectories. Am. J. Respir. Crit. Care Med. 2019,200, 327–335. [CrossRef]
56. Henning, D.J.; Carey, J.R.; Oedorf, K.; Day, D.E.; Redfield, C.S.; Huguenel, C.J.; Roberts, J.C.;Sanchez, L.D.; Wolfe, R.E.; Shapiro,
N.I. The Absence of Fever Is Associated with Higher Mortality and Decreased Antibiotic and IV Fluid Administration in Emergency Department Patients with Suspected Septic Shock. Crit. Care Med.2017, 45, e575–e582. [CrossRef] [PubMed]
57. Sunden-Cullberg, J.; Rylance, R.; Svefors, J.; Norrby-Teglund, A.; Bjork, J.; Inghammar, M. Fever in the Emergency Department Predicts Survival of Patients with Severe Sepsis and Septic Shock Admitted to the ICU. Crit. Care Med. 2017, 45, 591–599. [CrossRef] [PubMed]
58. Rumbus, Z.; Matics, R.; Hegyi, P.; Zsiboras, C.; Szabo, I.; Illes, A.; Petervari, E.; Balasko, M.; Marta, K.; Miko, A.; et al. Fever Is Associated with Reduced, Hypothermia with Increased Mortality in Septic Patients: A Meta-Analysis of Clinical Trials. PLoS ONE 2017, 12, e0170152. [CrossRef]
59. Wiewel, M.A.; Harmon, M.B.; van Vught, L.A.; Scicluna, B.P.; Hoogendijk, A.J.; Horn, J.; Zwinderman, A.H.; Cremer, O.L.; Bonten, M.J.; Schultz, M.J.; et al. Risk factors, host response andoutcome of hypothermic sepsis. Crit. Care 2016, 20, 328. [CrossRef]
60. Bhavani, S.V.; Huang, E.S.; Verhoef, P.A.; Churpek, M.M. Novel Temperature TrajectorySubphenotypes in COVID-19. Chest 2020,158, 2436–2439. [CrossRef]
61. Shimazui, T.; Nakada, T.A.; Walley, K.R.; Oshima, T.; Abe, T.; Ogura, H.; Shiraishi, A.;Kushimoto, S.; Saitoh, D.; Fujishima, S.; et al. Significance of body temperature in elderly patients with sepsis. Crit. Care 2020, 24, 387. [CrossRef]
62. Bhavani, S.V.; Wolfe, K.S.; Hrusch, C.L.; Greenberg, J.A.; Krishack, P.A.; Lin, J.; Lecompte-Osorio, P.; Carey, K.A.; Kress, J.P.; Coopersmith, C.M.; et al. Temperature Trajectory Subphenotypes Correlate with Immune Responses in Patients with Sepsis. Crit. Care Med. 2020, 48, 1645–1653.[CrossRef]
63. Ito, Y.; Kudo, D.; Kushimoto, S. Association between low body temperature on admission and in-hospital mortality according to body mass index categories of patients with sepsis. Medicine 2022,101, e31657. [CrossRef]
64. Bhavani, S.V.; Verhoef, P.A.; Maier, C.L.; Robichaux, C.; Parker, W.F.; Holder, A.; Kamaleswaran, R.; Wang, M.D.; Churpek, M.M.; Coopersmith, C.M. Coronavirus Disease 2019 Temperature Trajectories Correlate with Hyperinflammatory and Hypercoagulable Subphenotypes.Crit. Care Med. 2022, 50, 212–223. [CrossRef]
65. Zhu, J.L.; Yuan, S.Q.; Huang, T.; Zhang, L.M.; Xu, X.M.; Yin, H.Y.; Wei, J.R.; Lyu, J. Influence of systolic blood pressure trajectory on in-hospital mortality in patients with sepsis. BMC Infect. Dis.2023, 23, 90. [CrossRef]
66. Daulasim, A.; Vieillard-Baron, A.; Geri, G. Hemodynamic clinical phenotyping in septic shock.Curr. Opin. Crit. Care 2021, 27,290–297. [CrossRef] [PubMed]
67. Geri, G.; Vignon, P.; Aubry, A.; Fedou, A.L.; Charron, C.; Silva, S.; Repesse, X.; Vieillard-Baron, A. Cardiovascular clusters in septic shock combining clinical and echocardiographic parameters: Apost hoc analysis. Intensive Care Med. 2019, 45, 657–667. [CrossRef] [PubMed]
68. Knox, D.B.; Lanspa, M.J.; Kuttler, K.G.; Brewer, S.C.; Brown, S.M. Phenotypic clusters withinsepsis-associated multiple organ dysfunction syndrome. Intensive Care Med. 2015, 41, 814–822.[CrossRef] [PubMed]
69. Ibrahim, Z.M.; Wu, H.; Hamoud, A.; Stappen, L.; Dobson, R.J.B.; Agarossi, A. On classifyingsepsis heterogeneity in the ICU: Insight using machine learning. J. Am. Med. Inform. Assoc. 2020, 27,437–443. [CrossRef]
70. Zhang, Z.; Zhang, G.; Goyal, H.; Mo, L.; Hong, Y. Identification of subclasses of sepsis thatshowed different clinical outcomes and responses to amount of fluid resuscitation: A latent profileanalysis. Crit. Care 2018, 22, 347. [CrossRef]
71. Seymour, C.W.; Kennedy, J.N.; Wang, S.; Chang, C.H.; Elliott, C.F.; Xu, Z.; Berry, S.; Clermont, G.; Cooper, G.; Gomez, H.; et al. Derivation, Validation, and Potential Treatment Implications of Novel Clinical Phenotypes for Sepsis. JAMA 2019, 321, 2003–2017. [CrossRef]
72. Xu, Z.; Mao, C.; Su, C.; Zhang, H.; Siempos, I.; Torres, L.K.; Pan, D.; Luo, Y.; Schenck, E.J.; Wang, F. Sepsis subphenotyping based on organ dysfunction trajectory. Crit. Care 2022, 26, 197.[CrossRef]
73. Sharafoddini, A.; Dubin, J.A.; Lee, J. Identifying subpopulations of septic patients: A temporal data-driven approach. Comput. Biol. Med. 2021, 130, 104182. [CrossRef]
74. Aldewereld, Z.T.; Zhang, L.A.; Urbano, A.; Parker, R.S.; Swigon, D.; Banerjee, I.; Gomez, H.;Clermont, G. Identification of Clinical Phenotypes in Septic Patients Presenting with Hypotension orElevated Lactate. Front. Med. 2022, 9, 794423. [CrossRef] [PubMed]
75. Ding, M.; Luo, Y. Unsupervised phenotyping of sepsis using nonnegative matrix factorizationof temporal trends from a multivariate panel of physiological measurements. BMC Med. Inform. Decis. Mak. 2021, 21, 95. [CrossRef] [PubMed]
76. Papin, G.; Bailly, S.; Dupuis, C.; Ruckly, S.; Gainnier, M.; Argaud, L.; Azoulay, E.; Adrie, C.;Souweine, B.; Goldgran-Toledano, D.; et al. Clinical and biological clusters of sepsis patients usinghierarchical clustering. PLoS ONE 2021, 16, e0252793. [CrossRef]
77. Shald, E.A.; Erdman, M.J.; Ferreira, J.A. Impact of Clinical Sepsis Phenotypes on Mortalityand Fluid Status in Critically Ill Patients. Shock 2022, 57, 57–62. [CrossRef] [PubMed]
78. Wang, M.; Zhu, B.; Jiang, L.; Luo, X.; Wang, N.; Zhu, Y.; Xi, X. Association between Latent Trajectories of Fluid Balance and Clinical Outcomes in Critically Ill Patients with Acute Kidney Injury: A Prospective Multicenter Observational Study. Kidney Dis. 2022, 8, 82–92. [CrossRef]
79. Ma, P.; Liu, J.; Shen, F.; Liao, X.; Xiu, M.; Zhao, H.; Zhao, M.; Xie, J.; Wang, P.; Huang, M.; et al. Individualized resuscitation strategy for septic shock formalized by finite mixture modeling and dynamic treatment regimen. Crit. Care 2021, 25, 243. [CrossRef]
80. Zhang, Z.; Ho, K.M.; Gu, H.; Hong, Y.; Yu, Y. Defining persistent critical illness based on growth trajectories in patients with sepsis. Crit. Care 2020, 24, 57. [CrossRef]
81. Yang, R.; Han, D.; Zhang, L.; Huang, T.; Xu, F.; Zheng, S.; Yin, H.; Lyu, J. Analysis of the correlation between the longitudinal trajectory of SOFA scores and prognosis in patients with sepsis at72 hour after admission based on group trajectory modeling.
J. Intensive Med. 2022, 2, 39–49. [CrossRef]
82. Soussi, S.; Sharma, D.; Juni, P.; Lebovic, G.; Brochard, L.; Marshall, J.C.; Lawler, P.R.; Herridge, M.; Ferguson, N.; Del Sorbo, L.; et al. Identifying clinical subtypes in sepsis-survivors with different one-year outcomes: A secondary latent class analysis of the FROG-ICU cohort. Crit. Care 2022, 26,114. [CrossRef]
83. Taylor, S.P.; Bray, B.C.; Chou, S.H.; Burns, R.; Kowalkowski, M.A. Clinical Subtypes of SepsisSurvivors Predict Readmission and Mortality after Hospital Discharge. Ann. Am. Thorac. Soc. 2022,19, 1355–1363. [CrossRef]
84. Boede, M.; Gensichen, J.S.; Jackson, J.C.; Eissler, F.; Lehmann, T.; Schulz, S.; Petersen, J.J.; Wolf, F.P.; Dreischulte, T.; Schmidt, K.F.R. Trajectories of depression in sepsis survivors: Anobservational cohort study. Crit. Care 2021, 25, 161. [CrossRef] [PubMed]
85. Puthucheary, Z.A.; Gensichen, J.S.; Cakiroglu, A.S.; Cashmore, R.; Edbrooke, L.; Heintze, C.; Neumann, K.; Wollersheim, T.; Denehy, L.; Schmidt, K.F.R. Implications for post critical illness trial design: Sub-phenotyping trajectories of functional recovery among sepsis survivors. Crit. Care 2020,24, 577. [CrossRef] [PubMed]
86. Prescott, H.C. Identifying Sepsis Subtypes from Routine Clinical Data. Am. J. Respir. Crit. CareMed. 2019, 200, 272–273. [CrossRef][PubMed]
87. Nagin, D.S.; Jones, B.L.; Passos, V.L.; Tremblay, R.E. Group-based multi-trajectory modeling. Stat. Methods Med. Res. 2018, 27, 2015–2023. [CrossRef]
88. Leijte, G.P.; Kox, M.; Pickkers, P. Fever in Sepsis: Still a Hot Topic. Am. J. Respir. Crit. CareMed. 2019, 200, 263–264. [CrossRef]
89. Harmon, M.B.A.; Scicluna, B.P.; Wiewel, M.A.; Schultz, M.J.; Horn, J.; Cremer, O.L.; van der Poll, T.; Joost Wiersinga, W.; Juffermans, N.P.; The MARS Consortium. Patients with hypothermicsepsis have a unique gene expression profile compared to patients with fever and sepsis. J. Cell. Mol.Med. 2022, 26, 1896–1904. [CrossRef]
90. Young, P.J.; Bellomo, R. Fever in sepsis: Is it cool to be hot? Crit. Care 2014, 18, 109. [CrossRef]
91. Drewry, A.M.; Mohr, N.M.; Ablordeppey, E.A.; Dalton, C.M.; Doctor, R.J.; Fuller, B.M.; Kollef, M.H.; Hotchkiss, R.S. Therapeutic Hyperthermia Is Associated with Improved Survival in Afebrile Critically Ill Patients with Sepsis: A Pilot Randomized Trial. Crit. Care Med. 2022, 50, 924–934.[CrossRef]
92. Kula, R. Therapeutic Hyperthermia Is Associated with Improved Survival in Afebrile Critically Ill Patients with Sepsis: A Pilot Randomized Trial. Crit. Care Med. 2022, 50, e693–e694. [CrossRef]
93. Nowak, R.M.; Reed, B.P.; Nanayakkara, P.; DiSomma, S.; Moyer, M.L.; Millis, S.; Levy, P.Presenting hemodynamic phenotypes in ED patients with confirmed sepsis. Am. J. Emerg. Med. 2016, 34, 2291–2297. [CrossRef]
94. Hess, M.L.; Hastillo, A.; Greenfield, L.J. Spectrum of cardiovascular function during gram-negative sepsis. Prog. Cardiovasc. Dis.1981, 23, 279–298. [CrossRef] [PubMed]
95. Zhang, H.; Wang, X.; Yin, W.; Zhang, H.; Liu, L.; Pan, P.; Zhu, Y.; Huang, W.; Xing, Z.; Yao, B.; et al. A multicenter prospective cohort study of cardiac ultrasound phenotypes in patients with sepsis: Study protocol for a multicenter prospective cohort trial. Front. Med. 2022, 9, 938536. [CrossRef][PubMed]
96. Kattan, E.; Bakker, J.; Estenssoro, E.; Ospina-Tascon, G.A.; Cavalcanti, A.B.; Backer, D.; Vieillard-Baron, A.; Teboul, J.L.; Castro, R.; Hernandez, G. Hemodynamic phenotype-based, capillary refill time-targeted resuscitation in early septic shock: The ANDROMEDA-SHOCK-2 Randomized Clinical Trial study protocol. Rev. Bras. Ter. Intensiva 2022, 34, 96–106. [CrossRef] [PubMed]
97. Bhavani, S.V.; Semler, M.; Qian, E.T.; Verhoef, P.A.; Robichaux, C.; Churpek, M.M.;Coopersmith, C.M. Development and validation of novel sepsis subphenotypes using trajectories ofvital signs. Intensive Care Med. 2022, 48, 1582–1592. [CrossRef]
98. Knaus, W.A.; Marks, R.D. New Phenotypes for Sepsis: The Promise and Problem of ApplyingMachine Learning and Artificial Intelligence in Clinical Research. JAMA 2019, 321, 1981–1982.[CrossRef]
99. Hasegawa, D.; Nishida, O. Patient selection in sepsis: Precision medicine using phenotypes andits implications for future clinical trial design. J. Thorac. Dis. 2019, 11, 3672–3675. [CrossRef]
100. Stortz, J.A.; Cox, M.C.; Hawkins, R.B.; Ghita, G.L.; Brumback, B.A.; Mohr, A.M.; Moldawer,L.L.; Efron, P.A.; Brakenridge, S.C.; Moore, F.A. Phenotypic heterogeneity by site of infection in surgical sepsis: A prospective longitudinal study. Crit. Care 2020, 24, 203. [CrossRef]
101. Blot, S.; Antonelli, M.; Arvaniti, K.; Blot, K.; Creagh-Brown, B.; de Lange, D.; De Waele, J.;Deschepper, M.; Dikmen, Y.; Dimopoulos, G.; et al. Epidemiology of intra-abdominal infection and sepsis in critically ill patients: “AbSeS”, a multinational observational cohort study and ESICM TrialsGroup Project. Intensive Care Med. 2019, 45, 1703–1717. [CrossRef]
102. Miao, H.; Cui, Z.; Guo, Z.; Chen, Q.; Su, W.; Sun, Y.; Sun, M.; Ma, X.; Ding, R. Identification of Subphenotypes of Sepsis-Associated Liver Dysfunction Using Cluster Analysis. Shock 2023, 59, 368–374. [CrossRef]
103. Wiersema, R.; Jukarainen, S.; Vaara, S.T.; Poukkanen, M.; Lakkisto, P.; Wong, H.; Linder, A.; van der Horst, I.C.C.; Pettila, V. Two subphenotypes of septic acute kidney injury are associated withdifferent 90-day mortality and renal recovery. Crit. Care 2020, 24, 150. [CrossRef]
104. Thau, M.R.; Bhatraju, P.K. Sub-Phenotypes of Acute Kidney Injury: Do We Have Progress forPersonalizing Care? Nephron 2020,144, 677–679. [CrossRef]
105. Luo, X.Q.; Yan, P.; Zhang, N.Y.; Luo, B.; Wang, M.; Deng, Y.H.; Wu, T.; Wu, X.; Liu, Q.;Wang, H.S.; et al. Machine learning for early discrimination between transient and persistent acutekidney injury in critically ill patients with sepsis. Sci. Rep. 2021, 11, 20269. [CrossRef] [PubMed]
106. Ozrazgat-Baslanti, T.; Loftus, T.J.; Mohandas, R.; Wu, Q.; Brakenridge, S.; Brumback, B.; Efron, P.A.; Anton, S.; Moore, F.A.; Moldawer, L.L.; et al. Clinical Trajectories of Acute Kidney Injury in Surgical Sepsis: A Prospective Observational Study. Ann. Surg. 2022, 275, 1184–1193. [CrossRef]
107. Chen, X.; Li, J.; Liu, G.; Chen, X.; Huang, S.; Li, H.; Liu, S.; Li, D.; Yang, H.; Zheng, H.; et al.Identification of Distinct Clinical Phenotypes of Heterogeneous Mechanically Ventilated ICU Patients Using Cluster Analysis. J. Clin. Med. 2023, 12, 1499. [CrossRef] [PubMed]
108. Su, L.; Zhang, Z.; Zheng, F.; Pan, P.; Hong, N.; Liu, C.; He, J.; Zhu, W.; Long, Y.; Liu, D. Five novel clinical phenotypes for critically ill patients with mechanical ventilation in intensive care units: A retrospective and multi database study. Respir. Res. 2020, 21, 325. [CrossRef]
109. Yu, S.; Ma, X.; Li, X. Phenotype-oriented anticoagulant therapy for sepsis: Still a work in progress. Int. J. Hematol. 2022, 116, 48–54. [CrossRef] [PubMed]
110. Kudo, D.; Goto, T.; Uchimido, R.; Hayakawa, M.; Yamakawa, K.; Abe, T.; Shiraishi, A.; Kushimoto, S. Coagulation phenotypes in sepsis and effects of recombinant human thrombomodulin: An analysis of three multicentre observational studies. Crit. Care 2021, 25, 114. [CrossRef]
111. Helms, J.; Iba, T.; Connors, J.M.; Gando, S.; Levi, M.; Meziani, F.; Levy, J.H. How to managecoagulopathies in critically ill patients.
Intensive Care Med. 2023, 49, 273–290. [CrossRef]
112. Guo, F.; Zhu, X.; Wu, Z.; Zhu, L.; Wu, J.; Zhang, F. Clinical applications of machine learning in the survival prediction and classification of sepsis: Coagulation and heparin usage matter. J. Transl.Med. 2022, 20, 265. [CrossRef]
113. Dong, M.; Chen, S.; Lin, S.; Han, F.; Zhong, M. Insights into COVID-19-associated criticalillness: A narrative review. Ann. Transl. Med. 2023, 11, 220. [CrossRef]
114. Dubowski, K.; Braganza, G.T.; Bozack, A.; Colicino, E.; DeFelice, N.; McGuinn, L.; Maru, D.;Lee, A.G. COVID-19 subphenotypes at hospital admission are associated with mortality: A cross-sectional study. Ann. Med. 2023, 55, 12–23. [CrossRef] [PubMed]
115. Oh, W.; Jayaraman, P.; Sawant, A.S.; Chan, L.; Levin, M.A.; Charney, A.W.; Kovatch, P.; Glicksberg, B.S.; Nadkarni, G.N. Using sequence clustering to identify clinically relevantsubphenotypes in patients with COVID-19 admitted to the intensive care unit.J. Am. Med. Inform.Assoc. 2022, 29, 489–499. [CrossRef] [PubMed]
116. Fish, M.; Rynne, J.; Jennings, A.; Lam, C.; Lamikanra, A.A.; Ratcliff, J.; Cellone-Trevelin, S.; Timms, E.; Jiriha, J.; Tosi, I.; et al. Coronavirus disease 2019 subphenotypes and differential treatment response to convalescent plasma in critically ill adults: Secondary analyses of a randomized clinicaltrial. Intensive Care Med. 2022, 48, 1525–1538. [CrossRef] [PubMed]
117. Bruse, N.; Kooistra, E.J.; Jansen, A.; van Amstel, R.B.E.; de Keizer, N.F.; Kennedy, J.N.; Seymour, C.; van Vught, L.A.; Pickkers, P.; Kox, M. Clinical sepsis phenotypes in critically illCOVID-19 patients. Crit. Care 2022, 26, 244. [CrossRef]
118. de Prost, N.; Audureau, E.; Heming, N.; Gault, E.; Pham, T.; Chaghouri, A.; de Montmollin, N.; Voiriot, G.; Morand-Joubert, L.; Joseph, A.; et al. Clinical phenotypes and outcomes associated withSARS-CoV-2 variant Omicron in critically ill French patients with COVID-19. Nat. Commun. 2022,13, 6025. [CrossRef]
119. Morales Chacon, L.M.; Galan Garcia, L.; Cruz Hernandez, T.M.; Pavon Fuentes, N.; MaragotoRizo, C.; Morales Suarez, I.; Morales Chacon, O.; Abad Molina, E.; Rocha Arrieta, L. Clinical Phenotypes and Mortality Biomarkers: A Study Focused on COVID-19 Patients with NeurologicalDiseases in Intensive Care Units. Behav. Sci. 2022, 12, 234. [CrossRef]
120. Wang, X.; Jehi, L.; Ji, X.; Mazzone, P.J. Phenotypes and Subphenotypes of Patients with COVID-19: A Latent Class Modeling Analysis. Chest 2021, 159, 2191–2204. [CrossRef]
121. Bos, L.D.J.; Sjoding, M.; Sinha, P.; Bhavani, S.V.; Lyons, P.G.; Bewley, A.F.; Botta, M.; Tsonas, A.M.; Serpa Neto, A.; Schultz, M.J.; et al. Longitudinal respiratory subphenotypes in patients with COVID-19-related acute respiratory distress syndrome: Results from three observationalcohorts. Lancet Respir. Med. 2021, 9, 1377–1386. [CrossRef]
122. Su, C.; Xu, Z.; Hoffman, K.; Goyal, P.; Safford, M.M.; Lee, J.; Alvarez-Mulett, S.; Gomez-Escobar, L.; Price, D.R.; Harrington, J.S.; et al. Identifying organ dysfunction trajectory-based subphenotypes in critically ill patients with COVID-19. Sci. Rep. 2021, 11, 15872. [CrossRef]
123. Ranjeva, S.; Pinciroli, R.; Hodell, E.; Mueller, A.; Hardin, C.C.; Thompson, B.T.; Berra, L. Identifying clinical and biochemical phenotypes in acute respiratory distress syndrome secondary to coronavirus disease-2019. eClinicalMedicine 2021, 34, 100829. [CrossRef]
124. Vasquez, C.R.; Gupta, S.; Miano, T.A.; Roche, M.; Hsu, J.; Yang, W.; Holena, D.N.; Reilly, J.P.; Schrauben, S.J.; Leaf, D.E.; et al. Identification of Distinct Clinical Subphenotypes in Critically IllPatients with COVID-19. Chest 2021, 160, 929–943. [CrossRef]
125. Gutierrez-Gutierrez, B.; Del Toro, M.D.; Borobia, A.M.; Carcas, A.; Jarrin, I.; Yllescas, M.; Ryan, P.; Pachon, J.; Carratala, J.; Berenguer, J.; et al. Identification and validation of clinical phenotypes with prognostic implications in patients admitted to hospital with COVID-19: A multicentre cohortstudy. Lancet Infect. Dis. 2021, 21, 783–792. [CrossRef] [PubMed]
126. Chen, H.; Zhu, Z.; Su, N.; Wang, J.; Gu, J.; Lu, S.; Zhang, L.; Chen, X.; Xu, L.; Shao, X.; et al. Identification and Prediction of Novel Clinical Phenotypes for Intensive Care Patients with SARS-CoV-2 Pneumonia: An Observational Cohort Study. Front. Med. 2021, 8, 681336. [CrossRef][PubMed]
127. Osuchowski, M.F.; Rosengart, M.R. Change Is the Only Constant: How to Adopt the New Trends in Sepsis Modeling? Crit. Care Med. 2019, 47, 1673–1675. [CrossRef] [PubMed]
128. Sinha, P.; Calfee, C.S.; Cherian, S.; Brealey, D.; Cutler, S.; King, C.; Killick, C.; Richards, O.; Cheema, Y.; Bailey, C.; et al. Prevalence of phenotypes of acute respiratory distress syndrome in critically ill patients with COVID-19: A prospective observational study. Lancet Respir. Med. 2020, 8,1209–1218. [CrossRef]
129. Blanchard, F.; James, A.; Assefi, M.; Kapandji, N.; Constantin, J.M. Personalized medicine targeting different ARDS phenotypes: The future of pharmacotherapy for ARDS? Expert. Rev. Respir.Med. 2023, 17, 41–52. [CrossRef]
130. Sinha, P.; Meyer, N.J.; Calfee, C.S. Biological Phenotyping in Sepsis and Acute Respiratory Distress Syndrome. Annu. Rev. Med.
2023, 74, 457–471. [CrossRef]
131. Maddali, M.V.; Churpek, M.; Pham, T.; Rezoagli, E.; Zhuo, H.; Zhao, W.; He, J.; Delucchi, K.L.; Wang, C.; Wickersham, N.; et al. Validation and utility of ARDS subphenotypes identified by machine-learning models using clinical data: An observational, multicohort, retrospective analysis.Lancet Respir. Med. 2022, 10, 367–377. [CrossRef]
132. Bai, Y.; Xia, J.; Huang, X.; Chen, S.; Zhan, Q. Using machine learning for the early prediction of sepsis-associated ARDS in the ICU and identification of clinical phenotypes with differentialresponses to treatment. Front. Physiol. 2022, 13, 1050849. [CrossRef]
133. Hashem, M.D.; Hopkins, R.O.; Colantuoni, E.; Dinglas, V.D.; Sinha, P.; Aronson Friedman, L.; Morris, P.E.; Jackson, J.C.; Hough, C.L.; Calfee, C.S.; et al. Six-month and 12-month patient outcomes based on inflammatory subphenotypes in sepsis-associated ARDS: Secondary analysis of SAILS-ALTOS trial. Thorax 2022, 77, 22–30. [CrossRef]
134. Zhang, H.; Li, Z.; Zheng, W.; Zhang, L.; Yang, T.; Xie, K.; Yu, Y. Risk stratification of patients with acute respiratory distress syndrome complicated with sepsis using lactate trajectories. BMC Pulm. Med. 2022, 22, 339. [CrossRef] [PubMed]
135. Wu, L.; Lei, Q.; Gao, Z.; Zhang, W. Research Progress on Phenotypic Classification of Acute Respiratory Distress Syndrome: A Narrative Review. Int. J. Gen. Med. 2022, 15, 8767–8774.[CrossRef]
136. Alipanah, N.; Calfee, C.S. Phenotyping in acute respiratory distress syndrome: State of the art and clinical implications. Curr. Opin. Crit. Care 2022, 28, 1–8. [CrossRef] [PubMed]
137. Martin, T.R.; Zemans, R.L.; Ware, L.B.; Schmidt, E.P.; Riches, D.W.H.; Bastarache, L.; Calfee, C.S.; Desai, T.J.; Herold, S.; Hough, C.L.; et al. New Insights into Clinical and Mechanistic Heterogeneity of the Acute Respiratory Distress Syndrome: Summary of the Aspen Lung Conference2021. Am. J. Respir. Cell Mol. Biol. 2022, 67, 284–308. [CrossRef] [PubMed]
138. Chen, H.; Yu, Q.; Xie, J.; Liu, S.; Pan, C.; Liu, L.; Huang, Y.; Guo, F.; Qiu, H.; Yang, Y. Longitudinal phenotypes in patients with acute respiratory distress syndrome: A multi-database study.Crit. Care 2022, 26, 340. [CrossRef]
139. Duggal, A.; Kast, R.; Van Ark, E.; Bulgarelli, L.; Siuba, M.T.; Osborn, J.; Rey, D.A.; Zampieri, F.G.; Cavalcanti, A.B.; Maia, I.; et al. Identification of acute respiratory distress syndromesubphenotypes de novo using routine clinical data: A retrospective analysis of ARDS clinical trials.BMJ Open 2022, 12, e053297. [CrossRef]
140. Whebell, S.; Zhang, J. Bringing biological ARDS phenotypes to the bedside with machine-learning-based classifiers. Lancet Respir.Med. 2022, 10, 319–320. [CrossRef]
141. Bos, L.D.J.; Ware, L.B. Acute respiratory distress syndrome: Causes, pathophysiology, and phenotypes. Lancet 2022, 400, 1145–1156. [CrossRef]
142. Wendel Garcia, P.D.; Caccioppola, A.; Coppola, S.; Pozzi, T.; Ciabattoni, A.; Cenci, S.; Chiumello, D. Latent class analysis to predict intensive care outcomes in Acute Respiratory DistressSyndrome: A proposal of two pulmonary phenotypes. Crit. Care 2021, 25, 154. [CrossRef]
143. Sinha, P.; Furfaro, D.; Cummings, M.J.; Abrams, D.; Delucchi, K.; Maddali, M.V.; He, J.; Thompson, A.; Murn, M.; Fountain, J.; et al. Latent Class Analysis Reveals COVID-19-related Acute Respiratory Distress Syndrome Subgroups with Differential Responses to Corticosteroids. Am. J.Respir. Crit. Care Med. 2021, 204, 1274–1285. [CrossRef]
144. Sathe, N.A.; Zelnick, L.R.; Mikacenic, C.; Morrell, E.D.; Bhatraju, P.K.; McNeil, J.B.; Kosamo,S.; Hough, C.L.; Liles, W.C.; Ware, L.B.; et al. Identification of persistent and resolvingsubphenotypes of acute hypoxemic respiratory failure in two independent cohorts. Crit. Care 2021, 25,336. [CrossRef]
145. Liu, X.; Jiang, Y.; Jia, X.; Ma, X.; Han, C.; Guo, N.; Peng, Y.; Liu, H.; Ju, Y.; Luo, X.; et al.Identification of distinct clinical phenotypes of acute respiratory distress syndrome with differentialresponses to treatment. Crit. Care 2021, 25, 320. [CrossRef]
146. Millar, J.E.; Wildi, K.; Bartnikowski, N.; Bouquet, M.; Hyslop, K.; Passmore, M.R.; Ki, K.K.; See Hoe, L.E.; Obonyo, N.G.; Neyton, L.; et al. Characterizing preclinical sub-phenotypic models of acute respiratory distress syndrome: An experimental ovine study. Physiol. Rep. 2021, 9, e15048. [CrossRef][PubMed]
147. Heijnen, N.F.L.; Hagens, L.A.; Smit, M.R.; Cremer, O.L.; Ong, D.S.Y.; van der Poll, T.; vanVught, L.A.; Scicluna, B.P.; Schnabel, R.M.; van der Horst, I.C.C.; et al. Biological Subphenotypes of Acute Respiratory Distress Syndrome Show Prognostic Enrichment in Mechanically Ventilated Patients without Acute Respiratory Distress Syndrome. Am. J. Respir. Crit. Care Med. 2021, 203,1503–1511. [CrossRef] [PubMed]
148. Matthay, M.A.; Arabi, Y.M.; Siegel, E.R.; Ware, L.B.; Bos, L.D.J.; Sinha, P.; Beitler, J.R.;Wick, K.D.; Curley, M.A.Q.; Constantin, J.M.; et al. Phenotypes and personalized medicine in the acute respiratory distress syndrome. Intensive Care Med. 2020, 46, 2136–2152. [CrossRef]
149. McNicholas, B.; Madden, M.G.; Laffey, J.G. Machine Learning Classifier Models: The Future for Acute Respiratory Distress Syndrome Phenotyping? Am. J. Respir. Crit. Care Med. 2020, 202, 919–920. [CrossRef]
150. Sinha, P.; Churpek, M.M.; Calfee, C.S. Machine Learning Classifier Models Can Identify Acute Respiratory Distress Syndrome Phenotypes Using Readily Available Clinical Data. Am. J. Respir. Crit.Care Med. 2020, 202, 996–1004. [CrossRef]
151. Sinha, P.; Delucchi, K.L.; McAuley, D.F.; O’Kane, C.M.; Matthay, M.A.; Calfee, C.S. Development and validation of parsimonious algorithms to classify acute respiratory distress syndrome phenotypes: A secondary analysis of randomised controlled trials. Lancet Respir. Med.2020, 8, 247–257. [CrossRef] [PubMed]
152. Sinha, P.; Delucchi, K.L.; Thompson, B.T.; McAuley, D.F.; Matthay, M.A.; Calfee, C.S.; Network, N.A. Latent class analysis of ARDS subphenotypes: A secondary analysis of the statins for acutely injured lungs from sepsis (SAILS) study. Intensive Care Med. 2018, 44, 1859–1869.[CrossRef]
153. Levine, A.R.; Shanholtz, C.B. I, DOCTOR: The role of machine learning in phenotyping ARDS.eBioMedicine 2022, 75, 103770.[CrossRef]
154. Hu, W.; Chen, H.; Wang, H.; Peng, Q.; Wang, J.; Huang, W.; Liu, A.; Xu, J.; Li, Q.; Pan, C.; et al. Identifying high-risk phenotypes and associated harms of delayed time-to-antibiotics in patients with ICU onset sepsis: A retrospective cohort study. J. Crit. Care 2023, 74, 154221. [CrossRef] [PubMed]
155. Han, X.; Spicer, A.; Carey, K.A.; Gilbert, E.R.; Laiteerapong, N.; Shah, N.S.; Winslow, C.; Afshar,M.; Kashiouris, M.G.; Churpek,M.M. Identifying High-Risk Subphenotypes and Associated HarmsFrom Delayed Antibiotic Orders and Delivery. Crit. Care Med.2021, 49, 1694–1705. [CrossRef]
156. Qi, J.; Lei, J.; Li, N.; Huang, D.; Liu, H.; Zhou, K.; Dai, Z.; Sun, C. Machine learning modelsto predict in-hospital mortality in septic patients with diabetes. Front. Endocrinol. 2022, 13, 1034251.[CrossRef] [PubMed]
157. Bao, C.; Deng, F.; Zhao, S. Machine-learning models for prediction of sepsis patients mortality. Med. Intensiva 2022, 47, 315–325. [CrossRef]
158. Yu, H.; Zhang, H.; Lang, Y.; Li, S.; Wan, X. Identifying the Phenotypes of Sepsis that will Benefitfrom Red Blood Cell Transfusion Using Unsupervised Cluster Analysis. Clin. Lab. 2022, 68, 210619.[CrossRef] [PubMed]
159. Liu, R.; Greenstein, J.L.; Granite, S.J.; Fackler, J.C.; Bembea, M.M.; Sarma, S.V.; Winslow, R.L. Data-driven discovery of a novel sepsis pre-shock state predicts impending septic shock in the ICU.Sci. Rep. 2019, 9, 6145. [CrossRef]
160. Carcillo, J.A.; Halstead, E.S.; Hall, M.W.; Nguyen, T.C.; Reeder, R.; Aneja, R.; Shakoory, B.; Simon, D.; on behalf of the Eunice Kennedy Shriver National Institute of Child Health and Human Development Collaborative Pediatric Critical Care Research Network investigators. Three Hypothetical Inflammation Pathobiology Phenotypes and Pediatric Sepsis-Induced Multiple OrganFailure Outcome. Pediatr. Crit. Care Med. 2017, 18, 513–523. [CrossRef]
161. Carcillo, J.A.; Berg, R.A.; Wessel, D.; Pollack, M.; Meert, K.; Hall, M.; Newth, C.; Lin, J.C.; Doctor, A.; Shanley, T.; et al. A Multicenter Network Assessment of Three Inflammation Phenotypes in Pediatric Sepsis-Induced Multiple Organ Failure. Pediatr. Crit. Care Med. 2019, 20, 1137–1146.[CrossRef]
162. Stroup, E.K.; Luo, Y.; Sanchez-Pinto, L.N. Phenotyping Multiple Organ Dysfunction Syndrome Using Temporal Trends in Critically Ill Children. In Proceedings of the 2019 IEEE International Conference on Bioinformatics and Biomedicine (BIBM), San Diego, CA, USA, 18–21 November2019; pp. 968–972. [CrossRef]
163. Sanchez-Pinto, L.N.; Stroup, E.K.; Pendergrast, T.; Pinto, N.; Luo, Y. Derivation and Validation of Novel Phenotypes of Multiple Organ Dysfunction Syndrome in Critically Ill Children. JAMA Netw.Open 2020, 3, e209271. [CrossRef]
164. Atreya, M.R.; Sanchez-Pinto, L.N.; Kamaleswaran, R. Commentary: ‘Critical illness subclasses:All roads lead to Rome’. Crit. Care2022, 26, 387. [CrossRef]
165. Dahmer, M.K.; Yang, G.; Zhang, M.; Quasney, M.W.; Sapru, A.; Weeks, H.M.; Sinha, P.;Curley, M.A.Q.; Delucchi, K.L.; Calfee, C.S.; et al. Identification of phenotypes in paediatric patients with acute respiratory distress syndrome: A latent class analysis. Lancet Respir. Med. 2022, 10, 289–297. [CrossRef] [PubMed]
166. Wong, H.R.; Sweeney, T.E.; Hart, K.W.; Khatri, P.; Lindsell, C.J. Pediatric Sepsis EndotypesAmong Adults with Sepsis. Crit. Care
Med. 2017, 45, e1289–e1291. [CrossRef] [PubMed]
167. Qin, Y.; Kernan, K.F.; Fan, Z.; Park, H.J.; Kim, S.; Canna, S.W.; Kellum, J.A.; Berg, R.A.; Wessel, D.; Pollack, M.M.; et al. Machine learning derivation of four computable 24-h pediatricsepsis phenotypes to facilitate enrollment in early personalized anti-inflammatory clinical trials. Crit.Care 2022, 26, 128. [CrossRef] [PubMed]
168. Wong, H.R. Searching for a Pediatric Severe Sepsis Phenotype: We Might Indeed Be There.Pediatr. Crit. Care Med. 2017, 18,
502–503. [CrossRef] [PubMed]
169. Workman, J.K.; Larsen, G.Y. Searching for a Pediatric Severe Sepsis Phenotype: Are We ThereYet? Pediatr. Crit. Care Med. 2017,
18, 82–83. [CrossRef]
170. Jacobs, L.; Wong, H.R. Sepsis Subclasses: Be Careful of What You Wish for. Pediatr. Crit. CareMed. 2017, 18, 591–592. [CrossRef]
171. Martin, B.; Bennett, T.D. Sepsis Computable Phenotypes in the Service of Observational Research. Crit. Care Med. 2019, 47, 303–305. [CrossRef]
172. Koutroulis, I.; Velez, T.; Wang, T.; Yohannes, S.; Galarraga, J.E.; Morales, J.A.; Freishtat, R.J.; Chamberlain, J.M. Pediatric sepsis phenotypes for enhanced therapeutics: An application of clusteringto electronic health records. J. Am. Coll. Emerg. Physicians Open 2022, 3, e12660. [CrossRef]
173. Mehta, S.; Gill, S.E. Improving clinical outcomes in sepsis and multiple organ dysfunction throughprecision medicine. J. Thorac. Dis. 2019, 11, 21–28. [CrossRef]
174. Maslove, D.M.; Lamontagne, F.; Marshall, J.C.; Heyland, D.K. A path to precision in the ICU.Crit. Care 2017, 21, 79. [CrossRef]
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 13.12.2023
[~DATE_ACTIVE_FROM] => 13.12.2023
[ACTIVE_FROM_X] => 2023-12-13 00:00:00
[~ACTIVE_FROM_X] => 2023-12-13 00:00:00
[ACTIVE_FROM] => 13.12.2023
[~ACTIVE_FROM] => 13.12.2023
[SHOW_COUNTER] => 1034
[~SHOW_COUNTER] => 1034
[ID] => 8396
[~ID] => 8396
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 20.12.2023 13:00:34
[~TIMESTAMP_X] => 20.12.2023 13:00:34
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/klinicheskie-fenotipy-sepsisa-u-patsientov-v-kriticheskom-sostoyanii/
[~DETAIL_PAGE_URL] => /library/articles/klinicheskie-fenotipy-sepsisa-u-patsientov-v-kriticheskom-sostoyanii/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => klinicheskie-fenotipy-sepsisa-u-patsientov-v-kriticheskom-sostoyanii
[~CODE] => klinicheskie-fenotipy-sepsisa-u-patsientov-v-kriticheskom-sostoyanii
[EXTERNAL_ID] => 8396
[~EXTERNAL_ID] => 8396
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 13 декабря 2023
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
[PREVIEW_PICTURE] => Array
(
[ID] => 5464
[TIMESTAMP_X] => 20.12.2023 13:00:34
[MODULE_ID] => iblock
[HEIGHT] => 632
[WIDTH] => 1000
[FILE_SIZE] => 104394
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/0bf/mhs3d9p47km4b0inon0dmddrey8osxfi
[FILE_NAME] => close-up-people-wearing-lab-coats.jpg
[ORIGINAL_NAME] => close-up-people-wearing-lab-coats.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 45cd2485e3bcd158c7c9c454537071ba
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/0bf/mhs3d9p47km4b0inon0dmddrey8osxfi/close-up-people-wearing-lab-coats.jpg
[UNSAFE_SRC] => /upload/iblock/0bf/mhs3d9p47km4b0inon0dmddrey8osxfi/close-up-people-wearing-lab-coats.jpg
[SAFE_SRC] => /upload/iblock/0bf/mhs3d9p47km4b0inon0dmddrey8osxfi/close-up-people-wearing-lab-coats.jpg
[ALT] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
[TITLE] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
)
[DETAIL_TEXT] =>
Georgios Papathanakos , Ioannis Andrianopoulos , Menelaos Xenikakis , Athanasios Papathanasiou , Despoina Koulenti , Stijn Blot and Vasilios Koulouras
Clinical Sepsis Phenotypes in Critically Ill Patients
Microorganisms 2023, 11, 2165. doi.org/10.3390/ microorganisms11092165
Аннотация: Сепсис, определяемый как опасная для жизни нерегулируемая реакция организма на инфекцию, приводящая к органной дисфункции, считается одной из ведущих причин смертности во всем мире, особенно в отделениях интенсивной терапии (ОРИТ). Более того, сепсис остается загадочным клиническим синдромом со сложной патофизиологией, до конца не изученной и значительной гетерогенностью как с точки зрения клинического проявления, реакции пациентов на доступные в настоящее время методы лечения, так и с точки зрения результатов. Эта неоднородность оказывается основным препятствием в нашем стремлении обеспечить улучшение результатов лечение пациентов с сепсисом в критическом состоянии; таким образом, идентификация клинических фенотипов абсолютно необходима. Хотя это может показаться чрезвычайно сложной задачей, в настоящее время методы искусственного интеллекта и машинного обучения могут быть использованы для количественной оценки сходства между людьми в популяции сепсиса и дифференциации их по отдельным фенотипам в отношении не только температуры, гемодинамики или типа органной дисфункции, но и волемического статуса\реакции на инфузию, траектории пребывания в ОРИТ и исхода. Остается надеяться, что в конечном итоге нам удастся определить как подгруппу пациентов с сепсисом, которым будет полезно то или иное терапевтическое вмешательство, так и правильное время его проведения в ходе заболевания.
Ключевые слова: сепсис; неоднородность; фенотип; машинное обучение; прецизионная медицина
1. Введение
Древние греки использовали слово «сепсис» (ση´ψη) для описания гниения. Первоначально сепсис использовался для обозначения последствий процесса, а не причины [1]. Лишь в XIXвеке, когда были идентифицированы микроорганизмы как причина инфекции, термин «сепсис» стал использоваться для описания клинического заболевания, вызванного тяжелой инфекцией. В настоящее время сепсис определяют как опасную для жизни нерегулируемую реакцию организма на инфекцию, приводящую к дисфункции нескольких органов [2]. Несмотря на важные медицинские достижения, сепсис даже сейчас представляет собой серьезную проблему как для клиницистов, так и для исследователей, поскольку его лечение по-прежнему ограничивается антибиотиками, инфузионной терапией и поддержкой функции органов. Поскольку в течение многих лет новые методы лечения не были доступны сепсис продолжает оставаться основной причиной смертности во всем мире, затрагивая как страны, богатые ресурсами, так и страны с ограниченными ресурсами [3,4] и встречается во всех возрастных группах [5–11]. По оценкам недавнего исследования, в 2017 году сепсис возник у 48,9 миллионов человек во всем мире и стал причиной 11 миллионов смертей [12]. Поэтому ВОЗобъявила сепсис глобальным приоритетом здравоохранения [13].
В частности, в ОРИТ, сепсис также остается ведущей причиной смертности, независимо от того, вызван ли он внебольничными или внутрибольничными инфекциями [14–16]. Хотя общества интенсивной терапии разработали согласованные определения сепсиса и септического шока с целью гармонизации критериев диагностики, лечения и включения в клинические исследования, показатели смертности в различных исследованиях по-прежнему сильно различаются. Более конкретно, в метаанализе обсервационных исследований смертность от септического шока составила 46%; однако в двух важных клинических исследованиях пациентов с септическим шоком, проведенных почти в один и тот же период, смертность в контрольной группе была крайне контрастной: 18,8% против 80% [2,17–21]. С другой стороны, при систематическом анализе 65 рандомизированных контрольных исследований (РКИ) септического шока, опубликованных в период с 2006 по 2018 г., средняя смертность в контрольных группах составила 38,6% при очень широкой вариабельности (оценка 95%, интервалы прогнозирования 13,5-71,7%) [22]. Вышеизложенное можно, по крайней мере частично, объяснить значительной гетерогенностью клинических исследований.
Для того чтобы полученные результаты были воспроизводимы и могли быть экстраполированы, необходима единая феноменологическая структура в отношении диагностических критериев и критериев включения, набора случаев и характеристик пациентов. Однако в случае сепсиса это невозможно из-за значительной внутренней и внешней гетерогенности [23].
Если гетерогенную группу пациентов с сепсисом можно разделить на отдельные фенотипы, и эти фенотипы характеризуются дискретной патофизиологией, то они также могут различаться по реакции на терапию; следовательно, будущие исследования методов лечения сепсиса могут использовать определение фенотипов для стратификации пациентов с сепсисом в клинических испытаниях и разработки стратегий лечения, более точно ориентированных на конкретные фенотипы сепсиса. Основная цель этого обзора — предоставить обзор различных клинических фенотипов, существующих у пациентов с сепсисом в критическом состоянии. Описательный обзор был признан наиболее подходящим подходом. Поиск литературы проводился в библиографической базе данных PubMed с момента ее создания по май 2023 г.; поисковые термины, связанные с «фенотипированием сепсиса», были объединены с терминами, касающимися «реанимации и интенсивной терапии». Два автора осуществляли поиск в базе данных независимо. Третий рецензент урегулировал любые разногласия в результатах двух проверяющих. К включению подлежала рецензируемая опубликованная литература, в том числе описательные обзоры. Дополнительные статьи были включены на основе мнения экспертов. В итоге в обзор были включены исследования, опубликованные на английском языке, в которых использовались данные о фенотипировании сепсиса у больных в критическом состоянии..
2. Сепсис: очень гетерогенное заболевание
2.1 Причины неоднородности, специфичные для пациента
Сепсис не прогрессирует и не проявляется одинаково у всех пациентов из-за значительной гетерогенности между людьми, патофизиологических различий и иммунологических реакций [24,25].
Показательные, но не исключительные, причины гетерогенности включают специфические характеристики пациента, такие как возраст, пол, сопутствующие заболевания, ожирение, употребление алкоголя, курение, прием лекарств, состояние питания, источник инфекции, природа инфекционного агента и другие клинические и неклинические факторы, такие как нарушения, которые подавляют врожденный и адаптивный иммунитет, включая цирроз печени, рак и аутоиммунные заболевания, генетическую предрасположенность (например, полиморфизмы Toll-подобного рецептора 4), взаимодействия хозяина и патогена, реактивацию бессимптомных вирусных инфекций, основные механизмы острого заболевания, реакции иммунной системы, проводимое лечение и связанное со временем направление прогрессирования заболевания [25,26].
Эта гетерогенность оказывает существенное влияние на результаты клинических исследований. Например, это может произойти с клиническим испытанием, начатым для революционного препарата для лечения сепсиса или септического шока, вызванного грамотрицательным микробом; согласно строгому протоколу исследования, это лечение будет применяться только у пациентов в критическом состоянии, поступивших в ОРИТ в течение 4 часов после начала сепсиса/септического шока. Хотя вначале группа пациентов, которую нужно набрать, кажется очень специфичной, в конечном итоге в нее должны быть включены пациенты со значительными различиями в бесчисленных биологических характеристиках, которые могут скрыть потенциальную пользу нашего исследования. Например, одно дело лечить 19-летнюю девушку-спортсменку, которая двумя часами ранее поступила в отделение неотложной помощи с менингококковым сепсисом, и совсем другое дело лечить 80-летнего, прикованного к постели. мужчине с деменцией, постоянным мочевым катетером, бактериемией, вызванной Escherichiacoli, и аспирационной пневмонией, осложненной острым респираторным дистресс-синдромом (ОРДС), или 60-летнего мужчину с дивертикулитом и внутрибрюшным абсцессом, но без явной бактериемии.
2.2.Гетерогенность, связанная с клинической экспрессией
Несмотря на возросшую осведомленность и особое внимание к сепсису в последние десятилетия, среди врачей интенсивной терапии все еще существуют значительные различия в подходах к диагностике сепсиса. Даже сегодня сепсис в его полном проявлении не может быть определен с уверенностью, и если читателю это покажется странным, результаты исследования, проведенного несколько лет назад, подчеркивают эту неопределенность: пять случаев предполагаемой или подтвержденной инфекции и органной дисфункции были розданы выборка из 94 интенсивистов, практикующих в академических учреждениях; диагнозы, поставленные в каждом случае, имели очень широкую вариабельность, хотя врачи отделения интенсивной терапии обычно считаются специалистами, имеющими самый высокий опыт в диагностике и лечении сепсиса [27]. Сама идентификация септического пациента в полной клинической картине иногда оказывается трудной даже для опытного врача, поскольку даже лабораторные данные могут отсутствовать, и диагноз может основываться только на клинических ощущениях. Его особенности также искажаются сопутствующими заболеваниями, а дисфункция органов может быть неочевидной [28].
Ухудшение может быть постепенным и незаметным или внезапным. С другой стороны, ухудшение состояния пациента в 20% случаев можно ошибочно объяснить сепсисом. [29]. Кроме того, до сих пор не выявлено четкой связи между тяжестью сепсиса и количеством пораженных органов. Хотя оценка по шкале SOFA связана с тяжестью и прогнозом у пациентов с сепсисом [30], в клинических условиях отмечается большая гетерогенность типов пораженных органов. Например, пациент с сепсисом может быть гемодинамически нестабильным, и ему требуются два разных вазопрессора в сочетании с кортикостероидами, при этом шкала комы Глазго и функция почек остаются неизмененными, в то время как у других пациентов развивается тяжелое острое повреждение почек вместе с тяжелой неврологической дисфункцией, при стабильной гемодинамике. Что касается влияния возраста, сепсис поражает пожилых пациентов неодинаково, и у значительного процента из них уже может быть основная органная дисфункция. Что еще хуже, дисфункция органов может быть частично вызвана лечением сепсиса, а не самим сепсисом [29].
2.3. Определение сепсиса как причины гетерогенности
В 1970-е годы, несмотря на применение антибиотиков и эрадикацию возбудителя, больные сепсисом продолжали умирать. Это привело к гипотезе о том, что основной проблемой является не только патоген сам по себе, но, возможно, в большей степени, воспалительная реакция пациента, причем в последующие годы врачи решительно защищали такую точку зрения относительно патофизиологии сепсиса. В 1992 году сепсис был определен как клинический синдром при наличии как инфекции, так и синдрома системной воспалительной реакции (ССВО), определяемого по температуре, частоте сердечных сокращений, учащенному дыханию и количеству лейкоцитов в крови [17]. Эти критерии были настолько общими, что практически любой пациент с гастроэнтеритом или даже простудой в конечном итоге подпадал под определение сепсиса. Именно высокая смертность от сепсиса заставила научное сообщество действовать таким образом, чтобы врачам было легче заранее задуматься о сепсисе и своевременно поставить клинический диагноз. Однако низкая специфичность диагностических критериев ССВО привела к чрезвычайно большой популяции пациентов, соответствующих диагностическим критериям сепсиса, что вызвало огромные трудности как в клинической практике, так и в научных исследованиях. В 2001 г. последовало второе определение сепсиса, которое практически не отличалось от предыдущего, но в основном расширило перечень клинических и параклинических критериев и улучшило чувствительность за счет специфичности; к сожалению, ни один из критериев не был специфичен для сепсиса [18].
Как уже убедились многие врачи отделений интенсивной терапии в повседневной клинической практике, у многих тяжелобольных пациентов с SIRS нет сепсиса, а у некоторых септических пациентов нет SIRS.
Винсент и др. утверждал, что SIRS более чувствителен, но неспецифичен и что сепсис — это не просто реакция хозяина на инфекцию, но воспалительная реакция хозяина на инфекцию, приводящая к дисфункции органов, и подчеркнул, что реакция, которая преобладает в клиническом фенотипе, варьирует у разных пациентов и с течением времени у каждого пациента [31]. Хотя в 2016 г. последовало третье определение сепсиса (определение Sepsis-3), в котором подчеркивается, что сепсис - это угрожающая жизни дисфункция органов в результате дисрегулярного ответа хозяина на инфекцию, к сожалению, до сих пор очень сложно детально описать этот ответ, поскольку ни один из существующих клинических показателей не может точно определить, что подразумевается под дисрегулярным ответом хозяина, и, кроме того, предсуществующие заболевания, сопутствующие заболевания, лекарства или вмешательства могут изменять клинический и биологический фенотип сепсиса [2]. Более того, в медицинской литературе встречаются даже возражения и реакции на нынешнее определение сепсиса [32], поскольку определение «Сепсис-3» по-прежнему опирается на мнение клиницистов о наличии инфекции, а также о том, действительно ли наблюдаемая органная дисфункция является действительно развившейся вследствие инфекции [27].
2.4. Сепсис и прецизионная (или персонализированная) медицина
Именно эта неоднородность делает повседневную реальность сложной и проблематичной при работе с пациентами с сепсисом или септическим шоком. Ответ на вопрос, как эту большую разнородную группу пациентов с сепсисом можно разделить на более мелкие группы с различными клиническими характеристиками, может в то же время направить врачей отделения интенсивной терапии к «точной медицине», а для наиболее оптимистичных врачей — к «персонализированному» лечению. Хотя термины «прецизионная медицина» и «персонализированная (или индивидуализированная) медицина» часто используются как взаимозаменяемые, они не идентичны.
В центре внимания прецизионной медицины находится выявление подходов, которые, как ожидается, будут эффективны для конкретной группы пациентов на основе их общих характеристик. Конечной целью является возможность предложить индивидуальный уход для каждого человека (персонализированная медицина), но прогнозирование реакции на лечение на уровне отдельного пациента по-прежнему является довольно сложной задачей, поэтому в настоящее время усилия сосредоточены на медицине прецизионной [33]. Что определенно хорошо известно, так это то, что сепсис до сих пор остается загадочным клиническим синдромом со сложной патофизиологией, до конца не изученной, который может поражать практически все системы органов, приводя в конечном итоге к смерти у очень значительной части больных, хотя вовлеченные органы и степень поражения дисфункция может существенно различаться у разных пациентов [29,34]. Основная задача заключается не в определении того, получат ли большинство пациентов, которые соответствуют общим критериям сепсиса, какую-либо пользу от конкретной терапевтической стратегии, а в определении подгруппы пациентов, которая получит пользу, а также в правильном выборе времени использования того или иного метода лечения в процессе развития заболевания [1].
3. Больные сепсисом в отделениях интенсивной терапии.
Пациентов в критическом состоянии можно легко охарактеризовать как наиболее гетерогенную популяцию в больнице, с устойчивыми показателями мультиморбидности, как острой, так и рецидивирующей. Но у пациентов в критическом состоянии с сепсисом, поступивших в то же ОРИТ, вполне могут быть противоположные результаты, несмотря на продолжение соответствующего лечения [35].
За последние несколько лет появились новые рекомендации, которые требуют протокольного лечения пациентов с сепсисом и септическим шоком. Surviving Sepsis Campaign – современная инициатива Society of Critical Care Medicine (SCCM) и European Society of Intensive CareMedicine (ESICM), в настоящее время представляет собой наилучшее доступное доказательство эффективности лечения сепсиса, направленного на снижение смертности от сепсиса по всему миру. Однако высказывалась критика в отношении того, что не все пациенты должны получать одинаковое лечение и что не следует применять принцип «один размер подходит всем» [36–38].
Более того, как уже упоминалось, большинство рандомизированных контролируемых исследований фармакологической терапии по-прежнему не улучшают результаты. По этой причине лучшее определение закономерностей гетерогенности при сепсисе может стать первым шагом на пути к пониманию эффективности у различных групп пациентов ОРИТ использования доступных в настоящее время методов лечения. Хотя существование гетерогенности при сепсисе широко признано и ее наличие оказывает большое влияние на медицинскую литературу, до недавнего времени было проведено очень мало исследований, пытающихся сгруппировать ее характеристики. Таким образом, гетерогенность при сепсисе представляется непреодолимой проблемой для развития методов лечения пациента в критическом состоянии с сепсисом [23].
4. Фенотипирование сепсиса у пациентов ОРИТ
Что следует предпринять? Чтобы идентифицировать конкретные группы пациентов, которые могли бы ответить на конкретные вмешательства, идентификация клинических фенотипов абсолютно необходима [24]. Слово «феномен» происходит от греческой основы «φαι´νoμαι(феном)», глагола, означающего «появляться» или «казаться». Johannsen в своем определении «фенотип» в 1909 году описал его как характеристику типа внешности [39]. Хотя фенотип пациента представляет собой сумму всех выраженных характеристик, т. е. клиническое выражение, «фенотип» также может использоваться для описания траектории и исхода состояния или для клинического исследователя для описания набора представленных признаков, реализованных как критерии включения в экспериментальное исследование [40]. Кроме того, под сепсисом понимают процесс, но только до определенного момента. Например, какие гены участвуют в патогенезе сепсиса? Gregor Mendel, пионер современной генетики, начал с фенотипических признаков и закончил генами. Ответ на вопрос о том, как развивается сепсис у каждого отдельного пациента, требует решения фенотипических загадок, но фенотипы также могут быть решением для выбора лечения [41]. Связывая генную и фенотипическую экспрессию, потенциально можно открыть новые механизмы или терапевтические мишени для лечения сепсиса, а также различные биомаркеры для прогнозирования исхода у разных пациентов с сепсисом или даже для разных подклассов сепсиса, основанных на экспрессии генов, которые могут потребовать уникальных терапевтических подходов [42]. Учитывая все вышесказанное, идентификация различных фенотипов у пациентов с сепсисом кажется чрезвычайно сложной задачей, поскольку отсутствует эмпирические данные о том, как индивидуализировать лечение пациентов с сепсисом исключительно на основе клинических переменных.
5. Искусственный интеллект и машинное обучение
В последние годы искусственный интеллект и машинное обучение все чаще используются в медицине. Искусственный интеллект — это область, которая объединяет опыт из разных областей, включая алгоритмы, статистику, теорию информации и когнитивную науку, обучая компьютеры тому, как учиться и действовать разумно, используя данные и выполняя сложные задачи. Одной из отраслей искусственного интеллекта является машинное обучение; благодаря доступу к большим объемам данных и использованию алгоритмов машинное обучение имитирует работу человеческого мозга, постепенно и постоянно повышая точность [43]. Основная идея заключается в том, что неконтролируемые компьютеры учатся на собираемых ими данных, обычно на основе электронных медицинских записей, показателей жизнедеятельности и/или результатов лабораторных исследований, и распознают закономерности из больших наборов данных; доказано, что этот тип подхода превосходит традиционные аналитические и балльные модели [44]. Если искусственный интеллект рассматривать как мозг, то машинное обучение можно представить как способ завершения умственного процесса путем приобретения новых когнитивных способностей. Следовательно, алгоритм может быть создан на основе очень большого количества данных, что в конечном итоге приводит к созданию кластеров (или фенотипов).
Кластерный анализ — это тип неуправляемого машинного обучения , который был использован для исследования и выявления различных типов проявления заболеваний, включая рак и астму среди разных групп пациентов. В частности, кластерный анализ с использованием передовых математических алгоритмов, основанных на нескольких заданных переменных, может количественно оценить сходство между разными людьми в популяции пациентов. В конце концов, с помощью этого подхода могут быть созданы отдельные новые подгруппы, и эти новые подгруппы, которые не основаны на каких-либо априорных гипотезах, являются фенотипами [35,45]. Несмотря на эти многообещающие результаты, следует иметь в виду, что существуют некоторые ограничения, которые следует учитывать при использовании методов искусственного интеллекта. Например, оптимальное количество кластеров, которые можно получить из любого заданного набора данных, часто не может быть определено самим искусственным интеллектом. Кроме того, кластеры, полученные на основе наборов данных, определенных с использованием старых критериев сепсиса, могут значительно отличаться от тех, которые используются при использовании текущих критериев сепсиса. Более того, методы машинного обучения могут закреплять предвзятости, присутствующие в наборах обучающих данных; таким образом, полученные фенотипы должны быть подвергнуты внутренней и внешней оценке, а также должно быть применено клиническое правдоподобие. Если для внешней проверки не используется отдельная когорта, может быть трудно решить, являются ли данные кластеры «артефактами» или «настоящими», поскольку методы кластеризации могут находить потенциальные кластеры, даже если естественных кластеров не существует. Кроме того, может быть неясно, как согласовать различные наборы подгрупп пациентов, определенные с помощью методов машинного обучения и эмпирических подходов [46–50].
6. Температурное фенотипирование и корреляция с иммунологическим профилем
Основным отличительным клиническим признаком, используемым у пациентов с сепсисом, является температура. Хотя основным симптомом инфекции часто считают лихорадку, у некоторых больных (10–20%) при сепсисе сохраняется гипотермия. Начиная с 2016 года, было проведено более 10 исследований, которые показали, что гипотермия в контексте инфекции связана с увеличением смертности, тогда как лихорадка связана со снижением летального исхода (Table 1) [51–63].

Совсем недавно Baek et al. в многоцентровом ретроспективном исследовании с использованием подхода машинного обучения у 15 574 пациентов с сепсисом были выделили три различные группы пациентов: гипотермические, нормотермические и гипертермические, у которых 90-дневная смертность составила 27,4%, 19,6% и 11,9% соответственно. Кластерный анализ возраста и температуры тела (ТТ) выявил следующие отдельные кластеры пациентов: «кластер А» (>75 лет и <36 ◦C), «кластер Б» (относительно молодой возраст с широким диапазоном температуры тела -ТТ) и кластер C (относительно более высокая ТТ, чем в кластере A). Каждый кластер имел разные 90-дневные показатели смертности: 24,2%, 17,1% и 17,0% для кластера A, B и C соответственно. Смертность и ТТ имели отрицательную корреляцию даже в экстремальных возрастах, то есть в возрастных группах <75 лет и 75 лет [51]. Одинаково ли влияние гипотермии на смертность во всех возрастных группах, все еще изучается. Эта фенотипическая дихотомия между гипотермией и лихорадкой, а также связь гипотермии со смертностью была продемонстрирована и проанализирована в недавних крупных когортах пациентов, у которых выделялись дополнительные фенотипические характеристики и ассоциации.
Например, Thomas-Ruedell et al. у 6542 больных сепсисом подтверждили, что у больных с сепсисом существует бимодальное распределение температуры тела, при этом лихорадка и гипотермия являются двумя основными реакциями человека при сепсисе , а нормотермия является довольно редким состоянием. Факторами, независимо связанными с гипотермией, были внебольничный сепсис, абдоминальная инфекция, более низкий ИМТ, больший возраст и более низкие температуры окружающей среды. Напротив, факторами, независимо связанными с высокой температурой, были не только внебольничный, но и внутрибольничный сепсис, наличие возбудителя в культуре крови и высокие значения прокальцитонина. В этом исследовании гипотермия в целом была связана с более высокой смертностью, но эта связь уменьшилась после поправки на другие факторы риска [52].
Wu et al. изучили 862 пациента отделения интенсивной терапии с септическим шоком и пришли к выводу, что температура ниже 36 ◦C или выше 38 ◦C связана с увеличением смертности за 21 день [53]. С другой стороны, Shimazui et al. в ретроспективном многоцентровом исследовании с использованием когорты сепсиса (1148 пациентов) и двух проверочных групп сепсиса (1628 пациентов) пришли к выводу, что, хотя у более молодых пациентов с сепсисом смертность повышалась при гипотермии и снижалась при лихорадке, у пожилых пациентов смертность не была связана с ТТ. Эти результаты могут означать, что молодые и пожилые пациенты с сепсисом демонстрируют разные воспалительные реакции [54,61].
Bhavani et al. использовали групповое моделирование траекторий для выявления субфенотипов на основе температурных траекторий. Групповое моделирование траекторий характеризуется расширением кластерного анализа и используется для выявления групп среди пациентов, которые имеют схожие траектории в отношении конкретной интересующей переменной [86,87].
Авторы включили в депривационную когорту 12 413 пациентов и 19 053 в группу валидации пациентов с инфекцией, которые получали антибиотики в течение 24 часов с момента обращения. Они выделили в обеих когортах четыре группы температурных траекторий: «гипертермические, медленно разрешающиеся» (14,9%), «гипертермические, быстро разрешающиеся» (23,2%), «нормотермические» (32,8%) и «гипотермические» (29,1%).
Пациенты в «гипотермической» группе были самыми старшими, имели наибольшее количество сопутствующих заболеваний и самые низкие уровни маркеров воспаления. С другой стороны, самые молодые пациенты с наименьшим количеством сопутствующих заболеваний и самым высоким уровнем воспалительных маркеров попали в группу «гипертермических, медленно разрешающиеся». В депривационной когорте у «гипотермических» пациентов был самый высокий уровень внутрибольничной смертности (9,5%), тогда как у «гипертермических, быстро разрешающихся» - самый низкий (2,9%). В когорте валидации «гипертермические, медленно разрешающиеся» имели самый высокий уровень внутрибольничной смертности (10,2%), за ними следовали «гипотермические» 9,0%, тогда как «гипертермические, быстро разрешающиеся» снова имели самый низкий уровень больничной летальности (3,0%). Авторы предположили, что три различных субфенотипа представляют собой гипервоспалительный («гипертермический, медленно разрешающийся»), гиповоспалительный («гипотермический») и хорошо сбалансированный воспалительный субфенотип («гипертермический, быстро разрешающийся»), о чем свидетельствует низкий уровень смертности [55]. Хотя эти субфенотипы и обнаруженные более низкие показатели смертности, относятся к пациентам с инфекцией, т.е. к более многочисленной когорте, включающей как больных с сепсисом, так и без сепсиса, они все же могут отражать различные иммунологические реакции.
Что касается последнего, та же группа авторов обнаружила в другом исследовании, что две когорты пациентов (120 с септическим шоком и 88 с бактериемией, вызванной Staphylococcus aureus), можно снова отнести к одной из четырех ранее подтвержденных температурных субфенотипов. Среди пациентов с септическим шоком смертность составила 51,7%, 36,8%, 29,6% и 22,2% для «гипотермических», «гипертермических, медленно разрещающихся», «нормотермических» и «гипертермических, быстро разрешающихся» соответственно. Более того, когда сравнивались концентрации 44 цитокинов в плазме, только уровни 4 цитокинов: гранулоцитарный колониестимулирующий фактор (G-CSF_, хемокиновый лиганд 2 (CCL2), IL-7 и IL-10) статистически различались. среди четырех субфенотипов; у «гипотермических» пациентов были самые низкие средние значения. Несмотря на обнаружение того, что у «гипертермических, быстро разрешающихся» наблюдалось наиболее значительное снижение уровней пяти цитокинов: антагониста рецептора интерлейкина 1 (IL-1RA), IL-6 и IL-8, G-CSF и макрофаг-колониестимулирующего фактора (M-CSF) в течение 24 часов, еще предстоит ответить на вопрос, существует ли какая-либо корреляция между иммунологическим профилем и температурными траекториями [62,88].
Интересно, что Bhavani et al. в двух ретроспективных исследованиях среди пациентов с COVID-19 выявлено четыре фенотипа, сходных с сепсисом [60,64]. В частности, в своем последнем исследовании они определили 5903 пациента с COVID-19 как «гипертермические медленно разрешающиеся» (25%), «гипертермические быстро разрешающиеся» (25%), «нормотермические» (36%) и «гипотермические» (15%) с различными клиническими характеристиками и смертностью. Хотя было обнаружено, что «гипотермический» фенотип имеет выраженные нарушения свертываемости крови и наибольшую распространенность венозных тромбоэмболий и нарушений мозгового кровообращения, именно группа «гипертермических медленных разрешающихся» в отличие от «гипертермических быстро разрешающихся» имела самые высокие уровни воспалительных маркеров, наибольшую гемодинамическую нестабильность, требующую вазопрессоров, дыхательную недостаточность, требующую ИВЛ и значительно более высокую смертность. Интересно, что распространенность фенотипа «гипертермических медленно разрешающихся» по каким-то причинам резко снизилась за время пандемии [64].
Harmon et al. получили образцы крови у 168 пациентов с сепсисом в течение первых 24 часов после их поступления в ОРИТ. Они заметили, что 30-дневная смертность была значительно увеличена у пациентов с гипотермией (38% против 18%). Это соответствует вышеупомянутым исследованиям, но Harmon et al. также подтвердили, что пациенты с гипотермическим или «холодным» сепсисом имеют уникальный профиль экспрессии генов, что обеспечивает возможную связь с температурой тела и ранней иммуносупрессией [89]. Подтверждение вышеуказанных результатов будущими исследованиями может свидетельствовать о том, что пациентам с гипотермией и сепсисом могут быть полезны иммуностимулирующие препараты, в то время как пациентам с лихорадкой может быть полезна терапия иммунодепрессантами.
Все больше и больше исследований касается других аспектов фенотипической связи между температурой и смертностью у пациентов с сепсисом. Например, Ito et al. в проспективном когортном исследовании с участием 1184 пациентов с сепсисом, поступивших в 59 ОРИТ в Японии, оценивали, существует ли какая-либо связь между гипотермией и смертностью пациентов с сепсисом в соответствии с индексом массы тела (ИМТ). Они пришли к выводу, что пациенты с сепсисом, гипотермией и нормальным ИМТ могут иметь более высокий риск смертности, чем пациенты с низким или высоким ИМТ [63]. Однако, как показывают другие существующие исследования, гипотермия у пациентов с сепсисом независимо связана со смертностью или даже что отсутствие лихорадки связано с более высокой смертностью [56,57,59], и существует метаанализ, делающий вывод о том, что наличие лихорадки снижает смертность у пациентов с сепсисом по сравнению с пациентами с нормотермией [58]. Следующим шагом является рассмотрение возможности применения терапевтической гипертермии у пациентов с гипотермическим или «холодным» сепсисом [90]. Насколько нам известно, есть два клинических исследования, в которых было показано, что согревание пациентов с гипотермией и сепсисом связано с лучшим прогнозом [91,92].
7. Гемодинамическое фенотипирование и сепсис
Гемодинамика — еще один клинический признак, который может помочь в фенотипировании пациентов с сепсисом в критическом состоянии. Септический шок определяется стойкой гипотензией, требующей вазопрессоров для поддержания среднего артериального давления 65 мм рт. ст. и уровня лактата в сыворотке более 2 ммоль/л, несмотря на адекватную инфузионную терапию [2]. Принимая во внимание, что систолическое артериальное давление (САД) регулярно измеряется в ОРИТ, можно предложить использовать САД для быстрой и точной идентификации различных фенотипов.
Zhu et al. извлекли из большой медицинской базы данных информацию о 3034 пациентах с сепсисом, поступивших в ОРИТ, и после проведения траекторного анализа определили семь различных траекторий САД: у некоторых пациентов (36,9%) САД изменялось стабильно, но без явной тенденции к увеличению или снижению ( фенотип 1, среднее САД 100 мм рт. ст.); при фенотипе 2 (7,5%) тенденция САД была стабильной (среднее САД 82 мм рт.ст.), а при фенотипе 3 (8,4%) и фенотипе 4 (21,3%) в целом стабильна, при этом САД постепенно повышалось до 140 мм рт.ст. от 110–120 мм рт.ст. мм рт. ст. и 120–130 мм рт. ст. соответственно. С другой стороны, при фенотипе 5 (15,3%) и фенотипе 6 (8,2%) САД быстро снижалось примерно с 130 мм рт. ст. до 100 мм рт. ст. и примерно с 150–160 мм рт. ст. до 110–120 мм рт. ст. соответственно, тогда как при фенотипе 7 (2,8%) САД сначала демонстрировало тенденцию к увеличению, а затем к снижению. Внутрибольничная смертность составила 25,5%, 40,5%, 11,8%, 18,3%, 23,5%, 13,8% и 10,5% для 1-7 фенотипа пациентов соответственно. Как и в многомерном анализе, фенотип 3 имел самый низкий риск смертности, и авторы предполагают, что траектория САД, представленная в фенотипе 3, может использоваться в качестве идеальной гемодинамической цели для пациентов с сепсисом в течение 10 часов после госпитализации с целью улучшения результатов.
Кроме того, тот факт, что при сравнении фенотипов 2 и 6 было обнаружено, что фенотип 6 имел лучший прогноз, позволяет предположить, что, т.е. что стойкая гипотензия имеет худший прогноз по сравнению со значительным снижением САД. Таким образом, наблюдая за тенденцией САД, врачи могут легко выявить пациентов с высоким риском как можно раньше и тем самым обеспечить своевременное лечение. Стоит отметить, что в том же исследовании при анализе подгрупп возраст для фенотипа 2 был независимым предиктором внутрибольничной смертности: пациенты < 65 лет имели более высокий риск смертности, чем пациенты > 65 лет [65].
В другом исследовании с участием 127 пациентов с сепсисом, поступивших в отделение неотложной помощи, которым проводили неинвазивный непрерывный гемодинамический мониторинг: среди прочего, сердечный индекс (CI) и индекс системного сосудистого сопротивления (SVRI), применение подхода машинного обучения привело к выявление трех разных кластеров со значимо различной выраженностью гемодинамических показателей: фенотип 1 (56,7%) с высоким CI и нормальным SVRI , фенотип 2 (39,4%) с низким CI и повышенным SVRI и фенотип 3 (3,9%) с очень низким CI и очень высоким SVRI.
Пациенты как с фенотипом 2, так и с 3 могут получить пользу от терапии, направленной на индивидуальное реагирование на инфузионную терапию, тогда как пациенты с фенотипом 3 могут получить больше пользы использования вазодилататоров. Интересно, что эти три фенотипа значительно отличались друг от друга с точки зрения 30-дневной смертности, причем большинство смертей (20%) приходится на фенотипы 2 и 3, тогда как у пациентов с фенотипом 1 смертность составила только 5,6% [93]. Эти данные согласуются с классическими знаниями, полученными несколько десятилетий назад, о том, что у пациентов с сепсисом, которые не способны увеличить сердечный выброс, развивается метаболический ацидоз и в конечном итоге они умирают. Хотя в 1981 г. Hess и коллеги предложили модель сепсиса, в которой состояние гемодинамики рассматривалось как последовательность различных событий [94]; стоит отметить, что в настоящее время этот подход подвергается сомнению, поскольку современная литература предполагает, что септический шок не обязательно следует линейной естественной истории с четко определенными фенотипами, сменяющими друг друга; разные авторы предполагают, что сепсис и септический шок — это совершенно разные фенотипы, возникающие независимо друг от друга, а не последовательно и во временном континууме [66].
Недавно Geri et al. идентифицировали пять различных гемодинамических фенотипов у 360 пациентов с септическим шоком на основании клинических и эхокардиографических параметров: «кластер 1», «well- resuscitated» (16,9%), «кластер 2», у которых наблюдалась систолическая дисфункция левого желудочка (ЛЖ) (17,7%). ), «кластер 3», характеризующийся гиперкинезией ЛЖ (23,3%), «кластер 4», характеризующийся правожелудочковой недостаточностью (22,5%) и «кластер 5», характеризующийся устойчивой гиповолемией (19,4%). Смертность в ОРИТ в кластерах 1, 2, 3, 4 и 5 составила 21,3%, 50,0%, 23,8%, 42% и 38,6%, соответственно [67]. Оказывается, что, распознавая и дифференцируя пациентов на ранней стадии развития сепсиса по различным гемодинамическим фенотипам, можно каким-то образом индивидуализировать гемодинамическую поддержку, например с помощью вазопрессоров, и адаптировать инфузию инотропов и инфузию к потребностям каждого конкретного фенотипа.
В настоящее время проводится по крайней мере одно клиническое исследование, в котором изучается, существует ли связь между фенотипом септической кардиомиопатии, основанным на ультразвуковых характеристиках, и исходом сепсиса [95]. Кроме того, авторы исследования ANDROMEDA-2 стремятся определить, может ли при раннем септическом шоке, т.е. менее чем через 4 ч от момента постановки диагноза, стратегия периферической перфузии по сравнению со стандартным лечением, применяемая к различным фенотипам пациентов, определяемым по различным клиническим и гемодинамическим показателям, улучшить их исход (смертность, длительность органной поддержки и продолжительность пребывания в стационаре) [96].
Bhavani et al., чтобы разработать и подтвердить фенотипы траекторий жизненно важных функций, применили групповое моделирование траекторий к жизненно важным показателям с первых 8 часов госпитализации у пациентов с подозрением на инфекцию, как в обучающей, так и в проверочной когорте (12 473 и 8 256 пациентов соответственно). С помощью этого подхода в конечном итоге были идентифицированы четыре фенотипа: «Группа А» (28%) - пациенты с гипертермией, тахикардией, тахипноэ и с более низким систолическим и диастолическим артериальным давлением; «группа В» (13%) - пациенты также были с гипертермией, тахикардией, тахипноэ (но не в такой степени, как в «группе А») и с гипертонией; «группа С» (32%) и «группа D» (27%). Несмотря на то, что у пациентов как «группы С», так и «группы D» были более низкие температура тела, частота сердечных сокращений и дыхания, в «группе С» пациенты были нормотензивными, а в «группе D» было самое низкое артериальное давление. Что касается других особенностей четырех фенотипических групп, стоит отметить, что более молодые пациенты находились в группах А и В, тогда как пожилые пациенты были в группах С и D, что в «группе В» была самая высокая распространенность застойной сердечной недостаточности, гипертонии, сахарного диабета и хронической болезни почек. В группах А и D наблюдалось как самое высокое использование вазопрессоров, так и самая высокая 30-дневная смертность, «Группа D» имела значительно меньший риск - 30 -дневной смертности при сравнении введения сбалансированных кристаллоидов с физиологическим раствором [97].
Помимо температуры и гемодинамического статуса, дисфункция органов также может быть использована для фенотипирования пациентов с сепсисом в критическом состоянии.
8. Фенотипирование мультиорганной дисфункции при сепсисе
Вероятно, первое исследование мультиорганной дисфункции и фенотипирования сепсиса было проведено Knox et al. в 2015 году. В этом исследовании с использованием методов машинного обучения 2533 пациента с сепсисом, поступивших из отделения неотложной помощи в отделение интенсивной терапии, были сгруппированы по четырем различным фенотипам; В «кластер 1» вошли пациенты с шоком и повышенным креатинином, в «кластер 2» — пациенты с синдромом минимальной полиорганной дисфункции, в «кластер 3» — пациенты с шоком с гипоксемией и измененным психическим статусом, а в «кластер 4» — пациенты с заболеваниями печени. Смертность для этих кластеров составила 11%, 12%, 28% и 21% соответственно. Регрессионный анализ показал, что эти фенотипические кластеры в значительной степени не зависят от возраста, причины сепсиса, ожирения и других сопутствующих заболеваний и что они значительно различаются по связи между клиническими исходами и предикторами, такими как оценка по шкале APACHE II [68].
Пять лет спустя Ibrahim et al., используя данные пациентов с сепсисом, поступивших в ОИТ (13728 записей), подсчитав 63 жизненно важных параметров и лабораторных анализов, собранных в течение первых 24 часов после поступления, и следуя методологии машинного обучения Нокса, также выявили четыре клинически значимых субпопуляции сепсиса с отчетливыми паттернами органной дисфункции, представляющими либо заболевание печени (фенотип 1), либо кардиогенную дисфункцию с повышенным креатинином (фенотип 2) или минимальной органной дисфункцией (фенотип 3), либо кардиогенную дисфункцию с гипоксемией и измененным психическим статусом (фенотип 4). Выявленные популяции в основном не зависели от происхождения сепсиса, а 30-дневная смертность для этих кластеров составила 28%, 55%, 25% и 37% соответственно [69].
Zhang et al. в 2018 году опубликовали результаты ретроспективного исследования с участием 14 993 пациентов с сепсисом, в котором с помощью методов машинного обучения также были выявлены четыре фенотипа: исходным считался фенотип 1 (69%); фенотип 2 (9%) характеризовался респираторной дисфункцией; фенотип 3 (11%) — полиорганной дисфункцией (например, почек, системы свертывания крови, печени и шоке) и фенотип 4 (11%) — неврологической дисфункцией. Фенотип 3 показал самый высокий уровень смертности (45,4%), за ним следовали фенотип 4 (27,4%), фенотип 2 (18,2%) и фенотип 1 (16,9%) [70].
Seymour et al. в революционном исследовании проанализировали ретроспективно данные 63 858 пациентов с сепсисом, которые соответствовали критериям сепсиса-3 в течение 6 часов после поступления в больницу в трех различных когортах, используя инструменты статистики, машинного обучения и моделирования. Исследователи идентифицировали четыре фенотипа сепсиса (обозначенные α, β, γ и δ). Фенотипы варьировали по размеру (от 13% до 33% когорты), каждый из них отличался по демографическим, лабораторным показателям и характеру органной дисфункции, и каждый из них коррелировал с биомаркерами и смертностью. «α-фенотип» (33%) имел мало аномальных лабораторных показателей и меньшую дисфункцию систем органов; Пациенты с «β-фенотипом» (27%) были старше, с повышенной сопутствующей патологией и заболеваниями почек; У пациентов с «γ-фенотипом» (27%) наблюдались повышенные уровни маркеров воспаления, снижение уровня альбумина и повышение температуры, тогда как у пациентов с «δ-фенотипом» (13%) наблюдались высокие уровни лактата в сыворотке, повышенные уровни трансаминаз и гипотония. 28-дневная смертность для фенотипов α, β, γ и δ составила 5%, 13%, 24% и 40% соответственно [71]. Хотя эти четыре фенотипа имели некоторую значимость для традиционных оценок тяжести заболевания (APACHE, SOFA), было ясно, что они представляют собой отдельные клинические группы [98]. Стоит также отметить, что в том же исследовании в имитационных моделях изменения в распределении среди пациентов фенотипов α и δ имели существенные последствия. Это оказалось очень важным открытием, поскольку оно предположило, что эффективность клинического исследования, по-видимому, зависит от фенотипа, к которому оно будет применяться, и это, безусловно, то, что нам необходимо учитывать при планировании каждого нового клинического исследования. 71,98].
Этот последний вывод, а именно то, что на результат РКИ может влиять доля участия каждой фенотипической группы в исследуемой популяции, подчеркивает исследование Seymour et al. как знаковое и эпохальное исследование. Разумно полагать, что для проведения хорошо спланированных РКИ очень важно найти и отобрать соответствующую фенотипическую популяцию и провести соответствующее лечение в наиболее подходящее время. Даже если терапевтическое вмешательство действительно полезно для части популяции пациентов, но если оно не приносит пользы или даже вреда остальным пациентам, то это вмешательство в целом можно рассматривать как неэффективное. Основываясь на результатах Seymour et al., если бы мы могли на ранних стадиях распознать у пациента с сепсисом конкретный паттерн развития полиорганной недостаточности, мы могли бы действовать профилактически или терапевтически, как врачи, на более раннем этапе в пользу пациента или, в случае, когда мы хотим провести клиническое исследование, мы могли бы выборочно применить к пациенту то вмешательство, которое действительно принесет ему/ей пользу. Также представляется, что существует большая возможность повторения клинических исследований, которые уже были проведены и не показали в целом каких-либо положительных результатов, в конкретных группах населения с конкретными фенотипическими характеристиками, что может оказаться полезным; это может быть особенно верно для тех исследований, которые показали пользу только в некоторых конкретных подгруппах [99].
Xu et al. исследовали, могут ли 72-часовые траектории оценки SOFA помочь в фенотипировании пациентов с сепсисом; всего было набрано 4678, 3665, 12 282 и 4804 уникальных пациентов с сепсисом (одна группа разработки и три группы валидации), и были идентифицированы четыре различных кластера/фенотипа: «быстро ухудшающиеся» (13,1%), при котором показатель SOFA постоянно увеличивался от 4,5 при поступлении до более 7 через 72 ч; «отсроченное ухудшение» (20,5%), при котором показатель SOFA снизился в течение первых 2 дней с 5,2 до 3,7, а затем увеличился в течение последних 24 часов; «быстрое улучшение» (41,3%), при котором оценка SOFA постоянно снижается с 5,54 до менее 3, и фенотип «отсроченное улучшение» (25,1%), при котором оценка SOFA первоначально увеличивается, а затем постепенно снижается в течение 72 часов. Каждый фенотип имел разные исходные характеристики. Например, пациенты с «быстрым ухудшением» имели большую сопутствующую патологию, ацидоз и дисфункцию органов, в то время как пациенты с «быстрым улучшением» нуждались в вазопрессорах, но не имели ацидоза. Более того, несмотря на то, что «быстро ухудшающийся» фенотип имел более низкий балл SOFA (в среднем 4,5) по сравнению с «быстро улучшающимся» (средний 5,5), этот фенотип имел самую высокую внутрибольничную смертность (28,3% против 5,5% соответственно). Основным выводом этого исследования было то, что авторы смогли выявить зависящие от времени причины прогрессирования, которые могут быть связаны с дифференциальной реакцией дисфункции конкретного органа на стандартные вмешательства. Как уже предполагалось ранее на основе результатов Seymour et al., при проведении РКИ, оценивающего терапевтическое вмешательство, направленное на сокращение продолжительности органной дисфункции, если бы мы набрали пациентов, принадлежащих к фенотипу «быстрого улучшения», РКИ вряд ли выявило бы какие-либо положительный результат [72].
Sharafoddini et al., основываясь на демографических данных, жизненно важных показателях, лабораторных тестах и дисфункции органов, также применили методы машинного обучения среди 5539 взрослых пациентов с сепсисом, выявив не четыре, а 12 фенотипов. Авторы предполагают, что используемая методология могла бы уделять больше внимания деталям при оценке сходства между пациентами. Смертность в ОИТ, внутрибольничная смертность и 30-дневная смертность значительно различались между кластерами: показатели смертности были ниже в кластерах 10, 11 и 8, а в кластерах 9 и 2 были самыми высокими [73]. Прочитав их статью более внимательно, кто-то может предположить, что было идентифицировано 12 субфенотипов из пяти основных фенотипов, что подчеркивает вышеупомянутые ограничения методов машинного обучения, такие как отсутствие прозрачности и относительно низкая воспроизводимость между исследованиями в настоящее время.
Пять также было числом фенотипов, которые Aldewereld et al. описали в их исследовании. Авторы ретроспективно применили методы машинного обучения к когорте из 1023 человек с ранним септическим шоком. Они охарактеризовали два фенотипа «низкого риска» (L), один «умеренный риск» (M) и два фенотипа «высокого риска» (H). Это были пациенты с септическим шоком, характеризующиеся как «чувствительные к инфузии» (фенотип L2), «рефрактерные к инфузии» пациенты без полиорганной недостаточности (фенотип L1), пациенты с септическим шоком и дыхательной недостаточностью (фенотип М), пациенты с полиорганной дисфункцией (фенотип H1) и пациентов с септическим шоком с гепатобилиарной дисфункцией и коагулопатией (фенотип H2). Фенотипы H1 и H2, хотя и имели разные демографические данные, исходную оценку тяжести заболевания, лабораторные показатели и характер органной недостаточности, имели одинаково высокую смертность. Интересно, что это исследование предоставило уникальные доказательства того, что разные группы пациентов с разными фенотипическими особенностями, развивающиеся по-разному во времени, могут в конечном итоге сохранять одни и те же признаки органной дисфункции [74].
Ding et al. проанализировали когорту из 5782 септических пациентов с госпитализацией в отделение интенсивной терапии и вывели три клинических фенотипа из многомерной панели физиологических данных, используя субграфовую неотрицательную матричную факторизацию с дополнением. Поиск частых подграфов - это метод, используемый для выявления закономерностей в виде подграфов в наборе графов на основе определенного порогового значения частоты. Этот метод позволяет выявлять частые паттерны в графах временных рядов и успешно проводить фенотипирование популяций пациентов и прогнозировать исходы при различных заболеваниях. В этом исследовании пациенты с «фенотипом 1» были старше (73,1 года), имели избыточный вес, были мужчинами, и имели 17,0% 30-дневную и 12,0% внутрибольничную смертность. Пациенты с «фенотипом 2» были моложе (67,9 лет), с меньшим избыточным весом, мужского пола, с 28,4% 30-дневной и 24,8% внутрибольничной смертностью, в то время как пациенты с «фенотипом 3» были самыми молодыми (59,9 лет), с наименьшим избыточным весом, соотношение мужчин и женщин составляло 1:1, а смертность была самой низкой (10,1% 30-дневная и 7,3% внутрибольничная). Опять же, эти фенотипы характеризовались различными демографическими особенностями и сопутствующими заболеваниями, характером дисфункции органов и траекториями заболевания, при этом очевидна четкая связь между фенотипами и клиническим исходом [75].
Papin et al ретроспективно проанализировали 6046 пациентов с сепсисом, поступивших в ОРИТ с акцентом на очаг инфекции [76]. Эти исследователи выделили шесть фенотипических кластеров: фенотип 1 (40%) и фенотип 2 (4%) представляли молодых пациентов без каких-либо сопутствующих заболеваний, госпитализированных по поводу внебольничной пневмонии или менингита/энцефалита соответственно, «фенотип 3» (6%) и «Фенотип 4» (27%) представлял собой пожилых людей с хронической обструктивной болезнью легких, бронхиальной инфекцией и незначительной органной недостаточностью, «фенотип 5» (15%) представлял пациентов, госпитализированных после операции с нозокомиальной инфекцией, и «фенотип 6» (8%) представлял молодых пациентов с иммуносупрессией (например, СПИД, хроническая стероидная терапия или гематологические злокачественные новообразования). Смертность через 28 дней, 90 дней и один год значительно различалась для разных фенотипов, независимо от исходной органной недостаточности [76].
9. Фенотипы сепсиса, волемический статус и исход
Во время сепсиса и септического шока адекватная инфузионная терапия остается критически важной стратегией, направленной на поддержание гемодинамической стабильности пациента, перфузии органов и идеальной доставки кислорода. Перегрузка жидкостью имеет пагубное воздействие, и применение прецизионной медицины к пациентам с сепсисом в ОРИТ предполагает отход от хорошо известного подхода инфузионной реанимации как «стандарта медицинской помощи», который широко применялся в течение последних двух десятилетий. В настоящее время имеется достаточно доказательств того, что различия в балансе жидкости между разными фенотипами тесно связаны с разными исходами и что выявление подгруппы пациентов, особенно склонных к перегрузке жидкостью, может быть важным шагом для оптимизации управления водным балансом.
Например, Shald et al среди 320 больных с сепсисом, поступивших в ОРИТ, выявили четыре фенотипа: «Фенотип 1» (9,7%) - пациенты с полиорганной недостаточностью, «Фенотип 2» (15%) - пациенты с респираторной дисфункцией, «Фенотип 3» (18,1%) -пациенты с неврологической дисфункцией и «фенотип 4» (57,2%)- пациенты с другими проблемами. Уровень смертности между разными фенотипами также был разным; 48,4%, 20,8%, 39,7% и 13,7% для фенотипа 1, 2, 3 и 4 соответственно. Интересно, что балансы жидкости на 1, 2 и 3 дни также были разными: фенотипы 1 и 3 имели наибольший объемный баланс в эти моменты времени [77].
Wang и соавт. в проспективном многоцентровом обсервационном исследовании, в котором приняли участие 986 пациентов с сепсисом, исследовали влияние латентных траекторий баланса жидкости на клинические исходы и выявили три различных траектории/фенотипа: «Фенотип 1» (6,5%), при котором первоначально высокий баланс жидкости быстро снижается, поддерживая более низкий уровень; «фенотип 2» (85,3%), при котором баланс жидкости в целом был стабильным; и «фенотип 3» (8,2%), при котором баланс жидкости изначально был высоким и стабильным, но позже умеренно снижался. При сравнении фенотипов 2 и 3 «фенотип 3» демонстрировал более высокую внутрибольничную смертность (71,6% против 46,9%), органную дисфункцию (79,0% против 46,9%) и тяжелые респираторные нежелательные явления (58,0% против 29,7%). в то время как «фенотип 1» вызывал меньше неблагоприятных событий со стороны почек, чем «фенотип 2» (47,4% против 51,6%) [78].
В ранее упомянутом исследовании Zhang et al. каждый фенотип также показал различную реакцию на инфузионную терапию; «Фенотип 2» получал меньше жидкости, чем все остальные, тогда как «фенотип 3» получал наибольшее количество жидкости в течение первых 24 часов. Влияние более высокого баланса жидкости в первые 48 часов было непропорционально связано с исходом между различными фенотипами: «фенотип 3» снижал риск госпитальной смертности, а «фенотип 4» повышал [70].
Более того, Ma et al., применяя методы машинного обучения у 1437 пациентов с сепсисом, попытались разработать правило последовательного лечения, касающееся идеальной дозы инфузионной терапии и использования вазопрессоров. В конечном итоге были идентифицированы пять фенотипов: «Фенотип 1» (исходный уровень) включал большинство пациентов за все дни; «фенотип 2» включал пациентов с самой высокой тяжестью заболевания; «фенотип 3» включал пациентов с почечной дисфункцией; «фенотип 4» включал лиц с дыхательной недостаточностью; а к «фенотипу 5» относились пациенты с легкой степенью тяжести заболевания, у которых также наблюдался самый низкий уровень смертности (21%). Оптимальная инфузия жидкости следовала за фазами реанимации/дереанимации с начальной инфузией большого объема и поздней инфузией ограниченного объема. В то время как «фенотип 1» перешел в фазу дереанимации на третий день, «фенотип 3» - на первый день, и хотя фенотипы 1 и 3, по-видимому, получили пользу от раннего применения норадреналина, «фенотип 2», по-видимому, выиграл от отсроченного его использования. Это открытие подтверждает существующую гетерогенность сепсиса и еще раз дает понять, что раннее лечение может быть полезным у большинства пациентов с септическим шоком, но отсроченное лечение может быть полезным для других [79].
10. Фенотипирование траекторий ОРИТ: смертность и не только
Как уже объяснялось, сепсис сам по себе представляет собой смесь нескольких фенотипов с разными клиническими проявлениями, разным оптимальным лечением и разным исходом. Используя методы машинного обучения, мы также можем детально фенотипически исследовать и дифференцировать другие аспекты состояния пациентов интенсивной терапии во время госпитализации в отделение интенсивной терапии.
Например, Zhang et al., в ретроспективном многоцентровом когортном исследовании с участием 22 868 пациентов с сепсисом, поступивших в ОРИТ, исследовали, когда они стабилизировались, когда они переходили в состояние стойкого критического заболевания и различалось ли время такого перехода между подклассами этих пациентов. Они обнаружили, что, хотя только у 2,8% пациентов, принимавших участие в исследовании, развилось стойкое критическое заболевание, они составили 19% и 10% от общего числа койко-дней в ОРИТ и больнице соответственно, при этом повышенное соотношение мочевины и креатинина является хорошим биохимическим признаком персистирующего критического состояния. Авторы выделили пять латентных классов: 1-й (22,8%) и 2-й (3,5%) классы, при которых показатель SOFA непрерывно увеличивался и переход к стойкому критическому заболеванию происходил на 16 и 27 день соответственно, и 3-й (51,7%), 4-й (11,2%) и 5 (10,8%) классы, в которых показатель SOFA непрерывно снижался и переход к стойкому критическому заболеванию происходил между 6 и 8 днями. У пациентов как 2-го, так и 5-го класса наблюдался высокий уровень смертности (70% и 41,2% соответственно). У пациентов, у которых развилось стойкое критическое состояние, также наблюдалась в целом более высокая смертность, чем у пациентов без такового (25% против 16%).
Тот факт, что у пациентов с уменьшением балла по шкале SOFA в конечном итоге стойкое критическое заболевание развилось в более ранние сроки, чем у пациентов с увеличением балла по шкале SOFA, несмотря на лечение в ОРИТ, позволяет предположить, что реакция пациента с сепсисом на первоначальное лечение в отделении интенсивной терапии оказывает влияние на то, когда его можно стабилизировать [80].
Yang et al. провели ретроспективный анализ 16 743 пациентов с сепсисом и, применив групповое моделирование траекторий, выделили среди этих пациентов пять отдельных траекторий оценок SOFA через 72 часа: в «группе 1» (32,8%) пациенты имели самый низкий показатель SOFA, который первоначально увеличивался, затем уменьшался и позже увеличивался в течение 72 часов; в «группе 2» (30,0%) пациенты имели более высокий показатель SOFA, который первоначально увеличивался, а затем стабилизировался; в «группе 3» (17,6%). у пациентов были умеренные показатели SOFA (значения между показателями в группах 1 и 2), которые сначала увеличивались, затем резко снижались в течение 72 часов и, наконец, непрерывно увеличивались; а в «группе 4» (14,0%) и «группе 5» (5,7%) пациенты имели относительно высокие показатели SOFA со схожими тенденциями изменений. В группах 2–5 кумулятивный риск постепенно увеличивался, тогда как в «группе 1» риск оставался низким. Похоже, что раннее эффективное лечение сопровождалось снижением показателя SOFA, тогда как неадекватный инфекционный контроль сопровождался стабилизацией показателя SOFA. Более высокий риск смерти наблюдался у пациентов с сепсисом в возрасте < 65 лет и у тех, кто не находился на ИВЛ [81].
Soussi et al. снова с использованием методов машинного обучения проанализировали клинические и лабораторные данные, собранные у пациентов во французских и европейских регистрах ОРИТ; анализ латентного класса выявил два различных фенотипа выживших после сепсиса среди 467 пациентов: фенотипы А и В. Пациенты с «фенотипом В» (48%) имели более выраженную сердечно-сосудистую и почечную дисфункцию, гематологические нарушения и более высокие уровни воспалительных маркеров при выписке из ОРИТ и значительно более высокую смертность в течение года (34% против 16%). «Фенотип B» также был независимо связан с повышенной смертностью в течение года. Похоже, что если бы мы могли распознавать различные группы людей, переживших сепсис, при выписке из ОРИТ, мы могли бы также распознавать пациентов с более высоким риском плохих долгосрочных результатов и могли бы оптимизировать их лечение после переводя из ОРИТ [82].
Аналогичными были результаты были получены Taylor et al., которые пытались изучить смертность после выписки и частоту повторных госпитализаций среди 20 745 пациентов с сепсисом. Они использовали анализ латентных классов и разделили выживших после сепсиса на пять различных фенотипов: «Группа 1» (24,3%), т. е. пациенты, которые не нуждались в медицинской помощи (смертность 0,1%, повторная госпитализация 8,6%); «группа 2» (13,7%), ранее здоровые пациенты с тяжелым заболеванием и сложными потребностями после выписки и препятствиями для оказания медицинской помощи (смертность 2,1%, повторная госпитализация 20,1%); «3-я группа» (27,6%), пациенты с мультиморбидностью (смертность 2,1%, повторная госпитализация 26%); «4-я группа» (13,7%) — пациенты с плохим функциональным статусом (смертность 6,9%, повторная госпитализация 21,6%); и «группа 5» (20,7%) — пациенты с тяжелым заболеванием и сложными потребностями после выписки (смертность 7,9%, повторная госпитализация 35,1%). Результаты этого исследования убедительно подтверждают гипотезу о том, что выжившие после сепсиса представляют собой отдельные клинические фенотипы с различными потребностями в дополнительной поддержке после выписки и указывают на необходимость классификации перед выпиской, что в конечном итоге направлено на более индивидуализированный подход к лечению пациентов, переживших сепсис сепсиса [83].
Boede и соавт., используя латентно-классовый анализ, исследовали депрессивные симптомы у 224 человек, перенесших сепсис, в течение года наблюдения и определили три различные траектории: в одной группе пациентов (68%) наблюдалась легкая траектория выздоровления, при которой симптомы легкой депрессии регрессировали в течение 6 месяцев, у другой группы пациентов (12%) наблюдалась тяжелая персистирующая траектория, при которой депрессивные симптомы от умеренной до тяжелой степени сохранялись в течение 1 года, а у третьей группы пациентов (20%) симптомы тяжелой депрессии присутствовали через 1 месяц после выписки из ОРИТ, однако полностью исчезли через 6 месяцев [84].
Puthucheary и соавт., также используя латентно-классовый анализ, обследовали 159 человек, переживших сепсис, в течение двухлетнего периода наблюдения и выделили две отдельные группы: в одной группе наблюдалось более быстрое и полное выздоровление (38,4%), а в другой наблюдалось более устойчивые функциональные нарушения (61,6%), причем независимыми факторами риска плохой реабилитации являются пожилой возраст, низкий уровень образования и высокая коморбидность. Была также третья группа, которую нельзя было отнести ни к одной траектории, что иллюстрирует широкий спектр исходов сепсиса среди выживших [85].
11. Сепсис и фенотипы: это еще не все
Число исследований по фенотипированию сепсиса продолжает расти, принимая во внимание локализацию инфекции [100, 101], тип органной дисфункции, например, печени [102], почек [103–106], легких [107, 108] или системы свертывания крови [109–112] и тип заболевания, например, COVID-19 [113–128] или ОРДС, не связанный с COVID-19 [129–153]; они пытаются соотнести фенотипы и связанный с ними вред, связанный с отсроченным применением антибиотиков [154,155], и даже предсказать ответ на лечение или его результат [156–159]. Различные фенотипы были также идентифицированы у детей с сепсисом [160–172]. Полный обзор этих тем выходит за рамки данного обзора, и за более подробной информацией читатель отсылается к литературе.
12. Выводы
Сепсису всегда давалось широкое определение, чтобы охватить наибольшее количество пациентов из группы риска, ценой значительных трудностей, создаваемых гетерогенностью как для клинической практики, так и для исследований [173]. Такая значительная гетерогенность среди пациентов и принятие единой стратегии ведения пациентов могут привести к весьма разным и даже противоречивым результатам [174].
В течение многих лет не было новых методов лечения, и существует более чем когда-либо потребность в индивидуальном подходе к лечению сепсиса. Хотя в настоящее время может показаться невозможным включить фенотипирование в нашу повседневную клиническую практику и, следовательно, предложить персонализированные подходы к оказанию помощи пациентов с сепсисом, небольшие шаги в этом направлении уже сделаны, поскольку все более гибкие и сложные методы кластеризации позволяют анализировать большие выборки данных и помогают идентифицировать отдельные клинические фенотипы (Figure 1); разные фенотипы могут по-разному реагировать на стратегии лечения. Более точное определение клинических характеристик гетерогенности при сепсисе может стать первым шагом в наших усилиях по пониманию потенциальной реакции различных групп пациентов интенсивной терапии на доступные в настоящее время терапевтические подходы. Таким образом, перспектива прецизионной медицины заключается в том, что лучшее понимание индивидуальных клинических проявлений сепсиса, механизмов заболевания и гетерогенных моделей ответа на лечение приведет к переходу от «плохо охарактеризованной» к «персонализированной» медицине и улучшению результатов.

References
1. Vincent, J.L.; van der Poll, T.; Marshall, J.C. The End of “One Size Fits All” Sepsis Therapies:Toward an Individualized Approach.
Biomedicines 2022, 10, 2260. [CrossRef]
2. Singer, M.; Deutschman, C.S.; Seymour, C.W.; Shankar-Hari, M.; Annane, D.; Bauer, M.; Bellomo, R.; Bernard, G.R.; Chiche, J.D.; Coopersmith, C.M.; et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315, 801–810. [CrossRef]
3. Hussain, H.; Vutipongsatorn, K.; Jimenez, B.; Antcliffe, D.B. Patient Stratification in Sepsis:Using Metabolomics to Detect Clinical Phenotypes, Sub-Phenotypes and Therapeutic Response.Metabolites 2022, 12, 376. [CrossRef] [PubMed]
4. Taj, M.; Brenner, M.; Sulaiman, Z.; Pandian, V. Sepsis protocols to reduce mortality inresource-restricted settings: A systematic review. Intensive Crit. Care Nurs. 2022, 72, 103255.[CrossRef]
5. Afonso, E.; Smets, K.; Deschepper, M.; Verstraete, E.; Blot, S. The effect of late-onset sepsis onmortality across different gestational ages in a neonatal intensive care unit: A historical study. IntensiveCrit. Care Nurs. 2023, 77, 103421. [CrossRef]
6. Verstraete, E.H.; Mahieu, L.; De Coen, K.; Vogelaers, D.; Blot, S. Impact of healthcare-associated sepsis on mortality in critically ill infants. Eur. J. Pediatr. 2016, 175, 943–952. [CrossRef][PubMed]
7. Verstraete, E.; Boelens, J.; De Coen, K.; Claeys, G.; Vogelaers, D.; Vanhaesebrouck, P.; Blot, S.Healthcare-associated bloodstream infections in a neonatal intensive care unit over a 20-year period(1992–2011): Trends in incidence, pathogens, and mortality. Infect. Control Hosp. Epidemiol. 2014,35, 511–518. [CrossRef]
8. Arvaniti, K.; Dimopoulos, G.; Antonelli, M.; Blot, K.; Creagh-Brown, B.; Deschepper, M.; de Lange, D.; De Waele, J.; Dikmen, Y.; Eckmann, C.; et al. Epidemiology and age-related mortality incritically ill patients with intra-abdominal infection or sepsis: An international cohort study. Int. J.Antimicrob. Agents 2022, 60, 106591. [CrossRef] [PubMed]
9. Dimopoulos, G.; Koulenti, D.; Blot, S.; Sakr, Y.; Anzueto, A.; Spies, C.; Sole-Violan, J.; Kett, D.; Armaganidis, A.; Martin, C.; et al. Critically ill elderly adults with infection: Analysis of the extended prevalence of infection in intensive care study. J. Am. Geriatr. Soc. 2013, 61, 2065–2071. [CrossRef]
10. Blot, S.; Cankurtaran, M.; Petrovic, M.; Vandijck, D.; Lizy, C.; Decruyenaere, J.; Danneels, C.;Vandewoude, K.; Piette, A.; Vershraegen, G.; et al. Epidemiology and outcome of nosocomial bloodstream infection in elderly critically ill patients: A comparison between middle-aged, old, andvery old patients. Crit. Care Med. 2009, 37, 1634–1641. [CrossRef] [PubMed]
11. Blot, S.; Koulenti, D.; Dimopoulos, G.; Martin, C.; Komnos, A.; Krueger, W.A.; Spina, G.; Armaganidis, A.; Rello, J.; EU-VAP Study Investigators. Prevalence, risk factors, and mortality for ventilator-associated pneumonia in middle-aged, old, and very old critically ill patients. Crit. CareMed. 2014, 42, 601–609. [CrossRef]
12. Rudd, K.E.; Johnson, S.C.; Agesa, K.M.; Shackelford, K.A.; Tsoi, D.; Kievlan, D.R.; Colombara, D.V.; Ikuta, K.S.; Kissoon, N.; Finfer, S.; et al. Global, regional, and national sepsis incidence and mortality, 1990–2017: Analysis for the Global Burden of Disease Study. Lancet 2020, 395, 200–211.[CrossRef]
13. Cavaillon, J.M.; Singer, M.; Skirecki, T. Sepsis therapies: Learning from 30 years of failure of translational research to propose new leads. EMBO Mol. Med. 2020, 12, e10128. [CrossRef]
14. Sakr, Y.; Jaschinski, U.; Wittebole, X.; Szakmany, T.; Lipman, J.; Namendys-Silva, S.A.; Martin-Loeches, I.; Leone, M.; Lupu, M.N.; Vincent, J.L.; et al. Sepsis in Intensive Care Unit Patients: Worldwide Data From the Intensive Care over Nations Audit. Open Forum Infect. Dis. 2018, 5,ofy313. [CrossRef]
15. Karvouniaris, M.; Papadopoulos, D.; Koulenti, D.; Chatzimichail, M.; Papamichalis, P.; Ntafoulis, N.; Valsamaki, A.; Katsiafyl- loudis, P.; Vaitsi, E.; Oikonomou, K.; et al. Impact of secondary sepsis on mortality in adult intensive care unit patients. Intensive Crit. Care Nurs. 2023, 75, 103345.[CrossRef]
16. Blot, S.; Ruppe, E.; Harbarth, S.; Asehnoune, K.; Poulakou, G.; Luyt, C.E.; Rello, J.; Klompas, M.; Depuydt, P.; Eckmann, C.; et al. Healthcare-associated infections in adult intensive care unit patients: Changes in epidemiology, diagnosis, prevention and contributions of new technologies.Intensive Crit. Care Nurs. 2022, 70, 103227. [CrossRef] [PubMed]
17. Bone, R.C.; Balk, R.A.; Cerra, F.B.; Dellinger, R.P.; Fein, A.M.; Knaus, W.A.; Schein, R.M.; Sibbald, W.J. Definitions for sepsis and organ failure and guidelines for the use of innovativetherapies in sepsis. Chest 1992, 101, 1644–1655. [CrossRef] [PubMed]
18. Levy, M.M.; Fink, M.P.; Marshall, J.C.; Abraham, E.; Angus, D.; Cook, D.; Cohen, J.; Opal,S.M.; Vincent, J.L.; Ramsay, G.; et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International SepsisDefinitions Conference. Crit. Care Med. 2003, 31, 1250–1256. [CrossRef]
19. Investigators, A.; Group, A.C.T.; Peake, S.L.; Delaney, A.; Bailey, M.; Bellomo, R.; Cameron, P.A.; Cooper, D.J.; Higgins, A.M.; Holdgate, A.; et al. Goal-directed resuscitation for patients with early septic shock. N. Engl. J. Med. 2014, 371, 1496–1506. [CrossRef]
20. Morelli, A.; Ertmer, C.; Westphal, M.; Rehberg, S.; Kampmeier, T.; Ligges, S.; Orecchioni, A.; D’Egidio, A.; D’Ippoliti, F.; Raffone, C.; et al. Effect of heart rate control with esmolol onhemodynamic and clinical outcomes in patients with septic shock: A randomized clinical trial. JAMA2013, 310, 1683–1691. [CrossRef]
21. Shankar-Hari, M.; Phillips, G.S.; Levy, M.L.; Seymour, C.W.; Liu, V.X.; Deutschman, C.S.;Angus, D.C.; Rubenfeld, G.D.; Singer, M.; Sepsis Definitions Task, F. Developing a New Definitionand Assessing New Clinical Criteria for Septic Shock: For the Third International ConsensusDefinitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315, 775–787. [CrossRef]
22. de Grooth, H.J.; Postema, J.; Loer, S.A.; Parienti, J.J.; Oudemans-van Straaten, H.M.; Girbes, A.R. Unexplained mortality differences between septic shock trials: A systematic analysis of population characteristics and control-group mortality rates. Intensive Care Med. 2018, 44, 311–322.[CrossRef]
23. Fohner, A.E.; Greene, J.D.; Lawson, B.L.; Chen, J.H.; Kipnis, P.; Escobar, G.J.; Liu, V.X. Assessing clinical heterogeneity in sepsis through treatment patterns and machine learning. J. Am.Med. Inform. Assoc. 2019, 26, 1466–1477. [CrossRef] [PubMed]
24. Suarez-de-la-Rica, A.; Maseda, E. Precision Medicine in Sepsis and Septic Shock. J. Clin. Med.2022, 11, 5332. [CrossRef]
25. Gotts, J.E.; Matthay, M.A. Sepsis: Pathophysiology and clinical management. BMJ 2016, 353,i1585. [CrossRef]
26. Wong, H.R. Personalized medicine, endotypes, and intensive care medicine. Intensive Care Med.2015, 41, 1138–1140. [CrossRef]
27. Rhee, C.; Kadri, S.S.; Danner, R.L.; Suffredini, A.F.; Massaro, A.F.; Kitch, B.T.; Lee, G.;Klompas, M. Diagnosing sepsis is subjective and highly variable: A survey of intensivists using case vignettes. Crit. Care 2016, 20, 89. [CrossRef] [PubMed]
28. Vincent, J.L. The Clinical Challenge of Sepsis Identification and Monitoring. PLoS Med. 2016,13, e1002022. [CrossRef] [PubMed]
29. Kellum, J.A.; Formeck, C.L.; Kernan, K.F.; Gomez, H.; Carcillo, J.A. Subtypes and Mimics ofSepsis. Crit. Care Clin. 2022, 38, 195–211. [CrossRef]
30. Liu, C.; Suo, S.; Luo, L.; Chen, X.; Ling, C.; Cao, S. SOFA Score in relation to Sepsis: Clinical Implications in Diagnosis, Treatment, and Prognostic Assessment. Comput. Math. Methods Med. 2022,2022, 7870434. [CrossRef]
31. Vincent, J.L.; Opal, S.M.; Marshall, J.C.; Tracey, K.J. Sepsis definitions: Time for change. Lancet2013, 381, 774–775. [CrossRef]
32. Simpson, S.Q. New Sepsis Criteria: A Change We Should Not Make. Chest 2016, 149, 1117–1118. [CrossRef]
33. Shah, F.A.; Meyer, N.J.; Angus, D.C.; Awdish, R.; Azoulay, E.; Calfee, C.S.; Clermont, G.;Gordon, A.C.; Kwizera, A.; Leligdowicz, A.; et al. A Research Agenda for Precision Medicine in Sepsis and Acute Respiratory Distress Syndrome: An Official American Thoracic Society ResearchStatement. Am. J. Respir. Crit. Care Med. 2021, 204, 891–901. [CrossRef]
34. Wiersinga, W.J.; Seymour, C.W. (Eds.) Handbook of Sepsis; Springer: Cham, Switzerland, 2018.
35. Castela Forte, J.; Perner, A.; van der Horst, I.C.C. The use of clustering algorithms in critical care research to unravel patient heterogeneity. Intensive Care Med. 2019, 45, 1025–1028. [CrossRef]
36. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado,F.R.; McIntyre, L.; Ostermann, M.; Prescott, H.C.; et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 2021, 47, 1181–1247. [CrossRef] [PubMed]
37. Vincent, J.L.; Singer, M.; Einav, S.; Moreno, R.; Wendon, J.; Teboul, J.L.; Bakker, J.; Hernandez,G.; Annane, D.; de Man, A.M.E.; et al. Equilibrating SSC guidelines with individualized care. Crit.Care 2021, 25, 397. [CrossRef] [PubMed]
38. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado, F.R.; McIntyre, L.; Ostermann, M.; Prescott, H.C.; et al. Executive Summary: Surviving Sepsis Campaign: International Guidelines for the Management of Sepsis and Septic Shock 2021. Crit. CareMed. 2021, 49, 1974–1982. [CrossRef] [PubMed]
39. Nachtomy, O.; Shavit, A.; Yakhini, Z. Gene expression and the concept of the phenotype. Stud.Hist. Philos. Biol. Biomed. Sci. 2007,
38, 238–254. [CrossRef] [PubMed]
40. Seymour, C.W.; Gomez, H.; Chang, C.H.; Clermont, G.; Kellum, J.A.; Kennedy, J.; Yende, S.;Angus, D.C. Precision medicine for all? Challenges and opportunities for a precision medicineapproach to critical illness. Crit. Care 2017, 21, 257. [CrossRef]
41. Beutler, B.; Du, X.; Hoebe, K. From phenomenon to phenotype and from phenotype to gene: Forward genetics and the problem of sepsis. J. Infect. Dis. 2003, 187 (Suppl. S2), S321–S326.[CrossRef]
42. Ward, N.S.; Levy, M.M. (Eds.) Sepsis, Definitions, Pathophysiology and the Challenge ofBedside Management; Springer Nature: Cham,Switzerland, 2017.
43. Available online: https://www.ibm.com/topics/machine-learning (accessed on 12 May 2023).
44. Ke, X.; Zhang, F.; Huang, G.; Wang, A. Interpretable Machine Learning to Optimize Early In-Hospital Mortality Prediction for Elderly Patients with Sepsis: A Discovery Study. Comput. Math.Methods Med. 2022, 2022, 4820464. [CrossRef]
45. Vranas, K.C.; Jopling, J.K.; Sweeney, T.E.; Ramsey, M.C.; Milstein, A.S.; Slatore, C.G.;Escobar, G.J.; Liu, V.X. Identifying Distinct Subgroups of ICU Patients: A Machine Learning Approach. Crit. Care Med. 2017, 45, 1607–1615. [CrossRef]
46. Qin, Y.; Caldino Bohn, R.I.; Sriram, A.; Kernan, K.F.; Carcillo, J.A.; Kim, S.; Park, H.J.Refining empiric subgroups of pediatric sepsis using machine-learning techniques on observationaldata. Front. Pediatr. 2023, 11, 1035576. [CrossRef] [PubMed]
47. Komorowski, M.; Green, A.; Tatham, K.C.; Seymour, C.; Antcliffe, D. Sepsis biomarkers anddiagnostic tools with a focus on machine learning. eBioMedicine 2022, 86, 104394. [CrossRef]
48. Li, H.; Markal, A.; Balch, J.A.; Loftus, T.J.; Efron, P.A.; Ozrazgat-Baslanti, T.; Bihorac, A.Methods for Phenotyping Adult Patients in Sepsis and Septic Shock: A Scoping Review. Crit. CareExplor. 2022, 4, e0672. [CrossRef] [PubMed]
49. Sharma, M.; Taweesedt, P.T.; Surani, S. Utilizing Artificial Intelligence in Critical Care: AddingA Handy Tool to Our Armamen- tarium. Cureus 2021, 13, e15531. [CrossRef]
50. Loftus, T.J.; Shickel, B.; Balch, J.A.; Tighe, P.J.; Abbott, K.L.; Fazzone, B.; Anderson, E.M.; Rozowsky, J.; Ozrazgat-Baslanti, T.; Ren, Y.; et al. Phenotype clustering in health care: A narrative review for clinicians. Front. Artif. Intell. 2022, 5, 842306. [CrossRef] [PubMed]
51. Baek, M.S.; Kim, J.H.; Kwon, Y.S. Cluster analysis integrating age and body temperature for mortality in patients with sepsis: A multicenter retrospective study. Sci. Rep. 2022, 12, 1090.[CrossRef]
52. Thomas-Ruddel, D.O.; Hoffmann, P.; Schwarzkopf, D.; Scheer, C.; Bach, F.; Komann, M.; Gerlach, H.; Weiss, M.; Lindner, M.; Ruddel, H.; et al. Fever and hypothermia represent two populations of sepsis patients and are associated with outside temperature. Crit. Care 2021, 25, 368.[CrossRef]
53. Wu, D.Y.; Lu, S.Q. The Effects of Abnormal Body Temperature on the Prognosis of Patientswith Septic Shock. Ther. Hypothermia
Temp. Manag. 2020, 10, 148–152. [CrossRef]
54. Honore, P.M.; Barreto Gutierrez, L.; Kugener, L.; Redant, S.; Attou, R.; Gallerani, A.; De Bels, D. Mortality in non-elderly septic patients was increased with hypothermia and decreased with fever whilemortality in elderly patients was not associated with body temperature: Beware of some confounders!Crit. Care 2020, 24, 606. [CrossRef] [PubMed]
55. Bhavani, S.V.; Carey, K.A.; Gilbert, E.R.; Afshar, M.; Verhoef, P.A.; Churpek, M.M. Identifying Novel Sepsis Subphenotypes Using Temperature Trajectories. Am. J. Respir. Crit. Care Med. 2019,200, 327–335. [CrossRef]
56. Henning, D.J.; Carey, J.R.; Oedorf, K.; Day, D.E.; Redfield, C.S.; Huguenel, C.J.; Roberts, J.C.;Sanchez, L.D.; Wolfe, R.E.; Shapiro,
N.I. The Absence of Fever Is Associated with Higher Mortality and Decreased Antibiotic and IV Fluid Administration in Emergency Department Patients with Suspected Septic Shock. Crit. Care Med.2017, 45, e575–e582. [CrossRef] [PubMed]
57. Sunden-Cullberg, J.; Rylance, R.; Svefors, J.; Norrby-Teglund, A.; Bjork, J.; Inghammar, M. Fever in the Emergency Department Predicts Survival of Patients with Severe Sepsis and Septic Shock Admitted to the ICU. Crit. Care Med. 2017, 45, 591–599. [CrossRef] [PubMed]
58. Rumbus, Z.; Matics, R.; Hegyi, P.; Zsiboras, C.; Szabo, I.; Illes, A.; Petervari, E.; Balasko, M.; Marta, K.; Miko, A.; et al. Fever Is Associated with Reduced, Hypothermia with Increased Mortality in Septic Patients: A Meta-Analysis of Clinical Trials. PLoS ONE 2017, 12, e0170152. [CrossRef]
59. Wiewel, M.A.; Harmon, M.B.; van Vught, L.A.; Scicluna, B.P.; Hoogendijk, A.J.; Horn, J.; Zwinderman, A.H.; Cremer, O.L.; Bonten, M.J.; Schultz, M.J.; et al. Risk factors, host response andoutcome of hypothermic sepsis. Crit. Care 2016, 20, 328. [CrossRef]
60. Bhavani, S.V.; Huang, E.S.; Verhoef, P.A.; Churpek, M.M. Novel Temperature TrajectorySubphenotypes in COVID-19. Chest 2020,158, 2436–2439. [CrossRef]
61. Shimazui, T.; Nakada, T.A.; Walley, K.R.; Oshima, T.; Abe, T.; Ogura, H.; Shiraishi, A.;Kushimoto, S.; Saitoh, D.; Fujishima, S.; et al. Significance of body temperature in elderly patients with sepsis. Crit. Care 2020, 24, 387. [CrossRef]
62. Bhavani, S.V.; Wolfe, K.S.; Hrusch, C.L.; Greenberg, J.A.; Krishack, P.A.; Lin, J.; Lecompte-Osorio, P.; Carey, K.A.; Kress, J.P.; Coopersmith, C.M.; et al. Temperature Trajectory Subphenotypes Correlate with Immune Responses in Patients with Sepsis. Crit. Care Med. 2020, 48, 1645–1653.[CrossRef]
63. Ito, Y.; Kudo, D.; Kushimoto, S. Association between low body temperature on admission and in-hospital mortality according to body mass index categories of patients with sepsis. Medicine 2022,101, e31657. [CrossRef]
64. Bhavani, S.V.; Verhoef, P.A.; Maier, C.L.; Robichaux, C.; Parker, W.F.; Holder, A.; Kamaleswaran, R.; Wang, M.D.; Churpek, M.M.; Coopersmith, C.M. Coronavirus Disease 2019 Temperature Trajectories Correlate with Hyperinflammatory and Hypercoagulable Subphenotypes.Crit. Care Med. 2022, 50, 212–223. [CrossRef]
65. Zhu, J.L.; Yuan, S.Q.; Huang, T.; Zhang, L.M.; Xu, X.M.; Yin, H.Y.; Wei, J.R.; Lyu, J. Influence of systolic blood pressure trajectory on in-hospital mortality in patients with sepsis. BMC Infect. Dis.2023, 23, 90. [CrossRef]
66. Daulasim, A.; Vieillard-Baron, A.; Geri, G. Hemodynamic clinical phenotyping in septic shock.Curr. Opin. Crit. Care 2021, 27,290–297. [CrossRef] [PubMed]
67. Geri, G.; Vignon, P.; Aubry, A.; Fedou, A.L.; Charron, C.; Silva, S.; Repesse, X.; Vieillard-Baron, A. Cardiovascular clusters in septic shock combining clinical and echocardiographic parameters: Apost hoc analysis. Intensive Care Med. 2019, 45, 657–667. [CrossRef] [PubMed]
68. Knox, D.B.; Lanspa, M.J.; Kuttler, K.G.; Brewer, S.C.; Brown, S.M. Phenotypic clusters withinsepsis-associated multiple organ dysfunction syndrome. Intensive Care Med. 2015, 41, 814–822.[CrossRef] [PubMed]
69. Ibrahim, Z.M.; Wu, H.; Hamoud, A.; Stappen, L.; Dobson, R.J.B.; Agarossi, A. On classifyingsepsis heterogeneity in the ICU: Insight using machine learning. J. Am. Med. Inform. Assoc. 2020, 27,437–443. [CrossRef]
70. Zhang, Z.; Zhang, G.; Goyal, H.; Mo, L.; Hong, Y. Identification of subclasses of sepsis thatshowed different clinical outcomes and responses to amount of fluid resuscitation: A latent profileanalysis. Crit. Care 2018, 22, 347. [CrossRef]
71. Seymour, C.W.; Kennedy, J.N.; Wang, S.; Chang, C.H.; Elliott, C.F.; Xu, Z.; Berry, S.; Clermont, G.; Cooper, G.; Gomez, H.; et al. Derivation, Validation, and Potential Treatment Implications of Novel Clinical Phenotypes for Sepsis. JAMA 2019, 321, 2003–2017. [CrossRef]
72. Xu, Z.; Mao, C.; Su, C.; Zhang, H.; Siempos, I.; Torres, L.K.; Pan, D.; Luo, Y.; Schenck, E.J.; Wang, F. Sepsis subphenotyping based on organ dysfunction trajectory. Crit. Care 2022, 26, 197.[CrossRef]
73. Sharafoddini, A.; Dubin, J.A.; Lee, J. Identifying subpopulations of septic patients: A temporal data-driven approach. Comput. Biol. Med. 2021, 130, 104182. [CrossRef]
74. Aldewereld, Z.T.; Zhang, L.A.; Urbano, A.; Parker, R.S.; Swigon, D.; Banerjee, I.; Gomez, H.;Clermont, G. Identification of Clinical Phenotypes in Septic Patients Presenting with Hypotension orElevated Lactate. Front. Med. 2022, 9, 794423. [CrossRef] [PubMed]
75. Ding, M.; Luo, Y. Unsupervised phenotyping of sepsis using nonnegative matrix factorizationof temporal trends from a multivariate panel of physiological measurements. BMC Med. Inform. Decis. Mak. 2021, 21, 95. [CrossRef] [PubMed]
76. Papin, G.; Bailly, S.; Dupuis, C.; Ruckly, S.; Gainnier, M.; Argaud, L.; Azoulay, E.; Adrie, C.;Souweine, B.; Goldgran-Toledano, D.; et al. Clinical and biological clusters of sepsis patients usinghierarchical clustering. PLoS ONE 2021, 16, e0252793. [CrossRef]
77. Shald, E.A.; Erdman, M.J.; Ferreira, J.A. Impact of Clinical Sepsis Phenotypes on Mortalityand Fluid Status in Critically Ill Patients. Shock 2022, 57, 57–62. [CrossRef] [PubMed]
78. Wang, M.; Zhu, B.; Jiang, L.; Luo, X.; Wang, N.; Zhu, Y.; Xi, X. Association between Latent Trajectories of Fluid Balance and Clinical Outcomes in Critically Ill Patients with Acute Kidney Injury: A Prospective Multicenter Observational Study. Kidney Dis. 2022, 8, 82–92. [CrossRef]
79. Ma, P.; Liu, J.; Shen, F.; Liao, X.; Xiu, M.; Zhao, H.; Zhao, M.; Xie, J.; Wang, P.; Huang, M.; et al. Individualized resuscitation strategy for septic shock formalized by finite mixture modeling and dynamic treatment regimen. Crit. Care 2021, 25, 243. [CrossRef]
80. Zhang, Z.; Ho, K.M.; Gu, H.; Hong, Y.; Yu, Y. Defining persistent critical illness based on growth trajectories in patients with sepsis. Crit. Care 2020, 24, 57. [CrossRef]
81. Yang, R.; Han, D.; Zhang, L.; Huang, T.; Xu, F.; Zheng, S.; Yin, H.; Lyu, J. Analysis of the correlation between the longitudinal trajectory of SOFA scores and prognosis in patients with sepsis at72 hour after admission based on group trajectory modeling.
J. Intensive Med. 2022, 2, 39–49. [CrossRef]
82. Soussi, S.; Sharma, D.; Juni, P.; Lebovic, G.; Brochard, L.; Marshall, J.C.; Lawler, P.R.; Herridge, M.; Ferguson, N.; Del Sorbo, L.; et al. Identifying clinical subtypes in sepsis-survivors with different one-year outcomes: A secondary latent class analysis of the FROG-ICU cohort. Crit. Care 2022, 26,114. [CrossRef]
83. Taylor, S.P.; Bray, B.C.; Chou, S.H.; Burns, R.; Kowalkowski, M.A. Clinical Subtypes of SepsisSurvivors Predict Readmission and Mortality after Hospital Discharge. Ann. Am. Thorac. Soc. 2022,19, 1355–1363. [CrossRef]
84. Boede, M.; Gensichen, J.S.; Jackson, J.C.; Eissler, F.; Lehmann, T.; Schulz, S.; Petersen, J.J.; Wolf, F.P.; Dreischulte, T.; Schmidt, K.F.R. Trajectories of depression in sepsis survivors: Anobservational cohort study. Crit. Care 2021, 25, 161. [CrossRef] [PubMed]
85. Puthucheary, Z.A.; Gensichen, J.S.; Cakiroglu, A.S.; Cashmore, R.; Edbrooke, L.; Heintze, C.; Neumann, K.; Wollersheim, T.; Denehy, L.; Schmidt, K.F.R. Implications for post critical illness trial design: Sub-phenotyping trajectories of functional recovery among sepsis survivors. Crit. Care 2020,24, 577. [CrossRef] [PubMed]
86. Prescott, H.C. Identifying Sepsis Subtypes from Routine Clinical Data. Am. J. Respir. Crit. CareMed. 2019, 200, 272–273. [CrossRef][PubMed]
87. Nagin, D.S.; Jones, B.L.; Passos, V.L.; Tremblay, R.E. Group-based multi-trajectory modeling. Stat. Methods Med. Res. 2018, 27, 2015–2023. [CrossRef]
88. Leijte, G.P.; Kox, M.; Pickkers, P. Fever in Sepsis: Still a Hot Topic. Am. J. Respir. Crit. CareMed. 2019, 200, 263–264. [CrossRef]
89. Harmon, M.B.A.; Scicluna, B.P.; Wiewel, M.A.; Schultz, M.J.; Horn, J.; Cremer, O.L.; van der Poll, T.; Joost Wiersinga, W.; Juffermans, N.P.; The MARS Consortium. Patients with hypothermicsepsis have a unique gene expression profile compared to patients with fever and sepsis. J. Cell. Mol.Med. 2022, 26, 1896–1904. [CrossRef]
90. Young, P.J.; Bellomo, R. Fever in sepsis: Is it cool to be hot? Crit. Care 2014, 18, 109. [CrossRef]
91. Drewry, A.M.; Mohr, N.M.; Ablordeppey, E.A.; Dalton, C.M.; Doctor, R.J.; Fuller, B.M.; Kollef, M.H.; Hotchkiss, R.S. Therapeutic Hyperthermia Is Associated with Improved Survival in Afebrile Critically Ill Patients with Sepsis: A Pilot Randomized Trial. Crit. Care Med. 2022, 50, 924–934.[CrossRef]
92. Kula, R. Therapeutic Hyperthermia Is Associated with Improved Survival in Afebrile Critically Ill Patients with Sepsis: A Pilot Randomized Trial. Crit. Care Med. 2022, 50, e693–e694. [CrossRef]
93. Nowak, R.M.; Reed, B.P.; Nanayakkara, P.; DiSomma, S.; Moyer, M.L.; Millis, S.; Levy, P.Presenting hemodynamic phenotypes in ED patients with confirmed sepsis. Am. J. Emerg. Med. 2016, 34, 2291–2297. [CrossRef]
94. Hess, M.L.; Hastillo, A.; Greenfield, L.J. Spectrum of cardiovascular function during gram-negative sepsis. Prog. Cardiovasc. Dis.1981, 23, 279–298. [CrossRef] [PubMed]
95. Zhang, H.; Wang, X.; Yin, W.; Zhang, H.; Liu, L.; Pan, P.; Zhu, Y.; Huang, W.; Xing, Z.; Yao, B.; et al. A multicenter prospective cohort study of cardiac ultrasound phenotypes in patients with sepsis: Study protocol for a multicenter prospective cohort trial. Front. Med. 2022, 9, 938536. [CrossRef][PubMed]
96. Kattan, E.; Bakker, J.; Estenssoro, E.; Ospina-Tascon, G.A.; Cavalcanti, A.B.; Backer, D.; Vieillard-Baron, A.; Teboul, J.L.; Castro, R.; Hernandez, G. Hemodynamic phenotype-based, capillary refill time-targeted resuscitation in early septic shock: The ANDROMEDA-SHOCK-2 Randomized Clinical Trial study protocol. Rev. Bras. Ter. Intensiva 2022, 34, 96–106. [CrossRef] [PubMed]
97. Bhavani, S.V.; Semler, M.; Qian, E.T.; Verhoef, P.A.; Robichaux, C.; Churpek, M.M.;Coopersmith, C.M. Development and validation of novel sepsis subphenotypes using trajectories ofvital signs. Intensive Care Med. 2022, 48, 1582–1592. [CrossRef]
98. Knaus, W.A.; Marks, R.D. New Phenotypes for Sepsis: The Promise and Problem of ApplyingMachine Learning and Artificial Intelligence in Clinical Research. JAMA 2019, 321, 1981–1982.[CrossRef]
99. Hasegawa, D.; Nishida, O. Patient selection in sepsis: Precision medicine using phenotypes andits implications for future clinical trial design. J. Thorac. Dis. 2019, 11, 3672–3675. [CrossRef]
100. Stortz, J.A.; Cox, M.C.; Hawkins, R.B.; Ghita, G.L.; Brumback, B.A.; Mohr, A.M.; Moldawer,L.L.; Efron, P.A.; Brakenridge, S.C.; Moore, F.A. Phenotypic heterogeneity by site of infection in surgical sepsis: A prospective longitudinal study. Crit. Care 2020, 24, 203. [CrossRef]
101. Blot, S.; Antonelli, M.; Arvaniti, K.; Blot, K.; Creagh-Brown, B.; de Lange, D.; De Waele, J.;Deschepper, M.; Dikmen, Y.; Dimopoulos, G.; et al. Epidemiology of intra-abdominal infection and sepsis in critically ill patients: “AbSeS”, a multinational observational cohort study and ESICM TrialsGroup Project. Intensive Care Med. 2019, 45, 1703–1717. [CrossRef]
102. Miao, H.; Cui, Z.; Guo, Z.; Chen, Q.; Su, W.; Sun, Y.; Sun, M.; Ma, X.; Ding, R. Identification of Subphenotypes of Sepsis-Associated Liver Dysfunction Using Cluster Analysis. Shock 2023, 59, 368–374. [CrossRef]
103. Wiersema, R.; Jukarainen, S.; Vaara, S.T.; Poukkanen, M.; Lakkisto, P.; Wong, H.; Linder, A.; van der Horst, I.C.C.; Pettila, V. Two subphenotypes of septic acute kidney injury are associated withdifferent 90-day mortality and renal recovery. Crit. Care 2020, 24, 150. [CrossRef]
104. Thau, M.R.; Bhatraju, P.K. Sub-Phenotypes of Acute Kidney Injury: Do We Have Progress forPersonalizing Care? Nephron 2020,144, 677–679. [CrossRef]
105. Luo, X.Q.; Yan, P.; Zhang, N.Y.; Luo, B.; Wang, M.; Deng, Y.H.; Wu, T.; Wu, X.; Liu, Q.;Wang, H.S.; et al. Machine learning for early discrimination between transient and persistent acutekidney injury in critically ill patients with sepsis. Sci. Rep. 2021, 11, 20269. [CrossRef] [PubMed]
106. Ozrazgat-Baslanti, T.; Loftus, T.J.; Mohandas, R.; Wu, Q.; Brakenridge, S.; Brumback, B.; Efron, P.A.; Anton, S.; Moore, F.A.; Moldawer, L.L.; et al. Clinical Trajectories of Acute Kidney Injury in Surgical Sepsis: A Prospective Observational Study. Ann. Surg. 2022, 275, 1184–1193. [CrossRef]
107. Chen, X.; Li, J.; Liu, G.; Chen, X.; Huang, S.; Li, H.; Liu, S.; Li, D.; Yang, H.; Zheng, H.; et al.Identification of Distinct Clinical Phenotypes of Heterogeneous Mechanically Ventilated ICU Patients Using Cluster Analysis. J. Clin. Med. 2023, 12, 1499. [CrossRef] [PubMed]
108. Su, L.; Zhang, Z.; Zheng, F.; Pan, P.; Hong, N.; Liu, C.; He, J.; Zhu, W.; Long, Y.; Liu, D. Five novel clinical phenotypes for critically ill patients with mechanical ventilation in intensive care units: A retrospective and multi database study. Respir. Res. 2020, 21, 325. [CrossRef]
109. Yu, S.; Ma, X.; Li, X. Phenotype-oriented anticoagulant therapy for sepsis: Still a work in progress. Int. J. Hematol. 2022, 116, 48–54. [CrossRef] [PubMed]
110. Kudo, D.; Goto, T.; Uchimido, R.; Hayakawa, M.; Yamakawa, K.; Abe, T.; Shiraishi, A.; Kushimoto, S. Coagulation phenotypes in sepsis and effects of recombinant human thrombomodulin: An analysis of three multicentre observational studies. Crit. Care 2021, 25, 114. [CrossRef]
111. Helms, J.; Iba, T.; Connors, J.M.; Gando, S.; Levi, M.; Meziani, F.; Levy, J.H. How to managecoagulopathies in critically ill patients.
Intensive Care Med. 2023, 49, 273–290. [CrossRef]
112. Guo, F.; Zhu, X.; Wu, Z.; Zhu, L.; Wu, J.; Zhang, F. Clinical applications of machine learning in the survival prediction and classification of sepsis: Coagulation and heparin usage matter. J. Transl.Med. 2022, 20, 265. [CrossRef]
113. Dong, M.; Chen, S.; Lin, S.; Han, F.; Zhong, M. Insights into COVID-19-associated criticalillness: A narrative review. Ann. Transl. Med. 2023, 11, 220. [CrossRef]
114. Dubowski, K.; Braganza, G.T.; Bozack, A.; Colicino, E.; DeFelice, N.; McGuinn, L.; Maru, D.;Lee, A.G. COVID-19 subphenotypes at hospital admission are associated with mortality: A cross-sectional study. Ann. Med. 2023, 55, 12–23. [CrossRef] [PubMed]
115. Oh, W.; Jayaraman, P.; Sawant, A.S.; Chan, L.; Levin, M.A.; Charney, A.W.; Kovatch, P.; Glicksberg, B.S.; Nadkarni, G.N. Using sequence clustering to identify clinically relevantsubphenotypes in patients with COVID-19 admitted to the intensive care unit.J. Am. Med. Inform.Assoc. 2022, 29, 489–499. [CrossRef] [PubMed]
116. Fish, M.; Rynne, J.; Jennings, A.; Lam, C.; Lamikanra, A.A.; Ratcliff, J.; Cellone-Trevelin, S.; Timms, E.; Jiriha, J.; Tosi, I.; et al. Coronavirus disease 2019 subphenotypes and differential treatment response to convalescent plasma in critically ill adults: Secondary analyses of a randomized clinicaltrial. Intensive Care Med. 2022, 48, 1525–1538. [CrossRef] [PubMed]
117. Bruse, N.; Kooistra, E.J.; Jansen, A.; van Amstel, R.B.E.; de Keizer, N.F.; Kennedy, J.N.; Seymour, C.; van Vught, L.A.; Pickkers, P.; Kox, M. Clinical sepsis phenotypes in critically illCOVID-19 patients. Crit. Care 2022, 26, 244. [CrossRef]
118. de Prost, N.; Audureau, E.; Heming, N.; Gault, E.; Pham, T.; Chaghouri, A.; de Montmollin, N.; Voiriot, G.; Morand-Joubert, L.; Joseph, A.; et al. Clinical phenotypes and outcomes associated withSARS-CoV-2 variant Omicron in critically ill French patients with COVID-19. Nat. Commun. 2022,13, 6025. [CrossRef]
119. Morales Chacon, L.M.; Galan Garcia, L.; Cruz Hernandez, T.M.; Pavon Fuentes, N.; MaragotoRizo, C.; Morales Suarez, I.; Morales Chacon, O.; Abad Molina, E.; Rocha Arrieta, L. Clinical Phenotypes and Mortality Biomarkers: A Study Focused on COVID-19 Patients with NeurologicalDiseases in Intensive Care Units. Behav. Sci. 2022, 12, 234. [CrossRef]
120. Wang, X.; Jehi, L.; Ji, X.; Mazzone, P.J. Phenotypes and Subphenotypes of Patients with COVID-19: A Latent Class Modeling Analysis. Chest 2021, 159, 2191–2204. [CrossRef]
121. Bos, L.D.J.; Sjoding, M.; Sinha, P.; Bhavani, S.V.; Lyons, P.G.; Bewley, A.F.; Botta, M.; Tsonas, A.M.; Serpa Neto, A.; Schultz, M.J.; et al. Longitudinal respiratory subphenotypes in patients with COVID-19-related acute respiratory distress syndrome: Results from three observationalcohorts. Lancet Respir. Med. 2021, 9, 1377–1386. [CrossRef]
122. Su, C.; Xu, Z.; Hoffman, K.; Goyal, P.; Safford, M.M.; Lee, J.; Alvarez-Mulett, S.; Gomez-Escobar, L.; Price, D.R.; Harrington, J.S.; et al. Identifying organ dysfunction trajectory-based subphenotypes in critically ill patients with COVID-19. Sci. Rep. 2021, 11, 15872. [CrossRef]
123. Ranjeva, S.; Pinciroli, R.; Hodell, E.; Mueller, A.; Hardin, C.C.; Thompson, B.T.; Berra, L. Identifying clinical and biochemical phenotypes in acute respiratory distress syndrome secondary to coronavirus disease-2019. eClinicalMedicine 2021, 34, 100829. [CrossRef]
124. Vasquez, C.R.; Gupta, S.; Miano, T.A.; Roche, M.; Hsu, J.; Yang, W.; Holena, D.N.; Reilly, J.P.; Schrauben, S.J.; Leaf, D.E.; et al. Identification of Distinct Clinical Subphenotypes in Critically IllPatients with COVID-19. Chest 2021, 160, 929–943. [CrossRef]
125. Gutierrez-Gutierrez, B.; Del Toro, M.D.; Borobia, A.M.; Carcas, A.; Jarrin, I.; Yllescas, M.; Ryan, P.; Pachon, J.; Carratala, J.; Berenguer, J.; et al. Identification and validation of clinical phenotypes with prognostic implications in patients admitted to hospital with COVID-19: A multicentre cohortstudy. Lancet Infect. Dis. 2021, 21, 783–792. [CrossRef] [PubMed]
126. Chen, H.; Zhu, Z.; Su, N.; Wang, J.; Gu, J.; Lu, S.; Zhang, L.; Chen, X.; Xu, L.; Shao, X.; et al. Identification and Prediction of Novel Clinical Phenotypes for Intensive Care Patients with SARS-CoV-2 Pneumonia: An Observational Cohort Study. Front. Med. 2021, 8, 681336. [CrossRef][PubMed]
127. Osuchowski, M.F.; Rosengart, M.R. Change Is the Only Constant: How to Adopt the New Trends in Sepsis Modeling? Crit. Care Med. 2019, 47, 1673–1675. [CrossRef] [PubMed]
128. Sinha, P.; Calfee, C.S.; Cherian, S.; Brealey, D.; Cutler, S.; King, C.; Killick, C.; Richards, O.; Cheema, Y.; Bailey, C.; et al. Prevalence of phenotypes of acute respiratory distress syndrome in critically ill patients with COVID-19: A prospective observational study. Lancet Respir. Med. 2020, 8,1209–1218. [CrossRef]
129. Blanchard, F.; James, A.; Assefi, M.; Kapandji, N.; Constantin, J.M. Personalized medicine targeting different ARDS phenotypes: The future of pharmacotherapy for ARDS? Expert. Rev. Respir.Med. 2023, 17, 41–52. [CrossRef]
130. Sinha, P.; Meyer, N.J.; Calfee, C.S. Biological Phenotyping in Sepsis and Acute Respiratory Distress Syndrome. Annu. Rev. Med.
2023, 74, 457–471. [CrossRef]
131. Maddali, M.V.; Churpek, M.; Pham, T.; Rezoagli, E.; Zhuo, H.; Zhao, W.; He, J.; Delucchi, K.L.; Wang, C.; Wickersham, N.; et al. Validation and utility of ARDS subphenotypes identified by machine-learning models using clinical data: An observational, multicohort, retrospective analysis.Lancet Respir. Med. 2022, 10, 367–377. [CrossRef]
132. Bai, Y.; Xia, J.; Huang, X.; Chen, S.; Zhan, Q. Using machine learning for the early prediction of sepsis-associated ARDS in the ICU and identification of clinical phenotypes with differentialresponses to treatment. Front. Physiol. 2022, 13, 1050849. [CrossRef]
133. Hashem, M.D.; Hopkins, R.O.; Colantuoni, E.; Dinglas, V.D.; Sinha, P.; Aronson Friedman, L.; Morris, P.E.; Jackson, J.C.; Hough, C.L.; Calfee, C.S.; et al. Six-month and 12-month patient outcomes based on inflammatory subphenotypes in sepsis-associated ARDS: Secondary analysis of SAILS-ALTOS trial. Thorax 2022, 77, 22–30. [CrossRef]
134. Zhang, H.; Li, Z.; Zheng, W.; Zhang, L.; Yang, T.; Xie, K.; Yu, Y. Risk stratification of patients with acute respiratory distress syndrome complicated with sepsis using lactate trajectories. BMC Pulm. Med. 2022, 22, 339. [CrossRef] [PubMed]
135. Wu, L.; Lei, Q.; Gao, Z.; Zhang, W. Research Progress on Phenotypic Classification of Acute Respiratory Distress Syndrome: A Narrative Review. Int. J. Gen. Med. 2022, 15, 8767–8774.[CrossRef]
136. Alipanah, N.; Calfee, C.S. Phenotyping in acute respiratory distress syndrome: State of the art and clinical implications. Curr. Opin. Crit. Care 2022, 28, 1–8. [CrossRef] [PubMed]
137. Martin, T.R.; Zemans, R.L.; Ware, L.B.; Schmidt, E.P.; Riches, D.W.H.; Bastarache, L.; Calfee, C.S.; Desai, T.J.; Herold, S.; Hough, C.L.; et al. New Insights into Clinical and Mechanistic Heterogeneity of the Acute Respiratory Distress Syndrome: Summary of the Aspen Lung Conference2021. Am. J. Respir. Cell Mol. Biol. 2022, 67, 284–308. [CrossRef] [PubMed]
138. Chen, H.; Yu, Q.; Xie, J.; Liu, S.; Pan, C.; Liu, L.; Huang, Y.; Guo, F.; Qiu, H.; Yang, Y. Longitudinal phenotypes in patients with acute respiratory distress syndrome: A multi-database study.Crit. Care 2022, 26, 340. [CrossRef]
139. Duggal, A.; Kast, R.; Van Ark, E.; Bulgarelli, L.; Siuba, M.T.; Osborn, J.; Rey, D.A.; Zampieri, F.G.; Cavalcanti, A.B.; Maia, I.; et al. Identification of acute respiratory distress syndromesubphenotypes de novo using routine clinical data: A retrospective analysis of ARDS clinical trials.BMJ Open 2022, 12, e053297. [CrossRef]
140. Whebell, S.; Zhang, J. Bringing biological ARDS phenotypes to the bedside with machine-learning-based classifiers. Lancet Respir.Med. 2022, 10, 319–320. [CrossRef]
141. Bos, L.D.J.; Ware, L.B. Acute respiratory distress syndrome: Causes, pathophysiology, and phenotypes. Lancet 2022, 400, 1145–1156. [CrossRef]
142. Wendel Garcia, P.D.; Caccioppola, A.; Coppola, S.; Pozzi, T.; Ciabattoni, A.; Cenci, S.; Chiumello, D. Latent class analysis to predict intensive care outcomes in Acute Respiratory DistressSyndrome: A proposal of two pulmonary phenotypes. Crit. Care 2021, 25, 154. [CrossRef]
143. Sinha, P.; Furfaro, D.; Cummings, M.J.; Abrams, D.; Delucchi, K.; Maddali, M.V.; He, J.; Thompson, A.; Murn, M.; Fountain, J.; et al. Latent Class Analysis Reveals COVID-19-related Acute Respiratory Distress Syndrome Subgroups with Differential Responses to Corticosteroids. Am. J.Respir. Crit. Care Med. 2021, 204, 1274–1285. [CrossRef]
144. Sathe, N.A.; Zelnick, L.R.; Mikacenic, C.; Morrell, E.D.; Bhatraju, P.K.; McNeil, J.B.; Kosamo,S.; Hough, C.L.; Liles, W.C.; Ware, L.B.; et al. Identification of persistent and resolvingsubphenotypes of acute hypoxemic respiratory failure in two independent cohorts. Crit. Care 2021, 25,336. [CrossRef]
145. Liu, X.; Jiang, Y.; Jia, X.; Ma, X.; Han, C.; Guo, N.; Peng, Y.; Liu, H.; Ju, Y.; Luo, X.; et al.Identification of distinct clinical phenotypes of acute respiratory distress syndrome with differentialresponses to treatment. Crit. Care 2021, 25, 320. [CrossRef]
146. Millar, J.E.; Wildi, K.; Bartnikowski, N.; Bouquet, M.; Hyslop, K.; Passmore, M.R.; Ki, K.K.; See Hoe, L.E.; Obonyo, N.G.; Neyton, L.; et al. Characterizing preclinical sub-phenotypic models of acute respiratory distress syndrome: An experimental ovine study. Physiol. Rep. 2021, 9, e15048. [CrossRef][PubMed]
147. Heijnen, N.F.L.; Hagens, L.A.; Smit, M.R.; Cremer, O.L.; Ong, D.S.Y.; van der Poll, T.; vanVught, L.A.; Scicluna, B.P.; Schnabel, R.M.; van der Horst, I.C.C.; et al. Biological Subphenotypes of Acute Respiratory Distress Syndrome Show Prognostic Enrichment in Mechanically Ventilated Patients without Acute Respiratory Distress Syndrome. Am. J. Respir. Crit. Care Med. 2021, 203,1503–1511. [CrossRef] [PubMed]
148. Matthay, M.A.; Arabi, Y.M.; Siegel, E.R.; Ware, L.B.; Bos, L.D.J.; Sinha, P.; Beitler, J.R.;Wick, K.D.; Curley, M.A.Q.; Constantin, J.M.; et al. Phenotypes and personalized medicine in the acute respiratory distress syndrome. Intensive Care Med. 2020, 46, 2136–2152. [CrossRef]
149. McNicholas, B.; Madden, M.G.; Laffey, J.G. Machine Learning Classifier Models: The Future for Acute Respiratory Distress Syndrome Phenotyping? Am. J. Respir. Crit. Care Med. 2020, 202, 919–920. [CrossRef]
150. Sinha, P.; Churpek, M.M.; Calfee, C.S. Machine Learning Classifier Models Can Identify Acute Respiratory Distress Syndrome Phenotypes Using Readily Available Clinical Data. Am. J. Respir. Crit.Care Med. 2020, 202, 996–1004. [CrossRef]
151. Sinha, P.; Delucchi, K.L.; McAuley, D.F.; O’Kane, C.M.; Matthay, M.A.; Calfee, C.S. Development and validation of parsimonious algorithms to classify acute respiratory distress syndrome phenotypes: A secondary analysis of randomised controlled trials. Lancet Respir. Med.2020, 8, 247–257. [CrossRef] [PubMed]
152. Sinha, P.; Delucchi, K.L.; Thompson, B.T.; McAuley, D.F.; Matthay, M.A.; Calfee, C.S.; Network, N.A. Latent class analysis of ARDS subphenotypes: A secondary analysis of the statins for acutely injured lungs from sepsis (SAILS) study. Intensive Care Med. 2018, 44, 1859–1869.[CrossRef]
153. Levine, A.R.; Shanholtz, C.B. I, DOCTOR: The role of machine learning in phenotyping ARDS.eBioMedicine 2022, 75, 103770.[CrossRef]
154. Hu, W.; Chen, H.; Wang, H.; Peng, Q.; Wang, J.; Huang, W.; Liu, A.; Xu, J.; Li, Q.; Pan, C.; et al. Identifying high-risk phenotypes and associated harms of delayed time-to-antibiotics in patients with ICU onset sepsis: A retrospective cohort study. J. Crit. Care 2023, 74, 154221. [CrossRef] [PubMed]
155. Han, X.; Spicer, A.; Carey, K.A.; Gilbert, E.R.; Laiteerapong, N.; Shah, N.S.; Winslow, C.; Afshar,M.; Kashiouris, M.G.; Churpek,M.M. Identifying High-Risk Subphenotypes and Associated HarmsFrom Delayed Antibiotic Orders and Delivery. Crit. Care Med.2021, 49, 1694–1705. [CrossRef]
156. Qi, J.; Lei, J.; Li, N.; Huang, D.; Liu, H.; Zhou, K.; Dai, Z.; Sun, C. Machine learning modelsto predict in-hospital mortality in septic patients with diabetes. Front. Endocrinol. 2022, 13, 1034251.[CrossRef] [PubMed]
157. Bao, C.; Deng, F.; Zhao, S. Machine-learning models for prediction of sepsis patients mortality. Med. Intensiva 2022, 47, 315–325. [CrossRef]
158. Yu, H.; Zhang, H.; Lang, Y.; Li, S.; Wan, X. Identifying the Phenotypes of Sepsis that will Benefitfrom Red Blood Cell Transfusion Using Unsupervised Cluster Analysis. Clin. Lab. 2022, 68, 210619.[CrossRef] [PubMed]
159. Liu, R.; Greenstein, J.L.; Granite, S.J.; Fackler, J.C.; Bembea, M.M.; Sarma, S.V.; Winslow, R.L. Data-driven discovery of a novel sepsis pre-shock state predicts impending septic shock in the ICU.Sci. Rep. 2019, 9, 6145. [CrossRef]
160. Carcillo, J.A.; Halstead, E.S.; Hall, M.W.; Nguyen, T.C.; Reeder, R.; Aneja, R.; Shakoory, B.; Simon, D.; on behalf of the Eunice Kennedy Shriver National Institute of Child Health and Human Development Collaborative Pediatric Critical Care Research Network investigators. Three Hypothetical Inflammation Pathobiology Phenotypes and Pediatric Sepsis-Induced Multiple OrganFailure Outcome. Pediatr. Crit. Care Med. 2017, 18, 513–523. [CrossRef]
161. Carcillo, J.A.; Berg, R.A.; Wessel, D.; Pollack, M.; Meert, K.; Hall, M.; Newth, C.; Lin, J.C.; Doctor, A.; Shanley, T.; et al. A Multicenter Network Assessment of Three Inflammation Phenotypes in Pediatric Sepsis-Induced Multiple Organ Failure. Pediatr. Crit. Care Med. 2019, 20, 1137–1146.[CrossRef]
162. Stroup, E.K.; Luo, Y.; Sanchez-Pinto, L.N. Phenotyping Multiple Organ Dysfunction Syndrome Using Temporal Trends in Critically Ill Children. In Proceedings of the 2019 IEEE International Conference on Bioinformatics and Biomedicine (BIBM), San Diego, CA, USA, 18–21 November2019; pp. 968–972. [CrossRef]
163. Sanchez-Pinto, L.N.; Stroup, E.K.; Pendergrast, T.; Pinto, N.; Luo, Y. Derivation and Validation of Novel Phenotypes of Multiple Organ Dysfunction Syndrome in Critically Ill Children. JAMA Netw.Open 2020, 3, e209271. [CrossRef]
164. Atreya, M.R.; Sanchez-Pinto, L.N.; Kamaleswaran, R. Commentary: ‘Critical illness subclasses:All roads lead to Rome’. Crit. Care2022, 26, 387. [CrossRef]
165. Dahmer, M.K.; Yang, G.; Zhang, M.; Quasney, M.W.; Sapru, A.; Weeks, H.M.; Sinha, P.;Curley, M.A.Q.; Delucchi, K.L.; Calfee, C.S.; et al. Identification of phenotypes in paediatric patients with acute respiratory distress syndrome: A latent class analysis. Lancet Respir. Med. 2022, 10, 289–297. [CrossRef] [PubMed]
166. Wong, H.R.; Sweeney, T.E.; Hart, K.W.; Khatri, P.; Lindsell, C.J. Pediatric Sepsis EndotypesAmong Adults with Sepsis. Crit. Care
Med. 2017, 45, e1289–e1291. [CrossRef] [PubMed]
167. Qin, Y.; Kernan, K.F.; Fan, Z.; Park, H.J.; Kim, S.; Canna, S.W.; Kellum, J.A.; Berg, R.A.; Wessel, D.; Pollack, M.M.; et al. Machine learning derivation of four computable 24-h pediatricsepsis phenotypes to facilitate enrollment in early personalized anti-inflammatory clinical trials. Crit.Care 2022, 26, 128. [CrossRef] [PubMed]
168. Wong, H.R. Searching for a Pediatric Severe Sepsis Phenotype: We Might Indeed Be There.Pediatr. Crit. Care Med. 2017, 18,
502–503. [CrossRef] [PubMed]
169. Workman, J.K.; Larsen, G.Y. Searching for a Pediatric Severe Sepsis Phenotype: Are We ThereYet? Pediatr. Crit. Care Med. 2017,
18, 82–83. [CrossRef]
170. Jacobs, L.; Wong, H.R. Sepsis Subclasses: Be Careful of What You Wish for. Pediatr. Crit. CareMed. 2017, 18, 591–592. [CrossRef]
171. Martin, B.; Bennett, T.D. Sepsis Computable Phenotypes in the Service of Observational Research. Crit. Care Med. 2019, 47, 303–305. [CrossRef]
172. Koutroulis, I.; Velez, T.; Wang, T.; Yohannes, S.; Galarraga, J.E.; Morales, J.A.; Freishtat, R.J.; Chamberlain, J.M. Pediatric sepsis phenotypes for enhanced therapeutics: An application of clusteringto electronic health records. J. Am. Coll. Emerg. Physicians Open 2022, 3, e12660. [CrossRef]
173. Mehta, S.; Gill, S.E. Improving clinical outcomes in sepsis and multiple organ dysfunction throughprecision medicine. J. Thorac. Dis. 2019, 11, 21–28. [CrossRef]
174. Maslove, D.M.; Lamontagne, F.; Marshall, J.C.; Heyland, D.K. A path to precision in the ICU.Crit. Care 2017, 21, 79. [CrossRef]
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 13.12.2023
[ACTIVE_FROM] => 13.12.2023
[SHOW_COUNTER] => 1034
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2017-07-31 16:04:44
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829247
[VALUE] => Сепсис, фенотипы, критические состояния
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Сепсис, фенотипы, критические состояния
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2017-08-02 11:16:15
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829249
[VALUE] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2017-08-02 11:18:27
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829248
[VALUE] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829283
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2017-09-15 12:05:50
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2017-09-19 10:40:01
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2017-08-22 15:43:39
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829255
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2017-08-22 16:30:23
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2017-08-23 10:51:22
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2017-08-23 11:05:12
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829251
[1] => 829252
[2] => 829253
[3] => 829254
)
[VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => kriticheskiesostoyaniya
[3] => intensivnayaterapiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => kriticheskiesostoyaniya
[3] => intensivnayaterapiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2017-10-12 14:43:36
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2018-05-11 11:01:14
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829283
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829255
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829251
[1] => 829252
[2] => 829253
[3] => 829254
)
[VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => kriticheskiesostoyaniya
[3] => intensivnayaterapiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => kriticheskiesostoyaniya
[3] => intensivnayaterapiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Сепсис
[2] => Критические состояния
[3] => Интенсивная терапия
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 26.08.2022 14:38:28
[~TIMESTAMP_X] => 26.08.2022 14:38:28
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
[BROWSER_TITLE] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
[KEYWORDS] => Сепсис, фенотипы, критические состояния
[DESCRIPTION] => Клинические фенотипы сепсиса у пациентов в критическом состоянии
)
)

