Array
(
[NAME] => Современное ведение массивных кровотечений в реанимации
[~NAME] => Современное ведение массивных кровотечений в реанимации
[PREVIEW_PICTURE] => Array
(
[ID] => 5641
[TIMESTAMP_X] => 20.05.2024 12:46:46
[MODULE_ID] => iblock
[HEIGHT] => 5000
[WIDTH] => 5000
[FILE_SIZE] => 11937981
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/885/k77uu54of1uuaf7i6fta0g6sgppyjz1i
[FILE_NAME] => 3d-render-medical-background-with-blood-cells.jpg
[ORIGINAL_NAME] => 3d-render-medical-background-with-blood-cells.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => c7bca0173a9907c6487a2a7db5479635
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/885/k77uu54of1uuaf7i6fta0g6sgppyjz1i/3d-render-medical-background-with-blood-cells.jpg
[UNSAFE_SRC] => /upload/iblock/885/k77uu54of1uuaf7i6fta0g6sgppyjz1i/3d-render-medical-background-with-blood-cells.jpg
[SAFE_SRC] => /upload/iblock/885/k77uu54of1uuaf7i6fta0g6sgppyjz1i/3d-render-medical-background-with-blood-cells.jpg
[ALT] => Современное ведение массивных кровотечений в реанимации
[TITLE] => Современное ведение массивных кровотечений в реанимации
)
[~PREVIEW_PICTURE] => 5641
[DETAIL_TEXT] =>
Cheryl L. Maier, Karim Broh2, Nicola Curry, Nicole P. Juffermans, Lidia Mora Miquel, Matthew D. Neal,Beth H. Shaz, Alexander P. J. Vlaar and Julie Helms
REVIEW Contemporary management of major haemorrhage in critical care
Intensive Care Med (2024) 50:319–331
https://doi.org/10.1007/s00134-023-07303-5
Абстракт
Геморрагический шок часто встречается в отделениях интенсивной терапии и является причиной высокого уровня смертности из-за полиорганной дисфункции и коагулопатии. Лечение больных к критическом состоянии с кровотечением и шоком является сложным . Введение больших объемов компонентов крови приводит к серьезным физиологическим изменениям, которые необходимо коррелировать во время и после кровотечения. Раннее распознавание кровотечения и коагулопатии, понимание основной патофизиологии, связанной с конкретными патологическими состояниями, а также разработка индивидуальных протоколов лечения важны для достижения оптимальных результатов. В обзоре описаны современные представления о патофизиологии различных типов коагулопатических кровотечений; диагностика и ведение больных с кровотечением в критическом состоянии, включая протоколы лечения массивных кровотечений и ведение пациентов после переливания крови; и, наконец, освещает недавние области возможностей, позволяющие лучше понять оптимальные стратегии лечения кровотечений в отделениях интенсивной терапии (ОИТ).
Ключевые слова: массивное переливание крови, кровотечение, критическое состояние, кровотечение, коагулопатия.
Введение
Массивные кровотечения встречаются в ОИТ с частотой от 5 до более 50%, и по-прежнему связаны с высокой смертностью [1-3]. Оценка точной частоты крупных кровотечений в различных популяциях пациентов была сложной задачей, по крайней мере частично, из-за различий в критериях, используемых для их определения. Международное общество по тромбозам и гемостазу (ISTH) определяет большое кровотечение как симптоматическое кровотечение в критичной зоне или органе и/или кровотечение, которое вызывает падение гемоглобина на ≥ 2 г/дл или приводит к переливанию ≥ 2 единиц цельной крови или эритроцитов [4].
Кровотечение и геморрагический шок приводят к развитию нарушений гемостаза и коагулопатии, которые могут усугубляться или осложняться сопутствующими или основными заболеваниями, присутствующими у пациентов в критическом состоянии. Ведение этих пациентов сложное, и стратегии по остановке или уменьшению кровотечения должны быть быстрыми и окончательными.Кроме того, введение больших объемов компонентов крови, которые могут быть сбалансированы или не сбалансированы по количеству переливаемых эритроцитов, тромбоцитов и продуктов плазмы, может привести к серьезным физиологическим изменениям, которые необходимо коррелировать во время и после кровотечения. Раннее распознавание кровотечения и коагулопатии, понимание патофизиологии конкретных патологических состояний и эффективное индивидуальное лечение важны для обеспечения оптимальных результатов.
Общая цель этого обзора — описать современное понимание патофизиологии, диагностики и ведения пациентов с массивным кровотечением в условиях ОИТ. Сначала мы рассмотрим патофизиологию различных типов коагулопатических кровотечений, обычно встречающихся при критических заболеваниях, в том числе у пациентов с травмами, послеродовыми кровотечениями, хроническими заболеваниями печени, диссеминированным внутрисосудистым свертыванием крови и уремией. Далее мы обсудим диагностику и обследование пациентов в критическом состоянии с коагулопатическим кровотечением, а затем опишем основные протоколы лечения кровотечений, актуальные для пациентов с массивными кровотечениями. Учитывая уникальные подходы, необходимые пациентам после массивного кровотечения, мы резюмируем посттрансфузионное лечение, включая поддержку кровообращения и профилактику тромбоэмболических осложнений.Наконец, мы выделяем дополнительные соображения и области возможностей для лучшего определения оптимальных стратегий управления кровотечениями в ОИТ.
Патофизиология геморрагических коагулопатий
Различные патологические процессы, приводящие к кровотечению, приводят к различным моделям коагулопатии, которые необходимо понимать для обеспечения оптимального лечения. Несмотря на то, что существуют области дублирования, и может быть привлекательно упростить ведение лечения с помощью единого протокола массивного кровотечения (MHP), необходимо учитывать критические различия, чтобы гарантировать достижение гемостаза без немедленных или отдаленных осложнений.
Кровотечение, связанное с травмой
Наибольшему риску развития тяжелого кровотечения подвергаются пациенты с более высокой тяжестью травмы и лица с гиповолемическим шоком [5]. Множественные нарушения коагуляции, которые могут привести к травматической коагулопатии (TIC ), способствуют неэффективному гемостазу на раннем этапе после травмы. Центральными признаками TIC являются усиление фибринолиза, активация пути протеина С, дисфункция тромбоцитов и потребление факторов свертывания крови. Они сопровождаются активацией эндотелия с увеличением проницаемости сосудов микроциркуляторного русла и потерей эндотелиального гликокаликса. Гиперфибринолиз является одним из наиболее частых изменений после тяжелой травмы и может сопровождать даже легкую или умеренную травму [6]. Усиление фибринолиза, вероятно, опосредовано повышенной активностью плазмина в результате высокого уровня тканевого активатора плазминогена (tPA), высвобождающегося активированными эндотелиальными клетками. Уровни фибриногена падают до критически низкого уровня на ранних стадиях кровотечения, связанного с травмой, что является следствием усиленного распада фибриногена (фибриногенолиза), широкого потребления фибриногена и дилюционным эффектом инфузионной терапии [7].
Гипофибриногенемия также может отражать или усугубляться низким запасом фибриногена.Считается, что высокие уровни активированного протеина С (APC) являются одним из центральных эффекторов раннего гипокоагуляционного состояния. APC вызывает ингибирование FVa и FVIIIa, уменьшая образование тромбина, а также связывается с ингибитором активатора плазминогена-1, предотвращая его ингибирующее действие на t-PA и тем самым позволяя бесконтрольно продолжать фибринолиз. Дисфункция тромбоцитов проявляется глобальным снижением агрегации, часто описываемым как «истощение тромбоцитов», что усугубляет состояние гипокоагуляции. Механизмы дисфункции тромбоцитов до конца не изучены, хотя недавние данные указывают на нарушение мобилизации кальция, изменения GpVI или прямую атаку высвобождаемых при повреждении гистонов. Прямая травма, шок, выброс катехоламинов и гипоксия способствуют активации эндотелия, тогда как считается, что изменения в реологии крови лежат в основе разрушения эндотелиального гликокаликса.
Послеродовое кровотечение
Коагулопатия, связанная с послеродовым кровотечением (PPH ), еще не изучена так подробно, как TIC . Большинство случаев РРН не связано с коагулопатией, хотя кровотечение большого объема (т.е. более 3 л) связано с дилюционной коагулопатией или коагулопатией потребления. «Острая акушерская коагулопатия» — похожая на сложную многофакторную коагулопатию, наблюдаемую при TIC и характеризующуюся массивным фибринолизом, — встречается гораздо реже [8] и встречается в 1,06 случаев на 1000 беременностей. Беременность ассоциируется со значительным повышением уровня циркулирующего фибриногена, а уровень фибриногена ниже 2 г/л в начале РРН тесно связан с большей потребностью в переливании большого объема крови [9]. (Table 1). Две явные клинические ситуации, при которых возникает острая акушерская коагулопатия, включают эмболию околоплодными водами и отслойку плаценты. Острая акушерская коагулопатия имеет общие черты с TIC : она проявляется глубоким и быстрым снижением уровня фибриногена и выраженным гиперфибринолизом [8]. У этих рожениц также выявляют дисфибриногенемию, что не является подтвержденным признаком TIC. Таким образом, измерение фибриногена и адекватная его замена имеют решающее значение при оказании помощи таким пациенткам.
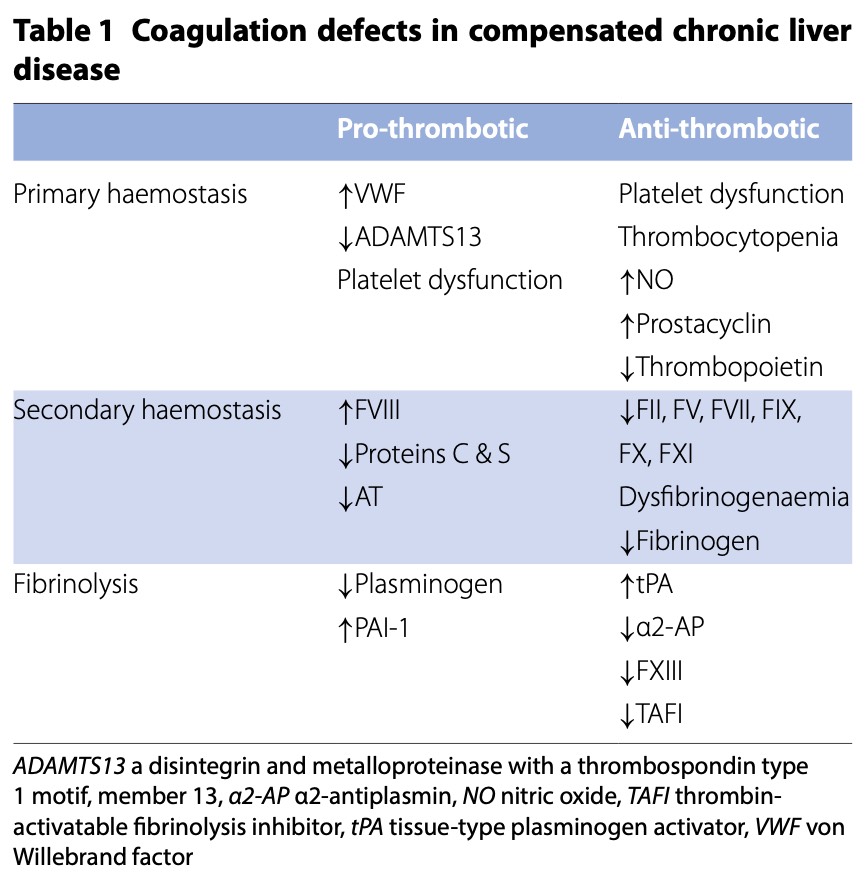
Хроническое заболевание печени
Примерно у каждого восьмого пациента с хроническим заболеванием печени (CLD ), находящегося на лечении в ОИТ, развивается значительное кровотечение по определению ISTH [10]. Три четверти случаев представляют собой желудочно-кишечные кровотечения [11], и более чем в 90% этих случаев основной причиной является портальная гипертензия. CLD связано с дефицитом факторов свертывания крови, дисфункцией тромбоцитов и гиперфибринолизом [12] (Table 1). Однако в этих системах также происходят прогемостатические изменения, которые уравновешивают эти гипокоагуляционные тенденции. Хотя рутинные лабораторные тесты обычно показывают тромбоцитопению, а также удлинение протромбинового времени (РТ), пациенты с компенсированным CLD не подвергаются большему риску кровотечения и не защищены от тромбоза. Однако пациенты имеют сниженный резерв свертывания крови и малоустойчивы к ряду заболеваний и травмам. В случае декомпенсации или развития инфекции, пациенты подвергаются риску как кровотечения, так и тромбоза [12].
Несмотря на сложность нарушений коагуляции при CLD , наиболее частой причиной острого кровотечения является кровотечение из варикозных вен, и для успешного лечения приоритет отдается методам, направленным на снижение портального давления, а не на инфузионную терапию в больших объемах и коррекцию выраженных функциональных нарушений коагуляции [13].
Диссеминированная внутрисосудистая коагулопатия
Диссеминированная внутрисосудистая коагулопатия (ДВС) — это приобретенное состояние, которое всегда является вторичным по отношению к основному состоянию, чаще всего сепсису, но также и другим заболеваниям, таким как злокачественные новообразования, травмы или акушерские осложнения. ДВС-синдром характеризуется системной активацией коагуляции, что приводит к распространенному образованию внутрисосудистых тромбов, богатых фибрином, вызывающих окклюзию сосудов малого и среднего калибра и последующую органную дисфункцию [14]. Сложная патофизиология ДВС-синдрома может приводить к тромбозам, кровотечениям или смешанным фенотипам [14, 15]. Помимо истощения тромбоцитов и факторов свертывания крови, уровень физиологических антикоагулянтов, таких как антитромбин и протеин С снижается из-за потребления и экстравазации вследствие повышенной проницаемости микрососудов. Значительно повышенный уровень продуктов деградации фибрина и системное воспаление вызывают дисфункцию тромбоцитов и препятствуют сшиванию фибрина, что еще больше способствует кровотечению. У пациентов с ДВС-синдромом может развиться массивное кровотечение, в зависимости от его фенотипа [14]; следовательно, лечение ДВС-синдрома зависит от его фенотипа и основного заболевания.
Уремия
Уремическое кровотечение является общепризнанным осложнением у пациентов с хронической почечной недостаточностью [16]. К сожалению, несмотря на то, что это относительно распространенная причина кровотечений, о механизме, лежащем в его основе, мало что известно.Дисфункция тромбоцитов, по-видимому, является доминирующим отклонением. Считается, что это является следствием множественных изменений, в том числе дисфункции фактора фон Виллебранда. (снижение способности связываться с гликопротеином тромбоцитов GP1b), что уменьшает привязку тромбоцитов к местам повреждения сосудов и сложных изменениях в ключевых сигнальных путях агонистов тромбоцитов [17]. Последнее включает снижение продукции тромбоксана, повышение уровня простациклина I2, повышение уровня циклического AMP/GMP , повышение уровня уремических токсинов и изменение гранул тромбоцитов, все из которых необходимы для нормальной агрегации тромбоцитов. Следовательно, переливание тромбоцитов в такие условиях не устраняет дисфункцию тромбоцитов.
Приобретенная коагулопатия, вторичная по отношению к антикоагулянтам
Многие пациенты в критическом состоянии получают антикоагулянты либо в качестве тромбопрофилактики, либо в качестве антикоагулянтной терапии, связанной с острым или основным заболеванием. Кровотечение может быть основной причиной госпитализации в ОИТ или может развиться во время пребывания там. Многоцентровое ретроспективное французское исследование показало, что частота пациентов, поступивших в ОИТ по поводу тяжелых экстракраниальных кровотечений, связанных с приемом антикоагулянтов, увеличилась с 3,2 на 1000 госпитализаций в 2007 году до 5,8/1000 в 2018 г., при этом уровень смертности составил 27% [18]. В этой когорте пациенты до госпитализации принимали антагонисты витамина К (VKA , 54%), гепарины (25%) или пероральные антикоагулянты прямого действия (DOAC, 7%). Экстракраниальное кровотечение, связанное с применением антикоагулянтов, требующее госпитализации в ОИТ, является серьезным осложнением антикоагулянтной терапии, которое может привести к органной недостаточности и значительной смертности. К сожалению, нынешнее терапевтическое лечение часто неоптимально, что, по крайней мере частично, связано с ограничениями лабораторного мониторинга, отсутствием опыта клинического лечения или отсутствием технологий отмены некоторых препаратов. Необходимы образование и разработка антикоагулянтных реверсивных агентов и протоколов, в дополнение к более доступным лабораторным измерениям гемостаза у пациентов, получающих антикоагулянтную терапию.
Диагностика и оценка
Раннее распознавание кровотечения у пациентов в критическом состоянии имеет важное значение для предотвращения развития шока и органной недостаточности. К сожалению, это может быть непросто, учитывая различные основные состояния, присутствующие у пациентов ОИТ. Оценка некоторых клинических и лабораторных параметров, связанных с геморрагическим шоком, таких как новая или ухудшающаяся тахикардия, тахипноэ или сужение пульсового давления, которые являются физиологической реакцией на низкий объем крови, может быть ранними клиническими признаками значительной гиповолемии [1]. Внезапное увеличение уровня лактата или дефицита оснований может быть полезным в качестве триггера начала лечения [19]. Однако все эти параметры могут быть замаскированы другими гемодинамическими нарушениями, включая синдром системной воспалительной реакции, септический шок, кардиогенный шок и применение инотропных и вазопрессорных препаратов. Иногда отклонения, отмеченные при лабораторных тестах, такие как снижение количества тромбоцитов или удлинение протромбинового времени (PT)/активированного частичного тромбопластинового времени (aPTT ), могут сигнализировать персоналу о развивающейся коагулопатии.
Хотя ожидается снижение гемоглобина, важно отметить, что гемоглобин может не падать резко из-за тяжести кровотечения и отставания компенсаторных механизмов. Действительно, наличие гемодинамической декомпенсации при нормальных показателях крови или коагуляции может быть окончательным признаком неконтролируемого скрытого кровотечения, требующего хирургического вмешательства. В конечном счете, важно поддерживать высокую настороженность , а также искать и исключать кровотечение как причину клинической декомпенсации. Признание тяжести и этиологии коагулопатии пациента также важно для надлежащего и индивидуализированного лечения.Традиционные лабораторные тесты, включая PT, aPTT, уровень фибриногена и наличие продуктов распада фибрина (например, D-димера), являются основой диагностики (table 2).
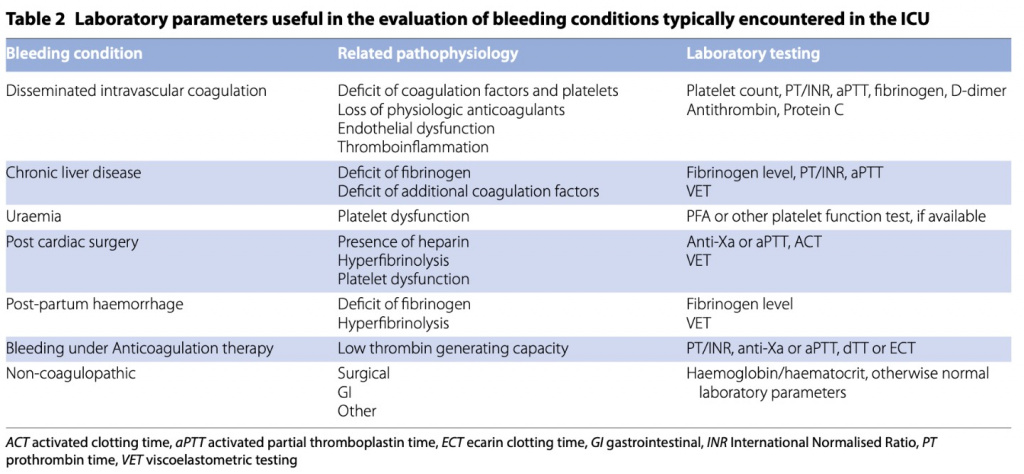
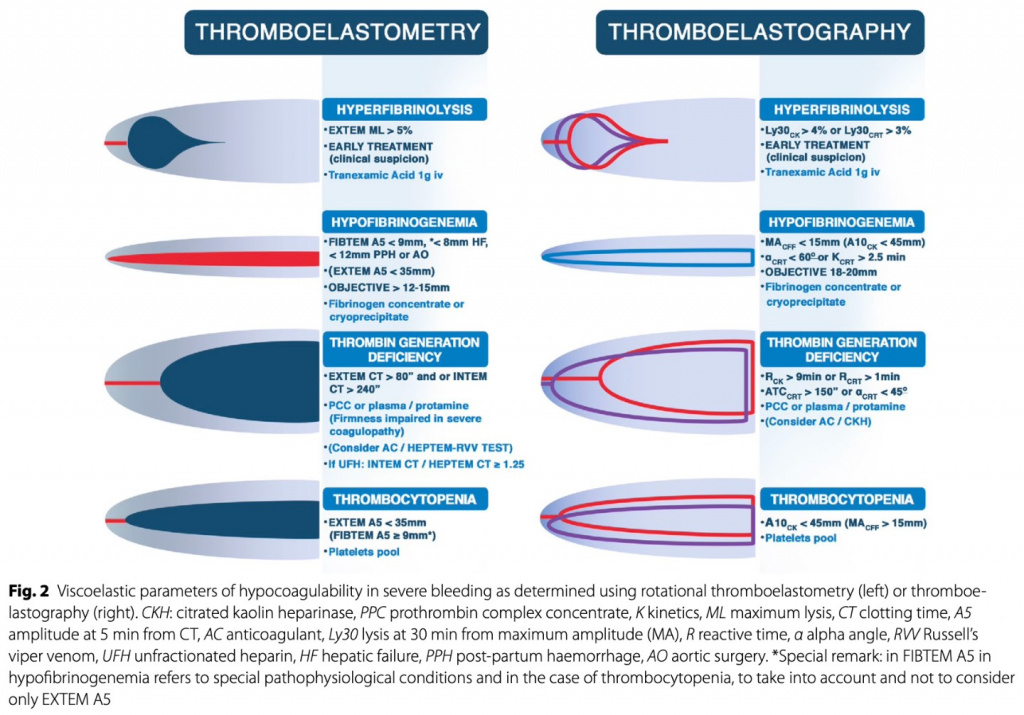
Увеличение D-димера в течение 2 дней недавно было идентифицировано как практический маркер для прогнозирования острого фибринолиза, предшествующего возникновению геморрагических осложнений у пациентов, находящихся на экстракорпоральной мембранной оксигенации (ECMO) [20].Функциональные вискоэластические тесты (тромбоэластометрия) могут дать более быструю и полную картину коагулопатии, чтобы назначить лечение. Использование данных тестов вместе с алгоритмами лечения коагулопатий показало преимущества при лечении кровотечений в кардиохирургии [21] и может быть полезным в акушерстве [22, 23], гепатологии [24, 25] и в других группах пациентов. Вискоэластичные тесты могут помочь диагностировать гиперфибринолиз, хотя и с низкой чувствительностью.
Например, Levrat et al. [26] обнаружили гиперфибринолиз только у 6% своих пациентов (5 из 83 истинно положительных пациентов), используя для диагностики ротационную тромбоэластометрию (ROTEM) и ELT (время лизиса эуглобулина) в качестве золотого стандарта. Было установлено, что у пациентов с коротким ELT (диагноз гиперфибринолиза) коррелирует с максимальной плотностью сгустка (MCF) и амплитудой сгустка на 10 и 15 мин, которые являются косвенными графическими параметрами. Важно отметить, что ELT обычно не проводится в большинстве лабораторий из-за серьезных проблем, связанных с методологией анализа. Наконец, у многих пациентов в критическом состоянии наблюдаются нарушения свертываемости крови в зависимости от заболевания, которые нормализуются при лечении основного заболевания. Таким образом, при отсутствии острого или предстоящего кровотечения нарушения коагуляции могут не требовать коррекции.
Протоколы лечения массивных кровотечений
Ведение пациентов в критическом состоянии с массивным кровотечением и связанной с ним коагулопатией требует оказания стандартизированной, научно обоснованной междисциплинарной помощи [27–32]. Сложность можно уменьшить, если иметь согласованный протокол оказания помощи при массивном кровотечении (MHP) ( также известный как протокол массивной трансфузии), хотя он еще не принят повсеместно [33]. Было показано, что внедрение MHP способствует выживанию пациентов и минимизирует осложнения массивной трансфузии, которую обычно определяют как переливание как минимум 10 единиц эритроцитов (RBC) в течение 24 часов [32,34–37].Первоначально MHP были разработаны для лечения массивных кровотечений у пациентов с травмами и были адаптированы для других клинических условий. Хотя MHP оптимизировали оказание помощи при массивных кровотечениях, некоторые компоненты могут быть основаны на предвзятых обсервационных исследованиях [38]. Одним из примеров является высокое соотношение плазмы к эритроцитам, которое, как предполагается, приводит к значительному снижению смертности (от 65 до 19%) [39]. После проведения временного анализа эффект смертности исчез [40].Хотя ни одно рандомизированное исследование не смогло подтвердить выводы первоначальных наблюдательных исследований, высокое соотношение плазмы-эритроцитов получило широкое распространение, включая пациентов с массивным кровотечением без травм. В обзоре использования высокого и низкого соотношения плазмы к эритроцитам в одной больнице США, где более 90% пациентов, подвергшихся массивному переливанию крови, не были пациентами с травмами, высокое соотношение плазмы к эритроцитам не было связано с улучшением исхода. 41].
Примечательно, что само по себе переливание эритроцитов не обеспечивает коррекции коагулопатии и даже способствует дилюционной коагулопатии. Поэтому плазма и тромбоциты важны после переливания больших объемов эритроцитов для предотвращения или коррекции коагулопатии.D-отрицательные женщины детородного потенциала (FCP — женщины до 50 лет), которые не могут дождаться типоспецифической или перекрестно-совместимой крови, обычно получают резус-отрицательные эритроциты группы O (RhD-) до тех пор, пока не будет определена их группа крови, чтобы предотвратить аллоиммунизацию и будущее развитие RhD+-ассоциированной гемолитической болезни плода и новорожденного (HDFN). Однако риск летального исхода в результате посттравматического кровотечения должен быть приоритетнее потенциального риска аллоиммунизации (20% для экстренной гемотрансфузии). Риск переливания RhD-положительной крови действительно считался низким на догоспитальном этапе [42]. Другое исследование, в котором рассматривались пациентки фертильного возраста с травмой, получившие RhD-положительные эритроциты, показало, что риск беременности, связанной с HDFN, может быть тем выше, чем моложе была пациентка , когда ей переливали RhD-положительные эритроциты [43]. В настоящее время ряд продуктов включается в MPH, особенно в травматологических отделениях
Из-за ограниченной доступности плазмы группы АВ и резкого роста спроса на нее используется плазма группы А. Имеющиеся на сегодняшний день данные подтверждают использование плазмы группы А, вероятно, из-за того, что пациенты получают эритроциты группы О. Еще одним недавним изменением является использование цельной крови группы О с низким титром для немедленного лечения травматического кровотечения [44]. Эти продукты имеют низкие титры анти-А и анти-, хотя стандартные титры не используются. Наконец, используются тромбоциты, хранящиеся в холодильнике, срок годности которых составляет 14 дней. Тромбоциты, хранящиеся в холоде, уже частично активируются и, таким образом, выводятся в течение 24 часов [45].
Этот протокол может быть более эффективным при геморрагических заболеваниях, но клинические испытания все еще продолжаются. MHP, включающие заранее заданные соотношения препаратов для трансфузии , позволяют врачам иметь время для остановки кровотечения, минимизировать использование кристаллоидов и понять суть коагулопатии, чтобы как можно скорее разработать более персонализированное лечение. Разработка основанной на протоколах структуры доставки продуктов крови, алгоритмов лабораторных исследований и других аспектов оказания помощи пациентам (использование препаратов, таких как транексамовая кислота или подогрев крови, для предотвращения гипотермии) остается важной для обеспечения немедленных действий в случаетяжелых и экстренных случаев. Кроме того, эти протоколы полагаются на командную работу, ситуационную осведомленность, общение, определение задач, распределение и принятие решений [32, 46, 47]. MHP должен разрабатываться как междисциплинарный и согласованный протокол с руководством трансфузиологом. Структура содержания протокола должна быть адаптирована к возможностям каждой больницы и соответствовать политике и правилам каждого учебного центра или организации. В протоколе должны быть подробно описаны процедуры и критерии оповещения лечащих врачей у постели больного и предоставления препаратов службой переливания крови.Нужно четко определить показатели качества и критерии проверки, такие как потери продукта, результаты лечения пациентов, лабораторные исследования, а также целесообразность пересмотра протокола [30, 36, 48, 49]. Обзор практики, результатов и использования MHP должен проводиться регулярно, с обновлением протокола для включения новых фактических данных и улучшения местной практики.
Центральным аспектом MHP является упрощенная доставка пациентам крови и ее компонентов.После получения заявки служба переливания крови должна иметь возможность быстро и стабильно предоставлять необходимые продукты крови. Это требует эффективного взаимодействия между службой переливания крови и клиническими бригадами без ненужных действий. Большинство протоколов обеспечивают базовое сбалансированное переливание эритроцитов и компонентной терапии (плазма, тромбоциты) в эмпирических упаковках, которые при необходимости дополняются дополнительными методами лечения. Эритроциты группы O (эритроциты) должны быть предоставлены пациентам без необходимости подтверждения группы крови. Большинство MHP поддерживают использование принципов инфузионной терапии с контролем повреждений, включая высокие соотношения плазмы к эритроцитам и тромбоцитов к эритроцитам [50]. Пример упаковки MHP может включать 4 единицы эритроцитов и 4 единицы плазмы и может включать компоненты тромбоцитов или криопреципитата (Fig. 1).
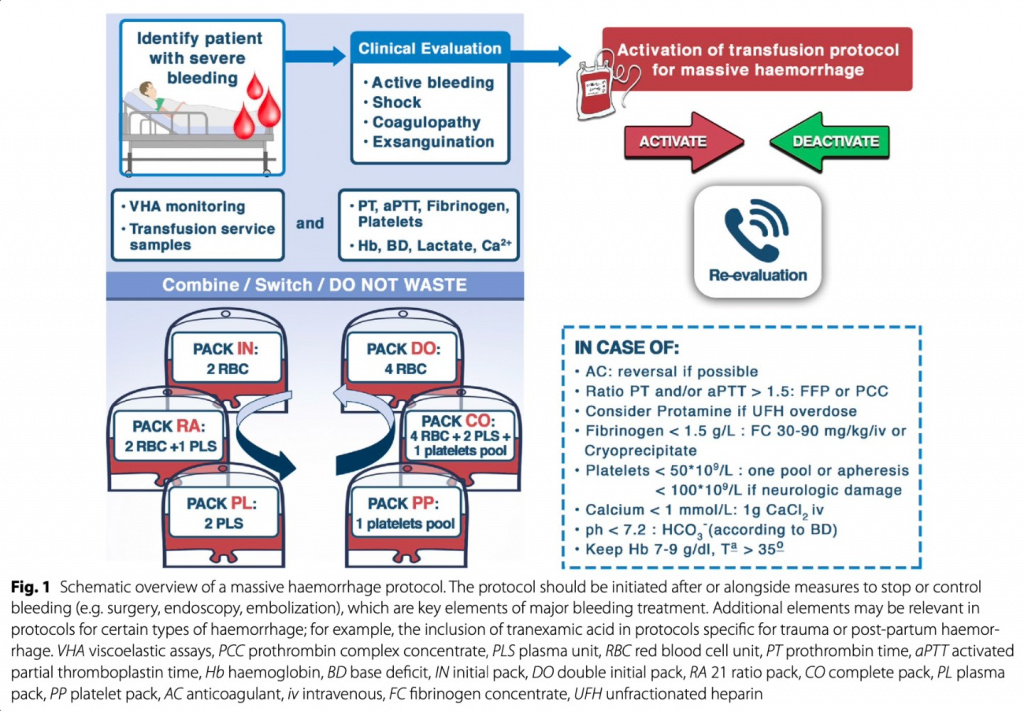
За последние несколько лет некоторые организации здравоохранения начали использовать цельную кровь. Цельная кровь содержит эритроциты, плазму и тромбоциты, что позволяет легче вводить ее по сравнению с отдельными компонентами крови, одновременно уменьшая дополнительное введение жидкости [51]. Однако цельная кровь не является универсально доступной, и компонентная терапия может оказаться более подходящей в некоторых больницах. Современные рекомендации рекомендуют дополнять эмпирическое введение препаратов для сбалансированной реанимации дополнительными средствами коагуляционной терапии, назначаемыми для лечения установленных коагулопатий, диагностированных по результатам вискоэластических или обычных коагуляционных тестов [27, 28,52–56]. Эти методы лечения могут включать концентраты фибриногена (или криопреципитат), концентраты тромбоцитов, концентраты прокоагулянтов или транексамовую кислоту. Эта стратегия, графически проиллюстрированная на Figs. 1 and 22, позволяет постоянно проводить повторную оценку развития коагулопатии, вызванной гемодилюцией, и лечить любые установленные нарушения коагуляции [57–59]. Как указано выше, важно контекстуализировать результаты коагуляционных тестов в контексте известного состояния (травма, PPH,CLD ) и соответствующим образом адаптировать лечение.
Концентраты протромбинового комплекса (PCCs ) рассматривались в некоторых MHP, хотя их роль остается неясной. Четырехфакторный (фактор II, фактор VII, фактор IX и фактор X) концентрат протромбинового комплекса в основном показан для устранения антагонистов витамина К [60], но иногда используется не по назначению для обеспечения витамин-К-зависимых факторов свертывания крови в различных клинических условиях. В зависимости от конкретного PCC продукты также содержат небольшое количество белков C, S и Z, нефракционированный гепарин или антитромбин. Хотя несколько ретроспективных исследований с сопоставлением по склонности предположили, что PCCs могут улучшить выживаемость и снизить общее потребление продуктов крови [61–64], исследование PROCOAG [65] недавно показало явное неблагоприятное соотношение риска и пользы при эмпирическом назначении PCCs пациентам с травмами. Действительно, у 327 пациентов с травмами, подвергающихся риску массивной гемотрансфузии, эмпирическое введение четырехфакторного концентрата протромбинового комплекса в сочетании с СЗП не смогло снизить общее потребление продуктов крови и значительно увеличило количество тромбоэмболических событий по сравнению с плацебо (относительный риск 1,48 [95] % ДИ 1,04–2,10];p = 0,03). Аналогичным образом, хотя кровотечение усугубляется острым дефицитом фибриногена, исследование RYOSTAT-2 [66] показало, что раннее эмпирическое введение высокой дозы криопреципитата (3 дозы; 6 г эквивалента фибриногена) в дополнение к стандартному лечению в течение 3 часов после травмы не улучшило 28-дневную смертность от всех причин ((ОШ 0,96 [95% ДИ 0,75–1,23]; p = 0,74). Оба исследования подчеркивают, что эмпирическое введение концентратов факторов свертывания крови больше не рекомендуется.
Ведение пациентов после кровотечения и массивной трансфузии
После массивного переливания крови и остановки кровотечения пациенты находятся в резко измененном и сложном физиологическом состоянии, требующем тщательного наблюдения и целенаправленной помощи для уменьшения дальнейших осложнений и оптимизации результатов.Широкомасштабная активация иммунной системы может привести к системному воспалительному состоянию, которое может быть дисрегулировано и сопровождаться иммунной супрессией и сепсисом [67, 68]. Кроме того, за геморрагическим шоком может наблюдаться гипердинамическое состояние с высоким сердечным выбросом и расширением сосудов, которое может маскировать продолжающуюся гиповолемию. Ишемия миокарда во время глубокого геморрагического шока может вызвать сердечную дисфункцию, которую трудно отличить от других состояний шока. Наконец, за начальной коагулопатией, связанной с кровотечением, может последовать рикошетная гиперкоагуляция с компенсаторной активацией гемостаза и протромботическим состоянием [14].Этот переход может произойти на очень ранних стадиях клинического течения и может усугубляться задержкой или чрезмерным введением прокоагулянтов или антифибринолитиков [69].
Поддержка кровообращения
Пациентам может продолжать требоваться инфузионная терапия после массивной трансфузии из-за утечки капилляров, связанной с расширением сосудов и повышенной проницаемостью эндотелия. Использование больших объемов кристаллоидов при травматическом геморрагическом шоке связано с повышенной смертностью и увеличением проницаемости эндотелия, что может быть связано с отторжением гликокаликса и разрушением адгезивных и плотных соединений [70]. Поэтому кристаллоиды следует использовать разумно. Переливание эритроцитов может быть целесообразным, если уровень гемоглобина низкий. Использование богатых белком жидкостей, таких как плазма, по сравнению с кристаллоидами, было связано с восстановлением толщины гликокаликса в экспериментальных моделях травмы [71–73]. Исследования на людях с травмами также предполагают полезную роль плазмы в поддержании целостности гликокаликса [74, 75]. У пациентов после травмы или операции, перенесших тяжелый геморрагический шок, развивается гипердинамияс картиной распределительного шока из-за системной воспалительной реакции. Для поддержания перфузионного давления часто требуется раннее введение вазопрессоров. Это может маскировать относительную или абсолютную гиповолемию. Кроме того, вторичное повреждение миокарда вследствие ишемии и воспаления также может возникать после глубокого шока, о чем свидетельствует повышение уровня тропонина в течение 24–48 часов, приводящее к сердечной дисфункции [76, 77]. Это может усугубляться ранними электролитными нарушениями, такими как гиперкалиемия и гипокальциемия. При наличии дополнительного компонента кардиогенного шока инотропные средства (такие как милринон, добутамин или адреналин) могут усиливать поддержку дистрибутивного и/или гиповолемического шока. Таким образом, лечение данных пациентов является сложным, требующим тонкого баланса жидкостей, вазопрессоров и инотропных средств, и данные в этой области ограничены.
Тромбопрофилактика
Пациенты, перенесшие шок и массивное переливание крови, находятся в состоянии гиперкоагуляции. Исследования продемонстрировали переход к состоянию гиперкоагуляции в течение 48 часов после травмы и, возможно, в течение 3–6 часов после травмы [78]. Венозная тромбоэмболия встречается у 20% пациентов с травмами и остается высокой даже при фармакологической тромбопрофилактике [79]. При черепно-мозговой травме одной из потенциальных причин, объясняющих высокий риск тромбоэмболических осложнений после массивного кровотечения, является избегание или отсрочка применения фармакологической тромбопрофилактики из-за страха усугубления или повторных кровотечений, что еще больше увеличивает риск венозной тромбоэмболии (VTE) [80, 81]. Действительно, хотя было показано, что тромбопрофилактика снижает риск VTE, имеются некоторые доказательства того, что раннее начало тромбопрофилактики может быть связано с необходимостью повторного хирургического вмешательства [82]. В 2020 году Western Trauma Association ассоциация выпустила алгоритм профилактики ВТЭ после травмы, чтобы помочь определить, какие пациенты нуждаются в фармакологической профилактике, а также ее тип и дозирование [83]. Данные о прогрессировании внутричерепного кровоизлияния после начала профилактики VTE противоречивы. Существует мало доказательств того, что стандартные дозы гепарина или низкомолекулярных гепаринов связаны с посттравматическими кровотечениями за пределами центральной нервной системы. Отказ от профилактики VTE в течение длительного периода из-за опасений усугубления кровотечения не имеет достаточных оснований и может привести к вреду, поскольку задержки и пропуск доз профилактики VTE связаны с повышенным риском ее развития [84]. Имеются убедительные доказательства в пользу использования низкомолекулярного гепарина (LMWH ) вместо нефракционированного гепарина (UFH ) [85]. Пациентам с травмами могут потребоваться промежуточные или высокие дозы LMWH, поскольку недавние данные свидетельствуют о том, что резистентность к LMWH может быть распространена у пациентов с тяжелыми травмами, связанными с дефицитом антитромбина [79]. Это может быть еще одним фактором, способствующим высокой частоте LMWH , несмотря на текущую «лучшую практику» химиопрофилактики. К сожалению, в настоящее время имеется мало доказательств для определения оптимальной тромбопрофилактики у пациентов без травм. Хотя роль механической тромбопрофилактики до сих пор дискутируется, а имеющиеся данные дают противоречивые результаты [86, 87], европейские руководства рекомендуют использование механической профилактики у пациентов с противопоказаниями к антикоагулянтной терапии (класс 1В) и предлагают использование периодической пневматической профилактики или чулки с градуированной компрессией (степень 2В) [88, 89]. Американские рекомендации не поддерживают использование комбинированной терапии вместо фармакологической терапии или компрессионной терапии [90].
Анемия
Анемия часто встречается среди пациентов в критическом состоянии в период выздоровления.Исследования показали, что анемией страдают 70–80% пациентов после перевода из ОИТ, причем почти у половины из них сохраняется анемия через 6 месяцев [91]. Анемия критических состояний является многофакторной, хотя ключевыми медиаторами являются низкий уровень эритропоэтина (EPO ), ятрогенная кровопотеря и функциональный дефицит железа (обусловленный высокими уровнями гепсидина) [92]. У тех пациентов, которые выживают после массивного переливания крови, кровопотеря и еще большее истощение запасов железа усугубляются анемией, что может ограничить способность пациента креабилитации. Было предложено превентивное лечение анемии критических состояний, с помощью EPO или железа, но это остается неопределенным и спорным [93].Европейские рекомендации не рекомендуют использовать ни EPO , ни железо у пациентов ОИТ [94], поскольку EPO может увеличить риск тромбоза у пациентов с прокоагулянтными состояниями, а железо может быть, по меньшей мере, неэффективным (или опасным) у пациентов с системным воспалением.
Дополнительные соображения
1. Индивидуализация алгоритмов лечения
Важно отметить, что протоколы, разработанные для лечения пациентов с одним источником массивного кровотечения, например, травмой, могут быть нелегко адаптированы к другим. Кроме того, даже у пациентов с одной и той же основной причиной кровотечения уникальные различия в ответе на переливание крови и протоколы лечения могут отражать дополнительные факторы, влияющие на патофизиологические процессы. Две недавние статьи [95, 96] подчеркивают существование уникальных эндотипов , которые могут помочь в выявлении пациентов, которые будут реагировать на различные варианты терапии.
2. Эндоваскулярная баллонная окклюзия аорты (REBOA)
Поскольку массивное кровотечение является наиболее распространенной причиной предотвратимой смерти после травмы, Jansen et al. [97] провели прагматичное байесовское РКИ для оценки эффективности REBOA в отношении смертности. Девяносто пациентов с травмами и обескровливающими кровотечениями были рандомизированы для получения либо стандартного лечения +REBOA, либо только стандартного лечения. Авторы показали, что стратегия, сочетающая REBOA и стандартную помощь, не снижает смертность и может даже увеличить смертность по сравнению с только стандартной помощью (54% против 42%; ОШ 1,58 [95% ДИ 0,72–3,52].
3. Поиски антикоагулянта «Святого Грааля»
Различные причины массивных кровотечений у пациентов в критическом состоянии сложно предотвратить, однако случаи, связанные с антикоагулянтной терапией, представляют собой ситуации, которые можно предотвратить за счет разработки более эффективных лекарств.Продолжается поиск антикоагулянта «Святого Грааля», который способен предотвращать тромботические явления, не влияя на общий гемостаз и, следовательно, не повышая риск кровотечений. На сегодняшний день почти все традиционные антикоагулянты ингибируют факторы II или X; и, учитывая существенную роль этих факторов в поддержании гемостаза в стабильных условиях, их использование несет в себе повышенный риск кровотечения, который не является незначительным.
Недавние исследования показали, что воздействие на другие факторы свертывания кровиозволит избежать этого риска. Контактно-фазовый (внутренний) путь обычно не важен для поддержания физиологического гемостаза, но принимает участие в развитии патологического тромбоза. Таким образом, некоторые предполагают, что ингибиторы, нацеленные на факторы XI (FXI) или XII, могут оказывать антитромботическое действие, не увеличивать риск кровотечения [86–89]. Были разработаны новые стратегии воздействия на FXI, включая использование олигонуклеотидов (ASO), которые уменьшают синтез FXI в печени или блокируют активацию или активность FXI с помощью антител, аптамеров или других небольших молекул [90]. Ингибирование FXI, вероятно, потребует тонкой настройки, поскольку может возникнуть серьезный дефицит FXI. приводят к более высокому риску небольших кровотечений слизистых оболочек (ротоглотки/носоглотки и мочеполовых путей) после травмы или хирургического вмешательства, учитывая фибринолитическую активность [90].Тем не менее, клиническая полезность трех классов ингибиторов контактного пути в настоящее время оценивается в исследованиях фазы 2 и 3 в различных клинических ситуациях (Table 2).
Заключение
Кровотечение остается частым осложнением, встречающимся в ОРИТ, которое требует понимания патофизиологии различных коагулопатических состояний для обеспечения надлежащего оказания помощи пациентам. Диагностика и оценка кровотечения и геморрагического шока могут быть трудными и зависят от сочетания клинических и лабораторных показателей. Пациентам с массивным кровотечением лучше всего оказывать поддержку с использованием протоколов лечения, разработанных многопрофильными бригадами, чтобы обеспечить быстрое и скоординированное реагирование. Лечение после массивного переливания крови является сложным и требует понимания многочисленных вовлеченных патологических процессов. Требуются дополнительные исследования, особенно в отношении нетравматических причин кровотечения. Тем не менее, значительное снижение смертности, осложнений, использования ресурсов и отходов может быть достигнуто с помощью планового, междисциплинарного и научно обоснованного подхода [98].
References
1. Hooper N, Armstrong TJ (2023) Hemorrhagic. ShockStatPearls, Treasure Island
2. Lauzier F, Arnold D, Rabbat C (2012) In medical-surgical ICU patients, major bleeding is common but independent of heparin prophylaxis. Crit Care 16(Suppl 1):P435
3. Russell L, Holst LB, Kjeldsen L, Stensballe J, Perner A (2017) Risks of bleeding and thrombosis in intensive care unit patients with haematological malignancies. Ann Intensive Care 7:119
4. Schulman S, Kearon C, Subcommittee on Control of Anticoagulation of the S, Standardization Committee of the International Society on T, Haemostasis (2005) Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. J Thromb
Haemost 3:692–694
5. Moore EE, Moore HB, Kornblith LZ, Neal MD, Hoffman M, Mutch NJ,Schochl H, Hunt BJ, Sauaia A (2021) Trauma-induced coagulopathy. NatRev Dis Primers 7:30
6. Raza I, Davenport R, Rourke C, Platton S, Manson J, Spoors C, Khan S, De’Ath HD, Allard S, Hart DP, Pasi KJ, Hunt BJ, Stanworth S, MacCallum PK, Brohi K (2013) The incidence and magnitude of fibrinolytic activation in trauma patients. J Thromb Haemost 11:307–314
7. Rourke C, Curry N, Khan S, Taylor R, Raza I, Davenport R, Stanworth S, Brohi K (2012) Fibrinogen levels during trauma hemorrhage, response to replacement therapy, and association with patient outcomes. J Thromb Haemost 10:1342–1351
8. de Lloyd L, Jenkins PV, Bell SF, Mutch NJ, Martins Pereira JF, Badenes PM, James D, Ridgeway A, Cohen L, Roberts T, Field V, Collis RE, Collins PW (2023) Acute obstetric coagulopathy during postpartum hemorrhage is caused by hyperfibrinolysis and dysfibrinogenemia: an observational cohort study. J Thromb Haemost 21:862–879
9. Charbit B, Mandelbrot L, Samain E, Baron G, Haddaoui B, Keita H, Sibony O, Mahieu-Caputo D, Hurtaud-Roux MF, Huisse MG, Denninger MH, de Prost D, Group PPHS (2007) The decrease of fibrinogen is an early predictor of the severity of postpartum hemorrhage. J Thromb Haemost 5:266–273
10. Schulman S, Angeras U, Bergqvist D, Eriksson B, Lassen MR, Fisher W, Subcommittee
on Control of Anticoagulation of the S, Standardization Committee of the International Society on T, Haemostasis (2010) Definition of major bleeding in clinical investigations of antihemostatic medicinal products in surgical patients. J Thromb Haemost 8:202–204
11. Ow TW, Fatourou E, Rabinowich L, van den Boom B, Nair S, Patel VC, Hogan B, McPhail M, Roberts LN, Bernal W (2022) Prevalence of bleeding and thrombosis in critically ill patients with chronic liver disease. Thromb Haemost 122:1006–1016
12. van den Boom BP, Lisman T (2022) Pathophysiology and management of bleeding and thrombosis in patients with liver disease. Int J Lab Hematol 44(Suppl 1):79–88
13. Roberts LN (2021) Rebalanced hemostasis in liver disease: a misunderstood coagulopathy. Hematol Am Soc Hematol Educ Progr 2021:485–491
14. Helms J, Iba T, Connors JM, Gando S, Levi M, Meziani F, Levy JH (2023) How to manage coagulopathies in critically ill patients. Intensive Care Med 49:273–290
15. Levi M, Scully M (2018) How I treat disseminated intravascular coagulation. Blood 131:845–854
16. Hedges SJ, Dehoney SB, Hooper JS, Amanzadeh J, Busti AJ (2007) Evidence-based treatment recommendations for uremic bleeding. Nat Clin Pract Nephrol 3:138–153
17. Hunt BJ (2014) Bleeding and coagulopathies in critical care. N Engl J Med 370:847–859
18. Botrel T, Cunat S, Helms J, Lemarie J, Gaillon J, Preau S, Favory R, Thille AW, Boissier F, Maury E, Joffre J, Ait-Oufella H (2023) Extracranial anticoagulant related bleedings admitted to intensive care units: a French multicenter retrospective study. Crit Care 27:312
19. Mutschler M, Nienaber U, Brockamp T, Wafaisade A, Fabian T, Paffrath T, Bouillon B, Maegele M, TraumaRegister DGU (2013) Renaissance of base deficit for the initial assessment of trauma patients: a base deficit-based classification for hypovolemic shock developed on data from 16,305 patients derived from the TraumaRegister DGU(R). Crit Care 17:R42
20. Helms J, Curtiaud A, Severac F, Merdji H, Angles-Cano E (2023) Dynamic longitudinal increase in D-dimers: an early predictor of bleeding complications in ECMO. Intensive Care Med 49:1416
21. Li C, Zhao Q, Yang K, Jiang L, Yu J (2019) Thromboelastography or rotational thromboelastometry for bleeding management in adults undergoing cardiac surgery: a systematic review with meta-analysis and trial sequential analysis. J Thorac Dis 11:1170–1181
22. Amgalan A, Allen T, Othman M, Ahmadzia HK (2020) Systematic review of viscoelastic testing (TEG/ROTEM) in obstetrics and recommendations from the women’s SSC of the ISTH. J Thromb Haemost 18:1813–1838
23. Collins PW, Cannings-John R, Bruynseels D, Mallaiah S, Dick J, Elton C, Weeks AD, Sanders J, Aawar N, Townson J, Hood K, Hall JE, Collis RE (2017) Viscoelastometric-guided early fibrinogen concentrate replacement during postpartum haemorrhage: OBS2, a double-blind randomized controlled trial. Br J Anaesth 119:411–421
24. Al Moosawi M, Trudeau J, Smith T, Lefebvre A, Shih AW (2021) ROTEM in the setting of liver transplant surgery reduces frozen plasma transfusion. Transfus Apher Sci 60:103125
25. Zamper RPC, Amorim TC, Queiroz VNF, Lira JDO, Costa LGV, Takaoka F, Juffermans NP, Neto AS (2018) Association between viscoelastic testsguided therapy with synthetic factor concentrates and allogenic blood transfusion in liver transplantation: a before-after study. BMC Anesthesiol 18:198
26. Levrat A, Gros A, Rugeri L, Inaba K, Floccard B, Negrier C, David JS (2008) Evaluation of rotation thrombelastography for the diagnosis of hyperfibrinolysis in trauma patients. Br J Anaesth 100:792–797
27. Rossaint R, Afshari A, Bouillon B, Cerny V, Cimpoesu D, Curry N, Duranteau J, Filipescu D, Grottke O, Gronlykke L, Harrois A, Hunt BJ, Kaserer A, Komadina R, Madsen MH, Maegele M, Mora L, Riddez L, Romero CS, Samama CM, Vincent JL, Wiberg S, Spahn DR (2023) The European guideline on management of major bleeding and coagulopathy following trauma:
sixth edition. Crit Care 27:80
28. Kietaibl S, Ahmed A, Afshari A, Albaladejo P, Aldecoa C, Barauskas G, De Robertis E, Faraoni D, Filipescu DC, Fries D, Godier A, Haas T, Jacob M, Lance MD, Llau JV, Meier J, Molnar Z, Mora L, Rahe-Meyer N, Samama CM, Scarlatescu E, Schlimp C, Wikkelso AJ, Zacharowski K (2023) Management of severe peri-operative bleeding: guidelines from the European Society of Anaesthesiology and Intensive Care: second update 2022. Eur J Anaesthesiol 40:226–304
29. Erdoes G, Faraoni D, Koster A, Steiner ME, Ghadimi K, Levy JH (2023) Perioperative considerations in management of the severely bleeding coagulopathic patient. Anesthesiology 138:535–560
30. Muldowney M, Aichholz P, Nathwani R, Stansbury LG, Hess JR, Vavilala MS (2022) Advances in hemorrhage control resuscitation. Curr Opin Anaesthesiol 35:176–181
31. Vlaar APJ, Dionne JC, de Bruin S, Wijnberge M, Raasveld SJ, van Baarle F, Antonelli M, Aubron C, Duranteau J, Juffermans NP, Meier J, Murphy GJ, Abbasciano R, Muller MCA, Lance M, Nielsen ND, Schochl H, Hunt BJ, Cecconi M, Oczkowski S (2021) Transfusion strategies in bleeding critically ill adults: a clinical practice guideline from the European Society of Intensive Care Medicine. Intensive Care Med 47:1368–1392
32. Pham HP, Shaz BH (2013) Update on massive transfusion. Br J Anaesth 111(Suppl 1):i71-82
33. de Bruin S, Eggermont D, van Bruggen R, de Korte D, Scheeren TWL, Bakker J, Vlaar APJ (2022) Transfusion practice in the bleeding critically ill: an international online survey-The TRACE-2 survey. Transfusion 62:324–335
34. Wiersum-Osselton JC, Whitaker B, Grey S, Land K, Perez G, Rajbhandary S, Andrzejewski C Jr, Bolton-Maggs P, Lucero H, Renaudier P, Robillard P, Santos M, Schipperus M (2019) Revised international surveillance case definition of transfusion-associated circulatory overload: a classification agreement validation study. Lancet Haematol 6:e350–e358
35. Bosboom JJ, Klanderman RB, Migdady Y, Bolhuis B, Veelo DP, Geerts BF, Murphy MF, Vlaar APJ (2019) Transfusion-associated circulatory overload: a clinical perspective. Transfus Med Rev 33:69–77
36. Ruseckaite R, McQuilten ZK, Oldroyd JC, Richter TH, Cameron PA, Isbister JP, Wood EM (2017) Descriptive characteristics and in-hospital mortality of critically bleeding patients requiring massive transfusion: results from the Australian and New Zealand Massive Transfusion Registry. Vox Sang 112:240–248
37. Karameh H, Bruoha S, Taha L, Tabi M, Farkash R, Karmi M, Hamayel K, Perel N, Steinmetz Y, Marmor D, Manassra M, Maller T, Hitter R, Amsalem I, Glikson M, Asher E (2023) Outcomes of patients treated with blood transfusion in a contemporary tertiary care medical center intensive cardiac care unit. J Clin Med 12:1304
38. Halmin M, Chiesa F, Vasan SK, Wikman A, Norda R, Rostgaard K, Vesterager Pedersen OB, Erikstrup C, Nielsen KR, Titlestad K, Ullum H, Hjalgrim H, Edgren G (2016) Epidemiology of massive transfusion: a binational study from Sweden and Denmark. Crit Care Med 44:468–477
39. Borgman MA, Spinella PC, Perkins JG, Grathwohl KW, Repine T, Beekley AC, Sebesta J, Jenkins D, Wade CE, Holcomb JB (2007) The ratio of blood products transfused affects mortality in patients receiving massive transfusions at a combat support hospital. J Trauma 63:805–813
40. Halmin M, Bostrom F, Brattstrom O, Lundahl J, Wikman A, Ostlund A, Edgren G (2013) Effect of plasma-to-RBC ratios in trauma patients: a cohort study with time-dependent data*. Crit Care Med 41:1905–1914
41. Mesar T, Larentzakis A, Dzik W, Chang Y, Velmahos G, Yeh DD (2017) Association between ratio of fresh frozen plasma to red blood cells during massive transfusion and survival among patients without traumatic injury. JAMA Surg 152:574–580
42. Cardigan R, Latham T, Weaver A, Yazer M, Green L (2022) Estimating the risks of prehospital transfusion of D-positive whole blood to trauma patients who are bleeding in England. Vox Sang 117:701–707
43. Seheult JN, Stram MN, Pearce T, Bub CB, Emery SP, Kutner J, Watanabe-Okochi N, Sperry JL, Takanashi M, Triulzi DJ, Yazer MH (2021) The risk to future pregnancies of transfusing Rh(D)-negative females of childbearing potential with Rh(D)-positive red blood cells during trauma resuscitation is dependent on their age at transfusion. Vox Sang 116:831–840
44. Gammon RR, Meena-Leist C, Al Mozain N, Cruz J, Hartwell E, Lu W, Karp JK, Noone S, Orabi M, Tayal A, Bocquet C, Tanhehco Y (2023) Whole blood in civilian transfusion practice: a review of the literature. Transfusion 63:1758–1766
45. Mack JP, Miles J, Stolla M (2020) Cold-stored platelets: review of studies in humans. Transfus Med Rev 34:221–226
46. Meneses E, Boneva D, McKenney M, Elkbuli A (2020) Massive transfusion protocol in adult trauma population. Am J Emerg Med 38:2661–2666
47. Sommer N, Schnuriger B, Candinas D, Haltmeier T (2019) Massive transfusion protocols in nontrauma patients: a systematic review and metaanalysis. J Trauma Acute Care Surg 86:493–504
48. Hu P, Uhlich R, Black J, Jansen JO, Kerby J, Holcomb JB (2021) A new definition for massive transfusion in the modern era of whole blood resuscitation. Transfusion 61(Suppl 1):S252-s263
49. Foster JC, Sappenfield JW, Smith RS, Kiley SP (2017) Initiation and termination of massive transfusion protocols: current strategies and future prospects. Anesth Analg 125:2045–2055
50. Camazine MN, Hemmila MR, Leonard JC, Jacobs RA, Horst JA, Kozar RA, Bochicchio GV, Nathens AB, Cryer HM, Spinella PC (2015) Massive transfusion policies at trauma centers participating in the American College of Surgeons Trauma Quality Improvement Program. J Trauma Acute Care Surg 78:S48-53
51. Ngatuvai M, Zagales I, Sauder M, Andrade R, Santos RG, Bilski T, Kornblith L, Elkbuli A (2023) Outcomes of transfusion with whole blood, component therapy, or both in adult civilian trauma patients: a systematic review and meta-analysis. J Surg Res 287:193–201
52. Casu S (2021) Simplified treatment algorithm for the management of trauma-induced hemorrhage without viscoelastic testing. Trauma Surg Acute Care Open 6:e000779
53. Bugaev N, Como JJ, Golani G, Freeman JJ, Sawhney JS, Vatsaas CJ, Yorkgitis BK, Kreiner LA, Garcia NM, Aziz HA, Pappas PA, Mahoney EJ, Brown ZW, Kasotakis G (2020) Thromboelastography and rotational thromboelastometry in bleeding patients with coagulopathy: practice management guideline from the Eastern Association for the Surgery of Trauma. J
Trauma Acute Care Surg 89:999–1017
54. Blaine KP, Steurer MP (2019) Viscoelastic monitoring to guide the correction of perioperative coagulopathy and massive transfusion in patients with life-threatening hemorrhage. Anesthesiol Clin 37:51–66
55. Baksaas-Aasen K, Gall LS, Stensballe J, Juffermans NP, Curry N, Maegele M, Brooks A, Rourke C, Gillespie S, Murphy J, Maroni R, Vulliamy P, Henriksen HH, Pedersen KH, Kolstadbraaten KM, Wirtz MR, Kleinveld DJB, Schafer N, Chinna S, Davenport RA, Naess PA, Goslings JC, Eaglestone S, Stanworth
S, Johansson PI, Gaarder C, Brohi K (2021) Viscoelastic haemostatic assay augmented protocols for major trauma haemorrhage (ITACTIC): a randomized, controlled trial. Intensive Care Med 47:49–59
56. Baksaas-Aasen K, Van Dieren S, Balvers K, Juffermans NP, Naess PA, Rourke C, Eaglestone S, Ostrowski SR, Stensballe J, Stanworth S, Maegele M, Goslings JC, Johansson PI, Brohi K, Gaarder C, collaborators TI (2019) Datadriven development of ROTEM and TEG algorithms for the management of trauma hemorrhage: a prospective observational multicenter study. Ann Surg 270:1178–1185
57. Gorlinger K, Perez-Ferrer A, Dirkmann D, Saner F, Maegele M, Calatayud AAP, Kim TY (2019) The role of evidence-based algorithms for rotational thromboelastometry-guided bleeding management. Korean J Anesthesiol 72:297–322
58. Hartmann J, Hermelin D, Levy JH (2023) Viscoelastic testing: an illustrated review of technology and clinical applications. Res Pract Thromb Haemost 7:100031
59. Zhu Z, Yu Y, Hong K, Luo M, Ke Y (2022) Utility of viscoelastic hemostatic assay to guide hemostatic resuscitation in trauma patients: a systematic review. World J Emerg Surg 17:48
60. Bouzat P, Hunt BJ, Juffermans NP (2023) Four-factor prothrombin complex concentrate in trauma patients. Intensive Care Med 49:1242–1244
61. Jehan F, Aziz H, O’Keeffe T, Khan M, Zakaria ER, Hamidi M, Zeeshan M, Kulvatunyou
N, Joseph B (2018) The role of four-factor prothrombin complex concentrate in coagulopathy of trauma: a propensity matched analysis. J Trauma Acute Care Surg 85:18–24
62. Zeeshan M, Hamidi M, Feinstein AJ, Gries L, Jehan F, Sakran J, Northcutt A, O’Keeffe T, Kulvatunyou N, Joseph B (2019) Four-factor prothrombin complex concentrate is associated with improved survival in trauma-related hemorrhage: a nationwide propensity-matched analysis. J Trauma Acute Care Surg 87:274–281
63. Joseph B, Aziz H, Pandit V, Hays D, Kulvatunyou N, Yousuf Z, Tang A, O’Keeffe T, Green D, Friese RS, Rhee P (2014) Prothrombin complex concentrate versus fresh-frozen plasma for reversal of coagulopathy of trauma: is there a difference? World J Surg 38:1875–1881
64. Joseph B, Khalil M, Harrison C, Swartz T, Kulvatunyou N, Haider AA, Jokar TO, Burk D, Mahmoud A, Latifi R, Rhee P (2016) Assessing the efficacy of prothrombin complex concentrate in multiply injured patients with highenergy pelvic and extremity fractures. J Orthop Trauma 30:653–658
65. Bouzat P, Charbit J, Abback PS, Huet-Garrigue D, Delhaye N, Leone M, Marcotte G, David JS, Levrat A, Asehnoune K, Pottecher J, Duranteau J, Courvalin E, Adolle A, Sourd D, Bosson JL, Riou B, Gauss T, Payen JF, Group PS (2023) Efficacy and safety of early administration of 4-factor prothrombin complex concentrate in patients with trauma at risk of massive transfusion:
the PROCOAG Randomized Clinical Trial. JAMA 329:1367–1375
66. Davenport R, Curry N, Fox EE, Thomas H, Lucas J, Evans A, Shanmugaranjan S, Sharma R, Deary A, Edwards A, Green L, Wade CE, Benger JR, Cotton BA, Stanworth SJ, Brohi K, Investigators C-P (2023) Early and empirical high-dose cryoprecipitate for hemorrhage after traumatic injury: the CRYOSTAT-2 randomized clinical trial. JAMA 21 330(19):1882–1891. https://doi. org/ 10. 1001/ jama. 2023. 21019
67. Cabrera CP, Manson J, Shepherd JM, Torrance HD, Watson D, Longhi MP,Hoti M, Patel MB, O’Dwyer M, Nourshargh S, Pennington DJ, Barnes MR,Brohi K (2017) Signatures of inflammation and impending multiple organ dysfunction in the hyperacute phase of trauma: a prospective cohort study. PLoS Med 14:e1002352
68. Mira JC, Brakenridge SC, Moldawer LL, Moore FA (2017) Persistent inflammation,
immunosuppression and catabolism syndrome. Crit Care Clin 33:245–258
69. Wirtz MR, Schalkers DV, Goslings JC, Juffermans NP (2020) The impact of blood product ratio and procoagulant therapy on the development of thromboembolic events in severely injured hemorrhaging trauma patients. Transfusion 60:1873–1882
70. Johansson PI, Stensballe J, Rasmussen LS, Ostrowski SR (2011) A high admission syndecan-1 level, a marker of endothelial glycocalyx degradation, is associated with inflammation, protein C depletion, fibrinolysis, and increased mortality in trauma patients. Ann Surg 254:194–200
71. Torres LN, Chung KK, Salgado CL, Dubick MA, Torres Filho IP (2017) Low volume
resuscitation with normal saline is associated with microvascular endothelial dysfunction after hemorrhage in rats, compared to colloids and balanced crystalloids. Crit Care 21:160
72. Torres LN, Sondeen JL, Ji L, Dubick MA, Torres Filho I (2013) Evaluation of resuscitation fluids on endothelial glycocalyx, venular blood flow, and coagulation function after hemorrhagic shock in rats. J Trauma Acute Care Surg 75:759–766
73. Kozar RA, Peng Z, Zhang R, Holcomb JB, Pati S, Park P, Ko TC, Paredes A (2011) Plasma restoration of endothelial glycocalyx in a rodent model of hemorrhagic shock. Anesth Analg 112:1289–1295
74. Gruen DS, Brown JB, Guyette FX, Vodovotz Y, Johansson PI, Stensballe J, Barclay DA, Yin J, Daley BJ, Miller RS, Harbrecht BG, Claridge JA, Phelan HA, Neal MD, Zuckerbraun BS, Billiar TR, Sperry JL, group PAs, (2020) Prehospital plasma is associated with distinct biomarker expression following injury. JCI Insight 5:e135350
75. Gruen DS, Guyette FX, Brown JB, Okonkwo DO, Puccio AM, Campwala IK, Tessmer MT, Daley BJ, Miller RS, Harbrecht BG, Claridge JA, Phelan HA, Neal MD, Zuckerbraun BS, Yazer MH, Billiar TR, Sperry JL (2020) Association of prehospital plasma with survival in patients with traumatic brain injury: a secondary analysis of the PAMPer cluster randomized clinical
trial. JAMA Netw Open 3:e2016869
76. Weber B, Lackner I, Gebhard F, Miclau T, Kalbitz M (2021) Trauma, a matter of the heart-molecular mechanism of post-traumatic cardiac dysfunction. Int J Mol Sci 22:737
77. De’Ath HD, Rourke C, Davenport R, Manson J, Renfrew I, Uppal R, Davies LC, Brohi K (2012) Clinical and biomarker profile of trauma-induced secondary cardiac injury. Br J Surg 99:789–797
78. Schellenberg M, Costantini T, Joseph B, Price MA, Bernard AC, Haut ER (2023) Timing of venous thromboembolism prophylaxis initiation after injury: Findings from the consensus conference to implement optimal VTE prophylaxis in trauma. J Trauma Acute Care Surg 94:484–489
79. Vincent LE, Talanker MM, Butler DD, Zhang X, Podbielski JM, Wang YW, Chen-Goodspeed A, Hernandez Gonzalez SL, Fox EE, Cotton BA, Wade CE, Cardenas JC (2022) Association of changes in antithrombin activity over time with responsiveness to enoxaparin prophylaxis and risk of trauma related venous thromboembolism. JAMA Surg 157:713–721
80. Lu VM, Alvi MA, Rovin RA, Kasper EM (2020) Clinical outcomes following early versus late pharmacologic thromboprophylaxis in patients with traumatic intracranial hemorrhage: a systematic review and meta-analysis. Neurosurg Rev 43:861–872
81. Spano PJ 2nd, Shaikh S, Boneva D, Hai S, McKenney M, Elkbuli A (2020) Anticoagulant chemoprophylaxis in patients with traumatic brain injuries: a systematic review. J Trauma Acute Care Surg 88:454–460
82. Byrne JP, Witiw CD, Schuster JM, Pascual JL, Cannon JW, Martin ND, Reilly PM, Nathens AB, Seamon MJ (2022) Association of venous thromboembolism prophylaxis after neurosurgical intervention for traumatic brain injury with thromboembolic complications, repeated neurosurgery, and mortality. JAMA Surg 157:e215794
83. Ley EJ, Brown CVR, Moore EE, Sava JA, Peck K, Ciesla DJ, Sperry JL, Rizzo AG, Rosen NG, Brasel KJ, Kozar R, Inaba K, Martin MJ (2020) Updated guidelines to reduce venous thromboembolism in trauma patients: a Western Trauma Association critical decisions algorithm. J Trauma Acute Care Surg 89:971–981
84. Skarupa D, Hanna K, Zeeshan M, Madbak F, Hamidi M, Haddadin Z, Northcutt A, Gries L, Kulvatunyou N, Joseph B (2019) Is early chemical thromboprophylaxis in patients with solid organ injury a solid decision? J Trauma Acute Care Surg 87:1104–1112
85. Tran A, Fernando SM, Carrier M, Siegal DM, Inaba K, Vogt K, Engels PT, English SW, Kanji S, Kyeremanteng K, Lampron J, Kim D, Rochwerg B (2022) Efficacy and safety of low molecular weight heparin versus unfractionated heparin for prevention of venous thromboembolism in trauma patients: a systematic review and meta-analysis. Ann Surg 275:19–28
86. Fernando SM, Tran A, Cheng W, Sadeghirad B, Arabi YM, Cook DJ, Moller MH, Mehta S, Fowler RA, Burns KEA, Wells PS, Carrier M, Crowther MA, Scales DC, English SW, Kyeremanteng K, Kanji S, Kho ME, Rochwerg B (2022) VTE prophylaxis in critically ill adults: a systematic review and network meta-analysis. Chest 161:418–428
87. Helms J, Middeldorp S, Spyropoulos AC (2023) Thromboprophylaxis in critical care. Intensive Care Med 49:75–78
88. Duranteau J, Taccone FS, Verhamme P, Ageno W, Force EVGT (2018) European guidelines on perioperative venous thromboembolism prophylaxis: Intensive care. Eur J Anaesthesiol 35:142–146
89. Afshari A, Fenger-Eriksen C, Monreal M, Verhamme P, Force EVGT (2018) European guidelines on perioperative venous thromboembolism prophylaxis: Mechanical prophylaxis. Eur J Anaesthesiol 35:112–115
90. Schunemann HJ, Cushman M, Burnett AE, Kahn SR, Beyer-Westendorf J, Spencer FA, Rezende SM, Zakai NA, Bauer KA, Dentali F, Lansing J, Balduzzi S, Darzi A, Morgano GP, Neumann I, Nieuwlaat R, Yepes-Nunez JJ, Zhang Y, Wiercioch W (2018) American Society of Hematology 2018 guidelines for management of venous thromboembolism: prophylaxis for hospitalized and nonhospitalized medical patients. Blood Adv 2:3198–3225
91. Bateman AP, McArdle F, Walsh TS (2009) Time course of anemia during six months follow up following intensive care discharge and factors associated with impaired recovery of erythropoiesis. Crit Care Med 37:1906–1912
92. Hayden SJ, Albert TJ, Watkins TR, Swenson ER (2012) Anemia in critical illness: insights into etiology, consequences, and management. Am J Respir Crit Care Med 185:1049–1057
93. Jelkmann I, Jelkmann W (2013) Impact of erythropoietin on intensive care unit patients. Transfus Med Hemother 40:310–318
94. Vlaar AP, Oczkowski S, de Bruin S, Wijnberge M, Antonelli M, Aubron C,Aries P, Duranteau J, Juffermans NP, Meier J, Murphy GJ, Abbasciano R, Muller M, Shah A, Perner A, Rygaard S, Walsh TS, Guyatt G, Dionne JC, Cecconi M (2020) Transfusion strategies in non-bleeding critically ill adults: a clinical practice guideline from the European Society of Intensive Care Medicine. Intensive Care Med 46:673–696
95. Thau MR, Liu T, Sathe NA, O’Keefe GE, Robinson BRH, Bulger E, Wade CE, Fox EE, Holcomb JB, Liles WC, Stanaway IB, Mikacenic C, Wurfel MM, Bhatraju PK, Morrell ED (2023) Association of trauma molecular endotypes with differential response to transfusion resuscitation strategies. JAMA Surg 158:728–736
96. Wu J, Vodovotz Y, Abdelhamid S, Guyette FX, Yaffe MB, Gruen DS, Cyr A,Okonkwo DO, Kar UK, Krishnamoorthi N, Voinchet RG, Billiar IM, Yazer MH, Namas RA, Daley BJ, Miller RS, Harbrecht BG, Claridge JA, Phelan HA, Zuckerbraun BS, Johansson PI, Stensballe J, Morrissey JH, Tracy RP, Wisniewski SR, Neal MD, Sperry JL, Billiar TR, Group PAs (2021) Multi-omic analysis in injured humans: patterns align with outcomes and treatment
responses. Cell Rep Med 2:100478
97. Jansen JO, Hudson J, Cochran C, MacLennan G, Lendrum R, Sadek S, Gillies K, Cotton S, Kennedy C, Boyers D, Ferry G, Lawrie L, Nath M, Wileman S, Forrest M, Brohi K, Harris T, Lecky F, Moran C, Morrison JJ, Norrie J, Paterson A, Tai N, Welch N, Campbell MK, Group U-RS, Aylwin C, Bew D, Brooks A, Chinery J, Cowlam T, Frith D, George A, Hudson A, Johnstone P, Mahmood A, Novak A, O’Meara M, Reid S, Sattout A, Smith C, Stansfield T,
Thompson J, (2023) Emergency department resuscitative endovascular balloon occlusion of the aorta in trauma patients with exsanguinating hemorrhage: the UK-REBOA randomized clinical trial. JAMA
98. Cole E, Weaver A, Gall L, West A, Nevin D, Tallach R, O’Neill B, Lahiri S, Allard S, Tai N, Davenport R, Green L, Brohi K (2021) A decade of damage control resuscitation: new transfusion practice, new survivors, new directions. Ann Surg 273(6):1215–1220. https:// doi. org/ 10. 1097/ SLA. 00000 00000 003657
[~DETAIL_TEXT] =>
Cheryl L. Maier, Karim Broh2, Nicola Curry, Nicole P. Juffermans, Lidia Mora Miquel, Matthew D. Neal,Beth H. Shaz, Alexander P. J. Vlaar and Julie Helms
REVIEW Contemporary management of major haemorrhage in critical care
Intensive Care Med (2024) 50:319–331
https://doi.org/10.1007/s00134-023-07303-5
Абстракт
Геморрагический шок часто встречается в отделениях интенсивной терапии и является причиной высокого уровня смертности из-за полиорганной дисфункции и коагулопатии. Лечение больных к критическом состоянии с кровотечением и шоком является сложным . Введение больших объемов компонентов крови приводит к серьезным физиологическим изменениям, которые необходимо коррелировать во время и после кровотечения. Раннее распознавание кровотечения и коагулопатии, понимание основной патофизиологии, связанной с конкретными патологическими состояниями, а также разработка индивидуальных протоколов лечения важны для достижения оптимальных результатов. В обзоре описаны современные представления о патофизиологии различных типов коагулопатических кровотечений; диагностика и ведение больных с кровотечением в критическом состоянии, включая протоколы лечения массивных кровотечений и ведение пациентов после переливания крови; и, наконец, освещает недавние области возможностей, позволяющие лучше понять оптимальные стратегии лечения кровотечений в отделениях интенсивной терапии (ОИТ).
Ключевые слова: массивное переливание крови, кровотечение, критическое состояние, кровотечение, коагулопатия.
Введение
Массивные кровотечения встречаются в ОИТ с частотой от 5 до более 50%, и по-прежнему связаны с высокой смертностью [1-3]. Оценка точной частоты крупных кровотечений в различных популяциях пациентов была сложной задачей, по крайней мере частично, из-за различий в критериях, используемых для их определения. Международное общество по тромбозам и гемостазу (ISTH) определяет большое кровотечение как симптоматическое кровотечение в критичной зоне или органе и/или кровотечение, которое вызывает падение гемоглобина на ≥ 2 г/дл или приводит к переливанию ≥ 2 единиц цельной крови или эритроцитов [4].
Кровотечение и геморрагический шок приводят к развитию нарушений гемостаза и коагулопатии, которые могут усугубляться или осложняться сопутствующими или основными заболеваниями, присутствующими у пациентов в критическом состоянии. Ведение этих пациентов сложное, и стратегии по остановке или уменьшению кровотечения должны быть быстрыми и окончательными.Кроме того, введение больших объемов компонентов крови, которые могут быть сбалансированы или не сбалансированы по количеству переливаемых эритроцитов, тромбоцитов и продуктов плазмы, может привести к серьезным физиологическим изменениям, которые необходимо коррелировать во время и после кровотечения. Раннее распознавание кровотечения и коагулопатии, понимание патофизиологии конкретных патологических состояний и эффективное индивидуальное лечение важны для обеспечения оптимальных результатов.
Общая цель этого обзора — описать современное понимание патофизиологии, диагностики и ведения пациентов с массивным кровотечением в условиях ОИТ. Сначала мы рассмотрим патофизиологию различных типов коагулопатических кровотечений, обычно встречающихся при критических заболеваниях, в том числе у пациентов с травмами, послеродовыми кровотечениями, хроническими заболеваниями печени, диссеминированным внутрисосудистым свертыванием крови и уремией. Далее мы обсудим диагностику и обследование пациентов в критическом состоянии с коагулопатическим кровотечением, а затем опишем основные протоколы лечения кровотечений, актуальные для пациентов с массивными кровотечениями. Учитывая уникальные подходы, необходимые пациентам после массивного кровотечения, мы резюмируем посттрансфузионное лечение, включая поддержку кровообращения и профилактику тромбоэмболических осложнений.Наконец, мы выделяем дополнительные соображения и области возможностей для лучшего определения оптимальных стратегий управления кровотечениями в ОИТ.
Патофизиология геморрагических коагулопатий
Различные патологические процессы, приводящие к кровотечению, приводят к различным моделям коагулопатии, которые необходимо понимать для обеспечения оптимального лечения. Несмотря на то, что существуют области дублирования, и может быть привлекательно упростить ведение лечения с помощью единого протокола массивного кровотечения (MHP), необходимо учитывать критические различия, чтобы гарантировать достижение гемостаза без немедленных или отдаленных осложнений.
Кровотечение, связанное с травмой
Наибольшему риску развития тяжелого кровотечения подвергаются пациенты с более высокой тяжестью травмы и лица с гиповолемическим шоком [5]. Множественные нарушения коагуляции, которые могут привести к травматической коагулопатии (TIC ), способствуют неэффективному гемостазу на раннем этапе после травмы. Центральными признаками TIC являются усиление фибринолиза, активация пути протеина С, дисфункция тромбоцитов и потребление факторов свертывания крови. Они сопровождаются активацией эндотелия с увеличением проницаемости сосудов микроциркуляторного русла и потерей эндотелиального гликокаликса. Гиперфибринолиз является одним из наиболее частых изменений после тяжелой травмы и может сопровождать даже легкую или умеренную травму [6]. Усиление фибринолиза, вероятно, опосредовано повышенной активностью плазмина в результате высокого уровня тканевого активатора плазминогена (tPA), высвобождающегося активированными эндотелиальными клетками. Уровни фибриногена падают до критически низкого уровня на ранних стадиях кровотечения, связанного с травмой, что является следствием усиленного распада фибриногена (фибриногенолиза), широкого потребления фибриногена и дилюционным эффектом инфузионной терапии [7].
Гипофибриногенемия также может отражать или усугубляться низким запасом фибриногена.Считается, что высокие уровни активированного протеина С (APC) являются одним из центральных эффекторов раннего гипокоагуляционного состояния. APC вызывает ингибирование FVa и FVIIIa, уменьшая образование тромбина, а также связывается с ингибитором активатора плазминогена-1, предотвращая его ингибирующее действие на t-PA и тем самым позволяя бесконтрольно продолжать фибринолиз. Дисфункция тромбоцитов проявляется глобальным снижением агрегации, часто описываемым как «истощение тромбоцитов», что усугубляет состояние гипокоагуляции. Механизмы дисфункции тромбоцитов до конца не изучены, хотя недавние данные указывают на нарушение мобилизации кальция, изменения GpVI или прямую атаку высвобождаемых при повреждении гистонов. Прямая травма, шок, выброс катехоламинов и гипоксия способствуют активации эндотелия, тогда как считается, что изменения в реологии крови лежат в основе разрушения эндотелиального гликокаликса.
Послеродовое кровотечение
Коагулопатия, связанная с послеродовым кровотечением (PPH ), еще не изучена так подробно, как TIC . Большинство случаев РРН не связано с коагулопатией, хотя кровотечение большого объема (т.е. более 3 л) связано с дилюционной коагулопатией или коагулопатией потребления. «Острая акушерская коагулопатия» — похожая на сложную многофакторную коагулопатию, наблюдаемую при TIC и характеризующуюся массивным фибринолизом, — встречается гораздо реже [8] и встречается в 1,06 случаев на 1000 беременностей. Беременность ассоциируется со значительным повышением уровня циркулирующего фибриногена, а уровень фибриногена ниже 2 г/л в начале РРН тесно связан с большей потребностью в переливании большого объема крови [9]. (Table 1). Две явные клинические ситуации, при которых возникает острая акушерская коагулопатия, включают эмболию околоплодными водами и отслойку плаценты. Острая акушерская коагулопатия имеет общие черты с TIC : она проявляется глубоким и быстрым снижением уровня фибриногена и выраженным гиперфибринолизом [8]. У этих рожениц также выявляют дисфибриногенемию, что не является подтвержденным признаком TIC. Таким образом, измерение фибриногена и адекватная его замена имеют решающее значение при оказании помощи таким пациенткам.

Хроническое заболевание печени
Примерно у каждого восьмого пациента с хроническим заболеванием печени (CLD ), находящегося на лечении в ОИТ, развивается значительное кровотечение по определению ISTH [10]. Три четверти случаев представляют собой желудочно-кишечные кровотечения [11], и более чем в 90% этих случаев основной причиной является портальная гипертензия. CLD связано с дефицитом факторов свертывания крови, дисфункцией тромбоцитов и гиперфибринолизом [12] (Table 1). Однако в этих системах также происходят прогемостатические изменения, которые уравновешивают эти гипокоагуляционные тенденции. Хотя рутинные лабораторные тесты обычно показывают тромбоцитопению, а также удлинение протромбинового времени (РТ), пациенты с компенсированным CLD не подвергаются большему риску кровотечения и не защищены от тромбоза. Однако пациенты имеют сниженный резерв свертывания крови и малоустойчивы к ряду заболеваний и травмам. В случае декомпенсации или развития инфекции, пациенты подвергаются риску как кровотечения, так и тромбоза [12].
Несмотря на сложность нарушений коагуляции при CLD , наиболее частой причиной острого кровотечения является кровотечение из варикозных вен, и для успешного лечения приоритет отдается методам, направленным на снижение портального давления, а не на инфузионную терапию в больших объемах и коррекцию выраженных функциональных нарушений коагуляции [13].
Диссеминированная внутрисосудистая коагулопатия
Диссеминированная внутрисосудистая коагулопатия (ДВС) — это приобретенное состояние, которое всегда является вторичным по отношению к основному состоянию, чаще всего сепсису, но также и другим заболеваниям, таким как злокачественные новообразования, травмы или акушерские осложнения. ДВС-синдром характеризуется системной активацией коагуляции, что приводит к распространенному образованию внутрисосудистых тромбов, богатых фибрином, вызывающих окклюзию сосудов малого и среднего калибра и последующую органную дисфункцию [14]. Сложная патофизиология ДВС-синдрома может приводить к тромбозам, кровотечениям или смешанным фенотипам [14, 15]. Помимо истощения тромбоцитов и факторов свертывания крови, уровень физиологических антикоагулянтов, таких как антитромбин и протеин С снижается из-за потребления и экстравазации вследствие повышенной проницаемости микрососудов. Значительно повышенный уровень продуктов деградации фибрина и системное воспаление вызывают дисфункцию тромбоцитов и препятствуют сшиванию фибрина, что еще больше способствует кровотечению. У пациентов с ДВС-синдромом может развиться массивное кровотечение, в зависимости от его фенотипа [14]; следовательно, лечение ДВС-синдрома зависит от его фенотипа и основного заболевания.
Уремия
Уремическое кровотечение является общепризнанным осложнением у пациентов с хронической почечной недостаточностью [16]. К сожалению, несмотря на то, что это относительно распространенная причина кровотечений, о механизме, лежащем в его основе, мало что известно.Дисфункция тромбоцитов, по-видимому, является доминирующим отклонением. Считается, что это является следствием множественных изменений, в том числе дисфункции фактора фон Виллебранда. (снижение способности связываться с гликопротеином тромбоцитов GP1b), что уменьшает привязку тромбоцитов к местам повреждения сосудов и сложных изменениях в ключевых сигнальных путях агонистов тромбоцитов [17]. Последнее включает снижение продукции тромбоксана, повышение уровня простациклина I2, повышение уровня циклического AMP/GMP , повышение уровня уремических токсинов и изменение гранул тромбоцитов, все из которых необходимы для нормальной агрегации тромбоцитов. Следовательно, переливание тромбоцитов в такие условиях не устраняет дисфункцию тромбоцитов.
Приобретенная коагулопатия, вторичная по отношению к антикоагулянтам
Многие пациенты в критическом состоянии получают антикоагулянты либо в качестве тромбопрофилактики, либо в качестве антикоагулянтной терапии, связанной с острым или основным заболеванием. Кровотечение может быть основной причиной госпитализации в ОИТ или может развиться во время пребывания там. Многоцентровое ретроспективное французское исследование показало, что частота пациентов, поступивших в ОИТ по поводу тяжелых экстракраниальных кровотечений, связанных с приемом антикоагулянтов, увеличилась с 3,2 на 1000 госпитализаций в 2007 году до 5,8/1000 в 2018 г., при этом уровень смертности составил 27% [18]. В этой когорте пациенты до госпитализации принимали антагонисты витамина К (VKA , 54%), гепарины (25%) или пероральные антикоагулянты прямого действия (DOAC, 7%). Экстракраниальное кровотечение, связанное с применением антикоагулянтов, требующее госпитализации в ОИТ, является серьезным осложнением антикоагулянтной терапии, которое может привести к органной недостаточности и значительной смертности. К сожалению, нынешнее терапевтическое лечение часто неоптимально, что, по крайней мере частично, связано с ограничениями лабораторного мониторинга, отсутствием опыта клинического лечения или отсутствием технологий отмены некоторых препаратов. Необходимы образование и разработка антикоагулянтных реверсивных агентов и протоколов, в дополнение к более доступным лабораторным измерениям гемостаза у пациентов, получающих антикоагулянтную терапию.
Диагностика и оценка
Раннее распознавание кровотечения у пациентов в критическом состоянии имеет важное значение для предотвращения развития шока и органной недостаточности. К сожалению, это может быть непросто, учитывая различные основные состояния, присутствующие у пациентов ОИТ. Оценка некоторых клинических и лабораторных параметров, связанных с геморрагическим шоком, таких как новая или ухудшающаяся тахикардия, тахипноэ или сужение пульсового давления, которые являются физиологической реакцией на низкий объем крови, может быть ранними клиническими признаками значительной гиповолемии [1]. Внезапное увеличение уровня лактата или дефицита оснований может быть полезным в качестве триггера начала лечения [19]. Однако все эти параметры могут быть замаскированы другими гемодинамическими нарушениями, включая синдром системной воспалительной реакции, септический шок, кардиогенный шок и применение инотропных и вазопрессорных препаратов. Иногда отклонения, отмеченные при лабораторных тестах, такие как снижение количества тромбоцитов или удлинение протромбинового времени (PT)/активированного частичного тромбопластинового времени (aPTT ), могут сигнализировать персоналу о развивающейся коагулопатии.
Хотя ожидается снижение гемоглобина, важно отметить, что гемоглобин может не падать резко из-за тяжести кровотечения и отставания компенсаторных механизмов. Действительно, наличие гемодинамической декомпенсации при нормальных показателях крови или коагуляции может быть окончательным признаком неконтролируемого скрытого кровотечения, требующего хирургического вмешательства. В конечном счете, важно поддерживать высокую настороженность , а также искать и исключать кровотечение как причину клинической декомпенсации. Признание тяжести и этиологии коагулопатии пациента также важно для надлежащего и индивидуализированного лечения.Традиционные лабораторные тесты, включая PT, aPTT, уровень фибриногена и наличие продуктов распада фибрина (например, D-димера), являются основой диагностики (table 2).

Увеличение D-димера в течение 2 дней недавно было идентифицировано как практический маркер для прогнозирования острого фибринолиза, предшествующего возникновению геморрагических осложнений у пациентов, находящихся на экстракорпоральной мембранной оксигенации (ECMO) [20].Функциональные вискоэластические тесты (тромбоэластометрия) могут дать более быструю и полную картину коагулопатии, чтобы назначить лечение. Использование данных тестов вместе с алгоритмами лечения коагулопатий показало преимущества при лечении кровотечений в кардиохирургии [21] и может быть полезным в акушерстве [22, 23], гепатологии [24, 25] и в других группах пациентов. Вискоэластичные тесты могут помочь диагностировать гиперфибринолиз, хотя и с низкой чувствительностью.
Например, Levrat et al. [26] обнаружили гиперфибринолиз только у 6% своих пациентов (5 из 83 истинно положительных пациентов), используя для диагностики ротационную тромбоэластометрию (ROTEM) и ELT (время лизиса эуглобулина) в качестве золотого стандарта. Было установлено, что у пациентов с коротким ELT (диагноз гиперфибринолиза) коррелирует с максимальной плотностью сгустка (MCF) и амплитудой сгустка на 10 и 15 мин, которые являются косвенными графическими параметрами. Важно отметить, что ELT обычно не проводится в большинстве лабораторий из-за серьезных проблем, связанных с методологией анализа. Наконец, у многих пациентов в критическом состоянии наблюдаются нарушения свертываемости крови в зависимости от заболевания, которые нормализуются при лечении основного заболевания. Таким образом, при отсутствии острого или предстоящего кровотечения нарушения коагуляции могут не требовать коррекции.
Протоколы лечения массивных кровотечений
Ведение пациентов в критическом состоянии с массивным кровотечением и связанной с ним коагулопатией требует оказания стандартизированной, научно обоснованной междисциплинарной помощи [27–32]. Сложность можно уменьшить, если иметь согласованный протокол оказания помощи при массивном кровотечении (MHP) ( также известный как протокол массивной трансфузии), хотя он еще не принят повсеместно [33]. Было показано, что внедрение MHP способствует выживанию пациентов и минимизирует осложнения массивной трансфузии, которую обычно определяют как переливание как минимум 10 единиц эритроцитов (RBC) в течение 24 часов [32,34–37].Первоначально MHP были разработаны для лечения массивных кровотечений у пациентов с травмами и были адаптированы для других клинических условий. Хотя MHP оптимизировали оказание помощи при массивных кровотечениях, некоторые компоненты могут быть основаны на предвзятых обсервационных исследованиях [38]. Одним из примеров является высокое соотношение плазмы к эритроцитам, которое, как предполагается, приводит к значительному снижению смертности (от 65 до 19%) [39]. После проведения временного анализа эффект смертности исчез [40].Хотя ни одно рандомизированное исследование не смогло подтвердить выводы первоначальных наблюдательных исследований, высокое соотношение плазмы-эритроцитов получило широкое распространение, включая пациентов с массивным кровотечением без травм. В обзоре использования высокого и низкого соотношения плазмы к эритроцитам в одной больнице США, где более 90% пациентов, подвергшихся массивному переливанию крови, не были пациентами с травмами, высокое соотношение плазмы к эритроцитам не было связано с улучшением исхода. 41].
Примечательно, что само по себе переливание эритроцитов не обеспечивает коррекции коагулопатии и даже способствует дилюционной коагулопатии. Поэтому плазма и тромбоциты важны после переливания больших объемов эритроцитов для предотвращения или коррекции коагулопатии.D-отрицательные женщины детородного потенциала (FCP — женщины до 50 лет), которые не могут дождаться типоспецифической или перекрестно-совместимой крови, обычно получают резус-отрицательные эритроциты группы O (RhD-) до тех пор, пока не будет определена их группа крови, чтобы предотвратить аллоиммунизацию и будущее развитие RhD+-ассоциированной гемолитической болезни плода и новорожденного (HDFN). Однако риск летального исхода в результате посттравматического кровотечения должен быть приоритетнее потенциального риска аллоиммунизации (20% для экстренной гемотрансфузии). Риск переливания RhD-положительной крови действительно считался низким на догоспитальном этапе [42]. Другое исследование, в котором рассматривались пациентки фертильного возраста с травмой, получившие RhD-положительные эритроциты, показало, что риск беременности, связанной с HDFN, может быть тем выше, чем моложе была пациентка , когда ей переливали RhD-положительные эритроциты [43]. В настоящее время ряд продуктов включается в MPH, особенно в травматологических отделениях
Из-за ограниченной доступности плазмы группы АВ и резкого роста спроса на нее используется плазма группы А. Имеющиеся на сегодняшний день данные подтверждают использование плазмы группы А, вероятно, из-за того, что пациенты получают эритроциты группы О. Еще одним недавним изменением является использование цельной крови группы О с низким титром для немедленного лечения травматического кровотечения [44]. Эти продукты имеют низкие титры анти-А и анти-, хотя стандартные титры не используются. Наконец, используются тромбоциты, хранящиеся в холодильнике, срок годности которых составляет 14 дней. Тромбоциты, хранящиеся в холоде, уже частично активируются и, таким образом, выводятся в течение 24 часов [45].
Этот протокол может быть более эффективным при геморрагических заболеваниях, но клинические испытания все еще продолжаются. MHP, включающие заранее заданные соотношения препаратов для трансфузии , позволяют врачам иметь время для остановки кровотечения, минимизировать использование кристаллоидов и понять суть коагулопатии, чтобы как можно скорее разработать более персонализированное лечение. Разработка основанной на протоколах структуры доставки продуктов крови, алгоритмов лабораторных исследований и других аспектов оказания помощи пациентам (использование препаратов, таких как транексамовая кислота или подогрев крови, для предотвращения гипотермии) остается важной для обеспечения немедленных действий в случаетяжелых и экстренных случаев. Кроме того, эти протоколы полагаются на командную работу, ситуационную осведомленность, общение, определение задач, распределение и принятие решений [32, 46, 47]. MHP должен разрабатываться как междисциплинарный и согласованный протокол с руководством трансфузиологом. Структура содержания протокола должна быть адаптирована к возможностям каждой больницы и соответствовать политике и правилам каждого учебного центра или организации. В протоколе должны быть подробно описаны процедуры и критерии оповещения лечащих врачей у постели больного и предоставления препаратов службой переливания крови.Нужно четко определить показатели качества и критерии проверки, такие как потери продукта, результаты лечения пациентов, лабораторные исследования, а также целесообразность пересмотра протокола [30, 36, 48, 49]. Обзор практики, результатов и использования MHP должен проводиться регулярно, с обновлением протокола для включения новых фактических данных и улучшения местной практики.
Центральным аспектом MHP является упрощенная доставка пациентам крови и ее компонентов.После получения заявки служба переливания крови должна иметь возможность быстро и стабильно предоставлять необходимые продукты крови. Это требует эффективного взаимодействия между службой переливания крови и клиническими бригадами без ненужных действий. Большинство протоколов обеспечивают базовое сбалансированное переливание эритроцитов и компонентной терапии (плазма, тромбоциты) в эмпирических упаковках, которые при необходимости дополняются дополнительными методами лечения. Эритроциты группы O (эритроциты) должны быть предоставлены пациентам без необходимости подтверждения группы крови. Большинство MHP поддерживают использование принципов инфузионной терапии с контролем повреждений, включая высокие соотношения плазмы к эритроцитам и тромбоцитов к эритроцитам [50]. Пример упаковки MHP может включать 4 единицы эритроцитов и 4 единицы плазмы и может включать компоненты тромбоцитов или криопреципитата (Fig. 1).

За последние несколько лет некоторые организации здравоохранения начали использовать цельную кровь. Цельная кровь содержит эритроциты, плазму и тромбоциты, что позволяет легче вводить ее по сравнению с отдельными компонентами крови, одновременно уменьшая дополнительное введение жидкости [51]. Однако цельная кровь не является универсально доступной, и компонентная терапия может оказаться более подходящей в некоторых больницах. Современные рекомендации рекомендуют дополнять эмпирическое введение препаратов для сбалансированной реанимации дополнительными средствами коагуляционной терапии, назначаемыми для лечения установленных коагулопатий, диагностированных по результатам вискоэластических или обычных коагуляционных тестов [27, 28,52–56]. Эти методы лечения могут включать концентраты фибриногена (или криопреципитат), концентраты тромбоцитов, концентраты прокоагулянтов или транексамовую кислоту. Эта стратегия, графически проиллюстрированная на Figs. 1 and 22, позволяет постоянно проводить повторную оценку развития коагулопатии, вызванной гемодилюцией, и лечить любые установленные нарушения коагуляции [57–59]. Как указано выше, важно контекстуализировать результаты коагуляционных тестов в контексте известного состояния (травма, PPH,CLD ) и соответствующим образом адаптировать лечение.

Концентраты протромбинового комплекса (PCCs ) рассматривались в некоторых MHP, хотя их роль остается неясной. Четырехфакторный (фактор II, фактор VII, фактор IX и фактор X) концентрат протромбинового комплекса в основном показан для устранения антагонистов витамина К [60], но иногда используется не по назначению для обеспечения витамин-К-зависимых факторов свертывания крови в различных клинических условиях. В зависимости от конкретного PCC продукты также содержат небольшое количество белков C, S и Z, нефракционированный гепарин или антитромбин. Хотя несколько ретроспективных исследований с сопоставлением по склонности предположили, что PCCs могут улучшить выживаемость и снизить общее потребление продуктов крови [61–64], исследование PROCOAG [65] недавно показало явное неблагоприятное соотношение риска и пользы при эмпирическом назначении PCCs пациентам с травмами. Действительно, у 327 пациентов с травмами, подвергающихся риску массивной гемотрансфузии, эмпирическое введение четырехфакторного концентрата протромбинового комплекса в сочетании с СЗП не смогло снизить общее потребление продуктов крови и значительно увеличило количество тромбоэмболических событий по сравнению с плацебо (относительный риск 1,48 [95] % ДИ 1,04–2,10];p = 0,03). Аналогичным образом, хотя кровотечение усугубляется острым дефицитом фибриногена, исследование RYOSTAT-2 [66] показало, что раннее эмпирическое введение высокой дозы криопреципитата (3 дозы; 6 г эквивалента фибриногена) в дополнение к стандартному лечению в течение 3 часов после травмы не улучшило 28-дневную смертность от всех причин ((ОШ 0,96 [95% ДИ 0,75–1,23]; p = 0,74). Оба исследования подчеркивают, что эмпирическое введение концентратов факторов свертывания крови больше не рекомендуется.
Ведение пациентов после кровотечения и массивной трансфузии
После массивного переливания крови и остановки кровотечения пациенты находятся в резко измененном и сложном физиологическом состоянии, требующем тщательного наблюдения и целенаправленной помощи для уменьшения дальнейших осложнений и оптимизации результатов.Широкомасштабная активация иммунной системы может привести к системному воспалительному состоянию, которое может быть дисрегулировано и сопровождаться иммунной супрессией и сепсисом [67, 68]. Кроме того, за геморрагическим шоком может наблюдаться гипердинамическое состояние с высоким сердечным выбросом и расширением сосудов, которое может маскировать продолжающуюся гиповолемию. Ишемия миокарда во время глубокого геморрагического шока может вызвать сердечную дисфункцию, которую трудно отличить от других состояний шока. Наконец, за начальной коагулопатией, связанной с кровотечением, может последовать рикошетная гиперкоагуляция с компенсаторной активацией гемостаза и протромботическим состоянием [14].Этот переход может произойти на очень ранних стадиях клинического течения и может усугубляться задержкой или чрезмерным введением прокоагулянтов или антифибринолитиков [69].
Поддержка кровообращения
Пациентам может продолжать требоваться инфузионная терапия после массивной трансфузии из-за утечки капилляров, связанной с расширением сосудов и повышенной проницаемостью эндотелия. Использование больших объемов кристаллоидов при травматическом геморрагическом шоке связано с повышенной смертностью и увеличением проницаемости эндотелия, что может быть связано с отторжением гликокаликса и разрушением адгезивных и плотных соединений [70]. Поэтому кристаллоиды следует использовать разумно. Переливание эритроцитов может быть целесообразным, если уровень гемоглобина низкий. Использование богатых белком жидкостей, таких как плазма, по сравнению с кристаллоидами, было связано с восстановлением толщины гликокаликса в экспериментальных моделях травмы [71–73]. Исследования на людях с травмами также предполагают полезную роль плазмы в поддержании целостности гликокаликса [74, 75]. У пациентов после травмы или операции, перенесших тяжелый геморрагический шок, развивается гипердинамияс картиной распределительного шока из-за системной воспалительной реакции. Для поддержания перфузионного давления часто требуется раннее введение вазопрессоров. Это может маскировать относительную или абсолютную гиповолемию. Кроме того, вторичное повреждение миокарда вследствие ишемии и воспаления также может возникать после глубокого шока, о чем свидетельствует повышение уровня тропонина в течение 24–48 часов, приводящее к сердечной дисфункции [76, 77]. Это может усугубляться ранними электролитными нарушениями, такими как гиперкалиемия и гипокальциемия. При наличии дополнительного компонента кардиогенного шока инотропные средства (такие как милринон, добутамин или адреналин) могут усиливать поддержку дистрибутивного и/или гиповолемического шока. Таким образом, лечение данных пациентов является сложным, требующим тонкого баланса жидкостей, вазопрессоров и инотропных средств, и данные в этой области ограничены.
Тромбопрофилактика
Пациенты, перенесшие шок и массивное переливание крови, находятся в состоянии гиперкоагуляции. Исследования продемонстрировали переход к состоянию гиперкоагуляции в течение 48 часов после травмы и, возможно, в течение 3–6 часов после травмы [78]. Венозная тромбоэмболия встречается у 20% пациентов с травмами и остается высокой даже при фармакологической тромбопрофилактике [79]. При черепно-мозговой травме одной из потенциальных причин, объясняющих высокий риск тромбоэмболических осложнений после массивного кровотечения, является избегание или отсрочка применения фармакологической тромбопрофилактики из-за страха усугубления или повторных кровотечений, что еще больше увеличивает риск венозной тромбоэмболии (VTE) [80, 81]. Действительно, хотя было показано, что тромбопрофилактика снижает риск VTE, имеются некоторые доказательства того, что раннее начало тромбопрофилактики может быть связано с необходимостью повторного хирургического вмешательства [82]. В 2020 году Western Trauma Association ассоциация выпустила алгоритм профилактики ВТЭ после травмы, чтобы помочь определить, какие пациенты нуждаются в фармакологической профилактике, а также ее тип и дозирование [83]. Данные о прогрессировании внутричерепного кровоизлияния после начала профилактики VTE противоречивы. Существует мало доказательств того, что стандартные дозы гепарина или низкомолекулярных гепаринов связаны с посттравматическими кровотечениями за пределами центральной нервной системы. Отказ от профилактики VTE в течение длительного периода из-за опасений усугубления кровотечения не имеет достаточных оснований и может привести к вреду, поскольку задержки и пропуск доз профилактики VTE связаны с повышенным риском ее развития [84]. Имеются убедительные доказательства в пользу использования низкомолекулярного гепарина (LMWH ) вместо нефракционированного гепарина (UFH ) [85]. Пациентам с травмами могут потребоваться промежуточные или высокие дозы LMWH, поскольку недавние данные свидетельствуют о том, что резистентность к LMWH может быть распространена у пациентов с тяжелыми травмами, связанными с дефицитом антитромбина [79]. Это может быть еще одним фактором, способствующим высокой частоте LMWH , несмотря на текущую «лучшую практику» химиопрофилактики. К сожалению, в настоящее время имеется мало доказательств для определения оптимальной тромбопрофилактики у пациентов без травм. Хотя роль механической тромбопрофилактики до сих пор дискутируется, а имеющиеся данные дают противоречивые результаты [86, 87], европейские руководства рекомендуют использование механической профилактики у пациентов с противопоказаниями к антикоагулянтной терапии (класс 1В) и предлагают использование периодической пневматической профилактики или чулки с градуированной компрессией (степень 2В) [88, 89]. Американские рекомендации не поддерживают использование комбинированной терапии вместо фармакологической терапии или компрессионной терапии [90].
Анемия
Анемия часто встречается среди пациентов в критическом состоянии в период выздоровления.Исследования показали, что анемией страдают 70–80% пациентов после перевода из ОИТ, причем почти у половины из них сохраняется анемия через 6 месяцев [91]. Анемия критических состояний является многофакторной, хотя ключевыми медиаторами являются низкий уровень эритропоэтина (EPO ), ятрогенная кровопотеря и функциональный дефицит железа (обусловленный высокими уровнями гепсидина) [92]. У тех пациентов, которые выживают после массивного переливания крови, кровопотеря и еще большее истощение запасов железа усугубляются анемией, что может ограничить способность пациента креабилитации. Было предложено превентивное лечение анемии критических состояний, с помощью EPO или железа, но это остается неопределенным и спорным [93].Европейские рекомендации не рекомендуют использовать ни EPO , ни железо у пациентов ОИТ [94], поскольку EPO может увеличить риск тромбоза у пациентов с прокоагулянтными состояниями, а железо может быть, по меньшей мере, неэффективным (или опасным) у пациентов с системным воспалением.
Дополнительные соображения
1. Индивидуализация алгоритмов лечения
Важно отметить, что протоколы, разработанные для лечения пациентов с одним источником массивного кровотечения, например, травмой, могут быть нелегко адаптированы к другим. Кроме того, даже у пациентов с одной и той же основной причиной кровотечения уникальные различия в ответе на переливание крови и протоколы лечения могут отражать дополнительные факторы, влияющие на патофизиологические процессы. Две недавние статьи [95, 96] подчеркивают существование уникальных эндотипов , которые могут помочь в выявлении пациентов, которые будут реагировать на различные варианты терапии.
2. Эндоваскулярная баллонная окклюзия аорты (REBOA)
Поскольку массивное кровотечение является наиболее распространенной причиной предотвратимой смерти после травмы, Jansen et al. [97] провели прагматичное байесовское РКИ для оценки эффективности REBOA в отношении смертности. Девяносто пациентов с травмами и обескровливающими кровотечениями были рандомизированы для получения либо стандартного лечения +REBOA, либо только стандартного лечения. Авторы показали, что стратегия, сочетающая REBOA и стандартную помощь, не снижает смертность и может даже увеличить смертность по сравнению с только стандартной помощью (54% против 42%; ОШ 1,58 [95% ДИ 0,72–3,52].
3. Поиски антикоагулянта «Святого Грааля»
Различные причины массивных кровотечений у пациентов в критическом состоянии сложно предотвратить, однако случаи, связанные с антикоагулянтной терапией, представляют собой ситуации, которые можно предотвратить за счет разработки более эффективных лекарств.Продолжается поиск антикоагулянта «Святого Грааля», который способен предотвращать тромботические явления, не влияя на общий гемостаз и, следовательно, не повышая риск кровотечений. На сегодняшний день почти все традиционные антикоагулянты ингибируют факторы II или X; и, учитывая существенную роль этих факторов в поддержании гемостаза в стабильных условиях, их использование несет в себе повышенный риск кровотечения, который не является незначительным.
Недавние исследования показали, что воздействие на другие факторы свертывания кровиозволит избежать этого риска. Контактно-фазовый (внутренний) путь обычно не важен для поддержания физиологического гемостаза, но принимает участие в развитии патологического тромбоза. Таким образом, некоторые предполагают, что ингибиторы, нацеленные на факторы XI (FXI) или XII, могут оказывать антитромботическое действие, не увеличивать риск кровотечения [86–89]. Были разработаны новые стратегии воздействия на FXI, включая использование олигонуклеотидов (ASO), которые уменьшают синтез FXI в печени или блокируют активацию или активность FXI с помощью антител, аптамеров или других небольших молекул [90]. Ингибирование FXI, вероятно, потребует тонкой настройки, поскольку может возникнуть серьезный дефицит FXI. приводят к более высокому риску небольших кровотечений слизистых оболочек (ротоглотки/носоглотки и мочеполовых путей) после травмы или хирургического вмешательства, учитывая фибринолитическую активность [90].Тем не менее, клиническая полезность трех классов ингибиторов контактного пути в настоящее время оценивается в исследованиях фазы 2 и 3 в различных клинических ситуациях (Table 2).
Заключение
Кровотечение остается частым осложнением, встречающимся в ОРИТ, которое требует понимания патофизиологии различных коагулопатических состояний для обеспечения надлежащего оказания помощи пациентам. Диагностика и оценка кровотечения и геморрагического шока могут быть трудными и зависят от сочетания клинических и лабораторных показателей. Пациентам с массивным кровотечением лучше всего оказывать поддержку с использованием протоколов лечения, разработанных многопрофильными бригадами, чтобы обеспечить быстрое и скоординированное реагирование. Лечение после массивного переливания крови является сложным и требует понимания многочисленных вовлеченных патологических процессов. Требуются дополнительные исследования, особенно в отношении нетравматических причин кровотечения. Тем не менее, значительное снижение смертности, осложнений, использования ресурсов и отходов может быть достигнуто с помощью планового, междисциплинарного и научно обоснованного подхода [98].
References
1. Hooper N, Armstrong TJ (2023) Hemorrhagic. ShockStatPearls, Treasure Island
2. Lauzier F, Arnold D, Rabbat C (2012) In medical-surgical ICU patients, major bleeding is common but independent of heparin prophylaxis. Crit Care 16(Suppl 1):P435
3. Russell L, Holst LB, Kjeldsen L, Stensballe J, Perner A (2017) Risks of bleeding and thrombosis in intensive care unit patients with haematological malignancies. Ann Intensive Care 7:119
4. Schulman S, Kearon C, Subcommittee on Control of Anticoagulation of the S, Standardization Committee of the International Society on T, Haemostasis (2005) Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. J Thromb
Haemost 3:692–694
5. Moore EE, Moore HB, Kornblith LZ, Neal MD, Hoffman M, Mutch NJ,Schochl H, Hunt BJ, Sauaia A (2021) Trauma-induced coagulopathy. NatRev Dis Primers 7:30
6. Raza I, Davenport R, Rourke C, Platton S, Manson J, Spoors C, Khan S, De’Ath HD, Allard S, Hart DP, Pasi KJ, Hunt BJ, Stanworth S, MacCallum PK, Brohi K (2013) The incidence and magnitude of fibrinolytic activation in trauma patients. J Thromb Haemost 11:307–314
7. Rourke C, Curry N, Khan S, Taylor R, Raza I, Davenport R, Stanworth S, Brohi K (2012) Fibrinogen levels during trauma hemorrhage, response to replacement therapy, and association with patient outcomes. J Thromb Haemost 10:1342–1351
8. de Lloyd L, Jenkins PV, Bell SF, Mutch NJ, Martins Pereira JF, Badenes PM, James D, Ridgeway A, Cohen L, Roberts T, Field V, Collis RE, Collins PW (2023) Acute obstetric coagulopathy during postpartum hemorrhage is caused by hyperfibrinolysis and dysfibrinogenemia: an observational cohort study. J Thromb Haemost 21:862–879
9. Charbit B, Mandelbrot L, Samain E, Baron G, Haddaoui B, Keita H, Sibony O, Mahieu-Caputo D, Hurtaud-Roux MF, Huisse MG, Denninger MH, de Prost D, Group PPHS (2007) The decrease of fibrinogen is an early predictor of the severity of postpartum hemorrhage. J Thromb Haemost 5:266–273
10. Schulman S, Angeras U, Bergqvist D, Eriksson B, Lassen MR, Fisher W, Subcommittee
on Control of Anticoagulation of the S, Standardization Committee of the International Society on T, Haemostasis (2010) Definition of major bleeding in clinical investigations of antihemostatic medicinal products in surgical patients. J Thromb Haemost 8:202–204
11. Ow TW, Fatourou E, Rabinowich L, van den Boom B, Nair S, Patel VC, Hogan B, McPhail M, Roberts LN, Bernal W (2022) Prevalence of bleeding and thrombosis in critically ill patients with chronic liver disease. Thromb Haemost 122:1006–1016
12. van den Boom BP, Lisman T (2022) Pathophysiology and management of bleeding and thrombosis in patients with liver disease. Int J Lab Hematol 44(Suppl 1):79–88
13. Roberts LN (2021) Rebalanced hemostasis in liver disease: a misunderstood coagulopathy. Hematol Am Soc Hematol Educ Progr 2021:485–491
14. Helms J, Iba T, Connors JM, Gando S, Levi M, Meziani F, Levy JH (2023) How to manage coagulopathies in critically ill patients. Intensive Care Med 49:273–290
15. Levi M, Scully M (2018) How I treat disseminated intravascular coagulation. Blood 131:845–854
16. Hedges SJ, Dehoney SB, Hooper JS, Amanzadeh J, Busti AJ (2007) Evidence-based treatment recommendations for uremic bleeding. Nat Clin Pract Nephrol 3:138–153
17. Hunt BJ (2014) Bleeding and coagulopathies in critical care. N Engl J Med 370:847–859
18. Botrel T, Cunat S, Helms J, Lemarie J, Gaillon J, Preau S, Favory R, Thille AW, Boissier F, Maury E, Joffre J, Ait-Oufella H (2023) Extracranial anticoagulant related bleedings admitted to intensive care units: a French multicenter retrospective study. Crit Care 27:312
19. Mutschler M, Nienaber U, Brockamp T, Wafaisade A, Fabian T, Paffrath T, Bouillon B, Maegele M, TraumaRegister DGU (2013) Renaissance of base deficit for the initial assessment of trauma patients: a base deficit-based classification for hypovolemic shock developed on data from 16,305 patients derived from the TraumaRegister DGU(R). Crit Care 17:R42
20. Helms J, Curtiaud A, Severac F, Merdji H, Angles-Cano E (2023) Dynamic longitudinal increase in D-dimers: an early predictor of bleeding complications in ECMO. Intensive Care Med 49:1416
21. Li C, Zhao Q, Yang K, Jiang L, Yu J (2019) Thromboelastography or rotational thromboelastometry for bleeding management in adults undergoing cardiac surgery: a systematic review with meta-analysis and trial sequential analysis. J Thorac Dis 11:1170–1181
22. Amgalan A, Allen T, Othman M, Ahmadzia HK (2020) Systematic review of viscoelastic testing (TEG/ROTEM) in obstetrics and recommendations from the women’s SSC of the ISTH. J Thromb Haemost 18:1813–1838
23. Collins PW, Cannings-John R, Bruynseels D, Mallaiah S, Dick J, Elton C, Weeks AD, Sanders J, Aawar N, Townson J, Hood K, Hall JE, Collis RE (2017) Viscoelastometric-guided early fibrinogen concentrate replacement during postpartum haemorrhage: OBS2, a double-blind randomized controlled trial. Br J Anaesth 119:411–421
24. Al Moosawi M, Trudeau J, Smith T, Lefebvre A, Shih AW (2021) ROTEM in the setting of liver transplant surgery reduces frozen plasma transfusion. Transfus Apher Sci 60:103125
25. Zamper RPC, Amorim TC, Queiroz VNF, Lira JDO, Costa LGV, Takaoka F, Juffermans NP, Neto AS (2018) Association between viscoelastic testsguided therapy with synthetic factor concentrates and allogenic blood transfusion in liver transplantation: a before-after study. BMC Anesthesiol 18:198
26. Levrat A, Gros A, Rugeri L, Inaba K, Floccard B, Negrier C, David JS (2008) Evaluation of rotation thrombelastography for the diagnosis of hyperfibrinolysis in trauma patients. Br J Anaesth 100:792–797
27. Rossaint R, Afshari A, Bouillon B, Cerny V, Cimpoesu D, Curry N, Duranteau J, Filipescu D, Grottke O, Gronlykke L, Harrois A, Hunt BJ, Kaserer A, Komadina R, Madsen MH, Maegele M, Mora L, Riddez L, Romero CS, Samama CM, Vincent JL, Wiberg S, Spahn DR (2023) The European guideline on management of major bleeding and coagulopathy following trauma:
sixth edition. Crit Care 27:80
28. Kietaibl S, Ahmed A, Afshari A, Albaladejo P, Aldecoa C, Barauskas G, De Robertis E, Faraoni D, Filipescu DC, Fries D, Godier A, Haas T, Jacob M, Lance MD, Llau JV, Meier J, Molnar Z, Mora L, Rahe-Meyer N, Samama CM, Scarlatescu E, Schlimp C, Wikkelso AJ, Zacharowski K (2023) Management of severe peri-operative bleeding: guidelines from the European Society of Anaesthesiology and Intensive Care: second update 2022. Eur J Anaesthesiol 40:226–304
29. Erdoes G, Faraoni D, Koster A, Steiner ME, Ghadimi K, Levy JH (2023) Perioperative considerations in management of the severely bleeding coagulopathic patient. Anesthesiology 138:535–560
30. Muldowney M, Aichholz P, Nathwani R, Stansbury LG, Hess JR, Vavilala MS (2022) Advances in hemorrhage control resuscitation. Curr Opin Anaesthesiol 35:176–181
31. Vlaar APJ, Dionne JC, de Bruin S, Wijnberge M, Raasveld SJ, van Baarle F, Antonelli M, Aubron C, Duranteau J, Juffermans NP, Meier J, Murphy GJ, Abbasciano R, Muller MCA, Lance M, Nielsen ND, Schochl H, Hunt BJ, Cecconi M, Oczkowski S (2021) Transfusion strategies in bleeding critically ill adults: a clinical practice guideline from the European Society of Intensive Care Medicine. Intensive Care Med 47:1368–1392
32. Pham HP, Shaz BH (2013) Update on massive transfusion. Br J Anaesth 111(Suppl 1):i71-82
33. de Bruin S, Eggermont D, van Bruggen R, de Korte D, Scheeren TWL, Bakker J, Vlaar APJ (2022) Transfusion practice in the bleeding critically ill: an international online survey-The TRACE-2 survey. Transfusion 62:324–335
34. Wiersum-Osselton JC, Whitaker B, Grey S, Land K, Perez G, Rajbhandary S, Andrzejewski C Jr, Bolton-Maggs P, Lucero H, Renaudier P, Robillard P, Santos M, Schipperus M (2019) Revised international surveillance case definition of transfusion-associated circulatory overload: a classification agreement validation study. Lancet Haematol 6:e350–e358
35. Bosboom JJ, Klanderman RB, Migdady Y, Bolhuis B, Veelo DP, Geerts BF, Murphy MF, Vlaar APJ (2019) Transfusion-associated circulatory overload: a clinical perspective. Transfus Med Rev 33:69–77
36. Ruseckaite R, McQuilten ZK, Oldroyd JC, Richter TH, Cameron PA, Isbister JP, Wood EM (2017) Descriptive characteristics and in-hospital mortality of critically bleeding patients requiring massive transfusion: results from the Australian and New Zealand Massive Transfusion Registry. Vox Sang 112:240–248
37. Karameh H, Bruoha S, Taha L, Tabi M, Farkash R, Karmi M, Hamayel K, Perel N, Steinmetz Y, Marmor D, Manassra M, Maller T, Hitter R, Amsalem I, Glikson M, Asher E (2023) Outcomes of patients treated with blood transfusion in a contemporary tertiary care medical center intensive cardiac care unit. J Clin Med 12:1304
38. Halmin M, Chiesa F, Vasan SK, Wikman A, Norda R, Rostgaard K, Vesterager Pedersen OB, Erikstrup C, Nielsen KR, Titlestad K, Ullum H, Hjalgrim H, Edgren G (2016) Epidemiology of massive transfusion: a binational study from Sweden and Denmark. Crit Care Med 44:468–477
39. Borgman MA, Spinella PC, Perkins JG, Grathwohl KW, Repine T, Beekley AC, Sebesta J, Jenkins D, Wade CE, Holcomb JB (2007) The ratio of blood products transfused affects mortality in patients receiving massive transfusions at a combat support hospital. J Trauma 63:805–813
40. Halmin M, Bostrom F, Brattstrom O, Lundahl J, Wikman A, Ostlund A, Edgren G (2013) Effect of plasma-to-RBC ratios in trauma patients: a cohort study with time-dependent data*. Crit Care Med 41:1905–1914
41. Mesar T, Larentzakis A, Dzik W, Chang Y, Velmahos G, Yeh DD (2017) Association between ratio of fresh frozen plasma to red blood cells during massive transfusion and survival among patients without traumatic injury. JAMA Surg 152:574–580
42. Cardigan R, Latham T, Weaver A, Yazer M, Green L (2022) Estimating the risks of prehospital transfusion of D-positive whole blood to trauma patients who are bleeding in England. Vox Sang 117:701–707
43. Seheult JN, Stram MN, Pearce T, Bub CB, Emery SP, Kutner J, Watanabe-Okochi N, Sperry JL, Takanashi M, Triulzi DJ, Yazer MH (2021) The risk to future pregnancies of transfusing Rh(D)-negative females of childbearing potential with Rh(D)-positive red blood cells during trauma resuscitation is dependent on their age at transfusion. Vox Sang 116:831–840
44. Gammon RR, Meena-Leist C, Al Mozain N, Cruz J, Hartwell E, Lu W, Karp JK, Noone S, Orabi M, Tayal A, Bocquet C, Tanhehco Y (2023) Whole blood in civilian transfusion practice: a review of the literature. Transfusion 63:1758–1766
45. Mack JP, Miles J, Stolla M (2020) Cold-stored platelets: review of studies in humans. Transfus Med Rev 34:221–226
46. Meneses E, Boneva D, McKenney M, Elkbuli A (2020) Massive transfusion protocol in adult trauma population. Am J Emerg Med 38:2661–2666
47. Sommer N, Schnuriger B, Candinas D, Haltmeier T (2019) Massive transfusion protocols in nontrauma patients: a systematic review and metaanalysis. J Trauma Acute Care Surg 86:493–504
48. Hu P, Uhlich R, Black J, Jansen JO, Kerby J, Holcomb JB (2021) A new definition for massive transfusion in the modern era of whole blood resuscitation. Transfusion 61(Suppl 1):S252-s263
49. Foster JC, Sappenfield JW, Smith RS, Kiley SP (2017) Initiation and termination of massive transfusion protocols: current strategies and future prospects. Anesth Analg 125:2045–2055
50. Camazine MN, Hemmila MR, Leonard JC, Jacobs RA, Horst JA, Kozar RA, Bochicchio GV, Nathens AB, Cryer HM, Spinella PC (2015) Massive transfusion policies at trauma centers participating in the American College of Surgeons Trauma Quality Improvement Program. J Trauma Acute Care Surg 78:S48-53
51. Ngatuvai M, Zagales I, Sauder M, Andrade R, Santos RG, Bilski T, Kornblith L, Elkbuli A (2023) Outcomes of transfusion with whole blood, component therapy, or both in adult civilian trauma patients: a systematic review and meta-analysis. J Surg Res 287:193–201
52. Casu S (2021) Simplified treatment algorithm for the management of trauma-induced hemorrhage without viscoelastic testing. Trauma Surg Acute Care Open 6:e000779
53. Bugaev N, Como JJ, Golani G, Freeman JJ, Sawhney JS, Vatsaas CJ, Yorkgitis BK, Kreiner LA, Garcia NM, Aziz HA, Pappas PA, Mahoney EJ, Brown ZW, Kasotakis G (2020) Thromboelastography and rotational thromboelastometry in bleeding patients with coagulopathy: practice management guideline from the Eastern Association for the Surgery of Trauma. J
Trauma Acute Care Surg 89:999–1017
54. Blaine KP, Steurer MP (2019) Viscoelastic monitoring to guide the correction of perioperative coagulopathy and massive transfusion in patients with life-threatening hemorrhage. Anesthesiol Clin 37:51–66
55. Baksaas-Aasen K, Gall LS, Stensballe J, Juffermans NP, Curry N, Maegele M, Brooks A, Rourke C, Gillespie S, Murphy J, Maroni R, Vulliamy P, Henriksen HH, Pedersen KH, Kolstadbraaten KM, Wirtz MR, Kleinveld DJB, Schafer N, Chinna S, Davenport RA, Naess PA, Goslings JC, Eaglestone S, Stanworth
S, Johansson PI, Gaarder C, Brohi K (2021) Viscoelastic haemostatic assay augmented protocols for major trauma haemorrhage (ITACTIC): a randomized, controlled trial. Intensive Care Med 47:49–59
56. Baksaas-Aasen K, Van Dieren S, Balvers K, Juffermans NP, Naess PA, Rourke C, Eaglestone S, Ostrowski SR, Stensballe J, Stanworth S, Maegele M, Goslings JC, Johansson PI, Brohi K, Gaarder C, collaborators TI (2019) Datadriven development of ROTEM and TEG algorithms for the management of trauma hemorrhage: a prospective observational multicenter study. Ann Surg 270:1178–1185
57. Gorlinger K, Perez-Ferrer A, Dirkmann D, Saner F, Maegele M, Calatayud AAP, Kim TY (2019) The role of evidence-based algorithms for rotational thromboelastometry-guided bleeding management. Korean J Anesthesiol 72:297–322
58. Hartmann J, Hermelin D, Levy JH (2023) Viscoelastic testing: an illustrated review of technology and clinical applications. Res Pract Thromb Haemost 7:100031
59. Zhu Z, Yu Y, Hong K, Luo M, Ke Y (2022) Utility of viscoelastic hemostatic assay to guide hemostatic resuscitation in trauma patients: a systematic review. World J Emerg Surg 17:48
60. Bouzat P, Hunt BJ, Juffermans NP (2023) Four-factor prothrombin complex concentrate in trauma patients. Intensive Care Med 49:1242–1244
61. Jehan F, Aziz H, O’Keeffe T, Khan M, Zakaria ER, Hamidi M, Zeeshan M, Kulvatunyou
N, Joseph B (2018) The role of four-factor prothrombin complex concentrate in coagulopathy of trauma: a propensity matched analysis. J Trauma Acute Care Surg 85:18–24
62. Zeeshan M, Hamidi M, Feinstein AJ, Gries L, Jehan F, Sakran J, Northcutt A, O’Keeffe T, Kulvatunyou N, Joseph B (2019) Four-factor prothrombin complex concentrate is associated with improved survival in trauma-related hemorrhage: a nationwide propensity-matched analysis. J Trauma Acute Care Surg 87:274–281
63. Joseph B, Aziz H, Pandit V, Hays D, Kulvatunyou N, Yousuf Z, Tang A, O’Keeffe T, Green D, Friese RS, Rhee P (2014) Prothrombin complex concentrate versus fresh-frozen plasma for reversal of coagulopathy of trauma: is there a difference? World J Surg 38:1875–1881
64. Joseph B, Khalil M, Harrison C, Swartz T, Kulvatunyou N, Haider AA, Jokar TO, Burk D, Mahmoud A, Latifi R, Rhee P (2016) Assessing the efficacy of prothrombin complex concentrate in multiply injured patients with highenergy pelvic and extremity fractures. J Orthop Trauma 30:653–658
65. Bouzat P, Charbit J, Abback PS, Huet-Garrigue D, Delhaye N, Leone M, Marcotte G, David JS, Levrat A, Asehnoune K, Pottecher J, Duranteau J, Courvalin E, Adolle A, Sourd D, Bosson JL, Riou B, Gauss T, Payen JF, Group PS (2023) Efficacy and safety of early administration of 4-factor prothrombin complex concentrate in patients with trauma at risk of massive transfusion:
the PROCOAG Randomized Clinical Trial. JAMA 329:1367–1375
66. Davenport R, Curry N, Fox EE, Thomas H, Lucas J, Evans A, Shanmugaranjan S, Sharma R, Deary A, Edwards A, Green L, Wade CE, Benger JR, Cotton BA, Stanworth SJ, Brohi K, Investigators C-P (2023) Early and empirical high-dose cryoprecipitate for hemorrhage after traumatic injury: the CRYOSTAT-2 randomized clinical trial. JAMA 21 330(19):1882–1891. https://doi. org/ 10. 1001/ jama. 2023. 21019
67. Cabrera CP, Manson J, Shepherd JM, Torrance HD, Watson D, Longhi MP,Hoti M, Patel MB, O’Dwyer M, Nourshargh S, Pennington DJ, Barnes MR,Brohi K (2017) Signatures of inflammation and impending multiple organ dysfunction in the hyperacute phase of trauma: a prospective cohort study. PLoS Med 14:e1002352
68. Mira JC, Brakenridge SC, Moldawer LL, Moore FA (2017) Persistent inflammation,
immunosuppression and catabolism syndrome. Crit Care Clin 33:245–258
69. Wirtz MR, Schalkers DV, Goslings JC, Juffermans NP (2020) The impact of blood product ratio and procoagulant therapy on the development of thromboembolic events in severely injured hemorrhaging trauma patients. Transfusion 60:1873–1882
70. Johansson PI, Stensballe J, Rasmussen LS, Ostrowski SR (2011) A high admission syndecan-1 level, a marker of endothelial glycocalyx degradation, is associated with inflammation, protein C depletion, fibrinolysis, and increased mortality in trauma patients. Ann Surg 254:194–200
71. Torres LN, Chung KK, Salgado CL, Dubick MA, Torres Filho IP (2017) Low volume
resuscitation with normal saline is associated with microvascular endothelial dysfunction after hemorrhage in rats, compared to colloids and balanced crystalloids. Crit Care 21:160
72. Torres LN, Sondeen JL, Ji L, Dubick MA, Torres Filho I (2013) Evaluation of resuscitation fluids on endothelial glycocalyx, venular blood flow, and coagulation function after hemorrhagic shock in rats. J Trauma Acute Care Surg 75:759–766
73. Kozar RA, Peng Z, Zhang R, Holcomb JB, Pati S, Park P, Ko TC, Paredes A (2011) Plasma restoration of endothelial glycocalyx in a rodent model of hemorrhagic shock. Anesth Analg 112:1289–1295
74. Gruen DS, Brown JB, Guyette FX, Vodovotz Y, Johansson PI, Stensballe J, Barclay DA, Yin J, Daley BJ, Miller RS, Harbrecht BG, Claridge JA, Phelan HA, Neal MD, Zuckerbraun BS, Billiar TR, Sperry JL, group PAs, (2020) Prehospital plasma is associated with distinct biomarker expression following injury. JCI Insight 5:e135350
75. Gruen DS, Guyette FX, Brown JB, Okonkwo DO, Puccio AM, Campwala IK, Tessmer MT, Daley BJ, Miller RS, Harbrecht BG, Claridge JA, Phelan HA, Neal MD, Zuckerbraun BS, Yazer MH, Billiar TR, Sperry JL (2020) Association of prehospital plasma with survival in patients with traumatic brain injury: a secondary analysis of the PAMPer cluster randomized clinical
trial. JAMA Netw Open 3:e2016869
76. Weber B, Lackner I, Gebhard F, Miclau T, Kalbitz M (2021) Trauma, a matter of the heart-molecular mechanism of post-traumatic cardiac dysfunction. Int J Mol Sci 22:737
77. De’Ath HD, Rourke C, Davenport R, Manson J, Renfrew I, Uppal R, Davies LC, Brohi K (2012) Clinical and biomarker profile of trauma-induced secondary cardiac injury. Br J Surg 99:789–797
78. Schellenberg M, Costantini T, Joseph B, Price MA, Bernard AC, Haut ER (2023) Timing of venous thromboembolism prophylaxis initiation after injury: Findings from the consensus conference to implement optimal VTE prophylaxis in trauma. J Trauma Acute Care Surg 94:484–489
79. Vincent LE, Talanker MM, Butler DD, Zhang X, Podbielski JM, Wang YW, Chen-Goodspeed A, Hernandez Gonzalez SL, Fox EE, Cotton BA, Wade CE, Cardenas JC (2022) Association of changes in antithrombin activity over time with responsiveness to enoxaparin prophylaxis and risk of trauma related venous thromboembolism. JAMA Surg 157:713–721
80. Lu VM, Alvi MA, Rovin RA, Kasper EM (2020) Clinical outcomes following early versus late pharmacologic thromboprophylaxis in patients with traumatic intracranial hemorrhage: a systematic review and meta-analysis. Neurosurg Rev 43:861–872
81. Spano PJ 2nd, Shaikh S, Boneva D, Hai S, McKenney M, Elkbuli A (2020) Anticoagulant chemoprophylaxis in patients with traumatic brain injuries: a systematic review. J Trauma Acute Care Surg 88:454–460
82. Byrne JP, Witiw CD, Schuster JM, Pascual JL, Cannon JW, Martin ND, Reilly PM, Nathens AB, Seamon MJ (2022) Association of venous thromboembolism prophylaxis after neurosurgical intervention for traumatic brain injury with thromboembolic complications, repeated neurosurgery, and mortality. JAMA Surg 157:e215794
83. Ley EJ, Brown CVR, Moore EE, Sava JA, Peck K, Ciesla DJ, Sperry JL, Rizzo AG, Rosen NG, Brasel KJ, Kozar R, Inaba K, Martin MJ (2020) Updated guidelines to reduce venous thromboembolism in trauma patients: a Western Trauma Association critical decisions algorithm. J Trauma Acute Care Surg 89:971–981
84. Skarupa D, Hanna K, Zeeshan M, Madbak F, Hamidi M, Haddadin Z, Northcutt A, Gries L, Kulvatunyou N, Joseph B (2019) Is early chemical thromboprophylaxis in patients with solid organ injury a solid decision? J Trauma Acute Care Surg 87:1104–1112
85. Tran A, Fernando SM, Carrier M, Siegal DM, Inaba K, Vogt K, Engels PT, English SW, Kanji S, Kyeremanteng K, Lampron J, Kim D, Rochwerg B (2022) Efficacy and safety of low molecular weight heparin versus unfractionated heparin for prevention of venous thromboembolism in trauma patients: a systematic review and meta-analysis. Ann Surg 275:19–28
86. Fernando SM, Tran A, Cheng W, Sadeghirad B, Arabi YM, Cook DJ, Moller MH, Mehta S, Fowler RA, Burns KEA, Wells PS, Carrier M, Crowther MA, Scales DC, English SW, Kyeremanteng K, Kanji S, Kho ME, Rochwerg B (2022) VTE prophylaxis in critically ill adults: a systematic review and network meta-analysis. Chest 161:418–428
87. Helms J, Middeldorp S, Spyropoulos AC (2023) Thromboprophylaxis in critical care. Intensive Care Med 49:75–78
88. Duranteau J, Taccone FS, Verhamme P, Ageno W, Force EVGT (2018) European guidelines on perioperative venous thromboembolism prophylaxis: Intensive care. Eur J Anaesthesiol 35:142–146
89. Afshari A, Fenger-Eriksen C, Monreal M, Verhamme P, Force EVGT (2018) European guidelines on perioperative venous thromboembolism prophylaxis: Mechanical prophylaxis. Eur J Anaesthesiol 35:112–115
90. Schunemann HJ, Cushman M, Burnett AE, Kahn SR, Beyer-Westendorf J, Spencer FA, Rezende SM, Zakai NA, Bauer KA, Dentali F, Lansing J, Balduzzi S, Darzi A, Morgano GP, Neumann I, Nieuwlaat R, Yepes-Nunez JJ, Zhang Y, Wiercioch W (2018) American Society of Hematology 2018 guidelines for management of venous thromboembolism: prophylaxis for hospitalized and nonhospitalized medical patients. Blood Adv 2:3198–3225
91. Bateman AP, McArdle F, Walsh TS (2009) Time course of anemia during six months follow up following intensive care discharge and factors associated with impaired recovery of erythropoiesis. Crit Care Med 37:1906–1912
92. Hayden SJ, Albert TJ, Watkins TR, Swenson ER (2012) Anemia in critical illness: insights into etiology, consequences, and management. Am J Respir Crit Care Med 185:1049–1057
93. Jelkmann I, Jelkmann W (2013) Impact of erythropoietin on intensive care unit patients. Transfus Med Hemother 40:310–318
94. Vlaar AP, Oczkowski S, de Bruin S, Wijnberge M, Antonelli M, Aubron C,Aries P, Duranteau J, Juffermans NP, Meier J, Murphy GJ, Abbasciano R, Muller M, Shah A, Perner A, Rygaard S, Walsh TS, Guyatt G, Dionne JC, Cecconi M (2020) Transfusion strategies in non-bleeding critically ill adults: a clinical practice guideline from the European Society of Intensive Care Medicine. Intensive Care Med 46:673–696
95. Thau MR, Liu T, Sathe NA, O’Keefe GE, Robinson BRH, Bulger E, Wade CE, Fox EE, Holcomb JB, Liles WC, Stanaway IB, Mikacenic C, Wurfel MM, Bhatraju PK, Morrell ED (2023) Association of trauma molecular endotypes with differential response to transfusion resuscitation strategies. JAMA Surg 158:728–736
96. Wu J, Vodovotz Y, Abdelhamid S, Guyette FX, Yaffe MB, Gruen DS, Cyr A,Okonkwo DO, Kar UK, Krishnamoorthi N, Voinchet RG, Billiar IM, Yazer MH, Namas RA, Daley BJ, Miller RS, Harbrecht BG, Claridge JA, Phelan HA, Zuckerbraun BS, Johansson PI, Stensballe J, Morrissey JH, Tracy RP, Wisniewski SR, Neal MD, Sperry JL, Billiar TR, Group PAs (2021) Multi-omic analysis in injured humans: patterns align with outcomes and treatment
responses. Cell Rep Med 2:100478
97. Jansen JO, Hudson J, Cochran C, MacLennan G, Lendrum R, Sadek S, Gillies K, Cotton S, Kennedy C, Boyers D, Ferry G, Lawrie L, Nath M, Wileman S, Forrest M, Brohi K, Harris T, Lecky F, Moran C, Morrison JJ, Norrie J, Paterson A, Tai N, Welch N, Campbell MK, Group U-RS, Aylwin C, Bew D, Brooks A, Chinery J, Cowlam T, Frith D, George A, Hudson A, Johnstone P, Mahmood A, Novak A, O’Meara M, Reid S, Sattout A, Smith C, Stansfield T,
Thompson J, (2023) Emergency department resuscitative endovascular balloon occlusion of the aorta in trauma patients with exsanguinating hemorrhage: the UK-REBOA randomized clinical trial. JAMA
98. Cole E, Weaver A, Gall L, West A, Nevin D, Tallach R, O’Neill B, Lahiri S, Allard S, Tai N, Davenport R, Green L, Brohi K (2021) A decade of damage control resuscitation: new transfusion practice, new survivors, new directions. Ann Surg 273(6):1215–1220. https:// doi. org/ 10. 1097/ SLA. 00000 00000 003657
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 15.05.2024
[~DATE_ACTIVE_FROM] => 15.05.2024
[ACTIVE_FROM_X] => 2024-05-15 00:00:00
[~ACTIVE_FROM_X] => 2024-05-15 00:00:00
[ACTIVE_FROM] => 15.05.2024
[~ACTIVE_FROM] => 15.05.2024
[SHOW_COUNTER] => 196
[~SHOW_COUNTER] => 196
[ID] => 8438
[~ID] => 8438
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 20.05.2024 12:46:46
[~TIMESTAMP_X] => 20.05.2024 12:46:46
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/sovremennoe-vedenie-massivnykh-krovotecheniy-v-reanimatsii/
[~DETAIL_PAGE_URL] => /library/articles/sovremennoe-vedenie-massivnykh-krovotecheniy-v-reanimatsii/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => sovremennoe-vedenie-massivnykh-krovotecheniy-v-reanimatsii
[~CODE] => sovremennoe-vedenie-massivnykh-krovotecheniy-v-reanimatsii
[EXTERNAL_ID] => 8438
[~EXTERNAL_ID] => 8438
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 15 мая 2024
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Современное ведение массивных кровотечений в реанимации
[PREVIEW_PICTURE] => Array
(
[ID] => 5641
[TIMESTAMP_X] => 20.05.2024 12:46:46
[MODULE_ID] => iblock
[HEIGHT] => 5000
[WIDTH] => 5000
[FILE_SIZE] => 11937981
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/885/k77uu54of1uuaf7i6fta0g6sgppyjz1i
[FILE_NAME] => 3d-render-medical-background-with-blood-cells.jpg
[ORIGINAL_NAME] => 3d-render-medical-background-with-blood-cells.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => c7bca0173a9907c6487a2a7db5479635
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/885/k77uu54of1uuaf7i6fta0g6sgppyjz1i/3d-render-medical-background-with-blood-cells.jpg
[UNSAFE_SRC] => /upload/iblock/885/k77uu54of1uuaf7i6fta0g6sgppyjz1i/3d-render-medical-background-with-blood-cells.jpg
[SAFE_SRC] => /upload/iblock/885/k77uu54of1uuaf7i6fta0g6sgppyjz1i/3d-render-medical-background-with-blood-cells.jpg
[ALT] => Современное ведение массивных кровотечений в реанимации
[TITLE] => Современное ведение массивных кровотечений в реанимации
)
[DETAIL_TEXT] =>
Cheryl L. Maier, Karim Broh2, Nicola Curry, Nicole P. Juffermans, Lidia Mora Miquel, Matthew D. Neal,Beth H. Shaz, Alexander P. J. Vlaar and Julie Helms
REVIEW Contemporary management of major haemorrhage in critical care
Intensive Care Med (2024) 50:319–331
https://doi.org/10.1007/s00134-023-07303-5
Абстракт
Геморрагический шок часто встречается в отделениях интенсивной терапии и является причиной высокого уровня смертности из-за полиорганной дисфункции и коагулопатии. Лечение больных к критическом состоянии с кровотечением и шоком является сложным . Введение больших объемов компонентов крови приводит к серьезным физиологическим изменениям, которые необходимо коррелировать во время и после кровотечения. Раннее распознавание кровотечения и коагулопатии, понимание основной патофизиологии, связанной с конкретными патологическими состояниями, а также разработка индивидуальных протоколов лечения важны для достижения оптимальных результатов. В обзоре описаны современные представления о патофизиологии различных типов коагулопатических кровотечений; диагностика и ведение больных с кровотечением в критическом состоянии, включая протоколы лечения массивных кровотечений и ведение пациентов после переливания крови; и, наконец, освещает недавние области возможностей, позволяющие лучше понять оптимальные стратегии лечения кровотечений в отделениях интенсивной терапии (ОИТ).
Ключевые слова: массивное переливание крови, кровотечение, критическое состояние, кровотечение, коагулопатия.
Введение
Массивные кровотечения встречаются в ОИТ с частотой от 5 до более 50%, и по-прежнему связаны с высокой смертностью [1-3]. Оценка точной частоты крупных кровотечений в различных популяциях пациентов была сложной задачей, по крайней мере частично, из-за различий в критериях, используемых для их определения. Международное общество по тромбозам и гемостазу (ISTH) определяет большое кровотечение как симптоматическое кровотечение в критичной зоне или органе и/или кровотечение, которое вызывает падение гемоглобина на ≥ 2 г/дл или приводит к переливанию ≥ 2 единиц цельной крови или эритроцитов [4].
Кровотечение и геморрагический шок приводят к развитию нарушений гемостаза и коагулопатии, которые могут усугубляться или осложняться сопутствующими или основными заболеваниями, присутствующими у пациентов в критическом состоянии. Ведение этих пациентов сложное, и стратегии по остановке или уменьшению кровотечения должны быть быстрыми и окончательными.Кроме того, введение больших объемов компонентов крови, которые могут быть сбалансированы или не сбалансированы по количеству переливаемых эритроцитов, тромбоцитов и продуктов плазмы, может привести к серьезным физиологическим изменениям, которые необходимо коррелировать во время и после кровотечения. Раннее распознавание кровотечения и коагулопатии, понимание патофизиологии конкретных патологических состояний и эффективное индивидуальное лечение важны для обеспечения оптимальных результатов.
Общая цель этого обзора — описать современное понимание патофизиологии, диагностики и ведения пациентов с массивным кровотечением в условиях ОИТ. Сначала мы рассмотрим патофизиологию различных типов коагулопатических кровотечений, обычно встречающихся при критических заболеваниях, в том числе у пациентов с травмами, послеродовыми кровотечениями, хроническими заболеваниями печени, диссеминированным внутрисосудистым свертыванием крови и уремией. Далее мы обсудим диагностику и обследование пациентов в критическом состоянии с коагулопатическим кровотечением, а затем опишем основные протоколы лечения кровотечений, актуальные для пациентов с массивными кровотечениями. Учитывая уникальные подходы, необходимые пациентам после массивного кровотечения, мы резюмируем посттрансфузионное лечение, включая поддержку кровообращения и профилактику тромбоэмболических осложнений.Наконец, мы выделяем дополнительные соображения и области возможностей для лучшего определения оптимальных стратегий управления кровотечениями в ОИТ.
Патофизиология геморрагических коагулопатий
Различные патологические процессы, приводящие к кровотечению, приводят к различным моделям коагулопатии, которые необходимо понимать для обеспечения оптимального лечения. Несмотря на то, что существуют области дублирования, и может быть привлекательно упростить ведение лечения с помощью единого протокола массивного кровотечения (MHP), необходимо учитывать критические различия, чтобы гарантировать достижение гемостаза без немедленных или отдаленных осложнений.
Кровотечение, связанное с травмой
Наибольшему риску развития тяжелого кровотечения подвергаются пациенты с более высокой тяжестью травмы и лица с гиповолемическим шоком [5]. Множественные нарушения коагуляции, которые могут привести к травматической коагулопатии (TIC ), способствуют неэффективному гемостазу на раннем этапе после травмы. Центральными признаками TIC являются усиление фибринолиза, активация пути протеина С, дисфункция тромбоцитов и потребление факторов свертывания крови. Они сопровождаются активацией эндотелия с увеличением проницаемости сосудов микроциркуляторного русла и потерей эндотелиального гликокаликса. Гиперфибринолиз является одним из наиболее частых изменений после тяжелой травмы и может сопровождать даже легкую или умеренную травму [6]. Усиление фибринолиза, вероятно, опосредовано повышенной активностью плазмина в результате высокого уровня тканевого активатора плазминогена (tPA), высвобождающегося активированными эндотелиальными клетками. Уровни фибриногена падают до критически низкого уровня на ранних стадиях кровотечения, связанного с травмой, что является следствием усиленного распада фибриногена (фибриногенолиза), широкого потребления фибриногена и дилюционным эффектом инфузионной терапии [7].
Гипофибриногенемия также может отражать или усугубляться низким запасом фибриногена.Считается, что высокие уровни активированного протеина С (APC) являются одним из центральных эффекторов раннего гипокоагуляционного состояния. APC вызывает ингибирование FVa и FVIIIa, уменьшая образование тромбина, а также связывается с ингибитором активатора плазминогена-1, предотвращая его ингибирующее действие на t-PA и тем самым позволяя бесконтрольно продолжать фибринолиз. Дисфункция тромбоцитов проявляется глобальным снижением агрегации, часто описываемым как «истощение тромбоцитов», что усугубляет состояние гипокоагуляции. Механизмы дисфункции тромбоцитов до конца не изучены, хотя недавние данные указывают на нарушение мобилизации кальция, изменения GpVI или прямую атаку высвобождаемых при повреждении гистонов. Прямая травма, шок, выброс катехоламинов и гипоксия способствуют активации эндотелия, тогда как считается, что изменения в реологии крови лежат в основе разрушения эндотелиального гликокаликса.
Послеродовое кровотечение
Коагулопатия, связанная с послеродовым кровотечением (PPH ), еще не изучена так подробно, как TIC . Большинство случаев РРН не связано с коагулопатией, хотя кровотечение большого объема (т.е. более 3 л) связано с дилюционной коагулопатией или коагулопатией потребления. «Острая акушерская коагулопатия» — похожая на сложную многофакторную коагулопатию, наблюдаемую при TIC и характеризующуюся массивным фибринолизом, — встречается гораздо реже [8] и встречается в 1,06 случаев на 1000 беременностей. Беременность ассоциируется со значительным повышением уровня циркулирующего фибриногена, а уровень фибриногена ниже 2 г/л в начале РРН тесно связан с большей потребностью в переливании большого объема крови [9]. (Table 1). Две явные клинические ситуации, при которых возникает острая акушерская коагулопатия, включают эмболию околоплодными водами и отслойку плаценты. Острая акушерская коагулопатия имеет общие черты с TIC : она проявляется глубоким и быстрым снижением уровня фибриногена и выраженным гиперфибринолизом [8]. У этих рожениц также выявляют дисфибриногенемию, что не является подтвержденным признаком TIC. Таким образом, измерение фибриногена и адекватная его замена имеют решающее значение при оказании помощи таким пациенткам.

Хроническое заболевание печени
Примерно у каждого восьмого пациента с хроническим заболеванием печени (CLD ), находящегося на лечении в ОИТ, развивается значительное кровотечение по определению ISTH [10]. Три четверти случаев представляют собой желудочно-кишечные кровотечения [11], и более чем в 90% этих случаев основной причиной является портальная гипертензия. CLD связано с дефицитом факторов свертывания крови, дисфункцией тромбоцитов и гиперфибринолизом [12] (Table 1). Однако в этих системах также происходят прогемостатические изменения, которые уравновешивают эти гипокоагуляционные тенденции. Хотя рутинные лабораторные тесты обычно показывают тромбоцитопению, а также удлинение протромбинового времени (РТ), пациенты с компенсированным CLD не подвергаются большему риску кровотечения и не защищены от тромбоза. Однако пациенты имеют сниженный резерв свертывания крови и малоустойчивы к ряду заболеваний и травмам. В случае декомпенсации или развития инфекции, пациенты подвергаются риску как кровотечения, так и тромбоза [12].
Несмотря на сложность нарушений коагуляции при CLD , наиболее частой причиной острого кровотечения является кровотечение из варикозных вен, и для успешного лечения приоритет отдается методам, направленным на снижение портального давления, а не на инфузионную терапию в больших объемах и коррекцию выраженных функциональных нарушений коагуляции [13].
Диссеминированная внутрисосудистая коагулопатия
Диссеминированная внутрисосудистая коагулопатия (ДВС) — это приобретенное состояние, которое всегда является вторичным по отношению к основному состоянию, чаще всего сепсису, но также и другим заболеваниям, таким как злокачественные новообразования, травмы или акушерские осложнения. ДВС-синдром характеризуется системной активацией коагуляции, что приводит к распространенному образованию внутрисосудистых тромбов, богатых фибрином, вызывающих окклюзию сосудов малого и среднего калибра и последующую органную дисфункцию [14]. Сложная патофизиология ДВС-синдрома может приводить к тромбозам, кровотечениям или смешанным фенотипам [14, 15]. Помимо истощения тромбоцитов и факторов свертывания крови, уровень физиологических антикоагулянтов, таких как антитромбин и протеин С снижается из-за потребления и экстравазации вследствие повышенной проницаемости микрососудов. Значительно повышенный уровень продуктов деградации фибрина и системное воспаление вызывают дисфункцию тромбоцитов и препятствуют сшиванию фибрина, что еще больше способствует кровотечению. У пациентов с ДВС-синдромом может развиться массивное кровотечение, в зависимости от его фенотипа [14]; следовательно, лечение ДВС-синдрома зависит от его фенотипа и основного заболевания.
Уремия
Уремическое кровотечение является общепризнанным осложнением у пациентов с хронической почечной недостаточностью [16]. К сожалению, несмотря на то, что это относительно распространенная причина кровотечений, о механизме, лежащем в его основе, мало что известно.Дисфункция тромбоцитов, по-видимому, является доминирующим отклонением. Считается, что это является следствием множественных изменений, в том числе дисфункции фактора фон Виллебранда. (снижение способности связываться с гликопротеином тромбоцитов GP1b), что уменьшает привязку тромбоцитов к местам повреждения сосудов и сложных изменениях в ключевых сигнальных путях агонистов тромбоцитов [17]. Последнее включает снижение продукции тромбоксана, повышение уровня простациклина I2, повышение уровня циклического AMP/GMP , повышение уровня уремических токсинов и изменение гранул тромбоцитов, все из которых необходимы для нормальной агрегации тромбоцитов. Следовательно, переливание тромбоцитов в такие условиях не устраняет дисфункцию тромбоцитов.
Приобретенная коагулопатия, вторичная по отношению к антикоагулянтам
Многие пациенты в критическом состоянии получают антикоагулянты либо в качестве тромбопрофилактики, либо в качестве антикоагулянтной терапии, связанной с острым или основным заболеванием. Кровотечение может быть основной причиной госпитализации в ОИТ или может развиться во время пребывания там. Многоцентровое ретроспективное французское исследование показало, что частота пациентов, поступивших в ОИТ по поводу тяжелых экстракраниальных кровотечений, связанных с приемом антикоагулянтов, увеличилась с 3,2 на 1000 госпитализаций в 2007 году до 5,8/1000 в 2018 г., при этом уровень смертности составил 27% [18]. В этой когорте пациенты до госпитализации принимали антагонисты витамина К (VKA , 54%), гепарины (25%) или пероральные антикоагулянты прямого действия (DOAC, 7%). Экстракраниальное кровотечение, связанное с применением антикоагулянтов, требующее госпитализации в ОИТ, является серьезным осложнением антикоагулянтной терапии, которое может привести к органной недостаточности и значительной смертности. К сожалению, нынешнее терапевтическое лечение часто неоптимально, что, по крайней мере частично, связано с ограничениями лабораторного мониторинга, отсутствием опыта клинического лечения или отсутствием технологий отмены некоторых препаратов. Необходимы образование и разработка антикоагулянтных реверсивных агентов и протоколов, в дополнение к более доступным лабораторным измерениям гемостаза у пациентов, получающих антикоагулянтную терапию.
Диагностика и оценка
Раннее распознавание кровотечения у пациентов в критическом состоянии имеет важное значение для предотвращения развития шока и органной недостаточности. К сожалению, это может быть непросто, учитывая различные основные состояния, присутствующие у пациентов ОИТ. Оценка некоторых клинических и лабораторных параметров, связанных с геморрагическим шоком, таких как новая или ухудшающаяся тахикардия, тахипноэ или сужение пульсового давления, которые являются физиологической реакцией на низкий объем крови, может быть ранними клиническими признаками значительной гиповолемии [1]. Внезапное увеличение уровня лактата или дефицита оснований может быть полезным в качестве триггера начала лечения [19]. Однако все эти параметры могут быть замаскированы другими гемодинамическими нарушениями, включая синдром системной воспалительной реакции, септический шок, кардиогенный шок и применение инотропных и вазопрессорных препаратов. Иногда отклонения, отмеченные при лабораторных тестах, такие как снижение количества тромбоцитов или удлинение протромбинового времени (PT)/активированного частичного тромбопластинового времени (aPTT ), могут сигнализировать персоналу о развивающейся коагулопатии.
Хотя ожидается снижение гемоглобина, важно отметить, что гемоглобин может не падать резко из-за тяжести кровотечения и отставания компенсаторных механизмов. Действительно, наличие гемодинамической декомпенсации при нормальных показателях крови или коагуляции может быть окончательным признаком неконтролируемого скрытого кровотечения, требующего хирургического вмешательства. В конечном счете, важно поддерживать высокую настороженность , а также искать и исключать кровотечение как причину клинической декомпенсации. Признание тяжести и этиологии коагулопатии пациента также важно для надлежащего и индивидуализированного лечения.Традиционные лабораторные тесты, включая PT, aPTT, уровень фибриногена и наличие продуктов распада фибрина (например, D-димера), являются основой диагностики (table 2).

Увеличение D-димера в течение 2 дней недавно было идентифицировано как практический маркер для прогнозирования острого фибринолиза, предшествующего возникновению геморрагических осложнений у пациентов, находящихся на экстракорпоральной мембранной оксигенации (ECMO) [20].Функциональные вискоэластические тесты (тромбоэластометрия) могут дать более быструю и полную картину коагулопатии, чтобы назначить лечение. Использование данных тестов вместе с алгоритмами лечения коагулопатий показало преимущества при лечении кровотечений в кардиохирургии [21] и может быть полезным в акушерстве [22, 23], гепатологии [24, 25] и в других группах пациентов. Вискоэластичные тесты могут помочь диагностировать гиперфибринолиз, хотя и с низкой чувствительностью.
Например, Levrat et al. [26] обнаружили гиперфибринолиз только у 6% своих пациентов (5 из 83 истинно положительных пациентов), используя для диагностики ротационную тромбоэластометрию (ROTEM) и ELT (время лизиса эуглобулина) в качестве золотого стандарта. Было установлено, что у пациентов с коротким ELT (диагноз гиперфибринолиза) коррелирует с максимальной плотностью сгустка (MCF) и амплитудой сгустка на 10 и 15 мин, которые являются косвенными графическими параметрами. Важно отметить, что ELT обычно не проводится в большинстве лабораторий из-за серьезных проблем, связанных с методологией анализа. Наконец, у многих пациентов в критическом состоянии наблюдаются нарушения свертываемости крови в зависимости от заболевания, которые нормализуются при лечении основного заболевания. Таким образом, при отсутствии острого или предстоящего кровотечения нарушения коагуляции могут не требовать коррекции.
Протоколы лечения массивных кровотечений
Ведение пациентов в критическом состоянии с массивным кровотечением и связанной с ним коагулопатией требует оказания стандартизированной, научно обоснованной междисциплинарной помощи [27–32]. Сложность можно уменьшить, если иметь согласованный протокол оказания помощи при массивном кровотечении (MHP) ( также известный как протокол массивной трансфузии), хотя он еще не принят повсеместно [33]. Было показано, что внедрение MHP способствует выживанию пациентов и минимизирует осложнения массивной трансфузии, которую обычно определяют как переливание как минимум 10 единиц эритроцитов (RBC) в течение 24 часов [32,34–37].Первоначально MHP были разработаны для лечения массивных кровотечений у пациентов с травмами и были адаптированы для других клинических условий. Хотя MHP оптимизировали оказание помощи при массивных кровотечениях, некоторые компоненты могут быть основаны на предвзятых обсервационных исследованиях [38]. Одним из примеров является высокое соотношение плазмы к эритроцитам, которое, как предполагается, приводит к значительному снижению смертности (от 65 до 19%) [39]. После проведения временного анализа эффект смертности исчез [40].Хотя ни одно рандомизированное исследование не смогло подтвердить выводы первоначальных наблюдательных исследований, высокое соотношение плазмы-эритроцитов получило широкое распространение, включая пациентов с массивным кровотечением без травм. В обзоре использования высокого и низкого соотношения плазмы к эритроцитам в одной больнице США, где более 90% пациентов, подвергшихся массивному переливанию крови, не были пациентами с травмами, высокое соотношение плазмы к эритроцитам не было связано с улучшением исхода. 41].
Примечательно, что само по себе переливание эритроцитов не обеспечивает коррекции коагулопатии и даже способствует дилюционной коагулопатии. Поэтому плазма и тромбоциты важны после переливания больших объемов эритроцитов для предотвращения или коррекции коагулопатии.D-отрицательные женщины детородного потенциала (FCP — женщины до 50 лет), которые не могут дождаться типоспецифической или перекрестно-совместимой крови, обычно получают резус-отрицательные эритроциты группы O (RhD-) до тех пор, пока не будет определена их группа крови, чтобы предотвратить аллоиммунизацию и будущее развитие RhD+-ассоциированной гемолитической болезни плода и новорожденного (HDFN). Однако риск летального исхода в результате посттравматического кровотечения должен быть приоритетнее потенциального риска аллоиммунизации (20% для экстренной гемотрансфузии). Риск переливания RhD-положительной крови действительно считался низким на догоспитальном этапе [42]. Другое исследование, в котором рассматривались пациентки фертильного возраста с травмой, получившие RhD-положительные эритроциты, показало, что риск беременности, связанной с HDFN, может быть тем выше, чем моложе была пациентка , когда ей переливали RhD-положительные эритроциты [43]. В настоящее время ряд продуктов включается в MPH, особенно в травматологических отделениях
Из-за ограниченной доступности плазмы группы АВ и резкого роста спроса на нее используется плазма группы А. Имеющиеся на сегодняшний день данные подтверждают использование плазмы группы А, вероятно, из-за того, что пациенты получают эритроциты группы О. Еще одним недавним изменением является использование цельной крови группы О с низким титром для немедленного лечения травматического кровотечения [44]. Эти продукты имеют низкие титры анти-А и анти-, хотя стандартные титры не используются. Наконец, используются тромбоциты, хранящиеся в холодильнике, срок годности которых составляет 14 дней. Тромбоциты, хранящиеся в холоде, уже частично активируются и, таким образом, выводятся в течение 24 часов [45].
Этот протокол может быть более эффективным при геморрагических заболеваниях, но клинические испытания все еще продолжаются. MHP, включающие заранее заданные соотношения препаратов для трансфузии , позволяют врачам иметь время для остановки кровотечения, минимизировать использование кристаллоидов и понять суть коагулопатии, чтобы как можно скорее разработать более персонализированное лечение. Разработка основанной на протоколах структуры доставки продуктов крови, алгоритмов лабораторных исследований и других аспектов оказания помощи пациентам (использование препаратов, таких как транексамовая кислота или подогрев крови, для предотвращения гипотермии) остается важной для обеспечения немедленных действий в случаетяжелых и экстренных случаев. Кроме того, эти протоколы полагаются на командную работу, ситуационную осведомленность, общение, определение задач, распределение и принятие решений [32, 46, 47]. MHP должен разрабатываться как междисциплинарный и согласованный протокол с руководством трансфузиологом. Структура содержания протокола должна быть адаптирована к возможностям каждой больницы и соответствовать политике и правилам каждого учебного центра или организации. В протоколе должны быть подробно описаны процедуры и критерии оповещения лечащих врачей у постели больного и предоставления препаратов службой переливания крови.Нужно четко определить показатели качества и критерии проверки, такие как потери продукта, результаты лечения пациентов, лабораторные исследования, а также целесообразность пересмотра протокола [30, 36, 48, 49]. Обзор практики, результатов и использования MHP должен проводиться регулярно, с обновлением протокола для включения новых фактических данных и улучшения местной практики.
Центральным аспектом MHP является упрощенная доставка пациентам крови и ее компонентов.После получения заявки служба переливания крови должна иметь возможность быстро и стабильно предоставлять необходимые продукты крови. Это требует эффективного взаимодействия между службой переливания крови и клиническими бригадами без ненужных действий. Большинство протоколов обеспечивают базовое сбалансированное переливание эритроцитов и компонентной терапии (плазма, тромбоциты) в эмпирических упаковках, которые при необходимости дополняются дополнительными методами лечения. Эритроциты группы O (эритроциты) должны быть предоставлены пациентам без необходимости подтверждения группы крови. Большинство MHP поддерживают использование принципов инфузионной терапии с контролем повреждений, включая высокие соотношения плазмы к эритроцитам и тромбоцитов к эритроцитам [50]. Пример упаковки MHP может включать 4 единицы эритроцитов и 4 единицы плазмы и может включать компоненты тромбоцитов или криопреципитата (Fig. 1).

За последние несколько лет некоторые организации здравоохранения начали использовать цельную кровь. Цельная кровь содержит эритроциты, плазму и тромбоциты, что позволяет легче вводить ее по сравнению с отдельными компонентами крови, одновременно уменьшая дополнительное введение жидкости [51]. Однако цельная кровь не является универсально доступной, и компонентная терапия может оказаться более подходящей в некоторых больницах. Современные рекомендации рекомендуют дополнять эмпирическое введение препаратов для сбалансированной реанимации дополнительными средствами коагуляционной терапии, назначаемыми для лечения установленных коагулопатий, диагностированных по результатам вискоэластических или обычных коагуляционных тестов [27, 28,52–56]. Эти методы лечения могут включать концентраты фибриногена (или криопреципитат), концентраты тромбоцитов, концентраты прокоагулянтов или транексамовую кислоту. Эта стратегия, графически проиллюстрированная на Figs. 1 and 22, позволяет постоянно проводить повторную оценку развития коагулопатии, вызванной гемодилюцией, и лечить любые установленные нарушения коагуляции [57–59]. Как указано выше, важно контекстуализировать результаты коагуляционных тестов в контексте известного состояния (травма, PPH,CLD ) и соответствующим образом адаптировать лечение.

Концентраты протромбинового комплекса (PCCs ) рассматривались в некоторых MHP, хотя их роль остается неясной. Четырехфакторный (фактор II, фактор VII, фактор IX и фактор X) концентрат протромбинового комплекса в основном показан для устранения антагонистов витамина К [60], но иногда используется не по назначению для обеспечения витамин-К-зависимых факторов свертывания крови в различных клинических условиях. В зависимости от конкретного PCC продукты также содержат небольшое количество белков C, S и Z, нефракционированный гепарин или антитромбин. Хотя несколько ретроспективных исследований с сопоставлением по склонности предположили, что PCCs могут улучшить выживаемость и снизить общее потребление продуктов крови [61–64], исследование PROCOAG [65] недавно показало явное неблагоприятное соотношение риска и пользы при эмпирическом назначении PCCs пациентам с травмами. Действительно, у 327 пациентов с травмами, подвергающихся риску массивной гемотрансфузии, эмпирическое введение четырехфакторного концентрата протромбинового комплекса в сочетании с СЗП не смогло снизить общее потребление продуктов крови и значительно увеличило количество тромбоэмболических событий по сравнению с плацебо (относительный риск 1,48 [95] % ДИ 1,04–2,10];p = 0,03). Аналогичным образом, хотя кровотечение усугубляется острым дефицитом фибриногена, исследование RYOSTAT-2 [66] показало, что раннее эмпирическое введение высокой дозы криопреципитата (3 дозы; 6 г эквивалента фибриногена) в дополнение к стандартному лечению в течение 3 часов после травмы не улучшило 28-дневную смертность от всех причин ((ОШ 0,96 [95% ДИ 0,75–1,23]; p = 0,74). Оба исследования подчеркивают, что эмпирическое введение концентратов факторов свертывания крови больше не рекомендуется.
Ведение пациентов после кровотечения и массивной трансфузии
После массивного переливания крови и остановки кровотечения пациенты находятся в резко измененном и сложном физиологическом состоянии, требующем тщательного наблюдения и целенаправленной помощи для уменьшения дальнейших осложнений и оптимизации результатов.Широкомасштабная активация иммунной системы может привести к системному воспалительному состоянию, которое может быть дисрегулировано и сопровождаться иммунной супрессией и сепсисом [67, 68]. Кроме того, за геморрагическим шоком может наблюдаться гипердинамическое состояние с высоким сердечным выбросом и расширением сосудов, которое может маскировать продолжающуюся гиповолемию. Ишемия миокарда во время глубокого геморрагического шока может вызвать сердечную дисфункцию, которую трудно отличить от других состояний шока. Наконец, за начальной коагулопатией, связанной с кровотечением, может последовать рикошетная гиперкоагуляция с компенсаторной активацией гемостаза и протромботическим состоянием [14].Этот переход может произойти на очень ранних стадиях клинического течения и может усугубляться задержкой или чрезмерным введением прокоагулянтов или антифибринолитиков [69].
Поддержка кровообращения
Пациентам может продолжать требоваться инфузионная терапия после массивной трансфузии из-за утечки капилляров, связанной с расширением сосудов и повышенной проницаемостью эндотелия. Использование больших объемов кристаллоидов при травматическом геморрагическом шоке связано с повышенной смертностью и увеличением проницаемости эндотелия, что может быть связано с отторжением гликокаликса и разрушением адгезивных и плотных соединений [70]. Поэтому кристаллоиды следует использовать разумно. Переливание эритроцитов может быть целесообразным, если уровень гемоглобина низкий. Использование богатых белком жидкостей, таких как плазма, по сравнению с кристаллоидами, было связано с восстановлением толщины гликокаликса в экспериментальных моделях травмы [71–73]. Исследования на людях с травмами также предполагают полезную роль плазмы в поддержании целостности гликокаликса [74, 75]. У пациентов после травмы или операции, перенесших тяжелый геморрагический шок, развивается гипердинамияс картиной распределительного шока из-за системной воспалительной реакции. Для поддержания перфузионного давления часто требуется раннее введение вазопрессоров. Это может маскировать относительную или абсолютную гиповолемию. Кроме того, вторичное повреждение миокарда вследствие ишемии и воспаления также может возникать после глубокого шока, о чем свидетельствует повышение уровня тропонина в течение 24–48 часов, приводящее к сердечной дисфункции [76, 77]. Это может усугубляться ранними электролитными нарушениями, такими как гиперкалиемия и гипокальциемия. При наличии дополнительного компонента кардиогенного шока инотропные средства (такие как милринон, добутамин или адреналин) могут усиливать поддержку дистрибутивного и/или гиповолемического шока. Таким образом, лечение данных пациентов является сложным, требующим тонкого баланса жидкостей, вазопрессоров и инотропных средств, и данные в этой области ограничены.
Тромбопрофилактика
Пациенты, перенесшие шок и массивное переливание крови, находятся в состоянии гиперкоагуляции. Исследования продемонстрировали переход к состоянию гиперкоагуляции в течение 48 часов после травмы и, возможно, в течение 3–6 часов после травмы [78]. Венозная тромбоэмболия встречается у 20% пациентов с травмами и остается высокой даже при фармакологической тромбопрофилактике [79]. При черепно-мозговой травме одной из потенциальных причин, объясняющих высокий риск тромбоэмболических осложнений после массивного кровотечения, является избегание или отсрочка применения фармакологической тромбопрофилактики из-за страха усугубления или повторных кровотечений, что еще больше увеличивает риск венозной тромбоэмболии (VTE) [80, 81]. Действительно, хотя было показано, что тромбопрофилактика снижает риск VTE, имеются некоторые доказательства того, что раннее начало тромбопрофилактики может быть связано с необходимостью повторного хирургического вмешательства [82]. В 2020 году Western Trauma Association ассоциация выпустила алгоритм профилактики ВТЭ после травмы, чтобы помочь определить, какие пациенты нуждаются в фармакологической профилактике, а также ее тип и дозирование [83]. Данные о прогрессировании внутричерепного кровоизлияния после начала профилактики VTE противоречивы. Существует мало доказательств того, что стандартные дозы гепарина или низкомолекулярных гепаринов связаны с посттравматическими кровотечениями за пределами центральной нервной системы. Отказ от профилактики VTE в течение длительного периода из-за опасений усугубления кровотечения не имеет достаточных оснований и может привести к вреду, поскольку задержки и пропуск доз профилактики VTE связаны с повышенным риском ее развития [84]. Имеются убедительные доказательства в пользу использования низкомолекулярного гепарина (LMWH ) вместо нефракционированного гепарина (UFH ) [85]. Пациентам с травмами могут потребоваться промежуточные или высокие дозы LMWH, поскольку недавние данные свидетельствуют о том, что резистентность к LMWH может быть распространена у пациентов с тяжелыми травмами, связанными с дефицитом антитромбина [79]. Это может быть еще одним фактором, способствующим высокой частоте LMWH , несмотря на текущую «лучшую практику» химиопрофилактики. К сожалению, в настоящее время имеется мало доказательств для определения оптимальной тромбопрофилактики у пациентов без травм. Хотя роль механической тромбопрофилактики до сих пор дискутируется, а имеющиеся данные дают противоречивые результаты [86, 87], европейские руководства рекомендуют использование механической профилактики у пациентов с противопоказаниями к антикоагулянтной терапии (класс 1В) и предлагают использование периодической пневматической профилактики или чулки с градуированной компрессией (степень 2В) [88, 89]. Американские рекомендации не поддерживают использование комбинированной терапии вместо фармакологической терапии или компрессионной терапии [90].
Анемия
Анемия часто встречается среди пациентов в критическом состоянии в период выздоровления.Исследования показали, что анемией страдают 70–80% пациентов после перевода из ОИТ, причем почти у половины из них сохраняется анемия через 6 месяцев [91]. Анемия критических состояний является многофакторной, хотя ключевыми медиаторами являются низкий уровень эритропоэтина (EPO ), ятрогенная кровопотеря и функциональный дефицит железа (обусловленный высокими уровнями гепсидина) [92]. У тех пациентов, которые выживают после массивного переливания крови, кровопотеря и еще большее истощение запасов железа усугубляются анемией, что может ограничить способность пациента креабилитации. Было предложено превентивное лечение анемии критических состояний, с помощью EPO или железа, но это остается неопределенным и спорным [93].Европейские рекомендации не рекомендуют использовать ни EPO , ни железо у пациентов ОИТ [94], поскольку EPO может увеличить риск тромбоза у пациентов с прокоагулянтными состояниями, а железо может быть, по меньшей мере, неэффективным (или опасным) у пациентов с системным воспалением.
Дополнительные соображения
1. Индивидуализация алгоритмов лечения
Важно отметить, что протоколы, разработанные для лечения пациентов с одним источником массивного кровотечения, например, травмой, могут быть нелегко адаптированы к другим. Кроме того, даже у пациентов с одной и той же основной причиной кровотечения уникальные различия в ответе на переливание крови и протоколы лечения могут отражать дополнительные факторы, влияющие на патофизиологические процессы. Две недавние статьи [95, 96] подчеркивают существование уникальных эндотипов , которые могут помочь в выявлении пациентов, которые будут реагировать на различные варианты терапии.
2. Эндоваскулярная баллонная окклюзия аорты (REBOA)
Поскольку массивное кровотечение является наиболее распространенной причиной предотвратимой смерти после травмы, Jansen et al. [97] провели прагматичное байесовское РКИ для оценки эффективности REBOA в отношении смертности. Девяносто пациентов с травмами и обескровливающими кровотечениями были рандомизированы для получения либо стандартного лечения +REBOA, либо только стандартного лечения. Авторы показали, что стратегия, сочетающая REBOA и стандартную помощь, не снижает смертность и может даже увеличить смертность по сравнению с только стандартной помощью (54% против 42%; ОШ 1,58 [95% ДИ 0,72–3,52].
3. Поиски антикоагулянта «Святого Грааля»
Различные причины массивных кровотечений у пациентов в критическом состоянии сложно предотвратить, однако случаи, связанные с антикоагулянтной терапией, представляют собой ситуации, которые можно предотвратить за счет разработки более эффективных лекарств.Продолжается поиск антикоагулянта «Святого Грааля», который способен предотвращать тромботические явления, не влияя на общий гемостаз и, следовательно, не повышая риск кровотечений. На сегодняшний день почти все традиционные антикоагулянты ингибируют факторы II или X; и, учитывая существенную роль этих факторов в поддержании гемостаза в стабильных условиях, их использование несет в себе повышенный риск кровотечения, который не является незначительным.
Недавние исследования показали, что воздействие на другие факторы свертывания кровиозволит избежать этого риска. Контактно-фазовый (внутренний) путь обычно не важен для поддержания физиологического гемостаза, но принимает участие в развитии патологического тромбоза. Таким образом, некоторые предполагают, что ингибиторы, нацеленные на факторы XI (FXI) или XII, могут оказывать антитромботическое действие, не увеличивать риск кровотечения [86–89]. Были разработаны новые стратегии воздействия на FXI, включая использование олигонуклеотидов (ASO), которые уменьшают синтез FXI в печени или блокируют активацию или активность FXI с помощью антител, аптамеров или других небольших молекул [90]. Ингибирование FXI, вероятно, потребует тонкой настройки, поскольку может возникнуть серьезный дефицит FXI. приводят к более высокому риску небольших кровотечений слизистых оболочек (ротоглотки/носоглотки и мочеполовых путей) после травмы или хирургического вмешательства, учитывая фибринолитическую активность [90].Тем не менее, клиническая полезность трех классов ингибиторов контактного пути в настоящее время оценивается в исследованиях фазы 2 и 3 в различных клинических ситуациях (Table 2).
Заключение
Кровотечение остается частым осложнением, встречающимся в ОРИТ, которое требует понимания патофизиологии различных коагулопатических состояний для обеспечения надлежащего оказания помощи пациентам. Диагностика и оценка кровотечения и геморрагического шока могут быть трудными и зависят от сочетания клинических и лабораторных показателей. Пациентам с массивным кровотечением лучше всего оказывать поддержку с использованием протоколов лечения, разработанных многопрофильными бригадами, чтобы обеспечить быстрое и скоординированное реагирование. Лечение после массивного переливания крови является сложным и требует понимания многочисленных вовлеченных патологических процессов. Требуются дополнительные исследования, особенно в отношении нетравматических причин кровотечения. Тем не менее, значительное снижение смертности, осложнений, использования ресурсов и отходов может быть достигнуто с помощью планового, междисциплинарного и научно обоснованного подхода [98].
References
1. Hooper N, Armstrong TJ (2023) Hemorrhagic. ShockStatPearls, Treasure Island
2. Lauzier F, Arnold D, Rabbat C (2012) In medical-surgical ICU patients, major bleeding is common but independent of heparin prophylaxis. Crit Care 16(Suppl 1):P435
3. Russell L, Holst LB, Kjeldsen L, Stensballe J, Perner A (2017) Risks of bleeding and thrombosis in intensive care unit patients with haematological malignancies. Ann Intensive Care 7:119
4. Schulman S, Kearon C, Subcommittee on Control of Anticoagulation of the S, Standardization Committee of the International Society on T, Haemostasis (2005) Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. J Thromb
Haemost 3:692–694
5. Moore EE, Moore HB, Kornblith LZ, Neal MD, Hoffman M, Mutch NJ,Schochl H, Hunt BJ, Sauaia A (2021) Trauma-induced coagulopathy. NatRev Dis Primers 7:30
6. Raza I, Davenport R, Rourke C, Platton S, Manson J, Spoors C, Khan S, De’Ath HD, Allard S, Hart DP, Pasi KJ, Hunt BJ, Stanworth S, MacCallum PK, Brohi K (2013) The incidence and magnitude of fibrinolytic activation in trauma patients. J Thromb Haemost 11:307–314
7. Rourke C, Curry N, Khan S, Taylor R, Raza I, Davenport R, Stanworth S, Brohi K (2012) Fibrinogen levels during trauma hemorrhage, response to replacement therapy, and association with patient outcomes. J Thromb Haemost 10:1342–1351
8. de Lloyd L, Jenkins PV, Bell SF, Mutch NJ, Martins Pereira JF, Badenes PM, James D, Ridgeway A, Cohen L, Roberts T, Field V, Collis RE, Collins PW (2023) Acute obstetric coagulopathy during postpartum hemorrhage is caused by hyperfibrinolysis and dysfibrinogenemia: an observational cohort study. J Thromb Haemost 21:862–879
9. Charbit B, Mandelbrot L, Samain E, Baron G, Haddaoui B, Keita H, Sibony O, Mahieu-Caputo D, Hurtaud-Roux MF, Huisse MG, Denninger MH, de Prost D, Group PPHS (2007) The decrease of fibrinogen is an early predictor of the severity of postpartum hemorrhage. J Thromb Haemost 5:266–273
10. Schulman S, Angeras U, Bergqvist D, Eriksson B, Lassen MR, Fisher W, Subcommittee
on Control of Anticoagulation of the S, Standardization Committee of the International Society on T, Haemostasis (2010) Definition of major bleeding in clinical investigations of antihemostatic medicinal products in surgical patients. J Thromb Haemost 8:202–204
11. Ow TW, Fatourou E, Rabinowich L, van den Boom B, Nair S, Patel VC, Hogan B, McPhail M, Roberts LN, Bernal W (2022) Prevalence of bleeding and thrombosis in critically ill patients with chronic liver disease. Thromb Haemost 122:1006–1016
12. van den Boom BP, Lisman T (2022) Pathophysiology and management of bleeding and thrombosis in patients with liver disease. Int J Lab Hematol 44(Suppl 1):79–88
13. Roberts LN (2021) Rebalanced hemostasis in liver disease: a misunderstood coagulopathy. Hematol Am Soc Hematol Educ Progr 2021:485–491
14. Helms J, Iba T, Connors JM, Gando S, Levi M, Meziani F, Levy JH (2023) How to manage coagulopathies in critically ill patients. Intensive Care Med 49:273–290
15. Levi M, Scully M (2018) How I treat disseminated intravascular coagulation. Blood 131:845–854
16. Hedges SJ, Dehoney SB, Hooper JS, Amanzadeh J, Busti AJ (2007) Evidence-based treatment recommendations for uremic bleeding. Nat Clin Pract Nephrol 3:138–153
17. Hunt BJ (2014) Bleeding and coagulopathies in critical care. N Engl J Med 370:847–859
18. Botrel T, Cunat S, Helms J, Lemarie J, Gaillon J, Preau S, Favory R, Thille AW, Boissier F, Maury E, Joffre J, Ait-Oufella H (2023) Extracranial anticoagulant related bleedings admitted to intensive care units: a French multicenter retrospective study. Crit Care 27:312
19. Mutschler M, Nienaber U, Brockamp T, Wafaisade A, Fabian T, Paffrath T, Bouillon B, Maegele M, TraumaRegister DGU (2013) Renaissance of base deficit for the initial assessment of trauma patients: a base deficit-based classification for hypovolemic shock developed on data from 16,305 patients derived from the TraumaRegister DGU(R). Crit Care 17:R42
20. Helms J, Curtiaud A, Severac F, Merdji H, Angles-Cano E (2023) Dynamic longitudinal increase in D-dimers: an early predictor of bleeding complications in ECMO. Intensive Care Med 49:1416
21. Li C, Zhao Q, Yang K, Jiang L, Yu J (2019) Thromboelastography or rotational thromboelastometry for bleeding management in adults undergoing cardiac surgery: a systematic review with meta-analysis and trial sequential analysis. J Thorac Dis 11:1170–1181
22. Amgalan A, Allen T, Othman M, Ahmadzia HK (2020) Systematic review of viscoelastic testing (TEG/ROTEM) in obstetrics and recommendations from the women’s SSC of the ISTH. J Thromb Haemost 18:1813–1838
23. Collins PW, Cannings-John R, Bruynseels D, Mallaiah S, Dick J, Elton C, Weeks AD, Sanders J, Aawar N, Townson J, Hood K, Hall JE, Collis RE (2017) Viscoelastometric-guided early fibrinogen concentrate replacement during postpartum haemorrhage: OBS2, a double-blind randomized controlled trial. Br J Anaesth 119:411–421
24. Al Moosawi M, Trudeau J, Smith T, Lefebvre A, Shih AW (2021) ROTEM in the setting of liver transplant surgery reduces frozen plasma transfusion. Transfus Apher Sci 60:103125
25. Zamper RPC, Amorim TC, Queiroz VNF, Lira JDO, Costa LGV, Takaoka F, Juffermans NP, Neto AS (2018) Association between viscoelastic testsguided therapy with synthetic factor concentrates and allogenic blood transfusion in liver transplantation: a before-after study. BMC Anesthesiol 18:198
26. Levrat A, Gros A, Rugeri L, Inaba K, Floccard B, Negrier C, David JS (2008) Evaluation of rotation thrombelastography for the diagnosis of hyperfibrinolysis in trauma patients. Br J Anaesth 100:792–797
27. Rossaint R, Afshari A, Bouillon B, Cerny V, Cimpoesu D, Curry N, Duranteau J, Filipescu D, Grottke O, Gronlykke L, Harrois A, Hunt BJ, Kaserer A, Komadina R, Madsen MH, Maegele M, Mora L, Riddez L, Romero CS, Samama CM, Vincent JL, Wiberg S, Spahn DR (2023) The European guideline on management of major bleeding and coagulopathy following trauma:
sixth edition. Crit Care 27:80
28. Kietaibl S, Ahmed A, Afshari A, Albaladejo P, Aldecoa C, Barauskas G, De Robertis E, Faraoni D, Filipescu DC, Fries D, Godier A, Haas T, Jacob M, Lance MD, Llau JV, Meier J, Molnar Z, Mora L, Rahe-Meyer N, Samama CM, Scarlatescu E, Schlimp C, Wikkelso AJ, Zacharowski K (2023) Management of severe peri-operative bleeding: guidelines from the European Society of Anaesthesiology and Intensive Care: second update 2022. Eur J Anaesthesiol 40:226–304
29. Erdoes G, Faraoni D, Koster A, Steiner ME, Ghadimi K, Levy JH (2023) Perioperative considerations in management of the severely bleeding coagulopathic patient. Anesthesiology 138:535–560
30. Muldowney M, Aichholz P, Nathwani R, Stansbury LG, Hess JR, Vavilala MS (2022) Advances in hemorrhage control resuscitation. Curr Opin Anaesthesiol 35:176–181
31. Vlaar APJ, Dionne JC, de Bruin S, Wijnberge M, Raasveld SJ, van Baarle F, Antonelli M, Aubron C, Duranteau J, Juffermans NP, Meier J, Murphy GJ, Abbasciano R, Muller MCA, Lance M, Nielsen ND, Schochl H, Hunt BJ, Cecconi M, Oczkowski S (2021) Transfusion strategies in bleeding critically ill adults: a clinical practice guideline from the European Society of Intensive Care Medicine. Intensive Care Med 47:1368–1392
32. Pham HP, Shaz BH (2013) Update on massive transfusion. Br J Anaesth 111(Suppl 1):i71-82
33. de Bruin S, Eggermont D, van Bruggen R, de Korte D, Scheeren TWL, Bakker J, Vlaar APJ (2022) Transfusion practice in the bleeding critically ill: an international online survey-The TRACE-2 survey. Transfusion 62:324–335
34. Wiersum-Osselton JC, Whitaker B, Grey S, Land K, Perez G, Rajbhandary S, Andrzejewski C Jr, Bolton-Maggs P, Lucero H, Renaudier P, Robillard P, Santos M, Schipperus M (2019) Revised international surveillance case definition of transfusion-associated circulatory overload: a classification agreement validation study. Lancet Haematol 6:e350–e358
35. Bosboom JJ, Klanderman RB, Migdady Y, Bolhuis B, Veelo DP, Geerts BF, Murphy MF, Vlaar APJ (2019) Transfusion-associated circulatory overload: a clinical perspective. Transfus Med Rev 33:69–77
36. Ruseckaite R, McQuilten ZK, Oldroyd JC, Richter TH, Cameron PA, Isbister JP, Wood EM (2017) Descriptive characteristics and in-hospital mortality of critically bleeding patients requiring massive transfusion: results from the Australian and New Zealand Massive Transfusion Registry. Vox Sang 112:240–248
37. Karameh H, Bruoha S, Taha L, Tabi M, Farkash R, Karmi M, Hamayel K, Perel N, Steinmetz Y, Marmor D, Manassra M, Maller T, Hitter R, Amsalem I, Glikson M, Asher E (2023) Outcomes of patients treated with blood transfusion in a contemporary tertiary care medical center intensive cardiac care unit. J Clin Med 12:1304
38. Halmin M, Chiesa F, Vasan SK, Wikman A, Norda R, Rostgaard K, Vesterager Pedersen OB, Erikstrup C, Nielsen KR, Titlestad K, Ullum H, Hjalgrim H, Edgren G (2016) Epidemiology of massive transfusion: a binational study from Sweden and Denmark. Crit Care Med 44:468–477
39. Borgman MA, Spinella PC, Perkins JG, Grathwohl KW, Repine T, Beekley AC, Sebesta J, Jenkins D, Wade CE, Holcomb JB (2007) The ratio of blood products transfused affects mortality in patients receiving massive transfusions at a combat support hospital. J Trauma 63:805–813
40. Halmin M, Bostrom F, Brattstrom O, Lundahl J, Wikman A, Ostlund A, Edgren G (2013) Effect of plasma-to-RBC ratios in trauma patients: a cohort study with time-dependent data*. Crit Care Med 41:1905–1914
41. Mesar T, Larentzakis A, Dzik W, Chang Y, Velmahos G, Yeh DD (2017) Association between ratio of fresh frozen plasma to red blood cells during massive transfusion and survival among patients without traumatic injury. JAMA Surg 152:574–580
42. Cardigan R, Latham T, Weaver A, Yazer M, Green L (2022) Estimating the risks of prehospital transfusion of D-positive whole blood to trauma patients who are bleeding in England. Vox Sang 117:701–707
43. Seheult JN, Stram MN, Pearce T, Bub CB, Emery SP, Kutner J, Watanabe-Okochi N, Sperry JL, Takanashi M, Triulzi DJ, Yazer MH (2021) The risk to future pregnancies of transfusing Rh(D)-negative females of childbearing potential with Rh(D)-positive red blood cells during trauma resuscitation is dependent on their age at transfusion. Vox Sang 116:831–840
44. Gammon RR, Meena-Leist C, Al Mozain N, Cruz J, Hartwell E, Lu W, Karp JK, Noone S, Orabi M, Tayal A, Bocquet C, Tanhehco Y (2023) Whole blood in civilian transfusion practice: a review of the literature. Transfusion 63:1758–1766
45. Mack JP, Miles J, Stolla M (2020) Cold-stored platelets: review of studies in humans. Transfus Med Rev 34:221–226
46. Meneses E, Boneva D, McKenney M, Elkbuli A (2020) Massive transfusion protocol in adult trauma population. Am J Emerg Med 38:2661–2666
47. Sommer N, Schnuriger B, Candinas D, Haltmeier T (2019) Massive transfusion protocols in nontrauma patients: a systematic review and metaanalysis. J Trauma Acute Care Surg 86:493–504
48. Hu P, Uhlich R, Black J, Jansen JO, Kerby J, Holcomb JB (2021) A new definition for massive transfusion in the modern era of whole blood resuscitation. Transfusion 61(Suppl 1):S252-s263
49. Foster JC, Sappenfield JW, Smith RS, Kiley SP (2017) Initiation and termination of massive transfusion protocols: current strategies and future prospects. Anesth Analg 125:2045–2055
50. Camazine MN, Hemmila MR, Leonard JC, Jacobs RA, Horst JA, Kozar RA, Bochicchio GV, Nathens AB, Cryer HM, Spinella PC (2015) Massive transfusion policies at trauma centers participating in the American College of Surgeons Trauma Quality Improvement Program. J Trauma Acute Care Surg 78:S48-53
51. Ngatuvai M, Zagales I, Sauder M, Andrade R, Santos RG, Bilski T, Kornblith L, Elkbuli A (2023) Outcomes of transfusion with whole blood, component therapy, or both in adult civilian trauma patients: a systematic review and meta-analysis. J Surg Res 287:193–201
52. Casu S (2021) Simplified treatment algorithm for the management of trauma-induced hemorrhage without viscoelastic testing. Trauma Surg Acute Care Open 6:e000779
53. Bugaev N, Como JJ, Golani G, Freeman JJ, Sawhney JS, Vatsaas CJ, Yorkgitis BK, Kreiner LA, Garcia NM, Aziz HA, Pappas PA, Mahoney EJ, Brown ZW, Kasotakis G (2020) Thromboelastography and rotational thromboelastometry in bleeding patients with coagulopathy: practice management guideline from the Eastern Association for the Surgery of Trauma. J
Trauma Acute Care Surg 89:999–1017
54. Blaine KP, Steurer MP (2019) Viscoelastic monitoring to guide the correction of perioperative coagulopathy and massive transfusion in patients with life-threatening hemorrhage. Anesthesiol Clin 37:51–66
55. Baksaas-Aasen K, Gall LS, Stensballe J, Juffermans NP, Curry N, Maegele M, Brooks A, Rourke C, Gillespie S, Murphy J, Maroni R, Vulliamy P, Henriksen HH, Pedersen KH, Kolstadbraaten KM, Wirtz MR, Kleinveld DJB, Schafer N, Chinna S, Davenport RA, Naess PA, Goslings JC, Eaglestone S, Stanworth
S, Johansson PI, Gaarder C, Brohi K (2021) Viscoelastic haemostatic assay augmented protocols for major trauma haemorrhage (ITACTIC): a randomized, controlled trial. Intensive Care Med 47:49–59
56. Baksaas-Aasen K, Van Dieren S, Balvers K, Juffermans NP, Naess PA, Rourke C, Eaglestone S, Ostrowski SR, Stensballe J, Stanworth S, Maegele M, Goslings JC, Johansson PI, Brohi K, Gaarder C, collaborators TI (2019) Datadriven development of ROTEM and TEG algorithms for the management of trauma hemorrhage: a prospective observational multicenter study. Ann Surg 270:1178–1185
57. Gorlinger K, Perez-Ferrer A, Dirkmann D, Saner F, Maegele M, Calatayud AAP, Kim TY (2019) The role of evidence-based algorithms for rotational thromboelastometry-guided bleeding management. Korean J Anesthesiol 72:297–322
58. Hartmann J, Hermelin D, Levy JH (2023) Viscoelastic testing: an illustrated review of technology and clinical applications. Res Pract Thromb Haemost 7:100031
59. Zhu Z, Yu Y, Hong K, Luo M, Ke Y (2022) Utility of viscoelastic hemostatic assay to guide hemostatic resuscitation in trauma patients: a systematic review. World J Emerg Surg 17:48
60. Bouzat P, Hunt BJ, Juffermans NP (2023) Four-factor prothrombin complex concentrate in trauma patients. Intensive Care Med 49:1242–1244
61. Jehan F, Aziz H, O’Keeffe T, Khan M, Zakaria ER, Hamidi M, Zeeshan M, Kulvatunyou
N, Joseph B (2018) The role of four-factor prothrombin complex concentrate in coagulopathy of trauma: a propensity matched analysis. J Trauma Acute Care Surg 85:18–24
62. Zeeshan M, Hamidi M, Feinstein AJ, Gries L, Jehan F, Sakran J, Northcutt A, O’Keeffe T, Kulvatunyou N, Joseph B (2019) Four-factor prothrombin complex concentrate is associated with improved survival in trauma-related hemorrhage: a nationwide propensity-matched analysis. J Trauma Acute Care Surg 87:274–281
63. Joseph B, Aziz H, Pandit V, Hays D, Kulvatunyou N, Yousuf Z, Tang A, O’Keeffe T, Green D, Friese RS, Rhee P (2014) Prothrombin complex concentrate versus fresh-frozen plasma for reversal of coagulopathy of trauma: is there a difference? World J Surg 38:1875–1881
64. Joseph B, Khalil M, Harrison C, Swartz T, Kulvatunyou N, Haider AA, Jokar TO, Burk D, Mahmoud A, Latifi R, Rhee P (2016) Assessing the efficacy of prothrombin complex concentrate in multiply injured patients with highenergy pelvic and extremity fractures. J Orthop Trauma 30:653–658
65. Bouzat P, Charbit J, Abback PS, Huet-Garrigue D, Delhaye N, Leone M, Marcotte G, David JS, Levrat A, Asehnoune K, Pottecher J, Duranteau J, Courvalin E, Adolle A, Sourd D, Bosson JL, Riou B, Gauss T, Payen JF, Group PS (2023) Efficacy and safety of early administration of 4-factor prothrombin complex concentrate in patients with trauma at risk of massive transfusion:
the PROCOAG Randomized Clinical Trial. JAMA 329:1367–1375
66. Davenport R, Curry N, Fox EE, Thomas H, Lucas J, Evans A, Shanmugaranjan S, Sharma R, Deary A, Edwards A, Green L, Wade CE, Benger JR, Cotton BA, Stanworth SJ, Brohi K, Investigators C-P (2023) Early and empirical high-dose cryoprecipitate for hemorrhage after traumatic injury: the CRYOSTAT-2 randomized clinical trial. JAMA 21 330(19):1882–1891. https://doi. org/ 10. 1001/ jama. 2023. 21019
67. Cabrera CP, Manson J, Shepherd JM, Torrance HD, Watson D, Longhi MP,Hoti M, Patel MB, O’Dwyer M, Nourshargh S, Pennington DJ, Barnes MR,Brohi K (2017) Signatures of inflammation and impending multiple organ dysfunction in the hyperacute phase of trauma: a prospective cohort study. PLoS Med 14:e1002352
68. Mira JC, Brakenridge SC, Moldawer LL, Moore FA (2017) Persistent inflammation,
immunosuppression and catabolism syndrome. Crit Care Clin 33:245–258
69. Wirtz MR, Schalkers DV, Goslings JC, Juffermans NP (2020) The impact of blood product ratio and procoagulant therapy on the development of thromboembolic events in severely injured hemorrhaging trauma patients. Transfusion 60:1873–1882
70. Johansson PI, Stensballe J, Rasmussen LS, Ostrowski SR (2011) A high admission syndecan-1 level, a marker of endothelial glycocalyx degradation, is associated with inflammation, protein C depletion, fibrinolysis, and increased mortality in trauma patients. Ann Surg 254:194–200
71. Torres LN, Chung KK, Salgado CL, Dubick MA, Torres Filho IP (2017) Low volume
resuscitation with normal saline is associated with microvascular endothelial dysfunction after hemorrhage in rats, compared to colloids and balanced crystalloids. Crit Care 21:160
72. Torres LN, Sondeen JL, Ji L, Dubick MA, Torres Filho I (2013) Evaluation of resuscitation fluids on endothelial glycocalyx, venular blood flow, and coagulation function after hemorrhagic shock in rats. J Trauma Acute Care Surg 75:759–766
73. Kozar RA, Peng Z, Zhang R, Holcomb JB, Pati S, Park P, Ko TC, Paredes A (2011) Plasma restoration of endothelial glycocalyx in a rodent model of hemorrhagic shock. Anesth Analg 112:1289–1295
74. Gruen DS, Brown JB, Guyette FX, Vodovotz Y, Johansson PI, Stensballe J, Barclay DA, Yin J, Daley BJ, Miller RS, Harbrecht BG, Claridge JA, Phelan HA, Neal MD, Zuckerbraun BS, Billiar TR, Sperry JL, group PAs, (2020) Prehospital plasma is associated with distinct biomarker expression following injury. JCI Insight 5:e135350
75. Gruen DS, Guyette FX, Brown JB, Okonkwo DO, Puccio AM, Campwala IK, Tessmer MT, Daley BJ, Miller RS, Harbrecht BG, Claridge JA, Phelan HA, Neal MD, Zuckerbraun BS, Yazer MH, Billiar TR, Sperry JL (2020) Association of prehospital plasma with survival in patients with traumatic brain injury: a secondary analysis of the PAMPer cluster randomized clinical
trial. JAMA Netw Open 3:e2016869
76. Weber B, Lackner I, Gebhard F, Miclau T, Kalbitz M (2021) Trauma, a matter of the heart-molecular mechanism of post-traumatic cardiac dysfunction. Int J Mol Sci 22:737
77. De’Ath HD, Rourke C, Davenport R, Manson J, Renfrew I, Uppal R, Davies LC, Brohi K (2012) Clinical and biomarker profile of trauma-induced secondary cardiac injury. Br J Surg 99:789–797
78. Schellenberg M, Costantini T, Joseph B, Price MA, Bernard AC, Haut ER (2023) Timing of venous thromboembolism prophylaxis initiation after injury: Findings from the consensus conference to implement optimal VTE prophylaxis in trauma. J Trauma Acute Care Surg 94:484–489
79. Vincent LE, Talanker MM, Butler DD, Zhang X, Podbielski JM, Wang YW, Chen-Goodspeed A, Hernandez Gonzalez SL, Fox EE, Cotton BA, Wade CE, Cardenas JC (2022) Association of changes in antithrombin activity over time with responsiveness to enoxaparin prophylaxis and risk of trauma related venous thromboembolism. JAMA Surg 157:713–721
80. Lu VM, Alvi MA, Rovin RA, Kasper EM (2020) Clinical outcomes following early versus late pharmacologic thromboprophylaxis in patients with traumatic intracranial hemorrhage: a systematic review and meta-analysis. Neurosurg Rev 43:861–872
81. Spano PJ 2nd, Shaikh S, Boneva D, Hai S, McKenney M, Elkbuli A (2020) Anticoagulant chemoprophylaxis in patients with traumatic brain injuries: a systematic review. J Trauma Acute Care Surg 88:454–460
82. Byrne JP, Witiw CD, Schuster JM, Pascual JL, Cannon JW, Martin ND, Reilly PM, Nathens AB, Seamon MJ (2022) Association of venous thromboembolism prophylaxis after neurosurgical intervention for traumatic brain injury with thromboembolic complications, repeated neurosurgery, and mortality. JAMA Surg 157:e215794
83. Ley EJ, Brown CVR, Moore EE, Sava JA, Peck K, Ciesla DJ, Sperry JL, Rizzo AG, Rosen NG, Brasel KJ, Kozar R, Inaba K, Martin MJ (2020) Updated guidelines to reduce venous thromboembolism in trauma patients: a Western Trauma Association critical decisions algorithm. J Trauma Acute Care Surg 89:971–981
84. Skarupa D, Hanna K, Zeeshan M, Madbak F, Hamidi M, Haddadin Z, Northcutt A, Gries L, Kulvatunyou N, Joseph B (2019) Is early chemical thromboprophylaxis in patients with solid organ injury a solid decision? J Trauma Acute Care Surg 87:1104–1112
85. Tran A, Fernando SM, Carrier M, Siegal DM, Inaba K, Vogt K, Engels PT, English SW, Kanji S, Kyeremanteng K, Lampron J, Kim D, Rochwerg B (2022) Efficacy and safety of low molecular weight heparin versus unfractionated heparin for prevention of venous thromboembolism in trauma patients: a systematic review and meta-analysis. Ann Surg 275:19–28
86. Fernando SM, Tran A, Cheng W, Sadeghirad B, Arabi YM, Cook DJ, Moller MH, Mehta S, Fowler RA, Burns KEA, Wells PS, Carrier M, Crowther MA, Scales DC, English SW, Kyeremanteng K, Kanji S, Kho ME, Rochwerg B (2022) VTE prophylaxis in critically ill adults: a systematic review and network meta-analysis. Chest 161:418–428
87. Helms J, Middeldorp S, Spyropoulos AC (2023) Thromboprophylaxis in critical care. Intensive Care Med 49:75–78
88. Duranteau J, Taccone FS, Verhamme P, Ageno W, Force EVGT (2018) European guidelines on perioperative venous thromboembolism prophylaxis: Intensive care. Eur J Anaesthesiol 35:142–146
89. Afshari A, Fenger-Eriksen C, Monreal M, Verhamme P, Force EVGT (2018) European guidelines on perioperative venous thromboembolism prophylaxis: Mechanical prophylaxis. Eur J Anaesthesiol 35:112–115
90. Schunemann HJ, Cushman M, Burnett AE, Kahn SR, Beyer-Westendorf J, Spencer FA, Rezende SM, Zakai NA, Bauer KA, Dentali F, Lansing J, Balduzzi S, Darzi A, Morgano GP, Neumann I, Nieuwlaat R, Yepes-Nunez JJ, Zhang Y, Wiercioch W (2018) American Society of Hematology 2018 guidelines for management of venous thromboembolism: prophylaxis for hospitalized and nonhospitalized medical patients. Blood Adv 2:3198–3225
91. Bateman AP, McArdle F, Walsh TS (2009) Time course of anemia during six months follow up following intensive care discharge and factors associated with impaired recovery of erythropoiesis. Crit Care Med 37:1906–1912
92. Hayden SJ, Albert TJ, Watkins TR, Swenson ER (2012) Anemia in critical illness: insights into etiology, consequences, and management. Am J Respir Crit Care Med 185:1049–1057
93. Jelkmann I, Jelkmann W (2013) Impact of erythropoietin on intensive care unit patients. Transfus Med Hemother 40:310–318
94. Vlaar AP, Oczkowski S, de Bruin S, Wijnberge M, Antonelli M, Aubron C,Aries P, Duranteau J, Juffermans NP, Meier J, Murphy GJ, Abbasciano R, Muller M, Shah A, Perner A, Rygaard S, Walsh TS, Guyatt G, Dionne JC, Cecconi M (2020) Transfusion strategies in non-bleeding critically ill adults: a clinical practice guideline from the European Society of Intensive Care Medicine. Intensive Care Med 46:673–696
95. Thau MR, Liu T, Sathe NA, O’Keefe GE, Robinson BRH, Bulger E, Wade CE, Fox EE, Holcomb JB, Liles WC, Stanaway IB, Mikacenic C, Wurfel MM, Bhatraju PK, Morrell ED (2023) Association of trauma molecular endotypes with differential response to transfusion resuscitation strategies. JAMA Surg 158:728–736
96. Wu J, Vodovotz Y, Abdelhamid S, Guyette FX, Yaffe MB, Gruen DS, Cyr A,Okonkwo DO, Kar UK, Krishnamoorthi N, Voinchet RG, Billiar IM, Yazer MH, Namas RA, Daley BJ, Miller RS, Harbrecht BG, Claridge JA, Phelan HA, Zuckerbraun BS, Johansson PI, Stensballe J, Morrissey JH, Tracy RP, Wisniewski SR, Neal MD, Sperry JL, Billiar TR, Group PAs (2021) Multi-omic analysis in injured humans: patterns align with outcomes and treatment
responses. Cell Rep Med 2:100478
97. Jansen JO, Hudson J, Cochran C, MacLennan G, Lendrum R, Sadek S, Gillies K, Cotton S, Kennedy C, Boyers D, Ferry G, Lawrie L, Nath M, Wileman S, Forrest M, Brohi K, Harris T, Lecky F, Moran C, Morrison JJ, Norrie J, Paterson A, Tai N, Welch N, Campbell MK, Group U-RS, Aylwin C, Bew D, Brooks A, Chinery J, Cowlam T, Frith D, George A, Hudson A, Johnstone P, Mahmood A, Novak A, O’Meara M, Reid S, Sattout A, Smith C, Stansfield T,
Thompson J, (2023) Emergency department resuscitative endovascular balloon occlusion of the aorta in trauma patients with exsanguinating hemorrhage: the UK-REBOA randomized clinical trial. JAMA
98. Cole E, Weaver A, Gall L, West A, Nevin D, Tallach R, O’Neill B, Lahiri S, Allard S, Tai N, Davenport R, Green L, Brohi K (2021) A decade of damage control resuscitation: new transfusion practice, new survivors, new directions. Ann Surg 273(6):1215–1220. https:// doi. org/ 10. 1097/ SLA. 00000 00000 003657
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 15.05.2024
[ACTIVE_FROM] => 15.05.2024
[SHOW_COUNTER] => 196
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2017-07-31 16:04:44
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829787
[VALUE] => массивное переливание крови, кровотечение, критическое состояние, кровотечение, коагулопатия
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => массивное переливание крови, кровотечение, критическое состояние, кровотечение, коагулопатия
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2017-08-02 11:16:15
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829789
[VALUE] => Современное ведение массивных кровотечений в реанимации
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Современное ведение массивных кровотечений в реанимации
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2017-08-02 11:18:27
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829788
[VALUE] => Современное ведение массивных кровотечений в реанимации
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Современное ведение массивных кровотечений в реанимации
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829817
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2017-09-15 12:05:50
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2017-09-19 10:40:01
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2017-08-22 15:43:39
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829794
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2017-08-22 16:30:23
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2017-08-23 10:51:22
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2017-08-23 11:05:12
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829791
[1] => 829792
[2] => 829793
)
[VALUE] => Array
(
[0] => statia
[1] => Krovotecheniya i koagulopatii
[2] => kriticheskiesostoyaniya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => Krovotecheniya i koagulopatii
[2] => kriticheskiesostoyaniya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2017-10-12 14:43:36
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2018-05-11 11:01:14
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829817
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829794
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829791
[1] => 829792
[2] => 829793
)
[VALUE] => Array
(
[0] => statia
[1] => Krovotecheniya i koagulopatii
[2] => kriticheskiesostoyaniya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => Krovotecheniya i koagulopatii
[2] => kriticheskiesostoyaniya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Кровотечения и коагулопатии
[2] => Критические состояния
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 26.08.2022 14:38:28
[~TIMESTAMP_X] => 26.08.2022 14:38:28
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Современное ведение массивных кровотечений в реанимации
[BROWSER_TITLE] => Современное ведение массивных кровотечений в реанимации
[KEYWORDS] => массивное переливание крови, кровотечение, критическое состояние, кровотечение, коагулопатия
[DESCRIPTION] => Современное ведение массивных кровотечений в реанимации
)
)



