Array
(
[NAME] => Гемоперфузия в отделении интенсивной терапии
[~NAME] => Гемоперфузия в отделении интенсивной терапии
[PREVIEW_PICTURE] => Array
(
[ID] => 5517
[TIMESTAMP_X] => 13.03.2024 11:16:13
[MODULE_ID] => iblock
[HEIGHT] => 3500
[WIDTH] => 5500
[FILE_SIZE] => 6172706
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/7c0/7d2deqfnkofg225kod1tie6r8edpjv1x
[FILE_NAME] => nanobots-are-repairing-damaged-blood-cells-nanotechnology-concept.jpg
[ORIGINAL_NAME] => nanobots-are-repairing-damaged-blood-cells-nanotechnology-concept.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => be0b9e4c725cecdbf7bc929c4924dc3d
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/7c0/7d2deqfnkofg225kod1tie6r8edpjv1x/nanobots-are-repairing-damaged-blood-cells-nanotechnology-concept.jpg
[UNSAFE_SRC] => /upload/iblock/7c0/7d2deqfnkofg225kod1tie6r8edpjv1x/nanobots-are-repairing-damaged-blood-cells-nanotechnology-concept.jpg
[SAFE_SRC] => /upload/iblock/7c0/7d2deqfnkofg225kod1tie6r8edpjv1x/nanobots-are-repairing-damaged-blood-cells-nanotechnology-concept.jpg
[ALT] => Гемоперфузия в отделении интенсивной терапии
[TITLE] => Гемоперфузия в отделении интенсивной терапии
)
[~PREVIEW_PICTURE] => 5517
[DETAIL_TEXT] => Zaccaria Ricci, Stefano Romagnoli, Thiago Reis, Rinaldo Bellomo and Claudio Ronфco
Hemoperfusion in the intensive care unit
Intensive Care Med (2022) 48:1397–1408
https://doi.org/10.1007/s00134-022-06810-1
Абстракт
Полиорганная недостаточность при сепсисе возникает из-за нарушения регуляции иммунитета. Многие из медиаторов этого процесса представляют собой гуморальные факторы (цитокины), которые теоретически могут быть удалены путем прямой адсорбции посредством процесса, называемого гемоперфузией. Гемоперфузия через устройства, которые связывают определенные молекулы, такие как эндотоксин, или теоретически обеспечивают неспецифическую адсорбцию провоспалительных медиаторов, предпринималась и изучалась в течение нескольких десятилетий с переменными результатами. Совсем недавно технологическая эволюция привела к более широкому применению адсорбции в связи с использованием более биосовместимых и, возможно, более эффективных биоматериалов. В результате появляются новые технологии и разрабатываются новые показания для их использования. В этом описательном обзоре будут представлены современные знания о технических концепциях, безопасности и клинических результатах гемоперфузии. Наконец, основное внимание будет уделено самой последней литературе, касающейся адсорбции, применяемой у пациентов в критическом состоянии, и ее показаниям, включая недавние рандомизированные контролируемые испытания и будущие области исследований.
Ключевые слова: сепсис, цитокин, очистка крови, адсорбция, гемоперфузия, COVID-19, липополисахарид.
Патофизиология сепсиса
Сепсис представляет собой сложный клинико-биологический синдром, определяемый как опасная для жизни органная дисфункция, вызванная нерегулируемым ответом хозяина на инфекцию [1]. Он начинается как инфекция, которая вызывает воспалительную реакцию у хозяина, запускаемую взаимодействием между несколькими растворимыми медиаторами [2].Воспалительный ответ на инфекцию со стороны врожденного иммунитета обычно является контролируемым, локализованным и защитным [3]. Взаимодействие между воспалительной реакцией и сопротивляемостью (ограничение воспаления адаптивным иммунитетом) является ключом к выживанию, но в некоторых не совсем понятных обстоятельствах этот сложный и хрупкий баланс теряется, и может развиться сепсис. В этом процессе нерегулируемого ответа могут быть повреждены как инфицированные, так и дистантные от очага инфекции органы, что приводит к опасному для жизни клиническому состоянию.Такой процесс имеет тенденцию вызывать избыточную выработку или подавление цитокинов и других медиаторов, которые влияют на функцию жизненно важных органов и запускают дальнейшие воспалительные и противовоспалительные реакции [4, 5]. Доминирующими клиническими фенотипами этих биологических явлений являются сепсис и септический шок, при которых пациенты могут умереть из-за трудноизлечимого воспаления или стойкого иммунного паралича.
Гипотеза очищения крови
Блокирование или ослабление воздействия растворимых медиаторов обеспечивает защиту в моделях острых молниеносных инфекций на животных [6]. Таким образом, манипулирование растворимыми компонентами иммунного ответа хозяина теоретически привлекательно. Этот подход является целью нескольких исследований, хотя и остается спорным [3]. Предыдущие попытки модулировать иммунный ответ путем нацеливания на отдельные цитокины не увенчались успехом [7]. Так, была предложена концепция очистки крови, основанная на неспецифическом манипулировании уровнями ряда медиаторов в плазме [8, 9]. Гемоперфузия теоретически может обеспечить неспецифическое лечение, как обсуждается ниже.
Обоснование гемоперфузии
Недостаточный клиренс растворимых провоспалительных медиаторов может быть одной из причин отсутствия значимых доказательств клинической эффективности адъювантной экстракорпоральной очистки крови при сепсисе [10]. Можно предположить, что прямой контакт крови со смолами с высокой адсорбционной способностью в экстракорпоральном контуре (гемоперфузия) должен логически увеличить клиренс по сравнению с непрямым удалением с помощью диализа или подходов, основанных на гемофильтрации. Гемоперфузия — это метод очистки крови, при котором удаление растворенных веществ достигается путем связывания молекул с адсорбирующими материалами [11], хотя доказательства, подтверждающие этот подход, пока неубедительны. Этот механизм лишь частично присутствует при непрерывной заместительной почечной терапии (ПЗПТ), но его клиническая значимость, вероятно, незначительна, за исключением, возможно, мембран с особым дизайном, таких как полиметилметакрилат или oXiris® (Baxter, Meyzieu, Франция) [12].
Клиренс конкретных веществ зависит не только от перфузии, но и от характеристик поверхности используемых материалов и их взаимодействия с конкретными веществами.Устройства, содержащие сорбенты, имеют большую площадь поверхности и оптимальную биосовместимость, а также обеспечивают высокоэффективное удаление растворенных веществ, особенно в диапазоне средней и высокой молекулярной массы [13]. Экстракорпоральную очистку крови можно проводить путем прямой гемоперфузии или плазмоперфузии после отделения плазмы. Возможность проведения такой гемоперфузии или плазменно-перфузионного лечения зависит от биосовместимости частиц сорбента и возможности привести сорбент в непосредственный контакт с клеточным компонентом крови, не вызывая повреждения клеток [14]
Технические аспекты адсорбции
Сорбенты могут состоять из природных (например, углей) или синтетических материалов (например, полимеров) [12] (Table 1). Сорбенты обычно готовят в виде шариков, гранул, хлопьев, волокон, сфер, цилиндрических гранул размером от 50 мкм до 1,2 см. Для них характерно высокое отношение площади поверхности к массе от 300 до 1200 м2/г, что способствует увеличению их адсорбционной способности [15]. Гранулы содержатся в пластиковом картридже, снабженном портами для притока и оттока плазмы/крови и специальными экранами для предотвращения распространения частиц в кровотоке. Как только растворитель поступает в сорбент, удаление растворенного вещества происходит в несколько фаз (Fig. 1): (а) конвективное движение от жидкости к внешней поверхности шарика, что требует дальнейшего диффузионного этапа через «пограничный слой». слой"; б) внутренний массоперенос растворенного вещества с внешней поверхности сорбента во внутреннюю пористую структуру по диффузионному механизму и в) окончательное связывание (адсорбция) растворенного вещества на пористой поверхности [15].
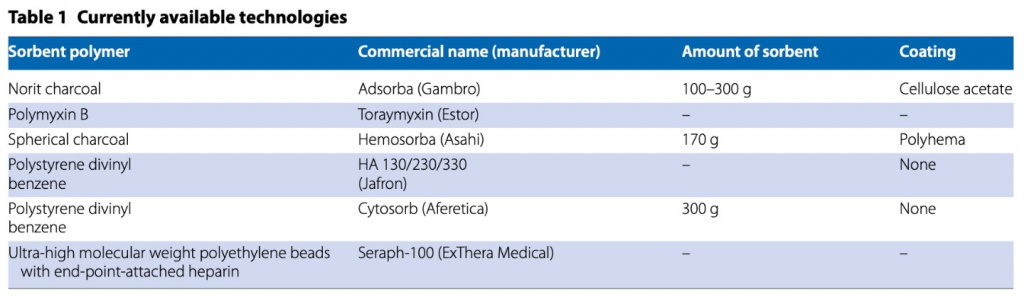
Окончательное связывание определяется плотностью и диаметром пор структуры сорбента (диаметр пор обычно находится в диапазоне 20–500 Å). Гидрофобное связывание является основным механизмом удаления растворенных веществ из экстракорпорального кровообращения [14]. Хотя задействованы и другие силы, такие как ван-дер-ваальсовы и ионные связи, гидрофобное сродство сорбента к целевым растворенным веществам представляет собой основной механизм для доступных в настоящее время картриджей с сорбентами [15]. После завершения связывания эта часть картриджа насыщается и больше не используется для очистки крови, поэтому сорбенты имеют ограниченный срок службы и должны быть заменены после полного насыщения. Анализ изотерм адсорбции описывает фазу насыщения как динамическое равновесие между адсорбцией и десорбцией (т. е. высвобождение адсорбированного соединения). Однако этот оборот представляет собой небольшой компонент динамического процесса, который происходит, когда задействованы силы Ван-дер-Ваальса и ионные связи. Поскольку эти силы не так сильны, как гидрофобные силы, связи могут быть обратимыми, и часть адсорбированного растворенного вещества может возвращаться в жидкую фазу, если равновесие для диффузии и химические градиенты благоприятствуют этому процессу. Однако это имеет ограниченное биологическое воздействие, и немедленно происходит насыщение. Динамический оборот (адсорбция/десорбция) в большинстве случаев составляет 5–7% от общего удаления объема [14, 15].
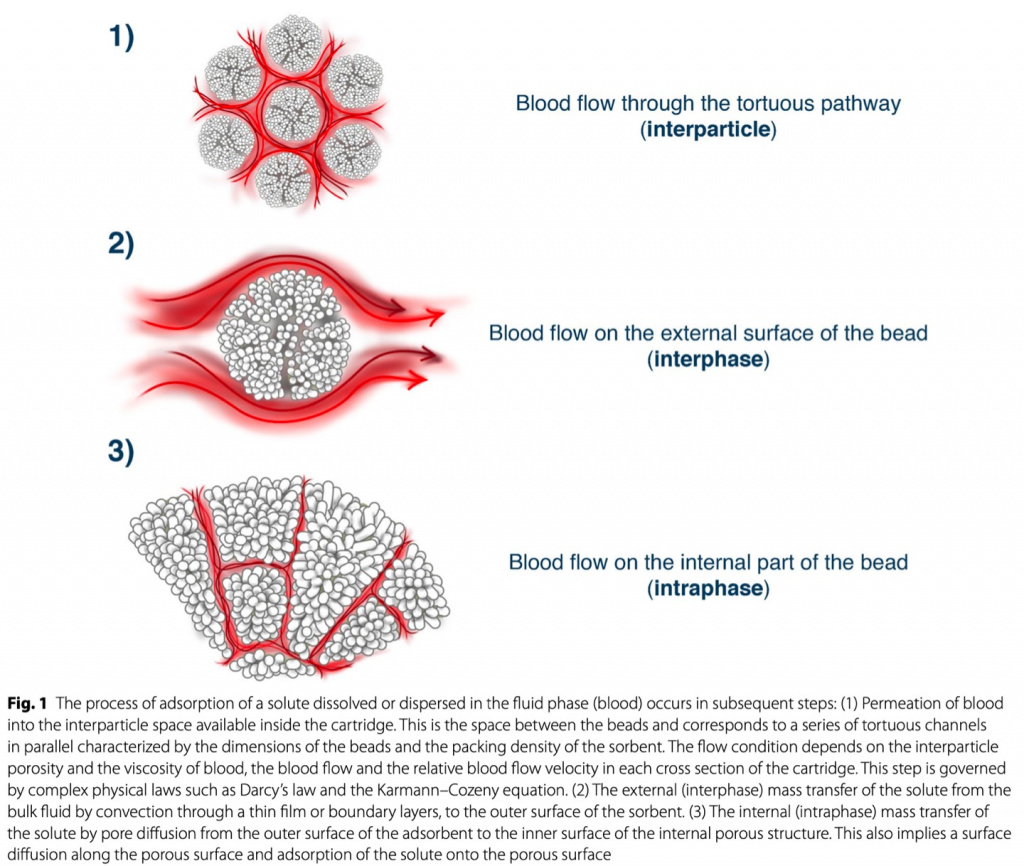
При разработке каждого картриджа с сорбентом необходимо учитывать несколько аспектов, таких как стоимость полимеров, высокая устойчивость к загрязнению, максимальная биосовместимость и отсутствие нежелательных побочных эффектов. Кроме того, сочетание пористости, полимеров и внутренних каналов внутри картриджа должно обеспечивать максимальный массоперенос вдоль слоя сорбента [15]. Другим важным аспектом, который следует учитывать, является скорость потока в картридже. В большинстве случаев предполагаемый кровоток колеблется в пределах от 100 до 200 мл/мин, но роль различных скоростей кровотока в воздействии на эффективность системы требует дальнейшего изучения. Наконец, селективность адсорбции целевых растворенных веществ является фундаментальным аспектом этой технологии. Все эти аспекты (т.е. тип полимера, расход, насыщение) можно варьировать и комбинировать в разных продуктах, существенно влияя на клинические эффекты экстракорпоральной очистки крови на основе адсорбции и показаний для их использования [16].
Доступные сорбенты
Древесный уголь и смолы
Первые применения сорбентов для гемоперфузии у больных были при лечении лекарственной интоксикации и отравления, так как в отдельных случаях адсорбция значительно эффективнее гемодиализа [17]. Как правило, это достигается с помощью угля или смол. Такие устройства обычно содержат от 100 до 300 г активированного угля или от 300 до 650 г смолы. Скорость кровотока для эффективного удаления лекарства составляет примерно 300 мл/мин, до 450 мл/мин, а прерывистая гемоперфузия обычно выполняется в течение 4 часов. После этого времени лечения дополнительный клиренс маловероятен из-за насыщения устройства и кинетики двойного пула в организме. Ретроспективные исследования показали, что гемоперфузия связана с увеличением выживаемости в случае приема внутрь параквата при раннем ее проведении [18], и что гемоперфузия иногда обеспечивает лучший клиренс, чем высокопоточный гемодиализ [19]. Гемоперфузия может быть показана и при других интоксикациях, включая интоксикацию грибами Amanita phalloides, передозировку барбитуратами, вальпроевой кислотой, теофиллином, алюминием и карбамазепином [20]. Тем не менее, гемодиализ может быть полезен при интоксикации теофиллином [21], вальпроевой кислотой [22], барбитуратами [23] и карбамазепином [24].
Гемоперфузия с полимиксином В
Картридж с адсорбентом, состоящий из полистироловых волокон, связанных с полимиксином B (PMX)® (Toray Medical Co.Ltd., Токио, Япония), продается в Японии и Европе для удаления эндотоксинов при сепсисе и септическом шоке [ 25]. Уровни эндотоксина снижаются in vitro в течение нескольких минут после начала гемоперфузии PMX (PMX-HP) [26]. Это лечение требует двухчасовых сеансов гемоперфузии и антикоагулянтной терапии гепарином, чтобы обеспечить полное лечение без образования тромбов в контуре со скоростью кровотока в диапазоне от 80 до 120 мл/мин. В первое рандомизированное контролируемое исследование (EUPHAS) PMX HP было включено 64 пациента с септическим шоком и интраабдоминальными грамотрицательными инфекциями, и было показано улучшение гемодинамики (среднее артериальное давление, доза катехоламинов), функции дыхания, шкалы SOFA и уровень летальности у пролеченных пациентов [27].
Второе исследование (ABDOMIX) включало 243 пациента с септическим шоком и перитонитом [28]: в ходе этого исследования пациенты были рандомизированы на основании наличия абдоминальной инфекции и независимо от наличия грамотрицательных бактерий. В этом исследовании сообщается о незначительной разнице в уровне смертности: 27 % в группе PMX HP и 19,5 % в традиционной группе. Однако это исследование было поставлено под сомнение из-за низкой смертности в контрольной группе и низкого процента пациентов, завершивших вмешательство в исследуемой группе.
Наконец, третье крупное рандомизированное двойное слепое контролируемое исследование (EUPHRATES) не выявило снижения смертности при использовании этой терапии [29]. Впервые в этом исследовании в качестве критерия для включения пациентов использовалась оценка уровня циркулирующего эндотоксина на основании теста по месту оказания медицинской помощи (анализ активности эндотоксина [EAA]). Этот интересный подход делает данное лечение потенциально открытым для мониторинга, поскольку лабораторная конечная точка может быть неоднократно измерена и оценена во время терапии. На самом деле измерение эндотоксина может быть более важным, чем тип бактерий при определении ответа на терапию. Например, в исследовании EUPHRATES у 20% пациентов была инфекция, вызванная грамположительными бактериями, и у них по-прежнему наблюдалась эндотоксемия, а у многих пациентов без бактериологического подтверждения был положительный EAA и некоторый клинический эффект от терапии [29].
Недавнее апостериорное исследование, опубликованное по результатам рандомизированного исследования EUPHRATES, показало снижение 28-дневной смертности на 10 % после поправки на показатели органной недостаточности и исходное среднее артериальное давление у пациентов со значениями ЕАА от 0,6 до 0,89 [30]. Было показано, что у пациентов со снижением EAA более 13% смертность была меньше. Тем не менее, не было различий в снижении уровня EAA между пациентами, перенесшими PMX-HP, и контрольной группой, что вызывает вопросы о клиническом влиянии этой стратегии и использовании EAA в качестве надежной конечной точки [30] (Table 2).
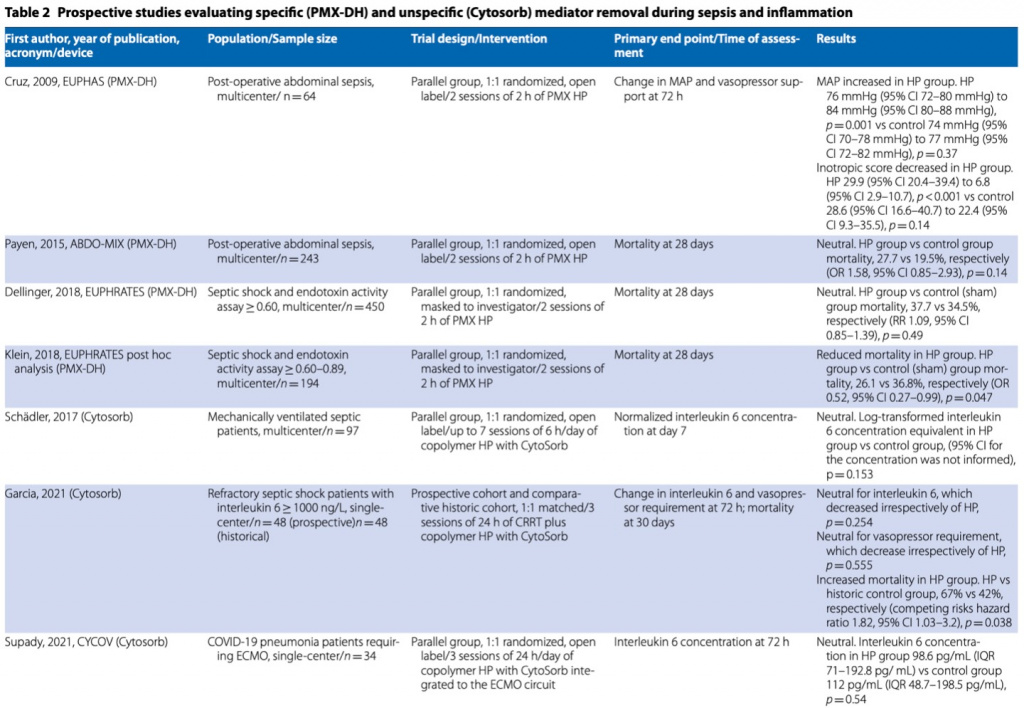
В ответ на вышеуказанные результаты в Северной Америке проводится еще одно рандомизированное контролируемое исследование (испытание TIGRIS, идентификатор ClinicalTrials.gov: NCT03901807). В исследовании запланирован размер выборки из 150 пациентов, включая пациентов с EAA в диапазоне от ≥ 0,60 до < 0,90. В свете вышеизложенного, до тех пор, пока не будут получены данные такого исследования, эффективность PMX-HP в отношении смертности все еще обсуждается.
Кроме того, недавнее наблюдение с использованием методологии масс-спектрометрии показало, что «липополисахаридная нагрузка», предположительно за счет кишечника , присутствует и у здоровых людей [31]. Тем не менее, пики эндотоксемии, по-видимому, возникают у пациентов с септическим шоком в критическом состоянии, возможно, из-за более высокой бактериальной нагрузки, изменения сосудисто-кишечного барьера или снижения клиренса липополисахаридов. [31]. Улучшенные возможности мониторинга сепсиса с помощью биомаркеров могут значительно оптимизировать применение технологий экстракорпоральной очистки крови Фактически, специфический и чувствительный биомаркер теоретически мог бы улучшить нашу способность применять эти методы лечения избирательно и своевременно, отслеживать их клиническую эффективность во времени и позволить своевременно прекратить использование.
Комбинированная плазмофильтрационная адсорбция
Хотя первоначальные обнадеживающие результаты были получены с помощью этой методики, комбинированная плазмофильтрационная адсорбция (CPFA) в настоящее время не рекомендуется у пациентов с септическим шоком или гипервоспалением после отрицательных результатов исследований COMPACT [32] и COMPACT-2 [33]. Такие исследования, по сути, не показали существенной пользы от CPFA и возможного потенциального вреда, особенно у пациентов без острого повреждения почек или потребности в ПЗПТ.
CytoSorb® гемоперфузия
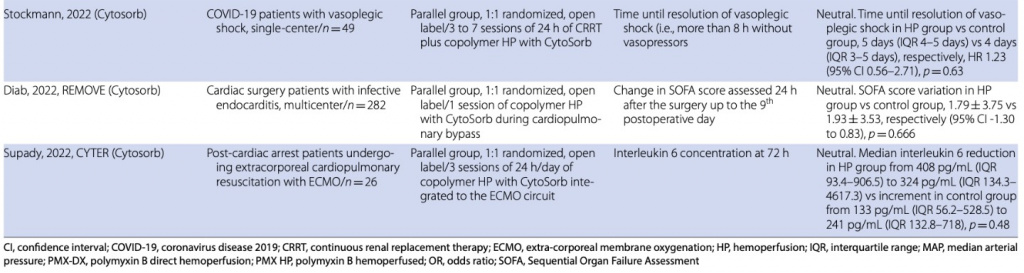
Устройство CytoSorb® (CytoSorb®, CytoSorbents Inc, Нью-Джерси, США) представляет собой картридж, предназначенный для прямой гемоперфузии, который неоднократно демонстрировал высокий профиль безопасности с точки зрения биосовместимости и простоты использования [34]. Он состоит из сополимеров полистирола, дивинилбензола и поливинилпирролидона и нацелен на молекулы в диапазоне 5–50 кДа, что включает молекулярную массу нескольких цитокинов [35]. Лечение с CytoSorb ®, по данным FDA, может быть продлено до 24 часов с учетом того, что распространение растворенных веществ незначительно даже при таком длительном времени лечения. Максимальная эффективность с точки зрения насыщения сорбента отмечена примерно через 12 часов [https:// www. fda. gov/media/ 136866/ downl oad]. Рекомендуемая скорость кровотока составляет 150–500 мл/мин, устройство можно использовать как самостоятельно, так и в комплексе с ПЗПТ. Картридж можно также использовать во время экстракорпоральной мембранной оксигенации (ЭКМО) или искусственного кровообращения. В этом случае CytoSorb ® следует размещать в шунте, который отходит от основного компонента потока контура, как это принято в современной практике с гемоконцентраторами, и рекомендуется мониторинг потока (≤ 700 мл/мин).
Сообщалось о снижении уровня цитокинов у пациентов с сепсисом [36], а интерлейкин-6 (IL-6) был идентифицирован как диагностический критерий и, часто, как потенциальная клиническая цель лечения CytoSorb® [37, 38]. Тем не менее, многие из этих исследований были неконтролируемыми, и окончательная демонстрация эффектов CytoSorb ® должна быть проверена в большом контролируемом исследовании адекватного масштаба, подтверждающем изменение целевого растворенного вещества у пациентов, получавших лечение, по сравнению с контрольной группой. Такие доказательства в настоящее время отсутствуют. Исследование склонности, проведенное Scharf et al. показали, что снижение уровня IL-6 у пациентов в критическом состоянии с гиперцитокинемией существенно не отличалось между пациентами, получавшими CytoSorb®, и пациентами, получавшими лечение без него [39]. Тем не менее, возможно, что эта гетерогенная популяция пациентов может нуждаться в дальнейшей стратификации с точки зрения конкретных показаний, риска смерти и клинических и лабораторных конечных точек [40, 41].
Интересно, что CytoSorb® можно использовать в качестве второго последовательного элемента в другом экстракорпоральном контуре, таком как ПЗПТ [42], искусственное кровообращение [43], ЭКМО [44]. Однако исследование профиля цитокинов до и после начала ЭКМО у пациентов с COVID-19 показало, что ЭКМО не предполагает значительного повышения уровня цитокинов и что, даже если у пациентов наблюдается снижение уровня ИЛ-6 , IL-10 и TNF-gamma, у пациентов без гемоперфузии CytoSorb® также наблюдается снижение концентрации цитокинов [45]. Это исследование ясно показало наше неадекватное понимание кинетики цитокинов в различных клинических состояниях и необходимость улучшения знаний для оптимизации модуляции уровней цитокинов. Фактически, лечение пациентов с COVID-19 с помощью экстракорпорального очищения крови и, в частности, с помощью гемоадсорбции CytoSorb® недавно исследовалось [46, 47], обсуждалось и подвергалось сомнению [48].
Даже если несколько серий случаев показали многообещающие результаты [35, 44], по крайней мере четыре рандомизированных исследования не показали каких-либо преимуществ с точки зрения смертности [37, 43, 46, 49], а два проспективных исследования (сопоставленное контролируемое и рандомизированное исследование) описали потенциальный вред [41, 47] (Table 2). Согласно приведенным выше исследованиям, CytoSorb®, по-видимому, не оказывает существенного влияния на потребность в вазопрессорах, измеренные уровни цитокинов, органную дисфункцию и смертность взрослых пациентов в критическом состоянии с признаками гипервоспаления после операций на сердце, инфекции, сепсиса или COVID-19. В ответ на вышеупомянутые результаты таких исследований недавняя редакционная статья открыто критиковала государственное финансирование лечения CytoSorb® в Германии и подчеркивала отсутствие убедительной литературы, подтверждающей его эффективность, и неоправданные затраты [50].
В некоторых сообщениях недавно описывалось применение гемоадсорбции в педиатрии.Как DH-PMX [51], так и CytoSorb® безопасно применялись при серии случаев септического шока [52], гемофагоцитарного лимфогистиоцитоза [53] и полиорганной недостаточности (MOF) [54], но педиатрические рандомизированные исследования в настоящее время не планируются.Более подробная информация об этой деликатной популяции должна быть предоставлена большими перспективными базами данных. Как у детей, так и у взрослых CytoSorb® использовался для значительного и эффективного снижения концентрации билирубина и миоглобина в сыворотке крови, зарекомендовав себя как потенциальное средство для пациентов с различными формами печеночной недостаточности с гипербилирубинемией [55, 56] и рабдомиолизом [57, 58]. ].
Серия Jafron HA для гемо/плазмоперфузии
Недавно была разработана группа новых картриджей для гемоперфузии: нейтро-макропористые смолы из сополимера стирола и дивинилбензола, называемые HA130, HA230 и HA330 (Jafron Biomedical, Гуандун, Китай) [59]. Распределение пор смол по размерам составляет 500D–40 кДа в HA130, 200D–10 кD в HA230 и 500D–60 кD в HA330/HA380. НА130 в основном применяют при хронических состояниях в сочетании с гемодиализом в течение одного или нескольких сеансов в неделю. В таких условиях дополнительная роль адсорбции, по-видимому, приводит к значительному улучшению таких симптомов, как зуд, мышечная слабость, аппетит и анемия [59]. HA230 в основном показан при острых интоксикациях, особенно при передозировке лекарств, пестицидов и отравлении промышленными токсинами [59]. Картриджи HA330 и HA380 в основном показаны при острых воспалительных состояниях, таких как сепсис, травма, ожоги, панкреатит и различные синдромы высвобождения цитокинов (CAR-T-клеточная терапия, тяжелый COVID-19, гемофагоцитарный синдром) [59]. В небольшом рандомизированном исследовании у субъектов с сепсисом и острым повреждением легких, которые лечились в течение 3 дней 2-часовыми сеансами HA330, по сравнению с обычной терапией уровни некоторых цитокинов снизились. Кроме того, исследование показало значительное улучшение оксигенации пациентов и снижение 28-дневнуой смертности (67% у пациентов, получавших лечение, против 28% у пациентов из контрольной группы) [60]. Аналогичные результаты, но без влияния на смертность, были получены в другом небольшом рандомизированном исследовании, в котором лечение сочеталось с высокообъемной гемофильтрацией [61]. Скорость кровотока с картриджем HA330 обычно такая же, как при обычной ПЗПТ, и поэтому может варьировать от 150 до 250 мл/мин. Следует отметить, что в картридже содержится специальная адсорбирующая смола для билирубина и желчных кислот, которая используется в методе, называемом DPMAS (система молекулярной адсорбции с двойной плазменной фильтрацией). Этот сорбент применялся отдельно или в сочетании с картриджем НА330-II для удаления цитокинов и билирубина/желчных кислот при острой печеночной недостаточности и фульминантном гепатите у взрослых и детей [62, 63].
Микроаффинный связыватель патогенов Seraph‑100
Особый интерес представляет картридж Seraph-100® (ExThera, Martinez, CA), предназначенный для удаления патогенов из кровотока [64]. Он содержит гранулы полиэтилена сверхвысокой молекулярной массы с присоединенным к концам гепарином, который считается способным иммобилизовать патогены аналогично действию гепарансульфата на поверхности клеток [65]. Его можно использовать как самостоятельно, так и последовательно с контуром НЗПТ. Скорость кровотока составляет от 150 до 350 мл/мин, а время лечения может быть увеличено до 24 часов по усмотрению лечащего врача [https://www.fda.gov/media/137105/download]. Если будущие контролируемые исследования подтвердят его эффективность у пациентов с сепсисом и пациентов с осложненной инфекцией COVID-19, это может гарантировать мультимодальный подход к лечению нерегулируемого воспаления, не только путем удаления цитокинов из кровотока, но и путем воздействия на бактериемию и виремию, включая повреждения, связанные с молекулярными паттернами, связанные с гиперпродукцией цитокинов.
Открытые вопросы: методология исследований, сроки, доза, продолжительность, антикоагулянтная терапия и стоимость.
Необходимы дополнительные исследования, чтобы установить реальную и эффективную роль методов экстракорпоральной очистки крови в условиях интенсивной терапии. Доказательства клинической эффективности адсорбционной терапии требуют хорошо структурированной программы исследований. Мы также должны учитывать, что первоначальные рандомизированные контролируемые испытания должны оценивать различные первичные конечные точки, а не смертность, чтобы также оценить другие важные эффекты экстракорпоральной очистки крови, такие как дни без вентиляции, дни без вазопрессорной терапии, дни без инвазивной поддержки органов (Fig. 2). Необходимо лучшее понять, на какие молекулы следует воздействовать в конкретном клиническом состоянии. Некоторые авторы предполагают, что вариабельность иммунных фенотипов и клинических ответов хозяина должна быть полностью оценена и срочно рассмотрена в качестве предмета будущих исследований в этой области [48]. Еще одним важным "черным ящиком" является удаление молекул, связанных с белком, по сравнению со свободными молекулами. Пока эти вопросы не будут четко решены, положительные результаты рандомизированных исследований гемоперфузии кажутся маловероятными.
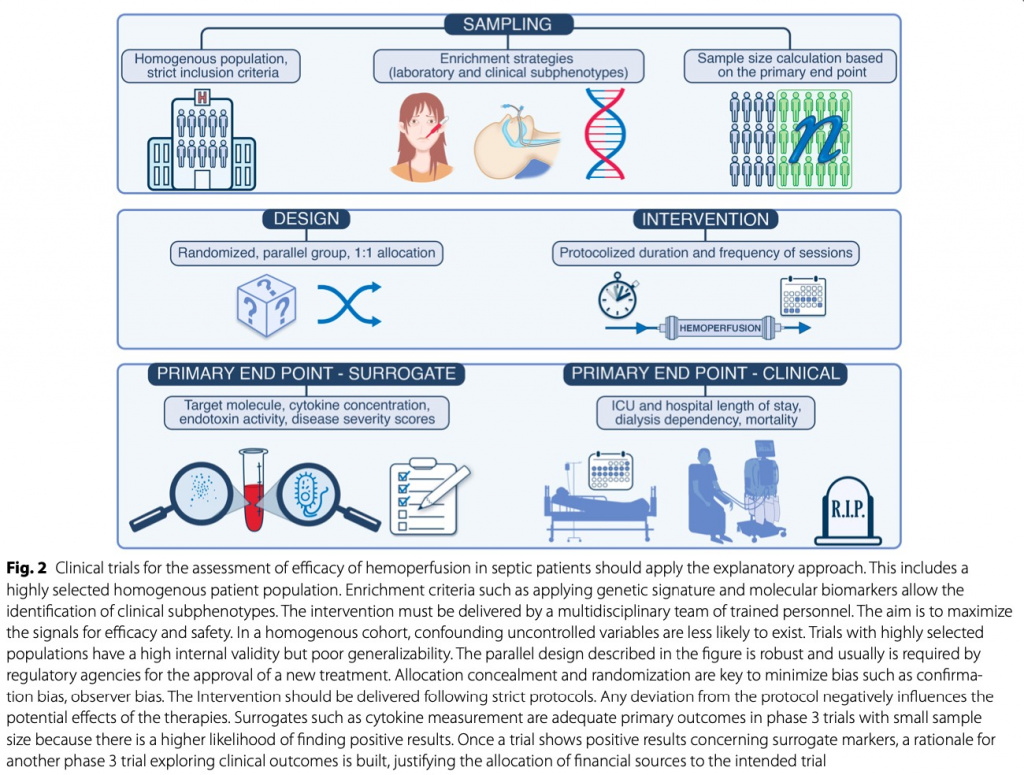
В недавнем обновленном систематическом обзоре экстракорпоральной адсорбции цитокинов [66] сделан явный вывод о том, что эффективность и безопасность этой стратегии в сочетании со стандартной терапией у пациентов с сепсисом/септическим шоком, перенесших операцию на сердце, не установлены. Доказательства, оценивающие фармакокинетику антибиотиков у пациентов, подвергающихся гемоперфузии, ограничены, и существует лишь несколько данных, полученных в результате небольших и разнородных исследований [67–72]. Из-за критической важности оптимального антимикробного лечения при сепсисе важно понять и компенсировать их экстракорпоральную потерю во время гемоперфузии. Неселективный клиренс растворенных веществ и потенциальная польза гемоперфузии для «восстановления иммунитета» могут быть нейтрализованы побочными эффектами, когда неизбирательное удаление «хороших» растворенных веществ может играть центральную роль в определении результатов лечения пациентов. Такой неселективный клиренс препарата у больных с сепсисом является малоизученной областью.
В 2002 г. проводилось исследование биосовместимого картриджа с сорбентом (Betasorb®, Renal Tech) [67], специально изготовленного для высокоэффективного удаления веществ средней молекулярной массы, таких как ß2-микроглобулин и цитокины [68]. В исследованиях invitro обнаружено эффективное удаление гликопептидов и других неантимикробных агентов (дигоксин, теофиллин, фенобарбитал, фенитоин, карбамазепин, вальпроевая кислота, такролимус и циклоспорин А).
Напротив, аминогликозиды менее подвержены влиянию картриджа. В недавнем исследовании in vitro оценивалась адсорбционная способность CytoSorb® в отношении многих распространенных противомикробных препаратов: ванкомицина, гентамицина, меропенема, флуклоксациллина, пиперациллина, ципрофлоксацина, рифампицина, флуконазола и вориконазола [67]. Исследование показало, что все исследованные препараты адсорбировались на поверхности картриджа CytoSorb® нелинейным образом, что приводило к насыщению поверхности адсорбента и постепенному снижению клиренса с течением времени. Следовательно, дополнительные экстрадозы противомикробных препаратов необходимо вводить в течение первых нескольких часов после начала гемоперфузии для поддержания клинически адекватной равновесной концентрации в сыворотке крови. Недавнее проспективное обсервационное исследование, предназначенное для количественной оценки адсорбции ванкомицина (в виде непрерывной инфузии с предшествующей нагрузочной дозой в течение 2 часов) продемонстрировало значительную адсорбцию препарата с линейным снижением во время лечения CytoSorb® [69].
Всего в анализ было включено 160 образцов сыворотки с ванкомицином от 7 пациентов с септическим шоком, и 15% образцов были собраны во время лечения CytoSorb®. Исследование показало значительную адсорбцию ванкомицина устройством CytoSorb® (макс. 572 мг) и необходимость введения дополнительных доз для достижения терапевтического действия. В интервенционном экспериментальном исследовании изучалась гемоадсорбция с помощью CytoSorb® 17 препаратов: клиндамицина, флуконазола, линезолида, меропенема, пиперациллина, анидулафунгина, ганцикловира, кларитромицина, посаконазола, тейкопланина, тобрамицина, цефтриаксона, ципрофлоксацина, метронидазола, липосомального амфотерицина В, флуклоксациллин и цефепим [70]. Единственным препаратом, на который не влияла гемадсорбция, оказался ганцикловир. Остальные препараты имели эффективный клиренс, который со временем снижался, считался умеренным для флуконазола (282 %) и линезолида (115 %), легким для липосомального амфотерицина В (75 %), позаконазола (32 %) и тейкопланина ( 31%) и незначительным для всех других препаратов. Наконец, in vitro было продемонстрировано, что CytoSorb® может активно элиминировать многие другие препараты, включая ремдесивир, дабигатран, эдоксабан, ривароксабан и тикагрелор [71, 72].
Другой открытый вопрос связан с "дозированием" гемоперфузии. Возможно, что некоторым пациентам потребуются «более высокие дозы» и повторные циклы адсорбции [73] с частой и последовательной сменой картриджей.
Опять же, в настоящее время мы не знаем, насколько ранним и продолжительным должен быть сеанс лечения (т. е. время начала и время окончания), а также каково влияние режима антикоагулянтной терапии (например, обеспечение эффективной перфузии, продление срока использования картриджа или уменьшение воспалительного триггера через коагуляционный каскад).
Наконец, высокая стоимость этих устройств должна быть окончательно оправдана с точки зрения клинической эффективности, особенно во времена экономических ограничений. Принимая во внимание текущие ограниченные знания и имеющиеся данные о методах и устройствах гемоперфузии, мы должны настоятельно рекомендовать сфокусированную программу исследований. Некоторым пациентам может помочь экстракорпоральная очистка крови на основе адсорбции, но нам необходимо идентифицировать таких людей или группу пациентов с использованием адекватных биомаркеров или методов идентификации фенотипа.
Вывод
Эволюция экстракорпоральной очистки крови происходила постоянно в течение последних двух десятилетий. Гемоперфузия и дизайн биосовместимых картриджей с возможностью настройки целевых растворов и реализации безопасных и селективных методов лечения в настоящее время стимулируют разработку устройств для очистки крови последнего поколения. Наше понимание патофизиологии интенсивной терапии и гипервоспалительных заболеваний также изменилось, и теперь ясно, что каждый пациент требует индивидуального подхода. Представляется вероятным, что исследования гемоперфузии перейдут от крупномасштабных рандомизированных испытаний к адаптированным исследованиям, которые включают только пациентов, соответствующих определенным и объективным критериям (например, биомаркерам, клиническим фенотипам), которые предлагают вероятные показания для лечения и/или конечные точки для оценки биологической эффективности очистки крови.
References
1. Singer M, Deutschman CS, Seymour CW et al (2016) The Third Interna- tional ConsensusDefinitions for Sepsis and Septic Shock (Sepsis-3). JAMA 315:801–810
2. Denning NL, Aziz M, Gurien SD, Wang P (2019) Damps and nets in sepsis. Front Immunol10:1–15. https://doi.org/10.3389/fimmu.2019.02536
3. Van Der Poll T, Van De Veerdonk FL, Scicluna BP, Netea MG (2017) Theimmunopathology of sepsis and potential therapeutic targets. Nat Rev Immunol 17:407–420
4. Delano MJ, Ward PA (2016) The immune system’s role in sepsis progres- sion, resolution,and long-term outcome. Immunol Rev 274:330–353. https://doi.org/10.1111/imr.12499
5. Hotchkiss R, Monneret G, Payen D (2013) Sepsis-induced immunosup- pression: fromcellular dysfunctions to immunotherapy. Nat Rev Immunol 13:862–874.https://doi.org/10.1038/nri3552.Sepsis-induced
6. Wiersinga WJ, Leopold SJ, Cranendonk DR, van der Poll T (2014) Host innate immuneresponses to sepsis. Virulence 5:36–44. https://doi.org/10. 4161/viru.25436
7. Deans KJ, Haley M, Natanson C et al (2005) Novel therapies for sepsis: a review. JTrauma Inj Infect Crit Care 58:867–874. https://doi.org/10.1097/ 01.TA.0000158244.69179.94
8. Barzilay E, Kessler D, Berlot G, Gullo A, Geber D, Ben Zeev I (1989) Use of extracorporealsupportive techniques as additional treatment for septic- induced multiple organ failure patients. CritCare Med 17:634–637
9. Rimmelé T, Kellum JA (2011) Clinical review: blood purification for sepsis. Crit Care15:1–10. https://doi.org/10.1186/cc9411
10. Ankawi G, Neri M, Zhang J et al (2018) Extracorporeal techniques for the treatment ofcritically ill patients with sepsis beyond conventional blood purification therapy: the promises and the pitfalls. Crit Care 22:1–16. https://doi.org/10.1186/s13054-018-2181-z
11. Clark WR, Gao D, Lorenzin A, Ronco C (2018) Membranes and Sorbents. Contrib Nephrol194:70–79. https://doi.org/10.1159/000485603
12. Feri M (2019) “In vitro comparison of the adsorption of inflamma- tory mediators byblood purification devices”: a misleading article for clinical practice? Intensive Care Med Exp. https://doi.org/10.1186/ s40635-018-0214-1
13. Clark WR, Ferrari F, La Manna G, Ronco C (2017) Extracorporeal sorbent technologies: basic concepts and clinical application. Contrib Nephrol 190:43–57.https://doi.org/10.1159/000468911
14. Ronco C, Bordoni V, Levin NW (2002) Adsorbents: from basic structure to clinicalapplication. Contrib Nephrol 137:158–164. https://doi.org/10. 1159/000060242
15. Ferrari F, Clark W (2018) Ronco C (2018) Sorbents: from basic structure to clinical application. In: Ronco C, Bellomo R, Kellum JA, Ricci Z (eds) Crit. Care Nephrol., 3rd edn. Elsevier
16. Ankawi G, Fan W, Pomarè Montin D et al (2019) A new series of sorbent devices formultiple clinical purposes: current evidence and future direc- tions. Blood Purif 47:94–100.https://doi.org/10.1159/000493523
17. Winchester J, Harbord N, Charen E, Ghannoum M (2015) Use of dialysis andhemoperfusion in treatment of poisioning. In: Daugirdas JT, Blake PG, Ing TS (eds) Handb. Dial., 5thedn. Lippincott
18. Rao R, Bhat R, Pathadka S et al (2017) Golden hours in severe paraquat poisoning-the roleof early haemoperfusion therapy. J Clin Diagnostic Res 11:OC06–OC08.https://doi.org/10.7860/JCDR/2017/24764.9166
19. Li C, Hu D, Xue W et al (2018) Treatment outcome of combined continu- ous venovenous hemofiltration and hemoperfusion in acute paraquat poisoning: a prospective controlled trial. Crit CareMed 46:100–107. https://doi.org/10.1097/CCM.0000000000002826
20. Winchester JF (2002) Dialysis and hemoperfusion in poisoning. Adv Ren Replace Ther9:26–30. https://doi.org/10.1053/jarr.2002.30470
21. Ghannoum M, Wiegand TJ, Liu KD et al (2015) Extracorporeal treatment for theophylline poisoning: systematic review and recommendations from the EXTRIP workgroup. Clin Toxicol53:215–229. https://doi.org/10. 3109/15563650.2015.1014907
22. Ghannoum M, Laliberté M, Nolin TD et al (2015) Extracorporeal treatment for valproic acid poisoning: systematic review and recommendations from the EXTRIP workgroup. Clin Toxicol53:454–465. https://doi.org/10. 3109/15563650.2015.1035441
23. Mactier R, Laliberté M, Mardini J et al (2014) Extracorporeal treatment for barbituratepoisoning: recommendations from the EXTRIP workgroup. Am J Kidney Dis 64:347–358.https://doi.org/10.1053/j.ajkd.2014.04.031
24. Ghannoum M, Yates C, Galvao TF et al (2014) Extracorporeal treatment for carbamazepine poisoning: systematic review and recommendations from the EXTRIP workgroup. ClinToxicol 52:993–1004. https://doi.org/10. 3109/15563650.2014.973572
25. Cruz DN, Perazella MA, Bellomo R et al (2007) Effectiveness of polymyxin B-immobilized fiber column in sepsis: a systematic review. Crit Care 11:1–12.https://doi.org/10.1186/cc5780
26. Shimizu T, Miyake T, Tani M (2017) History and current status of polymyxin B-immobilized fiber column for treatment of severe sepsis and septic shock. Ann Gastroenterol Surg1:105–113. https://doi.org/10.1002/ags3. 12015
27. Cruz D, Antonelli M, Fumagalli R et al (2009) Early use of polymyxin B hemoperfusion in abdominal septic shock: the EUPHAS randomized controlled trial. JAMA 301:2445–2452
28. Payen DM, Guilhot J, Launey Y, ABDOMIX Group et al (2015) Early use of polymyxin B hemoperfusion in patients with septic shock due to peritonitis: a multicenter randomized controltrial. Intensive Care Med 41:975–984
29. Dellinger RP, Bagshaw SM, Antonelli M et al (2018) Effect of targeted polymyxin B hemoperfusion on 28-day mortality in patients with septic shock and elevated endotoxin level: theEUPHRATES randomized clinical
30. Klein DJ, Foster D, Walker PM et al (2018) Polymyxin B hemoperfusion in endotoxemicseptic shock patients without extreme endotoxemia: a post hoc analysis of the EUPHRATES trial.Intensive Care Med 44:2205–2212. https://doi.org/10.1007/s00134-018-5463-7
31. Dargent A, Pais De Barros JP et al (2019) Improved quantification of plasma lipopolysaccharide (LPS) burden in sepsis using 3-hydroxy myristate (3HM): a cohort study. IntensiveCare Med 45:1678–1680
32. Livigni S, Bertolini G, Rossi C et al (2014) Efficacy of coupled plasma filtrationadsorption (CPFA) in patients with septic shock: a multicenter randomised controlled clinical trial.BMJ Open 4:e003536
33. Garbero E, Livigni S, Ferrari F et al (2021) High dose coupled plasma filtra- tion andadsorption in septic shock patients. results of the COMPACT-2: a multicentre, adaptive, randomisedclinical trial. Intensive Care Med 47:1303–1311
34. Ronco C, Bellomo R (2022) Hemoperfusion: technical aspects and state of the art. CritCare 26:135
35. Köhler T, Schwier E, Praxenthaler J et al (2021) Therapeutic modulation of the hostdefense by hemoadsorption with cytosorb®—basics, indica- tions and perspectives—a scoping review.Int J Mol Sci. https://doi.org/ 10.3390/ijms222312786
36. Harm S, Schildböck C, Hartmann J (2020) Cytokine removal in extracor- poreal bloodpurification: an in vitro study. Blood Purif 49:33–43. https:// doi.org/10.1159/000502680
37. Schädler D, Pausch C, Heise D et al (2017) The effect of a novel extracor- poreal cytokine hemoadsorption device on IL-6 elimination in septic patients: a randomized controlled trial. PLoS ONE 12:1–19. https://doi. org/10.1371/journal.pone.0187015
38. Mat-Nor MB, Ralib MDA, Abdulah NZ, Pickering JW (2016) The diagnostic ability ofprocalcitonin and interleukin-6 to differentiate infectious from noninfectious systemic inflammatoryresponse syndrome and to predict mortality. J Crit Care 33:245–251.https://doi.org/10.1016/j.jcrc.2016.01. 002
39. Scharf C, Schroeder I, Paal M et al (2021) Can the cytokine adsorber Cyto- Sorb® help tomitigate cytokine storm and reduce mortality in critically ill patients? A propensity score matchinganalysis. Ann Intensive Care. https://doi.org/10.1186/s13613-021-00905-6
40. Kogelmann K, Hübner T, Schwameis F et al (2021) Article first evaluation of a new dynamic scoring system intended to support prescription of adjuvant cytosorb hemoadsorption therapyin patients with septic shock. J Clin Med. https://doi.org/10.3390/jcm10132939
41. Wendel Garcia PD, Hilty MP, Held U et al (2021) Cytokine adsorption in severe, refractoryseptic shock. Intensive Care Med 47:1334–1336. https:// doi.org/10.1007/s00134-021-06512-0
42. Hakemi MS, Nassiri AA, Nobakht A et al (2022) Benefit of hemoadsorption therapy in patients suffering sepsis-associated acute kidney injury: a case series. Blood Purif.https://doi.org/10.1159/000521228
43. Diab M, Lehmann T, Bothe W et al (2022) cytokine hemoadsorption dur- ing cardiacsurgery versus standard surgical care for infective endocarditis (REMOVE): results from a multicenterrandomized controlled trial. Circula- tion 145:959–968
44. Träger K, Skrabal C, Fischer G et al (2020) Hemoadsorption treatment with CytoSorb ® inpatients with extracorporeal life support therapy: a case series. Int J Artif Organsartif Organs 43:422–429
45. Lebreton G, Dorgham K, Quentric P, Combes A, Gorochov G, Schmidt M (2021)Longitudinal cytokine profiling in patients with severe COVID-19 on extracorporeal membrane oxygenation and hemoadsorption. Am J Respir Crit Care Med 203:1433–1435
46. Stockmann H, Thelen P, Stroben F et al (2022) CytoSorb rescue for COVID-19 patientswith vasoplegic shock and multiple organ failure: a prospective, open-label, randomized controlled pilot study. Crit Care Med 50:964–976
47. Supady A, Weber E, Rieder M et al (2021) Cytokine adsorption in patients with severe COVID-19 pneumonia requiring extracorporeal membrane oxygenation (CYCOV): a single centre,open-label, randomised, controlled trial. Lancet Respir Med 9:755–762
48. Ostermann M, Koyner J (2022) Extracorporeal Blood Purification Is Appropriate inCritically Ill Patients with COVID-19 and Multiorgan Failure: COMMENTARY. Kidney 360(3):419–422. https://doi.org/10.34067/kid. 0007382020
49. Supady A, Zahn T, Kuhl M et al (2022) Cytokine adsorption in patients with post-cardiacarrest syndrome after extracorporeal cardiopulmo- nary resuscitation (CYTER)—a single-centre,open-label, randomised, controlled trial. Resuscitation 173:169–178. https://doi.org/10.1016/j.resuscitation.2022.02.001
50. Kielstein JT, Zarbock A (2022) Is this the beginning of the end of cytokine adsorption?Crit Care Med 50:1026–1029
51. Yaroustovsky M, Abramyan M, Rogalskaya E, Komardina E (2021) Selective polymyxin hemoperfusion in complex therapy of sepsis in children after cardiac surgery. Blood Purif 50:222–229.https://doi.org/10.1159/00051 0126
52. Bottari G, Lorenzetti G, Severini F et al (2021) Role of hemoperfusion with CytoSorb associated with continuous kidney replacement therapy on renal outcome in critically iii children with septic shock. Front Pediatr 9:1–9. https://doi.org/10.3389/fped.2021.718049
53. Bottari G, Murciano M, Merli P et al (2021) Hemoperfusion with CytoSorb to manage multiorgan dysfunction in the spectrum of hemophagocytic lymphohistiocytosis syndrome in critically ill children. Blood Purif. https:// doi.org/10.1159/000517471
54. Steurer LM, Schlager G, Sadeghi K et al (2021) Hemadsorption as rescue therapy forpatients with multisystem organ failure in pediatric intensive care—report of two cases reports andreview of the literature. Artif Organs 45:1582–1593. https://doi.org/10.1111/aor.14047
55. Scharf C, Liebchen U, Paal M et al (2021) Successful elimination of biliru- bin in criticallyill patients with acute liver dysfunction using a cytokine adsorber and albumin dialysis: a pilot study.Sci Rep 11:1–7. https://doi. org/10.1038/s41598-021-89712-4
56. Ocskay K, Tomescu D, Faltlhauser A et al (2021) Hemoadsorption in ‘liver indication’—analysis of 109 patients’ data from the cytosorb international registry. J Clin Med 10:1–10.https://doi.org/10.3390/jcm10215182
57. Scharf C, Liebchen U, Paal M et al (2021) Blood purification with a cytokine adsorber forthe elimination of myoglobin in critically ill patients with severe rhabdomyolysis. Crit Care 25:1–9.https://doi.org/10.1186/ s13054-021-03468-x
58. Moresco E, Rugg C, Ströhle M, Thoma M (2022) Rapid reduction of substantiallyincreased myoglobin and creatine kinase levels using a hemoadsorption device (CytoSorb ® )—a case report. Clin Case Rep 10:1–4. https://doi.org/10.1002/ccr3.5272
59. Pomarè Montin D, Ankawi G, Lorenzin A et al (2018) Biocompatibility and cytotoxicevaluation of new sorbent cartridges for blood hemoperfusion. Blood Purif 46:187–195.https://doi.org/10.1159/000489921
60. Huang Z, Wand S, Yang Z, Liu J (2013) Effect on extrapulmonary sepsis- induced acute lung injury by hemoperfusion with neutral microporous resin column. Ther Apher Dial 17:454–461
61. Chu L, Li G, Yu Y et al (2020) Clinical effects of hemoperfusion combined with pulse high-volume hemofiltration on septic shock. Medicine 99:e19058
62. Lei Y, Liang Y, Zhang X et al (2021) Alternating therapeutic plasma exchange (TPE) with double plasma molecular adsorption system (DPMAS) for the treatment of fulminant hepatic failure(FHF). Clin Case Rep 9(12):e05220
63. Wu M, Zhang H, Huang Y, Wu W, Huang J, Yan D (2021) Efficiency of dou- ble plasmamolecular absorption system on the acute severe cholestatic hepatitis. Blood Purif 50:876–882
64. Schmidt JJ, Borchina DN, van’t Klooster M et al (2022) Interim analysis of the COSA (COVID-19 patients treated with the Seraph® 100 Microbind® Affinity filter) registry. Nephrol DialTransplant 37:673–680
65. Seffer MT, Cottam D, Forni LG, Kielstein JT (2021) Heparin 2.0: a new approach to theinfection crisis. Blood Purif 50:28–34. https://doi.org/10. 1159/000508647
66. Goetz G, Hawlik K, Wild C (2021) Extracorporeal cytokine adsorption therapy as apreventive measure in cardiac surgery and as a therapeutic add-on treatment in sepsis: an updatedsystematic review of comparative efficacy and safety. Crit Care Med 49:1347–1357
67. Reiter K, Bordoni Dall’Olio VG, Ricatti MG, Soli M, Ruperti S et al (2002) In vitroremoval of therapeutic drugs with a novel adsorbent system. Blood Purif 20:380–388
68. Konig C, Rohr AC, Frey OR, Brinkmann A, Roberts JA, Wichmann D et al (2019) Invitro removal of anti-infective agents by a novel cytokine adsor- bent system. Int J Artif Org 42:57–64
69. Scharf C et al (2022) Does the cytokine adsorber CytoSorb® reduce vancomycin exposurein critically ill patients with sepsis or septic shock? a prospective observational study. Ann IntensiveCare 12:44
70. Schneider AG et al (2021) Pharmacokinetics of anti-infective agents dur- ing CytoSorbhemoadsorption. Sci Rep 11(1):10493. https://doi.org/10. 1038/s41598-021-89965-z
71. Biever P et al (2021) Hemoadsorption eliminates remdesivir from the circulation:Implications for the treatment of COVID-19. Pharmacol Res Perspect 9(2):e00743.https://doi.org/10.1002/prp2.743
72. Angheloiu AA, Angheloiu GO (2019) Removal of dabigatran using sorb- enthemadsorption. Int J Cardiol 293:73–75
73. Schultz P, Schwier E, Eickmeyer C et al (2021) High-dose CytoSorb hemoadsorption is associated with improved survival in patients with septic shock: a retrospective cohort study. J Crit Care 64:184–192. https:// doi.org/10.1016/j.jcrc.2021.04.011
[~DETAIL_TEXT] => Zaccaria Ricci, Stefano Romagnoli, Thiago Reis, Rinaldo Bellomo and Claudio Ronфco
Hemoperfusion in the intensive care unit
Intensive Care Med (2022) 48:1397–1408
https://doi.org/10.1007/s00134-022-06810-1
Абстракт
Полиорганная недостаточность при сепсисе возникает из-за нарушения регуляции иммунитета. Многие из медиаторов этого процесса представляют собой гуморальные факторы (цитокины), которые теоретически могут быть удалены путем прямой адсорбции посредством процесса, называемого гемоперфузией. Гемоперфузия через устройства, которые связывают определенные молекулы, такие как эндотоксин, или теоретически обеспечивают неспецифическую адсорбцию провоспалительных медиаторов, предпринималась и изучалась в течение нескольких десятилетий с переменными результатами. Совсем недавно технологическая эволюция привела к более широкому применению адсорбции в связи с использованием более биосовместимых и, возможно, более эффективных биоматериалов. В результате появляются новые технологии и разрабатываются новые показания для их использования. В этом описательном обзоре будут представлены современные знания о технических концепциях, безопасности и клинических результатах гемоперфузии. Наконец, основное внимание будет уделено самой последней литературе, касающейся адсорбции, применяемой у пациентов в критическом состоянии, и ее показаниям, включая недавние рандомизированные контролируемые испытания и будущие области исследований.
Ключевые слова: сепсис, цитокин, очистка крови, адсорбция, гемоперфузия, COVID-19, липополисахарид.
Патофизиология сепсиса
Сепсис представляет собой сложный клинико-биологический синдром, определяемый как опасная для жизни органная дисфункция, вызванная нерегулируемым ответом хозяина на инфекцию [1]. Он начинается как инфекция, которая вызывает воспалительную реакцию у хозяина, запускаемую взаимодействием между несколькими растворимыми медиаторами [2].Воспалительный ответ на инфекцию со стороны врожденного иммунитета обычно является контролируемым, локализованным и защитным [3]. Взаимодействие между воспалительной реакцией и сопротивляемостью (ограничение воспаления адаптивным иммунитетом) является ключом к выживанию, но в некоторых не совсем понятных обстоятельствах этот сложный и хрупкий баланс теряется, и может развиться сепсис. В этом процессе нерегулируемого ответа могут быть повреждены как инфицированные, так и дистантные от очага инфекции органы, что приводит к опасному для жизни клиническому состоянию.Такой процесс имеет тенденцию вызывать избыточную выработку или подавление цитокинов и других медиаторов, которые влияют на функцию жизненно важных органов и запускают дальнейшие воспалительные и противовоспалительные реакции [4, 5]. Доминирующими клиническими фенотипами этих биологических явлений являются сепсис и септический шок, при которых пациенты могут умереть из-за трудноизлечимого воспаления или стойкого иммунного паралича.
Гипотеза очищения крови
Блокирование или ослабление воздействия растворимых медиаторов обеспечивает защиту в моделях острых молниеносных инфекций на животных [6]. Таким образом, манипулирование растворимыми компонентами иммунного ответа хозяина теоретически привлекательно. Этот подход является целью нескольких исследований, хотя и остается спорным [3]. Предыдущие попытки модулировать иммунный ответ путем нацеливания на отдельные цитокины не увенчались успехом [7]. Так, была предложена концепция очистки крови, основанная на неспецифическом манипулировании уровнями ряда медиаторов в плазме [8, 9]. Гемоперфузия теоретически может обеспечить неспецифическое лечение, как обсуждается ниже.
Обоснование гемоперфузии
Недостаточный клиренс растворимых провоспалительных медиаторов может быть одной из причин отсутствия значимых доказательств клинической эффективности адъювантной экстракорпоральной очистки крови при сепсисе [10]. Можно предположить, что прямой контакт крови со смолами с высокой адсорбционной способностью в экстракорпоральном контуре (гемоперфузия) должен логически увеличить клиренс по сравнению с непрямым удалением с помощью диализа или подходов, основанных на гемофильтрации. Гемоперфузия — это метод очистки крови, при котором удаление растворенных веществ достигается путем связывания молекул с адсорбирующими материалами [11], хотя доказательства, подтверждающие этот подход, пока неубедительны. Этот механизм лишь частично присутствует при непрерывной заместительной почечной терапии (ПЗПТ), но его клиническая значимость, вероятно, незначительна, за исключением, возможно, мембран с особым дизайном, таких как полиметилметакрилат или oXiris® (Baxter, Meyzieu, Франция) [12].
Клиренс конкретных веществ зависит не только от перфузии, но и от характеристик поверхности используемых материалов и их взаимодействия с конкретными веществами.Устройства, содержащие сорбенты, имеют большую площадь поверхности и оптимальную биосовместимость, а также обеспечивают высокоэффективное удаление растворенных веществ, особенно в диапазоне средней и высокой молекулярной массы [13]. Экстракорпоральную очистку крови можно проводить путем прямой гемоперфузии или плазмоперфузии после отделения плазмы. Возможность проведения такой гемоперфузии или плазменно-перфузионного лечения зависит от биосовместимости частиц сорбента и возможности привести сорбент в непосредственный контакт с клеточным компонентом крови, не вызывая повреждения клеток [14]
Технические аспекты адсорбции
Сорбенты могут состоять из природных (например, углей) или синтетических материалов (например, полимеров) [12] (Table 1). Сорбенты обычно готовят в виде шариков, гранул, хлопьев, волокон, сфер, цилиндрических гранул размером от 50 мкм до 1,2 см. Для них характерно высокое отношение площади поверхности к массе от 300 до 1200 м2/г, что способствует увеличению их адсорбционной способности [15]. Гранулы содержатся в пластиковом картридже, снабженном портами для притока и оттока плазмы/крови и специальными экранами для предотвращения распространения частиц в кровотоке. Как только растворитель поступает в сорбент, удаление растворенного вещества происходит в несколько фаз (Fig. 1): (а) конвективное движение от жидкости к внешней поверхности шарика, что требует дальнейшего диффузионного этапа через «пограничный слой». слой"; б) внутренний массоперенос растворенного вещества с внешней поверхности сорбента во внутреннюю пористую структуру по диффузионному механизму и в) окончательное связывание (адсорбция) растворенного вещества на пористой поверхности [15].

Окончательное связывание определяется плотностью и диаметром пор структуры сорбента (диаметр пор обычно находится в диапазоне 20–500 Å). Гидрофобное связывание является основным механизмом удаления растворенных веществ из экстракорпорального кровообращения [14]. Хотя задействованы и другие силы, такие как ван-дер-ваальсовы и ионные связи, гидрофобное сродство сорбента к целевым растворенным веществам представляет собой основной механизм для доступных в настоящее время картриджей с сорбентами [15]. После завершения связывания эта часть картриджа насыщается и больше не используется для очистки крови, поэтому сорбенты имеют ограниченный срок службы и должны быть заменены после полного насыщения. Анализ изотерм адсорбции описывает фазу насыщения как динамическое равновесие между адсорбцией и десорбцией (т. е. высвобождение адсорбированного соединения). Однако этот оборот представляет собой небольшой компонент динамического процесса, который происходит, когда задействованы силы Ван-дер-Ваальса и ионные связи. Поскольку эти силы не так сильны, как гидрофобные силы, связи могут быть обратимыми, и часть адсорбированного растворенного вещества может возвращаться в жидкую фазу, если равновесие для диффузии и химические градиенты благоприятствуют этому процессу. Однако это имеет ограниченное биологическое воздействие, и немедленно происходит насыщение. Динамический оборот (адсорбция/десорбция) в большинстве случаев составляет 5–7% от общего удаления объема [14, 15].

При разработке каждого картриджа с сорбентом необходимо учитывать несколько аспектов, таких как стоимость полимеров, высокая устойчивость к загрязнению, максимальная биосовместимость и отсутствие нежелательных побочных эффектов. Кроме того, сочетание пористости, полимеров и внутренних каналов внутри картриджа должно обеспечивать максимальный массоперенос вдоль слоя сорбента [15]. Другим важным аспектом, который следует учитывать, является скорость потока в картридже. В большинстве случаев предполагаемый кровоток колеблется в пределах от 100 до 200 мл/мин, но роль различных скоростей кровотока в воздействии на эффективность системы требует дальнейшего изучения. Наконец, селективность адсорбции целевых растворенных веществ является фундаментальным аспектом этой технологии. Все эти аспекты (т.е. тип полимера, расход, насыщение) можно варьировать и комбинировать в разных продуктах, существенно влияя на клинические эффекты экстракорпоральной очистки крови на основе адсорбции и показаний для их использования [16].
Доступные сорбенты
Древесный уголь и смолы
Первые применения сорбентов для гемоперфузии у больных были при лечении лекарственной интоксикации и отравления, так как в отдельных случаях адсорбция значительно эффективнее гемодиализа [17]. Как правило, это достигается с помощью угля или смол. Такие устройства обычно содержат от 100 до 300 г активированного угля или от 300 до 650 г смолы. Скорость кровотока для эффективного удаления лекарства составляет примерно 300 мл/мин, до 450 мл/мин, а прерывистая гемоперфузия обычно выполняется в течение 4 часов. После этого времени лечения дополнительный клиренс маловероятен из-за насыщения устройства и кинетики двойного пула в организме. Ретроспективные исследования показали, что гемоперфузия связана с увеличением выживаемости в случае приема внутрь параквата при раннем ее проведении [18], и что гемоперфузия иногда обеспечивает лучший клиренс, чем высокопоточный гемодиализ [19]. Гемоперфузия может быть показана и при других интоксикациях, включая интоксикацию грибами Amanita phalloides, передозировку барбитуратами, вальпроевой кислотой, теофиллином, алюминием и карбамазепином [20]. Тем не менее, гемодиализ может быть полезен при интоксикации теофиллином [21], вальпроевой кислотой [22], барбитуратами [23] и карбамазепином [24].
Гемоперфузия с полимиксином В
Картридж с адсорбентом, состоящий из полистироловых волокон, связанных с полимиксином B (PMX)® (Toray Medical Co.Ltd., Токио, Япония), продается в Японии и Европе для удаления эндотоксинов при сепсисе и септическом шоке [ 25]. Уровни эндотоксина снижаются in vitro в течение нескольких минут после начала гемоперфузии PMX (PMX-HP) [26]. Это лечение требует двухчасовых сеансов гемоперфузии и антикоагулянтной терапии гепарином, чтобы обеспечить полное лечение без образования тромбов в контуре со скоростью кровотока в диапазоне от 80 до 120 мл/мин. В первое рандомизированное контролируемое исследование (EUPHAS) PMX HP было включено 64 пациента с септическим шоком и интраабдоминальными грамотрицательными инфекциями, и было показано улучшение гемодинамики (среднее артериальное давление, доза катехоламинов), функции дыхания, шкалы SOFA и уровень летальности у пролеченных пациентов [27].
Второе исследование (ABDOMIX) включало 243 пациента с септическим шоком и перитонитом [28]: в ходе этого исследования пациенты были рандомизированы на основании наличия абдоминальной инфекции и независимо от наличия грамотрицательных бактерий. В этом исследовании сообщается о незначительной разнице в уровне смертности: 27 % в группе PMX HP и 19,5 % в традиционной группе. Однако это исследование было поставлено под сомнение из-за низкой смертности в контрольной группе и низкого процента пациентов, завершивших вмешательство в исследуемой группе.
Наконец, третье крупное рандомизированное двойное слепое контролируемое исследование (EUPHRATES) не выявило снижения смертности при использовании этой терапии [29]. Впервые в этом исследовании в качестве критерия для включения пациентов использовалась оценка уровня циркулирующего эндотоксина на основании теста по месту оказания медицинской помощи (анализ активности эндотоксина [EAA]). Этот интересный подход делает данное лечение потенциально открытым для мониторинга, поскольку лабораторная конечная точка может быть неоднократно измерена и оценена во время терапии. На самом деле измерение эндотоксина может быть более важным, чем тип бактерий при определении ответа на терапию. Например, в исследовании EUPHRATES у 20% пациентов была инфекция, вызванная грамположительными бактериями, и у них по-прежнему наблюдалась эндотоксемия, а у многих пациентов без бактериологического подтверждения был положительный EAA и некоторый клинический эффект от терапии [29].
Недавнее апостериорное исследование, опубликованное по результатам рандомизированного исследования EUPHRATES, показало снижение 28-дневной смертности на 10 % после поправки на показатели органной недостаточности и исходное среднее артериальное давление у пациентов со значениями ЕАА от 0,6 до 0,89 [30]. Было показано, что у пациентов со снижением EAA более 13% смертность была меньше. Тем не менее, не было различий в снижении уровня EAA между пациентами, перенесшими PMX-HP, и контрольной группой, что вызывает вопросы о клиническом влиянии этой стратегии и использовании EAA в качестве надежной конечной точки [30] (Table 2).


В ответ на вышеуказанные результаты в Северной Америке проводится еще одно рандомизированное контролируемое исследование (испытание TIGRIS, идентификатор ClinicalTrials.gov: NCT03901807). В исследовании запланирован размер выборки из 150 пациентов, включая пациентов с EAA в диапазоне от ≥ 0,60 до < 0,90. В свете вышеизложенного, до тех пор, пока не будут получены данные такого исследования, эффективность PMX-HP в отношении смертности все еще обсуждается.
Кроме того, недавнее наблюдение с использованием методологии масс-спектрометрии показало, что «липополисахаридная нагрузка», предположительно за счет кишечника , присутствует и у здоровых людей [31]. Тем не менее, пики эндотоксемии, по-видимому, возникают у пациентов с септическим шоком в критическом состоянии, возможно, из-за более высокой бактериальной нагрузки, изменения сосудисто-кишечного барьера или снижения клиренса липополисахаридов. [31]. Улучшенные возможности мониторинга сепсиса с помощью биомаркеров могут значительно оптимизировать применение технологий экстракорпоральной очистки крови Фактически, специфический и чувствительный биомаркер теоретически мог бы улучшить нашу способность применять эти методы лечения избирательно и своевременно, отслеживать их клиническую эффективность во времени и позволить своевременно прекратить использование.
Комбинированная плазмофильтрационная адсорбция
Хотя первоначальные обнадеживающие результаты были получены с помощью этой методики, комбинированная плазмофильтрационная адсорбция (CPFA) в настоящее время не рекомендуется у пациентов с септическим шоком или гипервоспалением после отрицательных результатов исследований COMPACT [32] и COMPACT-2 [33]. Такие исследования, по сути, не показали существенной пользы от CPFA и возможного потенциального вреда, особенно у пациентов без острого повреждения почек или потребности в ПЗПТ.
CytoSorb® гемоперфузия
Устройство CytoSorb® (CytoSorb®, CytoSorbents Inc, Нью-Джерси, США) представляет собой картридж, предназначенный для прямой гемоперфузии, который неоднократно демонстрировал высокий профиль безопасности с точки зрения биосовместимости и простоты использования [34]. Он состоит из сополимеров полистирола, дивинилбензола и поливинилпирролидона и нацелен на молекулы в диапазоне 5–50 кДа, что включает молекулярную массу нескольких цитокинов [35]. Лечение с CytoSorb ®, по данным FDA, может быть продлено до 24 часов с учетом того, что распространение растворенных веществ незначительно даже при таком длительном времени лечения. Максимальная эффективность с точки зрения насыщения сорбента отмечена примерно через 12 часов [https:// www. fda. gov/media/ 136866/ downl oad]. Рекомендуемая скорость кровотока составляет 150–500 мл/мин, устройство можно использовать как самостоятельно, так и в комплексе с ПЗПТ. Картридж можно также использовать во время экстракорпоральной мембранной оксигенации (ЭКМО) или искусственного кровообращения. В этом случае CytoSorb ® следует размещать в шунте, который отходит от основного компонента потока контура, как это принято в современной практике с гемоконцентраторами, и рекомендуется мониторинг потока (≤ 700 мл/мин).
Сообщалось о снижении уровня цитокинов у пациентов с сепсисом [36], а интерлейкин-6 (IL-6) был идентифицирован как диагностический критерий и, часто, как потенциальная клиническая цель лечения CytoSorb® [37, 38]. Тем не менее, многие из этих исследований были неконтролируемыми, и окончательная демонстрация эффектов CytoSorb ® должна быть проверена в большом контролируемом исследовании адекватного масштаба, подтверждающем изменение целевого растворенного вещества у пациентов, получавших лечение, по сравнению с контрольной группой. Такие доказательства в настоящее время отсутствуют. Исследование склонности, проведенное Scharf et al. показали, что снижение уровня IL-6 у пациентов в критическом состоянии с гиперцитокинемией существенно не отличалось между пациентами, получавшими CytoSorb®, и пациентами, получавшими лечение без него [39]. Тем не менее, возможно, что эта гетерогенная популяция пациентов может нуждаться в дальнейшей стратификации с точки зрения конкретных показаний, риска смерти и клинических и лабораторных конечных точек [40, 41].
Интересно, что CytoSorb® можно использовать в качестве второго последовательного элемента в другом экстракорпоральном контуре, таком как ПЗПТ [42], искусственное кровообращение [43], ЭКМО [44]. Однако исследование профиля цитокинов до и после начала ЭКМО у пациентов с COVID-19 показало, что ЭКМО не предполагает значительного повышения уровня цитокинов и что, даже если у пациентов наблюдается снижение уровня ИЛ-6 , IL-10 и TNF-gamma, у пациентов без гемоперфузии CytoSorb® также наблюдается снижение концентрации цитокинов [45]. Это исследование ясно показало наше неадекватное понимание кинетики цитокинов в различных клинических состояниях и необходимость улучшения знаний для оптимизации модуляции уровней цитокинов. Фактически, лечение пациентов с COVID-19 с помощью экстракорпорального очищения крови и, в частности, с помощью гемоадсорбции CytoSorb® недавно исследовалось [46, 47], обсуждалось и подвергалось сомнению [48].
Даже если несколько серий случаев показали многообещающие результаты [35, 44], по крайней мере четыре рандомизированных исследования не показали каких-либо преимуществ с точки зрения смертности [37, 43, 46, 49], а два проспективных исследования (сопоставленное контролируемое и рандомизированное исследование) описали потенциальный вред [41, 47] (Table 2). Согласно приведенным выше исследованиям, CytoSorb®, по-видимому, не оказывает существенного влияния на потребность в вазопрессорах, измеренные уровни цитокинов, органную дисфункцию и смертность взрослых пациентов в критическом состоянии с признаками гипервоспаления после операций на сердце, инфекции, сепсиса или COVID-19. В ответ на вышеупомянутые результаты таких исследований недавняя редакционная статья открыто критиковала государственное финансирование лечения CytoSorb® в Германии и подчеркивала отсутствие убедительной литературы, подтверждающей его эффективность, и неоправданные затраты [50].
В некоторых сообщениях недавно описывалось применение гемоадсорбции в педиатрии.Как DH-PMX [51], так и CytoSorb® безопасно применялись при серии случаев септического шока [52], гемофагоцитарного лимфогистиоцитоза [53] и полиорганной недостаточности (MOF) [54], но педиатрические рандомизированные исследования в настоящее время не планируются.Более подробная информация об этой деликатной популяции должна быть предоставлена большими перспективными базами данных. Как у детей, так и у взрослых CytoSorb® использовался для значительного и эффективного снижения концентрации билирубина и миоглобина в сыворотке крови, зарекомендовав себя как потенциальное средство для пациентов с различными формами печеночной недостаточности с гипербилирубинемией [55, 56] и рабдомиолизом [57, 58]. ].
Серия Jafron HA для гемо/плазмоперфузии
Недавно была разработана группа новых картриджей для гемоперфузии: нейтро-макропористые смолы из сополимера стирола и дивинилбензола, называемые HA130, HA230 и HA330 (Jafron Biomedical, Гуандун, Китай) [59]. Распределение пор смол по размерам составляет 500D–40 кДа в HA130, 200D–10 кD в HA230 и 500D–60 кD в HA330/HA380. НА130 в основном применяют при хронических состояниях в сочетании с гемодиализом в течение одного или нескольких сеансов в неделю. В таких условиях дополнительная роль адсорбции, по-видимому, приводит к значительному улучшению таких симптомов, как зуд, мышечная слабость, аппетит и анемия [59]. HA230 в основном показан при острых интоксикациях, особенно при передозировке лекарств, пестицидов и отравлении промышленными токсинами [59]. Картриджи HA330 и HA380 в основном показаны при острых воспалительных состояниях, таких как сепсис, травма, ожоги, панкреатит и различные синдромы высвобождения цитокинов (CAR-T-клеточная терапия, тяжелый COVID-19, гемофагоцитарный синдром) [59]. В небольшом рандомизированном исследовании у субъектов с сепсисом и острым повреждением легких, которые лечились в течение 3 дней 2-часовыми сеансами HA330, по сравнению с обычной терапией уровни некоторых цитокинов снизились. Кроме того, исследование показало значительное улучшение оксигенации пациентов и снижение 28-дневнуой смертности (67% у пациентов, получавших лечение, против 28% у пациентов из контрольной группы) [60]. Аналогичные результаты, но без влияния на смертность, были получены в другом небольшом рандомизированном исследовании, в котором лечение сочеталось с высокообъемной гемофильтрацией [61]. Скорость кровотока с картриджем HA330 обычно такая же, как при обычной ПЗПТ, и поэтому может варьировать от 150 до 250 мл/мин. Следует отметить, что в картридже содержится специальная адсорбирующая смола для билирубина и желчных кислот, которая используется в методе, называемом DPMAS (система молекулярной адсорбции с двойной плазменной фильтрацией). Этот сорбент применялся отдельно или в сочетании с картриджем НА330-II для удаления цитокинов и билирубина/желчных кислот при острой печеночной недостаточности и фульминантном гепатите у взрослых и детей [62, 63].
Микроаффинный связыватель патогенов Seraph‑100
Особый интерес представляет картридж Seraph-100® (ExThera, Martinez, CA), предназначенный для удаления патогенов из кровотока [64]. Он содержит гранулы полиэтилена сверхвысокой молекулярной массы с присоединенным к концам гепарином, который считается способным иммобилизовать патогены аналогично действию гепарансульфата на поверхности клеток [65]. Его можно использовать как самостоятельно, так и последовательно с контуром НЗПТ. Скорость кровотока составляет от 150 до 350 мл/мин, а время лечения может быть увеличено до 24 часов по усмотрению лечащего врача [https://www.fda.gov/media/137105/download]. Если будущие контролируемые исследования подтвердят его эффективность у пациентов с сепсисом и пациентов с осложненной инфекцией COVID-19, это может гарантировать мультимодальный подход к лечению нерегулируемого воспаления, не только путем удаления цитокинов из кровотока, но и путем воздействия на бактериемию и виремию, включая повреждения, связанные с молекулярными паттернами, связанные с гиперпродукцией цитокинов.
Открытые вопросы: методология исследований, сроки, доза, продолжительность, антикоагулянтная терапия и стоимость.
Необходимы дополнительные исследования, чтобы установить реальную и эффективную роль методов экстракорпоральной очистки крови в условиях интенсивной терапии. Доказательства клинической эффективности адсорбционной терапии требуют хорошо структурированной программы исследований. Мы также должны учитывать, что первоначальные рандомизированные контролируемые испытания должны оценивать различные первичные конечные точки, а не смертность, чтобы также оценить другие важные эффекты экстракорпоральной очистки крови, такие как дни без вентиляции, дни без вазопрессорной терапии, дни без инвазивной поддержки органов (Fig. 2). Необходимо лучшее понять, на какие молекулы следует воздействовать в конкретном клиническом состоянии. Некоторые авторы предполагают, что вариабельность иммунных фенотипов и клинических ответов хозяина должна быть полностью оценена и срочно рассмотрена в качестве предмета будущих исследований в этой области [48]. Еще одним важным "черным ящиком" является удаление молекул, связанных с белком, по сравнению со свободными молекулами. Пока эти вопросы не будут четко решены, положительные результаты рандомизированных исследований гемоперфузии кажутся маловероятными.

В недавнем обновленном систематическом обзоре экстракорпоральной адсорбции цитокинов [66] сделан явный вывод о том, что эффективность и безопасность этой стратегии в сочетании со стандартной терапией у пациентов с сепсисом/септическим шоком, перенесших операцию на сердце, не установлены. Доказательства, оценивающие фармакокинетику антибиотиков у пациентов, подвергающихся гемоперфузии, ограничены, и существует лишь несколько данных, полученных в результате небольших и разнородных исследований [67–72]. Из-за критической важности оптимального антимикробного лечения при сепсисе важно понять и компенсировать их экстракорпоральную потерю во время гемоперфузии. Неселективный клиренс растворенных веществ и потенциальная польза гемоперфузии для «восстановления иммунитета» могут быть нейтрализованы побочными эффектами, когда неизбирательное удаление «хороших» растворенных веществ может играть центральную роль в определении результатов лечения пациентов. Такой неселективный клиренс препарата у больных с сепсисом является малоизученной областью.
В 2002 г. проводилось исследование биосовместимого картриджа с сорбентом (Betasorb®, Renal Tech) [67], специально изготовленного для высокоэффективного удаления веществ средней молекулярной массы, таких как ß2-микроглобулин и цитокины [68]. В исследованиях invitro обнаружено эффективное удаление гликопептидов и других неантимикробных агентов (дигоксин, теофиллин, фенобарбитал, фенитоин, карбамазепин, вальпроевая кислота, такролимус и циклоспорин А).
Напротив, аминогликозиды менее подвержены влиянию картриджа. В недавнем исследовании in vitro оценивалась адсорбционная способность CytoSorb® в отношении многих распространенных противомикробных препаратов: ванкомицина, гентамицина, меропенема, флуклоксациллина, пиперациллина, ципрофлоксацина, рифампицина, флуконазола и вориконазола [67]. Исследование показало, что все исследованные препараты адсорбировались на поверхности картриджа CytoSorb® нелинейным образом, что приводило к насыщению поверхности адсорбента и постепенному снижению клиренса с течением времени. Следовательно, дополнительные экстрадозы противомикробных препаратов необходимо вводить в течение первых нескольких часов после начала гемоперфузии для поддержания клинически адекватной равновесной концентрации в сыворотке крови. Недавнее проспективное обсервационное исследование, предназначенное для количественной оценки адсорбции ванкомицина (в виде непрерывной инфузии с предшествующей нагрузочной дозой в течение 2 часов) продемонстрировало значительную адсорбцию препарата с линейным снижением во время лечения CytoSorb® [69].
Всего в анализ было включено 160 образцов сыворотки с ванкомицином от 7 пациентов с септическим шоком, и 15% образцов были собраны во время лечения CytoSorb®. Исследование показало значительную адсорбцию ванкомицина устройством CytoSorb® (макс. 572 мг) и необходимость введения дополнительных доз для достижения терапевтического действия. В интервенционном экспериментальном исследовании изучалась гемоадсорбция с помощью CytoSorb® 17 препаратов: клиндамицина, флуконазола, линезолида, меропенема, пиперациллина, анидулафунгина, ганцикловира, кларитромицина, посаконазола, тейкопланина, тобрамицина, цефтриаксона, ципрофлоксацина, метронидазола, липосомального амфотерицина В, флуклоксациллин и цефепим [70]. Единственным препаратом, на который не влияла гемадсорбция, оказался ганцикловир. Остальные препараты имели эффективный клиренс, который со временем снижался, считался умеренным для флуконазола (282 %) и линезолида (115 %), легким для липосомального амфотерицина В (75 %), позаконазола (32 %) и тейкопланина ( 31%) и незначительным для всех других препаратов. Наконец, in vitro было продемонстрировано, что CytoSorb® может активно элиминировать многие другие препараты, включая ремдесивир, дабигатран, эдоксабан, ривароксабан и тикагрелор [71, 72].
Другой открытый вопрос связан с "дозированием" гемоперфузии. Возможно, что некоторым пациентам потребуются «более высокие дозы» и повторные циклы адсорбции [73] с частой и последовательной сменой картриджей.
Опять же, в настоящее время мы не знаем, насколько ранним и продолжительным должен быть сеанс лечения (т. е. время начала и время окончания), а также каково влияние режима антикоагулянтной терапии (например, обеспечение эффективной перфузии, продление срока использования картриджа или уменьшение воспалительного триггера через коагуляционный каскад).
Наконец, высокая стоимость этих устройств должна быть окончательно оправдана с точки зрения клинической эффективности, особенно во времена экономических ограничений. Принимая во внимание текущие ограниченные знания и имеющиеся данные о методах и устройствах гемоперфузии, мы должны настоятельно рекомендовать сфокусированную программу исследований. Некоторым пациентам может помочь экстракорпоральная очистка крови на основе адсорбции, но нам необходимо идентифицировать таких людей или группу пациентов с использованием адекватных биомаркеров или методов идентификации фенотипа.
Вывод
Эволюция экстракорпоральной очистки крови происходила постоянно в течение последних двух десятилетий. Гемоперфузия и дизайн биосовместимых картриджей с возможностью настройки целевых растворов и реализации безопасных и селективных методов лечения в настоящее время стимулируют разработку устройств для очистки крови последнего поколения. Наше понимание патофизиологии интенсивной терапии и гипервоспалительных заболеваний также изменилось, и теперь ясно, что каждый пациент требует индивидуального подхода. Представляется вероятным, что исследования гемоперфузии перейдут от крупномасштабных рандомизированных испытаний к адаптированным исследованиям, которые включают только пациентов, соответствующих определенным и объективным критериям (например, биомаркерам, клиническим фенотипам), которые предлагают вероятные показания для лечения и/или конечные точки для оценки биологической эффективности очистки крови.
References
1. Singer M, Deutschman CS, Seymour CW et al (2016) The Third Interna- tional ConsensusDefinitions for Sepsis and Septic Shock (Sepsis-3). JAMA 315:801–810
2. Denning NL, Aziz M, Gurien SD, Wang P (2019) Damps and nets in sepsis. Front Immunol10:1–15. https://doi.org/10.3389/fimmu.2019.02536
3. Van Der Poll T, Van De Veerdonk FL, Scicluna BP, Netea MG (2017) Theimmunopathology of sepsis and potential therapeutic targets. Nat Rev Immunol 17:407–420
4. Delano MJ, Ward PA (2016) The immune system’s role in sepsis progres- sion, resolution,and long-term outcome. Immunol Rev 274:330–353. https://doi.org/10.1111/imr.12499
5. Hotchkiss R, Monneret G, Payen D (2013) Sepsis-induced immunosup- pression: fromcellular dysfunctions to immunotherapy. Nat Rev Immunol 13:862–874.https://doi.org/10.1038/nri3552.Sepsis-induced
6. Wiersinga WJ, Leopold SJ, Cranendonk DR, van der Poll T (2014) Host innate immuneresponses to sepsis. Virulence 5:36–44. https://doi.org/10. 4161/viru.25436
7. Deans KJ, Haley M, Natanson C et al (2005) Novel therapies for sepsis: a review. JTrauma Inj Infect Crit Care 58:867–874. https://doi.org/10.1097/ 01.TA.0000158244.69179.94
8. Barzilay E, Kessler D, Berlot G, Gullo A, Geber D, Ben Zeev I (1989) Use of extracorporealsupportive techniques as additional treatment for septic- induced multiple organ failure patients. CritCare Med 17:634–637
9. Rimmelé T, Kellum JA (2011) Clinical review: blood purification for sepsis. Crit Care15:1–10. https://doi.org/10.1186/cc9411
10. Ankawi G, Neri M, Zhang J et al (2018) Extracorporeal techniques for the treatment ofcritically ill patients with sepsis beyond conventional blood purification therapy: the promises and the pitfalls. Crit Care 22:1–16. https://doi.org/10.1186/s13054-018-2181-z
11. Clark WR, Gao D, Lorenzin A, Ronco C (2018) Membranes and Sorbents. Contrib Nephrol194:70–79. https://doi.org/10.1159/000485603
12. Feri M (2019) “In vitro comparison of the adsorption of inflamma- tory mediators byblood purification devices”: a misleading article for clinical practice? Intensive Care Med Exp. https://doi.org/10.1186/ s40635-018-0214-1
13. Clark WR, Ferrari F, La Manna G, Ronco C (2017) Extracorporeal sorbent technologies: basic concepts and clinical application. Contrib Nephrol 190:43–57.https://doi.org/10.1159/000468911
14. Ronco C, Bordoni V, Levin NW (2002) Adsorbents: from basic structure to clinicalapplication. Contrib Nephrol 137:158–164. https://doi.org/10. 1159/000060242
15. Ferrari F, Clark W (2018) Ronco C (2018) Sorbents: from basic structure to clinical application. In: Ronco C, Bellomo R, Kellum JA, Ricci Z (eds) Crit. Care Nephrol., 3rd edn. Elsevier
16. Ankawi G, Fan W, Pomarè Montin D et al (2019) A new series of sorbent devices formultiple clinical purposes: current evidence and future direc- tions. Blood Purif 47:94–100.https://doi.org/10.1159/000493523
17. Winchester J, Harbord N, Charen E, Ghannoum M (2015) Use of dialysis andhemoperfusion in treatment of poisioning. In: Daugirdas JT, Blake PG, Ing TS (eds) Handb. Dial., 5thedn. Lippincott
18. Rao R, Bhat R, Pathadka S et al (2017) Golden hours in severe paraquat poisoning-the roleof early haemoperfusion therapy. J Clin Diagnostic Res 11:OC06–OC08.https://doi.org/10.7860/JCDR/2017/24764.9166
19. Li C, Hu D, Xue W et al (2018) Treatment outcome of combined continu- ous venovenous hemofiltration and hemoperfusion in acute paraquat poisoning: a prospective controlled trial. Crit CareMed 46:100–107. https://doi.org/10.1097/CCM.0000000000002826
20. Winchester JF (2002) Dialysis and hemoperfusion in poisoning. Adv Ren Replace Ther9:26–30. https://doi.org/10.1053/jarr.2002.30470
21. Ghannoum M, Wiegand TJ, Liu KD et al (2015) Extracorporeal treatment for theophylline poisoning: systematic review and recommendations from the EXTRIP workgroup. Clin Toxicol53:215–229. https://doi.org/10. 3109/15563650.2015.1014907
22. Ghannoum M, Laliberté M, Nolin TD et al (2015) Extracorporeal treatment for valproic acid poisoning: systematic review and recommendations from the EXTRIP workgroup. Clin Toxicol53:454–465. https://doi.org/10. 3109/15563650.2015.1035441
23. Mactier R, Laliberté M, Mardini J et al (2014) Extracorporeal treatment for barbituratepoisoning: recommendations from the EXTRIP workgroup. Am J Kidney Dis 64:347–358.https://doi.org/10.1053/j.ajkd.2014.04.031
24. Ghannoum M, Yates C, Galvao TF et al (2014) Extracorporeal treatment for carbamazepine poisoning: systematic review and recommendations from the EXTRIP workgroup. ClinToxicol 52:993–1004. https://doi.org/10. 3109/15563650.2014.973572
25. Cruz DN, Perazella MA, Bellomo R et al (2007) Effectiveness of polymyxin B-immobilized fiber column in sepsis: a systematic review. Crit Care 11:1–12.https://doi.org/10.1186/cc5780
26. Shimizu T, Miyake T, Tani M (2017) History and current status of polymyxin B-immobilized fiber column for treatment of severe sepsis and septic shock. Ann Gastroenterol Surg1:105–113. https://doi.org/10.1002/ags3. 12015
27. Cruz D, Antonelli M, Fumagalli R et al (2009) Early use of polymyxin B hemoperfusion in abdominal septic shock: the EUPHAS randomized controlled trial. JAMA 301:2445–2452
28. Payen DM, Guilhot J, Launey Y, ABDOMIX Group et al (2015) Early use of polymyxin B hemoperfusion in patients with septic shock due to peritonitis: a multicenter randomized controltrial. Intensive Care Med 41:975–984
29. Dellinger RP, Bagshaw SM, Antonelli M et al (2018) Effect of targeted polymyxin B hemoperfusion on 28-day mortality in patients with septic shock and elevated endotoxin level: theEUPHRATES randomized clinical
30. Klein DJ, Foster D, Walker PM et al (2018) Polymyxin B hemoperfusion in endotoxemicseptic shock patients without extreme endotoxemia: a post hoc analysis of the EUPHRATES trial.Intensive Care Med 44:2205–2212. https://doi.org/10.1007/s00134-018-5463-7
31. Dargent A, Pais De Barros JP et al (2019) Improved quantification of plasma lipopolysaccharide (LPS) burden in sepsis using 3-hydroxy myristate (3HM): a cohort study. IntensiveCare Med 45:1678–1680
32. Livigni S, Bertolini G, Rossi C et al (2014) Efficacy of coupled plasma filtrationadsorption (CPFA) in patients with septic shock: a multicenter randomised controlled clinical trial.BMJ Open 4:e003536
33. Garbero E, Livigni S, Ferrari F et al (2021) High dose coupled plasma filtra- tion andadsorption in septic shock patients. results of the COMPACT-2: a multicentre, adaptive, randomisedclinical trial. Intensive Care Med 47:1303–1311
34. Ronco C, Bellomo R (2022) Hemoperfusion: technical aspects and state of the art. CritCare 26:135
35. Köhler T, Schwier E, Praxenthaler J et al (2021) Therapeutic modulation of the hostdefense by hemoadsorption with cytosorb®—basics, indica- tions and perspectives—a scoping review.Int J Mol Sci. https://doi.org/ 10.3390/ijms222312786
36. Harm S, Schildböck C, Hartmann J (2020) Cytokine removal in extracor- poreal bloodpurification: an in vitro study. Blood Purif 49:33–43. https:// doi.org/10.1159/000502680
37. Schädler D, Pausch C, Heise D et al (2017) The effect of a novel extracor- poreal cytokine hemoadsorption device on IL-6 elimination in septic patients: a randomized controlled trial. PLoS ONE 12:1–19. https://doi. org/10.1371/journal.pone.0187015
38. Mat-Nor MB, Ralib MDA, Abdulah NZ, Pickering JW (2016) The diagnostic ability ofprocalcitonin and interleukin-6 to differentiate infectious from noninfectious systemic inflammatoryresponse syndrome and to predict mortality. J Crit Care 33:245–251.https://doi.org/10.1016/j.jcrc.2016.01. 002
39. Scharf C, Schroeder I, Paal M et al (2021) Can the cytokine adsorber Cyto- Sorb® help tomitigate cytokine storm and reduce mortality in critically ill patients? A propensity score matchinganalysis. Ann Intensive Care. https://doi.org/10.1186/s13613-021-00905-6
40. Kogelmann K, Hübner T, Schwameis F et al (2021) Article first evaluation of a new dynamic scoring system intended to support prescription of adjuvant cytosorb hemoadsorption therapyin patients with septic shock. J Clin Med. https://doi.org/10.3390/jcm10132939
41. Wendel Garcia PD, Hilty MP, Held U et al (2021) Cytokine adsorption in severe, refractoryseptic shock. Intensive Care Med 47:1334–1336. https:// doi.org/10.1007/s00134-021-06512-0
42. Hakemi MS, Nassiri AA, Nobakht A et al (2022) Benefit of hemoadsorption therapy in patients suffering sepsis-associated acute kidney injury: a case series. Blood Purif.https://doi.org/10.1159/000521228
43. Diab M, Lehmann T, Bothe W et al (2022) cytokine hemoadsorption dur- ing cardiacsurgery versus standard surgical care for infective endocarditis (REMOVE): results from a multicenterrandomized controlled trial. Circula- tion 145:959–968
44. Träger K, Skrabal C, Fischer G et al (2020) Hemoadsorption treatment with CytoSorb ® inpatients with extracorporeal life support therapy: a case series. Int J Artif Organsartif Organs 43:422–429
45. Lebreton G, Dorgham K, Quentric P, Combes A, Gorochov G, Schmidt M (2021)Longitudinal cytokine profiling in patients with severe COVID-19 on extracorporeal membrane oxygenation and hemoadsorption. Am J Respir Crit Care Med 203:1433–1435
46. Stockmann H, Thelen P, Stroben F et al (2022) CytoSorb rescue for COVID-19 patientswith vasoplegic shock and multiple organ failure: a prospective, open-label, randomized controlled pilot study. Crit Care Med 50:964–976
47. Supady A, Weber E, Rieder M et al (2021) Cytokine adsorption in patients with severe COVID-19 pneumonia requiring extracorporeal membrane oxygenation (CYCOV): a single centre,open-label, randomised, controlled trial. Lancet Respir Med 9:755–762
48. Ostermann M, Koyner J (2022) Extracorporeal Blood Purification Is Appropriate inCritically Ill Patients with COVID-19 and Multiorgan Failure: COMMENTARY. Kidney 360(3):419–422. https://doi.org/10.34067/kid. 0007382020
49. Supady A, Zahn T, Kuhl M et al (2022) Cytokine adsorption in patients with post-cardiacarrest syndrome after extracorporeal cardiopulmo- nary resuscitation (CYTER)—a single-centre,open-label, randomised, controlled trial. Resuscitation 173:169–178. https://doi.org/10.1016/j.resuscitation.2022.02.001
50. Kielstein JT, Zarbock A (2022) Is this the beginning of the end of cytokine adsorption?Crit Care Med 50:1026–1029
51. Yaroustovsky M, Abramyan M, Rogalskaya E, Komardina E (2021) Selective polymyxin hemoperfusion in complex therapy of sepsis in children after cardiac surgery. Blood Purif 50:222–229.https://doi.org/10.1159/00051 0126
52. Bottari G, Lorenzetti G, Severini F et al (2021) Role of hemoperfusion with CytoSorb associated with continuous kidney replacement therapy on renal outcome in critically iii children with septic shock. Front Pediatr 9:1–9. https://doi.org/10.3389/fped.2021.718049
53. Bottari G, Murciano M, Merli P et al (2021) Hemoperfusion with CytoSorb to manage multiorgan dysfunction in the spectrum of hemophagocytic lymphohistiocytosis syndrome in critically ill children. Blood Purif. https:// doi.org/10.1159/000517471
54. Steurer LM, Schlager G, Sadeghi K et al (2021) Hemadsorption as rescue therapy forpatients with multisystem organ failure in pediatric intensive care—report of two cases reports andreview of the literature. Artif Organs 45:1582–1593. https://doi.org/10.1111/aor.14047
55. Scharf C, Liebchen U, Paal M et al (2021) Successful elimination of biliru- bin in criticallyill patients with acute liver dysfunction using a cytokine adsorber and albumin dialysis: a pilot study.Sci Rep 11:1–7. https://doi. org/10.1038/s41598-021-89712-4
56. Ocskay K, Tomescu D, Faltlhauser A et al (2021) Hemoadsorption in ‘liver indication’—analysis of 109 patients’ data from the cytosorb international registry. J Clin Med 10:1–10.https://doi.org/10.3390/jcm10215182
57. Scharf C, Liebchen U, Paal M et al (2021) Blood purification with a cytokine adsorber forthe elimination of myoglobin in critically ill patients with severe rhabdomyolysis. Crit Care 25:1–9.https://doi.org/10.1186/ s13054-021-03468-x
58. Moresco E, Rugg C, Ströhle M, Thoma M (2022) Rapid reduction of substantiallyincreased myoglobin and creatine kinase levels using a hemoadsorption device (CytoSorb ® )—a case report. Clin Case Rep 10:1–4. https://doi.org/10.1002/ccr3.5272
59. Pomarè Montin D, Ankawi G, Lorenzin A et al (2018) Biocompatibility and cytotoxicevaluation of new sorbent cartridges for blood hemoperfusion. Blood Purif 46:187–195.https://doi.org/10.1159/000489921
60. Huang Z, Wand S, Yang Z, Liu J (2013) Effect on extrapulmonary sepsis- induced acute lung injury by hemoperfusion with neutral microporous resin column. Ther Apher Dial 17:454–461
61. Chu L, Li G, Yu Y et al (2020) Clinical effects of hemoperfusion combined with pulse high-volume hemofiltration on septic shock. Medicine 99:e19058
62. Lei Y, Liang Y, Zhang X et al (2021) Alternating therapeutic plasma exchange (TPE) with double plasma molecular adsorption system (DPMAS) for the treatment of fulminant hepatic failure(FHF). Clin Case Rep 9(12):e05220
63. Wu M, Zhang H, Huang Y, Wu W, Huang J, Yan D (2021) Efficiency of dou- ble plasmamolecular absorption system on the acute severe cholestatic hepatitis. Blood Purif 50:876–882
64. Schmidt JJ, Borchina DN, van’t Klooster M et al (2022) Interim analysis of the COSA (COVID-19 patients treated with the Seraph® 100 Microbind® Affinity filter) registry. Nephrol DialTransplant 37:673–680
65. Seffer MT, Cottam D, Forni LG, Kielstein JT (2021) Heparin 2.0: a new approach to theinfection crisis. Blood Purif 50:28–34. https://doi.org/10. 1159/000508647
66. Goetz G, Hawlik K, Wild C (2021) Extracorporeal cytokine adsorption therapy as apreventive measure in cardiac surgery and as a therapeutic add-on treatment in sepsis: an updatedsystematic review of comparative efficacy and safety. Crit Care Med 49:1347–1357
67. Reiter K, Bordoni Dall’Olio VG, Ricatti MG, Soli M, Ruperti S et al (2002) In vitroremoval of therapeutic drugs with a novel adsorbent system. Blood Purif 20:380–388
68. Konig C, Rohr AC, Frey OR, Brinkmann A, Roberts JA, Wichmann D et al (2019) Invitro removal of anti-infective agents by a novel cytokine adsor- bent system. Int J Artif Org 42:57–64
69. Scharf C et al (2022) Does the cytokine adsorber CytoSorb® reduce vancomycin exposurein critically ill patients with sepsis or septic shock? a prospective observational study. Ann IntensiveCare 12:44
70. Schneider AG et al (2021) Pharmacokinetics of anti-infective agents dur- ing CytoSorbhemoadsorption. Sci Rep 11(1):10493. https://doi.org/10. 1038/s41598-021-89965-z
71. Biever P et al (2021) Hemoadsorption eliminates remdesivir from the circulation:Implications for the treatment of COVID-19. Pharmacol Res Perspect 9(2):e00743.https://doi.org/10.1002/prp2.743
72. Angheloiu AA, Angheloiu GO (2019) Removal of dabigatran using sorb- enthemadsorption. Int J Cardiol 293:73–75
73. Schultz P, Schwier E, Eickmeyer C et al (2021) High-dose CytoSorb hemoadsorption is associated with improved survival in patients with septic shock: a retrospective cohort study. J Crit Care 64:184–192. https:// doi.org/10.1016/j.jcrc.2021.04.011
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 13.03.2024
[~DATE_ACTIVE_FROM] => 13.03.2024
[ACTIVE_FROM_X] => 2024-03-13 00:00:00
[~ACTIVE_FROM_X] => 2024-03-13 00:00:00
[ACTIVE_FROM] => 13.03.2024
[~ACTIVE_FROM] => 13.03.2024
[SHOW_COUNTER] => 493
[~SHOW_COUNTER] => 493
[ID] => 8408
[~ID] => 8408
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 13.03.2024 11:16:13
[~TIMESTAMP_X] => 13.03.2024 11:16:13
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/gemoperfuziya-v-otdelenii-intensivnoy-terapii-/
[~DETAIL_PAGE_URL] => /library/articles/gemoperfuziya-v-otdelenii-intensivnoy-terapii-/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => gemoperfuziya-v-otdelenii-intensivnoy-terapii-
[~CODE] => gemoperfuziya-v-otdelenii-intensivnoy-terapii-
[EXTERNAL_ID] => 8408
[~EXTERNAL_ID] => 8408
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 13 марта 2024
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Гемоперфузия в отделении интенсивной терапии
[PREVIEW_PICTURE] => Array
(
[ID] => 5517
[TIMESTAMP_X] => 13.03.2024 11:16:13
[MODULE_ID] => iblock
[HEIGHT] => 3500
[WIDTH] => 5500
[FILE_SIZE] => 6172706
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/7c0/7d2deqfnkofg225kod1tie6r8edpjv1x
[FILE_NAME] => nanobots-are-repairing-damaged-blood-cells-nanotechnology-concept.jpg
[ORIGINAL_NAME] => nanobots-are-repairing-damaged-blood-cells-nanotechnology-concept.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => be0b9e4c725cecdbf7bc929c4924dc3d
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/7c0/7d2deqfnkofg225kod1tie6r8edpjv1x/nanobots-are-repairing-damaged-blood-cells-nanotechnology-concept.jpg
[UNSAFE_SRC] => /upload/iblock/7c0/7d2deqfnkofg225kod1tie6r8edpjv1x/nanobots-are-repairing-damaged-blood-cells-nanotechnology-concept.jpg
[SAFE_SRC] => /upload/iblock/7c0/7d2deqfnkofg225kod1tie6r8edpjv1x/nanobots-are-repairing-damaged-blood-cells-nanotechnology-concept.jpg
[ALT] => Гемоперфузия в отделении интенсивной терапии
[TITLE] => Гемоперфузия в отделении интенсивной терапии
)
[DETAIL_TEXT] => Zaccaria Ricci, Stefano Romagnoli, Thiago Reis, Rinaldo Bellomo and Claudio Ronфco
Hemoperfusion in the intensive care unit
Intensive Care Med (2022) 48:1397–1408
https://doi.org/10.1007/s00134-022-06810-1
Абстракт
Полиорганная недостаточность при сепсисе возникает из-за нарушения регуляции иммунитета. Многие из медиаторов этого процесса представляют собой гуморальные факторы (цитокины), которые теоретически могут быть удалены путем прямой адсорбции посредством процесса, называемого гемоперфузией. Гемоперфузия через устройства, которые связывают определенные молекулы, такие как эндотоксин, или теоретически обеспечивают неспецифическую адсорбцию провоспалительных медиаторов, предпринималась и изучалась в течение нескольких десятилетий с переменными результатами. Совсем недавно технологическая эволюция привела к более широкому применению адсорбции в связи с использованием более биосовместимых и, возможно, более эффективных биоматериалов. В результате появляются новые технологии и разрабатываются новые показания для их использования. В этом описательном обзоре будут представлены современные знания о технических концепциях, безопасности и клинических результатах гемоперфузии. Наконец, основное внимание будет уделено самой последней литературе, касающейся адсорбции, применяемой у пациентов в критическом состоянии, и ее показаниям, включая недавние рандомизированные контролируемые испытания и будущие области исследований.
Ключевые слова: сепсис, цитокин, очистка крови, адсорбция, гемоперфузия, COVID-19, липополисахарид.
Патофизиология сепсиса
Сепсис представляет собой сложный клинико-биологический синдром, определяемый как опасная для жизни органная дисфункция, вызванная нерегулируемым ответом хозяина на инфекцию [1]. Он начинается как инфекция, которая вызывает воспалительную реакцию у хозяина, запускаемую взаимодействием между несколькими растворимыми медиаторами [2].Воспалительный ответ на инфекцию со стороны врожденного иммунитета обычно является контролируемым, локализованным и защитным [3]. Взаимодействие между воспалительной реакцией и сопротивляемостью (ограничение воспаления адаптивным иммунитетом) является ключом к выживанию, но в некоторых не совсем понятных обстоятельствах этот сложный и хрупкий баланс теряется, и может развиться сепсис. В этом процессе нерегулируемого ответа могут быть повреждены как инфицированные, так и дистантные от очага инфекции органы, что приводит к опасному для жизни клиническому состоянию.Такой процесс имеет тенденцию вызывать избыточную выработку или подавление цитокинов и других медиаторов, которые влияют на функцию жизненно важных органов и запускают дальнейшие воспалительные и противовоспалительные реакции [4, 5]. Доминирующими клиническими фенотипами этих биологических явлений являются сепсис и септический шок, при которых пациенты могут умереть из-за трудноизлечимого воспаления или стойкого иммунного паралича.
Гипотеза очищения крови
Блокирование или ослабление воздействия растворимых медиаторов обеспечивает защиту в моделях острых молниеносных инфекций на животных [6]. Таким образом, манипулирование растворимыми компонентами иммунного ответа хозяина теоретически привлекательно. Этот подход является целью нескольких исследований, хотя и остается спорным [3]. Предыдущие попытки модулировать иммунный ответ путем нацеливания на отдельные цитокины не увенчались успехом [7]. Так, была предложена концепция очистки крови, основанная на неспецифическом манипулировании уровнями ряда медиаторов в плазме [8, 9]. Гемоперфузия теоретически может обеспечить неспецифическое лечение, как обсуждается ниже.
Обоснование гемоперфузии
Недостаточный клиренс растворимых провоспалительных медиаторов может быть одной из причин отсутствия значимых доказательств клинической эффективности адъювантной экстракорпоральной очистки крови при сепсисе [10]. Можно предположить, что прямой контакт крови со смолами с высокой адсорбционной способностью в экстракорпоральном контуре (гемоперфузия) должен логически увеличить клиренс по сравнению с непрямым удалением с помощью диализа или подходов, основанных на гемофильтрации. Гемоперфузия — это метод очистки крови, при котором удаление растворенных веществ достигается путем связывания молекул с адсорбирующими материалами [11], хотя доказательства, подтверждающие этот подход, пока неубедительны. Этот механизм лишь частично присутствует при непрерывной заместительной почечной терапии (ПЗПТ), но его клиническая значимость, вероятно, незначительна, за исключением, возможно, мембран с особым дизайном, таких как полиметилметакрилат или oXiris® (Baxter, Meyzieu, Франция) [12].
Клиренс конкретных веществ зависит не только от перфузии, но и от характеристик поверхности используемых материалов и их взаимодействия с конкретными веществами.Устройства, содержащие сорбенты, имеют большую площадь поверхности и оптимальную биосовместимость, а также обеспечивают высокоэффективное удаление растворенных веществ, особенно в диапазоне средней и высокой молекулярной массы [13]. Экстракорпоральную очистку крови можно проводить путем прямой гемоперфузии или плазмоперфузии после отделения плазмы. Возможность проведения такой гемоперфузии или плазменно-перфузионного лечения зависит от биосовместимости частиц сорбента и возможности привести сорбент в непосредственный контакт с клеточным компонентом крови, не вызывая повреждения клеток [14]
Технические аспекты адсорбции
Сорбенты могут состоять из природных (например, углей) или синтетических материалов (например, полимеров) [12] (Table 1). Сорбенты обычно готовят в виде шариков, гранул, хлопьев, волокон, сфер, цилиндрических гранул размером от 50 мкм до 1,2 см. Для них характерно высокое отношение площади поверхности к массе от 300 до 1200 м2/г, что способствует увеличению их адсорбционной способности [15]. Гранулы содержатся в пластиковом картридже, снабженном портами для притока и оттока плазмы/крови и специальными экранами для предотвращения распространения частиц в кровотоке. Как только растворитель поступает в сорбент, удаление растворенного вещества происходит в несколько фаз (Fig. 1): (а) конвективное движение от жидкости к внешней поверхности шарика, что требует дальнейшего диффузионного этапа через «пограничный слой». слой"; б) внутренний массоперенос растворенного вещества с внешней поверхности сорбента во внутреннюю пористую структуру по диффузионному механизму и в) окончательное связывание (адсорбция) растворенного вещества на пористой поверхности [15].

Окончательное связывание определяется плотностью и диаметром пор структуры сорбента (диаметр пор обычно находится в диапазоне 20–500 Å). Гидрофобное связывание является основным механизмом удаления растворенных веществ из экстракорпорального кровообращения [14]. Хотя задействованы и другие силы, такие как ван-дер-ваальсовы и ионные связи, гидрофобное сродство сорбента к целевым растворенным веществам представляет собой основной механизм для доступных в настоящее время картриджей с сорбентами [15]. После завершения связывания эта часть картриджа насыщается и больше не используется для очистки крови, поэтому сорбенты имеют ограниченный срок службы и должны быть заменены после полного насыщения. Анализ изотерм адсорбции описывает фазу насыщения как динамическое равновесие между адсорбцией и десорбцией (т. е. высвобождение адсорбированного соединения). Однако этот оборот представляет собой небольшой компонент динамического процесса, который происходит, когда задействованы силы Ван-дер-Ваальса и ионные связи. Поскольку эти силы не так сильны, как гидрофобные силы, связи могут быть обратимыми, и часть адсорбированного растворенного вещества может возвращаться в жидкую фазу, если равновесие для диффузии и химические градиенты благоприятствуют этому процессу. Однако это имеет ограниченное биологическое воздействие, и немедленно происходит насыщение. Динамический оборот (адсорбция/десорбция) в большинстве случаев составляет 5–7% от общего удаления объема [14, 15].

При разработке каждого картриджа с сорбентом необходимо учитывать несколько аспектов, таких как стоимость полимеров, высокая устойчивость к загрязнению, максимальная биосовместимость и отсутствие нежелательных побочных эффектов. Кроме того, сочетание пористости, полимеров и внутренних каналов внутри картриджа должно обеспечивать максимальный массоперенос вдоль слоя сорбента [15]. Другим важным аспектом, который следует учитывать, является скорость потока в картридже. В большинстве случаев предполагаемый кровоток колеблется в пределах от 100 до 200 мл/мин, но роль различных скоростей кровотока в воздействии на эффективность системы требует дальнейшего изучения. Наконец, селективность адсорбции целевых растворенных веществ является фундаментальным аспектом этой технологии. Все эти аспекты (т.е. тип полимера, расход, насыщение) можно варьировать и комбинировать в разных продуктах, существенно влияя на клинические эффекты экстракорпоральной очистки крови на основе адсорбции и показаний для их использования [16].
Доступные сорбенты
Древесный уголь и смолы
Первые применения сорбентов для гемоперфузии у больных были при лечении лекарственной интоксикации и отравления, так как в отдельных случаях адсорбция значительно эффективнее гемодиализа [17]. Как правило, это достигается с помощью угля или смол. Такие устройства обычно содержат от 100 до 300 г активированного угля или от 300 до 650 г смолы. Скорость кровотока для эффективного удаления лекарства составляет примерно 300 мл/мин, до 450 мл/мин, а прерывистая гемоперфузия обычно выполняется в течение 4 часов. После этого времени лечения дополнительный клиренс маловероятен из-за насыщения устройства и кинетики двойного пула в организме. Ретроспективные исследования показали, что гемоперфузия связана с увеличением выживаемости в случае приема внутрь параквата при раннем ее проведении [18], и что гемоперфузия иногда обеспечивает лучший клиренс, чем высокопоточный гемодиализ [19]. Гемоперфузия может быть показана и при других интоксикациях, включая интоксикацию грибами Amanita phalloides, передозировку барбитуратами, вальпроевой кислотой, теофиллином, алюминием и карбамазепином [20]. Тем не менее, гемодиализ может быть полезен при интоксикации теофиллином [21], вальпроевой кислотой [22], барбитуратами [23] и карбамазепином [24].
Гемоперфузия с полимиксином В
Картридж с адсорбентом, состоящий из полистироловых волокон, связанных с полимиксином B (PMX)® (Toray Medical Co.Ltd., Токио, Япония), продается в Японии и Европе для удаления эндотоксинов при сепсисе и септическом шоке [ 25]. Уровни эндотоксина снижаются in vitro в течение нескольких минут после начала гемоперфузии PMX (PMX-HP) [26]. Это лечение требует двухчасовых сеансов гемоперфузии и антикоагулянтной терапии гепарином, чтобы обеспечить полное лечение без образования тромбов в контуре со скоростью кровотока в диапазоне от 80 до 120 мл/мин. В первое рандомизированное контролируемое исследование (EUPHAS) PMX HP было включено 64 пациента с септическим шоком и интраабдоминальными грамотрицательными инфекциями, и было показано улучшение гемодинамики (среднее артериальное давление, доза катехоламинов), функции дыхания, шкалы SOFA и уровень летальности у пролеченных пациентов [27].
Второе исследование (ABDOMIX) включало 243 пациента с септическим шоком и перитонитом [28]: в ходе этого исследования пациенты были рандомизированы на основании наличия абдоминальной инфекции и независимо от наличия грамотрицательных бактерий. В этом исследовании сообщается о незначительной разнице в уровне смертности: 27 % в группе PMX HP и 19,5 % в традиционной группе. Однако это исследование было поставлено под сомнение из-за низкой смертности в контрольной группе и низкого процента пациентов, завершивших вмешательство в исследуемой группе.
Наконец, третье крупное рандомизированное двойное слепое контролируемое исследование (EUPHRATES) не выявило снижения смертности при использовании этой терапии [29]. Впервые в этом исследовании в качестве критерия для включения пациентов использовалась оценка уровня циркулирующего эндотоксина на основании теста по месту оказания медицинской помощи (анализ активности эндотоксина [EAA]). Этот интересный подход делает данное лечение потенциально открытым для мониторинга, поскольку лабораторная конечная точка может быть неоднократно измерена и оценена во время терапии. На самом деле измерение эндотоксина может быть более важным, чем тип бактерий при определении ответа на терапию. Например, в исследовании EUPHRATES у 20% пациентов была инфекция, вызванная грамположительными бактериями, и у них по-прежнему наблюдалась эндотоксемия, а у многих пациентов без бактериологического подтверждения был положительный EAA и некоторый клинический эффект от терапии [29].
Недавнее апостериорное исследование, опубликованное по результатам рандомизированного исследования EUPHRATES, показало снижение 28-дневной смертности на 10 % после поправки на показатели органной недостаточности и исходное среднее артериальное давление у пациентов со значениями ЕАА от 0,6 до 0,89 [30]. Было показано, что у пациентов со снижением EAA более 13% смертность была меньше. Тем не менее, не было различий в снижении уровня EAA между пациентами, перенесшими PMX-HP, и контрольной группой, что вызывает вопросы о клиническом влиянии этой стратегии и использовании EAA в качестве надежной конечной точки [30] (Table 2).


В ответ на вышеуказанные результаты в Северной Америке проводится еще одно рандомизированное контролируемое исследование (испытание TIGRIS, идентификатор ClinicalTrials.gov: NCT03901807). В исследовании запланирован размер выборки из 150 пациентов, включая пациентов с EAA в диапазоне от ≥ 0,60 до < 0,90. В свете вышеизложенного, до тех пор, пока не будут получены данные такого исследования, эффективность PMX-HP в отношении смертности все еще обсуждается.
Кроме того, недавнее наблюдение с использованием методологии масс-спектрометрии показало, что «липополисахаридная нагрузка», предположительно за счет кишечника , присутствует и у здоровых людей [31]. Тем не менее, пики эндотоксемии, по-видимому, возникают у пациентов с септическим шоком в критическом состоянии, возможно, из-за более высокой бактериальной нагрузки, изменения сосудисто-кишечного барьера или снижения клиренса липополисахаридов. [31]. Улучшенные возможности мониторинга сепсиса с помощью биомаркеров могут значительно оптимизировать применение технологий экстракорпоральной очистки крови Фактически, специфический и чувствительный биомаркер теоретически мог бы улучшить нашу способность применять эти методы лечения избирательно и своевременно, отслеживать их клиническую эффективность во времени и позволить своевременно прекратить использование.
Комбинированная плазмофильтрационная адсорбция
Хотя первоначальные обнадеживающие результаты были получены с помощью этой методики, комбинированная плазмофильтрационная адсорбция (CPFA) в настоящее время не рекомендуется у пациентов с септическим шоком или гипервоспалением после отрицательных результатов исследований COMPACT [32] и COMPACT-2 [33]. Такие исследования, по сути, не показали существенной пользы от CPFA и возможного потенциального вреда, особенно у пациентов без острого повреждения почек или потребности в ПЗПТ.
CytoSorb® гемоперфузия
Устройство CytoSorb® (CytoSorb®, CytoSorbents Inc, Нью-Джерси, США) представляет собой картридж, предназначенный для прямой гемоперфузии, который неоднократно демонстрировал высокий профиль безопасности с точки зрения биосовместимости и простоты использования [34]. Он состоит из сополимеров полистирола, дивинилбензола и поливинилпирролидона и нацелен на молекулы в диапазоне 5–50 кДа, что включает молекулярную массу нескольких цитокинов [35]. Лечение с CytoSorb ®, по данным FDA, может быть продлено до 24 часов с учетом того, что распространение растворенных веществ незначительно даже при таком длительном времени лечения. Максимальная эффективность с точки зрения насыщения сорбента отмечена примерно через 12 часов [https:// www. fda. gov/media/ 136866/ downl oad]. Рекомендуемая скорость кровотока составляет 150–500 мл/мин, устройство можно использовать как самостоятельно, так и в комплексе с ПЗПТ. Картридж можно также использовать во время экстракорпоральной мембранной оксигенации (ЭКМО) или искусственного кровообращения. В этом случае CytoSorb ® следует размещать в шунте, который отходит от основного компонента потока контура, как это принято в современной практике с гемоконцентраторами, и рекомендуется мониторинг потока (≤ 700 мл/мин).
Сообщалось о снижении уровня цитокинов у пациентов с сепсисом [36], а интерлейкин-6 (IL-6) был идентифицирован как диагностический критерий и, часто, как потенциальная клиническая цель лечения CytoSorb® [37, 38]. Тем не менее, многие из этих исследований были неконтролируемыми, и окончательная демонстрация эффектов CytoSorb ® должна быть проверена в большом контролируемом исследовании адекватного масштаба, подтверждающем изменение целевого растворенного вещества у пациентов, получавших лечение, по сравнению с контрольной группой. Такие доказательства в настоящее время отсутствуют. Исследование склонности, проведенное Scharf et al. показали, что снижение уровня IL-6 у пациентов в критическом состоянии с гиперцитокинемией существенно не отличалось между пациентами, получавшими CytoSorb®, и пациентами, получавшими лечение без него [39]. Тем не менее, возможно, что эта гетерогенная популяция пациентов может нуждаться в дальнейшей стратификации с точки зрения конкретных показаний, риска смерти и клинических и лабораторных конечных точек [40, 41].
Интересно, что CytoSorb® можно использовать в качестве второго последовательного элемента в другом экстракорпоральном контуре, таком как ПЗПТ [42], искусственное кровообращение [43], ЭКМО [44]. Однако исследование профиля цитокинов до и после начала ЭКМО у пациентов с COVID-19 показало, что ЭКМО не предполагает значительного повышения уровня цитокинов и что, даже если у пациентов наблюдается снижение уровня ИЛ-6 , IL-10 и TNF-gamma, у пациентов без гемоперфузии CytoSorb® также наблюдается снижение концентрации цитокинов [45]. Это исследование ясно показало наше неадекватное понимание кинетики цитокинов в различных клинических состояниях и необходимость улучшения знаний для оптимизации модуляции уровней цитокинов. Фактически, лечение пациентов с COVID-19 с помощью экстракорпорального очищения крови и, в частности, с помощью гемоадсорбции CytoSorb® недавно исследовалось [46, 47], обсуждалось и подвергалось сомнению [48].
Даже если несколько серий случаев показали многообещающие результаты [35, 44], по крайней мере четыре рандомизированных исследования не показали каких-либо преимуществ с точки зрения смертности [37, 43, 46, 49], а два проспективных исследования (сопоставленное контролируемое и рандомизированное исследование) описали потенциальный вред [41, 47] (Table 2). Согласно приведенным выше исследованиям, CytoSorb®, по-видимому, не оказывает существенного влияния на потребность в вазопрессорах, измеренные уровни цитокинов, органную дисфункцию и смертность взрослых пациентов в критическом состоянии с признаками гипервоспаления после операций на сердце, инфекции, сепсиса или COVID-19. В ответ на вышеупомянутые результаты таких исследований недавняя редакционная статья открыто критиковала государственное финансирование лечения CytoSorb® в Германии и подчеркивала отсутствие убедительной литературы, подтверждающей его эффективность, и неоправданные затраты [50].
В некоторых сообщениях недавно описывалось применение гемоадсорбции в педиатрии.Как DH-PMX [51], так и CytoSorb® безопасно применялись при серии случаев септического шока [52], гемофагоцитарного лимфогистиоцитоза [53] и полиорганной недостаточности (MOF) [54], но педиатрические рандомизированные исследования в настоящее время не планируются.Более подробная информация об этой деликатной популяции должна быть предоставлена большими перспективными базами данных. Как у детей, так и у взрослых CytoSorb® использовался для значительного и эффективного снижения концентрации билирубина и миоглобина в сыворотке крови, зарекомендовав себя как потенциальное средство для пациентов с различными формами печеночной недостаточности с гипербилирубинемией [55, 56] и рабдомиолизом [57, 58]. ].
Серия Jafron HA для гемо/плазмоперфузии
Недавно была разработана группа новых картриджей для гемоперфузии: нейтро-макропористые смолы из сополимера стирола и дивинилбензола, называемые HA130, HA230 и HA330 (Jafron Biomedical, Гуандун, Китай) [59]. Распределение пор смол по размерам составляет 500D–40 кДа в HA130, 200D–10 кD в HA230 и 500D–60 кD в HA330/HA380. НА130 в основном применяют при хронических состояниях в сочетании с гемодиализом в течение одного или нескольких сеансов в неделю. В таких условиях дополнительная роль адсорбции, по-видимому, приводит к значительному улучшению таких симптомов, как зуд, мышечная слабость, аппетит и анемия [59]. HA230 в основном показан при острых интоксикациях, особенно при передозировке лекарств, пестицидов и отравлении промышленными токсинами [59]. Картриджи HA330 и HA380 в основном показаны при острых воспалительных состояниях, таких как сепсис, травма, ожоги, панкреатит и различные синдромы высвобождения цитокинов (CAR-T-клеточная терапия, тяжелый COVID-19, гемофагоцитарный синдром) [59]. В небольшом рандомизированном исследовании у субъектов с сепсисом и острым повреждением легких, которые лечились в течение 3 дней 2-часовыми сеансами HA330, по сравнению с обычной терапией уровни некоторых цитокинов снизились. Кроме того, исследование показало значительное улучшение оксигенации пациентов и снижение 28-дневнуой смертности (67% у пациентов, получавших лечение, против 28% у пациентов из контрольной группы) [60]. Аналогичные результаты, но без влияния на смертность, были получены в другом небольшом рандомизированном исследовании, в котором лечение сочеталось с высокообъемной гемофильтрацией [61]. Скорость кровотока с картриджем HA330 обычно такая же, как при обычной ПЗПТ, и поэтому может варьировать от 150 до 250 мл/мин. Следует отметить, что в картридже содержится специальная адсорбирующая смола для билирубина и желчных кислот, которая используется в методе, называемом DPMAS (система молекулярной адсорбции с двойной плазменной фильтрацией). Этот сорбент применялся отдельно или в сочетании с картриджем НА330-II для удаления цитокинов и билирубина/желчных кислот при острой печеночной недостаточности и фульминантном гепатите у взрослых и детей [62, 63].
Микроаффинный связыватель патогенов Seraph‑100
Особый интерес представляет картридж Seraph-100® (ExThera, Martinez, CA), предназначенный для удаления патогенов из кровотока [64]. Он содержит гранулы полиэтилена сверхвысокой молекулярной массы с присоединенным к концам гепарином, который считается способным иммобилизовать патогены аналогично действию гепарансульфата на поверхности клеток [65]. Его можно использовать как самостоятельно, так и последовательно с контуром НЗПТ. Скорость кровотока составляет от 150 до 350 мл/мин, а время лечения может быть увеличено до 24 часов по усмотрению лечащего врача [https://www.fda.gov/media/137105/download]. Если будущие контролируемые исследования подтвердят его эффективность у пациентов с сепсисом и пациентов с осложненной инфекцией COVID-19, это может гарантировать мультимодальный подход к лечению нерегулируемого воспаления, не только путем удаления цитокинов из кровотока, но и путем воздействия на бактериемию и виремию, включая повреждения, связанные с молекулярными паттернами, связанные с гиперпродукцией цитокинов.
Открытые вопросы: методология исследований, сроки, доза, продолжительность, антикоагулянтная терапия и стоимость.
Необходимы дополнительные исследования, чтобы установить реальную и эффективную роль методов экстракорпоральной очистки крови в условиях интенсивной терапии. Доказательства клинической эффективности адсорбционной терапии требуют хорошо структурированной программы исследований. Мы также должны учитывать, что первоначальные рандомизированные контролируемые испытания должны оценивать различные первичные конечные точки, а не смертность, чтобы также оценить другие важные эффекты экстракорпоральной очистки крови, такие как дни без вентиляции, дни без вазопрессорной терапии, дни без инвазивной поддержки органов (Fig. 2). Необходимо лучшее понять, на какие молекулы следует воздействовать в конкретном клиническом состоянии. Некоторые авторы предполагают, что вариабельность иммунных фенотипов и клинических ответов хозяина должна быть полностью оценена и срочно рассмотрена в качестве предмета будущих исследований в этой области [48]. Еще одним важным "черным ящиком" является удаление молекул, связанных с белком, по сравнению со свободными молекулами. Пока эти вопросы не будут четко решены, положительные результаты рандомизированных исследований гемоперфузии кажутся маловероятными.

В недавнем обновленном систематическом обзоре экстракорпоральной адсорбции цитокинов [66] сделан явный вывод о том, что эффективность и безопасность этой стратегии в сочетании со стандартной терапией у пациентов с сепсисом/септическим шоком, перенесших операцию на сердце, не установлены. Доказательства, оценивающие фармакокинетику антибиотиков у пациентов, подвергающихся гемоперфузии, ограничены, и существует лишь несколько данных, полученных в результате небольших и разнородных исследований [67–72]. Из-за критической важности оптимального антимикробного лечения при сепсисе важно понять и компенсировать их экстракорпоральную потерю во время гемоперфузии. Неселективный клиренс растворенных веществ и потенциальная польза гемоперфузии для «восстановления иммунитета» могут быть нейтрализованы побочными эффектами, когда неизбирательное удаление «хороших» растворенных веществ может играть центральную роль в определении результатов лечения пациентов. Такой неселективный клиренс препарата у больных с сепсисом является малоизученной областью.
В 2002 г. проводилось исследование биосовместимого картриджа с сорбентом (Betasorb®, Renal Tech) [67], специально изготовленного для высокоэффективного удаления веществ средней молекулярной массы, таких как ß2-микроглобулин и цитокины [68]. В исследованиях invitro обнаружено эффективное удаление гликопептидов и других неантимикробных агентов (дигоксин, теофиллин, фенобарбитал, фенитоин, карбамазепин, вальпроевая кислота, такролимус и циклоспорин А).
Напротив, аминогликозиды менее подвержены влиянию картриджа. В недавнем исследовании in vitro оценивалась адсорбционная способность CytoSorb® в отношении многих распространенных противомикробных препаратов: ванкомицина, гентамицина, меропенема, флуклоксациллина, пиперациллина, ципрофлоксацина, рифампицина, флуконазола и вориконазола [67]. Исследование показало, что все исследованные препараты адсорбировались на поверхности картриджа CytoSorb® нелинейным образом, что приводило к насыщению поверхности адсорбента и постепенному снижению клиренса с течением времени. Следовательно, дополнительные экстрадозы противомикробных препаратов необходимо вводить в течение первых нескольких часов после начала гемоперфузии для поддержания клинически адекватной равновесной концентрации в сыворотке крови. Недавнее проспективное обсервационное исследование, предназначенное для количественной оценки адсорбции ванкомицина (в виде непрерывной инфузии с предшествующей нагрузочной дозой в течение 2 часов) продемонстрировало значительную адсорбцию препарата с линейным снижением во время лечения CytoSorb® [69].
Всего в анализ было включено 160 образцов сыворотки с ванкомицином от 7 пациентов с септическим шоком, и 15% образцов были собраны во время лечения CytoSorb®. Исследование показало значительную адсорбцию ванкомицина устройством CytoSorb® (макс. 572 мг) и необходимость введения дополнительных доз для достижения терапевтического действия. В интервенционном экспериментальном исследовании изучалась гемоадсорбция с помощью CytoSorb® 17 препаратов: клиндамицина, флуконазола, линезолида, меропенема, пиперациллина, анидулафунгина, ганцикловира, кларитромицина, посаконазола, тейкопланина, тобрамицина, цефтриаксона, ципрофлоксацина, метронидазола, липосомального амфотерицина В, флуклоксациллин и цефепим [70]. Единственным препаратом, на который не влияла гемадсорбция, оказался ганцикловир. Остальные препараты имели эффективный клиренс, который со временем снижался, считался умеренным для флуконазола (282 %) и линезолида (115 %), легким для липосомального амфотерицина В (75 %), позаконазола (32 %) и тейкопланина ( 31%) и незначительным для всех других препаратов. Наконец, in vitro было продемонстрировано, что CytoSorb® может активно элиминировать многие другие препараты, включая ремдесивир, дабигатран, эдоксабан, ривароксабан и тикагрелор [71, 72].
Другой открытый вопрос связан с "дозированием" гемоперфузии. Возможно, что некоторым пациентам потребуются «более высокие дозы» и повторные циклы адсорбции [73] с частой и последовательной сменой картриджей.
Опять же, в настоящее время мы не знаем, насколько ранним и продолжительным должен быть сеанс лечения (т. е. время начала и время окончания), а также каково влияние режима антикоагулянтной терапии (например, обеспечение эффективной перфузии, продление срока использования картриджа или уменьшение воспалительного триггера через коагуляционный каскад).
Наконец, высокая стоимость этих устройств должна быть окончательно оправдана с точки зрения клинической эффективности, особенно во времена экономических ограничений. Принимая во внимание текущие ограниченные знания и имеющиеся данные о методах и устройствах гемоперфузии, мы должны настоятельно рекомендовать сфокусированную программу исследований. Некоторым пациентам может помочь экстракорпоральная очистка крови на основе адсорбции, но нам необходимо идентифицировать таких людей или группу пациентов с использованием адекватных биомаркеров или методов идентификации фенотипа.
Вывод
Эволюция экстракорпоральной очистки крови происходила постоянно в течение последних двух десятилетий. Гемоперфузия и дизайн биосовместимых картриджей с возможностью настройки целевых растворов и реализации безопасных и селективных методов лечения в настоящее время стимулируют разработку устройств для очистки крови последнего поколения. Наше понимание патофизиологии интенсивной терапии и гипервоспалительных заболеваний также изменилось, и теперь ясно, что каждый пациент требует индивидуального подхода. Представляется вероятным, что исследования гемоперфузии перейдут от крупномасштабных рандомизированных испытаний к адаптированным исследованиям, которые включают только пациентов, соответствующих определенным и объективным критериям (например, биомаркерам, клиническим фенотипам), которые предлагают вероятные показания для лечения и/или конечные точки для оценки биологической эффективности очистки крови.
References
1. Singer M, Deutschman CS, Seymour CW et al (2016) The Third Interna- tional ConsensusDefinitions for Sepsis and Septic Shock (Sepsis-3). JAMA 315:801–810
2. Denning NL, Aziz M, Gurien SD, Wang P (2019) Damps and nets in sepsis. Front Immunol10:1–15. https://doi.org/10.3389/fimmu.2019.02536
3. Van Der Poll T, Van De Veerdonk FL, Scicluna BP, Netea MG (2017) Theimmunopathology of sepsis and potential therapeutic targets. Nat Rev Immunol 17:407–420
4. Delano MJ, Ward PA (2016) The immune system’s role in sepsis progres- sion, resolution,and long-term outcome. Immunol Rev 274:330–353. https://doi.org/10.1111/imr.12499
5. Hotchkiss R, Monneret G, Payen D (2013) Sepsis-induced immunosup- pression: fromcellular dysfunctions to immunotherapy. Nat Rev Immunol 13:862–874.https://doi.org/10.1038/nri3552.Sepsis-induced
6. Wiersinga WJ, Leopold SJ, Cranendonk DR, van der Poll T (2014) Host innate immuneresponses to sepsis. Virulence 5:36–44. https://doi.org/10. 4161/viru.25436
7. Deans KJ, Haley M, Natanson C et al (2005) Novel therapies for sepsis: a review. JTrauma Inj Infect Crit Care 58:867–874. https://doi.org/10.1097/ 01.TA.0000158244.69179.94
8. Barzilay E, Kessler D, Berlot G, Gullo A, Geber D, Ben Zeev I (1989) Use of extracorporealsupportive techniques as additional treatment for septic- induced multiple organ failure patients. CritCare Med 17:634–637
9. Rimmelé T, Kellum JA (2011) Clinical review: blood purification for sepsis. Crit Care15:1–10. https://doi.org/10.1186/cc9411
10. Ankawi G, Neri M, Zhang J et al (2018) Extracorporeal techniques for the treatment ofcritically ill patients with sepsis beyond conventional blood purification therapy: the promises and the pitfalls. Crit Care 22:1–16. https://doi.org/10.1186/s13054-018-2181-z
11. Clark WR, Gao D, Lorenzin A, Ronco C (2018) Membranes and Sorbents. Contrib Nephrol194:70–79. https://doi.org/10.1159/000485603
12. Feri M (2019) “In vitro comparison of the adsorption of inflamma- tory mediators byblood purification devices”: a misleading article for clinical practice? Intensive Care Med Exp. https://doi.org/10.1186/ s40635-018-0214-1
13. Clark WR, Ferrari F, La Manna G, Ronco C (2017) Extracorporeal sorbent technologies: basic concepts and clinical application. Contrib Nephrol 190:43–57.https://doi.org/10.1159/000468911
14. Ronco C, Bordoni V, Levin NW (2002) Adsorbents: from basic structure to clinicalapplication. Contrib Nephrol 137:158–164. https://doi.org/10. 1159/000060242
15. Ferrari F, Clark W (2018) Ronco C (2018) Sorbents: from basic structure to clinical application. In: Ronco C, Bellomo R, Kellum JA, Ricci Z (eds) Crit. Care Nephrol., 3rd edn. Elsevier
16. Ankawi G, Fan W, Pomarè Montin D et al (2019) A new series of sorbent devices formultiple clinical purposes: current evidence and future direc- tions. Blood Purif 47:94–100.https://doi.org/10.1159/000493523
17. Winchester J, Harbord N, Charen E, Ghannoum M (2015) Use of dialysis andhemoperfusion in treatment of poisioning. In: Daugirdas JT, Blake PG, Ing TS (eds) Handb. Dial., 5thedn. Lippincott
18. Rao R, Bhat R, Pathadka S et al (2017) Golden hours in severe paraquat poisoning-the roleof early haemoperfusion therapy. J Clin Diagnostic Res 11:OC06–OC08.https://doi.org/10.7860/JCDR/2017/24764.9166
19. Li C, Hu D, Xue W et al (2018) Treatment outcome of combined continu- ous venovenous hemofiltration and hemoperfusion in acute paraquat poisoning: a prospective controlled trial. Crit CareMed 46:100–107. https://doi.org/10.1097/CCM.0000000000002826
20. Winchester JF (2002) Dialysis and hemoperfusion in poisoning. Adv Ren Replace Ther9:26–30. https://doi.org/10.1053/jarr.2002.30470
21. Ghannoum M, Wiegand TJ, Liu KD et al (2015) Extracorporeal treatment for theophylline poisoning: systematic review and recommendations from the EXTRIP workgroup. Clin Toxicol53:215–229. https://doi.org/10. 3109/15563650.2015.1014907
22. Ghannoum M, Laliberté M, Nolin TD et al (2015) Extracorporeal treatment for valproic acid poisoning: systematic review and recommendations from the EXTRIP workgroup. Clin Toxicol53:454–465. https://doi.org/10. 3109/15563650.2015.1035441
23. Mactier R, Laliberté M, Mardini J et al (2014) Extracorporeal treatment for barbituratepoisoning: recommendations from the EXTRIP workgroup. Am J Kidney Dis 64:347–358.https://doi.org/10.1053/j.ajkd.2014.04.031
24. Ghannoum M, Yates C, Galvao TF et al (2014) Extracorporeal treatment for carbamazepine poisoning: systematic review and recommendations from the EXTRIP workgroup. ClinToxicol 52:993–1004. https://doi.org/10. 3109/15563650.2014.973572
25. Cruz DN, Perazella MA, Bellomo R et al (2007) Effectiveness of polymyxin B-immobilized fiber column in sepsis: a systematic review. Crit Care 11:1–12.https://doi.org/10.1186/cc5780
26. Shimizu T, Miyake T, Tani M (2017) History and current status of polymyxin B-immobilized fiber column for treatment of severe sepsis and septic shock. Ann Gastroenterol Surg1:105–113. https://doi.org/10.1002/ags3. 12015
27. Cruz D, Antonelli M, Fumagalli R et al (2009) Early use of polymyxin B hemoperfusion in abdominal septic shock: the EUPHAS randomized controlled trial. JAMA 301:2445–2452
28. Payen DM, Guilhot J, Launey Y, ABDOMIX Group et al (2015) Early use of polymyxin B hemoperfusion in patients with septic shock due to peritonitis: a multicenter randomized controltrial. Intensive Care Med 41:975–984
29. Dellinger RP, Bagshaw SM, Antonelli M et al (2018) Effect of targeted polymyxin B hemoperfusion on 28-day mortality in patients with septic shock and elevated endotoxin level: theEUPHRATES randomized clinical
30. Klein DJ, Foster D, Walker PM et al (2018) Polymyxin B hemoperfusion in endotoxemicseptic shock patients without extreme endotoxemia: a post hoc analysis of the EUPHRATES trial.Intensive Care Med 44:2205–2212. https://doi.org/10.1007/s00134-018-5463-7
31. Dargent A, Pais De Barros JP et al (2019) Improved quantification of plasma lipopolysaccharide (LPS) burden in sepsis using 3-hydroxy myristate (3HM): a cohort study. IntensiveCare Med 45:1678–1680
32. Livigni S, Bertolini G, Rossi C et al (2014) Efficacy of coupled plasma filtrationadsorption (CPFA) in patients with septic shock: a multicenter randomised controlled clinical trial.BMJ Open 4:e003536
33. Garbero E, Livigni S, Ferrari F et al (2021) High dose coupled plasma filtra- tion andadsorption in septic shock patients. results of the COMPACT-2: a multicentre, adaptive, randomisedclinical trial. Intensive Care Med 47:1303–1311
34. Ronco C, Bellomo R (2022) Hemoperfusion: technical aspects and state of the art. CritCare 26:135
35. Köhler T, Schwier E, Praxenthaler J et al (2021) Therapeutic modulation of the hostdefense by hemoadsorption with cytosorb®—basics, indica- tions and perspectives—a scoping review.Int J Mol Sci. https://doi.org/ 10.3390/ijms222312786
36. Harm S, Schildböck C, Hartmann J (2020) Cytokine removal in extracor- poreal bloodpurification: an in vitro study. Blood Purif 49:33–43. https:// doi.org/10.1159/000502680
37. Schädler D, Pausch C, Heise D et al (2017) The effect of a novel extracor- poreal cytokine hemoadsorption device on IL-6 elimination in septic patients: a randomized controlled trial. PLoS ONE 12:1–19. https://doi. org/10.1371/journal.pone.0187015
38. Mat-Nor MB, Ralib MDA, Abdulah NZ, Pickering JW (2016) The diagnostic ability ofprocalcitonin and interleukin-6 to differentiate infectious from noninfectious systemic inflammatoryresponse syndrome and to predict mortality. J Crit Care 33:245–251.https://doi.org/10.1016/j.jcrc.2016.01. 002
39. Scharf C, Schroeder I, Paal M et al (2021) Can the cytokine adsorber Cyto- Sorb® help tomitigate cytokine storm and reduce mortality in critically ill patients? A propensity score matchinganalysis. Ann Intensive Care. https://doi.org/10.1186/s13613-021-00905-6
40. Kogelmann K, Hübner T, Schwameis F et al (2021) Article first evaluation of a new dynamic scoring system intended to support prescription of adjuvant cytosorb hemoadsorption therapyin patients with septic shock. J Clin Med. https://doi.org/10.3390/jcm10132939
41. Wendel Garcia PD, Hilty MP, Held U et al (2021) Cytokine adsorption in severe, refractoryseptic shock. Intensive Care Med 47:1334–1336. https:// doi.org/10.1007/s00134-021-06512-0
42. Hakemi MS, Nassiri AA, Nobakht A et al (2022) Benefit of hemoadsorption therapy in patients suffering sepsis-associated acute kidney injury: a case series. Blood Purif.https://doi.org/10.1159/000521228
43. Diab M, Lehmann T, Bothe W et al (2022) cytokine hemoadsorption dur- ing cardiacsurgery versus standard surgical care for infective endocarditis (REMOVE): results from a multicenterrandomized controlled trial. Circula- tion 145:959–968
44. Träger K, Skrabal C, Fischer G et al (2020) Hemoadsorption treatment with CytoSorb ® inpatients with extracorporeal life support therapy: a case series. Int J Artif Organsartif Organs 43:422–429
45. Lebreton G, Dorgham K, Quentric P, Combes A, Gorochov G, Schmidt M (2021)Longitudinal cytokine profiling in patients with severe COVID-19 on extracorporeal membrane oxygenation and hemoadsorption. Am J Respir Crit Care Med 203:1433–1435
46. Stockmann H, Thelen P, Stroben F et al (2022) CytoSorb rescue for COVID-19 patientswith vasoplegic shock and multiple organ failure: a prospective, open-label, randomized controlled pilot study. Crit Care Med 50:964–976
47. Supady A, Weber E, Rieder M et al (2021) Cytokine adsorption in patients with severe COVID-19 pneumonia requiring extracorporeal membrane oxygenation (CYCOV): a single centre,open-label, randomised, controlled trial. Lancet Respir Med 9:755–762
48. Ostermann M, Koyner J (2022) Extracorporeal Blood Purification Is Appropriate inCritically Ill Patients with COVID-19 and Multiorgan Failure: COMMENTARY. Kidney 360(3):419–422. https://doi.org/10.34067/kid. 0007382020
49. Supady A, Zahn T, Kuhl M et al (2022) Cytokine adsorption in patients with post-cardiacarrest syndrome after extracorporeal cardiopulmo- nary resuscitation (CYTER)—a single-centre,open-label, randomised, controlled trial. Resuscitation 173:169–178. https://doi.org/10.1016/j.resuscitation.2022.02.001
50. Kielstein JT, Zarbock A (2022) Is this the beginning of the end of cytokine adsorption?Crit Care Med 50:1026–1029
51. Yaroustovsky M, Abramyan M, Rogalskaya E, Komardina E (2021) Selective polymyxin hemoperfusion in complex therapy of sepsis in children after cardiac surgery. Blood Purif 50:222–229.https://doi.org/10.1159/00051 0126
52. Bottari G, Lorenzetti G, Severini F et al (2021) Role of hemoperfusion with CytoSorb associated with continuous kidney replacement therapy on renal outcome in critically iii children with septic shock. Front Pediatr 9:1–9. https://doi.org/10.3389/fped.2021.718049
53. Bottari G, Murciano M, Merli P et al (2021) Hemoperfusion with CytoSorb to manage multiorgan dysfunction in the spectrum of hemophagocytic lymphohistiocytosis syndrome in critically ill children. Blood Purif. https:// doi.org/10.1159/000517471
54. Steurer LM, Schlager G, Sadeghi K et al (2021) Hemadsorption as rescue therapy forpatients with multisystem organ failure in pediatric intensive care—report of two cases reports andreview of the literature. Artif Organs 45:1582–1593. https://doi.org/10.1111/aor.14047
55. Scharf C, Liebchen U, Paal M et al (2021) Successful elimination of biliru- bin in criticallyill patients with acute liver dysfunction using a cytokine adsorber and albumin dialysis: a pilot study.Sci Rep 11:1–7. https://doi. org/10.1038/s41598-021-89712-4
56. Ocskay K, Tomescu D, Faltlhauser A et al (2021) Hemoadsorption in ‘liver indication’—analysis of 109 patients’ data from the cytosorb international registry. J Clin Med 10:1–10.https://doi.org/10.3390/jcm10215182
57. Scharf C, Liebchen U, Paal M et al (2021) Blood purification with a cytokine adsorber forthe elimination of myoglobin in critically ill patients with severe rhabdomyolysis. Crit Care 25:1–9.https://doi.org/10.1186/ s13054-021-03468-x
58. Moresco E, Rugg C, Ströhle M, Thoma M (2022) Rapid reduction of substantiallyincreased myoglobin and creatine kinase levels using a hemoadsorption device (CytoSorb ® )—a case report. Clin Case Rep 10:1–4. https://doi.org/10.1002/ccr3.5272
59. Pomarè Montin D, Ankawi G, Lorenzin A et al (2018) Biocompatibility and cytotoxicevaluation of new sorbent cartridges for blood hemoperfusion. Blood Purif 46:187–195.https://doi.org/10.1159/000489921
60. Huang Z, Wand S, Yang Z, Liu J (2013) Effect on extrapulmonary sepsis- induced acute lung injury by hemoperfusion with neutral microporous resin column. Ther Apher Dial 17:454–461
61. Chu L, Li G, Yu Y et al (2020) Clinical effects of hemoperfusion combined with pulse high-volume hemofiltration on septic shock. Medicine 99:e19058
62. Lei Y, Liang Y, Zhang X et al (2021) Alternating therapeutic plasma exchange (TPE) with double plasma molecular adsorption system (DPMAS) for the treatment of fulminant hepatic failure(FHF). Clin Case Rep 9(12):e05220
63. Wu M, Zhang H, Huang Y, Wu W, Huang J, Yan D (2021) Efficiency of dou- ble plasmamolecular absorption system on the acute severe cholestatic hepatitis. Blood Purif 50:876–882
64. Schmidt JJ, Borchina DN, van’t Klooster M et al (2022) Interim analysis of the COSA (COVID-19 patients treated with the Seraph® 100 Microbind® Affinity filter) registry. Nephrol DialTransplant 37:673–680
65. Seffer MT, Cottam D, Forni LG, Kielstein JT (2021) Heparin 2.0: a new approach to theinfection crisis. Blood Purif 50:28–34. https://doi.org/10. 1159/000508647
66. Goetz G, Hawlik K, Wild C (2021) Extracorporeal cytokine adsorption therapy as apreventive measure in cardiac surgery and as a therapeutic add-on treatment in sepsis: an updatedsystematic review of comparative efficacy and safety. Crit Care Med 49:1347–1357
67. Reiter K, Bordoni Dall’Olio VG, Ricatti MG, Soli M, Ruperti S et al (2002) In vitroremoval of therapeutic drugs with a novel adsorbent system. Blood Purif 20:380–388
68. Konig C, Rohr AC, Frey OR, Brinkmann A, Roberts JA, Wichmann D et al (2019) Invitro removal of anti-infective agents by a novel cytokine adsor- bent system. Int J Artif Org 42:57–64
69. Scharf C et al (2022) Does the cytokine adsorber CytoSorb® reduce vancomycin exposurein critically ill patients with sepsis or septic shock? a prospective observational study. Ann IntensiveCare 12:44
70. Schneider AG et al (2021) Pharmacokinetics of anti-infective agents dur- ing CytoSorbhemoadsorption. Sci Rep 11(1):10493. https://doi.org/10. 1038/s41598-021-89965-z
71. Biever P et al (2021) Hemoadsorption eliminates remdesivir from the circulation:Implications for the treatment of COVID-19. Pharmacol Res Perspect 9(2):e00743.https://doi.org/10.1002/prp2.743
72. Angheloiu AA, Angheloiu GO (2019) Removal of dabigatran using sorb- enthemadsorption. Int J Cardiol 293:73–75
73. Schultz P, Schwier E, Eickmeyer C et al (2021) High-dose CytoSorb hemoadsorption is associated with improved survival in patients with septic shock: a retrospective cohort study. J Crit Care 64:184–192. https:// doi.org/10.1016/j.jcrc.2021.04.011
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 13.03.2024
[ACTIVE_FROM] => 13.03.2024
[SHOW_COUNTER] => 493
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2017-07-31 16:04:44
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829362
[VALUE] => Интенсивная терапия, реанимация, гемоперфузия
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Интенсивная терапия, реанимация, гемоперфузия
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2017-08-02 11:16:15
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829364
[VALUE] => Гемоперфузия в отделении интенсивной терапии
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Гемоперфузия в отделении интенсивной терапии
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2017-08-02 11:18:27
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829363
[VALUE] => Гемоперфузия в отделении интенсивной терапии
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Гемоперфузия в отделении интенсивной терапии
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829733
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2017-09-15 12:05:50
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2017-09-19 10:40:01
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2017-08-22 15:43:39
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829369
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2017-08-22 16:30:23
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2017-08-23 10:51:22
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2017-08-23 11:05:12
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829366
[1] => 829367
[2] => 829368
[3] => 829371
)
[VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => intensivnayaterapiya
[3] => Gemoperfusiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => intensivnayaterapiya
[3] => Gemoperfusiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2017-10-12 14:43:36
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2018-05-11 11:01:14
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829733
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829369
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829366
[1] => 829367
[2] => 829368
[3] => 829371
)
[VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => intensivnayaterapiya
[3] => Gemoperfusiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => intensivnayaterapiya
[3] => Gemoperfusiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Сепсис
[2] => Интенсивная терапия
[3] => Гемоперфузия
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 26.08.2022 14:38:28
[~TIMESTAMP_X] => 26.08.2022 14:38:28
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Гемоперфузия в отделении интенсивной терапии
[BROWSER_TITLE] => Гемоперфузия в отделении интенсивной терапии
[KEYWORDS] => Интенсивная терапия, реанимация, гемоперфузия
[DESCRIPTION] => Гемоперфузия в отделении интенсивной терапии
)
)




