ОПЫТ, НОВЫЕ ЗНАНИЯ И СОВРЕМЕННЫЕ ТЕХНОЛОГИИ ПОМОГАЮТ НАМ СПАСАТЬ ЖИЗНИ ТЫСЯЧ ЛЮДЕЙ
Array
(
[NAME] => Когда повреждены почки, страдают другие органы
[~NAME] => Когда повреждены почки, страдают другие органы
[PREVIEW_PICTURE] => Array
(
[ID] => 5661
[TIMESTAMP_X] => 03.06.2024 13:44:14
[MODULE_ID] => iblock
[HEIGHT] => 5376
[WIDTH] => 9408
[FILE_SIZE] => 15645806
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/9ad/40w2xemagaflaumceuk07n1l0da9rhw5
[FILE_NAME] => human-kidneys-flat-creative-illustration-generative-ai.jpg
[ORIGINAL_NAME] => human-kidneys-flat-creative-illustration-generative-ai.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 3a72314a341dd801136c464b094b6482
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/9ad/40w2xemagaflaumceuk07n1l0da9rhw5/human-kidneys-flat-creative-illustration-generative-ai.jpg
[UNSAFE_SRC] => /upload/iblock/9ad/40w2xemagaflaumceuk07n1l0da9rhw5/human-kidneys-flat-creative-illustration-generative-ai.jpg
[SAFE_SRC] => /upload/iblock/9ad/40w2xemagaflaumceuk07n1l0da9rhw5/human-kidneys-flat-creative-illustration-generative-ai.jpg
[ALT] => Когда повреждены почки, страдают другие органы
[TITLE] => Когда повреждены почки, страдают другие органы
)
[~PREVIEW_PICTURE] => 5661
[DETAIL_TEXT] =>
Intensive Care Med 2022 https://doi.org/10.1007/s00134-022-06925-5
When the kidneys hurt, the other organs suffer
Celine Monard, Melanie Meersch‑Dini and Michael Joannidis
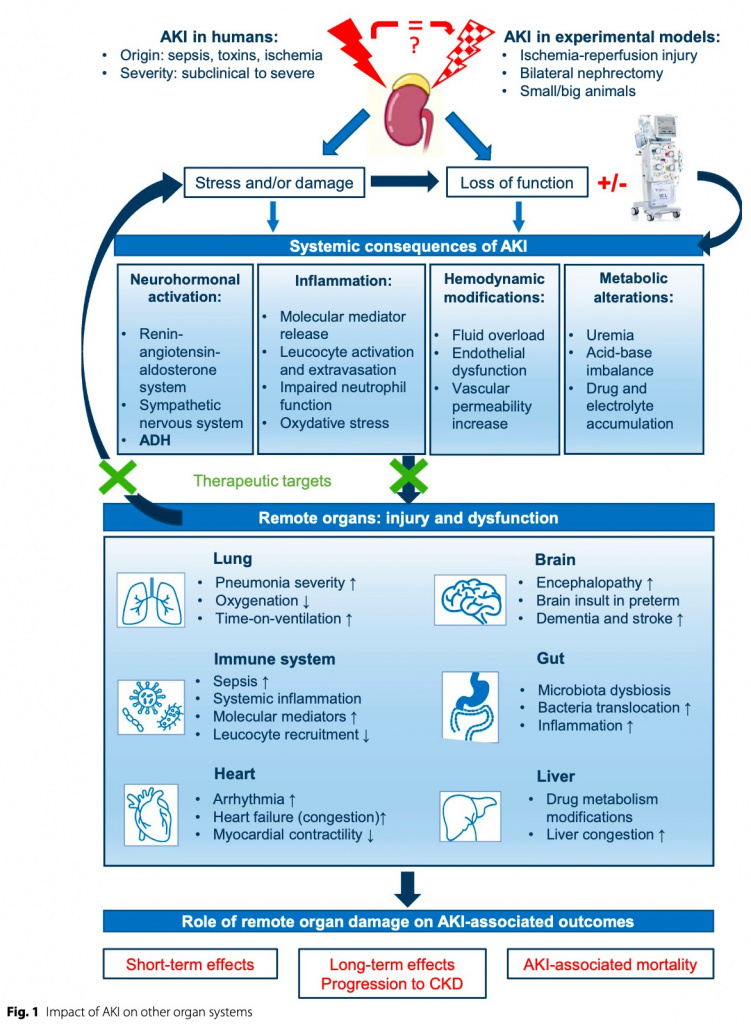
Из-за межорганных взаимодействий, которые являются неотъемлемой частью биологии человека, поврежденный орган обычно ставит под угрозу другие органы у пациентов в критическом состоянии. Острая почечная недостаточность (AKI ) характеризуется резким снижением скорости клубочковой фильтрации, диагностируемым либо по повышению уровня креатинина в сыворотке крови, либо по развитию олигурии, что отражено в диагностических критериях рекомендаций Kidney Disease Improving Global Outcomes (KDIGO). AKI приводит к задержке жидкости, нарушению электролитного баланса, метаболическому ацидозу и изменению фармакокинетики лекарств. Клиренс медиаторов воспаления также снижается, что приводит к значительному увеличению провоспалительной нагрузки [1]. Это, в сочетании с накоплением уремических токсинов, способствует повреждению эндотелия и повышению проницаемости сосудов [2]. В дополнение к потере функции почек стресс и/или повреждение почек, которые могут предшествовать диагностике AKI (субклиническое AKI ), также могут вызывать воспаление и иметь отдаленные последствия [3]. Эти последствия могут варьироваться в зависимости от основной причины ОПП.
В настоящей статье предлагается нефроцентрический взгляд на влияние AKI на функцию основных органов (Fig. 1). Хотя AKI может поражать почти каждый орган в организме, в этом обзоре основное внимание будет уделено наиболее задокументированным и клинически значимым взаимодействиям.
AKI и иммунная система
Клинические данные свидетельствуют о связи между AKI и последующим нарушением регуляции иммунной системы, что приводит, в частности, к повышенному риску сепсиса и перехода от AKI к хронической болезни почек (CKD ) [3]. Как молекулярные, так и клеточные эффекторы могут играть роль в воспалении, связанном с AKI . Во-первых, AKI оказывает сильное влияние на гомеостаз цитокинов. При системном воспалении потеря почечной функции может снизить клиренс цитокинов, что приведет к повышению уровня воспалительных молекул и дальнейшему усугублению системного воспаления [1]. В экспериментальных моделях уровень большой группа воспалительных цитокинов, включая IL6, IL8 и TNF-альфа, увеличивался во время AKI . При травме более высокие уровни IL6, IL8, IL1raи хемоаттрактантного белка-1 были обнаружены у пациентов с AKI по сравнению с пациентами без AKI [4].
Кроме того, предполагается, что клетки почечных канальцев также могут высвобождать воспалительные цитокины во время AKI [5]. Во-вторых, нарушение рекрутирования нейтрофилов, связанное с AKI , может влиять на воспалительную реакцию, подразумевая возможный противовоспалительный эффект, вызванный AKI Результаты экспериментального анализа свидетельствуют о нарушении свертывания и миграции нейтрофилов [6].
AKI и сердце
Кардиоренальный синдром (CRS ) определяет сложные двунаправленные взаимодействия между сердцем и почками, а CRS 3 типа определяет сердечную дисфункцию в результате AKI [7]. Патофизиологические механизмы, посредством которых AKI способствует развитию острой сердечной дисфункции, недостаточно известны. Некоторые экспериментальные данные свидетельствуют о том, что повреждение сердца может быть непосредственно вызвано медиаторами воспаления, окислительным стрессом и активацией нейроэндокринной системы в ранние сроки развития AKI. Среди физиологических нарушений, связанных с потерей почечной функции, особое значение имеет перегрузка жидкостью, поскольку она увеличивает преднагрузку и растягивает кардиомиоциты, тем самым снижая сократительную способность миокарда.
У пациентов с ацидемией накопленная кислота может изменять структуру белка и нарушать нормальную функцию, что приводит к снижению сократительной способности миокарда из-за измененной экспрессии β-рецепторов и неправильного обращения с внутриклеточным кальцием. Нарушения электролитного баланса, связанные с AKI , могут вызывать сердечные аритмии, уменьшая сердечный выброс и подвергая пациентов риску тромботических явлений.Кроме того, при AKI активируются как ренин-ангиотензин-альдостероновая, так и центральная нервная системы, что приводит к увеличению задержки жидкости, увеличению пред- и постнагрузки [7]. Что касается уремии, хотя мало что известно о влиянии уремических токсинов на сердечную функцию при AKI , связь с токсическим вличнием на функцию сердца и сосудов была продемонстрирована при CKD [2]. Кроме того, AKI способствует изменению фармакокинетики и фармакодинамики сердечно-сосудистых препаратов.
AKI и легкие
Влияние AKI на легкие может быть связано с иммуноопосредованными эффектами, задержкой жидкости и нарушениями электролитного баланса [8]. На животных моделях почечной ишемически-реперфузионного повреждения (IRI) сообщалось об изменениях в инфламмасоме легких, а также в метаболоме легких, отражающих окислительный стресс и истощение энергии [9]. Кроме того, в этих моделях наблюдалось снижение легочной экспрессии ENaC, Na, K-АТФазы и аквапорина-5, что влияло на резорбцию альвеолярной жидкости [10]. Кроме того, задержка жидкости увеличивает количество внесосудистой воды в легких и, следовательно, содержание альвеолярной жидкости, что приводит к нарушению оксигенации. Клинические исследования продемонстрировали связь между AKI и пневмонией и тяжестью сепсиса. При AKI время на ИВЛ и смертность увеличиваются у больных с острым респираторным дистресс-синдромом [8]. также метаболический ацидоз требует увеличения дыхательного объема для компенсации дыхания, тем самым увеличивая риск как самоповреждения, так и повреждения легких, вызванного вентилятором. Это может иметь особое значение у пациентов с хронической обструктивной болезнью легких, для которых необходима почечная компенсация респираторного ацидоза.
AKI и кишечник
Поскольку ЖКТ содержит сотни видов микробиоты и более половины иммунных клеток организма, он играет центральную роль в гомеостазе. В экспериментальных животных моделях IRI кишечная микробиота последовательно изменялась в течение 24 часов. Этот дисбиоз уменьшил количество продуктов бактериального брожения, содержащихся в просвете, таких как короткоцепочечные жирные кислоты (SCFA), которые играют ключевую роль в уменьшении воспаления и перекрестных взаимодействий кишечник-орган, тем самым усиливая воспаление.Экспериментальные модели AKI также демонстрируют инфильтрацию и активацию клеток врожденного иммунитета в стенках кишечника, где лимфоциты принимают более воспалительный фенотип. Предполагается, что перегрузка жидкостью и уремия, связанные с AKI , могут модифицировать плотные контакты эпителиальных клеток, увеличивая проницаемость кишечной стенки [3].
В целом дисбактериоз микробиоты, отек стенки и воспаление являются основными последствиями AKI в плане влияния на функцию и проницаемость кишечника. Последующая транслокация патогенов и эндотоксинов в кровоток еще больше усиливает системное воспаление и повреждение почек. Дисбиоз, вызванный AKI , также может играть ключевую роль в переходе к CKD . Среди других зарегистрированных долгосрочных эффектов — повышенный риск кровотечения из верхних отделов желудочно-кишечного тракта после CKD , требующей заместительной почечной терапии (RRT ) [11]. Недавние инновационные подходы, нацеленные на микробиоту, направлены на модулирование воспаления, связанного с AKI .
AKI и мозг
Хорошо известно, что энцефалопатия является основным симптомом уремии, частично коррелирующим с уровнем азота мочевины в крови. Хотя полноценная уремия является редким явлением при успешно контролируемом AKI , накопление даже низких уровней уремических токсинов может по-прежнему нарушать когнитивную функцию у пациентов в критическом состоянии, более выраженное и быстро прогрессирующее, чем у пациентов с CKD [ 2]. У взрослых пациентов в критическом состоянии AKI 2 и 3 стадии по KDIGO связаны с почти двукратным увеличением риска делирия и комы [12]. У недоношенных детей AKI связано с инсультом головного мозга, особенно в мозжечке [13]. AKI -ассоциированная энцефалопатия может быть результатом повышенных уровней системных цитокинов, а также повышенного окислительного стресса в головном мозге, который дополнительно усиливается стимуляцией почечных симпатических афферентных нервов. Эти факторы также могут играть роль в изменениях гематоэнцефалического барьера, наблюдаемых в экспериментах на животных, эффект которых может усугубляться изменением экспрессии аквапоринов 1 и 4. Наконец, необходимо учитывать измененный метаболизм препаратов центрального действия.
AKI и печень
В отличие от гепаторенального синдрома, влияние AKI на функцию печени в значительной степени остается неизвестным. Модели на мелких животных демонстрируют гистопатологические изменения печени после ренального IRI почки или нефрэктомии.Основными признаками являются инфильтрация тканей воспалительными клетками и медиаторами, такими как TNF-α и IL-6, повреждение и некроз гепатоцитов и окислительный стресс [14]. Недавно после ишемического IRI у свиней наблюдалось преходящее повышение активности печеночных ферментов, таких как аминотрансферазы. Интересно, что изменения в ткани печени были незначительными и полностью исчезли через 5 недель, что свидетельствует об умеренном и преходящем повреждении [15]. Однако AKI остается клинически значимым для функции печени. Потеря почечной функции может повлиять на ферментную систему цитохрома печени посредством метаболического ацидоза и уремии, что приводит к нарушению выведения лекарственного средства. Застой в печени и ее недостаточность также могут быть вторичными по отношению к скоплению жидкости при олигоанурическом AKI [14].
AKI воздействует на отдаленные органы различными путями, такими как воспаление, опосредованное клеточными и молекулярными эффекторами, метаболические и гемодинамические изменения и нейрогормональная система. Когда поражаются почки, страдают и отдаленные органы, что, вероятно, способствует смертности, связанным с AKI .Вмешательства, направленные на смягчение перекрестных взаимодействий между почками и органами, могут рассматриваться для улучшения результатов лечения пациентов. Это, однако, требует лучшего понимания взаимодействия между органами, которые на сегодняшний день основаны в основном на животных моделях или у пациентов с CKD и не учитывают причины и тяжесть AKI . Повреждения, вызванные потерей функции почек или повреждением самой почки, также необходимо различать.
References
1. Andres-Hernando A, Dursun B, Altmann C, Ahuja N, He Z, Bhargava R,
Edelstein CE, Jani A, Hoke TS, Klein C, Faubel S (2012) Cytokine production
increases and cytokine clearance decreases in mice with bilateral nephrectomy. Nephrol Dial Transplant Off Publ Eur Dial Transplant Assoc Eur Renal Assoc 27:4339–4347
2. Neirynck N, Vanholder R, Schepers E, Eloot S, Pletinck A, Glorieux G (2013)
An update on uremic toxins. Int Urol Nephrol 45:139–150
3. Andrade-Oliveira V, Foresto-Neto O, Watanabe IKM, Zatz R, Camara NOS
(2019) Inflammation in renal diseases: new and old players. Front Pharmacol
10:1192
4. Bihorac A, Baslanti TO, Cuenca AG, Hobson CE, Ang D, Efron PA, Maier
RV, Moore FA, Moldawer LL (2013) Acute kidney injury is associated with early cytokine changes after trauma. J Trauma Acute Care Surg 74:1005–1013
5. Bijuklic K, Jennings P, Kountchev J, Hasslacher J, Aydin S, Sturn D, Pfaller
W, Patsch JR, Joannidis M (2007) Migration of leukocytes across an endothelium-epithelium bilayer as a model of renal interstitial inflammation. Am J Physiol Cell Physiol 293:C486-492
6. Rossaint J, Spelten O, Kassens N, Mueller H, Van Aken HK, Singbartl K,
Zarbock A (2011) Acute loss of renal function attenuates slow leukocyte
rolling and transmigration by interfering with intracellular signaling.Kidney Int 80:493–503
7. Ronco C, Haapio M, House AA, Anavekar N, Bellomo R (2008) Cardiorenal
syndrome. J Am Coll Cardiol 52:1527–1539
8. Joannidis M, Forni LG, Klein SJ, Honore PM, Kashani K, Ostermann M,
Prowle J, Bagshaw SM, Cantaluppi V, Darmon M, Ding X, Fuhrmann V,
Hoste E, Husain-Syed F, Lubnow M, Maggiorini M, Meersch M, Murray
PT, Ricci Z, Singbartl K, Staudinger T, Welte T, Ronco C, Kellum JA (2020)
Lung-kidney interactions in critically ill patients: consensus report of the
Acute Disease Quality Initiative (ADQI) 21 Workgroup. Intensive Care Med
46:654–672
9. Ambruso SL, Gil HW, Fox B, Park B, Altmann C, Bagchi RA, Baker PR 2nd,
Reisz JA, Faubel S (2021) Lung metabolomics after ischemic acute kidney
injury reveals increased oxidative stress, altered energy production, and ATP depletion. Am J Physiol Lung Cell Mol Physiol 321:L50-l64
10. Rabb H, Wang Z, Nemoto T, Hotchkiss J, Yokota N, Soleimani M (2003)
Acute renal failure leads to dysregulation of lung salt and water channels.
Kidney Int 63:600–606
11. Wu PC, Wu CJ, Lin CJ, Wu VC (2015) Long-term risk of upper gastrointestinal hemorrhage after advanced AKI. Clin J Am Soc Nephrol CJASN
10:353–362
12. Siew ED, Fissell WH, Tripp CM, Blume JD, Wilson MD, Clark AJ, Vincz AJ, Ely EW, Pandharipande PP, Girard TD (2017) Acute Kidney Injury as a risk factor
for delirium and coma during critical illness. Am J Respir Crit Care Med 195: 1597–1607
13. Al-Mouqdad MM, Jamjoom DZ, Abdalgader AT, Ameen WS, Khalil TM,
Asfour YS, Al-Anazi MR, Asfour SS (2022) Association between acute kidney
injury and brain injury on term-equivalent age brain magnetic resonance
imaging in very preterm infants. Pediatr Nephrol 37(12):3235–3242
14. Bonavia A, Stiles N (2022) Renohepatic crosstalk: a review of the effects of
acute kidney injury on the liver. Nephrol Dial Transplant Off Publ Eur Dial
Transplant Assoc Eur Renal Assoc 37:1218–1228
15. Gardner DS, De Brot S, Dunford LJ, Grau-Roma L, Welham SJ, Fallman R,
O’Sullivan SE, Oh W, Devonald MA (2016) Remote effects of acute kidney
injury in a porcine model. Am J Physiol Renal Physiol 310:F259-271
[~DETAIL_TEXT] =>
Intensive Care Med 2022 https://doi.org/10.1007/s00134-022-06925-5
When the kidneys hurt, the other organs suffer
Celine Monard, Melanie Meersch‑Dini and Michael Joannidis
Из-за межорганных взаимодействий, которые являются неотъемлемой частью биологии человека, поврежденный орган обычно ставит под угрозу другие органы у пациентов в критическом состоянии. Острая почечная недостаточность (AKI ) характеризуется резким снижением скорости клубочковой фильтрации, диагностируемым либо по повышению уровня креатинина в сыворотке крови, либо по развитию олигурии, что отражено в диагностических критериях рекомендаций Kidney Disease Improving Global Outcomes (KDIGO). AKI приводит к задержке жидкости, нарушению электролитного баланса, метаболическому ацидозу и изменению фармакокинетики лекарств. Клиренс медиаторов воспаления также снижается, что приводит к значительному увеличению провоспалительной нагрузки [1]. Это, в сочетании с накоплением уремических токсинов, способствует повреждению эндотелия и повышению проницаемости сосудов [2]. В дополнение к потере функции почек стресс и/или повреждение почек, которые могут предшествовать диагностике AKI (субклиническое AKI ), также могут вызывать воспаление и иметь отдаленные последствия [3]. Эти последствия могут варьироваться в зависимости от основной причины ОПП.
В настоящей статье предлагается нефроцентрический взгляд на влияние AKI на функцию основных органов (Fig. 1). Хотя AKI может поражать почти каждый орган в организме, в этом обзоре основное внимание будет уделено наиболее задокументированным и клинически значимым взаимодействиям.

AKI и иммунная система
Клинические данные свидетельствуют о связи между AKI и последующим нарушением регуляции иммунной системы, что приводит, в частности, к повышенному риску сепсиса и перехода от AKI к хронической болезни почек (CKD ) [3]. Как молекулярные, так и клеточные эффекторы могут играть роль в воспалении, связанном с AKI . Во-первых, AKI оказывает сильное влияние на гомеостаз цитокинов. При системном воспалении потеря почечной функции может снизить клиренс цитокинов, что приведет к повышению уровня воспалительных молекул и дальнейшему усугублению системного воспаления [1]. В экспериментальных моделях уровень большой группа воспалительных цитокинов, включая IL6, IL8 и TNF-альфа, увеличивался во время AKI . При травме более высокие уровни IL6, IL8, IL1raи хемоаттрактантного белка-1 были обнаружены у пациентов с AKI по сравнению с пациентами без AKI [4].
Кроме того, предполагается, что клетки почечных канальцев также могут высвобождать воспалительные цитокины во время AKI [5]. Во-вторых, нарушение рекрутирования нейтрофилов, связанное с AKI , может влиять на воспалительную реакцию, подразумевая возможный противовоспалительный эффект, вызванный AKI Результаты экспериментального анализа свидетельствуют о нарушении свертывания и миграции нейтрофилов [6].
AKI и сердце
Кардиоренальный синдром (CRS ) определяет сложные двунаправленные взаимодействия между сердцем и почками, а CRS 3 типа определяет сердечную дисфункцию в результате AKI [7]. Патофизиологические механизмы, посредством которых AKI способствует развитию острой сердечной дисфункции, недостаточно известны. Некоторые экспериментальные данные свидетельствуют о том, что повреждение сердца может быть непосредственно вызвано медиаторами воспаления, окислительным стрессом и активацией нейроэндокринной системы в ранние сроки развития AKI. Среди физиологических нарушений, связанных с потерей почечной функции, особое значение имеет перегрузка жидкостью, поскольку она увеличивает преднагрузку и растягивает кардиомиоциты, тем самым снижая сократительную способность миокарда.
У пациентов с ацидемией накопленная кислота может изменять структуру белка и нарушать нормальную функцию, что приводит к снижению сократительной способности миокарда из-за измененной экспрессии β-рецепторов и неправильного обращения с внутриклеточным кальцием. Нарушения электролитного баланса, связанные с AKI , могут вызывать сердечные аритмии, уменьшая сердечный выброс и подвергая пациентов риску тромботических явлений.Кроме того, при AKI активируются как ренин-ангиотензин-альдостероновая, так и центральная нервная системы, что приводит к увеличению задержки жидкости, увеличению пред- и постнагрузки [7]. Что касается уремии, хотя мало что известно о влиянии уремических токсинов на сердечную функцию при AKI , связь с токсическим вличнием на функцию сердца и сосудов была продемонстрирована при CKD [2]. Кроме того, AKI способствует изменению фармакокинетики и фармакодинамики сердечно-сосудистых препаратов.
AKI и легкие
Влияние AKI на легкие может быть связано с иммуноопосредованными эффектами, задержкой жидкости и нарушениями электролитного баланса [8]. На животных моделях почечной ишемически-реперфузионного повреждения (IRI) сообщалось об изменениях в инфламмасоме легких, а также в метаболоме легких, отражающих окислительный стресс и истощение энергии [9]. Кроме того, в этих моделях наблюдалось снижение легочной экспрессии ENaC, Na, K-АТФазы и аквапорина-5, что влияло на резорбцию альвеолярной жидкости [10]. Кроме того, задержка жидкости увеличивает количество внесосудистой воды в легких и, следовательно, содержание альвеолярной жидкости, что приводит к нарушению оксигенации. Клинические исследования продемонстрировали связь между AKI и пневмонией и тяжестью сепсиса. При AKI время на ИВЛ и смертность увеличиваются у больных с острым респираторным дистресс-синдромом [8]. также метаболический ацидоз требует увеличения дыхательного объема для компенсации дыхания, тем самым увеличивая риск как самоповреждения, так и повреждения легких, вызванного вентилятором. Это может иметь особое значение у пациентов с хронической обструктивной болезнью легких, для которых необходима почечная компенсация респираторного ацидоза.
AKI и кишечник
Поскольку ЖКТ содержит сотни видов микробиоты и более половины иммунных клеток организма, он играет центральную роль в гомеостазе. В экспериментальных животных моделях IRI кишечная микробиота последовательно изменялась в течение 24 часов. Этот дисбиоз уменьшил количество продуктов бактериального брожения, содержащихся в просвете, таких как короткоцепочечные жирные кислоты (SCFA), которые играют ключевую роль в уменьшении воспаления и перекрестных взаимодействий кишечник-орган, тем самым усиливая воспаление.Экспериментальные модели AKI также демонстрируют инфильтрацию и активацию клеток врожденного иммунитета в стенках кишечника, где лимфоциты принимают более воспалительный фенотип. Предполагается, что перегрузка жидкостью и уремия, связанные с AKI , могут модифицировать плотные контакты эпителиальных клеток, увеличивая проницаемость кишечной стенки [3].
В целом дисбактериоз микробиоты, отек стенки и воспаление являются основными последствиями AKI в плане влияния на функцию и проницаемость кишечника. Последующая транслокация патогенов и эндотоксинов в кровоток еще больше усиливает системное воспаление и повреждение почек. Дисбиоз, вызванный AKI , также может играть ключевую роль в переходе к CKD . Среди других зарегистрированных долгосрочных эффектов — повышенный риск кровотечения из верхних отделов желудочно-кишечного тракта после CKD , требующей заместительной почечной терапии (RRT ) [11]. Недавние инновационные подходы, нацеленные на микробиоту, направлены на модулирование воспаления, связанного с AKI .
AKI и мозг
Хорошо известно, что энцефалопатия является основным симптомом уремии, частично коррелирующим с уровнем азота мочевины в крови. Хотя полноценная уремия является редким явлением при успешно контролируемом AKI , накопление даже низких уровней уремических токсинов может по-прежнему нарушать когнитивную функцию у пациентов в критическом состоянии, более выраженное и быстро прогрессирующее, чем у пациентов с CKD [ 2]. У взрослых пациентов в критическом состоянии AKI 2 и 3 стадии по KDIGO связаны с почти двукратным увеличением риска делирия и комы [12]. У недоношенных детей AKI связано с инсультом головного мозга, особенно в мозжечке [13]. AKI -ассоциированная энцефалопатия может быть результатом повышенных уровней системных цитокинов, а также повышенного окислительного стресса в головном мозге, который дополнительно усиливается стимуляцией почечных симпатических афферентных нервов. Эти факторы также могут играть роль в изменениях гематоэнцефалического барьера, наблюдаемых в экспериментах на животных, эффект которых может усугубляться изменением экспрессии аквапоринов 1 и 4. Наконец, необходимо учитывать измененный метаболизм препаратов центрального действия.
AKI и печень
В отличие от гепаторенального синдрома, влияние AKI на функцию печени в значительной степени остается неизвестным. Модели на мелких животных демонстрируют гистопатологические изменения печени после ренального IRI почки или нефрэктомии.Основными признаками являются инфильтрация тканей воспалительными клетками и медиаторами, такими как TNF-α и IL-6, повреждение и некроз гепатоцитов и окислительный стресс [14]. Недавно после ишемического IRI у свиней наблюдалось преходящее повышение активности печеночных ферментов, таких как аминотрансферазы. Интересно, что изменения в ткани печени были незначительными и полностью исчезли через 5 недель, что свидетельствует об умеренном и преходящем повреждении [15]. Однако AKI остается клинически значимым для функции печени. Потеря почечной функции может повлиять на ферментную систему цитохрома печени посредством метаболического ацидоза и уремии, что приводит к нарушению выведения лекарственного средства. Застой в печени и ее недостаточность также могут быть вторичными по отношению к скоплению жидкости при олигоанурическом AKI [14].
AKI воздействует на отдаленные органы различными путями, такими как воспаление, опосредованное клеточными и молекулярными эффекторами, метаболические и гемодинамические изменения и нейрогормональная система. Когда поражаются почки, страдают и отдаленные органы, что, вероятно, способствует смертности, связанным с AKI .Вмешательства, направленные на смягчение перекрестных взаимодействий между почками и органами, могут рассматриваться для улучшения результатов лечения пациентов. Это, однако, требует лучшего понимания взаимодействия между органами, которые на сегодняшний день основаны в основном на животных моделях или у пациентов с CKD и не учитывают причины и тяжесть AKI . Повреждения, вызванные потерей функции почек или повреждением самой почки, также необходимо различать.
References
1. Andres-Hernando A, Dursun B, Altmann C, Ahuja N, He Z, Bhargava R,
Edelstein CE, Jani A, Hoke TS, Klein C, Faubel S (2012) Cytokine production
increases and cytokine clearance decreases in mice with bilateral nephrectomy. Nephrol Dial Transplant Off Publ Eur Dial Transplant Assoc Eur Renal Assoc 27:4339–4347
2. Neirynck N, Vanholder R, Schepers E, Eloot S, Pletinck A, Glorieux G (2013)
An update on uremic toxins. Int Urol Nephrol 45:139–150
3. Andrade-Oliveira V, Foresto-Neto O, Watanabe IKM, Zatz R, Camara NOS
(2019) Inflammation in renal diseases: new and old players. Front Pharmacol
10:1192
4. Bihorac A, Baslanti TO, Cuenca AG, Hobson CE, Ang D, Efron PA, Maier
RV, Moore FA, Moldawer LL (2013) Acute kidney injury is associated with early cytokine changes after trauma. J Trauma Acute Care Surg 74:1005–1013
5. Bijuklic K, Jennings P, Kountchev J, Hasslacher J, Aydin S, Sturn D, Pfaller
W, Patsch JR, Joannidis M (2007) Migration of leukocytes across an endothelium-epithelium bilayer as a model of renal interstitial inflammation. Am J Physiol Cell Physiol 293:C486-492
6. Rossaint J, Spelten O, Kassens N, Mueller H, Van Aken HK, Singbartl K,
Zarbock A (2011) Acute loss of renal function attenuates slow leukocyte
rolling and transmigration by interfering with intracellular signaling.Kidney Int 80:493–503
7. Ronco C, Haapio M, House AA, Anavekar N, Bellomo R (2008) Cardiorenal
syndrome. J Am Coll Cardiol 52:1527–1539
8. Joannidis M, Forni LG, Klein SJ, Honore PM, Kashani K, Ostermann M,
Prowle J, Bagshaw SM, Cantaluppi V, Darmon M, Ding X, Fuhrmann V,
Hoste E, Husain-Syed F, Lubnow M, Maggiorini M, Meersch M, Murray
PT, Ricci Z, Singbartl K, Staudinger T, Welte T, Ronco C, Kellum JA (2020)
Lung-kidney interactions in critically ill patients: consensus report of the
Acute Disease Quality Initiative (ADQI) 21 Workgroup. Intensive Care Med
46:654–672
9. Ambruso SL, Gil HW, Fox B, Park B, Altmann C, Bagchi RA, Baker PR 2nd,
Reisz JA, Faubel S (2021) Lung metabolomics after ischemic acute kidney
injury reveals increased oxidative stress, altered energy production, and ATP depletion. Am J Physiol Lung Cell Mol Physiol 321:L50-l64
10. Rabb H, Wang Z, Nemoto T, Hotchkiss J, Yokota N, Soleimani M (2003)
Acute renal failure leads to dysregulation of lung salt and water channels.
Kidney Int 63:600–606
11. Wu PC, Wu CJ, Lin CJ, Wu VC (2015) Long-term risk of upper gastrointestinal hemorrhage after advanced AKI. Clin J Am Soc Nephrol CJASN
10:353–362
12. Siew ED, Fissell WH, Tripp CM, Blume JD, Wilson MD, Clark AJ, Vincz AJ, Ely EW, Pandharipande PP, Girard TD (2017) Acute Kidney Injury as a risk factor
for delirium and coma during critical illness. Am J Respir Crit Care Med 195: 1597–1607
13. Al-Mouqdad MM, Jamjoom DZ, Abdalgader AT, Ameen WS, Khalil TM,
Asfour YS, Al-Anazi MR, Asfour SS (2022) Association between acute kidney
injury and brain injury on term-equivalent age brain magnetic resonance
imaging in very preterm infants. Pediatr Nephrol 37(12):3235–3242
14. Bonavia A, Stiles N (2022) Renohepatic crosstalk: a review of the effects of
acute kidney injury on the liver. Nephrol Dial Transplant Off Publ Eur Dial
Transplant Assoc Eur Renal Assoc 37:1218–1228
15. Gardner DS, De Brot S, Dunford LJ, Grau-Roma L, Welham SJ, Fallman R,
O’Sullivan SE, Oh W, Devonald MA (2016) Remote effects of acute kidney
injury in a porcine model. Am J Physiol Renal Physiol 310:F259-271
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 12.06.2024
[~DATE_ACTIVE_FROM] => 12.06.2024
[ACTIVE_FROM_X] => 2024-06-12 00:00:00
[~ACTIVE_FROM_X] => 2024-06-12 00:00:00
[ACTIVE_FROM] => 12.06.2024
[~ACTIVE_FROM] => 12.06.2024
[SHOW_COUNTER] => 147
[~SHOW_COUNTER] => 147
[ID] => 8442
[~ID] => 8442
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 03.06.2024 13:44:14
[~TIMESTAMP_X] => 03.06.2024 13:44:14
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/kogda-povrezhdeny-pochki-stradayut-drugie-organy/
[~DETAIL_PAGE_URL] => /library/articles/kogda-povrezhdeny-pochki-stradayut-drugie-organy/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => kogda-povrezhdeny-pochki-stradayut-drugie-organy
[~CODE] => kogda-povrezhdeny-pochki-stradayut-drugie-organy
[EXTERNAL_ID] => 8442
[~EXTERNAL_ID] => 8442
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 12 июня 2024
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Когда повреждены почки, страдают другие органы
[PREVIEW_PICTURE] => Array
(
[ID] => 5661
[TIMESTAMP_X] => 03.06.2024 13:44:14
[MODULE_ID] => iblock
[HEIGHT] => 5376
[WIDTH] => 9408
[FILE_SIZE] => 15645806
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/9ad/40w2xemagaflaumceuk07n1l0da9rhw5
[FILE_NAME] => human-kidneys-flat-creative-illustration-generative-ai.jpg
[ORIGINAL_NAME] => human-kidneys-flat-creative-illustration-generative-ai.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 3a72314a341dd801136c464b094b6482
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/9ad/40w2xemagaflaumceuk07n1l0da9rhw5/human-kidneys-flat-creative-illustration-generative-ai.jpg
[UNSAFE_SRC] => /upload/iblock/9ad/40w2xemagaflaumceuk07n1l0da9rhw5/human-kidneys-flat-creative-illustration-generative-ai.jpg
[SAFE_SRC] => /upload/iblock/9ad/40w2xemagaflaumceuk07n1l0da9rhw5/human-kidneys-flat-creative-illustration-generative-ai.jpg
[ALT] => Когда повреждены почки, страдают другие органы
[TITLE] => Когда повреждены почки, страдают другие органы
)
[DETAIL_TEXT] =>
Intensive Care Med 2022 https://doi.org/10.1007/s00134-022-06925-5
When the kidneys hurt, the other organs suffer
Celine Monard, Melanie Meersch‑Dini and Michael Joannidis
Из-за межорганных взаимодействий, которые являются неотъемлемой частью биологии человека, поврежденный орган обычно ставит под угрозу другие органы у пациентов в критическом состоянии. Острая почечная недостаточность (AKI ) характеризуется резким снижением скорости клубочковой фильтрации, диагностируемым либо по повышению уровня креатинина в сыворотке крови, либо по развитию олигурии, что отражено в диагностических критериях рекомендаций Kidney Disease Improving Global Outcomes (KDIGO). AKI приводит к задержке жидкости, нарушению электролитного баланса, метаболическому ацидозу и изменению фармакокинетики лекарств. Клиренс медиаторов воспаления также снижается, что приводит к значительному увеличению провоспалительной нагрузки [1]. Это, в сочетании с накоплением уремических токсинов, способствует повреждению эндотелия и повышению проницаемости сосудов [2]. В дополнение к потере функции почек стресс и/или повреждение почек, которые могут предшествовать диагностике AKI (субклиническое AKI ), также могут вызывать воспаление и иметь отдаленные последствия [3]. Эти последствия могут варьироваться в зависимости от основной причины ОПП.
В настоящей статье предлагается нефроцентрический взгляд на влияние AKI на функцию основных органов (Fig. 1). Хотя AKI может поражать почти каждый орган в организме, в этом обзоре основное внимание будет уделено наиболее задокументированным и клинически значимым взаимодействиям.

AKI и иммунная система
Клинические данные свидетельствуют о связи между AKI и последующим нарушением регуляции иммунной системы, что приводит, в частности, к повышенному риску сепсиса и перехода от AKI к хронической болезни почек (CKD ) [3]. Как молекулярные, так и клеточные эффекторы могут играть роль в воспалении, связанном с AKI . Во-первых, AKI оказывает сильное влияние на гомеостаз цитокинов. При системном воспалении потеря почечной функции может снизить клиренс цитокинов, что приведет к повышению уровня воспалительных молекул и дальнейшему усугублению системного воспаления [1]. В экспериментальных моделях уровень большой группа воспалительных цитокинов, включая IL6, IL8 и TNF-альфа, увеличивался во время AKI . При травме более высокие уровни IL6, IL8, IL1raи хемоаттрактантного белка-1 были обнаружены у пациентов с AKI по сравнению с пациентами без AKI [4].
Кроме того, предполагается, что клетки почечных канальцев также могут высвобождать воспалительные цитокины во время AKI [5]. Во-вторых, нарушение рекрутирования нейтрофилов, связанное с AKI , может влиять на воспалительную реакцию, подразумевая возможный противовоспалительный эффект, вызванный AKI Результаты экспериментального анализа свидетельствуют о нарушении свертывания и миграции нейтрофилов [6].
AKI и сердце
Кардиоренальный синдром (CRS ) определяет сложные двунаправленные взаимодействия между сердцем и почками, а CRS 3 типа определяет сердечную дисфункцию в результате AKI [7]. Патофизиологические механизмы, посредством которых AKI способствует развитию острой сердечной дисфункции, недостаточно известны. Некоторые экспериментальные данные свидетельствуют о том, что повреждение сердца может быть непосредственно вызвано медиаторами воспаления, окислительным стрессом и активацией нейроэндокринной системы в ранние сроки развития AKI. Среди физиологических нарушений, связанных с потерей почечной функции, особое значение имеет перегрузка жидкостью, поскольку она увеличивает преднагрузку и растягивает кардиомиоциты, тем самым снижая сократительную способность миокарда.
У пациентов с ацидемией накопленная кислота может изменять структуру белка и нарушать нормальную функцию, что приводит к снижению сократительной способности миокарда из-за измененной экспрессии β-рецепторов и неправильного обращения с внутриклеточным кальцием. Нарушения электролитного баланса, связанные с AKI , могут вызывать сердечные аритмии, уменьшая сердечный выброс и подвергая пациентов риску тромботических явлений.Кроме того, при AKI активируются как ренин-ангиотензин-альдостероновая, так и центральная нервная системы, что приводит к увеличению задержки жидкости, увеличению пред- и постнагрузки [7]. Что касается уремии, хотя мало что известно о влиянии уремических токсинов на сердечную функцию при AKI , связь с токсическим вличнием на функцию сердца и сосудов была продемонстрирована при CKD [2]. Кроме того, AKI способствует изменению фармакокинетики и фармакодинамики сердечно-сосудистых препаратов.
AKI и легкие
Влияние AKI на легкие может быть связано с иммуноопосредованными эффектами, задержкой жидкости и нарушениями электролитного баланса [8]. На животных моделях почечной ишемически-реперфузионного повреждения (IRI) сообщалось об изменениях в инфламмасоме легких, а также в метаболоме легких, отражающих окислительный стресс и истощение энергии [9]. Кроме того, в этих моделях наблюдалось снижение легочной экспрессии ENaC, Na, K-АТФазы и аквапорина-5, что влияло на резорбцию альвеолярной жидкости [10]. Кроме того, задержка жидкости увеличивает количество внесосудистой воды в легких и, следовательно, содержание альвеолярной жидкости, что приводит к нарушению оксигенации. Клинические исследования продемонстрировали связь между AKI и пневмонией и тяжестью сепсиса. При AKI время на ИВЛ и смертность увеличиваются у больных с острым респираторным дистресс-синдромом [8]. также метаболический ацидоз требует увеличения дыхательного объема для компенсации дыхания, тем самым увеличивая риск как самоповреждения, так и повреждения легких, вызванного вентилятором. Это может иметь особое значение у пациентов с хронической обструктивной болезнью легких, для которых необходима почечная компенсация респираторного ацидоза.
AKI и кишечник
Поскольку ЖКТ содержит сотни видов микробиоты и более половины иммунных клеток организма, он играет центральную роль в гомеостазе. В экспериментальных животных моделях IRI кишечная микробиота последовательно изменялась в течение 24 часов. Этот дисбиоз уменьшил количество продуктов бактериального брожения, содержащихся в просвете, таких как короткоцепочечные жирные кислоты (SCFA), которые играют ключевую роль в уменьшении воспаления и перекрестных взаимодействий кишечник-орган, тем самым усиливая воспаление.Экспериментальные модели AKI также демонстрируют инфильтрацию и активацию клеток врожденного иммунитета в стенках кишечника, где лимфоциты принимают более воспалительный фенотип. Предполагается, что перегрузка жидкостью и уремия, связанные с AKI , могут модифицировать плотные контакты эпителиальных клеток, увеличивая проницаемость кишечной стенки [3].
В целом дисбактериоз микробиоты, отек стенки и воспаление являются основными последствиями AKI в плане влияния на функцию и проницаемость кишечника. Последующая транслокация патогенов и эндотоксинов в кровоток еще больше усиливает системное воспаление и повреждение почек. Дисбиоз, вызванный AKI , также может играть ключевую роль в переходе к CKD . Среди других зарегистрированных долгосрочных эффектов — повышенный риск кровотечения из верхних отделов желудочно-кишечного тракта после CKD , требующей заместительной почечной терапии (RRT ) [11]. Недавние инновационные подходы, нацеленные на микробиоту, направлены на модулирование воспаления, связанного с AKI .
AKI и мозг
Хорошо известно, что энцефалопатия является основным симптомом уремии, частично коррелирующим с уровнем азота мочевины в крови. Хотя полноценная уремия является редким явлением при успешно контролируемом AKI , накопление даже низких уровней уремических токсинов может по-прежнему нарушать когнитивную функцию у пациентов в критическом состоянии, более выраженное и быстро прогрессирующее, чем у пациентов с CKD [ 2]. У взрослых пациентов в критическом состоянии AKI 2 и 3 стадии по KDIGO связаны с почти двукратным увеличением риска делирия и комы [12]. У недоношенных детей AKI связано с инсультом головного мозга, особенно в мозжечке [13]. AKI -ассоциированная энцефалопатия может быть результатом повышенных уровней системных цитокинов, а также повышенного окислительного стресса в головном мозге, который дополнительно усиливается стимуляцией почечных симпатических афферентных нервов. Эти факторы также могут играть роль в изменениях гематоэнцефалического барьера, наблюдаемых в экспериментах на животных, эффект которых может усугубляться изменением экспрессии аквапоринов 1 и 4. Наконец, необходимо учитывать измененный метаболизм препаратов центрального действия.
AKI и печень
В отличие от гепаторенального синдрома, влияние AKI на функцию печени в значительной степени остается неизвестным. Модели на мелких животных демонстрируют гистопатологические изменения печени после ренального IRI почки или нефрэктомии.Основными признаками являются инфильтрация тканей воспалительными клетками и медиаторами, такими как TNF-α и IL-6, повреждение и некроз гепатоцитов и окислительный стресс [14]. Недавно после ишемического IRI у свиней наблюдалось преходящее повышение активности печеночных ферментов, таких как аминотрансферазы. Интересно, что изменения в ткани печени были незначительными и полностью исчезли через 5 недель, что свидетельствует об умеренном и преходящем повреждении [15]. Однако AKI остается клинически значимым для функции печени. Потеря почечной функции может повлиять на ферментную систему цитохрома печени посредством метаболического ацидоза и уремии, что приводит к нарушению выведения лекарственного средства. Застой в печени и ее недостаточность также могут быть вторичными по отношению к скоплению жидкости при олигоанурическом AKI [14].
AKI воздействует на отдаленные органы различными путями, такими как воспаление, опосредованное клеточными и молекулярными эффекторами, метаболические и гемодинамические изменения и нейрогормональная система. Когда поражаются почки, страдают и отдаленные органы, что, вероятно, способствует смертности, связанным с AKI .Вмешательства, направленные на смягчение перекрестных взаимодействий между почками и органами, могут рассматриваться для улучшения результатов лечения пациентов. Это, однако, требует лучшего понимания взаимодействия между органами, которые на сегодняшний день основаны в основном на животных моделях или у пациентов с CKD и не учитывают причины и тяжесть AKI . Повреждения, вызванные потерей функции почек или повреждением самой почки, также необходимо различать.
References
1. Andres-Hernando A, Dursun B, Altmann C, Ahuja N, He Z, Bhargava R,
Edelstein CE, Jani A, Hoke TS, Klein C, Faubel S (2012) Cytokine production
increases and cytokine clearance decreases in mice with bilateral nephrectomy. Nephrol Dial Transplant Off Publ Eur Dial Transplant Assoc Eur Renal Assoc 27:4339–4347
2. Neirynck N, Vanholder R, Schepers E, Eloot S, Pletinck A, Glorieux G (2013)
An update on uremic toxins. Int Urol Nephrol 45:139–150
3. Andrade-Oliveira V, Foresto-Neto O, Watanabe IKM, Zatz R, Camara NOS
(2019) Inflammation in renal diseases: new and old players. Front Pharmacol
10:1192
4. Bihorac A, Baslanti TO, Cuenca AG, Hobson CE, Ang D, Efron PA, Maier
RV, Moore FA, Moldawer LL (2013) Acute kidney injury is associated with early cytokine changes after trauma. J Trauma Acute Care Surg 74:1005–1013
5. Bijuklic K, Jennings P, Kountchev J, Hasslacher J, Aydin S, Sturn D, Pfaller
W, Patsch JR, Joannidis M (2007) Migration of leukocytes across an endothelium-epithelium bilayer as a model of renal interstitial inflammation. Am J Physiol Cell Physiol 293:C486-492
6. Rossaint J, Spelten O, Kassens N, Mueller H, Van Aken HK, Singbartl K,
Zarbock A (2011) Acute loss of renal function attenuates slow leukocyte
rolling and transmigration by interfering with intracellular signaling.Kidney Int 80:493–503
7. Ronco C, Haapio M, House AA, Anavekar N, Bellomo R (2008) Cardiorenal
syndrome. J Am Coll Cardiol 52:1527–1539
8. Joannidis M, Forni LG, Klein SJ, Honore PM, Kashani K, Ostermann M,
Prowle J, Bagshaw SM, Cantaluppi V, Darmon M, Ding X, Fuhrmann V,
Hoste E, Husain-Syed F, Lubnow M, Maggiorini M, Meersch M, Murray
PT, Ricci Z, Singbartl K, Staudinger T, Welte T, Ronco C, Kellum JA (2020)
Lung-kidney interactions in critically ill patients: consensus report of the
Acute Disease Quality Initiative (ADQI) 21 Workgroup. Intensive Care Med
46:654–672
9. Ambruso SL, Gil HW, Fox B, Park B, Altmann C, Bagchi RA, Baker PR 2nd,
Reisz JA, Faubel S (2021) Lung metabolomics after ischemic acute kidney
injury reveals increased oxidative stress, altered energy production, and ATP depletion. Am J Physiol Lung Cell Mol Physiol 321:L50-l64
10. Rabb H, Wang Z, Nemoto T, Hotchkiss J, Yokota N, Soleimani M (2003)
Acute renal failure leads to dysregulation of lung salt and water channels.
Kidney Int 63:600–606
11. Wu PC, Wu CJ, Lin CJ, Wu VC (2015) Long-term risk of upper gastrointestinal hemorrhage after advanced AKI. Clin J Am Soc Nephrol CJASN
10:353–362
12. Siew ED, Fissell WH, Tripp CM, Blume JD, Wilson MD, Clark AJ, Vincz AJ, Ely EW, Pandharipande PP, Girard TD (2017) Acute Kidney Injury as a risk factor
for delirium and coma during critical illness. Am J Respir Crit Care Med 195: 1597–1607
13. Al-Mouqdad MM, Jamjoom DZ, Abdalgader AT, Ameen WS, Khalil TM,
Asfour YS, Al-Anazi MR, Asfour SS (2022) Association between acute kidney
injury and brain injury on term-equivalent age brain magnetic resonance
imaging in very preterm infants. Pediatr Nephrol 37(12):3235–3242
14. Bonavia A, Stiles N (2022) Renohepatic crosstalk: a review of the effects of
acute kidney injury on the liver. Nephrol Dial Transplant Off Publ Eur Dial
Transplant Assoc Eur Renal Assoc 37:1218–1228
15. Gardner DS, De Brot S, Dunford LJ, Grau-Roma L, Welham SJ, Fallman R,
O’Sullivan SE, Oh W, Devonald MA (2016) Remote effects of acute kidney
injury in a porcine model. Am J Physiol Renal Physiol 310:F259-271
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 12.06.2024
[ACTIVE_FROM] => 12.06.2024
[SHOW_COUNTER] => 147
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2017-07-31 16:04:44
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829842
[VALUE] => Почки
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Почки
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2017-08-02 11:16:15
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829844
[VALUE] => Когда повреждены почки, страдают другие органы
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Когда повреждены почки, страдают другие органы
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2017-08-02 11:18:27
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829843
[VALUE] => Когда повреждены почки, страдают другие органы
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Когда повреждены почки, страдают другие органы
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829845
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2017-09-15 12:05:50
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2017-09-19 10:40:01
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2017-08-22 15:43:39
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829850
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2017-08-22 16:30:23
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2017-08-23 10:51:22
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2017-08-23 11:05:12
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829846
[1] => 829847
[2] => 829848
[3] => 829849
)
[VALUE] => Array
(
[0] => statia
[1] => Острое повреждение почек
[2] => poliorgannaya disfunktsiya
[3] => kriticheskiesostoyaniya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => Острое повреждение почек
[2] => poliorgannaya disfunktsiya
[3] => kriticheskiesostoyaniya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2017-10-12 14:43:36
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2018-05-11 11:01:14
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829845
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829850
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829846
[1] => 829847
[2] => 829848
[3] => 829849
)
[VALUE] => Array
(
[0] => statia
[1] => Острое повреждение почек
[2] => poliorgannaya disfunktsiya
[3] => kriticheskiesostoyaniya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => Острое повреждение почек
[2] => poliorgannaya disfunktsiya
[3] => kriticheskiesostoyaniya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Острое повреждение почек
[2] => Полиорганная дисфункция
[3] => Критические состояния
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 26.08.2022 14:38:28
[~TIMESTAMP_X] => 26.08.2022 14:38:28
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Когда повреждены почки, страдают другие органы
[BROWSER_TITLE] => Когда повреждены почки, страдают другие органы
[KEYWORDS] => Почки
[DESCRIPTION] => Когда повреждены почки, страдают другие органы
)
)
Когда повреждены почки, страдают другие органы
Intensive Care Med 2022 https://doi.org/10.1007/s00134-022-06925-5
When the kidneys hurt, the other organs suffer
Celine Monard, Melanie Meersch‑Dini and Michael Joannidis
Из-за межорганных взаимодействий, которые являются неотъемлемой частью биологии человека, поврежденный орган обычно ставит под угрозу другие органы у пациентов в критическом состоянии. Острая почечная недостаточность (AKI ) характеризуется резким снижением скорости клубочковой фильтрации, диагностируемым либо по повышению уровня креатинина в сыворотке крови, либо по развитию олигурии, что отражено в диагностических критериях рекомендаций Kidney Disease Improving Global Outcomes (KDIGO). AKI приводит к задержке жидкости, нарушению электролитного баланса, метаболическому ацидозу и изменению фармакокинетики лекарств. Клиренс медиаторов воспаления также снижается, что приводит к значительному увеличению провоспалительной нагрузки [1]. Это, в сочетании с накоплением уремических токсинов, способствует повреждению эндотелия и повышению проницаемости сосудов [2]. В дополнение к потере функции почек стресс и/или повреждение почек, которые могут предшествовать диагностике AKI (субклиническое AKI ), также могут вызывать воспаление и иметь отдаленные последствия [3]. Эти последствия могут варьироваться в зависимости от основной причины ОПП.
В настоящей статье предлагается нефроцентрический взгляд на влияние AKI на функцию основных органов (Fig. 1). Хотя AKI может поражать почти каждый орган в организме, в этом обзоре основное внимание будет уделено наиболее задокументированным и клинически значимым взаимодействиям.

AKI и иммунная система
Клинические данные свидетельствуют о связи между AKI и последующим нарушением регуляции иммунной системы, что приводит, в частности, к повышенному риску сепсиса и перехода от AKI к хронической болезни почек (CKD ) [3]. Как молекулярные, так и клеточные эффекторы могут играть роль в воспалении, связанном с AKI . Во-первых, AKI оказывает сильное влияние на гомеостаз цитокинов. При системном воспалении потеря почечной функции может снизить клиренс цитокинов, что приведет к повышению уровня воспалительных молекул и дальнейшему усугублению системного воспаления [1]. В экспериментальных моделях уровень большой группа воспалительных цитокинов, включая IL6, IL8 и TNF-альфа, увеличивался во время AKI . При травме более высокие уровни IL6, IL8, IL1raи хемоаттрактантного белка-1 были обнаружены у пациентов с AKI по сравнению с пациентами без AKI [4].
Кроме того, предполагается, что клетки почечных канальцев также могут высвобождать воспалительные цитокины во время AKI [5]. Во-вторых, нарушение рекрутирования нейтрофилов, связанное с AKI , может влиять на воспалительную реакцию, подразумевая возможный противовоспалительный эффект, вызванный AKI Результаты экспериментального анализа свидетельствуют о нарушении свертывания и миграции нейтрофилов [6].
AKI и сердце
Кардиоренальный синдром (CRS ) определяет сложные двунаправленные взаимодействия между сердцем и почками, а CRS 3 типа определяет сердечную дисфункцию в результате AKI [7]. Патофизиологические механизмы, посредством которых AKI способствует развитию острой сердечной дисфункции, недостаточно известны. Некоторые экспериментальные данные свидетельствуют о том, что повреждение сердца может быть непосредственно вызвано медиаторами воспаления, окислительным стрессом и активацией нейроэндокринной системы в ранние сроки развития AKI. Среди физиологических нарушений, связанных с потерей почечной функции, особое значение имеет перегрузка жидкостью, поскольку она увеличивает преднагрузку и растягивает кардиомиоциты, тем самым снижая сократительную способность миокарда.
У пациентов с ацидемией накопленная кислота может изменять структуру белка и нарушать нормальную функцию, что приводит к снижению сократительной способности миокарда из-за измененной экспрессии β-рецепторов и неправильного обращения с внутриклеточным кальцием. Нарушения электролитного баланса, связанные с AKI , могут вызывать сердечные аритмии, уменьшая сердечный выброс и подвергая пациентов риску тромботических явлений.Кроме того, при AKI активируются как ренин-ангиотензин-альдостероновая, так и центральная нервная системы, что приводит к увеличению задержки жидкости, увеличению пред- и постнагрузки [7]. Что касается уремии, хотя мало что известно о влиянии уремических токсинов на сердечную функцию при AKI , связь с токсическим вличнием на функцию сердца и сосудов была продемонстрирована при CKD [2]. Кроме того, AKI способствует изменению фармакокинетики и фармакодинамики сердечно-сосудистых препаратов.
AKI и легкие
Влияние AKI на легкие может быть связано с иммуноопосредованными эффектами, задержкой жидкости и нарушениями электролитного баланса [8]. На животных моделях почечной ишемически-реперфузионного повреждения (IRI) сообщалось об изменениях в инфламмасоме легких, а также в метаболоме легких, отражающих окислительный стресс и истощение энергии [9]. Кроме того, в этих моделях наблюдалось снижение легочной экспрессии ENaC, Na, K-АТФазы и аквапорина-5, что влияло на резорбцию альвеолярной жидкости [10]. Кроме того, задержка жидкости увеличивает количество внесосудистой воды в легких и, следовательно, содержание альвеолярной жидкости, что приводит к нарушению оксигенации. Клинические исследования продемонстрировали связь между AKI и пневмонией и тяжестью сепсиса. При AKI время на ИВЛ и смертность увеличиваются у больных с острым респираторным дистресс-синдромом [8]. также метаболический ацидоз требует увеличения дыхательного объема для компенсации дыхания, тем самым увеличивая риск как самоповреждения, так и повреждения легких, вызванного вентилятором. Это может иметь особое значение у пациентов с хронической обструктивной болезнью легких, для которых необходима почечная компенсация респираторного ацидоза.
AKI и кишечник
Поскольку ЖКТ содержит сотни видов микробиоты и более половины иммунных клеток организма, он играет центральную роль в гомеостазе. В экспериментальных животных моделях IRI кишечная микробиота последовательно изменялась в течение 24 часов. Этот дисбиоз уменьшил количество продуктов бактериального брожения, содержащихся в просвете, таких как короткоцепочечные жирные кислоты (SCFA), которые играют ключевую роль в уменьшении воспаления и перекрестных взаимодействий кишечник-орган, тем самым усиливая воспаление.Экспериментальные модели AKI также демонстрируют инфильтрацию и активацию клеток врожденного иммунитета в стенках кишечника, где лимфоциты принимают более воспалительный фенотип. Предполагается, что перегрузка жидкостью и уремия, связанные с AKI , могут модифицировать плотные контакты эпителиальных клеток, увеличивая проницаемость кишечной стенки [3].
В целом дисбактериоз микробиоты, отек стенки и воспаление являются основными последствиями AKI в плане влияния на функцию и проницаемость кишечника. Последующая транслокация патогенов и эндотоксинов в кровоток еще больше усиливает системное воспаление и повреждение почек. Дисбиоз, вызванный AKI , также может играть ключевую роль в переходе к CKD . Среди других зарегистрированных долгосрочных эффектов — повышенный риск кровотечения из верхних отделов желудочно-кишечного тракта после CKD , требующей заместительной почечной терапии (RRT ) [11]. Недавние инновационные подходы, нацеленные на микробиоту, направлены на модулирование воспаления, связанного с AKI .
AKI и мозг
Хорошо известно, что энцефалопатия является основным симптомом уремии, частично коррелирующим с уровнем азота мочевины в крови. Хотя полноценная уремия является редким явлением при успешно контролируемом AKI , накопление даже низких уровней уремических токсинов может по-прежнему нарушать когнитивную функцию у пациентов в критическом состоянии, более выраженное и быстро прогрессирующее, чем у пациентов с CKD [ 2]. У взрослых пациентов в критическом состоянии AKI 2 и 3 стадии по KDIGO связаны с почти двукратным увеличением риска делирия и комы [12]. У недоношенных детей AKI связано с инсультом головного мозга, особенно в мозжечке [13]. AKI -ассоциированная энцефалопатия может быть результатом повышенных уровней системных цитокинов, а также повышенного окислительного стресса в головном мозге, который дополнительно усиливается стимуляцией почечных симпатических афферентных нервов. Эти факторы также могут играть роль в изменениях гематоэнцефалического барьера, наблюдаемых в экспериментах на животных, эффект которых может усугубляться изменением экспрессии аквапоринов 1 и 4. Наконец, необходимо учитывать измененный метаболизм препаратов центрального действия.
AKI и печень
В отличие от гепаторенального синдрома, влияние AKI на функцию печени в значительной степени остается неизвестным. Модели на мелких животных демонстрируют гистопатологические изменения печени после ренального IRI почки или нефрэктомии.Основными признаками являются инфильтрация тканей воспалительными клетками и медиаторами, такими как TNF-α и IL-6, повреждение и некроз гепатоцитов и окислительный стресс [14]. Недавно после ишемического IRI у свиней наблюдалось преходящее повышение активности печеночных ферментов, таких как аминотрансферазы. Интересно, что изменения в ткани печени были незначительными и полностью исчезли через 5 недель, что свидетельствует об умеренном и преходящем повреждении [15]. Однако AKI остается клинически значимым для функции печени. Потеря почечной функции может повлиять на ферментную систему цитохрома печени посредством метаболического ацидоза и уремии, что приводит к нарушению выведения лекарственного средства. Застой в печени и ее недостаточность также могут быть вторичными по отношению к скоплению жидкости при олигоанурическом AKI [14].
AKI воздействует на отдаленные органы различными путями, такими как воспаление, опосредованное клеточными и молекулярными эффекторами, метаболические и гемодинамические изменения и нейрогормональная система. Когда поражаются почки, страдают и отдаленные органы, что, вероятно, способствует смертности, связанным с AKI .Вмешательства, направленные на смягчение перекрестных взаимодействий между почками и органами, могут рассматриваться для улучшения результатов лечения пациентов. Это, однако, требует лучшего понимания взаимодействия между органами, которые на сегодняшний день основаны в основном на животных моделях или у пациентов с CKD и не учитывают причины и тяжесть AKI . Повреждения, вызванные потерей функции почек или повреждением самой почки, также необходимо различать.
References
1. Andres-Hernando A, Dursun B, Altmann C, Ahuja N, He Z, Bhargava R,
Edelstein CE, Jani A, Hoke TS, Klein C, Faubel S (2012) Cytokine production
increases and cytokine clearance decreases in mice with bilateral nephrectomy. Nephrol Dial Transplant Off Publ Eur Dial Transplant Assoc Eur Renal Assoc 27:4339–4347
2. Neirynck N, Vanholder R, Schepers E, Eloot S, Pletinck A, Glorieux G (2013)
An update on uremic toxins. Int Urol Nephrol 45:139–150
3. Andrade-Oliveira V, Foresto-Neto O, Watanabe IKM, Zatz R, Camara NOS
(2019) Inflammation in renal diseases: new and old players. Front Pharmacol
10:1192
4. Bihorac A, Baslanti TO, Cuenca AG, Hobson CE, Ang D, Efron PA, Maier
RV, Moore FA, Moldawer LL (2013) Acute kidney injury is associated with early cytokine changes after trauma. J Trauma Acute Care Surg 74:1005–1013
5. Bijuklic K, Jennings P, Kountchev J, Hasslacher J, Aydin S, Sturn D, Pfaller
W, Patsch JR, Joannidis M (2007) Migration of leukocytes across an endothelium-epithelium bilayer as a model of renal interstitial inflammation. Am J Physiol Cell Physiol 293:C486-492
6. Rossaint J, Spelten O, Kassens N, Mueller H, Van Aken HK, Singbartl K,
Zarbock A (2011) Acute loss of renal function attenuates slow leukocyte
rolling and transmigration by interfering with intracellular signaling.Kidney Int 80:493–503
7. Ronco C, Haapio M, House AA, Anavekar N, Bellomo R (2008) Cardiorenal
syndrome. J Am Coll Cardiol 52:1527–1539
8. Joannidis M, Forni LG, Klein SJ, Honore PM, Kashani K, Ostermann M,
Prowle J, Bagshaw SM, Cantaluppi V, Darmon M, Ding X, Fuhrmann V,
Hoste E, Husain-Syed F, Lubnow M, Maggiorini M, Meersch M, Murray
PT, Ricci Z, Singbartl K, Staudinger T, Welte T, Ronco C, Kellum JA (2020)
Lung-kidney interactions in critically ill patients: consensus report of the
Acute Disease Quality Initiative (ADQI) 21 Workgroup. Intensive Care Med
46:654–672
9. Ambruso SL, Gil HW, Fox B, Park B, Altmann C, Bagchi RA, Baker PR 2nd,
Reisz JA, Faubel S (2021) Lung metabolomics after ischemic acute kidney
injury reveals increased oxidative stress, altered energy production, and ATP depletion. Am J Physiol Lung Cell Mol Physiol 321:L50-l64
10. Rabb H, Wang Z, Nemoto T, Hotchkiss J, Yokota N, Soleimani M (2003)
Acute renal failure leads to dysregulation of lung salt and water channels.
Kidney Int 63:600–606
11. Wu PC, Wu CJ, Lin CJ, Wu VC (2015) Long-term risk of upper gastrointestinal hemorrhage after advanced AKI. Clin J Am Soc Nephrol CJASN
10:353–362
12. Siew ED, Fissell WH, Tripp CM, Blume JD, Wilson MD, Clark AJ, Vincz AJ, Ely EW, Pandharipande PP, Girard TD (2017) Acute Kidney Injury as a risk factor
for delirium and coma during critical illness. Am J Respir Crit Care Med 195: 1597–1607
13. Al-Mouqdad MM, Jamjoom DZ, Abdalgader AT, Ameen WS, Khalil TM,
Asfour YS, Al-Anazi MR, Asfour SS (2022) Association between acute kidney
injury and brain injury on term-equivalent age brain magnetic resonance
imaging in very preterm infants. Pediatr Nephrol 37(12):3235–3242
14. Bonavia A, Stiles N (2022) Renohepatic crosstalk: a review of the effects of
acute kidney injury on the liver. Nephrol Dial Transplant Off Publ Eur Dial
Transplant Assoc Eur Renal Assoc 37:1218–1228
15. Gardner DS, De Brot S, Dunford LJ, Grau-Roma L, Welham SJ, Fallman R,
O’Sullivan SE, Oh W, Devonald MA (2016) Remote effects of acute kidney
injury in a porcine model. Am J Physiol Renal Physiol 310:F259-271