Array
(
[NAME] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
[~NAME] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
[PREVIEW_PICTURE] => Array
(
[ID] => 5619
[TIMESTAMP_X] => 10.04.2024 13:16:55
[MODULE_ID] => iblock
[HEIGHT] => 668
[WIDTH] => 1000
[FILE_SIZE] => 92715
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/679/3xmeounew5596uym6b0r68a6kxp9llka
[FILE_NAME] => male-student-practicing-medicine-2.jpg
[ORIGINAL_NAME] => male-student-practicing-medicine-2.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 9d8415725bf4076a759b5dde41c5524a
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/679/3xmeounew5596uym6b0r68a6kxp9llka/male-student-practicing-medicine-2.jpg
[UNSAFE_SRC] => /upload/iblock/679/3xmeounew5596uym6b0r68a6kxp9llka/male-student-practicing-medicine-2.jpg
[SAFE_SRC] => /upload/iblock/679/3xmeounew5596uym6b0r68a6kxp9llka/male-student-practicing-medicine-2.jpg
[ALT] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
[TITLE] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
)
[~PREVIEW_PICTURE] => 5619
[DETAIL_TEXT] => Yichi Zhang , Michael T. McCurdy and Jonathan Ludmir
Sepsis Management in the Cardiac Intensive Care Unit
J. Cardiovasc. Dev. Dis. 2023, 10, 429. https://doi.org/10.3390/jcdd10100429
Абстракт: Лечение септического шока в кардиологическом отделении интенсивной терапии (КОИТ) является сложной задачей из-за сложного патофизиологического взаимодействия между вазодилататорным и кардиогенным шоком, что усложняет оптимальное применение инфузионной терапии, вазопрессоров и устройств механической поддержки кровообращения. Поскольку смешанный шок чреват высокой смертностью, для борьбы с широким спектром возможных осложнений необходимо знать качественные современные клинические данные, касающиеся доступных методов и средств лечения. Данный обзор объединяет принципы патофизиологии и клинические рекомендации и представляет собой организованный, тематический обзор тонкостей лечения сепсиса в отделении каодиореанимации и интенсивной терапии.
Ключевые слова: сепсис; интенсивная терапия; кардиология; реанимационная помощь; шок; отделение интенсивной терапии; кардиологическое отделение интенсивной терапии
1. Введение
Сепсис и септический шок являются частыми осложнениями, которые развиваются у пациентов кардиореанимации [1]. Сложные патофизиологические особенности и взаимодействие между кардиогенным шоком (КШ) и септическим шоком имеют решающее значение для нашего современного многогранного диагностического и терапевтического подхода. Этот текущий обзор литературы объединяет соответствующие принципы патофизиологии с рекомендациями по ведению пациентов с сепсисом и КШ.
2. Эпидемиология и определения
Третий международный консенсус определяет сепсис как «опасную для жизни дисфункцию органов, вызванную нарушением регуляции реакции организма на инфекцию». Органную дисфункцию можно дополнительно квалифицировать по изменению по шале SOFA на ≥2 балла по сравнению с исходным уровнем [2]. Хотя шкалу qSOFA, проще использовать, поскольку она учитывает только частоту дыхания, уровень сознания и систолическое артериальное давление , она имеет низкую прогностическую точность. по сравнению с его традиционной шкалой SOFA [3]. В частности, оценка qSOFA сама по себе не должна использоваться для диагностики сепсиса, а скорее как ускоренный прогностический инструмент для прогнозирования смертности у пациентов с сепсисом. Септический шок, определяемый как ухудшение гемодинамики на фоне сепсиса, характеризуется необходимостью применения вазопрессоров для поддержания среднего артериального давления на уровне 65 мм рт. ст. и уровня лактата в сыворотке > 2 ммоль/л [4]. В этом случае септический шок следует рассматривать в первую очередь при отсутствии гиповолемии, поскольку инфекции часто могут вызывать постоянные потери жидкости (например, диарея или рвота), что приводит к гиповолемическому компоненту шока, который следует устранить в первую очередь. В общей сложности от 6 до 37% пациентов ОИТ страдают сепсисом [5,6], и до 44% пациентов, у которых развился сепсис, умирают [5]. Кроме того, у пациентов с инфарктом миокарда (ИМ), осложненным сепсисом, вероятность смерти на 103% выше, чем у пациентов с «несептическим» ИМ [7]. Аналогичным образом, несердечная мультисистемная органная недостаточность также значительно более распространена в когортах сепсиса. Несмотря на отсутствие стандартного определения КШ [6], один из самых известных критериев, возникший в исследовании SHOCK в 1999 году, определил его как (1) САД < 90 мм рт. ст. в течение > 30 мин или необходимость применения вазопрессоров для поддержания САД ≥ 90 мм рт. ст. ; (2) гипоперфузия органов-мишеней (например, диурез <30 мл/час или холодные конечности; и (3) сердечный индекс (CI) < 2,2 л/мин/м2 и давление заклинивания в легочных капиллярах >15 мм рт. ст. [8]. В последних рекомендациях Европейского общества кардиологов КШ определяется аналогичным образом [9].
3. Патофизиология кардиогенного и септического шока
Кардиогенный шок чаще всего возникает на фоне острого инфаркта миокарда (ОИМ), но может возникнуть и вследствие декомпенсации сердечной недостаточности, массивной ТЭЛА, миокардита, тяжелой дисфункции клапанов и других причин [10].
При КШ на фоне ОИМ инфаркт приводит к снижению сократимости и сердечного выброса (СВ), что приводит к увеличению конечного диастолического давления в левом желудочке (LVEDP). Поскольку левосторонняя коронарная перфузия зависит от разницы между диастолическим артериальным давлением и LVEDP, более жесткие стенки ЛЖ (и, соответственно, более высокое LVEDP) снижают коронарное перфузионное давление (CPP), тем самым уменьшая возможности аэробного дыхания и способствуя нестабильности системной гемодинамики [11]. В отличие от левого желудочка, правый желудочек перфузируется как во время диастолы, так и во время систолы, хотя его CPP по-прежнему определяется разницей между САД и давлением в правой желудочке. Первоначальной реакцией периферической сосудистой сети при сердечной дисфункции является вазоконстрикция для сохранения перфузионного давления [12], а клетки по всему телу максимизируют извлечение кислорода из соответствующих капилляров, чтобы компенсировать снижение кровотока [13].
Сепсис приводит к расширению сосудов периферического кровообращения под действием оксида азота (NO). Провоспалительные цитокины, такие как фактор некроза опухоли (TNF) или интерлейкин-1 (IL-1), активируются в результате острой инфекции и воспаления, увеличивая выработку NO, который активирует гуанилатциклазу [14]. Конечный продукт этого каскада, циклический гуанозинмонофосфат (GMP) , затем расслабляет гладкую мускулатуру сосудов и подавляет сосудистый тонус [15]. Таким образом, расширенные сосуды больше не могут поддерживать перфузионное давление, необходимое для оптимального физиологического функционирования, что приводит к мультиорганной органной недостаточности. Сердечная дисфункция может наблюдаться у 44% пациентов с септическим шоком [16]. Сепсис может ухудшить функцию кровообращения, затрагивая либо периферическую сосудистую систему [14], либо функцию миокарда [17]. Сепсис отрицательно влияет на функцию миокарда напрямую посредством нескольких различных механизмов. Во-первых, вышеупомянутый сосудорасширяющий фактор NO оказывает ингибирующее действие на бета-адренергические (β1) рецепторы, которые в норме отвечают за увеличение частоты сердечных сокращений и сократимости [17]. Снижение активности β1-рецепторов приводит к тому, что сердце теряет компенсаторный резерв для борьбы с шоком. Во-вторых, связанная с сепсисом митохондриальная дисрегуляция и последующее образование активных форм кислорода (ROS) также могут напрямую подавлять сердечную функцию [18]. Клетки миокарда часто насыщены митохондриями из-за их высоких аэробных потребностей в производстве энергии. Таким образом, воспалительные цитокины, которые приводят к митохондриальной дисфункции, могут привести к чрезмерному накоплению активных форм кислорода и прямому цитотоксическому повреждению кардиомиоцитов. Кроме того, сепсис может вызывать дисфункцию системы комплемента, при этом фактор комплемента C5a, мощный агент хемотаксиса тучных клеток и нейтрофилов, может напрямую подавлять функцию клеток миокарда [19]. Нацеливание на эти менее изученные механизмы прямого подавления миокарда может стать достойным направлением будущих биомедицинских или фармацевтических исследований.
4. Гемодинамическая оценка и диагностика коморбидного сепсиса и кардиогенного шока
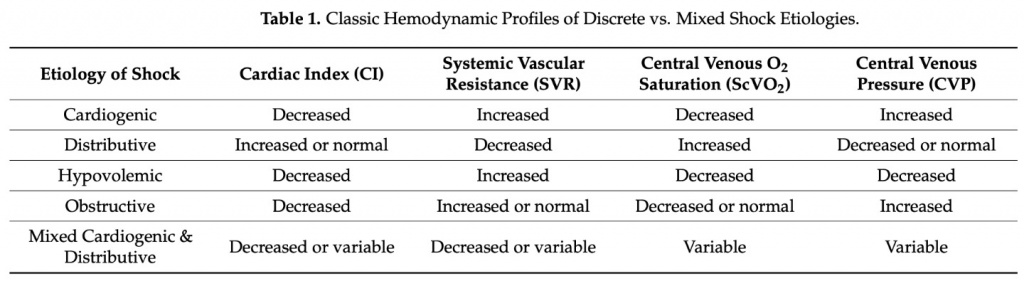
Распознавание и своевременная диагностика коморбидного септического и кардиогенного шока в ОРИТ может оказаться сложной задачей. Для дальнейшего понимания (Table 1) этиологии шока, будь то кардиогенный, дистрибутивный, обструктивный или какая-либо их комбинация, необходима комплексная гемодинамическая оценка. Коморбидный септический и кардиогенный шок демонстрируют уникальные изменения гемодинамических параметров (например, сердечного индекса, давления наполнения желудочков, насыщения кислородом смешанной венозной крови), которые могут существовать в «парадоксальных» комбинациях (например, сосуществование сохраненного сердечного индекса с высоким давлением наполнения). Таким образом, в этих сложных сценариях смешанного шока частая и тщательная оценка клинического статуса пациентов и параметров гемодинамики становится еще более необходимой для правильной диагностики и, в конечном итоге, для адекватного лечения.
Сердечные биомаркеры обычно получают в рамках первоначального исследования при подозрении на острую сердечную дисфункцию, включая тропонин и NT-proBNP [6]. В частности, тропонин I часто рассматривается как маркер повреждения миокарда при остром коронарном синдроме, одной из наиболее частой этиологии кардиогенного шока. Данные метаанализа также предполагают потенциальное использование тропонина I в качестве прогностического маркера при септическом шоке, и продолжаются попытки изучить это в крупномасштабных проспективных исследованиях [20,21]. С другой стороны, NT-proBNP часто используется в качестве суррогатного маркера для оценки волемического статуса и застойной сердечной недостаточности.
Аналогично, в ретроспективном анализе было обнаружено, что NT-proBNP также имеет прогностическую ценность при септическом шоке [22]. Однако существенное ограничение полезности как тропонина I, так и NT-proBNP при коморбидном септическом и кардиогенном шоке заключается в их специфичности. Оба маркера часто обнаруживаются повышенными у пациентов с хроническими воспалительными заболеваниями, а также с почечной дисфункцией, что приводит к проблемам с интерпретацией. Кроме того, ренин плазмы также исследовался в качестве биомаркера для прогноза и лечения шока, со сравнением его прогностической ценности с прогностической ценностью сывороточного лактата. Например, положительная скорость изменения уровня ренина в плазме, но не лактата, в течение более 72 часов была связана с увеличением внутрибольничной смертности [23]. В аналогичном контексте новые биомаркеры, такие как ST2 (член семейства рецепторов интерлейкина) [24], копептин (молекула, высвобождающаяся совместно с аргинин-вазопрессином) [25] и фактор дифференцировки роста 15 (GDF-15, белок из суперсемейства трансформирующего ростового фактора β) [26] исследуются в ретроспективных и проспективных исследованиях на предмет их прогностической ценности как при кардиогенном, так и при септическом шоке. Однако их нынешнее клиническое применение сильно затруднено из-за ограниченной доступности, которая в значительной степени сконцентрирована в крупных академических клинических центрах.
Два десятилетия назад знаковое исследование показало преимущество в снижении смертности от ранней целенаправленной терапии (EGDT), включающей гемодинамический мониторинг преднагрузки, постнагрузки и сатурации кислорода с помощью центрального венозного катетера у пациентов с септическим шоком [27]. Несмотря на то, что последующие исследования и метаанализы не подтвердили преимущества применения конкретного протокола EGDT [27], тщательный гемодинамический мониторинг и, как следствие, своевременные соответствующие вмешательства, тем не менее, получили широкую популяризацию в условиях интенсивной терапии.
Широкий спектр инвазивных и неинвазивных инструментов и маркеров (например, CO2 в конце выдоха [ETCO2], индекс коллабируемости нижней полой вены [IVC] при прикроватном УЗИ [POCUS]) был оценен на предмет их полезности для мониторинга гемодинамики при сепсисе и кардиогенном шоке [28].
В частности, POCUS обеспечивает быструю и удобную глобальную оценку функции как левого, так и правого желудочков, может быть выполнена с использованием дистанционного наведения даже в самых жестких условиях. [29]. В исследованиях POCUS изучалась полезность венозного допплеровского анализа формы волны только нижней полой вены, а также комплексного анализа печеночных, воротных и почечных вен для ультразвуковой оценки венозного избытка (VExUS), чтобы помочь предсказать тяжесть венозного застоя [30,31]. Кроме того, развитие системы POCUS с искусственным интеллектом может снизить общий барьер для входа в систему и повысить надежность межоперационного взаимодействия для таких более зависимых от навыков измерений, как интеграл скорости и времени оттока из левого желудочка (VTI) [32].
Однако не менее важно признать и ограничения POCUS, поскольку он сам по себе не может заменить комплексную оценку сердечно-сосудистой системы. Таким образом, результаты POCUS всегда следует рассматривать в контексте физикального осмотра и других клинических параметров, чтобы составить более полную картину гемодинамического статуса. Кроме того, возможно, самый простой метод оценки реакции на жидкость может быть достигнут с помощью «пассивного подъема ноги», который эффективно доставляет к сердцу около 300 мл преднагрузки [33]. Этот маневр безопасен благодаря его быстрой обратимости и может использоваться как часть первоначальной оценки гемодинамики, даже до введения болюсного тестового введения жидкости.
Новые достижения в технологии интенсивной терапии привели к появлению инструментов для мониторинга гемодинамики, таких как анализ контура пульса, который собирает данные из артериальной линии для расчета сердечного выброса [34,35]. Эта технология была валидирована по сравнению с катетеризацией легочной артерии у стабильных пациентов, подвергающихся хирургическому вмешательству, однако ее эффективность может быть менее надежной в клинических сценариях с чрезвычайно низким сосудистым сопротивлением, таких как сепсис и цирроз [35]. Хотя эти устройства могут учитывать эффекты введения жидкости, их надежность должна быть сбалансирована с клинической картиной.
В настоящее время золотым стандартом гемодинамической оценки кардиогенного шока остается катетер легочной артерии (PAC) [36]. Несмотря на свою инвазивность, PAC может предоставить важнейшие данные о давлении в левой и правой половине сердца и сердечном выбросе в режиме реального времени для принятия решений о тактике лечения. Несмотря на его способность предоставлять эти гемодинамические данные, остается много вопросов относительно влияния этих данных на снижение смертности от кардиогенного шока, как предполагает знаковый метаанализ, проведенный Shah et al. в 2005 году [37]. Авторы пришли к выводу, что, возможно, отсутствие пользы от использования PAC связано с отсутствием «эффективных, научно обоснованных методов лечения», используемых в сочетании с PAC [37]. Однако за последнее десятилетие достижения и инструменты в области кардиологической интенсивной терапии популяризировали использование PAC для мониторинга терапевтического эффекта в режиме реального времени. Недавние ретроспективные анализы показывают, что PAC связан с более низкой 30-дневной смертностью, сопоставленной по склонности [38].
Например, PAC может характеризовать смешанные профили шока и способствовать принятию клинических решений, связанных с механической поддержкой кровообращения (MCS). Постоянное ухудшение гемодинамики может служить основанием для перехода от внутриаортальной балонной помпы (IABP) к Impella, добавления поддержки левожелудочкового вспомогательного устройства (LVAD) пациентам только с RVAD или начала и повышения параметров экстракорпоральной мембранной оксигенации (ЭКМО) [39]. Хотя необходимы проспективные РКИ, PAC остается бесценным инструментом, помогающим врачам-реаниматологам оценивать гемодинамический статус пациентов с тяжелым кардиогенным шоком.
5. Рекомендации по лечению
Смертность, связанная с кардиогенным шоком, в кардиореанимации значительна, но коморбидный септический шок добавляет дополнительный уровень сложности и риска, который требует раннего распознавания, тщательного мониторинга и системного подхода к лечению (Figure 1).

5.1. Противомикробные препараты
Ранняя эмпирическая антимикробная терапия имеет решающее значение для лечения сепсиса и септического шока, предпочтительно в течение одного часа после выявления признаков и симптомов [40]. Эмпирические противомикробные препараты выбираются на основе наиболее вероятного патогена и индивидуальных факторов риска пациента, таких как ослабление иммунитета или недавняя госпитализация [41]. В рекомендациях SurvivingSepsis Campaign 2021 года по первоначальному выбору эмпирической антибиотикотерапии предлагается начинать с препаратов широкого спектра действия в течение одного часа после выявления признаков и симптомов сепсиса, а затем адаптировать ее к результатам посева и чувствительности у конкретного пациента, а также к местному уровню антибиотикорезистентности [42].
Эмпирический охват грамотрицательных бактерий часто считается стандартным и единообразным при лечении сепсиса. Эти патогены могут выделять эндотоксины, полученные из компонентов их клеточной стенки, таких как липид А, который может быть чрезвычайно иммуногенным, вызывая массивную воспалительную реакцию за счет выработки цитокинов (например, TNF-альфа) [43].
Кроме того, патоген-ассоциированные молекулярные паттерны (PAMP), которые являются продуктами распада микроорганизмов, также исследовались как на предмет их диагностической, так и терапевтической полезности, особенно в условиях сепсиса с отрицательными культурами [44]. Обычно используемые антибиотики для лечения грамотрицательного сепсиса включают пиперациллин-тазобактам, фторхинолоны, такие как левофлоксацин, цефалоспорины, такие как цефтазидим и цефепим, а также карбапенемы, такие как меропенем [45]. Охват грамотрицательных бактерий должен включать борьбу с Pseudomonas aeruginosa, грамотрицательной палочкой, связанной с высокими показателями устойчивости к антибиотикам и смертности [46]. Из-за изначально высокого уровня устойчивости к антибиотикам у грамотрицательных бактерий, таких как Pseudomonas и Enterobacteriaceae, Infection Disease Society of America (IDSA) поддерживает использование комбинированного лечения грамотрицательных микроорганизмов у пациентов с септическим шоком [47] до тех пор, пока не будут получены результаты чувствительности [48]. Кроме того, для пациентов, которые подвергаются высокому риску заражения MRSA либо из-за положительных результатов посева в прошлом, либо из-за недавнего контакта с медицинским учреждением, рекомендуется эмпирическое использование анти-MRSA препаратов до тех пор, пока не будут получены окончательные результаты посева [49].
Как только микроорганизм и источник инфекции будут идентифицированы, необходимо провести борьбу с источником в форме хирургического вмешательства и/или хирургической обработки или удаления трубок/дренажей/постоянных катетеров, а все противомикробные препараты следует как можно скорее деэскалировать, чтобы избежать параллельного ущерба [42]. Среди различных побочных эффектов длительного применения антибиотиков один менее изученный механизм, который может еще больше усложнить гемодинамическую функцию при коморбидном сепсисе и кардиогенном шоке, заключается в том, что растворы для внутривенных антибиотиков могут содержать большое количество натрия [50]. Например, при стандартной дозировке внутривенный ванкомицин может доставить поразительные 3540 мг натрия за 24 часа терапии, тогда как внутривенный пиперациллин-тазобактам добавит еще 2280 мг за тот же период [51]. Увеличение объема из-за солевой перегрузки может спровоцировать отек легких, кардиоренальный синдром и другие дисфункции органов-мишеней, особенно на фоне существующей сердечной дисфункции. Хотя соответствующие противомикробные препараты являются важной терапией при сепсисе, их постоянное разумное использование особенно важно при лечении коморбидного кардогенного шока.
5.2. Инфузионная терапия
Оптимальная инфузионная терапия является важным компонентом лечения сепсиса, поскольку многие пациенты поступают с гиповолемией из-за низкого перорального поступления жидкости и повышенных потерь из-за потоотделения, вызванного лихорадкой, что может дополнительно осложняться вызванным массивным воспалением низким тонусом сосудов и утечкой жидкости [52]. До недавнего времени большинство руководств рекомендовали агрессивную инфузию кристаллоидами при сепсисе с начальным болюсом 30 мл/кг массы тела с последующим введением поддерживающих объемов с целью достижения постоянного САД > 65 мм рт. ст. [53]. Однако современные метаанализы крупных РКИ показали, что меньшие объемы кристаллоидов не приводят к худшим результатам, что ставит под сомнение идеальный объем жидкости для лечения сепсиса [54,55]. Таким образом, в текущих рекомендациях Surviving Sepsis 2021 г. приводятся недостаточные доказательства, чтобы давать рекомендации относительно либеральной или ограничительной стратегии введения жидкости в первые 24 часа [49].
Существует давняя дискуссия о том, улучшит ли использование коллоидов (например, альбумина) для инфузионной терапии результаты по сравнению с кристаллоидами. Только 25% из каждого 1 л введенных кристаллоидов, в отличие от почти 50% введенных коллоидов, остается в плазме после распределения по различным внутриклеточным и внеклеточным пространствам. Кроме того, период полувыведения введенных кристаллоидов по сравнению с коллоидами, находящимися в кровообращении, составляет всего около 20–40 минут против 2–3 часов соответственно [56,57]. Многочисленные РКИ (например, SAFE, CRISTAL, ALBIOS) сравнивают эффективность кристаллоидов и коллоидов в ОИТ; однако ни одно из них не продемонстрировало значительной разницы в смертности или повреждении почек [56,58,59]. Аналогичным образом, коллоиды обычно используются для восстановления объема после операции на сердце, несмотря на их более высокую стоимость и отсутствие доказательств их превосходства над кристаллоидами [60]. Примечательно, что выводы некоторых из этих исследований ограничены обобщением различных типов коллоидных растворов, а также использованием коллоидов низкой концентрации. Недавно метаанализ более 5000 пациентов с септическим шоком действительно показал улучшение 90-дневных результатов при использовании 20% альбумина по сравнению с использованием кристаллоидов, что требует дальнейших проспективных исследований [61,62].
Еще одним фактором выбора жидкости при реанимации является выбор между различными кристаллоидными растворами (Table 2).
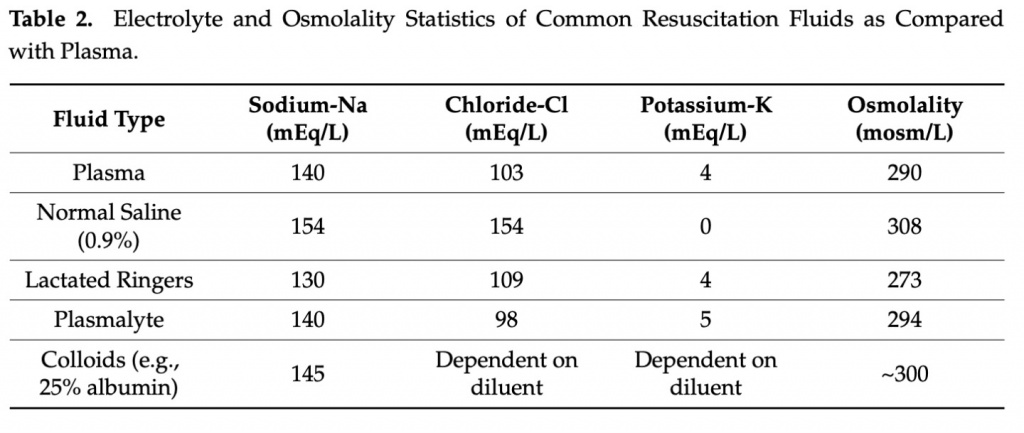
Хотя физиологический раствор, содержащий 154 мг-экв натрия и эквивалентное количество хлорида, может быть наиболее широко используемым вариантом, последние клинические данные подтверждают эффективность использования более «сбалансированных» растворов, таких как лактат Рингера и Plasma-Lyte, в большинстве клинических ситуаций. По сравнению с физиологическим раствором эти жидкости содержат концентрации электролитов, более физиологически схожие с плазмой [63]. Обычно это означает более низкие уровни натрия и хлоридов и добавление 4–5 мэкв/л калия вместе с буферным компонентом (например, лактатом), который в конечном итоге метаболизируется до бикарбоната. РКИ, сравнивающие использование физиологического раствора со «сбалансированными» кристаллоидами, показали неоднозначные результаты: исследования SMART[64] и SALT-ED [65] показали небольшое преимущество лактата Рингера, а BASICS [66] и PLUS [67]. не продемонстрировали различий в смертности или повреждении почек. Сторонники использования «сбалансированных» кристаллоидов называют высокую нагрузку хлоридами фактором риска гиперхлоремического метаболического ацидоза. Кроме того, эта нагрузка хлоридами, доставляемыми в maculadensa, может быть основным фактором острого повреждения почек, поскольку канальцево-клубочковая обратная связь вызывает вазоконстрикцию афферентных сосудов [68]. Между тем, сторонники физиологического раствора указывают на добавление калия в «сбалансированные» кристаллоиды как на потенциальное усугубление гиперкалиемии у пациентов из группы риска, но этот миф был в значительной степени развеян в последующих исследованиях [69]. Для пациентов с коморбидным сепсисом и кардиогенным шоком важна частая повторная оценка состояния волемии для определения необходимости инфузионной терапии или ограничения жидкости после восстановления гемодинамики. В исследовании CLOVERS пациенты с гипотонией, связанной с сепсисом, были рандомизированы на рестриктивную или либеральную стратегию введения жидкости и не обнаружили различий в 90-дневной смертности между двумя группами [70]. В конечном счете, решения, связанные с введением жидкости при коморбидном сепсисе и кардиогенном шоке, могут быть сложными, но разумным подходом является начинать с меньших болюсов жидкости и определять будущие потребности с частыми повторными оценками на основе результатов обследования и объективных данных.
5.3. Вазопрессоры
Использование вазопрессоров является краеугольным камнем в лечении септического шока для устранения низкого сосудистого сопротивления, гипотонии и последующей плохой перфузии органов вследствие массивного воспаления. Чтобы поддерживать целевой показатель САД на уровне ≥65 мм рт. ст., предложенном SurvivingSepsis campaign 2021 года [42], можно увеличивать дозу различных вазоактивных препаратов или использовать их в сочетании друг с другом. Норадреналин является наиболее часто используемым препаратом и считается экспертами и консенсусом в качестве препарата первой линии. Его активность в отношении как альфа-, так и бета-адренорецепторов способствует не только повышению сосудистого тонуса, но и сократимости миокарда.
Вазопрессин является препаратом второй линии, который часто добавляют, когда целевые значения САД не могут быть достигнуты только за счет введения норадреналина или для снижения катехоламинергической нагрузки, которая потенциально может вызвать такие проблемы, как аритмия [70]. Вазопрессин, или антидиуретический гормон (ADH), действует на рецепторы V1 и V2, повышая сосудистый тонус и задерживая жидкость в почках соответственно. У пациентов с кардиогенным шоком, нуждающихся в инотропных препаратах (например, милринон, добутамин) и имеющих сопутствующий дистрибутивный шок, вторичный по отношению к сепсису, часто необходима поддержка вазопрессорами с повышением титра, а также следует оптимизировать использование инотропных препаратов. Адреналин часто используется как двойной инотроп и вазопрессор, чтобы минимизировать потребность в норэпинефрине. Сильный бета-адренергический агонизм и альфа-агонизм адреналина делают его полезным при сердечной дисфункции, хотя в сочетании с норадреналином увеличивается риск перегрузки катехоламинами. В частности, риск опасных для жизни аритмий и ишемии органов вследствие значительного сосудистого тонуса увеличивается при длительном комбинированном применении таких препаратов.
Кроме того, чрезмерное применение адренергических препаратов может повысить сопротивление легочных сосудов, что может способствовать декомпенсации у пациентов с существующей дисфункцией правого желудочка. Поскольку чрезмерное использование адренергических препаратов может увеличить смертность у пациентов с кардиогенным шоком [71], настоятельно рекомендуется разумное использование минимально возможной дозы и минимально возможной продолжительности лечения. Исторически дофамин широко использовался при шоке из-за его интересного дозозависимого агонизма к дофаминергическим и адренергическим рецепторам; однако сравнительные исследования с норэпинефрином показали более частые побочные эффекты, такие как аритмии и повышенную смертность у пациентов с кардиогенным шоком [72]. Новые инотропы, такие как левосимендан, также активно исследуются на предмет их эффективности и безопасности по сравнению с традиционными препаратами [73], хотя никакие преимущества в отношении смертности не подтверждают его использование вместо стандартных методов лечения септического шока [74]. Роль этих новых агентов необходимо будет дополнительно изучить, прежде чем можно будет дать надежные рекомендации.
Еще один особенно интересный агент, заслуживающий обсуждения, который оказывает влияние на ренин-ангиотензин-альдостероновую систему (РААС) — ангиотензин II (АТ-II). РААС была ключевой фармакологической мишенью в лечении гипертонии, заболеваний почек и предотвращении неблагоприятного ремоделирования сердца, однако, несмотря на >30 лет клинического применения, ее роль в лечении шока до недавнего времени игнорировалась [75]. РКИ 2017 года продемонстрировало, что AT-II эффективно повышает САД на ≥10 мм рт.ст. от исходного уровня или до ≥75 мм рт.ст. у пациентов с вазодилатирующим шоком, которым требовалась инфузия норадреналина >0,2 µг/кг/мин, по сравнению с плацебо [76]. AT-II улучшил показатель SOFA через 48 часов без увеличения побочных эффектов по сравнению с плацебо. Обзор 24 исследований с использованием AT-II также продемонстрировал, что он эффективно увеличивает САД в среднем на 23,4% у пациентов с циркуляторным шоком [77]. В конечном счете, медикаментозная терапия, направленная на РААС, может стать мощным инструментом наряду с адренергически модифицирующими агентами для лечения шока.
5.4. Вентиляция с положительным давлением
У пациентов с сепсисом часто развиваются опасные для жизни нарушения дыхания либо в результате прямой инфекции паренхимы легких (например, пневмония), либо в результате развития острого респираторного дистресс-синдрома (ОРДС), когда воспаление приводит к массивной утечке из легочных капилляров и альвеолярному коллапсу. Этим пациентам часто требуется быстрое увеличение частоты неинвазивной или инвазивной вентиляции с положительным давлением (PPV) [78]. Хотя PPV критически поддерживает расширение альвеол и обмен кислорода через альвеолярную мембрану, она также оказывает различные гемодинамические эффекты на левый и правый желудочки. Как правило, функция левого желудочка выигрывает от PPV в виде снижения постнагрузки в результате рефлекторного ответа барорецепторов на компрессию аорты [79]. Однако PPV увеличивает как внутригрудное давление, так и сопротивление легочных сосудов (PVR) [80]. Эти гемодинамические воздействия становятся чрезвычайно важными при дисфункции правого желудочка. Увеличение внутригрудного давления может уменьшить объем венозного возврата, что приводит к снижению преднагрузки правого желудочка. Одновременно с этим PPV может вызывать перераздувание альвеол, что, в свою очередь, приводит к сдавлению сосудистого русла, увеличению легочного сосудистого сопротивления и, как следствие, увеличению постнагрузки на правый желудочек. В совокупности снижение преднагрузки и увеличение постнагрузки могут усугубить основные нарушения функции правого желудочка и значительно увеличить его работу и потребность в кислороде [81]. Впоследствии тяжелая дисфункция правого желудочка может привести к недостаточному обеспечению преднагрузки левого желудочка, вызывая левожелудочковую недостаточность и ухудшая сердечный выброс, что в конечном итоге приводит к гемодинамическому кризису. Таким образом, необходимо тщательно контролировать и поддерживать тонкий баланс между вентиляцией, оксигенацией и перфузией [79].
5.5. Механическая поддержка кровообращения
Устройства временной механической поддержки кровообращения (MCS) улучшают системную перфузию, дают время для восстановления миокарда после травмы и служат либо мостом к выздоровлению, либо мостом к более радикальному вмешательству (например, долговременному устройству, трансплантации сердца) [82]. Быстрое развитие MCS в последние годы предоставило новые возможности для пациентов с кардиогенным шоком, которые н отвечают на инфузионную терапию и вазопрессоры [83]. Правосторонние унивентрикулярные поддерживающие устройства обычно помогают обойти отказавший правый желудочек, тем самым улучшая преднагрузку левого желудочка и системную перфузию. Примеры устройств RV MCS включают Impella RP Flex и Protek Duo [84]. Левосторонние устройства (например, внутриаортальные баллонные насосы (IABP), серии Impella, TandemHeart) либо непосредственно способствуют увеличению сердечного выброса, либо увеличивают коронарную перфузию левого желудочка за счет улучшения диастолического коронарного кровотока [82]
Между тем, бивентрикулярная поддержка может быть достигнута с помощью веноартериальной экстракорпоральной мембранной оксигенации (VAECMO), бивентрикулярных вспомогательных устройств (например, BiPellas, Impella/Protek, хирургических BiVAD CentriMag) или тотального искусственного сердца (TAH) [85]. В частности, VAECMO все чаще используется в качестве моста к окончательной терапии в виде трансплантации или длительного LVAD для пациентов с сердечным индексом <2 л/мин/м2, с отсутствием восстановления миокарда, низким САД, несмотря на вазопрессоры, и другие методы MCS [86]. Несмотря на высокие абсолютные показатели смертности (т.е. 50–70%) в этой группе пациентов, использование VAECMO у пациентов с кардиогенным шоком, вызванным инфарктом миокарда, не улучшило клинические результаты [87,88]. Откладывание начала VAECMO до тех пор, пока у пациентов с тяжелым кардиогенным шоком не наступит клиническое ухудшение, может привести к таким же результатам, как и начало ее вскоре после постановки диагноза. Фактически, недавнее крупное РКИ показало, что среди пациентов с острым инфарктом миокарда, осложненным кардиогенным шоком, экстракорпоральное жизнеобеспечение не улучшило 30-дневную смертность по сравнению со стандартной медикаментозной терапией [89,90].
Несмотря на эти результаты, VAECMO остается важным инструментом при кардиогенном шоке, и разумное принятие клинических решений оправдано, чтобы помочь выявить пациентов, которые могут получить наибольшую пользу от VAECMO в качестве моста к окончательной терапии. Хотя MCS не может быть показан при первичном септическом шоке, при тщательном рассмотрении риска и преимуществ он может служить полезным инструментом для лечения рефрактерного смешанного вазодилататорного и кардиогенного шока [91]. У пациентов, у которых развился сепсис или септический шок во время использования MCS, следует разработать план действий на случай непредвиденных обстоятельств относительно того, следует ли и когда повышать уровень механической поддержки. Например, после тщательного анализа риска и пользы пациенту, получающему только поддержку правого желудочка, можно рассмотреть возможность установки временного устройства левого желудочка, если гемодинамика ухудшается при сепсисе [92]. Аналогичным образом, у пациентов, находящихся на VAECMO, следует рассмотреть вопрос о повышении параметра потока, если развивается сценарий смешанного шока [92].
Примечательно, что в недавнем ретроспективном анализе использования временной MCS при кардиогенном шоке, связанном с сепсисом, только использование внутриаортальной баллонной помпы (IABP) и устройств вспомогательного кровообращения (VAD) было связано с более низким риском внутрибольничной смертности [93]. У пациентов с септическим шоком и острым инфарктом миокарда MCS не продемонстрировала улучшения выживаемости. Хотя модели на животных находятся в стадии изучения [94], необходимы дальнейшие проспективные РКИ для дальнейшего выяснения результатов временного использования MCS у пациентов с сочетанием септического и кардиогенного шока.
Еще одно противоречие вокруг использования MCS сердца у пациентов с сепсисом связано с потенциальным риском появления нового потенциального источника или очага инфекции [91]. Во-первых, сепсис не является абсолютным противопоказанием для начала МКС [95]. Как независимые факторы, септический шок и кардиогенный шок уже каждый создают высокий риск смертности, а при совместном развитии они способствуют еще более быстрой декомпенсации [96]. Таким образом, гемодинамическая польза, получаемая при разумном использовании MCS, часто перевешивает потенциальный риск новой инфекции, связанной с устройством [97]. Наконец, начало различных MCS, особенно ЭКМО, может привести к риску как гемолиза, так и тромбоза, часто вторичного по отношению к напряжению сдвига, оказываемому на эритроциты и тромбоциты, что требует эмпирической антикоагулянтной терапии [98,99]. Без крупномасштабного проспективного исследования, оценивающего, как оптимально сбалансировать риски кровотечений и тромботических осложнений при использовании MCS у пациентов с сочетанием септического и кардиогенного шока, любое обсуждение соотношения риска и пользы должно включать этот вопрос. Решение о том, перевешивает ли гемодинамическая польза, обеспечиваемая MCS, повышенный риск массивного кровотечения или венозной тромбоэмболии, должно приниматься индивидуально для каждого пациента.
6. Выводы и перспективы на будущее
Лечение сепсиса в отделениях кардиореанимации является сложным, сложным и быстро развивающимся из-за постоянного появления новых данных по инфузионной терапии и использованию вазопрессоров, а также передовых технологий MCS. Инструменты скрининга и лечения сепсиса, управляемые искусственным интеллектом, также подвергаются активному моделированию и тестированию, хотя к их первоначальным применениям всегда следует подходить с равным оптимизмом и осторожностью.
References
1. Feldman, E.W.; Dugan, E.; Stephens, R.S.; Schulman, S.; Zakaria, S.; Metkus, T. Presentation and Outcomes of Sepsis in the Cardiac Intensive Care Unit. Am. Heart J. Plus Cardiol. Res. Pract. 2021, 7, 100040. [CrossRef] [PubMed]
2. Singer, M.; Deutschman, C.S.; Seymour, C.W.; Shankar-Hari, M.; Annane, D.; Bauer, M.; Bellomo, R.; Bernard, G.R.; Chiche, J.-D.; Coopersmith, C.M.; et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315,801–810. [CrossRef] [PubMed]
3. Govindan, S.; Prescott, H.C. Quick Sequential Organ Failure Assessment: Illness Severity Indicator, Clinical Decision Support Tool, or Both? Crit. Care Med. 2017, 45, 1947–1949. [CrossRef]
4. Thompson, K.; Venkatesh, B.; Finfer, S. Sepsis and Septic Shock: Current Approaches to Management. Intern. Med. J. 2019, 49, 160–170. [CrossRef] [PubMed]
5. Jentzer, J.C.; Bhat, A.G.; Patlolla, S.H.; Sinha, S.S.; Miller, P.E.; Lawler, P.R.; van Diepen, S.; Khanna, A.K.; Zhao, D.X.; Vallabhajosyula, S. Concomitant Sepsis Diagnoses in Acute Myocardial Infarction-Cardiogenic Shock: 15-Year National Temporal Trends,Management, and Outcomes. Crit. Care Explor. 2022, 4, e0637. [CrossRef] [PubMed]
6. Vahdatpour, C.; Collins, D.; Goldberg, S. Cardiogenic Shock. J. Am. Heart Assoc. 2019, 8, e011991. [CrossRef]
7. Kobbari, G.; Yandrapalli, S.; Anugu, V.R.; Pasam, R.T.; Atti, V.; Kanaparthy, N.; Nabors, C.; Aronow, W. Incidence and Outcomes of Cardiogenic Shock in Patients with Sepsis Complicated by Acute Myocardial Infarction. J. Am. Coll. Cardiol. 2019, 73 (Suppl. S1), 288. [CrossRef]
8. Hochman, J.S.; Sleeper, L.A.; Webb, J.G.; Sanborn, T.A.; White, H.D.; Talley, J.D.; Buller, C.E.; Jacobs, A.K.; Slater, J.N.; Col, J.; et al.
Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. SHOCK Investigators. Should We
Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N. Engl. J. Med. 1999, 341, 625–634. [CrossRef]
9. Ponikowski, P.; Voors, A.A.; Anker, S.D.; Bueno, H.; Cleland, J.G.F.; Coats, A.J.S.; Falk, V.; González-Juanatey, J.R.; Harjola, V.-P.; Jankowska, E.A.; et al. 2016 ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure of the European Society of Cardiology (ESC)Developed with the Special Contribution of the Heart Failure Association (HFA) of the ESC. Eur. Heart J. 2016, 37, 2129–2200. [CrossRef]
10. Chioncel, O.; Parissis, J.; Mebazaa, A.; Thiele, H.; Desch, S.; Bauersachs, J.; Harjola, V.-P.; Antohi, E.-L.; Arrigo, M.; Ben Gal, T.; et al. Epidemiology, Pathophysiology and Contemporary Management of Cardiogenic Shock—A Position Statement from the Heart Failure Association of the European Society of Cardiology. Eur. J. Heart Fail. 2020, 22, 1315–1341. [CrossRef]
11. Tehrani, B.N.; Truesdell, A.G.; Psotka, M.A.; Rosner, C.; Singh, R.; Sinha, S.S.; Damluji, A.A.; Batchelor, W.B. A Standardized and Comprehensive Approach to the Management of Cardiogenic Shock. JACC Heart Fail. 2020, 8, 879–891. [CrossRef] [PubMed]
12. Just, H. Peripheral Adaptations in Congestive Heart Failure: A Review. Am. J. Med. 1991, 90, 23S–26S. [CrossRef]
13. Dhakal, B.P.; Malhotra, R.; Murphy, R.M.; Pappagianopoulos, P.P.; Baggish, A.L.;Weiner, R.B.; Houstis, N.E.; Eisman, A.S.; Hough, S.S.; Lewis, G.D. Mechanisms of Exercise Intolerance in Heart Failure with Preserved Ejection Fraction: The Role of Abnormal
Peripheral Oxygen Extraction. Circ. Heart Fail. 2015, 8, 286–294. [CrossRef] [PubMed]
14. Greer, J. Pathophysiology of Cardiovascular Dysfunction in Sepsis. BJA Educ. 2015, 15, 316–321. [CrossRef]
15. VINCENT, J.-L.; ZHANG, H.; SZABO, C.; PREISER, J.-C. Effects of Nitric Oxide in Septic Shock. Am. J. Respir. Crit. Care Med. 2000, 161, 1781–1785. [CrossRef] [PubMed]
16. Kakihana, Y.; Ito, T.; Nakahara, M.; Yamaguchi, K.; Yasuda, T. Sepsis-Induced Myocardial Dysfunction: Pathophysiology and Management. J. Intensive Care 2016, 4, 22. [CrossRef]
17. Jarczak, D.; Kluge, S.; Nierhaus, A. Sepsis—Pathophysiology and Therapeutic Concepts. Front. Med. 2021, 8, 609. [CrossRef]
18. Brealey, D.; Brand, M.; Hargreaves, I.; Heales, S.; Land, J.; Smolenski, R.; Davies, N.A.; Cooper, C.E.; Singer, M. Association between Mitochondrial Dysfunction and Severity and Outcome of Septic Shock. Lancet Lond. Engl. 2002, 360, 219–223. [CrossRef]
19. Niederbichler, A.D.; Hoesel, L.M.;Westfall, M.V.; Gao, H.; Ipaktchi, K.R.; Sun, L.; Zetoune, F.S.; Su, G.L.; Arbabi, S.; Sarma, J.V.; et al. An Essential Role for Complement C5a in the Pathogenesis of Septic Cardiac Dysfunction. J. Exp. Med. 2006, 203, 53–61.[CrossRef]
20. Sheyin, O.; Davies, O.; Duan, W.; Perez, X. The Prognostic Significance of Troponin Elevation in Patients with Sepsis: A Meta-Analysis. Heart Lung J. Crit. Care 2015, 44, 75–81. [CrossRef]
21. Frencken, J.F.; Donker, D.W.; Spitoni, C.; Koster-Brouwer, M.E.; Soliman, I.W.; Ong, D.S.Y.; Horn, J.; van der Poll, T.; van Klei,W.A.; Bonten, M.J.M.; et al. Myocardial Injury in Patients with Sepsis and Its Association with Long-Term Outcome. Circ. Cardiovasc.
Qual. Outcomes 2018, 11, e004040. [CrossRef] [PubMed]
22. Omar, A.S.; Ur Rahman, M.; Dhatt, G.S.; Salami, G.O.; Abuhasna, S. Dynamics of Brain Natriuretic Peptide in Critically Ill Patients with Severe Sepsis and Septic Shock. Saudi J. Anaesth. 2013, 7, 270–276. [CrossRef] [PubMed]
23. Jeyaraju, M.; McCurdy, M.T.; Levine, A.R.; Devarajan, P.; Mazzeffi, M.A.; Mullins, K.E.; Reif, M.; Yim, D.N.; Parrino, C.; Lankford, A.S.; et al. Renin Kinetics Are Superior to Lactate Kinetics for Predicting In-Hospital Mortality in Hypotensive Critically Ill Patients. Crit. Care Med. 2022, 50, 50–60. [CrossRef]
24. Villacorta, H.; Maisel, A.S. Soluble ST2 Testing: A Promising Biomarker in the Management of Heart Failure. Arq. Bras. Cardiol. 2016, 106, 145–152. [CrossRef] [PubMed]
25. Gomes, D.A.; de Almeida Beltrão, R.L.; de Oliveira Junior, F.M.; da Silva Junior, J.C.; de Arruda, E.P.C.; Lira, E.C.; da Rocha, M.J.A. Vasopressin and Copeptin Release during Sepsis and Septic Shock. Peptides 2021, 136, 170437. [CrossRef] [PubMed]
26. Li, H.; Tang, D.; Chen, J.; Hu, Y.; Cai, X.; Zhang, P. The Clinical Value of GDF15 and Its Prospective Mechanism in Sepsis. Front. Immunol. 2021, 12, 710977. [CrossRef]
27. Rivers, E.; Nguyen, B.; Havstad, S.; Ressler, J.; Muzzin, A.; Knoblich, B.; Peterson, E.; Tomlanovich, M. Early Goal-Directed Therapy in the Treatment of Severe Sepsis and Septic Shock. N. Engl. J. Med. 2001, 345, 1368–1377. [CrossRef]
28. Baloch, K.; Rehman Memon, A.; Ikhlaq, U.; Umair, M.; Ansari, M.I.; Abubaker, J.; Salahuddin, N. Assessing the Utility of End-Tidal Carbon Dioxide as a Marker for Fluid Responsiveness in Cardiogenic Shock. Cureus 2021, 13, e13164. [CrossRef]
29. Salerno, A.; Kuhn, D.; El Sibai, R.; Levine, A.R.; McCurdy, M.T. Real-Time Remote Tele-Mentored Echocardiography: A Systematic Review. Med. Kaunas Lith. 2020, 56, 668. [CrossRef]
30. Safadi, S.; Murthi, S.; Kashani, K.B. Use of Ultrasound to Assess Hemodynamics in Acutely Ill Patients. Kidney360 2021, 2,1349–1359. [CrossRef]
31. Beaubien-Souligny, W.; Rola, P.; Haycock, K.; Bouchard, J.; Lamarche, Y.; Spiegel, R.; Denault, A.Y. Quantifying Systemic Congestion with Point-Of-Care Ultrasound: Development of the Venous Excess Ultrasound Grading System. Ultrasound J. 2020,12, 16. [CrossRef] [PubMed]
32. Barjaktarevic, I.; Kenny, J.-É.S.; Berlin, D.; Cannesson, M. The Evolution of Ultrasound in Critical Care: From Procedural Guidance to Hemodynamic Monitor. J. Ultrasound Med. Off. J. Am. Inst. Ultrasound Med. 2021, 40, 401–405. [CrossRef] [PubMed]
33. Monnet, X.; Teboul, J.-L. Passive Leg Raising: Five Rules, Not a Drop of Fluid! Crit. Care 2015, 19, 18. [CrossRef] [PubMed]
34. Marik, P.E. Noninvasive Cardiac Output Monitors: A State-of the-Art Review. J. Cardiothorac. Vasc. Anesth. 2013, 27, 121–134. [CrossRef] [PubMed]
35. Argueta, E.; Berdine, G.; Pena, C.; Nugent, K.M. FloTrac® Monitoring System: What Are Its Uses in Critically Ill Medical Patients? Am. J. Med. Sci. 2015, 349, 352–356. [CrossRef]
36. Ranka, S.; Mastoris, I.; Kapur, N.K.; Tedford, R.J.; Rali, A.; Acharya, P.; Weidling, R.; Goyal, A.; Sauer, A.J.; Gupta, B.; et al. Right Heart Catheterization in Cardiogenic Shock Is Associated with Improved Outcomes: Insights From the Nationwide Readmissions Database. J. Am. Heart Assoc. 2021, 10, e019843. [CrossRef]
37. Shah, M.R.; Hasselblad, V.; Stevenson, L.W.; Binanay, C.; O’Connor, C.M.; Sopko, G.; Califf, R.M. Impact of the Pulmonary Artery Catheter in Critically Ill Patients: Meta-Analysis of Randomized Clinical Trials. JAMA 2005, 294, 1664–1670. [CrossRef]
38. Bertaina, M.; Galluzzo, A.; Morici, N.; Sacco, A.; Oliva, F.; Valente, S.; D’Ascenzo, F.; Frea, S.; Sbarra, P.; Petitti, E.; et al. Pulmonary Artery Catheter Monitoring in Patients with Cardiogenic Shock: Time for a Reappraisal? Card. Fail. Rev. 2022, 8, e15. [CrossRef]
39. Saxena, A.; Garan, A.R.; Kapur, N.K.; O’Neill, W.W.; Lindenfeld, J.; Pinney, S.P.; Uriel, N.; Burkhoff, D.; Kern, M. Value of Hemodynamic Monitoring in Patients with Cardiogenic Shock Undergoing Mechanical Circulatory Support. Circulation 2020, 141, 1184–1197. [CrossRef]
40. Martínez, M.L.; Plata-Menchaca, E.P.; Ruiz-Rodríguez, J.C.; Ferrer, R. An Approach to Antibiotic Treatment in Patients with Sepsis. J. Thorac. Dis. 2020, 12, 1007–1021. [CrossRef]
41. Strich, J.R.; Heil, E.L.; Masur, H. Considerations for Empiric Antimicrobial Therapy in Sepsis and Septic Shock in an Era of Antimicrobial Resistance. J. Infect. Dis. 2020, 222 (Suppl. S2), S119–S131. [CrossRef] [PubMed]
42. Rhodes, A.; Evans, L.E.; Alhazzani, W.; Levy, M.M.; Antonelli, M.; Ferrer, R.; Kumar, A.; Sevransky, J.E.; Sprung, C.L.; Nunnally, M.E.; et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017, 43, 304–377. [CrossRef] [PubMed]
43. DiPiro, J.T. Pathophysiology and Treatment of Gram-Negative Sepsis. Am. J. Hosp. Pharm. 1990, 47 (Suppl. S3), S6–S10. [CrossRef] [PubMed]
44. Gentile, L.F.; Moldawer, L.L. DAMPs, PAMPs, and the Origins of SIRS in Bacterial Sepsis. Shock 2013, 39, 113–114. [CrossRef] [PubMed]
45. Kalil, A.C.; Metersky, M.L.; Klompas, M.; Muscedere, J.; Sweeney, D.A.; Palmer, L.B.; Napolitano, L.M.; O’Grady, N.P.; Bartlett, J.G.; Carratalà, J.; et al. Management of Adults with Hospital-Acquired and Ventilator-Associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin. Infect. Dis. Off. Publ. Infect. Dis. Soc. Am. 2016, 63, e61–e111. [CrossRef]
46. Zakhour, J.; Sharara, S.L.; Hindy, J.-R.; Haddad, S.F.; Kanj, S.S. Antimicrobial Treatment of Pseudomonas Aeruginosa Severe Sepsis. Antibiotics 2022, 11, 1432. [CrossRef]
47. Amaral, A.C.K.B.; Fowler, R.A.; Pinto, R.; Rubenfeld, G.D.; Ellis, P.; Bookatz, B.; Marshall, J.C.; Martinka, G.; Keenan, S.; Laporta, D.; et al. Patient and Organizational Factors Associated with Delays in Antimicrobial Therapy for Septic Shock. Crit. Care Med. 2016, 44, 2145–2153. [CrossRef]
48. Deshpande, A.; Haessler, S.; Brizendine, K.; Lindenauer, P.; Lagu, T.; Yu, P.-C.; Bakaki, P.; Pekow, P.; Rothberg, M. Empiric Double Coverage for Healthcare-Associated Pneumonia: Is It Still Necessary? Open Forum Infect. Dis. 2016, 3 (Suppl. S1), 1252. [CrossRef]
49. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado, F.R.; Mcintyre, L.; Ostermann, M.; Prescott, H.C.; et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock 2021.Intensive Care Med. 2021, 47, 1181–1247. [CrossRef]
50. Maimone, S.; Mazzeo, A.T.; Squadrito, G.; Raimondo, G. Sodium Load and Intravenous Antimicrobials in Patients with Cirrhosis. Dig. Liver Dis. Off. J. Ital. Soc. Gastroenterol. Ital. Assoc. Study Liver 2019, 51, 1490–1492. [CrossRef]
51. Wang, N.; Nguyen, P.K.; Pham, C.U.; Smith, E.A.; Kim, B.; Goetz, M.B.; Graber, C.J. Sodium Content of Intravenous Antibiotic Preparations. Open Forum Infect. Dis. 2019, 6, ofz508. [CrossRef] [PubMed]
52. Semler, M.W.; Rice, T.W. Sepsis Resuscitation: Fluid Choice and Dose. Clin. Chest Med. 2016, 37, 241–250. [CrossRef] [PubMed]
53. Finfer, S.; Liu, B.; Taylor, C.; Bellomo, R.; Billot, L.; Cook, D.; Du, B.; McArthur, C.; Myburgh, J. Resuscitation Fluid Use in Critically Ill Adults: An International Cross-Sectional Study in 391 Intensive Care Units. Crit. Care Lond. Engl. 2010, 14, R185. [CrossRef] [PubMed]
54. Sivapalan, P.; Ellekjaer, K.L.; Jessen, M.K.; Meyhoff, T.S.; Cronhjort, M.; Hjortrup, P.B.; Wetterslev, J.; Granholm, A.; Møller, M.H.; Perner, A. Lower vs Higher Fluid Volumes in Adult Patients with Sepsis: An Updated Systematic Review with Meta-Analysis and Trial Sequential Analysis. Chest 2023, 164, 892–912. [CrossRef]
55. Moschopoulos, C.D.; Dimopoulou, D.; Dimopoulou, A.; Dimopoulou, K.; Protopapas, K.; Zavras, N.; Tsiodras, S.; Kotanidou, A.; Fragkou, P.C. New Insights into the Fluid Management in Patients with Septic Shock. Medicina 2023, 59, 1047. [CrossRef]
56. Caironi, P.; Tognoni, G.; Masson, S.; Fumagalli, R.; Pesenti, A.; Romero, M.; Fanizza, C.; Caspani, L.; Faenza, S.; Grasselli, G.; et al. Albumin Replacement in Patients with Severe Sepsis or Septic Shock. N. Engl. J. Med. 2014, 370, 1412–1421. [CrossRef]
57. Hahn, R.G.; Lyons, G. The Half-Life of Infusion Fluids: An Educational Review. Eur. J. Anaesthesiol. 2016, 33, 475–482. [CrossRef]
58. The SAFE Study Investigators. A Comparison of Albumin and Saline for Fluid Resuscitation in the Intensive Care Unit. N. Engl.J. Med. 2004, 350, 2247–2256. [CrossRef]
59. Annane, D.; Siami, S.; Jaber, S.; Martin, C.; Elatrous, S.; Declère, A.D.; Preiser, J.C.; Outin, H.; Troché, G.; Charpentier, C.; et al. Effects of Fluid Resuscitation with Colloids vs Crystalloids on Mortality in Critically Ill Patients Presenting with Hypovolemic Shock: The CRISTAL Randomized Trial. JAMA 2013, 310, 1809–1817. [CrossRef]
60. Hanley, C.; Callum, J.; Karkouti, K.; Bartoszko, J. Albumin in Adult Cardiac Surgery: A Narrative Review. Can. J. Anesth. Can. Anesth. 2021, 68, 1197–1213. [CrossRef]
61. Geng, L.; Tian, X.; Gao, Z.; Mao, A.; Feng, L.; He, C. Different Concentrations of Albumin Versus Crystalloid in Patients with Sepsis and Septic Shock: A Meta-Analysis of Randomized Clinical Trials. J. Intensive Care Med. 2023, 38, 679–689. [CrossRef] [PubMed]
62. Sakr, Y.; Bauer, M.; Nierhaus, A.; Kluge, S.; Schumacher, U.; Putensen, C.; Fichtner, F.; Petros, S.; Scheer, C.; Jaschinski, U.; et al. Randomized Controlled Multicentre Study of Albumin Replacement Therapy in Septic Shock (ARISS): Protocol for a Randomized Controlled Trial. Trials 2020, 21, 1002. [CrossRef] [PubMed]
63. Semler, M.W.; Kellum, J.A. Balanced Crystalloid Solutions. Am. J. Respir. Crit. Care Med. 2019, 199, 952–960. [CrossRef] [PubMed]
64. Semler, M.W.; Self, W.H.; Wanderer, J.P.; Ehrenfeld, J.M.; Wang, L.; Byrne, D.W.; Stollings, J.L.; Kumar, A.B.; Hughes, C.G.; Hernandez, A.; et al. Balanced Crystalloids versus Saline in Critically Ill Adults. N. Engl. J. Med. 2018, 378, 829–839. [CrossRef]
65. Self, W.H.; Semler, M.W.; Wanderer, J.P.; Wang, L.; Byrne, D.W.; Collins, S.P.; Slovis, C.M.; Lindsell, C.J.; Ehrenfeld, J.M.; Siew,E.D.; et al. Balanced Crystalloids versus Saline in Noncritically Ill Adults. N. Engl. J. Med. 2018, 378, 819–828. [CrossRef]
66. Zampieri, F.G.; Machado, F.R.; Biondi, R.S.; Freitas, F.G.R.; Veiga, V.C.; Figueiredo, R.C.; Lovato, W.J.; Amêndola, C.P.; Serpa-Neto, A.; Paranhos, J.L.R.; et al. Effect of Intravenous Fluid Treatment with a Balanced Solution vs 0.9% Saline Solution on Mortality in Critically Ill Patients: The BaSICS Randomized Clinical Trial. JAMA 2021, 326, 818–829. [CrossRef]
67. Finfer, S.; Micallef, S.; Hammond, N.; Navarra, L.; Bellomo, R.; Billot, L.; Delaney, A.; Gallagher, M.; Gattas, D.; Li, Q.; et al. Balanced Multielectrolyte Solution versus Saline in Critically Ill Adults. N. Engl. J. Med. 2022, 386, 815–826. [CrossRef]
68. Vallon, V. Tubuloglomerular Feedback and the Control of Glomerular Filtration Rate. Physiology 2003, 18, 169–174. [CrossRef]
69. Toporek, A.H.; Semler, M.W.; Self,W.H.; Bernard, G.R.;Wang, L.; Siew, E.D.; Stollings, J.L.;Wanderer, J.P.; Rice, T.W.; Casey, J.D. Balanced Crystalloids versus Saline in Critically Ill Adults with Hyperkalemia or Acute Kidney Injury: Secondary Analysis of a
Clinical Trial. Am. J. Respir. Crit. Care Med. 2021, 203, 1322–1325. [CrossRef]
70. Demiselle, J.; Fage, N.; Radermacher, P.; Asfar, P. Vasopressin and Its Analogues in Shock States: A Review. Ann. Intensive Care 2020, 10, 9. [CrossRef]
71. Tarvasmäki, T.; Lassus, J.; Varpula, M.; Sionis, A.; Sund, R.; Køber, L.; Spinar, J.; Parissis, J.; Banaszewski, M.; Silva Cardoso, J.; et al. Current Real-Life Use of Vasopressors and Inotropes in Cardiogenic Shock—Adrenaline Use Is Associated with Excess Organ Injury and Mortality. Crit. Care Lond. Engl. 2016, 20, 208. [CrossRef]
72. De Backer, D.; Biston, P.; Devriendt, J.; Madl, C.; Chochrad, D.; Aldecoa, C.; Brasseur, A.; Defrance, P.; Gottignies, P.; Vincent, J.-L. Comparison of Dopamine and Norepinephrine in the Treatment of Shock. N. Engl. J. Med. 2010, 362, 779–789. [CrossRef]
73. Conti, N.; Gatti, M.; Raschi, E.; Diemberger, I.; Potena, L. Evidence and Current Use of Levosimendan in the Treatment of Heart Failure: Filling the Gap. Drug Des. Devel. Ther. 2021, 15, 3391–3409. [CrossRef]
74. Gordon, A.C.; Perkins, G.D.; Singer, M.; McAuley, D.F.; Orme, R.M.L.; Santhakumaran, S.; Mason, A.J.; Cross, M.; Al-Beidh, F.; Best-Lane, J.; et al. Levosimendan for the Prevention of Acute Organ Dysfunction in Sepsis. N. Engl. J. Med. 2016, 375, 1638–1648. [CrossRef]
75. McCurdy, M.T.; Busse, L.W. Rethinking Vasopressor Education: The Need to Avoid Teaching the Bare Minimum. ATS Sch. 2023, 4, 389–390. [CrossRef]
76. Khanna, A.; English, S.W.; Wang, X.S.; Ham, K.; Tumlin, J.; Szerlip, H.; Busse, L.W.; Altaweel, L.; Albertson, T.E.; Mackey, C.; et al. Angiotensin II for the Treatment of Vasodilatory Shock. N. Engl. J. Med. 2017, 377, 419–430. [CrossRef]
77. Busse, L.W.; McCurdy, M.T.; Ali, O.; Hall, A.; Chen, H.; Ostermann, M. The Effect of Angiotensin II on Blood Pressure in Patients with Circulatory Shock: A Structured Review of the Literature. Crit. Care Lond. Engl. 2017, 21, 324. [CrossRef]
78. Mercat, A.; Richard, J.-C.M.; Vielle, B.; Jaber, S.; Osman, D.; Diehl, J.-L.; Lefrant, J.-Y.; Prat, G.; Richecoeur, J.; Nieszkowska, A.;et al. Positive End-Expiratory Pressure Setting in Adults with Acute Lung Injury and Acute Respiratory Distress Syndrome: A Randomized Controlled Trial. JAMA 2008, 299, 646–655. [CrossRef]
79. Alviar, C.L.; Miller, P.E.; McAreavey, D.; Katz, J.N.; Lee, B.; Moriyama, B.; Soble, J.; van Diepen, S.; Solomon, M.A.; Morrow, D.A. Positive Pressure Ventilation in the Cardiac Intensive Care Unit. J. Am. Coll. Cardiol. 2018, 72, 1532–1553. [CrossRef]
80. Corp, A.; Thomas, C.; Adlam, M. The Cardiovascular Effects of Positive Pressure Ventilation. BJA Educ. 2021, 21, 202–209. [CrossRef]
81. Disselkamp, M.; Adkins, D.; Pandey, S.; Coz Yataco, A.O. Physiologic Approach to Mechanical Ventilation in Right Ventricular Failure. Ann. Am. Thorac. Soc. 2018, 15, 383–389. [CrossRef]
82. Atti, V.; Narayanan, M.A.; Patel, B.; Balla, S.; Siddique, A.; Lundgren, S.; Velagapudi, P. A Comprehensive Review of Mechanical Circulatory Support Devices. Heart Int. 2022, 16, 37–48. [CrossRef]
83. Thiele, H.; Ohman, E.M.; Desch, S.; Eitel, I.; de Waha, S. Management of Cardiogenic Shock. Eur. Heart J. 2015, 36, 1223–1230. [CrossRef]
84. Alkhunaizi, F.A.; Burkhoff, D.; Brener, M.I. Right-Sided Mechanical Circulatory Support—A Hemodynamic Perspective. Curr. Heart Fail. Rep. 2022, 19, 334–345. [CrossRef]
85. Vis, A.; Arfaee, M.; Khambati, H.; Slaughter, M.S.; Gummert, J.F.; Overvelde, J.T.B.; Kluin, J. The Ongoing Quest for the First Total Artificial Heart as Destination Therapy. Nat. Rev. Cardiol. 2022, 19, 813–828. [CrossRef]
86. Marasco, S.F.; Lukas, G.; McDonald, M.; McMillan, J.; Ihle, B. Review of ECMO (Extra Corporeal Membrane Oxygenation) Support in Critically Ill Adult Patients. Heart Lung Circ. 2008, 17 (Suppl. S4), S41–S47. [CrossRef]
87. Shin, T.G.; Choi, J.-H.; Jo, I.J.; Sim, M.S.; Song, H.G.; Jeong, Y.K.; Song, Y.-B.; Hahn, J.-Y.; Choi, S.H.; Gwon, H.-C. Extracorporeal Cardiopulmonary Resuscitation in Patients with Inhospital Cardiac Arrest: A Comparison with Conventional Cardiopulmonary Resuscitation. Crit. Care Med. 2011, 39, 1–7. [CrossRef]
88. Chen, Y.-S.; Lin, J.-W.; Yu, H.-Y.; Ko, W.-J.; Jerng, J.-S.; Chang, W.-T.; Chen, W.-J.; Huang, S.-C.; Chi, N.-H.; Wang, C.-H. Cardiopulmonary Resuscitation with Assisted Extracorporeal Life-Support versus Conventional Cardiopulmonary Resuscitation in Adults with in-Hospital Cardiac Arrest: An Observational Study and Propensity Analysis. Lancet 2008, 372, 554–561. [CrossRef]
89. Ostadal, P.; Rokyta, R.; Karasek, J.; Kruger, A.; Vondrakova, D.; Janotka, M.; Naar, J.; Smalcova, J.; Hubatova, M.; Hromadka, M.; et al. Extracorporeal Membrane Oxygenation in the Therapy of Cardiogenic Shock: Results of the ECMO-CS Randomized Clinical Trial. Circulation 2023, 147, 454–464. [CrossRef]
90. Thiele, H.; Zeymer, U.; Akin, I.; Behnes, M.; Rassaf, T.; Mahabadi, A.A.; Lehmann, R.; Eitel, I.; Graf, T.; Seidler, T.; et al. Extracorporeal Life Support in Infarct-Related Cardiogenic Shock. N. Engl. J. Med. 2023, 389, 1286–1297. [CrossRef]
91. Ling, R.R.; Ramanathan, K.; Poon, W.H.; Tan, C.S.; Brechot, N.; Brodie, D.; Combes, A.; MacLaren, G. Venoarterial Extracorporeal Membrane Oxygenation as Mechanical Circulatory Support in Adult Septic Shock: A Systematic Review and Meta-Analysis with Individual Participant Data Meta-Regression Analysis. Crit. Care 2021, 25, 246. [CrossRef]
92. Geller, B.J.; Sinha, S.S.; Kapur, N.K.; Bakitas, M.; Balsam, L.B.; Chikwe, J.; Klein, D.G.; Kochar, A.; Masri, S.C.; Sims, D.B.; et al. Escalating and De-Escalating Temporary Mechanical Circulatory Support in Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation 2022, 146, e50–e68. [CrossRef]
93. Sato, R.; Hasegawa, D.; Guo, S.C.; Nishida, K.; Dugar, S. Temporary Mechanical Circulatory Support in Sepsis-Associated Cardiogenic Shock with and Without Acute Myocardial Infarction. J. Cardiothorac. Vasc. Anesth. 2023, 9, 26. [CrossRef]
94. Chvojka, J.; Martinkova, V.; Benes, J.; Valesova, L.; Danihel, V.; Nalos, L.; Matejovic, M. Mechanical Circulatory Support in Refractory Vasodilatory Septic Shock: A Randomized Controlled Porcine Study. Shock 2020, 53, 124–131. [CrossRef]
95. Gilotra, N.A.; Stevens, G.R. Temporary Mechanical Circulatory Support: A Review of the Options, Indications, and Outcomes. Clin. Med. Insights Cardiol. 2014, 8 (Suppl. S1), 75–85. [CrossRef]
96. Mayr, V.D.; Dünser, M.W.; Greil, V.; Jochberger, S.; Luckner, G.; Ulmer, H.; Friesenecker, B.E.; Takala, J.; Hasibeder, W.R. Causes of Death and Determinants of Outcome in Critically Ill Patients. Crit. Care 2006, 10, R154. [CrossRef]
97. George, P.; Srivastava, M.C.; Ludmir, J.; Reed, R.M.; Tewelde, S.Z.; Gupta, A.; McCurdy, M.T. Augmenting Function for Infarction from Infection: Impella 2.5 for Ischemic Cardiogenic Shock Complicating Sepsis. Case Rep. Cardiol. 2017, 2017, 8407530. [CrossRef]
98. Petricevic, M.; Milicic, D.; Boban, M.; Mihaljevic, M.Z.; Baricevic, Z.; Kolic, K.; Dolic, K.; Konosic, L.; Kopjar, T.; Biocina, B. Bleeding and Thrombotic Events in Patients Undergoing Mechanical Circulatory Support: A Review of Literature. Thorac. Cardiovasc. Surg. 2015, 63, 636–646. [CrossRef]
99. Baumann Kreuziger, L.; Massicotte, M.P. Mechanical Circulatory Support: Balancing Bleeding and Clotting in High-Risk Patients. Hematology 2015, 2015, 61–68. [CrossRef]
[~DETAIL_TEXT] => Yichi Zhang , Michael T. McCurdy and Jonathan Ludmir
Sepsis Management in the Cardiac Intensive Care Unit
J. Cardiovasc. Dev. Dis. 2023, 10, 429. https://doi.org/10.3390/jcdd10100429
Абстракт: Лечение септического шока в кардиологическом отделении интенсивной терапии (КОИТ) является сложной задачей из-за сложного патофизиологического взаимодействия между вазодилататорным и кардиогенным шоком, что усложняет оптимальное применение инфузионной терапии, вазопрессоров и устройств механической поддержки кровообращения. Поскольку смешанный шок чреват высокой смертностью, для борьбы с широким спектром возможных осложнений необходимо знать качественные современные клинические данные, касающиеся доступных методов и средств лечения. Данный обзор объединяет принципы патофизиологии и клинические рекомендации и представляет собой организованный, тематический обзор тонкостей лечения сепсиса в отделении каодиореанимации и интенсивной терапии.
Ключевые слова: сепсис; интенсивная терапия; кардиология; реанимационная помощь; шок; отделение интенсивной терапии; кардиологическое отделение интенсивной терапии
1. Введение
Сепсис и септический шок являются частыми осложнениями, которые развиваются у пациентов кардиореанимации [1]. Сложные патофизиологические особенности и взаимодействие между кардиогенным шоком (КШ) и септическим шоком имеют решающее значение для нашего современного многогранного диагностического и терапевтического подхода. Этот текущий обзор литературы объединяет соответствующие принципы патофизиологии с рекомендациями по ведению пациентов с сепсисом и КШ.
2. Эпидемиология и определения
Третий международный консенсус определяет сепсис как «опасную для жизни дисфункцию органов, вызванную нарушением регуляции реакции организма на инфекцию». Органную дисфункцию можно дополнительно квалифицировать по изменению по шале SOFA на ≥2 балла по сравнению с исходным уровнем [2]. Хотя шкалу qSOFA, проще использовать, поскольку она учитывает только частоту дыхания, уровень сознания и систолическое артериальное давление , она имеет низкую прогностическую точность. по сравнению с его традиционной шкалой SOFA [3]. В частности, оценка qSOFA сама по себе не должна использоваться для диагностики сепсиса, а скорее как ускоренный прогностический инструмент для прогнозирования смертности у пациентов с сепсисом. Септический шок, определяемый как ухудшение гемодинамики на фоне сепсиса, характеризуется необходимостью применения вазопрессоров для поддержания среднего артериального давления на уровне 65 мм рт. ст. и уровня лактата в сыворотке > 2 ммоль/л [4]. В этом случае септический шок следует рассматривать в первую очередь при отсутствии гиповолемии, поскольку инфекции часто могут вызывать постоянные потери жидкости (например, диарея или рвота), что приводит к гиповолемическому компоненту шока, который следует устранить в первую очередь. В общей сложности от 6 до 37% пациентов ОИТ страдают сепсисом [5,6], и до 44% пациентов, у которых развился сепсис, умирают [5]. Кроме того, у пациентов с инфарктом миокарда (ИМ), осложненным сепсисом, вероятность смерти на 103% выше, чем у пациентов с «несептическим» ИМ [7]. Аналогичным образом, несердечная мультисистемная органная недостаточность также значительно более распространена в когортах сепсиса. Несмотря на отсутствие стандартного определения КШ [6], один из самых известных критериев, возникший в исследовании SHOCK в 1999 году, определил его как (1) САД < 90 мм рт. ст. в течение > 30 мин или необходимость применения вазопрессоров для поддержания САД ≥ 90 мм рт. ст. ; (2) гипоперфузия органов-мишеней (например, диурез <30 мл/час или холодные конечности; и (3) сердечный индекс (CI) < 2,2 л/мин/м2 и давление заклинивания в легочных капиллярах >15 мм рт. ст. [8]. В последних рекомендациях Европейского общества кардиологов КШ определяется аналогичным образом [9].
3. Патофизиология кардиогенного и септического шока
Кардиогенный шок чаще всего возникает на фоне острого инфаркта миокарда (ОИМ), но может возникнуть и вследствие декомпенсации сердечной недостаточности, массивной ТЭЛА, миокардита, тяжелой дисфункции клапанов и других причин [10].
При КШ на фоне ОИМ инфаркт приводит к снижению сократимости и сердечного выброса (СВ), что приводит к увеличению конечного диастолического давления в левом желудочке (LVEDP). Поскольку левосторонняя коронарная перфузия зависит от разницы между диастолическим артериальным давлением и LVEDP, более жесткие стенки ЛЖ (и, соответственно, более высокое LVEDP) снижают коронарное перфузионное давление (CPP), тем самым уменьшая возможности аэробного дыхания и способствуя нестабильности системной гемодинамики [11]. В отличие от левого желудочка, правый желудочек перфузируется как во время диастолы, так и во время систолы, хотя его CPP по-прежнему определяется разницей между САД и давлением в правой желудочке. Первоначальной реакцией периферической сосудистой сети при сердечной дисфункции является вазоконстрикция для сохранения перфузионного давления [12], а клетки по всему телу максимизируют извлечение кислорода из соответствующих капилляров, чтобы компенсировать снижение кровотока [13].
Сепсис приводит к расширению сосудов периферического кровообращения под действием оксида азота (NO). Провоспалительные цитокины, такие как фактор некроза опухоли (TNF) или интерлейкин-1 (IL-1), активируются в результате острой инфекции и воспаления, увеличивая выработку NO, который активирует гуанилатциклазу [14]. Конечный продукт этого каскада, циклический гуанозинмонофосфат (GMP) , затем расслабляет гладкую мускулатуру сосудов и подавляет сосудистый тонус [15]. Таким образом, расширенные сосуды больше не могут поддерживать перфузионное давление, необходимое для оптимального физиологического функционирования, что приводит к мультиорганной органной недостаточности. Сердечная дисфункция может наблюдаться у 44% пациентов с септическим шоком [16]. Сепсис может ухудшить функцию кровообращения, затрагивая либо периферическую сосудистую систему [14], либо функцию миокарда [17]. Сепсис отрицательно влияет на функцию миокарда напрямую посредством нескольких различных механизмов. Во-первых, вышеупомянутый сосудорасширяющий фактор NO оказывает ингибирующее действие на бета-адренергические (β1) рецепторы, которые в норме отвечают за увеличение частоты сердечных сокращений и сократимости [17]. Снижение активности β1-рецепторов приводит к тому, что сердце теряет компенсаторный резерв для борьбы с шоком. Во-вторых, связанная с сепсисом митохондриальная дисрегуляция и последующее образование активных форм кислорода (ROS) также могут напрямую подавлять сердечную функцию [18]. Клетки миокарда часто насыщены митохондриями из-за их высоких аэробных потребностей в производстве энергии. Таким образом, воспалительные цитокины, которые приводят к митохондриальной дисфункции, могут привести к чрезмерному накоплению активных форм кислорода и прямому цитотоксическому повреждению кардиомиоцитов. Кроме того, сепсис может вызывать дисфункцию системы комплемента, при этом фактор комплемента C5a, мощный агент хемотаксиса тучных клеток и нейтрофилов, может напрямую подавлять функцию клеток миокарда [19]. Нацеливание на эти менее изученные механизмы прямого подавления миокарда может стать достойным направлением будущих биомедицинских или фармацевтических исследований.
4. Гемодинамическая оценка и диагностика коморбидного сепсиса и кардиогенного шока
Распознавание и своевременная диагностика коморбидного септического и кардиогенного шока в ОРИТ может оказаться сложной задачей. Для дальнейшего понимания (Table 1) этиологии шока, будь то кардиогенный, дистрибутивный, обструктивный или какая-либо их комбинация, необходима комплексная гемодинамическая оценка. Коморбидный септический и кардиогенный шок демонстрируют уникальные изменения гемодинамических параметров (например, сердечного индекса, давления наполнения желудочков, насыщения кислородом смешанной венозной крови), которые могут существовать в «парадоксальных» комбинациях (например, сосуществование сохраненного сердечного индекса с высоким давлением наполнения). Таким образом, в этих сложных сценариях смешанного шока частая и тщательная оценка клинического статуса пациентов и параметров гемодинамики становится еще более необходимой для правильной диагностики и, в конечном итоге, для адекватного лечения.

Сердечные биомаркеры обычно получают в рамках первоначального исследования при подозрении на острую сердечную дисфункцию, включая тропонин и NT-proBNP [6]. В частности, тропонин I часто рассматривается как маркер повреждения миокарда при остром коронарном синдроме, одной из наиболее частой этиологии кардиогенного шока. Данные метаанализа также предполагают потенциальное использование тропонина I в качестве прогностического маркера при септическом шоке, и продолжаются попытки изучить это в крупномасштабных проспективных исследованиях [20,21]. С другой стороны, NT-proBNP часто используется в качестве суррогатного маркера для оценки волемического статуса и застойной сердечной недостаточности.
Аналогично, в ретроспективном анализе было обнаружено, что NT-proBNP также имеет прогностическую ценность при септическом шоке [22]. Однако существенное ограничение полезности как тропонина I, так и NT-proBNP при коморбидном септическом и кардиогенном шоке заключается в их специфичности. Оба маркера часто обнаруживаются повышенными у пациентов с хроническими воспалительными заболеваниями, а также с почечной дисфункцией, что приводит к проблемам с интерпретацией. Кроме того, ренин плазмы также исследовался в качестве биомаркера для прогноза и лечения шока, со сравнением его прогностической ценности с прогностической ценностью сывороточного лактата. Например, положительная скорость изменения уровня ренина в плазме, но не лактата, в течение более 72 часов была связана с увеличением внутрибольничной смертности [23]. В аналогичном контексте новые биомаркеры, такие как ST2 (член семейства рецепторов интерлейкина) [24], копептин (молекула, высвобождающаяся совместно с аргинин-вазопрессином) [25] и фактор дифференцировки роста 15 (GDF-15, белок из суперсемейства трансформирующего ростового фактора β) [26] исследуются в ретроспективных и проспективных исследованиях на предмет их прогностической ценности как при кардиогенном, так и при септическом шоке. Однако их нынешнее клиническое применение сильно затруднено из-за ограниченной доступности, которая в значительной степени сконцентрирована в крупных академических клинических центрах.
Два десятилетия назад знаковое исследование показало преимущество в снижении смертности от ранней целенаправленной терапии (EGDT), включающей гемодинамический мониторинг преднагрузки, постнагрузки и сатурации кислорода с помощью центрального венозного катетера у пациентов с септическим шоком [27]. Несмотря на то, что последующие исследования и метаанализы не подтвердили преимущества применения конкретного протокола EGDT [27], тщательный гемодинамический мониторинг и, как следствие, своевременные соответствующие вмешательства, тем не менее, получили широкую популяризацию в условиях интенсивной терапии.
Широкий спектр инвазивных и неинвазивных инструментов и маркеров (например, CO2 в конце выдоха [ETCO2], индекс коллабируемости нижней полой вены [IVC] при прикроватном УЗИ [POCUS]) был оценен на предмет их полезности для мониторинга гемодинамики при сепсисе и кардиогенном шоке [28].
В частности, POCUS обеспечивает быструю и удобную глобальную оценку функции как левого, так и правого желудочков, может быть выполнена с использованием дистанционного наведения даже в самых жестких условиях. [29]. В исследованиях POCUS изучалась полезность венозного допплеровского анализа формы волны только нижней полой вены, а также комплексного анализа печеночных, воротных и почечных вен для ультразвуковой оценки венозного избытка (VExUS), чтобы помочь предсказать тяжесть венозного застоя [30,31]. Кроме того, развитие системы POCUS с искусственным интеллектом может снизить общий барьер для входа в систему и повысить надежность межоперационного взаимодействия для таких более зависимых от навыков измерений, как интеграл скорости и времени оттока из левого желудочка (VTI) [32].
Однако не менее важно признать и ограничения POCUS, поскольку он сам по себе не может заменить комплексную оценку сердечно-сосудистой системы. Таким образом, результаты POCUS всегда следует рассматривать в контексте физикального осмотра и других клинических параметров, чтобы составить более полную картину гемодинамического статуса. Кроме того, возможно, самый простой метод оценки реакции на жидкость может быть достигнут с помощью «пассивного подъема ноги», который эффективно доставляет к сердцу около 300 мл преднагрузки [33]. Этот маневр безопасен благодаря его быстрой обратимости и может использоваться как часть первоначальной оценки гемодинамики, даже до введения болюсного тестового введения жидкости.
Новые достижения в технологии интенсивной терапии привели к появлению инструментов для мониторинга гемодинамики, таких как анализ контура пульса, который собирает данные из артериальной линии для расчета сердечного выброса [34,35]. Эта технология была валидирована по сравнению с катетеризацией легочной артерии у стабильных пациентов, подвергающихся хирургическому вмешательству, однако ее эффективность может быть менее надежной в клинических сценариях с чрезвычайно низким сосудистым сопротивлением, таких как сепсис и цирроз [35]. Хотя эти устройства могут учитывать эффекты введения жидкости, их надежность должна быть сбалансирована с клинической картиной.
В настоящее время золотым стандартом гемодинамической оценки кардиогенного шока остается катетер легочной артерии (PAC) [36]. Несмотря на свою инвазивность, PAC может предоставить важнейшие данные о давлении в левой и правой половине сердца и сердечном выбросе в режиме реального времени для принятия решений о тактике лечения. Несмотря на его способность предоставлять эти гемодинамические данные, остается много вопросов относительно влияния этих данных на снижение смертности от кардиогенного шока, как предполагает знаковый метаанализ, проведенный Shah et al. в 2005 году [37]. Авторы пришли к выводу, что, возможно, отсутствие пользы от использования PAC связано с отсутствием «эффективных, научно обоснованных методов лечения», используемых в сочетании с PAC [37]. Однако за последнее десятилетие достижения и инструменты в области кардиологической интенсивной терапии популяризировали использование PAC для мониторинга терапевтического эффекта в режиме реального времени. Недавние ретроспективные анализы показывают, что PAC связан с более низкой 30-дневной смертностью, сопоставленной по склонности [38].
Например, PAC может характеризовать смешанные профили шока и способствовать принятию клинических решений, связанных с механической поддержкой кровообращения (MCS). Постоянное ухудшение гемодинамики может служить основанием для перехода от внутриаортальной балонной помпы (IABP) к Impella, добавления поддержки левожелудочкового вспомогательного устройства (LVAD) пациентам только с RVAD или начала и повышения параметров экстракорпоральной мембранной оксигенации (ЭКМО) [39]. Хотя необходимы проспективные РКИ, PAC остается бесценным инструментом, помогающим врачам-реаниматологам оценивать гемодинамический статус пациентов с тяжелым кардиогенным шоком.
5. Рекомендации по лечению
Смертность, связанная с кардиогенным шоком, в кардиореанимации значительна, но коморбидный септический шок добавляет дополнительный уровень сложности и риска, который требует раннего распознавания, тщательного мониторинга и системного подхода к лечению (Figure 1).

5.1. Противомикробные препараты
Ранняя эмпирическая антимикробная терапия имеет решающее значение для лечения сепсиса и септического шока, предпочтительно в течение одного часа после выявления признаков и симптомов [40]. Эмпирические противомикробные препараты выбираются на основе наиболее вероятного патогена и индивидуальных факторов риска пациента, таких как ослабление иммунитета или недавняя госпитализация [41]. В рекомендациях SurvivingSepsis Campaign 2021 года по первоначальному выбору эмпирической антибиотикотерапии предлагается начинать с препаратов широкого спектра действия в течение одного часа после выявления признаков и симптомов сепсиса, а затем адаптировать ее к результатам посева и чувствительности у конкретного пациента, а также к местному уровню антибиотикорезистентности [42].
Эмпирический охват грамотрицательных бактерий часто считается стандартным и единообразным при лечении сепсиса. Эти патогены могут выделять эндотоксины, полученные из компонентов их клеточной стенки, таких как липид А, который может быть чрезвычайно иммуногенным, вызывая массивную воспалительную реакцию за счет выработки цитокинов (например, TNF-альфа) [43].
Кроме того, патоген-ассоциированные молекулярные паттерны (PAMP), которые являются продуктами распада микроорганизмов, также исследовались как на предмет их диагностической, так и терапевтической полезности, особенно в условиях сепсиса с отрицательными культурами [44]. Обычно используемые антибиотики для лечения грамотрицательного сепсиса включают пиперациллин-тазобактам, фторхинолоны, такие как левофлоксацин, цефалоспорины, такие как цефтазидим и цефепим, а также карбапенемы, такие как меропенем [45]. Охват грамотрицательных бактерий должен включать борьбу с Pseudomonas aeruginosa, грамотрицательной палочкой, связанной с высокими показателями устойчивости к антибиотикам и смертности [46]. Из-за изначально высокого уровня устойчивости к антибиотикам у грамотрицательных бактерий, таких как Pseudomonas и Enterobacteriaceae, Infection Disease Society of America (IDSA) поддерживает использование комбинированного лечения грамотрицательных микроорганизмов у пациентов с септическим шоком [47] до тех пор, пока не будут получены результаты чувствительности [48]. Кроме того, для пациентов, которые подвергаются высокому риску заражения MRSA либо из-за положительных результатов посева в прошлом, либо из-за недавнего контакта с медицинским учреждением, рекомендуется эмпирическое использование анти-MRSA препаратов до тех пор, пока не будут получены окончательные результаты посева [49].
Как только микроорганизм и источник инфекции будут идентифицированы, необходимо провести борьбу с источником в форме хирургического вмешательства и/или хирургической обработки или удаления трубок/дренажей/постоянных катетеров, а все противомикробные препараты следует как можно скорее деэскалировать, чтобы избежать параллельного ущерба [42]. Среди различных побочных эффектов длительного применения антибиотиков один менее изученный механизм, который может еще больше усложнить гемодинамическую функцию при коморбидном сепсисе и кардиогенном шоке, заключается в том, что растворы для внутривенных антибиотиков могут содержать большое количество натрия [50]. Например, при стандартной дозировке внутривенный ванкомицин может доставить поразительные 3540 мг натрия за 24 часа терапии, тогда как внутривенный пиперациллин-тазобактам добавит еще 2280 мг за тот же период [51]. Увеличение объема из-за солевой перегрузки может спровоцировать отек легких, кардиоренальный синдром и другие дисфункции органов-мишеней, особенно на фоне существующей сердечной дисфункции. Хотя соответствующие противомикробные препараты являются важной терапией при сепсисе, их постоянное разумное использование особенно важно при лечении коморбидного кардогенного шока.
5.2. Инфузионная терапия
Оптимальная инфузионная терапия является важным компонентом лечения сепсиса, поскольку многие пациенты поступают с гиповолемией из-за низкого перорального поступления жидкости и повышенных потерь из-за потоотделения, вызванного лихорадкой, что может дополнительно осложняться вызванным массивным воспалением низким тонусом сосудов и утечкой жидкости [52]. До недавнего времени большинство руководств рекомендовали агрессивную инфузию кристаллоидами при сепсисе с начальным болюсом 30 мл/кг массы тела с последующим введением поддерживающих объемов с целью достижения постоянного САД > 65 мм рт. ст. [53]. Однако современные метаанализы крупных РКИ показали, что меньшие объемы кристаллоидов не приводят к худшим результатам, что ставит под сомнение идеальный объем жидкости для лечения сепсиса [54,55]. Таким образом, в текущих рекомендациях Surviving Sepsis 2021 г. приводятся недостаточные доказательства, чтобы давать рекомендации относительно либеральной или ограничительной стратегии введения жидкости в первые 24 часа [49].
Существует давняя дискуссия о том, улучшит ли использование коллоидов (например, альбумина) для инфузионной терапии результаты по сравнению с кристаллоидами. Только 25% из каждого 1 л введенных кристаллоидов, в отличие от почти 50% введенных коллоидов, остается в плазме после распределения по различным внутриклеточным и внеклеточным пространствам. Кроме того, период полувыведения введенных кристаллоидов по сравнению с коллоидами, находящимися в кровообращении, составляет всего около 20–40 минут против 2–3 часов соответственно [56,57]. Многочисленные РКИ (например, SAFE, CRISTAL, ALBIOS) сравнивают эффективность кристаллоидов и коллоидов в ОИТ; однако ни одно из них не продемонстрировало значительной разницы в смертности или повреждении почек [56,58,59]. Аналогичным образом, коллоиды обычно используются для восстановления объема после операции на сердце, несмотря на их более высокую стоимость и отсутствие доказательств их превосходства над кристаллоидами [60]. Примечательно, что выводы некоторых из этих исследований ограничены обобщением различных типов коллоидных растворов, а также использованием коллоидов низкой концентрации. Недавно метаанализ более 5000 пациентов с септическим шоком действительно показал улучшение 90-дневных результатов при использовании 20% альбумина по сравнению с использованием кристаллоидов, что требует дальнейших проспективных исследований [61,62].
Еще одним фактором выбора жидкости при реанимации является выбор между различными кристаллоидными растворами (Table 2).

Хотя физиологический раствор, содержащий 154 мг-экв натрия и эквивалентное количество хлорида, может быть наиболее широко используемым вариантом, последние клинические данные подтверждают эффективность использования более «сбалансированных» растворов, таких как лактат Рингера и Plasma-Lyte, в большинстве клинических ситуаций. По сравнению с физиологическим раствором эти жидкости содержат концентрации электролитов, более физиологически схожие с плазмой [63]. Обычно это означает более низкие уровни натрия и хлоридов и добавление 4–5 мэкв/л калия вместе с буферным компонентом (например, лактатом), который в конечном итоге метаболизируется до бикарбоната. РКИ, сравнивающие использование физиологического раствора со «сбалансированными» кристаллоидами, показали неоднозначные результаты: исследования SMART[64] и SALT-ED [65] показали небольшое преимущество лактата Рингера, а BASICS [66] и PLUS [67]. не продемонстрировали различий в смертности или повреждении почек. Сторонники использования «сбалансированных» кристаллоидов называют высокую нагрузку хлоридами фактором риска гиперхлоремического метаболического ацидоза. Кроме того, эта нагрузка хлоридами, доставляемыми в maculadensa, может быть основным фактором острого повреждения почек, поскольку канальцево-клубочковая обратная связь вызывает вазоконстрикцию афферентных сосудов [68]. Между тем, сторонники физиологического раствора указывают на добавление калия в «сбалансированные» кристаллоиды как на потенциальное усугубление гиперкалиемии у пациентов из группы риска, но этот миф был в значительной степени развеян в последующих исследованиях [69]. Для пациентов с коморбидным сепсисом и кардиогенным шоком важна частая повторная оценка состояния волемии для определения необходимости инфузионной терапии или ограничения жидкости после восстановления гемодинамики. В исследовании CLOVERS пациенты с гипотонией, связанной с сепсисом, были рандомизированы на рестриктивную или либеральную стратегию введения жидкости и не обнаружили различий в 90-дневной смертности между двумя группами [70]. В конечном счете, решения, связанные с введением жидкости при коморбидном сепсисе и кардиогенном шоке, могут быть сложными, но разумным подходом является начинать с меньших болюсов жидкости и определять будущие потребности с частыми повторными оценками на основе результатов обследования и объективных данных.
5.3. Вазопрессоры
Использование вазопрессоров является краеугольным камнем в лечении септического шока для устранения низкого сосудистого сопротивления, гипотонии и последующей плохой перфузии органов вследствие массивного воспаления. Чтобы поддерживать целевой показатель САД на уровне ≥65 мм рт. ст., предложенном SurvivingSepsis campaign 2021 года [42], можно увеличивать дозу различных вазоактивных препаратов или использовать их в сочетании друг с другом. Норадреналин является наиболее часто используемым препаратом и считается экспертами и консенсусом в качестве препарата первой линии. Его активность в отношении как альфа-, так и бета-адренорецепторов способствует не только повышению сосудистого тонуса, но и сократимости миокарда.
Вазопрессин является препаратом второй линии, который часто добавляют, когда целевые значения САД не могут быть достигнуты только за счет введения норадреналина или для снижения катехоламинергической нагрузки, которая потенциально может вызвать такие проблемы, как аритмия [70]. Вазопрессин, или антидиуретический гормон (ADH), действует на рецепторы V1 и V2, повышая сосудистый тонус и задерживая жидкость в почках соответственно. У пациентов с кардиогенным шоком, нуждающихся в инотропных препаратах (например, милринон, добутамин) и имеющих сопутствующий дистрибутивный шок, вторичный по отношению к сепсису, часто необходима поддержка вазопрессорами с повышением титра, а также следует оптимизировать использование инотропных препаратов. Адреналин часто используется как двойной инотроп и вазопрессор, чтобы минимизировать потребность в норэпинефрине. Сильный бета-адренергический агонизм и альфа-агонизм адреналина делают его полезным при сердечной дисфункции, хотя в сочетании с норадреналином увеличивается риск перегрузки катехоламинами. В частности, риск опасных для жизни аритмий и ишемии органов вследствие значительного сосудистого тонуса увеличивается при длительном комбинированном применении таких препаратов.
Кроме того, чрезмерное применение адренергических препаратов может повысить сопротивление легочных сосудов, что может способствовать декомпенсации у пациентов с существующей дисфункцией правого желудочка. Поскольку чрезмерное использование адренергических препаратов может увеличить смертность у пациентов с кардиогенным шоком [71], настоятельно рекомендуется разумное использование минимально возможной дозы и минимально возможной продолжительности лечения. Исторически дофамин широко использовался при шоке из-за его интересного дозозависимого агонизма к дофаминергическим и адренергическим рецепторам; однако сравнительные исследования с норэпинефрином показали более частые побочные эффекты, такие как аритмии и повышенную смертность у пациентов с кардиогенным шоком [72]. Новые инотропы, такие как левосимендан, также активно исследуются на предмет их эффективности и безопасности по сравнению с традиционными препаратами [73], хотя никакие преимущества в отношении смертности не подтверждают его использование вместо стандартных методов лечения септического шока [74]. Роль этих новых агентов необходимо будет дополнительно изучить, прежде чем можно будет дать надежные рекомендации.
Еще один особенно интересный агент, заслуживающий обсуждения, который оказывает влияние на ренин-ангиотензин-альдостероновую систему (РААС) — ангиотензин II (АТ-II). РААС была ключевой фармакологической мишенью в лечении гипертонии, заболеваний почек и предотвращении неблагоприятного ремоделирования сердца, однако, несмотря на >30 лет клинического применения, ее роль в лечении шока до недавнего времени игнорировалась [75]. РКИ 2017 года продемонстрировало, что AT-II эффективно повышает САД на ≥10 мм рт.ст. от исходного уровня или до ≥75 мм рт.ст. у пациентов с вазодилатирующим шоком, которым требовалась инфузия норадреналина >0,2 µг/кг/мин, по сравнению с плацебо [76]. AT-II улучшил показатель SOFA через 48 часов без увеличения побочных эффектов по сравнению с плацебо. Обзор 24 исследований с использованием AT-II также продемонстрировал, что он эффективно увеличивает САД в среднем на 23,4% у пациентов с циркуляторным шоком [77]. В конечном счете, медикаментозная терапия, направленная на РААС, может стать мощным инструментом наряду с адренергически модифицирующими агентами для лечения шока.
5.4. Вентиляция с положительным давлением
У пациентов с сепсисом часто развиваются опасные для жизни нарушения дыхания либо в результате прямой инфекции паренхимы легких (например, пневмония), либо в результате развития острого респираторного дистресс-синдрома (ОРДС), когда воспаление приводит к массивной утечке из легочных капилляров и альвеолярному коллапсу. Этим пациентам часто требуется быстрое увеличение частоты неинвазивной или инвазивной вентиляции с положительным давлением (PPV) [78]. Хотя PPV критически поддерживает расширение альвеол и обмен кислорода через альвеолярную мембрану, она также оказывает различные гемодинамические эффекты на левый и правый желудочки. Как правило, функция левого желудочка выигрывает от PPV в виде снижения постнагрузки в результате рефлекторного ответа барорецепторов на компрессию аорты [79]. Однако PPV увеличивает как внутригрудное давление, так и сопротивление легочных сосудов (PVR) [80]. Эти гемодинамические воздействия становятся чрезвычайно важными при дисфункции правого желудочка. Увеличение внутригрудного давления может уменьшить объем венозного возврата, что приводит к снижению преднагрузки правого желудочка. Одновременно с этим PPV может вызывать перераздувание альвеол, что, в свою очередь, приводит к сдавлению сосудистого русла, увеличению легочного сосудистого сопротивления и, как следствие, увеличению постнагрузки на правый желудочек. В совокупности снижение преднагрузки и увеличение постнагрузки могут усугубить основные нарушения функции правого желудочка и значительно увеличить его работу и потребность в кислороде [81]. Впоследствии тяжелая дисфункция правого желудочка может привести к недостаточному обеспечению преднагрузки левого желудочка, вызывая левожелудочковую недостаточность и ухудшая сердечный выброс, что в конечном итоге приводит к гемодинамическому кризису. Таким образом, необходимо тщательно контролировать и поддерживать тонкий баланс между вентиляцией, оксигенацией и перфузией [79].
5.5. Механическая поддержка кровообращения
Устройства временной механической поддержки кровообращения (MCS) улучшают системную перфузию, дают время для восстановления миокарда после травмы и служат либо мостом к выздоровлению, либо мостом к более радикальному вмешательству (например, долговременному устройству, трансплантации сердца) [82]. Быстрое развитие MCS в последние годы предоставило новые возможности для пациентов с кардиогенным шоком, которые н отвечают на инфузионную терапию и вазопрессоры [83]. Правосторонние унивентрикулярные поддерживающие устройства обычно помогают обойти отказавший правый желудочек, тем самым улучшая преднагрузку левого желудочка и системную перфузию. Примеры устройств RV MCS включают Impella RP Flex и Protek Duo [84]. Левосторонние устройства (например, внутриаортальные баллонные насосы (IABP), серии Impella, TandemHeart) либо непосредственно способствуют увеличению сердечного выброса, либо увеличивают коронарную перфузию левого желудочка за счет улучшения диастолического коронарного кровотока [82]
Между тем, бивентрикулярная поддержка может быть достигнута с помощью веноартериальной экстракорпоральной мембранной оксигенации (VAECMO), бивентрикулярных вспомогательных устройств (например, BiPellas, Impella/Protek, хирургических BiVAD CentriMag) или тотального искусственного сердца (TAH) [85]. В частности, VAECMO все чаще используется в качестве моста к окончательной терапии в виде трансплантации или длительного LVAD для пациентов с сердечным индексом <2 л/мин/м2, с отсутствием восстановления миокарда, низким САД, несмотря на вазопрессоры, и другие методы MCS [86]. Несмотря на высокие абсолютные показатели смертности (т.е. 50–70%) в этой группе пациентов, использование VAECMO у пациентов с кардиогенным шоком, вызванным инфарктом миокарда, не улучшило клинические результаты [87,88]. Откладывание начала VAECMO до тех пор, пока у пациентов с тяжелым кардиогенным шоком не наступит клиническое ухудшение, может привести к таким же результатам, как и начало ее вскоре после постановки диагноза. Фактически, недавнее крупное РКИ показало, что среди пациентов с острым инфарктом миокарда, осложненным кардиогенным шоком, экстракорпоральное жизнеобеспечение не улучшило 30-дневную смертность по сравнению со стандартной медикаментозной терапией [89,90].
Несмотря на эти результаты, VAECMO остается важным инструментом при кардиогенном шоке, и разумное принятие клинических решений оправдано, чтобы помочь выявить пациентов, которые могут получить наибольшую пользу от VAECMO в качестве моста к окончательной терапии. Хотя MCS не может быть показан при первичном септическом шоке, при тщательном рассмотрении риска и преимуществ он может служить полезным инструментом для лечения рефрактерного смешанного вазодилататорного и кардиогенного шока [91]. У пациентов, у которых развился сепсис или септический шок во время использования MCS, следует разработать план действий на случай непредвиденных обстоятельств относительно того, следует ли и когда повышать уровень механической поддержки. Например, после тщательного анализа риска и пользы пациенту, получающему только поддержку правого желудочка, можно рассмотреть возможность установки временного устройства левого желудочка, если гемодинамика ухудшается при сепсисе [92]. Аналогичным образом, у пациентов, находящихся на VAECMO, следует рассмотреть вопрос о повышении параметра потока, если развивается сценарий смешанного шока [92].
Примечательно, что в недавнем ретроспективном анализе использования временной MCS при кардиогенном шоке, связанном с сепсисом, только использование внутриаортальной баллонной помпы (IABP) и устройств вспомогательного кровообращения (VAD) было связано с более низким риском внутрибольничной смертности [93]. У пациентов с септическим шоком и острым инфарктом миокарда MCS не продемонстрировала улучшения выживаемости. Хотя модели на животных находятся в стадии изучения [94], необходимы дальнейшие проспективные РКИ для дальнейшего выяснения результатов временного использования MCS у пациентов с сочетанием септического и кардиогенного шока.
Еще одно противоречие вокруг использования MCS сердца у пациентов с сепсисом связано с потенциальным риском появления нового потенциального источника или очага инфекции [91]. Во-первых, сепсис не является абсолютным противопоказанием для начала МКС [95]. Как независимые факторы, септический шок и кардиогенный шок уже каждый создают высокий риск смертности, а при совместном развитии они способствуют еще более быстрой декомпенсации [96]. Таким образом, гемодинамическая польза, получаемая при разумном использовании MCS, часто перевешивает потенциальный риск новой инфекции, связанной с устройством [97]. Наконец, начало различных MCS, особенно ЭКМО, может привести к риску как гемолиза, так и тромбоза, часто вторичного по отношению к напряжению сдвига, оказываемому на эритроциты и тромбоциты, что требует эмпирической антикоагулянтной терапии [98,99]. Без крупномасштабного проспективного исследования, оценивающего, как оптимально сбалансировать риски кровотечений и тромботических осложнений при использовании MCS у пациентов с сочетанием септического и кардиогенного шока, любое обсуждение соотношения риска и пользы должно включать этот вопрос. Решение о том, перевешивает ли гемодинамическая польза, обеспечиваемая MCS, повышенный риск массивного кровотечения или венозной тромбоэмболии, должно приниматься индивидуально для каждого пациента.
6. Выводы и перспективы на будущее
Лечение сепсиса в отделениях кардиореанимации является сложным, сложным и быстро развивающимся из-за постоянного появления новых данных по инфузионной терапии и использованию вазопрессоров, а также передовых технологий MCS. Инструменты скрининга и лечения сепсиса, управляемые искусственным интеллектом, также подвергаются активному моделированию и тестированию, хотя к их первоначальным применениям всегда следует подходить с равным оптимизмом и осторожностью.
References
1. Feldman, E.W.; Dugan, E.; Stephens, R.S.; Schulman, S.; Zakaria, S.; Metkus, T. Presentation and Outcomes of Sepsis in the Cardiac Intensive Care Unit. Am. Heart J. Plus Cardiol. Res. Pract. 2021, 7, 100040. [CrossRef] [PubMed]
2. Singer, M.; Deutschman, C.S.; Seymour, C.W.; Shankar-Hari, M.; Annane, D.; Bauer, M.; Bellomo, R.; Bernard, G.R.; Chiche, J.-D.; Coopersmith, C.M.; et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315,801–810. [CrossRef] [PubMed]
3. Govindan, S.; Prescott, H.C. Quick Sequential Organ Failure Assessment: Illness Severity Indicator, Clinical Decision Support Tool, or Both? Crit. Care Med. 2017, 45, 1947–1949. [CrossRef]
4. Thompson, K.; Venkatesh, B.; Finfer, S. Sepsis and Septic Shock: Current Approaches to Management. Intern. Med. J. 2019, 49, 160–170. [CrossRef] [PubMed]
5. Jentzer, J.C.; Bhat, A.G.; Patlolla, S.H.; Sinha, S.S.; Miller, P.E.; Lawler, P.R.; van Diepen, S.; Khanna, A.K.; Zhao, D.X.; Vallabhajosyula, S. Concomitant Sepsis Diagnoses in Acute Myocardial Infarction-Cardiogenic Shock: 15-Year National Temporal Trends,Management, and Outcomes. Crit. Care Explor. 2022, 4, e0637. [CrossRef] [PubMed]
6. Vahdatpour, C.; Collins, D.; Goldberg, S. Cardiogenic Shock. J. Am. Heart Assoc. 2019, 8, e011991. [CrossRef]
7. Kobbari, G.; Yandrapalli, S.; Anugu, V.R.; Pasam, R.T.; Atti, V.; Kanaparthy, N.; Nabors, C.; Aronow, W. Incidence and Outcomes of Cardiogenic Shock in Patients with Sepsis Complicated by Acute Myocardial Infarction. J. Am. Coll. Cardiol. 2019, 73 (Suppl. S1), 288. [CrossRef]
8. Hochman, J.S.; Sleeper, L.A.; Webb, J.G.; Sanborn, T.A.; White, H.D.; Talley, J.D.; Buller, C.E.; Jacobs, A.K.; Slater, J.N.; Col, J.; et al.
Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. SHOCK Investigators. Should We
Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N. Engl. J. Med. 1999, 341, 625–634. [CrossRef]
9. Ponikowski, P.; Voors, A.A.; Anker, S.D.; Bueno, H.; Cleland, J.G.F.; Coats, A.J.S.; Falk, V.; González-Juanatey, J.R.; Harjola, V.-P.; Jankowska, E.A.; et al. 2016 ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure of the European Society of Cardiology (ESC)Developed with the Special Contribution of the Heart Failure Association (HFA) of the ESC. Eur. Heart J. 2016, 37, 2129–2200. [CrossRef]
10. Chioncel, O.; Parissis, J.; Mebazaa, A.; Thiele, H.; Desch, S.; Bauersachs, J.; Harjola, V.-P.; Antohi, E.-L.; Arrigo, M.; Ben Gal, T.; et al. Epidemiology, Pathophysiology and Contemporary Management of Cardiogenic Shock—A Position Statement from the Heart Failure Association of the European Society of Cardiology. Eur. J. Heart Fail. 2020, 22, 1315–1341. [CrossRef]
11. Tehrani, B.N.; Truesdell, A.G.; Psotka, M.A.; Rosner, C.; Singh, R.; Sinha, S.S.; Damluji, A.A.; Batchelor, W.B. A Standardized and Comprehensive Approach to the Management of Cardiogenic Shock. JACC Heart Fail. 2020, 8, 879–891. [CrossRef] [PubMed]
12. Just, H. Peripheral Adaptations in Congestive Heart Failure: A Review. Am. J. Med. 1991, 90, 23S–26S. [CrossRef]
13. Dhakal, B.P.; Malhotra, R.; Murphy, R.M.; Pappagianopoulos, P.P.; Baggish, A.L.;Weiner, R.B.; Houstis, N.E.; Eisman, A.S.; Hough, S.S.; Lewis, G.D. Mechanisms of Exercise Intolerance in Heart Failure with Preserved Ejection Fraction: The Role of Abnormal
Peripheral Oxygen Extraction. Circ. Heart Fail. 2015, 8, 286–294. [CrossRef] [PubMed]
14. Greer, J. Pathophysiology of Cardiovascular Dysfunction in Sepsis. BJA Educ. 2015, 15, 316–321. [CrossRef]
15. VINCENT, J.-L.; ZHANG, H.; SZABO, C.; PREISER, J.-C. Effects of Nitric Oxide in Septic Shock. Am. J. Respir. Crit. Care Med. 2000, 161, 1781–1785. [CrossRef] [PubMed]
16. Kakihana, Y.; Ito, T.; Nakahara, M.; Yamaguchi, K.; Yasuda, T. Sepsis-Induced Myocardial Dysfunction: Pathophysiology and Management. J. Intensive Care 2016, 4, 22. [CrossRef]
17. Jarczak, D.; Kluge, S.; Nierhaus, A. Sepsis—Pathophysiology and Therapeutic Concepts. Front. Med. 2021, 8, 609. [CrossRef]
18. Brealey, D.; Brand, M.; Hargreaves, I.; Heales, S.; Land, J.; Smolenski, R.; Davies, N.A.; Cooper, C.E.; Singer, M. Association between Mitochondrial Dysfunction and Severity and Outcome of Septic Shock. Lancet Lond. Engl. 2002, 360, 219–223. [CrossRef]
19. Niederbichler, A.D.; Hoesel, L.M.;Westfall, M.V.; Gao, H.; Ipaktchi, K.R.; Sun, L.; Zetoune, F.S.; Su, G.L.; Arbabi, S.; Sarma, J.V.; et al. An Essential Role for Complement C5a in the Pathogenesis of Septic Cardiac Dysfunction. J. Exp. Med. 2006, 203, 53–61.[CrossRef]
20. Sheyin, O.; Davies, O.; Duan, W.; Perez, X. The Prognostic Significance of Troponin Elevation in Patients with Sepsis: A Meta-Analysis. Heart Lung J. Crit. Care 2015, 44, 75–81. [CrossRef]
21. Frencken, J.F.; Donker, D.W.; Spitoni, C.; Koster-Brouwer, M.E.; Soliman, I.W.; Ong, D.S.Y.; Horn, J.; van der Poll, T.; van Klei,W.A.; Bonten, M.J.M.; et al. Myocardial Injury in Patients with Sepsis and Its Association with Long-Term Outcome. Circ. Cardiovasc.
Qual. Outcomes 2018, 11, e004040. [CrossRef] [PubMed]
22. Omar, A.S.; Ur Rahman, M.; Dhatt, G.S.; Salami, G.O.; Abuhasna, S. Dynamics of Brain Natriuretic Peptide in Critically Ill Patients with Severe Sepsis and Septic Shock. Saudi J. Anaesth. 2013, 7, 270–276. [CrossRef] [PubMed]
23. Jeyaraju, M.; McCurdy, M.T.; Levine, A.R.; Devarajan, P.; Mazzeffi, M.A.; Mullins, K.E.; Reif, M.; Yim, D.N.; Parrino, C.; Lankford, A.S.; et al. Renin Kinetics Are Superior to Lactate Kinetics for Predicting In-Hospital Mortality in Hypotensive Critically Ill Patients. Crit. Care Med. 2022, 50, 50–60. [CrossRef]
24. Villacorta, H.; Maisel, A.S. Soluble ST2 Testing: A Promising Biomarker in the Management of Heart Failure. Arq. Bras. Cardiol. 2016, 106, 145–152. [CrossRef] [PubMed]
25. Gomes, D.A.; de Almeida Beltrão, R.L.; de Oliveira Junior, F.M.; da Silva Junior, J.C.; de Arruda, E.P.C.; Lira, E.C.; da Rocha, M.J.A. Vasopressin and Copeptin Release during Sepsis and Septic Shock. Peptides 2021, 136, 170437. [CrossRef] [PubMed]
26. Li, H.; Tang, D.; Chen, J.; Hu, Y.; Cai, X.; Zhang, P. The Clinical Value of GDF15 and Its Prospective Mechanism in Sepsis. Front. Immunol. 2021, 12, 710977. [CrossRef]
27. Rivers, E.; Nguyen, B.; Havstad, S.; Ressler, J.; Muzzin, A.; Knoblich, B.; Peterson, E.; Tomlanovich, M. Early Goal-Directed Therapy in the Treatment of Severe Sepsis and Septic Shock. N. Engl. J. Med. 2001, 345, 1368–1377. [CrossRef]
28. Baloch, K.; Rehman Memon, A.; Ikhlaq, U.; Umair, M.; Ansari, M.I.; Abubaker, J.; Salahuddin, N. Assessing the Utility of End-Tidal Carbon Dioxide as a Marker for Fluid Responsiveness in Cardiogenic Shock. Cureus 2021, 13, e13164. [CrossRef]
29. Salerno, A.; Kuhn, D.; El Sibai, R.; Levine, A.R.; McCurdy, M.T. Real-Time Remote Tele-Mentored Echocardiography: A Systematic Review. Med. Kaunas Lith. 2020, 56, 668. [CrossRef]
30. Safadi, S.; Murthi, S.; Kashani, K.B. Use of Ultrasound to Assess Hemodynamics in Acutely Ill Patients. Kidney360 2021, 2,1349–1359. [CrossRef]
31. Beaubien-Souligny, W.; Rola, P.; Haycock, K.; Bouchard, J.; Lamarche, Y.; Spiegel, R.; Denault, A.Y. Quantifying Systemic Congestion with Point-Of-Care Ultrasound: Development of the Venous Excess Ultrasound Grading System. Ultrasound J. 2020,12, 16. [CrossRef] [PubMed]
32. Barjaktarevic, I.; Kenny, J.-É.S.; Berlin, D.; Cannesson, M. The Evolution of Ultrasound in Critical Care: From Procedural Guidance to Hemodynamic Monitor. J. Ultrasound Med. Off. J. Am. Inst. Ultrasound Med. 2021, 40, 401–405. [CrossRef] [PubMed]
33. Monnet, X.; Teboul, J.-L. Passive Leg Raising: Five Rules, Not a Drop of Fluid! Crit. Care 2015, 19, 18. [CrossRef] [PubMed]
34. Marik, P.E. Noninvasive Cardiac Output Monitors: A State-of the-Art Review. J. Cardiothorac. Vasc. Anesth. 2013, 27, 121–134. [CrossRef] [PubMed]
35. Argueta, E.; Berdine, G.; Pena, C.; Nugent, K.M. FloTrac® Monitoring System: What Are Its Uses in Critically Ill Medical Patients? Am. J. Med. Sci. 2015, 349, 352–356. [CrossRef]
36. Ranka, S.; Mastoris, I.; Kapur, N.K.; Tedford, R.J.; Rali, A.; Acharya, P.; Weidling, R.; Goyal, A.; Sauer, A.J.; Gupta, B.; et al. Right Heart Catheterization in Cardiogenic Shock Is Associated with Improved Outcomes: Insights From the Nationwide Readmissions Database. J. Am. Heart Assoc. 2021, 10, e019843. [CrossRef]
37. Shah, M.R.; Hasselblad, V.; Stevenson, L.W.; Binanay, C.; O’Connor, C.M.; Sopko, G.; Califf, R.M. Impact of the Pulmonary Artery Catheter in Critically Ill Patients: Meta-Analysis of Randomized Clinical Trials. JAMA 2005, 294, 1664–1670. [CrossRef]
38. Bertaina, M.; Galluzzo, A.; Morici, N.; Sacco, A.; Oliva, F.; Valente, S.; D’Ascenzo, F.; Frea, S.; Sbarra, P.; Petitti, E.; et al. Pulmonary Artery Catheter Monitoring in Patients with Cardiogenic Shock: Time for a Reappraisal? Card. Fail. Rev. 2022, 8, e15. [CrossRef]
39. Saxena, A.; Garan, A.R.; Kapur, N.K.; O’Neill, W.W.; Lindenfeld, J.; Pinney, S.P.; Uriel, N.; Burkhoff, D.; Kern, M. Value of Hemodynamic Monitoring in Patients with Cardiogenic Shock Undergoing Mechanical Circulatory Support. Circulation 2020, 141, 1184–1197. [CrossRef]
40. Martínez, M.L.; Plata-Menchaca, E.P.; Ruiz-Rodríguez, J.C.; Ferrer, R. An Approach to Antibiotic Treatment in Patients with Sepsis. J. Thorac. Dis. 2020, 12, 1007–1021. [CrossRef]
41. Strich, J.R.; Heil, E.L.; Masur, H. Considerations for Empiric Antimicrobial Therapy in Sepsis and Septic Shock in an Era of Antimicrobial Resistance. J. Infect. Dis. 2020, 222 (Suppl. S2), S119–S131. [CrossRef] [PubMed]
42. Rhodes, A.; Evans, L.E.; Alhazzani, W.; Levy, M.M.; Antonelli, M.; Ferrer, R.; Kumar, A.; Sevransky, J.E.; Sprung, C.L.; Nunnally, M.E.; et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017, 43, 304–377. [CrossRef] [PubMed]
43. DiPiro, J.T. Pathophysiology and Treatment of Gram-Negative Sepsis. Am. J. Hosp. Pharm. 1990, 47 (Suppl. S3), S6–S10. [CrossRef] [PubMed]
44. Gentile, L.F.; Moldawer, L.L. DAMPs, PAMPs, and the Origins of SIRS in Bacterial Sepsis. Shock 2013, 39, 113–114. [CrossRef] [PubMed]
45. Kalil, A.C.; Metersky, M.L.; Klompas, M.; Muscedere, J.; Sweeney, D.A.; Palmer, L.B.; Napolitano, L.M.; O’Grady, N.P.; Bartlett, J.G.; Carratalà, J.; et al. Management of Adults with Hospital-Acquired and Ventilator-Associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin. Infect. Dis. Off. Publ. Infect. Dis. Soc. Am. 2016, 63, e61–e111. [CrossRef]
46. Zakhour, J.; Sharara, S.L.; Hindy, J.-R.; Haddad, S.F.; Kanj, S.S. Antimicrobial Treatment of Pseudomonas Aeruginosa Severe Sepsis. Antibiotics 2022, 11, 1432. [CrossRef]
47. Amaral, A.C.K.B.; Fowler, R.A.; Pinto, R.; Rubenfeld, G.D.; Ellis, P.; Bookatz, B.; Marshall, J.C.; Martinka, G.; Keenan, S.; Laporta, D.; et al. Patient and Organizational Factors Associated with Delays in Antimicrobial Therapy for Septic Shock. Crit. Care Med. 2016, 44, 2145–2153. [CrossRef]
48. Deshpande, A.; Haessler, S.; Brizendine, K.; Lindenauer, P.; Lagu, T.; Yu, P.-C.; Bakaki, P.; Pekow, P.; Rothberg, M. Empiric Double Coverage for Healthcare-Associated Pneumonia: Is It Still Necessary? Open Forum Infect. Dis. 2016, 3 (Suppl. S1), 1252. [CrossRef]
49. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado, F.R.; Mcintyre, L.; Ostermann, M.; Prescott, H.C.; et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock 2021.Intensive Care Med. 2021, 47, 1181–1247. [CrossRef]
50. Maimone, S.; Mazzeo, A.T.; Squadrito, G.; Raimondo, G. Sodium Load and Intravenous Antimicrobials in Patients with Cirrhosis. Dig. Liver Dis. Off. J. Ital. Soc. Gastroenterol. Ital. Assoc. Study Liver 2019, 51, 1490–1492. [CrossRef]
51. Wang, N.; Nguyen, P.K.; Pham, C.U.; Smith, E.A.; Kim, B.; Goetz, M.B.; Graber, C.J. Sodium Content of Intravenous Antibiotic Preparations. Open Forum Infect. Dis. 2019, 6, ofz508. [CrossRef] [PubMed]
52. Semler, M.W.; Rice, T.W. Sepsis Resuscitation: Fluid Choice and Dose. Clin. Chest Med. 2016, 37, 241–250. [CrossRef] [PubMed]
53. Finfer, S.; Liu, B.; Taylor, C.; Bellomo, R.; Billot, L.; Cook, D.; Du, B.; McArthur, C.; Myburgh, J. Resuscitation Fluid Use in Critically Ill Adults: An International Cross-Sectional Study in 391 Intensive Care Units. Crit. Care Lond. Engl. 2010, 14, R185. [CrossRef] [PubMed]
54. Sivapalan, P.; Ellekjaer, K.L.; Jessen, M.K.; Meyhoff, T.S.; Cronhjort, M.; Hjortrup, P.B.; Wetterslev, J.; Granholm, A.; Møller, M.H.; Perner, A. Lower vs Higher Fluid Volumes in Adult Patients with Sepsis: An Updated Systematic Review with Meta-Analysis and Trial Sequential Analysis. Chest 2023, 164, 892–912. [CrossRef]
55. Moschopoulos, C.D.; Dimopoulou, D.; Dimopoulou, A.; Dimopoulou, K.; Protopapas, K.; Zavras, N.; Tsiodras, S.; Kotanidou, A.; Fragkou, P.C. New Insights into the Fluid Management in Patients with Septic Shock. Medicina 2023, 59, 1047. [CrossRef]
56. Caironi, P.; Tognoni, G.; Masson, S.; Fumagalli, R.; Pesenti, A.; Romero, M.; Fanizza, C.; Caspani, L.; Faenza, S.; Grasselli, G.; et al. Albumin Replacement in Patients with Severe Sepsis or Septic Shock. N. Engl. J. Med. 2014, 370, 1412–1421. [CrossRef]
57. Hahn, R.G.; Lyons, G. The Half-Life of Infusion Fluids: An Educational Review. Eur. J. Anaesthesiol. 2016, 33, 475–482. [CrossRef]
58. The SAFE Study Investigators. A Comparison of Albumin and Saline for Fluid Resuscitation in the Intensive Care Unit. N. Engl.J. Med. 2004, 350, 2247–2256. [CrossRef]
59. Annane, D.; Siami, S.; Jaber, S.; Martin, C.; Elatrous, S.; Declère, A.D.; Preiser, J.C.; Outin, H.; Troché, G.; Charpentier, C.; et al. Effects of Fluid Resuscitation with Colloids vs Crystalloids on Mortality in Critically Ill Patients Presenting with Hypovolemic Shock: The CRISTAL Randomized Trial. JAMA 2013, 310, 1809–1817. [CrossRef]
60. Hanley, C.; Callum, J.; Karkouti, K.; Bartoszko, J. Albumin in Adult Cardiac Surgery: A Narrative Review. Can. J. Anesth. Can. Anesth. 2021, 68, 1197–1213. [CrossRef]
61. Geng, L.; Tian, X.; Gao, Z.; Mao, A.; Feng, L.; He, C. Different Concentrations of Albumin Versus Crystalloid in Patients with Sepsis and Septic Shock: A Meta-Analysis of Randomized Clinical Trials. J. Intensive Care Med. 2023, 38, 679–689. [CrossRef] [PubMed]
62. Sakr, Y.; Bauer, M.; Nierhaus, A.; Kluge, S.; Schumacher, U.; Putensen, C.; Fichtner, F.; Petros, S.; Scheer, C.; Jaschinski, U.; et al. Randomized Controlled Multicentre Study of Albumin Replacement Therapy in Septic Shock (ARISS): Protocol for a Randomized Controlled Trial. Trials 2020, 21, 1002. [CrossRef] [PubMed]
63. Semler, M.W.; Kellum, J.A. Balanced Crystalloid Solutions. Am. J. Respir. Crit. Care Med. 2019, 199, 952–960. [CrossRef] [PubMed]
64. Semler, M.W.; Self, W.H.; Wanderer, J.P.; Ehrenfeld, J.M.; Wang, L.; Byrne, D.W.; Stollings, J.L.; Kumar, A.B.; Hughes, C.G.; Hernandez, A.; et al. Balanced Crystalloids versus Saline in Critically Ill Adults. N. Engl. J. Med. 2018, 378, 829–839. [CrossRef]
65. Self, W.H.; Semler, M.W.; Wanderer, J.P.; Wang, L.; Byrne, D.W.; Collins, S.P.; Slovis, C.M.; Lindsell, C.J.; Ehrenfeld, J.M.; Siew,E.D.; et al. Balanced Crystalloids versus Saline in Noncritically Ill Adults. N. Engl. J. Med. 2018, 378, 819–828. [CrossRef]
66. Zampieri, F.G.; Machado, F.R.; Biondi, R.S.; Freitas, F.G.R.; Veiga, V.C.; Figueiredo, R.C.; Lovato, W.J.; Amêndola, C.P.; Serpa-Neto, A.; Paranhos, J.L.R.; et al. Effect of Intravenous Fluid Treatment with a Balanced Solution vs 0.9% Saline Solution on Mortality in Critically Ill Patients: The BaSICS Randomized Clinical Trial. JAMA 2021, 326, 818–829. [CrossRef]
67. Finfer, S.; Micallef, S.; Hammond, N.; Navarra, L.; Bellomo, R.; Billot, L.; Delaney, A.; Gallagher, M.; Gattas, D.; Li, Q.; et al. Balanced Multielectrolyte Solution versus Saline in Critically Ill Adults. N. Engl. J. Med. 2022, 386, 815–826. [CrossRef]
68. Vallon, V. Tubuloglomerular Feedback and the Control of Glomerular Filtration Rate. Physiology 2003, 18, 169–174. [CrossRef]
69. Toporek, A.H.; Semler, M.W.; Self,W.H.; Bernard, G.R.;Wang, L.; Siew, E.D.; Stollings, J.L.;Wanderer, J.P.; Rice, T.W.; Casey, J.D. Balanced Crystalloids versus Saline in Critically Ill Adults with Hyperkalemia or Acute Kidney Injury: Secondary Analysis of a
Clinical Trial. Am. J. Respir. Crit. Care Med. 2021, 203, 1322–1325. [CrossRef]
70. Demiselle, J.; Fage, N.; Radermacher, P.; Asfar, P. Vasopressin and Its Analogues in Shock States: A Review. Ann. Intensive Care 2020, 10, 9. [CrossRef]
71. Tarvasmäki, T.; Lassus, J.; Varpula, M.; Sionis, A.; Sund, R.; Køber, L.; Spinar, J.; Parissis, J.; Banaszewski, M.; Silva Cardoso, J.; et al. Current Real-Life Use of Vasopressors and Inotropes in Cardiogenic Shock—Adrenaline Use Is Associated with Excess Organ Injury and Mortality. Crit. Care Lond. Engl. 2016, 20, 208. [CrossRef]
72. De Backer, D.; Biston, P.; Devriendt, J.; Madl, C.; Chochrad, D.; Aldecoa, C.; Brasseur, A.; Defrance, P.; Gottignies, P.; Vincent, J.-L. Comparison of Dopamine and Norepinephrine in the Treatment of Shock. N. Engl. J. Med. 2010, 362, 779–789. [CrossRef]
73. Conti, N.; Gatti, M.; Raschi, E.; Diemberger, I.; Potena, L. Evidence and Current Use of Levosimendan in the Treatment of Heart Failure: Filling the Gap. Drug Des. Devel. Ther. 2021, 15, 3391–3409. [CrossRef]
74. Gordon, A.C.; Perkins, G.D.; Singer, M.; McAuley, D.F.; Orme, R.M.L.; Santhakumaran, S.; Mason, A.J.; Cross, M.; Al-Beidh, F.; Best-Lane, J.; et al. Levosimendan for the Prevention of Acute Organ Dysfunction in Sepsis. N. Engl. J. Med. 2016, 375, 1638–1648. [CrossRef]
75. McCurdy, M.T.; Busse, L.W. Rethinking Vasopressor Education: The Need to Avoid Teaching the Bare Minimum. ATS Sch. 2023, 4, 389–390. [CrossRef]
76. Khanna, A.; English, S.W.; Wang, X.S.; Ham, K.; Tumlin, J.; Szerlip, H.; Busse, L.W.; Altaweel, L.; Albertson, T.E.; Mackey, C.; et al. Angiotensin II for the Treatment of Vasodilatory Shock. N. Engl. J. Med. 2017, 377, 419–430. [CrossRef]
77. Busse, L.W.; McCurdy, M.T.; Ali, O.; Hall, A.; Chen, H.; Ostermann, M. The Effect of Angiotensin II on Blood Pressure in Patients with Circulatory Shock: A Structured Review of the Literature. Crit. Care Lond. Engl. 2017, 21, 324. [CrossRef]
78. Mercat, A.; Richard, J.-C.M.; Vielle, B.; Jaber, S.; Osman, D.; Diehl, J.-L.; Lefrant, J.-Y.; Prat, G.; Richecoeur, J.; Nieszkowska, A.;et al. Positive End-Expiratory Pressure Setting in Adults with Acute Lung Injury and Acute Respiratory Distress Syndrome: A Randomized Controlled Trial. JAMA 2008, 299, 646–655. [CrossRef]
79. Alviar, C.L.; Miller, P.E.; McAreavey, D.; Katz, J.N.; Lee, B.; Moriyama, B.; Soble, J.; van Diepen, S.; Solomon, M.A.; Morrow, D.A. Positive Pressure Ventilation in the Cardiac Intensive Care Unit. J. Am. Coll. Cardiol. 2018, 72, 1532–1553. [CrossRef]
80. Corp, A.; Thomas, C.; Adlam, M. The Cardiovascular Effects of Positive Pressure Ventilation. BJA Educ. 2021, 21, 202–209. [CrossRef]
81. Disselkamp, M.; Adkins, D.; Pandey, S.; Coz Yataco, A.O. Physiologic Approach to Mechanical Ventilation in Right Ventricular Failure. Ann. Am. Thorac. Soc. 2018, 15, 383–389. [CrossRef]
82. Atti, V.; Narayanan, M.A.; Patel, B.; Balla, S.; Siddique, A.; Lundgren, S.; Velagapudi, P. A Comprehensive Review of Mechanical Circulatory Support Devices. Heart Int. 2022, 16, 37–48. [CrossRef]
83. Thiele, H.; Ohman, E.M.; Desch, S.; Eitel, I.; de Waha, S. Management of Cardiogenic Shock. Eur. Heart J. 2015, 36, 1223–1230. [CrossRef]
84. Alkhunaizi, F.A.; Burkhoff, D.; Brener, M.I. Right-Sided Mechanical Circulatory Support—A Hemodynamic Perspective. Curr. Heart Fail. Rep. 2022, 19, 334–345. [CrossRef]
85. Vis, A.; Arfaee, M.; Khambati, H.; Slaughter, M.S.; Gummert, J.F.; Overvelde, J.T.B.; Kluin, J. The Ongoing Quest for the First Total Artificial Heart as Destination Therapy. Nat. Rev. Cardiol. 2022, 19, 813–828. [CrossRef]
86. Marasco, S.F.; Lukas, G.; McDonald, M.; McMillan, J.; Ihle, B. Review of ECMO (Extra Corporeal Membrane Oxygenation) Support in Critically Ill Adult Patients. Heart Lung Circ. 2008, 17 (Suppl. S4), S41–S47. [CrossRef]
87. Shin, T.G.; Choi, J.-H.; Jo, I.J.; Sim, M.S.; Song, H.G.; Jeong, Y.K.; Song, Y.-B.; Hahn, J.-Y.; Choi, S.H.; Gwon, H.-C. Extracorporeal Cardiopulmonary Resuscitation in Patients with Inhospital Cardiac Arrest: A Comparison with Conventional Cardiopulmonary Resuscitation. Crit. Care Med. 2011, 39, 1–7. [CrossRef]
88. Chen, Y.-S.; Lin, J.-W.; Yu, H.-Y.; Ko, W.-J.; Jerng, J.-S.; Chang, W.-T.; Chen, W.-J.; Huang, S.-C.; Chi, N.-H.; Wang, C.-H. Cardiopulmonary Resuscitation with Assisted Extracorporeal Life-Support versus Conventional Cardiopulmonary Resuscitation in Adults with in-Hospital Cardiac Arrest: An Observational Study and Propensity Analysis. Lancet 2008, 372, 554–561. [CrossRef]
89. Ostadal, P.; Rokyta, R.; Karasek, J.; Kruger, A.; Vondrakova, D.; Janotka, M.; Naar, J.; Smalcova, J.; Hubatova, M.; Hromadka, M.; et al. Extracorporeal Membrane Oxygenation in the Therapy of Cardiogenic Shock: Results of the ECMO-CS Randomized Clinical Trial. Circulation 2023, 147, 454–464. [CrossRef]
90. Thiele, H.; Zeymer, U.; Akin, I.; Behnes, M.; Rassaf, T.; Mahabadi, A.A.; Lehmann, R.; Eitel, I.; Graf, T.; Seidler, T.; et al. Extracorporeal Life Support in Infarct-Related Cardiogenic Shock. N. Engl. J. Med. 2023, 389, 1286–1297. [CrossRef]
91. Ling, R.R.; Ramanathan, K.; Poon, W.H.; Tan, C.S.; Brechot, N.; Brodie, D.; Combes, A.; MacLaren, G. Venoarterial Extracorporeal Membrane Oxygenation as Mechanical Circulatory Support in Adult Septic Shock: A Systematic Review and Meta-Analysis with Individual Participant Data Meta-Regression Analysis. Crit. Care 2021, 25, 246. [CrossRef]
92. Geller, B.J.; Sinha, S.S.; Kapur, N.K.; Bakitas, M.; Balsam, L.B.; Chikwe, J.; Klein, D.G.; Kochar, A.; Masri, S.C.; Sims, D.B.; et al. Escalating and De-Escalating Temporary Mechanical Circulatory Support in Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation 2022, 146, e50–e68. [CrossRef]
93. Sato, R.; Hasegawa, D.; Guo, S.C.; Nishida, K.; Dugar, S. Temporary Mechanical Circulatory Support in Sepsis-Associated Cardiogenic Shock with and Without Acute Myocardial Infarction. J. Cardiothorac. Vasc. Anesth. 2023, 9, 26. [CrossRef]
94. Chvojka, J.; Martinkova, V.; Benes, J.; Valesova, L.; Danihel, V.; Nalos, L.; Matejovic, M. Mechanical Circulatory Support in Refractory Vasodilatory Septic Shock: A Randomized Controlled Porcine Study. Shock 2020, 53, 124–131. [CrossRef]
95. Gilotra, N.A.; Stevens, G.R. Temporary Mechanical Circulatory Support: A Review of the Options, Indications, and Outcomes. Clin. Med. Insights Cardiol. 2014, 8 (Suppl. S1), 75–85. [CrossRef]
96. Mayr, V.D.; Dünser, M.W.; Greil, V.; Jochberger, S.; Luckner, G.; Ulmer, H.; Friesenecker, B.E.; Takala, J.; Hasibeder, W.R. Causes of Death and Determinants of Outcome in Critically Ill Patients. Crit. Care 2006, 10, R154. [CrossRef]
97. George, P.; Srivastava, M.C.; Ludmir, J.; Reed, R.M.; Tewelde, S.Z.; Gupta, A.; McCurdy, M.T. Augmenting Function for Infarction from Infection: Impella 2.5 for Ischemic Cardiogenic Shock Complicating Sepsis. Case Rep. Cardiol. 2017, 2017, 8407530. [CrossRef]
98. Petricevic, M.; Milicic, D.; Boban, M.; Mihaljevic, M.Z.; Baricevic, Z.; Kolic, K.; Dolic, K.; Konosic, L.; Kopjar, T.; Biocina, B. Bleeding and Thrombotic Events in Patients Undergoing Mechanical Circulatory Support: A Review of Literature. Thorac. Cardiovasc. Surg. 2015, 63, 636–646. [CrossRef]
99. Baumann Kreuziger, L.; Massicotte, M.P. Mechanical Circulatory Support: Balancing Bleeding and Clotting in High-Risk Patients. Hematology 2015, 2015, 61–68. [CrossRef]
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 10.04.2024
[~DATE_ACTIVE_FROM] => 10.04.2024
[ACTIVE_FROM_X] => 2024-04-10 00:00:00
[~ACTIVE_FROM_X] => 2024-04-10 00:00:00
[ACTIVE_FROM] => 10.04.2024
[~ACTIVE_FROM] => 10.04.2024
[SHOW_COUNTER] => 337
[~SHOW_COUNTER] => 337
[ID] => 8436
[~ID] => 8436
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 10.04.2024 13:16:55
[~TIMESTAMP_X] => 10.04.2024 13:16:55
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/lechenie-sepsisa-v-kardiologicheskom-otdelenii-intensivnoy-terapii/
[~DETAIL_PAGE_URL] => /library/articles/lechenie-sepsisa-v-kardiologicheskom-otdelenii-intensivnoy-terapii/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => lechenie-sepsisa-v-kardiologicheskom-otdelenii-intensivnoy-terapii
[~CODE] => lechenie-sepsisa-v-kardiologicheskom-otdelenii-intensivnoy-terapii
[EXTERNAL_ID] => 8436
[~EXTERNAL_ID] => 8436
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 10 апреля 2024
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
[PREVIEW_PICTURE] => Array
(
[ID] => 5619
[TIMESTAMP_X] => 10.04.2024 13:16:55
[MODULE_ID] => iblock
[HEIGHT] => 668
[WIDTH] => 1000
[FILE_SIZE] => 92715
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/679/3xmeounew5596uym6b0r68a6kxp9llka
[FILE_NAME] => male-student-practicing-medicine-2.jpg
[ORIGINAL_NAME] => male-student-practicing-medicine-2.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 9d8415725bf4076a759b5dde41c5524a
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/679/3xmeounew5596uym6b0r68a6kxp9llka/male-student-practicing-medicine-2.jpg
[UNSAFE_SRC] => /upload/iblock/679/3xmeounew5596uym6b0r68a6kxp9llka/male-student-practicing-medicine-2.jpg
[SAFE_SRC] => /upload/iblock/679/3xmeounew5596uym6b0r68a6kxp9llka/male-student-practicing-medicine-2.jpg
[ALT] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
[TITLE] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
)
[DETAIL_TEXT] => Yichi Zhang , Michael T. McCurdy and Jonathan Ludmir
Sepsis Management in the Cardiac Intensive Care Unit
J. Cardiovasc. Dev. Dis. 2023, 10, 429. https://doi.org/10.3390/jcdd10100429
Абстракт: Лечение септического шока в кардиологическом отделении интенсивной терапии (КОИТ) является сложной задачей из-за сложного патофизиологического взаимодействия между вазодилататорным и кардиогенным шоком, что усложняет оптимальное применение инфузионной терапии, вазопрессоров и устройств механической поддержки кровообращения. Поскольку смешанный шок чреват высокой смертностью, для борьбы с широким спектром возможных осложнений необходимо знать качественные современные клинические данные, касающиеся доступных методов и средств лечения. Данный обзор объединяет принципы патофизиологии и клинические рекомендации и представляет собой организованный, тематический обзор тонкостей лечения сепсиса в отделении каодиореанимации и интенсивной терапии.
Ключевые слова: сепсис; интенсивная терапия; кардиология; реанимационная помощь; шок; отделение интенсивной терапии; кардиологическое отделение интенсивной терапии
1. Введение
Сепсис и септический шок являются частыми осложнениями, которые развиваются у пациентов кардиореанимации [1]. Сложные патофизиологические особенности и взаимодействие между кардиогенным шоком (КШ) и септическим шоком имеют решающее значение для нашего современного многогранного диагностического и терапевтического подхода. Этот текущий обзор литературы объединяет соответствующие принципы патофизиологии с рекомендациями по ведению пациентов с сепсисом и КШ.
2. Эпидемиология и определения
Третий международный консенсус определяет сепсис как «опасную для жизни дисфункцию органов, вызванную нарушением регуляции реакции организма на инфекцию». Органную дисфункцию можно дополнительно квалифицировать по изменению по шале SOFA на ≥2 балла по сравнению с исходным уровнем [2]. Хотя шкалу qSOFA, проще использовать, поскольку она учитывает только частоту дыхания, уровень сознания и систолическое артериальное давление , она имеет низкую прогностическую точность. по сравнению с его традиционной шкалой SOFA [3]. В частности, оценка qSOFA сама по себе не должна использоваться для диагностики сепсиса, а скорее как ускоренный прогностический инструмент для прогнозирования смертности у пациентов с сепсисом. Септический шок, определяемый как ухудшение гемодинамики на фоне сепсиса, характеризуется необходимостью применения вазопрессоров для поддержания среднего артериального давления на уровне 65 мм рт. ст. и уровня лактата в сыворотке > 2 ммоль/л [4]. В этом случае септический шок следует рассматривать в первую очередь при отсутствии гиповолемии, поскольку инфекции часто могут вызывать постоянные потери жидкости (например, диарея или рвота), что приводит к гиповолемическому компоненту шока, который следует устранить в первую очередь. В общей сложности от 6 до 37% пациентов ОИТ страдают сепсисом [5,6], и до 44% пациентов, у которых развился сепсис, умирают [5]. Кроме того, у пациентов с инфарктом миокарда (ИМ), осложненным сепсисом, вероятность смерти на 103% выше, чем у пациентов с «несептическим» ИМ [7]. Аналогичным образом, несердечная мультисистемная органная недостаточность также значительно более распространена в когортах сепсиса. Несмотря на отсутствие стандартного определения КШ [6], один из самых известных критериев, возникший в исследовании SHOCK в 1999 году, определил его как (1) САД < 90 мм рт. ст. в течение > 30 мин или необходимость применения вазопрессоров для поддержания САД ≥ 90 мм рт. ст. ; (2) гипоперфузия органов-мишеней (например, диурез <30 мл/час или холодные конечности; и (3) сердечный индекс (CI) < 2,2 л/мин/м2 и давление заклинивания в легочных капиллярах >15 мм рт. ст. [8]. В последних рекомендациях Европейского общества кардиологов КШ определяется аналогичным образом [9].
3. Патофизиология кардиогенного и септического шока
Кардиогенный шок чаще всего возникает на фоне острого инфаркта миокарда (ОИМ), но может возникнуть и вследствие декомпенсации сердечной недостаточности, массивной ТЭЛА, миокардита, тяжелой дисфункции клапанов и других причин [10].
При КШ на фоне ОИМ инфаркт приводит к снижению сократимости и сердечного выброса (СВ), что приводит к увеличению конечного диастолического давления в левом желудочке (LVEDP). Поскольку левосторонняя коронарная перфузия зависит от разницы между диастолическим артериальным давлением и LVEDP, более жесткие стенки ЛЖ (и, соответственно, более высокое LVEDP) снижают коронарное перфузионное давление (CPP), тем самым уменьшая возможности аэробного дыхания и способствуя нестабильности системной гемодинамики [11]. В отличие от левого желудочка, правый желудочек перфузируется как во время диастолы, так и во время систолы, хотя его CPP по-прежнему определяется разницей между САД и давлением в правой желудочке. Первоначальной реакцией периферической сосудистой сети при сердечной дисфункции является вазоконстрикция для сохранения перфузионного давления [12], а клетки по всему телу максимизируют извлечение кислорода из соответствующих капилляров, чтобы компенсировать снижение кровотока [13].
Сепсис приводит к расширению сосудов периферического кровообращения под действием оксида азота (NO). Провоспалительные цитокины, такие как фактор некроза опухоли (TNF) или интерлейкин-1 (IL-1), активируются в результате острой инфекции и воспаления, увеличивая выработку NO, который активирует гуанилатциклазу [14]. Конечный продукт этого каскада, циклический гуанозинмонофосфат (GMP) , затем расслабляет гладкую мускулатуру сосудов и подавляет сосудистый тонус [15]. Таким образом, расширенные сосуды больше не могут поддерживать перфузионное давление, необходимое для оптимального физиологического функционирования, что приводит к мультиорганной органной недостаточности. Сердечная дисфункция может наблюдаться у 44% пациентов с септическим шоком [16]. Сепсис может ухудшить функцию кровообращения, затрагивая либо периферическую сосудистую систему [14], либо функцию миокарда [17]. Сепсис отрицательно влияет на функцию миокарда напрямую посредством нескольких различных механизмов. Во-первых, вышеупомянутый сосудорасширяющий фактор NO оказывает ингибирующее действие на бета-адренергические (β1) рецепторы, которые в норме отвечают за увеличение частоты сердечных сокращений и сократимости [17]. Снижение активности β1-рецепторов приводит к тому, что сердце теряет компенсаторный резерв для борьбы с шоком. Во-вторых, связанная с сепсисом митохондриальная дисрегуляция и последующее образование активных форм кислорода (ROS) также могут напрямую подавлять сердечную функцию [18]. Клетки миокарда часто насыщены митохондриями из-за их высоких аэробных потребностей в производстве энергии. Таким образом, воспалительные цитокины, которые приводят к митохондриальной дисфункции, могут привести к чрезмерному накоплению активных форм кислорода и прямому цитотоксическому повреждению кардиомиоцитов. Кроме того, сепсис может вызывать дисфункцию системы комплемента, при этом фактор комплемента C5a, мощный агент хемотаксиса тучных клеток и нейтрофилов, может напрямую подавлять функцию клеток миокарда [19]. Нацеливание на эти менее изученные механизмы прямого подавления миокарда может стать достойным направлением будущих биомедицинских или фармацевтических исследований.
4. Гемодинамическая оценка и диагностика коморбидного сепсиса и кардиогенного шока
Распознавание и своевременная диагностика коморбидного септического и кардиогенного шока в ОРИТ может оказаться сложной задачей. Для дальнейшего понимания (Table 1) этиологии шока, будь то кардиогенный, дистрибутивный, обструктивный или какая-либо их комбинация, необходима комплексная гемодинамическая оценка. Коморбидный септический и кардиогенный шок демонстрируют уникальные изменения гемодинамических параметров (например, сердечного индекса, давления наполнения желудочков, насыщения кислородом смешанной венозной крови), которые могут существовать в «парадоксальных» комбинациях (например, сосуществование сохраненного сердечного индекса с высоким давлением наполнения). Таким образом, в этих сложных сценариях смешанного шока частая и тщательная оценка клинического статуса пациентов и параметров гемодинамики становится еще более необходимой для правильной диагностики и, в конечном итоге, для адекватного лечения.

Сердечные биомаркеры обычно получают в рамках первоначального исследования при подозрении на острую сердечную дисфункцию, включая тропонин и NT-proBNP [6]. В частности, тропонин I часто рассматривается как маркер повреждения миокарда при остром коронарном синдроме, одной из наиболее частой этиологии кардиогенного шока. Данные метаанализа также предполагают потенциальное использование тропонина I в качестве прогностического маркера при септическом шоке, и продолжаются попытки изучить это в крупномасштабных проспективных исследованиях [20,21]. С другой стороны, NT-proBNP часто используется в качестве суррогатного маркера для оценки волемического статуса и застойной сердечной недостаточности.
Аналогично, в ретроспективном анализе было обнаружено, что NT-proBNP также имеет прогностическую ценность при септическом шоке [22]. Однако существенное ограничение полезности как тропонина I, так и NT-proBNP при коморбидном септическом и кардиогенном шоке заключается в их специфичности. Оба маркера часто обнаруживаются повышенными у пациентов с хроническими воспалительными заболеваниями, а также с почечной дисфункцией, что приводит к проблемам с интерпретацией. Кроме того, ренин плазмы также исследовался в качестве биомаркера для прогноза и лечения шока, со сравнением его прогностической ценности с прогностической ценностью сывороточного лактата. Например, положительная скорость изменения уровня ренина в плазме, но не лактата, в течение более 72 часов была связана с увеличением внутрибольничной смертности [23]. В аналогичном контексте новые биомаркеры, такие как ST2 (член семейства рецепторов интерлейкина) [24], копептин (молекула, высвобождающаяся совместно с аргинин-вазопрессином) [25] и фактор дифференцировки роста 15 (GDF-15, белок из суперсемейства трансформирующего ростового фактора β) [26] исследуются в ретроспективных и проспективных исследованиях на предмет их прогностической ценности как при кардиогенном, так и при септическом шоке. Однако их нынешнее клиническое применение сильно затруднено из-за ограниченной доступности, которая в значительной степени сконцентрирована в крупных академических клинических центрах.
Два десятилетия назад знаковое исследование показало преимущество в снижении смертности от ранней целенаправленной терапии (EGDT), включающей гемодинамический мониторинг преднагрузки, постнагрузки и сатурации кислорода с помощью центрального венозного катетера у пациентов с септическим шоком [27]. Несмотря на то, что последующие исследования и метаанализы не подтвердили преимущества применения конкретного протокола EGDT [27], тщательный гемодинамический мониторинг и, как следствие, своевременные соответствующие вмешательства, тем не менее, получили широкую популяризацию в условиях интенсивной терапии.
Широкий спектр инвазивных и неинвазивных инструментов и маркеров (например, CO2 в конце выдоха [ETCO2], индекс коллабируемости нижней полой вены [IVC] при прикроватном УЗИ [POCUS]) был оценен на предмет их полезности для мониторинга гемодинамики при сепсисе и кардиогенном шоке [28].
В частности, POCUS обеспечивает быструю и удобную глобальную оценку функции как левого, так и правого желудочков, может быть выполнена с использованием дистанционного наведения даже в самых жестких условиях. [29]. В исследованиях POCUS изучалась полезность венозного допплеровского анализа формы волны только нижней полой вены, а также комплексного анализа печеночных, воротных и почечных вен для ультразвуковой оценки венозного избытка (VExUS), чтобы помочь предсказать тяжесть венозного застоя [30,31]. Кроме того, развитие системы POCUS с искусственным интеллектом может снизить общий барьер для входа в систему и повысить надежность межоперационного взаимодействия для таких более зависимых от навыков измерений, как интеграл скорости и времени оттока из левого желудочка (VTI) [32].
Однако не менее важно признать и ограничения POCUS, поскольку он сам по себе не может заменить комплексную оценку сердечно-сосудистой системы. Таким образом, результаты POCUS всегда следует рассматривать в контексте физикального осмотра и других клинических параметров, чтобы составить более полную картину гемодинамического статуса. Кроме того, возможно, самый простой метод оценки реакции на жидкость может быть достигнут с помощью «пассивного подъема ноги», который эффективно доставляет к сердцу около 300 мл преднагрузки [33]. Этот маневр безопасен благодаря его быстрой обратимости и может использоваться как часть первоначальной оценки гемодинамики, даже до введения болюсного тестового введения жидкости.
Новые достижения в технологии интенсивной терапии привели к появлению инструментов для мониторинга гемодинамики, таких как анализ контура пульса, который собирает данные из артериальной линии для расчета сердечного выброса [34,35]. Эта технология была валидирована по сравнению с катетеризацией легочной артерии у стабильных пациентов, подвергающихся хирургическому вмешательству, однако ее эффективность может быть менее надежной в клинических сценариях с чрезвычайно низким сосудистым сопротивлением, таких как сепсис и цирроз [35]. Хотя эти устройства могут учитывать эффекты введения жидкости, их надежность должна быть сбалансирована с клинической картиной.
В настоящее время золотым стандартом гемодинамической оценки кардиогенного шока остается катетер легочной артерии (PAC) [36]. Несмотря на свою инвазивность, PAC может предоставить важнейшие данные о давлении в левой и правой половине сердца и сердечном выбросе в режиме реального времени для принятия решений о тактике лечения. Несмотря на его способность предоставлять эти гемодинамические данные, остается много вопросов относительно влияния этих данных на снижение смертности от кардиогенного шока, как предполагает знаковый метаанализ, проведенный Shah et al. в 2005 году [37]. Авторы пришли к выводу, что, возможно, отсутствие пользы от использования PAC связано с отсутствием «эффективных, научно обоснованных методов лечения», используемых в сочетании с PAC [37]. Однако за последнее десятилетие достижения и инструменты в области кардиологической интенсивной терапии популяризировали использование PAC для мониторинга терапевтического эффекта в режиме реального времени. Недавние ретроспективные анализы показывают, что PAC связан с более низкой 30-дневной смертностью, сопоставленной по склонности [38].
Например, PAC может характеризовать смешанные профили шока и способствовать принятию клинических решений, связанных с механической поддержкой кровообращения (MCS). Постоянное ухудшение гемодинамики может служить основанием для перехода от внутриаортальной балонной помпы (IABP) к Impella, добавления поддержки левожелудочкового вспомогательного устройства (LVAD) пациентам только с RVAD или начала и повышения параметров экстракорпоральной мембранной оксигенации (ЭКМО) [39]. Хотя необходимы проспективные РКИ, PAC остается бесценным инструментом, помогающим врачам-реаниматологам оценивать гемодинамический статус пациентов с тяжелым кардиогенным шоком.
5. Рекомендации по лечению
Смертность, связанная с кардиогенным шоком, в кардиореанимации значительна, но коморбидный септический шок добавляет дополнительный уровень сложности и риска, который требует раннего распознавания, тщательного мониторинга и системного подхода к лечению (Figure 1).

5.1. Противомикробные препараты
Ранняя эмпирическая антимикробная терапия имеет решающее значение для лечения сепсиса и септического шока, предпочтительно в течение одного часа после выявления признаков и симптомов [40]. Эмпирические противомикробные препараты выбираются на основе наиболее вероятного патогена и индивидуальных факторов риска пациента, таких как ослабление иммунитета или недавняя госпитализация [41]. В рекомендациях SurvivingSepsis Campaign 2021 года по первоначальному выбору эмпирической антибиотикотерапии предлагается начинать с препаратов широкого спектра действия в течение одного часа после выявления признаков и симптомов сепсиса, а затем адаптировать ее к результатам посева и чувствительности у конкретного пациента, а также к местному уровню антибиотикорезистентности [42].
Эмпирический охват грамотрицательных бактерий часто считается стандартным и единообразным при лечении сепсиса. Эти патогены могут выделять эндотоксины, полученные из компонентов их клеточной стенки, таких как липид А, который может быть чрезвычайно иммуногенным, вызывая массивную воспалительную реакцию за счет выработки цитокинов (например, TNF-альфа) [43].
Кроме того, патоген-ассоциированные молекулярные паттерны (PAMP), которые являются продуктами распада микроорганизмов, также исследовались как на предмет их диагностической, так и терапевтической полезности, особенно в условиях сепсиса с отрицательными культурами [44]. Обычно используемые антибиотики для лечения грамотрицательного сепсиса включают пиперациллин-тазобактам, фторхинолоны, такие как левофлоксацин, цефалоспорины, такие как цефтазидим и цефепим, а также карбапенемы, такие как меропенем [45]. Охват грамотрицательных бактерий должен включать борьбу с Pseudomonas aeruginosa, грамотрицательной палочкой, связанной с высокими показателями устойчивости к антибиотикам и смертности [46]. Из-за изначально высокого уровня устойчивости к антибиотикам у грамотрицательных бактерий, таких как Pseudomonas и Enterobacteriaceae, Infection Disease Society of America (IDSA) поддерживает использование комбинированного лечения грамотрицательных микроорганизмов у пациентов с септическим шоком [47] до тех пор, пока не будут получены результаты чувствительности [48]. Кроме того, для пациентов, которые подвергаются высокому риску заражения MRSA либо из-за положительных результатов посева в прошлом, либо из-за недавнего контакта с медицинским учреждением, рекомендуется эмпирическое использование анти-MRSA препаратов до тех пор, пока не будут получены окончательные результаты посева [49].
Как только микроорганизм и источник инфекции будут идентифицированы, необходимо провести борьбу с источником в форме хирургического вмешательства и/или хирургической обработки или удаления трубок/дренажей/постоянных катетеров, а все противомикробные препараты следует как можно скорее деэскалировать, чтобы избежать параллельного ущерба [42]. Среди различных побочных эффектов длительного применения антибиотиков один менее изученный механизм, который может еще больше усложнить гемодинамическую функцию при коморбидном сепсисе и кардиогенном шоке, заключается в том, что растворы для внутривенных антибиотиков могут содержать большое количество натрия [50]. Например, при стандартной дозировке внутривенный ванкомицин может доставить поразительные 3540 мг натрия за 24 часа терапии, тогда как внутривенный пиперациллин-тазобактам добавит еще 2280 мг за тот же период [51]. Увеличение объема из-за солевой перегрузки может спровоцировать отек легких, кардиоренальный синдром и другие дисфункции органов-мишеней, особенно на фоне существующей сердечной дисфункции. Хотя соответствующие противомикробные препараты являются важной терапией при сепсисе, их постоянное разумное использование особенно важно при лечении коморбидного кардогенного шока.
5.2. Инфузионная терапия
Оптимальная инфузионная терапия является важным компонентом лечения сепсиса, поскольку многие пациенты поступают с гиповолемией из-за низкого перорального поступления жидкости и повышенных потерь из-за потоотделения, вызванного лихорадкой, что может дополнительно осложняться вызванным массивным воспалением низким тонусом сосудов и утечкой жидкости [52]. До недавнего времени большинство руководств рекомендовали агрессивную инфузию кристаллоидами при сепсисе с начальным болюсом 30 мл/кг массы тела с последующим введением поддерживающих объемов с целью достижения постоянного САД > 65 мм рт. ст. [53]. Однако современные метаанализы крупных РКИ показали, что меньшие объемы кристаллоидов не приводят к худшим результатам, что ставит под сомнение идеальный объем жидкости для лечения сепсиса [54,55]. Таким образом, в текущих рекомендациях Surviving Sepsis 2021 г. приводятся недостаточные доказательства, чтобы давать рекомендации относительно либеральной или ограничительной стратегии введения жидкости в первые 24 часа [49].
Существует давняя дискуссия о том, улучшит ли использование коллоидов (например, альбумина) для инфузионной терапии результаты по сравнению с кристаллоидами. Только 25% из каждого 1 л введенных кристаллоидов, в отличие от почти 50% введенных коллоидов, остается в плазме после распределения по различным внутриклеточным и внеклеточным пространствам. Кроме того, период полувыведения введенных кристаллоидов по сравнению с коллоидами, находящимися в кровообращении, составляет всего около 20–40 минут против 2–3 часов соответственно [56,57]. Многочисленные РКИ (например, SAFE, CRISTAL, ALBIOS) сравнивают эффективность кристаллоидов и коллоидов в ОИТ; однако ни одно из них не продемонстрировало значительной разницы в смертности или повреждении почек [56,58,59]. Аналогичным образом, коллоиды обычно используются для восстановления объема после операции на сердце, несмотря на их более высокую стоимость и отсутствие доказательств их превосходства над кристаллоидами [60]. Примечательно, что выводы некоторых из этих исследований ограничены обобщением различных типов коллоидных растворов, а также использованием коллоидов низкой концентрации. Недавно метаанализ более 5000 пациентов с септическим шоком действительно показал улучшение 90-дневных результатов при использовании 20% альбумина по сравнению с использованием кристаллоидов, что требует дальнейших проспективных исследований [61,62].
Еще одним фактором выбора жидкости при реанимации является выбор между различными кристаллоидными растворами (Table 2).

Хотя физиологический раствор, содержащий 154 мг-экв натрия и эквивалентное количество хлорида, может быть наиболее широко используемым вариантом, последние клинические данные подтверждают эффективность использования более «сбалансированных» растворов, таких как лактат Рингера и Plasma-Lyte, в большинстве клинических ситуаций. По сравнению с физиологическим раствором эти жидкости содержат концентрации электролитов, более физиологически схожие с плазмой [63]. Обычно это означает более низкие уровни натрия и хлоридов и добавление 4–5 мэкв/л калия вместе с буферным компонентом (например, лактатом), который в конечном итоге метаболизируется до бикарбоната. РКИ, сравнивающие использование физиологического раствора со «сбалансированными» кристаллоидами, показали неоднозначные результаты: исследования SMART[64] и SALT-ED [65] показали небольшое преимущество лактата Рингера, а BASICS [66] и PLUS [67]. не продемонстрировали различий в смертности или повреждении почек. Сторонники использования «сбалансированных» кристаллоидов называют высокую нагрузку хлоридами фактором риска гиперхлоремического метаболического ацидоза. Кроме того, эта нагрузка хлоридами, доставляемыми в maculadensa, может быть основным фактором острого повреждения почек, поскольку канальцево-клубочковая обратная связь вызывает вазоконстрикцию афферентных сосудов [68]. Между тем, сторонники физиологического раствора указывают на добавление калия в «сбалансированные» кристаллоиды как на потенциальное усугубление гиперкалиемии у пациентов из группы риска, но этот миф был в значительной степени развеян в последующих исследованиях [69]. Для пациентов с коморбидным сепсисом и кардиогенным шоком важна частая повторная оценка состояния волемии для определения необходимости инфузионной терапии или ограничения жидкости после восстановления гемодинамики. В исследовании CLOVERS пациенты с гипотонией, связанной с сепсисом, были рандомизированы на рестриктивную или либеральную стратегию введения жидкости и не обнаружили различий в 90-дневной смертности между двумя группами [70]. В конечном счете, решения, связанные с введением жидкости при коморбидном сепсисе и кардиогенном шоке, могут быть сложными, но разумным подходом является начинать с меньших болюсов жидкости и определять будущие потребности с частыми повторными оценками на основе результатов обследования и объективных данных.
5.3. Вазопрессоры
Использование вазопрессоров является краеугольным камнем в лечении септического шока для устранения низкого сосудистого сопротивления, гипотонии и последующей плохой перфузии органов вследствие массивного воспаления. Чтобы поддерживать целевой показатель САД на уровне ≥65 мм рт. ст., предложенном SurvivingSepsis campaign 2021 года [42], можно увеличивать дозу различных вазоактивных препаратов или использовать их в сочетании друг с другом. Норадреналин является наиболее часто используемым препаратом и считается экспертами и консенсусом в качестве препарата первой линии. Его активность в отношении как альфа-, так и бета-адренорецепторов способствует не только повышению сосудистого тонуса, но и сократимости миокарда.
Вазопрессин является препаратом второй линии, который часто добавляют, когда целевые значения САД не могут быть достигнуты только за счет введения норадреналина или для снижения катехоламинергической нагрузки, которая потенциально может вызвать такие проблемы, как аритмия [70]. Вазопрессин, или антидиуретический гормон (ADH), действует на рецепторы V1 и V2, повышая сосудистый тонус и задерживая жидкость в почках соответственно. У пациентов с кардиогенным шоком, нуждающихся в инотропных препаратах (например, милринон, добутамин) и имеющих сопутствующий дистрибутивный шок, вторичный по отношению к сепсису, часто необходима поддержка вазопрессорами с повышением титра, а также следует оптимизировать использование инотропных препаратов. Адреналин часто используется как двойной инотроп и вазопрессор, чтобы минимизировать потребность в норэпинефрине. Сильный бета-адренергический агонизм и альфа-агонизм адреналина делают его полезным при сердечной дисфункции, хотя в сочетании с норадреналином увеличивается риск перегрузки катехоламинами. В частности, риск опасных для жизни аритмий и ишемии органов вследствие значительного сосудистого тонуса увеличивается при длительном комбинированном применении таких препаратов.
Кроме того, чрезмерное применение адренергических препаратов может повысить сопротивление легочных сосудов, что может способствовать декомпенсации у пациентов с существующей дисфункцией правого желудочка. Поскольку чрезмерное использование адренергических препаратов может увеличить смертность у пациентов с кардиогенным шоком [71], настоятельно рекомендуется разумное использование минимально возможной дозы и минимально возможной продолжительности лечения. Исторически дофамин широко использовался при шоке из-за его интересного дозозависимого агонизма к дофаминергическим и адренергическим рецепторам; однако сравнительные исследования с норэпинефрином показали более частые побочные эффекты, такие как аритмии и повышенную смертность у пациентов с кардиогенным шоком [72]. Новые инотропы, такие как левосимендан, также активно исследуются на предмет их эффективности и безопасности по сравнению с традиционными препаратами [73], хотя никакие преимущества в отношении смертности не подтверждают его использование вместо стандартных методов лечения септического шока [74]. Роль этих новых агентов необходимо будет дополнительно изучить, прежде чем можно будет дать надежные рекомендации.
Еще один особенно интересный агент, заслуживающий обсуждения, который оказывает влияние на ренин-ангиотензин-альдостероновую систему (РААС) — ангиотензин II (АТ-II). РААС была ключевой фармакологической мишенью в лечении гипертонии, заболеваний почек и предотвращении неблагоприятного ремоделирования сердца, однако, несмотря на >30 лет клинического применения, ее роль в лечении шока до недавнего времени игнорировалась [75]. РКИ 2017 года продемонстрировало, что AT-II эффективно повышает САД на ≥10 мм рт.ст. от исходного уровня или до ≥75 мм рт.ст. у пациентов с вазодилатирующим шоком, которым требовалась инфузия норадреналина >0,2 µг/кг/мин, по сравнению с плацебо [76]. AT-II улучшил показатель SOFA через 48 часов без увеличения побочных эффектов по сравнению с плацебо. Обзор 24 исследований с использованием AT-II также продемонстрировал, что он эффективно увеличивает САД в среднем на 23,4% у пациентов с циркуляторным шоком [77]. В конечном счете, медикаментозная терапия, направленная на РААС, может стать мощным инструментом наряду с адренергически модифицирующими агентами для лечения шока.
5.4. Вентиляция с положительным давлением
У пациентов с сепсисом часто развиваются опасные для жизни нарушения дыхания либо в результате прямой инфекции паренхимы легких (например, пневмония), либо в результате развития острого респираторного дистресс-синдрома (ОРДС), когда воспаление приводит к массивной утечке из легочных капилляров и альвеолярному коллапсу. Этим пациентам часто требуется быстрое увеличение частоты неинвазивной или инвазивной вентиляции с положительным давлением (PPV) [78]. Хотя PPV критически поддерживает расширение альвеол и обмен кислорода через альвеолярную мембрану, она также оказывает различные гемодинамические эффекты на левый и правый желудочки. Как правило, функция левого желудочка выигрывает от PPV в виде снижения постнагрузки в результате рефлекторного ответа барорецепторов на компрессию аорты [79]. Однако PPV увеличивает как внутригрудное давление, так и сопротивление легочных сосудов (PVR) [80]. Эти гемодинамические воздействия становятся чрезвычайно важными при дисфункции правого желудочка. Увеличение внутригрудного давления может уменьшить объем венозного возврата, что приводит к снижению преднагрузки правого желудочка. Одновременно с этим PPV может вызывать перераздувание альвеол, что, в свою очередь, приводит к сдавлению сосудистого русла, увеличению легочного сосудистого сопротивления и, как следствие, увеличению постнагрузки на правый желудочек. В совокупности снижение преднагрузки и увеличение постнагрузки могут усугубить основные нарушения функции правого желудочка и значительно увеличить его работу и потребность в кислороде [81]. Впоследствии тяжелая дисфункция правого желудочка может привести к недостаточному обеспечению преднагрузки левого желудочка, вызывая левожелудочковую недостаточность и ухудшая сердечный выброс, что в конечном итоге приводит к гемодинамическому кризису. Таким образом, необходимо тщательно контролировать и поддерживать тонкий баланс между вентиляцией, оксигенацией и перфузией [79].
5.5. Механическая поддержка кровообращения
Устройства временной механической поддержки кровообращения (MCS) улучшают системную перфузию, дают время для восстановления миокарда после травмы и служат либо мостом к выздоровлению, либо мостом к более радикальному вмешательству (например, долговременному устройству, трансплантации сердца) [82]. Быстрое развитие MCS в последние годы предоставило новые возможности для пациентов с кардиогенным шоком, которые н отвечают на инфузионную терапию и вазопрессоры [83]. Правосторонние унивентрикулярные поддерживающие устройства обычно помогают обойти отказавший правый желудочек, тем самым улучшая преднагрузку левого желудочка и системную перфузию. Примеры устройств RV MCS включают Impella RP Flex и Protek Duo [84]. Левосторонние устройства (например, внутриаортальные баллонные насосы (IABP), серии Impella, TandemHeart) либо непосредственно способствуют увеличению сердечного выброса, либо увеличивают коронарную перфузию левого желудочка за счет улучшения диастолического коронарного кровотока [82]
Между тем, бивентрикулярная поддержка может быть достигнута с помощью веноартериальной экстракорпоральной мембранной оксигенации (VAECMO), бивентрикулярных вспомогательных устройств (например, BiPellas, Impella/Protek, хирургических BiVAD CentriMag) или тотального искусственного сердца (TAH) [85]. В частности, VAECMO все чаще используется в качестве моста к окончательной терапии в виде трансплантации или длительного LVAD для пациентов с сердечным индексом <2 л/мин/м2, с отсутствием восстановления миокарда, низким САД, несмотря на вазопрессоры, и другие методы MCS [86]. Несмотря на высокие абсолютные показатели смертности (т.е. 50–70%) в этой группе пациентов, использование VAECMO у пациентов с кардиогенным шоком, вызванным инфарктом миокарда, не улучшило клинические результаты [87,88]. Откладывание начала VAECMO до тех пор, пока у пациентов с тяжелым кардиогенным шоком не наступит клиническое ухудшение, может привести к таким же результатам, как и начало ее вскоре после постановки диагноза. Фактически, недавнее крупное РКИ показало, что среди пациентов с острым инфарктом миокарда, осложненным кардиогенным шоком, экстракорпоральное жизнеобеспечение не улучшило 30-дневную смертность по сравнению со стандартной медикаментозной терапией [89,90].
Несмотря на эти результаты, VAECMO остается важным инструментом при кардиогенном шоке, и разумное принятие клинических решений оправдано, чтобы помочь выявить пациентов, которые могут получить наибольшую пользу от VAECMO в качестве моста к окончательной терапии. Хотя MCS не может быть показан при первичном септическом шоке, при тщательном рассмотрении риска и преимуществ он может служить полезным инструментом для лечения рефрактерного смешанного вазодилататорного и кардиогенного шока [91]. У пациентов, у которых развился сепсис или септический шок во время использования MCS, следует разработать план действий на случай непредвиденных обстоятельств относительно того, следует ли и когда повышать уровень механической поддержки. Например, после тщательного анализа риска и пользы пациенту, получающему только поддержку правого желудочка, можно рассмотреть возможность установки временного устройства левого желудочка, если гемодинамика ухудшается при сепсисе [92]. Аналогичным образом, у пациентов, находящихся на VAECMO, следует рассмотреть вопрос о повышении параметра потока, если развивается сценарий смешанного шока [92].
Примечательно, что в недавнем ретроспективном анализе использования временной MCS при кардиогенном шоке, связанном с сепсисом, только использование внутриаортальной баллонной помпы (IABP) и устройств вспомогательного кровообращения (VAD) было связано с более низким риском внутрибольничной смертности [93]. У пациентов с септическим шоком и острым инфарктом миокарда MCS не продемонстрировала улучшения выживаемости. Хотя модели на животных находятся в стадии изучения [94], необходимы дальнейшие проспективные РКИ для дальнейшего выяснения результатов временного использования MCS у пациентов с сочетанием септического и кардиогенного шока.
Еще одно противоречие вокруг использования MCS сердца у пациентов с сепсисом связано с потенциальным риском появления нового потенциального источника или очага инфекции [91]. Во-первых, сепсис не является абсолютным противопоказанием для начала МКС [95]. Как независимые факторы, септический шок и кардиогенный шок уже каждый создают высокий риск смертности, а при совместном развитии они способствуют еще более быстрой декомпенсации [96]. Таким образом, гемодинамическая польза, получаемая при разумном использовании MCS, часто перевешивает потенциальный риск новой инфекции, связанной с устройством [97]. Наконец, начало различных MCS, особенно ЭКМО, может привести к риску как гемолиза, так и тромбоза, часто вторичного по отношению к напряжению сдвига, оказываемому на эритроциты и тромбоциты, что требует эмпирической антикоагулянтной терапии [98,99]. Без крупномасштабного проспективного исследования, оценивающего, как оптимально сбалансировать риски кровотечений и тромботических осложнений при использовании MCS у пациентов с сочетанием септического и кардиогенного шока, любое обсуждение соотношения риска и пользы должно включать этот вопрос. Решение о том, перевешивает ли гемодинамическая польза, обеспечиваемая MCS, повышенный риск массивного кровотечения или венозной тромбоэмболии, должно приниматься индивидуально для каждого пациента.
6. Выводы и перспективы на будущее
Лечение сепсиса в отделениях кардиореанимации является сложным, сложным и быстро развивающимся из-за постоянного появления новых данных по инфузионной терапии и использованию вазопрессоров, а также передовых технологий MCS. Инструменты скрининга и лечения сепсиса, управляемые искусственным интеллектом, также подвергаются активному моделированию и тестированию, хотя к их первоначальным применениям всегда следует подходить с равным оптимизмом и осторожностью.
References
1. Feldman, E.W.; Dugan, E.; Stephens, R.S.; Schulman, S.; Zakaria, S.; Metkus, T. Presentation and Outcomes of Sepsis in the Cardiac Intensive Care Unit. Am. Heart J. Plus Cardiol. Res. Pract. 2021, 7, 100040. [CrossRef] [PubMed]
2. Singer, M.; Deutschman, C.S.; Seymour, C.W.; Shankar-Hari, M.; Annane, D.; Bauer, M.; Bellomo, R.; Bernard, G.R.; Chiche, J.-D.; Coopersmith, C.M.; et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315,801–810. [CrossRef] [PubMed]
3. Govindan, S.; Prescott, H.C. Quick Sequential Organ Failure Assessment: Illness Severity Indicator, Clinical Decision Support Tool, or Both? Crit. Care Med. 2017, 45, 1947–1949. [CrossRef]
4. Thompson, K.; Venkatesh, B.; Finfer, S. Sepsis and Septic Shock: Current Approaches to Management. Intern. Med. J. 2019, 49, 160–170. [CrossRef] [PubMed]
5. Jentzer, J.C.; Bhat, A.G.; Patlolla, S.H.; Sinha, S.S.; Miller, P.E.; Lawler, P.R.; van Diepen, S.; Khanna, A.K.; Zhao, D.X.; Vallabhajosyula, S. Concomitant Sepsis Diagnoses in Acute Myocardial Infarction-Cardiogenic Shock: 15-Year National Temporal Trends,Management, and Outcomes. Crit. Care Explor. 2022, 4, e0637. [CrossRef] [PubMed]
6. Vahdatpour, C.; Collins, D.; Goldberg, S. Cardiogenic Shock. J. Am. Heart Assoc. 2019, 8, e011991. [CrossRef]
7. Kobbari, G.; Yandrapalli, S.; Anugu, V.R.; Pasam, R.T.; Atti, V.; Kanaparthy, N.; Nabors, C.; Aronow, W. Incidence and Outcomes of Cardiogenic Shock in Patients with Sepsis Complicated by Acute Myocardial Infarction. J. Am. Coll. Cardiol. 2019, 73 (Suppl. S1), 288. [CrossRef]
8. Hochman, J.S.; Sleeper, L.A.; Webb, J.G.; Sanborn, T.A.; White, H.D.; Talley, J.D.; Buller, C.E.; Jacobs, A.K.; Slater, J.N.; Col, J.; et al.
Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. SHOCK Investigators. Should We
Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N. Engl. J. Med. 1999, 341, 625–634. [CrossRef]
9. Ponikowski, P.; Voors, A.A.; Anker, S.D.; Bueno, H.; Cleland, J.G.F.; Coats, A.J.S.; Falk, V.; González-Juanatey, J.R.; Harjola, V.-P.; Jankowska, E.A.; et al. 2016 ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure of the European Society of Cardiology (ESC)Developed with the Special Contribution of the Heart Failure Association (HFA) of the ESC. Eur. Heart J. 2016, 37, 2129–2200. [CrossRef]
10. Chioncel, O.; Parissis, J.; Mebazaa, A.; Thiele, H.; Desch, S.; Bauersachs, J.; Harjola, V.-P.; Antohi, E.-L.; Arrigo, M.; Ben Gal, T.; et al. Epidemiology, Pathophysiology and Contemporary Management of Cardiogenic Shock—A Position Statement from the Heart Failure Association of the European Society of Cardiology. Eur. J. Heart Fail. 2020, 22, 1315–1341. [CrossRef]
11. Tehrani, B.N.; Truesdell, A.G.; Psotka, M.A.; Rosner, C.; Singh, R.; Sinha, S.S.; Damluji, A.A.; Batchelor, W.B. A Standardized and Comprehensive Approach to the Management of Cardiogenic Shock. JACC Heart Fail. 2020, 8, 879–891. [CrossRef] [PubMed]
12. Just, H. Peripheral Adaptations in Congestive Heart Failure: A Review. Am. J. Med. 1991, 90, 23S–26S. [CrossRef]
13. Dhakal, B.P.; Malhotra, R.; Murphy, R.M.; Pappagianopoulos, P.P.; Baggish, A.L.;Weiner, R.B.; Houstis, N.E.; Eisman, A.S.; Hough, S.S.; Lewis, G.D. Mechanisms of Exercise Intolerance in Heart Failure with Preserved Ejection Fraction: The Role of Abnormal
Peripheral Oxygen Extraction. Circ. Heart Fail. 2015, 8, 286–294. [CrossRef] [PubMed]
14. Greer, J. Pathophysiology of Cardiovascular Dysfunction in Sepsis. BJA Educ. 2015, 15, 316–321. [CrossRef]
15. VINCENT, J.-L.; ZHANG, H.; SZABO, C.; PREISER, J.-C. Effects of Nitric Oxide in Septic Shock. Am. J. Respir. Crit. Care Med. 2000, 161, 1781–1785. [CrossRef] [PubMed]
16. Kakihana, Y.; Ito, T.; Nakahara, M.; Yamaguchi, K.; Yasuda, T. Sepsis-Induced Myocardial Dysfunction: Pathophysiology and Management. J. Intensive Care 2016, 4, 22. [CrossRef]
17. Jarczak, D.; Kluge, S.; Nierhaus, A. Sepsis—Pathophysiology and Therapeutic Concepts. Front. Med. 2021, 8, 609. [CrossRef]
18. Brealey, D.; Brand, M.; Hargreaves, I.; Heales, S.; Land, J.; Smolenski, R.; Davies, N.A.; Cooper, C.E.; Singer, M. Association between Mitochondrial Dysfunction and Severity and Outcome of Septic Shock. Lancet Lond. Engl. 2002, 360, 219–223. [CrossRef]
19. Niederbichler, A.D.; Hoesel, L.M.;Westfall, M.V.; Gao, H.; Ipaktchi, K.R.; Sun, L.; Zetoune, F.S.; Su, G.L.; Arbabi, S.; Sarma, J.V.; et al. An Essential Role for Complement C5a in the Pathogenesis of Septic Cardiac Dysfunction. J. Exp. Med. 2006, 203, 53–61.[CrossRef]
20. Sheyin, O.; Davies, O.; Duan, W.; Perez, X. The Prognostic Significance of Troponin Elevation in Patients with Sepsis: A Meta-Analysis. Heart Lung J. Crit. Care 2015, 44, 75–81. [CrossRef]
21. Frencken, J.F.; Donker, D.W.; Spitoni, C.; Koster-Brouwer, M.E.; Soliman, I.W.; Ong, D.S.Y.; Horn, J.; van der Poll, T.; van Klei,W.A.; Bonten, M.J.M.; et al. Myocardial Injury in Patients with Sepsis and Its Association with Long-Term Outcome. Circ. Cardiovasc.
Qual. Outcomes 2018, 11, e004040. [CrossRef] [PubMed]
22. Omar, A.S.; Ur Rahman, M.; Dhatt, G.S.; Salami, G.O.; Abuhasna, S. Dynamics of Brain Natriuretic Peptide in Critically Ill Patients with Severe Sepsis and Septic Shock. Saudi J. Anaesth. 2013, 7, 270–276. [CrossRef] [PubMed]
23. Jeyaraju, M.; McCurdy, M.T.; Levine, A.R.; Devarajan, P.; Mazzeffi, M.A.; Mullins, K.E.; Reif, M.; Yim, D.N.; Parrino, C.; Lankford, A.S.; et al. Renin Kinetics Are Superior to Lactate Kinetics for Predicting In-Hospital Mortality in Hypotensive Critically Ill Patients. Crit. Care Med. 2022, 50, 50–60. [CrossRef]
24. Villacorta, H.; Maisel, A.S. Soluble ST2 Testing: A Promising Biomarker in the Management of Heart Failure. Arq. Bras. Cardiol. 2016, 106, 145–152. [CrossRef] [PubMed]
25. Gomes, D.A.; de Almeida Beltrão, R.L.; de Oliveira Junior, F.M.; da Silva Junior, J.C.; de Arruda, E.P.C.; Lira, E.C.; da Rocha, M.J.A. Vasopressin and Copeptin Release during Sepsis and Septic Shock. Peptides 2021, 136, 170437. [CrossRef] [PubMed]
26. Li, H.; Tang, D.; Chen, J.; Hu, Y.; Cai, X.; Zhang, P. The Clinical Value of GDF15 and Its Prospective Mechanism in Sepsis. Front. Immunol. 2021, 12, 710977. [CrossRef]
27. Rivers, E.; Nguyen, B.; Havstad, S.; Ressler, J.; Muzzin, A.; Knoblich, B.; Peterson, E.; Tomlanovich, M. Early Goal-Directed Therapy in the Treatment of Severe Sepsis and Septic Shock. N. Engl. J. Med. 2001, 345, 1368–1377. [CrossRef]
28. Baloch, K.; Rehman Memon, A.; Ikhlaq, U.; Umair, M.; Ansari, M.I.; Abubaker, J.; Salahuddin, N. Assessing the Utility of End-Tidal Carbon Dioxide as a Marker for Fluid Responsiveness in Cardiogenic Shock. Cureus 2021, 13, e13164. [CrossRef]
29. Salerno, A.; Kuhn, D.; El Sibai, R.; Levine, A.R.; McCurdy, M.T. Real-Time Remote Tele-Mentored Echocardiography: A Systematic Review. Med. Kaunas Lith. 2020, 56, 668. [CrossRef]
30. Safadi, S.; Murthi, S.; Kashani, K.B. Use of Ultrasound to Assess Hemodynamics in Acutely Ill Patients. Kidney360 2021, 2,1349–1359. [CrossRef]
31. Beaubien-Souligny, W.; Rola, P.; Haycock, K.; Bouchard, J.; Lamarche, Y.; Spiegel, R.; Denault, A.Y. Quantifying Systemic Congestion with Point-Of-Care Ultrasound: Development of the Venous Excess Ultrasound Grading System. Ultrasound J. 2020,12, 16. [CrossRef] [PubMed]
32. Barjaktarevic, I.; Kenny, J.-É.S.; Berlin, D.; Cannesson, M. The Evolution of Ultrasound in Critical Care: From Procedural Guidance to Hemodynamic Monitor. J. Ultrasound Med. Off. J. Am. Inst. Ultrasound Med. 2021, 40, 401–405. [CrossRef] [PubMed]
33. Monnet, X.; Teboul, J.-L. Passive Leg Raising: Five Rules, Not a Drop of Fluid! Crit. Care 2015, 19, 18. [CrossRef] [PubMed]
34. Marik, P.E. Noninvasive Cardiac Output Monitors: A State-of the-Art Review. J. Cardiothorac. Vasc. Anesth. 2013, 27, 121–134. [CrossRef] [PubMed]
35. Argueta, E.; Berdine, G.; Pena, C.; Nugent, K.M. FloTrac® Monitoring System: What Are Its Uses in Critically Ill Medical Patients? Am. J. Med. Sci. 2015, 349, 352–356. [CrossRef]
36. Ranka, S.; Mastoris, I.; Kapur, N.K.; Tedford, R.J.; Rali, A.; Acharya, P.; Weidling, R.; Goyal, A.; Sauer, A.J.; Gupta, B.; et al. Right Heart Catheterization in Cardiogenic Shock Is Associated with Improved Outcomes: Insights From the Nationwide Readmissions Database. J. Am. Heart Assoc. 2021, 10, e019843. [CrossRef]
37. Shah, M.R.; Hasselblad, V.; Stevenson, L.W.; Binanay, C.; O’Connor, C.M.; Sopko, G.; Califf, R.M. Impact of the Pulmonary Artery Catheter in Critically Ill Patients: Meta-Analysis of Randomized Clinical Trials. JAMA 2005, 294, 1664–1670. [CrossRef]
38. Bertaina, M.; Galluzzo, A.; Morici, N.; Sacco, A.; Oliva, F.; Valente, S.; D’Ascenzo, F.; Frea, S.; Sbarra, P.; Petitti, E.; et al. Pulmonary Artery Catheter Monitoring in Patients with Cardiogenic Shock: Time for a Reappraisal? Card. Fail. Rev. 2022, 8, e15. [CrossRef]
39. Saxena, A.; Garan, A.R.; Kapur, N.K.; O’Neill, W.W.; Lindenfeld, J.; Pinney, S.P.; Uriel, N.; Burkhoff, D.; Kern, M. Value of Hemodynamic Monitoring in Patients with Cardiogenic Shock Undergoing Mechanical Circulatory Support. Circulation 2020, 141, 1184–1197. [CrossRef]
40. Martínez, M.L.; Plata-Menchaca, E.P.; Ruiz-Rodríguez, J.C.; Ferrer, R. An Approach to Antibiotic Treatment in Patients with Sepsis. J. Thorac. Dis. 2020, 12, 1007–1021. [CrossRef]
41. Strich, J.R.; Heil, E.L.; Masur, H. Considerations for Empiric Antimicrobial Therapy in Sepsis and Septic Shock in an Era of Antimicrobial Resistance. J. Infect. Dis. 2020, 222 (Suppl. S2), S119–S131. [CrossRef] [PubMed]
42. Rhodes, A.; Evans, L.E.; Alhazzani, W.; Levy, M.M.; Antonelli, M.; Ferrer, R.; Kumar, A.; Sevransky, J.E.; Sprung, C.L.; Nunnally, M.E.; et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017, 43, 304–377. [CrossRef] [PubMed]
43. DiPiro, J.T. Pathophysiology and Treatment of Gram-Negative Sepsis. Am. J. Hosp. Pharm. 1990, 47 (Suppl. S3), S6–S10. [CrossRef] [PubMed]
44. Gentile, L.F.; Moldawer, L.L. DAMPs, PAMPs, and the Origins of SIRS in Bacterial Sepsis. Shock 2013, 39, 113–114. [CrossRef] [PubMed]
45. Kalil, A.C.; Metersky, M.L.; Klompas, M.; Muscedere, J.; Sweeney, D.A.; Palmer, L.B.; Napolitano, L.M.; O’Grady, N.P.; Bartlett, J.G.; Carratalà, J.; et al. Management of Adults with Hospital-Acquired and Ventilator-Associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin. Infect. Dis. Off. Publ. Infect. Dis. Soc. Am. 2016, 63, e61–e111. [CrossRef]
46. Zakhour, J.; Sharara, S.L.; Hindy, J.-R.; Haddad, S.F.; Kanj, S.S. Antimicrobial Treatment of Pseudomonas Aeruginosa Severe Sepsis. Antibiotics 2022, 11, 1432. [CrossRef]
47. Amaral, A.C.K.B.; Fowler, R.A.; Pinto, R.; Rubenfeld, G.D.; Ellis, P.; Bookatz, B.; Marshall, J.C.; Martinka, G.; Keenan, S.; Laporta, D.; et al. Patient and Organizational Factors Associated with Delays in Antimicrobial Therapy for Septic Shock. Crit. Care Med. 2016, 44, 2145–2153. [CrossRef]
48. Deshpande, A.; Haessler, S.; Brizendine, K.; Lindenauer, P.; Lagu, T.; Yu, P.-C.; Bakaki, P.; Pekow, P.; Rothberg, M. Empiric Double Coverage for Healthcare-Associated Pneumonia: Is It Still Necessary? Open Forum Infect. Dis. 2016, 3 (Suppl. S1), 1252. [CrossRef]
49. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado, F.R.; Mcintyre, L.; Ostermann, M.; Prescott, H.C.; et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock 2021.Intensive Care Med. 2021, 47, 1181–1247. [CrossRef]
50. Maimone, S.; Mazzeo, A.T.; Squadrito, G.; Raimondo, G. Sodium Load and Intravenous Antimicrobials in Patients with Cirrhosis. Dig. Liver Dis. Off. J. Ital. Soc. Gastroenterol. Ital. Assoc. Study Liver 2019, 51, 1490–1492. [CrossRef]
51. Wang, N.; Nguyen, P.K.; Pham, C.U.; Smith, E.A.; Kim, B.; Goetz, M.B.; Graber, C.J. Sodium Content of Intravenous Antibiotic Preparations. Open Forum Infect. Dis. 2019, 6, ofz508. [CrossRef] [PubMed]
52. Semler, M.W.; Rice, T.W. Sepsis Resuscitation: Fluid Choice and Dose. Clin. Chest Med. 2016, 37, 241–250. [CrossRef] [PubMed]
53. Finfer, S.; Liu, B.; Taylor, C.; Bellomo, R.; Billot, L.; Cook, D.; Du, B.; McArthur, C.; Myburgh, J. Resuscitation Fluid Use in Critically Ill Adults: An International Cross-Sectional Study in 391 Intensive Care Units. Crit. Care Lond. Engl. 2010, 14, R185. [CrossRef] [PubMed]
54. Sivapalan, P.; Ellekjaer, K.L.; Jessen, M.K.; Meyhoff, T.S.; Cronhjort, M.; Hjortrup, P.B.; Wetterslev, J.; Granholm, A.; Møller, M.H.; Perner, A. Lower vs Higher Fluid Volumes in Adult Patients with Sepsis: An Updated Systematic Review with Meta-Analysis and Trial Sequential Analysis. Chest 2023, 164, 892–912. [CrossRef]
55. Moschopoulos, C.D.; Dimopoulou, D.; Dimopoulou, A.; Dimopoulou, K.; Protopapas, K.; Zavras, N.; Tsiodras, S.; Kotanidou, A.; Fragkou, P.C. New Insights into the Fluid Management in Patients with Septic Shock. Medicina 2023, 59, 1047. [CrossRef]
56. Caironi, P.; Tognoni, G.; Masson, S.; Fumagalli, R.; Pesenti, A.; Romero, M.; Fanizza, C.; Caspani, L.; Faenza, S.; Grasselli, G.; et al. Albumin Replacement in Patients with Severe Sepsis or Septic Shock. N. Engl. J. Med. 2014, 370, 1412–1421. [CrossRef]
57. Hahn, R.G.; Lyons, G. The Half-Life of Infusion Fluids: An Educational Review. Eur. J. Anaesthesiol. 2016, 33, 475–482. [CrossRef]
58. The SAFE Study Investigators. A Comparison of Albumin and Saline for Fluid Resuscitation in the Intensive Care Unit. N. Engl.J. Med. 2004, 350, 2247–2256. [CrossRef]
59. Annane, D.; Siami, S.; Jaber, S.; Martin, C.; Elatrous, S.; Declère, A.D.; Preiser, J.C.; Outin, H.; Troché, G.; Charpentier, C.; et al. Effects of Fluid Resuscitation with Colloids vs Crystalloids on Mortality in Critically Ill Patients Presenting with Hypovolemic Shock: The CRISTAL Randomized Trial. JAMA 2013, 310, 1809–1817. [CrossRef]
60. Hanley, C.; Callum, J.; Karkouti, K.; Bartoszko, J. Albumin in Adult Cardiac Surgery: A Narrative Review. Can. J. Anesth. Can. Anesth. 2021, 68, 1197–1213. [CrossRef]
61. Geng, L.; Tian, X.; Gao, Z.; Mao, A.; Feng, L.; He, C. Different Concentrations of Albumin Versus Crystalloid in Patients with Sepsis and Septic Shock: A Meta-Analysis of Randomized Clinical Trials. J. Intensive Care Med. 2023, 38, 679–689. [CrossRef] [PubMed]
62. Sakr, Y.; Bauer, M.; Nierhaus, A.; Kluge, S.; Schumacher, U.; Putensen, C.; Fichtner, F.; Petros, S.; Scheer, C.; Jaschinski, U.; et al. Randomized Controlled Multicentre Study of Albumin Replacement Therapy in Septic Shock (ARISS): Protocol for a Randomized Controlled Trial. Trials 2020, 21, 1002. [CrossRef] [PubMed]
63. Semler, M.W.; Kellum, J.A. Balanced Crystalloid Solutions. Am. J. Respir. Crit. Care Med. 2019, 199, 952–960. [CrossRef] [PubMed]
64. Semler, M.W.; Self, W.H.; Wanderer, J.P.; Ehrenfeld, J.M.; Wang, L.; Byrne, D.W.; Stollings, J.L.; Kumar, A.B.; Hughes, C.G.; Hernandez, A.; et al. Balanced Crystalloids versus Saline in Critically Ill Adults. N. Engl. J. Med. 2018, 378, 829–839. [CrossRef]
65. Self, W.H.; Semler, M.W.; Wanderer, J.P.; Wang, L.; Byrne, D.W.; Collins, S.P.; Slovis, C.M.; Lindsell, C.J.; Ehrenfeld, J.M.; Siew,E.D.; et al. Balanced Crystalloids versus Saline in Noncritically Ill Adults. N. Engl. J. Med. 2018, 378, 819–828. [CrossRef]
66. Zampieri, F.G.; Machado, F.R.; Biondi, R.S.; Freitas, F.G.R.; Veiga, V.C.; Figueiredo, R.C.; Lovato, W.J.; Amêndola, C.P.; Serpa-Neto, A.; Paranhos, J.L.R.; et al. Effect of Intravenous Fluid Treatment with a Balanced Solution vs 0.9% Saline Solution on Mortality in Critically Ill Patients: The BaSICS Randomized Clinical Trial. JAMA 2021, 326, 818–829. [CrossRef]
67. Finfer, S.; Micallef, S.; Hammond, N.; Navarra, L.; Bellomo, R.; Billot, L.; Delaney, A.; Gallagher, M.; Gattas, D.; Li, Q.; et al. Balanced Multielectrolyte Solution versus Saline in Critically Ill Adults. N. Engl. J. Med. 2022, 386, 815–826. [CrossRef]
68. Vallon, V. Tubuloglomerular Feedback and the Control of Glomerular Filtration Rate. Physiology 2003, 18, 169–174. [CrossRef]
69. Toporek, A.H.; Semler, M.W.; Self,W.H.; Bernard, G.R.;Wang, L.; Siew, E.D.; Stollings, J.L.;Wanderer, J.P.; Rice, T.W.; Casey, J.D. Balanced Crystalloids versus Saline in Critically Ill Adults with Hyperkalemia or Acute Kidney Injury: Secondary Analysis of a
Clinical Trial. Am. J. Respir. Crit. Care Med. 2021, 203, 1322–1325. [CrossRef]
70. Demiselle, J.; Fage, N.; Radermacher, P.; Asfar, P. Vasopressin and Its Analogues in Shock States: A Review. Ann. Intensive Care 2020, 10, 9. [CrossRef]
71. Tarvasmäki, T.; Lassus, J.; Varpula, M.; Sionis, A.; Sund, R.; Køber, L.; Spinar, J.; Parissis, J.; Banaszewski, M.; Silva Cardoso, J.; et al. Current Real-Life Use of Vasopressors and Inotropes in Cardiogenic Shock—Adrenaline Use Is Associated with Excess Organ Injury and Mortality. Crit. Care Lond. Engl. 2016, 20, 208. [CrossRef]
72. De Backer, D.; Biston, P.; Devriendt, J.; Madl, C.; Chochrad, D.; Aldecoa, C.; Brasseur, A.; Defrance, P.; Gottignies, P.; Vincent, J.-L. Comparison of Dopamine and Norepinephrine in the Treatment of Shock. N. Engl. J. Med. 2010, 362, 779–789. [CrossRef]
73. Conti, N.; Gatti, M.; Raschi, E.; Diemberger, I.; Potena, L. Evidence and Current Use of Levosimendan in the Treatment of Heart Failure: Filling the Gap. Drug Des. Devel. Ther. 2021, 15, 3391–3409. [CrossRef]
74. Gordon, A.C.; Perkins, G.D.; Singer, M.; McAuley, D.F.; Orme, R.M.L.; Santhakumaran, S.; Mason, A.J.; Cross, M.; Al-Beidh, F.; Best-Lane, J.; et al. Levosimendan for the Prevention of Acute Organ Dysfunction in Sepsis. N. Engl. J. Med. 2016, 375, 1638–1648. [CrossRef]
75. McCurdy, M.T.; Busse, L.W. Rethinking Vasopressor Education: The Need to Avoid Teaching the Bare Minimum. ATS Sch. 2023, 4, 389–390. [CrossRef]
76. Khanna, A.; English, S.W.; Wang, X.S.; Ham, K.; Tumlin, J.; Szerlip, H.; Busse, L.W.; Altaweel, L.; Albertson, T.E.; Mackey, C.; et al. Angiotensin II for the Treatment of Vasodilatory Shock. N. Engl. J. Med. 2017, 377, 419–430. [CrossRef]
77. Busse, L.W.; McCurdy, M.T.; Ali, O.; Hall, A.; Chen, H.; Ostermann, M. The Effect of Angiotensin II on Blood Pressure in Patients with Circulatory Shock: A Structured Review of the Literature. Crit. Care Lond. Engl. 2017, 21, 324. [CrossRef]
78. Mercat, A.; Richard, J.-C.M.; Vielle, B.; Jaber, S.; Osman, D.; Diehl, J.-L.; Lefrant, J.-Y.; Prat, G.; Richecoeur, J.; Nieszkowska, A.;et al. Positive End-Expiratory Pressure Setting in Adults with Acute Lung Injury and Acute Respiratory Distress Syndrome: A Randomized Controlled Trial. JAMA 2008, 299, 646–655. [CrossRef]
79. Alviar, C.L.; Miller, P.E.; McAreavey, D.; Katz, J.N.; Lee, B.; Moriyama, B.; Soble, J.; van Diepen, S.; Solomon, M.A.; Morrow, D.A. Positive Pressure Ventilation in the Cardiac Intensive Care Unit. J. Am. Coll. Cardiol. 2018, 72, 1532–1553. [CrossRef]
80. Corp, A.; Thomas, C.; Adlam, M. The Cardiovascular Effects of Positive Pressure Ventilation. BJA Educ. 2021, 21, 202–209. [CrossRef]
81. Disselkamp, M.; Adkins, D.; Pandey, S.; Coz Yataco, A.O. Physiologic Approach to Mechanical Ventilation in Right Ventricular Failure. Ann. Am. Thorac. Soc. 2018, 15, 383–389. [CrossRef]
82. Atti, V.; Narayanan, M.A.; Patel, B.; Balla, S.; Siddique, A.; Lundgren, S.; Velagapudi, P. A Comprehensive Review of Mechanical Circulatory Support Devices. Heart Int. 2022, 16, 37–48. [CrossRef]
83. Thiele, H.; Ohman, E.M.; Desch, S.; Eitel, I.; de Waha, S. Management of Cardiogenic Shock. Eur. Heart J. 2015, 36, 1223–1230. [CrossRef]
84. Alkhunaizi, F.A.; Burkhoff, D.; Brener, M.I. Right-Sided Mechanical Circulatory Support—A Hemodynamic Perspective. Curr. Heart Fail. Rep. 2022, 19, 334–345. [CrossRef]
85. Vis, A.; Arfaee, M.; Khambati, H.; Slaughter, M.S.; Gummert, J.F.; Overvelde, J.T.B.; Kluin, J. The Ongoing Quest for the First Total Artificial Heart as Destination Therapy. Nat. Rev. Cardiol. 2022, 19, 813–828. [CrossRef]
86. Marasco, S.F.; Lukas, G.; McDonald, M.; McMillan, J.; Ihle, B. Review of ECMO (Extra Corporeal Membrane Oxygenation) Support in Critically Ill Adult Patients. Heart Lung Circ. 2008, 17 (Suppl. S4), S41–S47. [CrossRef]
87. Shin, T.G.; Choi, J.-H.; Jo, I.J.; Sim, M.S.; Song, H.G.; Jeong, Y.K.; Song, Y.-B.; Hahn, J.-Y.; Choi, S.H.; Gwon, H.-C. Extracorporeal Cardiopulmonary Resuscitation in Patients with Inhospital Cardiac Arrest: A Comparison with Conventional Cardiopulmonary Resuscitation. Crit. Care Med. 2011, 39, 1–7. [CrossRef]
88. Chen, Y.-S.; Lin, J.-W.; Yu, H.-Y.; Ko, W.-J.; Jerng, J.-S.; Chang, W.-T.; Chen, W.-J.; Huang, S.-C.; Chi, N.-H.; Wang, C.-H. Cardiopulmonary Resuscitation with Assisted Extracorporeal Life-Support versus Conventional Cardiopulmonary Resuscitation in Adults with in-Hospital Cardiac Arrest: An Observational Study and Propensity Analysis. Lancet 2008, 372, 554–561. [CrossRef]
89. Ostadal, P.; Rokyta, R.; Karasek, J.; Kruger, A.; Vondrakova, D.; Janotka, M.; Naar, J.; Smalcova, J.; Hubatova, M.; Hromadka, M.; et al. Extracorporeal Membrane Oxygenation in the Therapy of Cardiogenic Shock: Results of the ECMO-CS Randomized Clinical Trial. Circulation 2023, 147, 454–464. [CrossRef]
90. Thiele, H.; Zeymer, U.; Akin, I.; Behnes, M.; Rassaf, T.; Mahabadi, A.A.; Lehmann, R.; Eitel, I.; Graf, T.; Seidler, T.; et al. Extracorporeal Life Support in Infarct-Related Cardiogenic Shock. N. Engl. J. Med. 2023, 389, 1286–1297. [CrossRef]
91. Ling, R.R.; Ramanathan, K.; Poon, W.H.; Tan, C.S.; Brechot, N.; Brodie, D.; Combes, A.; MacLaren, G. Venoarterial Extracorporeal Membrane Oxygenation as Mechanical Circulatory Support in Adult Septic Shock: A Systematic Review and Meta-Analysis with Individual Participant Data Meta-Regression Analysis. Crit. Care 2021, 25, 246. [CrossRef]
92. Geller, B.J.; Sinha, S.S.; Kapur, N.K.; Bakitas, M.; Balsam, L.B.; Chikwe, J.; Klein, D.G.; Kochar, A.; Masri, S.C.; Sims, D.B.; et al. Escalating and De-Escalating Temporary Mechanical Circulatory Support in Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation 2022, 146, e50–e68. [CrossRef]
93. Sato, R.; Hasegawa, D.; Guo, S.C.; Nishida, K.; Dugar, S. Temporary Mechanical Circulatory Support in Sepsis-Associated Cardiogenic Shock with and Without Acute Myocardial Infarction. J. Cardiothorac. Vasc. Anesth. 2023, 9, 26. [CrossRef]
94. Chvojka, J.; Martinkova, V.; Benes, J.; Valesova, L.; Danihel, V.; Nalos, L.; Matejovic, M. Mechanical Circulatory Support in Refractory Vasodilatory Septic Shock: A Randomized Controlled Porcine Study. Shock 2020, 53, 124–131. [CrossRef]
95. Gilotra, N.A.; Stevens, G.R. Temporary Mechanical Circulatory Support: A Review of the Options, Indications, and Outcomes. Clin. Med. Insights Cardiol. 2014, 8 (Suppl. S1), 75–85. [CrossRef]
96. Mayr, V.D.; Dünser, M.W.; Greil, V.; Jochberger, S.; Luckner, G.; Ulmer, H.; Friesenecker, B.E.; Takala, J.; Hasibeder, W.R. Causes of Death and Determinants of Outcome in Critically Ill Patients. Crit. Care 2006, 10, R154. [CrossRef]
97. George, P.; Srivastava, M.C.; Ludmir, J.; Reed, R.M.; Tewelde, S.Z.; Gupta, A.; McCurdy, M.T. Augmenting Function for Infarction from Infection: Impella 2.5 for Ischemic Cardiogenic Shock Complicating Sepsis. Case Rep. Cardiol. 2017, 2017, 8407530. [CrossRef]
98. Petricevic, M.; Milicic, D.; Boban, M.; Mihaljevic, M.Z.; Baricevic, Z.; Kolic, K.; Dolic, K.; Konosic, L.; Kopjar, T.; Biocina, B. Bleeding and Thrombotic Events in Patients Undergoing Mechanical Circulatory Support: A Review of Literature. Thorac. Cardiovasc. Surg. 2015, 63, 636–646. [CrossRef]
99. Baumann Kreuziger, L.; Massicotte, M.P. Mechanical Circulatory Support: Balancing Bleeding and Clotting in High-Risk Patients. Hematology 2015, 2015, 61–68. [CrossRef]
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 10.04.2024
[ACTIVE_FROM] => 10.04.2024
[SHOW_COUNTER] => 337
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2017-07-31 16:04:44
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829724
[VALUE] => Сепсис, интенсивная терапия
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Сепсис, интенсивная терапия
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2017-08-02 11:16:15
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829726
[VALUE] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2017-08-02 11:18:27
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829725
[VALUE] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829765
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2017-09-15 12:05:50
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2017-09-19 10:40:01
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2017-08-22 15:43:39
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829732
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2017-08-22 16:30:23
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2017-08-23 10:51:22
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2017-08-23 11:05:12
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829728
[1] => 829729
[2] => 829730
[3] => 829731
)
[VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => sepsis
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => sepsis
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2017-10-12 14:43:36
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2018-05-11 11:01:14
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829765
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829732
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829728
[1] => 829729
[2] => 829730
[3] => 829731
)
[VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => sepsis
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => sepsis
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Критические состояния
[2] => Интенсивная терапия
[3] => Сепсис
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 26.08.2022 14:38:28
[~TIMESTAMP_X] => 26.08.2022 14:38:28
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
[BROWSER_TITLE] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
[KEYWORDS] => Сепсис, интенсивная терапия
[DESCRIPTION] => Лечение сепсиса в кардиологическом отделении интенсивной терапии
)
)


