Array
(
[NAME] => Как лечить коагулопатии у пациентов в критическом состоянии
[~NAME] => Как лечить коагулопатии у пациентов в критическом состоянии
[PREVIEW_PICTURE] => Array
(
[ID] => 5607
[TIMESTAMP_X] => 11.11.2024 14:07:37
[MODULE_ID] => iblock
[HEIGHT] => 667
[WIDTH] => 1000
[FILE_SIZE] => 99683
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/ead/86kl3tqo2dld74udkpe82llg24em6s9b
[FILE_NAME] => front-view-doctor-holding-medical-element.jpg
[ORIGINAL_NAME] => front-view-doctor-holding-medical-element.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => e40afc6652a95dfa2d5811f4c99a2723
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/ead/86kl3tqo2dld74udkpe82llg24em6s9b/front-view-doctor-holding-medical-element.jpg
[UNSAFE_SRC] => /upload/iblock/ead/86kl3tqo2dld74udkpe82llg24em6s9b/front-view-doctor-holding-medical-element.jpg
[SAFE_SRC] => /upload/iblock/ead/86kl3tqo2dld74udkpe82llg24em6s9b/front-view-doctor-holding-medical-element.jpg
[ALT] => Как лечить коагулопатии у пациентов в критическом состоянии
[TITLE] => Как лечить коагулопатии у пациентов в критическом состоянии
)
[~PREVIEW_PICTURE] => 5607
[DETAIL_TEXT] => Julie Helms, Toshiaki Iba, Jean Marie Connors, Satoshi Gando, Marcel Levi, Ferhat Mezianiand Jerrold H. Levy
How to manage coagulopathies in critically ill patients
Intensive Care Med 2023 .doi.org/10.1007/s00134-023-06980-6
Абстракт
Коагулопатия является тяжелым и частым осложнением у пациентов в критическом состоянии, патогенез и проявления которой могут варьировать в зависимости от основного заболевания. На основании доминирующего клинического фенотипа в настоящем обзоре различают геморрагические коагулопатии, характеризующиеся состоянием гипокоагуляции и гиперфибринолиза, и тромботические коагулопатии с системным протромботическим и антифибринолитическим фенотипом. Обсуждаются различия в патогенезе и лечении распространенных коагулопатий.
Ключевые слова: диссеминированное внутрисосудистое свертывание крови, коагулопатия, сепсис, травма, гематологические заболевания, реаниматология.
Введение
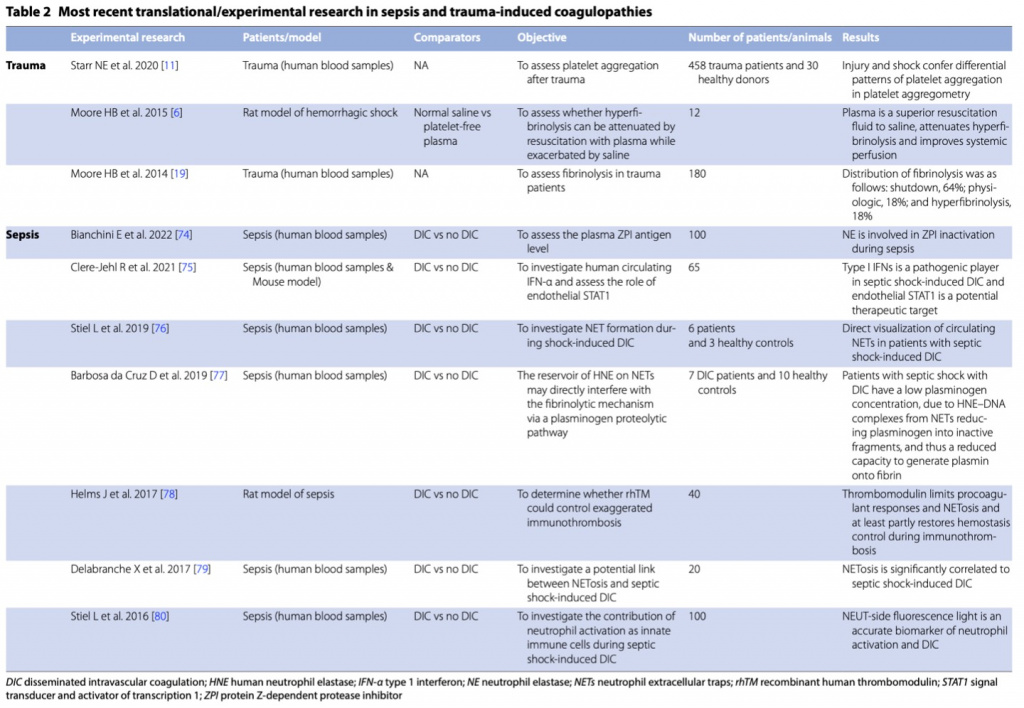
Нарушения свертывания крови — тяжелое, частое осложнение у больных в критическом состоянии, приводящее к синдрому полиорганной дисфункции (СПОН) и ассоциированное с ухудшением прогноза [1]. Таким образом, «коагулопатия» является общим термином, который можно определить как любое изменение или нарушение гемостаза по множеству причин, приводящее либо к кровотечению, либо к образованию тромбов, либо к тому и другому. Примеры включают сепсис-индуцированную коагулопатию (SIC) и травма-индуцированную коагулопатию (TIC). Однако, если они достаточно тяжелые, эти коагулопатии перерастают в диссеминированное внутрисосудистое свертывание крови (ДВС-синдром), что приводит к ПОН (Fig. 1).
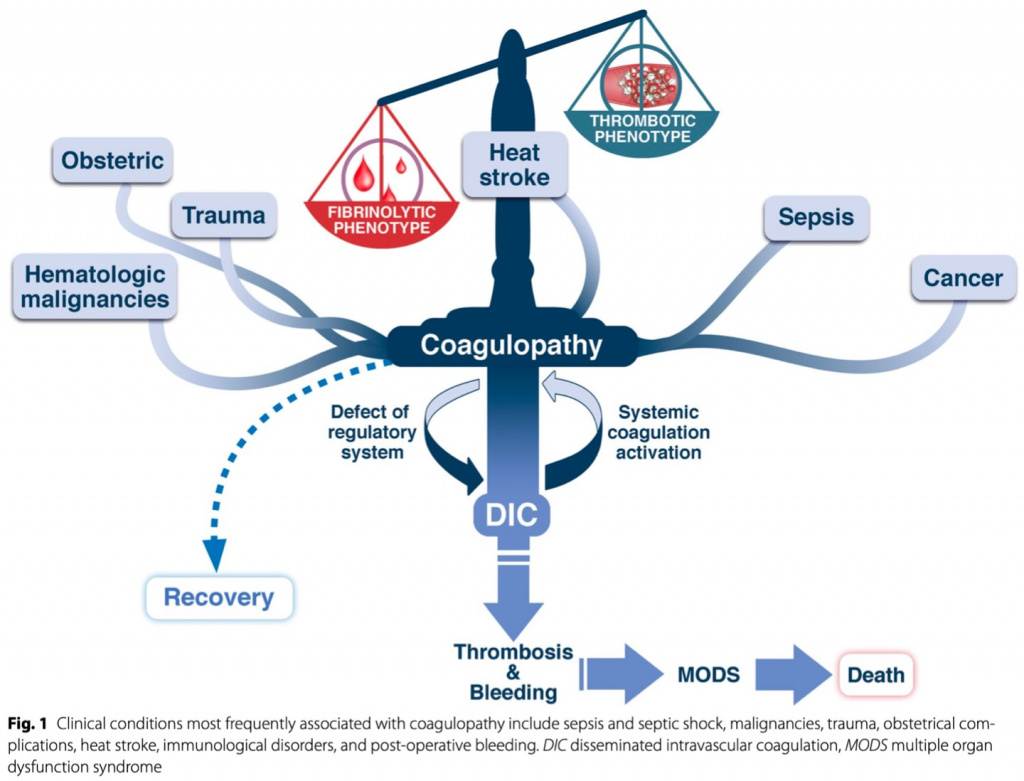
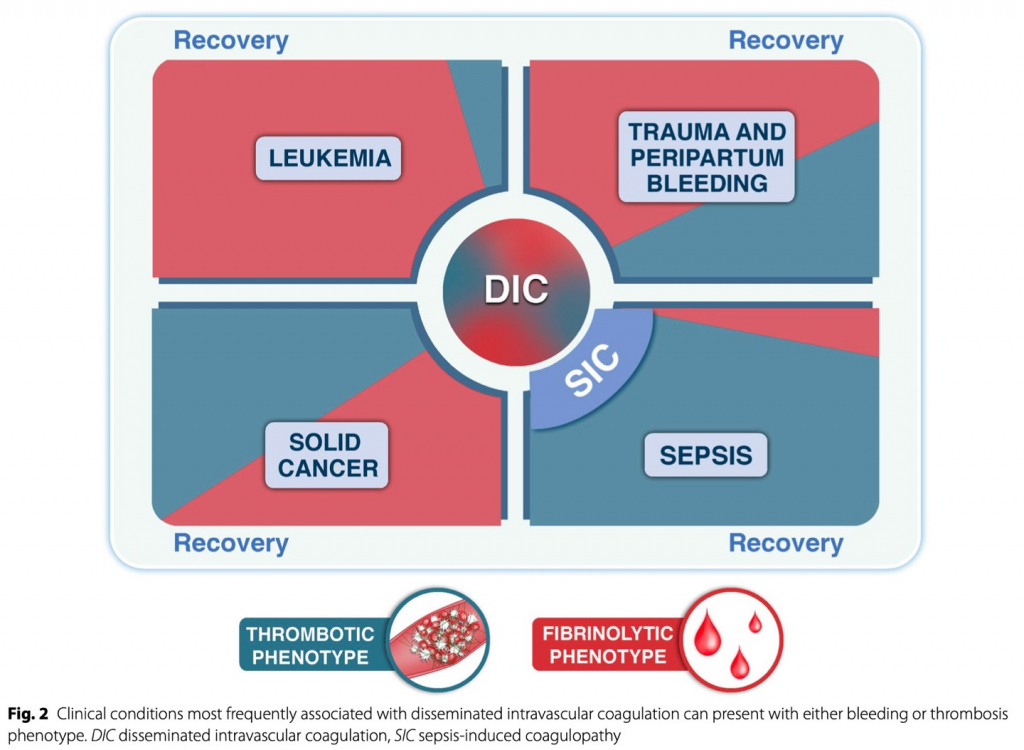
Патогенез, проявления и лечение различных коагулопатий частично зависят от основного заболевания (Fig. 2). При ДВС-синдроме и всех коагулопатиях лечение основного заболевания, вызвавшего коагулопатию, имеет решающее значение. Однако каждая коагулопатия имеет доминирующий клинический фенотип, но у пациента могут проявляться тромботические и/или геморрагические признаки в зависимости от прогрессирования заболевания, терапевтических вмешательств и времени. Основываясь на доминирующем клиническом фенотипе, в этом обзоре мы будем различать геморрагические коагулопатии, характеризующиеся гипокоагуляционными и/или гиперфибринолитическими состояниями, и тромботические коагулопатии с системным протромботическим и антифибринолитическим фенотипом, а также рассмотрим различия в патогенезе и лечении.
Геморрагические коагулопатии
Не обусловленные злокачественными опухолями геморрагические коагулопатии
После травма-индуцированной и перинатальной коагулопатии начальное гипокоагуляционное состояние приводит к кровотечению в месте (-ах) повреждения, хотя массивная активация гемостаза происходит в сразу после травмы (Fig. 3) [2-4]. Эта начальная стадия геморрагического шока связана с гиперфибринолитическим состоянием вследствие высвобождения эндотелием тканевого активатора плазминогена (tPA), превращающего плазминоген в плазмин [5–7]. После обширного повреждения тканей и эндотелия высвобождаются ассоциированные с повреждением молекулярные паттерны (DAMP) и провоспалительные цитокины, усиливая образование тромбина, образование сгустков и эндотелиопатию [8].
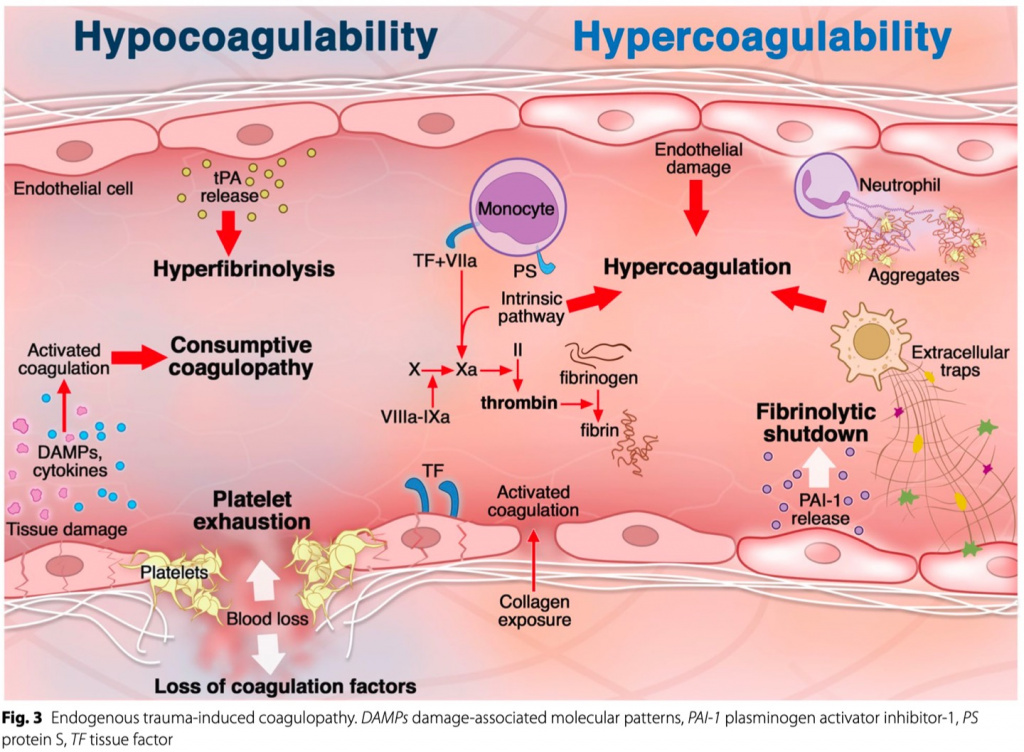
Тромбоциты прилипают к поврежденному эндотелию, обеспечивая прокоагулянтную поверхность для активации коагуляции и усиления образования тромбина на активированных тромбоцитах во время фазы распространения. Активированные лейкоциты и тромбоциты образуют тромбоцитарно-лейкоцитарные агрегаты, а активированные нейтрофилы и макрофаги высвобождают внеклеточные ловушки, способствуя агрегации тромбоцитов и образованию тромбина (Fig. 3). Кровотечение с продолжающимся образованием тромбина приводит к расходованию факторов свертывания крови. Кроме того, истощение тромбоцитов изменяет их агрегацию [9–11].
Повреждение тканей и/или органов также может изменить гемостатический баланс. Например, поврежденная мозговая ткань высвобождает большое количество прокоагулянтных фосфолипидов и микровезикул (МВ) [12], в то время как при повреждении поджелудочной железы, легких и урогенитальных органов может высвобождаться tPA для активации фибринолиза. Во время беременности синцитиотрофобласт приобретает свойства эндотелиальных клеток с гемостатическими функциями, включая высокую экспрессию тканевого фактора (ТФ), протеина С, протеина S, протеина Z и ингибиторов пути тканевого фактора (TFPI-2). Кроме того, плацента также может высвобождать ингибиторы активатора плазминогена PAI-1 и PAI-2 во время нормальной беременности для предотвращения фибринолиза. Разрушение синцитиотрофобласта приводит к прокоагулянтным эффектам за счет массивного высвобождения тканевого фактора, активации воспаления и гиперфибринолиза [13].
Эта геморрагическая коагулопатия может дополнительно усугубляться неконтролируемым кровотечением, гемодилюцией из-за увеличения перфузии для поддержания артериального давления, «летальной триадой» (коагулопатия, гипотермия и метаболический ацидоз) из-за шока и СПОН, а также гипокальциемии, вторичной по отношению к потреблению и инактивации цитратными препаратами крови [14–17]. Все это может объяснить снижение активности ферментов свертывания, изменение функции тромбоцитов, задержку образования тромбина, гипофибриногенемию, изменение полимеризации фибрина и изменение прочности сгустка [16, 18].
По мере развития геморрагического шока фенотип кровотечения прогрессирует до тромботического, особенно после лечения препаратами крови и/или концентратами факторов [19]. Этому тромботическому фенотипу способствует измененная иммунорегуляторная функция тромбоцитов [20]. Кроме того, начальный гиперфибринолиз подавляется через несколько часов после первоначального повреждения ткани, термин, описываемый как «фибринолитическое отключение» из-за обширного высвобождения ингибиторов, клеточных побочных продуктов повреждения и нейтрофильной эластазы из нейтрофильных внеклеточных ловушек (NETs), которые снижают доступность плазминогена [21]. Наконец, при травма-индуцированной коагулопатии повреждение головного мозга может способствовать протромботическим расстройствам за счет массивного воздействия тканевого фактора, высвобождения церебрального эндотелиального фактора фон Виллебранда (vWF) и нарушения клиренса с помощью ADAMTS13.
Злокачественные геморрагические коагулопатии
У больных лейкозами, злокачественными гематологическими заболеваниями и некоторыми формами солидных опухолей (например, аденокарцинома предстательной железы или рак поджелудочной железы) у 15–20% развивается ДВС-синдром с преобладанием геморрагических проявлений над тромботическими. Кровотечения являются ведущей причиной ранней смерти и клиническим признаком острого промиелоцитарного лейкоза (APL; AML-M3 по франко-американо-британской классификации), при этом у 70–80% пациентов развивается ДВС-синдром при постановке диагноза или во время начала терапии [22, 23]. Это опасное для жизни кровотечение, проявляющееся ДВС-синдромом, также происходит при моноцитарном лейкозе или при запущенной аденокарциноме. Более того, терапевтические агенты, включая химиотерапию, трансплантацию гемопоэтических стволовых клеток, терапию Т-клетками с химерным антигенным рецептором (CAR), осложненную синдромом высвобождения цитокинов, могут вызывать эндотелиит. Кроме того, у пациентов могут развиться вторичные инфекции, которые могут играть важную роль в развитии ДВС-синдрома [24].
При этих онкологических состояниях могут сосуществовать как прокоагулянтные, так и гиперфибринолитические признаки. Опухолевые клетки экспрессируют тканевой фактор, ответственный за активацию коагуляции, прокоагулянтные белки, а также воспалительные цитокины, такие как интерлейкин-1β и фактор некроза опухоли α, которые подавляют эндотелиальный тромбомодулин и активируют антикоагулянтный путь протеина С [25, 26]. Однако эти прокоагулянтные механизмы в значительной степени подавлены гиперфибринолизом из-за повышенного высвобождения тканевого активатора плазминогена (tPA) [26-30]. Гиперфибринолиз часто встречается при остром промиелоцитарном лейкозе или ДВС-синдроме, в то время как гипофибринолиз проявляется при миелопролиферативных заболеваниях, что согласуется с повышенным риском тромбоза, а также у пациентов с острым лимфобластным лейкозом, получающим лечение L-аспарагиназой [31]. В последнем случае повышенный риск тромбоза обусловлен приобретенным дефицитом антитромбина.
Тромботические коагулопатии
Сепсис-индуцированная коагулопатия
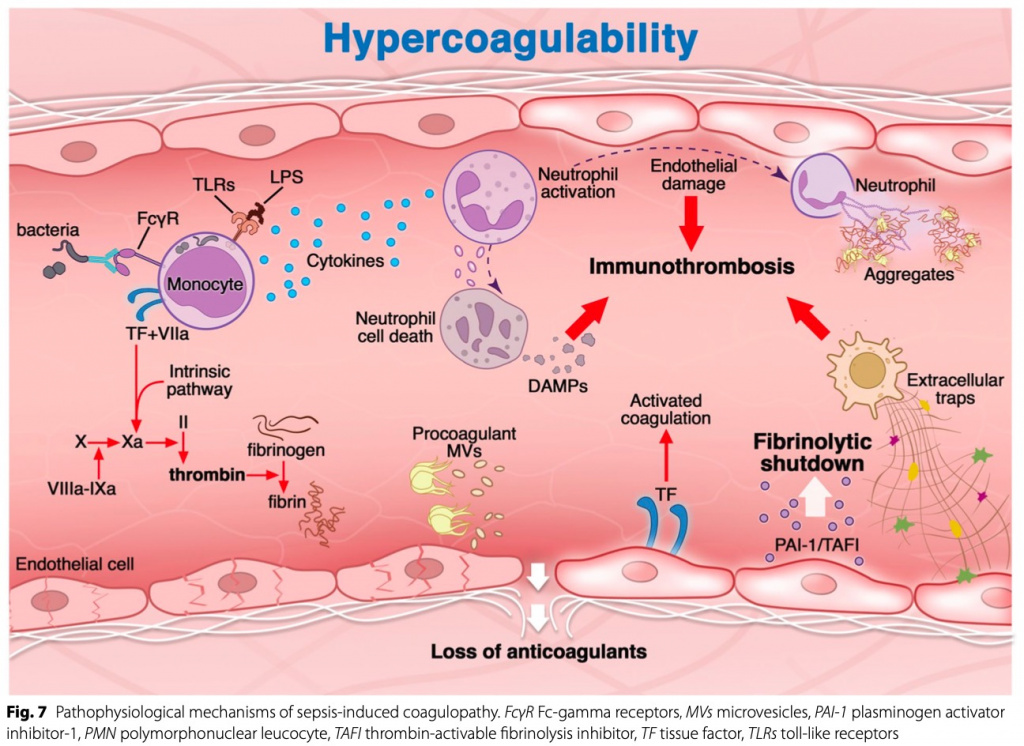
Системное воспаление, характеризующее инвазию патогенов в хозяина при сепсисе, ответственно за активацию системной коагуляции с внутрисосудистыми прокоагулянтными фенотипическими изменениями, приводящими к сепсис-индуцированной коагулопатии (SIC) (Fig. 7) [32, 33]. Провоспалительные цитокины индуцируют эндотелиальную и моноцитарную экспрессию, которая запускает коагуляцию, что приводит к избыточной генерации тромбина, превращающего фибриноген в нерастворимую фибриновую сеть [34]. Кроме того, прямая активация контактной фазы и ингибирование реактивного фибринолиза бактериальными полифосфатами могут усиливать эту реакцию и приводить к избыточной продукции тромбина и/или нарушенной деградации фибрина [35]. Фибринолиз может дополнительно ухудшаться за счет увеличения продукции/активации ингибиторов (PAI-1, тромбин-активируемый ингибитор фибринолиза — TAFI) и снижения tPA [36]. Естественные антикоагулянты (протеин С, протеин S, тромбомодулин и антитромбин) и ингибитор пути тканевого фактора, ограничивающие активацию свертывания, либо истощены, либо менее активны [36].
При сепсисе взаимодействие иммунных клеток с активацией коагуляции было описано как «иммунотромбоз» [37] и относится к врожденному внутрисосудистому иммунному ответу, вызывающему образование тромбина и микротромбов. Первоначально иммунотромбоз был описан как полезный механизм защиты хозяина от патогенов, позволяющий их распознавать, сдерживать и уничтожать [38]. Однако при сепсисе и септическом шоке нарушение регуляции иммунотромбоза может привести к чрезмерной активации коагуляции, что в конечном итоге приводит к ДВС-синдрому и способствует серьезному повреждению тканей [37-41].
Активированные нейтрофилы выделяют как прокоагулянтные микровезикулы (MV), так и нейтрофильные внеклеточные ловушки (NET). NET представляют собой волокна деконденсированной ДНК, несущие цитруллинированные гистоны и протеолитические ферменты, такие как миелопероксидаза и нейтрофильная эластаза [42, 43]. Микровезикулы представляют собой субмикронные везикулы плазматической мембраны, высвобождаемые тромбоцитами и активированными моноцитами и нейтрофилами. Микровезикулы могут запускать активацию эндотелия и лейкоцитов, индуцировать экспрессию тканевого фактора и способствовать воспалительным сигнальным путям в стенках сосудов и тканях сердца [44]. Кроме того, воздействие фосфатидилсерина на ВК индуцирует сборку факторов свертывания крови. Интересно, что эндотелиальные и лейкоцитарные МВ проявляют профибринолитическую функцию, тем самым дополняя их прокоагулянтную активность [45]. Кроме того, ко-локализация микровезикул на нейтрофильных внеклеточных ловушках представляет собой поверхность, способствующую свертыванию крови, что способствует потенциальной прокоагулянтной активности нейтрофильных внеклеточных ловушек посредством активации контактной фазы (фактор XII). Кроме того, образование тромбина может индуцироваться гистонами тромбоцит-зависимым образом и нейтрофильной эластазой посредством протеолиза ингибитора пути тканевого фактора (TFPI) [46-48].
Коагулопатия, связанная с солидным раком
В нескольких когортных исследованиях сообщалось о высоком риске тромботических осложнений у больных раком со средней распространенностью 15% при аденокарциномах высокого риска и относительным риском от 4 до 7 по сравнению с пациентами без рака [49]. Этот повышенный тромботический риск обусловлен злокачественностью, в зависимости от типа опухоли и стадии заболевания, а также противораковыми терапевтическими вмешательствами, включая химиотерапию, иммунотерапию, хирургию или наличие постоянных сосудистых катетеров [50]. Например, относительный риск тромбоза при химиотерапии рака повышается до 6,5, в первую очередь из-за повреждения эндотелия [49, 51].
Гиперкоагуляция при раке обычно следует за опосредованной тканевым фактором активацией свертывания, воспалительной модуляцией свертывания, фибринолитическими изменениями и эндотелиальной дисфункцией. И раковые клетки, и эндотелий играют ключевую роль в активации коагуляции и тромбообразовании. Повышенные уровни vWF в плазме, высвобождаемые во время повреждения эндотелия, усиливают агрегацию тромбоцитов в поврежденном эндотелии. Опухолевые клетки, моноциты, макрофаги и прокоагулянтные микровезикулы активируют тканевой фактор, способствуя гиперкоагуляции. Опухолевые клетки, продуцирующие муцин, могут также генерировать цистеиновую протеазу, которая непосредственно активирует фактор X, в то время как взаимодействия между раковыми клетками и тромбоцитарным и эндотелиальным P-селектином и лейкоцитарным L-селектином могут индуцировать образование микротромбов тромбоцитов. Провоспалительные цитокины могут дополнительно усугубить активацию прокоагулянтных путей, процесс, который может быть дополнительно усилен химиотерапией. Наконец, некоторые раковые клетки могут экспрессировать ингибиторы фибринолиза (PAI-1) или активаторы (tPA или uPA), что приводит к антифибринолитической активности или гиперфибринолизу, в зависимости от их относительных уровней [52-54].
Рак также может индуцировать ДВС-синдром, но в отличие от ДВС-синдрома, индуцированного сепсисом, у пациентов проявляются минимальные клинические симптомы с умеренными/подострыми/ хроническими клиническими проявлениями потребления тромбоцитов и факторов свертывания крови за счет компенсированного увеличения продукции некоторых прокоагулянтных белков в ответ на воспаление. ДВС-синдром при солидных опухолях в основном характеризуется прокоагулянтной активностью и отложением фибрина, что повышает при них риск тромботических осложнений по сравнению с больными без ДВС-синдрома [49].
В большом проспективном когортном исследовании солидных опухолей ДВС-синдром был диагностирован у 7% из 1117 пациентов на основании диагностических критериев Международного общества тромбоза и гемостаза (ISTH) [55]. Большинство из этих больных имели запущенные стадии рака (у 76% III/IV стадии), у 59% развились геморрагические осложнения, у 34% — тромботические, у 7% — кровотечения и тромботические. Факторы, независимо связанные с ДВС-синдромом при многомерном анализе, включали распространенный рак более высокой стадии, рак молочной железы и наличие некроза опухоли. В более общем плане аденокарциномы, в основном желудочно-кишечного тракта, поджелудочной железы, легких, молочной или предстательной железы, возможно, глиобластомы или другие опухоли головного мозга являются основными опухолями, связанными с ДВС-синдромом [55].
Лечение коагулопатий
Лечение геморрагических коагулопатий
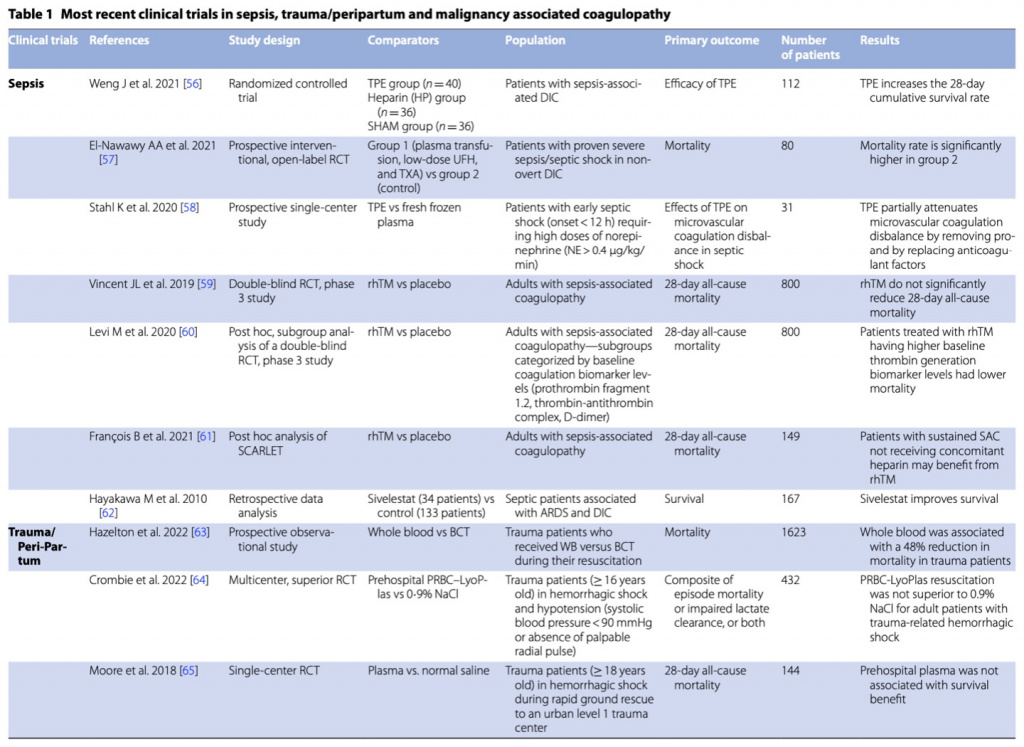
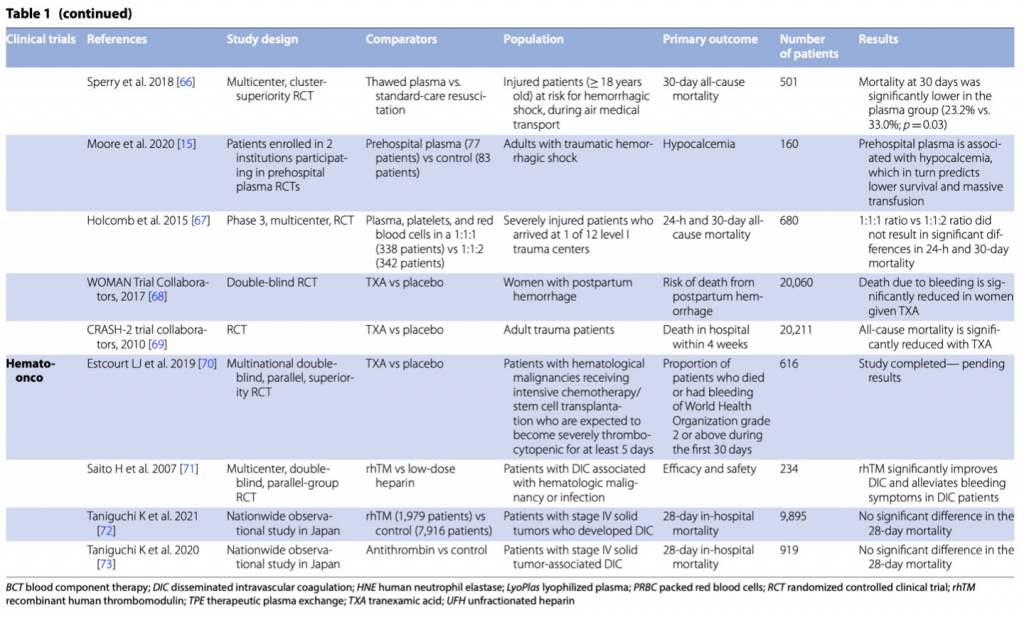
Лечение коагулопатии должно основываться на доминирующем клиническом фенотипе/проявлении, будь то геморрагическая коагулопатия с гипокоагуляцией и гиперфибринолизом или тромботическая коагулопатия с системным протромботическим и антифибринолитическим фенотипом (Fig. 4). Помимо лечения основного заболевания, большинство терапевтических вмешательств являются лишь поддерживающими и частично эффективными из-за заболевания, явившегося причиной развития коагулопатии. Однако антикоагулянтный и фибринолитический пути направлены на восстановление гемостатического баланса между кровотечением и тромбозом, который также изменяется в ходе терапии. Как показано в Tables 1 и 2, клинические испытания и экспериментальные данные привели к большим успехам в лечении коагулопатий за последнее десятилетие, хотя некоторые вопросы все еще остаются без ответа.
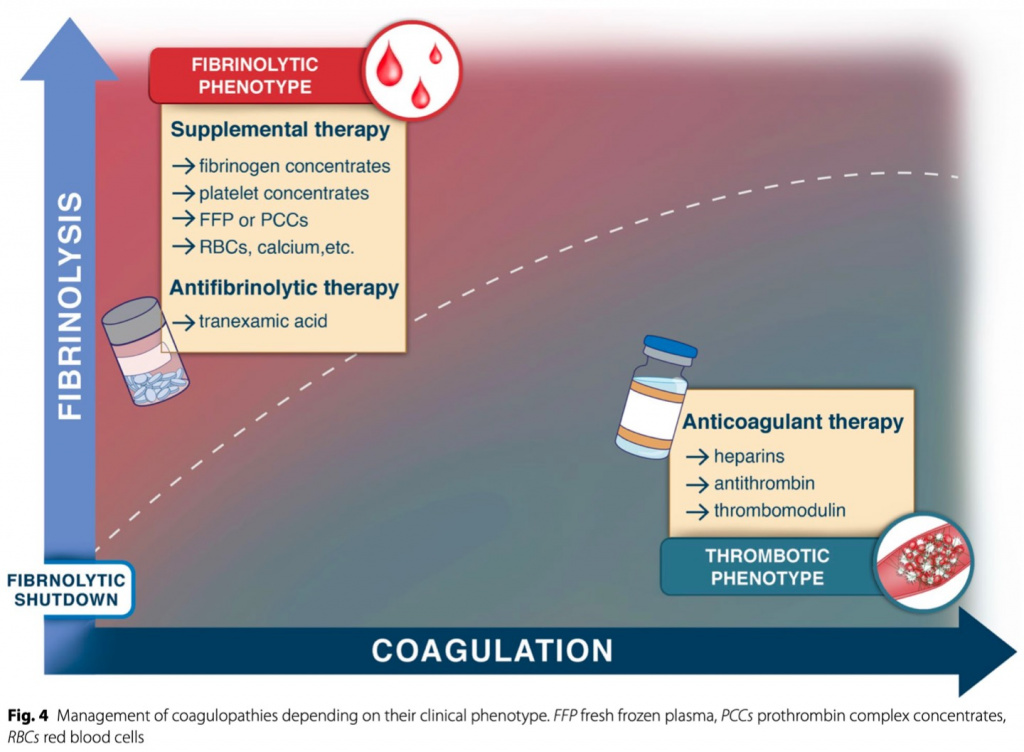
Остановка кровотечения
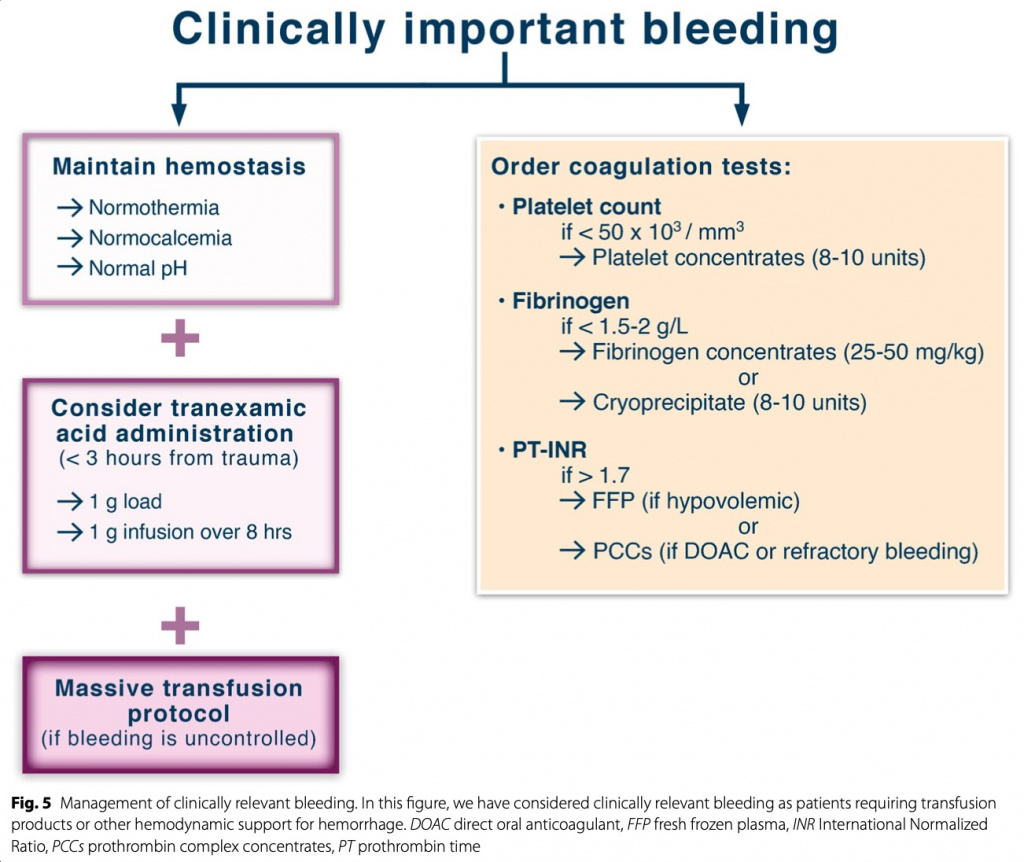
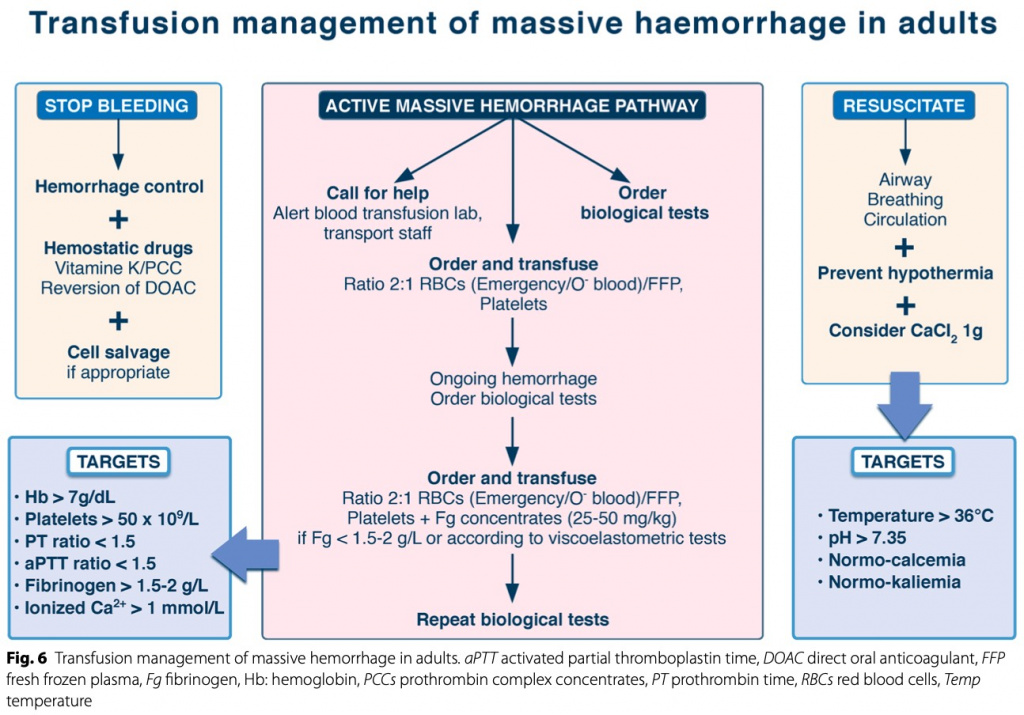
Лечение геморрагических коагулопатий при травме или в послеродовом периоде требует восстановления объема циркулирующей крови и купирования шока, и все это рассматривается как часть реанимационный мероприятий для контроля повреждений. Медикаментозная остановка кровотечения включает заместительную гемотрансфузию и/или концентратами факторов свертывания в зависимости от скорости кровотечения и коагулограммы (Fig. 5). Использование алгоритмов контроля за кровотечением имеет решающее значение как часть мультимодального терапевтического плана при геморрагическом шоке до тех пор, пока определенные хирургические или радиологические вмешательства не смогут остановить или контролировать кровотечение (Fig. 6). Для этой популяции пациентов были предложены специфические алгоритмы трансфузии многих факторов, включая переливание эритроцитов (эритроцитов) и тромбоцитов [81]. Европейское общество медицины критических состояний (ESICM) недавно опубликовало рекомендации по стратегии трансфузии [82]. Эксперты предлагают стратегии переливания с высоким соотношением (по крайней мере, одна единица плазмы/2 единицы эритроцитарной массы) у тяжелобольных с массивным кровотечением в следствии травмы (доказательства с низким уровнем достоверности), в то время как для пациентов без травмы рекомендации отсутствуют. Также отсутствуют экспертные рекомендации по раннему эмпирическому замещению фибриногеном у пациентов с травмами или в критическом состоянии. Кроме того, при переливании эритроцитов и тромбоцитов пациентам с немассивным кровотечением рекомендуются ограничительные стратегии трансфузии.
Острый ДВС-синдром, связанный с лейкемией, обычно быстро разрешается после начала противоопухолевой терапии, но геморрагические осложнения часто требуют трансфузионной поддержки из-за тромбоцитопении. Предложены пороги переливания тромбоцитов 20–30х109/л и 50х109/л, соответственно, у пациентов без кровотечения и с кровотечением, а также поддержание уровня фибриногена > 1,5–2 г/л. Таким пациентам не рекомендуются антифибринолитические препараты из-за вторичного повышенного тромботического риска, а также нефракционированный гепарин или рекомбинантный активированный фактор VII [22]. Рекомбинантный растворимый тромбомодулин может улучшать ДВС-синдром и облегчать симптомы кровотечения у пациентов с коагулопатией и гемобластозами [71].
Восстановление протромботико-фибринолитического гемостатического баланса
Гиперфибринолиз является важным фактором кровотечения и коагулопатии, наблюдаемых в дебюте коагулопатии, индуцированной травмой (TIC) и перинатальных кровотечений. В результате мультимодальное лечение ТИЦ включает дополнительную антифибринолитическую терапию транексамовой кислотой, хотя эндогенные ингибиторы фибринолиза, такие как PAI-1 mRNA [16, 17], могут уменьшить кровотечение после повреждения ткани [83]. В соответствии с данными крупнейшего рандомизированного контролируемого исследования CRASH-2, в котором приняли участие 20 211 пациентов с травмами, получавших в течение 8 часов после травмы либо транексамовую кислоту (ТК), либо плацебо, смертность от всех причин была снижена в группе ТК (14,5% по сравнению с 16% плацебо; относительный риск [ОР ] 0,91, 95% ДИ 0,85–0,97; p = 0,0035) [69], эксперты ESICM рекомендуют ее применение в течение 3 ч у пациентов в критическом состоянии с кровотечением из-за травмы (сильная рекомендация, высокая достоверность) [82].
При перинатальной коагулопатии эксперты ESICM также «предлагают раннее использование TК у пациентов в критическом состоянии с послеродовым кровотечением (условная рекомендация, высокая достоверность)». В исследовании WOMAN, проведенном с участием 20 060 женщин с клиническим диагнозом послеродового кровотечения, TК снижала смертность от кровотечения (ОР 0,81; 95% ДИ 0,65–1; p = 0,045), особенно если ее вводили в течение 3 ч после родов (ОР 0,69; 95). % ДИ 0,52–0,91, p = 0,008) [68]. Многонациональное рандомизированное, двойное слепое, плацебо-контролируемое, параллельное исследование превосходства (NCT03136445) в настоящее время проверяет, может ли введение TК пациентам, получающим лечение от онкогематологических заболеваний, снизить риск кровотечения или смерти и оценивает необходимость переливания тромбоцитов [70].
Рекомендации по гемостатической терапии
Помимо применения протоколов при массивных кровотечения, руководство своевременным назначением (Fig. 7) гемостатической терапии в зависимости от тяжести и характера гемостатического дефицита может позволить осуществить целенаправленный и индивидуальный подход к коррекции коагулопатии. Считалось, прикроватные исследования вязкости крови более эффективны, чем обычные тесты на коагуляцию. Однако в недавнем прагматическом, многоцентровом, рандомизированном контролируемом исследовании ITACTICу пациентов с травмой и кровотечением сообщалось, что вмешательства, проводимые под контролем показателей вязкости крови, не улучшали исходы по сравнению со стандартным протоколом, дополненным активным мониторингом обычных тестов на коагуляцию [84].
Лечение тромботических коагулопатий
Профилактика тромботических осложнений
В контексте тромботической коагулопатии с избыточным образованием тромбина при сепсисе и солидных опухолях антикоагулянтная терапия может предотвратить или обратить вспять чрезмерную активацию коагуляции и нарушение регуляции иммунотромбоза (Fig. 8). Нефракционированный гепарин (НФГ) и низкомолекулярный гепарин (НМГ) приводят к повышенной (антитромбинзависимой) инактивации фактора Ха и некоторых протеаз свертывания (IXa, XIa, XIIa), а НФГ также нейтрализует тромбин. Гепарин также проявляет иммуномодулирующие и противовоспалительные свойства, что важно для регуляции иммунотромбоза [85]. Независимо от контекста коагулопатии, клинические исследования показывают более высокую эффективность НМГ по сравнению с НФГ у пациентов в критическом состоянии без увеличения частоты геморрагических осложнений [86]. Таким образом, европейские и американские рекомендации рекомендуют фармакологическую профилактику НМГ вместо НФГ у пациентов в критическом состоянии (уровень 1В) [87, 88].
Несколько метаанализов, включая анализ Wang et al. сообщили о снижении смертности у пациентов с сепсисом, получавших гепарин [89], но данные крупных рандомизированных контролируемых исследований в этой популяции все еще необходимы. В японском двойном слепом исследовании, включавшем 125 пациентов с ДВС-синдромом, сравнивалась эффективность НМГ (FR-860) с гепарином и было высказано предположение, что FR-860 может привести к более высокой частоте улучшения, чем группа гепарина (20,5% и 8,2% соответственно) [90]. При сепсисе экспериментальные данные показывают благотворное влияние ингибиторов свертывания крови (антитромбина, протеина С и TFPI) на выживаемость экспериментальных животных (Table. 2) [91, 92]. Однако антитромбин не улучшал выживаемость пациентов в исследованиях III фазы и повышал риск тяжелых геморрагических осложнений [93, 94]. Рекомбинантный человеческий активированный протеин С был отозван из-за отсутствия положительного влияния на выживаемость пациентов с сепсисом и повышенного риска кровотечения (Table 1) [95].
Тромбомодулин (ТМ) представляет собой трансмембранный многодоменный гликопротеин, в основном экспрессируемый эндотелиальными клетками. Образуя комплекс с тромбином, ТМ позволяет активировать протеин С и последующую инактивацию кофакторов Va и VIIIa, тем самым ограничивая усиление коагуляционного каскада [96-98]. При септическом шоке эндотелиальная экспрессия ТМ подавляется, что приводит к дефекту активации протеина С. Кроме того, лектиноподобный домен рекомбинантного человеческого ТМ (rhTM) также обладает противовоспалительными свойствами, ингибируя каскад комплемента и адгезию лейкоцитов к эндотелию, нейтрализуя липополисахарид (LPS) и разрушая провоспалительный белок высокой подвижности группы 1 (HMGB1) [98-100].
Международное рандомизированное контролируемое исследование SCARLET, в котором сравнивается эффект rhTM с плацебо, является первым исследованием , в которое включены только пациенты с сепсисом и коагулопатией, определяемые тромбоцитопенией или снижением количества тромбоцитов более чем на 30% в течение 24 часов и МНО > 1,4 [59]. Хотя значительного снижения смертности на 28-й день в группе полного анализа не наблюдалось, rhTM был более эффективен в подгруппах пациентов с персистирующей коагулопатией на момент введения первой дозы лечения (т.е. между рандомизацией в исследовании и назначением лечения) и теми, кто не получал сопутствующего лечения гепарином в контексте тромбопрофилактики. Эти результаты были подтверждены апостериорным анализом, проведенным на когорте французских пациентов [61]. rhTM остается потенциально перспективным методом лечения ДВС-синдрома, вызванного септическим шоком, хотя он не рекомендуется отдельно в японских руководствах.
Отсутствие стратификации пациентов для назначения антикоагулянтной терапии является причиной некоторых неудач крупных клинических испытаний. Например, в некоторых апостериорных анализах рандомизированных клинических исследований наименее тяжелые пациенты (прогнозируемая смертность <25%, оценка по шкале APACHE II <25 или SAPS II<40) не получают пользы от лечения гепарином, антитромбином, APC или rhTM [101], так как у них нет коагулопатии. Действительно, лечение физиологическими ингибиторами свертывания при септическом шоке может принести пользу только пациентам с тяжелым ДВС-синдром, поскольку локальный иммунотромбоз может участвовать в физиологических реакциях иммунной защиты. При септической коагулопатии назначают антикоагулянты, чтобы изменить тонкий баланс между патогеном и адаптивной реакцией хозяина. Хотя активация адаптивной коагуляции является важной частью защитного механизма хозяина (иммунотромбоз), ее нерегулируемая и чрезмерная активация вредна [41, 79].
Поэтому необходимо различать пациентов с сепсисом или септическим шоком в зависимости от того, считается ли состояние активации свертывания вредным (чрезмерным) или полезным (контролируемым), что можно рассматривать как «адаптивный гемостаз»; первым может помочь лечение антикоагулянтами, а вторым - нет. Точно так же, в то время как коагулопатия, связанная с раком, чаще связана с легкими или подострыми/хроническими проявлениями, солидные опухоли на терминальной стадии являются одной из ведущих причин ДВС-синдрома и также являются предметом всесторонних исследований. Таким образом, в двух крупных японских стационарных исследованиях с базой данных оценивался эффект терапии антитромбином или rhTM у пациентов с ДВС-синдромом, ассоциированным с солидной опухолью IV стадии, но оба не показали снижения смертности по сравнению с контрольной группой [72, 73].
Наконец, поскольку контактный (внутренний) путь активации играет ключевую роль в росте тромба, интересной альтернативой для получения антитромботического эффекта без увеличения риска кровотечения из-за антикоагулянтной терапии было бы ингибирование этого пути [102]. FXI, как правило, не является необходимым для физиологического гемостаза. Таким образом, ингибирование FXI было определено как потенциальная антитромботическая мишень [103-105]. Были разработаны новые стратегии для нацеливания на FXI, включая антисенс-олигонуклеотиды (ASO), которые уменьшают синтез FXI в печени, блокируя активацию или активность FXI с помощью антител или аптамеров или вызывают обратимое связывание с активным центром FXI небольшими молекулами [106]. Эти новые терапевтические средства еще не были оценены при сепсис-индуцированной коагулопатии.
Восстановление протромботико-фибринолитического баланса
Помимо лечения антикоагулянтами, направленного на предотвращение чрезмерной активации свертывания, добавление белков плазмы у пациентов с крайне низким уровнем факторов свертывания крови и антитромбина, вторичного по отношению к септической коагулопатии, может снизить риск кровотечения и повысить эффективность гепарина. В клиническом исследовании с участием 80 детей с сепсисом или септическим шоком, осложненным предшествующим ДВС-синдромом, раннее применение комбинации свежезамороженной плазмы, низких доз гепарина и транексамовой кислоты было связано с улучшением выживаемости и предотвращением прогрессирования ДВС-синдрома без увеличения риска кровотечения [57]. Кроме того, два недавно опубликованных исследования, проведенных у взрослых пациентов, показали, что ранний плазмаферез может уменьшить дисбаланс между про- и антикоагулянтными факторами, приводящий к септической коагулопатии [56, 58].
Наконец, в недавнем исследовании с целью подтверждения концепции у пациентов с септическим шоком было показано, что эластаза, связанная с нейтрофильными внеклеточными ловушками ДНК , разрушает плазминоген, снижает образование плазмина и, таким образом, уменьшает фибринолиз [77]. Этот гипофибринолиз играет важную роль в возникновении ДВС-синдрома, ответственного за СПОН. Плазминоген превращается в плазмин под действием tPA, высвобождаемого поврежденным эндотелием сосудов. Однако концентрация циркулирующего плазминогена ограничивает способность тромбов к эндогенному лизису. У этих пациентов также наблюдалось резкое снижение концентрации плазминогена, частично связанное с его потреблением (превращением в плазмин) при фибринолизе.
However, in septic DIC, a persistence of microthrombi associated with hypofibrinolysis requires an alternative explanation. The major functionalplasminogen defi- ciency detected in these patients could be mainly related to proteolysis by DNA-bound elastase of NETs. Unlike free elastase, DNA-bound elastase is resistant to the α1-proteinase inhibitor, its main inhibitor, and is, there- fore, able to cleave plasminogen into fragments that have losttheir ability to generate plasmin. Fibrinolytic insuffi- ciency is, therefore, another therapeutic route of interest in septic DIC. In this context, sivelestat is aselective neutrophil elastase inhibitor available in Japan. Its use has been reported in patients with acute respiratory distress syn- drome and DIC, showing an improved outcome com- pared to the control group [62].
Однако при ДВС-синдроме на фоне сепсиса персистенция микротромбов, связанная с гипофибринолизом, требует альтернативного объяснения. Основной функциональный дефицит плазминогена, обнаруженный у этих пациентов, может быть в основном связан с протеолизом ДНК-связанной эластазой нейтрофильных внеклеточных ловушек. В отличие от свободной эластазы, ДНК-связанная эластаза устойчива к ингибитору α1-протеиназы, ее основному ингибитору, и поэтому способна расщеплять плазминоген на фрагменты, утратившие способность генерировать плазмин. Таким образом, фибринолитическая недостаточность является еще одним интересным терапевтическим путем при септическом ДВС-синдроме. В этом контексте может быть перспективным применение сивелестата - селективного ингибитора эластазы нейтрофилов у пациентов с острым респираторным дистресс-синдромом и ДВС-синдромом, что показало улучшение исхода по сравнению с контрольной группой [62].
Заключение
Коагулопатия является частым осложнением в интенсивной терапии, которое заслуживает особого внимания со стороны врачей, поскольку значительно ухудшает прогноз. В то время как основное заболевание обычно определяет специфическую клиническую и биологическую картину коагулопатии, клинические проявления развиваются в зависимости от времени течения заболевания и лечебных мероприятий.
References
1. Hjorleifsson E, Sigurdsson MI, Gudmundsdottir BR, Sigurdsson GH, Onundarson PT (2015) Prediction of survival in patients suspected of disseminated intravascular coagulation. Acta Anaesthesiol Scand 59:870–880. https://doi.org/10.1111/aas.12537
2. Kleinveld DJB, Hamada SR, Sandroni C (2022) Trauma-induced coagulopathy. Intensive Care Med. https://doi.org/10.1007/ s00134-022-06834-7
3. Callcut RA, Kornblith LZ, Conroy AS, Robles AJ, Meizoso JP, Namias N, Meyer DE, Haymaker A, Truitt MS, Agrawal V, Haan JM, Lightwine KL, Porter JM, San Roman JL, Biffl WL, Hayashi MS, Sise MJ, Badiee J, Recinos G, Inaba K, Schroeppel TJ, Callaghan E, Dunn JA, Godin S, McIntyre RC Jr, Peltz ED, O’Neill PJ, Diven CF, Scifres AM, Switzer EE, West MA, Storrs S, Cullinane DC, Cordova JF, Moore EE, Moore HB, Privette AR, Eriksson EA, Cohen MJ, Western Trauma Association Multicenter Study G (2019) The why and how our trauma patients die: a prospective Multicenter West- ern Trauma Association study. J Trauma Acute Care Surg 86:864–870. https://doi.org/10.1097/TA.0000000000002205
4. McLintock C (2020) Prevention and treatment of postpartum hemor- rhage: focus on hematological aspects of management. Hematol Am Soc Hematol Educ Progr 2020:542–546. https://doi.org/10.1182/hemat ology.2020000139
5. Raza I, Davenport R, Rourke C, Platton S, Manson J, Spoors C, Khan S, De’Ath HD, Allard S, Hart DP, Pasi KJ, Hunt BJ, Stanworth S, MacCallum PK, Brohi K (2013) The incidence and magnitude of fibrinolytic activa- tion in trauma patients. J Thromb Haemost 11:307–314. https://doi.org/ 10.1111/jth.12078
6. Moore HB, Moore EE, Morton AP, Gonzalez E, Fragoso M, Chapman MP, Dzieciatkowska M, Hansen KC, Banerjee A, Sauaia A, Silliman CC (2015) Shock-induced systemic hyperfibrinolysis is attenuated by plasma-first resuscitation. J Trauma Acute Care Surg 79:897–903. https://doi.org/10.1097/TA.0000000000000792
7. Gando S, Levi M, Toh CH (2016) Disseminated intravascular coagulation. Nat Rev Dis Primers 2:16037. https://doi.org/10.1038/nrdp.2016.37
8. Zhang Q, Raoof M, Chen Y, Sumi Y, Sursal T, Junger W, Brohi K, Itagaki K, Hauser CJ (2010) Circulating mitochondrial DAMPs cause inflammatory responses to injury. Nature 464:104–107. https://doi.org/10.1038/natur e08780
9. Vulliamy P, Kornblith LZ, Kutcher ME, Cohen MJ, Brohi K, Neal MD (2021) Alterations in platelet behavior after major trauma: adaptive or mala- daptive? Platelets 32:295–304. https://doi.org/10.1080/09537104.2020. 1718633
10. Kutcher ME, Redick BJ, McCreery RC, Crane IM, Greenberg MD, Cachola LM, Nelson MF, Cohen MJ (2012) Characterization of platelet dysfunc- tion after trauma. J Trauma Acute Care Surg 73:13–19. https://doi.org/ 10.1097/TA.0b013e318256deab
11. Starr NE, Matthay ZA, Fields AT, Nunez-Garcia B, Callcut RA, Cohen MJ, Kornblith LZ (2020) Identification of injury and shock driven effects on ex vivo platelet aggregometry: a cautionary tale of phenotyping. J Trauma Acute Care Surg 89:20–28. https://doi.org/10.1097/TA.0000000000002707
12. Zhang J, Zhang F, Dong JF (2018) Coagulopathy induced by traumatic brain injury: systemic manifestation of a localized injury. Blood 131:2001–2006. https://doi.org/10.1182/blood-2017-11-784108
13. Erez O (2017) Disseminated intravascular coagulation in pregnancy: clinical phenotypes and diagnostic scores. Thromb Res 151(Suppl 1):S56–S60. https://doi.org/10.1016/S0049-3848(17)30069-5
14. Kashuk JL, Moore EE, Millikan JS, Moore JB (1982) Major abdominal vascular trauma–a unified approach. J Trauma 22:672–679. https://doi. org/10.1097/00005373-198208000-00004
15. Moore HB, Tessmer MT, Moore EE, Sperry JL, Cohen MJ, Chapman MP, Pusateri AE, Guyette FX, Brown JB, Neal MD, Zuckerbraun B, Sauaia A (2020) Forgot calcium? Admission ionized-calcium in two civilian rand- omized controlled trials of prehospital plasma for traumatic hemor- rhagic shock. J Trauma Acute Care Surg 88:588–596. https://doi.org/10. 1097/TA.0000000000002614
16. Ditzel RM Jr, Anderson JL, Eisenhart WJ, Rankin CJ, DeFeo DR, Oak S, Siegler J (2020) A review of transfusion- and trauma-induced hypoc- alcemia: Is it time to change the lethal triad to the lethal diamond? J Trauma Acute Care Surg 88:434–439. https://doi.org/10.1097/TA.0000000000002570
17. Morton AP, Moore EE, Wohlauer MV, Lo K, Silliman CC, Burlew CC, Baner- jee A (2013) Revisiting early postinjury mortality: are they bleeding because they are dying or dying because they are bleeding? J Surg Res 179:5–9. https://doi.org/10.1016/j.jss.2012.05.054
18. Mitrophanov AY, Szlam F, Sniecinski RM, Levy JH, Reifman J (2020) Con- trolled multifactorial coagulopathy: effects of dilution, hypothermia, and acidosis on thrombin generation in vitro. Anesth Analg 130:1063– 1076. https://doi.org/10.1213/ANE.0000000000004479
19. Moore HB, Moore EE, Gonzalez E, Chapman MP, Chin TL, Silliman CC, Banerjee A, Sauaia A (2014) Hyperfibrinolysis, physiologic fibrinolysis, and fibrinolysis shutdown: the spectrum of postinjury fibrinolysis and relevance to antifibrinolytic therapy. J Trauma Acute Care Surg 77:811–817. https://doi.org/10.1097/TA.0000000000000341
20. Zipperle J, Altenburger K, Ponschab M, Schlimp CJ, Spittler A, Bahrami S, Redl H, Schochl H (2017) Potential role of platelet-leukocyte aggrega- tion in trauma-induced coagulopathy: ex vivo findings. J Trauma Acute Care Surg 82:921–926. https://doi.org/10.1097/TA.0000000000001410
21. Barrett CD, Moore HB, Banerjee A, Silliman CC, Moore EE, Yaffe MB (2017) Human neutrophil elastase mediates fibrinolysis shutdown through competitive degradation of plasminogen and generation of angiostatin. J Trauma Acute Care Surg 83:1053–1061. https://doi.org/10.1097/TA.0000000000001685
22. Wang TF, Makar RS, Antic D, Levy JH, Douketis JD, Connors JM, Carrier M, Zwicker JI (2020) Management of hemostatic complications in acute leukemia: guidance from the SSC of the ISTH. J Thromb Haemost 18:3174–3183. https://doi.org/10.1111/jth.15074
23. Ten Cate H, Leader A (2021) Management of disseminated intravascular coagulation in acute leukemias. Hamostaseologie 41:120–126. https:// doi.org/10.1055/a-1393-8302
24. Sanz MA, Montesinos P (2020) Advances in the management of coagulopathy in acute promyelocytic leukemia. Thromb Res 191(Suppl 1):S63–S67. https://doi.org/10.1016/S0049-3848(20)30399-6
25. Mitrovic M, Suvajdzic N, Elezovic I, Bogdanovic A, Djordjevic V, Miljic P, Djunic I, Gvozdenov M, Colovic N, Virijevic M, Lekovic D, Vidovic A, Tomin D (2015) Thrombotic events in acute promyelocytic leukemia.
Thromb Res 135:588–593. https://doi.org/10.1016/j.thromres.2014.11. 026
26. Stein E, McMahon B, Kwaan H, Altman JK, Frankfurt O, Tallman MS (2009) The coagulopathy of acute promyelocytic leukaemia revisited. Best Pract Res Clin Haematol 22:153–163. https://doi.org/10.1016/j. beha.2008.12.007
27. Bennett B, Booth NA, Croll A, Dawson AA (1989) The bleeding disorder in acute promyelocytic leukaemia: fibrinolysis due to u-PA rather than defibrination. Br J Haematol 71:511–517. https://doi.org/10.1111/j.1365- 2141.1989.tb06311.x
28. Graf M, Reif S, Hecht K, Pelka-Fleischer R, Pfister K, Schmetzer H (2005) High expression of urokinase plasminogen activator receptor (UPA-R) in acute myeloid leukemia (AML) is associated with worse prognosis. Am J Hematol 79:26–35. https://doi.org/10.1002/ajh.20337
29. Wang P, Zhang Y, Yang H, Hou W, Jin B, Hou J, Li H, Zhao H, Zhou J (2018) Characteristics of fibrinolytic disorders in acute promyelocytic leukemia. Hematology 23:756–764. https://doi.org/10.1080/10245332. 2018.1470069
30. Kwaan HC, Weiss I, Tallman MS (2019) The role of abnormal hemostasis and fibrinolysis in morbidity and mortality of acute promyelocytic leu- kemia. Semin Thromb Hemost 45:612–621. https://doi.org/10.1055/s- 0039-1693478
31. Bonlokke ST, Ommen HB, Hvas AM (2021) Altered fibrinolysis in hema- tological malignances. Semin Thromb Hemost 47:569–580. https://doi. org/10.1055/s-0041-1725099
32. Boisrame-Helms J, Kremer H, Schini-Kerth V, Meziani F (2013) Endothe- lial dysfunction in sepsis. Curr Vasc Pharmacol 11:150–160
33. Fourrier F (2012) Severe sepsis, coagulation, and fibrinolysis: dead end or one way? Crit Care Med 40:2704–2708. https://doi.org/10.1097/CCM. 0b013e318258ff30
34. Lane DA, Philippou H, Huntington JA (2005) Directing thrombin. Blood 106:2605–2612. https://doi.org/10.1182/blood-2005-04-1710
35. van der Poll T, Herwald H (2014) The coagulation system and its func- tion in early immune defense. Thromb Haemost. https://doi.org/10. 1160/TH14-01-0053
36. Delabranche X, Helms J, Meziani F (2017) Immunohaemostasis: a new view on haemostasis during sepsis. Ann Intensive Care 7:117. https:// doi.org/10.1186/s13613-017-0339-5
37. Levi M (2010) The coagulant response in sepsis and inflammation. Hamostaseologie 30:10–16
38. Pfeiler S, Massberg S, Engelmann B (2014) Biological basis and patho- logical relevance of microvascular thrombosis. Thromb Res 133(Suppl 1):S35-37. https://doi.org/10.1016/j.thromres.2014.03.016
39. Gould TJ, Lysov Z, Liaw PC (2015) Extracellular DNA and histones: double-edged swords in immunothrombosis. J Thromb Haemost 13(Suppl 1):S82-91. https://doi.org/10.1111/jth.12977
40. Yang H, Biermann MH, Brauner JM, Liu Y, Zhao Y, Herrmann M (2016) New insights into neutrophil extracellular traps: mechanisms of forma- tion and role in inflammation. Front Immunol 7:302. https://doi.org/10. 3389/fimmu.2016.00302
41. Stiel L, Meziani F, Helms J (2018) Neutrophil activation during septic shock. Shock 49:371–384. https://doi.org/10.1097/SHK.0000000000 000980
42. Brinkmann V, Reichard U, Goosmann C, Fauler B, Uhlemann Y, Weiss DS, Weinrauch Y, Zychlinsky A (2004) Neutrophil extracellular traps kill bac- teria. Science 303:1532–1535. https://doi.org/10.1126/science.1092385
43. Yipp BG, Kubes P (2013) NETosis: how vital is it? Blood 122:2784–2794. https://doi.org/10.1182/blood-2013-04-457671
44. Meziani F, Delabranche X, Asfar P, Toti F (2010) Bench-to-bedside review: circulating microparticles–a new player in sepsis? Crit Care 14:236. https://doi.org/10.1186/cc9231
45. Mortaza S, Martinez MC, Baron-Menguy C, Burban M, de la Bourdon- naye M, Fizanne L, Pierrot M, Cales P, Henrion D, Andriantsitohaina R, Mercat A, Asfar P, Meziani F (2009) Detrimental hemodynamic and inflammatory effects of microparticles originating from septic rats. Crit Care Med37:2045–2050. https://doi.org/10.1097/CCM.0b013e3181 a00629
46. Lacroix R, Plawinski L, Robert S, Doeuvre L, Sabatier F, Martinez de Lizarrondo S, Mezzapesa A, Anfosso F, Leroyer AS, Poullin P, Jourde N, Njock MS, Boulanger CM, Angles-Cano E, Dignat-George F (2012)
Leukocyte- and endothelial-derived microparticles: a circulating source for fibrinolysis. Haematologica 97:1864–1872. https://doi.org/10.3324/ haematol.2012.066167
47. Engelmann B, Massberg S (2013) Thrombosis as an intravascular effec- tor of innate immunity. Nat Rev Immunol 13:34–45. https://doi.org/10. 1038/nri3345
48. Massberg S, Grahl L, von Bruehl ML, Manukyan D, Pfeiler S, Goosmann C, Brinkmann V, Lorenz M, Bidzhekov K, Khandagale AB, Konrad I, Ken- nerknecht E, Reges K, Holdenrieder S, Braun S, Reinhardt C, Spannagl M, Preissner KT, Engelmann B (2010) Reciprocal coupling of coagula- tion and innate immunity via neutrophil serine proteases. Nat Med 16:887–896. https://doi.org/10.1038/nm.2184
49. Levi M (2019) Disseminated intravascular coagulation in cancer: an update. Semin Thromb Hemost 45:342–347. https://doi.org/10.1055/s- 0039-1687890
50. Leiva O, Newcomb R, Connors JM, Al-Samkari H (2020) Cancer and thrombosis: new insights to an old problem. J Med Vasc 45:6S8-6S16. https://doi.org/10.1016/S2542-4513(20)30514-9
51. Levi M, Sivapalaratnam S (2020) An overview of thrombotic complica- tions of old and new anticancer drugs. Thromb Res 191(Suppl 1):S17– S21. https://doi.org/10.1016/S0049-3848(20)30391-1
52. Rickles FR, Brenner B (2008) Tissue factor and cancer. Semin Thromb Hemost 34:143–145. https://doi.org/10.1055/s-2008-1079253
53. Falanga A, Marchetti M, Vignoli A (2013) Coagulation and cancer: biological and clinical aspects. J Thromb Haemost 11:223–233. https:// doi.org/10.1111/jth.12075
54. Kwaan HC, McMahon B (2009) The role of plasminogen-plasmin system in cancer. Cancer Treat Res 148:43–66. https://doi.org/10.1007/ 978-0-387-79962-9_4
55. Sallah S, Wan JY, Nguyen NP, Hanrahan LR, Sigounas G (2001) Dissemi- nated intravascular coagulation in solid tumors: clinical and pathologic study. Thromb Haemost 86:828–833
56. Weng J, Chen M, Fang D, Liu D, Guo R, Yang S (2021) Therapeutic Plasma exchange protects patients with sepsis-associated dissemi- nated intravascular coagulation by improving endothelial function. Clin Appl Thromb Hemost 27:10760296211053312. https://doi.org/10.1177/10760296211053313
57. El-Nawawy AA, Elshinawy MI, Khater DM, Moustafa AA, Hassanein NM, Wali YA, Nazir HF (2021) Outcome of early hemostatic intervention in children with sepsis and nonovert disseminated intravascular coagula- tion admitted to PICU: a randomized controlled trial. Pediatr Crit Care Med 22:e168–e177. https://doi.org/10.1097/PCC.0000000000002578
58. Stahl K, Schmidt JJ, Seeliger B, Schmidt BMW, Welte T, Haller H, Hoeper MM, Budde U, Bode C, David S (2020) Effect of therapeutic plasma exchange on endothelial activation and coagulation-related parameters in septic shock. Crit Care 24:71. https://doi.org/10.1186/ s13054-020-2799-5
59. Vincent JL, Francois B, Zabolotskikh I, Daga MK, Lascarrou JB, Kirov MY, Pettila V, Wittebole X, Meziani F, Mercier E, Lobo SM, Barie PS, Crowther M, Esmon CT, Fareed J, Gando S, Gorelick KJ, Levi M, Mira JP, Opal SM, Parrillo J, Russell JA, Saito H, Tsuruta K, Sakai T, Fineberg D, Group ST (2019) Effect of a recombinant human soluble thrombomodulin on mortality in patients with sepsis-associated coagulopathy: the SCARLET randomized clinical trial. JAMA 321:1993–2002. https://doi.org/10.1001/ jama.2019.5358
60. Levi M, Vincent JL, Tanaka K, Radford AH, Kayanoki T, Fineberg DA, Hop- pensteadt D, Fareed J (2020) Effect of a recombinant human soluble thrombomodulin on baseline coagulation biomarker levels and mortal- ity outcome in patients with sepsis-associated coagulopathy. Crit Care Med 48:1140–1147. https://doi.org/10.1097/CCM.0000000000004426
61. François B, Fiancette M, Helms J, Mercier E, Lascarrou JB, Kayanoki T, Tanaka K, Fineberg D, Vincent JL, Wittebole X (2021) Efficacy and safety of human soluble thrombomodulin (ART-123) for treatment of patients in France with sepsis-associated coagulopathy: post hoc analysis of SCARLET. Ann Intensive Care 11:53. https://doi.org/10.1186/ s13613-021-00842-4
62. Hayakawa M, Katabami K, Wada T, Sugano M, Hoshino H, Sawamura A, Gando S (2010) Sivelestat (selective neutrophil elastase inhibitor) improves the mortality rate of sepsis associated with both acute res-
piratory distress syndrome and disseminated intravascular coagulation patients. Shock 33:14–18. https://doi.org/10.1097/SHK.0b013e3181 aa95c4
63. Hazelton JP, Ssentongo AE, Oh JS, Ssentongo P, Seamon MJ, Byrne JP, Armento IG, Jenkins DH, Braverman MA, Mentzer C, Leonard GC, Perea LL, Docherty CK, Dunn JA, Smoot B, Martin MJ, Badiee J, Luis AJ, Murray JL, Noorbakhsh MR, Babowice JE, Mains C, Madayag RM, Kaafarani HMA, Mokhtari AK, Moore SA, Madden K, Tanner A 2nd, Redmond D, Millia
DJ, Brandolino A, Nguyen U, Chinchilli V, Armen SB, Porter JM (2022) Use of cold-stored whole blood is associated with improved mortality in hemostatic resuscitation of major bleeding: a multicenter study. Ann Surg 276:579–588. https://doi.org/10.1097/SLA.0000000000005603
64. Crombie N, Doughty HA, Bishop JRB, Desai A, Dixon EF, Hancox JM, Herbert MJ, Leech C, Lewis SJ, Nash MR, Naumann DN, Slinn G, Smith H, Smith IM, Wale RK, Wilson A, Ives N, Perkins GD, Pcg Re (2022) Resuscita- tion with blood products in patients with trauma-related haemorrhagic shock receiving prehospital care (RePHILL): a multicentre, open-label, randomised, controlled, phase 3 trial. Lancet Haematol 9:e250–e261. https://doi.org/10.1016/S2352-3026(22)00040-0
65. Moore HB, Moore EE, Chapman MP, McVaney K, Bryskiewicz G, Blechar R, Chin T, Burlew CC, Pieracci F, West FB, Fleming CD, Ghasabyan
A, Chandler J, Silliman CC, Banerjee A, Sauaia A (2018) Plasma-first resuscitation to treat haemorrhagic shock during emergency ground transportation in an urban area: a randomised trial. Lancet 392:283–291. https://doi.org/10.1016/S0140-6736(18)31553-8
66. Sperry JL, Guyette FX, Brown JB, Yazer MH, Triulzi DJ, Early-Young BJ, Adams PW, Daley BJ, Miller RS, Harbrecht BG, Claridge JA, Phelan HA, Witham WR, Putnam AT, Duane TM, Alarcon LH, Callaway CW, Zuck- erbraun BS, Neal MD, Rosengart MR, Forsythe RM, Billiar TR, Yealy DM, Peitzman AB, Zenati MS, Group PAS (2018) Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med 379:315–326. https://doi.org/10.1056/NEJMoa1802345
67. Holcomb JB, Tilley BC, Baraniuk S, Fox EE, Wade CE, Podbielski JM, del Junco DJ, Brasel KJ, Bulger EM, Callcut RA, Cohen MJ, Cotton BA, Fabian TC, Inaba K, Kerby JD, Muskat P, O’Keeffe T, Rizoli S, Robinson BR, Scalea TM, Schreiber MA, Stein DM, Weinberg JA, Callum JL, Hess JR, Matijevic N, Miller CN, Pittet JF, Hoyt DB, Pearson GD, Leroux B, van Belle G, Group PS (2015) Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: the PROPPR randomized clinical trial. JAMA 313:471–482. https://doi.org/ 10.1001/jama.2015.12
68. Collaborators WT (2017) Effect of early tranexamic acid administration on mortality, hysterectomy, and other morbidities in women with post-partum haemorrhage (WOMAN): an international, randomised, double-blind, placebo-controlled trial. Lancet 389:2105–2116. https://doi.org/10.1016/S0140-6736(17)30638-4
69. Collaborators C-T, Shakur H, Roberts I, Bautista R, Caballero J, Coats T, Dewan Y, El-Sayed H, Gogichaishvili T, Gupta S, Herrera J, Hunt B, Irib- hogbe P, Izurieta M, Khamis H, Komolafe E, Marrero MA, Mejia-Mantilla J, Miranda J, Morales C, Olaomi O, Olldashi F, Perel P, Peto R, Ramana PV, Ravi RR, Yutthakasemsunt S (2010) Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-con- trolled trial. Lancet 376:23–32. https://doi.org/10.1016/S0140-6736(10)60835-5
70. Estcourt LJ, McQuilten Z, Powter G, Dyer C, Curnow E, Wood EM, Stanworth SJ, Collaboration TT (2019) The TREATT Trial (TRial to EvaluAte Tranexamic acid therapy in Thrombocytopenia): safety and efficacy of tranexamic acid in patients with haematological malignan- cies with severe thrombocytopenia: study protocol for a double-blind randomised controlled trial. Trials 20:592. https://doi.org/10.1186/ s13063-019-3663-2
71. Saito H, Maruyama I, Shimazaki S, Yamamoto Y, Aikawa N, Ohno R, Hirayama A, Matsuda T, Asakura H, Nakashima M, Aoki N (2007) Efficacy and safety of recombinant human soluble thrombomodulin (ART-123) in disseminated intravascular coagulation: results of a phase III, rand- omized, double-blind clinical trial. J Thromb Haemost 5:31–41. https:// doi.org/10.1111/j.1538-7836.2006.02267.x
72. Taniguchi K, Ohbe H, Yamakawa K, Matsui H, Fushimi K, Yasunaga H (2021) Recombinant thrombomodulin in disseminated intravascular coagulation associated with stage IV solid tumors: a nationwide obser- vational study in Japan. Thromb Haemost 121:36–45. https://doi.org/10. 1055/s-0040-1715840
73. Taniguchi K, Ohbe H, Yamakawa K, Matsui H, Fushimi K, Yasunaga H (2020) Antithrombin use and mortality in patients with stage IV solid tumor-associated disseminated intravascular coagulation: a nationwide observational study in Japan. BMC Cancer 20:867. https://doi.org/10.1186/s12885-020-07375-2
74. Bianchini EP, Razanakolona M, Helms J, Zouiti F, Couteau-Chardon A, Marin-Esteban V, Chaisemartin L, De-Carvalho A, Bironien R, Chollet- Martin S, Denis CV, Diehl JL, Vasse M, Meziani F, Borgel D (2021) The proteolytic inactivation of protein z-dependent protease inhibitor by neutrophil elastase might promote the procoagulant activity of neutro- phil extracellular traps in sepsis. Thromb Haemost. https://doi.org/10. 1055/a-1530-3980
75. Clere-Jehl R, Merdji H, Kassem M, Macquin C, De Cauwer A, Sibony A, Kurihara K, Minniti L, Abou Fayçal C, Bahram S, Meziani F, Helms J, Georgel P (2021) A translational investigation of IFN-α and STAT1
signaling in endothelial cells during septic shock provides therapeutic perspectives. Am J Respir Cell Mol Biol 65:167–175. https://doi.org/10. 1165/rcmb.2020-0401OC
76. Stiel L, Mayeur-Rousse C, Helms J, Meziani F, Mauvieux L (2019) First visualization of circulating neutrophil extracellular traps using cell fluorescence during human septic shock-induced disseminated intravascular coagulation. Thromb Res 183:153–158. https://doi.org/10.1016/j.thromres.2019.09.036
77. Barbosa da Cruz D, Helms J, Aquino LR, Stiel L, Cougourdan L, Broussard C, Chafey P, Riès-Kautt M, Meziani F, Toti F, Gaussem P, Anglés-Cano E (2019) DNA-bound elastase of neutrophil extracellular traps degrades plasminogen, reduces plasmin formation, and decreases fibrinolysis: proof of concept in septic shock plasma. FASEB J 33:14270–14280. https://doi.org/10.1096/fj.201901363RRR
78. Helms J, Clere-Jehl R, Bianchini E, Le Borgne P, Burban M, Zobairi F, Diehl JL, Grunebaum L, Toti F, Meziani F, Borgel D (2017) Thrombomodulin favors leukocyte microvesicle fibrinolytic activity, reduces NETosis and prevents septic shock-induced coagulopathy in rats. Ann Intensive Care 7:118. https://doi.org/10.1186/s13613-017-0340-z
79. Delabranche X, Stiel L, Severac F, Galoisy AC, Mauvieux L, Zobairi F, Lavigne T, Toti F, Angles-Cano E, Meziani F, Boisrame-Helms J (2017) Evidence of netosis in septic shock-induced disseminated intravascular coagulation. Shock 47:313–317. https://doi.org/10.1097/SHK.0000000000000719
80. Stiel L, Delabranche X, Galoisy AC, Severac F, Toti F, Mauvieux L, Meziani F, Boisrame-Helms J (2016) Neutrophil fluorescence: a new indicator of cell activation during septic shock-induced disseminated intravascular coagulation. Crit Care Med 44:e1132–e1136. https://doi.org/10.1097/CCM.0000000000001851
81. Vlaar APJ (2022) Blood transfusion: the search for the sweet spot. Inten- sive Care Med. https://doi.org/10.1007/s00134-022-06799-7
82. Vlaar APJ, Dionne JC, de Bruin S, Wijnberge M, Raasveld SJ, van Baarle F, Antonelli M, Aubron C, Duranteau J, Juffermans NP, Meier J, Murphy GJ, Abbasciano R, Muller MCA, Lance M, Nielsen ND, Schochl H, Hunt BJ, Cecconi M, Oczkowski S (2021) Transfusion strategies in bleeding criti- cally ill adults: a clinical practice guideline from the European Society of Intensive Care Medicine. Intensive Care Med 47:1368–1392. https://doi. org/10.1007/s00134-021-06531-x
83. Levy JH (2010) Antifibrinolytic therapy: new data and new concepts. Lancet 376:3–4. https://doi.org/10.1016/S0140-6736(10)60939-7
84. Baksaas-Aasen K, Gall LS, Stensballe J, Juffermans NP, Curry N, Maegele M, Brooks A, Rourke C, Gillespie S, Murphy J, Maroni R, Vulliamy P, Hen- riksen HH, Pedersen KH, Kolstadbraaten KM, Wirtz MR, Kleinveld DJB, Schafer N, Chinna S, Davenport RA, Naess PA, Goslings JC, Eaglestone S, Stanworth S, Johansson PI, Gaarder C, Brohi K (2021) Viscoelastic hae- mostatic assay augmented protocols for major trauma haemorrhage (ITACTIC): a randomized, controlled trial. Intensive Care Med 47:49–59. https://doi.org/10.1007/s00134-020-06266-1
85. Li X, Ma X (2017) The role of heparin in sepsis: much more than just an anticoagulant. Br J Haematol 179:389–398. https://doi.org/10.1111/bjh. 14885
86. Helms J, Middeldorp S, Spyropoulos AC (2022) Thromboprophy- laxis in critical care. Intensive Care Med. https://doi.org/10.1007/ s00134-022-06850-7
87. Duranteau J, Taccone FS, Verhamme P, Ageno W, Force EVGT (2018) European guidelines on perioperative venous thromboembolism prophylaxis: intensive care. Eur J Anaesthesiol 35:142–146. https://doi. org/10.1097/EJA.0000000000000707
88. Schunemann HJ, Cushman M, Burnett AE, Kahn SR, Beyer-Westendorf J, Spencer FA, Rezende SM, Zakai NA, Bauer KA, Dentali F, Lansing J, Balduzzi S, Darzi A, Morgano GP, Neumann I, Nieuwlaat R, Yepes-Nunez JJ, Zhang Y, Wiercioch W (2018) American Society of Hematology 2018 guidelines for management of venous thromboembolism: prophylaxis for hospitalized and nonhospitalized medical patients. Blood Adv 2:3198–3225.https://doi.org/10.1182/bloodadvances.2018022954
89. Wang C, Chi C, Guo L, Wang X, Guo L, Sun J, Sun B, Liu S, Chang X, Li E (2014) Heparin therapy reduces 28-day mortality in adult severe
sepsis patients: a systematic review and meta-analysis. Crit Care 18:563. https://doi.org/10.1186/s13054-014-0563-4
90. Sakuragawa N, Hasegawa H, Maki M, Nakagawa M, Nakashima M (1993) Clinical evaluation of low-molecular-weight heparin (FR-860) on dis- seminated intravascular coagulation (DIC)–a multicenter co-operative double-blind trial in comparison with heparin. Thromb Res 72:475–500. https://doi.org/10.1016/0049-3848(93)90109-2
91. Fourrier F, Jourdain M, Tournois A, Caron C, Goudemand J, Chopin C (1995) Coagulation inhibitor substitution during sepsis. Intensive Care Med 21(2):S264-268
92. Giebler R, Schmidt U, Koch S, Peters J, Scherer R (1999) Combined antithrombin III and C1-esterase inhibitor treatment decreases intravas- cular fibrin deposition and attenuates cardiorespiratory impairment in rabbits exposed to Escherichia coli endotoxin. Crit Care Med 27:597–604
93. Allingstrup M, Wetterslev J, Ravn FB, Moller AM, Afshari A (2016) Antithrombin III for critically ill patients: a systematic review with meta- analysis and trial sequential analysis. Intensive Care Med 42:505–520. https://doi.org/10.1007/s00134-016-4225-7
94. Warren BL, Eid A, Singer P, Pillay SS, Carl P, Novak I, Chalupa P, Atherstone A, Penzes I, Kubler A, Knaub S, Keinecke HO, Heinrichs H, Schindel F, Juers M, Bone RC, Opal SM, KyberSept Trial Study G (2001) Caring for the critically ill patient. High-dose antithrombin III in severe sepsis: a randomized controlled trial. JAMA 286:1869–1878
95. Dhainaut JF, Laterre PF, Janes JM, Bernard GR, Artigas A, Bakker J, Riess H, Basson BR, Charpentier J, Utterback BG, Vincent JL, Recombinant Human Activated Protein CWEISSG (2003) Drotrecogin alfa (activated) in the treatment of severe sepsis patients with multiple-organ dysfunc- tion: data from the PROWESS trial. Intensive Care Med 29:894–903. https://doi.org/10.1007/s00134-003-1731-1
96. Levi M (2015) Recombinant soluble thrombomodulin: coagulation takes another chance to reduce sepsis mortality. J Thromb Haemost 13:505–507. https://doi.org/10.1111/jth.12868
97. Levi M, van der Poll T (2013) Endothelial injury in sepsis. Intensive Care Med 39:1839–1842. https://doi.org/10.1007/s00134-013-3054-1
98. Weiler H, Isermann BH (2003) Thrombomodulin. J Thromb Haemost 1:1515–1524. https://doi.org/10.1046/j.1538-7836.2003.00306.x
99. Ito T, Maruyama I (2011) Thrombomodulin: protectorate God of the vas- culature in thrombosis and inflammation. J Thromb Haemost 9(Suppl 1):168–173. https://doi.org/10.1111/j.1538-7836.2011.04319.x
100. Li YH, Kuo CH, Shi GY, Wu HL (2012) The role of thrombomodulin lectin- like domain in inflammation. J Biomed Sci 19:34. https://doi.org/10. 1186/1423-0127-19-34
101. Umemura Y, Yamakawa K (2016) Efficacy and safety of anticoagulant therapy in three specific populations with sepsis: a meta-analysis of randomized controlled trials: reply. J Thromb Haemost. https://doi.org/ 10.1111/jth.13473
102. Hsu C, Hutt E, Bloomfield DM, Gailani D, Weitz JI (2021) Factor XI inhibi- tion to uncouple thrombosis from hemostasis: JACC review topic of the week. J Am Coll Cardiol 78:625–631. https://doi.org/10.1016/j.jacc.2021. 06.010
103. Preis M, Hirsch J, Kotler A, Zoabi A, Stein N, Rennert G, Saliba W (2017) Factor XI deficiency is associated with lower risk for cardiovascular and venous thromboembolism events. Blood 129:1210–1215. https://doi. org/10.1182/blood-2016-09-742262
104. Gailani D, Gruber A (2016) Factor XI as a therapeutic target. Arterioscler Thromb Vasc Biol 36:1316–1322. https://doi.org/10.1161/ATVBAHA.116. 306925
105. Li T, Liu J, Wu W (2022) Factor XI, a potential target for anticoagulation therapy for venous thromboembolism. Front Cardiovasc Med 9:975767. https://doi.org/10.3389/fcvm.2022.975767
106. Fredenburgh JC, Weitz JI (2021) Factor XI as a target for new anti-coagulants.Hamostaseologie 41:104–110. https://doi.org/10. 1055/a-1384-3715
Источник фотоиллюстрации - www.freepik.com
[~DETAIL_TEXT] => Julie Helms, Toshiaki Iba, Jean Marie Connors, Satoshi Gando, Marcel Levi, Ferhat Mezianiand Jerrold H. Levy
How to manage coagulopathies in critically ill patients
Intensive Care Med 2023 .doi.org/10.1007/s00134-023-06980-6
Абстракт
Коагулопатия является тяжелым и частым осложнением у пациентов в критическом состоянии, патогенез и проявления которой могут варьировать в зависимости от основного заболевания. На основании доминирующего клинического фенотипа в настоящем обзоре различают геморрагические коагулопатии, характеризующиеся состоянием гипокоагуляции и гиперфибринолиза, и тромботические коагулопатии с системным протромботическим и антифибринолитическим фенотипом. Обсуждаются различия в патогенезе и лечении распространенных коагулопатий.
Ключевые слова: диссеминированное внутрисосудистое свертывание крови, коагулопатия, сепсис, травма, гематологические заболевания, реаниматология.
Введение
Нарушения свертывания крови — тяжелое, частое осложнение у больных в критическом состоянии, приводящее к синдрому полиорганной дисфункции (СПОН) и ассоциированное с ухудшением прогноза [1]. Таким образом, «коагулопатия» является общим термином, который можно определить как любое изменение или нарушение гемостаза по множеству причин, приводящее либо к кровотечению, либо к образованию тромбов, либо к тому и другому. Примеры включают сепсис-индуцированную коагулопатию (SIC) и травма-индуцированную коагулопатию (TIC). Однако, если они достаточно тяжелые, эти коагулопатии перерастают в диссеминированное внутрисосудистое свертывание крови (ДВС-синдром), что приводит к ПОН (Fig. 1).

Патогенез, проявления и лечение различных коагулопатий частично зависят от основного заболевания (Fig. 2). При ДВС-синдроме и всех коагулопатиях лечение основного заболевания, вызвавшего коагулопатию, имеет решающее значение. Однако каждая коагулопатия имеет доминирующий клинический фенотип, но у пациента могут проявляться тромботические и/или геморрагические признаки в зависимости от прогрессирования заболевания, терапевтических вмешательств и времени. Основываясь на доминирующем клиническом фенотипе, в этом обзоре мы будем различать геморрагические коагулопатии, характеризующиеся гипокоагуляционными и/или гиперфибринолитическими состояниями, и тромботические коагулопатии с системным протромботическим и антифибринолитическим фенотипом, а также рассмотрим различия в патогенезе и лечении.

Геморрагические коагулопатии
Не обусловленные злокачественными опухолями геморрагические коагулопатии
После травма-индуцированной и перинатальной коагулопатии начальное гипокоагуляционное состояние приводит к кровотечению в месте (-ах) повреждения, хотя массивная активация гемостаза происходит в сразу после травмы (Fig. 3) [2-4]. Эта начальная стадия геморрагического шока связана с гиперфибринолитическим состоянием вследствие высвобождения эндотелием тканевого активатора плазминогена (tPA), превращающего плазминоген в плазмин [5–7]. После обширного повреждения тканей и эндотелия высвобождаются ассоциированные с повреждением молекулярные паттерны (DAMP) и провоспалительные цитокины, усиливая образование тромбина, образование сгустков и эндотелиопатию [8].

Тромбоциты прилипают к поврежденному эндотелию, обеспечивая прокоагулянтную поверхность для активации коагуляции и усиления образования тромбина на активированных тромбоцитах во время фазы распространения. Активированные лейкоциты и тромбоциты образуют тромбоцитарно-лейкоцитарные агрегаты, а активированные нейтрофилы и макрофаги высвобождают внеклеточные ловушки, способствуя агрегации тромбоцитов и образованию тромбина (Fig. 3). Кровотечение с продолжающимся образованием тромбина приводит к расходованию факторов свертывания крови. Кроме того, истощение тромбоцитов изменяет их агрегацию [9–11].
Повреждение тканей и/или органов также может изменить гемостатический баланс. Например, поврежденная мозговая ткань высвобождает большое количество прокоагулянтных фосфолипидов и микровезикул (МВ) [12], в то время как при повреждении поджелудочной железы, легких и урогенитальных органов может высвобождаться tPA для активации фибринолиза. Во время беременности синцитиотрофобласт приобретает свойства эндотелиальных клеток с гемостатическими функциями, включая высокую экспрессию тканевого фактора (ТФ), протеина С, протеина S, протеина Z и ингибиторов пути тканевого фактора (TFPI-2). Кроме того, плацента также может высвобождать ингибиторы активатора плазминогена PAI-1 и PAI-2 во время нормальной беременности для предотвращения фибринолиза. Разрушение синцитиотрофобласта приводит к прокоагулянтным эффектам за счет массивного высвобождения тканевого фактора, активации воспаления и гиперфибринолиза [13].
Эта геморрагическая коагулопатия может дополнительно усугубляться неконтролируемым кровотечением, гемодилюцией из-за увеличения перфузии для поддержания артериального давления, «летальной триадой» (коагулопатия, гипотермия и метаболический ацидоз) из-за шока и СПОН, а также гипокальциемии, вторичной по отношению к потреблению и инактивации цитратными препаратами крови [14–17]. Все это может объяснить снижение активности ферментов свертывания, изменение функции тромбоцитов, задержку образования тромбина, гипофибриногенемию, изменение полимеризации фибрина и изменение прочности сгустка [16, 18].
По мере развития геморрагического шока фенотип кровотечения прогрессирует до тромботического, особенно после лечения препаратами крови и/или концентратами факторов [19]. Этому тромботическому фенотипу способствует измененная иммунорегуляторная функция тромбоцитов [20]. Кроме того, начальный гиперфибринолиз подавляется через несколько часов после первоначального повреждения ткани, термин, описываемый как «фибринолитическое отключение» из-за обширного высвобождения ингибиторов, клеточных побочных продуктов повреждения и нейтрофильной эластазы из нейтрофильных внеклеточных ловушек (NETs), которые снижают доступность плазминогена [21]. Наконец, при травма-индуцированной коагулопатии повреждение головного мозга может способствовать протромботическим расстройствам за счет массивного воздействия тканевого фактора, высвобождения церебрального эндотелиального фактора фон Виллебранда (vWF) и нарушения клиренса с помощью ADAMTS13.
Злокачественные геморрагические коагулопатии
У больных лейкозами, злокачественными гематологическими заболеваниями и некоторыми формами солидных опухолей (например, аденокарцинома предстательной железы или рак поджелудочной железы) у 15–20% развивается ДВС-синдром с преобладанием геморрагических проявлений над тромботическими. Кровотечения являются ведущей причиной ранней смерти и клиническим признаком острого промиелоцитарного лейкоза (APL; AML-M3 по франко-американо-британской классификации), при этом у 70–80% пациентов развивается ДВС-синдром при постановке диагноза или во время начала терапии [22, 23]. Это опасное для жизни кровотечение, проявляющееся ДВС-синдромом, также происходит при моноцитарном лейкозе или при запущенной аденокарциноме. Более того, терапевтические агенты, включая химиотерапию, трансплантацию гемопоэтических стволовых клеток, терапию Т-клетками с химерным антигенным рецептором (CAR), осложненную синдромом высвобождения цитокинов, могут вызывать эндотелиит. Кроме того, у пациентов могут развиться вторичные инфекции, которые могут играть важную роль в развитии ДВС-синдрома [24].
При этих онкологических состояниях могут сосуществовать как прокоагулянтные, так и гиперфибринолитические признаки. Опухолевые клетки экспрессируют тканевой фактор, ответственный за активацию коагуляции, прокоагулянтные белки, а также воспалительные цитокины, такие как интерлейкин-1β и фактор некроза опухоли α, которые подавляют эндотелиальный тромбомодулин и активируют антикоагулянтный путь протеина С [25, 26]. Однако эти прокоагулянтные механизмы в значительной степени подавлены гиперфибринолизом из-за повышенного высвобождения тканевого активатора плазминогена (tPA) [26-30]. Гиперфибринолиз часто встречается при остром промиелоцитарном лейкозе или ДВС-синдроме, в то время как гипофибринолиз проявляется при миелопролиферативных заболеваниях, что согласуется с повышенным риском тромбоза, а также у пациентов с острым лимфобластным лейкозом, получающим лечение L-аспарагиназой [31]. В последнем случае повышенный риск тромбоза обусловлен приобретенным дефицитом антитромбина.
Тромботические коагулопатии
Сепсис-индуцированная коагулопатия
Системное воспаление, характеризующее инвазию патогенов в хозяина при сепсисе, ответственно за активацию системной коагуляции с внутрисосудистыми прокоагулянтными фенотипическими изменениями, приводящими к сепсис-индуцированной коагулопатии (SIC) (Fig. 7) [32, 33]. Провоспалительные цитокины индуцируют эндотелиальную и моноцитарную экспрессию, которая запускает коагуляцию, что приводит к избыточной генерации тромбина, превращающего фибриноген в нерастворимую фибриновую сеть [34]. Кроме того, прямая активация контактной фазы и ингибирование реактивного фибринолиза бактериальными полифосфатами могут усиливать эту реакцию и приводить к избыточной продукции тромбина и/или нарушенной деградации фибрина [35]. Фибринолиз может дополнительно ухудшаться за счет увеличения продукции/активации ингибиторов (PAI-1, тромбин-активируемый ингибитор фибринолиза — TAFI) и снижения tPA [36]. Естественные антикоагулянты (протеин С, протеин S, тромбомодулин и антитромбин) и ингибитор пути тканевого фактора, ограничивающие активацию свертывания, либо истощены, либо менее активны [36].
При сепсисе взаимодействие иммунных клеток с активацией коагуляции было описано как «иммунотромбоз» [37] и относится к врожденному внутрисосудистому иммунному ответу, вызывающему образование тромбина и микротромбов. Первоначально иммунотромбоз был описан как полезный механизм защиты хозяина от патогенов, позволяющий их распознавать, сдерживать и уничтожать [38]. Однако при сепсисе и септическом шоке нарушение регуляции иммунотромбоза может привести к чрезмерной активации коагуляции, что в конечном итоге приводит к ДВС-синдрому и способствует серьезному повреждению тканей [37-41].
Активированные нейтрофилы выделяют как прокоагулянтные микровезикулы (MV), так и нейтрофильные внеклеточные ловушки (NET). NET представляют собой волокна деконденсированной ДНК, несущие цитруллинированные гистоны и протеолитические ферменты, такие как миелопероксидаза и нейтрофильная эластаза [42, 43]. Микровезикулы представляют собой субмикронные везикулы плазматической мембраны, высвобождаемые тромбоцитами и активированными моноцитами и нейтрофилами. Микровезикулы могут запускать активацию эндотелия и лейкоцитов, индуцировать экспрессию тканевого фактора и способствовать воспалительным сигнальным путям в стенках сосудов и тканях сердца [44]. Кроме того, воздействие фосфатидилсерина на ВК индуцирует сборку факторов свертывания крови. Интересно, что эндотелиальные и лейкоцитарные МВ проявляют профибринолитическую функцию, тем самым дополняя их прокоагулянтную активность [45]. Кроме того, ко-локализация микровезикул на нейтрофильных внеклеточных ловушках представляет собой поверхность, способствующую свертыванию крови, что способствует потенциальной прокоагулянтной активности нейтрофильных внеклеточных ловушек посредством активации контактной фазы (фактор XII). Кроме того, образование тромбина может индуцироваться гистонами тромбоцит-зависимым образом и нейтрофильной эластазой посредством протеолиза ингибитора пути тканевого фактора (TFPI) [46-48].
Коагулопатия, связанная с солидным раком
В нескольких когортных исследованиях сообщалось о высоком риске тромботических осложнений у больных раком со средней распространенностью 15% при аденокарциномах высокого риска и относительным риском от 4 до 7 по сравнению с пациентами без рака [49]. Этот повышенный тромботический риск обусловлен злокачественностью, в зависимости от типа опухоли и стадии заболевания, а также противораковыми терапевтическими вмешательствами, включая химиотерапию, иммунотерапию, хирургию или наличие постоянных сосудистых катетеров [50]. Например, относительный риск тромбоза при химиотерапии рака повышается до 6,5, в первую очередь из-за повреждения эндотелия [49, 51].
Гиперкоагуляция при раке обычно следует за опосредованной тканевым фактором активацией свертывания, воспалительной модуляцией свертывания, фибринолитическими изменениями и эндотелиальной дисфункцией. И раковые клетки, и эндотелий играют ключевую роль в активации коагуляции и тромбообразовании. Повышенные уровни vWF в плазме, высвобождаемые во время повреждения эндотелия, усиливают агрегацию тромбоцитов в поврежденном эндотелии. Опухолевые клетки, моноциты, макрофаги и прокоагулянтные микровезикулы активируют тканевой фактор, способствуя гиперкоагуляции. Опухолевые клетки, продуцирующие муцин, могут также генерировать цистеиновую протеазу, которая непосредственно активирует фактор X, в то время как взаимодействия между раковыми клетками и тромбоцитарным и эндотелиальным P-селектином и лейкоцитарным L-селектином могут индуцировать образование микротромбов тромбоцитов. Провоспалительные цитокины могут дополнительно усугубить активацию прокоагулянтных путей, процесс, который может быть дополнительно усилен химиотерапией. Наконец, некоторые раковые клетки могут экспрессировать ингибиторы фибринолиза (PAI-1) или активаторы (tPA или uPA), что приводит к антифибринолитической активности или гиперфибринолизу, в зависимости от их относительных уровней [52-54].
Рак также может индуцировать ДВС-синдром, но в отличие от ДВС-синдрома, индуцированного сепсисом, у пациентов проявляются минимальные клинические симптомы с умеренными/подострыми/ хроническими клиническими проявлениями потребления тромбоцитов и факторов свертывания крови за счет компенсированного увеличения продукции некоторых прокоагулянтных белков в ответ на воспаление. ДВС-синдром при солидных опухолях в основном характеризуется прокоагулянтной активностью и отложением фибрина, что повышает при них риск тромботических осложнений по сравнению с больными без ДВС-синдрома [49].
В большом проспективном когортном исследовании солидных опухолей ДВС-синдром был диагностирован у 7% из 1117 пациентов на основании диагностических критериев Международного общества тромбоза и гемостаза (ISTH) [55]. Большинство из этих больных имели запущенные стадии рака (у 76% III/IV стадии), у 59% развились геморрагические осложнения, у 34% — тромботические, у 7% — кровотечения и тромботические. Факторы, независимо связанные с ДВС-синдромом при многомерном анализе, включали распространенный рак более высокой стадии, рак молочной железы и наличие некроза опухоли. В более общем плане аденокарциномы, в основном желудочно-кишечного тракта, поджелудочной железы, легких, молочной или предстательной железы, возможно, глиобластомы или другие опухоли головного мозга являются основными опухолями, связанными с ДВС-синдромом [55].
Лечение коагулопатий
Лечение геморрагических коагулопатий
Лечение коагулопатии должно основываться на доминирующем клиническом фенотипе/проявлении, будь то геморрагическая коагулопатия с гипокоагуляцией и гиперфибринолизом или тромботическая коагулопатия с системным протромботическим и антифибринолитическим фенотипом (Fig. 4). Помимо лечения основного заболевания, большинство терапевтических вмешательств являются лишь поддерживающими и частично эффективными из-за заболевания, явившегося причиной развития коагулопатии. Однако антикоагулянтный и фибринолитический пути направлены на восстановление гемостатического баланса между кровотечением и тромбозом, который также изменяется в ходе терапии. Как показано в Tables 1 и 2, клинические испытания и экспериментальные данные привели к большим успехам в лечении коагулопатий за последнее десятилетие, хотя некоторые вопросы все еще остаются без ответа.




Остановка кровотечения
Лечение геморрагических коагулопатий при травме или в послеродовом периоде требует восстановления объема циркулирующей крови и купирования шока, и все это рассматривается как часть реанимационный мероприятий для контроля повреждений. Медикаментозная остановка кровотечения включает заместительную гемотрансфузию и/или концентратами факторов свертывания в зависимости от скорости кровотечения и коагулограммы (Fig. 5). Использование алгоритмов контроля за кровотечением имеет решающее значение как часть мультимодального терапевтического плана при геморрагическом шоке до тех пор, пока определенные хирургические или радиологические вмешательства не смогут остановить или контролировать кровотечение (Fig. 6). Для этой популяции пациентов были предложены специфические алгоритмы трансфузии многих факторов, включая переливание эритроцитов (эритроцитов) и тромбоцитов [81]. Европейское общество медицины критических состояний (ESICM) недавно опубликовало рекомендации по стратегии трансфузии [82]. Эксперты предлагают стратегии переливания с высоким соотношением (по крайней мере, одна единица плазмы/2 единицы эритроцитарной массы) у тяжелобольных с массивным кровотечением в следствии травмы (доказательства с низким уровнем достоверности), в то время как для пациентов без травмы рекомендации отсутствуют. Также отсутствуют экспертные рекомендации по раннему эмпирическому замещению фибриногеном у пациентов с травмами или в критическом состоянии. Кроме того, при переливании эритроцитов и тромбоцитов пациентам с немассивным кровотечением рекомендуются ограничительные стратегии трансфузии.

Острый ДВС-синдром, связанный с лейкемией, обычно быстро разрешается после начала противоопухолевой терапии, но геморрагические осложнения часто требуют трансфузионной поддержки из-за тромбоцитопении. Предложены пороги переливания тромбоцитов 20–30х109/л и 50х109/л, соответственно, у пациентов без кровотечения и с кровотечением, а также поддержание уровня фибриногена > 1,5–2 г/л. Таким пациентам не рекомендуются антифибринолитические препараты из-за вторичного повышенного тромботического риска, а также нефракционированный гепарин или рекомбинантный активированный фактор VII [22]. Рекомбинантный растворимый тромбомодулин может улучшать ДВС-синдром и облегчать симптомы кровотечения у пациентов с коагулопатией и гемобластозами [71].

Восстановление протромботико-фибринолитического гемостатического баланса
Гиперфибринолиз является важным фактором кровотечения и коагулопатии, наблюдаемых в дебюте коагулопатии, индуцированной травмой (TIC) и перинатальных кровотечений. В результате мультимодальное лечение ТИЦ включает дополнительную антифибринолитическую терапию транексамовой кислотой, хотя эндогенные ингибиторы фибринолиза, такие как PAI-1 mRNA [16, 17], могут уменьшить кровотечение после повреждения ткани [83]. В соответствии с данными крупнейшего рандомизированного контролируемого исследования CRASH-2, в котором приняли участие 20 211 пациентов с травмами, получавших в течение 8 часов после травмы либо транексамовую кислоту (ТК), либо плацебо, смертность от всех причин была снижена в группе ТК (14,5% по сравнению с 16% плацебо; относительный риск [ОР ] 0,91, 95% ДИ 0,85–0,97; p = 0,0035) [69], эксперты ESICM рекомендуют ее применение в течение 3 ч у пациентов в критическом состоянии с кровотечением из-за травмы (сильная рекомендация, высокая достоверность) [82].
При перинатальной коагулопатии эксперты ESICM также «предлагают раннее использование TК у пациентов в критическом состоянии с послеродовым кровотечением (условная рекомендация, высокая достоверность)». В исследовании WOMAN, проведенном с участием 20 060 женщин с клиническим диагнозом послеродового кровотечения, TК снижала смертность от кровотечения (ОР 0,81; 95% ДИ 0,65–1; p = 0,045), особенно если ее вводили в течение 3 ч после родов (ОР 0,69; 95). % ДИ 0,52–0,91, p = 0,008) [68]. Многонациональное рандомизированное, двойное слепое, плацебо-контролируемое, параллельное исследование превосходства (NCT03136445) в настоящее время проверяет, может ли введение TК пациентам, получающим лечение от онкогематологических заболеваний, снизить риск кровотечения или смерти и оценивает необходимость переливания тромбоцитов [70].
Рекомендации по гемостатической терапии
Помимо применения протоколов при массивных кровотечения, руководство своевременным назначением (Fig. 7) гемостатической терапии в зависимости от тяжести и характера гемостатического дефицита может позволить осуществить целенаправленный и индивидуальный подход к коррекции коагулопатии. Считалось, прикроватные исследования вязкости крови более эффективны, чем обычные тесты на коагуляцию. Однако в недавнем прагматическом, многоцентровом, рандомизированном контролируемом исследовании ITACTICу пациентов с травмой и кровотечением сообщалось, что вмешательства, проводимые под контролем показателей вязкости крови, не улучшали исходы по сравнению со стандартным протоколом, дополненным активным мониторингом обычных тестов на коагуляцию [84].

Лечение тромботических коагулопатий
Профилактика тромботических осложнений
В контексте тромботической коагулопатии с избыточным образованием тромбина при сепсисе и солидных опухолях антикоагулянтная терапия может предотвратить или обратить вспять чрезмерную активацию коагуляции и нарушение регуляции иммунотромбоза (Fig. 8). Нефракционированный гепарин (НФГ) и низкомолекулярный гепарин (НМГ) приводят к повышенной (антитромбинзависимой) инактивации фактора Ха и некоторых протеаз свертывания (IXa, XIa, XIIa), а НФГ также нейтрализует тромбин. Гепарин также проявляет иммуномодулирующие и противовоспалительные свойства, что важно для регуляции иммунотромбоза [85]. Независимо от контекста коагулопатии, клинические исследования показывают более высокую эффективность НМГ по сравнению с НФГ у пациентов в критическом состоянии без увеличения частоты геморрагических осложнений [86]. Таким образом, европейские и американские рекомендации рекомендуют фармакологическую профилактику НМГ вместо НФГ у пациентов в критическом состоянии (уровень 1В) [87, 88].
Несколько метаанализов, включая анализ Wang et al. сообщили о снижении смертности у пациентов с сепсисом, получавших гепарин [89], но данные крупных рандомизированных контролируемых исследований в этой популяции все еще необходимы. В японском двойном слепом исследовании, включавшем 125 пациентов с ДВС-синдромом, сравнивалась эффективность НМГ (FR-860) с гепарином и было высказано предположение, что FR-860 может привести к более высокой частоте улучшения, чем группа гепарина (20,5% и 8,2% соответственно) [90]. При сепсисе экспериментальные данные показывают благотворное влияние ингибиторов свертывания крови (антитромбина, протеина С и TFPI) на выживаемость экспериментальных животных (Table. 2) [91, 92]. Однако антитромбин не улучшал выживаемость пациентов в исследованиях III фазы и повышал риск тяжелых геморрагических осложнений [93, 94]. Рекомбинантный человеческий активированный протеин С был отозван из-за отсутствия положительного влияния на выживаемость пациентов с сепсисом и повышенного риска кровотечения (Table 1) [95].
Тромбомодулин (ТМ) представляет собой трансмембранный многодоменный гликопротеин, в основном экспрессируемый эндотелиальными клетками. Образуя комплекс с тромбином, ТМ позволяет активировать протеин С и последующую инактивацию кофакторов Va и VIIIa, тем самым ограничивая усиление коагуляционного каскада [96-98]. При септическом шоке эндотелиальная экспрессия ТМ подавляется, что приводит к дефекту активации протеина С. Кроме того, лектиноподобный домен рекомбинантного человеческого ТМ (rhTM) также обладает противовоспалительными свойствами, ингибируя каскад комплемента и адгезию лейкоцитов к эндотелию, нейтрализуя липополисахарид (LPS) и разрушая провоспалительный белок высокой подвижности группы 1 (HMGB1) [98-100].
Международное рандомизированное контролируемое исследование SCARLET, в котором сравнивается эффект rhTM с плацебо, является первым исследованием , в которое включены только пациенты с сепсисом и коагулопатией, определяемые тромбоцитопенией или снижением количества тромбоцитов более чем на 30% в течение 24 часов и МНО > 1,4 [59]. Хотя значительного снижения смертности на 28-й день в группе полного анализа не наблюдалось, rhTM был более эффективен в подгруппах пациентов с персистирующей коагулопатией на момент введения первой дозы лечения (т.е. между рандомизацией в исследовании и назначением лечения) и теми, кто не получал сопутствующего лечения гепарином в контексте тромбопрофилактики. Эти результаты были подтверждены апостериорным анализом, проведенным на когорте французских пациентов [61]. rhTM остается потенциально перспективным методом лечения ДВС-синдрома, вызванного септическим шоком, хотя он не рекомендуется отдельно в японских руководствах.
Отсутствие стратификации пациентов для назначения антикоагулянтной терапии является причиной некоторых неудач крупных клинических испытаний. Например, в некоторых апостериорных анализах рандомизированных клинических исследований наименее тяжелые пациенты (прогнозируемая смертность <25%, оценка по шкале APACHE II <25 или SAPS II<40) не получают пользы от лечения гепарином, антитромбином, APC или rhTM [101], так как у них нет коагулопатии. Действительно, лечение физиологическими ингибиторами свертывания при септическом шоке может принести пользу только пациентам с тяжелым ДВС-синдром, поскольку локальный иммунотромбоз может участвовать в физиологических реакциях иммунной защиты. При септической коагулопатии назначают антикоагулянты, чтобы изменить тонкий баланс между патогеном и адаптивной реакцией хозяина. Хотя активация адаптивной коагуляции является важной частью защитного механизма хозяина (иммунотромбоз), ее нерегулируемая и чрезмерная активация вредна [41, 79].
Поэтому необходимо различать пациентов с сепсисом или септическим шоком в зависимости от того, считается ли состояние активации свертывания вредным (чрезмерным) или полезным (контролируемым), что можно рассматривать как «адаптивный гемостаз»; первым может помочь лечение антикоагулянтами, а вторым - нет. Точно так же, в то время как коагулопатия, связанная с раком, чаще связана с легкими или подострыми/хроническими проявлениями, солидные опухоли на терминальной стадии являются одной из ведущих причин ДВС-синдрома и также являются предметом всесторонних исследований. Таким образом, в двух крупных японских стационарных исследованиях с базой данных оценивался эффект терапии антитромбином или rhTM у пациентов с ДВС-синдромом, ассоциированным с солидной опухолью IV стадии, но оба не показали снижения смертности по сравнению с контрольной группой [72, 73].
Наконец, поскольку контактный (внутренний) путь активации играет ключевую роль в росте тромба, интересной альтернативой для получения антитромботического эффекта без увеличения риска кровотечения из-за антикоагулянтной терапии было бы ингибирование этого пути [102]. FXI, как правило, не является необходимым для физиологического гемостаза. Таким образом, ингибирование FXI было определено как потенциальная антитромботическая мишень [103-105]. Были разработаны новые стратегии для нацеливания на FXI, включая антисенс-олигонуклеотиды (ASO), которые уменьшают синтез FXI в печени, блокируя активацию или активность FXI с помощью антител или аптамеров или вызывают обратимое связывание с активным центром FXI небольшими молекулами [106]. Эти новые терапевтические средства еще не были оценены при сепсис-индуцированной коагулопатии.
Восстановление протромботико-фибринолитического баланса
Помимо лечения антикоагулянтами, направленного на предотвращение чрезмерной активации свертывания, добавление белков плазмы у пациентов с крайне низким уровнем факторов свертывания крови и антитромбина, вторичного по отношению к септической коагулопатии, может снизить риск кровотечения и повысить эффективность гепарина. В клиническом исследовании с участием 80 детей с сепсисом или септическим шоком, осложненным предшествующим ДВС-синдромом, раннее применение комбинации свежезамороженной плазмы, низких доз гепарина и транексамовой кислоты было связано с улучшением выживаемости и предотвращением прогрессирования ДВС-синдрома без увеличения риска кровотечения [57]. Кроме того, два недавно опубликованных исследования, проведенных у взрослых пациентов, показали, что ранний плазмаферез может уменьшить дисбаланс между про- и антикоагулянтными факторами, приводящий к септической коагулопатии [56, 58].
Наконец, в недавнем исследовании с целью подтверждения концепции у пациентов с септическим шоком было показано, что эластаза, связанная с нейтрофильными внеклеточными ловушками ДНК , разрушает плазминоген, снижает образование плазмина и, таким образом, уменьшает фибринолиз [77]. Этот гипофибринолиз играет важную роль в возникновении ДВС-синдрома, ответственного за СПОН. Плазминоген превращается в плазмин под действием tPA, высвобождаемого поврежденным эндотелием сосудов. Однако концентрация циркулирующего плазминогена ограничивает способность тромбов к эндогенному лизису. У этих пациентов также наблюдалось резкое снижение концентрации плазминогена, частично связанное с его потреблением (превращением в плазмин) при фибринолизе.
However, in septic DIC, a persistence of microthrombi associated with hypofibrinolysis requires an alternative explanation. The major functionalplasminogen defi- ciency detected in these patients could be mainly related to proteolysis by DNA-bound elastase of NETs. Unlike free elastase, DNA-bound elastase is resistant to the α1-proteinase inhibitor, its main inhibitor, and is, there- fore, able to cleave plasminogen into fragments that have losttheir ability to generate plasmin. Fibrinolytic insuffi- ciency is, therefore, another therapeutic route of interest in septic DIC. In this context, sivelestat is aselective neutrophil elastase inhibitor available in Japan. Its use has been reported in patients with acute respiratory distress syn- drome and DIC, showing an improved outcome com- pared to the control group [62].
Однако при ДВС-синдроме на фоне сепсиса персистенция микротромбов, связанная с гипофибринолизом, требует альтернативного объяснения. Основной функциональный дефицит плазминогена, обнаруженный у этих пациентов, может быть в основном связан с протеолизом ДНК-связанной эластазой нейтрофильных внеклеточных ловушек. В отличие от свободной эластазы, ДНК-связанная эластаза устойчива к ингибитору α1-протеиназы, ее основному ингибитору, и поэтому способна расщеплять плазминоген на фрагменты, утратившие способность генерировать плазмин. Таким образом, фибринолитическая недостаточность является еще одним интересным терапевтическим путем при септическом ДВС-синдроме. В этом контексте может быть перспективным применение сивелестата - селективного ингибитора эластазы нейтрофилов у пациентов с острым респираторным дистресс-синдромом и ДВС-синдромом, что показало улучшение исхода по сравнению с контрольной группой [62].
Заключение
Коагулопатия является частым осложнением в интенсивной терапии, которое заслуживает особого внимания со стороны врачей, поскольку значительно ухудшает прогноз. В то время как основное заболевание обычно определяет специфическую клиническую и биологическую картину коагулопатии, клинические проявления развиваются в зависимости от времени течения заболевания и лечебных мероприятий.
References
1. Hjorleifsson E, Sigurdsson MI, Gudmundsdottir BR, Sigurdsson GH, Onundarson PT (2015) Prediction of survival in patients suspected of disseminated intravascular coagulation. Acta Anaesthesiol Scand 59:870–880. https://doi.org/10.1111/aas.12537
2. Kleinveld DJB, Hamada SR, Sandroni C (2022) Trauma-induced coagulopathy. Intensive Care Med. https://doi.org/10.1007/ s00134-022-06834-7
3. Callcut RA, Kornblith LZ, Conroy AS, Robles AJ, Meizoso JP, Namias N, Meyer DE, Haymaker A, Truitt MS, Agrawal V, Haan JM, Lightwine KL, Porter JM, San Roman JL, Biffl WL, Hayashi MS, Sise MJ, Badiee J, Recinos G, Inaba K, Schroeppel TJ, Callaghan E, Dunn JA, Godin S, McIntyre RC Jr, Peltz ED, O’Neill PJ, Diven CF, Scifres AM, Switzer EE, West MA, Storrs S, Cullinane DC, Cordova JF, Moore EE, Moore HB, Privette AR, Eriksson EA, Cohen MJ, Western Trauma Association Multicenter Study G (2019) The why and how our trauma patients die: a prospective Multicenter West- ern Trauma Association study. J Trauma Acute Care Surg 86:864–870. https://doi.org/10.1097/TA.0000000000002205
4. McLintock C (2020) Prevention and treatment of postpartum hemor- rhage: focus on hematological aspects of management. Hematol Am Soc Hematol Educ Progr 2020:542–546. https://doi.org/10.1182/hemat ology.2020000139
5. Raza I, Davenport R, Rourke C, Platton S, Manson J, Spoors C, Khan S, De’Ath HD, Allard S, Hart DP, Pasi KJ, Hunt BJ, Stanworth S, MacCallum PK, Brohi K (2013) The incidence and magnitude of fibrinolytic activa- tion in trauma patients. J Thromb Haemost 11:307–314. https://doi.org/ 10.1111/jth.12078
6. Moore HB, Moore EE, Morton AP, Gonzalez E, Fragoso M, Chapman MP, Dzieciatkowska M, Hansen KC, Banerjee A, Sauaia A, Silliman CC (2015) Shock-induced systemic hyperfibrinolysis is attenuated by plasma-first resuscitation. J Trauma Acute Care Surg 79:897–903. https://doi.org/10.1097/TA.0000000000000792
7. Gando S, Levi M, Toh CH (2016) Disseminated intravascular coagulation. Nat Rev Dis Primers 2:16037. https://doi.org/10.1038/nrdp.2016.37
8. Zhang Q, Raoof M, Chen Y, Sumi Y, Sursal T, Junger W, Brohi K, Itagaki K, Hauser CJ (2010) Circulating mitochondrial DAMPs cause inflammatory responses to injury. Nature 464:104–107. https://doi.org/10.1038/natur e08780
9. Vulliamy P, Kornblith LZ, Kutcher ME, Cohen MJ, Brohi K, Neal MD (2021) Alterations in platelet behavior after major trauma: adaptive or mala- daptive? Platelets 32:295–304. https://doi.org/10.1080/09537104.2020. 1718633
10. Kutcher ME, Redick BJ, McCreery RC, Crane IM, Greenberg MD, Cachola LM, Nelson MF, Cohen MJ (2012) Characterization of platelet dysfunc- tion after trauma. J Trauma Acute Care Surg 73:13–19. https://doi.org/ 10.1097/TA.0b013e318256deab
11. Starr NE, Matthay ZA, Fields AT, Nunez-Garcia B, Callcut RA, Cohen MJ, Kornblith LZ (2020) Identification of injury and shock driven effects on ex vivo platelet aggregometry: a cautionary tale of phenotyping. J Trauma Acute Care Surg 89:20–28. https://doi.org/10.1097/TA.0000000000002707
12. Zhang J, Zhang F, Dong JF (2018) Coagulopathy induced by traumatic brain injury: systemic manifestation of a localized injury. Blood 131:2001–2006. https://doi.org/10.1182/blood-2017-11-784108
13. Erez O (2017) Disseminated intravascular coagulation in pregnancy: clinical phenotypes and diagnostic scores. Thromb Res 151(Suppl 1):S56–S60. https://doi.org/10.1016/S0049-3848(17)30069-5
14. Kashuk JL, Moore EE, Millikan JS, Moore JB (1982) Major abdominal vascular trauma–a unified approach. J Trauma 22:672–679. https://doi. org/10.1097/00005373-198208000-00004
15. Moore HB, Tessmer MT, Moore EE, Sperry JL, Cohen MJ, Chapman MP, Pusateri AE, Guyette FX, Brown JB, Neal MD, Zuckerbraun B, Sauaia A (2020) Forgot calcium? Admission ionized-calcium in two civilian rand- omized controlled trials of prehospital plasma for traumatic hemor- rhagic shock. J Trauma Acute Care Surg 88:588–596. https://doi.org/10. 1097/TA.0000000000002614
16. Ditzel RM Jr, Anderson JL, Eisenhart WJ, Rankin CJ, DeFeo DR, Oak S, Siegler J (2020) A review of transfusion- and trauma-induced hypoc- alcemia: Is it time to change the lethal triad to the lethal diamond? J Trauma Acute Care Surg 88:434–439. https://doi.org/10.1097/TA.0000000000002570
17. Morton AP, Moore EE, Wohlauer MV, Lo K, Silliman CC, Burlew CC, Baner- jee A (2013) Revisiting early postinjury mortality: are they bleeding because they are dying or dying because they are bleeding? J Surg Res 179:5–9. https://doi.org/10.1016/j.jss.2012.05.054
18. Mitrophanov AY, Szlam F, Sniecinski RM, Levy JH, Reifman J (2020) Con- trolled multifactorial coagulopathy: effects of dilution, hypothermia, and acidosis on thrombin generation in vitro. Anesth Analg 130:1063– 1076. https://doi.org/10.1213/ANE.0000000000004479
19. Moore HB, Moore EE, Gonzalez E, Chapman MP, Chin TL, Silliman CC, Banerjee A, Sauaia A (2014) Hyperfibrinolysis, physiologic fibrinolysis, and fibrinolysis shutdown: the spectrum of postinjury fibrinolysis and relevance to antifibrinolytic therapy. J Trauma Acute Care Surg 77:811–817. https://doi.org/10.1097/TA.0000000000000341
20. Zipperle J, Altenburger K, Ponschab M, Schlimp CJ, Spittler A, Bahrami S, Redl H, Schochl H (2017) Potential role of platelet-leukocyte aggrega- tion in trauma-induced coagulopathy: ex vivo findings. J Trauma Acute Care Surg 82:921–926. https://doi.org/10.1097/TA.0000000000001410
21. Barrett CD, Moore HB, Banerjee A, Silliman CC, Moore EE, Yaffe MB (2017) Human neutrophil elastase mediates fibrinolysis shutdown through competitive degradation of plasminogen and generation of angiostatin. J Trauma Acute Care Surg 83:1053–1061. https://doi.org/10.1097/TA.0000000000001685
22. Wang TF, Makar RS, Antic D, Levy JH, Douketis JD, Connors JM, Carrier M, Zwicker JI (2020) Management of hemostatic complications in acute leukemia: guidance from the SSC of the ISTH. J Thromb Haemost 18:3174–3183. https://doi.org/10.1111/jth.15074
23. Ten Cate H, Leader A (2021) Management of disseminated intravascular coagulation in acute leukemias. Hamostaseologie 41:120–126. https:// doi.org/10.1055/a-1393-8302
24. Sanz MA, Montesinos P (2020) Advances in the management of coagulopathy in acute promyelocytic leukemia. Thromb Res 191(Suppl 1):S63–S67. https://doi.org/10.1016/S0049-3848(20)30399-6
25. Mitrovic M, Suvajdzic N, Elezovic I, Bogdanovic A, Djordjevic V, Miljic P, Djunic I, Gvozdenov M, Colovic N, Virijevic M, Lekovic D, Vidovic A, Tomin D (2015) Thrombotic events in acute promyelocytic leukemia.
Thromb Res 135:588–593. https://doi.org/10.1016/j.thromres.2014.11. 026
26. Stein E, McMahon B, Kwaan H, Altman JK, Frankfurt O, Tallman MS (2009) The coagulopathy of acute promyelocytic leukaemia revisited. Best Pract Res Clin Haematol 22:153–163. https://doi.org/10.1016/j. beha.2008.12.007
27. Bennett B, Booth NA, Croll A, Dawson AA (1989) The bleeding disorder in acute promyelocytic leukaemia: fibrinolysis due to u-PA rather than defibrination. Br J Haematol 71:511–517. https://doi.org/10.1111/j.1365- 2141.1989.tb06311.x
28. Graf M, Reif S, Hecht K, Pelka-Fleischer R, Pfister K, Schmetzer H (2005) High expression of urokinase plasminogen activator receptor (UPA-R) in acute myeloid leukemia (AML) is associated with worse prognosis. Am J Hematol 79:26–35. https://doi.org/10.1002/ajh.20337
29. Wang P, Zhang Y, Yang H, Hou W, Jin B, Hou J, Li H, Zhao H, Zhou J (2018) Characteristics of fibrinolytic disorders in acute promyelocytic leukemia. Hematology 23:756–764. https://doi.org/10.1080/10245332. 2018.1470069
30. Kwaan HC, Weiss I, Tallman MS (2019) The role of abnormal hemostasis and fibrinolysis in morbidity and mortality of acute promyelocytic leu- kemia. Semin Thromb Hemost 45:612–621. https://doi.org/10.1055/s- 0039-1693478
31. Bonlokke ST, Ommen HB, Hvas AM (2021) Altered fibrinolysis in hema- tological malignances. Semin Thromb Hemost 47:569–580. https://doi. org/10.1055/s-0041-1725099
32. Boisrame-Helms J, Kremer H, Schini-Kerth V, Meziani F (2013) Endothe- lial dysfunction in sepsis. Curr Vasc Pharmacol 11:150–160
33. Fourrier F (2012) Severe sepsis, coagulation, and fibrinolysis: dead end or one way? Crit Care Med 40:2704–2708. https://doi.org/10.1097/CCM. 0b013e318258ff30
34. Lane DA, Philippou H, Huntington JA (2005) Directing thrombin. Blood 106:2605–2612. https://doi.org/10.1182/blood-2005-04-1710
35. van der Poll T, Herwald H (2014) The coagulation system and its func- tion in early immune defense. Thromb Haemost. https://doi.org/10. 1160/TH14-01-0053
36. Delabranche X, Helms J, Meziani F (2017) Immunohaemostasis: a new view on haemostasis during sepsis. Ann Intensive Care 7:117. https:// doi.org/10.1186/s13613-017-0339-5
37. Levi M (2010) The coagulant response in sepsis and inflammation. Hamostaseologie 30:10–16
38. Pfeiler S, Massberg S, Engelmann B (2014) Biological basis and patho- logical relevance of microvascular thrombosis. Thromb Res 133(Suppl 1):S35-37. https://doi.org/10.1016/j.thromres.2014.03.016
39. Gould TJ, Lysov Z, Liaw PC (2015) Extracellular DNA and histones: double-edged swords in immunothrombosis. J Thromb Haemost 13(Suppl 1):S82-91. https://doi.org/10.1111/jth.12977
40. Yang H, Biermann MH, Brauner JM, Liu Y, Zhao Y, Herrmann M (2016) New insights into neutrophil extracellular traps: mechanisms of forma- tion and role in inflammation. Front Immunol 7:302. https://doi.org/10. 3389/fimmu.2016.00302
41. Stiel L, Meziani F, Helms J (2018) Neutrophil activation during septic shock. Shock 49:371–384. https://doi.org/10.1097/SHK.0000000000 000980
42. Brinkmann V, Reichard U, Goosmann C, Fauler B, Uhlemann Y, Weiss DS, Weinrauch Y, Zychlinsky A (2004) Neutrophil extracellular traps kill bac- teria. Science 303:1532–1535. https://doi.org/10.1126/science.1092385
43. Yipp BG, Kubes P (2013) NETosis: how vital is it? Blood 122:2784–2794. https://doi.org/10.1182/blood-2013-04-457671
44. Meziani F, Delabranche X, Asfar P, Toti F (2010) Bench-to-bedside review: circulating microparticles–a new player in sepsis? Crit Care 14:236. https://doi.org/10.1186/cc9231
45. Mortaza S, Martinez MC, Baron-Menguy C, Burban M, de la Bourdon- naye M, Fizanne L, Pierrot M, Cales P, Henrion D, Andriantsitohaina R, Mercat A, Asfar P, Meziani F (2009) Detrimental hemodynamic and inflammatory effects of microparticles originating from septic rats. Crit Care Med37:2045–2050. https://doi.org/10.1097/CCM.0b013e3181 a00629
46. Lacroix R, Plawinski L, Robert S, Doeuvre L, Sabatier F, Martinez de Lizarrondo S, Mezzapesa A, Anfosso F, Leroyer AS, Poullin P, Jourde N, Njock MS, Boulanger CM, Angles-Cano E, Dignat-George F (2012)
Leukocyte- and endothelial-derived microparticles: a circulating source for fibrinolysis. Haematologica 97:1864–1872. https://doi.org/10.3324/ haematol.2012.066167
47. Engelmann B, Massberg S (2013) Thrombosis as an intravascular effec- tor of innate immunity. Nat Rev Immunol 13:34–45. https://doi.org/10. 1038/nri3345
48. Massberg S, Grahl L, von Bruehl ML, Manukyan D, Pfeiler S, Goosmann C, Brinkmann V, Lorenz M, Bidzhekov K, Khandagale AB, Konrad I, Ken- nerknecht E, Reges K, Holdenrieder S, Braun S, Reinhardt C, Spannagl M, Preissner KT, Engelmann B (2010) Reciprocal coupling of coagula- tion and innate immunity via neutrophil serine proteases. Nat Med 16:887–896. https://doi.org/10.1038/nm.2184
49. Levi M (2019) Disseminated intravascular coagulation in cancer: an update. Semin Thromb Hemost 45:342–347. https://doi.org/10.1055/s- 0039-1687890
50. Leiva O, Newcomb R, Connors JM, Al-Samkari H (2020) Cancer and thrombosis: new insights to an old problem. J Med Vasc 45:6S8-6S16. https://doi.org/10.1016/S2542-4513(20)30514-9
51. Levi M, Sivapalaratnam S (2020) An overview of thrombotic complica- tions of old and new anticancer drugs. Thromb Res 191(Suppl 1):S17– S21. https://doi.org/10.1016/S0049-3848(20)30391-1
52. Rickles FR, Brenner B (2008) Tissue factor and cancer. Semin Thromb Hemost 34:143–145. https://doi.org/10.1055/s-2008-1079253
53. Falanga A, Marchetti M, Vignoli A (2013) Coagulation and cancer: biological and clinical aspects. J Thromb Haemost 11:223–233. https:// doi.org/10.1111/jth.12075
54. Kwaan HC, McMahon B (2009) The role of plasminogen-plasmin system in cancer. Cancer Treat Res 148:43–66. https://doi.org/10.1007/ 978-0-387-79962-9_4
55. Sallah S, Wan JY, Nguyen NP, Hanrahan LR, Sigounas G (2001) Dissemi- nated intravascular coagulation in solid tumors: clinical and pathologic study. Thromb Haemost 86:828–833
56. Weng J, Chen M, Fang D, Liu D, Guo R, Yang S (2021) Therapeutic Plasma exchange protects patients with sepsis-associated dissemi- nated intravascular coagulation by improving endothelial function. Clin Appl Thromb Hemost 27:10760296211053312. https://doi.org/10.1177/10760296211053313
57. El-Nawawy AA, Elshinawy MI, Khater DM, Moustafa AA, Hassanein NM, Wali YA, Nazir HF (2021) Outcome of early hemostatic intervention in children with sepsis and nonovert disseminated intravascular coagula- tion admitted to PICU: a randomized controlled trial. Pediatr Crit Care Med 22:e168–e177. https://doi.org/10.1097/PCC.0000000000002578
58. Stahl K, Schmidt JJ, Seeliger B, Schmidt BMW, Welte T, Haller H, Hoeper MM, Budde U, Bode C, David S (2020) Effect of therapeutic plasma exchange on endothelial activation and coagulation-related parameters in septic shock. Crit Care 24:71. https://doi.org/10.1186/ s13054-020-2799-5
59. Vincent JL, Francois B, Zabolotskikh I, Daga MK, Lascarrou JB, Kirov MY, Pettila V, Wittebole X, Meziani F, Mercier E, Lobo SM, Barie PS, Crowther M, Esmon CT, Fareed J, Gando S, Gorelick KJ, Levi M, Mira JP, Opal SM, Parrillo J, Russell JA, Saito H, Tsuruta K, Sakai T, Fineberg D, Group ST (2019) Effect of a recombinant human soluble thrombomodulin on mortality in patients with sepsis-associated coagulopathy: the SCARLET randomized clinical trial. JAMA 321:1993–2002. https://doi.org/10.1001/ jama.2019.5358
60. Levi M, Vincent JL, Tanaka K, Radford AH, Kayanoki T, Fineberg DA, Hop- pensteadt D, Fareed J (2020) Effect of a recombinant human soluble thrombomodulin on baseline coagulation biomarker levels and mortal- ity outcome in patients with sepsis-associated coagulopathy. Crit Care Med 48:1140–1147. https://doi.org/10.1097/CCM.0000000000004426
61. François B, Fiancette M, Helms J, Mercier E, Lascarrou JB, Kayanoki T, Tanaka K, Fineberg D, Vincent JL, Wittebole X (2021) Efficacy and safety of human soluble thrombomodulin (ART-123) for treatment of patients in France with sepsis-associated coagulopathy: post hoc analysis of SCARLET. Ann Intensive Care 11:53. https://doi.org/10.1186/ s13613-021-00842-4
62. Hayakawa M, Katabami K, Wada T, Sugano M, Hoshino H, Sawamura A, Gando S (2010) Sivelestat (selective neutrophil elastase inhibitor) improves the mortality rate of sepsis associated with both acute res-
piratory distress syndrome and disseminated intravascular coagulation patients. Shock 33:14–18. https://doi.org/10.1097/SHK.0b013e3181 aa95c4
63. Hazelton JP, Ssentongo AE, Oh JS, Ssentongo P, Seamon MJ, Byrne JP, Armento IG, Jenkins DH, Braverman MA, Mentzer C, Leonard GC, Perea LL, Docherty CK, Dunn JA, Smoot B, Martin MJ, Badiee J, Luis AJ, Murray JL, Noorbakhsh MR, Babowice JE, Mains C, Madayag RM, Kaafarani HMA, Mokhtari AK, Moore SA, Madden K, Tanner A 2nd, Redmond D, Millia
DJ, Brandolino A, Nguyen U, Chinchilli V, Armen SB, Porter JM (2022) Use of cold-stored whole blood is associated with improved mortality in hemostatic resuscitation of major bleeding: a multicenter study. Ann Surg 276:579–588. https://doi.org/10.1097/SLA.0000000000005603
64. Crombie N, Doughty HA, Bishop JRB, Desai A, Dixon EF, Hancox JM, Herbert MJ, Leech C, Lewis SJ, Nash MR, Naumann DN, Slinn G, Smith H, Smith IM, Wale RK, Wilson A, Ives N, Perkins GD, Pcg Re (2022) Resuscita- tion with blood products in patients with trauma-related haemorrhagic shock receiving prehospital care (RePHILL): a multicentre, open-label, randomised, controlled, phase 3 trial. Lancet Haematol 9:e250–e261. https://doi.org/10.1016/S2352-3026(22)00040-0
65. Moore HB, Moore EE, Chapman MP, McVaney K, Bryskiewicz G, Blechar R, Chin T, Burlew CC, Pieracci F, West FB, Fleming CD, Ghasabyan
A, Chandler J, Silliman CC, Banerjee A, Sauaia A (2018) Plasma-first resuscitation to treat haemorrhagic shock during emergency ground transportation in an urban area: a randomised trial. Lancet 392:283–291. https://doi.org/10.1016/S0140-6736(18)31553-8
66. Sperry JL, Guyette FX, Brown JB, Yazer MH, Triulzi DJ, Early-Young BJ, Adams PW, Daley BJ, Miller RS, Harbrecht BG, Claridge JA, Phelan HA, Witham WR, Putnam AT, Duane TM, Alarcon LH, Callaway CW, Zuck- erbraun BS, Neal MD, Rosengart MR, Forsythe RM, Billiar TR, Yealy DM, Peitzman AB, Zenati MS, Group PAS (2018) Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med 379:315–326. https://doi.org/10.1056/NEJMoa1802345
67. Holcomb JB, Tilley BC, Baraniuk S, Fox EE, Wade CE, Podbielski JM, del Junco DJ, Brasel KJ, Bulger EM, Callcut RA, Cohen MJ, Cotton BA, Fabian TC, Inaba K, Kerby JD, Muskat P, O’Keeffe T, Rizoli S, Robinson BR, Scalea TM, Schreiber MA, Stein DM, Weinberg JA, Callum JL, Hess JR, Matijevic N, Miller CN, Pittet JF, Hoyt DB, Pearson GD, Leroux B, van Belle G, Group PS (2015) Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: the PROPPR randomized clinical trial. JAMA 313:471–482. https://doi.org/ 10.1001/jama.2015.12
68. Collaborators WT (2017) Effect of early tranexamic acid administration on mortality, hysterectomy, and other morbidities in women with post-partum haemorrhage (WOMAN): an international, randomised, double-blind, placebo-controlled trial. Lancet 389:2105–2116. https://doi.org/10.1016/S0140-6736(17)30638-4
69. Collaborators C-T, Shakur H, Roberts I, Bautista R, Caballero J, Coats T, Dewan Y, El-Sayed H, Gogichaishvili T, Gupta S, Herrera J, Hunt B, Irib- hogbe P, Izurieta M, Khamis H, Komolafe E, Marrero MA, Mejia-Mantilla J, Miranda J, Morales C, Olaomi O, Olldashi F, Perel P, Peto R, Ramana PV, Ravi RR, Yutthakasemsunt S (2010) Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-con- trolled trial. Lancet 376:23–32. https://doi.org/10.1016/S0140-6736(10)60835-5
70. Estcourt LJ, McQuilten Z, Powter G, Dyer C, Curnow E, Wood EM, Stanworth SJ, Collaboration TT (2019) The TREATT Trial (TRial to EvaluAte Tranexamic acid therapy in Thrombocytopenia): safety and efficacy of tranexamic acid in patients with haematological malignan- cies with severe thrombocytopenia: study protocol for a double-blind randomised controlled trial. Trials 20:592. https://doi.org/10.1186/ s13063-019-3663-2
71. Saito H, Maruyama I, Shimazaki S, Yamamoto Y, Aikawa N, Ohno R, Hirayama A, Matsuda T, Asakura H, Nakashima M, Aoki N (2007) Efficacy and safety of recombinant human soluble thrombomodulin (ART-123) in disseminated intravascular coagulation: results of a phase III, rand- omized, double-blind clinical trial. J Thromb Haemost 5:31–41. https:// doi.org/10.1111/j.1538-7836.2006.02267.x
72. Taniguchi K, Ohbe H, Yamakawa K, Matsui H, Fushimi K, Yasunaga H (2021) Recombinant thrombomodulin in disseminated intravascular coagulation associated with stage IV solid tumors: a nationwide obser- vational study in Japan. Thromb Haemost 121:36–45. https://doi.org/10. 1055/s-0040-1715840
73. Taniguchi K, Ohbe H, Yamakawa K, Matsui H, Fushimi K, Yasunaga H (2020) Antithrombin use and mortality in patients with stage IV solid tumor-associated disseminated intravascular coagulation: a nationwide observational study in Japan. BMC Cancer 20:867. https://doi.org/10.1186/s12885-020-07375-2
74. Bianchini EP, Razanakolona M, Helms J, Zouiti F, Couteau-Chardon A, Marin-Esteban V, Chaisemartin L, De-Carvalho A, Bironien R, Chollet- Martin S, Denis CV, Diehl JL, Vasse M, Meziani F, Borgel D (2021) The proteolytic inactivation of protein z-dependent protease inhibitor by neutrophil elastase might promote the procoagulant activity of neutro- phil extracellular traps in sepsis. Thromb Haemost. https://doi.org/10. 1055/a-1530-3980
75. Clere-Jehl R, Merdji H, Kassem M, Macquin C, De Cauwer A, Sibony A, Kurihara K, Minniti L, Abou Fayçal C, Bahram S, Meziani F, Helms J, Georgel P (2021) A translational investigation of IFN-α and STAT1
signaling in endothelial cells during septic shock provides therapeutic perspectives. Am J Respir Cell Mol Biol 65:167–175. https://doi.org/10. 1165/rcmb.2020-0401OC
76. Stiel L, Mayeur-Rousse C, Helms J, Meziani F, Mauvieux L (2019) First visualization of circulating neutrophil extracellular traps using cell fluorescence during human septic shock-induced disseminated intravascular coagulation. Thromb Res 183:153–158. https://doi.org/10.1016/j.thromres.2019.09.036
77. Barbosa da Cruz D, Helms J, Aquino LR, Stiel L, Cougourdan L, Broussard C, Chafey P, Riès-Kautt M, Meziani F, Toti F, Gaussem P, Anglés-Cano E (2019) DNA-bound elastase of neutrophil extracellular traps degrades plasminogen, reduces plasmin formation, and decreases fibrinolysis: proof of concept in septic shock plasma. FASEB J 33:14270–14280. https://doi.org/10.1096/fj.201901363RRR
78. Helms J, Clere-Jehl R, Bianchini E, Le Borgne P, Burban M, Zobairi F, Diehl JL, Grunebaum L, Toti F, Meziani F, Borgel D (2017) Thrombomodulin favors leukocyte microvesicle fibrinolytic activity, reduces NETosis and prevents septic shock-induced coagulopathy in rats. Ann Intensive Care 7:118. https://doi.org/10.1186/s13613-017-0340-z
79. Delabranche X, Stiel L, Severac F, Galoisy AC, Mauvieux L, Zobairi F, Lavigne T, Toti F, Angles-Cano E, Meziani F, Boisrame-Helms J (2017) Evidence of netosis in septic shock-induced disseminated intravascular coagulation. Shock 47:313–317. https://doi.org/10.1097/SHK.0000000000000719
80. Stiel L, Delabranche X, Galoisy AC, Severac F, Toti F, Mauvieux L, Meziani F, Boisrame-Helms J (2016) Neutrophil fluorescence: a new indicator of cell activation during septic shock-induced disseminated intravascular coagulation. Crit Care Med 44:e1132–e1136. https://doi.org/10.1097/CCM.0000000000001851
81. Vlaar APJ (2022) Blood transfusion: the search for the sweet spot. Inten- sive Care Med. https://doi.org/10.1007/s00134-022-06799-7
82. Vlaar APJ, Dionne JC, de Bruin S, Wijnberge M, Raasveld SJ, van Baarle F, Antonelli M, Aubron C, Duranteau J, Juffermans NP, Meier J, Murphy GJ, Abbasciano R, Muller MCA, Lance M, Nielsen ND, Schochl H, Hunt BJ, Cecconi M, Oczkowski S (2021) Transfusion strategies in bleeding criti- cally ill adults: a clinical practice guideline from the European Society of Intensive Care Medicine. Intensive Care Med 47:1368–1392. https://doi. org/10.1007/s00134-021-06531-x
83. Levy JH (2010) Antifibrinolytic therapy: new data and new concepts. Lancet 376:3–4. https://doi.org/10.1016/S0140-6736(10)60939-7
84. Baksaas-Aasen K, Gall LS, Stensballe J, Juffermans NP, Curry N, Maegele M, Brooks A, Rourke C, Gillespie S, Murphy J, Maroni R, Vulliamy P, Hen- riksen HH, Pedersen KH, Kolstadbraaten KM, Wirtz MR, Kleinveld DJB, Schafer N, Chinna S, Davenport RA, Naess PA, Goslings JC, Eaglestone S, Stanworth S, Johansson PI, Gaarder C, Brohi K (2021) Viscoelastic hae- mostatic assay augmented protocols for major trauma haemorrhage (ITACTIC): a randomized, controlled trial. Intensive Care Med 47:49–59. https://doi.org/10.1007/s00134-020-06266-1
85. Li X, Ma X (2017) The role of heparin in sepsis: much more than just an anticoagulant. Br J Haematol 179:389–398. https://doi.org/10.1111/bjh. 14885
86. Helms J, Middeldorp S, Spyropoulos AC (2022) Thromboprophy- laxis in critical care. Intensive Care Med. https://doi.org/10.1007/ s00134-022-06850-7
87. Duranteau J, Taccone FS, Verhamme P, Ageno W, Force EVGT (2018) European guidelines on perioperative venous thromboembolism prophylaxis: intensive care. Eur J Anaesthesiol 35:142–146. https://doi. org/10.1097/EJA.0000000000000707
88. Schunemann HJ, Cushman M, Burnett AE, Kahn SR, Beyer-Westendorf J, Spencer FA, Rezende SM, Zakai NA, Bauer KA, Dentali F, Lansing J, Balduzzi S, Darzi A, Morgano GP, Neumann I, Nieuwlaat R, Yepes-Nunez JJ, Zhang Y, Wiercioch W (2018) American Society of Hematology 2018 guidelines for management of venous thromboembolism: prophylaxis for hospitalized and nonhospitalized medical patients. Blood Adv 2:3198–3225.https://doi.org/10.1182/bloodadvances.2018022954
89. Wang C, Chi C, Guo L, Wang X, Guo L, Sun J, Sun B, Liu S, Chang X, Li E (2014) Heparin therapy reduces 28-day mortality in adult severe
sepsis patients: a systematic review and meta-analysis. Crit Care 18:563. https://doi.org/10.1186/s13054-014-0563-4
90. Sakuragawa N, Hasegawa H, Maki M, Nakagawa M, Nakashima M (1993) Clinical evaluation of low-molecular-weight heparin (FR-860) on dis- seminated intravascular coagulation (DIC)–a multicenter co-operative double-blind trial in comparison with heparin. Thromb Res 72:475–500. https://doi.org/10.1016/0049-3848(93)90109-2
91. Fourrier F, Jourdain M, Tournois A, Caron C, Goudemand J, Chopin C (1995) Coagulation inhibitor substitution during sepsis. Intensive Care Med 21(2):S264-268
92. Giebler R, Schmidt U, Koch S, Peters J, Scherer R (1999) Combined antithrombin III and C1-esterase inhibitor treatment decreases intravas- cular fibrin deposition and attenuates cardiorespiratory impairment in rabbits exposed to Escherichia coli endotoxin. Crit Care Med 27:597–604
93. Allingstrup M, Wetterslev J, Ravn FB, Moller AM, Afshari A (2016) Antithrombin III for critically ill patients: a systematic review with meta- analysis and trial sequential analysis. Intensive Care Med 42:505–520. https://doi.org/10.1007/s00134-016-4225-7
94. Warren BL, Eid A, Singer P, Pillay SS, Carl P, Novak I, Chalupa P, Atherstone A, Penzes I, Kubler A, Knaub S, Keinecke HO, Heinrichs H, Schindel F, Juers M, Bone RC, Opal SM, KyberSept Trial Study G (2001) Caring for the critically ill patient. High-dose antithrombin III in severe sepsis: a randomized controlled trial. JAMA 286:1869–1878
95. Dhainaut JF, Laterre PF, Janes JM, Bernard GR, Artigas A, Bakker J, Riess H, Basson BR, Charpentier J, Utterback BG, Vincent JL, Recombinant Human Activated Protein CWEISSG (2003) Drotrecogin alfa (activated) in the treatment of severe sepsis patients with multiple-organ dysfunc- tion: data from the PROWESS trial. Intensive Care Med 29:894–903. https://doi.org/10.1007/s00134-003-1731-1
96. Levi M (2015) Recombinant soluble thrombomodulin: coagulation takes another chance to reduce sepsis mortality. J Thromb Haemost 13:505–507. https://doi.org/10.1111/jth.12868
97. Levi M, van der Poll T (2013) Endothelial injury in sepsis. Intensive Care Med 39:1839–1842. https://doi.org/10.1007/s00134-013-3054-1
98. Weiler H, Isermann BH (2003) Thrombomodulin. J Thromb Haemost 1:1515–1524. https://doi.org/10.1046/j.1538-7836.2003.00306.x
99. Ito T, Maruyama I (2011) Thrombomodulin: protectorate God of the vas- culature in thrombosis and inflammation. J Thromb Haemost 9(Suppl 1):168–173. https://doi.org/10.1111/j.1538-7836.2011.04319.x
100. Li YH, Kuo CH, Shi GY, Wu HL (2012) The role of thrombomodulin lectin- like domain in inflammation. J Biomed Sci 19:34. https://doi.org/10. 1186/1423-0127-19-34
101. Umemura Y, Yamakawa K (2016) Efficacy and safety of anticoagulant therapy in three specific populations with sepsis: a meta-analysis of randomized controlled trials: reply. J Thromb Haemost. https://doi.org/ 10.1111/jth.13473
102. Hsu C, Hutt E, Bloomfield DM, Gailani D, Weitz JI (2021) Factor XI inhibi- tion to uncouple thrombosis from hemostasis: JACC review topic of the week. J Am Coll Cardiol 78:625–631. https://doi.org/10.1016/j.jacc.2021. 06.010
103. Preis M, Hirsch J, Kotler A, Zoabi A, Stein N, Rennert G, Saliba W (2017) Factor XI deficiency is associated with lower risk for cardiovascular and venous thromboembolism events. Blood 129:1210–1215. https://doi. org/10.1182/blood-2016-09-742262
104. Gailani D, Gruber A (2016) Factor XI as a therapeutic target. Arterioscler Thromb Vasc Biol 36:1316–1322. https://doi.org/10.1161/ATVBAHA.116. 306925
105. Li T, Liu J, Wu W (2022) Factor XI, a potential target for anticoagulation therapy for venous thromboembolism. Front Cardiovasc Med 9:975767. https://doi.org/10.3389/fcvm.2022.975767
106. Fredenburgh JC, Weitz JI (2021) Factor XI as a target for new anti-coagulants.Hamostaseologie 41:104–110. https://doi.org/10. 1055/a-1384-3715
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 20.03.2024
[~DATE_ACTIVE_FROM] => 20.03.2024
[ACTIVE_FROM_X] => 2024-03-20 00:00:00
[~ACTIVE_FROM_X] => 2024-03-20 00:00:00
[ACTIVE_FROM] => 20.03.2024
[~ACTIVE_FROM] => 20.03.2024
[SHOW_COUNTER] => 849
[~SHOW_COUNTER] => 849
[ID] => 8433
[~ID] => 8433
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 11.11.2024 14:07:37
[~TIMESTAMP_X] => 11.11.2024 14:07:37
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/kak-lechitkoagulopatii-u-patsientov-v-kriticheskom-sostoyanii/
[~DETAIL_PAGE_URL] => /library/articles/kak-lechitkoagulopatii-u-patsientov-v-kriticheskom-sostoyanii/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => kak-lechitkoagulopatii-u-patsientov-v-kriticheskom-sostoyanii
[~CODE] => kak-lechitkoagulopatii-u-patsientov-v-kriticheskom-sostoyanii
[EXTERNAL_ID] => 8433
[~EXTERNAL_ID] => 8433
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 20 марта 2024
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Как лечить коагулопатии у пациентов в критическом состоянии
[PREVIEW_PICTURE] => Array
(
[ID] => 5607
[TIMESTAMP_X] => 11.11.2024 14:07:37
[MODULE_ID] => iblock
[HEIGHT] => 667
[WIDTH] => 1000
[FILE_SIZE] => 99683
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/ead/86kl3tqo2dld74udkpe82llg24em6s9b
[FILE_NAME] => front-view-doctor-holding-medical-element.jpg
[ORIGINAL_NAME] => front-view-doctor-holding-medical-element.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => e40afc6652a95dfa2d5811f4c99a2723
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/ead/86kl3tqo2dld74udkpe82llg24em6s9b/front-view-doctor-holding-medical-element.jpg
[UNSAFE_SRC] => /upload/iblock/ead/86kl3tqo2dld74udkpe82llg24em6s9b/front-view-doctor-holding-medical-element.jpg
[SAFE_SRC] => /upload/iblock/ead/86kl3tqo2dld74udkpe82llg24em6s9b/front-view-doctor-holding-medical-element.jpg
[ALT] => Как лечить коагулопатии у пациентов в критическом состоянии
[TITLE] => Как лечить коагулопатии у пациентов в критическом состоянии
)
[DETAIL_TEXT] => Julie Helms, Toshiaki Iba, Jean Marie Connors, Satoshi Gando, Marcel Levi, Ferhat Mezianiand Jerrold H. Levy
How to manage coagulopathies in critically ill patients
Intensive Care Med 2023 .doi.org/10.1007/s00134-023-06980-6
Абстракт
Коагулопатия является тяжелым и частым осложнением у пациентов в критическом состоянии, патогенез и проявления которой могут варьировать в зависимости от основного заболевания. На основании доминирующего клинического фенотипа в настоящем обзоре различают геморрагические коагулопатии, характеризующиеся состоянием гипокоагуляции и гиперфибринолиза, и тромботические коагулопатии с системным протромботическим и антифибринолитическим фенотипом. Обсуждаются различия в патогенезе и лечении распространенных коагулопатий.
Ключевые слова: диссеминированное внутрисосудистое свертывание крови, коагулопатия, сепсис, травма, гематологические заболевания, реаниматология.
Введение
Нарушения свертывания крови — тяжелое, частое осложнение у больных в критическом состоянии, приводящее к синдрому полиорганной дисфункции (СПОН) и ассоциированное с ухудшением прогноза [1]. Таким образом, «коагулопатия» является общим термином, который можно определить как любое изменение или нарушение гемостаза по множеству причин, приводящее либо к кровотечению, либо к образованию тромбов, либо к тому и другому. Примеры включают сепсис-индуцированную коагулопатию (SIC) и травма-индуцированную коагулопатию (TIC). Однако, если они достаточно тяжелые, эти коагулопатии перерастают в диссеминированное внутрисосудистое свертывание крови (ДВС-синдром), что приводит к ПОН (Fig. 1).

Патогенез, проявления и лечение различных коагулопатий частично зависят от основного заболевания (Fig. 2). При ДВС-синдроме и всех коагулопатиях лечение основного заболевания, вызвавшего коагулопатию, имеет решающее значение. Однако каждая коагулопатия имеет доминирующий клинический фенотип, но у пациента могут проявляться тромботические и/или геморрагические признаки в зависимости от прогрессирования заболевания, терапевтических вмешательств и времени. Основываясь на доминирующем клиническом фенотипе, в этом обзоре мы будем различать геморрагические коагулопатии, характеризующиеся гипокоагуляционными и/или гиперфибринолитическими состояниями, и тромботические коагулопатии с системным протромботическим и антифибринолитическим фенотипом, а также рассмотрим различия в патогенезе и лечении.

Геморрагические коагулопатии
Не обусловленные злокачественными опухолями геморрагические коагулопатии
После травма-индуцированной и перинатальной коагулопатии начальное гипокоагуляционное состояние приводит к кровотечению в месте (-ах) повреждения, хотя массивная активация гемостаза происходит в сразу после травмы (Fig. 3) [2-4]. Эта начальная стадия геморрагического шока связана с гиперфибринолитическим состоянием вследствие высвобождения эндотелием тканевого активатора плазминогена (tPA), превращающего плазминоген в плазмин [5–7]. После обширного повреждения тканей и эндотелия высвобождаются ассоциированные с повреждением молекулярные паттерны (DAMP) и провоспалительные цитокины, усиливая образование тромбина, образование сгустков и эндотелиопатию [8].

Тромбоциты прилипают к поврежденному эндотелию, обеспечивая прокоагулянтную поверхность для активации коагуляции и усиления образования тромбина на активированных тромбоцитах во время фазы распространения. Активированные лейкоциты и тромбоциты образуют тромбоцитарно-лейкоцитарные агрегаты, а активированные нейтрофилы и макрофаги высвобождают внеклеточные ловушки, способствуя агрегации тромбоцитов и образованию тромбина (Fig. 3). Кровотечение с продолжающимся образованием тромбина приводит к расходованию факторов свертывания крови. Кроме того, истощение тромбоцитов изменяет их агрегацию [9–11].
Повреждение тканей и/или органов также может изменить гемостатический баланс. Например, поврежденная мозговая ткань высвобождает большое количество прокоагулянтных фосфолипидов и микровезикул (МВ) [12], в то время как при повреждении поджелудочной железы, легких и урогенитальных органов может высвобождаться tPA для активации фибринолиза. Во время беременности синцитиотрофобласт приобретает свойства эндотелиальных клеток с гемостатическими функциями, включая высокую экспрессию тканевого фактора (ТФ), протеина С, протеина S, протеина Z и ингибиторов пути тканевого фактора (TFPI-2). Кроме того, плацента также может высвобождать ингибиторы активатора плазминогена PAI-1 и PAI-2 во время нормальной беременности для предотвращения фибринолиза. Разрушение синцитиотрофобласта приводит к прокоагулянтным эффектам за счет массивного высвобождения тканевого фактора, активации воспаления и гиперфибринолиза [13].
Эта геморрагическая коагулопатия может дополнительно усугубляться неконтролируемым кровотечением, гемодилюцией из-за увеличения перфузии для поддержания артериального давления, «летальной триадой» (коагулопатия, гипотермия и метаболический ацидоз) из-за шока и СПОН, а также гипокальциемии, вторичной по отношению к потреблению и инактивации цитратными препаратами крови [14–17]. Все это может объяснить снижение активности ферментов свертывания, изменение функции тромбоцитов, задержку образования тромбина, гипофибриногенемию, изменение полимеризации фибрина и изменение прочности сгустка [16, 18].
По мере развития геморрагического шока фенотип кровотечения прогрессирует до тромботического, особенно после лечения препаратами крови и/или концентратами факторов [19]. Этому тромботическому фенотипу способствует измененная иммунорегуляторная функция тромбоцитов [20]. Кроме того, начальный гиперфибринолиз подавляется через несколько часов после первоначального повреждения ткани, термин, описываемый как «фибринолитическое отключение» из-за обширного высвобождения ингибиторов, клеточных побочных продуктов повреждения и нейтрофильной эластазы из нейтрофильных внеклеточных ловушек (NETs), которые снижают доступность плазминогена [21]. Наконец, при травма-индуцированной коагулопатии повреждение головного мозга может способствовать протромботическим расстройствам за счет массивного воздействия тканевого фактора, высвобождения церебрального эндотелиального фактора фон Виллебранда (vWF) и нарушения клиренса с помощью ADAMTS13.
Злокачественные геморрагические коагулопатии
У больных лейкозами, злокачественными гематологическими заболеваниями и некоторыми формами солидных опухолей (например, аденокарцинома предстательной железы или рак поджелудочной железы) у 15–20% развивается ДВС-синдром с преобладанием геморрагических проявлений над тромботическими. Кровотечения являются ведущей причиной ранней смерти и клиническим признаком острого промиелоцитарного лейкоза (APL; AML-M3 по франко-американо-британской классификации), при этом у 70–80% пациентов развивается ДВС-синдром при постановке диагноза или во время начала терапии [22, 23]. Это опасное для жизни кровотечение, проявляющееся ДВС-синдромом, также происходит при моноцитарном лейкозе или при запущенной аденокарциноме. Более того, терапевтические агенты, включая химиотерапию, трансплантацию гемопоэтических стволовых клеток, терапию Т-клетками с химерным антигенным рецептором (CAR), осложненную синдромом высвобождения цитокинов, могут вызывать эндотелиит. Кроме того, у пациентов могут развиться вторичные инфекции, которые могут играть важную роль в развитии ДВС-синдрома [24].
При этих онкологических состояниях могут сосуществовать как прокоагулянтные, так и гиперфибринолитические признаки. Опухолевые клетки экспрессируют тканевой фактор, ответственный за активацию коагуляции, прокоагулянтные белки, а также воспалительные цитокины, такие как интерлейкин-1β и фактор некроза опухоли α, которые подавляют эндотелиальный тромбомодулин и активируют антикоагулянтный путь протеина С [25, 26]. Однако эти прокоагулянтные механизмы в значительной степени подавлены гиперфибринолизом из-за повышенного высвобождения тканевого активатора плазминогена (tPA) [26-30]. Гиперфибринолиз часто встречается при остром промиелоцитарном лейкозе или ДВС-синдроме, в то время как гипофибринолиз проявляется при миелопролиферативных заболеваниях, что согласуется с повышенным риском тромбоза, а также у пациентов с острым лимфобластным лейкозом, получающим лечение L-аспарагиназой [31]. В последнем случае повышенный риск тромбоза обусловлен приобретенным дефицитом антитромбина.
Тромботические коагулопатии
Сепсис-индуцированная коагулопатия
Системное воспаление, характеризующее инвазию патогенов в хозяина при сепсисе, ответственно за активацию системной коагуляции с внутрисосудистыми прокоагулянтными фенотипическими изменениями, приводящими к сепсис-индуцированной коагулопатии (SIC) (Fig. 7) [32, 33]. Провоспалительные цитокины индуцируют эндотелиальную и моноцитарную экспрессию, которая запускает коагуляцию, что приводит к избыточной генерации тромбина, превращающего фибриноген в нерастворимую фибриновую сеть [34]. Кроме того, прямая активация контактной фазы и ингибирование реактивного фибринолиза бактериальными полифосфатами могут усиливать эту реакцию и приводить к избыточной продукции тромбина и/или нарушенной деградации фибрина [35]. Фибринолиз может дополнительно ухудшаться за счет увеличения продукции/активации ингибиторов (PAI-1, тромбин-активируемый ингибитор фибринолиза — TAFI) и снижения tPA [36]. Естественные антикоагулянты (протеин С, протеин S, тромбомодулин и антитромбин) и ингибитор пути тканевого фактора, ограничивающие активацию свертывания, либо истощены, либо менее активны [36].
При сепсисе взаимодействие иммунных клеток с активацией коагуляции было описано как «иммунотромбоз» [37] и относится к врожденному внутрисосудистому иммунному ответу, вызывающему образование тромбина и микротромбов. Первоначально иммунотромбоз был описан как полезный механизм защиты хозяина от патогенов, позволяющий их распознавать, сдерживать и уничтожать [38]. Однако при сепсисе и септическом шоке нарушение регуляции иммунотромбоза может привести к чрезмерной активации коагуляции, что в конечном итоге приводит к ДВС-синдрому и способствует серьезному повреждению тканей [37-41].
Активированные нейтрофилы выделяют как прокоагулянтные микровезикулы (MV), так и нейтрофильные внеклеточные ловушки (NET). NET представляют собой волокна деконденсированной ДНК, несущие цитруллинированные гистоны и протеолитические ферменты, такие как миелопероксидаза и нейтрофильная эластаза [42, 43]. Микровезикулы представляют собой субмикронные везикулы плазматической мембраны, высвобождаемые тромбоцитами и активированными моноцитами и нейтрофилами. Микровезикулы могут запускать активацию эндотелия и лейкоцитов, индуцировать экспрессию тканевого фактора и способствовать воспалительным сигнальным путям в стенках сосудов и тканях сердца [44]. Кроме того, воздействие фосфатидилсерина на ВК индуцирует сборку факторов свертывания крови. Интересно, что эндотелиальные и лейкоцитарные МВ проявляют профибринолитическую функцию, тем самым дополняя их прокоагулянтную активность [45]. Кроме того, ко-локализация микровезикул на нейтрофильных внеклеточных ловушках представляет собой поверхность, способствующую свертыванию крови, что способствует потенциальной прокоагулянтной активности нейтрофильных внеклеточных ловушек посредством активации контактной фазы (фактор XII). Кроме того, образование тромбина может индуцироваться гистонами тромбоцит-зависимым образом и нейтрофильной эластазой посредством протеолиза ингибитора пути тканевого фактора (TFPI) [46-48].
Коагулопатия, связанная с солидным раком
В нескольких когортных исследованиях сообщалось о высоком риске тромботических осложнений у больных раком со средней распространенностью 15% при аденокарциномах высокого риска и относительным риском от 4 до 7 по сравнению с пациентами без рака [49]. Этот повышенный тромботический риск обусловлен злокачественностью, в зависимости от типа опухоли и стадии заболевания, а также противораковыми терапевтическими вмешательствами, включая химиотерапию, иммунотерапию, хирургию или наличие постоянных сосудистых катетеров [50]. Например, относительный риск тромбоза при химиотерапии рака повышается до 6,5, в первую очередь из-за повреждения эндотелия [49, 51].
Гиперкоагуляция при раке обычно следует за опосредованной тканевым фактором активацией свертывания, воспалительной модуляцией свертывания, фибринолитическими изменениями и эндотелиальной дисфункцией. И раковые клетки, и эндотелий играют ключевую роль в активации коагуляции и тромбообразовании. Повышенные уровни vWF в плазме, высвобождаемые во время повреждения эндотелия, усиливают агрегацию тромбоцитов в поврежденном эндотелии. Опухолевые клетки, моноциты, макрофаги и прокоагулянтные микровезикулы активируют тканевой фактор, способствуя гиперкоагуляции. Опухолевые клетки, продуцирующие муцин, могут также генерировать цистеиновую протеазу, которая непосредственно активирует фактор X, в то время как взаимодействия между раковыми клетками и тромбоцитарным и эндотелиальным P-селектином и лейкоцитарным L-селектином могут индуцировать образование микротромбов тромбоцитов. Провоспалительные цитокины могут дополнительно усугубить активацию прокоагулянтных путей, процесс, который может быть дополнительно усилен химиотерапией. Наконец, некоторые раковые клетки могут экспрессировать ингибиторы фибринолиза (PAI-1) или активаторы (tPA или uPA), что приводит к антифибринолитической активности или гиперфибринолизу, в зависимости от их относительных уровней [52-54].
Рак также может индуцировать ДВС-синдром, но в отличие от ДВС-синдрома, индуцированного сепсисом, у пациентов проявляются минимальные клинические симптомы с умеренными/подострыми/ хроническими клиническими проявлениями потребления тромбоцитов и факторов свертывания крови за счет компенсированного увеличения продукции некоторых прокоагулянтных белков в ответ на воспаление. ДВС-синдром при солидных опухолях в основном характеризуется прокоагулянтной активностью и отложением фибрина, что повышает при них риск тромботических осложнений по сравнению с больными без ДВС-синдрома [49].
В большом проспективном когортном исследовании солидных опухолей ДВС-синдром был диагностирован у 7% из 1117 пациентов на основании диагностических критериев Международного общества тромбоза и гемостаза (ISTH) [55]. Большинство из этих больных имели запущенные стадии рака (у 76% III/IV стадии), у 59% развились геморрагические осложнения, у 34% — тромботические, у 7% — кровотечения и тромботические. Факторы, независимо связанные с ДВС-синдромом при многомерном анализе, включали распространенный рак более высокой стадии, рак молочной железы и наличие некроза опухоли. В более общем плане аденокарциномы, в основном желудочно-кишечного тракта, поджелудочной железы, легких, молочной или предстательной железы, возможно, глиобластомы или другие опухоли головного мозга являются основными опухолями, связанными с ДВС-синдромом [55].
Лечение коагулопатий
Лечение геморрагических коагулопатий
Лечение коагулопатии должно основываться на доминирующем клиническом фенотипе/проявлении, будь то геморрагическая коагулопатия с гипокоагуляцией и гиперфибринолизом или тромботическая коагулопатия с системным протромботическим и антифибринолитическим фенотипом (Fig. 4). Помимо лечения основного заболевания, большинство терапевтических вмешательств являются лишь поддерживающими и частично эффективными из-за заболевания, явившегося причиной развития коагулопатии. Однако антикоагулянтный и фибринолитический пути направлены на восстановление гемостатического баланса между кровотечением и тромбозом, который также изменяется в ходе терапии. Как показано в Tables 1 и 2, клинические испытания и экспериментальные данные привели к большим успехам в лечении коагулопатий за последнее десятилетие, хотя некоторые вопросы все еще остаются без ответа.




Остановка кровотечения
Лечение геморрагических коагулопатий при травме или в послеродовом периоде требует восстановления объема циркулирующей крови и купирования шока, и все это рассматривается как часть реанимационный мероприятий для контроля повреждений. Медикаментозная остановка кровотечения включает заместительную гемотрансфузию и/или концентратами факторов свертывания в зависимости от скорости кровотечения и коагулограммы (Fig. 5). Использование алгоритмов контроля за кровотечением имеет решающее значение как часть мультимодального терапевтического плана при геморрагическом шоке до тех пор, пока определенные хирургические или радиологические вмешательства не смогут остановить или контролировать кровотечение (Fig. 6). Для этой популяции пациентов были предложены специфические алгоритмы трансфузии многих факторов, включая переливание эритроцитов (эритроцитов) и тромбоцитов [81]. Европейское общество медицины критических состояний (ESICM) недавно опубликовало рекомендации по стратегии трансфузии [82]. Эксперты предлагают стратегии переливания с высоким соотношением (по крайней мере, одна единица плазмы/2 единицы эритроцитарной массы) у тяжелобольных с массивным кровотечением в следствии травмы (доказательства с низким уровнем достоверности), в то время как для пациентов без травмы рекомендации отсутствуют. Также отсутствуют экспертные рекомендации по раннему эмпирическому замещению фибриногеном у пациентов с травмами или в критическом состоянии. Кроме того, при переливании эритроцитов и тромбоцитов пациентам с немассивным кровотечением рекомендуются ограничительные стратегии трансфузии.

Острый ДВС-синдром, связанный с лейкемией, обычно быстро разрешается после начала противоопухолевой терапии, но геморрагические осложнения часто требуют трансфузионной поддержки из-за тромбоцитопении. Предложены пороги переливания тромбоцитов 20–30х109/л и 50х109/л, соответственно, у пациентов без кровотечения и с кровотечением, а также поддержание уровня фибриногена > 1,5–2 г/л. Таким пациентам не рекомендуются антифибринолитические препараты из-за вторичного повышенного тромботического риска, а также нефракционированный гепарин или рекомбинантный активированный фактор VII [22]. Рекомбинантный растворимый тромбомодулин может улучшать ДВС-синдром и облегчать симптомы кровотечения у пациентов с коагулопатией и гемобластозами [71].

Восстановление протромботико-фибринолитического гемостатического баланса
Гиперфибринолиз является важным фактором кровотечения и коагулопатии, наблюдаемых в дебюте коагулопатии, индуцированной травмой (TIC) и перинатальных кровотечений. В результате мультимодальное лечение ТИЦ включает дополнительную антифибринолитическую терапию транексамовой кислотой, хотя эндогенные ингибиторы фибринолиза, такие как PAI-1 mRNA [16, 17], могут уменьшить кровотечение после повреждения ткани [83]. В соответствии с данными крупнейшего рандомизированного контролируемого исследования CRASH-2, в котором приняли участие 20 211 пациентов с травмами, получавших в течение 8 часов после травмы либо транексамовую кислоту (ТК), либо плацебо, смертность от всех причин была снижена в группе ТК (14,5% по сравнению с 16% плацебо; относительный риск [ОР ] 0,91, 95% ДИ 0,85–0,97; p = 0,0035) [69], эксперты ESICM рекомендуют ее применение в течение 3 ч у пациентов в критическом состоянии с кровотечением из-за травмы (сильная рекомендация, высокая достоверность) [82].
При перинатальной коагулопатии эксперты ESICM также «предлагают раннее использование TК у пациентов в критическом состоянии с послеродовым кровотечением (условная рекомендация, высокая достоверность)». В исследовании WOMAN, проведенном с участием 20 060 женщин с клиническим диагнозом послеродового кровотечения, TК снижала смертность от кровотечения (ОР 0,81; 95% ДИ 0,65–1; p = 0,045), особенно если ее вводили в течение 3 ч после родов (ОР 0,69; 95). % ДИ 0,52–0,91, p = 0,008) [68]. Многонациональное рандомизированное, двойное слепое, плацебо-контролируемое, параллельное исследование превосходства (NCT03136445) в настоящее время проверяет, может ли введение TК пациентам, получающим лечение от онкогематологических заболеваний, снизить риск кровотечения или смерти и оценивает необходимость переливания тромбоцитов [70].
Рекомендации по гемостатической терапии
Помимо применения протоколов при массивных кровотечения, руководство своевременным назначением (Fig. 7) гемостатической терапии в зависимости от тяжести и характера гемостатического дефицита может позволить осуществить целенаправленный и индивидуальный подход к коррекции коагулопатии. Считалось, прикроватные исследования вязкости крови более эффективны, чем обычные тесты на коагуляцию. Однако в недавнем прагматическом, многоцентровом, рандомизированном контролируемом исследовании ITACTICу пациентов с травмой и кровотечением сообщалось, что вмешательства, проводимые под контролем показателей вязкости крови, не улучшали исходы по сравнению со стандартным протоколом, дополненным активным мониторингом обычных тестов на коагуляцию [84].

Лечение тромботических коагулопатий
Профилактика тромботических осложнений
В контексте тромботической коагулопатии с избыточным образованием тромбина при сепсисе и солидных опухолях антикоагулянтная терапия может предотвратить или обратить вспять чрезмерную активацию коагуляции и нарушение регуляции иммунотромбоза (Fig. 8). Нефракционированный гепарин (НФГ) и низкомолекулярный гепарин (НМГ) приводят к повышенной (антитромбинзависимой) инактивации фактора Ха и некоторых протеаз свертывания (IXa, XIa, XIIa), а НФГ также нейтрализует тромбин. Гепарин также проявляет иммуномодулирующие и противовоспалительные свойства, что важно для регуляции иммунотромбоза [85]. Независимо от контекста коагулопатии, клинические исследования показывают более высокую эффективность НМГ по сравнению с НФГ у пациентов в критическом состоянии без увеличения частоты геморрагических осложнений [86]. Таким образом, европейские и американские рекомендации рекомендуют фармакологическую профилактику НМГ вместо НФГ у пациентов в критическом состоянии (уровень 1В) [87, 88].
Несколько метаанализов, включая анализ Wang et al. сообщили о снижении смертности у пациентов с сепсисом, получавших гепарин [89], но данные крупных рандомизированных контролируемых исследований в этой популяции все еще необходимы. В японском двойном слепом исследовании, включавшем 125 пациентов с ДВС-синдромом, сравнивалась эффективность НМГ (FR-860) с гепарином и было высказано предположение, что FR-860 может привести к более высокой частоте улучшения, чем группа гепарина (20,5% и 8,2% соответственно) [90]. При сепсисе экспериментальные данные показывают благотворное влияние ингибиторов свертывания крови (антитромбина, протеина С и TFPI) на выживаемость экспериментальных животных (Table. 2) [91, 92]. Однако антитромбин не улучшал выживаемость пациентов в исследованиях III фазы и повышал риск тяжелых геморрагических осложнений [93, 94]. Рекомбинантный человеческий активированный протеин С был отозван из-за отсутствия положительного влияния на выживаемость пациентов с сепсисом и повышенного риска кровотечения (Table 1) [95].
Тромбомодулин (ТМ) представляет собой трансмембранный многодоменный гликопротеин, в основном экспрессируемый эндотелиальными клетками. Образуя комплекс с тромбином, ТМ позволяет активировать протеин С и последующую инактивацию кофакторов Va и VIIIa, тем самым ограничивая усиление коагуляционного каскада [96-98]. При септическом шоке эндотелиальная экспрессия ТМ подавляется, что приводит к дефекту активации протеина С. Кроме того, лектиноподобный домен рекомбинантного человеческого ТМ (rhTM) также обладает противовоспалительными свойствами, ингибируя каскад комплемента и адгезию лейкоцитов к эндотелию, нейтрализуя липополисахарид (LPS) и разрушая провоспалительный белок высокой подвижности группы 1 (HMGB1) [98-100].
Международное рандомизированное контролируемое исследование SCARLET, в котором сравнивается эффект rhTM с плацебо, является первым исследованием , в которое включены только пациенты с сепсисом и коагулопатией, определяемые тромбоцитопенией или снижением количества тромбоцитов более чем на 30% в течение 24 часов и МНО > 1,4 [59]. Хотя значительного снижения смертности на 28-й день в группе полного анализа не наблюдалось, rhTM был более эффективен в подгруппах пациентов с персистирующей коагулопатией на момент введения первой дозы лечения (т.е. между рандомизацией в исследовании и назначением лечения) и теми, кто не получал сопутствующего лечения гепарином в контексте тромбопрофилактики. Эти результаты были подтверждены апостериорным анализом, проведенным на когорте французских пациентов [61]. rhTM остается потенциально перспективным методом лечения ДВС-синдрома, вызванного септическим шоком, хотя он не рекомендуется отдельно в японских руководствах.
Отсутствие стратификации пациентов для назначения антикоагулянтной терапии является причиной некоторых неудач крупных клинических испытаний. Например, в некоторых апостериорных анализах рандомизированных клинических исследований наименее тяжелые пациенты (прогнозируемая смертность <25%, оценка по шкале APACHE II <25 или SAPS II<40) не получают пользы от лечения гепарином, антитромбином, APC или rhTM [101], так как у них нет коагулопатии. Действительно, лечение физиологическими ингибиторами свертывания при септическом шоке может принести пользу только пациентам с тяжелым ДВС-синдром, поскольку локальный иммунотромбоз может участвовать в физиологических реакциях иммунной защиты. При септической коагулопатии назначают антикоагулянты, чтобы изменить тонкий баланс между патогеном и адаптивной реакцией хозяина. Хотя активация адаптивной коагуляции является важной частью защитного механизма хозяина (иммунотромбоз), ее нерегулируемая и чрезмерная активация вредна [41, 79].
Поэтому необходимо различать пациентов с сепсисом или септическим шоком в зависимости от того, считается ли состояние активации свертывания вредным (чрезмерным) или полезным (контролируемым), что можно рассматривать как «адаптивный гемостаз»; первым может помочь лечение антикоагулянтами, а вторым - нет. Точно так же, в то время как коагулопатия, связанная с раком, чаще связана с легкими или подострыми/хроническими проявлениями, солидные опухоли на терминальной стадии являются одной из ведущих причин ДВС-синдрома и также являются предметом всесторонних исследований. Таким образом, в двух крупных японских стационарных исследованиях с базой данных оценивался эффект терапии антитромбином или rhTM у пациентов с ДВС-синдромом, ассоциированным с солидной опухолью IV стадии, но оба не показали снижения смертности по сравнению с контрольной группой [72, 73].
Наконец, поскольку контактный (внутренний) путь активации играет ключевую роль в росте тромба, интересной альтернативой для получения антитромботического эффекта без увеличения риска кровотечения из-за антикоагулянтной терапии было бы ингибирование этого пути [102]. FXI, как правило, не является необходимым для физиологического гемостаза. Таким образом, ингибирование FXI было определено как потенциальная антитромботическая мишень [103-105]. Были разработаны новые стратегии для нацеливания на FXI, включая антисенс-олигонуклеотиды (ASO), которые уменьшают синтез FXI в печени, блокируя активацию или активность FXI с помощью антител или аптамеров или вызывают обратимое связывание с активным центром FXI небольшими молекулами [106]. Эти новые терапевтические средства еще не были оценены при сепсис-индуцированной коагулопатии.
Восстановление протромботико-фибринолитического баланса
Помимо лечения антикоагулянтами, направленного на предотвращение чрезмерной активации свертывания, добавление белков плазмы у пациентов с крайне низким уровнем факторов свертывания крови и антитромбина, вторичного по отношению к септической коагулопатии, может снизить риск кровотечения и повысить эффективность гепарина. В клиническом исследовании с участием 80 детей с сепсисом или септическим шоком, осложненным предшествующим ДВС-синдромом, раннее применение комбинации свежезамороженной плазмы, низких доз гепарина и транексамовой кислоты было связано с улучшением выживаемости и предотвращением прогрессирования ДВС-синдрома без увеличения риска кровотечения [57]. Кроме того, два недавно опубликованных исследования, проведенных у взрослых пациентов, показали, что ранний плазмаферез может уменьшить дисбаланс между про- и антикоагулянтными факторами, приводящий к септической коагулопатии [56, 58].
Наконец, в недавнем исследовании с целью подтверждения концепции у пациентов с септическим шоком было показано, что эластаза, связанная с нейтрофильными внеклеточными ловушками ДНК , разрушает плазминоген, снижает образование плазмина и, таким образом, уменьшает фибринолиз [77]. Этот гипофибринолиз играет важную роль в возникновении ДВС-синдрома, ответственного за СПОН. Плазминоген превращается в плазмин под действием tPA, высвобождаемого поврежденным эндотелием сосудов. Однако концентрация циркулирующего плазминогена ограничивает способность тромбов к эндогенному лизису. У этих пациентов также наблюдалось резкое снижение концентрации плазминогена, частично связанное с его потреблением (превращением в плазмин) при фибринолизе.
However, in septic DIC, a persistence of microthrombi associated with hypofibrinolysis requires an alternative explanation. The major functionalplasminogen defi- ciency detected in these patients could be mainly related to proteolysis by DNA-bound elastase of NETs. Unlike free elastase, DNA-bound elastase is resistant to the α1-proteinase inhibitor, its main inhibitor, and is, there- fore, able to cleave plasminogen into fragments that have losttheir ability to generate plasmin. Fibrinolytic insuffi- ciency is, therefore, another therapeutic route of interest in septic DIC. In this context, sivelestat is aselective neutrophil elastase inhibitor available in Japan. Its use has been reported in patients with acute respiratory distress syn- drome and DIC, showing an improved outcome com- pared to the control group [62].
Однако при ДВС-синдроме на фоне сепсиса персистенция микротромбов, связанная с гипофибринолизом, требует альтернативного объяснения. Основной функциональный дефицит плазминогена, обнаруженный у этих пациентов, может быть в основном связан с протеолизом ДНК-связанной эластазой нейтрофильных внеклеточных ловушек. В отличие от свободной эластазы, ДНК-связанная эластаза устойчива к ингибитору α1-протеиназы, ее основному ингибитору, и поэтому способна расщеплять плазминоген на фрагменты, утратившие способность генерировать плазмин. Таким образом, фибринолитическая недостаточность является еще одним интересным терапевтическим путем при септическом ДВС-синдроме. В этом контексте может быть перспективным применение сивелестата - селективного ингибитора эластазы нейтрофилов у пациентов с острым респираторным дистресс-синдромом и ДВС-синдромом, что показало улучшение исхода по сравнению с контрольной группой [62].
Заключение
Коагулопатия является частым осложнением в интенсивной терапии, которое заслуживает особого внимания со стороны врачей, поскольку значительно ухудшает прогноз. В то время как основное заболевание обычно определяет специфическую клиническую и биологическую картину коагулопатии, клинические проявления развиваются в зависимости от времени течения заболевания и лечебных мероприятий.
References
1. Hjorleifsson E, Sigurdsson MI, Gudmundsdottir BR, Sigurdsson GH, Onundarson PT (2015) Prediction of survival in patients suspected of disseminated intravascular coagulation. Acta Anaesthesiol Scand 59:870–880. https://doi.org/10.1111/aas.12537
2. Kleinveld DJB, Hamada SR, Sandroni C (2022) Trauma-induced coagulopathy. Intensive Care Med. https://doi.org/10.1007/ s00134-022-06834-7
3. Callcut RA, Kornblith LZ, Conroy AS, Robles AJ, Meizoso JP, Namias N, Meyer DE, Haymaker A, Truitt MS, Agrawal V, Haan JM, Lightwine KL, Porter JM, San Roman JL, Biffl WL, Hayashi MS, Sise MJ, Badiee J, Recinos G, Inaba K, Schroeppel TJ, Callaghan E, Dunn JA, Godin S, McIntyre RC Jr, Peltz ED, O’Neill PJ, Diven CF, Scifres AM, Switzer EE, West MA, Storrs S, Cullinane DC, Cordova JF, Moore EE, Moore HB, Privette AR, Eriksson EA, Cohen MJ, Western Trauma Association Multicenter Study G (2019) The why and how our trauma patients die: a prospective Multicenter West- ern Trauma Association study. J Trauma Acute Care Surg 86:864–870. https://doi.org/10.1097/TA.0000000000002205
4. McLintock C (2020) Prevention and treatment of postpartum hemor- rhage: focus on hematological aspects of management. Hematol Am Soc Hematol Educ Progr 2020:542–546. https://doi.org/10.1182/hemat ology.2020000139
5. Raza I, Davenport R, Rourke C, Platton S, Manson J, Spoors C, Khan S, De’Ath HD, Allard S, Hart DP, Pasi KJ, Hunt BJ, Stanworth S, MacCallum PK, Brohi K (2013) The incidence and magnitude of fibrinolytic activa- tion in trauma patients. J Thromb Haemost 11:307–314. https://doi.org/ 10.1111/jth.12078
6. Moore HB, Moore EE, Morton AP, Gonzalez E, Fragoso M, Chapman MP, Dzieciatkowska M, Hansen KC, Banerjee A, Sauaia A, Silliman CC (2015) Shock-induced systemic hyperfibrinolysis is attenuated by plasma-first resuscitation. J Trauma Acute Care Surg 79:897–903. https://doi.org/10.1097/TA.0000000000000792
7. Gando S, Levi M, Toh CH (2016) Disseminated intravascular coagulation. Nat Rev Dis Primers 2:16037. https://doi.org/10.1038/nrdp.2016.37
8. Zhang Q, Raoof M, Chen Y, Sumi Y, Sursal T, Junger W, Brohi K, Itagaki K, Hauser CJ (2010) Circulating mitochondrial DAMPs cause inflammatory responses to injury. Nature 464:104–107. https://doi.org/10.1038/natur e08780
9. Vulliamy P, Kornblith LZ, Kutcher ME, Cohen MJ, Brohi K, Neal MD (2021) Alterations in platelet behavior after major trauma: adaptive or mala- daptive? Platelets 32:295–304. https://doi.org/10.1080/09537104.2020. 1718633
10. Kutcher ME, Redick BJ, McCreery RC, Crane IM, Greenberg MD, Cachola LM, Nelson MF, Cohen MJ (2012) Characterization of platelet dysfunc- tion after trauma. J Trauma Acute Care Surg 73:13–19. https://doi.org/ 10.1097/TA.0b013e318256deab
11. Starr NE, Matthay ZA, Fields AT, Nunez-Garcia B, Callcut RA, Cohen MJ, Kornblith LZ (2020) Identification of injury and shock driven effects on ex vivo platelet aggregometry: a cautionary tale of phenotyping. J Trauma Acute Care Surg 89:20–28. https://doi.org/10.1097/TA.0000000000002707
12. Zhang J, Zhang F, Dong JF (2018) Coagulopathy induced by traumatic brain injury: systemic manifestation of a localized injury. Blood 131:2001–2006. https://doi.org/10.1182/blood-2017-11-784108
13. Erez O (2017) Disseminated intravascular coagulation in pregnancy: clinical phenotypes and diagnostic scores. Thromb Res 151(Suppl 1):S56–S60. https://doi.org/10.1016/S0049-3848(17)30069-5
14. Kashuk JL, Moore EE, Millikan JS, Moore JB (1982) Major abdominal vascular trauma–a unified approach. J Trauma 22:672–679. https://doi. org/10.1097/00005373-198208000-00004
15. Moore HB, Tessmer MT, Moore EE, Sperry JL, Cohen MJ, Chapman MP, Pusateri AE, Guyette FX, Brown JB, Neal MD, Zuckerbraun B, Sauaia A (2020) Forgot calcium? Admission ionized-calcium in two civilian rand- omized controlled trials of prehospital plasma for traumatic hemor- rhagic shock. J Trauma Acute Care Surg 88:588–596. https://doi.org/10. 1097/TA.0000000000002614
16. Ditzel RM Jr, Anderson JL, Eisenhart WJ, Rankin CJ, DeFeo DR, Oak S, Siegler J (2020) A review of transfusion- and trauma-induced hypoc- alcemia: Is it time to change the lethal triad to the lethal diamond? J Trauma Acute Care Surg 88:434–439. https://doi.org/10.1097/TA.0000000000002570
17. Morton AP, Moore EE, Wohlauer MV, Lo K, Silliman CC, Burlew CC, Baner- jee A (2013) Revisiting early postinjury mortality: are they bleeding because they are dying or dying because they are bleeding? J Surg Res 179:5–9. https://doi.org/10.1016/j.jss.2012.05.054
18. Mitrophanov AY, Szlam F, Sniecinski RM, Levy JH, Reifman J (2020) Con- trolled multifactorial coagulopathy: effects of dilution, hypothermia, and acidosis on thrombin generation in vitro. Anesth Analg 130:1063– 1076. https://doi.org/10.1213/ANE.0000000000004479
19. Moore HB, Moore EE, Gonzalez E, Chapman MP, Chin TL, Silliman CC, Banerjee A, Sauaia A (2014) Hyperfibrinolysis, physiologic fibrinolysis, and fibrinolysis shutdown: the spectrum of postinjury fibrinolysis and relevance to antifibrinolytic therapy. J Trauma Acute Care Surg 77:811–817. https://doi.org/10.1097/TA.0000000000000341
20. Zipperle J, Altenburger K, Ponschab M, Schlimp CJ, Spittler A, Bahrami S, Redl H, Schochl H (2017) Potential role of platelet-leukocyte aggrega- tion in trauma-induced coagulopathy: ex vivo findings. J Trauma Acute Care Surg 82:921–926. https://doi.org/10.1097/TA.0000000000001410
21. Barrett CD, Moore HB, Banerjee A, Silliman CC, Moore EE, Yaffe MB (2017) Human neutrophil elastase mediates fibrinolysis shutdown through competitive degradation of plasminogen and generation of angiostatin. J Trauma Acute Care Surg 83:1053–1061. https://doi.org/10.1097/TA.0000000000001685
22. Wang TF, Makar RS, Antic D, Levy JH, Douketis JD, Connors JM, Carrier M, Zwicker JI (2020) Management of hemostatic complications in acute leukemia: guidance from the SSC of the ISTH. J Thromb Haemost 18:3174–3183. https://doi.org/10.1111/jth.15074
23. Ten Cate H, Leader A (2021) Management of disseminated intravascular coagulation in acute leukemias. Hamostaseologie 41:120–126. https:// doi.org/10.1055/a-1393-8302
24. Sanz MA, Montesinos P (2020) Advances in the management of coagulopathy in acute promyelocytic leukemia. Thromb Res 191(Suppl 1):S63–S67. https://doi.org/10.1016/S0049-3848(20)30399-6
25. Mitrovic M, Suvajdzic N, Elezovic I, Bogdanovic A, Djordjevic V, Miljic P, Djunic I, Gvozdenov M, Colovic N, Virijevic M, Lekovic D, Vidovic A, Tomin D (2015) Thrombotic events in acute promyelocytic leukemia.
Thromb Res 135:588–593. https://doi.org/10.1016/j.thromres.2014.11. 026
26. Stein E, McMahon B, Kwaan H, Altman JK, Frankfurt O, Tallman MS (2009) The coagulopathy of acute promyelocytic leukaemia revisited. Best Pract Res Clin Haematol 22:153–163. https://doi.org/10.1016/j. beha.2008.12.007
27. Bennett B, Booth NA, Croll A, Dawson AA (1989) The bleeding disorder in acute promyelocytic leukaemia: fibrinolysis due to u-PA rather than defibrination. Br J Haematol 71:511–517. https://doi.org/10.1111/j.1365- 2141.1989.tb06311.x
28. Graf M, Reif S, Hecht K, Pelka-Fleischer R, Pfister K, Schmetzer H (2005) High expression of urokinase plasminogen activator receptor (UPA-R) in acute myeloid leukemia (AML) is associated with worse prognosis. Am J Hematol 79:26–35. https://doi.org/10.1002/ajh.20337
29. Wang P, Zhang Y, Yang H, Hou W, Jin B, Hou J, Li H, Zhao H, Zhou J (2018) Characteristics of fibrinolytic disorders in acute promyelocytic leukemia. Hematology 23:756–764. https://doi.org/10.1080/10245332. 2018.1470069
30. Kwaan HC, Weiss I, Tallman MS (2019) The role of abnormal hemostasis and fibrinolysis in morbidity and mortality of acute promyelocytic leu- kemia. Semin Thromb Hemost 45:612–621. https://doi.org/10.1055/s- 0039-1693478
31. Bonlokke ST, Ommen HB, Hvas AM (2021) Altered fibrinolysis in hema- tological malignances. Semin Thromb Hemost 47:569–580. https://doi. org/10.1055/s-0041-1725099
32. Boisrame-Helms J, Kremer H, Schini-Kerth V, Meziani F (2013) Endothe- lial dysfunction in sepsis. Curr Vasc Pharmacol 11:150–160
33. Fourrier F (2012) Severe sepsis, coagulation, and fibrinolysis: dead end or one way? Crit Care Med 40:2704–2708. https://doi.org/10.1097/CCM. 0b013e318258ff30
34. Lane DA, Philippou H, Huntington JA (2005) Directing thrombin. Blood 106:2605–2612. https://doi.org/10.1182/blood-2005-04-1710
35. van der Poll T, Herwald H (2014) The coagulation system and its func- tion in early immune defense. Thromb Haemost. https://doi.org/10. 1160/TH14-01-0053
36. Delabranche X, Helms J, Meziani F (2017) Immunohaemostasis: a new view on haemostasis during sepsis. Ann Intensive Care 7:117. https:// doi.org/10.1186/s13613-017-0339-5
37. Levi M (2010) The coagulant response in sepsis and inflammation. Hamostaseologie 30:10–16
38. Pfeiler S, Massberg S, Engelmann B (2014) Biological basis and patho- logical relevance of microvascular thrombosis. Thromb Res 133(Suppl 1):S35-37. https://doi.org/10.1016/j.thromres.2014.03.016
39. Gould TJ, Lysov Z, Liaw PC (2015) Extracellular DNA and histones: double-edged swords in immunothrombosis. J Thromb Haemost 13(Suppl 1):S82-91. https://doi.org/10.1111/jth.12977
40. Yang H, Biermann MH, Brauner JM, Liu Y, Zhao Y, Herrmann M (2016) New insights into neutrophil extracellular traps: mechanisms of forma- tion and role in inflammation. Front Immunol 7:302. https://doi.org/10. 3389/fimmu.2016.00302
41. Stiel L, Meziani F, Helms J (2018) Neutrophil activation during septic shock. Shock 49:371–384. https://doi.org/10.1097/SHK.0000000000 000980
42. Brinkmann V, Reichard U, Goosmann C, Fauler B, Uhlemann Y, Weiss DS, Weinrauch Y, Zychlinsky A (2004) Neutrophil extracellular traps kill bac- teria. Science 303:1532–1535. https://doi.org/10.1126/science.1092385
43. Yipp BG, Kubes P (2013) NETosis: how vital is it? Blood 122:2784–2794. https://doi.org/10.1182/blood-2013-04-457671
44. Meziani F, Delabranche X, Asfar P, Toti F (2010) Bench-to-bedside review: circulating microparticles–a new player in sepsis? Crit Care 14:236. https://doi.org/10.1186/cc9231
45. Mortaza S, Martinez MC, Baron-Menguy C, Burban M, de la Bourdon- naye M, Fizanne L, Pierrot M, Cales P, Henrion D, Andriantsitohaina R, Mercat A, Asfar P, Meziani F (2009) Detrimental hemodynamic and inflammatory effects of microparticles originating from septic rats. Crit Care Med37:2045–2050. https://doi.org/10.1097/CCM.0b013e3181 a00629
46. Lacroix R, Plawinski L, Robert S, Doeuvre L, Sabatier F, Martinez de Lizarrondo S, Mezzapesa A, Anfosso F, Leroyer AS, Poullin P, Jourde N, Njock MS, Boulanger CM, Angles-Cano E, Dignat-George F (2012)
Leukocyte- and endothelial-derived microparticles: a circulating source for fibrinolysis. Haematologica 97:1864–1872. https://doi.org/10.3324/ haematol.2012.066167
47. Engelmann B, Massberg S (2013) Thrombosis as an intravascular effec- tor of innate immunity. Nat Rev Immunol 13:34–45. https://doi.org/10. 1038/nri3345
48. Massberg S, Grahl L, von Bruehl ML, Manukyan D, Pfeiler S, Goosmann C, Brinkmann V, Lorenz M, Bidzhekov K, Khandagale AB, Konrad I, Ken- nerknecht E, Reges K, Holdenrieder S, Braun S, Reinhardt C, Spannagl M, Preissner KT, Engelmann B (2010) Reciprocal coupling of coagula- tion and innate immunity via neutrophil serine proteases. Nat Med 16:887–896. https://doi.org/10.1038/nm.2184
49. Levi M (2019) Disseminated intravascular coagulation in cancer: an update. Semin Thromb Hemost 45:342–347. https://doi.org/10.1055/s- 0039-1687890
50. Leiva O, Newcomb R, Connors JM, Al-Samkari H (2020) Cancer and thrombosis: new insights to an old problem. J Med Vasc 45:6S8-6S16. https://doi.org/10.1016/S2542-4513(20)30514-9
51. Levi M, Sivapalaratnam S (2020) An overview of thrombotic complica- tions of old and new anticancer drugs. Thromb Res 191(Suppl 1):S17– S21. https://doi.org/10.1016/S0049-3848(20)30391-1
52. Rickles FR, Brenner B (2008) Tissue factor and cancer. Semin Thromb Hemost 34:143–145. https://doi.org/10.1055/s-2008-1079253
53. Falanga A, Marchetti M, Vignoli A (2013) Coagulation and cancer: biological and clinical aspects. J Thromb Haemost 11:223–233. https:// doi.org/10.1111/jth.12075
54. Kwaan HC, McMahon B (2009) The role of plasminogen-plasmin system in cancer. Cancer Treat Res 148:43–66. https://doi.org/10.1007/ 978-0-387-79962-9_4
55. Sallah S, Wan JY, Nguyen NP, Hanrahan LR, Sigounas G (2001) Dissemi- nated intravascular coagulation in solid tumors: clinical and pathologic study. Thromb Haemost 86:828–833
56. Weng J, Chen M, Fang D, Liu D, Guo R, Yang S (2021) Therapeutic Plasma exchange protects patients with sepsis-associated dissemi- nated intravascular coagulation by improving endothelial function. Clin Appl Thromb Hemost 27:10760296211053312. https://doi.org/10.1177/10760296211053313
57. El-Nawawy AA, Elshinawy MI, Khater DM, Moustafa AA, Hassanein NM, Wali YA, Nazir HF (2021) Outcome of early hemostatic intervention in children with sepsis and nonovert disseminated intravascular coagula- tion admitted to PICU: a randomized controlled trial. Pediatr Crit Care Med 22:e168–e177. https://doi.org/10.1097/PCC.0000000000002578
58. Stahl K, Schmidt JJ, Seeliger B, Schmidt BMW, Welte T, Haller H, Hoeper MM, Budde U, Bode C, David S (2020) Effect of therapeutic plasma exchange on endothelial activation and coagulation-related parameters in septic shock. Crit Care 24:71. https://doi.org/10.1186/ s13054-020-2799-5
59. Vincent JL, Francois B, Zabolotskikh I, Daga MK, Lascarrou JB, Kirov MY, Pettila V, Wittebole X, Meziani F, Mercier E, Lobo SM, Barie PS, Crowther M, Esmon CT, Fareed J, Gando S, Gorelick KJ, Levi M, Mira JP, Opal SM, Parrillo J, Russell JA, Saito H, Tsuruta K, Sakai T, Fineberg D, Group ST (2019) Effect of a recombinant human soluble thrombomodulin on mortality in patients with sepsis-associated coagulopathy: the SCARLET randomized clinical trial. JAMA 321:1993–2002. https://doi.org/10.1001/ jama.2019.5358
60. Levi M, Vincent JL, Tanaka K, Radford AH, Kayanoki T, Fineberg DA, Hop- pensteadt D, Fareed J (2020) Effect of a recombinant human soluble thrombomodulin on baseline coagulation biomarker levels and mortal- ity outcome in patients with sepsis-associated coagulopathy. Crit Care Med 48:1140–1147. https://doi.org/10.1097/CCM.0000000000004426
61. François B, Fiancette M, Helms J, Mercier E, Lascarrou JB, Kayanoki T, Tanaka K, Fineberg D, Vincent JL, Wittebole X (2021) Efficacy and safety of human soluble thrombomodulin (ART-123) for treatment of patients in France with sepsis-associated coagulopathy: post hoc analysis of SCARLET. Ann Intensive Care 11:53. https://doi.org/10.1186/ s13613-021-00842-4
62. Hayakawa M, Katabami K, Wada T, Sugano M, Hoshino H, Sawamura A, Gando S (2010) Sivelestat (selective neutrophil elastase inhibitor) improves the mortality rate of sepsis associated with both acute res-
piratory distress syndrome and disseminated intravascular coagulation patients. Shock 33:14–18. https://doi.org/10.1097/SHK.0b013e3181 aa95c4
63. Hazelton JP, Ssentongo AE, Oh JS, Ssentongo P, Seamon MJ, Byrne JP, Armento IG, Jenkins DH, Braverman MA, Mentzer C, Leonard GC, Perea LL, Docherty CK, Dunn JA, Smoot B, Martin MJ, Badiee J, Luis AJ, Murray JL, Noorbakhsh MR, Babowice JE, Mains C, Madayag RM, Kaafarani HMA, Mokhtari AK, Moore SA, Madden K, Tanner A 2nd, Redmond D, Millia
DJ, Brandolino A, Nguyen U, Chinchilli V, Armen SB, Porter JM (2022) Use of cold-stored whole blood is associated with improved mortality in hemostatic resuscitation of major bleeding: a multicenter study. Ann Surg 276:579–588. https://doi.org/10.1097/SLA.0000000000005603
64. Crombie N, Doughty HA, Bishop JRB, Desai A, Dixon EF, Hancox JM, Herbert MJ, Leech C, Lewis SJ, Nash MR, Naumann DN, Slinn G, Smith H, Smith IM, Wale RK, Wilson A, Ives N, Perkins GD, Pcg Re (2022) Resuscita- tion with blood products in patients with trauma-related haemorrhagic shock receiving prehospital care (RePHILL): a multicentre, open-label, randomised, controlled, phase 3 trial. Lancet Haematol 9:e250–e261. https://doi.org/10.1016/S2352-3026(22)00040-0
65. Moore HB, Moore EE, Chapman MP, McVaney K, Bryskiewicz G, Blechar R, Chin T, Burlew CC, Pieracci F, West FB, Fleming CD, Ghasabyan
A, Chandler J, Silliman CC, Banerjee A, Sauaia A (2018) Plasma-first resuscitation to treat haemorrhagic shock during emergency ground transportation in an urban area: a randomised trial. Lancet 392:283–291. https://doi.org/10.1016/S0140-6736(18)31553-8
66. Sperry JL, Guyette FX, Brown JB, Yazer MH, Triulzi DJ, Early-Young BJ, Adams PW, Daley BJ, Miller RS, Harbrecht BG, Claridge JA, Phelan HA, Witham WR, Putnam AT, Duane TM, Alarcon LH, Callaway CW, Zuck- erbraun BS, Neal MD, Rosengart MR, Forsythe RM, Billiar TR, Yealy DM, Peitzman AB, Zenati MS, Group PAS (2018) Prehospital plasma during air medical transport in trauma patients at risk for hemorrhagic shock. N Engl J Med 379:315–326. https://doi.org/10.1056/NEJMoa1802345
67. Holcomb JB, Tilley BC, Baraniuk S, Fox EE, Wade CE, Podbielski JM, del Junco DJ, Brasel KJ, Bulger EM, Callcut RA, Cohen MJ, Cotton BA, Fabian TC, Inaba K, Kerby JD, Muskat P, O’Keeffe T, Rizoli S, Robinson BR, Scalea TM, Schreiber MA, Stein DM, Weinberg JA, Callum JL, Hess JR, Matijevic N, Miller CN, Pittet JF, Hoyt DB, Pearson GD, Leroux B, van Belle G, Group PS (2015) Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: the PROPPR randomized clinical trial. JAMA 313:471–482. https://doi.org/ 10.1001/jama.2015.12
68. Collaborators WT (2017) Effect of early tranexamic acid administration on mortality, hysterectomy, and other morbidities in women with post-partum haemorrhage (WOMAN): an international, randomised, double-blind, placebo-controlled trial. Lancet 389:2105–2116. https://doi.org/10.1016/S0140-6736(17)30638-4
69. Collaborators C-T, Shakur H, Roberts I, Bautista R, Caballero J, Coats T, Dewan Y, El-Sayed H, Gogichaishvili T, Gupta S, Herrera J, Hunt B, Irib- hogbe P, Izurieta M, Khamis H, Komolafe E, Marrero MA, Mejia-Mantilla J, Miranda J, Morales C, Olaomi O, Olldashi F, Perel P, Peto R, Ramana PV, Ravi RR, Yutthakasemsunt S (2010) Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-con- trolled trial. Lancet 376:23–32. https://doi.org/10.1016/S0140-6736(10)60835-5
70. Estcourt LJ, McQuilten Z, Powter G, Dyer C, Curnow E, Wood EM, Stanworth SJ, Collaboration TT (2019) The TREATT Trial (TRial to EvaluAte Tranexamic acid therapy in Thrombocytopenia): safety and efficacy of tranexamic acid in patients with haematological malignan- cies with severe thrombocytopenia: study protocol for a double-blind randomised controlled trial. Trials 20:592. https://doi.org/10.1186/ s13063-019-3663-2
71. Saito H, Maruyama I, Shimazaki S, Yamamoto Y, Aikawa N, Ohno R, Hirayama A, Matsuda T, Asakura H, Nakashima M, Aoki N (2007) Efficacy and safety of recombinant human soluble thrombomodulin (ART-123) in disseminated intravascular coagulation: results of a phase III, rand- omized, double-blind clinical trial. J Thromb Haemost 5:31–41. https:// doi.org/10.1111/j.1538-7836.2006.02267.x
72. Taniguchi K, Ohbe H, Yamakawa K, Matsui H, Fushimi K, Yasunaga H (2021) Recombinant thrombomodulin in disseminated intravascular coagulation associated with stage IV solid tumors: a nationwide obser- vational study in Japan. Thromb Haemost 121:36–45. https://doi.org/10. 1055/s-0040-1715840
73. Taniguchi K, Ohbe H, Yamakawa K, Matsui H, Fushimi K, Yasunaga H (2020) Antithrombin use and mortality in patients with stage IV solid tumor-associated disseminated intravascular coagulation: a nationwide observational study in Japan. BMC Cancer 20:867. https://doi.org/10.1186/s12885-020-07375-2
74. Bianchini EP, Razanakolona M, Helms J, Zouiti F, Couteau-Chardon A, Marin-Esteban V, Chaisemartin L, De-Carvalho A, Bironien R, Chollet- Martin S, Denis CV, Diehl JL, Vasse M, Meziani F, Borgel D (2021) The proteolytic inactivation of protein z-dependent protease inhibitor by neutrophil elastase might promote the procoagulant activity of neutro- phil extracellular traps in sepsis. Thromb Haemost. https://doi.org/10. 1055/a-1530-3980
75. Clere-Jehl R, Merdji H, Kassem M, Macquin C, De Cauwer A, Sibony A, Kurihara K, Minniti L, Abou Fayçal C, Bahram S, Meziani F, Helms J, Georgel P (2021) A translational investigation of IFN-α and STAT1
signaling in endothelial cells during septic shock provides therapeutic perspectives. Am J Respir Cell Mol Biol 65:167–175. https://doi.org/10. 1165/rcmb.2020-0401OC
76. Stiel L, Mayeur-Rousse C, Helms J, Meziani F, Mauvieux L (2019) First visualization of circulating neutrophil extracellular traps using cell fluorescence during human septic shock-induced disseminated intravascular coagulation. Thromb Res 183:153–158. https://doi.org/10.1016/j.thromres.2019.09.036
77. Barbosa da Cruz D, Helms J, Aquino LR, Stiel L, Cougourdan L, Broussard C, Chafey P, Riès-Kautt M, Meziani F, Toti F, Gaussem P, Anglés-Cano E (2019) DNA-bound elastase of neutrophil extracellular traps degrades plasminogen, reduces plasmin formation, and decreases fibrinolysis: proof of concept in septic shock plasma. FASEB J 33:14270–14280. https://doi.org/10.1096/fj.201901363RRR
78. Helms J, Clere-Jehl R, Bianchini E, Le Borgne P, Burban M, Zobairi F, Diehl JL, Grunebaum L, Toti F, Meziani F, Borgel D (2017) Thrombomodulin favors leukocyte microvesicle fibrinolytic activity, reduces NETosis and prevents septic shock-induced coagulopathy in rats. Ann Intensive Care 7:118. https://doi.org/10.1186/s13613-017-0340-z
79. Delabranche X, Stiel L, Severac F, Galoisy AC, Mauvieux L, Zobairi F, Lavigne T, Toti F, Angles-Cano E, Meziani F, Boisrame-Helms J (2017) Evidence of netosis in septic shock-induced disseminated intravascular coagulation. Shock 47:313–317. https://doi.org/10.1097/SHK.0000000000000719
80. Stiel L, Delabranche X, Galoisy AC, Severac F, Toti F, Mauvieux L, Meziani F, Boisrame-Helms J (2016) Neutrophil fluorescence: a new indicator of cell activation during septic shock-induced disseminated intravascular coagulation. Crit Care Med 44:e1132–e1136. https://doi.org/10.1097/CCM.0000000000001851
81. Vlaar APJ (2022) Blood transfusion: the search for the sweet spot. Inten- sive Care Med. https://doi.org/10.1007/s00134-022-06799-7
82. Vlaar APJ, Dionne JC, de Bruin S, Wijnberge M, Raasveld SJ, van Baarle F, Antonelli M, Aubron C, Duranteau J, Juffermans NP, Meier J, Murphy GJ, Abbasciano R, Muller MCA, Lance M, Nielsen ND, Schochl H, Hunt BJ, Cecconi M, Oczkowski S (2021) Transfusion strategies in bleeding criti- cally ill adults: a clinical practice guideline from the European Society of Intensive Care Medicine. Intensive Care Med 47:1368–1392. https://doi. org/10.1007/s00134-021-06531-x
83. Levy JH (2010) Antifibrinolytic therapy: new data and new concepts. Lancet 376:3–4. https://doi.org/10.1016/S0140-6736(10)60939-7
84. Baksaas-Aasen K, Gall LS, Stensballe J, Juffermans NP, Curry N, Maegele M, Brooks A, Rourke C, Gillespie S, Murphy J, Maroni R, Vulliamy P, Hen- riksen HH, Pedersen KH, Kolstadbraaten KM, Wirtz MR, Kleinveld DJB, Schafer N, Chinna S, Davenport RA, Naess PA, Goslings JC, Eaglestone S, Stanworth S, Johansson PI, Gaarder C, Brohi K (2021) Viscoelastic hae- mostatic assay augmented protocols for major trauma haemorrhage (ITACTIC): a randomized, controlled trial. Intensive Care Med 47:49–59. https://doi.org/10.1007/s00134-020-06266-1
85. Li X, Ma X (2017) The role of heparin in sepsis: much more than just an anticoagulant. Br J Haematol 179:389–398. https://doi.org/10.1111/bjh. 14885
86. Helms J, Middeldorp S, Spyropoulos AC (2022) Thromboprophy- laxis in critical care. Intensive Care Med. https://doi.org/10.1007/ s00134-022-06850-7
87. Duranteau J, Taccone FS, Verhamme P, Ageno W, Force EVGT (2018) European guidelines on perioperative venous thromboembolism prophylaxis: intensive care. Eur J Anaesthesiol 35:142–146. https://doi. org/10.1097/EJA.0000000000000707
88. Schunemann HJ, Cushman M, Burnett AE, Kahn SR, Beyer-Westendorf J, Spencer FA, Rezende SM, Zakai NA, Bauer KA, Dentali F, Lansing J, Balduzzi S, Darzi A, Morgano GP, Neumann I, Nieuwlaat R, Yepes-Nunez JJ, Zhang Y, Wiercioch W (2018) American Society of Hematology 2018 guidelines for management of venous thromboembolism: prophylaxis for hospitalized and nonhospitalized medical patients. Blood Adv 2:3198–3225.https://doi.org/10.1182/bloodadvances.2018022954
89. Wang C, Chi C, Guo L, Wang X, Guo L, Sun J, Sun B, Liu S, Chang X, Li E (2014) Heparin therapy reduces 28-day mortality in adult severe
sepsis patients: a systematic review and meta-analysis. Crit Care 18:563. https://doi.org/10.1186/s13054-014-0563-4
90. Sakuragawa N, Hasegawa H, Maki M, Nakagawa M, Nakashima M (1993) Clinical evaluation of low-molecular-weight heparin (FR-860) on dis- seminated intravascular coagulation (DIC)–a multicenter co-operative double-blind trial in comparison with heparin. Thromb Res 72:475–500. https://doi.org/10.1016/0049-3848(93)90109-2
91. Fourrier F, Jourdain M, Tournois A, Caron C, Goudemand J, Chopin C (1995) Coagulation inhibitor substitution during sepsis. Intensive Care Med 21(2):S264-268
92. Giebler R, Schmidt U, Koch S, Peters J, Scherer R (1999) Combined antithrombin III and C1-esterase inhibitor treatment decreases intravas- cular fibrin deposition and attenuates cardiorespiratory impairment in rabbits exposed to Escherichia coli endotoxin. Crit Care Med 27:597–604
93. Allingstrup M, Wetterslev J, Ravn FB, Moller AM, Afshari A (2016) Antithrombin III for critically ill patients: a systematic review with meta- analysis and trial sequential analysis. Intensive Care Med 42:505–520. https://doi.org/10.1007/s00134-016-4225-7
94. Warren BL, Eid A, Singer P, Pillay SS, Carl P, Novak I, Chalupa P, Atherstone A, Penzes I, Kubler A, Knaub S, Keinecke HO, Heinrichs H, Schindel F, Juers M, Bone RC, Opal SM, KyberSept Trial Study G (2001) Caring for the critically ill patient. High-dose antithrombin III in severe sepsis: a randomized controlled trial. JAMA 286:1869–1878
95. Dhainaut JF, Laterre PF, Janes JM, Bernard GR, Artigas A, Bakker J, Riess H, Basson BR, Charpentier J, Utterback BG, Vincent JL, Recombinant Human Activated Protein CWEISSG (2003) Drotrecogin alfa (activated) in the treatment of severe sepsis patients with multiple-organ dysfunc- tion: data from the PROWESS trial. Intensive Care Med 29:894–903. https://doi.org/10.1007/s00134-003-1731-1
96. Levi M (2015) Recombinant soluble thrombomodulin: coagulation takes another chance to reduce sepsis mortality. J Thromb Haemost 13:505–507. https://doi.org/10.1111/jth.12868
97. Levi M, van der Poll T (2013) Endothelial injury in sepsis. Intensive Care Med 39:1839–1842. https://doi.org/10.1007/s00134-013-3054-1
98. Weiler H, Isermann BH (2003) Thrombomodulin. J Thromb Haemost 1:1515–1524. https://doi.org/10.1046/j.1538-7836.2003.00306.x
99. Ito T, Maruyama I (2011) Thrombomodulin: protectorate God of the vas- culature in thrombosis and inflammation. J Thromb Haemost 9(Suppl 1):168–173. https://doi.org/10.1111/j.1538-7836.2011.04319.x
100. Li YH, Kuo CH, Shi GY, Wu HL (2012) The role of thrombomodulin lectin- like domain in inflammation. J Biomed Sci 19:34. https://doi.org/10. 1186/1423-0127-19-34
101. Umemura Y, Yamakawa K (2016) Efficacy and safety of anticoagulant therapy in three specific populations with sepsis: a meta-analysis of randomized controlled trials: reply. J Thromb Haemost. https://doi.org/ 10.1111/jth.13473
102. Hsu C, Hutt E, Bloomfield DM, Gailani D, Weitz JI (2021) Factor XI inhibi- tion to uncouple thrombosis from hemostasis: JACC review topic of the week. J Am Coll Cardiol 78:625–631. https://doi.org/10.1016/j.jacc.2021. 06.010
103. Preis M, Hirsch J, Kotler A, Zoabi A, Stein N, Rennert G, Saliba W (2017) Factor XI deficiency is associated with lower risk for cardiovascular and venous thromboembolism events. Blood 129:1210–1215. https://doi. org/10.1182/blood-2016-09-742262
104. Gailani D, Gruber A (2016) Factor XI as a therapeutic target. Arterioscler Thromb Vasc Biol 36:1316–1322. https://doi.org/10.1161/ATVBAHA.116. 306925
105. Li T, Liu J, Wu W (2022) Factor XI, a potential target for anticoagulation therapy for venous thromboembolism. Front Cardiovasc Med 9:975767. https://doi.org/10.3389/fcvm.2022.975767
106. Fredenburgh JC, Weitz JI (2021) Factor XI as a target for new anti-coagulants.Hamostaseologie 41:104–110. https://doi.org/10. 1055/a-1384-3715
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 20.03.2024
[ACTIVE_FROM] => 20.03.2024
[SHOW_COUNTER] => 849
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829696
[VALUE] => Коагулопатия, критические состояния, интенсивная терапия
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Коагулопатия, критические состояния, интенсивная терапия
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829698
[VALUE] => Как лечить коагулопатии у пациентов в критическом состоянии
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Как лечить коагулопатии у пациентов в критическом состоянии
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829697
[VALUE] => Как лечить коагулопатии у пациентов в критическом состоянии
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Как лечить коагулопатии у пациентов в критическом состоянии
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830402
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829704
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829700
[1] => 829701
[2] => 829702
[3] => 829703
)
[VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => sepsis
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => sepsis
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830402
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829704
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829700
[1] => 829701
[2] => 829702
[3] => 829703
)
[VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => sepsis
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => sepsis
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Критические состояния
[2] => Интенсивная терапия
[3] => Сепсис
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 03.07.2025 10:45:52
[~TIMESTAMP_X] => 03.07.2025 10:45:52
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[FULLTEXT_INDEX] => N
[~FULLTEXT_INDEX] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Как лечить коагулопатии у пациентов в критическом состоянии
[BROWSER_TITLE] => Как лечить коагулопатии у пациентов в критическом состоянии
[KEYWORDS] => Коагулопатия, критические состояния, интенсивная терапия
[DESCRIPTION] => Как лечить коагулопатии у пациентов в критическом состоянии
)
)









