Array
(
[NAME] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
[~NAME] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
[PREVIEW_PICTURE] => Array
(
[ID] => 5636
[TIMESTAMP_X] => 11.11.2024 14:06:09
[MODULE_ID] => iblock
[HEIGHT] => 667
[WIDTH] => 1000
[FILE_SIZE] => 93908
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/6c6/zi3ilib2w07eh3ixengk927r2j70ivpi
[FILE_NAME] => portrait-friendly-doctor-isolated-gray.jpg
[ORIGINAL_NAME] => portrait-friendly-doctor-isolated-gray.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 7f9b14a798910e5339da85bbb304f1b2
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/6c6/zi3ilib2w07eh3ixengk927r2j70ivpi/portrait-friendly-doctor-isolated-gray.jpg
[UNSAFE_SRC] => /upload/iblock/6c6/zi3ilib2w07eh3ixengk927r2j70ivpi/portrait-friendly-doctor-isolated-gray.jpg
[SAFE_SRC] => /upload/iblock/6c6/zi3ilib2w07eh3ixengk927r2j70ivpi/portrait-friendly-doctor-isolated-gray.jpg
[ALT] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
[TITLE] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
)
[~PREVIEW_PICTURE] => 5636
[DETAIL_TEXT] =>
J Helms, H Merdji, S Loewert, F Severac, A Monnier, J Kaurin, A Curtiaud, F Meziani and J Demiselle
Disseminated intravascular coagulation is strongly associated with severe acute kidney injury in patients with septic shock
Annals of Intensive Care (2023) 13:119
doi.org/10.1186/s13613-023-01216-8
Абстракт
Диссеминированное внутрисосудистое свертывание (ДВС) ухудшает прогноз септического шока и способствует полиорганной недостаточности. На сегодняшний день нет данных, связывающих возникновение, тяжесть и развитие ДВС-синдрома и острого повреждения почек (ОПП) в этих условиях. Целью нашей работы было проанализировать связь между возникновением, тяжестью и развитием ОПП у пациентов с ДВС-синдромом, вызванным септическим шоком. В проспективном моноцентровом когортном исследовании участвовали последовательные пациенты в возрасте 18 лет и старше, поступившие в отделение интенсивной терапии Страсбургской университетской больницы с системной гипотензией, требующей применения вазопрессора, связанной с инфекцией, без терминальной стадии хронической болезни почек в анамнезе. ОПП определяли по классификации KDIGO. Диагностика ДВС-синдрома основывалась на шкале Международного общества тромбозов и гемостаза (ISTH). Эволюцию ОПП оценивали по комбинированной конечной точке, состоящей из основных неблагоприятных событий со стороны почек. Рассматривались только пациенты с ДВС-синдромом, возникшим до или во время диагностики ОПП. Для определения факторов, связанных с почечными исходами, был проведен одномерный и многомерный анализ.
В исследование было включено 350 пациентов, из которых у 129 развился ДВС-синдром. Пациенты с ДВС-синдромом были более тяжелыми (медиана SAPS II 64 против 56, р <0,001) и имели более высокую 28-дневную смертность (43,3% против 26,2%, р<0,001). ОПП чаще встречалось у пациентов с ДВС-синдромом (86,8% против 74,2%, p < 0,005), особенно на более тяжелой стадии ОПП [KDIGO 3 у 58,1% пациентов с ДВС-синдромом против 30,8% пациентов без ДВС-синдрома, p < 0,001, ОПП, требующее заместительной почечной терапии (ЗПТ), у 47,3% пациентов с ДВС-синдромом против 21,3% пациентов без ДВС-синдрома, p < 0,001]. После поправки на мешающие факторы возникновение ДВС-синдрома оставалось связанным с риском развития более тяжелой стадии ОПП с отношением шансов (ОШ) 2,74 [ИК 95% (1,53–4,91), р < 0,001] и с риском необходимости ЗПТ во время пребывания в ОИТ [ОШ 2,82 (1,53–5,2), p < 0,001].
ДВС-синдром, по-видимому, тесно связан с риском развития более тяжелой формы ОПП (3-я стадия классификации KDIGO, требование ЗПТ), даже после поправки на тяжесть и другие соответствующие факторы.
Ключевые слова: диссеминированное внутрисосудистое свертывание крови, сепсис, септический шок, острое повреждение почек, острая болезнь почек.
Введение
Острое повреждение почек (ОПП) в отделении интенсивной терапии (ОРИТ) связано с более высоким уровнем смертности, при этом существует тесная связь между тяжестью ОПП и смертностью [1, 2]. Сообщалось также, что ОПП связано с худшим долгосрочным исходом: пациенты, у которых возникло ОПП во время пребывания в ОИТ, подвергаются более высокому риску развития хронической болезни почек (ХБП) и серьезных сердечно-сосудистых событий [3,4]. Помимо общих факторов, связанных с ОПП в ОИТ, септический шок остается основным триггером ОПП [5]. Однако патофизиология ОПП, вызванного сепсисом, сложна и до сих пор плохо изучена. Хотя в нем, безусловно, участвуют такие факторы, как воспаление, окислительный стресс, микрососудистая дисфункция и ишемия канальцевых эпителиальных клеток [6, 7], диссеминированное внутрисосудистое свертывание (ДВС) также может способствовать развитию ОПП. ДВС-синдром возникает в результате чрезмерной активации коагуляции наряду с дефектом антикоагулянтной и фибринолитической регуляторных систем [8,9] и, таким образом, приводит к диссеминированному микротромбозу, что может способствовать органной дисфункции во время септического шока [10, 11]. Поскольку у 30–40% пациентов с септическим шоком развивается ДВС-синдром, что связано с тяжестью заболевания и увеличением смертности [12, 13], он может вносить значительный вклад в развитие ОПП. Однако лишь немногие исследования изучали связь между ДВС и ОПП. Было высказано предположение о более высокой частоте ОПП у пациентов с септическим шоком и ДВС-синдромом, но эта возможная связь не анализировалась с корректировкой вмешивающихся переменных, в основном тяжести заболевания [14, 15]. Таким образом, данное исследование было направлено на изучение связи между ДВС-синдромом и ОПП у пациентов с септическим шоком, уделяя особое внимание возникновению, тяжести и динамике развития ОПП.
Методы
Дизайн исследования
Проспективное когортное исследование проводилось в период с июля 2013 г. по март 2019 г. в ОИТ университетской больницы Страсбурга (Франция). Критериями включения были пациенты в возрасте 18 лет и старше, поступившие в ОИТ по поводу септического шока в соответствии с определением «Сепсис-2». Пациентов необходимо было включить в исследование в течение 12 часов после начала приема вазопрессоров. Пациенты в агональном состоянии на этапе скрининга, или пациенты с ограничением поддерживающей жизнь терапии при поступлении были исключены. Пациенты, находящиеся под правовой защитой (невозможность дать согласие, тюремное заключение…) были исключены. Пациенты, уже включенные в настоящее исследование, были исключены в случае повторной госпитализации, а пациенты, у которых развился шок позже во время пребывания в ОИТ, не подвергались скринингу. Кроме того, из исследования были исключены пациенты с терминальной хронической болезнью почек (5 стадия ХБП [16], находящиеся на заместительной почечной терапии или реципиенты трансплантата почки). Чтобы определить связь между ДВС-синдромом и ОПП и его тяжестью, были исключены пациенты, у которых ДВС-синдром был диагностирован после того, как ОПП достигло более высокой стадии.
Сбор данных
Проспективно записывались следующие данные: возраст, пол, индекс массы тела, сопутствующие заболевания и индекс Чарльсона [17]. Острое состояние характеризовалось: тяжестью по шкале SAPSII и SOFA [18, 19], гемодинамическими параметрами (среднее артериальное давление, диурез), источником инфекции, внутрибольничными или внебольничными инфекциями, а также собирались доступные микробиологические данные. Мы зарегистрировали все поддерживающие методы лечения, необходимые во время пребывания в ОИТ (ИВЛ, вазопрессоры, инфузионная терапия, заместительная почечная терапия (RRT)] и их продолжительность. Смертность оценивалась в конце пребывания в ОИТ и стационаре, а также на 28-й день.
Определения
• Частота и тяжесть ОПП определялись в соответствии с классификацией KDIGO [20]. Стадию 1 (KDIGO1) рассматривали, когда уровень креатинина в сыворотке крови увеличивался как минимум на 26 мкмоль/л или в 1,5–1,9 раза по сравнению с исходным уровнем или если диурез был ниже 0,5 мл/кг/ч в течение 6–12 часов. Стадия 2 (KDIGO2) - если креатинин сыворотки увеличивался более чем в два раза по сравнению с исходным уровнем или если диурез был менее 0,5 мл/кг/час в течение как минимум 12 часов. Стадия 3 (KDIGO 3) представляла собой наиболее тяжелую форму ОПП и определялась как повышение уровня креатинина в сыворотке крови более, чем в три раза по сравнению с исходным уровнем или был выше 354 мкмоль/л, либо необходимость ЗПТ или диурез ниже 0,3 мл/кг/ ч в течение как минимум 24 ч или анурия в течение как минимум 12 ч.
• Исходный уровень креатинина сыворотки: для каждого пациента, если таковой имеется, креатинин сыворотки перед госпитализацией учитывался в течение периода времени минимум 7 дней и максимум 1 года с момента госпитализации. В случае отсутствия данных, когда креатинин в сыворотке был повышен при поступлении, исходный уровень креатинина в сыворотке экстраполировали с использованием формулы MDRD [21], предполагая, что исходная расчетная скорость клубочковой фильтрации (СКФ) составляет 75 мл/мин/1,73 м2, как предложено в руководствах [20]. Пациентов относили к считали ХБП, когда исходная СКФ была ниже 60 мл/мин/1,73 м2.
Для описания развития ОПП мы собрали, насколько это возможно, критерии острого заболевания почек, которое определялось как персистирующее ОПП (стадия 1 или выше по классификации KDIGO) в течение более 7 дней. Кроме того, в конце пребывания в больнице для каждого пациента были собраны критерии комбинированной конечной точки для серьезного нежелательного явления со стороны почек (MAKE) в конце госпитализации. MAKE определялся как комбинированный критерий смерти, потребности в ЗПТ или ухудшения функции почек (двукратное увеличение уровня креатинина в сыворотке крови по сравнению с исходным уровнем) в конце периода госпитализации [22].
• Диагностика ДВС-синдрома основывалась на шкале Международного общества по тромбозам и гемостазу (ISTH) [23], и, соответственно, балл, превышающий или равный 5, был сохранен для диагностики ДВС-синдрома. Биологические тесты для диагностики ДВС-синдрома проводились при поступлении в ОИТ и ежедневно до 7-го дня.
• Нефротоксичные препараты: все потенциально нефротоксичные препараты, назначаемые до поступления в ОИТ и до возникновения ОПП во время пребывания в ОИТ, из заранее определенного списка, основанного на предыдущей работе [24], были идентифицированы в карте пациента (см. Additional file 1).
Этические проблемы
Дизайн исследования был одобрен этическим комитетом Страсбурга (Comite de Protection des Personnes N° 12/35, DC-2012-1633). Перед включением,от всех пациентов было получено письменное информированное согласие. Если пациенты не могли дать информированное согласие, оно было получено от их ближайших родственников или другого лица, замещающего лицо, принимающее решения, в зависимости от обстоятельств. У этих пациентов согласие post hoc было получено как можно скорее.
Статистика
Количественные данные выражались как среднее значение, стандартное отклонение, медиана и межквартильный размах (IQR) для параметрического и непараметрического распределения соответственно и сравнивались с использованием t-критерия Стьюдента или ранговой суммы Вилкоксона при необходимости. Качественные переменные сравнивали с использованием χ2 или точного критерия Фишера. Для выявления факторов, связанных с возникновением, тяжестью и развитием ОПП (критерии MAKE в конце пребывания в стационаре), таких как отношения шансов, были использованы модели логистической регрессии. На первом этапе одномерный анализ проводился для каждой исходной характеристической переменной независимо друг от друга. На втором этапе были построены многомерные модели с использованием переменных, имеющих клиническую значимость и/или со значением p <0,2 в одномерном анализе. Если некоторые ковариаты сильно коррелировали между собой, в многомерную модель включался наиболее связанный. Некоторые непрерывные переменные (норадреналин и введение жидкости) были преобразованы в качественные переменные в соответствии с клинически значимыми значениями. Поскольку частота и тяжесть ОПП в ОИТ влияет на смертность и продолжительность пребывания в ОИТ, мы провели анализ выживаемости в ОИТ без возникновения ОПП 3-й стадии у пациентов с ДВС-синдромом и без него (диагноз ДВС считался исходным) в течение первых 7 дней. Выживаемость без ОПП 3-й стадии оценивалась по методу Каплана-Мейера и сравнивалась между двумя группами с использованием лог-рангового теста.
Результаты
Из 437 пациентов исходной группы 350 пациентов соответствовали критериям участия и были включены в исследование. Причины исключения пациентов представлены на схеме (Fig. 1). Исходные характеристики представлены в Table 1. Включенные пациенты были преимущественно мужчинами, средний возраст 69 лет. Пациенты были в тяжелом состоянии, медиана SAPS II составляла 58 (48–73) баллов. Заболевания сердечно-сосудистой системы были наиболее частой сопутствующей патологией. Исходный уровень креатинина сыворотки был недоступен у 106 пациентов (30,3%) и был экстраполирован с помощью расчета по уравнению MDRD как запланировано в дизайне исследования. Инфекции, вызывающие септический шок, были в основном внебольничными.

Всем пациентам потребовалась вазопрессорная терапия с норэпинефрином в качестве первого препарата, а большинству из них (n = 306, 87,4%) потребовалась искусственная вентиляция легких. Среди 350 включенных пациентов у 129 развился ДВС-синдром, а у 221 - нет. ДВС-синдром возник в первый день у 92 пациентов, во второй день у 22 пациентов, в третий день у 7 и между 4 и 7 днями у 8 пациентов. Коагуляционные тесты при поступлении и при диагностике ДВС-синдрома представлены в Additional file 2: Table S1. У пациентов с ДВС-синдромом не было другой причины его развития , кроме сепсиса. Состояние пациентов с ДВС-синдромом было более тяжелым. Как показано в Table 1, хотя у пациентов с ДВС-синдромом было меньше сопутствующих заболеваний, их баллы тяжести (SOFA и SAPSII) при поступлении в ОИТ были выше. Между пациентами с ДВС-синдромом и без него не было различий по источнику инфекции, внебольничному или нозокомиальному характеру инфекции и микробиологическим данным. Вследствие более высокой степени тяжести пациентам с ДВС-синдромом требовались более высокие дозы норадреналина и более частая инвазивная искусственная вентиляция легких. Среди 129 пациентов с ДВС-синдромом 11 страдали циррозом печени, из них 6 соответствовали критериям ISTH для ДВС-синдрома без компонента протромбинового времени. У остальных пяти пациентов в качестве дополнительного критерия учитывалось снижение количества тромбоцитов не менее, чем на 30% с течением времени [25]. Аналогичным образом, у пациентов, получавших пероральные антикоагулянты с антагонистами витамина К, диагноз ДВС-синдрома сохранялся только в том случае, если они соответствовали критериям ISTH без компонента протромбинового времени и положительному баллу JAAM 2016.
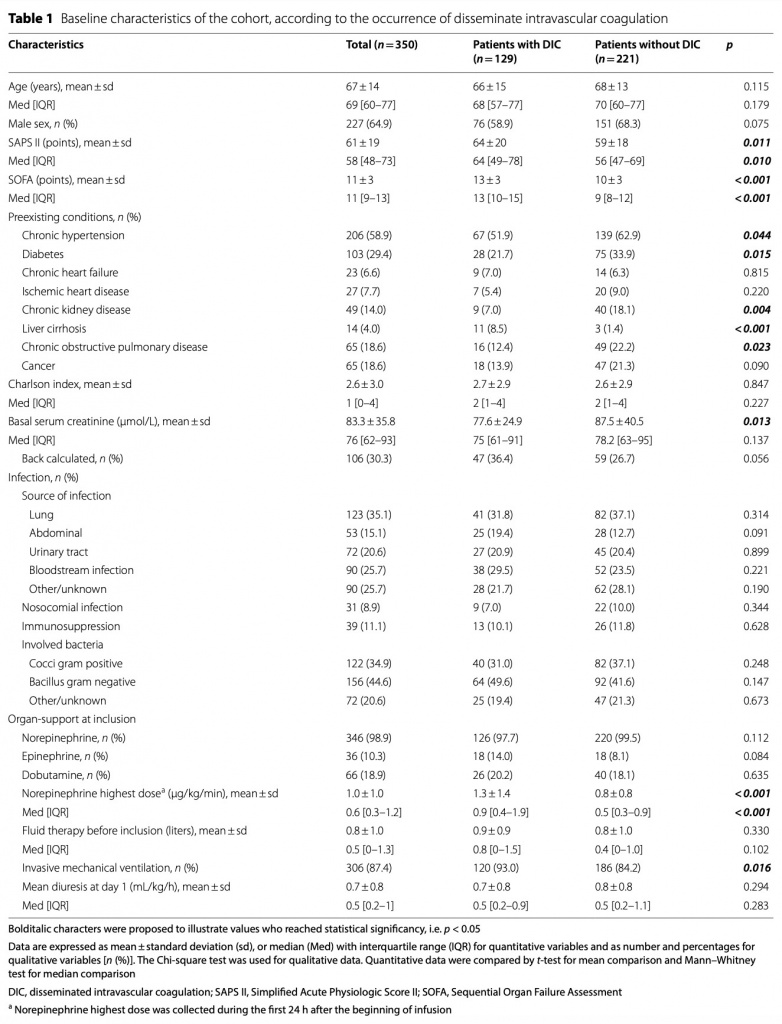
У пациентов с ДВС-синдромом наблюдались более высокие показатели смертности и частота ОПП.
У пациентов с ДВС-синдромом уровень смертности был выше, чем у пациентов без ДВС-синдрома (43,3% против 26,2% соответственно, p < 0,01 для смертности в ОИТ). ОПП возникло у 276 больных (78,9%). У 256 пациентов ОПП началось в течение первых 24 ч после поступления в ОИТ и достигло высшей стадии в 1-й день у 185 пациентов, на 2-й день у 62 пациентов, на 3-й день у 13 пациентов и между 4-м и 7-м днями у остальных 16 пациентов. ОПП чаще встречалось у пациентов с ДВС-синдромом: 112 (86,8%) против 164 (74,2%) у пациентов без ДВС-синдрома (p = 0,005) (см. Fig. 2 and Additional file 3: Fig. S1a ). ОПП и ДВС-синдром возникли в один и тот же день у 95 из 112 пациентов.
У пациентов с ДВС-синдромом чаще развивалось тяжелое ОПП и они соответствовали критериям MAKE.
У пациентов с ДВС-синдромом чаще развивалось тяжелое ОПП, достигающее 3-й стадии по классификации KDIGO у 73/129 пациентов с ДВС-синдромом (58,1%) против 68/221 пациентов без ДВС-синдрома (30,8%) соответственно (p <0,001) (see Fig. 2 and Additional file 3: Fig. S1b ). ОПП 3 стадии и ДВС-синдром возникли в один и тот же день у 57 из 73 пациентов.
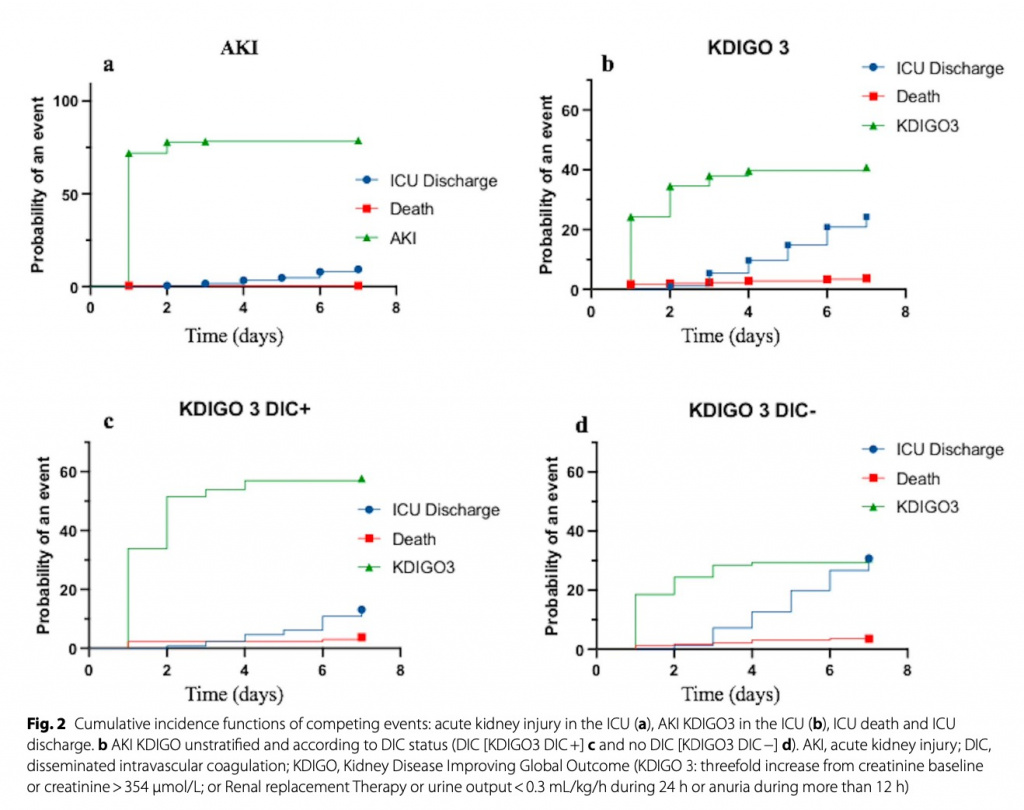
Среди пациентов с ОПП 3 стадии 108 потребовалась ЗПТ во время пребывания в ОИТ (61 из 129 пациентов с ДВС-синдромом (47,3%) против 47 из 221 пациентов без ДВС-синдрома (21,3%), p < 0,001). Мы обнаружили, что чем выше балл ISTH, тем выше доля пациентов с ОПП 3 стадии (p < 0,001) (Fig. 3). Связь между показателем ISTH и другими Результаты представлены в Additional file 2: Table S2.
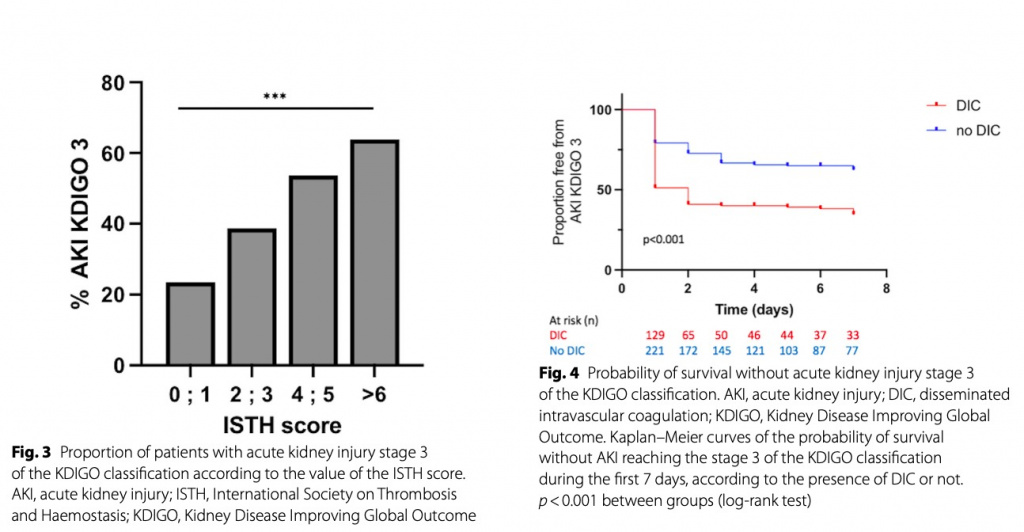
Анализ кривой Каплана-Мейера, оценивающий вероятность развития ОПП 3-й стадии по классификации KDIGO, показал более высокий риск для пациентов с ДВС-синдромом по сравнению с пациентами без ДВС-синдрома, демонстрируя отношение рисков 2,05 (1,48-2,85), p < 0,001 (log-rank test) (Fig. 4) (данные цензурированы по смертям и переводам из ОИТ). ОПП была оценена у 236 пациентов, поскольку те, кто умер до 7-го дня после госпитализации, не подходили для этой оценки. Среди пациентов с доступной оценкой функции почек после 7-го дня у 74 развилась ОПП (31,4%), из них у 34 был ДВС-синдром, а у 40 не было ДВС [34/75 (45,3%) против 40/161 (24,8%), p = 0,002 χ2 тест].
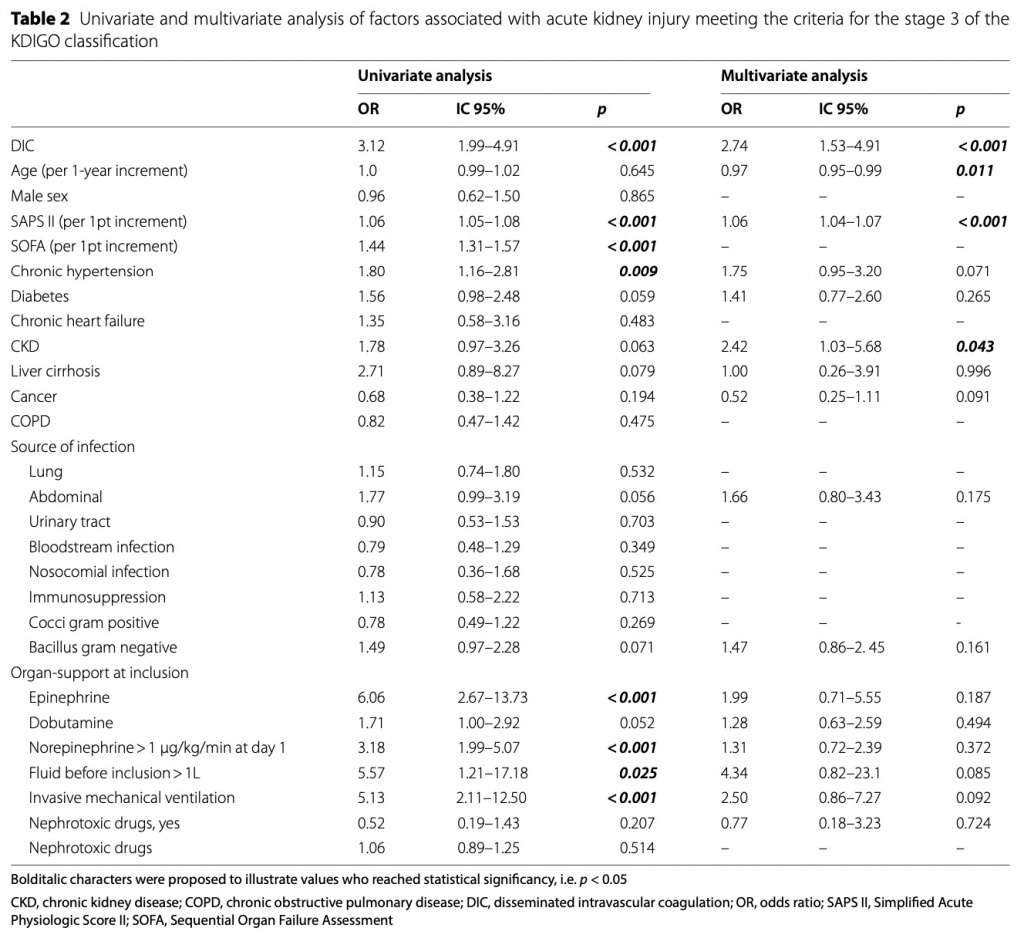
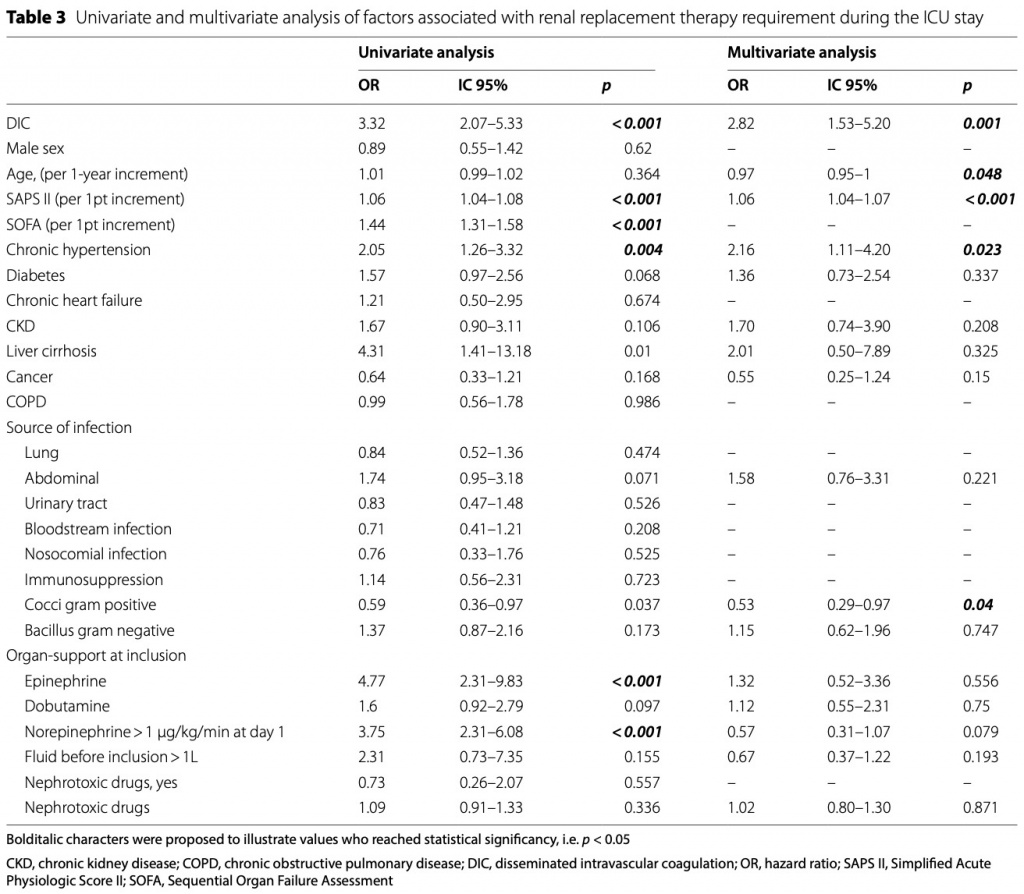
К концу пребывания в стационаре 71 пациент (55%) с ДВС-синдромом соответствовал критериям MAKE по сравнению с 78 пациентами (35,3%) без ДВС-синдрома (р < 0,001). После корректировки по сооснователям ДВС-синдром оставался значимо связанным с тяжестью ОПП и необходимостью заместительной почечной терапии. После корректировки по кофаундерам ДВС-синдром все еще был значимо связан с более высоким риском ОПП 3 по KDIGO с отношением шансов (ОШ) 2,74 [IC 95% (1,53–4,91), p < 0,001] (Table 2). Другими факторами, достоверно связанными с ОПП KDIGO3, были ХБП в анамнезе [ОШ 2,42 (1,03–5,68), p = 0,043), более высокий SAPS II [ОШ 1,06 (1,04–1,07), на прирост на 1 балл p < 0,001] и возраст [ОШ] 0,97 (0,95–0,99), р = 0,011]. Также была обнаружена связь между ДВС-синдромом и потребностью в ЗПТ [ОШ 2,83 (1,53–5,20), р < 0,001] (Table 3). При рассмотрении ОПП — независимо от его стадии — возникновение ДВС-синдрома больше не было связано ни с возникновением ОПП после многомерного анализа, ни с MAKE в конце пребывания в стационаре (Additional file 2:Tables S3 and 4).
Обсуждение
В этой проспективной когорте пациентов с септическим шоком ДВС-синдром был связан с почти трехкратным увеличением риска развития более тяжелой стадии ОПП (KDIGO3) и необходимости ЗПТ, что позволяет предположить, что ДВС-синдром ухудшает прогноз пациентов с септическим шоком и способствует множественной органной недостаточности и степени ее выраженности. Однако после корректировки ДВС-синдром не был связан с критериями ОПП или MAKE. Эти выводы представляют интерес. Действительно, если ранее сообщалось, что возникновение ДВС-синдрома является независимым фактором, связанным как с тяжестью, так и со смертностью, у пациентов с септическим шоком [11, 12, 26, 27] связь между ОПП и ДВС-синдромом изучена недостаточно.
В ретроспективной когорте пациентов с септическим шоком, вызванным внутрибрюшной инфекцией, Xu et al. [28] показали, что некоторые биомаркеры свертывания крови (аЧТВ, протромбиновое время и D-димеры) при поступлении в ОИТ были значимо связаны с ОПП после многовариантного логистического регрессионного анализа, что позволяет предположить, что активация свертывания крови может играть роль в развитии ОПП. Другое ретроспективное исследование предположило связь между ДВС-синдромом и ОПП, поскольку биомаркеры повреждения эндотелия (такими как растворимый тромбомодулин, Е-селектин, белок С и ингибитор активатора плазминогена-1) были связаны с возникновением ОПП [29]. В этом исследовании ДВС-синдром был связан с ОПП при одномерном анализе, но никаких корректировок с кофаундерами не проводилось, а время возникновения ДВС-синдрома и ОПП не описано.
При остром и хроническом заболевании почек система свертывания крови и передача сигналов, зависящая от протеазы свертывания крови, могут быть изменены [30]. Регуляторы и рецепторы свертывания крови играют ключевую роль в гемостазе и негемостатических функциях почек. Действительно было показано, что протеазы коагуляции способны изменять функцию почечных клеток через активируемые протеазами рецепторы (PAR) и корецепторы, в то время как активированный протеин С будет оказывать нефропротективное действие, которое, по крайней мере, частично не зависит от его антикоагулянтной функции. Поэтому неудивительно, что чрезмерная активация коагуляции может изменить функцию почек.
В моноцентрическом ретроспективном исследовании, включавшем 582 пациента в критическом состоянии, явный ДВС-синдром был связан с возникновением ОПП в однофакторном, но не в многомерном анализе.
анализ, и ДВС-синдром был связан с более высокой смертностью в многомерном анализе [31]. Другие исследования подчеркнули эту связь [14, 15, 32]; однако ни одно из этих исследований не предоставило четкой информации относительно: (1) времени развития ОПП и (2) тяжести ОПП. Поэтому план нашего исследования является оригинальным в отношении этих двух пунктов. Действительно, мы попытались оценить раннее течение как ОПП, так и ДВС-синдрома во время септического шока. Учитывая это, мы включили пациентов, которые соответствовали критериям ОПП и ДВС-синдрома в один и тот же период времени.
С патофизиологической точки зрения в настоящее время признано, что ОПП, связанное с септическим шоком, является многофакторным заболеванием, обусловленным не только гипоперфузией почек. ОПП, связанное с сепсисом, включает в себя множество механизмов, включая окислительный стресс, воспаление, адаптацию канальцевых клеток к повреждению, изменения почечной гемодинамики и дисфункцию микроциркуляции [7, 33]. Нарушение микроциркуляции почек при сепсисе связано как с изменением почечного кровотока [34], так и с повреждением эндотелия [35, 36], особенно перитубулярных капилляров [37]. В результате эндотелиальные биомаркеры, такие как, например, растворимый тромбомодулин, оказались независимыми прогностическими биомаркерами АКИ [29], хотя с этим следует повременить, поскольку растворимый тромбомодулин выводится почками.
Такое взаимодействие между ОПП и эндотелиальной дисфункцией подтверждает гипотезу о том, что ОПП и ДВС-синдром могут быть связаны.
ДВС действительно возникает в результате чрезмерной активации путей свертывания крови, связанной с повреждением сосудистого эндотелия и гипофибринолизом [10, 38], что в конечном итоге приводит к образованию диссеминированных микротромбов, ухудшающих микроциркуляцию. Таким образом, ДВС-синдром вносит основной вклад в развитие или ухудшение органной недостаточности [10, 11]. Однако гистопатологические изменения не подтверждают такую связь. Действительно, при посмертной биопсии почек 19 пациентов с септическим шоком артериолярные тромбозы были обнаружены только у 4 пациентов, независимо от наличия или отсутствия ДВС-синдрома [39]. Настоящее исследование также страдает от некоторых недостатков: будучи моноцентровым, обобщение полученных результатов не представляется возможным. Основным ограничением настоящего исследования является то, что, несмотря на дизайн нашего исследования, ДВС-синдром и ОПП возникали одновременно более чем у 80% пациентов и у 76% пациентов с ОПП KDIGO3 и ДВС-синдромом.
В других странах высокая частота ОПП (78,9%) ограничивает внешнюю достоверность нашего исследования. Однако такая высокая заболеваемость может быть объяснена тяжестью включенных пациентов (медиана SAPS II 61 балл) и определением случаев ОПП строго по определению KDIGO с учетом критериев диуреза. Действительно, в большой многоцентровой обсервационной когорте сообщалось, что учет или отсутствие компонента диуреза приводит к значительной разнице в количестве пациентов с диагнозом сепсис-индуцированной АКИ, а также к различиям в общей и почечной эволюции [40]. Кроме того, эпидемиология ОПП, вызванного сепсисом, изучена недостаточно [41]. Однако в апостериорном анализе исследования ProCESS ОПП возникло у 69% пациентов с септическим шоком в течение первых 7 дней после поступления в ОИТ, что наиболее близко к нашим данным, с меньшей тяжестью (29,7% пациентов с ОПП KDIGO 3). [42].
Такая высокая частота ОПП у пациентов с высокой степенью тяжести может объяснить отсутствие связи между ОПП и ДВС-синдромом после поправки на вмешивающиеся факторы из-за недостаточной статистической мощности. К сожалению, данные о состоянии почек на 7-й день отсутствовали у 33% пациентов, что не позволяет сделать какие-либо выводы об эволюции почек.. Чтобы справиться с этой проблемой, мы собрали критерии классификации MAKE, которые, как сообщается, являются подходящим составным критерием для иллюстрации клинически значимых неблагоприятных исходов после ОПП: новый этап гемодиализа, смерть и стойкое нарушение функции почек (с переменным диапазоном такого определения). Связь между ДВС-синдромом и пациентами, которые соответствовали критериям MAKE, не была обнаружена после корректировки, но время этой оценки (окончание госпитализации), вероятно, слишком рано для значимой оценки восстановления функции почек у пациентов, перенесших септический шок. Наконец, мы выбрали оценку ISTH [23] для определения ДВС-синдрома, тогда как другие шкалы, такие как Японская ассоциация неотложной медицины-ДВС (JAAM-DIC) [43], были предложены для более раннего распознавания ДВС-синдрома в условиях сепсиса. Если оптимальная оценка для диагностики ДВС остается предметом споров [44], то сегодня научные общества рекомендуют оценку ISTH [45].
Заключение
В этой проспективной когорте пациентов с септическим шоком ДВС-синдром был тесно связан с риском ОПП KDIGO3, даже после поправки на тяжесть и другие соответствующие факторы. Разумеется, данное исследование не может установить причинно-следственную связь. Если ДВС действительно играет роль в патогенезе ОПП у пациентов с септическим шоком, предстоящие исследования, посвященные ДВС-синдрому, вероятно, должны включить ОПП в качестве значимого исхода. Аналогичным образом, исследовательские усилия по изучению ОПП в контексте сепсиса и его факторов риска, возможно, должны учитывать ДВС-синдром как потенциальный способствующий фактор, и это соображение до сих пор не рассматривалось.
Ссылка на документ с дополнительными данными исследования (Supplementary) - Часть 1.
Ссылка на документ с дополнительными данными исследования (Supplementary) - Часть 2.
References
1. Bagshaw SM, Lapinsky S, Dial S, Arabi Y, Dodek P, Wood G, et al. Acute kidney injury in septic shock: clinical outcomes and impact of duration of hypotension prior to initiation of antimicrobial therapy. Intens Care Med.2009;35(5):871–81.
2. Metnitz PGH, Krenn CG, Steltzer H, Lang T, Ploder J, Lenz K, et al. Effect of
acute renal failure requiring renal replacement therapy on outcome in critically ill patients. Crit Care Med. 2002;30(9):2051–8.
3. Coca SG, Singanamala S, Parikh CR. Chronic kidney disease after acute kidney injury: a systematic review and meta-analysis. Kidney Int. 2012;81(5):442–8.
4. Wu VC, Wu CH, Huang TM, Wang CY, Lai CF, Shiao CC, et al. Long-term risk of coronary events after AKI. J Am Soc Nephrol. 2014;25(3):595–605.
5. Uchino S, Kellum JA, Bellomo R, Doig GS, Morimatsu H, Morgera S, et al.
Acute renal failure in critically ill patients: a multinational, multicenter study. JAMA. 2005;294(7):813–8.
6. Bellomo R, Kellum JA, Ronco C, Wald R, Martensson J, Maiden M, et al.Acute kidney injury in sepsis. Intens Care Med. 2017;43(6):816–28.
7. Gomez H, Ince C, De Backer D, Pickkers P, Payen D, Hotchkiss J, et al. А
unified theory of sepsis-induced acute kidney injury: inflammation, microcirculatory dysfunction, bioenergetics, and the tubular cell adaptation to injury. Shock. 2014;41(1):3–11.
8. Helms J, Iba T, Connors JM, Gando S, Levi M, Meziani F, et al. How to manage coagulopathies in critically ill patients. Intensive Care Med. 2023;49(3):273–90.
9. da Cruz DB, Helms J, Aquino LR, Stiel L, Cougourdan L, Broussard C, et al.
DNA-bound elastase of neutrophil extracellular traps degrades plasminogen,
reduces plasmin formation, and decreases fibrinolysis: proof of concept in septic shock plasma. FASEB J. 2019;33(12):14270–80.
10. Delabranche X, Helms J, Meziani F. Immunohaemostasis: a new view on
haemostasis during sepsis. Ann Intens Care. 2017;7(1):117.
11. Hartemink KJ, Hack CE, Groeneveld ABJ. Relation between coagulation/
fibrinolysis and lactate in the course of human septic shock. J Clin Pathol.
2010;63(11):1021–6.
12. Gando S, Shiraishi A, Yamakawa K, Ogura H, Saitoh D, Fujishima S, et al.
Role of disseminated intravascular coagulation in severe sepsis. Thromb Res. 2019;178:182–8.
13. Okabayashi K, Wada H, Ohta S, Shiku H, Nobori T, Maruyama K. Hemostatic
markers and the sepsis-related organ failure assessment score in patients with disseminated intravascular coagulation in an intensive care unit. Am J Hematol. 2004;76(3):225–9.
14. Delabranche X, Quenot JP, Lavigne T, Mercier E, Franзois B, Severac F, et al. Early detection of disseminated intravascular coagulation during septic shock: a multicenter prospective study. Crit Care Med. 2016;44(10):e930-939.
15. Dhainaut JF, Yan SB, Joyce DE, Pettila V, Basson B, Brandt JT, et al. Treatment effects of drotrecogin alfa (activated) in patients with severe sepsis with or without overt disseminated intravascular coagulation1. J Thromb Haemost. 2004;2(11):1924–33.
16. KDIGO 2012 clinical practice guideline for the evaluation and management
of chronic kidney disease. Kidney International Supplements. 2013 Jan;3(1):1–150.
17. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and
validation. J Chronic Dis. 1987;40(5):373–83.
18. Le Gall JR, Lemeshow S, Saulnier F. A new simplified acute physiology score (SAPS II) based on a European/North American multicenter study.JAMA. 1993;270(24):2957–63.
19. Vincent JL, Moreno R, Takala J, Willatts S, De Mendonзa A, Bruining H, et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine. Intensive Care Med. 1996;22(7):707–10.
20. Ad-hoc working group of ERBP, Fliser D, Laville M, Covic A, Fouque D,
Vanholder R, et al. A European Renal Best Practice (ERBP) position statement on the Kidney Disease Improving Global Outcomes (KDIGO) clinical practice guidelines on acute kidney injury: part 1: definitions, conservative management and contrast-induced nephropathy. Nephrol Dial Transpl. 2012;27(12):4263–72.
21. Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF, Feldman HI, et al.
A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009;150(9):604–12.
22. Palevsky PM, Molitoris BA, Okusa MD, Levin A, Waikar SS, Wald R, et al.
Design of clinical trials in acute kidney injury: report from an NIDDK workshop on trial methodology. CJASN. 2012;7(5):844–50.
23. Taylor FB, Toh CH, Hoots WK, Wada H, Levi M, Scientific Subcommittee on
Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost. 2001;86(5):1327–30.
24. Ehrmann S, Helms J, Joret A, Martin-Lefevre L, Quenot JP, Herbrecht JE,et al. Nephrotoxic drug burden among 1001 critically ill patients: impact on acute kidney injury. Ann Intens Care. 2019;9(1):106.
25. Wada H, Takahashi H, Uchiyama T, Eguchi Y, Okamoto K, Kawasugi K, et al.
The approval of revised diagnostic criteria for DIC from the Japanese Society on Thrombosis and Hemostasis. Thromb J. 2017;15:17.
26. Vallet B. Bench-to-bedside review: endothelial cell dysfunction in severe
sepsis: a role in organ dysfunction? Crit Care. 2003;7(2):130–8.
27. Fourrier F, Chopin C, Goudemand J, Hendrycx S, Caron C, Rime A, et al.
Septic shock, multiple organ failure, and disseminated intravascular coagulation. Compared patterns of antithrombin III, protein C, and protein S deficiencies. Chest. 1992;101(3):816–23.
28. Xu Z, Cheng B, Fu S, Liu X, Xie G, Li Z, et al. Coagulative biomarkers on
admission to the ICU predict acute kidney injury and mortality in patients with septic shock caused by intra-abdominal infection. Infect Drug Resist. 2019;12:2755–64.
29. Katayama S, Nunomiya S, Koyama K, Wada M, Koinuma T, Goto Y, et al.
Markers of acute kidney injury in patients with sepsis: the role of soluble
thrombomodulin. Crit Care. 2017;21(1):229.
30. Madhusudhan T, Kerlin BA, Isermann B. The emerging role of coagulation
proteases in kidney disease. Nat Rev Nephrol. 2016;12(2):94–109.
31. Zhi DY, Lin J, Zhuang HZ, Dong L, Ji XJ, Guo DC, et al. Acute kidney injury
in critically ill patients with sepsis: clinical characteristics and outcomes. J Invest Surg. 2019;32(8):689–96.
32. Delabranche X, Boisramй-Helms J, Asfar P, Berger A, Mootien Y,Lavigne T, et al. Microparticles are new biomarkers of septic shock induced disseminated intravascular coagulopathy. Intens Care Med.2013;39(10):1695–703.
33. De Vriese AS. Prevention and treatment of acute renal failure in sepsis. J
Am Soc Nephrol. 2003;14(3):792–805.
34. Tiwari MM, Brock RW, Megyesi JK, Kaushal GP, Mayeux PR. Disruption
of renal peritubular blood flow in lipopolysaccharide-induced renal failure: role of nitric oxide and caspases. Am J Physiol Renal Physiol.2005;289(6):F1324-1332.
35. Umbro I, Gentile G, Tinti F, Muiesan P, Mitterhofer AP. Recent advances in
pathophysiology and biomarkers of sepsis-induced acute kidney injury. J Infect. 2016;72(2):131–42.
36. Schrier RW, Wang W. Acute renal failure and sepsis. N Engl J Med.2004; 351(2):159–69.
37. Wu L, Tiwari MM, Messer KJ, Holthoff JH, Gokden N, Brock RW, et al.
Peritubular capillary dysfunction and renal tubular epithelial cell stress following lipopolysaccharide administration in mice. Am J Physiol Renal Physiol. 2007;292(1):F261-268.
38. Iba T, Levi M, Thachil J, Levy JH. Disseminated intravascular coagulation:
the past, present, and future considerations. Semin Thromb Hemost. 2022;48(8):978–87.
39. Lerolle N, Nochy D, Guйrot E, Bruneval P, Fagon JY, Diehl JL, et al. Histopathology of septic shock induced acute kidney injury: apoptosis and
leukocytic infiltration. Intens Care Med. 2010;36(3):471–8.
40. White KC, Serpa-Neto A, Hurford R, Clement P, Laupland KB, See E, et al.
Sepsis-associated acute kidney injury in the intensive care unit: incidence,
patient characteristics, timing, trajectory, treatment, and associated outcomes.
A multicenter, observational study. Intensive Care Med [Internet]. 2023 July 11 [cited 2023 Aug 2]; Available from: https:// doi. org/ 10. 1007/s00134- 023- 07138-0.
41. Peerapornratana S, Manrique-Caballero CL, Gуmez H, Kellum JA. Acute
kidney injury from sepsis: current concepts, epidemiology, pathophysiology,
prevention and treatment. Kidney Int. 2019;96(5):1083–99.
42. Kellum JA, Chawla LS, Keener C, Singbartl K, Palevsky PM, Pike FL, et al.
The effects of alternative resuscitation strategies on acute kidney injury in
patients with septic Shock. Am J Respir Crit Care Med. 2016;193(3):281–7.
43. Iba T, Di Nisio M, Thachil J, Wada H, Asakura H, Sato K, et al. Revision of the Japanese Association for Acute Medicine (JAAM) disseminated intravascular
coagulation (DIC) diagnostic criteria using antithrombin activity. Crit Care. 2016;20(1):287.
44. Iba T, Umemura Y, Watanabe E, Wada T, Hayashida K, Kushimoto S, et al.
Diagnosis of sepsis‐induced disseminated intravascular coagulation and
coagulopathy. Acute Med Surg. 2019 Apr;ams2.411.
45. Iba T, Levy JH, Yamakawa K, Thachil J, Warkentin TE, Levi M. Proposal of
a two-step process for the diagnosis of sepsis-induced disseminated intravascular coagulation. J Thromb Haemost. 2019;17(8):1265–8.
Источник фотоиллюстрации - www.freepik.com
[~DETAIL_TEXT] =>
J Helms, H Merdji, S Loewert, F Severac, A Monnier, J Kaurin, A Curtiaud, F Meziani and J Demiselle
Disseminated intravascular coagulation is strongly associated with severe acute kidney injury in patients with septic shock
Annals of Intensive Care (2023) 13:119
doi.org/10.1186/s13613-023-01216-8
Абстракт
Диссеминированное внутрисосудистое свертывание (ДВС) ухудшает прогноз септического шока и способствует полиорганной недостаточности. На сегодняшний день нет данных, связывающих возникновение, тяжесть и развитие ДВС-синдрома и острого повреждения почек (ОПП) в этих условиях. Целью нашей работы было проанализировать связь между возникновением, тяжестью и развитием ОПП у пациентов с ДВС-синдромом, вызванным септическим шоком. В проспективном моноцентровом когортном исследовании участвовали последовательные пациенты в возрасте 18 лет и старше, поступившие в отделение интенсивной терапии Страсбургской университетской больницы с системной гипотензией, требующей применения вазопрессора, связанной с инфекцией, без терминальной стадии хронической болезни почек в анамнезе. ОПП определяли по классификации KDIGO. Диагностика ДВС-синдрома основывалась на шкале Международного общества тромбозов и гемостаза (ISTH). Эволюцию ОПП оценивали по комбинированной конечной точке, состоящей из основных неблагоприятных событий со стороны почек. Рассматривались только пациенты с ДВС-синдромом, возникшим до или во время диагностики ОПП. Для определения факторов, связанных с почечными исходами, был проведен одномерный и многомерный анализ.
В исследование было включено 350 пациентов, из которых у 129 развился ДВС-синдром. Пациенты с ДВС-синдромом были более тяжелыми (медиана SAPS II 64 против 56, р <0,001) и имели более высокую 28-дневную смертность (43,3% против 26,2%, р<0,001). ОПП чаще встречалось у пациентов с ДВС-синдромом (86,8% против 74,2%, p < 0,005), особенно на более тяжелой стадии ОПП [KDIGO 3 у 58,1% пациентов с ДВС-синдромом против 30,8% пациентов без ДВС-синдрома, p < 0,001, ОПП, требующее заместительной почечной терапии (ЗПТ), у 47,3% пациентов с ДВС-синдромом против 21,3% пациентов без ДВС-синдрома, p < 0,001]. После поправки на мешающие факторы возникновение ДВС-синдрома оставалось связанным с риском развития более тяжелой стадии ОПП с отношением шансов (ОШ) 2,74 [ИК 95% (1,53–4,91), р < 0,001] и с риском необходимости ЗПТ во время пребывания в ОИТ [ОШ 2,82 (1,53–5,2), p < 0,001].
ДВС-синдром, по-видимому, тесно связан с риском развития более тяжелой формы ОПП (3-я стадия классификации KDIGO, требование ЗПТ), даже после поправки на тяжесть и другие соответствующие факторы.
Ключевые слова: диссеминированное внутрисосудистое свертывание крови, сепсис, септический шок, острое повреждение почек, острая болезнь почек.
Введение
Острое повреждение почек (ОПП) в отделении интенсивной терапии (ОРИТ) связано с более высоким уровнем смертности, при этом существует тесная связь между тяжестью ОПП и смертностью [1, 2]. Сообщалось также, что ОПП связано с худшим долгосрочным исходом: пациенты, у которых возникло ОПП во время пребывания в ОИТ, подвергаются более высокому риску развития хронической болезни почек (ХБП) и серьезных сердечно-сосудистых событий [3,4]. Помимо общих факторов, связанных с ОПП в ОИТ, септический шок остается основным триггером ОПП [5]. Однако патофизиология ОПП, вызванного сепсисом, сложна и до сих пор плохо изучена. Хотя в нем, безусловно, участвуют такие факторы, как воспаление, окислительный стресс, микрососудистая дисфункция и ишемия канальцевых эпителиальных клеток [6, 7], диссеминированное внутрисосудистое свертывание (ДВС) также может способствовать развитию ОПП. ДВС-синдром возникает в результате чрезмерной активации коагуляции наряду с дефектом антикоагулянтной и фибринолитической регуляторных систем [8,9] и, таким образом, приводит к диссеминированному микротромбозу, что может способствовать органной дисфункции во время септического шока [10, 11]. Поскольку у 30–40% пациентов с септическим шоком развивается ДВС-синдром, что связано с тяжестью заболевания и увеличением смертности [12, 13], он может вносить значительный вклад в развитие ОПП. Однако лишь немногие исследования изучали связь между ДВС и ОПП. Было высказано предположение о более высокой частоте ОПП у пациентов с септическим шоком и ДВС-синдромом, но эта возможная связь не анализировалась с корректировкой вмешивающихся переменных, в основном тяжести заболевания [14, 15]. Таким образом, данное исследование было направлено на изучение связи между ДВС-синдромом и ОПП у пациентов с септическим шоком, уделяя особое внимание возникновению, тяжести и динамике развития ОПП.
Методы
Дизайн исследования
Проспективное когортное исследование проводилось в период с июля 2013 г. по март 2019 г. в ОИТ университетской больницы Страсбурга (Франция). Критериями включения были пациенты в возрасте 18 лет и старше, поступившие в ОИТ по поводу септического шока в соответствии с определением «Сепсис-2». Пациентов необходимо было включить в исследование в течение 12 часов после начала приема вазопрессоров. Пациенты в агональном состоянии на этапе скрининга, или пациенты с ограничением поддерживающей жизнь терапии при поступлении были исключены. Пациенты, находящиеся под правовой защитой (невозможность дать согласие, тюремное заключение…) были исключены. Пациенты, уже включенные в настоящее исследование, были исключены в случае повторной госпитализации, а пациенты, у которых развился шок позже во время пребывания в ОИТ, не подвергались скринингу. Кроме того, из исследования были исключены пациенты с терминальной хронической болезнью почек (5 стадия ХБП [16], находящиеся на заместительной почечной терапии или реципиенты трансплантата почки). Чтобы определить связь между ДВС-синдромом и ОПП и его тяжестью, были исключены пациенты, у которых ДВС-синдром был диагностирован после того, как ОПП достигло более высокой стадии.
Сбор данных
Проспективно записывались следующие данные: возраст, пол, индекс массы тела, сопутствующие заболевания и индекс Чарльсона [17]. Острое состояние характеризовалось: тяжестью по шкале SAPSII и SOFA [18, 19], гемодинамическими параметрами (среднее артериальное давление, диурез), источником инфекции, внутрибольничными или внебольничными инфекциями, а также собирались доступные микробиологические данные. Мы зарегистрировали все поддерживающие методы лечения, необходимые во время пребывания в ОИТ (ИВЛ, вазопрессоры, инфузионная терапия, заместительная почечная терапия (RRT)] и их продолжительность. Смертность оценивалась в конце пребывания в ОИТ и стационаре, а также на 28-й день.
Определения
• Частота и тяжесть ОПП определялись в соответствии с классификацией KDIGO [20]. Стадию 1 (KDIGO1) рассматривали, когда уровень креатинина в сыворотке крови увеличивался как минимум на 26 мкмоль/л или в 1,5–1,9 раза по сравнению с исходным уровнем или если диурез был ниже 0,5 мл/кг/ч в течение 6–12 часов. Стадия 2 (KDIGO2) - если креатинин сыворотки увеличивался более чем в два раза по сравнению с исходным уровнем или если диурез был менее 0,5 мл/кг/час в течение как минимум 12 часов. Стадия 3 (KDIGO 3) представляла собой наиболее тяжелую форму ОПП и определялась как повышение уровня креатинина в сыворотке крови более, чем в три раза по сравнению с исходным уровнем или был выше 354 мкмоль/л, либо необходимость ЗПТ или диурез ниже 0,3 мл/кг/ ч в течение как минимум 24 ч или анурия в течение как минимум 12 ч.
• Исходный уровень креатинина сыворотки: для каждого пациента, если таковой имеется, креатинин сыворотки перед госпитализацией учитывался в течение периода времени минимум 7 дней и максимум 1 года с момента госпитализации. В случае отсутствия данных, когда креатинин в сыворотке был повышен при поступлении, исходный уровень креатинина в сыворотке экстраполировали с использованием формулы MDRD [21], предполагая, что исходная расчетная скорость клубочковой фильтрации (СКФ) составляет 75 мл/мин/1,73 м2, как предложено в руководствах [20]. Пациентов относили к считали ХБП, когда исходная СКФ была ниже 60 мл/мин/1,73 м2.
Для описания развития ОПП мы собрали, насколько это возможно, критерии острого заболевания почек, которое определялось как персистирующее ОПП (стадия 1 или выше по классификации KDIGO) в течение более 7 дней. Кроме того, в конце пребывания в больнице для каждого пациента были собраны критерии комбинированной конечной точки для серьезного нежелательного явления со стороны почек (MAKE) в конце госпитализации. MAKE определялся как комбинированный критерий смерти, потребности в ЗПТ или ухудшения функции почек (двукратное увеличение уровня креатинина в сыворотке крови по сравнению с исходным уровнем) в конце периода госпитализации [22].
• Диагностика ДВС-синдрома основывалась на шкале Международного общества по тромбозам и гемостазу (ISTH) [23], и, соответственно, балл, превышающий или равный 5, был сохранен для диагностики ДВС-синдрома. Биологические тесты для диагностики ДВС-синдрома проводились при поступлении в ОИТ и ежедневно до 7-го дня.
• Нефротоксичные препараты: все потенциально нефротоксичные препараты, назначаемые до поступления в ОИТ и до возникновения ОПП во время пребывания в ОИТ, из заранее определенного списка, основанного на предыдущей работе [24], были идентифицированы в карте пациента (см. Additional file 1).
Этические проблемы
Дизайн исследования был одобрен этическим комитетом Страсбурга (Comite de Protection des Personnes N° 12/35, DC-2012-1633). Перед включением,от всех пациентов было получено письменное информированное согласие. Если пациенты не могли дать информированное согласие, оно было получено от их ближайших родственников или другого лица, замещающего лицо, принимающее решения, в зависимости от обстоятельств. У этих пациентов согласие post hoc было получено как можно скорее.
Статистика
Количественные данные выражались как среднее значение, стандартное отклонение, медиана и межквартильный размах (IQR) для параметрического и непараметрического распределения соответственно и сравнивались с использованием t-критерия Стьюдента или ранговой суммы Вилкоксона при необходимости. Качественные переменные сравнивали с использованием χ2 или точного критерия Фишера. Для выявления факторов, связанных с возникновением, тяжестью и развитием ОПП (критерии MAKE в конце пребывания в стационаре), таких как отношения шансов, были использованы модели логистической регрессии. На первом этапе одномерный анализ проводился для каждой исходной характеристической переменной независимо друг от друга. На втором этапе были построены многомерные модели с использованием переменных, имеющих клиническую значимость и/или со значением p <0,2 в одномерном анализе. Если некоторые ковариаты сильно коррелировали между собой, в многомерную модель включался наиболее связанный. Некоторые непрерывные переменные (норадреналин и введение жидкости) были преобразованы в качественные переменные в соответствии с клинически значимыми значениями. Поскольку частота и тяжесть ОПП в ОИТ влияет на смертность и продолжительность пребывания в ОИТ, мы провели анализ выживаемости в ОИТ без возникновения ОПП 3-й стадии у пациентов с ДВС-синдромом и без него (диагноз ДВС считался исходным) в течение первых 7 дней. Выживаемость без ОПП 3-й стадии оценивалась по методу Каплана-Мейера и сравнивалась между двумя группами с использованием лог-рангового теста.
Результаты
Из 437 пациентов исходной группы 350 пациентов соответствовали критериям участия и были включены в исследование. Причины исключения пациентов представлены на схеме (Fig. 1). Исходные характеристики представлены в Table 1. Включенные пациенты были преимущественно мужчинами, средний возраст 69 лет. Пациенты были в тяжелом состоянии, медиана SAPS II составляла 58 (48–73) баллов. Заболевания сердечно-сосудистой системы были наиболее частой сопутствующей патологией. Исходный уровень креатинина сыворотки был недоступен у 106 пациентов (30,3%) и был экстраполирован с помощью расчета по уравнению MDRD как запланировано в дизайне исследования. Инфекции, вызывающие септический шок, были в основном внебольничными.

Всем пациентам потребовалась вазопрессорная терапия с норэпинефрином в качестве первого препарата, а большинству из них (n = 306, 87,4%) потребовалась искусственная вентиляция легких. Среди 350 включенных пациентов у 129 развился ДВС-синдром, а у 221 - нет. ДВС-синдром возник в первый день у 92 пациентов, во второй день у 22 пациентов, в третий день у 7 и между 4 и 7 днями у 8 пациентов. Коагуляционные тесты при поступлении и при диагностике ДВС-синдрома представлены в Additional file 2: Table S1. У пациентов с ДВС-синдромом не было другой причины его развития , кроме сепсиса. Состояние пациентов с ДВС-синдромом было более тяжелым. Как показано в Table 1, хотя у пациентов с ДВС-синдромом было меньше сопутствующих заболеваний, их баллы тяжести (SOFA и SAPSII) при поступлении в ОИТ были выше. Между пациентами с ДВС-синдромом и без него не было различий по источнику инфекции, внебольничному или нозокомиальному характеру инфекции и микробиологическим данным. Вследствие более высокой степени тяжести пациентам с ДВС-синдромом требовались более высокие дозы норадреналина и более частая инвазивная искусственная вентиляция легких. Среди 129 пациентов с ДВС-синдромом 11 страдали циррозом печени, из них 6 соответствовали критериям ISTH для ДВС-синдрома без компонента протромбинового времени. У остальных пяти пациентов в качестве дополнительного критерия учитывалось снижение количества тромбоцитов не менее, чем на 30% с течением времени [25]. Аналогичным образом, у пациентов, получавших пероральные антикоагулянты с антагонистами витамина К, диагноз ДВС-синдрома сохранялся только в том случае, если они соответствовали критериям ISTH без компонента протромбинового времени и положительному баллу JAAM 2016.

У пациентов с ДВС-синдромом наблюдались более высокие показатели смертности и частота ОПП.
У пациентов с ДВС-синдромом уровень смертности был выше, чем у пациентов без ДВС-синдрома (43,3% против 26,2% соответственно, p < 0,01 для смертности в ОИТ). ОПП возникло у 276 больных (78,9%). У 256 пациентов ОПП началось в течение первых 24 ч после поступления в ОИТ и достигло высшей стадии в 1-й день у 185 пациентов, на 2-й день у 62 пациентов, на 3-й день у 13 пациентов и между 4-м и 7-м днями у остальных 16 пациентов. ОПП чаще встречалось у пациентов с ДВС-синдромом: 112 (86,8%) против 164 (74,2%) у пациентов без ДВС-синдрома (p = 0,005) (см. Fig. 2 and Additional file 3: Fig. S1a ). ОПП и ДВС-синдром возникли в один и тот же день у 95 из 112 пациентов.

У пациентов с ДВС-синдромом чаще развивалось тяжелое ОПП и они соответствовали критериям MAKE.
У пациентов с ДВС-синдромом чаще развивалось тяжелое ОПП, достигающее 3-й стадии по классификации KDIGO у 73/129 пациентов с ДВС-синдромом (58,1%) против 68/221 пациентов без ДВС-синдрома (30,8%) соответственно (p <0,001) (see Fig. 2 and Additional file 3: Fig. S1b ). ОПП 3 стадии и ДВС-синдром возникли в один и тот же день у 57 из 73 пациентов.
Среди пациентов с ОПП 3 стадии 108 потребовалась ЗПТ во время пребывания в ОИТ (61 из 129 пациентов с ДВС-синдромом (47,3%) против 47 из 221 пациентов без ДВС-синдрома (21,3%), p < 0,001). Мы обнаружили, что чем выше балл ISTH, тем выше доля пациентов с ОПП 3 стадии (p < 0,001) (Fig. 3). Связь между показателем ISTH и другими Результаты представлены в Additional file 2: Table S2.

Анализ кривой Каплана-Мейера, оценивающий вероятность развития ОПП 3-й стадии по классификации KDIGO, показал более высокий риск для пациентов с ДВС-синдромом по сравнению с пациентами без ДВС-синдрома, демонстрируя отношение рисков 2,05 (1,48-2,85), p < 0,001 (log-rank test) (Fig. 4) (данные цензурированы по смертям и переводам из ОИТ). ОПП была оценена у 236 пациентов, поскольку те, кто умер до 7-го дня после госпитализации, не подходили для этой оценки. Среди пациентов с доступной оценкой функции почек после 7-го дня у 74 развилась ОПП (31,4%), из них у 34 был ДВС-синдром, а у 40 не было ДВС [34/75 (45,3%) против 40/161 (24,8%), p = 0,002 χ2 тест].

К концу пребывания в стационаре 71 пациент (55%) с ДВС-синдромом соответствовал критериям MAKE по сравнению с 78 пациентами (35,3%) без ДВС-синдрома (р < 0,001). После корректировки по сооснователям ДВС-синдром оставался значимо связанным с тяжестью ОПП и необходимостью заместительной почечной терапии. После корректировки по кофаундерам ДВС-синдром все еще был значимо связан с более высоким риском ОПП 3 по KDIGO с отношением шансов (ОШ) 2,74 [IC 95% (1,53–4,91), p < 0,001] (Table 2). Другими факторами, достоверно связанными с ОПП KDIGO3, были ХБП в анамнезе [ОШ 2,42 (1,03–5,68), p = 0,043), более высокий SAPS II [ОШ 1,06 (1,04–1,07), на прирост на 1 балл p < 0,001] и возраст [ОШ] 0,97 (0,95–0,99), р = 0,011]. Также была обнаружена связь между ДВС-синдромом и потребностью в ЗПТ [ОШ 2,83 (1,53–5,20), р < 0,001] (Table 3). При рассмотрении ОПП — независимо от его стадии — возникновение ДВС-синдрома больше не было связано ни с возникновением ОПП после многомерного анализа, ни с MAKE в конце пребывания в стационаре (Additional file 2:Tables S3 and 4).

Обсуждение
В этой проспективной когорте пациентов с септическим шоком ДВС-синдром был связан с почти трехкратным увеличением риска развития более тяжелой стадии ОПП (KDIGO3) и необходимости ЗПТ, что позволяет предположить, что ДВС-синдром ухудшает прогноз пациентов с септическим шоком и способствует множественной органной недостаточности и степени ее выраженности. Однако после корректировки ДВС-синдром не был связан с критериями ОПП или MAKE. Эти выводы представляют интерес. Действительно, если ранее сообщалось, что возникновение ДВС-синдрома является независимым фактором, связанным как с тяжестью, так и со смертностью, у пациентов с септическим шоком [11, 12, 26, 27] связь между ОПП и ДВС-синдромом изучена недостаточно.
В ретроспективной когорте пациентов с септическим шоком, вызванным внутрибрюшной инфекцией, Xu et al. [28] показали, что некоторые биомаркеры свертывания крови (аЧТВ, протромбиновое время и D-димеры) при поступлении в ОИТ были значимо связаны с ОПП после многовариантного логистического регрессионного анализа, что позволяет предположить, что активация свертывания крови может играть роль в развитии ОПП. Другое ретроспективное исследование предположило связь между ДВС-синдромом и ОПП, поскольку биомаркеры повреждения эндотелия (такими как растворимый тромбомодулин, Е-селектин, белок С и ингибитор активатора плазминогена-1) были связаны с возникновением ОПП [29]. В этом исследовании ДВС-синдром был связан с ОПП при одномерном анализе, но никаких корректировок с кофаундерами не проводилось, а время возникновения ДВС-синдрома и ОПП не описано.
При остром и хроническом заболевании почек система свертывания крови и передача сигналов, зависящая от протеазы свертывания крови, могут быть изменены [30]. Регуляторы и рецепторы свертывания крови играют ключевую роль в гемостазе и негемостатических функциях почек. Действительно было показано, что протеазы коагуляции способны изменять функцию почечных клеток через активируемые протеазами рецепторы (PAR) и корецепторы, в то время как активированный протеин С будет оказывать нефропротективное действие, которое, по крайней мере, частично не зависит от его антикоагулянтной функции. Поэтому неудивительно, что чрезмерная активация коагуляции может изменить функцию почек.
В моноцентрическом ретроспективном исследовании, включавшем 582 пациента в критическом состоянии, явный ДВС-синдром был связан с возникновением ОПП в однофакторном, но не в многомерном анализе.
анализ, и ДВС-синдром был связан с более высокой смертностью в многомерном анализе [31]. Другие исследования подчеркнули эту связь [14, 15, 32]; однако ни одно из этих исследований не предоставило четкой информации относительно: (1) времени развития ОПП и (2) тяжести ОПП. Поэтому план нашего исследования является оригинальным в отношении этих двух пунктов. Действительно, мы попытались оценить раннее течение как ОПП, так и ДВС-синдрома во время септического шока. Учитывая это, мы включили пациентов, которые соответствовали критериям ОПП и ДВС-синдрома в один и тот же период времени.
С патофизиологической точки зрения в настоящее время признано, что ОПП, связанное с септическим шоком, является многофакторным заболеванием, обусловленным не только гипоперфузией почек. ОПП, связанное с сепсисом, включает в себя множество механизмов, включая окислительный стресс, воспаление, адаптацию канальцевых клеток к повреждению, изменения почечной гемодинамики и дисфункцию микроциркуляции [7, 33]. Нарушение микроциркуляции почек при сепсисе связано как с изменением почечного кровотока [34], так и с повреждением эндотелия [35, 36], особенно перитубулярных капилляров [37]. В результате эндотелиальные биомаркеры, такие как, например, растворимый тромбомодулин, оказались независимыми прогностическими биомаркерами АКИ [29], хотя с этим следует повременить, поскольку растворимый тромбомодулин выводится почками.
Такое взаимодействие между ОПП и эндотелиальной дисфункцией подтверждает гипотезу о том, что ОПП и ДВС-синдром могут быть связаны.
ДВС действительно возникает в результате чрезмерной активации путей свертывания крови, связанной с повреждением сосудистого эндотелия и гипофибринолизом [10, 38], что в конечном итоге приводит к образованию диссеминированных микротромбов, ухудшающих микроциркуляцию. Таким образом, ДВС-синдром вносит основной вклад в развитие или ухудшение органной недостаточности [10, 11]. Однако гистопатологические изменения не подтверждают такую связь. Действительно, при посмертной биопсии почек 19 пациентов с септическим шоком артериолярные тромбозы были обнаружены только у 4 пациентов, независимо от наличия или отсутствия ДВС-синдрома [39]. Настоящее исследование также страдает от некоторых недостатков: будучи моноцентровым, обобщение полученных результатов не представляется возможным. Основным ограничением настоящего исследования является то, что, несмотря на дизайн нашего исследования, ДВС-синдром и ОПП возникали одновременно более чем у 80% пациентов и у 76% пациентов с ОПП KDIGO3 и ДВС-синдромом.
В других странах высокая частота ОПП (78,9%) ограничивает внешнюю достоверность нашего исследования. Однако такая высокая заболеваемость может быть объяснена тяжестью включенных пациентов (медиана SAPS II 61 балл) и определением случаев ОПП строго по определению KDIGO с учетом критериев диуреза. Действительно, в большой многоцентровой обсервационной когорте сообщалось, что учет или отсутствие компонента диуреза приводит к значительной разнице в количестве пациентов с диагнозом сепсис-индуцированной АКИ, а также к различиям в общей и почечной эволюции [40]. Кроме того, эпидемиология ОПП, вызванного сепсисом, изучена недостаточно [41]. Однако в апостериорном анализе исследования ProCESS ОПП возникло у 69% пациентов с септическим шоком в течение первых 7 дней после поступления в ОИТ, что наиболее близко к нашим данным, с меньшей тяжестью (29,7% пациентов с ОПП KDIGO 3). [42].
Такая высокая частота ОПП у пациентов с высокой степенью тяжести может объяснить отсутствие связи между ОПП и ДВС-синдромом после поправки на вмешивающиеся факторы из-за недостаточной статистической мощности. К сожалению, данные о состоянии почек на 7-й день отсутствовали у 33% пациентов, что не позволяет сделать какие-либо выводы об эволюции почек.. Чтобы справиться с этой проблемой, мы собрали критерии классификации MAKE, которые, как сообщается, являются подходящим составным критерием для иллюстрации клинически значимых неблагоприятных исходов после ОПП: новый этап гемодиализа, смерть и стойкое нарушение функции почек (с переменным диапазоном такого определения). Связь между ДВС-синдромом и пациентами, которые соответствовали критериям MAKE, не была обнаружена после корректировки, но время этой оценки (окончание госпитализации), вероятно, слишком рано для значимой оценки восстановления функции почек у пациентов, перенесших септический шок. Наконец, мы выбрали оценку ISTH [23] для определения ДВС-синдрома, тогда как другие шкалы, такие как Японская ассоциация неотложной медицины-ДВС (JAAM-DIC) [43], были предложены для более раннего распознавания ДВС-синдрома в условиях сепсиса. Если оптимальная оценка для диагностики ДВС остается предметом споров [44], то сегодня научные общества рекомендуют оценку ISTH [45].
Заключение
В этой проспективной когорте пациентов с септическим шоком ДВС-синдром был тесно связан с риском ОПП KDIGO3, даже после поправки на тяжесть и другие соответствующие факторы. Разумеется, данное исследование не может установить причинно-следственную связь. Если ДВС действительно играет роль в патогенезе ОПП у пациентов с септическим шоком, предстоящие исследования, посвященные ДВС-синдрому, вероятно, должны включить ОПП в качестве значимого исхода. Аналогичным образом, исследовательские усилия по изучению ОПП в контексте сепсиса и его факторов риска, возможно, должны учитывать ДВС-синдром как потенциальный способствующий фактор, и это соображение до сих пор не рассматривалось.
Ссылка на документ с дополнительными данными исследования (Supplementary) - Часть 1.
Ссылка на документ с дополнительными данными исследования (Supplementary) - Часть 2.
References
1. Bagshaw SM, Lapinsky S, Dial S, Arabi Y, Dodek P, Wood G, et al. Acute kidney injury in septic shock: clinical outcomes and impact of duration of hypotension prior to initiation of antimicrobial therapy. Intens Care Med.2009;35(5):871–81.
2. Metnitz PGH, Krenn CG, Steltzer H, Lang T, Ploder J, Lenz K, et al. Effect of
acute renal failure requiring renal replacement therapy on outcome in critically ill patients. Crit Care Med. 2002;30(9):2051–8.
3. Coca SG, Singanamala S, Parikh CR. Chronic kidney disease after acute kidney injury: a systematic review and meta-analysis. Kidney Int. 2012;81(5):442–8.
4. Wu VC, Wu CH, Huang TM, Wang CY, Lai CF, Shiao CC, et al. Long-term risk of coronary events after AKI. J Am Soc Nephrol. 2014;25(3):595–605.
5. Uchino S, Kellum JA, Bellomo R, Doig GS, Morimatsu H, Morgera S, et al.
Acute renal failure in critically ill patients: a multinational, multicenter study. JAMA. 2005;294(7):813–8.
6. Bellomo R, Kellum JA, Ronco C, Wald R, Martensson J, Maiden M, et al.Acute kidney injury in sepsis. Intens Care Med. 2017;43(6):816–28.
7. Gomez H, Ince C, De Backer D, Pickkers P, Payen D, Hotchkiss J, et al. А
unified theory of sepsis-induced acute kidney injury: inflammation, microcirculatory dysfunction, bioenergetics, and the tubular cell adaptation to injury. Shock. 2014;41(1):3–11.
8. Helms J, Iba T, Connors JM, Gando S, Levi M, Meziani F, et al. How to manage coagulopathies in critically ill patients. Intensive Care Med. 2023;49(3):273–90.
9. da Cruz DB, Helms J, Aquino LR, Stiel L, Cougourdan L, Broussard C, et al.
DNA-bound elastase of neutrophil extracellular traps degrades plasminogen,
reduces plasmin formation, and decreases fibrinolysis: proof of concept in septic shock plasma. FASEB J. 2019;33(12):14270–80.
10. Delabranche X, Helms J, Meziani F. Immunohaemostasis: a new view on
haemostasis during sepsis. Ann Intens Care. 2017;7(1):117.
11. Hartemink KJ, Hack CE, Groeneveld ABJ. Relation between coagulation/
fibrinolysis and lactate in the course of human septic shock. J Clin Pathol.
2010;63(11):1021–6.
12. Gando S, Shiraishi A, Yamakawa K, Ogura H, Saitoh D, Fujishima S, et al.
Role of disseminated intravascular coagulation in severe sepsis. Thromb Res. 2019;178:182–8.
13. Okabayashi K, Wada H, Ohta S, Shiku H, Nobori T, Maruyama K. Hemostatic
markers and the sepsis-related organ failure assessment score in patients with disseminated intravascular coagulation in an intensive care unit. Am J Hematol. 2004;76(3):225–9.
14. Delabranche X, Quenot JP, Lavigne T, Mercier E, Franзois B, Severac F, et al. Early detection of disseminated intravascular coagulation during septic shock: a multicenter prospective study. Crit Care Med. 2016;44(10):e930-939.
15. Dhainaut JF, Yan SB, Joyce DE, Pettila V, Basson B, Brandt JT, et al. Treatment effects of drotrecogin alfa (activated) in patients with severe sepsis with or without overt disseminated intravascular coagulation1. J Thromb Haemost. 2004;2(11):1924–33.
16. KDIGO 2012 clinical practice guideline for the evaluation and management
of chronic kidney disease. Kidney International Supplements. 2013 Jan;3(1):1–150.
17. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and
validation. J Chronic Dis. 1987;40(5):373–83.
18. Le Gall JR, Lemeshow S, Saulnier F. A new simplified acute physiology score (SAPS II) based on a European/North American multicenter study.JAMA. 1993;270(24):2957–63.
19. Vincent JL, Moreno R, Takala J, Willatts S, De Mendonзa A, Bruining H, et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine. Intensive Care Med. 1996;22(7):707–10.
20. Ad-hoc working group of ERBP, Fliser D, Laville M, Covic A, Fouque D,
Vanholder R, et al. A European Renal Best Practice (ERBP) position statement on the Kidney Disease Improving Global Outcomes (KDIGO) clinical practice guidelines on acute kidney injury: part 1: definitions, conservative management and contrast-induced nephropathy. Nephrol Dial Transpl. 2012;27(12):4263–72.
21. Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF, Feldman HI, et al.
A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009;150(9):604–12.
22. Palevsky PM, Molitoris BA, Okusa MD, Levin A, Waikar SS, Wald R, et al.
Design of clinical trials in acute kidney injury: report from an NIDDK workshop on trial methodology. CJASN. 2012;7(5):844–50.
23. Taylor FB, Toh CH, Hoots WK, Wada H, Levi M, Scientific Subcommittee on
Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost. 2001;86(5):1327–30.
24. Ehrmann S, Helms J, Joret A, Martin-Lefevre L, Quenot JP, Herbrecht JE,et al. Nephrotoxic drug burden among 1001 critically ill patients: impact on acute kidney injury. Ann Intens Care. 2019;9(1):106.
25. Wada H, Takahashi H, Uchiyama T, Eguchi Y, Okamoto K, Kawasugi K, et al.
The approval of revised diagnostic criteria for DIC from the Japanese Society on Thrombosis and Hemostasis. Thromb J. 2017;15:17.
26. Vallet B. Bench-to-bedside review: endothelial cell dysfunction in severe
sepsis: a role in organ dysfunction? Crit Care. 2003;7(2):130–8.
27. Fourrier F, Chopin C, Goudemand J, Hendrycx S, Caron C, Rime A, et al.
Septic shock, multiple organ failure, and disseminated intravascular coagulation. Compared patterns of antithrombin III, protein C, and protein S deficiencies. Chest. 1992;101(3):816–23.
28. Xu Z, Cheng B, Fu S, Liu X, Xie G, Li Z, et al. Coagulative biomarkers on
admission to the ICU predict acute kidney injury and mortality in patients with septic shock caused by intra-abdominal infection. Infect Drug Resist. 2019;12:2755–64.
29. Katayama S, Nunomiya S, Koyama K, Wada M, Koinuma T, Goto Y, et al.
Markers of acute kidney injury in patients with sepsis: the role of soluble
thrombomodulin. Crit Care. 2017;21(1):229.
30. Madhusudhan T, Kerlin BA, Isermann B. The emerging role of coagulation
proteases in kidney disease. Nat Rev Nephrol. 2016;12(2):94–109.
31. Zhi DY, Lin J, Zhuang HZ, Dong L, Ji XJ, Guo DC, et al. Acute kidney injury
in critically ill patients with sepsis: clinical characteristics and outcomes. J Invest Surg. 2019;32(8):689–96.
32. Delabranche X, Boisramй-Helms J, Asfar P, Berger A, Mootien Y,Lavigne T, et al. Microparticles are new biomarkers of septic shock induced disseminated intravascular coagulopathy. Intens Care Med.2013;39(10):1695–703.
33. De Vriese AS. Prevention and treatment of acute renal failure in sepsis. J
Am Soc Nephrol. 2003;14(3):792–805.
34. Tiwari MM, Brock RW, Megyesi JK, Kaushal GP, Mayeux PR. Disruption
of renal peritubular blood flow in lipopolysaccharide-induced renal failure: role of nitric oxide and caspases. Am J Physiol Renal Physiol.2005;289(6):F1324-1332.
35. Umbro I, Gentile G, Tinti F, Muiesan P, Mitterhofer AP. Recent advances in
pathophysiology and biomarkers of sepsis-induced acute kidney injury. J Infect. 2016;72(2):131–42.
36. Schrier RW, Wang W. Acute renal failure and sepsis. N Engl J Med.2004; 351(2):159–69.
37. Wu L, Tiwari MM, Messer KJ, Holthoff JH, Gokden N, Brock RW, et al.
Peritubular capillary dysfunction and renal tubular epithelial cell stress following lipopolysaccharide administration in mice. Am J Physiol Renal Physiol. 2007;292(1):F261-268.
38. Iba T, Levi M, Thachil J, Levy JH. Disseminated intravascular coagulation:
the past, present, and future considerations. Semin Thromb Hemost. 2022;48(8):978–87.
39. Lerolle N, Nochy D, Guйrot E, Bruneval P, Fagon JY, Diehl JL, et al. Histopathology of septic shock induced acute kidney injury: apoptosis and
leukocytic infiltration. Intens Care Med. 2010;36(3):471–8.
40. White KC, Serpa-Neto A, Hurford R, Clement P, Laupland KB, See E, et al.
Sepsis-associated acute kidney injury in the intensive care unit: incidence,
patient characteristics, timing, trajectory, treatment, and associated outcomes.
A multicenter, observational study. Intensive Care Med [Internet]. 2023 July 11 [cited 2023 Aug 2]; Available from: https:// doi. org/ 10. 1007/s00134- 023- 07138-0.
41. Peerapornratana S, Manrique-Caballero CL, Gуmez H, Kellum JA. Acute
kidney injury from sepsis: current concepts, epidemiology, pathophysiology,
prevention and treatment. Kidney Int. 2019;96(5):1083–99.
42. Kellum JA, Chawla LS, Keener C, Singbartl K, Palevsky PM, Pike FL, et al.
The effects of alternative resuscitation strategies on acute kidney injury in
patients with septic Shock. Am J Respir Crit Care Med. 2016;193(3):281–7.
43. Iba T, Di Nisio M, Thachil J, Wada H, Asakura H, Sato K, et al. Revision of the Japanese Association for Acute Medicine (JAAM) disseminated intravascular
coagulation (DIC) diagnostic criteria using antithrombin activity. Crit Care. 2016;20(1):287.
44. Iba T, Umemura Y, Watanabe E, Wada T, Hayashida K, Kushimoto S, et al.
Diagnosis of sepsis‐induced disseminated intravascular coagulation and
coagulopathy. Acute Med Surg. 2019 Apr;ams2.411.
45. Iba T, Levy JH, Yamakawa K, Thachil J, Warkentin TE, Levi M. Proposal of
a two-step process for the diagnosis of sepsis-induced disseminated intravascular coagulation. J Thromb Haemost. 2019;17(8):1265–8.
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 08.05.2024
[~DATE_ACTIVE_FROM] => 08.05.2024
[ACTIVE_FROM_X] => 2024-05-08 00:00:00
[~ACTIVE_FROM_X] => 2024-05-08 00:00:00
[ACTIVE_FROM] => 08.05.2024
[~ACTIVE_FROM] => 08.05.2024
[SHOW_COUNTER] => 338
[~SHOW_COUNTER] => 338
[ID] => 8437
[~ID] => 8437
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 11.11.2024 14:06:09
[~TIMESTAMP_X] => 11.11.2024 14:06:09
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/disseminirovannoe-vnutrisosudistoe-svertyvanie-tesno-svyazano-s-tyazhelym-ostrym-povrezhdeniem-poche/
[~DETAIL_PAGE_URL] => /library/articles/disseminirovannoe-vnutrisosudistoe-svertyvanie-tesno-svyazano-s-tyazhelym-ostrym-povrezhdeniem-poche/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => disseminirovannoe-vnutrisosudistoe-svertyvanie-tesno-svyazano-s-tyazhelym-ostrym-povrezhdeniem-poche
[~CODE] => disseminirovannoe-vnutrisosudistoe-svertyvanie-tesno-svyazano-s-tyazhelym-ostrym-povrezhdeniem-poche
[EXTERNAL_ID] => 8437
[~EXTERNAL_ID] => 8437
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 8 мая 2024
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
[PREVIEW_PICTURE] => Array
(
[ID] => 5636
[TIMESTAMP_X] => 11.11.2024 14:06:09
[MODULE_ID] => iblock
[HEIGHT] => 667
[WIDTH] => 1000
[FILE_SIZE] => 93908
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/6c6/zi3ilib2w07eh3ixengk927r2j70ivpi
[FILE_NAME] => portrait-friendly-doctor-isolated-gray.jpg
[ORIGINAL_NAME] => portrait-friendly-doctor-isolated-gray.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 7f9b14a798910e5339da85bbb304f1b2
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/6c6/zi3ilib2w07eh3ixengk927r2j70ivpi/portrait-friendly-doctor-isolated-gray.jpg
[UNSAFE_SRC] => /upload/iblock/6c6/zi3ilib2w07eh3ixengk927r2j70ivpi/portrait-friendly-doctor-isolated-gray.jpg
[SAFE_SRC] => /upload/iblock/6c6/zi3ilib2w07eh3ixengk927r2j70ivpi/portrait-friendly-doctor-isolated-gray.jpg
[ALT] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
[TITLE] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
)
[DETAIL_TEXT] =>
J Helms, H Merdji, S Loewert, F Severac, A Monnier, J Kaurin, A Curtiaud, F Meziani and J Demiselle
Disseminated intravascular coagulation is strongly associated with severe acute kidney injury in patients with septic shock
Annals of Intensive Care (2023) 13:119
doi.org/10.1186/s13613-023-01216-8
Абстракт
Диссеминированное внутрисосудистое свертывание (ДВС) ухудшает прогноз септического шока и способствует полиорганной недостаточности. На сегодняшний день нет данных, связывающих возникновение, тяжесть и развитие ДВС-синдрома и острого повреждения почек (ОПП) в этих условиях. Целью нашей работы было проанализировать связь между возникновением, тяжестью и развитием ОПП у пациентов с ДВС-синдромом, вызванным септическим шоком. В проспективном моноцентровом когортном исследовании участвовали последовательные пациенты в возрасте 18 лет и старше, поступившие в отделение интенсивной терапии Страсбургской университетской больницы с системной гипотензией, требующей применения вазопрессора, связанной с инфекцией, без терминальной стадии хронической болезни почек в анамнезе. ОПП определяли по классификации KDIGO. Диагностика ДВС-синдрома основывалась на шкале Международного общества тромбозов и гемостаза (ISTH). Эволюцию ОПП оценивали по комбинированной конечной точке, состоящей из основных неблагоприятных событий со стороны почек. Рассматривались только пациенты с ДВС-синдромом, возникшим до или во время диагностики ОПП. Для определения факторов, связанных с почечными исходами, был проведен одномерный и многомерный анализ.
В исследование было включено 350 пациентов, из которых у 129 развился ДВС-синдром. Пациенты с ДВС-синдромом были более тяжелыми (медиана SAPS II 64 против 56, р <0,001) и имели более высокую 28-дневную смертность (43,3% против 26,2%, р<0,001). ОПП чаще встречалось у пациентов с ДВС-синдромом (86,8% против 74,2%, p < 0,005), особенно на более тяжелой стадии ОПП [KDIGO 3 у 58,1% пациентов с ДВС-синдромом против 30,8% пациентов без ДВС-синдрома, p < 0,001, ОПП, требующее заместительной почечной терапии (ЗПТ), у 47,3% пациентов с ДВС-синдромом против 21,3% пациентов без ДВС-синдрома, p < 0,001]. После поправки на мешающие факторы возникновение ДВС-синдрома оставалось связанным с риском развития более тяжелой стадии ОПП с отношением шансов (ОШ) 2,74 [ИК 95% (1,53–4,91), р < 0,001] и с риском необходимости ЗПТ во время пребывания в ОИТ [ОШ 2,82 (1,53–5,2), p < 0,001].
ДВС-синдром, по-видимому, тесно связан с риском развития более тяжелой формы ОПП (3-я стадия классификации KDIGO, требование ЗПТ), даже после поправки на тяжесть и другие соответствующие факторы.
Ключевые слова: диссеминированное внутрисосудистое свертывание крови, сепсис, септический шок, острое повреждение почек, острая болезнь почек.
Введение
Острое повреждение почек (ОПП) в отделении интенсивной терапии (ОРИТ) связано с более высоким уровнем смертности, при этом существует тесная связь между тяжестью ОПП и смертностью [1, 2]. Сообщалось также, что ОПП связано с худшим долгосрочным исходом: пациенты, у которых возникло ОПП во время пребывания в ОИТ, подвергаются более высокому риску развития хронической болезни почек (ХБП) и серьезных сердечно-сосудистых событий [3,4]. Помимо общих факторов, связанных с ОПП в ОИТ, септический шок остается основным триггером ОПП [5]. Однако патофизиология ОПП, вызванного сепсисом, сложна и до сих пор плохо изучена. Хотя в нем, безусловно, участвуют такие факторы, как воспаление, окислительный стресс, микрососудистая дисфункция и ишемия канальцевых эпителиальных клеток [6, 7], диссеминированное внутрисосудистое свертывание (ДВС) также может способствовать развитию ОПП. ДВС-синдром возникает в результате чрезмерной активации коагуляции наряду с дефектом антикоагулянтной и фибринолитической регуляторных систем [8,9] и, таким образом, приводит к диссеминированному микротромбозу, что может способствовать органной дисфункции во время септического шока [10, 11]. Поскольку у 30–40% пациентов с септическим шоком развивается ДВС-синдром, что связано с тяжестью заболевания и увеличением смертности [12, 13], он может вносить значительный вклад в развитие ОПП. Однако лишь немногие исследования изучали связь между ДВС и ОПП. Было высказано предположение о более высокой частоте ОПП у пациентов с септическим шоком и ДВС-синдромом, но эта возможная связь не анализировалась с корректировкой вмешивающихся переменных, в основном тяжести заболевания [14, 15]. Таким образом, данное исследование было направлено на изучение связи между ДВС-синдромом и ОПП у пациентов с септическим шоком, уделяя особое внимание возникновению, тяжести и динамике развития ОПП.
Методы
Дизайн исследования
Проспективное когортное исследование проводилось в период с июля 2013 г. по март 2019 г. в ОИТ университетской больницы Страсбурга (Франция). Критериями включения были пациенты в возрасте 18 лет и старше, поступившие в ОИТ по поводу септического шока в соответствии с определением «Сепсис-2». Пациентов необходимо было включить в исследование в течение 12 часов после начала приема вазопрессоров. Пациенты в агональном состоянии на этапе скрининга, или пациенты с ограничением поддерживающей жизнь терапии при поступлении были исключены. Пациенты, находящиеся под правовой защитой (невозможность дать согласие, тюремное заключение…) были исключены. Пациенты, уже включенные в настоящее исследование, были исключены в случае повторной госпитализации, а пациенты, у которых развился шок позже во время пребывания в ОИТ, не подвергались скринингу. Кроме того, из исследования были исключены пациенты с терминальной хронической болезнью почек (5 стадия ХБП [16], находящиеся на заместительной почечной терапии или реципиенты трансплантата почки). Чтобы определить связь между ДВС-синдромом и ОПП и его тяжестью, были исключены пациенты, у которых ДВС-синдром был диагностирован после того, как ОПП достигло более высокой стадии.
Сбор данных
Проспективно записывались следующие данные: возраст, пол, индекс массы тела, сопутствующие заболевания и индекс Чарльсона [17]. Острое состояние характеризовалось: тяжестью по шкале SAPSII и SOFA [18, 19], гемодинамическими параметрами (среднее артериальное давление, диурез), источником инфекции, внутрибольничными или внебольничными инфекциями, а также собирались доступные микробиологические данные. Мы зарегистрировали все поддерживающие методы лечения, необходимые во время пребывания в ОИТ (ИВЛ, вазопрессоры, инфузионная терапия, заместительная почечная терапия (RRT)] и их продолжительность. Смертность оценивалась в конце пребывания в ОИТ и стационаре, а также на 28-й день.
Определения
• Частота и тяжесть ОПП определялись в соответствии с классификацией KDIGO [20]. Стадию 1 (KDIGO1) рассматривали, когда уровень креатинина в сыворотке крови увеличивался как минимум на 26 мкмоль/л или в 1,5–1,9 раза по сравнению с исходным уровнем или если диурез был ниже 0,5 мл/кг/ч в течение 6–12 часов. Стадия 2 (KDIGO2) - если креатинин сыворотки увеличивался более чем в два раза по сравнению с исходным уровнем или если диурез был менее 0,5 мл/кг/час в течение как минимум 12 часов. Стадия 3 (KDIGO 3) представляла собой наиболее тяжелую форму ОПП и определялась как повышение уровня креатинина в сыворотке крови более, чем в три раза по сравнению с исходным уровнем или был выше 354 мкмоль/л, либо необходимость ЗПТ или диурез ниже 0,3 мл/кг/ ч в течение как минимум 24 ч или анурия в течение как минимум 12 ч.
• Исходный уровень креатинина сыворотки: для каждого пациента, если таковой имеется, креатинин сыворотки перед госпитализацией учитывался в течение периода времени минимум 7 дней и максимум 1 года с момента госпитализации. В случае отсутствия данных, когда креатинин в сыворотке был повышен при поступлении, исходный уровень креатинина в сыворотке экстраполировали с использованием формулы MDRD [21], предполагая, что исходная расчетная скорость клубочковой фильтрации (СКФ) составляет 75 мл/мин/1,73 м2, как предложено в руководствах [20]. Пациентов относили к считали ХБП, когда исходная СКФ была ниже 60 мл/мин/1,73 м2.
Для описания развития ОПП мы собрали, насколько это возможно, критерии острого заболевания почек, которое определялось как персистирующее ОПП (стадия 1 или выше по классификации KDIGO) в течение более 7 дней. Кроме того, в конце пребывания в больнице для каждого пациента были собраны критерии комбинированной конечной точки для серьезного нежелательного явления со стороны почек (MAKE) в конце госпитализации. MAKE определялся как комбинированный критерий смерти, потребности в ЗПТ или ухудшения функции почек (двукратное увеличение уровня креатинина в сыворотке крови по сравнению с исходным уровнем) в конце периода госпитализации [22].
• Диагностика ДВС-синдрома основывалась на шкале Международного общества по тромбозам и гемостазу (ISTH) [23], и, соответственно, балл, превышающий или равный 5, был сохранен для диагностики ДВС-синдрома. Биологические тесты для диагностики ДВС-синдрома проводились при поступлении в ОИТ и ежедневно до 7-го дня.
• Нефротоксичные препараты: все потенциально нефротоксичные препараты, назначаемые до поступления в ОИТ и до возникновения ОПП во время пребывания в ОИТ, из заранее определенного списка, основанного на предыдущей работе [24], были идентифицированы в карте пациента (см. Additional file 1).
Этические проблемы
Дизайн исследования был одобрен этическим комитетом Страсбурга (Comite de Protection des Personnes N° 12/35, DC-2012-1633). Перед включением,от всех пациентов было получено письменное информированное согласие. Если пациенты не могли дать информированное согласие, оно было получено от их ближайших родственников или другого лица, замещающего лицо, принимающее решения, в зависимости от обстоятельств. У этих пациентов согласие post hoc было получено как можно скорее.
Статистика
Количественные данные выражались как среднее значение, стандартное отклонение, медиана и межквартильный размах (IQR) для параметрического и непараметрического распределения соответственно и сравнивались с использованием t-критерия Стьюдента или ранговой суммы Вилкоксона при необходимости. Качественные переменные сравнивали с использованием χ2 или точного критерия Фишера. Для выявления факторов, связанных с возникновением, тяжестью и развитием ОПП (критерии MAKE в конце пребывания в стационаре), таких как отношения шансов, были использованы модели логистической регрессии. На первом этапе одномерный анализ проводился для каждой исходной характеристической переменной независимо друг от друга. На втором этапе были построены многомерные модели с использованием переменных, имеющих клиническую значимость и/или со значением p <0,2 в одномерном анализе. Если некоторые ковариаты сильно коррелировали между собой, в многомерную модель включался наиболее связанный. Некоторые непрерывные переменные (норадреналин и введение жидкости) были преобразованы в качественные переменные в соответствии с клинически значимыми значениями. Поскольку частота и тяжесть ОПП в ОИТ влияет на смертность и продолжительность пребывания в ОИТ, мы провели анализ выживаемости в ОИТ без возникновения ОПП 3-й стадии у пациентов с ДВС-синдромом и без него (диагноз ДВС считался исходным) в течение первых 7 дней. Выживаемость без ОПП 3-й стадии оценивалась по методу Каплана-Мейера и сравнивалась между двумя группами с использованием лог-рангового теста.
Результаты
Из 437 пациентов исходной группы 350 пациентов соответствовали критериям участия и были включены в исследование. Причины исключения пациентов представлены на схеме (Fig. 1). Исходные характеристики представлены в Table 1. Включенные пациенты были преимущественно мужчинами, средний возраст 69 лет. Пациенты были в тяжелом состоянии, медиана SAPS II составляла 58 (48–73) баллов. Заболевания сердечно-сосудистой системы были наиболее частой сопутствующей патологией. Исходный уровень креатинина сыворотки был недоступен у 106 пациентов (30,3%) и был экстраполирован с помощью расчета по уравнению MDRD как запланировано в дизайне исследования. Инфекции, вызывающие септический шок, были в основном внебольничными.

Всем пациентам потребовалась вазопрессорная терапия с норэпинефрином в качестве первого препарата, а большинству из них (n = 306, 87,4%) потребовалась искусственная вентиляция легких. Среди 350 включенных пациентов у 129 развился ДВС-синдром, а у 221 - нет. ДВС-синдром возник в первый день у 92 пациентов, во второй день у 22 пациентов, в третий день у 7 и между 4 и 7 днями у 8 пациентов. Коагуляционные тесты при поступлении и при диагностике ДВС-синдрома представлены в Additional file 2: Table S1. У пациентов с ДВС-синдромом не было другой причины его развития , кроме сепсиса. Состояние пациентов с ДВС-синдромом было более тяжелым. Как показано в Table 1, хотя у пациентов с ДВС-синдромом было меньше сопутствующих заболеваний, их баллы тяжести (SOFA и SAPSII) при поступлении в ОИТ были выше. Между пациентами с ДВС-синдромом и без него не было различий по источнику инфекции, внебольничному или нозокомиальному характеру инфекции и микробиологическим данным. Вследствие более высокой степени тяжести пациентам с ДВС-синдромом требовались более высокие дозы норадреналина и более частая инвазивная искусственная вентиляция легких. Среди 129 пациентов с ДВС-синдромом 11 страдали циррозом печени, из них 6 соответствовали критериям ISTH для ДВС-синдрома без компонента протромбинового времени. У остальных пяти пациентов в качестве дополнительного критерия учитывалось снижение количества тромбоцитов не менее, чем на 30% с течением времени [25]. Аналогичным образом, у пациентов, получавших пероральные антикоагулянты с антагонистами витамина К, диагноз ДВС-синдрома сохранялся только в том случае, если они соответствовали критериям ISTH без компонента протромбинового времени и положительному баллу JAAM 2016.

У пациентов с ДВС-синдромом наблюдались более высокие показатели смертности и частота ОПП.
У пациентов с ДВС-синдромом уровень смертности был выше, чем у пациентов без ДВС-синдрома (43,3% против 26,2% соответственно, p < 0,01 для смертности в ОИТ). ОПП возникло у 276 больных (78,9%). У 256 пациентов ОПП началось в течение первых 24 ч после поступления в ОИТ и достигло высшей стадии в 1-й день у 185 пациентов, на 2-й день у 62 пациентов, на 3-й день у 13 пациентов и между 4-м и 7-м днями у остальных 16 пациентов. ОПП чаще встречалось у пациентов с ДВС-синдромом: 112 (86,8%) против 164 (74,2%) у пациентов без ДВС-синдрома (p = 0,005) (см. Fig. 2 and Additional file 3: Fig. S1a ). ОПП и ДВС-синдром возникли в один и тот же день у 95 из 112 пациентов.

У пациентов с ДВС-синдромом чаще развивалось тяжелое ОПП и они соответствовали критериям MAKE.
У пациентов с ДВС-синдромом чаще развивалось тяжелое ОПП, достигающее 3-й стадии по классификации KDIGO у 73/129 пациентов с ДВС-синдромом (58,1%) против 68/221 пациентов без ДВС-синдрома (30,8%) соответственно (p <0,001) (see Fig. 2 and Additional file 3: Fig. S1b ). ОПП 3 стадии и ДВС-синдром возникли в один и тот же день у 57 из 73 пациентов.
Среди пациентов с ОПП 3 стадии 108 потребовалась ЗПТ во время пребывания в ОИТ (61 из 129 пациентов с ДВС-синдромом (47,3%) против 47 из 221 пациентов без ДВС-синдрома (21,3%), p < 0,001). Мы обнаружили, что чем выше балл ISTH, тем выше доля пациентов с ОПП 3 стадии (p < 0,001) (Fig. 3). Связь между показателем ISTH и другими Результаты представлены в Additional file 2: Table S2.

Анализ кривой Каплана-Мейера, оценивающий вероятность развития ОПП 3-й стадии по классификации KDIGO, показал более высокий риск для пациентов с ДВС-синдромом по сравнению с пациентами без ДВС-синдрома, демонстрируя отношение рисков 2,05 (1,48-2,85), p < 0,001 (log-rank test) (Fig. 4) (данные цензурированы по смертям и переводам из ОИТ). ОПП была оценена у 236 пациентов, поскольку те, кто умер до 7-го дня после госпитализации, не подходили для этой оценки. Среди пациентов с доступной оценкой функции почек после 7-го дня у 74 развилась ОПП (31,4%), из них у 34 был ДВС-синдром, а у 40 не было ДВС [34/75 (45,3%) против 40/161 (24,8%), p = 0,002 χ2 тест].

К концу пребывания в стационаре 71 пациент (55%) с ДВС-синдромом соответствовал критериям MAKE по сравнению с 78 пациентами (35,3%) без ДВС-синдрома (р < 0,001). После корректировки по сооснователям ДВС-синдром оставался значимо связанным с тяжестью ОПП и необходимостью заместительной почечной терапии. После корректировки по кофаундерам ДВС-синдром все еще был значимо связан с более высоким риском ОПП 3 по KDIGO с отношением шансов (ОШ) 2,74 [IC 95% (1,53–4,91), p < 0,001] (Table 2). Другими факторами, достоверно связанными с ОПП KDIGO3, были ХБП в анамнезе [ОШ 2,42 (1,03–5,68), p = 0,043), более высокий SAPS II [ОШ 1,06 (1,04–1,07), на прирост на 1 балл p < 0,001] и возраст [ОШ] 0,97 (0,95–0,99), р = 0,011]. Также была обнаружена связь между ДВС-синдромом и потребностью в ЗПТ [ОШ 2,83 (1,53–5,20), р < 0,001] (Table 3). При рассмотрении ОПП — независимо от его стадии — возникновение ДВС-синдрома больше не было связано ни с возникновением ОПП после многомерного анализа, ни с MAKE в конце пребывания в стационаре (Additional file 2:Tables S3 and 4).

Обсуждение
В этой проспективной когорте пациентов с септическим шоком ДВС-синдром был связан с почти трехкратным увеличением риска развития более тяжелой стадии ОПП (KDIGO3) и необходимости ЗПТ, что позволяет предположить, что ДВС-синдром ухудшает прогноз пациентов с септическим шоком и способствует множественной органной недостаточности и степени ее выраженности. Однако после корректировки ДВС-синдром не был связан с критериями ОПП или MAKE. Эти выводы представляют интерес. Действительно, если ранее сообщалось, что возникновение ДВС-синдрома является независимым фактором, связанным как с тяжестью, так и со смертностью, у пациентов с септическим шоком [11, 12, 26, 27] связь между ОПП и ДВС-синдромом изучена недостаточно.
В ретроспективной когорте пациентов с септическим шоком, вызванным внутрибрюшной инфекцией, Xu et al. [28] показали, что некоторые биомаркеры свертывания крови (аЧТВ, протромбиновое время и D-димеры) при поступлении в ОИТ были значимо связаны с ОПП после многовариантного логистического регрессионного анализа, что позволяет предположить, что активация свертывания крови может играть роль в развитии ОПП. Другое ретроспективное исследование предположило связь между ДВС-синдромом и ОПП, поскольку биомаркеры повреждения эндотелия (такими как растворимый тромбомодулин, Е-селектин, белок С и ингибитор активатора плазминогена-1) были связаны с возникновением ОПП [29]. В этом исследовании ДВС-синдром был связан с ОПП при одномерном анализе, но никаких корректировок с кофаундерами не проводилось, а время возникновения ДВС-синдрома и ОПП не описано.
При остром и хроническом заболевании почек система свертывания крови и передача сигналов, зависящая от протеазы свертывания крови, могут быть изменены [30]. Регуляторы и рецепторы свертывания крови играют ключевую роль в гемостазе и негемостатических функциях почек. Действительно было показано, что протеазы коагуляции способны изменять функцию почечных клеток через активируемые протеазами рецепторы (PAR) и корецепторы, в то время как активированный протеин С будет оказывать нефропротективное действие, которое, по крайней мере, частично не зависит от его антикоагулянтной функции. Поэтому неудивительно, что чрезмерная активация коагуляции может изменить функцию почек.
В моноцентрическом ретроспективном исследовании, включавшем 582 пациента в критическом состоянии, явный ДВС-синдром был связан с возникновением ОПП в однофакторном, но не в многомерном анализе.
анализ, и ДВС-синдром был связан с более высокой смертностью в многомерном анализе [31]. Другие исследования подчеркнули эту связь [14, 15, 32]; однако ни одно из этих исследований не предоставило четкой информации относительно: (1) времени развития ОПП и (2) тяжести ОПП. Поэтому план нашего исследования является оригинальным в отношении этих двух пунктов. Действительно, мы попытались оценить раннее течение как ОПП, так и ДВС-синдрома во время септического шока. Учитывая это, мы включили пациентов, которые соответствовали критериям ОПП и ДВС-синдрома в один и тот же период времени.
С патофизиологической точки зрения в настоящее время признано, что ОПП, связанное с септическим шоком, является многофакторным заболеванием, обусловленным не только гипоперфузией почек. ОПП, связанное с сепсисом, включает в себя множество механизмов, включая окислительный стресс, воспаление, адаптацию канальцевых клеток к повреждению, изменения почечной гемодинамики и дисфункцию микроциркуляции [7, 33]. Нарушение микроциркуляции почек при сепсисе связано как с изменением почечного кровотока [34], так и с повреждением эндотелия [35, 36], особенно перитубулярных капилляров [37]. В результате эндотелиальные биомаркеры, такие как, например, растворимый тромбомодулин, оказались независимыми прогностическими биомаркерами АКИ [29], хотя с этим следует повременить, поскольку растворимый тромбомодулин выводится почками.
Такое взаимодействие между ОПП и эндотелиальной дисфункцией подтверждает гипотезу о том, что ОПП и ДВС-синдром могут быть связаны.
ДВС действительно возникает в результате чрезмерной активации путей свертывания крови, связанной с повреждением сосудистого эндотелия и гипофибринолизом [10, 38], что в конечном итоге приводит к образованию диссеминированных микротромбов, ухудшающих микроциркуляцию. Таким образом, ДВС-синдром вносит основной вклад в развитие или ухудшение органной недостаточности [10, 11]. Однако гистопатологические изменения не подтверждают такую связь. Действительно, при посмертной биопсии почек 19 пациентов с септическим шоком артериолярные тромбозы были обнаружены только у 4 пациентов, независимо от наличия или отсутствия ДВС-синдрома [39]. Настоящее исследование также страдает от некоторых недостатков: будучи моноцентровым, обобщение полученных результатов не представляется возможным. Основным ограничением настоящего исследования является то, что, несмотря на дизайн нашего исследования, ДВС-синдром и ОПП возникали одновременно более чем у 80% пациентов и у 76% пациентов с ОПП KDIGO3 и ДВС-синдромом.
В других странах высокая частота ОПП (78,9%) ограничивает внешнюю достоверность нашего исследования. Однако такая высокая заболеваемость может быть объяснена тяжестью включенных пациентов (медиана SAPS II 61 балл) и определением случаев ОПП строго по определению KDIGO с учетом критериев диуреза. Действительно, в большой многоцентровой обсервационной когорте сообщалось, что учет или отсутствие компонента диуреза приводит к значительной разнице в количестве пациентов с диагнозом сепсис-индуцированной АКИ, а также к различиям в общей и почечной эволюции [40]. Кроме того, эпидемиология ОПП, вызванного сепсисом, изучена недостаточно [41]. Однако в апостериорном анализе исследования ProCESS ОПП возникло у 69% пациентов с септическим шоком в течение первых 7 дней после поступления в ОИТ, что наиболее близко к нашим данным, с меньшей тяжестью (29,7% пациентов с ОПП KDIGO 3). [42].
Такая высокая частота ОПП у пациентов с высокой степенью тяжести может объяснить отсутствие связи между ОПП и ДВС-синдромом после поправки на вмешивающиеся факторы из-за недостаточной статистической мощности. К сожалению, данные о состоянии почек на 7-й день отсутствовали у 33% пациентов, что не позволяет сделать какие-либо выводы об эволюции почек.. Чтобы справиться с этой проблемой, мы собрали критерии классификации MAKE, которые, как сообщается, являются подходящим составным критерием для иллюстрации клинически значимых неблагоприятных исходов после ОПП: новый этап гемодиализа, смерть и стойкое нарушение функции почек (с переменным диапазоном такого определения). Связь между ДВС-синдромом и пациентами, которые соответствовали критериям MAKE, не была обнаружена после корректировки, но время этой оценки (окончание госпитализации), вероятно, слишком рано для значимой оценки восстановления функции почек у пациентов, перенесших септический шок. Наконец, мы выбрали оценку ISTH [23] для определения ДВС-синдрома, тогда как другие шкалы, такие как Японская ассоциация неотложной медицины-ДВС (JAAM-DIC) [43], были предложены для более раннего распознавания ДВС-синдрома в условиях сепсиса. Если оптимальная оценка для диагностики ДВС остается предметом споров [44], то сегодня научные общества рекомендуют оценку ISTH [45].
Заключение
В этой проспективной когорте пациентов с септическим шоком ДВС-синдром был тесно связан с риском ОПП KDIGO3, даже после поправки на тяжесть и другие соответствующие факторы. Разумеется, данное исследование не может установить причинно-следственную связь. Если ДВС действительно играет роль в патогенезе ОПП у пациентов с септическим шоком, предстоящие исследования, посвященные ДВС-синдрому, вероятно, должны включить ОПП в качестве значимого исхода. Аналогичным образом, исследовательские усилия по изучению ОПП в контексте сепсиса и его факторов риска, возможно, должны учитывать ДВС-синдром как потенциальный способствующий фактор, и это соображение до сих пор не рассматривалось.
Ссылка на документ с дополнительными данными исследования (Supplementary) - Часть 1.
Ссылка на документ с дополнительными данными исследования (Supplementary) - Часть 2.
References
1. Bagshaw SM, Lapinsky S, Dial S, Arabi Y, Dodek P, Wood G, et al. Acute kidney injury in septic shock: clinical outcomes and impact of duration of hypotension prior to initiation of antimicrobial therapy. Intens Care Med.2009;35(5):871–81.
2. Metnitz PGH, Krenn CG, Steltzer H, Lang T, Ploder J, Lenz K, et al. Effect of
acute renal failure requiring renal replacement therapy on outcome in critically ill patients. Crit Care Med. 2002;30(9):2051–8.
3. Coca SG, Singanamala S, Parikh CR. Chronic kidney disease after acute kidney injury: a systematic review and meta-analysis. Kidney Int. 2012;81(5):442–8.
4. Wu VC, Wu CH, Huang TM, Wang CY, Lai CF, Shiao CC, et al. Long-term risk of coronary events after AKI. J Am Soc Nephrol. 2014;25(3):595–605.
5. Uchino S, Kellum JA, Bellomo R, Doig GS, Morimatsu H, Morgera S, et al.
Acute renal failure in critically ill patients: a multinational, multicenter study. JAMA. 2005;294(7):813–8.
6. Bellomo R, Kellum JA, Ronco C, Wald R, Martensson J, Maiden M, et al.Acute kidney injury in sepsis. Intens Care Med. 2017;43(6):816–28.
7. Gomez H, Ince C, De Backer D, Pickkers P, Payen D, Hotchkiss J, et al. А
unified theory of sepsis-induced acute kidney injury: inflammation, microcirculatory dysfunction, bioenergetics, and the tubular cell adaptation to injury. Shock. 2014;41(1):3–11.
8. Helms J, Iba T, Connors JM, Gando S, Levi M, Meziani F, et al. How to manage coagulopathies in critically ill patients. Intensive Care Med. 2023;49(3):273–90.
9. da Cruz DB, Helms J, Aquino LR, Stiel L, Cougourdan L, Broussard C, et al.
DNA-bound elastase of neutrophil extracellular traps degrades plasminogen,
reduces plasmin formation, and decreases fibrinolysis: proof of concept in septic shock plasma. FASEB J. 2019;33(12):14270–80.
10. Delabranche X, Helms J, Meziani F. Immunohaemostasis: a new view on
haemostasis during sepsis. Ann Intens Care. 2017;7(1):117.
11. Hartemink KJ, Hack CE, Groeneveld ABJ. Relation between coagulation/
fibrinolysis and lactate in the course of human septic shock. J Clin Pathol.
2010;63(11):1021–6.
12. Gando S, Shiraishi A, Yamakawa K, Ogura H, Saitoh D, Fujishima S, et al.
Role of disseminated intravascular coagulation in severe sepsis. Thromb Res. 2019;178:182–8.
13. Okabayashi K, Wada H, Ohta S, Shiku H, Nobori T, Maruyama K. Hemostatic
markers and the sepsis-related organ failure assessment score in patients with disseminated intravascular coagulation in an intensive care unit. Am J Hematol. 2004;76(3):225–9.
14. Delabranche X, Quenot JP, Lavigne T, Mercier E, Franзois B, Severac F, et al. Early detection of disseminated intravascular coagulation during septic shock: a multicenter prospective study. Crit Care Med. 2016;44(10):e930-939.
15. Dhainaut JF, Yan SB, Joyce DE, Pettila V, Basson B, Brandt JT, et al. Treatment effects of drotrecogin alfa (activated) in patients with severe sepsis with or without overt disseminated intravascular coagulation1. J Thromb Haemost. 2004;2(11):1924–33.
16. KDIGO 2012 clinical practice guideline for the evaluation and management
of chronic kidney disease. Kidney International Supplements. 2013 Jan;3(1):1–150.
17. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and
validation. J Chronic Dis. 1987;40(5):373–83.
18. Le Gall JR, Lemeshow S, Saulnier F. A new simplified acute physiology score (SAPS II) based on a European/North American multicenter study.JAMA. 1993;270(24):2957–63.
19. Vincent JL, Moreno R, Takala J, Willatts S, De Mendonзa A, Bruining H, et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine. Intensive Care Med. 1996;22(7):707–10.
20. Ad-hoc working group of ERBP, Fliser D, Laville M, Covic A, Fouque D,
Vanholder R, et al. A European Renal Best Practice (ERBP) position statement on the Kidney Disease Improving Global Outcomes (KDIGO) clinical practice guidelines on acute kidney injury: part 1: definitions, conservative management and contrast-induced nephropathy. Nephrol Dial Transpl. 2012;27(12):4263–72.
21. Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF, Feldman HI, et al.
A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009;150(9):604–12.
22. Palevsky PM, Molitoris BA, Okusa MD, Levin A, Waikar SS, Wald R, et al.
Design of clinical trials in acute kidney injury: report from an NIDDK workshop on trial methodology. CJASN. 2012;7(5):844–50.
23. Taylor FB, Toh CH, Hoots WK, Wada H, Levi M, Scientific Subcommittee on
Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost. 2001;86(5):1327–30.
24. Ehrmann S, Helms J, Joret A, Martin-Lefevre L, Quenot JP, Herbrecht JE,et al. Nephrotoxic drug burden among 1001 critically ill patients: impact on acute kidney injury. Ann Intens Care. 2019;9(1):106.
25. Wada H, Takahashi H, Uchiyama T, Eguchi Y, Okamoto K, Kawasugi K, et al.
The approval of revised diagnostic criteria for DIC from the Japanese Society on Thrombosis and Hemostasis. Thromb J. 2017;15:17.
26. Vallet B. Bench-to-bedside review: endothelial cell dysfunction in severe
sepsis: a role in organ dysfunction? Crit Care. 2003;7(2):130–8.
27. Fourrier F, Chopin C, Goudemand J, Hendrycx S, Caron C, Rime A, et al.
Septic shock, multiple organ failure, and disseminated intravascular coagulation. Compared patterns of antithrombin III, protein C, and protein S deficiencies. Chest. 1992;101(3):816–23.
28. Xu Z, Cheng B, Fu S, Liu X, Xie G, Li Z, et al. Coagulative biomarkers on
admission to the ICU predict acute kidney injury and mortality in patients with septic shock caused by intra-abdominal infection. Infect Drug Resist. 2019;12:2755–64.
29. Katayama S, Nunomiya S, Koyama K, Wada M, Koinuma T, Goto Y, et al.
Markers of acute kidney injury in patients with sepsis: the role of soluble
thrombomodulin. Crit Care. 2017;21(1):229.
30. Madhusudhan T, Kerlin BA, Isermann B. The emerging role of coagulation
proteases in kidney disease. Nat Rev Nephrol. 2016;12(2):94–109.
31. Zhi DY, Lin J, Zhuang HZ, Dong L, Ji XJ, Guo DC, et al. Acute kidney injury
in critically ill patients with sepsis: clinical characteristics and outcomes. J Invest Surg. 2019;32(8):689–96.
32. Delabranche X, Boisramй-Helms J, Asfar P, Berger A, Mootien Y,Lavigne T, et al. Microparticles are new biomarkers of septic shock induced disseminated intravascular coagulopathy. Intens Care Med.2013;39(10):1695–703.
33. De Vriese AS. Prevention and treatment of acute renal failure in sepsis. J
Am Soc Nephrol. 2003;14(3):792–805.
34. Tiwari MM, Brock RW, Megyesi JK, Kaushal GP, Mayeux PR. Disruption
of renal peritubular blood flow in lipopolysaccharide-induced renal failure: role of nitric oxide and caspases. Am J Physiol Renal Physiol.2005;289(6):F1324-1332.
35. Umbro I, Gentile G, Tinti F, Muiesan P, Mitterhofer AP. Recent advances in
pathophysiology and biomarkers of sepsis-induced acute kidney injury. J Infect. 2016;72(2):131–42.
36. Schrier RW, Wang W. Acute renal failure and sepsis. N Engl J Med.2004; 351(2):159–69.
37. Wu L, Tiwari MM, Messer KJ, Holthoff JH, Gokden N, Brock RW, et al.
Peritubular capillary dysfunction and renal tubular epithelial cell stress following lipopolysaccharide administration in mice. Am J Physiol Renal Physiol. 2007;292(1):F261-268.
38. Iba T, Levi M, Thachil J, Levy JH. Disseminated intravascular coagulation:
the past, present, and future considerations. Semin Thromb Hemost. 2022;48(8):978–87.
39. Lerolle N, Nochy D, Guйrot E, Bruneval P, Fagon JY, Diehl JL, et al. Histopathology of septic shock induced acute kidney injury: apoptosis and
leukocytic infiltration. Intens Care Med. 2010;36(3):471–8.
40. White KC, Serpa-Neto A, Hurford R, Clement P, Laupland KB, See E, et al.
Sepsis-associated acute kidney injury in the intensive care unit: incidence,
patient characteristics, timing, trajectory, treatment, and associated outcomes.
A multicenter, observational study. Intensive Care Med [Internet]. 2023 July 11 [cited 2023 Aug 2]; Available from: https:// doi. org/ 10. 1007/s00134- 023- 07138-0.
41. Peerapornratana S, Manrique-Caballero CL, Gуmez H, Kellum JA. Acute
kidney injury from sepsis: current concepts, epidemiology, pathophysiology,
prevention and treatment. Kidney Int. 2019;96(5):1083–99.
42. Kellum JA, Chawla LS, Keener C, Singbartl K, Palevsky PM, Pike FL, et al.
The effects of alternative resuscitation strategies on acute kidney injury in
patients with septic Shock. Am J Respir Crit Care Med. 2016;193(3):281–7.
43. Iba T, Di Nisio M, Thachil J, Wada H, Asakura H, Sato K, et al. Revision of the Japanese Association for Acute Medicine (JAAM) disseminated intravascular
coagulation (DIC) diagnostic criteria using antithrombin activity. Crit Care. 2016;20(1):287.
44. Iba T, Umemura Y, Watanabe E, Wada T, Hayashida K, Kushimoto S, et al.
Diagnosis of sepsis‐induced disseminated intravascular coagulation and
coagulopathy. Acute Med Surg. 2019 Apr;ams2.411.
45. Iba T, Levy JH, Yamakawa K, Thachil J, Warkentin TE, Levi M. Proposal of
a two-step process for the diagnosis of sepsis-induced disseminated intravascular coagulation. J Thromb Haemost. 2019;17(8):1265–8.
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 08.05.2024
[ACTIVE_FROM] => 08.05.2024
[SHOW_COUNTER] => 338
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829775
[VALUE] => Диссеминированное внутрисосудистое свертывание, острое повреждение почек, септический шок
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Диссеминированное внутрисосудистое свертывание, острое повреждение почек, септический шок
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829777
[VALUE] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829776
[VALUE] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830398
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829784
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829779
[1] => 829780
[2] => 829781
[3] => 829782
[4] => 829783
)
[VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => septicheskiyshok
[3] => sepsis
[4] => Острое повреждение почек
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => septicheskiyshok
[3] => sepsis
[4] => Острое повреждение почек
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830398
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829784
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-06-11 14:19:05
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829779
[1] => 829780
[2] => 829781
[3] => 829782
[4] => 829783
)
[VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => septicheskiyshok
[3] => sepsis
[4] => Острое повреждение почек
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => septicheskiyshok
[3] => sepsis
[4] => Острое повреждение почек
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Критические состояния
[2] => Септический шок
[3] => Сепсис
[4] => Острое повреждение почек
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 11.06.2025 14:19:05
[~TIMESTAMP_X] => 11.06.2025 14:19:05
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[FULLTEXT_INDEX] => N
[~FULLTEXT_INDEX] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
[BROWSER_TITLE] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
[KEYWORDS] => Диссеминированное внутрисосудистое свертывание, острое повреждение почек, септический шок
[DESCRIPTION] => Диссеминированное внутрисосудистое свертывание тесно связано с тяжелым острым повреждением почек у пациентов с септическим шоком
)
)





