Array
(
[NAME] => Дисбиоз микобиома кишечника после сепсиса и травмы
[~NAME] => Дисбиоз микобиома кишечника после сепсиса и травмы
[PREVIEW_PICTURE] => Array
(
[ID] => 5504
[TIMESTAMP_X] => 14.02.2024 15:44:46
[MODULE_ID] => iblock
[HEIGHT] => 675
[WIDTH] => 1000
[FILE_SIZE] => 1419347
[CONTENT_TYPE] => image/png
[SUBDIR] => iblock/bc4/asn1j7mj7yysyey1brhxb2xfvlcqu0u3
[FILE_NAME] => Title-Image-2.png
[ORIGINAL_NAME] => Title-Image-2.png
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => b2ba65b971d8723ac9e8a5b053d5a7ae
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/bc4/asn1j7mj7yysyey1brhxb2xfvlcqu0u3/Title-Image-2.png
[UNSAFE_SRC] => /upload/iblock/bc4/asn1j7mj7yysyey1brhxb2xfvlcqu0u3/Title-Image-2.png
[SAFE_SRC] => /upload/iblock/bc4/asn1j7mj7yysyey1brhxb2xfvlcqu0u3/Title-Image-2.png
[ALT] => Дисбиоз микобиома кишечника после сепсиса и травмы
[TITLE] => Дисбиоз микобиома кишечника после сепсиса и травмы
)
[~PREVIEW_PICTURE] => 5504
[DETAIL_TEXT] => Park et al. Critical Care (2024) 28:18
https://doi.org/10.1186/s13054-023-04780-4
Исследование
Перевод оригинальной статьи «Gut mycobiome dysbiosis after sepsis and trauma»
Авторы: Gwoncheol Park1, Jennifer A. Munley2, Lauren S. Kelly2, Kolenkode B. Kannan2, Robert T. Mankowski3, Ashish Sharma2, Gilbert Upchurch2, Gemma Casadesus4, Paramita Chakrabarty5, Shannon M. Wallet6, Robert Maile2, Letitia E. Bible2, Bo Wang7, Lyle L. Moldawer2, Alicia M. Mohr2, Philip A. Efron2, Ravinder Nagpal*
1 Department of Health, Nutrition, and Food Sciences, Florida State University, Tallahassee, FL 32306, USA.
2 Department of Surgery and Sepsis and Critical Illness Research Center, University of Florida College of Medicine, Gainesville, FL 32611, USA.
3 Department of Aging and Geriatric Research, University of Florida College of Medicine, Gainesville, FL 32611, USA. 4 Department of Pharmacology and Therapeutics, University of Florida College of Medicine, Gainesville, FL 32611, USA.
5 Department of Neuroscience, University of Florida College of Medicine, Gainesville, FL 32611, USA.
6 Department of Oral Biology, University of Florida College of Dentistry, Gainesville, FL 32611, USA.
7 Department of Biomedical and Chemical Engineering and Sciences, Florida Institute of Technology, Melbourne, FL 32901, USA.
Ключевые слова: терапия критических состояний, критическое заболевание, дисбиоз, грибы, метаболом, микробиота, микобиом, патобиом, сепсис, травма
Введение
Микобиом кишечника (грибковый микробиом) составляет важную часть общего сообщества микробов кишечника. При том, что грибы, ассоциированные с кишечником, занимают относительно небольшую нишу по сравнению с бактериями, они играют заметную роль в поддержании бактериального кишечного микробиома, неся на себе определяющую функцию как в гомеостазе хозяина, так и в физиологических процессах [1]. За последние несколько десятилетий исследования показали, что нарушение баланса в микобиоме кишечника (дисбиоз) может вносить свой вклад в патогенез заболеваний кишечника, включая воспалительные заболевания кишечника [2, 3], синдром раздраженной кишки [4, 5] и колоректальные злокачественные новообразования [6]. Более того, последствия дисбиоза микобиома не ограничиваются только лишь желудочно-кишечным трактом и могут быть тесно связаны с развитием экстра-кишечных заболеваний, таких как аллергические заболевания дыхательных путей за счет влияния на локальный и периферический иммунный гомеостаз [7]. Очевидно, что чрезмерное преобладание оппортунистических патогенных грибов (микопатобиом) при дисбиотических состояниях может привести к системной грибковой инфекции, как, например, кандидоз, что потенциально может приводить к фатальному исходу [8]. Кандидозы относят к одним из наиболее распространенных случаев инфекций кровотока у госпитализированных пациентов [9, 10]. Нарушение сотрудничества бактерий и грибов за счет бактериального дисбиоза может приводить к разрушению баланса и в грибковом сообществе с последующим чрезмерным ростом патогенных грибов [11]. И наоборот, нарушения в грибковом сообществе могут стимулировать рост бактериальных патобионтов, что неизбежно ведет к развитию и/или ухудшению воспалительных заболеваний тонкого кишечника [12].
Несмотря на то, что сепсис и травма представляют собой два различных медицинских состояния, к их общим чертам можно отнести клинические особенности и исходы после госпитализации. Предыдущие исследования показали, что и пациенты с сепсисом, и пациенты с травмой классифицируются как «пациенты с критическим заболеванием», страдающие выраженным дисбиозом микробиома кишечника во время госпитализации [13, 14] и такой дисбиотический статус очень строго коррелирует с риском госпитальной летальности [15, 16]. Дисбиоз кишечника у таких критически больных пациентов может увеличивать уязвимость к госпитальным инфекциям с последующим развитием сепсиса и синдрома полиорганной недостаточности [17]. В общем и целом, критически больные пациенты могут стать иммуноскомпроментированными или даже иммуносупрессивными на фоне продолжающегося заболевания [18]. Скомпрометированная иммунная система не может сдержать пролиферацию патогенов, что позволяет оппортунистическим патогенам и патобионтам преодолевать защитные механизмы иммунной системы хозяина и неблагоприятно влиять на микроэкологию кишечника [19]. Важно то, что антибиотики, часто применяемые у пациентов с сепсисом и травмой в целях борьбы или профилактики инфекций, разрушают полезных комменсалов кишечника, что усугубляет состояние уязвимости к инфекции [20].
Ранее мы наблюдали персистирующий бактериальный дисбиоз и нарушения профилей метаболома, что приводило к состоянию патобиома у критически больных пациентов на 2–3 неделе после поступления в отделение интенсивной терапии (ОИТ). Принимая во внимание тесные и взаимовыгодные взаимодействия между бактериальным и грибковым сообществами, становится возможным то, что случай выраженного бактериального дисбиоза может приводить к коморбидным пертурбациям в сообществе грибкового микробиома. При этом имеется совсем немного информации в отношении нарушений в грибковом сообществе, особенно на поздних стадиях сепсиса или травмы, когда восстановление пациентов задерживается. Принимая во внимание то, что измененный микробиом кишечника у таких критически больных пациентов может служить основой длительного воспаления, иммуносупрессии и катаболизма (prolonged inflammation, immunosuppression, and catabolism [PICS]), мы выдвинули гипотезу, что критически больные пациенты с травмой и сепсисом с отсроченным восстановлением могут показывать паттерны нарушений регуляции микобиома. Наши результаты показали, что профиль микобиома у таких критически больных пациентов сдвигается к патологическому паттерну за счет Candida spp., но с одновременными изменениями в микроэкологических нишах бактериального микробиома. Поскольку и частота рецидивов, и предрасположенность к неблагоприятным долгосрочным исходам у таких пациентов очень высокие, наши результаты имеют важное клиническое значение, относящееся к интенсивной терапии и исходам, особенно у пациентов, страдающих хроническим критическим заболеванием, ассоциированным с пребыванием в ОИТ, и задержкой восстановления.
Методы
Популяция исследования
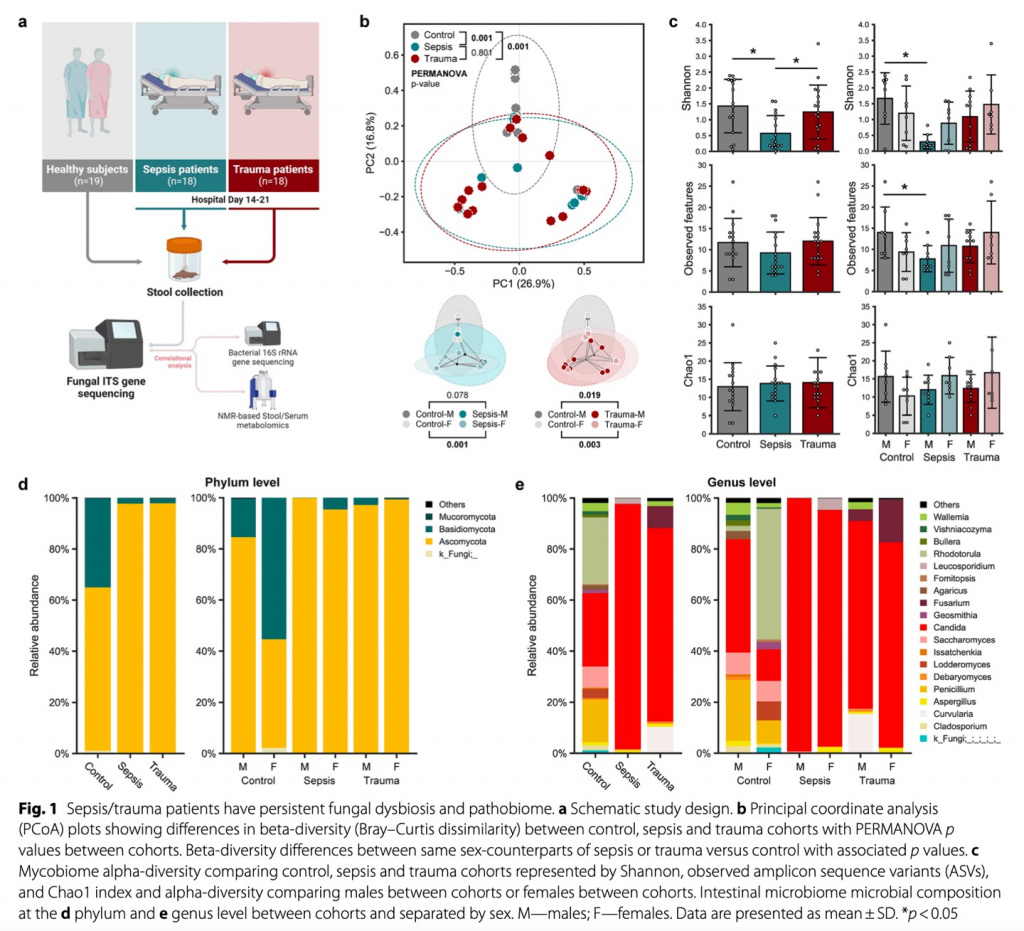
Общая структура эксперимента показана на Рис. 1А. Это исследование было одноцентровым, проспективным, обсервационным, когортным, проведенным с травмацентре первого уровня. Период исследования 2019–2023 гг., критерии включения и исключения подробно изложены в дополнительном файле 1: Table S1. Сбор основных данных для специфических пациентов с сепсисом и для здорового контроля был проведен в рамках исследования под названием «Persistent Inflammation, Immunosuppression, and Catabolism Syndrome (PICS): A New Horizon for Surgical Critical Care», что было одобрено «the Institutional Review Board (IRB)» под номером 201400611 от 28 октября 2014 года с последующей регистрацией на ClinicalTrials.gov под идентификационным номером NCT02276417. Начальные данные для определенных пациентов с травмой были собраны в рамках исследования под названием «Hematopoietic Stem Cell Dysfunction in the Elderly after Severe Injury», что было одобрено IRB под номером 201601386 от 06 сентября 2016 года с последующей регистрацией на ClinicalTrials.gov с идентификационным номером NCT02577731. Дополнительные данные были получены в контексте исследования под названием «Gut Microbiome Dysfunction in Sepsis and Trauma Survivors» (одобрение IRB № 202102863 от 03 мая 2022 года, регистрация на ClinicalTrials.gov № NCT05357170). Отчет об исследовании составлен в соответствии с руководящими принципами STROBE (the Strengthening the Reporting of Observational Studies in Epidemiology) [22]. В исследование включено 19 здоровых субъектов контроля, 18 пациентов с тяжелой травмой и 18 хирургических пациентов с сепсисом. Выбор такого размера выборки основывался на анализе мощности, при котором предположено, что 80% или более высокая вероятность (бета) обнаружения 30%-го изменения по сравнению с исходным уровнем потребует размера выборки, как n =18 для каждой группы.
Клинические данные и сбор проб
Клинические данные, включая возраст, пол, расу, этническую принадлежность и сопутствующую патологию были собраны для профилирования демографических характеристик когорт. Дополнительно были документированы параметры лечения и результатов, включая сюда такие факторы, как оценки тяжести повреждения, критерии сепсиса, трансфузии продуктов крови, введение антибиотиков, питание, а также длительность пребывания в ОИТ и госпитализации. Также фиксировалась летальность. Важно отметить, что все пациенты с травмой и сепсисом, включенные в исследование, подвергались по меньшей мере двухнедельному лечению в ОИТ и отвечали критериям Хронического критического заболевания (Chronic Critical Illness [CCI]) и PICS [23].
Пробы стула получались per rectum с помощью ректальной трубки или из колостомы в период с 14 по 21 день госпитализации, после чего эти образцы разделяли на аликвоты и хранили в бактериальной среде Cary-Blair (ThermoFisher Scientific, Waltham, MA) при температуре -80ºC. Одновременно с этим получались образцы крови при одноразовой пункции вены с последующим хранением в пробирках с гепарином (Becton–Dickinson & Co., Franklin Lakes, NJ). Далее образцы крови подвергались центрифугированию 800 × g в течение 10 минут, а полученная плазма хранилась при температуре -80 °C.
Анализ микобиома
Измерения микробиома и его анализ проводился согласно ранее описанному нами методу [24, 25]. Если кратко, то мы извлекали геном ДНК высокого качества из 200 мг фекальных проб, используя для этого QIAmp PowerFecal Pro DNA Kit (Qiagen, Hilden, Germany), с количественной оценкой с помощью спектрометра Nanodrop (Thermo Fisher Scientific, Waltham, MA, USA). Внутренняя транскрибируемая спейсерная область (The internal transcribed spacer[ITS]) гена грибковой рРНК была амплифицирована в соответствии с эталонным протоколом проекта Earth Microbiome Project (www.earthmicrobiome.org). Результирующие ампликоны были очищены с использованием AMPure ® XP magnetic beads kit (Beckman Coulter, Indianapolis, IN), а уже очищенные продукты были количественно оценены с помощью Qubit-4 fluorimeter(InVitrogen, Waltham, MA, USA). Создание библиотеки ампликонов шло согласно ранее описанному методу [26]. Все очищенные продукты объединяли согласно эквимолярным концентрациям с дальнейшим секвенированием на платформе Illumina MiSeq (Illumina Inc., SanDiego, CA, USA), используя для этого набор реагентов (MiSeq reagent kit v3; Illumina Inc).
Биоинформатика и статистический анализ
Грубые последовательности подвергались обработке с помощью программного обеспечения theQuantitative Insights Into Microbial Ecology (QIIME2) версии 2.2023.5) [27]. Качественная фильтрация, адаптерная обрезка, подавление шума и удаление не химерных ампликонов проводилось с использованием магистрали DADA2 с заранее установленными параметрами на плагинах «the q2-dada2». Все идентифицированные варианты последовательности ампликонов (identified amplicon sequence variants [ASVs]) выравнивались с помощью MAFFT [29]. Таксономическое выделение для этих ASVs было выполнено с использованием sklearnклассификатора, в основе которого лежит предварительно обученный наивный байесовский классификатор таксономии. Процесс классификации включал в себя приведение в соответствие с 99% базы данных UNITE 9.0. Альфа-разнообразие количественно определялось с помощью числа наблюдаемых метрик ASVs, Chao1 и Shannon. Для оценки бета-разнообразия был применен индекс различия (непохожести) Bray–Curtis, а результаты представлены с анализом главных координат (principal coordinate analysis [PcoA]). Статистический анализ, включая непараметрический тест Kruskal–Wallis и PERMANOVA с 999 рандомными перестановками, был применен для идентификации значительных различий в микробном разнообразии и структуре. Дифференциальная численность таксонов определялась с помощью подхода ANOVA-Like Differential Expression (ALDEx2) [30]. Предсказать группу на основании микробного состава с помощью контролируемой классификации помог плагин q2-sample-classifier в QIIME2. Этот процесс включал в себя вложенную стратифицированную пятикратную перекрестную проверку с использованием классификатора «Рандомный лес», построенного на 5 000 деревьев. Для изучения двух факторов, - группа и пол, - на численность таксонов и потенциальные эффекты взаимодействия был проведен двусторонний ANOVA тест. Для изучения корреляций между грибковыми таксонами и бактериальными таксонами, кишечником и метаболитами плазмы, использовалась ранговая корреляция Spearman. Сети, соединяющие таксоны грибов и метаболиты кишечника, устанавливались путем расчета корреляций Spearman, при этом существенные ассоциации (коэффициент корреляции Spearman> 0.30 и скорректированное значение р<0.05 по Benjamini–Hochberg) были визуализированы с помощью Cytoscape v3.9.1 [31]. Визуализация данных проводилась с использованием пакетов «R» или «Python».
Результаты
Характеристики субъектов
Характеристики пациентов, - здоровых субъектов группы контроля, пациентов с сепсисом и пациентов с травмой, - детально показаны в дополнительном файле 1:Table S2. Не было значительных различий в возрасте, поле, расе или в этнической принадлежности. При сравнении сопутствующей патологии (коморбидности) в виде гипертензии, гиперлипидемии, заболевания почек с креатинином> 1.5 мг/дл, заболевания коронарных сосудов, диабетов, застойной сердечной недостаточности, хронической обструктивной болезни легких, а также злокачественные новообразования, то существенное различие наблюдалось для гипертензии и заболевания коронарных сосудов. Как в когорте сепсиса, так и в когорте травмы имелось высокое распространение гипертензии по сравнению с контрольной группой, в то время как когорта сепсиса показывала большее количество пациентов с болезнью коронарных сосудов в анамнезе. Внимание заслуживает и то, что все пациенты с сепсисом и травмой получали антибиотики во время госпитализации. Как и ожидалось, пациенты с сепсисом получали более разнообразные антибиотики и более длительное время, в большей степени по причине необходимости в проведении контроля за очагом инфекции. Все пациенты в когортах сепсиса и травмы получали энтеральное питание, как через зонд, так и самостоятельно. Только один пациент с сепсисом получал тотальное парентеральное питание в течение 10 дней. Группа сепсиса показала существенно более длительное время пребывания в ОИТ и госпитализации по сравнению с когортой травмы.
Сигнатуры дисбиотического микобиома после сепсиса и травмы смещаются в сторону профиля патобиома, восприимчивого к инфекции
Для изучения изменений в микобиоме кишечника после госпитализации критически больных пациентов с травмой и сепсисом мы провели анализ разнообразия и состава сообщества грибов. Более того, мы изучили различия, основываясь еще и на половой принадлежности хозяина (Рис. 1b, c). Общие профили микобиома в когортах сепсиса и травмы были практически аналогичными, при этом в значительной степени контрастировали с составом в контрольной когорте. В контрольной группе дистанция бета-разнообразия (мера сходства микробных сообществ между двумя пробами или экосистемами) между субъектами, преобразованная в двумерный график с использованием анализа PCoA, основанного на различии, показала намного меньшую разницу между женщинами по сравнению с мужчинами. Это привело к более отчетливым расхождениям в массивах между здоровыми взрослыми и пациентами с сепсисом или травмами среди женщин (Рис. 1b), что указывает на существование различных профилей микобиома между этими группами. Во всех группах микробное альфа-разнообразие (богатство видов) у пациентов представляло высокий уровень дисперсии. При этом пациенты с сепсисом показывали существенно более низкое микробное разнообразие по сравнению со здоровым контролем и пациентами с травмой (согласно индексу Shannon, который измеряет как микробиологическую насыщенность, так и однородность). При том, что не наблюдались различия между группами в общем количестве вариантов последовательностей ампликонов (ASVs, как непрямой показатель численности видов), что представляют наблюдаемое количество генов, потенциально исходящих из различных бактерий, и микробном разнообразии, измеряемом с помощью индекса Chao1 (измеряющим исключительно микробное разнообразие), что указывает на отсутствие вариаций в микробном богатстве между группами, только в группе сепсиса наблюдалась явная микробная однородность. В группе контроля мужчины, по сравнению с женщинами, показали высокое разнообразие, в то время как у пациентов с сепсисом и травмой наблюдался противоположный тренд. Только пациенты с сепсисом мужского пола показали существенно более низкое разнообразие Shannon и имели меньше ASVs, чем здоровые мужчины в группе контроля. И наоборот, пациенты женского пола с сепсисом и травмой показали почти сопоставимое или даже немного большее разнообразие по сравнению со здоровыми женщинами (Рис.1c). На уровне вида сообщество микобиома показало доминирование двух больших видов грибов, а именно Basidiomycota и Ascomycota. Примечательно, что Basidiomycota, которые в остальном составляли значительную долю состава у здоровых взрослых, были почти истощены как у пациентов с сепсисом, так и у пациентов с травмой (Рис. 1d). Более глубокий анализ показал, что такое различие в первую очередь было связано со взрывным увеличением уровня генов Candida у пациентов с сепсисом и травмой. У здоровых взрослых Rhodotorula, Saccharomyces и Penicillium являются основными родами, составляющими микобиом кишечника, но у пациентов с сепсисом Candida становится преобладающим родом. Если говорить о пациентах с сепсисом, то Candida достигает 95% от всего состава микобиома (Рис.1e). В дифференциальном анализе изобилия (differentialabundance analysis) Candida была идентифицирована как наиболее пролиферирующий род у пациентов с сепсисом и травмой, далее следовала Fusarium, в то время как Penicillium и Saccharomyces были на грани истощения (Рис. 2a, b). Более того, дальнейший анализ с использованием ANOVA, выделил Candida, Penicillium, Fusarium и Rhodotorula в качестве основных таксонов, существенно различающихся между тремя группами (Рис. 2f). К тому же здоровые взрослые показывают явные отличия микробного состава в зависимости от пола. Мужчины имеют более высокие уровни Candida and Penicillium, а вот женщины показывают преобладание Saccharomyces и Rhodotorula (Рис. 1e, 2e). У обоих полов наличие таксонов, отличных от Candida, было незначительно ниже при у пациентов с сепсисом и травмой, при этом Aspergillus имели тенденцию к большей распространенности у женщин с сепсисом, чем у мужчин, а Chimonocalamus имели тенденцию к преобладанию у пациентов женского пола с травмой по сравнению с пациентами мужского пола. Высокие уровни Rhodotorula наблюдались у субъектов женщин во всех группах (Рис. 2c-e). Несмотря на то, что ни один из таксонов не был идентифицирован как существенно различающийся по полу в ANOVA, Rhodotorula и Chimonocalamus показали наибольшее влияние пола, независимо от группы, среди всех таксонов (Рис. 2f). Далее мы обучили и внедрили модель машинного обучения для того, чтобы предсказать и уловить различия между пациентами с сепсисом и травмой, а также здоровым контролем, имея намерение понять нарушения в их микобиоме.
Контрольная группа показала очень высокую прогностическую точность (AUC = 0.92), в то время как в группах сепсиса и травмы прогностическая точность была относительной (AUC = 0.74 и 0.75, соответственно) (Рис. 2h). В группе сепсиса образцы, что некорректно указывали на прогноз, с большей вероятностью были отнесены к группе травмы, чем к контрольной группе, и этот паттерн наблюдался и группе травмы (Рис. 2g). Это может быть объяснено аналогичными микробными профилями, что наблюдались как у пациентов с сепсисом, так и у пациентов с травмой. Candida последовательно идентифицировалась как наиболее значимый признак для прогнозирования, далее следовали Curvularia и Penicillium и эти таксоны наиболее часто наблюдались при сепсисе, травме и в контрольной группе, соответственно (Рис. 2i).
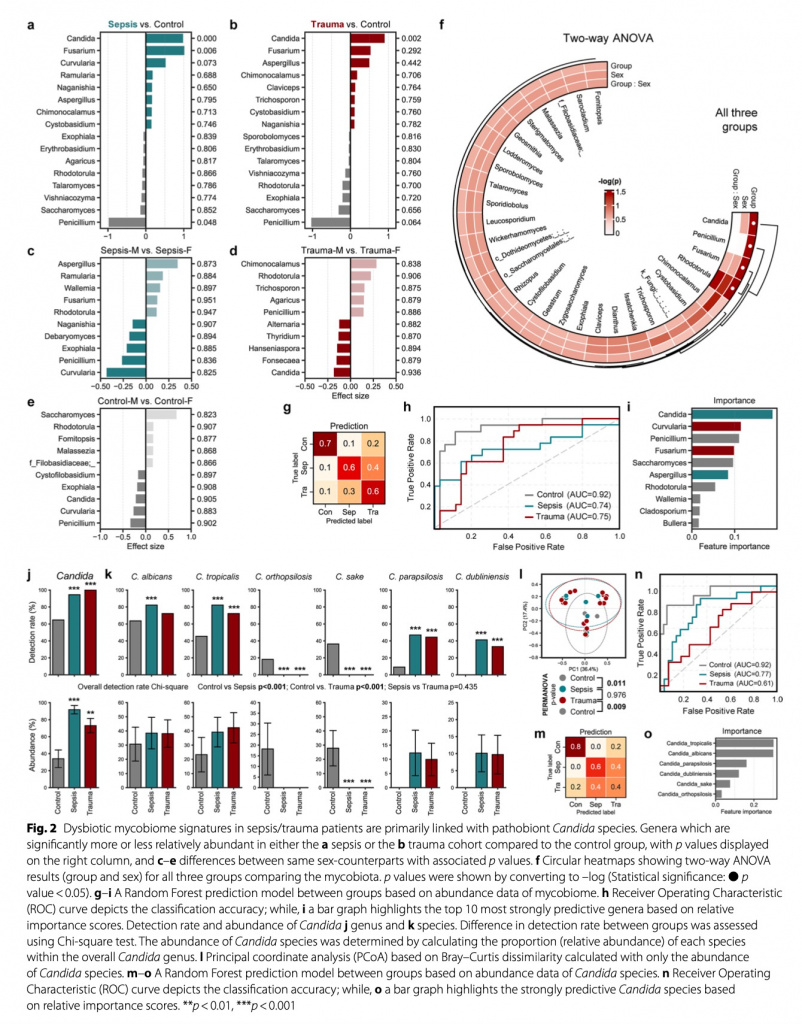
В каждом анализе воспроизводимо доказано, что Candida является наиболее значительным отличительном видом для различения пациентов с сепсисом и травмой от здорового контроля. Мы изучили, действительно ли только лишь профиль Candida способен дать характеристику группам и, тем самым, использоваться в качестве эксклюзивного фактора прогнозирования по группам. В общем и целом, не только наличие Candida, но частота выявления при сепсисе и травме было существенно выше, чем в группе контроля (Рис. 2j). Несмотря на то, что наличие Candida в группе сепсиса было наивысшим, частота выявления Candida была наивысшей в группе травмы, где все пациенты оказались носителями Candida. Все ASVs, определенные как Candida, были успешно распределены на видовом уровне с выявлением шести родов. Профили родов Candida показывали существенные различия между группой контроля против групп пациентов с сепсисом и травмой, при этом у пациентов с сепсисом и травмой имелись аналогичные профили. Более конкретно, C. orthopsilosis и C. sake выявлялись только в группе здорового контроля и представляли значительную пропорцию всей флоры Candida в этой группе. И наоборот, C. dubliniensis и C. parapsilosis, что были наиболее частыми видами в группах сепсиса и травмы, в группе здорового контроля выявлялись не часто. C. albicans и C.tropicalis показали наибольшую численность и частое выявление во всех группах, с умеренно большей частотой выявления в группах сепсиса и травмы по сравнению со здоровым контролем (Рис. 2k). При изучении с помощью анализа PCoA, основанного на профилях видов Candida, здоровая контрольная группа продемонстрировала явно отличающийся от групп сепсиса и травмы профиль. Стоит обратить внимание на то, что общий профиль внутри каждой группы был почти идентичен групповым структурам, полученным со всеми ASVs, что указывает на то, что ASVs, отнесенные к видам Candida, были основными признаками, определяющими как общую групповую структуру, так и различия между группами (Рис.2l). Помимо этого, точность прогнозирования модели, обученной исключительно для видов Candida, показала аналогичные закономерности для модели прогнозирования, обученной со всеми данными микробиома (Рис. 2m, n). C. tropicalis и C. albicans были последовательно определены как наиболее важные виды для определения и прогнозирования групп (Рис. 2o).
Сигнатуры дисбиоза микобиома коррелируют с нарушениями в микроэкологических нишах бактериом-метаболома
Кишечник является очень сложной экосистемой с различными формами симбиоза. Изменения в одном домене в значительной степени оказывают влияние на другие домены и побочные продукты метаболизма микробов. Ранее мы наблюдали значительно снижение разнообразия кишечных бактерий у пациентов с сепсисом и травмой, что сопровождалось существенным сдвигом в составе микробиоты, включая появление специфических паттернов патобиома. К этому же, что при травме, что при сепсисе имеются ассоциации с определенными метаболитами фекалий и плазмы (Дополнительный файл 2: Figure S1). Исходя из этого и для понимания экологической ниши и фундаментальной взаимосвязанной регуляции микобиомных сообществ в кишечнике, мы провели корреляционный анализ таксонов грибов с микробиомом кишечника, а также с кишечными метаболитами и метаболитами плазмы (Рис. 3a-e). Бактериальные таксоны, что имели хотя бы одну существенную связь с таксонами грибов, были разделены на две ветви, основываясь на пациентах с сепсисом и травмой. Другая ветвь в большинстве своем содержала таксоны комменсалов, включая сюда Bifidobacterium, Akkermansia и Ruminococcus, которые, как правило, сосуществуют с родами грибов, наиболее часто встречающихся у здоровых взрослых (Рис. 3a). Конкретнее, три основных рода, а именно Candida, Fusarium и Penicillium, показывают наиболее значимые корреляции с бактериями-комменсалами, включая Faecalibacterium, Anaerostipes и Eubacterium. Candida и Fusarium, что показывают рост при сепсисе и травме, отрицательно коррелируют с бактериями-комменсалами, в то время как род Penicillium, более изобильный у здорового контроля, показал строгую положительную корреляцию с этими бактериями. Более того, несколько полезных бактерий, таких как Akkermansia и Blautia, показали положительную корреляцию с Penicillium и отрицательную корреляцию с Candida. При этом мы наблюдали обратный тренд с Lactobacillus, которые положительно коррелировали с таксонами грибов, в изобилии представленными у пациентов с сепсисом и травмой (Рис. 3d).

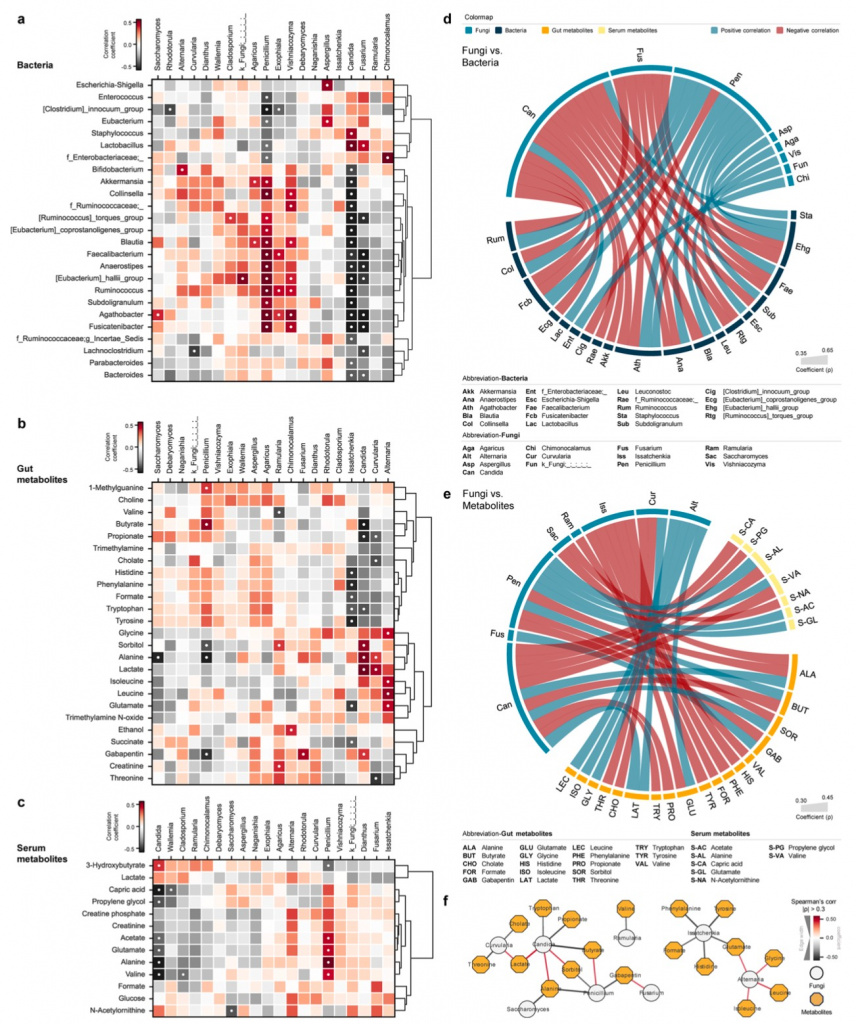
Микробные метаболиты кишечника также разделены на иерархические кластеры на основании сетевой взаиморегуляции с таксонами грибов. Один кластер состоял из короткоцепочечных жирных кислот (short-chain fatty acids [SCFAs]), включая бутират и пропионат, что положительно коррелировали с таксонами грибов, преобладающих у здоровых взрослых. Другой кластер состоял из побочных продуктов метаболизма микробов и включал в себя лактат, триметиламин N-оксид (trimethylamineN-oxide [TMAO]) и этанол, которые положительно коррелировали с таксонами, преобладающими у пациентов с сепсисом и травмой (Рис. 3b).Candida показали строгую отрицательную корреляцию с SCFAs, тогда как Penicillium показали не менее строгую положительную корреляцию с бутиратом. Эти результаты также отражены в сетевом анализе, где Candida показали совместную сеть с аланином и сорбитолом, а также с бутиратом. И наоборот, Penicillium показал прямо противоположные сети к этим метаболитам (Рис. 3f). Род грибов Curvularia представил аналогичные корреляционные профили с Candida, в большей части отрицательно коррелируя с основными метаболитами, ассоциированными с целостностью кишечника, такими как пропионат, холат и треонин. В то время как Issatchenkia и Alternaria показали существенны корреляции с аминокислотами, их низкие показатели распространенности (9.4% и 5.7%, соответственно) позволяют предположить, что значимость результатов может вводить в заблуждение по причине искажения данных. Касательно метаболома крови (плазмы), то здесь три метаболита, - лактат, глутамат и аланин, - несут общие черты с метаболитами кишечника. Но только лактат показал аналогичные паттерны корреляции с грибами, как это наблюдалось для лактата кишечника, но это не достигло статистически значимых значений. В общем и целом, только Candida и Penicillium показали строгие и явные корреляции с метаболитами плазмы, но у этих родов были прямо противоположные профили.
Penicillium отрицательно коррелировал с 3-гидроксибутиратом, основным кетоновым телом, продуцируемом при кетогенезе, но положительно коррелировал с ацетатом, глутаматом и аланином, которые вовлечены в глюконеогенез. Candida показала прямо противоположные взаимоотношения с этими метаболитами (Рис. 3c, e).
Обсуждение
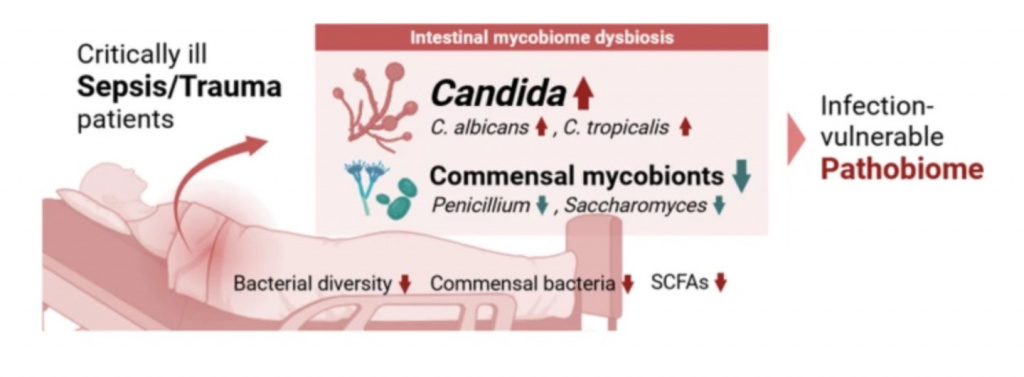
Микробиом служит в качестве первой линии защиты против патогенов кишечника, а нарушения в микробиоме (дисбиоз) могут приводить к увеличению уязвимости к тяжелым инфекциям. Действительно, ранее проведенные исследования показали, что пациенты, получавшие в госпитале лечение антибиотиками, находятся под высоким риском последующих госпитализаций с сепсисом и основной причиной здесь является дисбиоз кишечника и патобиом [32]. В то время как у пациентов с сепсисом или после тяжелой травмы следует ожидать значительные нарушения в микробиоме, исследования в этой области очень ограничены, при этом в большей степени исследования сосредоточены на бактериальном микробиоме. В нашем исследовании мы показали наличие, постоянство и фенотип дисбиоза микобиома кишечника при сепсисе и у пациентов с травмой после двух недель госпитализации. Эти результаты показывают то, что у критически больных пациентов с сепсисом и травмой, у которых на две-три недели задерживается восстановление и они остаются в ОИТ, развивается поздний дисбиоз. Примечательно, что у этих пациентов очень высокие риски/предрасположенность к неблагоприятным долгосрочным исходам.
В общем и целом, мы идентифицировали дисбиоз в микобиоме, что характеризуется снижением разнообразия (богатство видов), нарушенной микробной структурой и острым увеличением Candida на фоне истощения таксонов грибов-комменсалов, включая сюда Penicillium и Saccharomyces, у пациентов с сепсисом и у пациентов с травмой. Принимая во внимание тот факт, что именно эти грибы являются основными родами, что составляют сообщество микобиома, то пациенты с сепсисом и травмой могут испытывать существенные нарушения в экологических нишах грибов, тем самым обретая высокий риск последующей грибковой инфекции, к примеру кандидоз. Несмотря на то, что не имеется специализированных исследований, в которых сообщалось бы об общих изменениях микобиома у пациентов с сепсисом и травмой, имеется консенсус в том, что критически больные пациенты в ОИТ имеют восприимчивую к инфекции кишечную микросреду [20]. В предыдущих исследованиях сообщалось, что во время пребывания в ОИТ бактериальное сообщество разрушается одновременно с сообществом грибов, что имело взаимовыгодное сотрудничество с бактериальным сообществом. И как следствие, истощаются или нарушаются иммуномодуляторные и ключевые метаболиты, такие как SCFAs и желчные кислоты [20]. К тому же наблюдение аналогичных паттернов в двух отличающихся друг от друга медицинских состояниях, - сепсис и травма, - предоставляют доказательства потенциальной причинно-следственной связи между травмой и развитием сепсиса.
Ранее уже сообщалось, что тяжелая травма может индуцировать выраженный дисбиоз в течение очень короткого периода времени и приводить к сепсису за счет разрушения эпителиального барьера кишечника [33, 34]. Мы также наблюдали различия в микробном спектре между мужчинами и женщинами. Пациенты мужского пола показали значительное снижение разнообразия, особенно в когорте сепсиса, в то время как микробное разнообразие у пациентов женского пола либо немного снизилось, либо почти не изменилось, что позволяет предположить более тяжелый дисбиоз у мужчин по сравнению с женщинами. Эти результаты находятся в согласии с нашими предыдущими наблюдениями в отношении бактериальных сообществ, когда микробиом у женщин показывал большее сопротивление к инфекции и повреждению [24, 35, 36]. Эти результаты позволяют предположить, что тенденция к развитию тяжелого сепсиса превалирует у мужчин, а половой диморфизм в дисбиозе, возможно, является одной из основных причин большей тяжести сепсиса, наряду с его распространенностью, у мужчин [37, 38].
Одним из самых важных факторов, приводящих к таким дисбиотическим состояниям, без сомнения, является антибиотикотерапия. Введение антибиотиков может вести к чрезмерному росту Candida при одновременном разрушении общего микробного сообщества, как это наблюдалось в исследованиях [20, 39, 40]. В целом, были идентифицированы виды Candida, а четыре из них были наиболее изобильными у пациентов с сепсисом и травмой. C. parapsilosis и C. dubliniensis, которые исключительно выявляются только у пациентов с сепсисом и травмой, как правило не выявляются в кишечнике, а чаще обнаруживаются на руках и в ротовой полости, соответственно [41, 42]. При том, что C. albicans и C. tropicalis были найдены во всех группах, но большее изобилие и распространенность они показали у пациентов с сепсисом и травмой. Оба этих вида таксономически близки и имеют общие черты [43], что делает их хорошо знакомыми причинами кандидоза, что часто обнаруживается у пациентов ОИТ, получавших лечение антибиотиками [20]. Взятое все вместе, как экзогенные, так и эндогенные виды Candidaвсегда готовы пролиферировать в кишечник пациентов с сепсисом и травмой, так как у этих пациентов все экологические ниши в кишечнике разрушены, что ведет к иммуноскомпроментированному состоянию. Более того, исследования пациентов или новорожденных в ОИТ уже предположили, что антибиотики широкого спектра и длительная антибиотикотерапия может вносить существенный вклад в частоту развития инвазивного кандидоза [44, 45]. К том же, экспансия патогенных видов Candida может стать ранним маркером системного кандидоза [8]. Механистические пути, с помощью которых эти виды становятся доминирующими в кишечнике при дисбиозе с последующим развитием кандидозов, могут быть многофакторными и мультидинамичными. К примеру, потеря бактерий-комменсалов с одновременным снижением SCFAs могут может послужить триггером или ингибитором пролиферации Candida. Специфичные бактерии-комменсалы, как это уже показано, могут подавлять колонизацию C. Albicans за счет активации эффекторов врожденной иммунной системы и антимикробных пептидов [40]. Пептидогликан напрямую влияет на рост C. albicans за счет активации аденилилциклазы Cyr1p, что контролирует рост нитей хитина (гифов или hyphal) [46]. Антибиотикотерапия может увеличивать доступность фрагментов пептидогликана за счет более быстрого высвобождения субъединиц пептидогликана, что приводит к росту хитиновых нитей у C. Albicans [47]. Наш анализ показал строгую корреляцию Candida с различными комменсалами, включая и грамположительные бактерии. Это позволяет предположить, что у пациентов с сепсисом и травмой не только утерян эффект подавления от скомпрометированных комменсалов, но и созданы благоприятные экологические ниши за счет фрагментов пептидогликана для пролиферации Candida. SCFAs тоже имеют эффекты подавления против роста и развития компонентов Candida, включая зародышевые трубки, нити хитина (гиф) и биопленки, соответственно, снижение уровней SCFAs у животных моделей связано с ростом C. Albicans [39]. Аналогично этому, наши результаты показали строгую отрицательную корреляцию уровней SCFAs с Candida, что указывает на ослабление или даже потерю супрессивного эффекта SCFAs на Candida у пациентов с сепсисом и травмой в связи с истощением популяции продуцентов SCFAs.
Когда мы наблюдали сокращение Penicillium и Saccharomyces, то здесь следует отметить, что Penicillium spp является продуцентом разнообразных вторичных метаболитов, включая жирные кислоты с антибактериальной активностью [48]. Несмотря на то, что имеются некоторые возражения в отношении жизнеспособности Penicillium в кишечной среде из-за ограничений роста у некоторых видов [49], было показано очень высокое изобилие у здоровых взрослых [50, 51], а также и антимикробные эффекты против патогенных бактерий [52]. Аналогично Penicillium, была обнаружена большая пропорция Saccharomyces у здоровых взрослых со строгой отрицательной корреляцией с Candida [53, 54]. Saccharomyces очень эффективно служат в качестве функциональной замены бактериям тонкой кишки, поддерживая защиту против повреждения ткани слизистой оболочки и повышая реактивность циркулирующих иммунных клеток [55]. Исследования показали, что введение S. cerevisiae мышам, которых лечили антибиотиками, не только снижает дисбиоз за счет восстановления бактерий-комменсалов [56. 57], но и существенно улучшает смертность и снижает восприимчивость к вирусной инфекции [55]. Несмотря на конфликтующие результаты в отношении эффекта подавления Saccharomycesна C. albicans [58], в нескольких исследованиях было показано, что введение Saccharomyces sppснижает колонизацию тонкого кишечника C. Albicans и частоту развития инвазивного кандидоза [59, 60]. Одним из важных наших наблюдений стали значительные корреляции микобиома с разрушением метаболомических ниш. Среди этих ассоциаций одна связана с плазменным 3-гидрооксибутиратом. Как ранее было отмечено, 3-гидрооксибутират является одним из кетоновых тел, что синтезируется в печени в период низкого потребления углеводов или во время голодания [61]. Увеличение уровней этого соединения наблюдалось у пациентов с сепсисом и травмой, что согласуется с ранее проведенными исследованиями у пациентов с сепсисом [62, 63] и указывает на то, что эти пациенты находятся в состоянии кетогенеза в связи с недостаточностью глюкозы в крови и неадекватным глюконеогенезом. Критически больные пациенты часто испытывают гипогликемию [64], что, вероятно, связано с митохондриальными расстройствами, индуцированными окислительным стрессом [65, 66]. К тому же, пациенты в ОИТ, получающие энтеральное питание, часто показывают непереносимость энтерального питания, в основном по причине нарушений в моторике желудочно-кишечного тракта и пареза желудка [67], при этом распространенность таких расстройств достигает 75% (в среднем 38%) [68]. Как наши результаты, так и результаты других исследований показывают, что у пациентов с сепсисом и травмой обнаруживаются нарушенные уровни сахара крови со снижением доступности сахара в кишечнике в связи с их медицинскими состояниями. В нашем корреляционном анализе Candida показывала положительную ассоциацию с уровнями 3-гидрооксибутирата в крови и лактата кишечника. Предыдущие исследования обнаружили, что тяжелая гипергликемия и кетонемия, характеризующаяся высокими уровнями 3-гидрооксибутирата, может приводить к снижению пролиферации антиген-специфичных Т-клеток. Такое снижение делает пациентов более уязвимыми к грибковой инфекции, больше к инфекции, вызываемой C. Albicans, так и к манифестации Candida-сепсиса [69, 70]. Эти результаты означают, что во время пребывания в ОИТ пациенты могут подвергнуться высокому риску инфицирования Candida по причине длительного кетонемического состояния. Более того, Candida, а особенно C. albicans, известна своей замечательной метаболической гибкостью, что позволяет ей использовать различные нутриенты при ограниченном поступлении сахара, когда лактат становится доступной альтернативой источникам углеводов. Интригующе здесь то, что рост C. albicans на лактате менее заметен для иммунной системы и, тем самым, иммунная система становится менее эффективной за счет снижения фагоцитоза иммунными клетками [71]. Возможно, что здесь можно предположить, что в условиях снижения доступности нутриентов в нишах хозяина во время сепсиса и травмы не только благоприятствует росту грибковых патобионтов, но и стимулирует их вирулентность.
Выводы
В итоге наши результаты впервые раскрыли постоянство дисбиоза кишечного микобиома и его сигнатуры, что приводит к состоянию патобиома с высокой уязвимостью к инфекции на протяжении двух недель после сепсиса и травмы. Как и любое исследование такого рода, наше исследование имеет ряд ограничений. Мы имели возможность собирать пробы только в одну фиксированную временную точку и поэтому мы не смогли изучить временную траекторию большого таксона грибов за все время госпитализации. Большинство участников исследования были европеоидами. Мы не имели возможности контролировать другие факторы, что могли бы оказать влияние на микобиом, включая тип энтерального питания и вид анестезии [72, 73]. Тем не менее, исследование обладало достаточной мощностью для каждой группы и обнаружило постоянство дисбиоза микобиома как у пациентов с сепсисом, так и у пациентов с травмой с развитием в течение двух недель после сепсиса и травмы. Продолжительность таких пертурбаций у пациентов с отсроченной или осложненной клинической траекторией позволяет с уверенностью предположить, что борьба с таким дисбиозом могла бы стать эффективным направлением для разработки схем терапии, направленных на снижение риска развития последующей грибковой инфекции. Такие схемы могли бы применять стратегии реабилитации анти-Candida микробиома, к примеру введение S. Cerevisiae или про/пре/постбиотическую фармакологическую активацию врожденной иммунной системы в целях противодействия колонизации оппортунистическими патогенными грибами [40]. Полученные нами результаты должны дать дополнительный стимул для последующих исследований в целях изучения новых подходов, что позволят снизить частоту развития грибковых инфекций за счет разработки терапевтических вмешательств, направленных на предотвращение дисбиоза и восстановление микроэкологического гомеостаза кишечника, которые позволят улучшить исходы с точки зрения здоровья и качества жизни после госпитализации у пациентов с критическими заболеваниями.
Список литературы:
1. Zhang F, Aschenbrenner D, Yoo JY, Zuo T. The gut mycobiome in health, disease, and clinical applications in association with the gut bacterial microbiome assembly. Lancet Microbe. 2022;3:e969–83.
2. Hoarau G, Mukherjee P, Gower-Rousseau C, Hager C, Chandra J, Retuerto M, et al. Bacteriome and mycobiome interactions underscore microbial dysbiosis in familial Crohn’s disease. MBio. 2016;7:10–1128.
3. Limon JJ, Tang J, Li D, Wolf AJ, Michelsen KS, Funari V, et al. Malassezia is associated with Crohn’s disease and exacerbates colitis in mouse models. Cell Host Microbe. 2019;25:377-388.e6.
4. Sciavilla P, Strati F, Di Paola M, Modesto M, Vitali F, Cavalieri D, et al. Gut microbiota profiles and characterization of cultivable fungal isolates in IBS patients. Appl Microbiol Biotechnol. 2021;105:3277–88.
5. Das A, O’Herlihy E, Shanahan F, O’Toole P, Jeffery I. The fecal mycobiome in patients with Irritable bowel syndrome. Sci Rep. 2021;11:124.
6. Coker OO, Nakatsu G, Dai RZ, Wu WKK, Wong SH, Ng SC, et al. Enteric fungal microbiota dysbiosis and ecological alterations in colorectal cancer. Gut. 2019;68:654–62.
7. Wheeler ML, Limon JJ, Bar AS, Leal CA, Gargus M, Tang J, et al. Immunological consequences of Intestinal Fungal Dysbiosis. Cell Host Microbe. 2016;19:865–73.
8. Zhai B, Ola M, Rolling T, Tosini NL, Joshowitz S, Littmann ER, et al. High-resolution mycobiota analysis reveals dynamic intestinal translocation preceding invasive candidiasis. Nat Med. 2020;26:59–64.
9. Wisplinghoff H, Bischoff T, Tallent SM, Seifert H, Wenzel RP, Edmond MB.
Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clin Infect Dis. 2004;39:309–17.
10. Magill SS, O’Leary E, Janelle SJ, Thompson DL, Dumyati G, Nadle J, et al.
Changes in prevalence of health care-associated infections in U.S. Hospitals. N Engl J Med. 2018;379:1732–44.
11. Seelbinder B, Lohinai Z, Vazquez-Uribe R, Brunke S, Chen X, Mirhakkak M, et al. Candida expansion in the gut of lung cancer patients associates with an ecological signature that supports growth under dysbiotic conditions. Nat Commun. 2023;14:2673.
12. Sam QH, Chang MW, Chai LYA. The fungal mycobiome and its interaction with gut bacteria in the host. Int J Mol Sci. 2017;18:330.
13. Yeh A, Rogers MB, Firek B, Neal MD, Zuckerbraun BS, Morowitz MJ. Dysbiosis across multiple body sites in critically ill adult surgical patients. Shock: injury. Inflam Sepsis Lab Clin Appr. 2016;46:649–54.
14. Munley JA, Kirkpatrick SL, Gillies GS, Bible LE, Efron PA, Nagpal R, et al.
The intestinal microbiome after traumatic injury. Microorganisms. 2023;11:1990.
15. Wei R, Chen X, Hu L, He Z, Ouyang X, Liang S, et al. Dysbiosis of intestinal microbiota in critically ill patients and risk of in-hospital mortality. Am J Transl Res. 2021;13:1548–57.
16. Ojima M, Shimizu K, Motooka D, Ishihara T, Nakamura S, Shintani A, et al.
Gut dysbiosis associated with antibiotics and disease severity and its relation to mortality in critically Ill patients. Dig Dis Sci. 2022;67:2420–32.
17. McDonald D, Ackermann G, Khailova L, Baird C, Heyland D, Kozar R, et al. Extreme dysbiosis of the microbiome in critical illness. Msphere. 2016;1:e00199-e216.
18. Efron PA, Mohr AM, Bihorac A, Horiguchi H, Hollen MK, Segal MS, et al. Persistent inflammation, immunosuppression, and catabolism and the development of chronic critical illness after surgery. Surgery. 2018;164:178–84.
19. Krezalek MA, DeFazio J, Zaborina O, Zaborin A, Alverdy JC. The shift of an intestinal “microbiome” to a “pathobiome” governs the course and outcome of sepsis following surgical injury. Shock. 2016;45:475.
20. Marfil-Sánchez A, Zhang L, Alonso-Pernas P, Mirhakkak M, Mueller M, Seelbinder B, et al. An integrative understanding of the large metabolic shifts induced by antibiotics in critical illness. Gut Microbes. 2021;13:1993598.
21. Efron PA, Brakenridge SC, Mohr AM, Barrios EL, Polcz VE, Anton S, et al. The persistent inflammation, immunosuppression, and catabolism syndrome (PICS) ten years later. J Trauma Acute Care Surg. 2023;95:790.
22. Cuschieri S. The STROBE guidelines. Saudi J Anaesth. 2019;13:S31–4.
23. Mira JC, Brakenridge SC, Moldawer LL, Moore FA. Persistent inflammation, immunosuppression and catabolism syndrome. Crit Care Clin. 2017;33:245–58.
24. Munley JA, Kelly LS, Park G, Gillies GS, Pons EE, Kannan KB, et al. Multicompartmental traumatic injury induces sex-specific alterations in the gut microbiome. J Trauma Acute Care Surg. 2023;95:30–8.
25. Nagpal R, Neth BJ, Wang S, Mishra SP, Craft S, Yadav H. Gut mycobiome and its interaction with diet, gut bacteria and alzheimer’s disease markers in subjects with mild cognitive impairment: A pilot study. eBioMedicine [Internet]. 2020 [cited 2023 Aug 8];59. Available from: https://www.thela ncet.com/journals/ebiom/article/PIIS2352-3964(20)30326-1/fulltext
26. Caporaso JG, Lauber CL, Walters WA, Berg-Lyons D, Huntley J, Fierer N, et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms. ISME J. 2012;6:1621–4.
27. Bolyen E, Rideout JR, Dillon MR, Bokulich NA, Abnet CC, Al-Ghalith GA, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2. Nat Biotechnol. 2019;37:852–7.
28. Callahan BJ, McMurdie PJ, Rosen MJ, Han AW, Johnson AJA, Holmes SP.
DADA2: high-resolution sample inference from Illumina amplicon data. Nat Methods. 2016;13:581.
29. Katoh K, Misawa K, Kuma K, Miyata T. MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform. Nucl Acids Res. 2002;30:3059–66.
30. Fernandes AD, Reid JN, Macklaim JM, McMurrough TA, Edgell DR, Gloor GB. Unifying the analysis of high-throughput sequencing datasets: characterizing RNA-seq, 16S rRNA gene sequencing and selective growth experiments by compositional data analysis. Microbiome. 2014;2:1–13.
31. Shannon P, Markiel A, Ozier O, Baliga NS, Wang JT, Ramage D, et al.
Cytoscape: a software environment for integrated models of biomolecular interaction networks. Genome Res. 2003;13:2498–504.
32. Baggs J, Jernigan JA, Halpin AL, Epstein L, Hatfield KM, McDonald LC.
Risk of subsequent sepsis within 90 days after a hospital stay by type of antibiotic exposure. Clin Infect Dis. 2018;66:1004–12.
33. Howard BM, Kornblith LZ, Christie SA, Conroy AS, Nelson MF, Campion EM, et al. Characterizing the gut microbiome in trauma: significant changes in microbial diversity occur early after severe injury. Trauma Surg Acute Care Open. 2017;2:e000108.
34. Earley ZM, Akhtar S, Green SJ, Naqib A, Khan O, Cannon AR, et al. Burn injury alters the intestinal microbiome and increases gut permeability and bacterial translocation. PLoS ONE. 2015;10:e0129996.
35. Munley JA, Kelly LS, Park G, Gillies GS, Pons EE, Kannan KB, et al. Sexspecific intestinal dysbiosis persists after multicompartmental injury. Surgery. 2023;S0039–6060(23)00524-X.
36. Efron PA, Darden DB, Li EC, Munley J, Kelly L, Fenner B, et al. Sex differences associate with late microbiome alterations after murine surgical sepsis. J Trauma Acute Care Surg. 2022;93:137.
37. Sakr Y, Elia C, Mascia L, Barberis B, Cardellino S, Livigni S, et al. The influence of gender on the epidemiology of and outcome from severe sepsis. Crit Care. 2013;17:R50.
38. Mayr FB, Yende S, Angus DC. Epidemiology of severe sepsis. Virulence.
Front Microbiol. 2022. https://doi.org/10.3389/fmicb.2022. 892859.
39. Guinan J, Wang S, Hazbun TR, Yadav H, Thangamani S. Antibiotic-induced decreases in the levels of microbial-derived short-chain fatty acids correlate with increased gastrointestinal colonization of Candida albicans. Sci Rep. 2019;9:8872.
40. Fan D, Coughlin LA, Neubauer MM, Kim J, Kim MS, Zhan X, et al. Activation of HIF-1α and LL-37 by commensal bacteria inhibits Candida albicans colonization. Nat Med. 2015;21:808–14.
41. Trofa D, Gácser A, Nosanchuk JD. Candida parapsilosis, an emerging fungal pathogen. Clin Microbiol Rev. 2008;21:606–25.
42. Sullivan D, Coleman D. Candida dubliniensis: characteristics and identification. J Clin Microbiol. 1998;36:329–34.
43. Ann Chai LY, Denning DW, Warn P. Candida tropicalis in human disease. Crit Rev Microbiol. 2010;36:282–98.
44. Aliaga S, Clark RH, Laughon M, Walsh TJ, Hope WW, Benjamin DK, et al. Changes in the incidence of candidiasis in neonatal intensive care units. Pediatrics. 2014;133:236–42.
45. Jensen J-US, Hein L, Lundgren B, Bestle MH, Mohr T, Andersen MH, et al. Invasive candida infections and the harm from antibacterial drugs in critically Ill patients: data from a randomized, controlled trial to determine the role of ciprofloxacin, piperacillin-tazobactam, meropenem, and cefuroxime*. Critic Care Med. 2015;43:594.
46. Xu X-L, Lee RTH, Fang H-M, Wang Y-M, Li R, Zou H, et al. Bacterial peptidoglycan triggers Candida albicans hyphal growth by directly activating the adenylyl cyclase Cyr1p. Cell Host Microbe. 2008;4:28–39.
47. Tan CT, Xu X, Qiao Y, Wang Y. A peptidoglycan storm caused by β-lactam antibiotic’s action on host microbiota drives Candida albicans infection. Nat Commun. 2021;12:2560.
48. Kumar A, Asthana M, Gupta A, Nigam D, Mahajan S. Chapter 3 - secondary metabolism and antimicrobial metabolites of penicillium. In: Gupta VK, Rodriguez-Couto S, editors. New and future developments in microbial biotechnology and bioengineering. Amsterdam: Elsevier; 2018. p. 47–68.
49. Suhr MJ, Hallen-Adams HE. The human gut mycobiome: pitfalls and potentials—a mycologist’s perspective. Mycologia. 2015;107:1057–73.
50. Shuai M, Fu Y, Zhong H, Gou W, Jiang Z, Liang Y, et al. Mapping the human gut mycobiome in middle-aged and elderly adults: multiomics insights and implications for host metabolic health. Gut. 2022;71:1812–20.
51. Suhr MJ, Banjara N, Hallen-Adams HE. Sequence-based methods for detecting and evaluating the human gut mycobiome. Lett Appl Microbiol. 2016;62:209–15.
52. Wu N, Mo H, Mu Q, Liu P, Liu G, Yu W. The gut mycobiome characterization of gestational diabetes mellitus and its association with dietary intervention. Front Microbiol. 2022. https://doi.org/10.3389/fmicb.2022. 892859.
53. Nash AK, Auchtung TA, Wong MC, Smith DP, Gesell JR, Ross MC, et al.
The gut mycobiome of the human microbiome project healthy cohort. Microbiome. 2017;5:153.
54. Enaud R, Vandenborght L-E, Coron N, Bazin T, Prevel R, Schaeverbeke T, et al. The mycobiome: a neglected component in the microbiota-gutbrain axis. Microorganisms. 2018;6:22.
55. Jiang TT, Shao T-Y, Ang WXG, Kinder JM, Turner LH, Pham G, et al. Commensal fungi recapitulate the protective benefits of intestinal bacteria. Cell Host Microb. 2017;22:809-816.e4.
56. Duysburgh C, Van den Abbeele P, Morera M, Marzorati M. Lacticaseibacillus rhamnosus GG and saccharomyces cerevisiae boulardii supplementation exert protective effects on human gut microbiome following antibiotic administration in vitro. Benef Microb. 2021;12:365–79.
57. Roy Sarkar S, Mitra Mazumder P, Chatterjee K, Sarkar A, Adhikary M, Mukhopadhyay K, et al. Saccharomyces boulardii ameliorates gut dysbiosis associated cognitive decline. Physiol Behav. 2021;236:113411.
58. Samonis G, Falagas M, Lionakis S, Ntaoukakis M, Kofteridis D, Ntalas I, et al.
Saccharomyces boulardii and Candida albicans experimental colonization of the murine gut. Med Mycol. 2011;49:395–9.
59. Berg R, Bernasconi P, Fowler D, Gautreaux M. Inhibition of Candida albicans translocation from the gastrointestinal tract of mice by oral administration of saccharomyces boulardii. J Infect Dis. 1993;168:1314–8.
60. Jawhara S, Poulain D. Saccharomyces boulardii decreases inflammation and intestinal colonization by Candida albicans in a mouse model of chemically-induced colitis. Med Mycol. 2007;45:691–700. 2014;5:4–11.
61. Møller N. Ketone body, 3-hydroxybutyrate: minor metabolite - major medical manifestations. J Clin Endocrinol Metab. 2020;105:2884–92.
62. Mickiewicz B, Tam P, Jenne CN, Leger C, Wong J, Winston BW, et al. Integration of metabolic and inflammatory mediator profiles as a potential prognostic approach for septic shock in the intensive care unit. Crit Care. 2015;19:11.
63. Pandey S, Siddiqui MA, Azim A, Sinha N. Metabolic fingerprint of patients showing responsiveness to treatment of septic shock in intensive care unit. Magn Reson Mater Phy. 2023;36:659–69.
64. Hypoglycemia and Risk of Death in Critically Ill Patients. New England Journal of Medicine. 2012;367:1108–18.
65. Galley HF. Oxidative stress and mitochondrial dysfunction in sepsis. BJA Br J Anaesth. 2011;107:57–64.
66. Ashfaq M, Moats AR, Northrup H, Singletary CN, Hashmi SS, Koenig MK, et al. Hypoglycemia in mitochondrial disorders. Mitochondrion. 2021;58:179–83.
67. Piziak VK, Carpentier W. Candida sepsis manifested by recurrent diabetic ketoacidosis. Diabetes Care. 1987;10:784–5.
68. Gregory R, McElveen J, Tattersall RB, Todd I. The effects of 3-hydroxybutyrate and glucose on human T cell responses to Candida albicans. FEMS Immunol Med Microbiol. 1993;7:315–20.
69. Pinto TF, Rocha R, Paula CA, de Jesus RP. Tolerance to enteral nutrition therapy in traumatic brain injury patients. Brain Inj. 2012;26:1113–7.
70. Blaser AR, Starkopf J, Kirsimägi Ü, Deane AM. Definition, prevalence, and outcome of feeding intolerance in intensive care: a systematic review and meta-analysis: How to define feeding intolerance? Acta Anaesthesiol Scand. 2014;58:914–22.
71. Ene IV, Cheng S-C, Netea MG, Brown AJP. Growth of Candida albicans cells on the physiologically relevant carbon source lactate affects their recognition and phagocytosis by immune cells. Infect Immun. 2013;81:238–48.
72. Oami T, Chihade DB, Coopersmith CM. The microbiome and nutrition in critical illness. Curr Opin Crit Care. 2019;25:145.
73. Serbanescu MA, Mathena RP, Xu J, Santiago-Rodriguez T, Hartsell TL, Cano RJ, et al. General anesthesia alters the diversity and composition of the intestinal microbiota in mice. Anesth Analg. 2019;129:e126.
[~DETAIL_TEXT] => Park et al. Critical Care (2024) 28:18
https://doi.org/10.1186/s13054-023-04780-4
Исследование
Перевод оригинальной статьи «Gut mycobiome dysbiosis after sepsis and trauma»
Авторы: Gwoncheol Park1, Jennifer A. Munley2, Lauren S. Kelly2, Kolenkode B. Kannan2, Robert T. Mankowski3, Ashish Sharma2, Gilbert Upchurch2, Gemma Casadesus4, Paramita Chakrabarty5, Shannon M. Wallet6, Robert Maile2, Letitia E. Bible2, Bo Wang7, Lyle L. Moldawer2, Alicia M. Mohr2, Philip A. Efron2, Ravinder Nagpal*
1 Department of Health, Nutrition, and Food Sciences, Florida State University, Tallahassee, FL 32306, USA.
2 Department of Surgery and Sepsis and Critical Illness Research Center, University of Florida College of Medicine, Gainesville, FL 32611, USA.
3 Department of Aging and Geriatric Research, University of Florida College of Medicine, Gainesville, FL 32611, USA. 4 Department of Pharmacology and Therapeutics, University of Florida College of Medicine, Gainesville, FL 32611, USA.
5 Department of Neuroscience, University of Florida College of Medicine, Gainesville, FL 32611, USA.
6 Department of Oral Biology, University of Florida College of Dentistry, Gainesville, FL 32611, USA.
7 Department of Biomedical and Chemical Engineering and Sciences, Florida Institute of Technology, Melbourne, FL 32901, USA.
Ключевые слова: терапия критических состояний, критическое заболевание, дисбиоз, грибы, метаболом, микробиота, микобиом, патобиом, сепсис, травма

Введение
Микобиом кишечника (грибковый микробиом) составляет важную часть общего сообщества микробов кишечника. При том, что грибы, ассоциированные с кишечником, занимают относительно небольшую нишу по сравнению с бактериями, они играют заметную роль в поддержании бактериального кишечного микробиома, неся на себе определяющую функцию как в гомеостазе хозяина, так и в физиологических процессах [1]. За последние несколько десятилетий исследования показали, что нарушение баланса в микобиоме кишечника (дисбиоз) может вносить свой вклад в патогенез заболеваний кишечника, включая воспалительные заболевания кишечника [2, 3], синдром раздраженной кишки [4, 5] и колоректальные злокачественные новообразования [6]. Более того, последствия дисбиоза микобиома не ограничиваются только лишь желудочно-кишечным трактом и могут быть тесно связаны с развитием экстра-кишечных заболеваний, таких как аллергические заболевания дыхательных путей за счет влияния на локальный и периферический иммунный гомеостаз [7]. Очевидно, что чрезмерное преобладание оппортунистических патогенных грибов (микопатобиом) при дисбиотических состояниях может привести к системной грибковой инфекции, как, например, кандидоз, что потенциально может приводить к фатальному исходу [8]. Кандидозы относят к одним из наиболее распространенных случаев инфекций кровотока у госпитализированных пациентов [9, 10]. Нарушение сотрудничества бактерий и грибов за счет бактериального дисбиоза может приводить к разрушению баланса и в грибковом сообществе с последующим чрезмерным ростом патогенных грибов [11]. И наоборот, нарушения в грибковом сообществе могут стимулировать рост бактериальных патобионтов, что неизбежно ведет к развитию и/или ухудшению воспалительных заболеваний тонкого кишечника [12].
Несмотря на то, что сепсис и травма представляют собой два различных медицинских состояния, к их общим чертам можно отнести клинические особенности и исходы после госпитализации. Предыдущие исследования показали, что и пациенты с сепсисом, и пациенты с травмой классифицируются как «пациенты с критическим заболеванием», страдающие выраженным дисбиозом микробиома кишечника во время госпитализации [13, 14] и такой дисбиотический статус очень строго коррелирует с риском госпитальной летальности [15, 16]. Дисбиоз кишечника у таких критически больных пациентов может увеличивать уязвимость к госпитальным инфекциям с последующим развитием сепсиса и синдрома полиорганной недостаточности [17]. В общем и целом, критически больные пациенты могут стать иммуноскомпроментированными или даже иммуносупрессивными на фоне продолжающегося заболевания [18]. Скомпрометированная иммунная система не может сдержать пролиферацию патогенов, что позволяет оппортунистическим патогенам и патобионтам преодолевать защитные механизмы иммунной системы хозяина и неблагоприятно влиять на микроэкологию кишечника [19]. Важно то, что антибиотики, часто применяемые у пациентов с сепсисом и травмой в целях борьбы или профилактики инфекций, разрушают полезных комменсалов кишечника, что усугубляет состояние уязвимости к инфекции [20].
Ранее мы наблюдали персистирующий бактериальный дисбиоз и нарушения профилей метаболома, что приводило к состоянию патобиома у критически больных пациентов на 2–3 неделе после поступления в отделение интенсивной терапии (ОИТ). Принимая во внимание тесные и взаимовыгодные взаимодействия между бактериальным и грибковым сообществами, становится возможным то, что случай выраженного бактериального дисбиоза может приводить к коморбидным пертурбациям в сообществе грибкового микробиома. При этом имеется совсем немного информации в отношении нарушений в грибковом сообществе, особенно на поздних стадиях сепсиса или травмы, когда восстановление пациентов задерживается. Принимая во внимание то, что измененный микробиом кишечника у таких критически больных пациентов может служить основой длительного воспаления, иммуносупрессии и катаболизма (prolonged inflammation, immunosuppression, and catabolism [PICS]), мы выдвинули гипотезу, что критически больные пациенты с травмой и сепсисом с отсроченным восстановлением могут показывать паттерны нарушений регуляции микобиома. Наши результаты показали, что профиль микобиома у таких критически больных пациентов сдвигается к патологическому паттерну за счет Candida spp., но с одновременными изменениями в микроэкологических нишах бактериального микробиома. Поскольку и частота рецидивов, и предрасположенность к неблагоприятным долгосрочным исходам у таких пациентов очень высокие, наши результаты имеют важное клиническое значение, относящееся к интенсивной терапии и исходам, особенно у пациентов, страдающих хроническим критическим заболеванием, ассоциированным с пребыванием в ОИТ, и задержкой восстановления.
Методы
Популяция исследования
Общая структура эксперимента показана на Рис. 1А. Это исследование было одноцентровым, проспективным, обсервационным, когортным, проведенным с травмацентре первого уровня. Период исследования 2019–2023 гг., критерии включения и исключения подробно изложены в дополнительном файле 1: Table S1. Сбор основных данных для специфических пациентов с сепсисом и для здорового контроля был проведен в рамках исследования под названием «Persistent Inflammation, Immunosuppression, and Catabolism Syndrome (PICS): A New Horizon for Surgical Critical Care», что было одобрено «the Institutional Review Board (IRB)» под номером 201400611 от 28 октября 2014 года с последующей регистрацией на ClinicalTrials.gov под идентификационным номером NCT02276417. Начальные данные для определенных пациентов с травмой были собраны в рамках исследования под названием «Hematopoietic Stem Cell Dysfunction in the Elderly after Severe Injury», что было одобрено IRB под номером 201601386 от 06 сентября 2016 года с последующей регистрацией на ClinicalTrials.gov с идентификационным номером NCT02577731. Дополнительные данные были получены в контексте исследования под названием «Gut Microbiome Dysfunction in Sepsis and Trauma Survivors» (одобрение IRB № 202102863 от 03 мая 2022 года, регистрация на ClinicalTrials.gov № NCT05357170). Отчет об исследовании составлен в соответствии с руководящими принципами STROBE (the Strengthening the Reporting of Observational Studies in Epidemiology) [22]. В исследование включено 19 здоровых субъектов контроля, 18 пациентов с тяжелой травмой и 18 хирургических пациентов с сепсисом. Выбор такого размера выборки основывался на анализе мощности, при котором предположено, что 80% или более высокая вероятность (бета) обнаружения 30%-го изменения по сравнению с исходным уровнем потребует размера выборки, как n =18 для каждой группы.

Клинические данные и сбор проб
Клинические данные, включая возраст, пол, расу, этническую принадлежность и сопутствующую патологию были собраны для профилирования демографических характеристик когорт. Дополнительно были документированы параметры лечения и результатов, включая сюда такие факторы, как оценки тяжести повреждения, критерии сепсиса, трансфузии продуктов крови, введение антибиотиков, питание, а также длительность пребывания в ОИТ и госпитализации. Также фиксировалась летальность. Важно отметить, что все пациенты с травмой и сепсисом, включенные в исследование, подвергались по меньшей мере двухнедельному лечению в ОИТ и отвечали критериям Хронического критического заболевания (Chronic Critical Illness [CCI]) и PICS [23].
Пробы стула получались per rectum с помощью ректальной трубки или из колостомы в период с 14 по 21 день госпитализации, после чего эти образцы разделяли на аликвоты и хранили в бактериальной среде Cary-Blair (ThermoFisher Scientific, Waltham, MA) при температуре -80ºC. Одновременно с этим получались образцы крови при одноразовой пункции вены с последующим хранением в пробирках с гепарином (Becton–Dickinson & Co., Franklin Lakes, NJ). Далее образцы крови подвергались центрифугированию 800 × g в течение 10 минут, а полученная плазма хранилась при температуре -80 °C.
Анализ микобиома
Измерения микробиома и его анализ проводился согласно ранее описанному нами методу [24, 25]. Если кратко, то мы извлекали геном ДНК высокого качества из 200 мг фекальных проб, используя для этого QIAmp PowerFecal Pro DNA Kit (Qiagen, Hilden, Germany), с количественной оценкой с помощью спектрометра Nanodrop (Thermo Fisher Scientific, Waltham, MA, USA). Внутренняя транскрибируемая спейсерная область (The internal transcribed spacer[ITS]) гена грибковой рРНК была амплифицирована в соответствии с эталонным протоколом проекта Earth Microbiome Project (www.earthmicrobiome.org). Результирующие ампликоны были очищены с использованием AMPure ® XP magnetic beads kit (Beckman Coulter, Indianapolis, IN), а уже очищенные продукты были количественно оценены с помощью Qubit-4 fluorimeter(InVitrogen, Waltham, MA, USA). Создание библиотеки ампликонов шло согласно ранее описанному методу [26]. Все очищенные продукты объединяли согласно эквимолярным концентрациям с дальнейшим секвенированием на платформе Illumina MiSeq (Illumina Inc., SanDiego, CA, USA), используя для этого набор реагентов (MiSeq reagent kit v3; Illumina Inc).
Биоинформатика и статистический анализ
Грубые последовательности подвергались обработке с помощью программного обеспечения theQuantitative Insights Into Microbial Ecology (QIIME2) версии 2.2023.5) [27]. Качественная фильтрация, адаптерная обрезка, подавление шума и удаление не химерных ампликонов проводилось с использованием магистрали DADA2 с заранее установленными параметрами на плагинах «the q2-dada2». Все идентифицированные варианты последовательности ампликонов (identified amplicon sequence variants [ASVs]) выравнивались с помощью MAFFT [29]. Таксономическое выделение для этих ASVs было выполнено с использованием sklearnклассификатора, в основе которого лежит предварительно обученный наивный байесовский классификатор таксономии. Процесс классификации включал в себя приведение в соответствие с 99% базы данных UNITE 9.0. Альфа-разнообразие количественно определялось с помощью числа наблюдаемых метрик ASVs, Chao1 и Shannon. Для оценки бета-разнообразия был применен индекс различия (непохожести) Bray–Curtis, а результаты представлены с анализом главных координат (principal coordinate analysis [PcoA]). Статистический анализ, включая непараметрический тест Kruskal–Wallis и PERMANOVA с 999 рандомными перестановками, был применен для идентификации значительных различий в микробном разнообразии и структуре. Дифференциальная численность таксонов определялась с помощью подхода ANOVA-Like Differential Expression (ALDEx2) [30]. Предсказать группу на основании микробного состава с помощью контролируемой классификации помог плагин q2-sample-classifier в QIIME2. Этот процесс включал в себя вложенную стратифицированную пятикратную перекрестную проверку с использованием классификатора «Рандомный лес», построенного на 5 000 деревьев. Для изучения двух факторов, - группа и пол, - на численность таксонов и потенциальные эффекты взаимодействия был проведен двусторонний ANOVA тест. Для изучения корреляций между грибковыми таксонами и бактериальными таксонами, кишечником и метаболитами плазмы, использовалась ранговая корреляция Spearman. Сети, соединяющие таксоны грибов и метаболиты кишечника, устанавливались путем расчета корреляций Spearman, при этом существенные ассоциации (коэффициент корреляции Spearman> 0.30 и скорректированное значение р<0.05 по Benjamini–Hochberg) были визуализированы с помощью Cytoscape v3.9.1 [31]. Визуализация данных проводилась с использованием пакетов «R» или «Python».
Результаты
Характеристики субъектов
Характеристики пациентов, - здоровых субъектов группы контроля, пациентов с сепсисом и пациентов с травмой, - детально показаны в дополнительном файле 1:Table S2. Не было значительных различий в возрасте, поле, расе или в этнической принадлежности. При сравнении сопутствующей патологии (коморбидности) в виде гипертензии, гиперлипидемии, заболевания почек с креатинином> 1.5 мг/дл, заболевания коронарных сосудов, диабетов, застойной сердечной недостаточности, хронической обструктивной болезни легких, а также злокачественные новообразования, то существенное различие наблюдалось для гипертензии и заболевания коронарных сосудов. Как в когорте сепсиса, так и в когорте травмы имелось высокое распространение гипертензии по сравнению с контрольной группой, в то время как когорта сепсиса показывала большее количество пациентов с болезнью коронарных сосудов в анамнезе. Внимание заслуживает и то, что все пациенты с сепсисом и травмой получали антибиотики во время госпитализации. Как и ожидалось, пациенты с сепсисом получали более разнообразные антибиотики и более длительное время, в большей степени по причине необходимости в проведении контроля за очагом инфекции. Все пациенты в когортах сепсиса и травмы получали энтеральное питание, как через зонд, так и самостоятельно. Только один пациент с сепсисом получал тотальное парентеральное питание в течение 10 дней. Группа сепсиса показала существенно более длительное время пребывания в ОИТ и госпитализации по сравнению с когортой травмы.
Сигнатуры дисбиотического микобиома после сепсиса и травмы смещаются в сторону профиля патобиома, восприимчивого к инфекции
Для изучения изменений в микобиоме кишечника после госпитализации критически больных пациентов с травмой и сепсисом мы провели анализ разнообразия и состава сообщества грибов. Более того, мы изучили различия, основываясь еще и на половой принадлежности хозяина (Рис. 1b, c). Общие профили микобиома в когортах сепсиса и травмы были практически аналогичными, при этом в значительной степени контрастировали с составом в контрольной когорте. В контрольной группе дистанция бета-разнообразия (мера сходства микробных сообществ между двумя пробами или экосистемами) между субъектами, преобразованная в двумерный график с использованием анализа PCoA, основанного на различии, показала намного меньшую разницу между женщинами по сравнению с мужчинами. Это привело к более отчетливым расхождениям в массивах между здоровыми взрослыми и пациентами с сепсисом или травмами среди женщин (Рис. 1b), что указывает на существование различных профилей микобиома между этими группами. Во всех группах микробное альфа-разнообразие (богатство видов) у пациентов представляло высокий уровень дисперсии. При этом пациенты с сепсисом показывали существенно более низкое микробное разнообразие по сравнению со здоровым контролем и пациентами с травмой (согласно индексу Shannon, который измеряет как микробиологическую насыщенность, так и однородность). При том, что не наблюдались различия между группами в общем количестве вариантов последовательностей ампликонов (ASVs, как непрямой показатель численности видов), что представляют наблюдаемое количество генов, потенциально исходящих из различных бактерий, и микробном разнообразии, измеряемом с помощью индекса Chao1 (измеряющим исключительно микробное разнообразие), что указывает на отсутствие вариаций в микробном богатстве между группами, только в группе сепсиса наблюдалась явная микробная однородность. В группе контроля мужчины, по сравнению с женщинами, показали высокое разнообразие, в то время как у пациентов с сепсисом и травмой наблюдался противоположный тренд. Только пациенты с сепсисом мужского пола показали существенно более низкое разнообразие Shannon и имели меньше ASVs, чем здоровые мужчины в группе контроля. И наоборот, пациенты женского пола с сепсисом и травмой показали почти сопоставимое или даже немного большее разнообразие по сравнению со здоровыми женщинами (Рис.1c). На уровне вида сообщество микобиома показало доминирование двух больших видов грибов, а именно Basidiomycota и Ascomycota. Примечательно, что Basidiomycota, которые в остальном составляли значительную долю состава у здоровых взрослых, были почти истощены как у пациентов с сепсисом, так и у пациентов с травмой (Рис. 1d). Более глубокий анализ показал, что такое различие в первую очередь было связано со взрывным увеличением уровня генов Candida у пациентов с сепсисом и травмой. У здоровых взрослых Rhodotorula, Saccharomyces и Penicillium являются основными родами, составляющими микобиом кишечника, но у пациентов с сепсисом Candida становится преобладающим родом. Если говорить о пациентах с сепсисом, то Candida достигает 95% от всего состава микобиома (Рис.1e). В дифференциальном анализе изобилия (differentialabundance analysis) Candida была идентифицирована как наиболее пролиферирующий род у пациентов с сепсисом и травмой, далее следовала Fusarium, в то время как Penicillium и Saccharomyces были на грани истощения (Рис. 2a, b). Более того, дальнейший анализ с использованием ANOVA, выделил Candida, Penicillium, Fusarium и Rhodotorula в качестве основных таксонов, существенно различающихся между тремя группами (Рис. 2f). К тому же здоровые взрослые показывают явные отличия микробного состава в зависимости от пола. Мужчины имеют более высокие уровни Candida and Penicillium, а вот женщины показывают преобладание Saccharomyces и Rhodotorula (Рис. 1e, 2e). У обоих полов наличие таксонов, отличных от Candida, было незначительно ниже при у пациентов с сепсисом и травмой, при этом Aspergillus имели тенденцию к большей распространенности у женщин с сепсисом, чем у мужчин, а Chimonocalamus имели тенденцию к преобладанию у пациентов женского пола с травмой по сравнению с пациентами мужского пола. Высокие уровни Rhodotorula наблюдались у субъектов женщин во всех группах (Рис. 2c-e). Несмотря на то, что ни один из таксонов не был идентифицирован как существенно различающийся по полу в ANOVA, Rhodotorula и Chimonocalamus показали наибольшее влияние пола, независимо от группы, среди всех таксонов (Рис. 2f). Далее мы обучили и внедрили модель машинного обучения для того, чтобы предсказать и уловить различия между пациентами с сепсисом и травмой, а также здоровым контролем, имея намерение понять нарушения в их микобиоме.
Контрольная группа показала очень высокую прогностическую точность (AUC = 0.92), в то время как в группах сепсиса и травмы прогностическая точность была относительной (AUC = 0.74 и 0.75, соответственно) (Рис. 2h). В группе сепсиса образцы, что некорректно указывали на прогноз, с большей вероятностью были отнесены к группе травмы, чем к контрольной группе, и этот паттерн наблюдался и группе травмы (Рис. 2g). Это может быть объяснено аналогичными микробными профилями, что наблюдались как у пациентов с сепсисом, так и у пациентов с травмой. Candida последовательно идентифицировалась как наиболее значимый признак для прогнозирования, далее следовали Curvularia и Penicillium и эти таксоны наиболее часто наблюдались при сепсисе, травме и в контрольной группе, соответственно (Рис. 2i).

В каждом анализе воспроизводимо доказано, что Candida является наиболее значительным отличительном видом для различения пациентов с сепсисом и травмой от здорового контроля. Мы изучили, действительно ли только лишь профиль Candida способен дать характеристику группам и, тем самым, использоваться в качестве эксклюзивного фактора прогнозирования по группам. В общем и целом, не только наличие Candida, но частота выявления при сепсисе и травме было существенно выше, чем в группе контроля (Рис. 2j). Несмотря на то, что наличие Candida в группе сепсиса было наивысшим, частота выявления Candida была наивысшей в группе травмы, где все пациенты оказались носителями Candida. Все ASVs, определенные как Candida, были успешно распределены на видовом уровне с выявлением шести родов. Профили родов Candida показывали существенные различия между группой контроля против групп пациентов с сепсисом и травмой, при этом у пациентов с сепсисом и травмой имелись аналогичные профили. Более конкретно, C. orthopsilosis и C. sake выявлялись только в группе здорового контроля и представляли значительную пропорцию всей флоры Candida в этой группе. И наоборот, C. dubliniensis и C. parapsilosis, что были наиболее частыми видами в группах сепсиса и травмы, в группе здорового контроля выявлялись не часто. C. albicans и C.tropicalis показали наибольшую численность и частое выявление во всех группах, с умеренно большей частотой выявления в группах сепсиса и травмы по сравнению со здоровым контролем (Рис. 2k). При изучении с помощью анализа PCoA, основанного на профилях видов Candida, здоровая контрольная группа продемонстрировала явно отличающийся от групп сепсиса и травмы профиль. Стоит обратить внимание на то, что общий профиль внутри каждой группы был почти идентичен групповым структурам, полученным со всеми ASVs, что указывает на то, что ASVs, отнесенные к видам Candida, были основными признаками, определяющими как общую групповую структуру, так и различия между группами (Рис.2l). Помимо этого, точность прогнозирования модели, обученной исключительно для видов Candida, показала аналогичные закономерности для модели прогнозирования, обученной со всеми данными микробиома (Рис. 2m, n). C. tropicalis и C. albicans были последовательно определены как наиболее важные виды для определения и прогнозирования групп (Рис. 2o).
Сигнатуры дисбиоза микобиома коррелируют с нарушениями в микроэкологических нишах бактериом-метаболома
Кишечник является очень сложной экосистемой с различными формами симбиоза. Изменения в одном домене в значительной степени оказывают влияние на другие домены и побочные продукты метаболизма микробов. Ранее мы наблюдали значительно снижение разнообразия кишечных бактерий у пациентов с сепсисом и травмой, что сопровождалось существенным сдвигом в составе микробиоты, включая появление специфических паттернов патобиома. К этому же, что при травме, что при сепсисе имеются ассоциации с определенными метаболитами фекалий и плазмы (Дополнительный файл 2: Figure S1). Исходя из этого и для понимания экологической ниши и фундаментальной взаимосвязанной регуляции микобиомных сообществ в кишечнике, мы провели корреляционный анализ таксонов грибов с микробиомом кишечника, а также с кишечными метаболитами и метаболитами плазмы (Рис. 3a-e). Бактериальные таксоны, что имели хотя бы одну существенную связь с таксонами грибов, были разделены на две ветви, основываясь на пациентах с сепсисом и травмой. Другая ветвь в большинстве своем содержала таксоны комменсалов, включая сюда Bifidobacterium, Akkermansia и Ruminococcus, которые, как правило, сосуществуют с родами грибов, наиболее часто встречающихся у здоровых взрослых (Рис. 3a). Конкретнее, три основных рода, а именно Candida, Fusarium и Penicillium, показывают наиболее значимые корреляции с бактериями-комменсалами, включая Faecalibacterium, Anaerostipes и Eubacterium. Candida и Fusarium, что показывают рост при сепсисе и травме, отрицательно коррелируют с бактериями-комменсалами, в то время как род Penicillium, более изобильный у здорового контроля, показал строгую положительную корреляцию с этими бактериями. Более того, несколько полезных бактерий, таких как Akkermansia и Blautia, показали положительную корреляцию с Penicillium и отрицательную корреляцию с Candida. При этом мы наблюдали обратный тренд с Lactobacillus, которые положительно коррелировали с таксонами грибов, в изобилии представленными у пациентов с сепсисом и травмой (Рис. 3d).


Микробные метаболиты кишечника также разделены на иерархические кластеры на основании сетевой взаиморегуляции с таксонами грибов. Один кластер состоял из короткоцепочечных жирных кислот (short-chain fatty acids [SCFAs]), включая бутират и пропионат, что положительно коррелировали с таксонами грибов, преобладающих у здоровых взрослых. Другой кластер состоял из побочных продуктов метаболизма микробов и включал в себя лактат, триметиламин N-оксид (trimethylamineN-oxide [TMAO]) и этанол, которые положительно коррелировали с таксонами, преобладающими у пациентов с сепсисом и травмой (Рис. 3b).Candida показали строгую отрицательную корреляцию с SCFAs, тогда как Penicillium показали не менее строгую положительную корреляцию с бутиратом. Эти результаты также отражены в сетевом анализе, где Candida показали совместную сеть с аланином и сорбитолом, а также с бутиратом. И наоборот, Penicillium показал прямо противоположные сети к этим метаболитам (Рис. 3f). Род грибов Curvularia представил аналогичные корреляционные профили с Candida, в большей части отрицательно коррелируя с основными метаболитами, ассоциированными с целостностью кишечника, такими как пропионат, холат и треонин. В то время как Issatchenkia и Alternaria показали существенны корреляции с аминокислотами, их низкие показатели распространенности (9.4% и 5.7%, соответственно) позволяют предположить, что значимость результатов может вводить в заблуждение по причине искажения данных. Касательно метаболома крови (плазмы), то здесь три метаболита, - лактат, глутамат и аланин, - несут общие черты с метаболитами кишечника. Но только лактат показал аналогичные паттерны корреляции с грибами, как это наблюдалось для лактата кишечника, но это не достигло статистически значимых значений. В общем и целом, только Candida и Penicillium показали строгие и явные корреляции с метаболитами плазмы, но у этих родов были прямо противоположные профили.
Penicillium отрицательно коррелировал с 3-гидроксибутиратом, основным кетоновым телом, продуцируемом при кетогенезе, но положительно коррелировал с ацетатом, глутаматом и аланином, которые вовлечены в глюконеогенез. Candida показала прямо противоположные взаимоотношения с этими метаболитами (Рис. 3c, e).
Обсуждение
Микробиом служит в качестве первой линии защиты против патогенов кишечника, а нарушения в микробиоме (дисбиоз) могут приводить к увеличению уязвимости к тяжелым инфекциям. Действительно, ранее проведенные исследования показали, что пациенты, получавшие в госпитале лечение антибиотиками, находятся под высоким риском последующих госпитализаций с сепсисом и основной причиной здесь является дисбиоз кишечника и патобиом [32]. В то время как у пациентов с сепсисом или после тяжелой травмы следует ожидать значительные нарушения в микробиоме, исследования в этой области очень ограничены, при этом в большей степени исследования сосредоточены на бактериальном микробиоме. В нашем исследовании мы показали наличие, постоянство и фенотип дисбиоза микобиома кишечника при сепсисе и у пациентов с травмой после двух недель госпитализации. Эти результаты показывают то, что у критически больных пациентов с сепсисом и травмой, у которых на две-три недели задерживается восстановление и они остаются в ОИТ, развивается поздний дисбиоз. Примечательно, что у этих пациентов очень высокие риски/предрасположенность к неблагоприятным долгосрочным исходам.
В общем и целом, мы идентифицировали дисбиоз в микобиоме, что характеризуется снижением разнообразия (богатство видов), нарушенной микробной структурой и острым увеличением Candida на фоне истощения таксонов грибов-комменсалов, включая сюда Penicillium и Saccharomyces, у пациентов с сепсисом и у пациентов с травмой. Принимая во внимание тот факт, что именно эти грибы являются основными родами, что составляют сообщество микобиома, то пациенты с сепсисом и травмой могут испытывать существенные нарушения в экологических нишах грибов, тем самым обретая высокий риск последующей грибковой инфекции, к примеру кандидоз. Несмотря на то, что не имеется специализированных исследований, в которых сообщалось бы об общих изменениях микобиома у пациентов с сепсисом и травмой, имеется консенсус в том, что критически больные пациенты в ОИТ имеют восприимчивую к инфекции кишечную микросреду [20]. В предыдущих исследованиях сообщалось, что во время пребывания в ОИТ бактериальное сообщество разрушается одновременно с сообществом грибов, что имело взаимовыгодное сотрудничество с бактериальным сообществом. И как следствие, истощаются или нарушаются иммуномодуляторные и ключевые метаболиты, такие как SCFAs и желчные кислоты [20]. К тому же наблюдение аналогичных паттернов в двух отличающихся друг от друга медицинских состояниях, - сепсис и травма, - предоставляют доказательства потенциальной причинно-следственной связи между травмой и развитием сепсиса.
Ранее уже сообщалось, что тяжелая травма может индуцировать выраженный дисбиоз в течение очень короткого периода времени и приводить к сепсису за счет разрушения эпителиального барьера кишечника [33, 34]. Мы также наблюдали различия в микробном спектре между мужчинами и женщинами. Пациенты мужского пола показали значительное снижение разнообразия, особенно в когорте сепсиса, в то время как микробное разнообразие у пациентов женского пола либо немного снизилось, либо почти не изменилось, что позволяет предположить более тяжелый дисбиоз у мужчин по сравнению с женщинами. Эти результаты находятся в согласии с нашими предыдущими наблюдениями в отношении бактериальных сообществ, когда микробиом у женщин показывал большее сопротивление к инфекции и повреждению [24, 35, 36]. Эти результаты позволяют предположить, что тенденция к развитию тяжелого сепсиса превалирует у мужчин, а половой диморфизм в дисбиозе, возможно, является одной из основных причин большей тяжести сепсиса, наряду с его распространенностью, у мужчин [37, 38].
Одним из самых важных факторов, приводящих к таким дисбиотическим состояниям, без сомнения, является антибиотикотерапия. Введение антибиотиков может вести к чрезмерному росту Candida при одновременном разрушении общего микробного сообщества, как это наблюдалось в исследованиях [20, 39, 40]. В целом, были идентифицированы виды Candida, а четыре из них были наиболее изобильными у пациентов с сепсисом и травмой. C. parapsilosis и C. dubliniensis, которые исключительно выявляются только у пациентов с сепсисом и травмой, как правило не выявляются в кишечнике, а чаще обнаруживаются на руках и в ротовой полости, соответственно [41, 42]. При том, что C. albicans и C. tropicalis были найдены во всех группах, но большее изобилие и распространенность они показали у пациентов с сепсисом и травмой. Оба этих вида таксономически близки и имеют общие черты [43], что делает их хорошо знакомыми причинами кандидоза, что часто обнаруживается у пациентов ОИТ, получавших лечение антибиотиками [20]. Взятое все вместе, как экзогенные, так и эндогенные виды Candidaвсегда готовы пролиферировать в кишечник пациентов с сепсисом и травмой, так как у этих пациентов все экологические ниши в кишечнике разрушены, что ведет к иммуноскомпроментированному состоянию. Более того, исследования пациентов или новорожденных в ОИТ уже предположили, что антибиотики широкого спектра и длительная антибиотикотерапия может вносить существенный вклад в частоту развития инвазивного кандидоза [44, 45]. К том же, экспансия патогенных видов Candida может стать ранним маркером системного кандидоза [8]. Механистические пути, с помощью которых эти виды становятся доминирующими в кишечнике при дисбиозе с последующим развитием кандидозов, могут быть многофакторными и мультидинамичными. К примеру, потеря бактерий-комменсалов с одновременным снижением SCFAs могут может послужить триггером или ингибитором пролиферации Candida. Специфичные бактерии-комменсалы, как это уже показано, могут подавлять колонизацию C. Albicans за счет активации эффекторов врожденной иммунной системы и антимикробных пептидов [40]. Пептидогликан напрямую влияет на рост C. albicans за счет активации аденилилциклазы Cyr1p, что контролирует рост нитей хитина (гифов или hyphal) [46]. Антибиотикотерапия может увеличивать доступность фрагментов пептидогликана за счет более быстрого высвобождения субъединиц пептидогликана, что приводит к росту хитиновых нитей у C. Albicans [47]. Наш анализ показал строгую корреляцию Candida с различными комменсалами, включая и грамположительные бактерии. Это позволяет предположить, что у пациентов с сепсисом и травмой не только утерян эффект подавления от скомпрометированных комменсалов, но и созданы благоприятные экологические ниши за счет фрагментов пептидогликана для пролиферации Candida. SCFAs тоже имеют эффекты подавления против роста и развития компонентов Candida, включая зародышевые трубки, нити хитина (гиф) и биопленки, соответственно, снижение уровней SCFAs у животных моделей связано с ростом C. Albicans [39]. Аналогично этому, наши результаты показали строгую отрицательную корреляцию уровней SCFAs с Candida, что указывает на ослабление или даже потерю супрессивного эффекта SCFAs на Candida у пациентов с сепсисом и травмой в связи с истощением популяции продуцентов SCFAs.
Когда мы наблюдали сокращение Penicillium и Saccharomyces, то здесь следует отметить, что Penicillium spp является продуцентом разнообразных вторичных метаболитов, включая жирные кислоты с антибактериальной активностью [48]. Несмотря на то, что имеются некоторые возражения в отношении жизнеспособности Penicillium в кишечной среде из-за ограничений роста у некоторых видов [49], было показано очень высокое изобилие у здоровых взрослых [50, 51], а также и антимикробные эффекты против патогенных бактерий [52]. Аналогично Penicillium, была обнаружена большая пропорция Saccharomyces у здоровых взрослых со строгой отрицательной корреляцией с Candida [53, 54]. Saccharomyces очень эффективно служат в качестве функциональной замены бактериям тонкой кишки, поддерживая защиту против повреждения ткани слизистой оболочки и повышая реактивность циркулирующих иммунных клеток [55]. Исследования показали, что введение S. cerevisiae мышам, которых лечили антибиотиками, не только снижает дисбиоз за счет восстановления бактерий-комменсалов [56. 57], но и существенно улучшает смертность и снижает восприимчивость к вирусной инфекции [55]. Несмотря на конфликтующие результаты в отношении эффекта подавления Saccharomycesна C. albicans [58], в нескольких исследованиях было показано, что введение Saccharomyces sppснижает колонизацию тонкого кишечника C. Albicans и частоту развития инвазивного кандидоза [59, 60]. Одним из важных наших наблюдений стали значительные корреляции микобиома с разрушением метаболомических ниш. Среди этих ассоциаций одна связана с плазменным 3-гидрооксибутиратом. Как ранее было отмечено, 3-гидрооксибутират является одним из кетоновых тел, что синтезируется в печени в период низкого потребления углеводов или во время голодания [61]. Увеличение уровней этого соединения наблюдалось у пациентов с сепсисом и травмой, что согласуется с ранее проведенными исследованиями у пациентов с сепсисом [62, 63] и указывает на то, что эти пациенты находятся в состоянии кетогенеза в связи с недостаточностью глюкозы в крови и неадекватным глюконеогенезом. Критически больные пациенты часто испытывают гипогликемию [64], что, вероятно, связано с митохондриальными расстройствами, индуцированными окислительным стрессом [65, 66]. К тому же, пациенты в ОИТ, получающие энтеральное питание, часто показывают непереносимость энтерального питания, в основном по причине нарушений в моторике желудочно-кишечного тракта и пареза желудка [67], при этом распространенность таких расстройств достигает 75% (в среднем 38%) [68]. Как наши результаты, так и результаты других исследований показывают, что у пациентов с сепсисом и травмой обнаруживаются нарушенные уровни сахара крови со снижением доступности сахара в кишечнике в связи с их медицинскими состояниями. В нашем корреляционном анализе Candida показывала положительную ассоциацию с уровнями 3-гидрооксибутирата в крови и лактата кишечника. Предыдущие исследования обнаружили, что тяжелая гипергликемия и кетонемия, характеризующаяся высокими уровнями 3-гидрооксибутирата, может приводить к снижению пролиферации антиген-специфичных Т-клеток. Такое снижение делает пациентов более уязвимыми к грибковой инфекции, больше к инфекции, вызываемой C. Albicans, так и к манифестации Candida-сепсиса [69, 70]. Эти результаты означают, что во время пребывания в ОИТ пациенты могут подвергнуться высокому риску инфицирования Candida по причине длительного кетонемического состояния. Более того, Candida, а особенно C. albicans, известна своей замечательной метаболической гибкостью, что позволяет ей использовать различные нутриенты при ограниченном поступлении сахара, когда лактат становится доступной альтернативой источникам углеводов. Интригующе здесь то, что рост C. albicans на лактате менее заметен для иммунной системы и, тем самым, иммунная система становится менее эффективной за счет снижения фагоцитоза иммунными клетками [71]. Возможно, что здесь можно предположить, что в условиях снижения доступности нутриентов в нишах хозяина во время сепсиса и травмы не только благоприятствует росту грибковых патобионтов, но и стимулирует их вирулентность.
Выводы
В итоге наши результаты впервые раскрыли постоянство дисбиоза кишечного микобиома и его сигнатуры, что приводит к состоянию патобиома с высокой уязвимостью к инфекции на протяжении двух недель после сепсиса и травмы. Как и любое исследование такого рода, наше исследование имеет ряд ограничений. Мы имели возможность собирать пробы только в одну фиксированную временную точку и поэтому мы не смогли изучить временную траекторию большого таксона грибов за все время госпитализации. Большинство участников исследования были европеоидами. Мы не имели возможности контролировать другие факторы, что могли бы оказать влияние на микобиом, включая тип энтерального питания и вид анестезии [72, 73]. Тем не менее, исследование обладало достаточной мощностью для каждой группы и обнаружило постоянство дисбиоза микобиома как у пациентов с сепсисом, так и у пациентов с травмой с развитием в течение двух недель после сепсиса и травмы. Продолжительность таких пертурбаций у пациентов с отсроченной или осложненной клинической траекторией позволяет с уверенностью предположить, что борьба с таким дисбиозом могла бы стать эффективным направлением для разработки схем терапии, направленных на снижение риска развития последующей грибковой инфекции. Такие схемы могли бы применять стратегии реабилитации анти-Candida микробиома, к примеру введение S. Cerevisiae или про/пре/постбиотическую фармакологическую активацию врожденной иммунной системы в целях противодействия колонизации оппортунистическими патогенными грибами [40]. Полученные нами результаты должны дать дополнительный стимул для последующих исследований в целях изучения новых подходов, что позволят снизить частоту развития грибковых инфекций за счет разработки терапевтических вмешательств, направленных на предотвращение дисбиоза и восстановление микроэкологического гомеостаза кишечника, которые позволят улучшить исходы с точки зрения здоровья и качества жизни после госпитализации у пациентов с критическими заболеваниями.
Список литературы:
1. Zhang F, Aschenbrenner D, Yoo JY, Zuo T. The gut mycobiome in health, disease, and clinical applications in association with the gut bacterial microbiome assembly. Lancet Microbe. 2022;3:e969–83.
2. Hoarau G, Mukherjee P, Gower-Rousseau C, Hager C, Chandra J, Retuerto M, et al. Bacteriome and mycobiome interactions underscore microbial dysbiosis in familial Crohn’s disease. MBio. 2016;7:10–1128.
3. Limon JJ, Tang J, Li D, Wolf AJ, Michelsen KS, Funari V, et al. Malassezia is associated with Crohn’s disease and exacerbates colitis in mouse models. Cell Host Microbe. 2019;25:377-388.e6.
4. Sciavilla P, Strati F, Di Paola M, Modesto M, Vitali F, Cavalieri D, et al. Gut microbiota profiles and characterization of cultivable fungal isolates in IBS patients. Appl Microbiol Biotechnol. 2021;105:3277–88.
5. Das A, O’Herlihy E, Shanahan F, O’Toole P, Jeffery I. The fecal mycobiome in patients with Irritable bowel syndrome. Sci Rep. 2021;11:124.
6. Coker OO, Nakatsu G, Dai RZ, Wu WKK, Wong SH, Ng SC, et al. Enteric fungal microbiota dysbiosis and ecological alterations in colorectal cancer. Gut. 2019;68:654–62.
7. Wheeler ML, Limon JJ, Bar AS, Leal CA, Gargus M, Tang J, et al. Immunological consequences of Intestinal Fungal Dysbiosis. Cell Host Microbe. 2016;19:865–73.
8. Zhai B, Ola M, Rolling T, Tosini NL, Joshowitz S, Littmann ER, et al. High-resolution mycobiota analysis reveals dynamic intestinal translocation preceding invasive candidiasis. Nat Med. 2020;26:59–64.
9. Wisplinghoff H, Bischoff T, Tallent SM, Seifert H, Wenzel RP, Edmond MB.
Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clin Infect Dis. 2004;39:309–17.
10. Magill SS, O’Leary E, Janelle SJ, Thompson DL, Dumyati G, Nadle J, et al.
Changes in prevalence of health care-associated infections in U.S. Hospitals. N Engl J Med. 2018;379:1732–44.
11. Seelbinder B, Lohinai Z, Vazquez-Uribe R, Brunke S, Chen X, Mirhakkak M, et al. Candida expansion in the gut of lung cancer patients associates with an ecological signature that supports growth under dysbiotic conditions. Nat Commun. 2023;14:2673.
12. Sam QH, Chang MW, Chai LYA. The fungal mycobiome and its interaction with gut bacteria in the host. Int J Mol Sci. 2017;18:330.
13. Yeh A, Rogers MB, Firek B, Neal MD, Zuckerbraun BS, Morowitz MJ. Dysbiosis across multiple body sites in critically ill adult surgical patients. Shock: injury. Inflam Sepsis Lab Clin Appr. 2016;46:649–54.
14. Munley JA, Kirkpatrick SL, Gillies GS, Bible LE, Efron PA, Nagpal R, et al.
The intestinal microbiome after traumatic injury. Microorganisms. 2023;11:1990.
15. Wei R, Chen X, Hu L, He Z, Ouyang X, Liang S, et al. Dysbiosis of intestinal microbiota in critically ill patients and risk of in-hospital mortality. Am J Transl Res. 2021;13:1548–57.
16. Ojima M, Shimizu K, Motooka D, Ishihara T, Nakamura S, Shintani A, et al.
Gut dysbiosis associated with antibiotics and disease severity and its relation to mortality in critically Ill patients. Dig Dis Sci. 2022;67:2420–32.
17. McDonald D, Ackermann G, Khailova L, Baird C, Heyland D, Kozar R, et al. Extreme dysbiosis of the microbiome in critical illness. Msphere. 2016;1:e00199-e216.
18. Efron PA, Mohr AM, Bihorac A, Horiguchi H, Hollen MK, Segal MS, et al. Persistent inflammation, immunosuppression, and catabolism and the development of chronic critical illness after surgery. Surgery. 2018;164:178–84.
19. Krezalek MA, DeFazio J, Zaborina O, Zaborin A, Alverdy JC. The shift of an intestinal “microbiome” to a “pathobiome” governs the course and outcome of sepsis following surgical injury. Shock. 2016;45:475.
20. Marfil-Sánchez A, Zhang L, Alonso-Pernas P, Mirhakkak M, Mueller M, Seelbinder B, et al. An integrative understanding of the large metabolic shifts induced by antibiotics in critical illness. Gut Microbes. 2021;13:1993598.
21. Efron PA, Brakenridge SC, Mohr AM, Barrios EL, Polcz VE, Anton S, et al. The persistent inflammation, immunosuppression, and catabolism syndrome (PICS) ten years later. J Trauma Acute Care Surg. 2023;95:790.
22. Cuschieri S. The STROBE guidelines. Saudi J Anaesth. 2019;13:S31–4.
23. Mira JC, Brakenridge SC, Moldawer LL, Moore FA. Persistent inflammation, immunosuppression and catabolism syndrome. Crit Care Clin. 2017;33:245–58.
24. Munley JA, Kelly LS, Park G, Gillies GS, Pons EE, Kannan KB, et al. Multicompartmental traumatic injury induces sex-specific alterations in the gut microbiome. J Trauma Acute Care Surg. 2023;95:30–8.
25. Nagpal R, Neth BJ, Wang S, Mishra SP, Craft S, Yadav H. Gut mycobiome and its interaction with diet, gut bacteria and alzheimer’s disease markers in subjects with mild cognitive impairment: A pilot study. eBioMedicine [Internet]. 2020 [cited 2023 Aug 8];59. Available from: https://www.thela ncet.com/journals/ebiom/article/PIIS2352-3964(20)30326-1/fulltext
26. Caporaso JG, Lauber CL, Walters WA, Berg-Lyons D, Huntley J, Fierer N, et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms. ISME J. 2012;6:1621–4.
27. Bolyen E, Rideout JR, Dillon MR, Bokulich NA, Abnet CC, Al-Ghalith GA, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2. Nat Biotechnol. 2019;37:852–7.
28. Callahan BJ, McMurdie PJ, Rosen MJ, Han AW, Johnson AJA, Holmes SP.
DADA2: high-resolution sample inference from Illumina amplicon data. Nat Methods. 2016;13:581.
29. Katoh K, Misawa K, Kuma K, Miyata T. MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform. Nucl Acids Res. 2002;30:3059–66.
30. Fernandes AD, Reid JN, Macklaim JM, McMurrough TA, Edgell DR, Gloor GB. Unifying the analysis of high-throughput sequencing datasets: characterizing RNA-seq, 16S rRNA gene sequencing and selective growth experiments by compositional data analysis. Microbiome. 2014;2:1–13.
31. Shannon P, Markiel A, Ozier O, Baliga NS, Wang JT, Ramage D, et al.
Cytoscape: a software environment for integrated models of biomolecular interaction networks. Genome Res. 2003;13:2498–504.
32. Baggs J, Jernigan JA, Halpin AL, Epstein L, Hatfield KM, McDonald LC.
Risk of subsequent sepsis within 90 days after a hospital stay by type of antibiotic exposure. Clin Infect Dis. 2018;66:1004–12.
33. Howard BM, Kornblith LZ, Christie SA, Conroy AS, Nelson MF, Campion EM, et al. Characterizing the gut microbiome in trauma: significant changes in microbial diversity occur early after severe injury. Trauma Surg Acute Care Open. 2017;2:e000108.
34. Earley ZM, Akhtar S, Green SJ, Naqib A, Khan O, Cannon AR, et al. Burn injury alters the intestinal microbiome and increases gut permeability and bacterial translocation. PLoS ONE. 2015;10:e0129996.
35. Munley JA, Kelly LS, Park G, Gillies GS, Pons EE, Kannan KB, et al. Sexspecific intestinal dysbiosis persists after multicompartmental injury. Surgery. 2023;S0039–6060(23)00524-X.
36. Efron PA, Darden DB, Li EC, Munley J, Kelly L, Fenner B, et al. Sex differences associate with late microbiome alterations after murine surgical sepsis. J Trauma Acute Care Surg. 2022;93:137.
37. Sakr Y, Elia C, Mascia L, Barberis B, Cardellino S, Livigni S, et al. The influence of gender on the epidemiology of and outcome from severe sepsis. Crit Care. 2013;17:R50.
38. Mayr FB, Yende S, Angus DC. Epidemiology of severe sepsis. Virulence.
Front Microbiol. 2022. https://doi.org/10.3389/fmicb.2022. 892859.
39. Guinan J, Wang S, Hazbun TR, Yadav H, Thangamani S. Antibiotic-induced decreases in the levels of microbial-derived short-chain fatty acids correlate with increased gastrointestinal colonization of Candida albicans. Sci Rep. 2019;9:8872.
40. Fan D, Coughlin LA, Neubauer MM, Kim J, Kim MS, Zhan X, et al. Activation of HIF-1α and LL-37 by commensal bacteria inhibits Candida albicans colonization. Nat Med. 2015;21:808–14.
41. Trofa D, Gácser A, Nosanchuk JD. Candida parapsilosis, an emerging fungal pathogen. Clin Microbiol Rev. 2008;21:606–25.
42. Sullivan D, Coleman D. Candida dubliniensis: characteristics and identification. J Clin Microbiol. 1998;36:329–34.
43. Ann Chai LY, Denning DW, Warn P. Candida tropicalis in human disease. Crit Rev Microbiol. 2010;36:282–98.
44. Aliaga S, Clark RH, Laughon M, Walsh TJ, Hope WW, Benjamin DK, et al. Changes in the incidence of candidiasis in neonatal intensive care units. Pediatrics. 2014;133:236–42.
45. Jensen J-US, Hein L, Lundgren B, Bestle MH, Mohr T, Andersen MH, et al. Invasive candida infections and the harm from antibacterial drugs in critically Ill patients: data from a randomized, controlled trial to determine the role of ciprofloxacin, piperacillin-tazobactam, meropenem, and cefuroxime*. Critic Care Med. 2015;43:594.
46. Xu X-L, Lee RTH, Fang H-M, Wang Y-M, Li R, Zou H, et al. Bacterial peptidoglycan triggers Candida albicans hyphal growth by directly activating the adenylyl cyclase Cyr1p. Cell Host Microbe. 2008;4:28–39.
47. Tan CT, Xu X, Qiao Y, Wang Y. A peptidoglycan storm caused by β-lactam antibiotic’s action on host microbiota drives Candida albicans infection. Nat Commun. 2021;12:2560.
48. Kumar A, Asthana M, Gupta A, Nigam D, Mahajan S. Chapter 3 - secondary metabolism and antimicrobial metabolites of penicillium. In: Gupta VK, Rodriguez-Couto S, editors. New and future developments in microbial biotechnology and bioengineering. Amsterdam: Elsevier; 2018. p. 47–68.
49. Suhr MJ, Hallen-Adams HE. The human gut mycobiome: pitfalls and potentials—a mycologist’s perspective. Mycologia. 2015;107:1057–73.
50. Shuai M, Fu Y, Zhong H, Gou W, Jiang Z, Liang Y, et al. Mapping the human gut mycobiome in middle-aged and elderly adults: multiomics insights and implications for host metabolic health. Gut. 2022;71:1812–20.
51. Suhr MJ, Banjara N, Hallen-Adams HE. Sequence-based methods for detecting and evaluating the human gut mycobiome. Lett Appl Microbiol. 2016;62:209–15.
52. Wu N, Mo H, Mu Q, Liu P, Liu G, Yu W. The gut mycobiome characterization of gestational diabetes mellitus and its association with dietary intervention. Front Microbiol. 2022. https://doi.org/10.3389/fmicb.2022. 892859.
53. Nash AK, Auchtung TA, Wong MC, Smith DP, Gesell JR, Ross MC, et al.
The gut mycobiome of the human microbiome project healthy cohort. Microbiome. 2017;5:153.
54. Enaud R, Vandenborght L-E, Coron N, Bazin T, Prevel R, Schaeverbeke T, et al. The mycobiome: a neglected component in the microbiota-gutbrain axis. Microorganisms. 2018;6:22.
55. Jiang TT, Shao T-Y, Ang WXG, Kinder JM, Turner LH, Pham G, et al. Commensal fungi recapitulate the protective benefits of intestinal bacteria. Cell Host Microb. 2017;22:809-816.e4.
56. Duysburgh C, Van den Abbeele P, Morera M, Marzorati M. Lacticaseibacillus rhamnosus GG and saccharomyces cerevisiae boulardii supplementation exert protective effects on human gut microbiome following antibiotic administration in vitro. Benef Microb. 2021;12:365–79.
57. Roy Sarkar S, Mitra Mazumder P, Chatterjee K, Sarkar A, Adhikary M, Mukhopadhyay K, et al. Saccharomyces boulardii ameliorates gut dysbiosis associated cognitive decline. Physiol Behav. 2021;236:113411.
58. Samonis G, Falagas M, Lionakis S, Ntaoukakis M, Kofteridis D, Ntalas I, et al.
Saccharomyces boulardii and Candida albicans experimental colonization of the murine gut. Med Mycol. 2011;49:395–9.
59. Berg R, Bernasconi P, Fowler D, Gautreaux M. Inhibition of Candida albicans translocation from the gastrointestinal tract of mice by oral administration of saccharomyces boulardii. J Infect Dis. 1993;168:1314–8.
60. Jawhara S, Poulain D. Saccharomyces boulardii decreases inflammation and intestinal colonization by Candida albicans in a mouse model of chemically-induced colitis. Med Mycol. 2007;45:691–700. 2014;5:4–11.
61. Møller N. Ketone body, 3-hydroxybutyrate: minor metabolite - major medical manifestations. J Clin Endocrinol Metab. 2020;105:2884–92.
62. Mickiewicz B, Tam P, Jenne CN, Leger C, Wong J, Winston BW, et al. Integration of metabolic and inflammatory mediator profiles as a potential prognostic approach for septic shock in the intensive care unit. Crit Care. 2015;19:11.
63. Pandey S, Siddiqui MA, Azim A, Sinha N. Metabolic fingerprint of patients showing responsiveness to treatment of septic shock in intensive care unit. Magn Reson Mater Phy. 2023;36:659–69.
64. Hypoglycemia and Risk of Death in Critically Ill Patients. New England Journal of Medicine. 2012;367:1108–18.
65. Galley HF. Oxidative stress and mitochondrial dysfunction in sepsis. BJA Br J Anaesth. 2011;107:57–64.
66. Ashfaq M, Moats AR, Northrup H, Singletary CN, Hashmi SS, Koenig MK, et al. Hypoglycemia in mitochondrial disorders. Mitochondrion. 2021;58:179–83.
67. Piziak VK, Carpentier W. Candida sepsis manifested by recurrent diabetic ketoacidosis. Diabetes Care. 1987;10:784–5.
68. Gregory R, McElveen J, Tattersall RB, Todd I. The effects of 3-hydroxybutyrate and glucose on human T cell responses to Candida albicans. FEMS Immunol Med Microbiol. 1993;7:315–20.
69. Pinto TF, Rocha R, Paula CA, de Jesus RP. Tolerance to enteral nutrition therapy in traumatic brain injury patients. Brain Inj. 2012;26:1113–7.
70. Blaser AR, Starkopf J, Kirsimägi Ü, Deane AM. Definition, prevalence, and outcome of feeding intolerance in intensive care: a systematic review and meta-analysis: How to define feeding intolerance? Acta Anaesthesiol Scand. 2014;58:914–22.
71. Ene IV, Cheng S-C, Netea MG, Brown AJP. Growth of Candida albicans cells on the physiologically relevant carbon source lactate affects their recognition and phagocytosis by immune cells. Infect Immun. 2013;81:238–48.
72. Oami T, Chihade DB, Coopersmith CM. The microbiome and nutrition in critical illness. Curr Opin Crit Care. 2019;25:145.
73. Serbanescu MA, Mathena RP, Xu J, Santiago-Rodriguez T, Hartsell TL, Cano RJ, et al. General anesthesia alters the diversity and composition of the intestinal microbiota in mice. Anesth Analg. 2019;129:e126.
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 14.02.2024
[~DATE_ACTIVE_FROM] => 14.02.2024
[ACTIVE_FROM_X] => 2024-02-14 00:00:00
[~ACTIVE_FROM_X] => 2024-02-14 00:00:00
[ACTIVE_FROM] => 14.02.2024
[~ACTIVE_FROM] => 14.02.2024
[SHOW_COUNTER] => 410
[~SHOW_COUNTER] => 410
[ID] => 8404
[~ID] => 8404
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 14.02.2024 15:44:46
[~TIMESTAMP_X] => 14.02.2024 15:44:46
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/disbioz-mikobioma-kishechnika-posle-sepsisa-i-travmy/
[~DETAIL_PAGE_URL] => /library/articles/disbioz-mikobioma-kishechnika-posle-sepsisa-i-travmy/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => disbioz-mikobioma-kishechnika-posle-sepsisa-i-travmy
[~CODE] => disbioz-mikobioma-kishechnika-posle-sepsisa-i-travmy
[EXTERNAL_ID] => 8404
[~EXTERNAL_ID] => 8404
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 14 февраля 2024
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Дисбиоз микобиома кишечника после сепсиса и травмы
[PREVIEW_PICTURE] => Array
(
[ID] => 5504
[TIMESTAMP_X] => 14.02.2024 15:44:46
[MODULE_ID] => iblock
[HEIGHT] => 675
[WIDTH] => 1000
[FILE_SIZE] => 1419347
[CONTENT_TYPE] => image/png
[SUBDIR] => iblock/bc4/asn1j7mj7yysyey1brhxb2xfvlcqu0u3
[FILE_NAME] => Title-Image-2.png
[ORIGINAL_NAME] => Title-Image-2.png
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => b2ba65b971d8723ac9e8a5b053d5a7ae
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/bc4/asn1j7mj7yysyey1brhxb2xfvlcqu0u3/Title-Image-2.png
[UNSAFE_SRC] => /upload/iblock/bc4/asn1j7mj7yysyey1brhxb2xfvlcqu0u3/Title-Image-2.png
[SAFE_SRC] => /upload/iblock/bc4/asn1j7mj7yysyey1brhxb2xfvlcqu0u3/Title-Image-2.png
[ALT] => Дисбиоз микобиома кишечника после сепсиса и травмы
[TITLE] => Дисбиоз микобиома кишечника после сепсиса и травмы
)
[DETAIL_TEXT] => Park et al. Critical Care (2024) 28:18
https://doi.org/10.1186/s13054-023-04780-4
Исследование
Перевод оригинальной статьи «Gut mycobiome dysbiosis after sepsis and trauma»
Авторы: Gwoncheol Park1, Jennifer A. Munley2, Lauren S. Kelly2, Kolenkode B. Kannan2, Robert T. Mankowski3, Ashish Sharma2, Gilbert Upchurch2, Gemma Casadesus4, Paramita Chakrabarty5, Shannon M. Wallet6, Robert Maile2, Letitia E. Bible2, Bo Wang7, Lyle L. Moldawer2, Alicia M. Mohr2, Philip A. Efron2, Ravinder Nagpal*
1 Department of Health, Nutrition, and Food Sciences, Florida State University, Tallahassee, FL 32306, USA.
2 Department of Surgery and Sepsis and Critical Illness Research Center, University of Florida College of Medicine, Gainesville, FL 32611, USA.
3 Department of Aging and Geriatric Research, University of Florida College of Medicine, Gainesville, FL 32611, USA. 4 Department of Pharmacology and Therapeutics, University of Florida College of Medicine, Gainesville, FL 32611, USA.
5 Department of Neuroscience, University of Florida College of Medicine, Gainesville, FL 32611, USA.
6 Department of Oral Biology, University of Florida College of Dentistry, Gainesville, FL 32611, USA.
7 Department of Biomedical and Chemical Engineering and Sciences, Florida Institute of Technology, Melbourne, FL 32901, USA.
Ключевые слова: терапия критических состояний, критическое заболевание, дисбиоз, грибы, метаболом, микробиота, микобиом, патобиом, сепсис, травма

Введение
Микобиом кишечника (грибковый микробиом) составляет важную часть общего сообщества микробов кишечника. При том, что грибы, ассоциированные с кишечником, занимают относительно небольшую нишу по сравнению с бактериями, они играют заметную роль в поддержании бактериального кишечного микробиома, неся на себе определяющую функцию как в гомеостазе хозяина, так и в физиологических процессах [1]. За последние несколько десятилетий исследования показали, что нарушение баланса в микобиоме кишечника (дисбиоз) может вносить свой вклад в патогенез заболеваний кишечника, включая воспалительные заболевания кишечника [2, 3], синдром раздраженной кишки [4, 5] и колоректальные злокачественные новообразования [6]. Более того, последствия дисбиоза микобиома не ограничиваются только лишь желудочно-кишечным трактом и могут быть тесно связаны с развитием экстра-кишечных заболеваний, таких как аллергические заболевания дыхательных путей за счет влияния на локальный и периферический иммунный гомеостаз [7]. Очевидно, что чрезмерное преобладание оппортунистических патогенных грибов (микопатобиом) при дисбиотических состояниях может привести к системной грибковой инфекции, как, например, кандидоз, что потенциально может приводить к фатальному исходу [8]. Кандидозы относят к одним из наиболее распространенных случаев инфекций кровотока у госпитализированных пациентов [9, 10]. Нарушение сотрудничества бактерий и грибов за счет бактериального дисбиоза может приводить к разрушению баланса и в грибковом сообществе с последующим чрезмерным ростом патогенных грибов [11]. И наоборот, нарушения в грибковом сообществе могут стимулировать рост бактериальных патобионтов, что неизбежно ведет к развитию и/или ухудшению воспалительных заболеваний тонкого кишечника [12].
Несмотря на то, что сепсис и травма представляют собой два различных медицинских состояния, к их общим чертам можно отнести клинические особенности и исходы после госпитализации. Предыдущие исследования показали, что и пациенты с сепсисом, и пациенты с травмой классифицируются как «пациенты с критическим заболеванием», страдающие выраженным дисбиозом микробиома кишечника во время госпитализации [13, 14] и такой дисбиотический статус очень строго коррелирует с риском госпитальной летальности [15, 16]. Дисбиоз кишечника у таких критически больных пациентов может увеличивать уязвимость к госпитальным инфекциям с последующим развитием сепсиса и синдрома полиорганной недостаточности [17]. В общем и целом, критически больные пациенты могут стать иммуноскомпроментированными или даже иммуносупрессивными на фоне продолжающегося заболевания [18]. Скомпрометированная иммунная система не может сдержать пролиферацию патогенов, что позволяет оппортунистическим патогенам и патобионтам преодолевать защитные механизмы иммунной системы хозяина и неблагоприятно влиять на микроэкологию кишечника [19]. Важно то, что антибиотики, часто применяемые у пациентов с сепсисом и травмой в целях борьбы или профилактики инфекций, разрушают полезных комменсалов кишечника, что усугубляет состояние уязвимости к инфекции [20].
Ранее мы наблюдали персистирующий бактериальный дисбиоз и нарушения профилей метаболома, что приводило к состоянию патобиома у критически больных пациентов на 2–3 неделе после поступления в отделение интенсивной терапии (ОИТ). Принимая во внимание тесные и взаимовыгодные взаимодействия между бактериальным и грибковым сообществами, становится возможным то, что случай выраженного бактериального дисбиоза может приводить к коморбидным пертурбациям в сообществе грибкового микробиома. При этом имеется совсем немного информации в отношении нарушений в грибковом сообществе, особенно на поздних стадиях сепсиса или травмы, когда восстановление пациентов задерживается. Принимая во внимание то, что измененный микробиом кишечника у таких критически больных пациентов может служить основой длительного воспаления, иммуносупрессии и катаболизма (prolonged inflammation, immunosuppression, and catabolism [PICS]), мы выдвинули гипотезу, что критически больные пациенты с травмой и сепсисом с отсроченным восстановлением могут показывать паттерны нарушений регуляции микобиома. Наши результаты показали, что профиль микобиома у таких критически больных пациентов сдвигается к патологическому паттерну за счет Candida spp., но с одновременными изменениями в микроэкологических нишах бактериального микробиома. Поскольку и частота рецидивов, и предрасположенность к неблагоприятным долгосрочным исходам у таких пациентов очень высокие, наши результаты имеют важное клиническое значение, относящееся к интенсивной терапии и исходам, особенно у пациентов, страдающих хроническим критическим заболеванием, ассоциированным с пребыванием в ОИТ, и задержкой восстановления.
Методы
Популяция исследования
Общая структура эксперимента показана на Рис. 1А. Это исследование было одноцентровым, проспективным, обсервационным, когортным, проведенным с травмацентре первого уровня. Период исследования 2019–2023 гг., критерии включения и исключения подробно изложены в дополнительном файле 1: Table S1. Сбор основных данных для специфических пациентов с сепсисом и для здорового контроля был проведен в рамках исследования под названием «Persistent Inflammation, Immunosuppression, and Catabolism Syndrome (PICS): A New Horizon for Surgical Critical Care», что было одобрено «the Institutional Review Board (IRB)» под номером 201400611 от 28 октября 2014 года с последующей регистрацией на ClinicalTrials.gov под идентификационным номером NCT02276417. Начальные данные для определенных пациентов с травмой были собраны в рамках исследования под названием «Hematopoietic Stem Cell Dysfunction in the Elderly after Severe Injury», что было одобрено IRB под номером 201601386 от 06 сентября 2016 года с последующей регистрацией на ClinicalTrials.gov с идентификационным номером NCT02577731. Дополнительные данные были получены в контексте исследования под названием «Gut Microbiome Dysfunction in Sepsis and Trauma Survivors» (одобрение IRB № 202102863 от 03 мая 2022 года, регистрация на ClinicalTrials.gov № NCT05357170). Отчет об исследовании составлен в соответствии с руководящими принципами STROBE (the Strengthening the Reporting of Observational Studies in Epidemiology) [22]. В исследование включено 19 здоровых субъектов контроля, 18 пациентов с тяжелой травмой и 18 хирургических пациентов с сепсисом. Выбор такого размера выборки основывался на анализе мощности, при котором предположено, что 80% или более высокая вероятность (бета) обнаружения 30%-го изменения по сравнению с исходным уровнем потребует размера выборки, как n =18 для каждой группы.

Клинические данные и сбор проб
Клинические данные, включая возраст, пол, расу, этническую принадлежность и сопутствующую патологию были собраны для профилирования демографических характеристик когорт. Дополнительно были документированы параметры лечения и результатов, включая сюда такие факторы, как оценки тяжести повреждения, критерии сепсиса, трансфузии продуктов крови, введение антибиотиков, питание, а также длительность пребывания в ОИТ и госпитализации. Также фиксировалась летальность. Важно отметить, что все пациенты с травмой и сепсисом, включенные в исследование, подвергались по меньшей мере двухнедельному лечению в ОИТ и отвечали критериям Хронического критического заболевания (Chronic Critical Illness [CCI]) и PICS [23].
Пробы стула получались per rectum с помощью ректальной трубки или из колостомы в период с 14 по 21 день госпитализации, после чего эти образцы разделяли на аликвоты и хранили в бактериальной среде Cary-Blair (ThermoFisher Scientific, Waltham, MA) при температуре -80ºC. Одновременно с этим получались образцы крови при одноразовой пункции вены с последующим хранением в пробирках с гепарином (Becton–Dickinson & Co., Franklin Lakes, NJ). Далее образцы крови подвергались центрифугированию 800 × g в течение 10 минут, а полученная плазма хранилась при температуре -80 °C.
Анализ микобиома
Измерения микробиома и его анализ проводился согласно ранее описанному нами методу [24, 25]. Если кратко, то мы извлекали геном ДНК высокого качества из 200 мг фекальных проб, используя для этого QIAmp PowerFecal Pro DNA Kit (Qiagen, Hilden, Germany), с количественной оценкой с помощью спектрометра Nanodrop (Thermo Fisher Scientific, Waltham, MA, USA). Внутренняя транскрибируемая спейсерная область (The internal transcribed spacer[ITS]) гена грибковой рРНК была амплифицирована в соответствии с эталонным протоколом проекта Earth Microbiome Project (www.earthmicrobiome.org). Результирующие ампликоны были очищены с использованием AMPure ® XP magnetic beads kit (Beckman Coulter, Indianapolis, IN), а уже очищенные продукты были количественно оценены с помощью Qubit-4 fluorimeter(InVitrogen, Waltham, MA, USA). Создание библиотеки ампликонов шло согласно ранее описанному методу [26]. Все очищенные продукты объединяли согласно эквимолярным концентрациям с дальнейшим секвенированием на платформе Illumina MiSeq (Illumina Inc., SanDiego, CA, USA), используя для этого набор реагентов (MiSeq reagent kit v3; Illumina Inc).
Биоинформатика и статистический анализ
Грубые последовательности подвергались обработке с помощью программного обеспечения theQuantitative Insights Into Microbial Ecology (QIIME2) версии 2.2023.5) [27]. Качественная фильтрация, адаптерная обрезка, подавление шума и удаление не химерных ампликонов проводилось с использованием магистрали DADA2 с заранее установленными параметрами на плагинах «the q2-dada2». Все идентифицированные варианты последовательности ампликонов (identified amplicon sequence variants [ASVs]) выравнивались с помощью MAFFT [29]. Таксономическое выделение для этих ASVs было выполнено с использованием sklearnклассификатора, в основе которого лежит предварительно обученный наивный байесовский классификатор таксономии. Процесс классификации включал в себя приведение в соответствие с 99% базы данных UNITE 9.0. Альфа-разнообразие количественно определялось с помощью числа наблюдаемых метрик ASVs, Chao1 и Shannon. Для оценки бета-разнообразия был применен индекс различия (непохожести) Bray–Curtis, а результаты представлены с анализом главных координат (principal coordinate analysis [PcoA]). Статистический анализ, включая непараметрический тест Kruskal–Wallis и PERMANOVA с 999 рандомными перестановками, был применен для идентификации значительных различий в микробном разнообразии и структуре. Дифференциальная численность таксонов определялась с помощью подхода ANOVA-Like Differential Expression (ALDEx2) [30]. Предсказать группу на основании микробного состава с помощью контролируемой классификации помог плагин q2-sample-classifier в QIIME2. Этот процесс включал в себя вложенную стратифицированную пятикратную перекрестную проверку с использованием классификатора «Рандомный лес», построенного на 5 000 деревьев. Для изучения двух факторов, - группа и пол, - на численность таксонов и потенциальные эффекты взаимодействия был проведен двусторонний ANOVA тест. Для изучения корреляций между грибковыми таксонами и бактериальными таксонами, кишечником и метаболитами плазмы, использовалась ранговая корреляция Spearman. Сети, соединяющие таксоны грибов и метаболиты кишечника, устанавливались путем расчета корреляций Spearman, при этом существенные ассоциации (коэффициент корреляции Spearman> 0.30 и скорректированное значение р<0.05 по Benjamini–Hochberg) были визуализированы с помощью Cytoscape v3.9.1 [31]. Визуализация данных проводилась с использованием пакетов «R» или «Python».
Результаты
Характеристики субъектов
Характеристики пациентов, - здоровых субъектов группы контроля, пациентов с сепсисом и пациентов с травмой, - детально показаны в дополнительном файле 1:Table S2. Не было значительных различий в возрасте, поле, расе или в этнической принадлежности. При сравнении сопутствующей патологии (коморбидности) в виде гипертензии, гиперлипидемии, заболевания почек с креатинином> 1.5 мг/дл, заболевания коронарных сосудов, диабетов, застойной сердечной недостаточности, хронической обструктивной болезни легких, а также злокачественные новообразования, то существенное различие наблюдалось для гипертензии и заболевания коронарных сосудов. Как в когорте сепсиса, так и в когорте травмы имелось высокое распространение гипертензии по сравнению с контрольной группой, в то время как когорта сепсиса показывала большее количество пациентов с болезнью коронарных сосудов в анамнезе. Внимание заслуживает и то, что все пациенты с сепсисом и травмой получали антибиотики во время госпитализации. Как и ожидалось, пациенты с сепсисом получали более разнообразные антибиотики и более длительное время, в большей степени по причине необходимости в проведении контроля за очагом инфекции. Все пациенты в когортах сепсиса и травмы получали энтеральное питание, как через зонд, так и самостоятельно. Только один пациент с сепсисом получал тотальное парентеральное питание в течение 10 дней. Группа сепсиса показала существенно более длительное время пребывания в ОИТ и госпитализации по сравнению с когортой травмы.
Сигнатуры дисбиотического микобиома после сепсиса и травмы смещаются в сторону профиля патобиома, восприимчивого к инфекции
Для изучения изменений в микобиоме кишечника после госпитализации критически больных пациентов с травмой и сепсисом мы провели анализ разнообразия и состава сообщества грибов. Более того, мы изучили различия, основываясь еще и на половой принадлежности хозяина (Рис. 1b, c). Общие профили микобиома в когортах сепсиса и травмы были практически аналогичными, при этом в значительной степени контрастировали с составом в контрольной когорте. В контрольной группе дистанция бета-разнообразия (мера сходства микробных сообществ между двумя пробами или экосистемами) между субъектами, преобразованная в двумерный график с использованием анализа PCoA, основанного на различии, показала намного меньшую разницу между женщинами по сравнению с мужчинами. Это привело к более отчетливым расхождениям в массивах между здоровыми взрослыми и пациентами с сепсисом или травмами среди женщин (Рис. 1b), что указывает на существование различных профилей микобиома между этими группами. Во всех группах микробное альфа-разнообразие (богатство видов) у пациентов представляло высокий уровень дисперсии. При этом пациенты с сепсисом показывали существенно более низкое микробное разнообразие по сравнению со здоровым контролем и пациентами с травмой (согласно индексу Shannon, который измеряет как микробиологическую насыщенность, так и однородность). При том, что не наблюдались различия между группами в общем количестве вариантов последовательностей ампликонов (ASVs, как непрямой показатель численности видов), что представляют наблюдаемое количество генов, потенциально исходящих из различных бактерий, и микробном разнообразии, измеряемом с помощью индекса Chao1 (измеряющим исключительно микробное разнообразие), что указывает на отсутствие вариаций в микробном богатстве между группами, только в группе сепсиса наблюдалась явная микробная однородность. В группе контроля мужчины, по сравнению с женщинами, показали высокое разнообразие, в то время как у пациентов с сепсисом и травмой наблюдался противоположный тренд. Только пациенты с сепсисом мужского пола показали существенно более низкое разнообразие Shannon и имели меньше ASVs, чем здоровые мужчины в группе контроля. И наоборот, пациенты женского пола с сепсисом и травмой показали почти сопоставимое или даже немного большее разнообразие по сравнению со здоровыми женщинами (Рис.1c). На уровне вида сообщество микобиома показало доминирование двух больших видов грибов, а именно Basidiomycota и Ascomycota. Примечательно, что Basidiomycota, которые в остальном составляли значительную долю состава у здоровых взрослых, были почти истощены как у пациентов с сепсисом, так и у пациентов с травмой (Рис. 1d). Более глубокий анализ показал, что такое различие в первую очередь было связано со взрывным увеличением уровня генов Candida у пациентов с сепсисом и травмой. У здоровых взрослых Rhodotorula, Saccharomyces и Penicillium являются основными родами, составляющими микобиом кишечника, но у пациентов с сепсисом Candida становится преобладающим родом. Если говорить о пациентах с сепсисом, то Candida достигает 95% от всего состава микобиома (Рис.1e). В дифференциальном анализе изобилия (differentialabundance analysis) Candida была идентифицирована как наиболее пролиферирующий род у пациентов с сепсисом и травмой, далее следовала Fusarium, в то время как Penicillium и Saccharomyces были на грани истощения (Рис. 2a, b). Более того, дальнейший анализ с использованием ANOVA, выделил Candida, Penicillium, Fusarium и Rhodotorula в качестве основных таксонов, существенно различающихся между тремя группами (Рис. 2f). К тому же здоровые взрослые показывают явные отличия микробного состава в зависимости от пола. Мужчины имеют более высокие уровни Candida and Penicillium, а вот женщины показывают преобладание Saccharomyces и Rhodotorula (Рис. 1e, 2e). У обоих полов наличие таксонов, отличных от Candida, было незначительно ниже при у пациентов с сепсисом и травмой, при этом Aspergillus имели тенденцию к большей распространенности у женщин с сепсисом, чем у мужчин, а Chimonocalamus имели тенденцию к преобладанию у пациентов женского пола с травмой по сравнению с пациентами мужского пола. Высокие уровни Rhodotorula наблюдались у субъектов женщин во всех группах (Рис. 2c-e). Несмотря на то, что ни один из таксонов не был идентифицирован как существенно различающийся по полу в ANOVA, Rhodotorula и Chimonocalamus показали наибольшее влияние пола, независимо от группы, среди всех таксонов (Рис. 2f). Далее мы обучили и внедрили модель машинного обучения для того, чтобы предсказать и уловить различия между пациентами с сепсисом и травмой, а также здоровым контролем, имея намерение понять нарушения в их микобиоме.
Контрольная группа показала очень высокую прогностическую точность (AUC = 0.92), в то время как в группах сепсиса и травмы прогностическая точность была относительной (AUC = 0.74 и 0.75, соответственно) (Рис. 2h). В группе сепсиса образцы, что некорректно указывали на прогноз, с большей вероятностью были отнесены к группе травмы, чем к контрольной группе, и этот паттерн наблюдался и группе травмы (Рис. 2g). Это может быть объяснено аналогичными микробными профилями, что наблюдались как у пациентов с сепсисом, так и у пациентов с травмой. Candida последовательно идентифицировалась как наиболее значимый признак для прогнозирования, далее следовали Curvularia и Penicillium и эти таксоны наиболее часто наблюдались при сепсисе, травме и в контрольной группе, соответственно (Рис. 2i).

В каждом анализе воспроизводимо доказано, что Candida является наиболее значительным отличительном видом для различения пациентов с сепсисом и травмой от здорового контроля. Мы изучили, действительно ли только лишь профиль Candida способен дать характеристику группам и, тем самым, использоваться в качестве эксклюзивного фактора прогнозирования по группам. В общем и целом, не только наличие Candida, но частота выявления при сепсисе и травме было существенно выше, чем в группе контроля (Рис. 2j). Несмотря на то, что наличие Candida в группе сепсиса было наивысшим, частота выявления Candida была наивысшей в группе травмы, где все пациенты оказались носителями Candida. Все ASVs, определенные как Candida, были успешно распределены на видовом уровне с выявлением шести родов. Профили родов Candida показывали существенные различия между группой контроля против групп пациентов с сепсисом и травмой, при этом у пациентов с сепсисом и травмой имелись аналогичные профили. Более конкретно, C. orthopsilosis и C. sake выявлялись только в группе здорового контроля и представляли значительную пропорцию всей флоры Candida в этой группе. И наоборот, C. dubliniensis и C. parapsilosis, что были наиболее частыми видами в группах сепсиса и травмы, в группе здорового контроля выявлялись не часто. C. albicans и C.tropicalis показали наибольшую численность и частое выявление во всех группах, с умеренно большей частотой выявления в группах сепсиса и травмы по сравнению со здоровым контролем (Рис. 2k). При изучении с помощью анализа PCoA, основанного на профилях видов Candida, здоровая контрольная группа продемонстрировала явно отличающийся от групп сепсиса и травмы профиль. Стоит обратить внимание на то, что общий профиль внутри каждой группы был почти идентичен групповым структурам, полученным со всеми ASVs, что указывает на то, что ASVs, отнесенные к видам Candida, были основными признаками, определяющими как общую групповую структуру, так и различия между группами (Рис.2l). Помимо этого, точность прогнозирования модели, обученной исключительно для видов Candida, показала аналогичные закономерности для модели прогнозирования, обученной со всеми данными микробиома (Рис. 2m, n). C. tropicalis и C. albicans были последовательно определены как наиболее важные виды для определения и прогнозирования групп (Рис. 2o).
Сигнатуры дисбиоза микобиома коррелируют с нарушениями в микроэкологических нишах бактериом-метаболома
Кишечник является очень сложной экосистемой с различными формами симбиоза. Изменения в одном домене в значительной степени оказывают влияние на другие домены и побочные продукты метаболизма микробов. Ранее мы наблюдали значительно снижение разнообразия кишечных бактерий у пациентов с сепсисом и травмой, что сопровождалось существенным сдвигом в составе микробиоты, включая появление специфических паттернов патобиома. К этому же, что при травме, что при сепсисе имеются ассоциации с определенными метаболитами фекалий и плазмы (Дополнительный файл 2: Figure S1). Исходя из этого и для понимания экологической ниши и фундаментальной взаимосвязанной регуляции микобиомных сообществ в кишечнике, мы провели корреляционный анализ таксонов грибов с микробиомом кишечника, а также с кишечными метаболитами и метаболитами плазмы (Рис. 3a-e). Бактериальные таксоны, что имели хотя бы одну существенную связь с таксонами грибов, были разделены на две ветви, основываясь на пациентах с сепсисом и травмой. Другая ветвь в большинстве своем содержала таксоны комменсалов, включая сюда Bifidobacterium, Akkermansia и Ruminococcus, которые, как правило, сосуществуют с родами грибов, наиболее часто встречающихся у здоровых взрослых (Рис. 3a). Конкретнее, три основных рода, а именно Candida, Fusarium и Penicillium, показывают наиболее значимые корреляции с бактериями-комменсалами, включая Faecalibacterium, Anaerostipes и Eubacterium. Candida и Fusarium, что показывают рост при сепсисе и травме, отрицательно коррелируют с бактериями-комменсалами, в то время как род Penicillium, более изобильный у здорового контроля, показал строгую положительную корреляцию с этими бактериями. Более того, несколько полезных бактерий, таких как Akkermansia и Blautia, показали положительную корреляцию с Penicillium и отрицательную корреляцию с Candida. При этом мы наблюдали обратный тренд с Lactobacillus, которые положительно коррелировали с таксонами грибов, в изобилии представленными у пациентов с сепсисом и травмой (Рис. 3d).


Микробные метаболиты кишечника также разделены на иерархические кластеры на основании сетевой взаиморегуляции с таксонами грибов. Один кластер состоял из короткоцепочечных жирных кислот (short-chain fatty acids [SCFAs]), включая бутират и пропионат, что положительно коррелировали с таксонами грибов, преобладающих у здоровых взрослых. Другой кластер состоял из побочных продуктов метаболизма микробов и включал в себя лактат, триметиламин N-оксид (trimethylamineN-oxide [TMAO]) и этанол, которые положительно коррелировали с таксонами, преобладающими у пациентов с сепсисом и травмой (Рис. 3b).Candida показали строгую отрицательную корреляцию с SCFAs, тогда как Penicillium показали не менее строгую положительную корреляцию с бутиратом. Эти результаты также отражены в сетевом анализе, где Candida показали совместную сеть с аланином и сорбитолом, а также с бутиратом. И наоборот, Penicillium показал прямо противоположные сети к этим метаболитам (Рис. 3f). Род грибов Curvularia представил аналогичные корреляционные профили с Candida, в большей части отрицательно коррелируя с основными метаболитами, ассоциированными с целостностью кишечника, такими как пропионат, холат и треонин. В то время как Issatchenkia и Alternaria показали существенны корреляции с аминокислотами, их низкие показатели распространенности (9.4% и 5.7%, соответственно) позволяют предположить, что значимость результатов может вводить в заблуждение по причине искажения данных. Касательно метаболома крови (плазмы), то здесь три метаболита, - лактат, глутамат и аланин, - несут общие черты с метаболитами кишечника. Но только лактат показал аналогичные паттерны корреляции с грибами, как это наблюдалось для лактата кишечника, но это не достигло статистически значимых значений. В общем и целом, только Candida и Penicillium показали строгие и явные корреляции с метаболитами плазмы, но у этих родов были прямо противоположные профили.
Penicillium отрицательно коррелировал с 3-гидроксибутиратом, основным кетоновым телом, продуцируемом при кетогенезе, но положительно коррелировал с ацетатом, глутаматом и аланином, которые вовлечены в глюконеогенез. Candida показала прямо противоположные взаимоотношения с этими метаболитами (Рис. 3c, e).
Обсуждение
Микробиом служит в качестве первой линии защиты против патогенов кишечника, а нарушения в микробиоме (дисбиоз) могут приводить к увеличению уязвимости к тяжелым инфекциям. Действительно, ранее проведенные исследования показали, что пациенты, получавшие в госпитале лечение антибиотиками, находятся под высоким риском последующих госпитализаций с сепсисом и основной причиной здесь является дисбиоз кишечника и патобиом [32]. В то время как у пациентов с сепсисом или после тяжелой травмы следует ожидать значительные нарушения в микробиоме, исследования в этой области очень ограничены, при этом в большей степени исследования сосредоточены на бактериальном микробиоме. В нашем исследовании мы показали наличие, постоянство и фенотип дисбиоза микобиома кишечника при сепсисе и у пациентов с травмой после двух недель госпитализации. Эти результаты показывают то, что у критически больных пациентов с сепсисом и травмой, у которых на две-три недели задерживается восстановление и они остаются в ОИТ, развивается поздний дисбиоз. Примечательно, что у этих пациентов очень высокие риски/предрасположенность к неблагоприятным долгосрочным исходам.
В общем и целом, мы идентифицировали дисбиоз в микобиоме, что характеризуется снижением разнообразия (богатство видов), нарушенной микробной структурой и острым увеличением Candida на фоне истощения таксонов грибов-комменсалов, включая сюда Penicillium и Saccharomyces, у пациентов с сепсисом и у пациентов с травмой. Принимая во внимание тот факт, что именно эти грибы являются основными родами, что составляют сообщество микобиома, то пациенты с сепсисом и травмой могут испытывать существенные нарушения в экологических нишах грибов, тем самым обретая высокий риск последующей грибковой инфекции, к примеру кандидоз. Несмотря на то, что не имеется специализированных исследований, в которых сообщалось бы об общих изменениях микобиома у пациентов с сепсисом и травмой, имеется консенсус в том, что критически больные пациенты в ОИТ имеют восприимчивую к инфекции кишечную микросреду [20]. В предыдущих исследованиях сообщалось, что во время пребывания в ОИТ бактериальное сообщество разрушается одновременно с сообществом грибов, что имело взаимовыгодное сотрудничество с бактериальным сообществом. И как следствие, истощаются или нарушаются иммуномодуляторные и ключевые метаболиты, такие как SCFAs и желчные кислоты [20]. К тому же наблюдение аналогичных паттернов в двух отличающихся друг от друга медицинских состояниях, - сепсис и травма, - предоставляют доказательства потенциальной причинно-следственной связи между травмой и развитием сепсиса.
Ранее уже сообщалось, что тяжелая травма может индуцировать выраженный дисбиоз в течение очень короткого периода времени и приводить к сепсису за счет разрушения эпителиального барьера кишечника [33, 34]. Мы также наблюдали различия в микробном спектре между мужчинами и женщинами. Пациенты мужского пола показали значительное снижение разнообразия, особенно в когорте сепсиса, в то время как микробное разнообразие у пациентов женского пола либо немного снизилось, либо почти не изменилось, что позволяет предположить более тяжелый дисбиоз у мужчин по сравнению с женщинами. Эти результаты находятся в согласии с нашими предыдущими наблюдениями в отношении бактериальных сообществ, когда микробиом у женщин показывал большее сопротивление к инфекции и повреждению [24, 35, 36]. Эти результаты позволяют предположить, что тенденция к развитию тяжелого сепсиса превалирует у мужчин, а половой диморфизм в дисбиозе, возможно, является одной из основных причин большей тяжести сепсиса, наряду с его распространенностью, у мужчин [37, 38].
Одним из самых важных факторов, приводящих к таким дисбиотическим состояниям, без сомнения, является антибиотикотерапия. Введение антибиотиков может вести к чрезмерному росту Candida при одновременном разрушении общего микробного сообщества, как это наблюдалось в исследованиях [20, 39, 40]. В целом, были идентифицированы виды Candida, а четыре из них были наиболее изобильными у пациентов с сепсисом и травмой. C. parapsilosis и C. dubliniensis, которые исключительно выявляются только у пациентов с сепсисом и травмой, как правило не выявляются в кишечнике, а чаще обнаруживаются на руках и в ротовой полости, соответственно [41, 42]. При том, что C. albicans и C. tropicalis были найдены во всех группах, но большее изобилие и распространенность они показали у пациентов с сепсисом и травмой. Оба этих вида таксономически близки и имеют общие черты [43], что делает их хорошо знакомыми причинами кандидоза, что часто обнаруживается у пациентов ОИТ, получавших лечение антибиотиками [20]. Взятое все вместе, как экзогенные, так и эндогенные виды Candidaвсегда готовы пролиферировать в кишечник пациентов с сепсисом и травмой, так как у этих пациентов все экологические ниши в кишечнике разрушены, что ведет к иммуноскомпроментированному состоянию. Более того, исследования пациентов или новорожденных в ОИТ уже предположили, что антибиотики широкого спектра и длительная антибиотикотерапия может вносить существенный вклад в частоту развития инвазивного кандидоза [44, 45]. К том же, экспансия патогенных видов Candida может стать ранним маркером системного кандидоза [8]. Механистические пути, с помощью которых эти виды становятся доминирующими в кишечнике при дисбиозе с последующим развитием кандидозов, могут быть многофакторными и мультидинамичными. К примеру, потеря бактерий-комменсалов с одновременным снижением SCFAs могут может послужить триггером или ингибитором пролиферации Candida. Специфичные бактерии-комменсалы, как это уже показано, могут подавлять колонизацию C. Albicans за счет активации эффекторов врожденной иммунной системы и антимикробных пептидов [40]. Пептидогликан напрямую влияет на рост C. albicans за счет активации аденилилциклазы Cyr1p, что контролирует рост нитей хитина (гифов или hyphal) [46]. Антибиотикотерапия может увеличивать доступность фрагментов пептидогликана за счет более быстрого высвобождения субъединиц пептидогликана, что приводит к росту хитиновых нитей у C. Albicans [47]. Наш анализ показал строгую корреляцию Candida с различными комменсалами, включая и грамположительные бактерии. Это позволяет предположить, что у пациентов с сепсисом и травмой не только утерян эффект подавления от скомпрометированных комменсалов, но и созданы благоприятные экологические ниши за счет фрагментов пептидогликана для пролиферации Candida. SCFAs тоже имеют эффекты подавления против роста и развития компонентов Candida, включая зародышевые трубки, нити хитина (гиф) и биопленки, соответственно, снижение уровней SCFAs у животных моделей связано с ростом C. Albicans [39]. Аналогично этому, наши результаты показали строгую отрицательную корреляцию уровней SCFAs с Candida, что указывает на ослабление или даже потерю супрессивного эффекта SCFAs на Candida у пациентов с сепсисом и травмой в связи с истощением популяции продуцентов SCFAs.
Когда мы наблюдали сокращение Penicillium и Saccharomyces, то здесь следует отметить, что Penicillium spp является продуцентом разнообразных вторичных метаболитов, включая жирные кислоты с антибактериальной активностью [48]. Несмотря на то, что имеются некоторые возражения в отношении жизнеспособности Penicillium в кишечной среде из-за ограничений роста у некоторых видов [49], было показано очень высокое изобилие у здоровых взрослых [50, 51], а также и антимикробные эффекты против патогенных бактерий [52]. Аналогично Penicillium, была обнаружена большая пропорция Saccharomyces у здоровых взрослых со строгой отрицательной корреляцией с Candida [53, 54]. Saccharomyces очень эффективно служат в качестве функциональной замены бактериям тонкой кишки, поддерживая защиту против повреждения ткани слизистой оболочки и повышая реактивность циркулирующих иммунных клеток [55]. Исследования показали, что введение S. cerevisiae мышам, которых лечили антибиотиками, не только снижает дисбиоз за счет восстановления бактерий-комменсалов [56. 57], но и существенно улучшает смертность и снижает восприимчивость к вирусной инфекции [55]. Несмотря на конфликтующие результаты в отношении эффекта подавления Saccharomycesна C. albicans [58], в нескольких исследованиях было показано, что введение Saccharomyces sppснижает колонизацию тонкого кишечника C. Albicans и частоту развития инвазивного кандидоза [59, 60]. Одним из важных наших наблюдений стали значительные корреляции микобиома с разрушением метаболомических ниш. Среди этих ассоциаций одна связана с плазменным 3-гидрооксибутиратом. Как ранее было отмечено, 3-гидрооксибутират является одним из кетоновых тел, что синтезируется в печени в период низкого потребления углеводов или во время голодания [61]. Увеличение уровней этого соединения наблюдалось у пациентов с сепсисом и травмой, что согласуется с ранее проведенными исследованиями у пациентов с сепсисом [62, 63] и указывает на то, что эти пациенты находятся в состоянии кетогенеза в связи с недостаточностью глюкозы в крови и неадекватным глюконеогенезом. Критически больные пациенты часто испытывают гипогликемию [64], что, вероятно, связано с митохондриальными расстройствами, индуцированными окислительным стрессом [65, 66]. К тому же, пациенты в ОИТ, получающие энтеральное питание, часто показывают непереносимость энтерального питания, в основном по причине нарушений в моторике желудочно-кишечного тракта и пареза желудка [67], при этом распространенность таких расстройств достигает 75% (в среднем 38%) [68]. Как наши результаты, так и результаты других исследований показывают, что у пациентов с сепсисом и травмой обнаруживаются нарушенные уровни сахара крови со снижением доступности сахара в кишечнике в связи с их медицинскими состояниями. В нашем корреляционном анализе Candida показывала положительную ассоциацию с уровнями 3-гидрооксибутирата в крови и лактата кишечника. Предыдущие исследования обнаружили, что тяжелая гипергликемия и кетонемия, характеризующаяся высокими уровнями 3-гидрооксибутирата, может приводить к снижению пролиферации антиген-специфичных Т-клеток. Такое снижение делает пациентов более уязвимыми к грибковой инфекции, больше к инфекции, вызываемой C. Albicans, так и к манифестации Candida-сепсиса [69, 70]. Эти результаты означают, что во время пребывания в ОИТ пациенты могут подвергнуться высокому риску инфицирования Candida по причине длительного кетонемического состояния. Более того, Candida, а особенно C. albicans, известна своей замечательной метаболической гибкостью, что позволяет ей использовать различные нутриенты при ограниченном поступлении сахара, когда лактат становится доступной альтернативой источникам углеводов. Интригующе здесь то, что рост C. albicans на лактате менее заметен для иммунной системы и, тем самым, иммунная система становится менее эффективной за счет снижения фагоцитоза иммунными клетками [71]. Возможно, что здесь можно предположить, что в условиях снижения доступности нутриентов в нишах хозяина во время сепсиса и травмы не только благоприятствует росту грибковых патобионтов, но и стимулирует их вирулентность.
Выводы
В итоге наши результаты впервые раскрыли постоянство дисбиоза кишечного микобиома и его сигнатуры, что приводит к состоянию патобиома с высокой уязвимостью к инфекции на протяжении двух недель после сепсиса и травмы. Как и любое исследование такого рода, наше исследование имеет ряд ограничений. Мы имели возможность собирать пробы только в одну фиксированную временную точку и поэтому мы не смогли изучить временную траекторию большого таксона грибов за все время госпитализации. Большинство участников исследования были европеоидами. Мы не имели возможности контролировать другие факторы, что могли бы оказать влияние на микобиом, включая тип энтерального питания и вид анестезии [72, 73]. Тем не менее, исследование обладало достаточной мощностью для каждой группы и обнаружило постоянство дисбиоза микобиома как у пациентов с сепсисом, так и у пациентов с травмой с развитием в течение двух недель после сепсиса и травмы. Продолжительность таких пертурбаций у пациентов с отсроченной или осложненной клинической траекторией позволяет с уверенностью предположить, что борьба с таким дисбиозом могла бы стать эффективным направлением для разработки схем терапии, направленных на снижение риска развития последующей грибковой инфекции. Такие схемы могли бы применять стратегии реабилитации анти-Candida микробиома, к примеру введение S. Cerevisiae или про/пре/постбиотическую фармакологическую активацию врожденной иммунной системы в целях противодействия колонизации оппортунистическими патогенными грибами [40]. Полученные нами результаты должны дать дополнительный стимул для последующих исследований в целях изучения новых подходов, что позволят снизить частоту развития грибковых инфекций за счет разработки терапевтических вмешательств, направленных на предотвращение дисбиоза и восстановление микроэкологического гомеостаза кишечника, которые позволят улучшить исходы с точки зрения здоровья и качества жизни после госпитализации у пациентов с критическими заболеваниями.
Список литературы:
1. Zhang F, Aschenbrenner D, Yoo JY, Zuo T. The gut mycobiome in health, disease, and clinical applications in association with the gut bacterial microbiome assembly. Lancet Microbe. 2022;3:e969–83.
2. Hoarau G, Mukherjee P, Gower-Rousseau C, Hager C, Chandra J, Retuerto M, et al. Bacteriome and mycobiome interactions underscore microbial dysbiosis in familial Crohn’s disease. MBio. 2016;7:10–1128.
3. Limon JJ, Tang J, Li D, Wolf AJ, Michelsen KS, Funari V, et al. Malassezia is associated with Crohn’s disease and exacerbates colitis in mouse models. Cell Host Microbe. 2019;25:377-388.e6.
4. Sciavilla P, Strati F, Di Paola M, Modesto M, Vitali F, Cavalieri D, et al. Gut microbiota profiles and characterization of cultivable fungal isolates in IBS patients. Appl Microbiol Biotechnol. 2021;105:3277–88.
5. Das A, O’Herlihy E, Shanahan F, O’Toole P, Jeffery I. The fecal mycobiome in patients with Irritable bowel syndrome. Sci Rep. 2021;11:124.
6. Coker OO, Nakatsu G, Dai RZ, Wu WKK, Wong SH, Ng SC, et al. Enteric fungal microbiota dysbiosis and ecological alterations in colorectal cancer. Gut. 2019;68:654–62.
7. Wheeler ML, Limon JJ, Bar AS, Leal CA, Gargus M, Tang J, et al. Immunological consequences of Intestinal Fungal Dysbiosis. Cell Host Microbe. 2016;19:865–73.
8. Zhai B, Ola M, Rolling T, Tosini NL, Joshowitz S, Littmann ER, et al. High-resolution mycobiota analysis reveals dynamic intestinal translocation preceding invasive candidiasis. Nat Med. 2020;26:59–64.
9. Wisplinghoff H, Bischoff T, Tallent SM, Seifert H, Wenzel RP, Edmond MB.
Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clin Infect Dis. 2004;39:309–17.
10. Magill SS, O’Leary E, Janelle SJ, Thompson DL, Dumyati G, Nadle J, et al.
Changes in prevalence of health care-associated infections in U.S. Hospitals. N Engl J Med. 2018;379:1732–44.
11. Seelbinder B, Lohinai Z, Vazquez-Uribe R, Brunke S, Chen X, Mirhakkak M, et al. Candida expansion in the gut of lung cancer patients associates with an ecological signature that supports growth under dysbiotic conditions. Nat Commun. 2023;14:2673.
12. Sam QH, Chang MW, Chai LYA. The fungal mycobiome and its interaction with gut bacteria in the host. Int J Mol Sci. 2017;18:330.
13. Yeh A, Rogers MB, Firek B, Neal MD, Zuckerbraun BS, Morowitz MJ. Dysbiosis across multiple body sites in critically ill adult surgical patients. Shock: injury. Inflam Sepsis Lab Clin Appr. 2016;46:649–54.
14. Munley JA, Kirkpatrick SL, Gillies GS, Bible LE, Efron PA, Nagpal R, et al.
The intestinal microbiome after traumatic injury. Microorganisms. 2023;11:1990.
15. Wei R, Chen X, Hu L, He Z, Ouyang X, Liang S, et al. Dysbiosis of intestinal microbiota in critically ill patients and risk of in-hospital mortality. Am J Transl Res. 2021;13:1548–57.
16. Ojima M, Shimizu K, Motooka D, Ishihara T, Nakamura S, Shintani A, et al.
Gut dysbiosis associated with antibiotics and disease severity and its relation to mortality in critically Ill patients. Dig Dis Sci. 2022;67:2420–32.
17. McDonald D, Ackermann G, Khailova L, Baird C, Heyland D, Kozar R, et al. Extreme dysbiosis of the microbiome in critical illness. Msphere. 2016;1:e00199-e216.
18. Efron PA, Mohr AM, Bihorac A, Horiguchi H, Hollen MK, Segal MS, et al. Persistent inflammation, immunosuppression, and catabolism and the development of chronic critical illness after surgery. Surgery. 2018;164:178–84.
19. Krezalek MA, DeFazio J, Zaborina O, Zaborin A, Alverdy JC. The shift of an intestinal “microbiome” to a “pathobiome” governs the course and outcome of sepsis following surgical injury. Shock. 2016;45:475.
20. Marfil-Sánchez A, Zhang L, Alonso-Pernas P, Mirhakkak M, Mueller M, Seelbinder B, et al. An integrative understanding of the large metabolic shifts induced by antibiotics in critical illness. Gut Microbes. 2021;13:1993598.
21. Efron PA, Brakenridge SC, Mohr AM, Barrios EL, Polcz VE, Anton S, et al. The persistent inflammation, immunosuppression, and catabolism syndrome (PICS) ten years later. J Trauma Acute Care Surg. 2023;95:790.
22. Cuschieri S. The STROBE guidelines. Saudi J Anaesth. 2019;13:S31–4.
23. Mira JC, Brakenridge SC, Moldawer LL, Moore FA. Persistent inflammation, immunosuppression and catabolism syndrome. Crit Care Clin. 2017;33:245–58.
24. Munley JA, Kelly LS, Park G, Gillies GS, Pons EE, Kannan KB, et al. Multicompartmental traumatic injury induces sex-specific alterations in the gut microbiome. J Trauma Acute Care Surg. 2023;95:30–8.
25. Nagpal R, Neth BJ, Wang S, Mishra SP, Craft S, Yadav H. Gut mycobiome and its interaction with diet, gut bacteria and alzheimer’s disease markers in subjects with mild cognitive impairment: A pilot study. eBioMedicine [Internet]. 2020 [cited 2023 Aug 8];59. Available from: https://www.thela ncet.com/journals/ebiom/article/PIIS2352-3964(20)30326-1/fulltext
26. Caporaso JG, Lauber CL, Walters WA, Berg-Lyons D, Huntley J, Fierer N, et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms. ISME J. 2012;6:1621–4.
27. Bolyen E, Rideout JR, Dillon MR, Bokulich NA, Abnet CC, Al-Ghalith GA, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2. Nat Biotechnol. 2019;37:852–7.
28. Callahan BJ, McMurdie PJ, Rosen MJ, Han AW, Johnson AJA, Holmes SP.
DADA2: high-resolution sample inference from Illumina amplicon data. Nat Methods. 2016;13:581.
29. Katoh K, Misawa K, Kuma K, Miyata T. MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform. Nucl Acids Res. 2002;30:3059–66.
30. Fernandes AD, Reid JN, Macklaim JM, McMurrough TA, Edgell DR, Gloor GB. Unifying the analysis of high-throughput sequencing datasets: characterizing RNA-seq, 16S rRNA gene sequencing and selective growth experiments by compositional data analysis. Microbiome. 2014;2:1–13.
31. Shannon P, Markiel A, Ozier O, Baliga NS, Wang JT, Ramage D, et al.
Cytoscape: a software environment for integrated models of biomolecular interaction networks. Genome Res. 2003;13:2498–504.
32. Baggs J, Jernigan JA, Halpin AL, Epstein L, Hatfield KM, McDonald LC.
Risk of subsequent sepsis within 90 days after a hospital stay by type of antibiotic exposure. Clin Infect Dis. 2018;66:1004–12.
33. Howard BM, Kornblith LZ, Christie SA, Conroy AS, Nelson MF, Campion EM, et al. Characterizing the gut microbiome in trauma: significant changes in microbial diversity occur early after severe injury. Trauma Surg Acute Care Open. 2017;2:e000108.
34. Earley ZM, Akhtar S, Green SJ, Naqib A, Khan O, Cannon AR, et al. Burn injury alters the intestinal microbiome and increases gut permeability and bacterial translocation. PLoS ONE. 2015;10:e0129996.
35. Munley JA, Kelly LS, Park G, Gillies GS, Pons EE, Kannan KB, et al. Sexspecific intestinal dysbiosis persists after multicompartmental injury. Surgery. 2023;S0039–6060(23)00524-X.
36. Efron PA, Darden DB, Li EC, Munley J, Kelly L, Fenner B, et al. Sex differences associate with late microbiome alterations after murine surgical sepsis. J Trauma Acute Care Surg. 2022;93:137.
37. Sakr Y, Elia C, Mascia L, Barberis B, Cardellino S, Livigni S, et al. The influence of gender on the epidemiology of and outcome from severe sepsis. Crit Care. 2013;17:R50.
38. Mayr FB, Yende S, Angus DC. Epidemiology of severe sepsis. Virulence.
Front Microbiol. 2022. https://doi.org/10.3389/fmicb.2022. 892859.
39. Guinan J, Wang S, Hazbun TR, Yadav H, Thangamani S. Antibiotic-induced decreases in the levels of microbial-derived short-chain fatty acids correlate with increased gastrointestinal colonization of Candida albicans. Sci Rep. 2019;9:8872.
40. Fan D, Coughlin LA, Neubauer MM, Kim J, Kim MS, Zhan X, et al. Activation of HIF-1α and LL-37 by commensal bacteria inhibits Candida albicans colonization. Nat Med. 2015;21:808–14.
41. Trofa D, Gácser A, Nosanchuk JD. Candida parapsilosis, an emerging fungal pathogen. Clin Microbiol Rev. 2008;21:606–25.
42. Sullivan D, Coleman D. Candida dubliniensis: characteristics and identification. J Clin Microbiol. 1998;36:329–34.
43. Ann Chai LY, Denning DW, Warn P. Candida tropicalis in human disease. Crit Rev Microbiol. 2010;36:282–98.
44. Aliaga S, Clark RH, Laughon M, Walsh TJ, Hope WW, Benjamin DK, et al. Changes in the incidence of candidiasis in neonatal intensive care units. Pediatrics. 2014;133:236–42.
45. Jensen J-US, Hein L, Lundgren B, Bestle MH, Mohr T, Andersen MH, et al. Invasive candida infections and the harm from antibacterial drugs in critically Ill patients: data from a randomized, controlled trial to determine the role of ciprofloxacin, piperacillin-tazobactam, meropenem, and cefuroxime*. Critic Care Med. 2015;43:594.
46. Xu X-L, Lee RTH, Fang H-M, Wang Y-M, Li R, Zou H, et al. Bacterial peptidoglycan triggers Candida albicans hyphal growth by directly activating the adenylyl cyclase Cyr1p. Cell Host Microbe. 2008;4:28–39.
47. Tan CT, Xu X, Qiao Y, Wang Y. A peptidoglycan storm caused by β-lactam antibiotic’s action on host microbiota drives Candida albicans infection. Nat Commun. 2021;12:2560.
48. Kumar A, Asthana M, Gupta A, Nigam D, Mahajan S. Chapter 3 - secondary metabolism and antimicrobial metabolites of penicillium. In: Gupta VK, Rodriguez-Couto S, editors. New and future developments in microbial biotechnology and bioengineering. Amsterdam: Elsevier; 2018. p. 47–68.
49. Suhr MJ, Hallen-Adams HE. The human gut mycobiome: pitfalls and potentials—a mycologist’s perspective. Mycologia. 2015;107:1057–73.
50. Shuai M, Fu Y, Zhong H, Gou W, Jiang Z, Liang Y, et al. Mapping the human gut mycobiome in middle-aged and elderly adults: multiomics insights and implications for host metabolic health. Gut. 2022;71:1812–20.
51. Suhr MJ, Banjara N, Hallen-Adams HE. Sequence-based methods for detecting and evaluating the human gut mycobiome. Lett Appl Microbiol. 2016;62:209–15.
52. Wu N, Mo H, Mu Q, Liu P, Liu G, Yu W. The gut mycobiome characterization of gestational diabetes mellitus and its association with dietary intervention. Front Microbiol. 2022. https://doi.org/10.3389/fmicb.2022. 892859.
53. Nash AK, Auchtung TA, Wong MC, Smith DP, Gesell JR, Ross MC, et al.
The gut mycobiome of the human microbiome project healthy cohort. Microbiome. 2017;5:153.
54. Enaud R, Vandenborght L-E, Coron N, Bazin T, Prevel R, Schaeverbeke T, et al. The mycobiome: a neglected component in the microbiota-gutbrain axis. Microorganisms. 2018;6:22.
55. Jiang TT, Shao T-Y, Ang WXG, Kinder JM, Turner LH, Pham G, et al. Commensal fungi recapitulate the protective benefits of intestinal bacteria. Cell Host Microb. 2017;22:809-816.e4.
56. Duysburgh C, Van den Abbeele P, Morera M, Marzorati M. Lacticaseibacillus rhamnosus GG and saccharomyces cerevisiae boulardii supplementation exert protective effects on human gut microbiome following antibiotic administration in vitro. Benef Microb. 2021;12:365–79.
57. Roy Sarkar S, Mitra Mazumder P, Chatterjee K, Sarkar A, Adhikary M, Mukhopadhyay K, et al. Saccharomyces boulardii ameliorates gut dysbiosis associated cognitive decline. Physiol Behav. 2021;236:113411.
58. Samonis G, Falagas M, Lionakis S, Ntaoukakis M, Kofteridis D, Ntalas I, et al.
Saccharomyces boulardii and Candida albicans experimental colonization of the murine gut. Med Mycol. 2011;49:395–9.
59. Berg R, Bernasconi P, Fowler D, Gautreaux M. Inhibition of Candida albicans translocation from the gastrointestinal tract of mice by oral administration of saccharomyces boulardii. J Infect Dis. 1993;168:1314–8.
60. Jawhara S, Poulain D. Saccharomyces boulardii decreases inflammation and intestinal colonization by Candida albicans in a mouse model of chemically-induced colitis. Med Mycol. 2007;45:691–700. 2014;5:4–11.
61. Møller N. Ketone body, 3-hydroxybutyrate: minor metabolite - major medical manifestations. J Clin Endocrinol Metab. 2020;105:2884–92.
62. Mickiewicz B, Tam P, Jenne CN, Leger C, Wong J, Winston BW, et al. Integration of metabolic and inflammatory mediator profiles as a potential prognostic approach for septic shock in the intensive care unit. Crit Care. 2015;19:11.
63. Pandey S, Siddiqui MA, Azim A, Sinha N. Metabolic fingerprint of patients showing responsiveness to treatment of septic shock in intensive care unit. Magn Reson Mater Phy. 2023;36:659–69.
64. Hypoglycemia and Risk of Death in Critically Ill Patients. New England Journal of Medicine. 2012;367:1108–18.
65. Galley HF. Oxidative stress and mitochondrial dysfunction in sepsis. BJA Br J Anaesth. 2011;107:57–64.
66. Ashfaq M, Moats AR, Northrup H, Singletary CN, Hashmi SS, Koenig MK, et al. Hypoglycemia in mitochondrial disorders. Mitochondrion. 2021;58:179–83.
67. Piziak VK, Carpentier W. Candida sepsis manifested by recurrent diabetic ketoacidosis. Diabetes Care. 1987;10:784–5.
68. Gregory R, McElveen J, Tattersall RB, Todd I. The effects of 3-hydroxybutyrate and glucose on human T cell responses to Candida albicans. FEMS Immunol Med Microbiol. 1993;7:315–20.
69. Pinto TF, Rocha R, Paula CA, de Jesus RP. Tolerance to enteral nutrition therapy in traumatic brain injury patients. Brain Inj. 2012;26:1113–7.
70. Blaser AR, Starkopf J, Kirsimägi Ü, Deane AM. Definition, prevalence, and outcome of feeding intolerance in intensive care: a systematic review and meta-analysis: How to define feeding intolerance? Acta Anaesthesiol Scand. 2014;58:914–22.
71. Ene IV, Cheng S-C, Netea MG, Brown AJP. Growth of Candida albicans cells on the physiologically relevant carbon source lactate affects their recognition and phagocytosis by immune cells. Infect Immun. 2013;81:238–48.
72. Oami T, Chihade DB, Coopersmith CM. The microbiome and nutrition in critical illness. Curr Opin Crit Care. 2019;25:145.
73. Serbanescu MA, Mathena RP, Xu J, Santiago-Rodriguez T, Hartsell TL, Cano RJ, et al. General anesthesia alters the diversity and composition of the intestinal microbiota in mice. Anesth Analg. 2019;129:e126.
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 14.02.2024
[ACTIVE_FROM] => 14.02.2024
[SHOW_COUNTER] => 410
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2017-07-31 16:04:44
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829326
[VALUE] => терапия критических состояний, критическое заболевание, дисбиоз, грибы, метаболом, микробиота, микобиом, патобиом, сепсис, травма
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => терапия критических состояний, критическое заболевание, дисбиоз, грибы, метаболом, микробиота, микобиом, патобиом, сепсис, травма
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2017-08-02 11:16:15
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829328
[VALUE] => Дисбиоз микобиома кишечника после сепсиса и травмы
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Дисбиоз микобиома кишечника после сепсиса и травмы
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2017-08-02 11:18:27
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829327
[VALUE] => Дисбиоз микобиома кишечника после сепсиса и травмы
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Дисбиоз микобиома кишечника после сепсиса и травмы
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829425
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2017-09-15 12:05:50
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2017-09-19 10:40:01
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2017-08-22 15:43:39
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829332
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2017-08-22 16:30:23
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2017-08-23 10:51:22
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2017-08-23 11:05:12
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829330
[1] => 829331
[2] => 829334
)
[VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => Disbioz
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => Disbioz
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2017-10-12 14:43:36
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2018-05-11 11:01:14
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829425
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829332
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829330
[1] => 829331
[2] => 829334
)
[VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => Disbioz
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => Disbioz
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Сепсис
[2] => Дисбиоз
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 26.08.2022 14:38:28
[~TIMESTAMP_X] => 26.08.2022 14:38:28
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Дисбиоз микобиома кишечника после сепсиса и травмы
[BROWSER_TITLE] => Дисбиоз микобиома кишечника после сепсиса и травмы
[KEYWORDS] => терапия критических состояний, критическое заболевание, дисбиоз, грибы, метаболом, микробиота, микобиом, патобиом, сепсис, травма
[DESCRIPTION] => Дисбиоз микобиома кишечника после сепсиса и травмы
)
)




