Array
(
[NAME] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
[~NAME] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
[PREVIEW_PICTURE] => Array
(
[ID] => 5498
[TIMESTAMP_X] => 12.02.2024 17:46:36
[MODULE_ID] => iblock
[HEIGHT] => 633
[WIDTH] => 950
[FILE_SIZE] => 51631
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/248/qu6wbx46edqlbdr7h9kkehn00gb0cto8
[FILE_NAME] => donnez-votre-plasma-le-traitement-est-en-vous20231020185446_950X633.jpeg
[ORIGINAL_NAME] => donnez-votre-plasma-le-traitement-est-en-vous20231020185446_950X633.jpeg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 55f8ccc35e1abc0c5642d5ce3131de8a
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/248/qu6wbx46edqlbdr7h9kkehn00gb0cto8/donnez-votre-plasma-le-traitement-est-en-vous20231020185446_950X633.jpeg
[UNSAFE_SRC] => /upload/iblock/248/qu6wbx46edqlbdr7h9kkehn00gb0cto8/donnez-votre-plasma-le-traitement-est-en-vous20231020185446_950X633.jpeg
[SAFE_SRC] => /upload/iblock/248/qu6wbx46edqlbdr7h9kkehn00gb0cto8/donnez-votre-plasma-le-traitement-est-en-vous20231020185446_950X633.jpeg
[ALT] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
[TITLE] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
)
[~PREVIEW_PICTURE] => 5498
[DETAIL_TEXT] => Kuklin et al. Critical Care (2024) 28:12
https://doi.org/10.1186/s13054-023-04795-x
Перевод оригинальной статьи «Influence of therapeutic plasma exchange treatment on short-term mortality of critically ill adult patients with sepsis-induced organ dysfunction: a systematic review and meta-analysis»
Авторы: Vladimir Kuklin1, Michael Sovershaev2, Johan Bjerner2, Philip Keith3, L. Keith Scott4, Owen Matthew Truscott Thomas5, Wladimir Szpirt6, Gail Rock7, Bernd Stegmayr8
1 Department of Anaesthesiology and Intensive Care Medicine, Ahus University Hospital, Sykehusveien, 25, 1478 Lorenskog, Norway.
2 Fürst Medical Laboratory, Oslo, Norway.
3 Critical Care Medicine, Lexington Medical Center, West Columbia, SC, USA.
4 Division of Trauma and Surgical Critical Care, Louisiana State University Health Sciences Center, Shreveport, USA.
5 Department of Health Services Research, Ahus University Hospital, Lorenskog, Norway.
6 Department of Nephrology, Rigshospitalet, University of Copenhagen, Copenhagen, Denmark.
7 University of Ottawa, Ottawa, ON, Canada.
8 Department of Public Health and Clinical Medicine, Umea University, Umea, Sweden.
Ключевые слова: сепсис, сепсис-индуцированная органная дисфункция, терапевтический плазмаобмен, COVID-19, краткосрочная летальность.
Введение
Согласно Третьему международному консенсусу, сепсис определяется как «угрожающая жизни органная дисфункция, вызванная дисрегуляцией иммунного ответа (ответа хозяина или hostresponse) на инфекцию» [1] и представляет собой сложное, взаимосвязанное взаимодействие воспаления, эндотелиальной дисфункции, капиллярной утечки и широкого спектра патологий коагуляции [2]. Было изучено множество различных видов лечения [3], целью которых стали специфические компоненты патологического иммунного ответа, но, за исключением раннего введения антибиотиков [4], результаты были непоследовательными и даже разочаровывающими. Гипотеза о том, что терапевтический плазмаобмен (therapeutic plasmaexchange [ТРЕ]) может служить возможным методом лечения [5] за счет своего одномоментного влияния на множество аспектов патогенеза, насчитывает десятки лет. И на протяжении этих лет большое количество сообщений о случае или серии случаев [6-34] предоставляли обнадеживающие результаты, показывая снижение краткосрочной летальности и улучшение клинических исходов у пациентов с сепсис-индуцированной органной дисфункцией, которым адъювантная терапия проводилась с помощью ТРЕ. При этом проспективные и рандомизированные данные редки и противоречивы [35, 36]. Прежние попытки прояснить ситуацию привели к пяти мета-анализам [37-41], авторы которых пришли к выводу, что фактических данных недостаточно для того, чтобы рекомендовать ТРЕ в качестве рутинной терапии пациентов с сепсис-индуцированной органной дисфункцией. На сегодня клиническое руководство Американской ассоциации афереза (the American Society for Apheresis [ASFA]) содержит в себе рекомендацию категории III, 2А по применению ТРЕ у пациентов с сепсис-индуцированной органной дисфункцией, что позволяет индивидуальное использование ТРЕ в каждом конкретном случае.
Цель нашего исследования – предоставить исчерпывающий обзор с анализом доступной литературы в целях повторного изучения клинического влияния ТРЕ в качестве адъювантной терапии на краткосрочную летальность критически больных взрослых пациентов с полиорганной недостаточностью.
Материалы и методы
Источники данных и стратегия поиска
Этот систематический обзор и мета-анализ выполнен двумя исследователями согласно руководящим принципам PRISMA (Preferred Reporting Items Systematic Reviews and Meta-Analysis) [43] и заранее опубликованному протоколу (PROSPERO database, CRD 42022377753). Поиск рандомизированных, обсервационных и ретроспективных исследований, что изучали ТРЕ при лечении септических пациентов, проводился в базах данных Medline, Ovid (Embase),Cochrane library и clinicaltrial.gov с помощью следующих поисковых терминов: плазмаобмен, плазмаферез, сепсис, септический шок. В дополнение к этому мы в ручном режиме проводили поиск в списках литературы полученных статей с целью выявления других клинических исследований, отвечающих нашим критериям. В поиск вошли исследования, опубликованные в период с 01.01.1966 по 01.11.2022, с ограничениями по языку публикации (только английский). Поначалу мы планировали включить в наше исследование только ТРЕ на основе технологии центрифугирования, но позже мы внесли изменения в протокол по причине значительного количества исследований, в которых ТРЕ проводился на основе технологии фильтрации, что, возможно, могло оказать влияние на результаты.
Оцениваемым первичным исходом стала краткосрочная летальность (14–35 дней) в зависимости от конечных точек каждого конкретного исследования. Вторичные исходы включили клинические параметры (гемодинамика, режим дозирования норадреналина), лабораторные параметры и оценки по шкалам тяжести заболевания (SOFA, APACHE II, APACHE III). Post hoc анализ подгрупп проводился на основании типа процедуры ТРЕ (мембрана, центрифуга) или типа инфекции (не-COVID-19 против COVID-19).
Выбор исследований
Для выбора исследований с последующим включением в мета-анализ использовались критерии включения PICO (Patient/Population [пациент/популяция], Intervention [вмешательство],Comparison [сравнение], Outcome [результат]). 1. Популяция: критически больные взрослые пациенты с сепсис-индуцированной полиорганной дисфункцией. 2. Вмешательство: терапевтический плазмаобмен. 3. Сравнение вмешательства: стандартная терапия. 4. Результат/исход: клинические маркеры, лабораторные маркеры и краткосрочная летальность. 5. Дизайн исследования: рандомизированное и контролируемое исследование (РКИ), обсервационное и ретроспективное исследование (MCS).
Все списки литературы были подвергнуты независимому скринингу на уровне рефератов (абстрактов) двумя независимыми исследователями (VK, MS), после чего, при условии соответствия критериям включения, запрашивались полноразмерные статьи и, после их получения, эти статьи включались в обзор.
Извлечение данных и менеджмент
Первый автор извлекал соответствующую информацию (авторы, название статьи и журнала, год публикации, демографические данные пациентов, оценки по шкалам тяжести, ТРЕ, краткосрочная летальность, гемодинамический статус/режим дозирования норадреналина до и после ТРЕ, данные лабораторных исследований) из выбранных статей. Эти данные проверялись независимо вторым автором. Разногласия между двумя исследователями разрешались путем консенсуса в ходе обсуждения с третьим автором.
Оценка качества
Для оценки риска предвзятости/систематической ошибки (bias) использовался The CochraneCollaboration инструмент (ROB2) в отношении рандомизированных контролируемых исследований (РКИ) [44] и инструмент ROBINS-I для оценки риска предвзятости в других исследованиях [45].
Инструмент Cochrane оценивает генерацию последовательности распределения, сокрытие последовательности распределения, ослепление (участников/персонала и лиц, оценивающих результаты), неполные данные о результатах, выборочную отчетность о результатах и другие предвзятости [44]. Все включенные РКИ были оценены двумя независимыми рецензентами на предмет потенциального риска предвзятости с применением оценки “Низкий”, “Высокий” или “Неясный”.
Инструмент ROBINS-I оценивает предвзятость по причине путаницы (количество вмешивающихся факторов), предвзятость при отборе участников исследования, предвзятость при классификации вмешательств, предвзятость из-за отклонений от запланированных вмешательств, предвзятость из-за отсутствия данных, предвзятость при измерении результатов и предвзятость при выборе сообщаемого результата. Категории риска предвзятых суждений с помощью инструмента ROBINS-I были оценены двумя независимыми рецензентами и получили оценку “Низкий риск”, или “Умеренный риск”, или “Серьезный риск”, или “Критический риск”, или “Нет информации”.
Два автора (VK, MS) независимо проанализировали наличие возможного конфликта интересов авторов и источник финансирования для каждого исследования, затем оценили каждое исследование как “Низкий”, “Высокий” или “Неясный” риск в отношении этих конкретных моментов.
Статистический анализ
Мета-анализ был проведен с использованием статистической программы R [46], с использованием пакетов “meta” [47] и “robvis” [48]. В мета-анализ были включены только MCSs, в которых проводилось сравнение пациентов, получавших адъювантный TPE, с контрольной группой. Кроме того, были проведены множественные post hoc анализы для подгрупп пациентов, получавших лечение TPE методами центрифугирования и мембранной фильтрации, а также подгрупп пациентов, получавшими лечение TPE, с COVID-19 по сравнению с пациентами без COVID-19. Отдельные исследования и сводные результаты были представлены в виде относительного риска (RR) с 95% доверительными интервалами (CI) зарегистрированной летальности у пациентов, получавших TPE, по сравнению с контрольной группой. Для всех анализов была представлена модель случайных эффектов. RR менее 1 указывает на более низкий уровень смертности среди пациентов. Статистическая неоднородность среди РКИ и MCSs, включенных в мета-анализ, была количественно оценена с помощью Cochran Q теста и показателя Higgins I2, соответственно. Р <0,05 считался статистически значимым. Для оценки риска предвзятости публикации были использованы воронкообразный график и линейный регрессионный Peters-тест асимметрии.
Результаты
Выбор исследований
Мы идентифицировали 1 305 публикаций при электронном и ручном поиске (Рис. 1). После удаления дубликатов и обзора заглавий и абстрактов было исключено 1 254 исследований с оставлением 51 записи для анализа. Из них 27 записей были исключены из-за несоответствия критериям включения. Из оставшихся 24 записей три были исключены, так были представлены только лишь в виде абстрактов, и всего осталось 20 исследований, которые и были включены в окончательный анализ (5 РКИ и 15 MCSs) (Рис. 1).
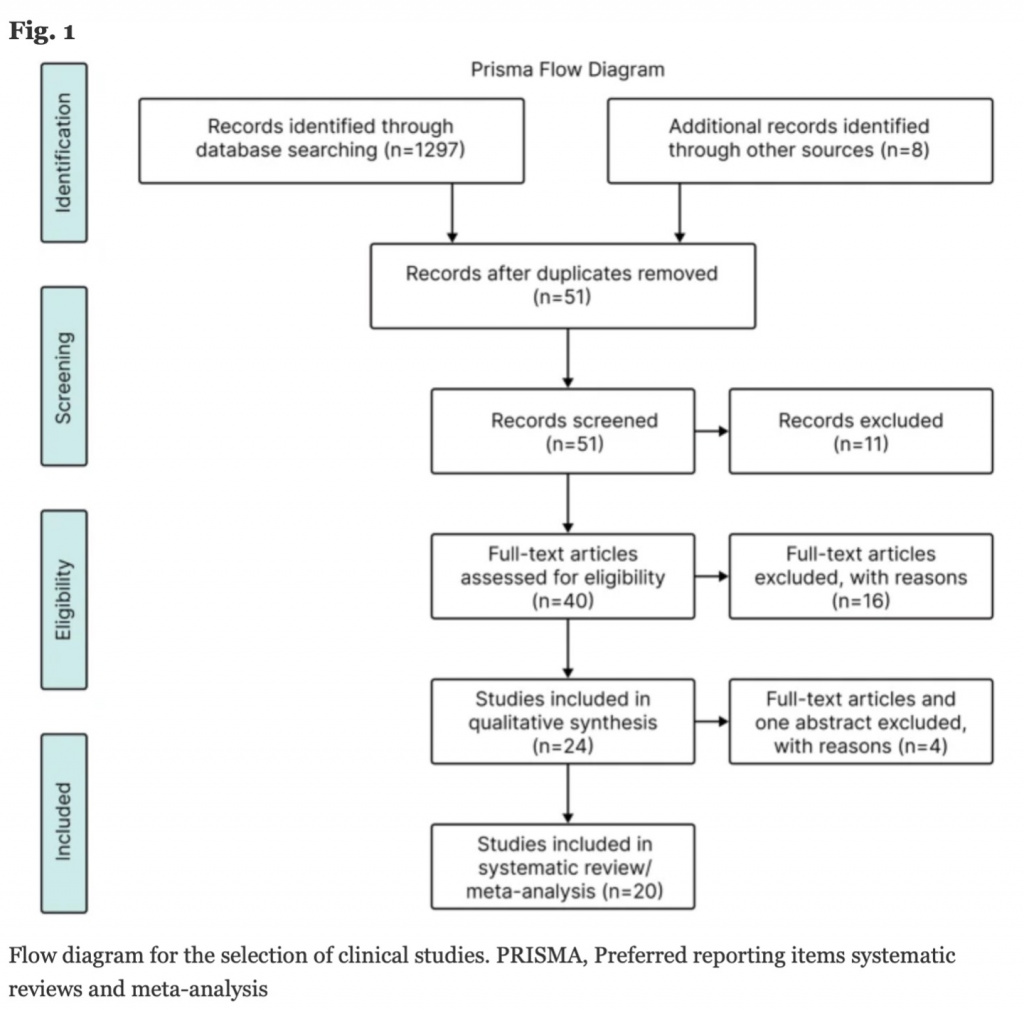
Систематический обзор включил все пять рандомизированных, контролируемых исследования (РКИ) [35, 36, 49–51] и 15 исследований сопоставимых когорт (matched cohort studies [MCSs]) [17, 32, 52–64] с анализом 937 критически больных взрослых пациентов с сепсисом и полиорганной дисфункцией. Среди них 543 пациента получили терапевтический плазмаобмен как адъювантную терапию к стандартному лечению сепсиса, в то время как 394 пациента получили только лишь стандартное лечение.
Мета-анализ включил только те исследования, что сравнивали пациентов, получивших адъювантную терапию ТРЕ, с контролем, и здесь было пять РКИ [35, 36, 49–51] и шесть MCSs[17, 55, 59, 61–63] со включением 627 взрослых пациентов с сепсисом и полиорганной дисфункцией. Среди этих пациентов 300 получили адъювантный ТРЕ в дополнение к стандартному лечению сепсиса, а 327 пациентов получили только лишь стандартную терапию.
Оценка риска предвзятости публикации
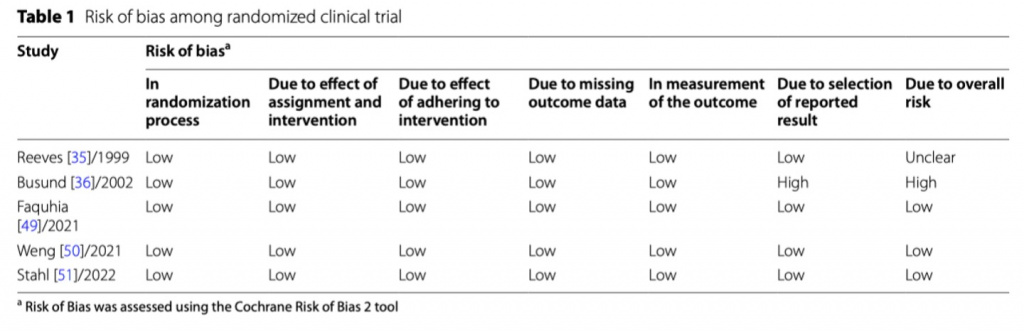
Четыре из пяти РКИ были оценены как исследования хорошего качества с низким риском предвзятости, в то время как пятое РКИ имело высокий риск предвзятости в связи с выбором сообщенных результатов (Таблица 1, Дополнительный файл 1: Fig. S1A, B). Четыре из шести MCS исследований были оценены как хорошего качества с низким риском предвзятости. Одно MCS исследование имело серьезный риск предвзятости в связи с большим количеством вмешивающихся факторов и средний риск предвзятости в связи с выбором участников. Шестое MCS исследование имело средний риск предвзятости в связи с большим количеством вмешивающихся факторов (Дополнительный файл 1: Fig. S2A, B). По причине особенностей процедуры терапевтического плазмаобмена и тяжести состояния пациентов с сепсисом ослепление этой процедуры/пациентов от медицинского персонала представляется трудноразрешимой и не логичной задачей и поэтому мы решили не оценивать этот фактор как критический при анализе РКИ и MCS.
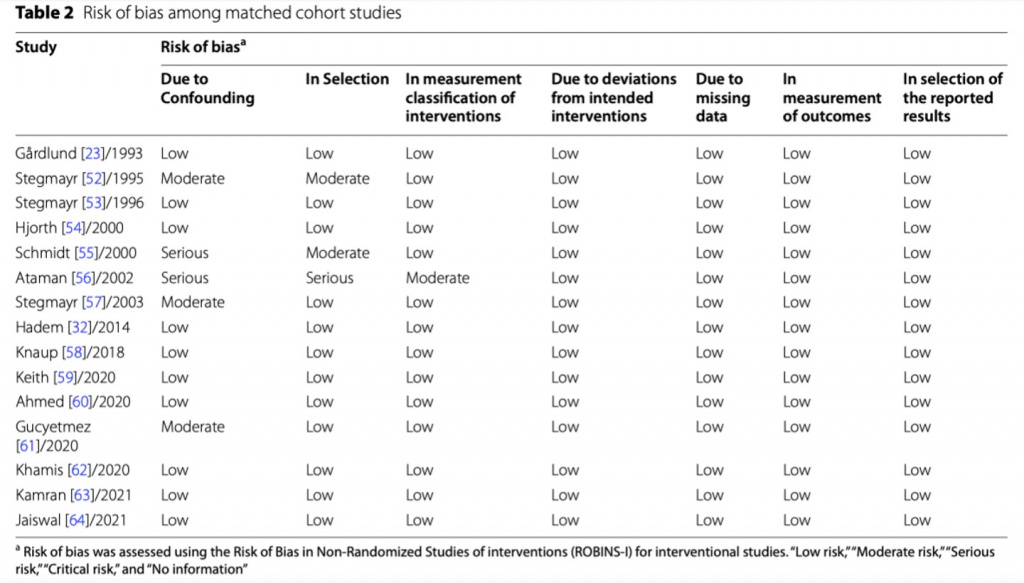
Далее мы изучили риски предвзятости публикации с помощью воронкообразного графика (Дополнительный файл 1: Fig. S3) и заметили, что более крупные исследования равномерно распределялись вокруг оценки модели случайных эффектов, в то время как более мелкие исследования, по-видимому, были смещены в сторону больших размеров эффекта. Тест регрессии Peters для асимметрии воронкообразного графика [65] не вернул значимого результата (t = − 0.69, p = 0.507), что указывало на низкий риск предвзятости публикации (Таб. 2).
Характеристики и основной исход клинических исследований
Средний размер исследования составил 43 пациента с диапазоном от 7 до 106 участников. За исключением одного РКИ [36] (различия в среднем возрасте), не было существенных различий в исходных характеристиках между контрольной группой и пациентами, которым проводились процедуры ТРЕ. Критерии включения, технология проведения ТРЕ, выбор и объем замещающей жидкости, количество процедур ТРЕ различались между исследованиями (Таб. 3).
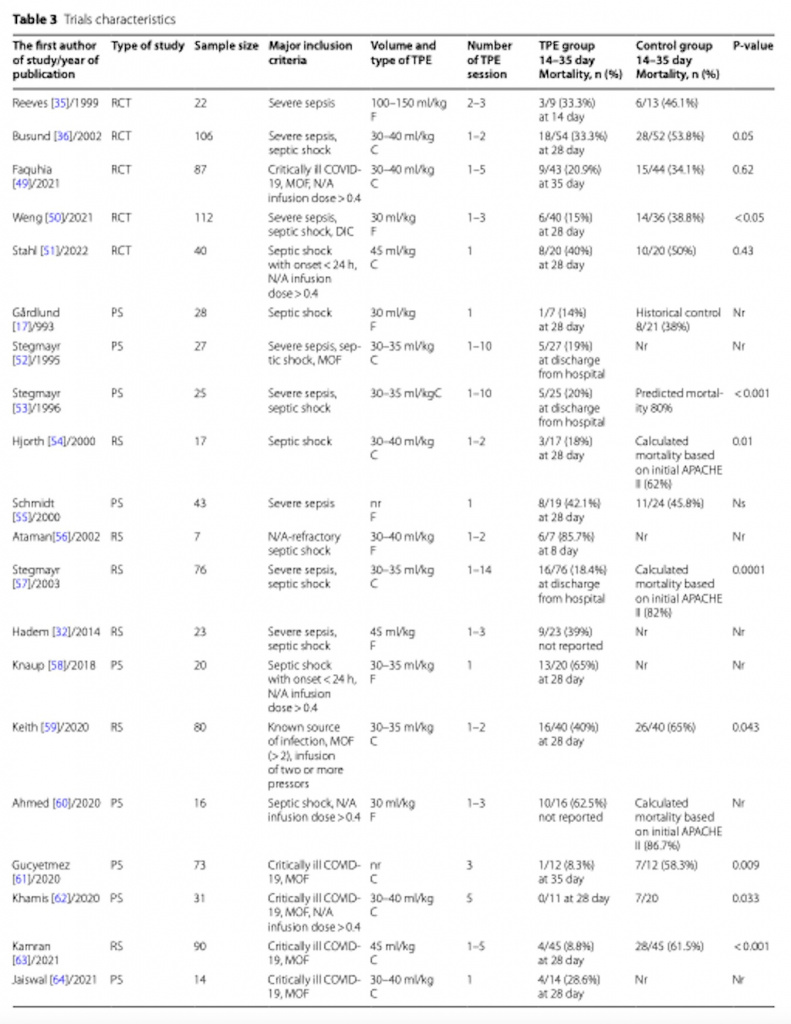
Пять РКИ включили в себя 331 пациента с сепсисом [35, 36, 49–51], 166 из них получили адъювантный ТРЕ (Таб. 3). В этих исследованиях пациенты, получившие адъювантный ТРЕ, имели более низкую летальность (RR: 0.62 [95% CI: 0.46, 0.83]) по сравнению с пациентами, получившими только лишь стандартную терапию (Рис. 2). В трех РКИ [36, 49, 51] ТРЕ выполнялся с помощью центрифуги, а объем удаленной плазмы и возмещения находился в диапазоне 30–45 мл/кг (Таб. 3). Мембранная фильтрация использовалась в двух РКИ [35, 50] с удалением 30–150 мл/кг плазмы (Таб. 3).
Пятьсот семьдесят пациентов было включено в 15 MCS исследований [17, 28, 52–64], из них 377 пациентов получили адъювантный ТРЕ (Таб. 3). По сравнению с пациентами, получившими только стандартную терапию, пациенты, получившие адъювантный ТРЕ, имели несущественное снижение риска краткосрочной летальности в подгруппе проспективных исследований (RR: 0.83 [95% CI: 0.44, 1.58]), в то время как существенное снижение риска краткосрочной летальности наблюдалось в подгруппе ретроспективных исследований (RR: 0.33 [95% CI: 0.14, 0.76], Рис. 2). ТРЕ с центрифугой использовался в девяти исследованиях [52–54, 57, 59, 61–64] с удалением и замещением 30–45 мл/кг плазмы. В оставшихся шести MCS исследованиях [17, 28, 55, 56, 58, 60] использовалась технология фильтрации с удалением, в среднем, 30–45 мл/кг плазмы (Таб. 3).
Мета-анализ общей краткосрочной летальности и анализ подгрупп
Мы объединили данные о краткосрочной летальности из пяти РКИ и шести MCSs (n = 627), проводя сравнения между пациентами, получившими только стандартную терапию (n = 327), с пациентами, лечение которых проводилось с адъювантным ТРЕ (n = 300). Модель случайных эффектов показала значительное снижение отношения рисков смерти (RR 0.59, [95% CI 0.47, 0.74]) с небольшой гетерогенностью (I 2 = 3%, τ 2 <0.0001; Рис. 2).
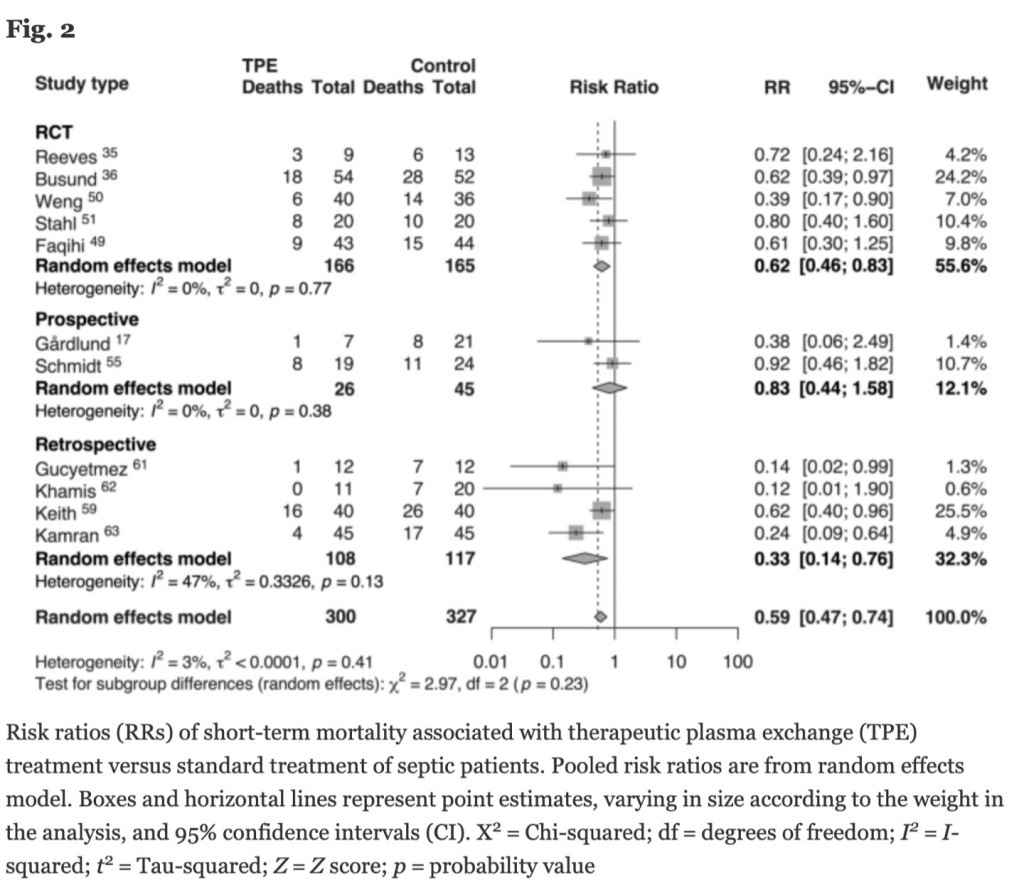
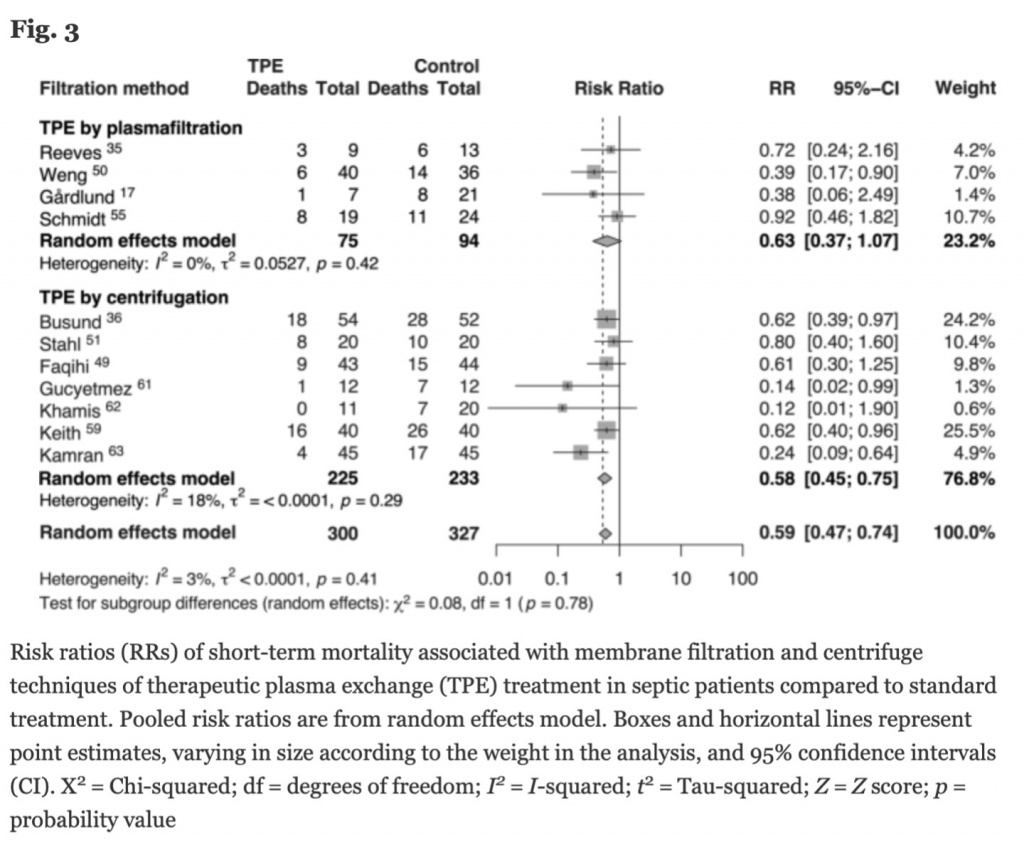
Мы выполнили анализ подгрупп, в которых использовался ТРЕ. При анализе случайных эффектов технология фильтрации показала несущественное снижение летальности (RR =2 0.63, [95% CI 0.37, 1.07]) с очень низкой гетерогенностью (I2 = 0%, τ 2 = 0.0527). И наоборот, в моделях случайных эффектов технология центрифугирования показала снижение риска краткосрочной летальности с большим размером эффекта и значимостью (RR = 0.58, [95% CI 0.45, 0.75]), но с чуть большей гетерогенностью (I 2 = 18%, τ 2 <0.0001) (Рис. 3).
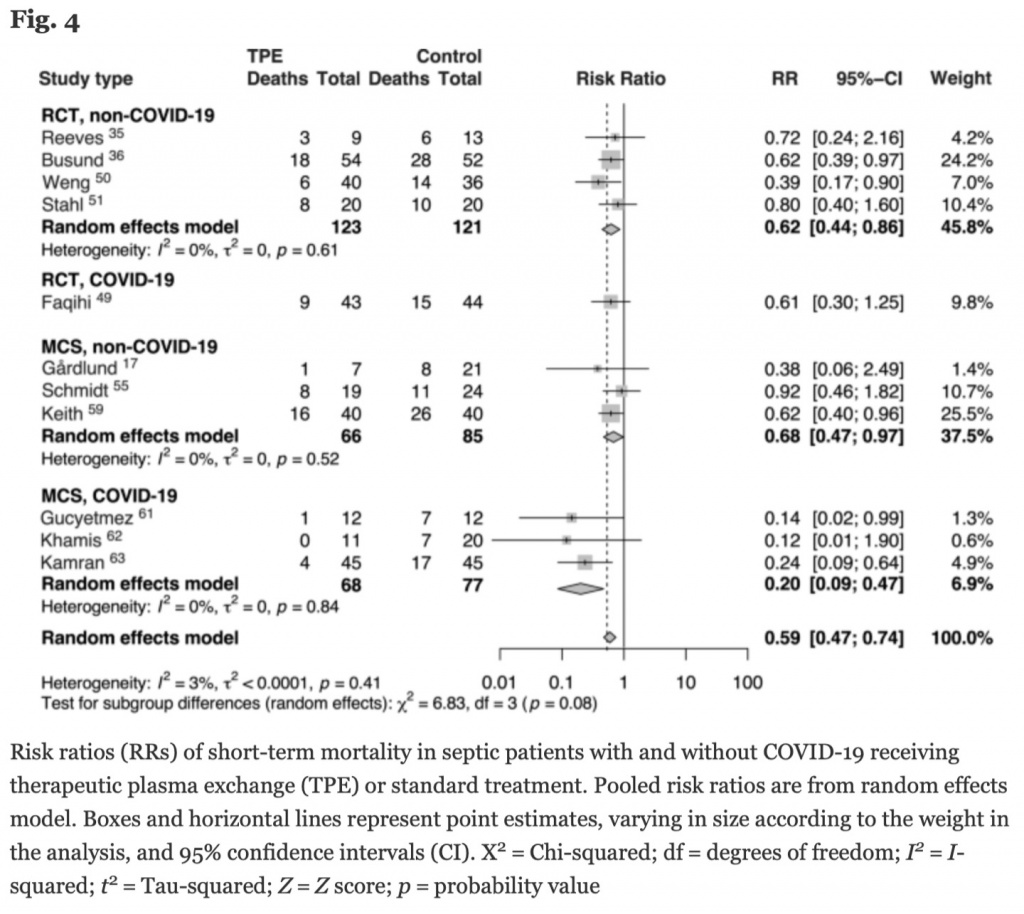
Мы также выполнили анализ подгрупп, в котором сравнили пациентов с сепсисом, причиной которого был COVID-19, с пациентами, у которых этиология сепсиса была отличной от COVID-19 (Рис. 4). Пациенты, у которых причиной сепсиса были патогены, отличные от COVID-19 (не- COVID-19 сепсис), показали снижение риска краткосрочной летальности как в рандомизированных контролируемых исследованиях (RR = 0.62, [95% CI 0.44, 0.86]), так и в обсервационных MCS исследованиях (RR = 0.68, [95% CI 0.47, 0.97]). При этом модель случайных эффектов показала низкую гетерогенность (I 2 = 0%, τ 2 = 0). С другой стороны, пациенты с сепсисом, причиной которого стал COVID-19, показали снижение риска краткосрочной летальности в MCS исследованиях (RR = 0.20, [95% CI 0.09, 0.47]) и тоже с низкой гетерогенностью (I 2 = 0%, τ 2 = 0) (Рис. 4).
Вторичные клинические и лабораторные исходы
Во многих исследованиях сообщается о потенциально важных клинических и лабораторных конечных точках. Три РКИ [49-51] сообщили о значительном снижении дозы норадреналина, требовавшейся для поддержания целевого артериального давления (АД) после ТРЕ. Два MCS [58, 60] показали, что ТРЕ существенно улучшал среднее артериальное давление и ударный объем с одновременным снижением доз норадреналина. В одном MCS [56] не было найдено изменений в гемодинамическом статусе после ТРЕ. Значительное снижение оценок по шкалам APACHE II [50], APACHE III [36] и SOFA[49, 50] после ТРЕ наблюдалось в четырех РКИ [35, 36, 49, 50], а в одном MCS исследовании [59] показано существенно снижение оценок по шкале SOFA после ТРЕ. Одно MCS исследование [55] не показало каких-либо изменений в оценках по шкале APACHE II после ТРЕ.
Три РКИ [49–51] показали, что после ТРЕ наблюдается существенное снижение концентрации в плазме воспалительных цитокинов, иммунных антител, сывороточного лактата, лактатдегидрогеназы (ЛДГ), ферритина, D-димера и таких медиаторов, как прокальцитонин (ПКТ), антиген фактора Виллебранда (vWF:Ag), ангиопоэтин 2 (Angpt-2), растворимый рецептор тирозинкиназы sTie-2. В этих исследованиях ТРЕ также приводил к значительному увеличению количества лимфоцитов и тромбоцитов, к насыщению защитными факторами, такими как антитромбин III (AT III), протеин С, дизинтегрин и металлопротеиназа с тромбоспондиновым мотивом I типа 13 (ADAMTS-13) [49–51].
Два MCS исследования [56, 58] показали, что после TPE наблюдается существенное снижение концентраций в плазме воспалительных цитокинов (интерлейкинов) IL-1[58], IL-6 [58, 61], IL-8 [58], IL-10 [58]), C-реактивного белка [61], прокальцитонина [61], D-димера [61], ферритина [61] и ЛДГ [61].
Обсуждение
Наш мета-анализ показал значительное снижение краткосрочной летальности у критически больных пациентов с сепсис-индуцированной органной дисфункцией тогда, когда в качестве адъювантной терапии (дополнение к стандартной терапии) применяется терапевтический плазмаобмен. Эти результаты в сочетании с результатами трех недавно опубликованных мета-анализов [66–68] дополняют доказательную базу, что отразилась в рекомендации клинического руководства ASFA рассматривать ТРЕ как метод выбора при сепсисе, течение которого осложнилось полиорганной дисфункцией (рекомендация категории III, 2А) [41]. Более того, совсем недавно (ноябрь 2023 года) был опубликован анализ [69], показавший снижение 28-дневной летальности и одногодичной смертности, ассоциированных с ТРЕ, у пациентов с сепсисом и полиорганной недостаточностью. Этот анализ не был включен в наш мета-анализ во избежание отклонений от заранее предопределенного протокола и связанного с этим риска предвзятости.
При этом, что все эти вышеуказанные результаты несут в себе надежду, важно признать и разрешить некоторые ограничения. Любому анализу, что включил в себя ретроспективные обсервационные сообщения, свойственна предвзятость, которую невозможно полностью устранить. Еще раз стоит отметить, что в каждом исследовании, включая и РКИ, «фиктивное» вмешательство не проводилось, поскольку ТРЕ невозможно скрыть от медицинского персонала/пациентов. Такое отсутствие ослепления может вести к предвзятости у команды, что проводит лечение, что, в свою очередь, может оказать влияние на сам процесс лечения и эту предвзятость невозможно устранить по указанным выше причинам. Более того, исследователи, получившие отрицательные или сомнительные результаты, с большой вероятностью не станут их публиковать, так что о таких исходах мы не имеем представления. В нашей попытке выявить опубликованные и не опубликованные исследования мы провели обширный поиск в нескольких базах данных, выявив те исследования, на которые даны ссылки в Таблице 3. Более того, мы изучили риск предвзятости публикации с помощью воронкообразного графика (Дополнительный файл 1: Fig. S3) и регрессией Peters для асимметрии воронкообразного графика [65], что показало низкий риск предвзятости публикации (t = − 0.69, p = 0.507). Несмотря на то, что все предпринятые нами меры не могут гарантировать отсутствие противоречивых клинических результатов, все-таки наш поиск был всеобъемлющим и всесторонним.
По характеру своего дизайна мета-анализы и систематические обзоры ограничены различающимися протоколами лечения/алгоритмами и различными измерениями исходов среди включенных исследований. При том, что для исследований в критической медицине типично сообщение о 28 – 30-дневной летальности [2], в исследованиях, включенных в наш анализ этот показатель варьировался от 14 до 35 дней (Таб. 3). Также следует отметить, что актуальный день смерти в индивидуальных исследованиях не сообщался, скорее сообщались данные только о краткосрочной летальности или краткосрочной выживаемости (Таб. 3). Будучи авторами нашей рукописи, мы не имели доступа к результатам, выходящим за рамки тех, о которых сообщалось в оригинальных рукописях, что сделало невозможным для нас подвергнуть анализу, отличалось бы влияние на летальность при условии, что во всех исследованиях использовалась бы одна и та же конечная точка (летальность). Более того, для нас были бы желательными долгосрочные исходы, но дизайн и конечные точки включенных исследований не позволили нам оценить исходы за пределами 35 дней.
Самым большим ограничением нашего систематического обзора стала невозможность оценить влияние времени проведения ТРЕ на летальность. Отличительный признак лечения сепсиса – ранняя терапия и интуитивно понятно, что своевременное проведение ТРЕ может быть важнейшим условием благоприятного ответа. Только одно из всех включенных исследований содержало четкий критерий в отношении своевременности ТРЕ, но ни в одном исследовании не сообщалось о связи клинических исходов со временем инициации ТРЕ. Также между исследованиями наблюдалась большая неоднородность в отношении отбора пациентов к ТРЕ. Критерии диагностики сепсиса изменились, так что количественная оценка/анализ тяжести заболевания на основании имеющихся данных уже невозможны. Отсутствие такой информации ограничивает генерализацию наших результатов, что должно стать приоритетом в будущих проспективных исследованиях.
Следующим ограничением нашего обзора стала вариабельность в количестве проведенных процедур ТРЕ (Таб. 3). К сожалению, дальнейший анализ с имеющимися доступными данными был невозможен. Основываясь на клиническом опыте авторов, мы поддерживаем то, что количество процедур ТРЕ должно основываться на клиническом ответе, а не быть заранее определенным. Несмотря на то, что это утверждение не может быть подтверждено или опровергнуто на основании имеющейся литературы, мы полагаем, что такая стратегия обоснована низкой частотой развития тяжелых неблагоприятных событий, ассоциированных с процедурой ТРЕ [70]. Будущие проспективные исследования должны включить и этот важный вопрос.
Клинические руководства и протоколы также несут в себе различия и это не обошло стороной включенные исследования, особенно в части технологий. Как центрифуга, так и мембрана эффективно удаляют патологические макромолекулы, но есть некоторые различия, на которые должно обратить внимание. Использование фильтрующей мембраны имеет более низкий коэффициент экстракции плазмы, что требует более высокой скорости потока крови и более продолжительной процедуры. При центрифугировании удаляются внеклеточные везикулы (extracellular vesicles [EV]), выдворенные как медиаторы воспаления в плазму [71], в то время как мембранная фильтрация приводит к частичному накоплению EV на фильтре [72]. Более того, взаимодействие «мембрана-кровь» само по себе активирует клетки и воспаление, что может потребовать увеличения количества процедур для достижения снижения воспаления [73]. Анализ подгрупп по технологиям ТРЕ предположил различную их эффективность (Рис. 3). В будущих исследованиях следует уделить этому вопросу повышенное внимание.
Тип и объем замещающей жидкости также разнится между исследованиями, что тоже может оказывать влияние на исходы. Сепсис характеризуется снижением активности ADAMTS-13, что приводит к росту уровня тромбогенного фактора фон Виллебранда большой молекулярной массы (ultra-large von Willebrand factor [ULvWF]) с последующим развитием диффузного тромбоза за счет тромбоцитов в микроциркуляции [2, 3]. Увеличение активности ингибитора активатора плазминогена (plasminogen activator inhibitor [PAI-1]) ведет к снижению фибринолиза с последующим диссеминированным свертыванием крови в микроциркуляции за счет фибрина [73–75]. В итоге развивается микроциркуляторное тромботическое состояние с избытком фибрина и тромбоцитов с неспецифическими показателями свертываемости крови, отличающимися от тромботических состояний другой этиологии.
Замещение плазмы пациента плазмой, полученной от здоровых доноров, является необходимым условием восполнения основных защитных противовоспалительных медиаторов и факторов коагуляции, включая ADAMTS-13, что может приводить к улучшению тканевой перфузии с дальнейшим разрешением органной дисфункции [51, 58]. Предыдущие исследования также выявили циркулирующие маркеры эндотелиального повреждения, что ассоциированы с изменениями эндотелия, обнаруженных с помощью электронной микроскопии [58]. Гипотензия связана не только с воспалительной вазодилятацией, но и с увеличением сосудистой утечки, которая, в свою очередь, вызвана повреждением эндотелия [58]. Интенсивная терапия со свежезамороженной плазмой (СЗП) во время процедуры ТРЕ показала восстановление целостности эндотелия, на что указывает улучшение уровней циркулирующих маркеров и данные микроскопических исследований эндотелия [58]. Задержка жидкости может привести к формированию отека легких, поэтому необходимо удаление жидкости с помощью диализа при отсутствии адекватного диуреза.
В некоторых исследованиях было показано улучшение гемодинамики сразу после процедуры ТРЕ, что, возможно, связано с эффектом ТРЕ на эндотелий и, если это так, то можно позволить проводить лечение сепсиса меньшими объемами внутривенных растворов и меньшими дозами вазопрессоров, что все вместе ассоциировано с улучшением выживаемости и увеличением свободных от вентилятора дней [49]. Следовательно, даже при условии, что наш обзор не в силах устранить все эти различия, мы строго рекомендуем использовать СЗП как замещающую жидкость во время процедуры ТРЕ, показанием к которой является сепсис (как это отражено в клиническом руководстве ASFA от 2023 года). Часть данных, подвергнутых анализу нашем обзоре, получена из исследований пациентов с сепсисом, индуцированным COVID19, а на Рис. 4 показано снижение краткосрочной летальности у тех пациентов, которым проводился адъювантный ТРЕ. В то время как эффективные вакцины и терапевтические средства резко сократили количество пациентов, у которых развивались критические состояния вследствие COVID-19, у небольшого процента пациентов может развиться сепсис. Основное внимание в нашем обзоре было уделено лечению сепсиса, течение которого осложнилось развитием полиорганной дисфункции, а не на специфические патогены, послужившие причиной сепсиса. Адъювантная терапия, включая ТРЕ, не должна проводиться исключительно при инфекции COVID-19, эта терапия должна рассматриваться при каждом случае сепсиса, течение которого осложнилось полиорганной дисфункцией.
Несмотря на ограничения, наш обзор показал снижение краткосрочной летальности у критически больных пациентов с сепсисом и полиорганной недостаточностью, которые в качестве адъювантной терапии получили ТРЕ вне зависимости от причинного патогена (Рис. 4). В отсутствие хорошо структурированных, проспективных РКИ с двойным ослеплением, клиническое значение этих результатов не следует игнорировать. Скорее, наши выводы и наблюдаемые ограничения показывают актуальность и могут послужить основой для последующих исследований.
Выводы
Несмотря на небольшой размер исследований и гетерогенность критически больных пациентов с сепсисом и полиорганной дисфункцией, наш мета-анализ показал, что адъювантный терапевтический плазмаобмена (ТРЕ) с использованием плазмы здоровых доноров в качестве замещающей жидкости ассоциирован со снижением риска краткосрочной летальности. Но при том, что результаты нашего мета-анализа очень обнадеживающие, это не исключает настоятельной необходимости в проведении большого, хорошо структурированного, рандомизированного исследования в целях выявления оптимальной популяции пациентов и характеристик процедуры ТРЕ до момента широкого внедрения ТРЕ в клиническую практику.
Список литературы:
1. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, Bellomo R, Bernard GR, Chiche JD, Coopersmith CM, Hotchkiss RS, Levy MM, Marshall JC, Martin GS, Opal SM, Rubenfeld GD, van der Poll T, Vincent JL, Angus DC. The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA. 2016;315(8):801–10. https://doi. org/10.1001/jama.2016.0287.
2. Arina P, Singer M. Pathophysiology of sepsis. Curr Opin Anaesthesiol. 2021;34(2):77–84. https://doi.org/10.1097/ACO.0000000000000963.
3. Martí-Carvajal AJ, Solà I, Lathyris D, Cardona AF. Human recombinant activated protein C for severe sepsis. Cochrane Database Syst Rev. 2011. https://doi.org/10.1002/14651858.CD004388.pub.
4. Seymour CW, Gesten F, Prescott HC, Friedrich ME, Iwashyna TJ, Phillips GS, Lemeshow S, Osborn T, Terry KM, Levy MM. Time to treatment and mortality during mandated emergency care for sepsis. N Engl J Med. 2017;376(23):2235–44. https://doi.org/10.1056/NEJMoa1703058.
5. Scharfman WB, Tillotson JR, Taft EG, Wright E. Plasmapheresis for meningococcemia with disseminated intravascular coagulation. N Engl J Med. 1979;300(22):1277–8.
6. Vain NE, Mazlumian JR, Swarner OW, Cha CC. Role of exchange transfusion in the treatment of severe septicemia. Pediatrics. 1980;66(5):693–7.
7. Norska-Borowka I, Grzywna W, Monsiol A, Karczewska K, Godula-Stuglik
U. Usefulness of exchange transfusions in the treatment of septicemia complicated by intravascular coagulation in newborn infants. Pediatr Pol. 1980;55:943–9.
8. Bjorvatn B, Bjertnaes L, Fadnes HO, Flaegstad T, Gutteberg TJ, Kristiansen BE, Pape J, Rekvig OP, Osterud B, Aanderud L. Meningococcal septicaemia treated with combined plasmapheresis and leucapheresis or with blood exchange. Br Med J. 1984;288(6415):439–41.
9. Osterud B, Flaegstad T. Increased tissue thromboplastin activity in monocytes of patients with meningococcal infection: related to an unfavourable prognosis. Thromb Haemost. 1983;49(1):5–7.
10. Brandtzaeg P, Sirnes K, Folsland B, et al. Plasmapheresis in the treatment of severe meningococcal or pneumococcal septicaemia with DIC and fibrinolysis. Preliminary data on eight patients. Scand J Clin Lab Invest. 1985;178:53–5.
11. Ender LA, Lobakov AI, Lipats AA, Vatazin AV, Filizhanko VN. Plasmapheresis in the complex treatment of suppurative-septic complications of acute surgical diseases of the abdominal organs. Klin Med. 1985;63:98–101.
12. Drapkin MS, Wisch JS, Gelfand JA, Cannon JG, Dinarello CA. Plasmapheresis for fulminant meningococcemia. Pediatr Infect Dis J. 1989;8(6):399–400;
13. McClelland P, Williams PS, Yaqoob M, et al. Multiple organ failure—a role for plasma exchange? Intensive Care Med. 1990;16:100–3.
14. Janbon B, Vuillez JP, Carpentier F, Barnoud D, André-Poyaud P, Barbe G, Guignier M. Removal of circulating tumor necrosis factor. Its role in septic shock treatment. Ann Med Interne. 1992;143(Suppl 1):13–6.
15. Westendorp RG, Brand A, Haanen J, van Hinsbergh VW, Thompson J, van Furth R, Meinders EA. Leukaplasmapheresis in meningococcal septic shock. Am J Med. 1992;92(5):577–8. https://doi.org/10.1016/00029343(92)90761-y.
16. van Deuren M, Santman FW, van Dalen R, Sauerwein RW, Span LF, van der Meer JW. Plasma and whole blood exchange in meningococcal sepsis. Clin Infect Dis. 1992;15(3):424–30. https://doi.org/10.1093/clind/15.3.424.
17. Gårdlund B, Sjölin J, Nilsson A, Roll M, Wickerts CJ, Wikström B, Wretlind B. Plasmapheresis in the treatment of primary septic shock in humans. Scand J Infect Dis. 1993;25(6):757–61. https://doi.org/10.3109/00365 549309008575.
18. Churchwell KB, McManus ML, Kent P, Gorlin J, Galacki D, Humphreys D, Kevy SV. Intensive blood and plasma exchange for treatment of coagulopathy in meningococcemia. J Clin Apher. 1995;10(4):171–7. https://doi. org/10.1002/jca.2920100403.
19. Gårdlund B, Sjölin J, Nilsson A, Roll M, Wickerts CJ, Wretlind B. Plasma levels of cytokines in primary septic shock in humans: correlation with disease severity. J Infect Dis. 1995;172(1):296–301. https://doi.org/10. 1093/infdis/172.1.296.
20. Schött U, Björsell-Ostling E. Sonoclot coagulation analysis and plasma exchange in a case of meningococcal septicaemia. Can J Anaesth. 1995;42(1):64–8. https://doi.org/10.1007/BF03010573.
21. Haupt W, Fritzsche H, Hohenberger W, Zirngibl H. Selective cytokine release induced by serum and separated plasma from septic patients. Eur J Surg. 1996;162(10):769–76.
22. Mok Q, Butt W. The outcome of children admitted to intensive care with meningococcal septicaemia. Intensive Care Med. 1996;22(3):259–63. https://doi.org/10.1007/BF01712247.
23. Campbell WN, Joshi M, Sileo D. Osteonecrosis following meningococcemia and disseminated intravascular coagulation in an adult: case report and review. Clin Infect Dis. 1997;24(3):452–5. https://doi.org/10.1093/clini ds/24.3.452.
24. Kumar A, Kanagasundaram NS, Collyns TA, Davison AM. Plasma exchange and haemodiafiltration in fulminant meningococcal sepsis. Nephrol Dial Transplant. 1998;13(2):484–7. https://doi.org/10.1093/oxfordjournals.ndt. a027853.
25. Darmon M, Azoulay E, Thiery G, Ciroldi M, Galicier L, Parquet N, Veyradier A, Le Gall JR, Oksenhendler E, Schlemmer B. Time course of organ dysfunction in thrombotic microangiopathy patients receiving either plasma perfusion or plasma exchange. Crit Care Med. 2006;34(8):2127–33.
26. Nguyen TC, Han YY, Kiss JE, Hall MW, Hassett AC, Jaffe R, Orr RA, Janosky J, Carcillo JA. Intensive plasma exchange increases a disintegrin and metalloprotease with thrombospondin motifs-13 activity and reverses organ dysfunction in children with thrombocytopenia-associated multiple organ failure. Crit Care Med. 2008;36(10):2878–87.
27. Sevketoglu E, Yildizdas D, Horoz OO, Kihtir HS, Kendirli T, Bayraktar S, Carcillo JA. Use of therapeutic plasma exchange in children with thrombocytopenia-associated multiple organ failure in the Turkish thrombocytopenia-associated multiple organ failure network. Pediatr Crit Care Med. 2014;15(8):e354-359.
28. Hadem J, Hafer C, Schneider AS, Wiesner O, Beutel G, Fuehner T, Welte T, Hoeper MM, Kielstein JT. Therapeutic plasma exchange as rescue therapy in severe sepsis and septic shock: retrospective observational singlecentre study of 23 patients. BMC Anesthesiol. 2014;14:24. https://doi.org/10.1186/1471-2253-14-24.
29. De Simone N, Racsa L, Bevan S, Matevosyan K, Valley T, Girod C, Sarode R. Therapeutic plasma exchange in the management of sepsis and multiple organ dysfunction syndrome: a report of three cases. J Clin Apher. 2014;29(2):127–31. https://doi.org/10.1002/jca.21296.
30. Kawai Y, Cornell TT, Cooley EG, Beckman CN, Baldridge PK, Mottes TA, Luckritz KE, Plomaritas KS, Meade JM, Odetola FO, Han YY, Blatt NB, Annich GM. Therapeutic plasma exchange may improve hemodynamics and organ failure among children with sepsis-induced multiple organ dysfunction syndrome receiving extracorporeal life support. Pediatr Crit Care Med. 2015;16(4):366–74. https://doi.org/10.1097/PCC.0000000000 000351.
31. Stegmayr BG. Plasmapheresis in severe sepsis or septic shock. Blood Purif. 1996;14(1):94–101. https://doi.org/10.1159/000170250.
32. Stegmayr BG. Apheresis as therapy for patients with severe sepsis and multiorgan dysfunction syndrome. Ther Apher. 2001;5(2):123–7. https:// doi.org/10.1046/j.1526-0968.2001.005002123.x.
33. Stegmayr B. Apheresis in patients with severe sepsis and multi organ dysfunction syndrome. Transfus Apher Sci. 2008;38(3):203–8. https://doi. org/10.1016/j.transci.2008.03.009.
34. Garbero E, Livigni S, Ferrari F, Finazzi S, Langer M, Malacarne P, Meca MCC, Mosca S, Olivieri C, Pozzato M, Rossi C, Tavola M, Terzitta M, Viaggi B, Bertolini G. GiViTI High dose coupled plasma filtration and adsorption in septic shock patients. Results of the COMPACT-2: a multicentre, adaptive, randomised clinical trial. Intensive Care Med. 2021;47(11):1303–11. https://doi.org/10.1007/s00134-021-06501-3.
35. Reeves JH, Butt WW, Shann F, Layton JE, Stewart A, Waring PM, Presneill JJ. Continuous plasmafiltration in sepsis syndrome. Plasmafiltration in Sepsis Study Group. Crit Care Med. 1999;27(10):2096–104.
36. Busund R, Koukline V, Utrobin U, Nedashkovsky E. Plasmapheresis in severe sepsis and septic shock: a prospective, randomised, controlled trial. Intensive Care Med. 2002;28(10):1434–9. https://doi.org/10.1007/ s00134-002-1410-7.
37. Zhou F, Peng Z, Murugan R, Kellum JA. Blood purification and mortality in sepsis: a meta-analysis of randomized trials. Crit Care Med. 2013;41(9):2209–20.
38. Rimmer E, Houston BL, Kumar A, Abou-Setta AM, Friesen C, Marshall JC, Rock G, Turgeon AF, Cook DJ, Houston DS, Zarychanski R. The efficacy and safety of plasma exchange in patients with sepsis and septic shock: a systematic review and meta-analysis. Crit Care. 2014;18(6):699. https://doi. org/10.1186/s13054-014-0699-2.
39. Putzu A, Schorer R, Lopez-Delgado JC, Cassina T, Landoni G. Blood purification and mortality in sepsis and septic shock: a systematic review and meta-analysis of randomized trials. Anesthesiology. 2019;131(3):580–93. https://doi.org/10.1097/ALN.0000000000002820.
40. Snow TAC, Littlewood S, Corredor C, Singer M, Arulkumaran N. Effect of extracorporeal blood purification on mortality in sepsis: a meta-analysis and trial sequential analysis. Blood Purif. 2021;50(4–5):462–72. https://doi. org/10.1159/000510982.
41. Prakash S, Sahu A, Routray SS, Maiti R, Mitra JK, Mukherjee S. Efficacy of therapeutic plasma exchange in severe COVID-19 disease: a meta-analysis. Vox Sang. 2023;118(1):49–58. https://doi.org/10.1111/vox.13367.
42. Connelly-Smith L, Alquist CR, Aqui N, Hofmann J, Klingel R, Onwuemene O, Patriquin C, Pham H, Sanchez A, Schneiderman J, Witt V, Zantek N, Dunbar N. Guidelines on the use of therapeutic apheresis in clinical practice–evidence-based approach from the writing committee of the American society for apheresis: the ninth special issue. J Clin Apher. 2023;38(2):77–278. https://doi.org/10.1002/jca.22043.
43. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, Shamseer L, Tetzlaff JM, Akl EA, Brennan SE, Chou R, Glanville J, Grimshaw JM, Hróbjartsson A, Lalu MM, Li T, Loder EW, Mayo-Wilson E, McDonald S, McGuinness LA, Stewart LA, Thomas J, Tricco AC, Welch VA, Whiting P, Moher D. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ. 2021;372:71. https://doi.org/10.1136/bmj. n71.
44. Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, Savovic J, Schulz KF, Weeks L, Sterne JA, Cochrane Bias Methods Group, Cochrane Statistical Methods Group. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011;343:5928.
45. Sterne JA, Hernán MA, Reeves BC, Savović J, Berkman ND, Viswanathan M, Henry D, Altman DG, Ansari MT, Boutron I, Carpenter JR, Chan AW, Churchill R, Deeks JJ, Hróbjartsson A, Kirkham J, Jüni P, Loke YK, Pigott TD, Ramsay CR, Regidor D, Rothstein HR, Sandhu L, Santaguida PL, Schünemann HJ, Shea B, Shrier I, Tugwell P, Turner L, Valentine JC, Waddington H, Waters E, Wells GA, Whiting PF, Higgins JP. ROBINS-I: a tool for assessing risk of bias in non-randomised studies of interventions. BMJ. 2016;355:i4919. https://doi.org/10.1136/bmj.i4919.
46. R Core Team (2023). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria, https:// www.R-project.org/.
47. Balduzzi S, Rücker G, Schwarzer G. How to perform a meta-analysis with R: a practical tutorial. Evid Based Ment Health. 2019;22:153–60.
48. McGuinness, LA robvis: An R package and web application for visualising risk-of-bias assessments. 2019, https://github.com/mcguinlu/robvis
49. Faqihi F, Alharthy A, Abdulaziz S, Balhamar A, Alomari A, AlAseri Z, Tamim H, Alqahtani SA, Kutsogiannis DJ, Brindley PG, Karakitsos D, Memish ZA. Therapeutic plasma exchange in patients with life-threatening COVID-19: a randomised controlled clinical trial. Int J Antimicrob Agents. 2021;57(5):106334. https://doi.org/10.1016/j.ijantimicag.2021.106334.
50. Weng J, Chen M, Fang D, Liu D, Guo R, Yang S. Therapeutic plasma exchange protects patients with sepsis-associated disseminated intravascular coagulation by improving endothelial function. Clin Appl Thromb Hemost. 2021. https://doi.org/10.1177/10760296211053313.
51. Stahl K, Wand P, Seeliger B, Wendel-Garcia PD, Schmidt JJ, Schmidt BMW, Sauer A, Lehmann F, Budde U, Busch M, Wiesner O, Welte T, Haller H, Wedemeyer H, Putensen C, Hoeper MM, Bode C, David S. Clinical and biochemical endpoints and predictors of response to plasma exchange in septic shock: results from a randomized controlled trial. Crit Care. 2022;26(1):134. https://doi.org/10.1186/s13054-022-04003-2
52. Stegmayr BG, Jakobson S, Rydvall A, Björsell-Ostling E. Plasma exchange in patients with acute renal failure in the course of multiorgan failure. Int J Artif Organs. 1995;18(1):45–52.
53. Stegmayr BG. Plasma exchange in patients with septic shock including acute renal failure. Blood Purif. 1996;14(1):102–8. https://doi.org/10.1159/ 000170251.
54. Hjorth V, Stenlund G. Plasmapheresis as part of the treatment for septic shock. Scand J Infect Dis. 2000;32(5):511–4. https://doi.org/10.1080/00365 5400458794.
55. Schmidt J, Mann S, Mohr VD, Lampert R, Firla U, Zirngibl H. Plasmapheresis combined with continuous venovenous hemofiltration in surgical patients with sepsis. Intensive Care Med. 2000;26(5):532–7. https://doi. org/10.1007/s001340051200.
56. Ataman K, Jehmlich M, Kock S, Neumann S, Leischik M, Filipovic Z, Hopf HB. Short-term cardiovascular effects of plasmapheresis in norepinephrine-refractory septic shock. Intensive Care Med. 2002;28(8):1164–7. https://doi.org/10.1007/s00134-002-1375-6.
57. Stegmayr BG, Banga R, Berggren L, Norda R, Rydvall A, Vikerfors T. Plasma exchange as rescue therapy in multiple organ failure including acute renal failure. Crit Care Med. 2003;31(6):1730–6. https://doi.org/10.1097/01. CCM.0000064742.00981.14.
58. Knaup H, Stahl K, Schmidt BMW, Idowu TO, Busch M, Wiesner O, Welte T, Haller H, Kielstein JT, Hoeper MM, David S. Early therapeutic plasma exchange in septic shock: a prospective open-label nonrandomized pilot study focusing on safety, hemodynamics, vascular barrier function, and biologic markers. Crit Care. 2018;22(1):285. https://doi.org/10.1186/ s13054-018-2220-9.
59. Keith PD, Wells AH, Hodges J, Fast SH, Adams A, Scott LK. The therapeutic efficacy of adjunct therapeutic plasma exchange for septic shock with multiple organ failure: a single-center experience. Crit Care. 2020;24(1):518. https://doi.org/10.1186/s13054-020-03241-6.
60. Ahmed RM, Soliman AR, Yousry A, Marzouk K, Faris F. Efficacy of 4-hour rescue therapeutic plasma exchange in severe septic shock patients. Rom J Intern Med. 2020;58(2):75–80. https://doi.org/10.2478/rjim-2019-0026.
61. Gucyetmez B, Atalan HK, Sertdemir I, Cakir U, Telci L, COVID-19 Study Group. Therapeutic plasma exchange in patients with COVID-19 pneumonia in intensive care unit: a retrospective study. Crit Care. 2020;24(1):492. https://doi.org/10.1186/s13054-020-03215-8.
62. Khamis F, Al-Zakwani I, Al Hashmi S, Al Dowaiki S, Al Bahrani M, Pandak N, Al Khalili H, Memish Z. Therapeutic plasma exchange in adults with severe COVID-19 infection. Int J Infect Dis. 2020;99:214–8
63. Kamran SM, Mirza ZE, Naseem A, Liaqat J, Fazal I, Alamgir W, Saeed F, Saleem S, Nisar S, Yousaf MA, Khan AZ, Hussain M, Azam R, Hussain M, Khan KA, Jamal Y, Iftikhar R. Therapeutic plasma exchange for coronavirus disease-2019 triggered cytokine release syndrome; a retrospective propensity matched control study. PLoS ONE. 2021;16(1): e0244853. https:// doi.org/10.1371/journal.pone.0244853.
64. Jaiswal V, Nasa P, Raouf M, Gupta M, Dewedar H, Mohammad H, Al Rais Z, Ali Baqer M, Alsabbah A, Ibrahim Y, Salem M, Shammass D, Marashi M. Therapeutic plasma exchange followed by convalescent plasma transfusion in critical COVID-19-An exploratory study. Int J Infect Dis. 2021;102:332–4. https://doi.org/10.1016/j.ijid.2020.10.085.
65. Peters JL, Sutton AJ, Jones DR, Abrams KR, Rushton L. Comparison of two methods to detect publication bias in meta-analysis. JAMA. 2006;295(6):676–80. https://doi.org/10.1001/jama.295.6.676.
66. Lee OPE, Kanesan N, Leow EH, Sultana R, Chor YK, Gan CS, Lee JH. Survival benefits of therapeutic plasma exchange in severe sepsis and septic shock: a systematic review and meta-analysis. J Intensive Care Med. 2023;38(7):598–611. https://doi.org/10.1177/08850666231170775.
67. Zhang L, Yan X, Fan Q, Liu H, Liu X, Liu Z, Zhang Z. D-dimer levels on admission to predict in-hospital mortality in patients with Covid-19. J Thromb Haemost. 2020;18:1324–9.
68. Chen JJ, Lai PC, Lee TH, Huang YT. Blood purification for adult patients with severe infection or sepsis/septic shock: a network meta-analysis of randomized controlled trials. Crit Care Med. 2023. https://doi.org/10. 1097/CCM.0000000000005991.
69. Yan D, Yao R, Xie X, Fu X, Pei S, Wang Y, Xu D, Li N. The therapeutic efficacy of plasmapheresis for sepsis with multiple organ failure: a propensity score-matched analysis based on the MIMIC-IV database. Shock. 2023. https://doi.org/10.1097/SHK.0000000000002254.
70. Rock G, Weber V, Stegmayr B. Therapeutic plasma exchange (TPE) as a plausible rescue therapy in severe vaccine-induced immune thrombotic thrombocytopenia. Transfus Apher Sci. 2021;60(4):103174. https://doi. org/10.1016/j.transci.2021.103174.
71. Momen-Heravi F. Isolation of extracellular vesicles by ultracentrifugation. Methods Mol Biol. 2017;1660:25–32. https://doi.org/10.1007/ 978-1-4939-7253-1_3.
72. Stegmayr B, Abdel-Rahman EM, Balogun RA. Septic shock with multiorgan failure: from conventional apheresis to adsorption therapies. Semin Dial. 2012;25:171–5.
73. Fujimura Y, Holland LZ. COVID-19 microthrombosis: unusually large VWF multimers are a platform for activation of the alternative complement pathway under cytokine storm. Int J Hematol. 2022;115(4):457–69. https://doi.org/10.1007/s12185-022-03324-w.
74. Nedeva C, Menassa J, Puthalakath H. Sepsis: inflammation is a necessary evil. Front Cell Dev Biol. 2019;7:108.
75. Helms J, Tacquard C, Severac F, Leonard-Lorant I, Ohana M, Delabranche X, Merdji H, Clere-Jehl R, Schenck M, Fagot Gandet F, Fafi-Kremer S, Castelain V, Schneider F, Grunebaum L, Anglés-Cano E, Sattler L, Mertes PM, Meziani F, CRICS TRIGGERSEP Group. High risk of thrombosis in patients with severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med. 2020;46:1089–98.
[~DETAIL_TEXT] => Kuklin et al. Critical Care (2024) 28:12
https://doi.org/10.1186/s13054-023-04795-x
Перевод оригинальной статьи «Influence of therapeutic plasma exchange treatment on short-term mortality of critically ill adult patients with sepsis-induced organ dysfunction: a systematic review and meta-analysis»
Авторы: Vladimir Kuklin1, Michael Sovershaev2, Johan Bjerner2, Philip Keith3, L. Keith Scott4, Owen Matthew Truscott Thomas5, Wladimir Szpirt6, Gail Rock7, Bernd Stegmayr8
1 Department of Anaesthesiology and Intensive Care Medicine, Ahus University Hospital, Sykehusveien, 25, 1478 Lorenskog, Norway.
2 Fürst Medical Laboratory, Oslo, Norway.
3 Critical Care Medicine, Lexington Medical Center, West Columbia, SC, USA.
4 Division of Trauma and Surgical Critical Care, Louisiana State University Health Sciences Center, Shreveport, USA.
5 Department of Health Services Research, Ahus University Hospital, Lorenskog, Norway.
6 Department of Nephrology, Rigshospitalet, University of Copenhagen, Copenhagen, Denmark.
7 University of Ottawa, Ottawa, ON, Canada.
8 Department of Public Health and Clinical Medicine, Umea University, Umea, Sweden.
Ключевые слова: сепсис, сепсис-индуцированная органная дисфункция, терапевтический плазмаобмен, COVID-19, краткосрочная летальность.
Введение
Согласно Третьему международному консенсусу, сепсис определяется как «угрожающая жизни органная дисфункция, вызванная дисрегуляцией иммунного ответа (ответа хозяина или hostresponse) на инфекцию» [1] и представляет собой сложное, взаимосвязанное взаимодействие воспаления, эндотелиальной дисфункции, капиллярной утечки и широкого спектра патологий коагуляции [2]. Было изучено множество различных видов лечения [3], целью которых стали специфические компоненты патологического иммунного ответа, но, за исключением раннего введения антибиотиков [4], результаты были непоследовательными и даже разочаровывающими. Гипотеза о том, что терапевтический плазмаобмен (therapeutic plasmaexchange [ТРЕ]) может служить возможным методом лечения [5] за счет своего одномоментного влияния на множество аспектов патогенеза, насчитывает десятки лет. И на протяжении этих лет большое количество сообщений о случае или серии случаев [6-34] предоставляли обнадеживающие результаты, показывая снижение краткосрочной летальности и улучшение клинических исходов у пациентов с сепсис-индуцированной органной дисфункцией, которым адъювантная терапия проводилась с помощью ТРЕ. При этом проспективные и рандомизированные данные редки и противоречивы [35, 36]. Прежние попытки прояснить ситуацию привели к пяти мета-анализам [37-41], авторы которых пришли к выводу, что фактических данных недостаточно для того, чтобы рекомендовать ТРЕ в качестве рутинной терапии пациентов с сепсис-индуцированной органной дисфункцией. На сегодня клиническое руководство Американской ассоциации афереза (the American Society for Apheresis [ASFA]) содержит в себе рекомендацию категории III, 2А по применению ТРЕ у пациентов с сепсис-индуцированной органной дисфункцией, что позволяет индивидуальное использование ТРЕ в каждом конкретном случае.
Цель нашего исследования – предоставить исчерпывающий обзор с анализом доступной литературы в целях повторного изучения клинического влияния ТРЕ в качестве адъювантной терапии на краткосрочную летальность критически больных взрослых пациентов с полиорганной недостаточностью.
Материалы и методы
Источники данных и стратегия поиска
Этот систематический обзор и мета-анализ выполнен двумя исследователями согласно руководящим принципам PRISMA (Preferred Reporting Items Systematic Reviews and Meta-Analysis) [43] и заранее опубликованному протоколу (PROSPERO database, CRD 42022377753). Поиск рандомизированных, обсервационных и ретроспективных исследований, что изучали ТРЕ при лечении септических пациентов, проводился в базах данных Medline, Ovid (Embase),Cochrane library и clinicaltrial.gov с помощью следующих поисковых терминов: плазмаобмен, плазмаферез, сепсис, септический шок. В дополнение к этому мы в ручном режиме проводили поиск в списках литературы полученных статей с целью выявления других клинических исследований, отвечающих нашим критериям. В поиск вошли исследования, опубликованные в период с 01.01.1966 по 01.11.2022, с ограничениями по языку публикации (только английский). Поначалу мы планировали включить в наше исследование только ТРЕ на основе технологии центрифугирования, но позже мы внесли изменения в протокол по причине значительного количества исследований, в которых ТРЕ проводился на основе технологии фильтрации, что, возможно, могло оказать влияние на результаты.
Оцениваемым первичным исходом стала краткосрочная летальность (14–35 дней) в зависимости от конечных точек каждого конкретного исследования. Вторичные исходы включили клинические параметры (гемодинамика, режим дозирования норадреналина), лабораторные параметры и оценки по шкалам тяжести заболевания (SOFA, APACHE II, APACHE III). Post hoc анализ подгрупп проводился на основании типа процедуры ТРЕ (мембрана, центрифуга) или типа инфекции (не-COVID-19 против COVID-19).
Выбор исследований
Для выбора исследований с последующим включением в мета-анализ использовались критерии включения PICO (Patient/Population [пациент/популяция], Intervention [вмешательство],Comparison [сравнение], Outcome [результат]). 1. Популяция: критически больные взрослые пациенты с сепсис-индуцированной полиорганной дисфункцией. 2. Вмешательство: терапевтический плазмаобмен. 3. Сравнение вмешательства: стандартная терапия. 4. Результат/исход: клинические маркеры, лабораторные маркеры и краткосрочная летальность. 5. Дизайн исследования: рандомизированное и контролируемое исследование (РКИ), обсервационное и ретроспективное исследование (MCS).
Все списки литературы были подвергнуты независимому скринингу на уровне рефератов (абстрактов) двумя независимыми исследователями (VK, MS), после чего, при условии соответствия критериям включения, запрашивались полноразмерные статьи и, после их получения, эти статьи включались в обзор.
Извлечение данных и менеджмент
Первый автор извлекал соответствующую информацию (авторы, название статьи и журнала, год публикации, демографические данные пациентов, оценки по шкалам тяжести, ТРЕ, краткосрочная летальность, гемодинамический статус/режим дозирования норадреналина до и после ТРЕ, данные лабораторных исследований) из выбранных статей. Эти данные проверялись независимо вторым автором. Разногласия между двумя исследователями разрешались путем консенсуса в ходе обсуждения с третьим автором.
Оценка качества
Для оценки риска предвзятости/систематической ошибки (bias) использовался The CochraneCollaboration инструмент (ROB2) в отношении рандомизированных контролируемых исследований (РКИ) [44] и инструмент ROBINS-I для оценки риска предвзятости в других исследованиях [45].
Инструмент Cochrane оценивает генерацию последовательности распределения, сокрытие последовательности распределения, ослепление (участников/персонала и лиц, оценивающих результаты), неполные данные о результатах, выборочную отчетность о результатах и другие предвзятости [44]. Все включенные РКИ были оценены двумя независимыми рецензентами на предмет потенциального риска предвзятости с применением оценки “Низкий”, “Высокий” или “Неясный”.
Инструмент ROBINS-I оценивает предвзятость по причине путаницы (количество вмешивающихся факторов), предвзятость при отборе участников исследования, предвзятость при классификации вмешательств, предвзятость из-за отклонений от запланированных вмешательств, предвзятость из-за отсутствия данных, предвзятость при измерении результатов и предвзятость при выборе сообщаемого результата. Категории риска предвзятых суждений с помощью инструмента ROBINS-I были оценены двумя независимыми рецензентами и получили оценку “Низкий риск”, или “Умеренный риск”, или “Серьезный риск”, или “Критический риск”, или “Нет информации”.
Два автора (VK, MS) независимо проанализировали наличие возможного конфликта интересов авторов и источник финансирования для каждого исследования, затем оценили каждое исследование как “Низкий”, “Высокий” или “Неясный” риск в отношении этих конкретных моментов.
Статистический анализ
Мета-анализ был проведен с использованием статистической программы R [46], с использованием пакетов “meta” [47] и “robvis” [48]. В мета-анализ были включены только MCSs, в которых проводилось сравнение пациентов, получавших адъювантный TPE, с контрольной группой. Кроме того, были проведены множественные post hoc анализы для подгрупп пациентов, получавших лечение TPE методами центрифугирования и мембранной фильтрации, а также подгрупп пациентов, получавшими лечение TPE, с COVID-19 по сравнению с пациентами без COVID-19. Отдельные исследования и сводные результаты были представлены в виде относительного риска (RR) с 95% доверительными интервалами (CI) зарегистрированной летальности у пациентов, получавших TPE, по сравнению с контрольной группой. Для всех анализов была представлена модель случайных эффектов. RR менее 1 указывает на более низкий уровень смертности среди пациентов. Статистическая неоднородность среди РКИ и MCSs, включенных в мета-анализ, была количественно оценена с помощью Cochran Q теста и показателя Higgins I2, соответственно. Р <0,05 считался статистически значимым. Для оценки риска предвзятости публикации были использованы воронкообразный график и линейный регрессионный Peters-тест асимметрии.
Результаты
Выбор исследований
Мы идентифицировали 1 305 публикаций при электронном и ручном поиске (Рис. 1). После удаления дубликатов и обзора заглавий и абстрактов было исключено 1 254 исследований с оставлением 51 записи для анализа. Из них 27 записей были исключены из-за несоответствия критериям включения. Из оставшихся 24 записей три были исключены, так были представлены только лишь в виде абстрактов, и всего осталось 20 исследований, которые и были включены в окончательный анализ (5 РКИ и 15 MCSs) (Рис. 1).

Систематический обзор включил все пять рандомизированных, контролируемых исследования (РКИ) [35, 36, 49–51] и 15 исследований сопоставимых когорт (matched cohort studies [MCSs]) [17, 32, 52–64] с анализом 937 критически больных взрослых пациентов с сепсисом и полиорганной дисфункцией. Среди них 543 пациента получили терапевтический плазмаобмен как адъювантную терапию к стандартному лечению сепсиса, в то время как 394 пациента получили только лишь стандартное лечение.
Мета-анализ включил только те исследования, что сравнивали пациентов, получивших адъювантную терапию ТРЕ, с контролем, и здесь было пять РКИ [35, 36, 49–51] и шесть MCSs[17, 55, 59, 61–63] со включением 627 взрослых пациентов с сепсисом и полиорганной дисфункцией. Среди этих пациентов 300 получили адъювантный ТРЕ в дополнение к стандартному лечению сепсиса, а 327 пациентов получили только лишь стандартную терапию.
Оценка риска предвзятости публикации
Четыре из пяти РКИ были оценены как исследования хорошего качества с низким риском предвзятости, в то время как пятое РКИ имело высокий риск предвзятости в связи с выбором сообщенных результатов (Таблица 1, Дополнительный файл 1: Fig. S1A, B). Четыре из шести MCS исследований были оценены как хорошего качества с низким риском предвзятости. Одно MCS исследование имело серьезный риск предвзятости в связи с большим количеством вмешивающихся факторов и средний риск предвзятости в связи с выбором участников. Шестое MCS исследование имело средний риск предвзятости в связи с большим количеством вмешивающихся факторов (Дополнительный файл 1: Fig. S2A, B). По причине особенностей процедуры терапевтического плазмаобмена и тяжести состояния пациентов с сепсисом ослепление этой процедуры/пациентов от медицинского персонала представляется трудноразрешимой и не логичной задачей и поэтому мы решили не оценивать этот фактор как критический при анализе РКИ и MCS.

Далее мы изучили риски предвзятости публикации с помощью воронкообразного графика (Дополнительный файл 1: Fig. S3) и заметили, что более крупные исследования равномерно распределялись вокруг оценки модели случайных эффектов, в то время как более мелкие исследования, по-видимому, были смещены в сторону больших размеров эффекта. Тест регрессии Peters для асимметрии воронкообразного графика [65] не вернул значимого результата (t = − 0.69, p = 0.507), что указывало на низкий риск предвзятости публикации (Таб. 2).

Характеристики и основной исход клинических исследований
Средний размер исследования составил 43 пациента с диапазоном от 7 до 106 участников. За исключением одного РКИ [36] (различия в среднем возрасте), не было существенных различий в исходных характеристиках между контрольной группой и пациентами, которым проводились процедуры ТРЕ. Критерии включения, технология проведения ТРЕ, выбор и объем замещающей жидкости, количество процедур ТРЕ различались между исследованиями (Таб. 3).

Пять РКИ включили в себя 331 пациента с сепсисом [35, 36, 49–51], 166 из них получили адъювантный ТРЕ (Таб. 3). В этих исследованиях пациенты, получившие адъювантный ТРЕ, имели более низкую летальность (RR: 0.62 [95% CI: 0.46, 0.83]) по сравнению с пациентами, получившими только лишь стандартную терапию (Рис. 2). В трех РКИ [36, 49, 51] ТРЕ выполнялся с помощью центрифуги, а объем удаленной плазмы и возмещения находился в диапазоне 30–45 мл/кг (Таб. 3). Мембранная фильтрация использовалась в двух РКИ [35, 50] с удалением 30–150 мл/кг плазмы (Таб. 3).
Пятьсот семьдесят пациентов было включено в 15 MCS исследований [17, 28, 52–64], из них 377 пациентов получили адъювантный ТРЕ (Таб. 3). По сравнению с пациентами, получившими только стандартную терапию, пациенты, получившие адъювантный ТРЕ, имели несущественное снижение риска краткосрочной летальности в подгруппе проспективных исследований (RR: 0.83 [95% CI: 0.44, 1.58]), в то время как существенное снижение риска краткосрочной летальности наблюдалось в подгруппе ретроспективных исследований (RR: 0.33 [95% CI: 0.14, 0.76], Рис. 2). ТРЕ с центрифугой использовался в девяти исследованиях [52–54, 57, 59, 61–64] с удалением и замещением 30–45 мл/кг плазмы. В оставшихся шести MCS исследованиях [17, 28, 55, 56, 58, 60] использовалась технология фильтрации с удалением, в среднем, 30–45 мл/кг плазмы (Таб. 3).
Мета-анализ общей краткосрочной летальности и анализ подгрупп
Мы объединили данные о краткосрочной летальности из пяти РКИ и шести MCSs (n = 627), проводя сравнения между пациентами, получившими только стандартную терапию (n = 327), с пациентами, лечение которых проводилось с адъювантным ТРЕ (n = 300). Модель случайных эффектов показала значительное снижение отношения рисков смерти (RR 0.59, [95% CI 0.47, 0.74]) с небольшой гетерогенностью (I 2 = 3%, τ 2 <0.0001; Рис. 2).

Мы выполнили анализ подгрупп, в которых использовался ТРЕ. При анализе случайных эффектов технология фильтрации показала несущественное снижение летальности (RR =2 0.63, [95% CI 0.37, 1.07]) с очень низкой гетерогенностью (I2 = 0%, τ 2 = 0.0527). И наоборот, в моделях случайных эффектов технология центрифугирования показала снижение риска краткосрочной летальности с большим размером эффекта и значимостью (RR = 0.58, [95% CI 0.45, 0.75]), но с чуть большей гетерогенностью (I 2 = 18%, τ 2 <0.0001) (Рис. 3).

Мы также выполнили анализ подгрупп, в котором сравнили пациентов с сепсисом, причиной которого был COVID-19, с пациентами, у которых этиология сепсиса была отличной от COVID-19 (Рис. 4). Пациенты, у которых причиной сепсиса были патогены, отличные от COVID-19 (не- COVID-19 сепсис), показали снижение риска краткосрочной летальности как в рандомизированных контролируемых исследованиях (RR = 0.62, [95% CI 0.44, 0.86]), так и в обсервационных MCS исследованиях (RR = 0.68, [95% CI 0.47, 0.97]). При этом модель случайных эффектов показала низкую гетерогенность (I 2 = 0%, τ 2 = 0). С другой стороны, пациенты с сепсисом, причиной которого стал COVID-19, показали снижение риска краткосрочной летальности в MCS исследованиях (RR = 0.20, [95% CI 0.09, 0.47]) и тоже с низкой гетерогенностью (I 2 = 0%, τ 2 = 0) (Рис. 4).

Вторичные клинические и лабораторные исходы
Во многих исследованиях сообщается о потенциально важных клинических и лабораторных конечных точках. Три РКИ [49-51] сообщили о значительном снижении дозы норадреналина, требовавшейся для поддержания целевого артериального давления (АД) после ТРЕ. Два MCS [58, 60] показали, что ТРЕ существенно улучшал среднее артериальное давление и ударный объем с одновременным снижением доз норадреналина. В одном MCS [56] не было найдено изменений в гемодинамическом статусе после ТРЕ. Значительное снижение оценок по шкалам APACHE II [50], APACHE III [36] и SOFA[49, 50] после ТРЕ наблюдалось в четырех РКИ [35, 36, 49, 50], а в одном MCS исследовании [59] показано существенно снижение оценок по шкале SOFA после ТРЕ. Одно MCS исследование [55] не показало каких-либо изменений в оценках по шкале APACHE II после ТРЕ.
Три РКИ [49–51] показали, что после ТРЕ наблюдается существенное снижение концентрации в плазме воспалительных цитокинов, иммунных антител, сывороточного лактата, лактатдегидрогеназы (ЛДГ), ферритина, D-димера и таких медиаторов, как прокальцитонин (ПКТ), антиген фактора Виллебранда (vWF:Ag), ангиопоэтин 2 (Angpt-2), растворимый рецептор тирозинкиназы sTie-2. В этих исследованиях ТРЕ также приводил к значительному увеличению количества лимфоцитов и тромбоцитов, к насыщению защитными факторами, такими как антитромбин III (AT III), протеин С, дизинтегрин и металлопротеиназа с тромбоспондиновым мотивом I типа 13 (ADAMTS-13) [49–51].
Два MCS исследования [56, 58] показали, что после TPE наблюдается существенное снижение концентраций в плазме воспалительных цитокинов (интерлейкинов) IL-1[58], IL-6 [58, 61], IL-8 [58], IL-10 [58]), C-реактивного белка [61], прокальцитонина [61], D-димера [61], ферритина [61] и ЛДГ [61].
Обсуждение
Наш мета-анализ показал значительное снижение краткосрочной летальности у критически больных пациентов с сепсис-индуцированной органной дисфункцией тогда, когда в качестве адъювантной терапии (дополнение к стандартной терапии) применяется терапевтический плазмаобмен. Эти результаты в сочетании с результатами трех недавно опубликованных мета-анализов [66–68] дополняют доказательную базу, что отразилась в рекомендации клинического руководства ASFA рассматривать ТРЕ как метод выбора при сепсисе, течение которого осложнилось полиорганной дисфункцией (рекомендация категории III, 2А) [41]. Более того, совсем недавно (ноябрь 2023 года) был опубликован анализ [69], показавший снижение 28-дневной летальности и одногодичной смертности, ассоциированных с ТРЕ, у пациентов с сепсисом и полиорганной недостаточностью. Этот анализ не был включен в наш мета-анализ во избежание отклонений от заранее предопределенного протокола и связанного с этим риска предвзятости.
При этом, что все эти вышеуказанные результаты несут в себе надежду, важно признать и разрешить некоторые ограничения. Любому анализу, что включил в себя ретроспективные обсервационные сообщения, свойственна предвзятость, которую невозможно полностью устранить. Еще раз стоит отметить, что в каждом исследовании, включая и РКИ, «фиктивное» вмешательство не проводилось, поскольку ТРЕ невозможно скрыть от медицинского персонала/пациентов. Такое отсутствие ослепления может вести к предвзятости у команды, что проводит лечение, что, в свою очередь, может оказать влияние на сам процесс лечения и эту предвзятость невозможно устранить по указанным выше причинам. Более того, исследователи, получившие отрицательные или сомнительные результаты, с большой вероятностью не станут их публиковать, так что о таких исходах мы не имеем представления. В нашей попытке выявить опубликованные и не опубликованные исследования мы провели обширный поиск в нескольких базах данных, выявив те исследования, на которые даны ссылки в Таблице 3. Более того, мы изучили риск предвзятости публикации с помощью воронкообразного графика (Дополнительный файл 1: Fig. S3) и регрессией Peters для асимметрии воронкообразного графика [65], что показало низкий риск предвзятости публикации (t = − 0.69, p = 0.507). Несмотря на то, что все предпринятые нами меры не могут гарантировать отсутствие противоречивых клинических результатов, все-таки наш поиск был всеобъемлющим и всесторонним.
По характеру своего дизайна мета-анализы и систематические обзоры ограничены различающимися протоколами лечения/алгоритмами и различными измерениями исходов среди включенных исследований. При том, что для исследований в критической медицине типично сообщение о 28 – 30-дневной летальности [2], в исследованиях, включенных в наш анализ этот показатель варьировался от 14 до 35 дней (Таб. 3). Также следует отметить, что актуальный день смерти в индивидуальных исследованиях не сообщался, скорее сообщались данные только о краткосрочной летальности или краткосрочной выживаемости (Таб. 3). Будучи авторами нашей рукописи, мы не имели доступа к результатам, выходящим за рамки тех, о которых сообщалось в оригинальных рукописях, что сделало невозможным для нас подвергнуть анализу, отличалось бы влияние на летальность при условии, что во всех исследованиях использовалась бы одна и та же конечная точка (летальность). Более того, для нас были бы желательными долгосрочные исходы, но дизайн и конечные точки включенных исследований не позволили нам оценить исходы за пределами 35 дней.
Самым большим ограничением нашего систематического обзора стала невозможность оценить влияние времени проведения ТРЕ на летальность. Отличительный признак лечения сепсиса – ранняя терапия и интуитивно понятно, что своевременное проведение ТРЕ может быть важнейшим условием благоприятного ответа. Только одно из всех включенных исследований содержало четкий критерий в отношении своевременности ТРЕ, но ни в одном исследовании не сообщалось о связи клинических исходов со временем инициации ТРЕ. Также между исследованиями наблюдалась большая неоднородность в отношении отбора пациентов к ТРЕ. Критерии диагностики сепсиса изменились, так что количественная оценка/анализ тяжести заболевания на основании имеющихся данных уже невозможны. Отсутствие такой информации ограничивает генерализацию наших результатов, что должно стать приоритетом в будущих проспективных исследованиях.
Следующим ограничением нашего обзора стала вариабельность в количестве проведенных процедур ТРЕ (Таб. 3). К сожалению, дальнейший анализ с имеющимися доступными данными был невозможен. Основываясь на клиническом опыте авторов, мы поддерживаем то, что количество процедур ТРЕ должно основываться на клиническом ответе, а не быть заранее определенным. Несмотря на то, что это утверждение не может быть подтверждено или опровергнуто на основании имеющейся литературы, мы полагаем, что такая стратегия обоснована низкой частотой развития тяжелых неблагоприятных событий, ассоциированных с процедурой ТРЕ [70]. Будущие проспективные исследования должны включить и этот важный вопрос.
Клинические руководства и протоколы также несут в себе различия и это не обошло стороной включенные исследования, особенно в части технологий. Как центрифуга, так и мембрана эффективно удаляют патологические макромолекулы, но есть некоторые различия, на которые должно обратить внимание. Использование фильтрующей мембраны имеет более низкий коэффициент экстракции плазмы, что требует более высокой скорости потока крови и более продолжительной процедуры. При центрифугировании удаляются внеклеточные везикулы (extracellular vesicles [EV]), выдворенные как медиаторы воспаления в плазму [71], в то время как мембранная фильтрация приводит к частичному накоплению EV на фильтре [72]. Более того, взаимодействие «мембрана-кровь» само по себе активирует клетки и воспаление, что может потребовать увеличения количества процедур для достижения снижения воспаления [73]. Анализ подгрупп по технологиям ТРЕ предположил различную их эффективность (Рис. 3). В будущих исследованиях следует уделить этому вопросу повышенное внимание.
Тип и объем замещающей жидкости также разнится между исследованиями, что тоже может оказывать влияние на исходы. Сепсис характеризуется снижением активности ADAMTS-13, что приводит к росту уровня тромбогенного фактора фон Виллебранда большой молекулярной массы (ultra-large von Willebrand factor [ULvWF]) с последующим развитием диффузного тромбоза за счет тромбоцитов в микроциркуляции [2, 3]. Увеличение активности ингибитора активатора плазминогена (plasminogen activator inhibitor [PAI-1]) ведет к снижению фибринолиза с последующим диссеминированным свертыванием крови в микроциркуляции за счет фибрина [73–75]. В итоге развивается микроциркуляторное тромботическое состояние с избытком фибрина и тромбоцитов с неспецифическими показателями свертываемости крови, отличающимися от тромботических состояний другой этиологии.
Замещение плазмы пациента плазмой, полученной от здоровых доноров, является необходимым условием восполнения основных защитных противовоспалительных медиаторов и факторов коагуляции, включая ADAMTS-13, что может приводить к улучшению тканевой перфузии с дальнейшим разрешением органной дисфункции [51, 58]. Предыдущие исследования также выявили циркулирующие маркеры эндотелиального повреждения, что ассоциированы с изменениями эндотелия, обнаруженных с помощью электронной микроскопии [58]. Гипотензия связана не только с воспалительной вазодилятацией, но и с увеличением сосудистой утечки, которая, в свою очередь, вызвана повреждением эндотелия [58]. Интенсивная терапия со свежезамороженной плазмой (СЗП) во время процедуры ТРЕ показала восстановление целостности эндотелия, на что указывает улучшение уровней циркулирующих маркеров и данные микроскопических исследований эндотелия [58]. Задержка жидкости может привести к формированию отека легких, поэтому необходимо удаление жидкости с помощью диализа при отсутствии адекватного диуреза.
В некоторых исследованиях было показано улучшение гемодинамики сразу после процедуры ТРЕ, что, возможно, связано с эффектом ТРЕ на эндотелий и, если это так, то можно позволить проводить лечение сепсиса меньшими объемами внутривенных растворов и меньшими дозами вазопрессоров, что все вместе ассоциировано с улучшением выживаемости и увеличением свободных от вентилятора дней [49]. Следовательно, даже при условии, что наш обзор не в силах устранить все эти различия, мы строго рекомендуем использовать СЗП как замещающую жидкость во время процедуры ТРЕ, показанием к которой является сепсис (как это отражено в клиническом руководстве ASFA от 2023 года). Часть данных, подвергнутых анализу нашем обзоре, получена из исследований пациентов с сепсисом, индуцированным COVID19, а на Рис. 4 показано снижение краткосрочной летальности у тех пациентов, которым проводился адъювантный ТРЕ. В то время как эффективные вакцины и терапевтические средства резко сократили количество пациентов, у которых развивались критические состояния вследствие COVID-19, у небольшого процента пациентов может развиться сепсис. Основное внимание в нашем обзоре было уделено лечению сепсиса, течение которого осложнилось развитием полиорганной дисфункции, а не на специфические патогены, послужившие причиной сепсиса. Адъювантная терапия, включая ТРЕ, не должна проводиться исключительно при инфекции COVID-19, эта терапия должна рассматриваться при каждом случае сепсиса, течение которого осложнилось полиорганной дисфункцией.
Несмотря на ограничения, наш обзор показал снижение краткосрочной летальности у критически больных пациентов с сепсисом и полиорганной недостаточностью, которые в качестве адъювантной терапии получили ТРЕ вне зависимости от причинного патогена (Рис. 4). В отсутствие хорошо структурированных, проспективных РКИ с двойным ослеплением, клиническое значение этих результатов не следует игнорировать. Скорее, наши выводы и наблюдаемые ограничения показывают актуальность и могут послужить основой для последующих исследований.
Выводы
Несмотря на небольшой размер исследований и гетерогенность критически больных пациентов с сепсисом и полиорганной дисфункцией, наш мета-анализ показал, что адъювантный терапевтический плазмаобмена (ТРЕ) с использованием плазмы здоровых доноров в качестве замещающей жидкости ассоциирован со снижением риска краткосрочной летальности. Но при том, что результаты нашего мета-анализа очень обнадеживающие, это не исключает настоятельной необходимости в проведении большого, хорошо структурированного, рандомизированного исследования в целях выявления оптимальной популяции пациентов и характеристик процедуры ТРЕ до момента широкого внедрения ТРЕ в клиническую практику.
Список литературы:
1. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, Bellomo R, Bernard GR, Chiche JD, Coopersmith CM, Hotchkiss RS, Levy MM, Marshall JC, Martin GS, Opal SM, Rubenfeld GD, van der Poll T, Vincent JL, Angus DC. The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA. 2016;315(8):801–10. https://doi. org/10.1001/jama.2016.0287.
2. Arina P, Singer M. Pathophysiology of sepsis. Curr Opin Anaesthesiol. 2021;34(2):77–84. https://doi.org/10.1097/ACO.0000000000000963.
3. Martí-Carvajal AJ, Solà I, Lathyris D, Cardona AF. Human recombinant activated protein C for severe sepsis. Cochrane Database Syst Rev. 2011. https://doi.org/10.1002/14651858.CD004388.pub.
4. Seymour CW, Gesten F, Prescott HC, Friedrich ME, Iwashyna TJ, Phillips GS, Lemeshow S, Osborn T, Terry KM, Levy MM. Time to treatment and mortality during mandated emergency care for sepsis. N Engl J Med. 2017;376(23):2235–44. https://doi.org/10.1056/NEJMoa1703058.
5. Scharfman WB, Tillotson JR, Taft EG, Wright E. Plasmapheresis for meningococcemia with disseminated intravascular coagulation. N Engl J Med. 1979;300(22):1277–8.
6. Vain NE, Mazlumian JR, Swarner OW, Cha CC. Role of exchange transfusion in the treatment of severe septicemia. Pediatrics. 1980;66(5):693–7.
7. Norska-Borowka I, Grzywna W, Monsiol A, Karczewska K, Godula-Stuglik
U. Usefulness of exchange transfusions in the treatment of septicemia complicated by intravascular coagulation in newborn infants. Pediatr Pol. 1980;55:943–9.
8. Bjorvatn B, Bjertnaes L, Fadnes HO, Flaegstad T, Gutteberg TJ, Kristiansen BE, Pape J, Rekvig OP, Osterud B, Aanderud L. Meningococcal septicaemia treated with combined plasmapheresis and leucapheresis or with blood exchange. Br Med J. 1984;288(6415):439–41.
9. Osterud B, Flaegstad T. Increased tissue thromboplastin activity in monocytes of patients with meningococcal infection: related to an unfavourable prognosis. Thromb Haemost. 1983;49(1):5–7.
10. Brandtzaeg P, Sirnes K, Folsland B, et al. Plasmapheresis in the treatment of severe meningococcal or pneumococcal septicaemia with DIC and fibrinolysis. Preliminary data on eight patients. Scand J Clin Lab Invest. 1985;178:53–5.
11. Ender LA, Lobakov AI, Lipats AA, Vatazin AV, Filizhanko VN. Plasmapheresis in the complex treatment of suppurative-septic complications of acute surgical diseases of the abdominal organs. Klin Med. 1985;63:98–101.
12. Drapkin MS, Wisch JS, Gelfand JA, Cannon JG, Dinarello CA. Plasmapheresis for fulminant meningococcemia. Pediatr Infect Dis J. 1989;8(6):399–400;
13. McClelland P, Williams PS, Yaqoob M, et al. Multiple organ failure—a role for plasma exchange? Intensive Care Med. 1990;16:100–3.
14. Janbon B, Vuillez JP, Carpentier F, Barnoud D, André-Poyaud P, Barbe G, Guignier M. Removal of circulating tumor necrosis factor. Its role in septic shock treatment. Ann Med Interne. 1992;143(Suppl 1):13–6.
15. Westendorp RG, Brand A, Haanen J, van Hinsbergh VW, Thompson J, van Furth R, Meinders EA. Leukaplasmapheresis in meningococcal septic shock. Am J Med. 1992;92(5):577–8. https://doi.org/10.1016/00029343(92)90761-y.
16. van Deuren M, Santman FW, van Dalen R, Sauerwein RW, Span LF, van der Meer JW. Plasma and whole blood exchange in meningococcal sepsis. Clin Infect Dis. 1992;15(3):424–30. https://doi.org/10.1093/clind/15.3.424.
17. Gårdlund B, Sjölin J, Nilsson A, Roll M, Wickerts CJ, Wikström B, Wretlind B. Plasmapheresis in the treatment of primary septic shock in humans. Scand J Infect Dis. 1993;25(6):757–61. https://doi.org/10.3109/00365 549309008575.
18. Churchwell KB, McManus ML, Kent P, Gorlin J, Galacki D, Humphreys D, Kevy SV. Intensive blood and plasma exchange for treatment of coagulopathy in meningococcemia. J Clin Apher. 1995;10(4):171–7. https://doi. org/10.1002/jca.2920100403.
19. Gårdlund B, Sjölin J, Nilsson A, Roll M, Wickerts CJ, Wretlind B. Plasma levels of cytokines in primary septic shock in humans: correlation with disease severity. J Infect Dis. 1995;172(1):296–301. https://doi.org/10. 1093/infdis/172.1.296.
20. Schött U, Björsell-Ostling E. Sonoclot coagulation analysis and plasma exchange in a case of meningococcal septicaemia. Can J Anaesth. 1995;42(1):64–8. https://doi.org/10.1007/BF03010573.
21. Haupt W, Fritzsche H, Hohenberger W, Zirngibl H. Selective cytokine release induced by serum and separated plasma from septic patients. Eur J Surg. 1996;162(10):769–76.
22. Mok Q, Butt W. The outcome of children admitted to intensive care with meningococcal septicaemia. Intensive Care Med. 1996;22(3):259–63. https://doi.org/10.1007/BF01712247.
23. Campbell WN, Joshi M, Sileo D. Osteonecrosis following meningococcemia and disseminated intravascular coagulation in an adult: case report and review. Clin Infect Dis. 1997;24(3):452–5. https://doi.org/10.1093/clini ds/24.3.452.
24. Kumar A, Kanagasundaram NS, Collyns TA, Davison AM. Plasma exchange and haemodiafiltration in fulminant meningococcal sepsis. Nephrol Dial Transplant. 1998;13(2):484–7. https://doi.org/10.1093/oxfordjournals.ndt. a027853.
25. Darmon M, Azoulay E, Thiery G, Ciroldi M, Galicier L, Parquet N, Veyradier A, Le Gall JR, Oksenhendler E, Schlemmer B. Time course of organ dysfunction in thrombotic microangiopathy patients receiving either plasma perfusion or plasma exchange. Crit Care Med. 2006;34(8):2127–33.
26. Nguyen TC, Han YY, Kiss JE, Hall MW, Hassett AC, Jaffe R, Orr RA, Janosky J, Carcillo JA. Intensive plasma exchange increases a disintegrin and metalloprotease with thrombospondin motifs-13 activity and reverses organ dysfunction in children with thrombocytopenia-associated multiple organ failure. Crit Care Med. 2008;36(10):2878–87.
27. Sevketoglu E, Yildizdas D, Horoz OO, Kihtir HS, Kendirli T, Bayraktar S, Carcillo JA. Use of therapeutic plasma exchange in children with thrombocytopenia-associated multiple organ failure in the Turkish thrombocytopenia-associated multiple organ failure network. Pediatr Crit Care Med. 2014;15(8):e354-359.
28. Hadem J, Hafer C, Schneider AS, Wiesner O, Beutel G, Fuehner T, Welte T, Hoeper MM, Kielstein JT. Therapeutic plasma exchange as rescue therapy in severe sepsis and septic shock: retrospective observational singlecentre study of 23 patients. BMC Anesthesiol. 2014;14:24. https://doi.org/10.1186/1471-2253-14-24.
29. De Simone N, Racsa L, Bevan S, Matevosyan K, Valley T, Girod C, Sarode R. Therapeutic plasma exchange in the management of sepsis and multiple organ dysfunction syndrome: a report of three cases. J Clin Apher. 2014;29(2):127–31. https://doi.org/10.1002/jca.21296.
30. Kawai Y, Cornell TT, Cooley EG, Beckman CN, Baldridge PK, Mottes TA, Luckritz KE, Plomaritas KS, Meade JM, Odetola FO, Han YY, Blatt NB, Annich GM. Therapeutic plasma exchange may improve hemodynamics and organ failure among children with sepsis-induced multiple organ dysfunction syndrome receiving extracorporeal life support. Pediatr Crit Care Med. 2015;16(4):366–74. https://doi.org/10.1097/PCC.0000000000 000351.
31. Stegmayr BG. Plasmapheresis in severe sepsis or septic shock. Blood Purif. 1996;14(1):94–101. https://doi.org/10.1159/000170250.
32. Stegmayr BG. Apheresis as therapy for patients with severe sepsis and multiorgan dysfunction syndrome. Ther Apher. 2001;5(2):123–7. https:// doi.org/10.1046/j.1526-0968.2001.005002123.x.
33. Stegmayr B. Apheresis in patients with severe sepsis and multi organ dysfunction syndrome. Transfus Apher Sci. 2008;38(3):203–8. https://doi. org/10.1016/j.transci.2008.03.009.
34. Garbero E, Livigni S, Ferrari F, Finazzi S, Langer M, Malacarne P, Meca MCC, Mosca S, Olivieri C, Pozzato M, Rossi C, Tavola M, Terzitta M, Viaggi B, Bertolini G. GiViTI High dose coupled plasma filtration and adsorption in septic shock patients. Results of the COMPACT-2: a multicentre, adaptive, randomised clinical trial. Intensive Care Med. 2021;47(11):1303–11. https://doi.org/10.1007/s00134-021-06501-3.
35. Reeves JH, Butt WW, Shann F, Layton JE, Stewart A, Waring PM, Presneill JJ. Continuous plasmafiltration in sepsis syndrome. Plasmafiltration in Sepsis Study Group. Crit Care Med. 1999;27(10):2096–104.
36. Busund R, Koukline V, Utrobin U, Nedashkovsky E. Plasmapheresis in severe sepsis and septic shock: a prospective, randomised, controlled trial. Intensive Care Med. 2002;28(10):1434–9. https://doi.org/10.1007/ s00134-002-1410-7.
37. Zhou F, Peng Z, Murugan R, Kellum JA. Blood purification and mortality in sepsis: a meta-analysis of randomized trials. Crit Care Med. 2013;41(9):2209–20.
38. Rimmer E, Houston BL, Kumar A, Abou-Setta AM, Friesen C, Marshall JC, Rock G, Turgeon AF, Cook DJ, Houston DS, Zarychanski R. The efficacy and safety of plasma exchange in patients with sepsis and septic shock: a systematic review and meta-analysis. Crit Care. 2014;18(6):699. https://doi. org/10.1186/s13054-014-0699-2.
39. Putzu A, Schorer R, Lopez-Delgado JC, Cassina T, Landoni G. Blood purification and mortality in sepsis and septic shock: a systematic review and meta-analysis of randomized trials. Anesthesiology. 2019;131(3):580–93. https://doi.org/10.1097/ALN.0000000000002820.
40. Snow TAC, Littlewood S, Corredor C, Singer M, Arulkumaran N. Effect of extracorporeal blood purification on mortality in sepsis: a meta-analysis and trial sequential analysis. Blood Purif. 2021;50(4–5):462–72. https://doi. org/10.1159/000510982.
41. Prakash S, Sahu A, Routray SS, Maiti R, Mitra JK, Mukherjee S. Efficacy of therapeutic plasma exchange in severe COVID-19 disease: a meta-analysis. Vox Sang. 2023;118(1):49–58. https://doi.org/10.1111/vox.13367.
42. Connelly-Smith L, Alquist CR, Aqui N, Hofmann J, Klingel R, Onwuemene O, Patriquin C, Pham H, Sanchez A, Schneiderman J, Witt V, Zantek N, Dunbar N. Guidelines on the use of therapeutic apheresis in clinical practice–evidence-based approach from the writing committee of the American society for apheresis: the ninth special issue. J Clin Apher. 2023;38(2):77–278. https://doi.org/10.1002/jca.22043.
43. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, Shamseer L, Tetzlaff JM, Akl EA, Brennan SE, Chou R, Glanville J, Grimshaw JM, Hróbjartsson A, Lalu MM, Li T, Loder EW, Mayo-Wilson E, McDonald S, McGuinness LA, Stewart LA, Thomas J, Tricco AC, Welch VA, Whiting P, Moher D. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ. 2021;372:71. https://doi.org/10.1136/bmj. n71.
44. Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, Savovic J, Schulz KF, Weeks L, Sterne JA, Cochrane Bias Methods Group, Cochrane Statistical Methods Group. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011;343:5928.
45. Sterne JA, Hernán MA, Reeves BC, Savović J, Berkman ND, Viswanathan M, Henry D, Altman DG, Ansari MT, Boutron I, Carpenter JR, Chan AW, Churchill R, Deeks JJ, Hróbjartsson A, Kirkham J, Jüni P, Loke YK, Pigott TD, Ramsay CR, Regidor D, Rothstein HR, Sandhu L, Santaguida PL, Schünemann HJ, Shea B, Shrier I, Tugwell P, Turner L, Valentine JC, Waddington H, Waters E, Wells GA, Whiting PF, Higgins JP. ROBINS-I: a tool for assessing risk of bias in non-randomised studies of interventions. BMJ. 2016;355:i4919. https://doi.org/10.1136/bmj.i4919.
46. R Core Team (2023). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria, https:// www.R-project.org/.
47. Balduzzi S, Rücker G, Schwarzer G. How to perform a meta-analysis with R: a practical tutorial. Evid Based Ment Health. 2019;22:153–60.
48. McGuinness, LA robvis: An R package and web application for visualising risk-of-bias assessments. 2019, https://github.com/mcguinlu/robvis
49. Faqihi F, Alharthy A, Abdulaziz S, Balhamar A, Alomari A, AlAseri Z, Tamim H, Alqahtani SA, Kutsogiannis DJ, Brindley PG, Karakitsos D, Memish ZA. Therapeutic plasma exchange in patients with life-threatening COVID-19: a randomised controlled clinical trial. Int J Antimicrob Agents. 2021;57(5):106334. https://doi.org/10.1016/j.ijantimicag.2021.106334.
50. Weng J, Chen M, Fang D, Liu D, Guo R, Yang S. Therapeutic plasma exchange protects patients with sepsis-associated disseminated intravascular coagulation by improving endothelial function. Clin Appl Thromb Hemost. 2021. https://doi.org/10.1177/10760296211053313.
51. Stahl K, Wand P, Seeliger B, Wendel-Garcia PD, Schmidt JJ, Schmidt BMW, Sauer A, Lehmann F, Budde U, Busch M, Wiesner O, Welte T, Haller H, Wedemeyer H, Putensen C, Hoeper MM, Bode C, David S. Clinical and biochemical endpoints and predictors of response to plasma exchange in septic shock: results from a randomized controlled trial. Crit Care. 2022;26(1):134. https://doi.org/10.1186/s13054-022-04003-2
52. Stegmayr BG, Jakobson S, Rydvall A, Björsell-Ostling E. Plasma exchange in patients with acute renal failure in the course of multiorgan failure. Int J Artif Organs. 1995;18(1):45–52.
53. Stegmayr BG. Plasma exchange in patients with septic shock including acute renal failure. Blood Purif. 1996;14(1):102–8. https://doi.org/10.1159/ 000170251.
54. Hjorth V, Stenlund G. Plasmapheresis as part of the treatment for septic shock. Scand J Infect Dis. 2000;32(5):511–4. https://doi.org/10.1080/00365 5400458794.
55. Schmidt J, Mann S, Mohr VD, Lampert R, Firla U, Zirngibl H. Plasmapheresis combined with continuous venovenous hemofiltration in surgical patients with sepsis. Intensive Care Med. 2000;26(5):532–7. https://doi. org/10.1007/s001340051200.
56. Ataman K, Jehmlich M, Kock S, Neumann S, Leischik M, Filipovic Z, Hopf HB. Short-term cardiovascular effects of plasmapheresis in norepinephrine-refractory septic shock. Intensive Care Med. 2002;28(8):1164–7. https://doi.org/10.1007/s00134-002-1375-6.
57. Stegmayr BG, Banga R, Berggren L, Norda R, Rydvall A, Vikerfors T. Plasma exchange as rescue therapy in multiple organ failure including acute renal failure. Crit Care Med. 2003;31(6):1730–6. https://doi.org/10.1097/01. CCM.0000064742.00981.14.
58. Knaup H, Stahl K, Schmidt BMW, Idowu TO, Busch M, Wiesner O, Welte T, Haller H, Kielstein JT, Hoeper MM, David S. Early therapeutic plasma exchange in septic shock: a prospective open-label nonrandomized pilot study focusing on safety, hemodynamics, vascular barrier function, and biologic markers. Crit Care. 2018;22(1):285. https://doi.org/10.1186/ s13054-018-2220-9.
59. Keith PD, Wells AH, Hodges J, Fast SH, Adams A, Scott LK. The therapeutic efficacy of adjunct therapeutic plasma exchange for septic shock with multiple organ failure: a single-center experience. Crit Care. 2020;24(1):518. https://doi.org/10.1186/s13054-020-03241-6.
60. Ahmed RM, Soliman AR, Yousry A, Marzouk K, Faris F. Efficacy of 4-hour rescue therapeutic plasma exchange in severe septic shock patients. Rom J Intern Med. 2020;58(2):75–80. https://doi.org/10.2478/rjim-2019-0026.
61. Gucyetmez B, Atalan HK, Sertdemir I, Cakir U, Telci L, COVID-19 Study Group. Therapeutic plasma exchange in patients with COVID-19 pneumonia in intensive care unit: a retrospective study. Crit Care. 2020;24(1):492. https://doi.org/10.1186/s13054-020-03215-8.
62. Khamis F, Al-Zakwani I, Al Hashmi S, Al Dowaiki S, Al Bahrani M, Pandak N, Al Khalili H, Memish Z. Therapeutic plasma exchange in adults with severe COVID-19 infection. Int J Infect Dis. 2020;99:214–8
63. Kamran SM, Mirza ZE, Naseem A, Liaqat J, Fazal I, Alamgir W, Saeed F, Saleem S, Nisar S, Yousaf MA, Khan AZ, Hussain M, Azam R, Hussain M, Khan KA, Jamal Y, Iftikhar R. Therapeutic plasma exchange for coronavirus disease-2019 triggered cytokine release syndrome; a retrospective propensity matched control study. PLoS ONE. 2021;16(1): e0244853. https:// doi.org/10.1371/journal.pone.0244853.
64. Jaiswal V, Nasa P, Raouf M, Gupta M, Dewedar H, Mohammad H, Al Rais Z, Ali Baqer M, Alsabbah A, Ibrahim Y, Salem M, Shammass D, Marashi M. Therapeutic plasma exchange followed by convalescent plasma transfusion in critical COVID-19-An exploratory study. Int J Infect Dis. 2021;102:332–4. https://doi.org/10.1016/j.ijid.2020.10.085.
65. Peters JL, Sutton AJ, Jones DR, Abrams KR, Rushton L. Comparison of two methods to detect publication bias in meta-analysis. JAMA. 2006;295(6):676–80. https://doi.org/10.1001/jama.295.6.676.
66. Lee OPE, Kanesan N, Leow EH, Sultana R, Chor YK, Gan CS, Lee JH. Survival benefits of therapeutic plasma exchange in severe sepsis and septic shock: a systematic review and meta-analysis. J Intensive Care Med. 2023;38(7):598–611. https://doi.org/10.1177/08850666231170775.
67. Zhang L, Yan X, Fan Q, Liu H, Liu X, Liu Z, Zhang Z. D-dimer levels on admission to predict in-hospital mortality in patients with Covid-19. J Thromb Haemost. 2020;18:1324–9.
68. Chen JJ, Lai PC, Lee TH, Huang YT. Blood purification for adult patients with severe infection or sepsis/septic shock: a network meta-analysis of randomized controlled trials. Crit Care Med. 2023. https://doi.org/10. 1097/CCM.0000000000005991.
69. Yan D, Yao R, Xie X, Fu X, Pei S, Wang Y, Xu D, Li N. The therapeutic efficacy of plasmapheresis for sepsis with multiple organ failure: a propensity score-matched analysis based on the MIMIC-IV database. Shock. 2023. https://doi.org/10.1097/SHK.0000000000002254.
70. Rock G, Weber V, Stegmayr B. Therapeutic plasma exchange (TPE) as a plausible rescue therapy in severe vaccine-induced immune thrombotic thrombocytopenia. Transfus Apher Sci. 2021;60(4):103174. https://doi. org/10.1016/j.transci.2021.103174.
71. Momen-Heravi F. Isolation of extracellular vesicles by ultracentrifugation. Methods Mol Biol. 2017;1660:25–32. https://doi.org/10.1007/ 978-1-4939-7253-1_3.
72. Stegmayr B, Abdel-Rahman EM, Balogun RA. Septic shock with multiorgan failure: from conventional apheresis to adsorption therapies. Semin Dial. 2012;25:171–5.
73. Fujimura Y, Holland LZ. COVID-19 microthrombosis: unusually large VWF multimers are a platform for activation of the alternative complement pathway under cytokine storm. Int J Hematol. 2022;115(4):457–69. https://doi.org/10.1007/s12185-022-03324-w.
74. Nedeva C, Menassa J, Puthalakath H. Sepsis: inflammation is a necessary evil. Front Cell Dev Biol. 2019;7:108.
75. Helms J, Tacquard C, Severac F, Leonard-Lorant I, Ohana M, Delabranche X, Merdji H, Clere-Jehl R, Schenck M, Fagot Gandet F, Fafi-Kremer S, Castelain V, Schneider F, Grunebaum L, Anglés-Cano E, Sattler L, Mertes PM, Meziani F, CRICS TRIGGERSEP Group. High risk of thrombosis in patients with severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med. 2020;46:1089–98.
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 07.02.2024
[~DATE_ACTIVE_FROM] => 07.02.2024
[ACTIVE_FROM_X] => 2024-02-07 00:00:00
[~ACTIVE_FROM_X] => 2024-02-07 00:00:00
[ACTIVE_FROM] => 07.02.2024
[~ACTIVE_FROM] => 07.02.2024
[SHOW_COUNTER] => 640
[~SHOW_COUNTER] => 640
[ID] => 8403
[~ID] => 8403
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 12.02.2024 17:46:36
[~TIMESTAMP_X] => 12.02.2024 17:46:36
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/vliyanie-terapevticheskogo-plazmoobmena-na-kratkosrochnuyu-letalnost-kriticheski-bolnykh-vzroslykh-p/
[~DETAIL_PAGE_URL] => /library/articles/vliyanie-terapevticheskogo-plazmoobmena-na-kratkosrochnuyu-letalnost-kriticheski-bolnykh-vzroslykh-p/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => vliyanie-terapevticheskogo-plazmoobmena-na-kratkosrochnuyu-letalnost-kriticheski-bolnykh-vzroslykh-p
[~CODE] => vliyanie-terapevticheskogo-plazmoobmena-na-kratkosrochnuyu-letalnost-kriticheski-bolnykh-vzroslykh-p
[EXTERNAL_ID] => 8403
[~EXTERNAL_ID] => 8403
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 7 февраля 2024
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
[PREVIEW_PICTURE] => Array
(
[ID] => 5498
[TIMESTAMP_X] => 12.02.2024 17:46:36
[MODULE_ID] => iblock
[HEIGHT] => 633
[WIDTH] => 950
[FILE_SIZE] => 51631
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/248/qu6wbx46edqlbdr7h9kkehn00gb0cto8
[FILE_NAME] => donnez-votre-plasma-le-traitement-est-en-vous20231020185446_950X633.jpeg
[ORIGINAL_NAME] => donnez-votre-plasma-le-traitement-est-en-vous20231020185446_950X633.jpeg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 55f8ccc35e1abc0c5642d5ce3131de8a
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/248/qu6wbx46edqlbdr7h9kkehn00gb0cto8/donnez-votre-plasma-le-traitement-est-en-vous20231020185446_950X633.jpeg
[UNSAFE_SRC] => /upload/iblock/248/qu6wbx46edqlbdr7h9kkehn00gb0cto8/donnez-votre-plasma-le-traitement-est-en-vous20231020185446_950X633.jpeg
[SAFE_SRC] => /upload/iblock/248/qu6wbx46edqlbdr7h9kkehn00gb0cto8/donnez-votre-plasma-le-traitement-est-en-vous20231020185446_950X633.jpeg
[ALT] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
[TITLE] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
)
[DETAIL_TEXT] => Kuklin et al. Critical Care (2024) 28:12
https://doi.org/10.1186/s13054-023-04795-x
Перевод оригинальной статьи «Influence of therapeutic plasma exchange treatment on short-term mortality of critically ill adult patients with sepsis-induced organ dysfunction: a systematic review and meta-analysis»
Авторы: Vladimir Kuklin1, Michael Sovershaev2, Johan Bjerner2, Philip Keith3, L. Keith Scott4, Owen Matthew Truscott Thomas5, Wladimir Szpirt6, Gail Rock7, Bernd Stegmayr8
1 Department of Anaesthesiology and Intensive Care Medicine, Ahus University Hospital, Sykehusveien, 25, 1478 Lorenskog, Norway.
2 Fürst Medical Laboratory, Oslo, Norway.
3 Critical Care Medicine, Lexington Medical Center, West Columbia, SC, USA.
4 Division of Trauma and Surgical Critical Care, Louisiana State University Health Sciences Center, Shreveport, USA.
5 Department of Health Services Research, Ahus University Hospital, Lorenskog, Norway.
6 Department of Nephrology, Rigshospitalet, University of Copenhagen, Copenhagen, Denmark.
7 University of Ottawa, Ottawa, ON, Canada.
8 Department of Public Health and Clinical Medicine, Umea University, Umea, Sweden.
Ключевые слова: сепсис, сепсис-индуцированная органная дисфункция, терапевтический плазмаобмен, COVID-19, краткосрочная летальность.
Введение
Согласно Третьему международному консенсусу, сепсис определяется как «угрожающая жизни органная дисфункция, вызванная дисрегуляцией иммунного ответа (ответа хозяина или hostresponse) на инфекцию» [1] и представляет собой сложное, взаимосвязанное взаимодействие воспаления, эндотелиальной дисфункции, капиллярной утечки и широкого спектра патологий коагуляции [2]. Было изучено множество различных видов лечения [3], целью которых стали специфические компоненты патологического иммунного ответа, но, за исключением раннего введения антибиотиков [4], результаты были непоследовательными и даже разочаровывающими. Гипотеза о том, что терапевтический плазмаобмен (therapeutic plasmaexchange [ТРЕ]) может служить возможным методом лечения [5] за счет своего одномоментного влияния на множество аспектов патогенеза, насчитывает десятки лет. И на протяжении этих лет большое количество сообщений о случае или серии случаев [6-34] предоставляли обнадеживающие результаты, показывая снижение краткосрочной летальности и улучшение клинических исходов у пациентов с сепсис-индуцированной органной дисфункцией, которым адъювантная терапия проводилась с помощью ТРЕ. При этом проспективные и рандомизированные данные редки и противоречивы [35, 36]. Прежние попытки прояснить ситуацию привели к пяти мета-анализам [37-41], авторы которых пришли к выводу, что фактических данных недостаточно для того, чтобы рекомендовать ТРЕ в качестве рутинной терапии пациентов с сепсис-индуцированной органной дисфункцией. На сегодня клиническое руководство Американской ассоциации афереза (the American Society for Apheresis [ASFA]) содержит в себе рекомендацию категории III, 2А по применению ТРЕ у пациентов с сепсис-индуцированной органной дисфункцией, что позволяет индивидуальное использование ТРЕ в каждом конкретном случае.
Цель нашего исследования – предоставить исчерпывающий обзор с анализом доступной литературы в целях повторного изучения клинического влияния ТРЕ в качестве адъювантной терапии на краткосрочную летальность критически больных взрослых пациентов с полиорганной недостаточностью.
Материалы и методы
Источники данных и стратегия поиска
Этот систематический обзор и мета-анализ выполнен двумя исследователями согласно руководящим принципам PRISMA (Preferred Reporting Items Systematic Reviews and Meta-Analysis) [43] и заранее опубликованному протоколу (PROSPERO database, CRD 42022377753). Поиск рандомизированных, обсервационных и ретроспективных исследований, что изучали ТРЕ при лечении септических пациентов, проводился в базах данных Medline, Ovid (Embase),Cochrane library и clinicaltrial.gov с помощью следующих поисковых терминов: плазмаобмен, плазмаферез, сепсис, септический шок. В дополнение к этому мы в ручном режиме проводили поиск в списках литературы полученных статей с целью выявления других клинических исследований, отвечающих нашим критериям. В поиск вошли исследования, опубликованные в период с 01.01.1966 по 01.11.2022, с ограничениями по языку публикации (только английский). Поначалу мы планировали включить в наше исследование только ТРЕ на основе технологии центрифугирования, но позже мы внесли изменения в протокол по причине значительного количества исследований, в которых ТРЕ проводился на основе технологии фильтрации, что, возможно, могло оказать влияние на результаты.
Оцениваемым первичным исходом стала краткосрочная летальность (14–35 дней) в зависимости от конечных точек каждого конкретного исследования. Вторичные исходы включили клинические параметры (гемодинамика, режим дозирования норадреналина), лабораторные параметры и оценки по шкалам тяжести заболевания (SOFA, APACHE II, APACHE III). Post hoc анализ подгрупп проводился на основании типа процедуры ТРЕ (мембрана, центрифуга) или типа инфекции (не-COVID-19 против COVID-19).
Выбор исследований
Для выбора исследований с последующим включением в мета-анализ использовались критерии включения PICO (Patient/Population [пациент/популяция], Intervention [вмешательство],Comparison [сравнение], Outcome [результат]). 1. Популяция: критически больные взрослые пациенты с сепсис-индуцированной полиорганной дисфункцией. 2. Вмешательство: терапевтический плазмаобмен. 3. Сравнение вмешательства: стандартная терапия. 4. Результат/исход: клинические маркеры, лабораторные маркеры и краткосрочная летальность. 5. Дизайн исследования: рандомизированное и контролируемое исследование (РКИ), обсервационное и ретроспективное исследование (MCS).
Все списки литературы были подвергнуты независимому скринингу на уровне рефератов (абстрактов) двумя независимыми исследователями (VK, MS), после чего, при условии соответствия критериям включения, запрашивались полноразмерные статьи и, после их получения, эти статьи включались в обзор.
Извлечение данных и менеджмент
Первый автор извлекал соответствующую информацию (авторы, название статьи и журнала, год публикации, демографические данные пациентов, оценки по шкалам тяжести, ТРЕ, краткосрочная летальность, гемодинамический статус/режим дозирования норадреналина до и после ТРЕ, данные лабораторных исследований) из выбранных статей. Эти данные проверялись независимо вторым автором. Разногласия между двумя исследователями разрешались путем консенсуса в ходе обсуждения с третьим автором.
Оценка качества
Для оценки риска предвзятости/систематической ошибки (bias) использовался The CochraneCollaboration инструмент (ROB2) в отношении рандомизированных контролируемых исследований (РКИ) [44] и инструмент ROBINS-I для оценки риска предвзятости в других исследованиях [45].
Инструмент Cochrane оценивает генерацию последовательности распределения, сокрытие последовательности распределения, ослепление (участников/персонала и лиц, оценивающих результаты), неполные данные о результатах, выборочную отчетность о результатах и другие предвзятости [44]. Все включенные РКИ были оценены двумя независимыми рецензентами на предмет потенциального риска предвзятости с применением оценки “Низкий”, “Высокий” или “Неясный”.
Инструмент ROBINS-I оценивает предвзятость по причине путаницы (количество вмешивающихся факторов), предвзятость при отборе участников исследования, предвзятость при классификации вмешательств, предвзятость из-за отклонений от запланированных вмешательств, предвзятость из-за отсутствия данных, предвзятость при измерении результатов и предвзятость при выборе сообщаемого результата. Категории риска предвзятых суждений с помощью инструмента ROBINS-I были оценены двумя независимыми рецензентами и получили оценку “Низкий риск”, или “Умеренный риск”, или “Серьезный риск”, или “Критический риск”, или “Нет информации”.
Два автора (VK, MS) независимо проанализировали наличие возможного конфликта интересов авторов и источник финансирования для каждого исследования, затем оценили каждое исследование как “Низкий”, “Высокий” или “Неясный” риск в отношении этих конкретных моментов.
Статистический анализ
Мета-анализ был проведен с использованием статистической программы R [46], с использованием пакетов “meta” [47] и “robvis” [48]. В мета-анализ были включены только MCSs, в которых проводилось сравнение пациентов, получавших адъювантный TPE, с контрольной группой. Кроме того, были проведены множественные post hoc анализы для подгрупп пациентов, получавших лечение TPE методами центрифугирования и мембранной фильтрации, а также подгрупп пациентов, получавшими лечение TPE, с COVID-19 по сравнению с пациентами без COVID-19. Отдельные исследования и сводные результаты были представлены в виде относительного риска (RR) с 95% доверительными интервалами (CI) зарегистрированной летальности у пациентов, получавших TPE, по сравнению с контрольной группой. Для всех анализов была представлена модель случайных эффектов. RR менее 1 указывает на более низкий уровень смертности среди пациентов. Статистическая неоднородность среди РКИ и MCSs, включенных в мета-анализ, была количественно оценена с помощью Cochran Q теста и показателя Higgins I2, соответственно. Р <0,05 считался статистически значимым. Для оценки риска предвзятости публикации были использованы воронкообразный график и линейный регрессионный Peters-тест асимметрии.
Результаты
Выбор исследований
Мы идентифицировали 1 305 публикаций при электронном и ручном поиске (Рис. 1). После удаления дубликатов и обзора заглавий и абстрактов было исключено 1 254 исследований с оставлением 51 записи для анализа. Из них 27 записей были исключены из-за несоответствия критериям включения. Из оставшихся 24 записей три были исключены, так были представлены только лишь в виде абстрактов, и всего осталось 20 исследований, которые и были включены в окончательный анализ (5 РКИ и 15 MCSs) (Рис. 1).

Систематический обзор включил все пять рандомизированных, контролируемых исследования (РКИ) [35, 36, 49–51] и 15 исследований сопоставимых когорт (matched cohort studies [MCSs]) [17, 32, 52–64] с анализом 937 критически больных взрослых пациентов с сепсисом и полиорганной дисфункцией. Среди них 543 пациента получили терапевтический плазмаобмен как адъювантную терапию к стандартному лечению сепсиса, в то время как 394 пациента получили только лишь стандартное лечение.
Мета-анализ включил только те исследования, что сравнивали пациентов, получивших адъювантную терапию ТРЕ, с контролем, и здесь было пять РКИ [35, 36, 49–51] и шесть MCSs[17, 55, 59, 61–63] со включением 627 взрослых пациентов с сепсисом и полиорганной дисфункцией. Среди этих пациентов 300 получили адъювантный ТРЕ в дополнение к стандартному лечению сепсиса, а 327 пациентов получили только лишь стандартную терапию.
Оценка риска предвзятости публикации
Четыре из пяти РКИ были оценены как исследования хорошего качества с низким риском предвзятости, в то время как пятое РКИ имело высокий риск предвзятости в связи с выбором сообщенных результатов (Таблица 1, Дополнительный файл 1: Fig. S1A, B). Четыре из шести MCS исследований были оценены как хорошего качества с низким риском предвзятости. Одно MCS исследование имело серьезный риск предвзятости в связи с большим количеством вмешивающихся факторов и средний риск предвзятости в связи с выбором участников. Шестое MCS исследование имело средний риск предвзятости в связи с большим количеством вмешивающихся факторов (Дополнительный файл 1: Fig. S2A, B). По причине особенностей процедуры терапевтического плазмаобмена и тяжести состояния пациентов с сепсисом ослепление этой процедуры/пациентов от медицинского персонала представляется трудноразрешимой и не логичной задачей и поэтому мы решили не оценивать этот фактор как критический при анализе РКИ и MCS.

Далее мы изучили риски предвзятости публикации с помощью воронкообразного графика (Дополнительный файл 1: Fig. S3) и заметили, что более крупные исследования равномерно распределялись вокруг оценки модели случайных эффектов, в то время как более мелкие исследования, по-видимому, были смещены в сторону больших размеров эффекта. Тест регрессии Peters для асимметрии воронкообразного графика [65] не вернул значимого результата (t = − 0.69, p = 0.507), что указывало на низкий риск предвзятости публикации (Таб. 2).

Характеристики и основной исход клинических исследований
Средний размер исследования составил 43 пациента с диапазоном от 7 до 106 участников. За исключением одного РКИ [36] (различия в среднем возрасте), не было существенных различий в исходных характеристиках между контрольной группой и пациентами, которым проводились процедуры ТРЕ. Критерии включения, технология проведения ТРЕ, выбор и объем замещающей жидкости, количество процедур ТРЕ различались между исследованиями (Таб. 3).

Пять РКИ включили в себя 331 пациента с сепсисом [35, 36, 49–51], 166 из них получили адъювантный ТРЕ (Таб. 3). В этих исследованиях пациенты, получившие адъювантный ТРЕ, имели более низкую летальность (RR: 0.62 [95% CI: 0.46, 0.83]) по сравнению с пациентами, получившими только лишь стандартную терапию (Рис. 2). В трех РКИ [36, 49, 51] ТРЕ выполнялся с помощью центрифуги, а объем удаленной плазмы и возмещения находился в диапазоне 30–45 мл/кг (Таб. 3). Мембранная фильтрация использовалась в двух РКИ [35, 50] с удалением 30–150 мл/кг плазмы (Таб. 3).
Пятьсот семьдесят пациентов было включено в 15 MCS исследований [17, 28, 52–64], из них 377 пациентов получили адъювантный ТРЕ (Таб. 3). По сравнению с пациентами, получившими только стандартную терапию, пациенты, получившие адъювантный ТРЕ, имели несущественное снижение риска краткосрочной летальности в подгруппе проспективных исследований (RR: 0.83 [95% CI: 0.44, 1.58]), в то время как существенное снижение риска краткосрочной летальности наблюдалось в подгруппе ретроспективных исследований (RR: 0.33 [95% CI: 0.14, 0.76], Рис. 2). ТРЕ с центрифугой использовался в девяти исследованиях [52–54, 57, 59, 61–64] с удалением и замещением 30–45 мл/кг плазмы. В оставшихся шести MCS исследованиях [17, 28, 55, 56, 58, 60] использовалась технология фильтрации с удалением, в среднем, 30–45 мл/кг плазмы (Таб. 3).
Мета-анализ общей краткосрочной летальности и анализ подгрупп
Мы объединили данные о краткосрочной летальности из пяти РКИ и шести MCSs (n = 627), проводя сравнения между пациентами, получившими только стандартную терапию (n = 327), с пациентами, лечение которых проводилось с адъювантным ТРЕ (n = 300). Модель случайных эффектов показала значительное снижение отношения рисков смерти (RR 0.59, [95% CI 0.47, 0.74]) с небольшой гетерогенностью (I 2 = 3%, τ 2 <0.0001; Рис. 2).

Мы выполнили анализ подгрупп, в которых использовался ТРЕ. При анализе случайных эффектов технология фильтрации показала несущественное снижение летальности (RR =2 0.63, [95% CI 0.37, 1.07]) с очень низкой гетерогенностью (I2 = 0%, τ 2 = 0.0527). И наоборот, в моделях случайных эффектов технология центрифугирования показала снижение риска краткосрочной летальности с большим размером эффекта и значимостью (RR = 0.58, [95% CI 0.45, 0.75]), но с чуть большей гетерогенностью (I 2 = 18%, τ 2 <0.0001) (Рис. 3).

Мы также выполнили анализ подгрупп, в котором сравнили пациентов с сепсисом, причиной которого был COVID-19, с пациентами, у которых этиология сепсиса была отличной от COVID-19 (Рис. 4). Пациенты, у которых причиной сепсиса были патогены, отличные от COVID-19 (не- COVID-19 сепсис), показали снижение риска краткосрочной летальности как в рандомизированных контролируемых исследованиях (RR = 0.62, [95% CI 0.44, 0.86]), так и в обсервационных MCS исследованиях (RR = 0.68, [95% CI 0.47, 0.97]). При этом модель случайных эффектов показала низкую гетерогенность (I 2 = 0%, τ 2 = 0). С другой стороны, пациенты с сепсисом, причиной которого стал COVID-19, показали снижение риска краткосрочной летальности в MCS исследованиях (RR = 0.20, [95% CI 0.09, 0.47]) и тоже с низкой гетерогенностью (I 2 = 0%, τ 2 = 0) (Рис. 4).

Вторичные клинические и лабораторные исходы
Во многих исследованиях сообщается о потенциально важных клинических и лабораторных конечных точках. Три РКИ [49-51] сообщили о значительном снижении дозы норадреналина, требовавшейся для поддержания целевого артериального давления (АД) после ТРЕ. Два MCS [58, 60] показали, что ТРЕ существенно улучшал среднее артериальное давление и ударный объем с одновременным снижением доз норадреналина. В одном MCS [56] не было найдено изменений в гемодинамическом статусе после ТРЕ. Значительное снижение оценок по шкалам APACHE II [50], APACHE III [36] и SOFA[49, 50] после ТРЕ наблюдалось в четырех РКИ [35, 36, 49, 50], а в одном MCS исследовании [59] показано существенно снижение оценок по шкале SOFA после ТРЕ. Одно MCS исследование [55] не показало каких-либо изменений в оценках по шкале APACHE II после ТРЕ.
Три РКИ [49–51] показали, что после ТРЕ наблюдается существенное снижение концентрации в плазме воспалительных цитокинов, иммунных антител, сывороточного лактата, лактатдегидрогеназы (ЛДГ), ферритина, D-димера и таких медиаторов, как прокальцитонин (ПКТ), антиген фактора Виллебранда (vWF:Ag), ангиопоэтин 2 (Angpt-2), растворимый рецептор тирозинкиназы sTie-2. В этих исследованиях ТРЕ также приводил к значительному увеличению количества лимфоцитов и тромбоцитов, к насыщению защитными факторами, такими как антитромбин III (AT III), протеин С, дизинтегрин и металлопротеиназа с тромбоспондиновым мотивом I типа 13 (ADAMTS-13) [49–51].
Два MCS исследования [56, 58] показали, что после TPE наблюдается существенное снижение концентраций в плазме воспалительных цитокинов (интерлейкинов) IL-1[58], IL-6 [58, 61], IL-8 [58], IL-10 [58]), C-реактивного белка [61], прокальцитонина [61], D-димера [61], ферритина [61] и ЛДГ [61].
Обсуждение
Наш мета-анализ показал значительное снижение краткосрочной летальности у критически больных пациентов с сепсис-индуцированной органной дисфункцией тогда, когда в качестве адъювантной терапии (дополнение к стандартной терапии) применяется терапевтический плазмаобмен. Эти результаты в сочетании с результатами трех недавно опубликованных мета-анализов [66–68] дополняют доказательную базу, что отразилась в рекомендации клинического руководства ASFA рассматривать ТРЕ как метод выбора при сепсисе, течение которого осложнилось полиорганной дисфункцией (рекомендация категории III, 2А) [41]. Более того, совсем недавно (ноябрь 2023 года) был опубликован анализ [69], показавший снижение 28-дневной летальности и одногодичной смертности, ассоциированных с ТРЕ, у пациентов с сепсисом и полиорганной недостаточностью. Этот анализ не был включен в наш мета-анализ во избежание отклонений от заранее предопределенного протокола и связанного с этим риска предвзятости.
При этом, что все эти вышеуказанные результаты несут в себе надежду, важно признать и разрешить некоторые ограничения. Любому анализу, что включил в себя ретроспективные обсервационные сообщения, свойственна предвзятость, которую невозможно полностью устранить. Еще раз стоит отметить, что в каждом исследовании, включая и РКИ, «фиктивное» вмешательство не проводилось, поскольку ТРЕ невозможно скрыть от медицинского персонала/пациентов. Такое отсутствие ослепления может вести к предвзятости у команды, что проводит лечение, что, в свою очередь, может оказать влияние на сам процесс лечения и эту предвзятость невозможно устранить по указанным выше причинам. Более того, исследователи, получившие отрицательные или сомнительные результаты, с большой вероятностью не станут их публиковать, так что о таких исходах мы не имеем представления. В нашей попытке выявить опубликованные и не опубликованные исследования мы провели обширный поиск в нескольких базах данных, выявив те исследования, на которые даны ссылки в Таблице 3. Более того, мы изучили риск предвзятости публикации с помощью воронкообразного графика (Дополнительный файл 1: Fig. S3) и регрессией Peters для асимметрии воронкообразного графика [65], что показало низкий риск предвзятости публикации (t = − 0.69, p = 0.507). Несмотря на то, что все предпринятые нами меры не могут гарантировать отсутствие противоречивых клинических результатов, все-таки наш поиск был всеобъемлющим и всесторонним.
По характеру своего дизайна мета-анализы и систематические обзоры ограничены различающимися протоколами лечения/алгоритмами и различными измерениями исходов среди включенных исследований. При том, что для исследований в критической медицине типично сообщение о 28 – 30-дневной летальности [2], в исследованиях, включенных в наш анализ этот показатель варьировался от 14 до 35 дней (Таб. 3). Также следует отметить, что актуальный день смерти в индивидуальных исследованиях не сообщался, скорее сообщались данные только о краткосрочной летальности или краткосрочной выживаемости (Таб. 3). Будучи авторами нашей рукописи, мы не имели доступа к результатам, выходящим за рамки тех, о которых сообщалось в оригинальных рукописях, что сделало невозможным для нас подвергнуть анализу, отличалось бы влияние на летальность при условии, что во всех исследованиях использовалась бы одна и та же конечная точка (летальность). Более того, для нас были бы желательными долгосрочные исходы, но дизайн и конечные точки включенных исследований не позволили нам оценить исходы за пределами 35 дней.
Самым большим ограничением нашего систематического обзора стала невозможность оценить влияние времени проведения ТРЕ на летальность. Отличительный признак лечения сепсиса – ранняя терапия и интуитивно понятно, что своевременное проведение ТРЕ может быть важнейшим условием благоприятного ответа. Только одно из всех включенных исследований содержало четкий критерий в отношении своевременности ТРЕ, но ни в одном исследовании не сообщалось о связи клинических исходов со временем инициации ТРЕ. Также между исследованиями наблюдалась большая неоднородность в отношении отбора пациентов к ТРЕ. Критерии диагностики сепсиса изменились, так что количественная оценка/анализ тяжести заболевания на основании имеющихся данных уже невозможны. Отсутствие такой информации ограничивает генерализацию наших результатов, что должно стать приоритетом в будущих проспективных исследованиях.
Следующим ограничением нашего обзора стала вариабельность в количестве проведенных процедур ТРЕ (Таб. 3). К сожалению, дальнейший анализ с имеющимися доступными данными был невозможен. Основываясь на клиническом опыте авторов, мы поддерживаем то, что количество процедур ТРЕ должно основываться на клиническом ответе, а не быть заранее определенным. Несмотря на то, что это утверждение не может быть подтверждено или опровергнуто на основании имеющейся литературы, мы полагаем, что такая стратегия обоснована низкой частотой развития тяжелых неблагоприятных событий, ассоциированных с процедурой ТРЕ [70]. Будущие проспективные исследования должны включить и этот важный вопрос.
Клинические руководства и протоколы также несут в себе различия и это не обошло стороной включенные исследования, особенно в части технологий. Как центрифуга, так и мембрана эффективно удаляют патологические макромолекулы, но есть некоторые различия, на которые должно обратить внимание. Использование фильтрующей мембраны имеет более низкий коэффициент экстракции плазмы, что требует более высокой скорости потока крови и более продолжительной процедуры. При центрифугировании удаляются внеклеточные везикулы (extracellular vesicles [EV]), выдворенные как медиаторы воспаления в плазму [71], в то время как мембранная фильтрация приводит к частичному накоплению EV на фильтре [72]. Более того, взаимодействие «мембрана-кровь» само по себе активирует клетки и воспаление, что может потребовать увеличения количества процедур для достижения снижения воспаления [73]. Анализ подгрупп по технологиям ТРЕ предположил различную их эффективность (Рис. 3). В будущих исследованиях следует уделить этому вопросу повышенное внимание.
Тип и объем замещающей жидкости также разнится между исследованиями, что тоже может оказывать влияние на исходы. Сепсис характеризуется снижением активности ADAMTS-13, что приводит к росту уровня тромбогенного фактора фон Виллебранда большой молекулярной массы (ultra-large von Willebrand factor [ULvWF]) с последующим развитием диффузного тромбоза за счет тромбоцитов в микроциркуляции [2, 3]. Увеличение активности ингибитора активатора плазминогена (plasminogen activator inhibitor [PAI-1]) ведет к снижению фибринолиза с последующим диссеминированным свертыванием крови в микроциркуляции за счет фибрина [73–75]. В итоге развивается микроциркуляторное тромботическое состояние с избытком фибрина и тромбоцитов с неспецифическими показателями свертываемости крови, отличающимися от тромботических состояний другой этиологии.
Замещение плазмы пациента плазмой, полученной от здоровых доноров, является необходимым условием восполнения основных защитных противовоспалительных медиаторов и факторов коагуляции, включая ADAMTS-13, что может приводить к улучшению тканевой перфузии с дальнейшим разрешением органной дисфункции [51, 58]. Предыдущие исследования также выявили циркулирующие маркеры эндотелиального повреждения, что ассоциированы с изменениями эндотелия, обнаруженных с помощью электронной микроскопии [58]. Гипотензия связана не только с воспалительной вазодилятацией, но и с увеличением сосудистой утечки, которая, в свою очередь, вызвана повреждением эндотелия [58]. Интенсивная терапия со свежезамороженной плазмой (СЗП) во время процедуры ТРЕ показала восстановление целостности эндотелия, на что указывает улучшение уровней циркулирующих маркеров и данные микроскопических исследований эндотелия [58]. Задержка жидкости может привести к формированию отека легких, поэтому необходимо удаление жидкости с помощью диализа при отсутствии адекватного диуреза.
В некоторых исследованиях было показано улучшение гемодинамики сразу после процедуры ТРЕ, что, возможно, связано с эффектом ТРЕ на эндотелий и, если это так, то можно позволить проводить лечение сепсиса меньшими объемами внутривенных растворов и меньшими дозами вазопрессоров, что все вместе ассоциировано с улучшением выживаемости и увеличением свободных от вентилятора дней [49]. Следовательно, даже при условии, что наш обзор не в силах устранить все эти различия, мы строго рекомендуем использовать СЗП как замещающую жидкость во время процедуры ТРЕ, показанием к которой является сепсис (как это отражено в клиническом руководстве ASFA от 2023 года). Часть данных, подвергнутых анализу нашем обзоре, получена из исследований пациентов с сепсисом, индуцированным COVID19, а на Рис. 4 показано снижение краткосрочной летальности у тех пациентов, которым проводился адъювантный ТРЕ. В то время как эффективные вакцины и терапевтические средства резко сократили количество пациентов, у которых развивались критические состояния вследствие COVID-19, у небольшого процента пациентов может развиться сепсис. Основное внимание в нашем обзоре было уделено лечению сепсиса, течение которого осложнилось развитием полиорганной дисфункции, а не на специфические патогены, послужившие причиной сепсиса. Адъювантная терапия, включая ТРЕ, не должна проводиться исключительно при инфекции COVID-19, эта терапия должна рассматриваться при каждом случае сепсиса, течение которого осложнилось полиорганной дисфункцией.
Несмотря на ограничения, наш обзор показал снижение краткосрочной летальности у критически больных пациентов с сепсисом и полиорганной недостаточностью, которые в качестве адъювантной терапии получили ТРЕ вне зависимости от причинного патогена (Рис. 4). В отсутствие хорошо структурированных, проспективных РКИ с двойным ослеплением, клиническое значение этих результатов не следует игнорировать. Скорее, наши выводы и наблюдаемые ограничения показывают актуальность и могут послужить основой для последующих исследований.
Выводы
Несмотря на небольшой размер исследований и гетерогенность критически больных пациентов с сепсисом и полиорганной дисфункцией, наш мета-анализ показал, что адъювантный терапевтический плазмаобмена (ТРЕ) с использованием плазмы здоровых доноров в качестве замещающей жидкости ассоциирован со снижением риска краткосрочной летальности. Но при том, что результаты нашего мета-анализа очень обнадеживающие, это не исключает настоятельной необходимости в проведении большого, хорошо структурированного, рандомизированного исследования в целях выявления оптимальной популяции пациентов и характеристик процедуры ТРЕ до момента широкого внедрения ТРЕ в клиническую практику.
Список литературы:
1. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, Bellomo R, Bernard GR, Chiche JD, Coopersmith CM, Hotchkiss RS, Levy MM, Marshall JC, Martin GS, Opal SM, Rubenfeld GD, van der Poll T, Vincent JL, Angus DC. The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA. 2016;315(8):801–10. https://doi. org/10.1001/jama.2016.0287.
2. Arina P, Singer M. Pathophysiology of sepsis. Curr Opin Anaesthesiol. 2021;34(2):77–84. https://doi.org/10.1097/ACO.0000000000000963.
3. Martí-Carvajal AJ, Solà I, Lathyris D, Cardona AF. Human recombinant activated protein C for severe sepsis. Cochrane Database Syst Rev. 2011. https://doi.org/10.1002/14651858.CD004388.pub.
4. Seymour CW, Gesten F, Prescott HC, Friedrich ME, Iwashyna TJ, Phillips GS, Lemeshow S, Osborn T, Terry KM, Levy MM. Time to treatment and mortality during mandated emergency care for sepsis. N Engl J Med. 2017;376(23):2235–44. https://doi.org/10.1056/NEJMoa1703058.
5. Scharfman WB, Tillotson JR, Taft EG, Wright E. Plasmapheresis for meningococcemia with disseminated intravascular coagulation. N Engl J Med. 1979;300(22):1277–8.
6. Vain NE, Mazlumian JR, Swarner OW, Cha CC. Role of exchange transfusion in the treatment of severe septicemia. Pediatrics. 1980;66(5):693–7.
7. Norska-Borowka I, Grzywna W, Monsiol A, Karczewska K, Godula-Stuglik
U. Usefulness of exchange transfusions in the treatment of septicemia complicated by intravascular coagulation in newborn infants. Pediatr Pol. 1980;55:943–9.
8. Bjorvatn B, Bjertnaes L, Fadnes HO, Flaegstad T, Gutteberg TJ, Kristiansen BE, Pape J, Rekvig OP, Osterud B, Aanderud L. Meningococcal septicaemia treated with combined plasmapheresis and leucapheresis or with blood exchange. Br Med J. 1984;288(6415):439–41.
9. Osterud B, Flaegstad T. Increased tissue thromboplastin activity in monocytes of patients with meningococcal infection: related to an unfavourable prognosis. Thromb Haemost. 1983;49(1):5–7.
10. Brandtzaeg P, Sirnes K, Folsland B, et al. Plasmapheresis in the treatment of severe meningococcal or pneumococcal septicaemia with DIC and fibrinolysis. Preliminary data on eight patients. Scand J Clin Lab Invest. 1985;178:53–5.
11. Ender LA, Lobakov AI, Lipats AA, Vatazin AV, Filizhanko VN. Plasmapheresis in the complex treatment of suppurative-septic complications of acute surgical diseases of the abdominal organs. Klin Med. 1985;63:98–101.
12. Drapkin MS, Wisch JS, Gelfand JA, Cannon JG, Dinarello CA. Plasmapheresis for fulminant meningococcemia. Pediatr Infect Dis J. 1989;8(6):399–400;
13. McClelland P, Williams PS, Yaqoob M, et al. Multiple organ failure—a role for plasma exchange? Intensive Care Med. 1990;16:100–3.
14. Janbon B, Vuillez JP, Carpentier F, Barnoud D, André-Poyaud P, Barbe G, Guignier M. Removal of circulating tumor necrosis factor. Its role in septic shock treatment. Ann Med Interne. 1992;143(Suppl 1):13–6.
15. Westendorp RG, Brand A, Haanen J, van Hinsbergh VW, Thompson J, van Furth R, Meinders EA. Leukaplasmapheresis in meningococcal septic shock. Am J Med. 1992;92(5):577–8. https://doi.org/10.1016/00029343(92)90761-y.
16. van Deuren M, Santman FW, van Dalen R, Sauerwein RW, Span LF, van der Meer JW. Plasma and whole blood exchange in meningococcal sepsis. Clin Infect Dis. 1992;15(3):424–30. https://doi.org/10.1093/clind/15.3.424.
17. Gårdlund B, Sjölin J, Nilsson A, Roll M, Wickerts CJ, Wikström B, Wretlind B. Plasmapheresis in the treatment of primary septic shock in humans. Scand J Infect Dis. 1993;25(6):757–61. https://doi.org/10.3109/00365 549309008575.
18. Churchwell KB, McManus ML, Kent P, Gorlin J, Galacki D, Humphreys D, Kevy SV. Intensive blood and plasma exchange for treatment of coagulopathy in meningococcemia. J Clin Apher. 1995;10(4):171–7. https://doi. org/10.1002/jca.2920100403.
19. Gårdlund B, Sjölin J, Nilsson A, Roll M, Wickerts CJ, Wretlind B. Plasma levels of cytokines in primary septic shock in humans: correlation with disease severity. J Infect Dis. 1995;172(1):296–301. https://doi.org/10. 1093/infdis/172.1.296.
20. Schött U, Björsell-Ostling E. Sonoclot coagulation analysis and plasma exchange in a case of meningococcal septicaemia. Can J Anaesth. 1995;42(1):64–8. https://doi.org/10.1007/BF03010573.
21. Haupt W, Fritzsche H, Hohenberger W, Zirngibl H. Selective cytokine release induced by serum and separated plasma from septic patients. Eur J Surg. 1996;162(10):769–76.
22. Mok Q, Butt W. The outcome of children admitted to intensive care with meningococcal septicaemia. Intensive Care Med. 1996;22(3):259–63. https://doi.org/10.1007/BF01712247.
23. Campbell WN, Joshi M, Sileo D. Osteonecrosis following meningococcemia and disseminated intravascular coagulation in an adult: case report and review. Clin Infect Dis. 1997;24(3):452–5. https://doi.org/10.1093/clini ds/24.3.452.
24. Kumar A, Kanagasundaram NS, Collyns TA, Davison AM. Plasma exchange and haemodiafiltration in fulminant meningococcal sepsis. Nephrol Dial Transplant. 1998;13(2):484–7. https://doi.org/10.1093/oxfordjournals.ndt. a027853.
25. Darmon M, Azoulay E, Thiery G, Ciroldi M, Galicier L, Parquet N, Veyradier A, Le Gall JR, Oksenhendler E, Schlemmer B. Time course of organ dysfunction in thrombotic microangiopathy patients receiving either plasma perfusion or plasma exchange. Crit Care Med. 2006;34(8):2127–33.
26. Nguyen TC, Han YY, Kiss JE, Hall MW, Hassett AC, Jaffe R, Orr RA, Janosky J, Carcillo JA. Intensive plasma exchange increases a disintegrin and metalloprotease with thrombospondin motifs-13 activity and reverses organ dysfunction in children with thrombocytopenia-associated multiple organ failure. Crit Care Med. 2008;36(10):2878–87.
27. Sevketoglu E, Yildizdas D, Horoz OO, Kihtir HS, Kendirli T, Bayraktar S, Carcillo JA. Use of therapeutic plasma exchange in children with thrombocytopenia-associated multiple organ failure in the Turkish thrombocytopenia-associated multiple organ failure network. Pediatr Crit Care Med. 2014;15(8):e354-359.
28. Hadem J, Hafer C, Schneider AS, Wiesner O, Beutel G, Fuehner T, Welte T, Hoeper MM, Kielstein JT. Therapeutic plasma exchange as rescue therapy in severe sepsis and septic shock: retrospective observational singlecentre study of 23 patients. BMC Anesthesiol. 2014;14:24. https://doi.org/10.1186/1471-2253-14-24.
29. De Simone N, Racsa L, Bevan S, Matevosyan K, Valley T, Girod C, Sarode R. Therapeutic plasma exchange in the management of sepsis and multiple organ dysfunction syndrome: a report of three cases. J Clin Apher. 2014;29(2):127–31. https://doi.org/10.1002/jca.21296.
30. Kawai Y, Cornell TT, Cooley EG, Beckman CN, Baldridge PK, Mottes TA, Luckritz KE, Plomaritas KS, Meade JM, Odetola FO, Han YY, Blatt NB, Annich GM. Therapeutic plasma exchange may improve hemodynamics and organ failure among children with sepsis-induced multiple organ dysfunction syndrome receiving extracorporeal life support. Pediatr Crit Care Med. 2015;16(4):366–74. https://doi.org/10.1097/PCC.0000000000 000351.
31. Stegmayr BG. Plasmapheresis in severe sepsis or septic shock. Blood Purif. 1996;14(1):94–101. https://doi.org/10.1159/000170250.
32. Stegmayr BG. Apheresis as therapy for patients with severe sepsis and multiorgan dysfunction syndrome. Ther Apher. 2001;5(2):123–7. https:// doi.org/10.1046/j.1526-0968.2001.005002123.x.
33. Stegmayr B. Apheresis in patients with severe sepsis and multi organ dysfunction syndrome. Transfus Apher Sci. 2008;38(3):203–8. https://doi. org/10.1016/j.transci.2008.03.009.
34. Garbero E, Livigni S, Ferrari F, Finazzi S, Langer M, Malacarne P, Meca MCC, Mosca S, Olivieri C, Pozzato M, Rossi C, Tavola M, Terzitta M, Viaggi B, Bertolini G. GiViTI High dose coupled plasma filtration and adsorption in septic shock patients. Results of the COMPACT-2: a multicentre, adaptive, randomised clinical trial. Intensive Care Med. 2021;47(11):1303–11. https://doi.org/10.1007/s00134-021-06501-3.
35. Reeves JH, Butt WW, Shann F, Layton JE, Stewart A, Waring PM, Presneill JJ. Continuous plasmafiltration in sepsis syndrome. Plasmafiltration in Sepsis Study Group. Crit Care Med. 1999;27(10):2096–104.
36. Busund R, Koukline V, Utrobin U, Nedashkovsky E. Plasmapheresis in severe sepsis and septic shock: a prospective, randomised, controlled trial. Intensive Care Med. 2002;28(10):1434–9. https://doi.org/10.1007/ s00134-002-1410-7.
37. Zhou F, Peng Z, Murugan R, Kellum JA. Blood purification and mortality in sepsis: a meta-analysis of randomized trials. Crit Care Med. 2013;41(9):2209–20.
38. Rimmer E, Houston BL, Kumar A, Abou-Setta AM, Friesen C, Marshall JC, Rock G, Turgeon AF, Cook DJ, Houston DS, Zarychanski R. The efficacy and safety of plasma exchange in patients with sepsis and septic shock: a systematic review and meta-analysis. Crit Care. 2014;18(6):699. https://doi. org/10.1186/s13054-014-0699-2.
39. Putzu A, Schorer R, Lopez-Delgado JC, Cassina T, Landoni G. Blood purification and mortality in sepsis and septic shock: a systematic review and meta-analysis of randomized trials. Anesthesiology. 2019;131(3):580–93. https://doi.org/10.1097/ALN.0000000000002820.
40. Snow TAC, Littlewood S, Corredor C, Singer M, Arulkumaran N. Effect of extracorporeal blood purification on mortality in sepsis: a meta-analysis and trial sequential analysis. Blood Purif. 2021;50(4–5):462–72. https://doi. org/10.1159/000510982.
41. Prakash S, Sahu A, Routray SS, Maiti R, Mitra JK, Mukherjee S. Efficacy of therapeutic plasma exchange in severe COVID-19 disease: a meta-analysis. Vox Sang. 2023;118(1):49–58. https://doi.org/10.1111/vox.13367.
42. Connelly-Smith L, Alquist CR, Aqui N, Hofmann J, Klingel R, Onwuemene O, Patriquin C, Pham H, Sanchez A, Schneiderman J, Witt V, Zantek N, Dunbar N. Guidelines on the use of therapeutic apheresis in clinical practice–evidence-based approach from the writing committee of the American society for apheresis: the ninth special issue. J Clin Apher. 2023;38(2):77–278. https://doi.org/10.1002/jca.22043.
43. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, Shamseer L, Tetzlaff JM, Akl EA, Brennan SE, Chou R, Glanville J, Grimshaw JM, Hróbjartsson A, Lalu MM, Li T, Loder EW, Mayo-Wilson E, McDonald S, McGuinness LA, Stewart LA, Thomas J, Tricco AC, Welch VA, Whiting P, Moher D. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ. 2021;372:71. https://doi.org/10.1136/bmj. n71.
44. Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, Savovic J, Schulz KF, Weeks L, Sterne JA, Cochrane Bias Methods Group, Cochrane Statistical Methods Group. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011;343:5928.
45. Sterne JA, Hernán MA, Reeves BC, Savović J, Berkman ND, Viswanathan M, Henry D, Altman DG, Ansari MT, Boutron I, Carpenter JR, Chan AW, Churchill R, Deeks JJ, Hróbjartsson A, Kirkham J, Jüni P, Loke YK, Pigott TD, Ramsay CR, Regidor D, Rothstein HR, Sandhu L, Santaguida PL, Schünemann HJ, Shea B, Shrier I, Tugwell P, Turner L, Valentine JC, Waddington H, Waters E, Wells GA, Whiting PF, Higgins JP. ROBINS-I: a tool for assessing risk of bias in non-randomised studies of interventions. BMJ. 2016;355:i4919. https://doi.org/10.1136/bmj.i4919.
46. R Core Team (2023). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria, https:// www.R-project.org/.
47. Balduzzi S, Rücker G, Schwarzer G. How to perform a meta-analysis with R: a practical tutorial. Evid Based Ment Health. 2019;22:153–60.
48. McGuinness, LA robvis: An R package and web application for visualising risk-of-bias assessments. 2019, https://github.com/mcguinlu/robvis
49. Faqihi F, Alharthy A, Abdulaziz S, Balhamar A, Alomari A, AlAseri Z, Tamim H, Alqahtani SA, Kutsogiannis DJ, Brindley PG, Karakitsos D, Memish ZA. Therapeutic plasma exchange in patients with life-threatening COVID-19: a randomised controlled clinical trial. Int J Antimicrob Agents. 2021;57(5):106334. https://doi.org/10.1016/j.ijantimicag.2021.106334.
50. Weng J, Chen M, Fang D, Liu D, Guo R, Yang S. Therapeutic plasma exchange protects patients with sepsis-associated disseminated intravascular coagulation by improving endothelial function. Clin Appl Thromb Hemost. 2021. https://doi.org/10.1177/10760296211053313.
51. Stahl K, Wand P, Seeliger B, Wendel-Garcia PD, Schmidt JJ, Schmidt BMW, Sauer A, Lehmann F, Budde U, Busch M, Wiesner O, Welte T, Haller H, Wedemeyer H, Putensen C, Hoeper MM, Bode C, David S. Clinical and biochemical endpoints and predictors of response to plasma exchange in septic shock: results from a randomized controlled trial. Crit Care. 2022;26(1):134. https://doi.org/10.1186/s13054-022-04003-2
52. Stegmayr BG, Jakobson S, Rydvall A, Björsell-Ostling E. Plasma exchange in patients with acute renal failure in the course of multiorgan failure. Int J Artif Organs. 1995;18(1):45–52.
53. Stegmayr BG. Plasma exchange in patients with septic shock including acute renal failure. Blood Purif. 1996;14(1):102–8. https://doi.org/10.1159/ 000170251.
54. Hjorth V, Stenlund G. Plasmapheresis as part of the treatment for septic shock. Scand J Infect Dis. 2000;32(5):511–4. https://doi.org/10.1080/00365 5400458794.
55. Schmidt J, Mann S, Mohr VD, Lampert R, Firla U, Zirngibl H. Plasmapheresis combined with continuous venovenous hemofiltration in surgical patients with sepsis. Intensive Care Med. 2000;26(5):532–7. https://doi. org/10.1007/s001340051200.
56. Ataman K, Jehmlich M, Kock S, Neumann S, Leischik M, Filipovic Z, Hopf HB. Short-term cardiovascular effects of plasmapheresis in norepinephrine-refractory septic shock. Intensive Care Med. 2002;28(8):1164–7. https://doi.org/10.1007/s00134-002-1375-6.
57. Stegmayr BG, Banga R, Berggren L, Norda R, Rydvall A, Vikerfors T. Plasma exchange as rescue therapy in multiple organ failure including acute renal failure. Crit Care Med. 2003;31(6):1730–6. https://doi.org/10.1097/01. CCM.0000064742.00981.14.
58. Knaup H, Stahl K, Schmidt BMW, Idowu TO, Busch M, Wiesner O, Welte T, Haller H, Kielstein JT, Hoeper MM, David S. Early therapeutic plasma exchange in septic shock: a prospective open-label nonrandomized pilot study focusing on safety, hemodynamics, vascular barrier function, and biologic markers. Crit Care. 2018;22(1):285. https://doi.org/10.1186/ s13054-018-2220-9.
59. Keith PD, Wells AH, Hodges J, Fast SH, Adams A, Scott LK. The therapeutic efficacy of adjunct therapeutic plasma exchange for septic shock with multiple organ failure: a single-center experience. Crit Care. 2020;24(1):518. https://doi.org/10.1186/s13054-020-03241-6.
60. Ahmed RM, Soliman AR, Yousry A, Marzouk K, Faris F. Efficacy of 4-hour rescue therapeutic plasma exchange in severe septic shock patients. Rom J Intern Med. 2020;58(2):75–80. https://doi.org/10.2478/rjim-2019-0026.
61. Gucyetmez B, Atalan HK, Sertdemir I, Cakir U, Telci L, COVID-19 Study Group. Therapeutic plasma exchange in patients with COVID-19 pneumonia in intensive care unit: a retrospective study. Crit Care. 2020;24(1):492. https://doi.org/10.1186/s13054-020-03215-8.
62. Khamis F, Al-Zakwani I, Al Hashmi S, Al Dowaiki S, Al Bahrani M, Pandak N, Al Khalili H, Memish Z. Therapeutic plasma exchange in adults with severe COVID-19 infection. Int J Infect Dis. 2020;99:214–8
63. Kamran SM, Mirza ZE, Naseem A, Liaqat J, Fazal I, Alamgir W, Saeed F, Saleem S, Nisar S, Yousaf MA, Khan AZ, Hussain M, Azam R, Hussain M, Khan KA, Jamal Y, Iftikhar R. Therapeutic plasma exchange for coronavirus disease-2019 triggered cytokine release syndrome; a retrospective propensity matched control study. PLoS ONE. 2021;16(1): e0244853. https:// doi.org/10.1371/journal.pone.0244853.
64. Jaiswal V, Nasa P, Raouf M, Gupta M, Dewedar H, Mohammad H, Al Rais Z, Ali Baqer M, Alsabbah A, Ibrahim Y, Salem M, Shammass D, Marashi M. Therapeutic plasma exchange followed by convalescent plasma transfusion in critical COVID-19-An exploratory study. Int J Infect Dis. 2021;102:332–4. https://doi.org/10.1016/j.ijid.2020.10.085.
65. Peters JL, Sutton AJ, Jones DR, Abrams KR, Rushton L. Comparison of two methods to detect publication bias in meta-analysis. JAMA. 2006;295(6):676–80. https://doi.org/10.1001/jama.295.6.676.
66. Lee OPE, Kanesan N, Leow EH, Sultana R, Chor YK, Gan CS, Lee JH. Survival benefits of therapeutic plasma exchange in severe sepsis and septic shock: a systematic review and meta-analysis. J Intensive Care Med. 2023;38(7):598–611. https://doi.org/10.1177/08850666231170775.
67. Zhang L, Yan X, Fan Q, Liu H, Liu X, Liu Z, Zhang Z. D-dimer levels on admission to predict in-hospital mortality in patients with Covid-19. J Thromb Haemost. 2020;18:1324–9.
68. Chen JJ, Lai PC, Lee TH, Huang YT. Blood purification for adult patients with severe infection or sepsis/septic shock: a network meta-analysis of randomized controlled trials. Crit Care Med. 2023. https://doi.org/10. 1097/CCM.0000000000005991.
69. Yan D, Yao R, Xie X, Fu X, Pei S, Wang Y, Xu D, Li N. The therapeutic efficacy of plasmapheresis for sepsis with multiple organ failure: a propensity score-matched analysis based on the MIMIC-IV database. Shock. 2023. https://doi.org/10.1097/SHK.0000000000002254.
70. Rock G, Weber V, Stegmayr B. Therapeutic plasma exchange (TPE) as a plausible rescue therapy in severe vaccine-induced immune thrombotic thrombocytopenia. Transfus Apher Sci. 2021;60(4):103174. https://doi. org/10.1016/j.transci.2021.103174.
71. Momen-Heravi F. Isolation of extracellular vesicles by ultracentrifugation. Methods Mol Biol. 2017;1660:25–32. https://doi.org/10.1007/ 978-1-4939-7253-1_3.
72. Stegmayr B, Abdel-Rahman EM, Balogun RA. Septic shock with multiorgan failure: from conventional apheresis to adsorption therapies. Semin Dial. 2012;25:171–5.
73. Fujimura Y, Holland LZ. COVID-19 microthrombosis: unusually large VWF multimers are a platform for activation of the alternative complement pathway under cytokine storm. Int J Hematol. 2022;115(4):457–69. https://doi.org/10.1007/s12185-022-03324-w.
74. Nedeva C, Menassa J, Puthalakath H. Sepsis: inflammation is a necessary evil. Front Cell Dev Biol. 2019;7:108.
75. Helms J, Tacquard C, Severac F, Leonard-Lorant I, Ohana M, Delabranche X, Merdji H, Clere-Jehl R, Schenck M, Fagot Gandet F, Fafi-Kremer S, Castelain V, Schneider F, Grunebaum L, Anglés-Cano E, Sattler L, Mertes PM, Meziani F, CRICS TRIGGERSEP Group. High risk of thrombosis in patients with severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med. 2020;46:1089–98.
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 07.02.2024
[ACTIVE_FROM] => 07.02.2024
[SHOW_COUNTER] => 640
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2017-07-31 16:04:44
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829316
[VALUE] => сепсис, сепсис-индуцированная органная дисфункция, терапевтический плазмаобмен, COVID-19, краткосрочная летальность
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => сепсис, сепсис-индуцированная органная дисфункция, терапевтический плазмаобмен, COVID-19, краткосрочная летальность
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2017-08-02 11:16:15
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829318
[VALUE] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2017-08-02 11:18:27
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829317
[VALUE] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829335
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2017-09-15 12:05:50
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2017-09-19 10:40:01
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2017-08-22 15:43:39
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829325
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2017-08-22 16:30:23
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2017-08-23 10:51:22
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2017-08-23 11:05:12
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829320
[1] => 829321
[2] => 829322
[3] => 829323
[4] => 829324
)
[VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => intensivnayaterapiya
[3] => plazmoobmen
[4] => poliorgannaya disfunktsiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => intensivnayaterapiya
[3] => plazmoobmen
[4] => poliorgannaya disfunktsiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2017-10-12 14:43:36
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2018-05-11 11:01:14
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829335
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829325
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829320
[1] => 829321
[2] => 829322
[3] => 829323
[4] => 829324
)
[VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => intensivnayaterapiya
[3] => plazmoobmen
[4] => poliorgannaya disfunktsiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => intensivnayaterapiya
[3] => plazmoobmen
[4] => poliorgannaya disfunktsiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Сепсис
[2] => Интенсивная терапия
[3] => Плазмообмен
[4] => Полиорганная дисфункция
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 26.08.2022 14:38:28
[~TIMESTAMP_X] => 26.08.2022 14:38:28
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
[BROWSER_TITLE] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
[KEYWORDS] => сепсис, сепсис-индуцированная органная дисфункция, терапевтический плазмаобмен, COVID-19, краткосрочная летальность
[DESCRIPTION] => Влияние терапевтического плазмообмена на краткосрочную летальность критически больных взрослых пациентов с сепсис-индуцированной органной дисфункцией: систематический обзор и мета-анализ
)
)






