Array
(
[NAME] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
[~NAME] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
[PREVIEW_PICTURE] => Array
(
[ID] => 5437
[TIMESTAMP_X] => 22.11.2023 23:12:43
[MODULE_ID] => iblock
[HEIGHT] => 706
[WIDTH] => 1000
[FILE_SIZE] => 49430
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/c75/bmdo0s31qnjofgmnc6sm1pwxiwjg0qb3
[FILE_NAME] => close-up-finger-pressing-virtual-button.jpg
[ORIGINAL_NAME] => close-up-finger-pressing-virtual-button.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 78c9083daa73ce631d21e84f0f07c252
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/c75/bmdo0s31qnjofgmnc6sm1pwxiwjg0qb3/close-up-finger-pressing-virtual-button.jpg
[UNSAFE_SRC] => /upload/iblock/c75/bmdo0s31qnjofgmnc6sm1pwxiwjg0qb3/close-up-finger-pressing-virtual-button.jpg
[SAFE_SRC] => /upload/iblock/c75/bmdo0s31qnjofgmnc6sm1pwxiwjg0qb3/close-up-finger-pressing-virtual-button.jpg
[ALT] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
[TITLE] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
)
[~PREVIEW_PICTURE] => 5437
[DETAIL_TEXT] =>
Marek Wełna, Barbara Adamik, Andrzej Kübler and Waldemar Goz´dzikThe NUTRIC Score as a Tool to Predict Mortality and Increased Resource Utilization in Intensive Care Patients with Sepsis
Nutrients. 2023, 15, 1648.Абстракт
Шкала нутриционного риска в критическом состоянии (NUTRIC) является важным инструментом оценки нутритивного риска для пациентов в отделении интенсивной терапии (ОИТ). Цель этого исследования состояла в том, чтобы оценить способность шкалы прогнозировать смертность у пациентов, получавших лечение по поводу сепсиса, а также прогнозировать повышенное использование ресурсов и сестринскую нагрузку в ОИТ. Шкала NUTRIC предсказывала смертность (AUC 0,833, p < 0,001) с оптимальным пороговым значением 6 баллов. Среди пациентов с оценкой ≥ 6 при поступлении в ОИТ 28-дневная смертность составила 61%, а с оценкой < 6 — 10 % (p < 0,001). Кроме того, балл NUTRIC ≥6 был связан с более интенсивным использованием ресурсов ОРИТ, о чем свидетельствует более высокая доля пациентов, нуждающихся в инфузии вазопрессоров (98 против 82%), искусственной вентиляции легких (99 против 87%), заместительной терапии при почечной недостаточности (54 против 26%), стероиды (68 против 31%) и продуктов крови (60 против 43%); рабочая нагрузка медсестер также была значительно выше в этой группе. В заключение следует отметить, что оценка NUTRIC, полученная при поступлении в ОИТ, обеспечивает хорошую дискриминационную ценность для смертности и позволяет выявить пациентов, которым в конечном итоге потребуется интенсивное использование ресурсов ОИТ и связанное с этим увеличение рабочей нагрузки на медсестер во время лечения.
Ключевые слова: интенсивная терапия; сепсис; питание; предсказание смертности
1. Введение
Шкала NUTRIC является инструментом оценки риска. Она был разработан для использования у пациентов, находящихся на лечении в ОИТ, чтобы помочь выявить тех, кому нутриционная терапия принесет наибольшую пользу [1]. Польза от использования шкалы оценивается путем расчета изменения выживаемости; более низкий балл NUTRIC связан с более низкой смертностью, что было подтверждено в различных группах, включая пациентов с COVID-19 в критическом состоянии [2,3], пациентов на ИВЛ [4,5] пациентов после кардиоторакальной хирургии, находящихся на лечении в реабилитационном отделении [6], а также и у больных с тяжелой внебольничной пневмонией [7]. Концептуальная модель, использованная для разработки шкалы NUTRIC, была сложной и состояла из параметров, описывающих хроническое и острое воспаление, возраст, общую клиническую оценку, оценку органной недостаточности и маркеры острого и хронического голодания. Модель прошла внешнюю валидацию, и хорошая дискриминация подтвердила ее прогностическую способность [8]. Несколько дальнейших исследований показали связь между оценкой NUTRIC и смертностью в ОИТ, и было замечено, что особенно пациенты с высокими показателями NUTRIC могут получить пользу от оптимального питания, тем самым улучшая выживаемость. [9–11].
Валидацию шкалы NUTRIC можно увидеть, прежде всего, по влиянию на 28-дневную смертность или потребность в длительной ИВЛ у пациентов в ОИТ [1,12]. Однако взаимосвязь между оценкой и необходимостью использования других ресурсов ОИТ не оценивалась. Группа пациентов, которым требуется гораздо большее использование ресурсов во время пребывания в ОИТ/стационаре, — это пациенты с сепсисом [13,14]. Анализ, проведенный Jones et al. показал, что пациенты, госпитализированные по поводу сепсиса, потребляли значительно больше ресурсов стационара в течение 12-месячного периода по сравнению с пациентами, госпитализированными по поводу других заболеваний, кроме сепсиса [15]. Полный доступ к больничным ресурсам чрезвычайно важен в условиях быстрой и неожиданной перегрузки ОИТ, которая наблюдалась во время пандемии COVID-19. Однако неуклонный рост потребностей в ресурсах ОИТ был задокументирован еще до глобальной пандемии COVID-19 [16]. Было замечено, что основными факторами растущего спроса на интенсивную терапию являются старение населения, увеличение количества и сложности хирургических вмешательств, внедрение новых методов лечения и растущие ожидания общества в отношении доступности и эффективности здравоохранения на основе улучшенных результаты. Поэтому дополнительный прогностический инструмент может быть полезен для более эффективного использования ресурсов в ОИТ. Взаимосвязь между оценкой NUTRIC и необходимостью использования большего количества ресурсов ОИТ для госпитализированных пациентов с сепсисом не оценивалась.
Цель данного исследования состояла в том, чтобы оценить силу шкалы NUTRIC в прогнозировании 28-дневной летальности у пациентов с сепсисом, поскольку худший прогноз при поступлении может быть связан с необходимостью более интенсивного использования ресурсов ОИТ и, соответственно, большей нагрузкой на сестринский персонал. Мы предположили, что оценка NUTRIC может иметь дополнительное применение в качестве инструмента для прогнозирования увеличения использования ресурсов в ОИТ.
2. Материалы и методы
2.1. Популяция пациентов
Это исследование было вторичным анализом проспективно собранных данных из базы данных регистра сепсиса. База данных была построена с использованием клинических и демографических данных пациентов, лечившихся в смешанном ОИТ на 25 коек, оказывающем помощь в университетской больнице на 996 коек. В исследование были включены взрослые (старше 18 лет) пациенты с диагнозом сепсис или септический шок, госпитализированные с января по декабрь 2014 г. Критериями исключения были повторная госпитализация в ОРИТ или пребывание в ОРИТ менее 24 часов. В течение периода исследования в общей сложности 332 последовательных пациента, поступивших в ОИТ были проверены на соответствие критериям включения/исключения. В общей сложности 156 пациентов соответствовали критериям включения. Было 10 случаев неполных данных, поэтому 146 пациентов были включены в окончательный анализ.
2.2. Этика
Исследование было одобрено локальным комитетом по этике Вроцлавского медицинского университета, номер одобрения KB 23/2015, и соответствует Хельсинкской декларации. От необходимости получения информированного согласия отказались в связи с ретроспективным наблюдательным характером исследования.
2.3. Ведение пациентов и сбор данных
Все пациенты в исследовании получали стандартное лечение сепсиса или септического шока в соответствии с рекомендациями кампании Surviving Sepsis Campaign, которые использовались в то время в ОИТ [17]. Не менее трех специалистов по анестезиологии и реаниматологии и четыре ординатора оказывали помощь пациентам ОИТ в дневные смены с 7 до 15 часов. Позже помощь оказывали один специалист по анестезиологии-реаниматологии и два ординатора. Соотношение медсестра/пациент составляло 1:1 или 1:2 в зависимости от стабильности пациента. Для целей данного исследования критерии SEPSIS-III были ретроспективно применены к базе данных регистра сепсиса [18].
В связи с отсутствием информации о IL-6 в базе данных для расчетов использовалась ранее валидированная модифицированная версия шкалы (оценка mNUTRIC) [1]. Следующие данные, собранные в базе данных регистра сепсиса, использовались для расчета показателя mNUTRIC в настоящем исследовании: возраст, исходный показатель оценки по шкале APACHE II и SOFA, количество сопутствующих заболеваний и дней от госпитализации до поступления в ОИТ. Оценка mNUTRIC рассчитывалась при поступлении в ОИТ. Оценки APACHE II и SOFA были рассчитаны в соответствии с исходными публикациями [19,20]. Обе шкалы обычно используются для оценки тяжести клинического состояния пациентов в ОИТ. Подробная система оценки, используемая для расчета оценки mNUTRIC, представлена в Table 1.
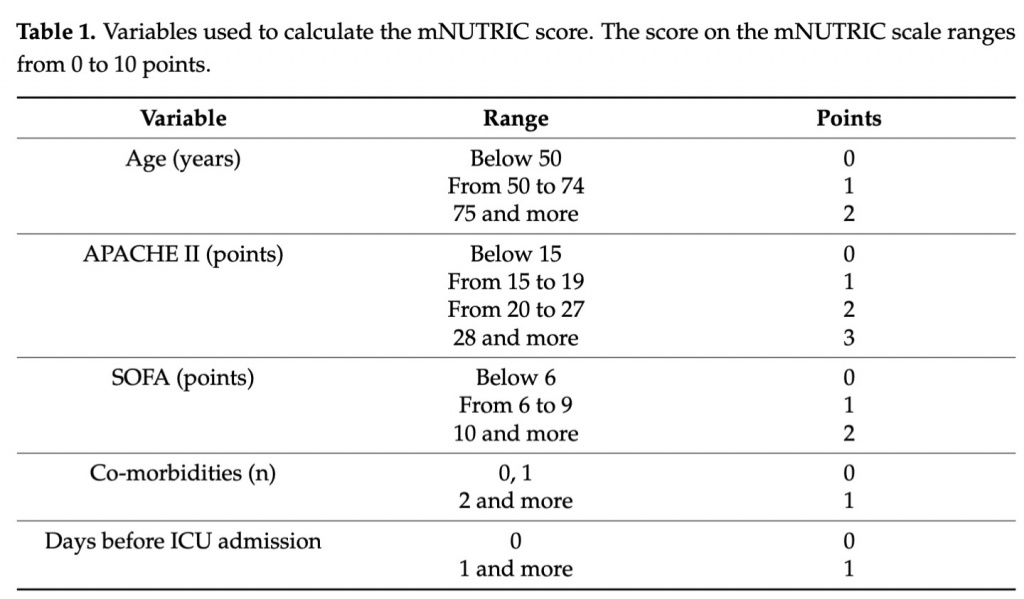
Кроме того, требования к лечению во время пребывания в ОИТ были зарегистрированы в базе данных, и ресурсоемкие вмешательства были в центре внимания этого анализа. Были отмечены следующие процедуры ведения каждого пациента во время пребывания в ОРИТ: инфузионная терапия и вазоактивные препараты; ИВЛ; заместительная почечная терапия; диетотерапия; введение кортикостероидов, антикоагулянтов и препаратов крови; контроль уровня глюкозы; и хирургия. Количественная оценка ежедневной сестринской нагрузки для каждого пациента была рассчитана с использованием Therapeutic Intervention Scoring System-28 (TISS-28), а среднее значение индекса было записано в базу данных. В нашем ОИТ шкала TISS-28 обычно используется в качестве системы оценки нагрузки на медсестер [21].
2.4. Статистический анализ
Описательная статистика включала медиану (межквартильный размах) для количественных переменных и частоту (в процентах) для качественных переменных. В базе не было пропущенных данных. Для сравнения непрерывных переменных между исследуемыми группами использовался Т-критерий Стьюдента. Категориальные переменные анализировались с помощью критерия хи-квадрат, а таблицы сопряженности использовались для анализа частотного распределения категориальных переменных. ROC-анализ использовался для измерения способности оценки NUTRIC различать смерть и выживших путем расчета площади под кривой (AUC), включая 95% доверительные интервалы (ДИ), для определения чувствительности и специфичности; результаты статистики Younden показали оптимальное пороговое значение для оценки NUTRIC. Кривые Каплана-Мейера и критерий логарифмического ранга использовались для оценки различий в функциях 28-дневной выживаемости на основе значения показателя NUTRIC. Однофакторная логистическая регрессия была выполнена для сравнения прогностической способности клинических шкал (NUTRIC, APACHE II и SOFA) для прогнозирования 28-дневной смертности; результаты были представлены как отношение шансов (ОШ) с 95% доверительными интервалами (ДИ).
Для создания модели, предсказывающей 28-дневную смертность, был проведен многофакторный логистический регрессионный анализ. Связь между оценкой NUTRIC и выбранными ковариантами (пол, сопутствующие заболевания, уровень лактата, уровень прокальцитонина, гипогликемия, потребность в заместительной почечной терапии и респираторной поддержке, положительная культура крови, время до начала антибиотикотерапии) и смертностью оценивали; результаты были представлены как отношение шансов (ОШ) с 95% доверительными интервалами (ДИ). Весь статистический анализ был проведен с помощью Statistica, версия 13 (StatSoft Inc., Tulsa, OK, USA ). Значение p <0,05 считалось статистически значимым.
3. Результаты
3.1. Образец исследования
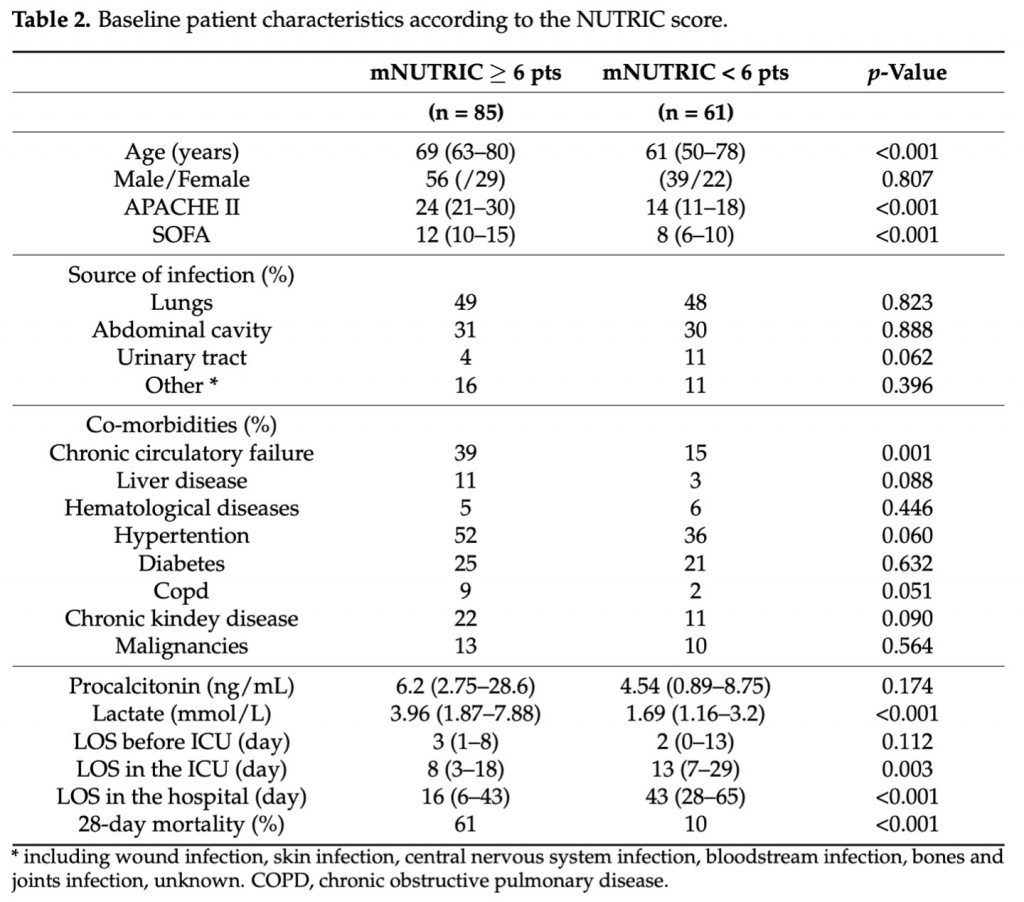
В течение периода исследования в общей сложности 332 последовательных пациента, поступивших в ОИТ, были проверены на соответствие критериям включения/исключения. Из них 156 пациентов соответствовали критериям включения. Из-за неполных данных в окончательный анализ были включены 146 пациентов. Средний возраст в выборке составлял 66 лет (межквартильный интервал 58–77 лет), и большинство пациентов были мужчинами (n = 95, 65%). Из 146 зарегистрированных пациентов с сепсисом у 129 (88%) был септический шок при поступлении в ОИТ. Основными причинами сепсиса и септического шока были пневмония (49%), внутрибрюшная инфекция (35%) и инфекция мочевыводящих путей (7%). Пациенты были переведены из общих палат (48%), операционной (38%), отделения неотложной помощи (7%), других больниц (6%) и палат интенсивной терапии (1%). Большинство пациентов поступили в критическом состоянии с медианой баллов по шкале SOFA, рассчитанной в 1-е сутки, на уровне 10 баллов (IQR 7–13) и с оценкой по шкале APACHEII 21 балла (IQR 15–27). Тяжесть клинического состояния больных также отражалась в высокой доле случаев недостаточности четырех и более органов, диагностированных при поступлении в ОРИТ (51%). Медиана пребывания в ОИТ составила 10 дней (IQR 4–23), а пребывание в больнице — 32 дня (IQR 11–55). Исходные характеристики пациентов представлены в Table 2.
3.2. Оптимальная точка отсечения для mNUTRIC
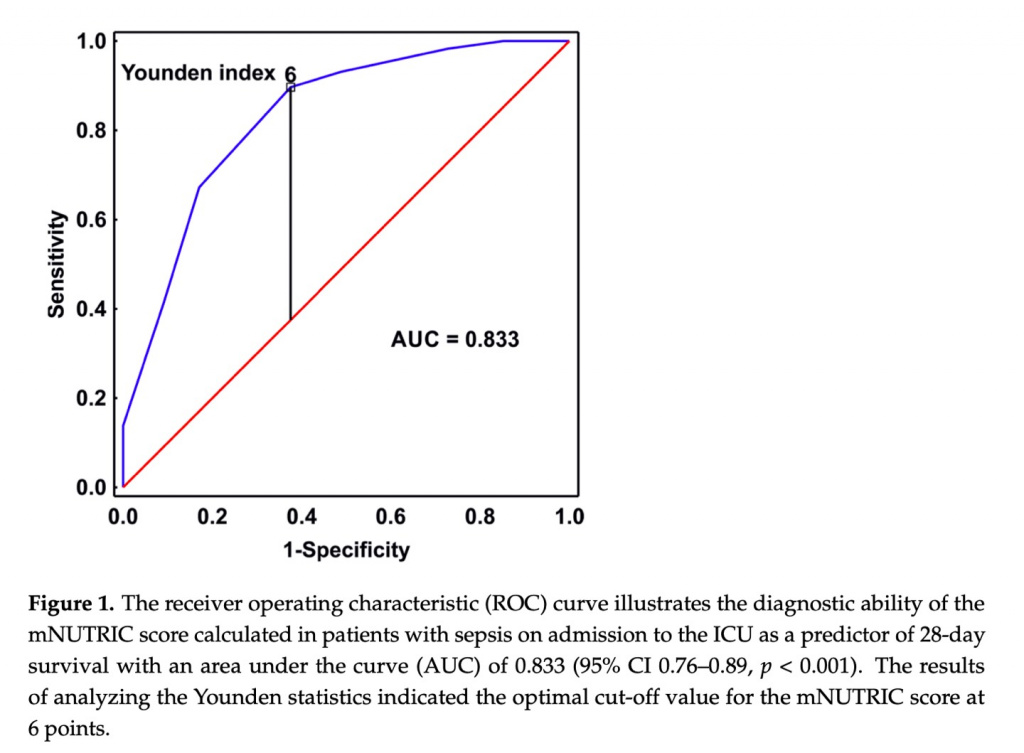
Во-первых, мы оценили прогностическую эффективность шкалы mNUTRIC для 28-дневной смертности. Оценка mNUTRIC представляет собой 9-балльную шкалу. При анализе ROC-кривой оценка mNUTRIC, рассчитанная при поступлении в ОИТ, позволяла прогнозировать 28-дневную смертность с AUC 0,833 (95% ДИ 0,76–0,89, p <0,001). Это показано на Figure 1. Оптимальное пороговое значение для оценки mNUTRIC составило 6 баллов с чувствительностью 90% и специфичностью 63%, и эта точка использовалась для разделения исследуемой выборки для дальнейшего анализа, т.е. группа пациентов с оценкой mNUTRIC 6 баллов и группа с оценкой mNUTRIC < 6 баллов. Среди пациентов с оценкой mNUTRIC 6 при поступлении в ОИТ 28-дневная смертность составила 61%, а с оценкой < 6 — 10 % (p < 0,001).
3.3 Прогностическая сила . mNUTRIC
Затем был проведен односторонний логистический регрессионный анализ для сравнения прогностической способности клинических шкал, рассчитанных при поступлении в ОИТ. mNUTRIC прогнозировал 28-дневную смертность с отношением шансов 2,24 (95% ДИ 1,71–2,95, p < 0,001), только APACHE II с ОШ 1,21 (95% ДИ 1,13–1,29, p < 0,001) и только SOFA с ОШ 1,43 (95% ДИ 1,26–1,63, р <0,001)
3.4. Характеристика групп пациентов в соответствии с оптимальной пороговой точкой шкалы mNUTRIC.
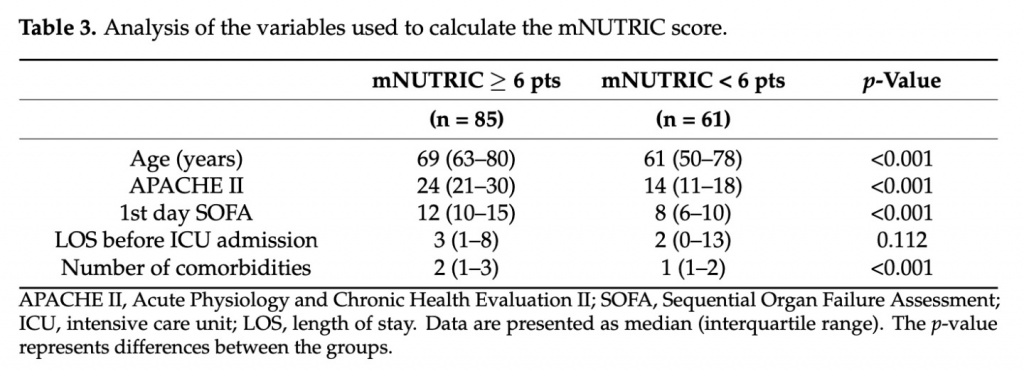
На основании результатов анализа ROC-кривой и результатов статистики Younden выборка исследования была разделена на 1-ю группу (пациенты с оценкой mNUTRIC < 6 баллов, n = 61) и 2-ю группу (пациенты с оценкой mNUTRIC 6 баллов , n = 85). В группе mNUTRITIC < 6 мужчин было 64%, а в группе mNUTRITIC 6 — 66% (p = 0,807). Анализ переменных, использованных для расчета показателя mNUTRIC, показан в Table 3.
3.5. Ведение пациентов
Участие медсестер в процессе ухода за больными оценивали с помощью индекса TISSS-28, и полученные результаты свидетельствовали о том, что рабочая нагрузка сестринского персонала была значительно выше в группе с оценкой mNUTRIC 6 баллов по сравнению с оценкой mNUTRIC <6 баллов (TISS-28: 36 баллов, IQR 33–40 против 31 балла, IQR 28–34, p < 0,001). У пациентов с оценкой mNUTRIC 6 баллов септический шок был диагностирован в 96% случаев, а при mNUTRIC < 6 баллов — в 78% (р = 0,001). Инфузионная терапия использовалась у большинства пациентов в обеих группах (p = 0,154), а вазопрессоры пришлось назначать почти всем пациентам с оценкой mNUTRIC 6 баллов (98%) и в 82% случаев с оценкой mNUTRIC < 6 баллов ( р = 0,001). ИВЛ и ЗПТ чаще применялись при лечении пациентов с оценкой mNUTRIC6 баллов, чем в случаях с оценкой mNUTRIC < 6 баллов (99 против 82% и 54 против 26% соответственно). Терапия стероидами требовалась более, чем в два раза чаще в группе с mNUTRIC 6 баллов по сравнению с mNUTRIC < 6 баллов (68 против 31%), а потребность в препаратах крови также была значительно выше (60 против 43%). ). В Table 4 сравнивается частота различных требований к лечению в день поступления в ОИТ.
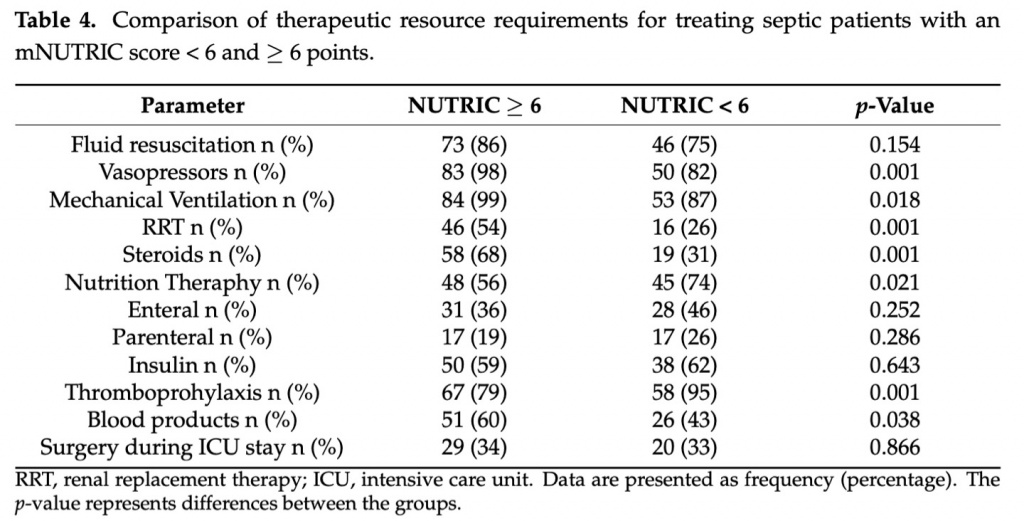
3.6. Ведение пациентов
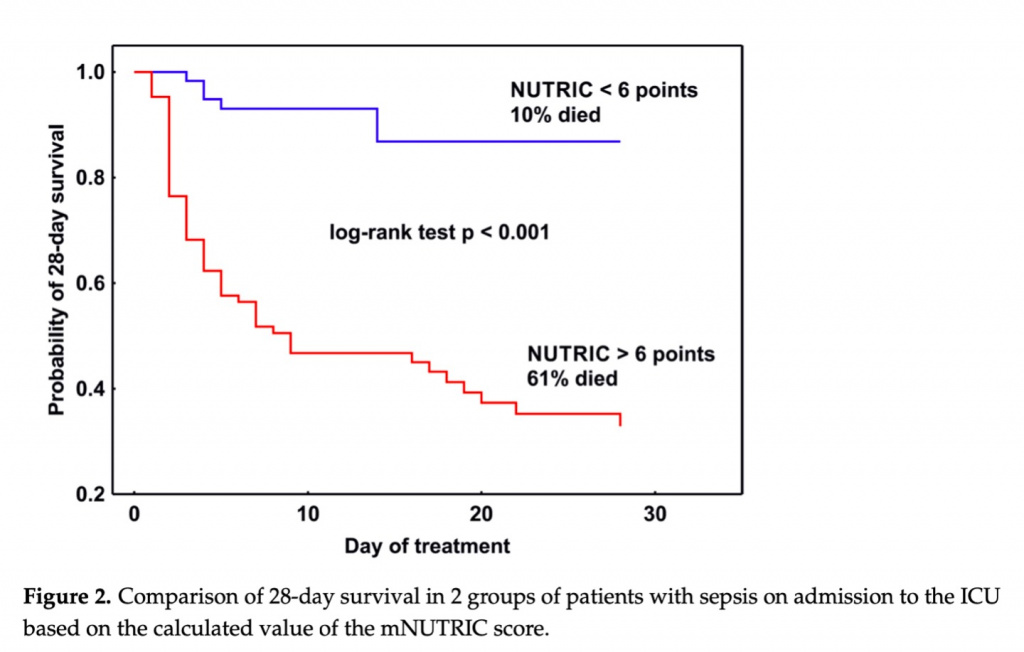
28-дневная летальность всей исследуемой группы составила 40%. Среди умерших пациентов оценка NUTRIC, рассчитанная при поступлении в ОИТ, в 90% случаев составила 6 баллов. Медиана оценки mNUTRIC у выживших пациентов составила 4 балла (IQR 3-6), а у не выживших - 7 (IQR 6-8). Анализ 28-дневной выживаемости по методу Каплана-Мейера показал, что между группами с оценкой mNUTRIC < 6 и 6 баллов существует статистическая значимость (p < 0,001, log-rank test), (Figure 2).
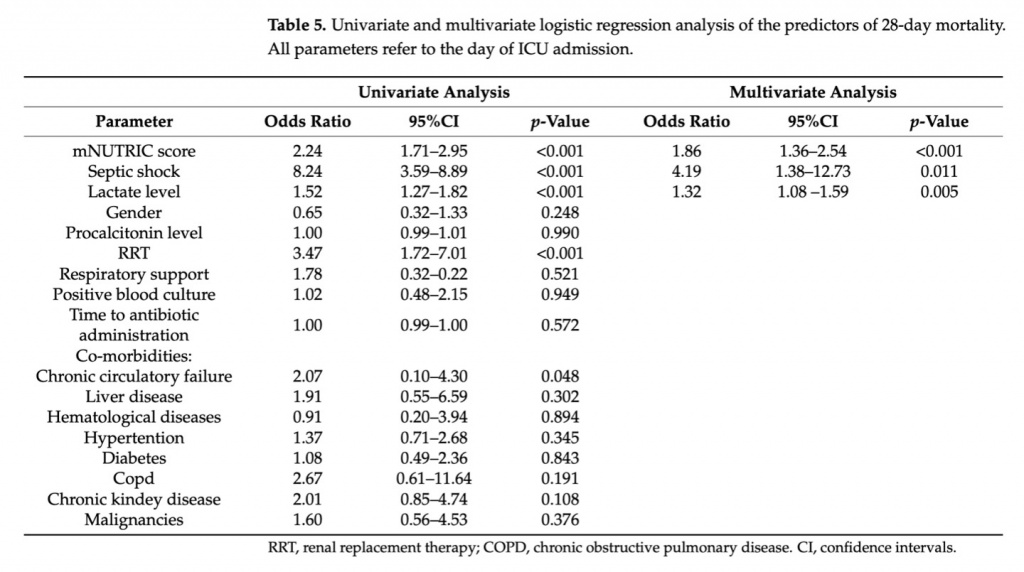
Кроме того, для создания модели прогнозирования 28-дневной летальности был проведен многомерный логистический регрессионный анализ. Обратный выбор модели определял выбор переменных из набора параметров, оцениваемых при поступлении в ОИТ (балл mNUTRIC, пол, уровень лактата, уровень прокальцитонина, необходимость ЗПТ, необходимость респираторной поддержки, положительная культура крови, время до введения антибиотиков, сопутствующие заболевания). Базовый балл mNUTRIC (OR = 1,86; 95%CI 1,36-2,54), наличие септического шока при поступлении в ОИТ (OR = 4,19; 95%CI 1,38-12,73) и уровень лактата (OR = 1,32; 95%CI 1,08-1,59) были значимыми предикторами 28-дневной летальности; другие параметры в модель не вошли. Результаты представлены в Table 5.
4. Дискуссия
Результаты нашего исследования показали, что в популяции пациентов с сепсисом те, кто имел 6 баллов по mNUTRIC при поступлении в ОИТ, имели значительно более низкие шансы на выживание. Кроме того, показатель mNUTRIC 6 был связан с более интенсивным использованием ресурсов ОИТ, о чем свидетельствует значительно более высокая доля случаев, требующих ИВЛ, ЗПТ и вазопрессорной поддержки. Стероидная терапия также требовалась более чем в два раза чаще в группе с mNUTRIC 6 баллов, и потребность в препаратах крови также была значительно выше. Сестринская нагрузка, определенная количественно по шкале TISS-28, была значительно выше в группе с оценкой mNUTRIC ≥ 6 баллов по сравнению с потребностью в уходе у пациентов с mNUTRIC < 6 баллов. Таким образом, уже при поступлении в ОРИТ можно было предположить, что лечение больного сепсисом с оценкой mNUTRIC 6 баллов потребует более интенсивного использования ресурсов ОРИТ. Насколько нам известно, это первое исследование по оценке использования ресурсов при лечении пациентов с сепсисом на основе шкалы mNUTRIC.
Шкала ьNUTRIC — это новый инструмент оценки риска, изначально разработанный для выявления пациентов, которые с большей вероятностью получат пользу от нутритивной поддержки в условиях ОИТ [1]. Концептуальная модель разработки шкалы NUTRIC включала маркеры-предикторы острого голодания, хронического голодания, острого и хронического воспаления [22]. В отличие от многих широко используемых оценок нутритивного риска, эта шкала была разработана специально для пациентов, госпитализированных в ОИТ [23–30]. Один потенциальный недостаток оценки mNUTRIC связан с характеристиками группы, которые использовались для разработки оценки; исследование было основано на относительно небольшой группе (n = 597), состоящей в основном из пациентов европеоидной расы (90%) [1]. Эти потенциальные недостатки были устранены в серии исследований, проведенных в различных географических регионах с привлечением более крупных групп пациентов разной расы и социального статуса [31].
Шкала mNUTRIC точно предсказывала 28-дневную смертность 1199 пациентов на ИВЛ в рандомизированном контрольном исследовании, проведенном в Канаде [8]. Аналогичная группа пациентов в критическом состоянии, нуждающихся в ИВЛ, была включена в исследование, проведенное в Аргентине, и полученные результаты подтвердили взаимосвязь между более высокой смертностью и повышенным показателем mNUTRIC [32]. Другое исследование в Португалии, в котором анализировались исходы 1143 взрослых пациентов ОИТ, также подтвердило вышеупомянутые результаты: высокий балл mNUTRIC был связан с более длительной госпитализацией, меньшим количеством дней без ИВЛ и более высокой 28-дневной смертностью [33].
Аналогичные выводы были сделаны в индийском исследовании, где были отмечены значительные различия между группами с высоким и низким уровнем NUTRIC с точки зрения смертности (p < 0,001), продолжительности пребывания в ОИТ (p < 0,014) и продолжительности ИВЛ (p < 0,001). [4]. Данные сингапурского исследования подтвердили связь высокого показателя mNUTRIC с госпитальной летальностью [34]. Эти результаты убедительно свидетельствуют о том, что шкала mNURTRIC при использовании в качестве предиктора смертности хорошо работает в когортах с разной расой и социальным статусом, изучаемых в разных географических регионах. Наше исследование также подтвердило более ранние наблюдения.
Основным практическим недостатком оригинальной шкалы NUTRIC было включение в нее концентрации интерлейкина 6, поскольку этот параметр обычно не измеряется у пациентов ОИТ и часто недоступен в больничных базах данных. Поэтому позже был предложен модифицированный вариант шкалы (mNUTRIC), не учитывающий значение концентрации интерлейкина 6 [1]. Шкала mNUTRIC была подтверждена внешними данными с использованием данных из базы данных рандомизированных клинических испытаний 1223 пациентов, находящихся на ИВЛ [35]. Внешняя валидация была повторена в более позднем исследовании Rahman et al., которые обнаружили, что вероятность смерти на 28-й день увеличивалась на 1,4 (95% ДИ, 1,3–1,5) на каждое увеличение балла по шкале mNUTRIC, подтверждая взаимосвязь между оценкой по шкале mNUTRIC и смертностью [8].
В настоящем исследовании использовалась модифицированная версия шкалы NUTRIC. В анализируемой когорте была обнаружена очень хорошая эффективность шкалы mNUTRIC для прогнозирования 28-дневной смертности с AUC 0,833 (95% ДИ 0,76–0,89, p < 0,001), а с помощью статистики Яндена было определено оптимальное значение отсечения, равное 6 баллам, которое использовалось для разделения исследуемой выборки для дальнейшего анализа. В группе с оценкой mNUTRIC 6 баллов смертность была значительно выше по сравнению с группой с <6 баллов (81% против 28%, p < 0,001). Ранее de Vries et al. подтвердили прогностическую способность шкалы mNUTRIC с использованием когорты из 475 пациентов на ИВЛ, поступивших в ОИТ в Нидерландах в период с 2011 по 2013 г. % ДИ 0,722–0,814) [12]. Аналогичные результаты были получены Mukhopadhyay et al. в азиатской популяции пациентов ОИТ с AUC 0,71 для прогнозирования смертности с использованием шкалы mNUTRIC [10]. Эти результаты подтвердили способность шкалы mNUTRIC прогнозировать смертность в определенной подгруппе пациентов с сепсисом и септическим шоком, т. е. в группе пациентов с высоким риском смерти.
Сообщалось о высокой распространенности недостаточности питания (от 38% до 78%) у пациентов в ОИТ, что было связано с плохим исходом [36]. Недостаточность питания может оказывать негативное влияние на иммунный ответ при сепсисе, увеличивая смертность в ОИТ и продолжительность пребывания в больнице [37,38]. Многочисленные исследования подтвердили полезность шкалы mNUTRIC для выявления пациентов из группы высокого алиментарного риска в популяции пациентов ОИТ [1,8,10,39]. Эта субпопуляция получит наибольшую пользу от соответствующей нутритивной терапии. Согласно исследованию Hung etal., иммунокомпетентные пациенты чаще страдали от неадекватного питания, а пациенты с неудовлетворенной потребностью в калориях имели худший прогноз с 90-дневной смертностью более 90% [40]. Напротив, у пациентов с иммунодефицитом с сепсисом недостаточное питание не влияло на смертность. Оценка mNUTRIC не делала различий между пациентами с ослабленным иммунитетом и иммунокомпетентными, но у выживших пациентов были более низкие оценки SOFA и NUTRIC и более высокое содержание калорий, чем у невыживших.
Существует недостаток крупных исследований, оценивающих исходы у пациентов с сепсисом, подвергнутых различным режимам калорийности. Ретроспективный анализ потребления калорий и белка у 1171 больного в критическом состоянии (22,8% с сепсисом) подтвердил, что как недостаточное, так и избыточное питание вредно [41]. Этот вывод не был подтвержден в исследовании TARGET, в котором оценивался эффект введения 1,5 кКл/мл по сравнению с 1 кКл/мл энтерального питания на кг массы тела у пациентов, находящихся в ОИТ на ИВЛ. Сепсис присутствовал в 25% в каждой группе лечения. Пациенты в энергоплотной группе получали значительно большее количество калорий. Это не влияло на смертность, длительность органной поддержки и частоту инфекционных осложнений [42].
Недавно опубликованное исследование показало, что в 2017 году во всем мире было зарегистрировано 48,9 миллиона случаев сепсиса; в том же году было также 11 миллионов смертей, связанных с сепсисом [43]. Эти оценки основаны на уникальном подробном анализе свидетельств о смерти и являются глобальными оценками заболеваемости сепсисом, включая случаи сепсиса, которые не лечились в стационаре. Самая высокая заболеваемость и смертность от сепсиса были оценены в регионах с наименьшей доступностью медицинских ресурсов, что указывает на необходимость использования административных инструментов для улучшения использования ресурсов ОИТ. До сих пор было проведено много исследований, чтобы найти модель для улучшения доступа к ресурсам интенсивной терапии. Одним из доступных методов является прогнозирование продолжительности пребывания в ОИТ, предполагая, что этот параметр может быть связан с интенсивностью использования ресурсов ОИТ. Verburg et al. предоставили систематический обзор моделей, предназначенных для прогнозирования продолжительности пребывания в ОИТ и было выявлено и исследовано 11 различных моделей [44].
Наиболее часто используемыми предикторами в этих моделях были общая тяжесть заболевания, источник госпитализации, возраст, использование ИВЛ, оценка комы Глазго, сопутствующие заболевания и организационные предикторы. К сожалению, ни одна модель не была признана полностью пригодной для планирования и выявления неожиданно длительного пребывания в ОИТ или для целей сравнительного анализа. Другой подход к улучшению доступа к ресурсам интенсивной терапии заключается в использовании показателей тяжести конкретного заболевания. Шкала PIRO (predisposition, insult, response, organ dysfunction) использовалась для оценки тяжести и прогнозирования использования ресурсов при вентилятор-ассоциированной пневмонии (ВАП) [45]. Модель была разработана как простой, практичный клинический инструмент для прогнозирования использования ресурсов здравоохранения на основе продолжительности пребывания в ОИТ и продолжительности ИВЛ, и продемонстрировала более широкое использование медицинских ресурсов у пациентов с высоким и очень высоким риском смерти на основе прогноза PIRO. Еще одним подходом к прогнозированию использования ресурсов отделения интенсивной терапии может быть модель, предназначенная для прогнозирования использования конкретных инвазивных методов лечения. Недавно Sukmark et al. разработали упрощенную систему оценки для прогнозирования серьезных осложнений у пациентов с диагнозом острая почечная недостаточность (ОПП) и находящихся на лечении в ОИТ [46].
Эта упрощенная клиническая оценка была основана на легкодоступных параметрах, таких как шкала комы Глазго, тахипноэ, использование вазопрессоров, использование ИВЛ, олигурия, креатинин сыворотки, азот мочевины крови, гематокрит и тромбоцитопения. Производительность модели была адекватной при внутренней проверке (AUC ниже ROC-кривой 0,80) и осуществимой даже в условиях ограниченных ресурсов; однако модель еще не прошла внешнюю проверку. Также были разработаны и оценены различные модели для прогнозирования шока и применения вазопрессоров. Недавно Kwak et. al. использовали модель обучения, основанную на внимании, для прогнозирования потребности в вазопрессорной терапии в течение первых 24 часов пребывания в ОИТ. В окончательной модели использовались только жизненные показатели, при этом наибольший вклад вносили частота сердечных сокращений, частота дыхания и среднее артериальное давление (AUC 0,83) [47]. В исследовании Liu et. al. для создания модели, предсказывающей потребность в вазопрессорах у тяжелобольных пациентов (AUC 0,81), была использована методика кластеризации, названная fuzzy c-means [48].
Авторы предполагают существование предшокового состояния, предшествующего переходу сепсиса в септический шок; обнаружение этого состояния с помощью разработанной модели может быть полезным при распределении ресурсов, особенно когда доступность ОИТ ограничена. Позже для внешней проверки модели использовалась база данных Medical Information Mart for Intensive Care-III. Были использованы три различных метода машинного обучения, которые показали хорошие результаты при выявлении пациентов с сепсисом, у которых может развиться септический шок, с AUC 0,93 и средним временем раннего предупреждения 7 часов [49, 50]. Аналогичный подход применялся для прогнозирования необходимости интубации [51–53]. Siu et al. использовали машинное обучение для разработки модели, предсказывающей необходимость интубации в течение первых 24 часов после поступления в ОИТ. Параметры, необходимые для модели, были следующими: результаты анализа газов крови, шкала комы Глазго, частота дыхания, насыщение кислородом, температура, возраст и параметры оксигенотерапии. Сообщаемая AUC модели составляла 0,86 (95% ДИ 0,85–0,87) [50].
Подходы, представленные выше, часто требовали расширенного автоматизированного электронного сбора и анализа данных в режиме реального времени. Такое ноу-хау не всегда доступно в условиях ОИТ. Мы использовали показатель mNUTRIC в качестве простого инструмента для прогнозирования использования ресурсов ОИТ. Следует отметить, что все параметры, необходимые для расчета mNUTRIC (возраст, исходная оценка по шкале APACHE IIи SOFA, количество сопутствующих заболеваний и количество дней от госпитализации до поступления в ОИТ), регулярно собираются или рассчитываются и хранятся в больничных записях пациентов. Используя порог отсечения 6 по 9-балльной шкале mNUTRIC, мы смогли выделить группу пациентов, которым достоверно чаще требовалось интенсивное использование ресурсов в течение всего пребывания в ОИТ.
5. Ограничения
В многочисленных предыдущих исследованиях было замечено, что шкала mNUTRIC выявляет пациентов с высоким риском недостаточности питания, которые, вероятно, получат пользу от нутритивной терапии во время пребывания в ОИТ [1,8,10,39]. Из-за отсутствия конкретных данных о питании взаимосвязь между смертностью, адекватностью питания и оценкой mNUTRIC не оценивалась в исследуемой когорте, и мы признаем, что это является ограничением исследования. С развитием интенсивной терапии возросла и сложность организации и структуры этих отделений; следовательно, разработка и использование систем оценки может способствовать улучшению распределения материальных и человеческих ресурсов. Показатели количественной оценки рабочей нагрузки медсестер в настоящее время являются одним из основных инструментов планирования и оценки в ОИТ. Наши результаты указывают на полезность оценки mNUTRIC в качестве потенциального инструмента для прогнозирования увеличения использования ресурсов в ОИТ; однако это одноцентровый анализ с относительно небольшим размером выборки, и мы считаем это еще одним ограничением исследования.
6. Выводы
Оценка NUTRIC, полученная при поступлении в ОРИТ, обеспечивает хорошую дискриминационную ценность для 28-дневной летальности и позволяет выявить пациентов, которым в конечном итоге потребуется интенсивное использование ресурсов ОИТ с сопутствующим увеличением сестринской нагрузки при лечении сепсиса в ОИТ. Наши данные показывают, что оценка mNUTRIC может быть полезна при планировании ресурсов ОИТ, особенно в условиях повышенного спроса на услуги интенсивной терапии, например, во время глобальной пандемии. Однако требуется внешняя проверка на основе большей когорты, прежде чем выступать за более широкое использование оценки mNUTRIC в качестве дополнительного инструмента для планирования ресурсов ОИТ.
References
1. Heyland, D.K.; Dhaliwal, R.; Jiang, X.; Day, A.G. Identifying Critically Ill Patients Who Benefit the Most from Nutrition Therapy: The Development and Initial Validation of a Novel RiskAssessment Tool. Crit. Care 2011, 15, R268. [CrossRef] [PubMed]
2. Zhang, P.; He, Z.; Yu, G.; Peng, D.; Feng, Y.; Ling, J.; Wang, Y.; Li, S.; Bian, Y. The Modified NUTRIC Score Can Be Used for Nutritional Risk Assessment as Well as Prognosis Prediction inCritically Ill COVID-19 Patients. Clin. Nutr. 2021, 40, 534–541. [CrossRef] [PubMed]
3. Kumar, N.; Kumar, A.; Kumar, A.; Pattanayak, A.; Singh, K.; Singh, P. NUTRIC Score as aPredictor of Outcome in COVID-19 ARDS Patients: A Retrospective Observational Study.Indian J. Anaesth. 2021, 65, 669. [CrossRef] [PubMed]
4. Renuka, M.K.; Arunkumar, A.S. Use of Nutrition Risk in Critically Ill (NUTRIC) Score toAssess Nutritional Risk in Mechanically Ventilated Patients: A Prospective Observational Study.Indian J. Crit. Care Med. 2017, 21, 253–256. [CrossRef] [PubMed]
5. Lin, P.-Y.; Yen, Y.-T.; Lam, C.-T.; Li, K.-C.; Lu, M.-J.; Hsu, H.-S. Use of Modified-NUTRICScore to Assess Nutritional Risk in Surgical Intensive Care Unit. J. Chin. Med. Assoc. 2021, 84,860–864. [CrossRef]
6. Zheng, C.; Xie, K.; Li, X.; Wang, G.; Luo, J.; Zhang, C.; Jiang, Z.; Wang, Y.; Luo, C.; Qiang, Y.; et al. The Prognostic Value of Modified NUTRIC Score for Patients in CardiothoracicSurgery Recovery Unit: A Retrospective Cohort Study. J. Hum. Nutr. Diet 2021, 34, 926–934.[CrossRef] [PubMed]
7. Tseng, C.-C.; Tu, C.-Y.; Chen, C.-H.; Wang, Y.-T.; Chen, W.-C.; Fu, P.-K.; Chen, C.-M.; Lai, C.-C.; Kuo, L.-K.; Ku, S.-C.; et al. Significance of the Modified NUTRIC Score for PredictingClinical Outcomes in Patients with Severe Community-Acquired Pneumonia. Nutrients 2021, 14,198. [CrossRef]
8. Rahman, A.; Hasan, R.M.; Agarwala, R.; Martin, C.; Day, A.G.; Heyland, D.K. Identifying Critically-Ill Patients Who Will Benefit Most from Nutritional Therapy: Further Validation of the “Modified NUTRIC” Nutritional Risk Assessment Tool. Clin. Nutr. 2016, 35, 158–162.[CrossRef]
9. Jeong, D.H.; Hong, S.-B.; Lim, C.-M.; Koh, Y.; Seo, J.; Kim, Y.; Min, J.-Y.; Huh, J.W.Relationship between Nutrition Intake and 28-Day Mortality Using Modified NUTRIC Score inPatients with Sepsis. Nutrients 2019, 11, 1906. [CrossRef]
10. Mukhopadhyay, A.; Henry, J.; Ong, V.; Leong, C.S.-F.; Teh, A.L.; van Dam, R.M.;Kowitlawakul, Y. Association of Modified NUTRIC Score with 28-Day Mortality in CriticallyIll Patients. Clin. Nutr. 2017, 36, 1143–1148. [CrossRef]
11. Villacrs, C.Q.; Ochoa, G.S.; Sarmiento-Bobadilla, M.; Hilbron, A.S.; Garcia, C.; Cuenca, J. 376:Assessing the nutric score 28-day mortality prediction in critically ill cancer patients. Crit. CareMed. 2020, 48, 170. [CrossRef]
12. de Vries, M.C.; Koekkoek, W.; Opdam, M.H.; van Blokland, D.; van Zanten, A.R. NutritionalAssessment of Critically Ill Patients: Validation of the Modified NUTRIC Score. Eur. J. Clin.Nutr. 2018, 72, 428–435. [CrossRef]
13. van den Berg, M.; van Beuningen, F.E.; ter Maaten, J.C.; Bouma, H.R. Hospital-Related Costsof Sepsis around the World: A Systematic Review Exploring the Economic Burden of Sepsis. J.Crit. Care 2022, 71, 154096. [CrossRef]
14. Lasater, K.B.; McHugh, M.D.; Rosenbaum, P.R.; Aiken, L.H.; Smith, H.L.; Reiter, J.G.;Niknam, B.A.; Hill, A.S.; Hochman, L.L.; Jain, S.; et al. Evaluating the Costs and Outcomes of Hospital Nursing Resources: A Matched Cohort Study of Patients with Common MedicalConditions. J. Gen. Intern. Med. 2021, 36, 84–91. [CrossRef] [PubMed]
15. Jones, S.L.; Ashton, C.M.; Kiehne, L.B.; Nicolas, J.C.; Rose, A.L.; Shirkey, B.A.; Masud, F.; Wray, N.P. Outcomes and Resource Use of Sepsis-Associated Stays by Presence on Admission,Severity, and Hospital Type. Med. Care 2016, 54, 303–310. [CrossRef]
16. Al-Saad, N.A.; Nortje, J. Principles of Resource Allocation in Critical Care. BJA Educ. 2017, 17,6. [CrossRef]
17. Dellinger, R.P.; Levy, M.M.; Rhodes, A.; Annane, D.; Gerlach, H.; Opal, S.M.; Sevransky, J.E.; Sprung, C.L.; Douglas, I.S.; Jaeschke, R.; et al. Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock, 2012. Intensive Care Med. 2013,39, 165–228. [CrossRef] [PubMed]
18. Singer, M.; Deutschman, C.S.; Seymour, C.W.; Shankar-Hari, M.; Annane, D.; Bauer, M.; Bellomo, R.; Bernard, G.R.; Chiche, J.-D.; Coopersmith, C.M.; et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315, 801–810.[CrossRef]
19. Knaus, W.A.; Draper, E.A.; Wagner, D.P.; Zimmerman, J.E. APACHE II: A Severity of Disease Classification System. Crit. Care Med. 1985, 13, 818–829. [CrossRef]
20. Vincent, J.-L.; Moreno, R.; Takala, J.; Willatts, S.; De Mendonça, A.; Bruining, H.; Reinhart, C.K.; Suter, P.; Thijs, L.G. The SOFA (Sepsis-Related Organ Failure Assessment) Score to Describe Organ Dysfunction/Failure. Intensive Care Med. 1996, 22, 707–710. [CrossRef]
21. Miranda, D.R.; de Rijk, A.; Schaufeli, W. Simplified Therapeutic Intervention Scoring System:The TISS-28 Items–Results from a Multicenter Study. Crit. Care Med. 1996, 24, 64–73.[CrossRef] [PubMed]
22. Jensen, G.L.; Mirtallo, J.; Compher, C.; Dhaliwal, R.; Forbes, A.; Grijalba, R.F.; Hardy, G.;Kondrup, J.; Labadarios, D.; Nyulasi, I.; et al. Adult Starvation and Disease-Related Malnutrition: A Proposal for Etiology-Based Diagnosis in the Clinical Practice Setting from theInternational Consensus Guideline Committee. Clin. Nutr. 2010, 29, 151–153. [CrossRef]
23. Malnutrition Advisory Group. A Consistent and Reliable Tool for Malnutrition Screening. Nurs.Times 2003, 99, 26–27.
24. Lim, S.-L.; Tong, C.-Y.; Ang, E.; Lee, E.J.-C.; Loke, W.-C.; Chen, Y.; Ferguson, M.; Daniels, L. Development and Validation of 3-Minute Nutrition Screening (3-MinNS) Tool for AcuteHospital Patients in Singapore. Asia Pac. J. Clin. Nutr. 2009, 18, 395–403.
25. Kruizenga, H.M.; Seidell, J.C.; de Vet, H.C.W.; Wierdsma, N.J.; van Bokhorst-de van der Schueren, M.A.E. Development and Validation of a Hospital Screening Tool for Malnutrition: The Short Nutritional Assessment Questionnaire (SNAQ). Clin. Nutr. 2005, 24, 75–82.[CrossRef]
26. Ferguson, M.; Capra, S.; Bauer, J.; Banks, M. Development of a Valid and Reliable Malnutrition Screening Tool for Adult Acute Hospital Patients. Nutrition 1999, 15, 458–464. [CrossRef] [PubMed]
27. Anthony, P.S. Nutrition Screening Tools for Hospitalized Patients. Nutr. Clin. Pract. 2008, 23,373–382. [CrossRef]
28. Kondrup, J.; Rasmussen, H.H.; Hamberg, O.; Stanga, Z. Ad Hoc ESPEN Working GroupNutritional Risk Screening (NRS 2002): A New Method Based on an Analysis of ControlledClinical Trials. Clin. Nutr. 2003, 22, 321–336. [CrossRef]
29. Detsky, A.S.; McLaughlin, J.R.; Baker, J.P.; Johnston, N.; Whittaker, S.; Mendelson, R.A.; Jeejeebhoy, K.N. What Is Subjective Global Assessment of Nutritional Status? JPEN J. Parenter.Enteral Nutr. 1987, 11, 8–13. [CrossRef]
30. Fu, P.-K.; Wang, C.-Y.; Wang, W.-N.; Hsu, C.-Y.; Lin, S.-P.; Kuo, C.-T. Energy Achievement Rate Is an Independent Factor Associated with Intensive Care Unit Mortality in High-Nutritional-Risk Patients with Acute Respiratory Distress Syndrome Requiring Prolonged Prone Positioning Therapy. Nutrients 2021, 13, 3176. [CrossRef]
31. dos Reis, A.M.; Fructhenicht, A.V.G.; Moreira, L.F. NUTRIC Score Use around the World: ASystematic Review. Rev. Bras. Ter.
Intensiv. 2019, 31, 379–385. [CrossRef]
32. Moretti, D. Estudio de dos variantes de la puntuación de riesgo nutricional. Nutr. Hosp. 2014,166–172. [CrossRef]
33. Mendes, R.; Policarpo, S.; Fortuna, P.; Alves, M.; Virella, D.; Heyland, D.K. Nutritional Risk Assessment and Cultural Validation of the Modified NUTRIC Score in Critically Ill Patients—A Multicenter Prospective Cohort Study. J. Crit. Care 2017, 37, 45–49. [CrossRef] [PubMed]
34. Lew, C.C.H.; Cheung, K.P.; Chong, M.F.F.; Chua, A.P.; Fraser, R.J.L.; Miller, M. Combining 2 Commonly Adopted Nutrition Instruments in the Critical Care Setting Is Superior to Administering Either One Alone. JPEN J. Parenter. Enteral Nutr. 2017, 45, 872–876. [CrossRef][PubMed]
35. Heyland, D.; Muscedere, J.; Wischmeyer, P.E.; Cook, D.; Jones, G.; Albert, M.; Elke, G.; Berger, M.M.; Day, A.G. A Randomized Trial of Glutamine and Antioxidants in Critically Ill Patients.N. Engl. J. Med. 2013, 368, 1489–1497. [CrossRef] [PubMed]
36. Lew, C.C.H.; Yandell, R.; Fraser, R.J.L.; Chua, A.P.; Chong, M.F.F.; Miller, M. Association Between Malnutrition and Clinical Outcomes in the Intensive Care Unit: A Systematic Review.JPEN J. Parenter. Enteral Nutr. 2017, 41, 744–758. [CrossRef]
37. Hamers, L.; Kox, M.; Pickkers, P. Sepsis-Induced Immunoparalysis: Mechanisms, Markers, and Treatment Options. Minerva Anestesiol 2015, 81, 426–439.
38. Villet, S.; Chiolero, R.L.; Bollmann, M.D.; Revelly, J.-P.; Cayeux RN, M.-C.; Delarue, J.;Berger, M.M. Negative Impact of Hypocaloric Feeding and Energy Balance on Clinical Outcomein ICU Patients. Clin. Nutr. 2005, 24, 502–509. [CrossRef]
39. Bodolea, C.; Nemes, A.; Avram, L.; Craciun, R.; Coman, M.; Ene-Cocis, M.; Ciobanu, C.; Crisan, D. Nutritional Risk Assessment Scores Effectively Predict Mortality in Critically IllPatients with Severe COVID-19. Nutrients 2022, 14, 2105. [CrossRef]
40. Hung, K.-Y.; Chen, Y.-M.; Wang, C.-C.; Wang, Y.-H.; Lin, C.-Y.; Chang, Y.-T.; Huang, K.-T.; Lin, M.-C.; Fang, W.-F. Insufficient Nutrition and Mortality Risk in Septic Patients Admitted toICU with a Focus on Immune Dysfunction. Nutrients 2019, 11, 367. [CrossRef]
41. Zusman, O.; Theilla, M.; Cohen, J.; Kagan, I.; Bendavid, I.; Singer, P. Resting EnergyExpenditure, Calorie and Protein Consumption in Critically Ill Patients: A Retrospective CohortStudy. Crit. Care 2016, 20, 367. [CrossRef]
42. The TARGET Investigators, for the ANZICS Clinical Trials Group. Energy-Dense versusRoutine Enteral Nutrition in the Critically Ill. N. Engl. J. Med. 2018, 379, 1823–1834.[CrossRef] [PubMed]
43. Rudd, K.E.; Johnson, S.C.; Agesa, K.M.; Shackelford, K.A.; Tsoi, D.; Kievlan, D.R.; Colombara, D.V.; Ikuta, K.S.; Kissoon, N.; Finfer, S.; et al. Global, Regional, and National Sepsis Incidence and Mortality, 1990–2017: Analysis for the Global Burden of Disease Study. Lancet 2020, 395,200–211. [CrossRef] [PubMed]
44. Verburg, I.W.M.; Atashi, A.; Eslami, S.; Holman, R.; Abu-Hanna, A.; de Jonge, E.; Peek, N.; deKeizer, N.F. Which Models Can I Use to Predict Adult ICU Length of Stay? A SystematicReview. Crit. Care Med. 2017, 45, e222–e231. [CrossRef]
45. Lisboa, T.; Diaz, E.; Sa-Borges, M.; Socias, A.; Sole-Violan, J.; Rodríguez, A.; Rello, J. The Ventilator-Associated Pneumonia PIRO Score. Chest 2008, 134, 1208–1216. [CrossRef]
46. Sukmark, T.; Lumlertgul, N.; Praditpornsilpa, K.; Tungsanga, K.; Eiam-Ong, S.; Srisawat, N. SEA-MAKE Score as a Tool for Predicting Major Adverse Kidney Events in Critically Ill Patients with Acute Kidney Injury: Results from the SEA-AKI Study. Ann. Intensive Care 2020,10, 42. [CrossRef]
47. Kwak, G.H.; Ling, L.; Hui, P. Predicting the Need for Vasopressors in the Intensive Care Unit Using an Attention Based Deep Learning Model. Shock 2020. Publish Ahead of Print.[CrossRef] [PubMed]
48. Rodrigues, J.M.; Fialho, A.S.; Vieira, S.M.; Mendonca, L.F.; Sousa, J.M.C. Data Mining and Modeling to Predict the Necessity of Vasopressors for ICU Patients. In Proceedings of the 2013 IEEE International Conference on Fuzzy Systems (FUZZ-IEEE), Hyderabad, India, 7–10July 2013; IEEE: Hyderabad, India, 2013; pp. 1–6.
49. Liu, R.; Greenstein, J.L.; Granite, S.J.; Fackler, J.C.; Bembea, M.M.; Sarma, S.V.; Winslow, R.L. Data-Driven Discovery of a Novel Sepsis Pre-Shock State Predicts Impending Septic Shock inthe ICU. Sci. Rep. 2019, 9, 6145. [CrossRef]
50. Johnson, A.E.W.; Pollard, T.J.; Shen, L.; Lehman, L.H.; Feng, M.; Ghassemi, M.; Moody, B.;Szolovits, P.; Anthony Celi, L.; Mark,
R.G. MIMIC-III, a Freely Accessible Critical Care Database. Sci. Data 2016, 3, 160035.[CrossRef]
51. Siu, B.M.K.; Kwak, G.H.; Ling, L.; Hui, P. Predicting the Need for Intubation in the First 24 h after Critical Care Admission Using Machine Learning Approaches. Sci. Rep. 2020, 10, 20931.[CrossRef]
52. Buswell, L.; Hayes, A.; Baombe, J. BET 2: Predicting the Need for Endotracheal Intubation in Poisoned Patients. Emerg. Med. J.
2019, 36, 573–575. [CrossRef] [PubMed]
53. Onishi, S.; Osuka, A.; Kuroki, Y.; Ueyama, M. Indications of Early Intubation for Patients withInhalation Injury. Acute Med. Surg.
2017, 4, 278–285. [CrossRef] [PubMed]
[~DETAIL_TEXT] =>
Marek Wełna, Barbara Adamik, Andrzej Kübler and Waldemar Goz´dzikThe NUTRIC Score as a Tool to Predict Mortality and Increased Resource Utilization in Intensive Care Patients with Sepsis
Nutrients. 2023, 15, 1648.Абстракт
Шкала нутриционного риска в критическом состоянии (NUTRIC) является важным инструментом оценки нутритивного риска для пациентов в отделении интенсивной терапии (ОИТ). Цель этого исследования состояла в том, чтобы оценить способность шкалы прогнозировать смертность у пациентов, получавших лечение по поводу сепсиса, а также прогнозировать повышенное использование ресурсов и сестринскую нагрузку в ОИТ. Шкала NUTRIC предсказывала смертность (AUC 0,833, p < 0,001) с оптимальным пороговым значением 6 баллов. Среди пациентов с оценкой ≥ 6 при поступлении в ОИТ 28-дневная смертность составила 61%, а с оценкой < 6 — 10 % (p < 0,001). Кроме того, балл NUTRIC ≥6 был связан с более интенсивным использованием ресурсов ОРИТ, о чем свидетельствует более высокая доля пациентов, нуждающихся в инфузии вазопрессоров (98 против 82%), искусственной вентиляции легких (99 против 87%), заместительной терапии при почечной недостаточности (54 против 26%), стероиды (68 против 31%) и продуктов крови (60 против 43%); рабочая нагрузка медсестер также была значительно выше в этой группе. В заключение следует отметить, что оценка NUTRIC, полученная при поступлении в ОИТ, обеспечивает хорошую дискриминационную ценность для смертности и позволяет выявить пациентов, которым в конечном итоге потребуется интенсивное использование ресурсов ОИТ и связанное с этим увеличение рабочей нагрузки на медсестер во время лечения.
Ключевые слова: интенсивная терапия; сепсис; питание; предсказание смертности
1. Введение
Шкала NUTRIC является инструментом оценки риска. Она был разработан для использования у пациентов, находящихся на лечении в ОИТ, чтобы помочь выявить тех, кому нутриционная терапия принесет наибольшую пользу [1]. Польза от использования шкалы оценивается путем расчета изменения выживаемости; более низкий балл NUTRIC связан с более низкой смертностью, что было подтверждено в различных группах, включая пациентов с COVID-19 в критическом состоянии [2,3], пациентов на ИВЛ [4,5] пациентов после кардиоторакальной хирургии, находящихся на лечении в реабилитационном отделении [6], а также и у больных с тяжелой внебольничной пневмонией [7]. Концептуальная модель, использованная для разработки шкалы NUTRIC, была сложной и состояла из параметров, описывающих хроническое и острое воспаление, возраст, общую клиническую оценку, оценку органной недостаточности и маркеры острого и хронического голодания. Модель прошла внешнюю валидацию, и хорошая дискриминация подтвердила ее прогностическую способность [8]. Несколько дальнейших исследований показали связь между оценкой NUTRIC и смертностью в ОИТ, и было замечено, что особенно пациенты с высокими показателями NUTRIC могут получить пользу от оптимального питания, тем самым улучшая выживаемость. [9–11].
Валидацию шкалы NUTRIC можно увидеть, прежде всего, по влиянию на 28-дневную смертность или потребность в длительной ИВЛ у пациентов в ОИТ [1,12]. Однако взаимосвязь между оценкой и необходимостью использования других ресурсов ОИТ не оценивалась. Группа пациентов, которым требуется гораздо большее использование ресурсов во время пребывания в ОИТ/стационаре, — это пациенты с сепсисом [13,14]. Анализ, проведенный Jones et al. показал, что пациенты, госпитализированные по поводу сепсиса, потребляли значительно больше ресурсов стационара в течение 12-месячного периода по сравнению с пациентами, госпитализированными по поводу других заболеваний, кроме сепсиса [15]. Полный доступ к больничным ресурсам чрезвычайно важен в условиях быстрой и неожиданной перегрузки ОИТ, которая наблюдалась во время пандемии COVID-19. Однако неуклонный рост потребностей в ресурсах ОИТ был задокументирован еще до глобальной пандемии COVID-19 [16]. Было замечено, что основными факторами растущего спроса на интенсивную терапию являются старение населения, увеличение количества и сложности хирургических вмешательств, внедрение новых методов лечения и растущие ожидания общества в отношении доступности и эффективности здравоохранения на основе улучшенных результаты. Поэтому дополнительный прогностический инструмент может быть полезен для более эффективного использования ресурсов в ОИТ. Взаимосвязь между оценкой NUTRIC и необходимостью использования большего количества ресурсов ОИТ для госпитализированных пациентов с сепсисом не оценивалась.
Цель данного исследования состояла в том, чтобы оценить силу шкалы NUTRIC в прогнозировании 28-дневной летальности у пациентов с сепсисом, поскольку худший прогноз при поступлении может быть связан с необходимостью более интенсивного использования ресурсов ОИТ и, соответственно, большей нагрузкой на сестринский персонал. Мы предположили, что оценка NUTRIC может иметь дополнительное применение в качестве инструмента для прогнозирования увеличения использования ресурсов в ОИТ.
2. Материалы и методы
2.1. Популяция пациентов
Это исследование было вторичным анализом проспективно собранных данных из базы данных регистра сепсиса. База данных была построена с использованием клинических и демографических данных пациентов, лечившихся в смешанном ОИТ на 25 коек, оказывающем помощь в университетской больнице на 996 коек. В исследование были включены взрослые (старше 18 лет) пациенты с диагнозом сепсис или септический шок, госпитализированные с января по декабрь 2014 г. Критериями исключения были повторная госпитализация в ОРИТ или пребывание в ОРИТ менее 24 часов. В течение периода исследования в общей сложности 332 последовательных пациента, поступивших в ОИТ были проверены на соответствие критериям включения/исключения. В общей сложности 156 пациентов соответствовали критериям включения. Было 10 случаев неполных данных, поэтому 146 пациентов были включены в окончательный анализ.
2.2. Этика
Исследование было одобрено локальным комитетом по этике Вроцлавского медицинского университета, номер одобрения KB 23/2015, и соответствует Хельсинкской декларации. От необходимости получения информированного согласия отказались в связи с ретроспективным наблюдательным характером исследования.
2.3. Ведение пациентов и сбор данных
Все пациенты в исследовании получали стандартное лечение сепсиса или септического шока в соответствии с рекомендациями кампании Surviving Sepsis Campaign, которые использовались в то время в ОИТ [17]. Не менее трех специалистов по анестезиологии и реаниматологии и четыре ординатора оказывали помощь пациентам ОИТ в дневные смены с 7 до 15 часов. Позже помощь оказывали один специалист по анестезиологии-реаниматологии и два ординатора. Соотношение медсестра/пациент составляло 1:1 или 1:2 в зависимости от стабильности пациента. Для целей данного исследования критерии SEPSIS-III были ретроспективно применены к базе данных регистра сепсиса [18].
В связи с отсутствием информации о IL-6 в базе данных для расчетов использовалась ранее валидированная модифицированная версия шкалы (оценка mNUTRIC) [1]. Следующие данные, собранные в базе данных регистра сепсиса, использовались для расчета показателя mNUTRIC в настоящем исследовании: возраст, исходный показатель оценки по шкале APACHE II и SOFA, количество сопутствующих заболеваний и дней от госпитализации до поступления в ОИТ. Оценка mNUTRIC рассчитывалась при поступлении в ОИТ. Оценки APACHE II и SOFA были рассчитаны в соответствии с исходными публикациями [19,20]. Обе шкалы обычно используются для оценки тяжести клинического состояния пациентов в ОИТ. Подробная система оценки, используемая для расчета оценки mNUTRIC, представлена в Table 1.

Кроме того, требования к лечению во время пребывания в ОИТ были зарегистрированы в базе данных, и ресурсоемкие вмешательства были в центре внимания этого анализа. Были отмечены следующие процедуры ведения каждого пациента во время пребывания в ОРИТ: инфузионная терапия и вазоактивные препараты; ИВЛ; заместительная почечная терапия; диетотерапия; введение кортикостероидов, антикоагулянтов и препаратов крови; контроль уровня глюкозы; и хирургия. Количественная оценка ежедневной сестринской нагрузки для каждого пациента была рассчитана с использованием Therapeutic Intervention Scoring System-28 (TISS-28), а среднее значение индекса было записано в базу данных. В нашем ОИТ шкала TISS-28 обычно используется в качестве системы оценки нагрузки на медсестер [21].
2.4. Статистический анализ
Описательная статистика включала медиану (межквартильный размах) для количественных переменных и частоту (в процентах) для качественных переменных. В базе не было пропущенных данных. Для сравнения непрерывных переменных между исследуемыми группами использовался Т-критерий Стьюдента. Категориальные переменные анализировались с помощью критерия хи-квадрат, а таблицы сопряженности использовались для анализа частотного распределения категориальных переменных. ROC-анализ использовался для измерения способности оценки NUTRIC различать смерть и выживших путем расчета площади под кривой (AUC), включая 95% доверительные интервалы (ДИ), для определения чувствительности и специфичности; результаты статистики Younden показали оптимальное пороговое значение для оценки NUTRIC. Кривые Каплана-Мейера и критерий логарифмического ранга использовались для оценки различий в функциях 28-дневной выживаемости на основе значения показателя NUTRIC. Однофакторная логистическая регрессия была выполнена для сравнения прогностической способности клинических шкал (NUTRIC, APACHE II и SOFA) для прогнозирования 28-дневной смертности; результаты были представлены как отношение шансов (ОШ) с 95% доверительными интервалами (ДИ).
Для создания модели, предсказывающей 28-дневную смертность, был проведен многофакторный логистический регрессионный анализ. Связь между оценкой NUTRIC и выбранными ковариантами (пол, сопутствующие заболевания, уровень лактата, уровень прокальцитонина, гипогликемия, потребность в заместительной почечной терапии и респираторной поддержке, положительная культура крови, время до начала антибиотикотерапии) и смертностью оценивали; результаты были представлены как отношение шансов (ОШ) с 95% доверительными интервалами (ДИ). Весь статистический анализ был проведен с помощью Statistica, версия 13 (StatSoft Inc., Tulsa, OK, USA ). Значение p <0,05 считалось статистически значимым.
3. Результаты
3.1. Образец исследования
В течение периода исследования в общей сложности 332 последовательных пациента, поступивших в ОИТ, были проверены на соответствие критериям включения/исключения. Из них 156 пациентов соответствовали критериям включения. Из-за неполных данных в окончательный анализ были включены 146 пациентов. Средний возраст в выборке составлял 66 лет (межквартильный интервал 58–77 лет), и большинство пациентов были мужчинами (n = 95, 65%). Из 146 зарегистрированных пациентов с сепсисом у 129 (88%) был септический шок при поступлении в ОИТ. Основными причинами сепсиса и септического шока были пневмония (49%), внутрибрюшная инфекция (35%) и инфекция мочевыводящих путей (7%). Пациенты были переведены из общих палат (48%), операционной (38%), отделения неотложной помощи (7%), других больниц (6%) и палат интенсивной терапии (1%). Большинство пациентов поступили в критическом состоянии с медианой баллов по шкале SOFA, рассчитанной в 1-е сутки, на уровне 10 баллов (IQR 7–13) и с оценкой по шкале APACHEII 21 балла (IQR 15–27). Тяжесть клинического состояния больных также отражалась в высокой доле случаев недостаточности четырех и более органов, диагностированных при поступлении в ОРИТ (51%). Медиана пребывания в ОИТ составила 10 дней (IQR 4–23), а пребывание в больнице — 32 дня (IQR 11–55). Исходные характеристики пациентов представлены в Table 2.

3.2. Оптимальная точка отсечения для mNUTRIC
Во-первых, мы оценили прогностическую эффективность шкалы mNUTRIC для 28-дневной смертности. Оценка mNUTRIC представляет собой 9-балльную шкалу. При анализе ROC-кривой оценка mNUTRIC, рассчитанная при поступлении в ОИТ, позволяла прогнозировать 28-дневную смертность с AUC 0,833 (95% ДИ 0,76–0,89, p <0,001). Это показано на Figure 1. Оптимальное пороговое значение для оценки mNUTRIC составило 6 баллов с чувствительностью 90% и специфичностью 63%, и эта точка использовалась для разделения исследуемой выборки для дальнейшего анализа, т.е. группа пациентов с оценкой mNUTRIC 6 баллов и группа с оценкой mNUTRIC < 6 баллов. Среди пациентов с оценкой mNUTRIC 6 при поступлении в ОИТ 28-дневная смертность составила 61%, а с оценкой < 6 — 10 % (p < 0,001).

3.3 Прогностическая сила . mNUTRIC
Затем был проведен односторонний логистический регрессионный анализ для сравнения прогностической способности клинических шкал, рассчитанных при поступлении в ОИТ. mNUTRIC прогнозировал 28-дневную смертность с отношением шансов 2,24 (95% ДИ 1,71–2,95, p < 0,001), только APACHE II с ОШ 1,21 (95% ДИ 1,13–1,29, p < 0,001) и только SOFA с ОШ 1,43 (95% ДИ 1,26–1,63, р <0,001)
3.4. Характеристика групп пациентов в соответствии с оптимальной пороговой точкой шкалы mNUTRIC.
На основании результатов анализа ROC-кривой и результатов статистики Younden выборка исследования была разделена на 1-ю группу (пациенты с оценкой mNUTRIC < 6 баллов, n = 61) и 2-ю группу (пациенты с оценкой mNUTRIC 6 баллов , n = 85). В группе mNUTRITIC < 6 мужчин было 64%, а в группе mNUTRITIC 6 — 66% (p = 0,807). Анализ переменных, использованных для расчета показателя mNUTRIC, показан в Table 3.

3.5. Ведение пациентов
Участие медсестер в процессе ухода за больными оценивали с помощью индекса TISSS-28, и полученные результаты свидетельствовали о том, что рабочая нагрузка сестринского персонала была значительно выше в группе с оценкой mNUTRIC 6 баллов по сравнению с оценкой mNUTRIC <6 баллов (TISS-28: 36 баллов, IQR 33–40 против 31 балла, IQR 28–34, p < 0,001). У пациентов с оценкой mNUTRIC 6 баллов септический шок был диагностирован в 96% случаев, а при mNUTRIC < 6 баллов — в 78% (р = 0,001). Инфузионная терапия использовалась у большинства пациентов в обеих группах (p = 0,154), а вазопрессоры пришлось назначать почти всем пациентам с оценкой mNUTRIC 6 баллов (98%) и в 82% случаев с оценкой mNUTRIC < 6 баллов ( р = 0,001). ИВЛ и ЗПТ чаще применялись при лечении пациентов с оценкой mNUTRIC6 баллов, чем в случаях с оценкой mNUTRIC < 6 баллов (99 против 82% и 54 против 26% соответственно). Терапия стероидами требовалась более, чем в два раза чаще в группе с mNUTRIC 6 баллов по сравнению с mNUTRIC < 6 баллов (68 против 31%), а потребность в препаратах крови также была значительно выше (60 против 43%). ). В Table 4 сравнивается частота различных требований к лечению в день поступления в ОИТ.

3.6. Ведение пациентов
28-дневная летальность всей исследуемой группы составила 40%. Среди умерших пациентов оценка NUTRIC, рассчитанная при поступлении в ОИТ, в 90% случаев составила 6 баллов. Медиана оценки mNUTRIC у выживших пациентов составила 4 балла (IQR 3-6), а у не выживших - 7 (IQR 6-8). Анализ 28-дневной выживаемости по методу Каплана-Мейера показал, что между группами с оценкой mNUTRIC < 6 и 6 баллов существует статистическая значимость (p < 0,001, log-rank test), (Figure 2).

Кроме того, для создания модели прогнозирования 28-дневной летальности был проведен многомерный логистический регрессионный анализ. Обратный выбор модели определял выбор переменных из набора параметров, оцениваемых при поступлении в ОИТ (балл mNUTRIC, пол, уровень лактата, уровень прокальцитонина, необходимость ЗПТ, необходимость респираторной поддержки, положительная культура крови, время до введения антибиотиков, сопутствующие заболевания). Базовый балл mNUTRIC (OR = 1,86; 95%CI 1,36-2,54), наличие септического шока при поступлении в ОИТ (OR = 4,19; 95%CI 1,38-12,73) и уровень лактата (OR = 1,32; 95%CI 1,08-1,59) были значимыми предикторами 28-дневной летальности; другие параметры в модель не вошли. Результаты представлены в Table 5.

4. Дискуссия
Результаты нашего исследования показали, что в популяции пациентов с сепсисом те, кто имел 6 баллов по mNUTRIC при поступлении в ОИТ, имели значительно более низкие шансы на выживание. Кроме того, показатель mNUTRIC 6 был связан с более интенсивным использованием ресурсов ОИТ, о чем свидетельствует значительно более высокая доля случаев, требующих ИВЛ, ЗПТ и вазопрессорной поддержки. Стероидная терапия также требовалась более чем в два раза чаще в группе с mNUTRIC 6 баллов, и потребность в препаратах крови также была значительно выше. Сестринская нагрузка, определенная количественно по шкале TISS-28, была значительно выше в группе с оценкой mNUTRIC ≥ 6 баллов по сравнению с потребностью в уходе у пациентов с mNUTRIC < 6 баллов. Таким образом, уже при поступлении в ОРИТ можно было предположить, что лечение больного сепсисом с оценкой mNUTRIC 6 баллов потребует более интенсивного использования ресурсов ОРИТ. Насколько нам известно, это первое исследование по оценке использования ресурсов при лечении пациентов с сепсисом на основе шкалы mNUTRIC.
Шкала ьNUTRIC — это новый инструмент оценки риска, изначально разработанный для выявления пациентов, которые с большей вероятностью получат пользу от нутритивной поддержки в условиях ОИТ [1]. Концептуальная модель разработки шкалы NUTRIC включала маркеры-предикторы острого голодания, хронического голодания, острого и хронического воспаления [22]. В отличие от многих широко используемых оценок нутритивного риска, эта шкала была разработана специально для пациентов, госпитализированных в ОИТ [23–30]. Один потенциальный недостаток оценки mNUTRIC связан с характеристиками группы, которые использовались для разработки оценки; исследование было основано на относительно небольшой группе (n = 597), состоящей в основном из пациентов европеоидной расы (90%) [1]. Эти потенциальные недостатки были устранены в серии исследований, проведенных в различных географических регионах с привлечением более крупных групп пациентов разной расы и социального статуса [31].
Шкала mNUTRIC точно предсказывала 28-дневную смертность 1199 пациентов на ИВЛ в рандомизированном контрольном исследовании, проведенном в Канаде [8]. Аналогичная группа пациентов в критическом состоянии, нуждающихся в ИВЛ, была включена в исследование, проведенное в Аргентине, и полученные результаты подтвердили взаимосвязь между более высокой смертностью и повышенным показателем mNUTRIC [32]. Другое исследование в Португалии, в котором анализировались исходы 1143 взрослых пациентов ОИТ, также подтвердило вышеупомянутые результаты: высокий балл mNUTRIC был связан с более длительной госпитализацией, меньшим количеством дней без ИВЛ и более высокой 28-дневной смертностью [33].
Аналогичные выводы были сделаны в индийском исследовании, где были отмечены значительные различия между группами с высоким и низким уровнем NUTRIC с точки зрения смертности (p < 0,001), продолжительности пребывания в ОИТ (p < 0,014) и продолжительности ИВЛ (p < 0,001). [4]. Данные сингапурского исследования подтвердили связь высокого показателя mNUTRIC с госпитальной летальностью [34]. Эти результаты убедительно свидетельствуют о том, что шкала mNURTRIC при использовании в качестве предиктора смертности хорошо работает в когортах с разной расой и социальным статусом, изучаемых в разных географических регионах. Наше исследование также подтвердило более ранние наблюдения.
Основным практическим недостатком оригинальной шкалы NUTRIC было включение в нее концентрации интерлейкина 6, поскольку этот параметр обычно не измеряется у пациентов ОИТ и часто недоступен в больничных базах данных. Поэтому позже был предложен модифицированный вариант шкалы (mNUTRIC), не учитывающий значение концентрации интерлейкина 6 [1]. Шкала mNUTRIC была подтверждена внешними данными с использованием данных из базы данных рандомизированных клинических испытаний 1223 пациентов, находящихся на ИВЛ [35]. Внешняя валидация была повторена в более позднем исследовании Rahman et al., которые обнаружили, что вероятность смерти на 28-й день увеличивалась на 1,4 (95% ДИ, 1,3–1,5) на каждое увеличение балла по шкале mNUTRIC, подтверждая взаимосвязь между оценкой по шкале mNUTRIC и смертностью [8].
В настоящем исследовании использовалась модифицированная версия шкалы NUTRIC. В анализируемой когорте была обнаружена очень хорошая эффективность шкалы mNUTRIC для прогнозирования 28-дневной смертности с AUC 0,833 (95% ДИ 0,76–0,89, p < 0,001), а с помощью статистики Яндена было определено оптимальное значение отсечения, равное 6 баллам, которое использовалось для разделения исследуемой выборки для дальнейшего анализа. В группе с оценкой mNUTRIC 6 баллов смертность была значительно выше по сравнению с группой с <6 баллов (81% против 28%, p < 0,001). Ранее de Vries et al. подтвердили прогностическую способность шкалы mNUTRIC с использованием когорты из 475 пациентов на ИВЛ, поступивших в ОИТ в Нидерландах в период с 2011 по 2013 г. % ДИ 0,722–0,814) [12]. Аналогичные результаты были получены Mukhopadhyay et al. в азиатской популяции пациентов ОИТ с AUC 0,71 для прогнозирования смертности с использованием шкалы mNUTRIC [10]. Эти результаты подтвердили способность шкалы mNUTRIC прогнозировать смертность в определенной подгруппе пациентов с сепсисом и септическим шоком, т. е. в группе пациентов с высоким риском смерти.
Сообщалось о высокой распространенности недостаточности питания (от 38% до 78%) у пациентов в ОИТ, что было связано с плохим исходом [36]. Недостаточность питания может оказывать негативное влияние на иммунный ответ при сепсисе, увеличивая смертность в ОИТ и продолжительность пребывания в больнице [37,38]. Многочисленные исследования подтвердили полезность шкалы mNUTRIC для выявления пациентов из группы высокого алиментарного риска в популяции пациентов ОИТ [1,8,10,39]. Эта субпопуляция получит наибольшую пользу от соответствующей нутритивной терапии. Согласно исследованию Hung etal., иммунокомпетентные пациенты чаще страдали от неадекватного питания, а пациенты с неудовлетворенной потребностью в калориях имели худший прогноз с 90-дневной смертностью более 90% [40]. Напротив, у пациентов с иммунодефицитом с сепсисом недостаточное питание не влияло на смертность. Оценка mNUTRIC не делала различий между пациентами с ослабленным иммунитетом и иммунокомпетентными, но у выживших пациентов были более низкие оценки SOFA и NUTRIC и более высокое содержание калорий, чем у невыживших.
Существует недостаток крупных исследований, оценивающих исходы у пациентов с сепсисом, подвергнутых различным режимам калорийности. Ретроспективный анализ потребления калорий и белка у 1171 больного в критическом состоянии (22,8% с сепсисом) подтвердил, что как недостаточное, так и избыточное питание вредно [41]. Этот вывод не был подтвержден в исследовании TARGET, в котором оценивался эффект введения 1,5 кКл/мл по сравнению с 1 кКл/мл энтерального питания на кг массы тела у пациентов, находящихся в ОИТ на ИВЛ. Сепсис присутствовал в 25% в каждой группе лечения. Пациенты в энергоплотной группе получали значительно большее количество калорий. Это не влияло на смертность, длительность органной поддержки и частоту инфекционных осложнений [42].
Недавно опубликованное исследование показало, что в 2017 году во всем мире было зарегистрировано 48,9 миллиона случаев сепсиса; в том же году было также 11 миллионов смертей, связанных с сепсисом [43]. Эти оценки основаны на уникальном подробном анализе свидетельств о смерти и являются глобальными оценками заболеваемости сепсисом, включая случаи сепсиса, которые не лечились в стационаре. Самая высокая заболеваемость и смертность от сепсиса были оценены в регионах с наименьшей доступностью медицинских ресурсов, что указывает на необходимость использования административных инструментов для улучшения использования ресурсов ОИТ. До сих пор было проведено много исследований, чтобы найти модель для улучшения доступа к ресурсам интенсивной терапии. Одним из доступных методов является прогнозирование продолжительности пребывания в ОИТ, предполагая, что этот параметр может быть связан с интенсивностью использования ресурсов ОИТ. Verburg et al. предоставили систематический обзор моделей, предназначенных для прогнозирования продолжительности пребывания в ОИТ и было выявлено и исследовано 11 различных моделей [44].
Наиболее часто используемыми предикторами в этих моделях были общая тяжесть заболевания, источник госпитализации, возраст, использование ИВЛ, оценка комы Глазго, сопутствующие заболевания и организационные предикторы. К сожалению, ни одна модель не была признана полностью пригодной для планирования и выявления неожиданно длительного пребывания в ОИТ или для целей сравнительного анализа. Другой подход к улучшению доступа к ресурсам интенсивной терапии заключается в использовании показателей тяжести конкретного заболевания. Шкала PIRO (predisposition, insult, response, organ dysfunction) использовалась для оценки тяжести и прогнозирования использования ресурсов при вентилятор-ассоциированной пневмонии (ВАП) [45]. Модель была разработана как простой, практичный клинический инструмент для прогнозирования использования ресурсов здравоохранения на основе продолжительности пребывания в ОИТ и продолжительности ИВЛ, и продемонстрировала более широкое использование медицинских ресурсов у пациентов с высоким и очень высоким риском смерти на основе прогноза PIRO. Еще одним подходом к прогнозированию использования ресурсов отделения интенсивной терапии может быть модель, предназначенная для прогнозирования использования конкретных инвазивных методов лечения. Недавно Sukmark et al. разработали упрощенную систему оценки для прогнозирования серьезных осложнений у пациентов с диагнозом острая почечная недостаточность (ОПП) и находящихся на лечении в ОИТ [46].
Эта упрощенная клиническая оценка была основана на легкодоступных параметрах, таких как шкала комы Глазго, тахипноэ, использование вазопрессоров, использование ИВЛ, олигурия, креатинин сыворотки, азот мочевины крови, гематокрит и тромбоцитопения. Производительность модели была адекватной при внутренней проверке (AUC ниже ROC-кривой 0,80) и осуществимой даже в условиях ограниченных ресурсов; однако модель еще не прошла внешнюю проверку. Также были разработаны и оценены различные модели для прогнозирования шока и применения вазопрессоров. Недавно Kwak et. al. использовали модель обучения, основанную на внимании, для прогнозирования потребности в вазопрессорной терапии в течение первых 24 часов пребывания в ОИТ. В окончательной модели использовались только жизненные показатели, при этом наибольший вклад вносили частота сердечных сокращений, частота дыхания и среднее артериальное давление (AUC 0,83) [47]. В исследовании Liu et. al. для создания модели, предсказывающей потребность в вазопрессорах у тяжелобольных пациентов (AUC 0,81), была использована методика кластеризации, названная fuzzy c-means [48].
Авторы предполагают существование предшокового состояния, предшествующего переходу сепсиса в септический шок; обнаружение этого состояния с помощью разработанной модели может быть полезным при распределении ресурсов, особенно когда доступность ОИТ ограничена. Позже для внешней проверки модели использовалась база данных Medical Information Mart for Intensive Care-III. Были использованы три различных метода машинного обучения, которые показали хорошие результаты при выявлении пациентов с сепсисом, у которых может развиться септический шок, с AUC 0,93 и средним временем раннего предупреждения 7 часов [49, 50]. Аналогичный подход применялся для прогнозирования необходимости интубации [51–53]. Siu et al. использовали машинное обучение для разработки модели, предсказывающей необходимость интубации в течение первых 24 часов после поступления в ОИТ. Параметры, необходимые для модели, были следующими: результаты анализа газов крови, шкала комы Глазго, частота дыхания, насыщение кислородом, температура, возраст и параметры оксигенотерапии. Сообщаемая AUC модели составляла 0,86 (95% ДИ 0,85–0,87) [50].
Подходы, представленные выше, часто требовали расширенного автоматизированного электронного сбора и анализа данных в режиме реального времени. Такое ноу-хау не всегда доступно в условиях ОИТ. Мы использовали показатель mNUTRIC в качестве простого инструмента для прогнозирования использования ресурсов ОИТ. Следует отметить, что все параметры, необходимые для расчета mNUTRIC (возраст, исходная оценка по шкале APACHE IIи SOFA, количество сопутствующих заболеваний и количество дней от госпитализации до поступления в ОИТ), регулярно собираются или рассчитываются и хранятся в больничных записях пациентов. Используя порог отсечения 6 по 9-балльной шкале mNUTRIC, мы смогли выделить группу пациентов, которым достоверно чаще требовалось интенсивное использование ресурсов в течение всего пребывания в ОИТ.
5. Ограничения
В многочисленных предыдущих исследованиях было замечено, что шкала mNUTRIC выявляет пациентов с высоким риском недостаточности питания, которые, вероятно, получат пользу от нутритивной терапии во время пребывания в ОИТ [1,8,10,39]. Из-за отсутствия конкретных данных о питании взаимосвязь между смертностью, адекватностью питания и оценкой mNUTRIC не оценивалась в исследуемой когорте, и мы признаем, что это является ограничением исследования. С развитием интенсивной терапии возросла и сложность организации и структуры этих отделений; следовательно, разработка и использование систем оценки может способствовать улучшению распределения материальных и человеческих ресурсов. Показатели количественной оценки рабочей нагрузки медсестер в настоящее время являются одним из основных инструментов планирования и оценки в ОИТ. Наши результаты указывают на полезность оценки mNUTRIC в качестве потенциального инструмента для прогнозирования увеличения использования ресурсов в ОИТ; однако это одноцентровый анализ с относительно небольшим размером выборки, и мы считаем это еще одним ограничением исследования.
6. Выводы
Оценка NUTRIC, полученная при поступлении в ОРИТ, обеспечивает хорошую дискриминационную ценность для 28-дневной летальности и позволяет выявить пациентов, которым в конечном итоге потребуется интенсивное использование ресурсов ОИТ с сопутствующим увеличением сестринской нагрузки при лечении сепсиса в ОИТ. Наши данные показывают, что оценка mNUTRIC может быть полезна при планировании ресурсов ОИТ, особенно в условиях повышенного спроса на услуги интенсивной терапии, например, во время глобальной пандемии. Однако требуется внешняя проверка на основе большей когорты, прежде чем выступать за более широкое использование оценки mNUTRIC в качестве дополнительного инструмента для планирования ресурсов ОИТ.
References
1. Heyland, D.K.; Dhaliwal, R.; Jiang, X.; Day, A.G. Identifying Critically Ill Patients Who Benefit the Most from Nutrition Therapy: The Development and Initial Validation of a Novel RiskAssessment Tool. Crit. Care 2011, 15, R268. [CrossRef] [PubMed]
2. Zhang, P.; He, Z.; Yu, G.; Peng, D.; Feng, Y.; Ling, J.; Wang, Y.; Li, S.; Bian, Y. The Modified NUTRIC Score Can Be Used for Nutritional Risk Assessment as Well as Prognosis Prediction inCritically Ill COVID-19 Patients. Clin. Nutr. 2021, 40, 534–541. [CrossRef] [PubMed]
3. Kumar, N.; Kumar, A.; Kumar, A.; Pattanayak, A.; Singh, K.; Singh, P. NUTRIC Score as aPredictor of Outcome in COVID-19 ARDS Patients: A Retrospective Observational Study.Indian J. Anaesth. 2021, 65, 669. [CrossRef] [PubMed]
4. Renuka, M.K.; Arunkumar, A.S. Use of Nutrition Risk in Critically Ill (NUTRIC) Score toAssess Nutritional Risk in Mechanically Ventilated Patients: A Prospective Observational Study.Indian J. Crit. Care Med. 2017, 21, 253–256. [CrossRef] [PubMed]
5. Lin, P.-Y.; Yen, Y.-T.; Lam, C.-T.; Li, K.-C.; Lu, M.-J.; Hsu, H.-S. Use of Modified-NUTRICScore to Assess Nutritional Risk in Surgical Intensive Care Unit. J. Chin. Med. Assoc. 2021, 84,860–864. [CrossRef]
6. Zheng, C.; Xie, K.; Li, X.; Wang, G.; Luo, J.; Zhang, C.; Jiang, Z.; Wang, Y.; Luo, C.; Qiang, Y.; et al. The Prognostic Value of Modified NUTRIC Score for Patients in CardiothoracicSurgery Recovery Unit: A Retrospective Cohort Study. J. Hum. Nutr. Diet 2021, 34, 926–934.[CrossRef] [PubMed]
7. Tseng, C.-C.; Tu, C.-Y.; Chen, C.-H.; Wang, Y.-T.; Chen, W.-C.; Fu, P.-K.; Chen, C.-M.; Lai, C.-C.; Kuo, L.-K.; Ku, S.-C.; et al. Significance of the Modified NUTRIC Score for PredictingClinical Outcomes in Patients with Severe Community-Acquired Pneumonia. Nutrients 2021, 14,198. [CrossRef]
8. Rahman, A.; Hasan, R.M.; Agarwala, R.; Martin, C.; Day, A.G.; Heyland, D.K. Identifying Critically-Ill Patients Who Will Benefit Most from Nutritional Therapy: Further Validation of the “Modified NUTRIC” Nutritional Risk Assessment Tool. Clin. Nutr. 2016, 35, 158–162.[CrossRef]
9. Jeong, D.H.; Hong, S.-B.; Lim, C.-M.; Koh, Y.; Seo, J.; Kim, Y.; Min, J.-Y.; Huh, J.W.Relationship between Nutrition Intake and 28-Day Mortality Using Modified NUTRIC Score inPatients with Sepsis. Nutrients 2019, 11, 1906. [CrossRef]
10. Mukhopadhyay, A.; Henry, J.; Ong, V.; Leong, C.S.-F.; Teh, A.L.; van Dam, R.M.;Kowitlawakul, Y. Association of Modified NUTRIC Score with 28-Day Mortality in CriticallyIll Patients. Clin. Nutr. 2017, 36, 1143–1148. [CrossRef]
11. Villacrs, C.Q.; Ochoa, G.S.; Sarmiento-Bobadilla, M.; Hilbron, A.S.; Garcia, C.; Cuenca, J. 376:Assessing the nutric score 28-day mortality prediction in critically ill cancer patients. Crit. CareMed. 2020, 48, 170. [CrossRef]
12. de Vries, M.C.; Koekkoek, W.; Opdam, M.H.; van Blokland, D.; van Zanten, A.R. NutritionalAssessment of Critically Ill Patients: Validation of the Modified NUTRIC Score. Eur. J. Clin.Nutr. 2018, 72, 428–435. [CrossRef]
13. van den Berg, M.; van Beuningen, F.E.; ter Maaten, J.C.; Bouma, H.R. Hospital-Related Costsof Sepsis around the World: A Systematic Review Exploring the Economic Burden of Sepsis. J.Crit. Care 2022, 71, 154096. [CrossRef]
14. Lasater, K.B.; McHugh, M.D.; Rosenbaum, P.R.; Aiken, L.H.; Smith, H.L.; Reiter, J.G.;Niknam, B.A.; Hill, A.S.; Hochman, L.L.; Jain, S.; et al. Evaluating the Costs and Outcomes of Hospital Nursing Resources: A Matched Cohort Study of Patients with Common MedicalConditions. J. Gen. Intern. Med. 2021, 36, 84–91. [CrossRef] [PubMed]
15. Jones, S.L.; Ashton, C.M.; Kiehne, L.B.; Nicolas, J.C.; Rose, A.L.; Shirkey, B.A.; Masud, F.; Wray, N.P. Outcomes and Resource Use of Sepsis-Associated Stays by Presence on Admission,Severity, and Hospital Type. Med. Care 2016, 54, 303–310. [CrossRef]
16. Al-Saad, N.A.; Nortje, J. Principles of Resource Allocation in Critical Care. BJA Educ. 2017, 17,6. [CrossRef]
17. Dellinger, R.P.; Levy, M.M.; Rhodes, A.; Annane, D.; Gerlach, H.; Opal, S.M.; Sevransky, J.E.; Sprung, C.L.; Douglas, I.S.; Jaeschke, R.; et al. Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock, 2012. Intensive Care Med. 2013,39, 165–228. [CrossRef] [PubMed]
18. Singer, M.; Deutschman, C.S.; Seymour, C.W.; Shankar-Hari, M.; Annane, D.; Bauer, M.; Bellomo, R.; Bernard, G.R.; Chiche, J.-D.; Coopersmith, C.M.; et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315, 801–810.[CrossRef]
19. Knaus, W.A.; Draper, E.A.; Wagner, D.P.; Zimmerman, J.E. APACHE II: A Severity of Disease Classification System. Crit. Care Med. 1985, 13, 818–829. [CrossRef]
20. Vincent, J.-L.; Moreno, R.; Takala, J.; Willatts, S.; De Mendonça, A.; Bruining, H.; Reinhart, C.K.; Suter, P.; Thijs, L.G. The SOFA (Sepsis-Related Organ Failure Assessment) Score to Describe Organ Dysfunction/Failure. Intensive Care Med. 1996, 22, 707–710. [CrossRef]
21. Miranda, D.R.; de Rijk, A.; Schaufeli, W. Simplified Therapeutic Intervention Scoring System:The TISS-28 Items–Results from a Multicenter Study. Crit. Care Med. 1996, 24, 64–73.[CrossRef] [PubMed]
22. Jensen, G.L.; Mirtallo, J.; Compher, C.; Dhaliwal, R.; Forbes, A.; Grijalba, R.F.; Hardy, G.;Kondrup, J.; Labadarios, D.; Nyulasi, I.; et al. Adult Starvation and Disease-Related Malnutrition: A Proposal for Etiology-Based Diagnosis in the Clinical Practice Setting from theInternational Consensus Guideline Committee. Clin. Nutr. 2010, 29, 151–153. [CrossRef]
23. Malnutrition Advisory Group. A Consistent and Reliable Tool for Malnutrition Screening. Nurs.Times 2003, 99, 26–27.
24. Lim, S.-L.; Tong, C.-Y.; Ang, E.; Lee, E.J.-C.; Loke, W.-C.; Chen, Y.; Ferguson, M.; Daniels, L. Development and Validation of 3-Minute Nutrition Screening (3-MinNS) Tool for AcuteHospital Patients in Singapore. Asia Pac. J. Clin. Nutr. 2009, 18, 395–403.
25. Kruizenga, H.M.; Seidell, J.C.; de Vet, H.C.W.; Wierdsma, N.J.; van Bokhorst-de van der Schueren, M.A.E. Development and Validation of a Hospital Screening Tool for Malnutrition: The Short Nutritional Assessment Questionnaire (SNAQ). Clin. Nutr. 2005, 24, 75–82.[CrossRef]
26. Ferguson, M.; Capra, S.; Bauer, J.; Banks, M. Development of a Valid and Reliable Malnutrition Screening Tool for Adult Acute Hospital Patients. Nutrition 1999, 15, 458–464. [CrossRef] [PubMed]
27. Anthony, P.S. Nutrition Screening Tools for Hospitalized Patients. Nutr. Clin. Pract. 2008, 23,373–382. [CrossRef]
28. Kondrup, J.; Rasmussen, H.H.; Hamberg, O.; Stanga, Z. Ad Hoc ESPEN Working GroupNutritional Risk Screening (NRS 2002): A New Method Based on an Analysis of ControlledClinical Trials. Clin. Nutr. 2003, 22, 321–336. [CrossRef]
29. Detsky, A.S.; McLaughlin, J.R.; Baker, J.P.; Johnston, N.; Whittaker, S.; Mendelson, R.A.; Jeejeebhoy, K.N. What Is Subjective Global Assessment of Nutritional Status? JPEN J. Parenter.Enteral Nutr. 1987, 11, 8–13. [CrossRef]
30. Fu, P.-K.; Wang, C.-Y.; Wang, W.-N.; Hsu, C.-Y.; Lin, S.-P.; Kuo, C.-T. Energy Achievement Rate Is an Independent Factor Associated with Intensive Care Unit Mortality in High-Nutritional-Risk Patients with Acute Respiratory Distress Syndrome Requiring Prolonged Prone Positioning Therapy. Nutrients 2021, 13, 3176. [CrossRef]
31. dos Reis, A.M.; Fructhenicht, A.V.G.; Moreira, L.F. NUTRIC Score Use around the World: ASystematic Review. Rev. Bras. Ter.
Intensiv. 2019, 31, 379–385. [CrossRef]
32. Moretti, D. Estudio de dos variantes de la puntuación de riesgo nutricional. Nutr. Hosp. 2014,166–172. [CrossRef]
33. Mendes, R.; Policarpo, S.; Fortuna, P.; Alves, M.; Virella, D.; Heyland, D.K. Nutritional Risk Assessment and Cultural Validation of the Modified NUTRIC Score in Critically Ill Patients—A Multicenter Prospective Cohort Study. J. Crit. Care 2017, 37, 45–49. [CrossRef] [PubMed]
34. Lew, C.C.H.; Cheung, K.P.; Chong, M.F.F.; Chua, A.P.; Fraser, R.J.L.; Miller, M. Combining 2 Commonly Adopted Nutrition Instruments in the Critical Care Setting Is Superior to Administering Either One Alone. JPEN J. Parenter. Enteral Nutr. 2017, 45, 872–876. [CrossRef][PubMed]
35. Heyland, D.; Muscedere, J.; Wischmeyer, P.E.; Cook, D.; Jones, G.; Albert, M.; Elke, G.; Berger, M.M.; Day, A.G. A Randomized Trial of Glutamine and Antioxidants in Critically Ill Patients.N. Engl. J. Med. 2013, 368, 1489–1497. [CrossRef] [PubMed]
36. Lew, C.C.H.; Yandell, R.; Fraser, R.J.L.; Chua, A.P.; Chong, M.F.F.; Miller, M. Association Between Malnutrition and Clinical Outcomes in the Intensive Care Unit: A Systematic Review.JPEN J. Parenter. Enteral Nutr. 2017, 41, 744–758. [CrossRef]
37. Hamers, L.; Kox, M.; Pickkers, P. Sepsis-Induced Immunoparalysis: Mechanisms, Markers, and Treatment Options. Minerva Anestesiol 2015, 81, 426–439.
38. Villet, S.; Chiolero, R.L.; Bollmann, M.D.; Revelly, J.-P.; Cayeux RN, M.-C.; Delarue, J.;Berger, M.M. Negative Impact of Hypocaloric Feeding and Energy Balance on Clinical Outcomein ICU Patients. Clin. Nutr. 2005, 24, 502–509. [CrossRef]
39. Bodolea, C.; Nemes, A.; Avram, L.; Craciun, R.; Coman, M.; Ene-Cocis, M.; Ciobanu, C.; Crisan, D. Nutritional Risk Assessment Scores Effectively Predict Mortality in Critically IllPatients with Severe COVID-19. Nutrients 2022, 14, 2105. [CrossRef]
40. Hung, K.-Y.; Chen, Y.-M.; Wang, C.-C.; Wang, Y.-H.; Lin, C.-Y.; Chang, Y.-T.; Huang, K.-T.; Lin, M.-C.; Fang, W.-F. Insufficient Nutrition and Mortality Risk in Septic Patients Admitted toICU with a Focus on Immune Dysfunction. Nutrients 2019, 11, 367. [CrossRef]
41. Zusman, O.; Theilla, M.; Cohen, J.; Kagan, I.; Bendavid, I.; Singer, P. Resting EnergyExpenditure, Calorie and Protein Consumption in Critically Ill Patients: A Retrospective CohortStudy. Crit. Care 2016, 20, 367. [CrossRef]
42. The TARGET Investigators, for the ANZICS Clinical Trials Group. Energy-Dense versusRoutine Enteral Nutrition in the Critically Ill. N. Engl. J. Med. 2018, 379, 1823–1834.[CrossRef] [PubMed]
43. Rudd, K.E.; Johnson, S.C.; Agesa, K.M.; Shackelford, K.A.; Tsoi, D.; Kievlan, D.R.; Colombara, D.V.; Ikuta, K.S.; Kissoon, N.; Finfer, S.; et al. Global, Regional, and National Sepsis Incidence and Mortality, 1990–2017: Analysis for the Global Burden of Disease Study. Lancet 2020, 395,200–211. [CrossRef] [PubMed]
44. Verburg, I.W.M.; Atashi, A.; Eslami, S.; Holman, R.; Abu-Hanna, A.; de Jonge, E.; Peek, N.; deKeizer, N.F. Which Models Can I Use to Predict Adult ICU Length of Stay? A SystematicReview. Crit. Care Med. 2017, 45, e222–e231. [CrossRef]
45. Lisboa, T.; Diaz, E.; Sa-Borges, M.; Socias, A.; Sole-Violan, J.; Rodríguez, A.; Rello, J. The Ventilator-Associated Pneumonia PIRO Score. Chest 2008, 134, 1208–1216. [CrossRef]
46. Sukmark, T.; Lumlertgul, N.; Praditpornsilpa, K.; Tungsanga, K.; Eiam-Ong, S.; Srisawat, N. SEA-MAKE Score as a Tool for Predicting Major Adverse Kidney Events in Critically Ill Patients with Acute Kidney Injury: Results from the SEA-AKI Study. Ann. Intensive Care 2020,10, 42. [CrossRef]
47. Kwak, G.H.; Ling, L.; Hui, P. Predicting the Need for Vasopressors in the Intensive Care Unit Using an Attention Based Deep Learning Model. Shock 2020. Publish Ahead of Print.[CrossRef] [PubMed]
48. Rodrigues, J.M.; Fialho, A.S.; Vieira, S.M.; Mendonca, L.F.; Sousa, J.M.C. Data Mining and Modeling to Predict the Necessity of Vasopressors for ICU Patients. In Proceedings of the 2013 IEEE International Conference on Fuzzy Systems (FUZZ-IEEE), Hyderabad, India, 7–10July 2013; IEEE: Hyderabad, India, 2013; pp. 1–6.
49. Liu, R.; Greenstein, J.L.; Granite, S.J.; Fackler, J.C.; Bembea, M.M.; Sarma, S.V.; Winslow, R.L. Data-Driven Discovery of a Novel Sepsis Pre-Shock State Predicts Impending Septic Shock inthe ICU. Sci. Rep. 2019, 9, 6145. [CrossRef]
50. Johnson, A.E.W.; Pollard, T.J.; Shen, L.; Lehman, L.H.; Feng, M.; Ghassemi, M.; Moody, B.;Szolovits, P.; Anthony Celi, L.; Mark,
R.G. MIMIC-III, a Freely Accessible Critical Care Database. Sci. Data 2016, 3, 160035.[CrossRef]
51. Siu, B.M.K.; Kwak, G.H.; Ling, L.; Hui, P. Predicting the Need for Intubation in the First 24 h after Critical Care Admission Using Machine Learning Approaches. Sci. Rep. 2020, 10, 20931.[CrossRef]
52. Buswell, L.; Hayes, A.; Baombe, J. BET 2: Predicting the Need for Endotracheal Intubation in Poisoned Patients. Emerg. Med. J.
2019, 36, 573–575. [CrossRef] [PubMed]
53. Onishi, S.; Osuka, A.; Kuroki, Y.; Ueyama, M. Indications of Early Intubation for Patients withInhalation Injury. Acute Med. Surg.
2017, 4, 278–285. [CrossRef] [PubMed]
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 22.11.2023
[~DATE_ACTIVE_FROM] => 22.11.2023
[ACTIVE_FROM_X] => 2023-11-22 00:00:00
[~ACTIVE_FROM_X] => 2023-11-22 00:00:00
[ACTIVE_FROM] => 22.11.2023
[~ACTIVE_FROM] => 22.11.2023
[SHOW_COUNTER] => 831
[~SHOW_COUNTER] => 831
[ID] => 8390
[~ID] => 8390
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 22.11.2023 23:12:43
[~TIMESTAMP_X] => 22.11.2023 23:12:43
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/shkala-nutric-kak-instrument-dlya-prognozirovaniya-smertnosti-i-uvelicheniya-ispolzovaniya-resursov-/
[~DETAIL_PAGE_URL] => /library/articles/shkala-nutric-kak-instrument-dlya-prognozirovaniya-smertnosti-i-uvelicheniya-ispolzovaniya-resursov-/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => shkala-nutric-kak-instrument-dlya-prognozirovaniya-smertnosti-i-uvelicheniya-ispolzovaniya-resursov-
[~CODE] => shkala-nutric-kak-instrument-dlya-prognozirovaniya-smertnosti-i-uvelicheniya-ispolzovaniya-resursov-
[EXTERNAL_ID] => 8390
[~EXTERNAL_ID] => 8390
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 22 ноября 2023
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
[PREVIEW_PICTURE] => Array
(
[ID] => 5437
[TIMESTAMP_X] => 22.11.2023 23:12:43
[MODULE_ID] => iblock
[HEIGHT] => 706
[WIDTH] => 1000
[FILE_SIZE] => 49430
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/c75/bmdo0s31qnjofgmnc6sm1pwxiwjg0qb3
[FILE_NAME] => close-up-finger-pressing-virtual-button.jpg
[ORIGINAL_NAME] => close-up-finger-pressing-virtual-button.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 78c9083daa73ce631d21e84f0f07c252
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/c75/bmdo0s31qnjofgmnc6sm1pwxiwjg0qb3/close-up-finger-pressing-virtual-button.jpg
[UNSAFE_SRC] => /upload/iblock/c75/bmdo0s31qnjofgmnc6sm1pwxiwjg0qb3/close-up-finger-pressing-virtual-button.jpg
[SAFE_SRC] => /upload/iblock/c75/bmdo0s31qnjofgmnc6sm1pwxiwjg0qb3/close-up-finger-pressing-virtual-button.jpg
[ALT] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
[TITLE] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
)
[DETAIL_TEXT] =>
Marek Wełna, Barbara Adamik, Andrzej Kübler and Waldemar Goz´dzikThe NUTRIC Score as a Tool to Predict Mortality and Increased Resource Utilization in Intensive Care Patients with Sepsis
Nutrients. 2023, 15, 1648.Абстракт
Шкала нутриционного риска в критическом состоянии (NUTRIC) является важным инструментом оценки нутритивного риска для пациентов в отделении интенсивной терапии (ОИТ). Цель этого исследования состояла в том, чтобы оценить способность шкалы прогнозировать смертность у пациентов, получавших лечение по поводу сепсиса, а также прогнозировать повышенное использование ресурсов и сестринскую нагрузку в ОИТ. Шкала NUTRIC предсказывала смертность (AUC 0,833, p < 0,001) с оптимальным пороговым значением 6 баллов. Среди пациентов с оценкой ≥ 6 при поступлении в ОИТ 28-дневная смертность составила 61%, а с оценкой < 6 — 10 % (p < 0,001). Кроме того, балл NUTRIC ≥6 был связан с более интенсивным использованием ресурсов ОРИТ, о чем свидетельствует более высокая доля пациентов, нуждающихся в инфузии вазопрессоров (98 против 82%), искусственной вентиляции легких (99 против 87%), заместительной терапии при почечной недостаточности (54 против 26%), стероиды (68 против 31%) и продуктов крови (60 против 43%); рабочая нагрузка медсестер также была значительно выше в этой группе. В заключение следует отметить, что оценка NUTRIC, полученная при поступлении в ОИТ, обеспечивает хорошую дискриминационную ценность для смертности и позволяет выявить пациентов, которым в конечном итоге потребуется интенсивное использование ресурсов ОИТ и связанное с этим увеличение рабочей нагрузки на медсестер во время лечения.
Ключевые слова: интенсивная терапия; сепсис; питание; предсказание смертности
1. Введение
Шкала NUTRIC является инструментом оценки риска. Она был разработан для использования у пациентов, находящихся на лечении в ОИТ, чтобы помочь выявить тех, кому нутриционная терапия принесет наибольшую пользу [1]. Польза от использования шкалы оценивается путем расчета изменения выживаемости; более низкий балл NUTRIC связан с более низкой смертностью, что было подтверждено в различных группах, включая пациентов с COVID-19 в критическом состоянии [2,3], пациентов на ИВЛ [4,5] пациентов после кардиоторакальной хирургии, находящихся на лечении в реабилитационном отделении [6], а также и у больных с тяжелой внебольничной пневмонией [7]. Концептуальная модель, использованная для разработки шкалы NUTRIC, была сложной и состояла из параметров, описывающих хроническое и острое воспаление, возраст, общую клиническую оценку, оценку органной недостаточности и маркеры острого и хронического голодания. Модель прошла внешнюю валидацию, и хорошая дискриминация подтвердила ее прогностическую способность [8]. Несколько дальнейших исследований показали связь между оценкой NUTRIC и смертностью в ОИТ, и было замечено, что особенно пациенты с высокими показателями NUTRIC могут получить пользу от оптимального питания, тем самым улучшая выживаемость. [9–11].
Валидацию шкалы NUTRIC можно увидеть, прежде всего, по влиянию на 28-дневную смертность или потребность в длительной ИВЛ у пациентов в ОИТ [1,12]. Однако взаимосвязь между оценкой и необходимостью использования других ресурсов ОИТ не оценивалась. Группа пациентов, которым требуется гораздо большее использование ресурсов во время пребывания в ОИТ/стационаре, — это пациенты с сепсисом [13,14]. Анализ, проведенный Jones et al. показал, что пациенты, госпитализированные по поводу сепсиса, потребляли значительно больше ресурсов стационара в течение 12-месячного периода по сравнению с пациентами, госпитализированными по поводу других заболеваний, кроме сепсиса [15]. Полный доступ к больничным ресурсам чрезвычайно важен в условиях быстрой и неожиданной перегрузки ОИТ, которая наблюдалась во время пандемии COVID-19. Однако неуклонный рост потребностей в ресурсах ОИТ был задокументирован еще до глобальной пандемии COVID-19 [16]. Было замечено, что основными факторами растущего спроса на интенсивную терапию являются старение населения, увеличение количества и сложности хирургических вмешательств, внедрение новых методов лечения и растущие ожидания общества в отношении доступности и эффективности здравоохранения на основе улучшенных результаты. Поэтому дополнительный прогностический инструмент может быть полезен для более эффективного использования ресурсов в ОИТ. Взаимосвязь между оценкой NUTRIC и необходимостью использования большего количества ресурсов ОИТ для госпитализированных пациентов с сепсисом не оценивалась.
Цель данного исследования состояла в том, чтобы оценить силу шкалы NUTRIC в прогнозировании 28-дневной летальности у пациентов с сепсисом, поскольку худший прогноз при поступлении может быть связан с необходимостью более интенсивного использования ресурсов ОИТ и, соответственно, большей нагрузкой на сестринский персонал. Мы предположили, что оценка NUTRIC может иметь дополнительное применение в качестве инструмента для прогнозирования увеличения использования ресурсов в ОИТ.
2. Материалы и методы
2.1. Популяция пациентов
Это исследование было вторичным анализом проспективно собранных данных из базы данных регистра сепсиса. База данных была построена с использованием клинических и демографических данных пациентов, лечившихся в смешанном ОИТ на 25 коек, оказывающем помощь в университетской больнице на 996 коек. В исследование были включены взрослые (старше 18 лет) пациенты с диагнозом сепсис или септический шок, госпитализированные с января по декабрь 2014 г. Критериями исключения были повторная госпитализация в ОРИТ или пребывание в ОРИТ менее 24 часов. В течение периода исследования в общей сложности 332 последовательных пациента, поступивших в ОИТ были проверены на соответствие критериям включения/исключения. В общей сложности 156 пациентов соответствовали критериям включения. Было 10 случаев неполных данных, поэтому 146 пациентов были включены в окончательный анализ.
2.2. Этика
Исследование было одобрено локальным комитетом по этике Вроцлавского медицинского университета, номер одобрения KB 23/2015, и соответствует Хельсинкской декларации. От необходимости получения информированного согласия отказались в связи с ретроспективным наблюдательным характером исследования.
2.3. Ведение пациентов и сбор данных
Все пациенты в исследовании получали стандартное лечение сепсиса или септического шока в соответствии с рекомендациями кампании Surviving Sepsis Campaign, которые использовались в то время в ОИТ [17]. Не менее трех специалистов по анестезиологии и реаниматологии и четыре ординатора оказывали помощь пациентам ОИТ в дневные смены с 7 до 15 часов. Позже помощь оказывали один специалист по анестезиологии-реаниматологии и два ординатора. Соотношение медсестра/пациент составляло 1:1 или 1:2 в зависимости от стабильности пациента. Для целей данного исследования критерии SEPSIS-III были ретроспективно применены к базе данных регистра сепсиса [18].
В связи с отсутствием информации о IL-6 в базе данных для расчетов использовалась ранее валидированная модифицированная версия шкалы (оценка mNUTRIC) [1]. Следующие данные, собранные в базе данных регистра сепсиса, использовались для расчета показателя mNUTRIC в настоящем исследовании: возраст, исходный показатель оценки по шкале APACHE II и SOFA, количество сопутствующих заболеваний и дней от госпитализации до поступления в ОИТ. Оценка mNUTRIC рассчитывалась при поступлении в ОИТ. Оценки APACHE II и SOFA были рассчитаны в соответствии с исходными публикациями [19,20]. Обе шкалы обычно используются для оценки тяжести клинического состояния пациентов в ОИТ. Подробная система оценки, используемая для расчета оценки mNUTRIC, представлена в Table 1.

Кроме того, требования к лечению во время пребывания в ОИТ были зарегистрированы в базе данных, и ресурсоемкие вмешательства были в центре внимания этого анализа. Были отмечены следующие процедуры ведения каждого пациента во время пребывания в ОРИТ: инфузионная терапия и вазоактивные препараты; ИВЛ; заместительная почечная терапия; диетотерапия; введение кортикостероидов, антикоагулянтов и препаратов крови; контроль уровня глюкозы; и хирургия. Количественная оценка ежедневной сестринской нагрузки для каждого пациента была рассчитана с использованием Therapeutic Intervention Scoring System-28 (TISS-28), а среднее значение индекса было записано в базу данных. В нашем ОИТ шкала TISS-28 обычно используется в качестве системы оценки нагрузки на медсестер [21].
2.4. Статистический анализ
Описательная статистика включала медиану (межквартильный размах) для количественных переменных и частоту (в процентах) для качественных переменных. В базе не было пропущенных данных. Для сравнения непрерывных переменных между исследуемыми группами использовался Т-критерий Стьюдента. Категориальные переменные анализировались с помощью критерия хи-квадрат, а таблицы сопряженности использовались для анализа частотного распределения категориальных переменных. ROC-анализ использовался для измерения способности оценки NUTRIC различать смерть и выживших путем расчета площади под кривой (AUC), включая 95% доверительные интервалы (ДИ), для определения чувствительности и специфичности; результаты статистики Younden показали оптимальное пороговое значение для оценки NUTRIC. Кривые Каплана-Мейера и критерий логарифмического ранга использовались для оценки различий в функциях 28-дневной выживаемости на основе значения показателя NUTRIC. Однофакторная логистическая регрессия была выполнена для сравнения прогностической способности клинических шкал (NUTRIC, APACHE II и SOFA) для прогнозирования 28-дневной смертности; результаты были представлены как отношение шансов (ОШ) с 95% доверительными интервалами (ДИ).
Для создания модели, предсказывающей 28-дневную смертность, был проведен многофакторный логистический регрессионный анализ. Связь между оценкой NUTRIC и выбранными ковариантами (пол, сопутствующие заболевания, уровень лактата, уровень прокальцитонина, гипогликемия, потребность в заместительной почечной терапии и респираторной поддержке, положительная культура крови, время до начала антибиотикотерапии) и смертностью оценивали; результаты были представлены как отношение шансов (ОШ) с 95% доверительными интервалами (ДИ). Весь статистический анализ был проведен с помощью Statistica, версия 13 (StatSoft Inc., Tulsa, OK, USA ). Значение p <0,05 считалось статистически значимым.
3. Результаты
3.1. Образец исследования
В течение периода исследования в общей сложности 332 последовательных пациента, поступивших в ОИТ, были проверены на соответствие критериям включения/исключения. Из них 156 пациентов соответствовали критериям включения. Из-за неполных данных в окончательный анализ были включены 146 пациентов. Средний возраст в выборке составлял 66 лет (межквартильный интервал 58–77 лет), и большинство пациентов были мужчинами (n = 95, 65%). Из 146 зарегистрированных пациентов с сепсисом у 129 (88%) был септический шок при поступлении в ОИТ. Основными причинами сепсиса и септического шока были пневмония (49%), внутрибрюшная инфекция (35%) и инфекция мочевыводящих путей (7%). Пациенты были переведены из общих палат (48%), операционной (38%), отделения неотложной помощи (7%), других больниц (6%) и палат интенсивной терапии (1%). Большинство пациентов поступили в критическом состоянии с медианой баллов по шкале SOFA, рассчитанной в 1-е сутки, на уровне 10 баллов (IQR 7–13) и с оценкой по шкале APACHEII 21 балла (IQR 15–27). Тяжесть клинического состояния больных также отражалась в высокой доле случаев недостаточности четырех и более органов, диагностированных при поступлении в ОРИТ (51%). Медиана пребывания в ОИТ составила 10 дней (IQR 4–23), а пребывание в больнице — 32 дня (IQR 11–55). Исходные характеристики пациентов представлены в Table 2.

3.2. Оптимальная точка отсечения для mNUTRIC
Во-первых, мы оценили прогностическую эффективность шкалы mNUTRIC для 28-дневной смертности. Оценка mNUTRIC представляет собой 9-балльную шкалу. При анализе ROC-кривой оценка mNUTRIC, рассчитанная при поступлении в ОИТ, позволяла прогнозировать 28-дневную смертность с AUC 0,833 (95% ДИ 0,76–0,89, p <0,001). Это показано на Figure 1. Оптимальное пороговое значение для оценки mNUTRIC составило 6 баллов с чувствительностью 90% и специфичностью 63%, и эта точка использовалась для разделения исследуемой выборки для дальнейшего анализа, т.е. группа пациентов с оценкой mNUTRIC 6 баллов и группа с оценкой mNUTRIC < 6 баллов. Среди пациентов с оценкой mNUTRIC 6 при поступлении в ОИТ 28-дневная смертность составила 61%, а с оценкой < 6 — 10 % (p < 0,001).

3.3 Прогностическая сила . mNUTRIC
Затем был проведен односторонний логистический регрессионный анализ для сравнения прогностической способности клинических шкал, рассчитанных при поступлении в ОИТ. mNUTRIC прогнозировал 28-дневную смертность с отношением шансов 2,24 (95% ДИ 1,71–2,95, p < 0,001), только APACHE II с ОШ 1,21 (95% ДИ 1,13–1,29, p < 0,001) и только SOFA с ОШ 1,43 (95% ДИ 1,26–1,63, р <0,001)
3.4. Характеристика групп пациентов в соответствии с оптимальной пороговой точкой шкалы mNUTRIC.
На основании результатов анализа ROC-кривой и результатов статистики Younden выборка исследования была разделена на 1-ю группу (пациенты с оценкой mNUTRIC < 6 баллов, n = 61) и 2-ю группу (пациенты с оценкой mNUTRIC 6 баллов , n = 85). В группе mNUTRITIC < 6 мужчин было 64%, а в группе mNUTRITIC 6 — 66% (p = 0,807). Анализ переменных, использованных для расчета показателя mNUTRIC, показан в Table 3.

3.5. Ведение пациентов
Участие медсестер в процессе ухода за больными оценивали с помощью индекса TISSS-28, и полученные результаты свидетельствовали о том, что рабочая нагрузка сестринского персонала была значительно выше в группе с оценкой mNUTRIC 6 баллов по сравнению с оценкой mNUTRIC <6 баллов (TISS-28: 36 баллов, IQR 33–40 против 31 балла, IQR 28–34, p < 0,001). У пациентов с оценкой mNUTRIC 6 баллов септический шок был диагностирован в 96% случаев, а при mNUTRIC < 6 баллов — в 78% (р = 0,001). Инфузионная терапия использовалась у большинства пациентов в обеих группах (p = 0,154), а вазопрессоры пришлось назначать почти всем пациентам с оценкой mNUTRIC 6 баллов (98%) и в 82% случаев с оценкой mNUTRIC < 6 баллов ( р = 0,001). ИВЛ и ЗПТ чаще применялись при лечении пациентов с оценкой mNUTRIC6 баллов, чем в случаях с оценкой mNUTRIC < 6 баллов (99 против 82% и 54 против 26% соответственно). Терапия стероидами требовалась более, чем в два раза чаще в группе с mNUTRIC 6 баллов по сравнению с mNUTRIC < 6 баллов (68 против 31%), а потребность в препаратах крови также была значительно выше (60 против 43%). ). В Table 4 сравнивается частота различных требований к лечению в день поступления в ОИТ.

3.6. Ведение пациентов
28-дневная летальность всей исследуемой группы составила 40%. Среди умерших пациентов оценка NUTRIC, рассчитанная при поступлении в ОИТ, в 90% случаев составила 6 баллов. Медиана оценки mNUTRIC у выживших пациентов составила 4 балла (IQR 3-6), а у не выживших - 7 (IQR 6-8). Анализ 28-дневной выживаемости по методу Каплана-Мейера показал, что между группами с оценкой mNUTRIC < 6 и 6 баллов существует статистическая значимость (p < 0,001, log-rank test), (Figure 2).

Кроме того, для создания модели прогнозирования 28-дневной летальности был проведен многомерный логистический регрессионный анализ. Обратный выбор модели определял выбор переменных из набора параметров, оцениваемых при поступлении в ОИТ (балл mNUTRIC, пол, уровень лактата, уровень прокальцитонина, необходимость ЗПТ, необходимость респираторной поддержки, положительная культура крови, время до введения антибиотиков, сопутствующие заболевания). Базовый балл mNUTRIC (OR = 1,86; 95%CI 1,36-2,54), наличие септического шока при поступлении в ОИТ (OR = 4,19; 95%CI 1,38-12,73) и уровень лактата (OR = 1,32; 95%CI 1,08-1,59) были значимыми предикторами 28-дневной летальности; другие параметры в модель не вошли. Результаты представлены в Table 5.

4. Дискуссия
Результаты нашего исследования показали, что в популяции пациентов с сепсисом те, кто имел 6 баллов по mNUTRIC при поступлении в ОИТ, имели значительно более низкие шансы на выживание. Кроме того, показатель mNUTRIC 6 был связан с более интенсивным использованием ресурсов ОИТ, о чем свидетельствует значительно более высокая доля случаев, требующих ИВЛ, ЗПТ и вазопрессорной поддержки. Стероидная терапия также требовалась более чем в два раза чаще в группе с mNUTRIC 6 баллов, и потребность в препаратах крови также была значительно выше. Сестринская нагрузка, определенная количественно по шкале TISS-28, была значительно выше в группе с оценкой mNUTRIC ≥ 6 баллов по сравнению с потребностью в уходе у пациентов с mNUTRIC < 6 баллов. Таким образом, уже при поступлении в ОРИТ можно было предположить, что лечение больного сепсисом с оценкой mNUTRIC 6 баллов потребует более интенсивного использования ресурсов ОРИТ. Насколько нам известно, это первое исследование по оценке использования ресурсов при лечении пациентов с сепсисом на основе шкалы mNUTRIC.
Шкала ьNUTRIC — это новый инструмент оценки риска, изначально разработанный для выявления пациентов, которые с большей вероятностью получат пользу от нутритивной поддержки в условиях ОИТ [1]. Концептуальная модель разработки шкалы NUTRIC включала маркеры-предикторы острого голодания, хронического голодания, острого и хронического воспаления [22]. В отличие от многих широко используемых оценок нутритивного риска, эта шкала была разработана специально для пациентов, госпитализированных в ОИТ [23–30]. Один потенциальный недостаток оценки mNUTRIC связан с характеристиками группы, которые использовались для разработки оценки; исследование было основано на относительно небольшой группе (n = 597), состоящей в основном из пациентов европеоидной расы (90%) [1]. Эти потенциальные недостатки были устранены в серии исследований, проведенных в различных географических регионах с привлечением более крупных групп пациентов разной расы и социального статуса [31].
Шкала mNUTRIC точно предсказывала 28-дневную смертность 1199 пациентов на ИВЛ в рандомизированном контрольном исследовании, проведенном в Канаде [8]. Аналогичная группа пациентов в критическом состоянии, нуждающихся в ИВЛ, была включена в исследование, проведенное в Аргентине, и полученные результаты подтвердили взаимосвязь между более высокой смертностью и повышенным показателем mNUTRIC [32]. Другое исследование в Португалии, в котором анализировались исходы 1143 взрослых пациентов ОИТ, также подтвердило вышеупомянутые результаты: высокий балл mNUTRIC был связан с более длительной госпитализацией, меньшим количеством дней без ИВЛ и более высокой 28-дневной смертностью [33].
Аналогичные выводы были сделаны в индийском исследовании, где были отмечены значительные различия между группами с высоким и низким уровнем NUTRIC с точки зрения смертности (p < 0,001), продолжительности пребывания в ОИТ (p < 0,014) и продолжительности ИВЛ (p < 0,001). [4]. Данные сингапурского исследования подтвердили связь высокого показателя mNUTRIC с госпитальной летальностью [34]. Эти результаты убедительно свидетельствуют о том, что шкала mNURTRIC при использовании в качестве предиктора смертности хорошо работает в когортах с разной расой и социальным статусом, изучаемых в разных географических регионах. Наше исследование также подтвердило более ранние наблюдения.
Основным практическим недостатком оригинальной шкалы NUTRIC было включение в нее концентрации интерлейкина 6, поскольку этот параметр обычно не измеряется у пациентов ОИТ и часто недоступен в больничных базах данных. Поэтому позже был предложен модифицированный вариант шкалы (mNUTRIC), не учитывающий значение концентрации интерлейкина 6 [1]. Шкала mNUTRIC была подтверждена внешними данными с использованием данных из базы данных рандомизированных клинических испытаний 1223 пациентов, находящихся на ИВЛ [35]. Внешняя валидация была повторена в более позднем исследовании Rahman et al., которые обнаружили, что вероятность смерти на 28-й день увеличивалась на 1,4 (95% ДИ, 1,3–1,5) на каждое увеличение балла по шкале mNUTRIC, подтверждая взаимосвязь между оценкой по шкале mNUTRIC и смертностью [8].
В настоящем исследовании использовалась модифицированная версия шкалы NUTRIC. В анализируемой когорте была обнаружена очень хорошая эффективность шкалы mNUTRIC для прогнозирования 28-дневной смертности с AUC 0,833 (95% ДИ 0,76–0,89, p < 0,001), а с помощью статистики Яндена было определено оптимальное значение отсечения, равное 6 баллам, которое использовалось для разделения исследуемой выборки для дальнейшего анализа. В группе с оценкой mNUTRIC 6 баллов смертность была значительно выше по сравнению с группой с <6 баллов (81% против 28%, p < 0,001). Ранее de Vries et al. подтвердили прогностическую способность шкалы mNUTRIC с использованием когорты из 475 пациентов на ИВЛ, поступивших в ОИТ в Нидерландах в период с 2011 по 2013 г. % ДИ 0,722–0,814) [12]. Аналогичные результаты были получены Mukhopadhyay et al. в азиатской популяции пациентов ОИТ с AUC 0,71 для прогнозирования смертности с использованием шкалы mNUTRIC [10]. Эти результаты подтвердили способность шкалы mNUTRIC прогнозировать смертность в определенной подгруппе пациентов с сепсисом и септическим шоком, т. е. в группе пациентов с высоким риском смерти.
Сообщалось о высокой распространенности недостаточности питания (от 38% до 78%) у пациентов в ОИТ, что было связано с плохим исходом [36]. Недостаточность питания может оказывать негативное влияние на иммунный ответ при сепсисе, увеличивая смертность в ОИТ и продолжительность пребывания в больнице [37,38]. Многочисленные исследования подтвердили полезность шкалы mNUTRIC для выявления пациентов из группы высокого алиментарного риска в популяции пациентов ОИТ [1,8,10,39]. Эта субпопуляция получит наибольшую пользу от соответствующей нутритивной терапии. Согласно исследованию Hung etal., иммунокомпетентные пациенты чаще страдали от неадекватного питания, а пациенты с неудовлетворенной потребностью в калориях имели худший прогноз с 90-дневной смертностью более 90% [40]. Напротив, у пациентов с иммунодефицитом с сепсисом недостаточное питание не влияло на смертность. Оценка mNUTRIC не делала различий между пациентами с ослабленным иммунитетом и иммунокомпетентными, но у выживших пациентов были более низкие оценки SOFA и NUTRIC и более высокое содержание калорий, чем у невыживших.
Существует недостаток крупных исследований, оценивающих исходы у пациентов с сепсисом, подвергнутых различным режимам калорийности. Ретроспективный анализ потребления калорий и белка у 1171 больного в критическом состоянии (22,8% с сепсисом) подтвердил, что как недостаточное, так и избыточное питание вредно [41]. Этот вывод не был подтвержден в исследовании TARGET, в котором оценивался эффект введения 1,5 кКл/мл по сравнению с 1 кКл/мл энтерального питания на кг массы тела у пациентов, находящихся в ОИТ на ИВЛ. Сепсис присутствовал в 25% в каждой группе лечения. Пациенты в энергоплотной группе получали значительно большее количество калорий. Это не влияло на смертность, длительность органной поддержки и частоту инфекционных осложнений [42].
Недавно опубликованное исследование показало, что в 2017 году во всем мире было зарегистрировано 48,9 миллиона случаев сепсиса; в том же году было также 11 миллионов смертей, связанных с сепсисом [43]. Эти оценки основаны на уникальном подробном анализе свидетельств о смерти и являются глобальными оценками заболеваемости сепсисом, включая случаи сепсиса, которые не лечились в стационаре. Самая высокая заболеваемость и смертность от сепсиса были оценены в регионах с наименьшей доступностью медицинских ресурсов, что указывает на необходимость использования административных инструментов для улучшения использования ресурсов ОИТ. До сих пор было проведено много исследований, чтобы найти модель для улучшения доступа к ресурсам интенсивной терапии. Одним из доступных методов является прогнозирование продолжительности пребывания в ОИТ, предполагая, что этот параметр может быть связан с интенсивностью использования ресурсов ОИТ. Verburg et al. предоставили систематический обзор моделей, предназначенных для прогнозирования продолжительности пребывания в ОИТ и было выявлено и исследовано 11 различных моделей [44].
Наиболее часто используемыми предикторами в этих моделях были общая тяжесть заболевания, источник госпитализации, возраст, использование ИВЛ, оценка комы Глазго, сопутствующие заболевания и организационные предикторы. К сожалению, ни одна модель не была признана полностью пригодной для планирования и выявления неожиданно длительного пребывания в ОИТ или для целей сравнительного анализа. Другой подход к улучшению доступа к ресурсам интенсивной терапии заключается в использовании показателей тяжести конкретного заболевания. Шкала PIRO (predisposition, insult, response, organ dysfunction) использовалась для оценки тяжести и прогнозирования использования ресурсов при вентилятор-ассоциированной пневмонии (ВАП) [45]. Модель была разработана как простой, практичный клинический инструмент для прогнозирования использования ресурсов здравоохранения на основе продолжительности пребывания в ОИТ и продолжительности ИВЛ, и продемонстрировала более широкое использование медицинских ресурсов у пациентов с высоким и очень высоким риском смерти на основе прогноза PIRO. Еще одним подходом к прогнозированию использования ресурсов отделения интенсивной терапии может быть модель, предназначенная для прогнозирования использования конкретных инвазивных методов лечения. Недавно Sukmark et al. разработали упрощенную систему оценки для прогнозирования серьезных осложнений у пациентов с диагнозом острая почечная недостаточность (ОПП) и находящихся на лечении в ОИТ [46].
Эта упрощенная клиническая оценка была основана на легкодоступных параметрах, таких как шкала комы Глазго, тахипноэ, использование вазопрессоров, использование ИВЛ, олигурия, креатинин сыворотки, азот мочевины крови, гематокрит и тромбоцитопения. Производительность модели была адекватной при внутренней проверке (AUC ниже ROC-кривой 0,80) и осуществимой даже в условиях ограниченных ресурсов; однако модель еще не прошла внешнюю проверку. Также были разработаны и оценены различные модели для прогнозирования шока и применения вазопрессоров. Недавно Kwak et. al. использовали модель обучения, основанную на внимании, для прогнозирования потребности в вазопрессорной терапии в течение первых 24 часов пребывания в ОИТ. В окончательной модели использовались только жизненные показатели, при этом наибольший вклад вносили частота сердечных сокращений, частота дыхания и среднее артериальное давление (AUC 0,83) [47]. В исследовании Liu et. al. для создания модели, предсказывающей потребность в вазопрессорах у тяжелобольных пациентов (AUC 0,81), была использована методика кластеризации, названная fuzzy c-means [48].
Авторы предполагают существование предшокового состояния, предшествующего переходу сепсиса в септический шок; обнаружение этого состояния с помощью разработанной модели может быть полезным при распределении ресурсов, особенно когда доступность ОИТ ограничена. Позже для внешней проверки модели использовалась база данных Medical Information Mart for Intensive Care-III. Были использованы три различных метода машинного обучения, которые показали хорошие результаты при выявлении пациентов с сепсисом, у которых может развиться септический шок, с AUC 0,93 и средним временем раннего предупреждения 7 часов [49, 50]. Аналогичный подход применялся для прогнозирования необходимости интубации [51–53]. Siu et al. использовали машинное обучение для разработки модели, предсказывающей необходимость интубации в течение первых 24 часов после поступления в ОИТ. Параметры, необходимые для модели, были следующими: результаты анализа газов крови, шкала комы Глазго, частота дыхания, насыщение кислородом, температура, возраст и параметры оксигенотерапии. Сообщаемая AUC модели составляла 0,86 (95% ДИ 0,85–0,87) [50].
Подходы, представленные выше, часто требовали расширенного автоматизированного электронного сбора и анализа данных в режиме реального времени. Такое ноу-хау не всегда доступно в условиях ОИТ. Мы использовали показатель mNUTRIC в качестве простого инструмента для прогнозирования использования ресурсов ОИТ. Следует отметить, что все параметры, необходимые для расчета mNUTRIC (возраст, исходная оценка по шкале APACHE IIи SOFA, количество сопутствующих заболеваний и количество дней от госпитализации до поступления в ОИТ), регулярно собираются или рассчитываются и хранятся в больничных записях пациентов. Используя порог отсечения 6 по 9-балльной шкале mNUTRIC, мы смогли выделить группу пациентов, которым достоверно чаще требовалось интенсивное использование ресурсов в течение всего пребывания в ОИТ.
5. Ограничения
В многочисленных предыдущих исследованиях было замечено, что шкала mNUTRIC выявляет пациентов с высоким риском недостаточности питания, которые, вероятно, получат пользу от нутритивной терапии во время пребывания в ОИТ [1,8,10,39]. Из-за отсутствия конкретных данных о питании взаимосвязь между смертностью, адекватностью питания и оценкой mNUTRIC не оценивалась в исследуемой когорте, и мы признаем, что это является ограничением исследования. С развитием интенсивной терапии возросла и сложность организации и структуры этих отделений; следовательно, разработка и использование систем оценки может способствовать улучшению распределения материальных и человеческих ресурсов. Показатели количественной оценки рабочей нагрузки медсестер в настоящее время являются одним из основных инструментов планирования и оценки в ОИТ. Наши результаты указывают на полезность оценки mNUTRIC в качестве потенциального инструмента для прогнозирования увеличения использования ресурсов в ОИТ; однако это одноцентровый анализ с относительно небольшим размером выборки, и мы считаем это еще одним ограничением исследования.
6. Выводы
Оценка NUTRIC, полученная при поступлении в ОРИТ, обеспечивает хорошую дискриминационную ценность для 28-дневной летальности и позволяет выявить пациентов, которым в конечном итоге потребуется интенсивное использование ресурсов ОИТ с сопутствующим увеличением сестринской нагрузки при лечении сепсиса в ОИТ. Наши данные показывают, что оценка mNUTRIC может быть полезна при планировании ресурсов ОИТ, особенно в условиях повышенного спроса на услуги интенсивной терапии, например, во время глобальной пандемии. Однако требуется внешняя проверка на основе большей когорты, прежде чем выступать за более широкое использование оценки mNUTRIC в качестве дополнительного инструмента для планирования ресурсов ОИТ.
References
1. Heyland, D.K.; Dhaliwal, R.; Jiang, X.; Day, A.G. Identifying Critically Ill Patients Who Benefit the Most from Nutrition Therapy: The Development and Initial Validation of a Novel RiskAssessment Tool. Crit. Care 2011, 15, R268. [CrossRef] [PubMed]
2. Zhang, P.; He, Z.; Yu, G.; Peng, D.; Feng, Y.; Ling, J.; Wang, Y.; Li, S.; Bian, Y. The Modified NUTRIC Score Can Be Used for Nutritional Risk Assessment as Well as Prognosis Prediction inCritically Ill COVID-19 Patients. Clin. Nutr. 2021, 40, 534–541. [CrossRef] [PubMed]
3. Kumar, N.; Kumar, A.; Kumar, A.; Pattanayak, A.; Singh, K.; Singh, P. NUTRIC Score as aPredictor of Outcome in COVID-19 ARDS Patients: A Retrospective Observational Study.Indian J. Anaesth. 2021, 65, 669. [CrossRef] [PubMed]
4. Renuka, M.K.; Arunkumar, A.S. Use of Nutrition Risk in Critically Ill (NUTRIC) Score toAssess Nutritional Risk in Mechanically Ventilated Patients: A Prospective Observational Study.Indian J. Crit. Care Med. 2017, 21, 253–256. [CrossRef] [PubMed]
5. Lin, P.-Y.; Yen, Y.-T.; Lam, C.-T.; Li, K.-C.; Lu, M.-J.; Hsu, H.-S. Use of Modified-NUTRICScore to Assess Nutritional Risk in Surgical Intensive Care Unit. J. Chin. Med. Assoc. 2021, 84,860–864. [CrossRef]
6. Zheng, C.; Xie, K.; Li, X.; Wang, G.; Luo, J.; Zhang, C.; Jiang, Z.; Wang, Y.; Luo, C.; Qiang, Y.; et al. The Prognostic Value of Modified NUTRIC Score for Patients in CardiothoracicSurgery Recovery Unit: A Retrospective Cohort Study. J. Hum. Nutr. Diet 2021, 34, 926–934.[CrossRef] [PubMed]
7. Tseng, C.-C.; Tu, C.-Y.; Chen, C.-H.; Wang, Y.-T.; Chen, W.-C.; Fu, P.-K.; Chen, C.-M.; Lai, C.-C.; Kuo, L.-K.; Ku, S.-C.; et al. Significance of the Modified NUTRIC Score for PredictingClinical Outcomes in Patients with Severe Community-Acquired Pneumonia. Nutrients 2021, 14,198. [CrossRef]
8. Rahman, A.; Hasan, R.M.; Agarwala, R.; Martin, C.; Day, A.G.; Heyland, D.K. Identifying Critically-Ill Patients Who Will Benefit Most from Nutritional Therapy: Further Validation of the “Modified NUTRIC” Nutritional Risk Assessment Tool. Clin. Nutr. 2016, 35, 158–162.[CrossRef]
9. Jeong, D.H.; Hong, S.-B.; Lim, C.-M.; Koh, Y.; Seo, J.; Kim, Y.; Min, J.-Y.; Huh, J.W.Relationship between Nutrition Intake and 28-Day Mortality Using Modified NUTRIC Score inPatients with Sepsis. Nutrients 2019, 11, 1906. [CrossRef]
10. Mukhopadhyay, A.; Henry, J.; Ong, V.; Leong, C.S.-F.; Teh, A.L.; van Dam, R.M.;Kowitlawakul, Y. Association of Modified NUTRIC Score with 28-Day Mortality in CriticallyIll Patients. Clin. Nutr. 2017, 36, 1143–1148. [CrossRef]
11. Villacrs, C.Q.; Ochoa, G.S.; Sarmiento-Bobadilla, M.; Hilbron, A.S.; Garcia, C.; Cuenca, J. 376:Assessing the nutric score 28-day mortality prediction in critically ill cancer patients. Crit. CareMed. 2020, 48, 170. [CrossRef]
12. de Vries, M.C.; Koekkoek, W.; Opdam, M.H.; van Blokland, D.; van Zanten, A.R. NutritionalAssessment of Critically Ill Patients: Validation of the Modified NUTRIC Score. Eur. J. Clin.Nutr. 2018, 72, 428–435. [CrossRef]
13. van den Berg, M.; van Beuningen, F.E.; ter Maaten, J.C.; Bouma, H.R. Hospital-Related Costsof Sepsis around the World: A Systematic Review Exploring the Economic Burden of Sepsis. J.Crit. Care 2022, 71, 154096. [CrossRef]
14. Lasater, K.B.; McHugh, M.D.; Rosenbaum, P.R.; Aiken, L.H.; Smith, H.L.; Reiter, J.G.;Niknam, B.A.; Hill, A.S.; Hochman, L.L.; Jain, S.; et al. Evaluating the Costs and Outcomes of Hospital Nursing Resources: A Matched Cohort Study of Patients with Common MedicalConditions. J. Gen. Intern. Med. 2021, 36, 84–91. [CrossRef] [PubMed]
15. Jones, S.L.; Ashton, C.M.; Kiehne, L.B.; Nicolas, J.C.; Rose, A.L.; Shirkey, B.A.; Masud, F.; Wray, N.P. Outcomes and Resource Use of Sepsis-Associated Stays by Presence on Admission,Severity, and Hospital Type. Med. Care 2016, 54, 303–310. [CrossRef]
16. Al-Saad, N.A.; Nortje, J. Principles of Resource Allocation in Critical Care. BJA Educ. 2017, 17,6. [CrossRef]
17. Dellinger, R.P.; Levy, M.M.; Rhodes, A.; Annane, D.; Gerlach, H.; Opal, S.M.; Sevransky, J.E.; Sprung, C.L.; Douglas, I.S.; Jaeschke, R.; et al. Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock, 2012. Intensive Care Med. 2013,39, 165–228. [CrossRef] [PubMed]
18. Singer, M.; Deutschman, C.S.; Seymour, C.W.; Shankar-Hari, M.; Annane, D.; Bauer, M.; Bellomo, R.; Bernard, G.R.; Chiche, J.-D.; Coopersmith, C.M.; et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315, 801–810.[CrossRef]
19. Knaus, W.A.; Draper, E.A.; Wagner, D.P.; Zimmerman, J.E. APACHE II: A Severity of Disease Classification System. Crit. Care Med. 1985, 13, 818–829. [CrossRef]
20. Vincent, J.-L.; Moreno, R.; Takala, J.; Willatts, S.; De Mendonça, A.; Bruining, H.; Reinhart, C.K.; Suter, P.; Thijs, L.G. The SOFA (Sepsis-Related Organ Failure Assessment) Score to Describe Organ Dysfunction/Failure. Intensive Care Med. 1996, 22, 707–710. [CrossRef]
21. Miranda, D.R.; de Rijk, A.; Schaufeli, W. Simplified Therapeutic Intervention Scoring System:The TISS-28 Items–Results from a Multicenter Study. Crit. Care Med. 1996, 24, 64–73.[CrossRef] [PubMed]
22. Jensen, G.L.; Mirtallo, J.; Compher, C.; Dhaliwal, R.; Forbes, A.; Grijalba, R.F.; Hardy, G.;Kondrup, J.; Labadarios, D.; Nyulasi, I.; et al. Adult Starvation and Disease-Related Malnutrition: A Proposal for Etiology-Based Diagnosis in the Clinical Practice Setting from theInternational Consensus Guideline Committee. Clin. Nutr. 2010, 29, 151–153. [CrossRef]
23. Malnutrition Advisory Group. A Consistent and Reliable Tool for Malnutrition Screening. Nurs.Times 2003, 99, 26–27.
24. Lim, S.-L.; Tong, C.-Y.; Ang, E.; Lee, E.J.-C.; Loke, W.-C.; Chen, Y.; Ferguson, M.; Daniels, L. Development and Validation of 3-Minute Nutrition Screening (3-MinNS) Tool for AcuteHospital Patients in Singapore. Asia Pac. J. Clin. Nutr. 2009, 18, 395–403.
25. Kruizenga, H.M.; Seidell, J.C.; de Vet, H.C.W.; Wierdsma, N.J.; van Bokhorst-de van der Schueren, M.A.E. Development and Validation of a Hospital Screening Tool for Malnutrition: The Short Nutritional Assessment Questionnaire (SNAQ). Clin. Nutr. 2005, 24, 75–82.[CrossRef]
26. Ferguson, M.; Capra, S.; Bauer, J.; Banks, M. Development of a Valid and Reliable Malnutrition Screening Tool for Adult Acute Hospital Patients. Nutrition 1999, 15, 458–464. [CrossRef] [PubMed]
27. Anthony, P.S. Nutrition Screening Tools for Hospitalized Patients. Nutr. Clin. Pract. 2008, 23,373–382. [CrossRef]
28. Kondrup, J.; Rasmussen, H.H.; Hamberg, O.; Stanga, Z. Ad Hoc ESPEN Working GroupNutritional Risk Screening (NRS 2002): A New Method Based on an Analysis of ControlledClinical Trials. Clin. Nutr. 2003, 22, 321–336. [CrossRef]
29. Detsky, A.S.; McLaughlin, J.R.; Baker, J.P.; Johnston, N.; Whittaker, S.; Mendelson, R.A.; Jeejeebhoy, K.N. What Is Subjective Global Assessment of Nutritional Status? JPEN J. Parenter.Enteral Nutr. 1987, 11, 8–13. [CrossRef]
30. Fu, P.-K.; Wang, C.-Y.; Wang, W.-N.; Hsu, C.-Y.; Lin, S.-P.; Kuo, C.-T. Energy Achievement Rate Is an Independent Factor Associated with Intensive Care Unit Mortality in High-Nutritional-Risk Patients with Acute Respiratory Distress Syndrome Requiring Prolonged Prone Positioning Therapy. Nutrients 2021, 13, 3176. [CrossRef]
31. dos Reis, A.M.; Fructhenicht, A.V.G.; Moreira, L.F. NUTRIC Score Use around the World: ASystematic Review. Rev. Bras. Ter.
Intensiv. 2019, 31, 379–385. [CrossRef]
32. Moretti, D. Estudio de dos variantes de la puntuación de riesgo nutricional. Nutr. Hosp. 2014,166–172. [CrossRef]
33. Mendes, R.; Policarpo, S.; Fortuna, P.; Alves, M.; Virella, D.; Heyland, D.K. Nutritional Risk Assessment and Cultural Validation of the Modified NUTRIC Score in Critically Ill Patients—A Multicenter Prospective Cohort Study. J. Crit. Care 2017, 37, 45–49. [CrossRef] [PubMed]
34. Lew, C.C.H.; Cheung, K.P.; Chong, M.F.F.; Chua, A.P.; Fraser, R.J.L.; Miller, M. Combining 2 Commonly Adopted Nutrition Instruments in the Critical Care Setting Is Superior to Administering Either One Alone. JPEN J. Parenter. Enteral Nutr. 2017, 45, 872–876. [CrossRef][PubMed]
35. Heyland, D.; Muscedere, J.; Wischmeyer, P.E.; Cook, D.; Jones, G.; Albert, M.; Elke, G.; Berger, M.M.; Day, A.G. A Randomized Trial of Glutamine and Antioxidants in Critically Ill Patients.N. Engl. J. Med. 2013, 368, 1489–1497. [CrossRef] [PubMed]
36. Lew, C.C.H.; Yandell, R.; Fraser, R.J.L.; Chua, A.P.; Chong, M.F.F.; Miller, M. Association Between Malnutrition and Clinical Outcomes in the Intensive Care Unit: A Systematic Review.JPEN J. Parenter. Enteral Nutr. 2017, 41, 744–758. [CrossRef]
37. Hamers, L.; Kox, M.; Pickkers, P. Sepsis-Induced Immunoparalysis: Mechanisms, Markers, and Treatment Options. Minerva Anestesiol 2015, 81, 426–439.
38. Villet, S.; Chiolero, R.L.; Bollmann, M.D.; Revelly, J.-P.; Cayeux RN, M.-C.; Delarue, J.;Berger, M.M. Negative Impact of Hypocaloric Feeding and Energy Balance on Clinical Outcomein ICU Patients. Clin. Nutr. 2005, 24, 502–509. [CrossRef]
39. Bodolea, C.; Nemes, A.; Avram, L.; Craciun, R.; Coman, M.; Ene-Cocis, M.; Ciobanu, C.; Crisan, D. Nutritional Risk Assessment Scores Effectively Predict Mortality in Critically IllPatients with Severe COVID-19. Nutrients 2022, 14, 2105. [CrossRef]
40. Hung, K.-Y.; Chen, Y.-M.; Wang, C.-C.; Wang, Y.-H.; Lin, C.-Y.; Chang, Y.-T.; Huang, K.-T.; Lin, M.-C.; Fang, W.-F. Insufficient Nutrition and Mortality Risk in Septic Patients Admitted toICU with a Focus on Immune Dysfunction. Nutrients 2019, 11, 367. [CrossRef]
41. Zusman, O.; Theilla, M.; Cohen, J.; Kagan, I.; Bendavid, I.; Singer, P. Resting EnergyExpenditure, Calorie and Protein Consumption in Critically Ill Patients: A Retrospective CohortStudy. Crit. Care 2016, 20, 367. [CrossRef]
42. The TARGET Investigators, for the ANZICS Clinical Trials Group. Energy-Dense versusRoutine Enteral Nutrition in the Critically Ill. N. Engl. J. Med. 2018, 379, 1823–1834.[CrossRef] [PubMed]
43. Rudd, K.E.; Johnson, S.C.; Agesa, K.M.; Shackelford, K.A.; Tsoi, D.; Kievlan, D.R.; Colombara, D.V.; Ikuta, K.S.; Kissoon, N.; Finfer, S.; et al. Global, Regional, and National Sepsis Incidence and Mortality, 1990–2017: Analysis for the Global Burden of Disease Study. Lancet 2020, 395,200–211. [CrossRef] [PubMed]
44. Verburg, I.W.M.; Atashi, A.; Eslami, S.; Holman, R.; Abu-Hanna, A.; de Jonge, E.; Peek, N.; deKeizer, N.F. Which Models Can I Use to Predict Adult ICU Length of Stay? A SystematicReview. Crit. Care Med. 2017, 45, e222–e231. [CrossRef]
45. Lisboa, T.; Diaz, E.; Sa-Borges, M.; Socias, A.; Sole-Violan, J.; Rodríguez, A.; Rello, J. The Ventilator-Associated Pneumonia PIRO Score. Chest 2008, 134, 1208–1216. [CrossRef]
46. Sukmark, T.; Lumlertgul, N.; Praditpornsilpa, K.; Tungsanga, K.; Eiam-Ong, S.; Srisawat, N. SEA-MAKE Score as a Tool for Predicting Major Adverse Kidney Events in Critically Ill Patients with Acute Kidney Injury: Results from the SEA-AKI Study. Ann. Intensive Care 2020,10, 42. [CrossRef]
47. Kwak, G.H.; Ling, L.; Hui, P. Predicting the Need for Vasopressors in the Intensive Care Unit Using an Attention Based Deep Learning Model. Shock 2020. Publish Ahead of Print.[CrossRef] [PubMed]
48. Rodrigues, J.M.; Fialho, A.S.; Vieira, S.M.; Mendonca, L.F.; Sousa, J.M.C. Data Mining and Modeling to Predict the Necessity of Vasopressors for ICU Patients. In Proceedings of the 2013 IEEE International Conference on Fuzzy Systems (FUZZ-IEEE), Hyderabad, India, 7–10July 2013; IEEE: Hyderabad, India, 2013; pp. 1–6.
49. Liu, R.; Greenstein, J.L.; Granite, S.J.; Fackler, J.C.; Bembea, M.M.; Sarma, S.V.; Winslow, R.L. Data-Driven Discovery of a Novel Sepsis Pre-Shock State Predicts Impending Septic Shock inthe ICU. Sci. Rep. 2019, 9, 6145. [CrossRef]
50. Johnson, A.E.W.; Pollard, T.J.; Shen, L.; Lehman, L.H.; Feng, M.; Ghassemi, M.; Moody, B.;Szolovits, P.; Anthony Celi, L.; Mark,
R.G. MIMIC-III, a Freely Accessible Critical Care Database. Sci. Data 2016, 3, 160035.[CrossRef]
51. Siu, B.M.K.; Kwak, G.H.; Ling, L.; Hui, P. Predicting the Need for Intubation in the First 24 h after Critical Care Admission Using Machine Learning Approaches. Sci. Rep. 2020, 10, 20931.[CrossRef]
52. Buswell, L.; Hayes, A.; Baombe, J. BET 2: Predicting the Need for Endotracheal Intubation in Poisoned Patients. Emerg. Med. J.
2019, 36, 573–575. [CrossRef] [PubMed]
53. Onishi, S.; Osuka, A.; Kuroki, Y.; Ueyama, M. Indications of Early Intubation for Patients withInhalation Injury. Acute Med. Surg.
2017, 4, 278–285. [CrossRef] [PubMed]
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 22.11.2023
[ACTIVE_FROM] => 22.11.2023
[SHOW_COUNTER] => 831
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2017-07-31 16:04:44
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829169
[VALUE] => Шкала NUTRIC, сепсис, ОРИТ,
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Шкала NUTRIC, сепсис, ОРИТ,
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2017-08-02 11:16:15
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829171
[VALUE] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2017-08-02 11:18:27
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829170
[VALUE] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829210
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2017-09-15 12:05:50
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2017-09-19 10:40:01
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2017-08-22 15:43:39
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829176
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2017-08-22 16:30:23
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2017-08-23 10:51:22
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2017-08-23 11:05:12
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829173
[1] => 829174
[2] => 829175
)
[VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => intensivnayaterapiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => intensivnayaterapiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2017-10-12 14:43:36
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2018-05-11 11:01:14
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829210
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829176
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829173
[1] => 829174
[2] => 829175
)
[VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => intensivnayaterapiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => intensivnayaterapiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Сепсис
[2] => Интенсивная терапия
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 26.08.2022 14:38:28
[~TIMESTAMP_X] => 26.08.2022 14:38:28
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
[BROWSER_TITLE] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
[KEYWORDS] => Шкала NUTRIC, сепсис, ОРИТ,
[DESCRIPTION] => Шкала NUTRIC как инструмент для прогнозирования смертности и увеличения использования ресурсов у пациентов ОРИТ с сепсисом
)
)






