Array
(
[NAME] => Управление сепсисом: загадка антибиотикотерапии в контексте индивидуализации принятия решений
[~NAME] => Управление сепсисом: загадка антибиотикотерапии в контексте индивидуализации принятия решений
[PREVIEW_PICTURE] => Array
(
[ID] => 5693
[TIMESTAMP_X] => 11.11.2024 13:59:29
[MODULE_ID] => iblock
[HEIGHT] => 3200
[WIDTH] => 5600
[FILE_SIZE] => 6003396
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/827/vz25xno5q9t4bw672gsnvomq4uiv9k8r
[FILE_NAME] => microorganism-magnified-science-reveals-nature-complex-workings-generated-by-ai.jpg
[ORIGINAL_NAME] => microorganism-magnified-science-reveals-nature-complex-workings-generated-by-ai.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 3f432ffa6514691a95c68d79ad520cc6
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/827/vz25xno5q9t4bw672gsnvomq4uiv9k8r/microorganism-magnified-science-reveals-nature-complex-workings-generated-by-ai.jpg
[UNSAFE_SRC] => /upload/iblock/827/vz25xno5q9t4bw672gsnvomq4uiv9k8r/microorganism-magnified-science-reveals-nature-complex-workings-generated-by-ai.jpg
[SAFE_SRC] => /upload/iblock/827/vz25xno5q9t4bw672gsnvomq4uiv9k8r/microorganism-magnified-science-reveals-nature-complex-workings-generated-by-ai.jpg
[ALT] => Управление сепсисом: загадка антибиотикотерапии в контексте индивидуализации принятия решений
[TITLE] => Управление сепсисом: загадка антибиотикотерапии в контексте индивидуализации принятия решений
)
[~PREVIEW_PICTURE] => 5693
[DETAIL_TEXT] => Ramasco, F.; Méndez, R.;Suarez de la Rica, A.; González de Castro, R.; Maseda, E.
Sepsis Stewardship: The Puzzle of Antibiotic Therapy in the Context of Individualization of Decision Making
J. Pers. Med. 2024, 14, 106. doi.org/10.3390/jpm14010106
АБСТРАКТ:
Основным недавним изменением, наблюдаемым в области инфекций у пациентов в критическом состоянии , стало всеобщее осознание необходимости более эффективного использования противомикробных препаратов, особенно в наиболее серьезных случаях за пределами применения простых и эффективных формул или жестких протоколов. Увеличение числа резистентных микроорганизмов, количественное увеличение масштабов хирургических операций и интервенционных процедур у пациентов с самым высоким риском, а также появление в последние годы новых антибиотиков (некоторые из которых очень специфически направлены против определенных механизмов резистентности, а другие с более широким спектром действия) заставили нас сместить наши вопросы с «с чем бороться» на «как лечить». В последнее время ведутся споры о том, как лучше подходить к антибиотикотерапии при сепсисе. Индивидуально подобранная и скорректированная доза, момент введения, цель и выбор схемы лечения указываются как факторы, имеющие особое значение для больных в критическом состоянии, у которых частота резистентных микроорганизмов, особенно среди группы Enterobacterales усложнили выбор антибиотикотерапии, требуя постоянного обновления знаний и создания мультидисциплинарных команд для противостояния инфекциям, трудно поддающимся лечению. В этой статье мы рассмотрели феномен возникновения резистентности к антибактериальным препаратам и попытались поделиться некоторыми идеями, такими как управление антибактериальной терапией, сохранение карбапенемов, а также организационные, микробиологические, фармакологические и информационные инструменты, которые мы рассматривали наиболее полезные и эффективные для принятия индивидуальных решений, учитывающих феномен множественной лекарственной устойчивости. Поэтому самая большая проблема принятия решений в этом контексте заключается в определении эффективного, оптимального и сбалансированного эмпирического лечения антибиотиками.
1. Введение
Основным недавним изменением, наблюдаемым в области инфекций у пациентов в критическом состоянии, стало всеобщее осознание необходимости более эффективного использования противомикробных препаратов, помимо применения простых формул и жестких протоколов. Рост резистентных микроорганизмов и количественный рост масштабных операций и интервенционных процедур у пациентов из группы наиболее высокого риска, а также появление в последние годы значительного числа новых антибиотиков привели к тому, что мы сместили наши вопросы с «чем лечить?» на «как лечить?» [1]. Существуют некоторые разногласия относительно того, как лучше всего подходить к лечению антибиотиками в этих случаях. Индивидуализированная и скорректированная доза, время введения и выбор режима отмечаются как факторы, важные для исходов при тяжелых инфекциях [2]. Частота резистентных микроорганизмов, особенно среди группы энтеробактерий, а также альтернатив лечения антибиотиками усложнили выбор соответствующего лечения, требуя постоянного обновления знаний и создания мультидисциплинарных команд для борьбы с инфекциями, которые трудно поддаются лечению [3]. В этой статье мы рассмотрим феномен возникновения антибактериальной резистентности и попытаемся поделиться некоторыми идеями и организационными, микробиологическими, фармакологическими и информационными инструментами, которые мы считаем наиболее полезными и эффективными для индивидуализированной терапии и принятия решений с учетом текущего контекста множественной лекарственной устойчивости. Поэтому самая большая проблема принятия решений в этом контексте заключается в определении эффективного, оптимального и сбалансированного эмпирического лечения антибиотиками.
2. Актуальная проблема антимикробной резистентности
Устойчивость к противомикробным препаратам в настоящее время является одной из самых серьезных проблем в лечении пациентов в критическом состоянии. Одной из основных причин устойчивости к противомикробным препаратам является безответственное и чрезмерное использование антибиотиков в животноводстве, сельском хозяйстве, ветиринарии и здравоохранении. Этому выводу способствовала инициатива «Единое здоровье», созданная Всемирной организацией здравоохранения (ВОЗ) (https://www.who.int/europe/initiatives/one-health (по состоянию на 15 января 2024 г), в рамках которой устойчивость к противомикробным препаратам считается наиболее актуальной чрезвычайной ситуацией в области общественного здравоохранения [4,5]. По оценкам, в 2019 году число смертей, связанных с устойчивостью к противомикробным препаратам, во всем мире составило 4,95 миллиона, из которых в общей сложности 1,27 миллиона были непосредственно связаны с устойчивостью к противомикробным препаратам, и, по оценкам, к 2050 году может быть достигнуто 10 миллионов смертей.Устойчивость к противомикробным препаратам среди грамположительных бактерий (GPB), по-видимому, стабилизируется или даже снижается, согласно недавнему исследованию, проведенному на пациентах с бактериемией, частота резистентности к грамотрицательным бактериям (GNB) растет и в настоящее время является причиной большинство случаев и смертей связаных с устойчивостью к противомикробным препаратам [6].
Однако тот факт, что существование инфекции, вызванной бактерией с множественной лекарственной устойчивостью, увеличивает смертность, является спорным. Влияние множественной лекарственной устойчивости на стоимость и продолжительность пребывания в больнице кажется очевидным, но строгое причинное влияние на смертность, несмотря на явную связь, является спорным. Существование неконтролируемых вмешивающихся факторов могло привести к выявлению такой связи в опубликованных исследованиях. Среди этих факторов можно выделить то, что, хотя множественная лекарственная устойчивость может сопровождаться терапевтической неудачей, в некоторых случаях такой неудачи не происходит. Однако использование более высоких доз и более продолжительное время лечения связано с появлением большего количества побочных эффектов, а также наблюдается более высокая распространенность колонизации и инфекций у пациентов с множественной лекарственной устойчивостью у пожилых пациентов и пациентов с ослабленным иммунитетом, что может привести к большему ограничению выбора препарата для лечения инфекций в отделениях интенсивной терапии (ОИТ) [7]. Эти данные делают устойчивость к противомикробным препаратам серьезной проблемой, требующей скоординированного глобального плана действий. ВОЗ разработала Global Action Plan for the Management of Antibiotic Resistance (GAP-AMR) и создала Global AntimicrobialResistance and Use Surveillance System (глобальную систему надзора за устойчивостью к противомикробным препаратам и их применением) для достижения целей программы. Среди основных ошибокк, с которыми мы сталкиваемся уже несколько лет, текущая проблема, как упоминалось ранее, сосредоточена на устойчивых GNB, сгруппированных вместе с некоторыми проблемными GPB под аббревиатурой ESKAPE [8,9].
Таким образом, во всем мире мы сталкиваемся с проблемой лечения супербактерий, и их распространенность в ОИТ трудно установить [9]. Для стандартизации терминологии в 2012 году множественная лекарственная устойчивость (MDR) определялась как приобретенная нечувствительность по крайней мере к одному препарату из трех или более категорий, экстремальная устойчивость определялась как нечувствительность по крайней мере к одному лекарственному средству во всех категориях, кроме двух или меньшего числа, и панрезистентность - как невосприимчивость всем агентам всех категорий [10]. Факторы риска множественной лекарственной устойчивости часто сосуществуют у пациентов в критическом состоянии и, тем более, в периоперационном контексте, когда реакция хозяина может быть девальвирована из-за нарушения функции иммунитета, вызванного острым или сопутствующими заболеваниями [11].
Основными индивидуальными факторами риска являются предыдущее воздействие антибиотиков в течение последних 90 дней, госпитализация в течение предыдущих 3 месяцев, длительная текущая госпитализация более 5 дней, наличие инвазивных устройств и предыдущая колонизация или инфекция микроорганизмами с множественной лекарственной устойчивостью. Местная эпидемиология с высокими показателями множественной лекарственной устойчивости является важным фактором риска, который необходимо учитывать [12]. Тяжесть заболевания как фактора риска множественной лекарственной устойчивости является спорным, хотя наличие септического шока является признанным фактором риска развития пневмонии с множественной лекарственной устойчивостью при нозокомиальной пневмонии и вентилятор-ассоциированной пневмонии как в европейских, так и в американских руководствах [13]. В недавнем многоцентровом исследовании, включавшем 2621 пациента в критическом состоянии с интраабдоминальным инфекции, не было различий в частоте множественной лекарственной устойчивости между группами пациентов с инфекциями с сепсисом или без него и с септическим шоком [14].
Стратегии, направленные на борьбу с устойчивостью к противомикробным препаратам, можно разделить на пять типов:
1. Профилактика снутрибольничных инфекций (инфекционный контроль в стационаре) и программы профилактики инфекций среди населения, основанные на гигиене и водопользовании;
2. Вакцинация как метод профилактики инфекции и ограничения применения антибиотиков;
3. Сокращение использования антибиотиков в немедицинских целях;
4. Увеличение инвестиций в разработку новых антибиотиков;
5. Сведение к минимуму длительность использования антибиотиков для лечения инфекций у человека. Именно этому последнему пункту способствует концепция рационального использования противомикробных препаратов (AMS ,СКАТ).
3. Управление противомикробными препаратами (СКАТ)
Целью СКАТ является правильное и эффективное назначение антибиотиков, позволяющее свести к минимуму возникновение резистентности, обеспечить устойчивое использование за счет оптимизации использования противомикробных препаратов в эмпирическом лечении и совершенствования таргетного лечения [15]. Однако в широком смысле программа такого типа должна преследовать цель создания «культуры инфекции», возглавляемой несколькими людьми, которые решающим образом влияют на быструю диагностику и правильное назначение противомикробных препаратов, на непрерывное обучение и внедрение новых методов диагнстики.Благодаря междисциплинарной философии работы эта программа не ограничивается созданием протоколов или членами команды. Существующие рекомендации относительно того, кто должен входить в состав ответственной группы, советуют, что группа должна состоять из экспертов или специалистов, более специализирующихся на инфекциях в ОИТ, микробиологов, фармакологов и врачи, специализирующиеся на инфекциях, независимо от их специальности [16]. Короче говоря, программы СКАТ, таким образом, приобретают значение «принятия на себя ответственности за то, за что вы не несете прямой ответственности» и, как было показано, улучшают исходы тяжелобольных пациентов с сепсисом, уменьшают возникновение резистентности в ОИТ и в больницах, значительно уменьшают ошибки и побочные эффекты, а также позволяют контролировать затраты [17–19]. Европейское общество интенсивной терапии (ESICM) создало очень интересную образовательную платформу под руководством Jan deWaele и Maurizio Cecconi для обучения созданию и развитию СКАТ (https://www.esicm.org/education/educational-initiatives/qualityimprovement). (по состоянию на 15 января 2024 г.).Реализация программы СКАТ начинается с выявления барьеров, которые мешают адекватному управлению инфекцией, в процессе постоянного совершенствования и поиска альянса с микробиологическими службами, рабочими группами по сепсису и т. д.
В этом смысле программы кодирования сепсиса (программы повышения эффективности лечения сепсиса) доказали свою эффективность в снижении смертности и являются еще одним примером важности вопроса «как» над вопросом «почему» [20,21]. Они были вдохновлены руководствами Surviving Sepsis Campaign (SSC) [22] и включают в себя набор клинических, организационных, аналитических и микробиологических инструментов, которые вместе с интенсивными обучающими и когнитивными средствами призваны улучшить результаты лечения сепсиса, определения приоритетов ухода [23]. Фокус этих программ ограничен первыми 24–36 часами оказания помощи пациентам с сепсисом и септическим шоком, и их философия включает оптимизацию и постоянное улучшение эмпирического лечения антибиотиками. Между этими типами моделей и программами СКАТ возникает все больше и больше координации, поскольку пациенты, которым наиболее срочно назначаются антибиотики, являются пациентами с сепсисом, и им требуется частая повторная оценка после первых 36–48 часов, чтобы провести деэскалацию, эскалацию или изменить их лечение. С этой целью важно знать местный уровень резистентности, используя местные рекомендации и рекомендации, опубликованные экспертами и научными обществами в качестве информационных материалов, чтобы иметь глубокие знания в области микробиологии, которые позволяют общаться с экспертами в нашей стране и больнице, и это позволяет нам улучшить фармакокинетические аспекты применения, учитывать возможную лекарственную аллергию и продвигать образовательные инициативы, направленные на более эффективное использование антибиотиков. В следующих разделах мы представим некоторые из этих инициатив, рассмотрим наиболее полезные классические концепции и предложим другие, более инновационные и авангардные аспекты [16].
3.1. "Начать умно" (Start Smart)
Эта модель подхода к тяжелой инфекции у пациентов в критическом состоянии включает в себя оптимизацию диагностики и стратегии деэскалации под эгидой программ СКАТ. Существование новых биомаркеров и быстрые микробиологические методы являются ключевым элементом этого нового подхода.
3.2. "Начни с умом, а затем сосредоточься"
Несколько лет назад правительство Соединенного Королевства выдвинуло лозунг “Start Smart and then focus” » https://www.gov.uk/government/publications/antimicrobialstewardship-start-smart-then-focus) (дата доступа: 17 январь 2024 г.), и мы считаем, что этот лозунг может быть хорошей моделью подхода к антибактериальной терапии сепсиса , поскольку разумное назначение антибиотиков тесно связано с персонализированным подходом, который не предусматривает одинаковое лечение всех очень серьезных случаев. Например, пациент с септическим шоком и с высокой бактериальной нагрузкой (при котором действует лозунг “hit fast and strong!” «ударить быстро и сильно!») не будет лечиться так же, как менее тяжелый случай, у которого есть подозрение на инфекцию, даже если оба могут быть госпитализированы в ОИТ [24].
Ключевые положения разумного начала антимикробной терапии включают:
Начинайте противомикробную терапию только при наличии явного подозрения или доказательства инфекции;
Имейте полное представление о лекарственной аллергии и других особенностях пациента;
Начинайте раннее и эффективное лечение пациентов с сепсисом и/или СШ;
Избегайте рутинного применения антибиотиков широкого спектра действия при лечении любой подозреваемой инфекции, не обращая внимания на сопутствующие клинические симптомы;
Будьте в курсе данных о местной микробиологии и моделях резистентности, преобладающих в отделении и стационарее;
По возможности получите посев перед началом терапии, принимая во внимание, что лечение не следует слишком сильно откладывать;
У тяжелобольных пациентов с септическим шоком используйте лучший из доступных антимикробных препаратов для устранения инфекции, а также контролируйте очаг, если это возможно, чтобы как можно скорее снизить бактериальную нагрузку [24].
Наконец, в качестве одного из самых ясных и твердых принципов «начинайте с умом» необходимо обеспечить документирование всех решений, связанных с инфекцией, в медицинской документации, поскольку очень часто лечение продолжается без необходимости, поскольку у врачей нет необходимой информации о причине начала приема этих антибиотиков, а также о том, когда они были начаты и как долго планируется продолжать их прием.Ситуация усугубляется, когда уход за пациентом передается от одного врача к другому в последовательные рабочие смены. Поэтому в записи рекомендуется указывать название антибиотика и его дозу, причину назначения, тяжесть заболевания, предполагаемую продолжительность лечения и дату оценки эффективности и коррекции (отмены) при необходимости.
3.3. «. . . А потом сосредоточься»: в чем это состоит
Вторая часть этого девиза напоминает нам об настоятельной необходимости пересмотреть клинический диагноз и рассмотреть возможность изменения, деэскалации или эскалации лечения. Благодаря современным достижениям в области быстрой микробиологической диагностики эта возможность может быть предоставлена менее, чем за 48 ч, что позволит принять решение о необходимости продолжения антибиотикотерапии теми же или другими антибиотиками и в какой дозе, а также задокументировать четкий план действий по принятию решения о назначении этих антибиотиков [25]. Каждый день необходимо задаться вопросом, адекватен ли антибиотик, оптимальна ли доза и нужен ли он пациенту [26].
Проблема лечения супербактерий: о чем следует думать, если АБТ неэффективна:
Позднее начало ;
Неподходящий спектр действия;
Неадекватный уровень в крови или недостаточное проникновение в очаг инфекции;
Наличие резистентных бактерий, не входящих в спектр назначенного антибиотика;
Наличие суперинфекции;
Неинфекционный источник лихорадки;
Очаг инфекции не контролируется должным образом.
4. Микробиология: ключевые понятия при сепсисе
Роль микробиологии при сепсисе является ключевой и требует от клиницистов наличия твердых микробиологических представлений, которые позволяют им правильно понимать информацию. Мы кратко рассмотрим некоторые моменты знаний, которые мы считаем важными в их ежедневном применении для улучшения результатов лечения [27,28].
4.1. Образцы и диагностические методы
Хорошая микробиологическая диагностика должна начинаться с правильного выбора клинического материала, предоставляемого в лабораторию; этот образец должен быть репрезентативным для подозреваемой инфекции, и при его обработке должны соблюдаться стандарты забора, отправки, документирования, и хранение.Микробиологическая культура продолжает оставаться эталонным методом, поскольку она не только позволяет охарактеризовать микроорганизмы, вызывающие инфекцию, но также позволяет провести соответствующие тесты на чувствительность к противомикробным препаратам выделенного образца. Однако необходимость быстрого получения результатов и технологический прогресс привели к развитию молекулярных методов, которые произвели революцию в микробиологической диагностике [29].
Среди быстрых методик в настоящее время выделяются две:
- MALDI-TOF : метод, основанный на масс-спектрометрии. MALDI-TOF в настоящее время позволяет идентифицировать микроорганизмы менее чем за 30 минут (ранее это занимало до 18 часов) посредством анализа их белкового профиля. Это, пожалуй, самый распространенный экспресс-метод [30].
- RT-PCR (полимеразная цепная реакция в реальном времени): молекулярный метод, позволяющий напрямую идентифицировать микробы в образце. Другие доступные молекулярные методы, по-видимому, сегодня менее распространены из-за их высокой стоимости [30], а системы быстрой микробиологической диагностики непосредственно на месте лечения (POC) становятся все более распространенными в ОИТ [31].
4.2. Минимальная ингибирующая концентрация (МИК)
При выполнении метода определения чувствительности к антибиотикам in vitro основная цель состоит в том, чтобы предсказать, можно ли лечить пациента с инфекцией, вызванной определенным микробом, антимикробным препаратом или следует выбрать другой вариант. Минимальная ингибирующая концентрация (МИК) определяется как самая низкая концентрация противомикробного препарата, которая подавляет рост микроорганизма после инкубации. МИК, следовательно, имеет решающее значение для подтверждения устойчивости микроорганизмов к противомикробному агенту, а также для мониторинга активности новых противомикробных агентов [32]. Классически мы знаем, что существуют антибиотики, зависящие как от времени, так и от концентрации. Антибиотики, зависящие от времени, считаются адекватными для лечения инфекции, вызванной бактерией, если при введении в дозах, считающихся терапевтическими (т. е. нетоксичными), они достигают концентрации в плазме в месте инфекции, по крайней мере, в четыре раза превышающей МИК в период между введениями. Концентрационно-зависимые антибиотики – это антибиотики, которые считаются адекватными для лечения инфекции, когда их пиковая концентрация в 10–12 раз превышает значение МИК. Для интерпретации тестов на чувствительность European Committee on Antimicrobial Susceptibility Testing (EUCAST) с 2019 года определил следующие категории [33]:
S: чувствительный. бактерия, ингибируемая in vitro концентрацией противомикробного препарата, что связано с высокой вероятностью терапевтического успеха.
I: (ранее промежуточная) чувствительность при увеличении экспозиции. В этом случае микроорганизм становится чувствительным при увеличении воздействия антибиотика; следовательно, существует высокая вероятность терапевтического успеха, поскольку воздействие агента увеличивается за счет корректировки режима дозирования или увеличения дозы препарата.
R: устойчивый. Лечение исследуемого микроорганизма данным антибиотиком имеет высокую вероятность терапевтической неудачи.
Чтобы включить противомикробный препарат в одну из этих категорий, требуется точка отсечения (BP), которая представляет собой МПК, определяющую включение в конкретную категорию. В настоящее время EUCAST определяет ВР в Европе и публикует их данные на веб-сайте с открытым доступом: http://www.eucast.org. (по состоянию на 17 января 2024 г.). По мере развития микробиологических, фармакокинетических, фармакодинамических и клинических знаний EUCAST периодически пересматривает BP и можно наблюдать, что ранее чувствительный микроорганизм с такой же МПК через год может быть определен как обладающий повышенной чувствительностью или даже как устойчивый.
МИК используется не только для определения концентрации противомикробного препарата, который будет получать пациент, но также и типа используемого противомикробного препарата, что позволяет снизить вероятность развития устойчивости микроорганизмов к конкретным противомикробным препаратам. Это не означает, что необходимо выбирать противомикробные препараты с более низким значением МИК, поскольку играют роль другие факторы, такие как фармакокинетика противомикробного препарата и концентрация, достигаемая в месте инфекции. Однако более низкое значение МИК приводит к более высокой вероятности достижения терапевтической цели и возможности меньшего развития механизмов токсичности и устойчивости, особенно мутационных. Важно отметить, что МИК определены для каждого микроорганизма в отношении каждого антибиотика; поэтому, строго говоря, тот факт, что один антибиотик имеет более низкую МИК, чем другой, для одного и того же микроорганизма, не имеет терапевтического значения. С другой стороны, ссылка на один и тот же антибиотик для определенного микроорганизма (например, МИК 1 г/мл или 8 г/мл), несмотря на то, что оба имеют «чувствительные» значения МИК, будет иметь терапевтические последствия. Продолжая пример, при МИК 8 г/мл для достижения оптимального лечения потребуется более высокая доза антибиотика, что может повысить токсичность или потребовать проведения продленной инфузии; для оценки второго чувствительного противомикробного препарата и принятия решения о его применении, синергизме и в некоторых случаях, может побудить к решению использовать другой антибиотик, несмотря на то, что этот другой антибиотик был классифицирован как «чувствительный», [33].
4.3. Концентрация антибиотика ,ингибирующая появление резистентных мутантов
"Профилактическая концентрация" (MPC) представляет собой МИК наименее чувствительного мутанта среди гетерогенной бактериальной популяции и представляет собой самую низкую концентрацию антибиотика, которая предотвращает или блокирует появление резистентных мутантов [34]. Существует окно концентраций, предотвращающее появление устойчивых мутантов. Подвергание бактериальной популяции действию противомикробного препарата обычно оказывает на нее пагубное воздействие, подавляя ее рост или вызывая ее гибель. Этот эффект не всегда очевиден, либо из-за наличия у микроба предшествующего механизма устойчивости, либо из-за появления устойчивых мутантов. Во время применения противомикробных препаратов отбор устойчивых мутантов может происходить динамически с течением времени. Это связано с дозой противомикробного препарата и частотой его применения, его фармакокинетикой в месте инфекции и временем, в течение которого достигаются концентрации, равные или превышающие MPC. Противомикробные препараты можно охарактеризовать как обладающие мутагенным действием и вызывающие мутации.
Однако устойчивые мутанты естественным образом обнаруживаются в бактериальных популяциях независимо от присутствия противомикробного препарата в окружающей среде. Каждая бактериальная популяция с разной частотой имеет устойчивые мутанты, сосуществующие с наиболее восприимчивой популяцией. При определенных обстоятельствах, когда бактериальная популяция подвергается действию противомикробного препарата, устойчивые мутанты могут стать доминантными, ингибируя наиболее чувствительную фракцию, но не устойчивых мутантов. Этот процесс известен как отбор устойчивых мутантов. В этих случаях вероятность отбора этих мутантов будет выше при неподходящем лечении, не адаптированном к фармакокинетическим/фармакодинамическим параметрам (Pk/Pd) и при использовании неадекватных доз [35]. МРС не является строго параметром антимикробной активности, который лучше определять по значению МИК и его правильной интерпретации; однако его можно использовать как таковое. Ее применение для ограничения или уменьшения селекции резистентных мутантов при использовании антимикробных препаратов с критериями Pk/Pd и, следовательно, для возможности избежать связанных с этим клинических неудач позволило бы предположить, что MPC является параметром активности. Кроме того, эта концепция имеет четкое клиническое применение и помогает определить наиболее подходящую дозу антимикробного препарата, по крайней мере, с точки зрения селекции мутантов, и дифференцирует антимикробные препараты, которые следует использовать при разработке рекомендаций по лечению и определению антимикробной политики [36
4.4. Важность ректального экссудата
В рамках микробиологических тестов у пациентов в критическом состоянии мы подчеркиваем роль, которую ректальный экссудат может играть в качестве эффективной и высокопродуктивной культуры для наблюдения, которая может определить, какой микроорганизм потенциально вызывает серьезную инфекцию и как действовать на основе результата. Результат этого теста, доступный через 24–36 часов, может быть очень полезен, когда микроорганизм-возбудитель не идентифицирован, чтобы помочь решить, что назначить в качестве окончательного эмпирического лечения антибиотиками. Большинство внутрибольничных инфекций являются эндогенными и происходят из микробиоты слизистых оболочек. Эта эндогенная инфекция возникает вследствие транслокации преобладающих аэробных микроорганизмов в слизистую оболочку кишечника, и вероятность диагностики зависит от плотности и площади колонизации. Значительное или неоднократное присутствие ГНБ в ректальном экссудате предполагает их избыточный рост в просвете кишечника, а связь между колонизацией кишечника и риском бактериемии, инфицирования микроорганизмами, продуцирующими карбапенемазы, или кандидемии, среди прочего, была подтверждена [37]. Состав кишечной микробиоты может измениться в течение 72 часов после появления нового микроорганизма или начала лечения антибиотиками; таким образом, определение микроорганизмов, составляющих эту микробиоту, и их чувствительности дает нам важные показатели, касающиеся возможной этиологии инфекций.
По этой причине рекомендуется активно искать наличие MDR у всех пациентов путем получения ректального экссудата, независимо от наличия получения культур из иного клинического материала. Это особенно актуально для пациентов с септическим шоком на момент поступления в ОИТ. Этот процесс следует проводить не реже одного раза в неделю на протяжении всего пребывания [24]. Аналогичным образом, при поступлении пациента в ОИТ необходимо заполнить «контрольный список» для выявления лиц с высоким риском носительства MDR, особенно устойчивых к карбапенемам [38].
Факторы риска носительства MDR :
1. Более 5 дней госпитализации в течение предшествующих 3 месяцев;
2. Пациенты, находящиеся в домах длительного ухода;
3. Известная колонизация или инфекция MDR ;
4. Продолжительность лечения антибиотиками более 1 недели в предыдущие 3 месяца (особенно цефалоспоринами третьего и четвертого поколений, хинолонами или карбапенемами);
5. Больные хронической почечной недостаточностью, находящиеся на диализе;
6. Больные с хронической патологией и высокой частотой MDR -инфекций (бронхоэктатическая болезнь, муковисцидоз и др.).
5. Фармакокинетика и фармакодинамика бета-лактамов
Учитывая нехватку эффективных лекарств против резистентных штаммов, Pk/Pd уделяется больше внимания при выборе антибиотиков и способах их введения [39]. Ввиду их важности и частоты использования мы сосредоточим внимание на изучении Pk/Pd бета-лактамов. Эти препараты зависят от времени: их антибактериальная эффективность связана с параметром, который учитывает время, когда их концентрации в плазме в четыре-восемь раз превышают МИК. По данным экспериментальных исследований и в зависимости от стабильности каждой коммерческой формы рекомендуется применять эти препараты в виде продленной инфузии продолжительностью от 1 до 4 часов или даже непрерывной инфузии, по крайней мере, когда рассматривается возможность лечения инфекций, вызванных MDR -возбудителями и это возможно из-за стабильности препарата. Хотя ожидаемая клиническая эффективность этого предложения не была продемонстрирована, либо из-за отсутствия эффекта, либо из-за недостаточного размера проведенных сравнительных исследований, либо даже из-за возможных методологических ошибок, такие влиятельные исследования, как DALI, продемонстрировавшие недостаточную экспозицию [40], и влияние врачебных сообществ сделали длительные инфузии бета-лактамов стандартом в ОИТ [41]. В этой связи интересно прокомментировать результаты недавнего РКИ с явно противоречивыми результатами по этой теме. Что касается меропенема, на сегодняшний день рекомендовано введение общей суточной фракционированной дозы, но при длительной инфузии в течение 3–4 ч. РКИ «Исследование MERCY» показало, что у пациентов в критическом состоянии с сепсисом или септическим шоком не было различий в смертности через 28 дней или в появлении резистентности между непрерывным инфузионным введением одного и того же препарата: доза 3 г в течение 24 ч и прерывистый прием (1 г каждые 8 ч, в течение 30–60 мин). Как указано в редакционной статье, сопровождающей исследование, поскольку инфузии не причиняют вреда и не влекут за собой дополнительных затрат, в рекомендациях трудно обсуждать даже опубликованы метаанализы, которые указывают на возможное снижение смертности [42]. Фактически, текущие консенсусные рекомендации нескольких обществ, хотя и признают низкий уровень доказательности, по-прежнему предполагают использование бета-лактамов с пролонгированной инфузией по сравнению с бета-лактамами с короткой инфузией у взрослых пациентов , особенно в случаях инфекции GNB [42].
Более того, в этом смысле существует интерес к введению антибиотиков не внутривенным путем для лечения определенных инфекций. Это относится к аэрозолям для профилактики и лечения респираторных инфекций, связанных с интубацией. Однако отсутствие достаточных РКИ [43], а также необходимость в специальных устройствах для правильной аэрозолизации означает, что аэрозолизация остается практикой, не рекомендованной Американским торакальным обществом (ATS), CDC и ESCMID [44–46]. Однако в клинической практике показания должны обсуждаться и персонализироваться для каждого случая. Хотя качественных клинических данных нет, существует большое количество экспериментальных данных о том, что у ослабленных пациентов с тяжелой пневмонией, вызванной бактериями с множественной лекарственной устойчивостью и с высоким риском неудачи лечения небулайзерная терапия антибиотиками может увеличить вероятность достижения очень высоких концентраций препарата в месте инфекции, что способствует терапевтическому успеху [47].
Несмотря на то, что до сих пор недостаточно доказательств в пользу новых бета-лактамов с ингибитором бета-лактамаз (BL-BLI), терапевтический лекарственный мониторинг (TDM) может решить определенные проблемы, если мы также будем помнить, что любой антибиотик имеет риск достижения «недостаточно стабильных» концентраций в плазме во время непрерывного инфузионного введения. Хотя постоянная или расширенная инфузия могут несколько снизить этот риск (поскольку во время введения будет, по крайней мере, легче достичь достаточных пиков в плазме), только TDM может подтвердить достижение желаемых уровней [48]. В отсутствие этого и благодаря широкому терапевтическому диапазону бета-лактамов у пациентов в критическом состоянии с высокими объемами распределения и возможным увеличением клиренса мы считаем, что предпочтительнее назначать самые высокие рекомендуемые дозы, а не отдавать предпочтение введению в более низких дозах [49].
6. Аллергия на бета-лактамы
Ярлык аллергии на бета-лактамы часто навешивается самими пациентами, и в большом количестве случаев из-за появления симптомов, которые даже не имеют основного иммунного механизма (диарея, головная боль и т. д.).Подсчитано, что этот термин применяется к 15% населения в целом и верен менее чем в 10% этих случаев (следовательно, только примерно к 1% населения) [50,51]. По этой причине важно заложить определенные основы, которые становятся все более необходимыми, чтобы не ограничивать использование группы антибиотиков, которая является первой линией лечения при многих инфекциях из-за ее более или менее широкого спектра действия, а также потому, что она недорогая и генерирует мало побочных эффектов для пациента. Строго говоря, истинной аллергией считаются только иммунологические реакции, опосредованные IgE (тип I по классификации Гелла и Кумбса). Проявления этих реакций разнообразны и обычно появляются в течение первого часа после введения препарата. Хотя не все эти реакции являются тяжелыми, наиболее тяжелые формы (анафилаксия и бронхоспазм) опасны для жизни и противопоказаны к последующему назначению препарата, вызвавшего их. Однако существуют и другие типы иммунологических реакций, опосредованных другими различными и иммунокомплексными антителами (реакции типа II и III) или Т-лимфоцитами (реакции типа IV), которые либо противопоказаны к такому введению, например: тяжелые кожные синдромы или могут потребовать осторожности и наблюдения при последующих введениях (например, цитопения). Теперь мы знаем, что бета-лактамы вызывают мало перекрестных реакций между собой из-за самого бета-лактамного кольца, а большинство перекрестных реакций происходит из-за сходства боковых цепей, которые являются общими для различных препаратов в группе, что делает такие перекрестные реакции частыми между отдельными бета-лактамными соединениями (например, между аминопенициллинами и аминоцефалоспоринами), но не между всеми из них [52]. Провокационная проба или пероральный тест по-прежнему являются золотым стандартом диагностики.Однако примечательно, что научные общества обычно считают скрининг по анамнезу недостаточным [53,54], в то время как многие авторы требуют его использования в экстренных случаях и предложить подход, который обеспечивает безопасное и немедленное введение препарата в тяжелых случаях, когда нет разумных альтернатив [55–58].
7. Что следует знать о старых антибиотиках
Интересное исследование, проведенное ESCMID в ряде европейских стран, США, Канаде и Австралии, показало, что такие препараты, как клоксациллин или азтреонам, доступны только примерно в половине этих стран, что не во всех из них был колистин, и только 5 из 38 имели препарат для внутривенного введения [59].Однако появление резистентности, особенно среди Г(-) бактерий, возродило интерес к использованию этого типа препарата с хорошей активностью против MDR -микробактерий, длительной историей применения и который, по данным данного исследования, был отодвинут на второй план из-за к токсичности, поскольку препарат имеет узкий спектр действия или по рыночным причинам [60]. Среди этих препаратов, проявляющих активность в отношении ГНБ, — фосфомицин, колистин и котримоксазол. Все они практически не обладают активностью в отношении анаэробов, а их активность в отношении Г (+) бактерий варьирует. Что касается фосфомицина, то, похоже, существует консенсус относительно его полезности только в качестве альтернативы нитрофурантоину или триметоприму-сульфаметоксазолу (TMP-SMX) при неосложненном цистите, вызванный GNB-продуцирующими бета-лактамазами расширенного спектра действия или карбапенемазами. В почечной паренхиме он не достигает достаточных концентраций, поэтому не рекомендуется в случаях осложненной инфекции мочевыводящих путей , бактериемии или других серьезных инфекционных заболеваниях иной локализации и должен применяться только если возбудителем является E. coli, поскольку K. pneumoniae и другие грамотрицательные возбудители инфекции являются частыми носителями гидролазы fosA, которая инактивирует препарат. Однако учитывая распространенность микроорганизмов с множественной лекарственной устойчивостью его использование возросло, особенно в сочетании с другими препаратами [61]. Колистин, обладающий известным нефротоксическим потенциалом и узким терапевтическим индексом, был ранее рекомендовался в схемах комбинированной АБТ для лечения карбапенемазы, продуцирующей GNB или Pseudomonas aeruginosa MDR, но наличие нового BL-BLI и растущее увеличение резистентности к колистину вследствие его применения в последние годы. способствовал тому, что от этой практики практику рекомендовали воздержаться. В настоящее время колистин практически выведен из употребления. для лечения инфекций, вызванных Acinetobacter baumannii, а также в случаях резистентности или непереносимость нового BL-BLI [62].
Котримоксазол играет ключевую роль при ИМП (осложненных или нет), как вызванных энтеробактериями, продуцирующими ESBL, так и резистентными к карбапенемам. Он теряет свою эффективность против Pseudomonas aeruginosa, но восстанавливает свою эффективность против стенотрофомонас мальтофилия, против которой он является одним из методов лечения [63]. Однако, как и в случае с колистином, в ОИТ часто показано использование альтернатив, таких как цефидерокол или комбинация цефтазидима/авибактама с азтреонамом [64]. Тигециклин обладает широким спектром активности, что делает его привлекательным вариантом лечения MDR-инфекции [65]. Однако сообщалось, что в некоторых случаях он может привести к неэффективности лечения, если его использовать в качестве монотерапии, поскольку он является бактериостатическим антибиотиком [66]. Таким образом, эти альтернативы, как правило, не следует рекомендовать для текущего эмпирического использования, а также, в контексте септического шока, в отделениях с высоким уровнем резистентности. Что касается Г (+) бактерий для лечения этих инфекций также стоит упомянуть TMP-SMX (дешевого и востребованного препарата для последовательного лечения), а также рифампицина и клиндамицина.Ни один из них не представлен в качестве препарата выбора по сравнению к более эффективным альтернативам, таким как ванкомицин, линезолид и даптомицин. TMP-SMX, по-видимому, рекомендуется только при инфекциях, требующих длительного лечения (бактериемия и внутрибольничная пневмония), а также при выявлении чувствительности к нему микроба [68]. Рифампицин и клиндамицин рекомендуются только в составе комбинированного режима в сочетании с лечением первой линии при определенных состояниях, таких как остеомиелит, некротическая пневмония, менингит и, особенно, в случае рифампицина, эндокардита протезированного клапана, за счет потенциально более сильного эффекта эрадикации рифампицина на материал протеза [69]. Наконец, стоит отметить потенциальную роль хинупристина-дальфопристина в альтернативном лечении инфекций, вызванных E. faecium, когда этот микроорганизм проявляет устойчивость к ванкомицину, линезолиду и даптомицину [59].
8. Что нужно знать о новых антибиотиках
Инициативы «10 антибиотиков к 2020 году», предложенные администрацией Обамы и способствующие патентованию новых противомикробных препаратов, позволили нам стать свидетелями в последние годы появления новых антибиотиков, которые улучшили арсенал, доступный для лечения инфекций, вызванных MDR-возбудителями и разумное использование которых повышает эффективность значение существования программ СКАТ [70]. Всесторонний обзор новых антибиотиков выходит за рамки данного обзора, и в литературе имеются очень хорошие обзоры, как специфические, так и генерические [71,72]. По этой причине, прежде чем перейти к более конкретным рекомендациям, мы кратко рассмотрим некоторые характеристики новых антибиотиков. Мы остановимся подробнее на цефтазидиме/авибактаме ввиду уже существующего клинического опыта и профиля цефтазидима/авибактама для эмпирического лечения в контексте множественной лекарственной устойчивости. Кроме того, более кратко, мы выскажем несколько интересных соображений относительно цефтолозана/тазобактама и цефидерокола. В Таб 1 показаны новые и наиболее важные препараты, которые уже имеются на рынке или сроко появятсяя на рынке, а также некоторые их ключевые характеристики, такие как доза и спектр действия.
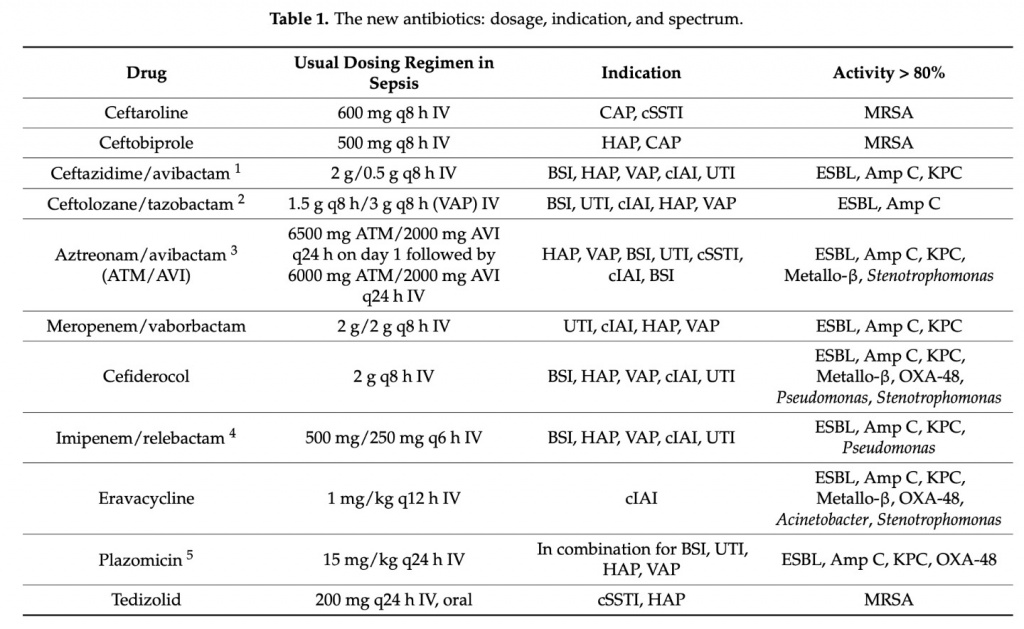

8.1. Цефтазидим/Авибактам
Цефтазидим/авибактам представляет собой комбинацию существующего цефалоспорина цефтазидима (ингибитора синтеза бактериальной клеточной стенки, вызывающего гибель клеток) и нового ингибитора авибактама (инактиватора некоторых бета-лактамаз путем ковалентного ацилирования бета-лактамаз и которое само по себе не обладает антибактериальными свойствами). Добавление авибактама восстанавливает активность цефтазидима in vitro в отношении значительного числа бета-лактамаз, включая ферменты класса А по классификации Амблера (ESBL и карбапенемазы K. pneumoniae (KPCs), ферменты класса C (Amp C) и некоторыеферменты класса D (карбапенемазы OXA-48). Он не проявляет активности в присутствии ферментов класса В (металло-ß-лактамаз) [73]. Таким образом, он обладает спектром антипсевдомонадного действия цефтазидима и активен в отношении других ГНБ в целом и в отношении Enterobacterales в частности. Однако он не проявляет активности в отношении Acinetobacter, Stenotropomonas maltophilia, или анаэробы (при этом стоит напомнить, что необходимо дополнить препаратов с антианаэроной активностью при оИАИ). Антибиотик зарегистрирован FDA и EMA для лечения осложненных внутрибрюшных инфекций, осложненных инфекций мочевыводящих путей, внутрибольничной пневмонии и пневмонии, связанной с искусственной вентиляцией легких [74]. Эффективность цефтазидима/авибактама подтверждена значительными клиническими данными, и различные общества и эксперты рекомендуют его использование в качестве первой альтернативы при таргетном лечении инфекций, вызванных энтеробактериями, продуцирующими карбапенемазы, такими как OXA-48 или KPC, а также его альтернативное применение в качестве отдельного препарата или в сочетании с другими препаратами в других ситуациях, связанных с инфекцией Pseudomonas или карбапенемазами, кроме упомянутые выше [64,75–77].Реальные данные также указывают на благоприятные результаты, даже при инфекциях MDR5. [78]. Мы выделим EZTEAM, в которую вошли 569 пациентов в 11 странах, получавших лечение в первой или второй линии цефтазидимом/авибактамом, со всеми типами тяжелой инфекции, в из которых 89,3% были устойчивы к карбапенемам [79].
Что касается важности раннего введения препарата, то его использование в течение 48 часов после начала инфекции было связано с лучшими клиническими результатами [80]. Примером может служить исследование Jorgensen et al., в которое были включены 203 пациента с МDR-инфекциями, 117 из которых были устойчивыми к карбапенемам Enterobacterales (CRE) или Pseudomonas [81]. Из 203 пациентов 91 получил цефтазидим/авибактам в течение 48 часов от начала инфекции. Показатель клинического успеха, когда лечение было начато в течение 48 часов, составил 33,3%, а неудача — 18,6%. Каждые 24 часа отсрочки введения цефтазидима/авибактама значительно ухудшала результаты, тогда как регрессионная модель клинической неудачи показала, что цефтазидим/авибактам, введенный в течение 48 часов после сбора культуры, имел защитный эффект (ОШ: 0,409). Наша группа участвовала в другом интересном исследовании по оценке возможных преимуществ комбинации цефтазидим/авибактам при эмпирическом лечении [82]. В этом ретроспективном исследовании с участием 339 пациентов лечение цефтазидимом/авибактамом при инфекциях, продуцирующих карбапенемазу OXA-48 и KPC, сравнивали с лучшей доступной терапией, которая включала, среди прочего, карбапенемы с тигециклином, колистином или фосфомицином. Мы заметили, что лечение цефтазидимом/авибактамом было связано с более длительной выживаемостью. Интересно, что у наиболее тяжело больных пациентов результаты лечения цефтазидимом/авибактамом в монотерапии были лучше. Подобные исследования, а также другие исследования реальной практики подчеркивают преимущества использования цефтазидима/авибактама на ранней стадии сепсиса и у наиболее тяжелых пациентов.
По этой причине испанский консенсус оценивает тяжесть по шкале Чарльсона, среди прочего для принятия решения об эмпирической антибиотикотерапии и включает цефтазидим/авибактам в качестве одного из основных антибиотиков в эмпирическом лечении, аналогично меропенему, учитывая его очень широкий спектр действия в отношении МЛУ-ГНБ, а также его бактерицидную и синергическую способность [24]. Что касается синергизма, то очень интересно проанализировать его в контексте внутрибольничных инфекций в отделениях с большим количеством MDR-инфекций. Был изучен синергизм цефтазидима/авибактама с меропенемом, амикацином, азтреонамом, колистином и фосфомицином против мультирезистентных Klebsiella pneumoniae и Pseudomonas aeruginosa, что привело к полезной ассоциации, значительно снижающей бактериальную нагрузку в логарифмической форме и, в случае, меропенема и азтреонама, восстанавливая их активность в отношении этих микроорганизмов [83]. Таким образом, комбинация цефтазидима/авибактама и меропенема может иметь смысл при наличии MDR-микроорганизмов у пациентов с септическим шоком и высокой бактериальной нагрузкой.
8.2. Цефтолозан/Тазобактам
Цефтолозан/тазобактам — новый антибиотик, состоящий из нового цефалоспорина, связанного с тазобактамом, известным ингибитором β-лактамаз. Цефтолозан/тазобактам активен в отношении Pseudomonas aeruginosa MDR, в том числе устойчивых к карбапенемам, и против энтеробактерий, продуцирующих ESBL. Однако в случае CRE он не активен. Препарат одобрен FDA и EMA для лечения внутрибрюшных инфекций, осложненных инфекций мочевыводящих путей, а также внутрибольничных и вентилятор-ассоциированных пневмоний [84]. Отсутствие активности в отношении CRE ограничивает эмпирическое использование цефтолозана/тазобактама в некоторых ситуациях. Однако когда фокусом подозрения на сепсис является нозокомиальная пневмония, ее эмпирические результаты очень хорошие, и в этой ситуации его можно рекомендовать в качестве эмпирического лечения [85].Особо следует отметить исследование Timsit, являющееся частью ключевого исследование по показаниям к применению цефтолозан/тазобактам при пневмонии (ASPECT), в котором сравнивалась эффективность с точки зрения смертности дозы цефтолозана/тазобактама в дозе 3 г и меропенема при внутрибольничной пневмонии и вентилятор-ассоциированной пневмонии. Результаты были значительно лучше у пациентов, получавших цефтолозан/тазобактам, особенно в группе пневмонии, требующей искусственной вентиляции легких [86]. Это важно, учитывая, что пациенты с внутрибольничной пневмонией, у которых развивается дыхательная недостаточность настолько тяжелая, что требуется искусственная вентиляция легких, считаются наиболее клинически тяжелым подтипом с худшими исходами. Его практическое использование у пациентов в критическом состоянии также было подтверждено при различных типах инфекций, особенно в контексте инфекции Pseudomonas [87].
8.3. Цефидерокол
Цефидерокол представляет собой сидерофор цефалоспорина катехолового типа с очень мощной активностью in vitro против лекарственно-устойчивых CRE и неферментирующихо GNB. Он использует путь комплекса сидерофор-железо для проникновения через грамотрицательные мембраны посредством механизма, который сравнивали со знаменитым троянским конем. Попав внутрь бактерии, цефидерокол отделяется от железа и связывается с пенициллинсвязывающими белками, ингибируя синтез пептидогликана [88]. Этот антибиотик, по-видимому, более устойчив к гидролизу многих β-лактамаз и карбапенемаз. Его спектр действия — в принципе, самый широкий из антибиотиков, продаваемых для лечения ГНБ, включая антибиотики с множественной лекарственной устойчивостью и особенно продуценты металло-бета-лактамаз — привел к большим ожиданиям в отношении этого препарата [89]. Однако в амбициозном исследовании CREDIBLE-CR20 фазы 3, сравнивающем цефидерокол с лучшим доступным лечением (выбранным исследователем, с комбинацией до трех препаратов) при лечении тяжелых инфекций, вызванных GNB MDR и CRE, результаты были следующими: в обеих группах были получены одинаковые показатели клинического излечения, а смертность была численно выше в подгруппе пациентов с инфекцией Acinetobacter baumannii, получавших цефидерокол. Однако в этой подгруппе наблюдалась систематическая ошибка отбора, поскольку у этих пациентов чаще был шок, что ставит вопрос, были ли результаты хуже по этой причине [90]. Антибиотик был одобрен FDA и EMA для лечения GNB-инфекций, когда другие методы лечения могут оказаться неэффективными, а в реальной жизни результаты применения цефидерокола очень эффективны против карбапенемаз, продуцирующих Acinetobacter, Stenotropomonas, Pseudomonas и Enterobacterales [91].
9. Передовые подходы к новым антибиотикам
9.1. Сохранение карбапенемов
Концепция экономии карбапенема направлена на сохранение этого типа антибиотиков и разумное использование новых препаратов, которые могут участвовать в этой стратегии, принимая во внимание соответствующие меры инфекционного контроля и профилактики в рамках СКАТ [92]. Карбапенемы являются отличными антибиотиками и мощным оружием против устойчивых к лекарствам грамотрицательных бактерий из-за их широкого спектра действия, бактерицидного действия и способности преодолевать многие виды устойчивости.Их чрезмерное использование в условиях отсутствия на сегодняшний день безопасных альтернатив, особенно при эмпирическом лечении, породило проблему резистентности к карбапенемам [93].
Колонизация кишечника является основным резервуаром устойчивых к карбапенемам GNB (CRE) среди пациентов в критическом состоянии, а кишечная транслокация связана с повышенным риском участия CRE при последующих инфекциях. Неудивительно, что чрезмерное использование карбапенемов является одним из важнейших факторов, определяющих приобретение CRE, и связано с более высоким уровнем суперинфекции по сравнению с лечением без карбапенемов. При лечении карбапенемами существует повышенный риск развития резистентности из-за давления, оказываемого карбапенемами. на чувствительные штаммы, предоставляя устойчивым штаммам возможность их преодоления [94].
Среди стратегий, используемых для сохранения карбапенемов, выделим следующие [3]:
1. Оценка показаний к использованию карбапенемов при отсутствии явного риска MDR-возбудителей;
2. Установление того, у каких пациентов пиперациллин тазобактам все еще может играть важную роль, даже несмотря на отрицательные результаты исследования MERINO [95];
3. Оценка использования новых бета-лактамных антибиотиков и новых ингибиторов бета-лактамаз, применение которых уже имеется значительный клинический опыт, в качестве альтернативы карбапенемам при эмпирическом лечении пациентов с септическим шоком, особенно при наличии риска множественной лекарственной устойчивости в контексте ESBL и CRE [77];
4. Оценка комбинированного использования альтернатив на основе небета-лактамных препаратов и старых антибиотиков по некоторым показаниям [96];
5. Корректировка продолжительности терапии карбапенемами. Недавние данные показывают, что краткосрочное лечение (<10 дней) Enterobacterales не ухудшает клинические исходы [97];
6. Оценка роли деэскалации после тщательного микробиологического контроля, связанного с клинической оценкой в рамках СКАТа, для снижения потребности в продлении эмпирической терапии карбапенемами [98].
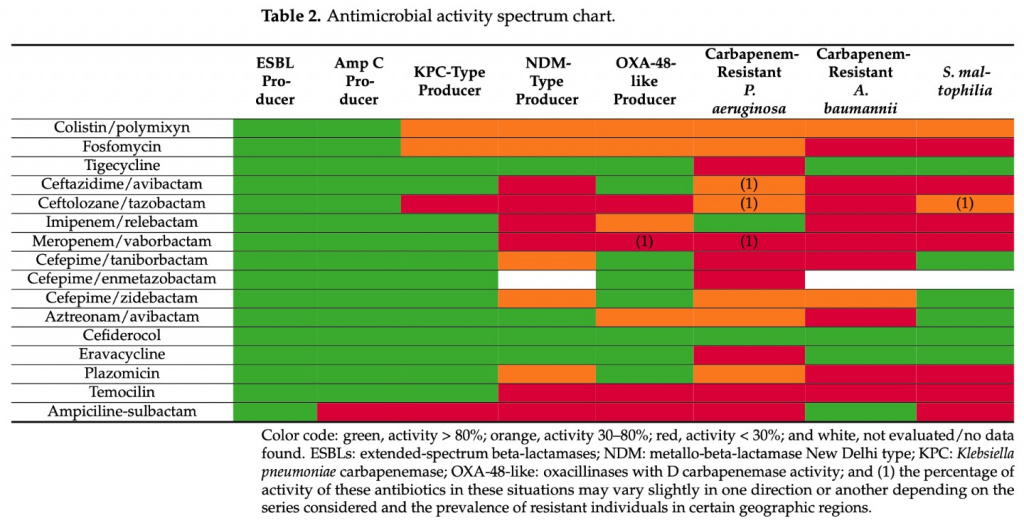
Сохранение карбапенемов (хотя карбапенемы по-прежнему должны занимать центральное место в антимикробной терапии пациентов в критическом состоянии) жизненно важно для успеха в улучшении результатов лечения септического шока. Использование новых бета-лактамов и ингибиторов бета-лактамов в программах управления антимикробной терапией и деэскалации, принимая во внимание желание сократить использование карбапенемов, представляют собой лучший курс действий в настоящем и, будем надеяться, в будущем, особенно в контексте распространенности трудно поддающихся лечению патогенов, таких как ESBL иCRE и устойчивость к Pseudomonas и Acinetobacter (Table 2) [27].
9.2. Роль новых антибиотиков в эмпирическом лечении нозокомиального сепсиса и септического шока
Несомненно, к наиболее сложным и противоречивым вопросам лечения сепсиса относятся определение персонализированной эмпирической терапии антибиотиками и определение роли новых антибиотиков в этой схеме [99].
Хотя таргетная терапия против ГНБ не лишена противоречий, сегодня у нас есть несколько рекомендаций по таргетному лечению против микроорганизмов с множественной лекарственной устойчивостью (продуцентов ESBL и/или карбапенемов, трудно поддающихся лечению Pseudomonas или других проблемных микроорганизмов, таких как Ацинетобактер или Стенотрофомонас). Эти рекомендации очень сбалансированы и показательны и имеют очень схожую основу, часто основанную на современных мнениях экспертов или опубликованных данных с использованием методологии GRADE. [64,75,76].
Помимо различий, связанных с позиционированием конкретных препаратов из-за противоречивых исследований и роли, которую в предыдущие годы играли старые антибиотики, используемые для лечения MDR-инфекций, позиционирование антибиотиков особенно вышеупомянутые препараты, которые были предметом многочисленных публикаций и последовательного клинического опыта, таких как цефтазидим/авибактам или цефтолозан/тазобактам очень четкое.
В то же время к новым молекулам, таким как цефидерокол или карбапенемы, связанные с ингибиторами бета-лактамаз, относятся консервативно, ожидая результатов в реальных условиях. Вместе с конкретными рекомендациями и консенсусом по лечению основных инфекционных синдромов, связанных с сепсисом (внутрибольничная пневмония, вентилятор-ассоциированная пневмония, вторичный и третичный перитонит, бактериемия, связанная с другими инфекциями, или инфекция мочевыводящих путей), эти новые молекулы могут оказать очень важную помощь при принятии решения об эмпирической терапии в рамках политики СКАТ при ситуациях высокой степени тяжести и риска смерти
Между тем, новые молекулы, такие как цефидерокол или карбапенемы, связанные с ингибиторами бета-лактамаз, лечатся консервативно, пока мы ожидаем реальных результатов. Вместе с конкретными руководящими принципами и консенсусом по Для лечения основных инфекционных синдромов, связанных с сепсисом (госпитальная пневмония, вентилятор-ассоциированная пневмония, вторичный и третичный перитонит, бактериемия, связанная с другими инфекциями или инфекциями мочевыводящих путей), эти новые молекулы могут оказывают очень важную когнитивную помощь при принятии решения об эмпирической терапии в рамках политики СКАТ в сценариях высокой тяжести и риска смерти.
Прежде чем приступить к обсуждению темы эмпирического лечения антибиотиками пациентов с септическим шоком нозокомиального происхождения, мы должны контекстуализировать это с имеющимися данными. Это область, в которой существует несколько теоретических моделей, все они поддерживаются. доказательствами, но не одинакового качества, которые защищены тщательно продуманными обоснованиями. Мы можем разделить эти модели на две категории, определяемые двумя консенсусами, упомянутыми выше. Одна из них — более консервативная французская модель, которая позиционирует использование новых антибиотиков в эмпирическом лечении и даже не под эгидой сохранения карбапенемов [100]. Другая модель иллюстрируется испанским консенсусом, который выступает за эмпирическое использование новых антибиотиков из-за их эффективности против MDR в контексте острой необходимости применения правильного лечения с первого раза, особенно при наличии факторов риска, связанных с инфекцией. и пациентом [24]. В этой области баланс колеблется между увеличением вероятности применения правильного эмпирического лечения и формированием резистентности, связанной с чрезмерным использованием новых антибиотиков.
Однако в литературе и, в частности, между этими двумя французскими и испанскими консенсусными руководствами есть некоторые общие положения [24,100]:
1. В случае септического шока в эмпирическом лечении допускается применение новых антибиотиков, особенно в случаях высокой локальной доли MDR и у носителей MDR -возбудителей в культурах эпидемиологического надзора, особенно если это ректальный экссудат;
2. Такие стратегии, как быстрая микробиологическая диагностика, деэскалация и сокращение продолжительности антибиотикотерапии, настоятельно рекомендуются для того, чтобы избежать побочных эффектов, связанных с чрезмерным использованием антибиотиков, независимо от выбранной схемы широкого спектра действия.
Представляется очевидным, что в данном сценарии интенсивной терапии и сепсиса имеет место чрезмерное использование антибиотиков, поскольку существует значительный процент пациентов, которым назначаются антибиотики широкого спектра действия, а инфекция не проявляется. Кроме того, эмпирические рекомендации часто сохраняются в течение длительного времени либо из-за отсутствия экспресс-тестов, либо из-за отсутствия СКАТ, которые требует ежедневной оценки лечения [94].
Такое злоупотребление имеет свои последствия.
Мы укажем некоторые из основных или тех, к которым в настоящее время имеется наибольший интерес:
1. Воздействие на микробиоту пациента, селекция MDR-бактерий и уничтожение привычной флоры, необходимой для жизнедеятельности, в том числе связанных с пищеварением и гомеостазом в целом [101];
2. Заражение Clostridium difficile [102];
3. Повышенная вероятность устойчивости к новым антибиотикам, которые можно приберечь для особых ситуаций, когда карбапенемы неэффективны [103]. Проблема в том, что во многих сценариях карбапенемы уже имеют высокий процент устойчивости, превышающий 20–25%. Это нельзя обобщать, существуют географические и местные различия, но это очень распространено [93]. Фактом всех эпидемиологических исследований в ОИТ является повышенное влияние микробов GNB MDR [77].
Когда дело доходит до принятия решения об эмпирической терапии в этом сценарии сепсиса и септического шока, как мы уже обсуждали, важно признать, что, хотя это и континуум, это две разные сущности. Существует разумный консенсус в отношении того, что в контексте сепсиса, который протекает без шока, можно подождать несколько часов, чтобы выбрать лучшее лечение, подтвердить наличие инфекции, получить соответствующие посевы и выбрать разумные антибиотики, которые, конечно, также могут включать карбапенемы и новые антибиотики [77]. Диапазон выбора антибиотиков в этом случае шире, а потребность в широте охвата может быть ниже. Те же рекомендации SSC указывают на необходимость обеспечить покрытие от MRSA или покрытие двумя антипсевдомонадаными препаратами, хотя, при отсутствии шока, можно не покрывать MRSA и назначать один антибиотик с антисинегнойной активностью [22].
Однако все это меняется при двух ситуациях:
1. У больных с шоком и тяжелыми сопутствующими заболеваниями;
2. У пациентов со значительными факторами риска развития MDR-бактерий, колонизированных MDR или поступивших в отделение с высоким процентом резистентности (порогом которого считается 20%). У пациентов с шоком и/или в условиях высокой вероятности инфицирования микроорганизмом с MDR или колонизации MDR существует консенсус в отношении выбора эмпирического лечения, охватывающего, в зависимости от очага инфекции, все возможные микробы, которые могли вызвать состояния, включая те вероятные MDRвозбудители, с наибольшей вероятностью успеха и вводимыми в наиболее оптимальных возможных дозах и формах [100].
По этой причине и в зависимости от контекста эмпирическая схема лечения антибиотиками должна включать в себя [104]
1. Защита от MRSA в целом и от энтерококка, если он возникает на фоне внутрибрюшной инфекции;
2. Защита от GNB, особенно трудно поддающихся лечению Pseudomonas и MDR GNB в целом (продуценты ESBL и карбапенемов, в частности), с использованием как минимум двух препаратов в течение первых 48 часов;
3. Оценка необходимости противогрибкового лечения, особенно при внутрибрюшной инфекции с факторами риска инвазивного кандидоза.
10. Рекомендации по эмпирическому лечению антибиотиками пациентов с септическим шоком
10.1. Предварительные соображения
При выборе эмпирического руководства в каждом сценарии, чтобы попытаться персонализировать лечение, мы должны учитывать загадку Pea и Viale [105]. Лечение антибиотиками тяжелобольных пациентов похоже на детскую головоломку, состоящую из нескольких частей, которые объединены в единое целое для содействия клиническому излечению и предотвращению развития резистентности: антибиотик и/или противогрибковый препарат и его свойства, место инфекции, ответственный возбудитель и его восприимчивость к лечению (МИК), атакже патофизиология пациента (Figure 1).
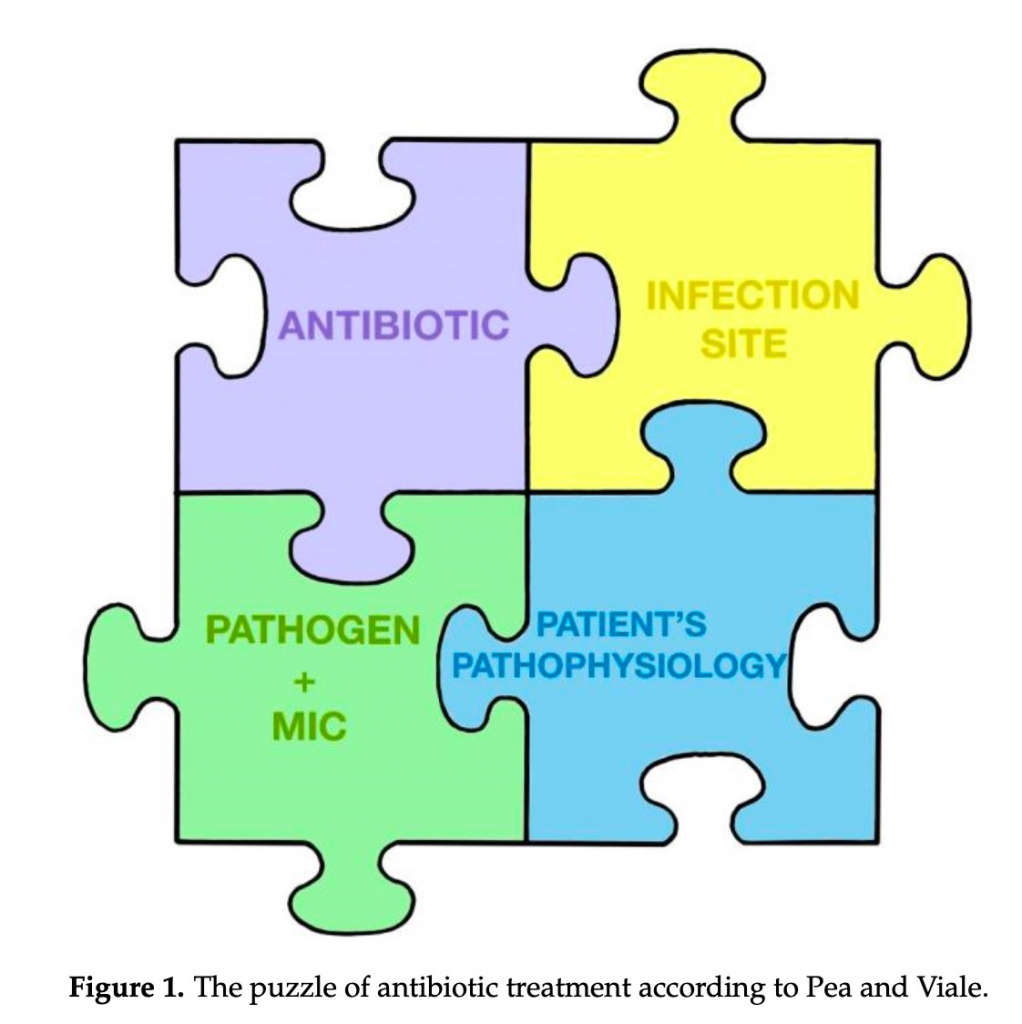
На эмпирические рекомендации большое влияние будет оказывать очаг инфекции, поскольку он может варьировать, например, от пневмонии или внутрибрюшной инфекции. Что касается важности снижения бактериальной нагрузки, интересно знать, как бактериальная нагрузка влияет на эффект антибиотиков, напоминая, что когда бактериальная нагрузка очень высока, цефтазидим/авибактам может быть наименее подвержен влиянию в этом контексте [106,107] . Наконец, как отмечают Bassetti и Montravers важным фактором является оценка местной распространенности инфекций с MDR [96]. Если процент устойчивости к карбапенемам превышает 20%, стратегия эмпирического лечения антибиотиками с использованием новых антибиотиков будет иметь смысл даже в случаях сепсиса, а не только при септическом шоке.
Таким образом, при принятии решения относительно первоначального эмпирического лечения антибиотиками пациентов с септическим шоком следует учитывать следующие предпосылки:
1. Бактериальная нагрузка в очаге инфекции обычно высокая. Чем выше бактериальная нагрузка в очаге инфекции, тем выше концентрация антибиотика, необходимая для подавления роста микроорганизма и тем больше вероятность выделения устойчивые мутанты, если введенная доза недостаточна. Воздействие антибиотика, необходимое для подавления возникновения резистентности, должно поддерживаться выше окна отбора мутантов. Контроль очага с помощью хирургического вмешательства или дренирования имеет важное значение, чтобы уменьшить бактериальную нагрузку, когда это возможно.
2. Поскольку мы не знаем микроорганизмы, вызывающие инфекцию, или характер их чувствительности к антибиотикам, мы можем ориентироваться на предполагаемый источник или на контрольные культуры, особенно ректальный экссудат в течение предыдущих 48–72 часов [99].
3. На решение влияет местная экология MDR бактерий. Высокий процент устойчивости к карбапенемам заставляет рассмотреть возможность применения новых антибиотиков [77].
4. Эмпирическое лечение должно быть активным против всех потенциально вовлеченных микроорганизмов и, по возможности, должно включать бета-лактамный антибиотик из-за его эффективности, спектра действия и бактерицидного действия. Среди доступных в настоящее время β-лактамных антибиотиков наиболее в случае любой вспышки из-за их антибактериального спектра и вероятности достижения оптимального уровня Pk/Pd против MDR -ГНБ рекомендуется использовать цефтазидим/авибактам и меропенем. В зависимости от очага инфекции и колонизации может потребоваться персонализация и могут существовать альтернативы: например, при внутрибольничной пневмонии мы могли бы включить цефтолозан/тазобактам, а если пациент колонизирован микробами, продуцирующими металло-бета-лактамазу, или стенотрофомонас мы могли бы использовать цефидерокол [77].
5. Фармакокинетика применения антибиотиков при сепсисе будет сильно зависеть от индивидуальных особенностей тяжелобольного пациента [108].
6. Пациент в состоянии шока подвергается риску необратимых повреждений, поэтому необходимо срочно снизить бактериальную нагрузку и контролировать иммунный ответ, одновременно используя органную поддержку.
7. Первоначальная эмпирическая терапия пациентов с септическим шоком и пневмонией должна включать два антибиотика и основываться на факторах риска для MDR возбудителей, обсуждавшихся выше, с первоначальным подходом, основанным на терапии широкого спектра действия, с последующим снижением дозы, если MDRвозбудители исключены [109].
8. Осложненная внутрибрюшная инфекция обычно полимикробная, нередко с участием ГНБ, анаэробов и энтерококков. Начальная эмпирическая терапия пациентов с септическим шоком в таких условиях должна включать бета-лактамы с ингибитором бета-лактамаз или карбапенем, а также покрытие от анаэробов, если бета-лактам не покрывает их, от энтерококков, если инфекция носит нозокомиальный характер, а у некоторых пациентов с факторами риска следует добавить дополнительное покрытие для видов Candida, отличных от Candida. альбиканс. В этой ситуации крайне важно контролировать источник, получать качественные образцы и быстро их обрабатывать [110].
9. Против Г (+) бактерий можно использовать даптомицин, линезолид, тедизолид или ванкомицин. Выбор зависит от локализации инфекции, функции почек и необходимости одновременного применения других нефротоксичных препаратов. Следует напомнить, что даптомицин не проявляют активность в легких [111].
10. Грибковая инфекция составляет 5% сепсиса. Чаще всего это вызвано Candida spp. и может быть предсказан по конкретным показателям, таким как Candida Score, а также по эпидемиологическим , микробиологическим данным и биомаркерам. Факторы риска частично совпадают с другими в ОИТ. Часто необходима профилактика и эмпирическая терапия, и эхинокандины предпочтительнее при Candida, но некоторые штаммы становятся устойчивыми, поэтому в некоторых случаях, таких как внутрибрюшная инфекция или случаи, когда трудно поддающиеся лечению, подходящей альтернативой может быть липосомальный амфотерицин B [112,113].
11 Соответствующие посевы следует всегда получать в зависимости от очага инфекции (посевы крови, ректальный экссудат или другие посевы для наблюдения, в зависимости от ситуации) перед началом или вскоре после первоначального эмпирического лечения антибиотиками. Сигнал тревоги, например, код сепсиса, должен быть активирован, чтобы обеспечить обработку проб с помощью систем быстрой микробиологической идентификации, и, если возможно, дежурный микробиолог должен быть предупрежден и с ним можно было взаимодействовать [28].
12. Через первые 24–48 ч лечение следует пересмотреть на предмет снижения бактериальной нагрузки и клинического улучшения. Методы быстрой диагностики позволят нам оценить отсутствие или присутствие энтеробактерий, продуцирующих БЛРС, или карбапенемазы, резистентность P. aeruginosa, MRSA, а также низкое значение -D-глюкана или его позитивность, что позволит сузить спектр антибиотиков или предположить необходимость изменения лечения [114].
13. Следует предусмотреть краткосрочное лечение. Биомаркеры, такие как прокальцитонин могут помочь нам в применении коротких схем лечения антибиотиками [115].
10.2. Индивидуализация антибиотикотерапии у пациентов в критическом состоянии
Хотя основные проблемы в условиях высокой распространенности резистентных штаммов заключаются в том, чтобы избежать задержки диагностики путем быстрого выявления микроорганизмов и особенностей их чувствительности, адекватное лечение осложняется особенностями наиболее тяжелобольных пациентов, у которых, помимо других симптомов, наблюдаются изменения внеклеточного объема, функции почек и иммунитета. Таким образом, тяжесть их состояния не только приводит к более высокому уровню смертности сама по себе, но также влияет на клинический ответ на антимикробное лечение. Если мы добавим к этому разногласия относительно имеющихся данных по другим аспектам антимикробного лечения, таким как использование комбинированной терапии, продолжительность лечения, сложность деэскалации и существующие средства на каждом рабочем месте в отношении клинического лечения,. лабораторных и организационных моментов, несомненно, не будет единого размера, подходящего всем, и хорошим началом будет персонализация лечения с учетом клинических особенностей. обстоятельства и микробиологические данные каждого пациента и каждого центра [116]. В чем тогда будет заключаться индивидуализация лечения антибиотиками пациентов в критическом состоянии, чтобы добиться максимальной эффективности? «Оптимизация» ищет лучший способ выполнить какое-либо действие или улучшить производительность чего-либо. «Эффективность» определяется как способность достигать желаемого или ожидаемого эффекта. «Индивидуализировать» значит приписать кому-то или чему-то характеристики, которые отличают его от других. Поскольку нашей основной первоначальной целью должна быть быстрая элиминация возбудителя, нашим приоритетом становится достижение максимальной эффективности лечения антибиотиками у каждого пациента. Хотя в литературе часто говорится об охвате антибиотиками, появляются новые доказательства того, что предполагают, что чувствительность микроорганизма к антибиотику in vitro имеет решающее значение и что знания этой чувствительности недостаточно для достижения наилучших результатов. Таким образом, фиксированные схемы лечения, независимо от места заражения и патофизиологического состояния пациентов, могут не дать ожидаемых результатов и оказаться неэффективными. С этой целью мы выделим, как предлагают разные авторы, эти разные уровни успеха на Figure 2 [117,118].
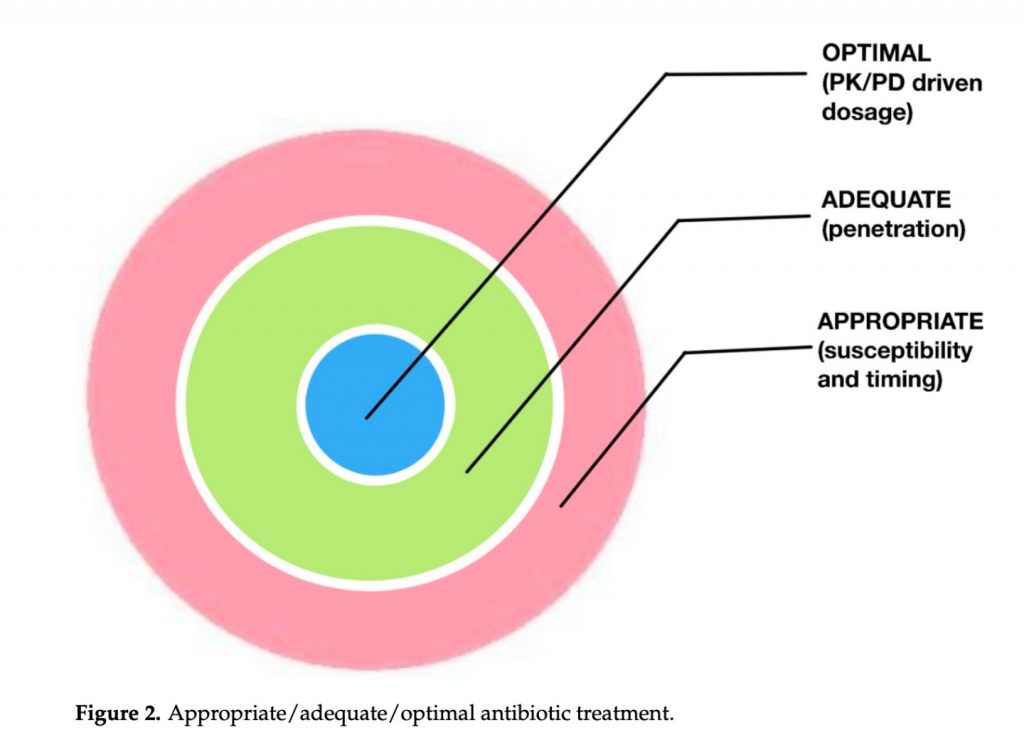
(а) Соответствующий (подходящий,приемлемый): определяется чувствительностью in vitro к возбудителю и ранним назначением противоинфекционного лечения. То, что соответствует опубликованному консенсусу и руководящим принципам, также считается приемлемым.
(b) Адекватный: в дополнение к «подходящим» характеристикам уровень успеха считается адекватным, если применяются и принимаются во внимание фармакокинетические и фармакодинамические стратегии, такие как более короткие интервалы введения, оценка физико-химических характеристик при подходе к различным местаминфекции, мониторинг уровней, избежание взаимодействий и т. д.
(c) Оптимальный: в дополнение к «подходящим и адекватным» характеристикам этот уровень успеха заключается во введении дозы, которая позволяет проникнуть в очаг инфекции в эффективной концентрации для ликвидации инфекции.
У пациентов в критическом состоянии вероятность получения недостаточных концентраций препарата для микроорганизмов, чувствительных in vitro, но с МИК, очень близкой к пороговому пределу, иногда наблюдается отсутствие эффективности in vivo, что приводит к терапевтической неудаче и возникновение устойчивости.Трудно достичь оптимальных схем лечения антибиотиками у пациентов в критическом состоянии без существенного изменения дозирования [39,105].
10.3. Раннее лечение антибиотиками у пациентов с септическим шоком
Современный стандарт назначения антибиотиков пациентам в критическом состоянии основан на раннем лечении и предполагает введение препаратов менее, чем за час после установления диагноза у наиболее тяжелых пациентов или при септическом шоке [22]. Хотя большая часть доступных данных не извлечена из клинических исследований, из-за очевидных этических трудностей с возможностью рандомизировать отсрочку лечения антибиотиками, начиная с публикации в 2006 году классического ретроспективного обсервационного исследования (в котором Кумар показал, что среди 2154 пациентов при септическом шоке на каждый час задержки антимикробной терапии наблюдалось среднее снижение выживаемости на 7,6%), все руководства настоятельно рекомендуют эту стратегию раннего начала антибактериальной терапии [119]. Последующие крупные наблюдательные исследования подтвердили эти результаты. Одно из них, многоцентровое международное исследование с данными 17 990 пациентов с септическим шоком, получавших антибиотики, подтвердило, что задержка в назначении антибиотиков связана с более высокой внутрибольничной смертностью [120]. В этом исследовании наблюдалось линейное увеличение риска смертности на каждый час задержки введения антибиотика с первого по шестой час после идентификации диагноза. Недавно, используя новые определения сепсиса, исследование 3035 пациентов показало, что у пациентов с септическим шоком назначение антибиотиков широкого спектра действия в течение 1 часа после установления диагноза снижает внутрибольничную смертность. Однако у пациентов с сепсисом без шока связь между введением антибиотиков в течение 1 ч и внутрибольничной смертностью не была статистически значимой. В моделях линейной регрессии, ограниченных пациентами, получившими антибиотики в течение первых 3 часов, у пациентов с септическим шоком наблюдался повышенный риск смертности на каждый час задержки введения антибиотиков, но у пациентов без шока такой тенденции не наблюдалось [121].
Это правда, что врачи не намеренно откладывают назначение антибиотиков широкого спектра действия, но верно также и то, что существуют трудности с быстрой постановкой диагноза и что может быть трудно распознать всех пациентов с высоким риском. В более тяжелых случаях, при большом количестве сопутствующих заболеваний и более четкими симптомами инфекции врачам зачастую проще назначить антибиотики раньше [122]. Кроме того, в больницах могут существовать организационные правила, которые могут препятствовать раннему назначению антибиотиков [123].
Барьеры для раннего назначения антибиотиков:
Отсутствие знаний;
Отсутствие правильной оценки тяжести и позднее распознавание сепсиса;
Повышенная нагрузка на персонал;
Трансфер больного (в операционную, на анализы и т.п.);
Возможны атипичные проявления без лихорадки и спутанности сознания;
Задержки из-за других диагностических тестов и медленного сбора проб для микробиологического исследования;
MDR-инфекции и нераспознавание факторов риска MDR ;
Ожидание проведения посева крови перед введением антибиотика;
Очень важно не понимать, что давать неподходящий антибиотик - это все равно что не давать никакого или даже хуже.
Не указан порядок введения антибиотиков и какой антибиотик широкого спектра действия является «ключевым»;
Необходимость получения разрешения на назначение препарата у другого специалиста, заведующего отделением или аптеки перед началом лечения.
Подход, позволяющий избежать задержки в назначении антибиотиков:
Наличие артериальной гипотензии у пациента с подозрением на инфекцию следует расценивать как септический шок при отсутствии альтернативного объяснения; Невозможность перевезти или транспортировать пациента до начала лечения антибиотиками;
Если в таких ситуациях требуется назначение антибиотика, необходимо обеспечить его немедленное введение (сообщалось, что задержка с момента назначения лечения до момента его введения может составлять в среднем до 3 часов);
Комбинированные схемы лечения следует назначать в первую очередь с основным антибиотиком (самого широкого спектра действия);
Содействуйте образованию, обучению и командной работе, чтобы сократить время администрирования.
Ранняя антимикробная терапия может иметь негативное влияние с точки зрения токсичности и затрат, особенно при менее тяжелых инфекциях и сепсисе без шока, а также может способствовать задержке постановки диагноза у некоторых первоначально неинфицированных пациентов, таких как хирургические пациенты в критическом состоянии, в которым особенно трудно отличить последствия воспалительной реакции, вызванной хирургическим вмешательством или другими патологическими обстоятельствами, от реакции, вызванной инфекцией. В последнее время большее значение придается также влиянию лечения антибиотиками в ОИТ на микробиоту, его влиянию а на иммунитет и исход пациентов, а также стратегиям поддержания регулярной кишечной флоры, но это выходит за рамки данного обзора.
Реальность такова, что литература о связи между временем начала лечения антибиотиками и смертностью при сепсисе противоречива, почти исключительно носит наблюдательный характер и имеет высокий риск систематической ошибки. Источники систематической ошибки включают отсутствие дифференциации между сепсисом и септическим шоком, недостаточная корректировка с учетом потенциальных искажающих факторов и сочетание высокого роста смертности, связанного с поздней диагностикой заболевания [124].
Недавние метаанализы не дали окончательных результатов в отношении пользы лечения антибиотиками, поэтому, строго с точки зрения научных данных, нельзя рекомендовать чрезвычайно быстрое введение антибиотиков, по крайней мере, при сепсисе; однако, возможно, это это не так при септическом шоке [125]. Тем не менее, тот факт, что антибиотик следует назначать в первые несколько часов, по-прежнему является обязательным в рекомендациях SSC, хотя это и привело к критике со стороны IDSA по поводу преждевременного использования у пациентов без шока [126]. В будущем, возможно, потребуется уточнить, каково истинное определение понятия «ранний», каков временной интервал, в течение которого назначение антибиотиков является наиболее эффективным в борьбе с бременем инфекции, и как интерпретировать спектр тяжести, крайней срочности и скорости, необходимой для введения антибиотиков. По-видимому, существует достаточно сильная связь между ежечасным приемом антибиотиков и смертностью от септического шока, но менее выраженная связь для сепсиса без шока. Имеются данные, показывающие, что интервалы введения антибиотиков до 90 минут у пациентов с сепсисом без шока не имеют значения. По-видимому, риск повышенной смертности у пациентов с сепсисом без шока возрастает примерно через 3-5 ч до начала применения антибиотиков и в последующем, однако данные, позволяющие точно определить влияние интервалов от 3 до 5 ч, немногочисленны и несовершенны. В случае септического шока, несмотря на то что в большинстве исследований имеются многочисленные погрешности, а линейная связь между задержкой и смертностью явно является статистической ассоциацией и результатом, в частности, неиспользования в анализе сбивающих факторов, представляется, что оперативность начала течения более важна [127].
Учитывая то, что было сказано ранеер, возможно, в настоящее время хорошей отправной точкой было бы продолжение быстрого введения антибиотиков, например, всегда в течение первых 3 часов, как это было предложено IDSA. Однако, следует приложить усилия быстро поставить диагноз до введения препарата (или, по крайней мере, получить ранние и выгодные образцы) и иметь достаточно времени для размышлений и консультаций, если необходимо, по выбору оптимальной антимикробной схемы для каждого пациента. В наиболее тяжелых случаях септического шока целесообразно, чтобы оптимальное время введения препарата наступило до третьего часа и ближе к первому часу, поскольку быстрое снижение бактериальной нагрузки за счет контроля над очагом инфекции и адекватной и ранней антибиотикотерапии являются ключевым моментом.
10.4. Важность контроля очага инфекции в хирургических отделениях
Лечение инфекции в ОИТ у хирургических пациентов представляет свои собственные проблемы, поскольку, как и в других условиях, диагностика часто затруднена, а множественная лекарственная устойчивость и фармакокинетические изменения представляют собой проблемы. Необходимость контролировать очаг инфекции хирургическим и/или чрескожным дренирование усложняет ситуацию [128]. Восстановление анатомии и функции одинаково важно и может быть выполнено одномоментно, хотя иногда это бывает затруднительным. Как правило, меры по контролю очага инфекции не следует откладывать, за исключением тех ситуаций, когда предпочтительнее отграничение нежизнеспособных тканей, например, при инфицированном некротическом панкреатите или в ситуациях, когда доступ к источнику инфекции затруднен. В настоящее время возобновился интерес к так называемой хирургии контроля повреждений при внутрибрюшной инфекции, которая включает первоначальный контроль инфекции с использованием "открытого живота", чтобы облегчить последующую санацию брюшной полости и свести к минимуму риск компартмент-синдрома [129]. Окончательная анатомическая реконструкция будет выполнена позже, через 24–72 часа. При таком подходе выбор системы временного закрытия брюшной полости представляется важным, при этом терапия отрицательным давлением является распространенным вариантом, поскольку она приводит к меньшему количеству свищей, меньшему количеству абсцессов и более высокой выживаемости [129]. В руководствах SSC рекомендуется определить анатомический источник инфекции, который может потребовать контроля и устранить его как можно скорее с логистической и медицинской точки зрения. Подход должен быть индивидуализированным: визуализирующие исследования очень важны и не должны ограничиваться брюшной полостью [130]. Нет смысла откладывать такой контроль, если нет значительных метаболических или коагуляционных изменений или если у пациента очень нестабильная гемодинамика. Выбор подходящего времени для хирургического контроля очага является предметом дискуссий, и следует соблюдать междисциплинарный подход, руководствуясь тяжестью инфекции, темпами ухудшения состояния пациента, предполагаемым источником инфекции. Есть отдельные данные, свидетельствующих о том, что при наиболее тяжелых инфекциях контроль очага инфекции дает лучшие результаты, если его проводить через 2–6 ч после постановки диагноза [131].
Концепция управления заключается в создании бригад, занимающихся контролем очага, с доступностью диагностических и терапевтических методов, включая интервенционную радиологию, 24 часа в сутки, что может помочь выбрать более подходящее лечение и реализовать хирургические стратегии, улучшающие исходы у этих пациентов [132].
Хирургические инфекции, в частности инфекции брюшной полости, являются наиболее сложными среди нозокомиальных инфекций: они связаны с более длительным пребыванием в стационаре, большим количеством пациентов в состоянии шока, более частым развитием почечной недостаточности и более высокой смертностью. Их микробиологическая картина обычно полимикробна с незначительным присутствием грибов, трудностями в определении патогенной роли каждого из них и их вклада в общее состояние пациента, а также растущим присутствием организмов с множественной лекарственной устойчивостью, особенно карбапенемазопродуцирующих организмов [110].
Воспаление, связанное с хирургической травмой, означает, что традиционные критерии системной воспалительной реакции присутствуют регулярно и, следовательно, малопригодны для диагностики инфекционного процесса, как и аналитические маркеры инфекции. Точно так же мало пользы приносят измерения лейкоцитоза, величины PCT (хотя повышение последнего, удваивающее его исходное значение в первые 24 ч после операции, может помочь предупредить о неадекватности контроля очага инфекции) или другие признаки, такие как гипотония или олигурия, которые могут быть связаны с послеоперационными осложнениями неинфекционного происхождения [133]. Все это усложняет процесс принятия решения о том, начинать или не начинать антибиотикотерапию и какими препаратами. Кроме того, если тяжелое состояние пациента персистирует, деэскалация также будет затруднена. Если предполагается отличный контроль, антибиотикотерапия абдоминальной инфекции должна быть ограничена 3-5 днями.
Это продемонстрировано при нозокомиальных инфекциях, даже у пациентов с APACHE > 10, без увеличения числа релапаротомий или повышения смертности [134]. Таким образом, клиническая настороженность по-прежнему остается лучшим оружием для контроля возможной неудачи в борьбе с очагом инфекции. Добавление параметров органной дисфункции (SOFA score) может выявить пациентов, которым потребуется дополнительный контроль очага инфекции. Методы визуализации, такие как УЗИ и КТ, также очень важны в данном случае, поскольку они добавляют возможность чрескожного дренирования абсцессов, сопровождающихся развитием органной дисфункции, при наличии постоянного квалифицированного персонала [135].
Оценка остаточной инфекции после контроля очага инфекции может помочь оценить роль определенных вмешательств и корректировать антибиотикотерапию. Для этих целей под остаточной инфекцией обычно понимают неполное чрескожное дренирование абсцесса или остаточные некротические ткани, который невозможно удалить, а под продолжающейся контаминацией понимают источник инфекции (например, перфорацию, которая не может трансформироваться в фистулу и продолжает дренироваться в брюшную полость) [136].
10.5. Оптимизация лечения антибиотиками согласно гипотезе Кумара
В связи с актуальностью для современной концепции сепсиса и возможного значения при выборе и назначении антибиотикотерапии, мы посвятим раздел комментариям теории Кумара [106]. После того, как с появлением пенициллина произошло снижение смертности от инфекционных причин, абсолютные показатели смертности остаются постоянными и сегодня, несмотря на появление новых противомикробных препаратов. Это связано с более высокой распространенностью резистентных микроорганизмов, более высокой частотой сепсиса среди пожилых людей и существованием более агрессивных микроорганизмов [137]. Другие поддерживающие меры и методы лечения, не связанные с антибиотиками, были подвергнуты сомнению после десятков исследований.Гипотеза Кумара заключается в том, что протестированные методы лечения оказались безуспешными, поскольку процесс заболевания не был правильно интерпретирован [138]. Альтернативная патофизиологическая модель, предложенная Кумаром, предполагает существенное значение бактериальной нагрузки как основного фактора дисфункции органов и, следовательно, предполагает, что именно бактериальная нагрузка должна определять схему лечения антибиотиками при сепсисе. Тогда ключом к улучшению результатов может стать скорейшее снижение этого бремени на основе более эффективного применения доступных антибиотиков и других стратегий, направленных на эту цель. Поэтому раннее введение и использование бактерицидных препаратов становится основополагающим в этой модели.
Микробиологическая модель сепсиса, как и иммунологическая модель, не способны полностью объяснить патофизиологию заболевания. Это понятно, если учесть ключевой элемент смертности при сепсисе - концепцию необратимого шока, которая предполагает, что шок, независимо от его этиологии, можно переживать лишь ограниченное время и что после его возникновения он становится необратимым, с неизбежным прогрессированием до хронического критического заболевания или смерти, если не обратить его вспять в течение короткого периода времени. Параллельным понятием в реанимации является гемодинамическая нестабильность.Эта концепция связана с «золотым часом», демонстрируемым при травматическом геморрагическом шоке, но применима и к различным формам критических состояний.
Концептуальная модель, включающая ключевые элементы модели сепсиса, должна учитывать следующее:
Во-первых, понимание того, что существует порог, при достижении которого медиаторы воспаления будут ассоциироваться с клеточной дисфункцией и повреждением тканей, проявляющимся как септический шок, и что этот порог может варьировать у разных людей: у лиц с плохим сердечно-легочным резервом шок разовьется раньше и на более низких уровнях клеточной дисфункции или повреждения тканей, в то время как молодым, здоровым пациентам может потребоваться значительно более высокая степень воспаления, чтобы достичь того же порога шока.
Во-вторых, появление нового элемента, такого как наличие шока, обычно проявляющегося в виде рецидивирующей или стойкой гипотензии, особенно если он проявляется плохой перфузией, которая не восстанавливается, и гемодинамической некогерентностью, в свою очередь, ставит пациентов на путь к необратимому повреждению органов. В какой-то неопределенный момент после возникновения гипотонии, в зависимости от степени гипотонии, влияния сопутствующих заболеваний и генотипа пациента, у пациента будет высокий риск развития хронического критического заболевания или смерти.
Из-за генетических вариаций хозяина и возбудителя, а также клинической изменчивости инфекции, точный момент, когда сепсис становится необратимым для каждого пациента, сегодня не может быть известен заранее;тем не менее, прогрессирование будет одинаковым для всех пациентов, которые его достигнут. Согласно модели Кумара, в основе септического шока лежит микробная нагрузка. Скорость достижения ее снижения до субкритического порога после начала инфекции будет иметь первостепенное значение для выживания, сводя таким образом к минимуму период, в течение которого существует достаточно микроорганизмов для возникновения шока, ограничивая риск достижения точки, когда выздоровление уже невозможно (Figures 3 и 4).
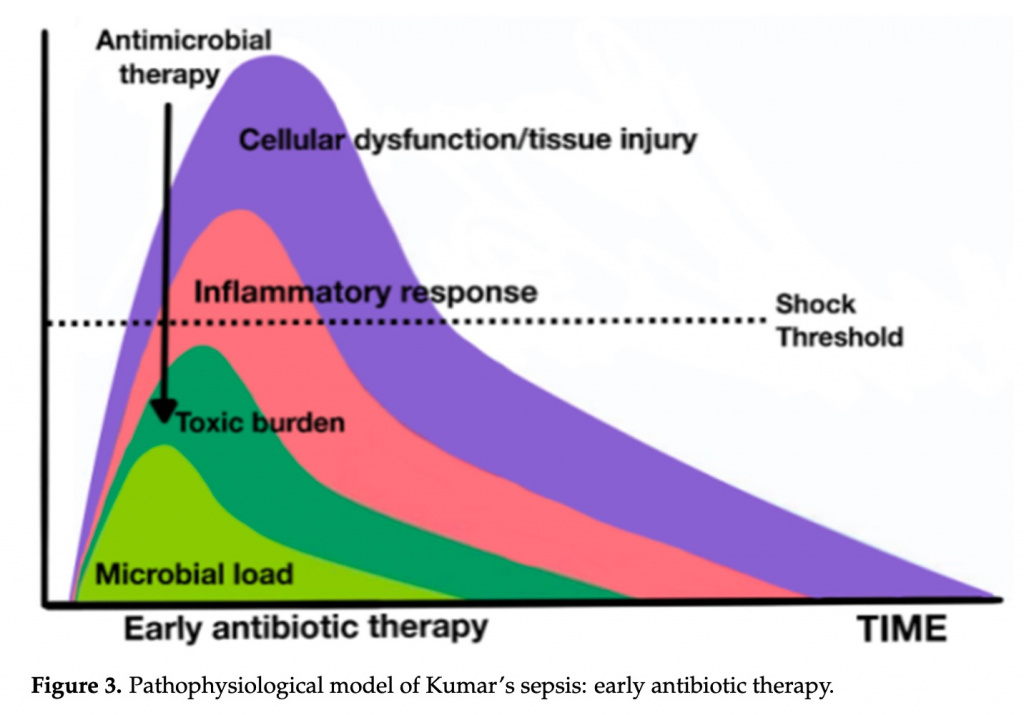
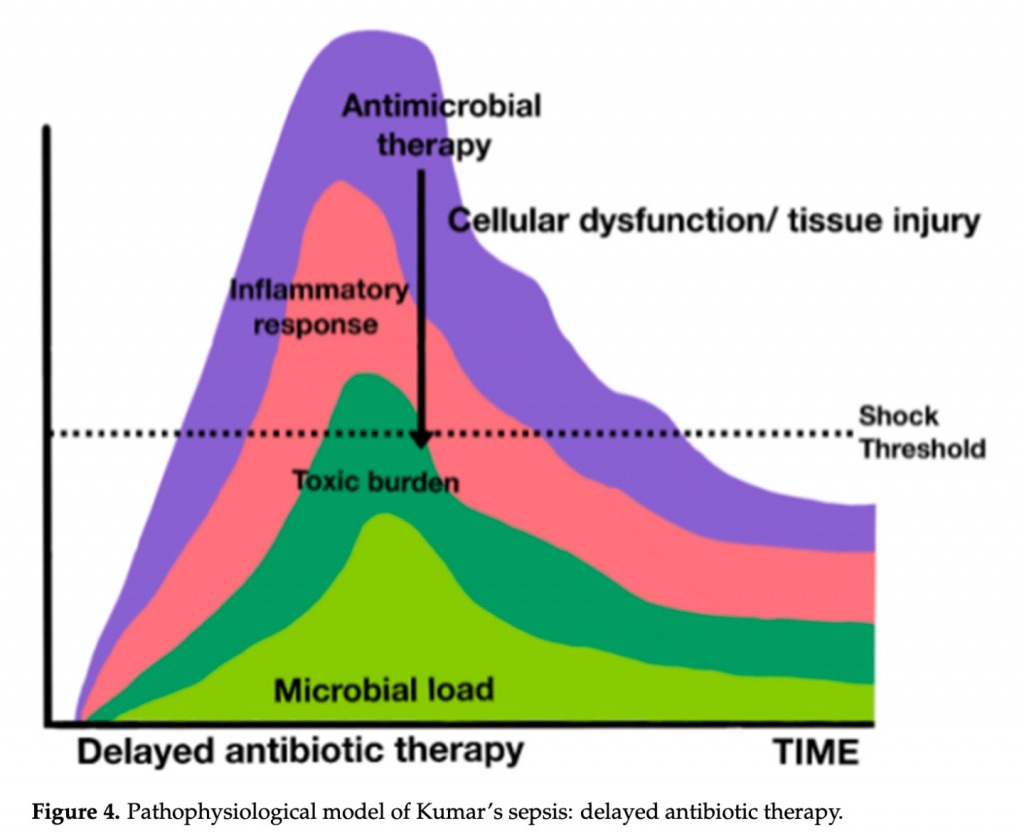
Эта модель позволяет предположить, что септический шок и сепсис - это две разные сущности, а не разновидности одного и того же заболевания. Основное различие между ними заключается во времени, отведенном для наступления необратимой и невосстановимой органной недостаточности. Простой факт наблюдения в обоих случаях клинических проявлений гипотонии, лактат-ацидоза и исчерпания компенсаторных реакций, а также значительные различия в уровне смертности при септическом шоке (более 40%) и сепсисе (около 10%) заставляют нас думать об этих двух состояниях, по мнению Кумара, как о разных явлениях.
Таким образом, согласно этой модели, важными факторами, которые следует учитывать при уменьшении бактериальной нагрузки при септическом шоке, являются:
1. Ранняя антимикробная терапия:
2. Антимикробная активность:
Обеспечить бактерицидную противомикробную активность;
Оптимизировать фармакокинетические показатели (препараты, зависящие от времени; и концентрационно-зависимые антибиотики)
Используйте комбинированную терапию с антибиотиками, имеющими разные механизмы действия.
3. Дополнительная терапия: контроль очага и инфузионная терапия для обеспечения перфузии и гемодинамической стабильности.
10.6. Продолжительность лечения антибиотиками в рамках программ управления АБТ
В рамках программ управления существует несколько причин попытаться сократить продолжительность лечения антибиотиками. Изменения в микробиоте усиливаются с каждым днем лечения антибиотиками. Последствия этого изменения недостаточно изучены, но оно может способствовать увеличению риска сепсиса в последующие месяцы [139]. Повышенная частота побочных эффектов также является поводом для беспокойства, включая появление резистентности к противомикробным препаратам, острой почечной недостаточности или инфекций, вызванных C. difficile. С каждым днем продления лечения антибиотиками риск увеличивается [140]. Что касается раннего прекращения лечения антибиотиками, мы должны учитывать две разные ситуации. С одной стороны, у пациентов с подозрением на инфекцию, у которых культуры, выделенные до начала лечения антибиотиками, отрицательны или демонстрируют незначительную контаминацию, лечение антибиотиками должно быть прекращено.
У пациентов с подозрением на вентилятор-ассоциированную пневмонию, но с отрицательным результатом БАЛж, Raman et al. предложили раннее прекращение лечения антибиотиками, не обнаружив различий в смертности (4 дня лечения против 9 дней). Между тем, появление бактерий с множественной лекарственной устойчивостью было явно менее частым в группе краткосрочного лечения. (7,5% против 35,7%) [141]. У пациентов в критическом состоянии с микробиологическим подтверждением инфекции имеются данные, свидетельствующие о не меньшей эффективности коротких схем лечения по сравнению с длительным лечением, главным образом при нозокомиальных пневмониях, связанных с искусственной вентиляцией легких и послеоперационной внутрибрюшной инфекции, при этом в большинстве случаев достаточно 7-дневного лечения антибиотиками [134]. Клиническое исследование, проведенное на пациентах с осложненной внутрибрюшной инфекцией (это не были исключительно тяжелобольные пациенты), показало даже, что продолжительность лечения антибиотиками можно безопасно сократить до 3–5 дней при условии адекватного контроля очага инфекции [142]. В исследовании, проведенном у гемодинамически стабильных пациентов с ГНБ-бактериемией, Yahav et al.продемонстрировали не меньшую эффективность короткого режима лечения (8 дней) по сравнению с длительным режимом лечения (14 дней) [143]. При неосложненной стафилококковой бактериемии, текущие рекомендации по-прежнему указывают на необходимость 14-дневного лечения антибиотиками, но в настоящее время проводятся клинические исследования. сравнивая продолжительность 7 дней с 14 днями [144], а также существуют обсервационные исследования, подтверждающие использование короткого режима у пациентов с бактериемией, вызванной S. aureus, при отсутствии эндокардита, отдаленных метастатических очагов или наличия имплантов [145]
Chastre et al . не обнаружили различий в смертности при краткосрочном лечении у пациентов с вентилятор-ассоциированной пневмонией или в частоте рецидивов инфекции, за исключением пневмонии, вызванной P. aeruginosa, которая была выше в группе краткосрочного лечения [146]. В недавнем клиническом исследовании, которое было остановлено из-за отсутствия набора пациентов, сравнивали продолжительность лечения 8 и 15 дней у пациентов с вентилятор-ассоциированной пневмонией. вызываемый P. aeruginosa. Эти исследователи не смогли продемонстрировать не меньшую эффективность короткого режима лечения с точки зрения первичного результата в виде рецидива легочной инфекции и смертности [147]. Несмотря на эти результаты, оптимальная продолжительность лечения антибиотиками 7 дней можно установить даже при инфекциях, вызванных P. aeruginosa, поскольку потенциальная польза от продления лечения антибиотиками, вероятно, перевешивается вредом, вызванным ненужным продлением терапии [148]. У пациентов, поступившие в ОИТ в связи с COVID-19, вероятно, должны принимать индивидуальные решения, а в некоторых случаях может потребоваться продление лечения антибиотиками из-за очень высокого уровня вторичных инфекций и рецидива [149]. Использование биомаркеров также может помочь сократить продолжительность лечения антибиотиками у пациентов в критическом состоянии. ПКТ является биомаркером, уровень которого увеличивается в основном во время бактериальных инфекций, но также, в меньшей степени, при воспалительной реакции или хирургической травме [150,151]. Несколько клинических исследований показали, что продолжительность лечения антибиотиками с корректировкой ПКТ можно безопасно сократить у пациентов в критическом состоянии. Исследования, в которых участвовало большинство пациентов, проводились Bouadma et al. и De Jong et al. Bouadma et al. продемонстрировали, что у пациентов было больше дней без антибиотиков в группе ПКТ, в которой лечение антибиотиками прекращалось, когда уровень ПКТ составлял менее 0,5 нг/мл или снижался как минимум на 80% от пиковой концентрации [152]. De Jong et al. продемонстрировал у 1575 пациентов в критическом состоянии, что использование того же протокола позволило сократить среднюю продолжительность лечения антибиотиками до 5 дней по сравнению с 7 днями в контрольной группе и даже обнаружило снижение 28-дневной смертности [153]. Обсервационное исследование показало, что у критических послеоперационных пациентов с вторичным перитонитом алгоритм на основе ПКТ может быть полезен для сокращения продолжительности лечения антибиотиками (5,1 дней против 10,2) [133]. Недавно было высказано предположение, что кальпротектин может превосходить прокальцитонин в качестве биомаркера при сепсисе и индикатора необходимости интенсивной терапии у этих пациентов [154,155]. Наша общая рекомендация по продолжительности лечения антибиотиками у пациентов в критическом состоянии составляет 7 дней, которую можно дополнительно сократитьвод контролем динамики ПКТ. В случае абдоминальной инфекции при адекватном контроле очага продолжительность АБТ может составлять 5–7 дней [156].
10.7. Инструменты для принятия обоснованных решений
Среди инструментов, доступных для улучшения оказания помощи больным с инфекциями в критическом состоянии, есть обучающие средства, ярким примером которых являются опубликованные рекомендации по лечению антибиотиками. Мы выделим два из них: рекомендации Mensa (Испания) и Sanford (США).
11. Резюме по индивидуализации лечения антибиотиками у пациентов в критическом состоянии
Различные исследования подтверждают взаимосвязь между задержкой начала адекватного лечения антибиотиками и смертностью [97,119]. При инфекциях, вызванных Г(-) бактериями ненадлежащее лечение антибиотиками увеличивало риск смертности почти в четыре раза [157]. Кроме того, необходимость быстро определить правильное лечение антибиотиками чрезвычайно важно у пациентов с сепсисом или септическим шоком, у которых даже при адекватном лечении антибиотиками смертность может достигать от 27% до 40% у пациентов с множественными сопутствующими заболеваниями и низкми функциональными резервами, а также у пациентов с иммуносупрессией [158].
Несмотря на важность этих данных, реальность такова, что частота неадекватного лечения антибиотиками остается, по данным Vázquez-Guillamet et al., почти у 30% пациентов с сепсисом или септическим шоком, и, по данным этих авторов, число пациентов, которым потребуется соответствующее противомикробное лечение для спасения жизни равно пяти [159]. Наиболее важным фактором, предрасполагающим пациента к неадекватному лечению антибиотиками, является инфекция, вызванная микроорганизмами с множественной лекарственной устойчивостью [157]. Знание местной эпидемиологии необходимо для начала соответствующего эмпирического лечения. Знание общего уровня резистентности Г (-) бактерий к карбапенемам, имеющего эпидемиологическое значение, в каждом отделении и больнице можно использовать в качестве индикатора риска для пациента с наличием колонизации или инфицирования этими микроорганизмами. Как обсуждалось ранее, порог устойчивости к карбапенемам в 10–20% считается достаточным для инициации лечения новыми противомикробными препаратами, направленным на сбережение карбапенемов. Карбапенемы можно использовать, если частота резистентности составляет менее 10–20%, поскольку сами по себе они являются очень хорошими антибиотиками [96].
Большинство внутрибольничных инфекций вызываются представителями эндогенной микробиоты поверхностей слизистых оболочек путем транслокации или инвазии преобладающих микроорганизмов. в зависимости от плотности бактериальной популяции. Следовательно, знание колонизирующей флоры и характера ее чувствительности к противомикробным препаратам может иметь важное значение при выборе первоначального эмпирического лечения. По всем этим причинам казалось бы разумным проводить контрольные посевы при поступлении в ОИТ и в дальнейшем один-два раза в неделю, хотя нельзя исключать изменения в составе микробиоты до возникновения эпизода сепсиса. Альтернативной стратегией является получение полуколичественного ректального, глоточного и мазка слизистой оболочки носа во время сепсиса. Также важно оценить локализацию очага инфекции. У пациентов с факторами риска карбапенем-резистентного ГНБ следует рассмотреть возможность использования новых антибиотиков, когда ожидается, что клиническая эффективность возможных альтернатив будет субоптимальной, как в случае с полимиксинами и/или аминогликозидами у пациентов с пневмонией [160, 161]
Однако принятие решения об использовании активного эмпирического лечения при CRE-инфекциях может быть трудным для клинициста. Были опубликованы и проверены шкалы для прогнозирования индивидуального риска развития бактериемии у пациентов, колонизированных этими микроорганизмами [162–165]. Эти шкалы имеют свои ограничения в том смысле, что они валидированы в эпидемиологических условиях для конкретной группы пациентов и не обязательно могут воспроизводится в различных клинических ситуациях, что приводит к высокой отрицательной , но ограниченной положительной прогностической ценности.
В любом случае крайне важно начать раннее эмпирическое лечение антибиотиками, при котором нет права на ошибку у пациентов с нозокомиальной инфекцией и септическим шоком, у пациентов с сепсисом и низкими функциональными резервамии или у пациентов с подавленным иммунитетом. Для этих типов пациентов и для тех, у кого из-за местной экологии, индивидуального анамнеза колонизации, предшествующей инфекции и факторов риска CRE, таких как наличие множественных сопутствующих заболеваний, лучшим вариантом было бы начать активное эмпирическое лечение против CRE (в течение 24–36 часов и с использованием информации, полученной от культур) [166] — можно принять решение об окончательном эмпирическом или таргетном лечении и избежать ненужного чрезмерного использования этих антибиотиков. Нам нужны антибиотики, активные против как можно большего количества Г(-) бактерий, устойчивых к к карбапенемам. В зависимости от очага инфекции следует добавлять противомикробные препараты, активные в отношении Г (+) бактерий (даптомицин, линезолид, ванкомицин) и анаэробов, как в случай внутрибрюшной инфекции (тигециклин или метронидазол) [167]. На Figure 5 графически суммированы возможные факторы, определяющие выбор новых антибиотиков при эмпирическом и целенаправленном антимикробном лечении карбапенем-резистентных Г(-) бактерий при нозокомиальной инфекции. Принимая во внимание, что до недавнего времени у нас не было полностью эффективных и хорошо переносимых противомикробных средств против этого типа инфекции, необходимо оптимизировать использование новых антибиотиков, гарантируя пациентам наилучшее доступное лечение, одновременно отодвигая сроки появления и распространения устойчивости к ним.
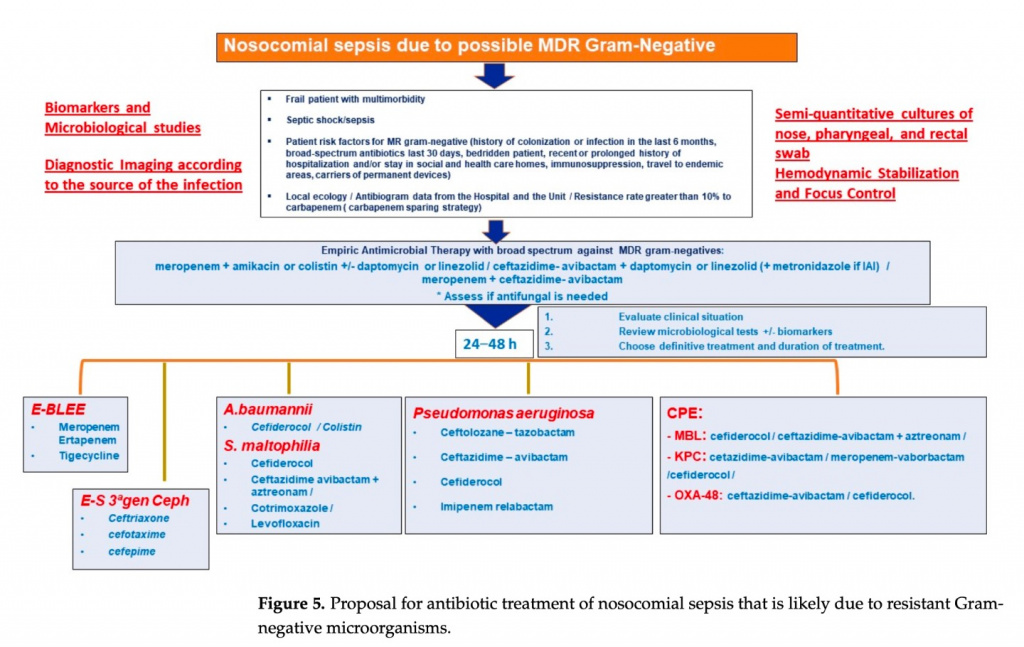
12. Выводы
Проблемы лечения антибиотиками при сепсисе включают в себя адекватные программы управления, основанные на знаниях об инфекциях в ОИТ и в контексте мультирезистентных микроорганизмов, особенно грамотрицательных микроорганизмов, основанных на сбережении карбапенемов, а также эмпирическом и рациональном использовании новых антибиотиков.
References
1. Cortegiani, A.; Antonelli, M.; Falcone, M.; Giarratano, A.; Girardis, M.; Leone, M.; Pea, F.; Stefani, S.; Vaggi, B.; Viale, P. Rationale and clinical application of antimicrobial stewardship principles in the intensive care unit: A multidisciplinary statement. J. Anesth. Analg. Crit. Care 2023, 3, 11. [CrossRef] [PubMed]
2. Liebchen, U.; Briegel, J.; Brinkmann, A.; Frey, O.; Wicha, S.G. Individualised dosing of antibiotics in ICU patients: Timing, target and model selection matter. Intensive Care Med. 2023, 49, 475–476. [PubMed]
3. Yoo, J.H. The Infinity War: How to Cope with Carbapenem-resistant Enterobacteriaceae. J. Korean Med. Sci. 2018, 33, e255. [CrossRef] [PubMed]
4. Tang, K.W.K.; Millar, B.C.; Moore, J.E. Antimicrobial Resistance (AMR). Br. J. Biomed. Sci. 2023, 80, 11387. [CrossRef] [PubMed]
5. Llor, C.; Bjerrum, L. Antimicrobial resistance: Risk associated with antibiotic overuse and initiatives to reduce the problem. Ther.Adv. Drug Saf. 2014, 5, 229–241. [PubMed]
6. Diekema, D.J.; Hsueh, P.R.; Mendes, R.E.; Pfaller, M.A.; Rolston, K.V.; Sader, H.S.; Jones, R.N. The Microbiology of Bloodstream Infection: 20-Year Trends from the SENTRY Antimicrobial Surveillance Program. Antimicrob. Agents Chemother. 2019, 63, e00355-19.
[PubMed]
7. Leone, M.; Duclos, G.; Lakbar, I.; Martin-Loeches, I.; Einav, S. Antimicrobial resistance and outcome in the critically ill patient: An opinion paper. J. Crit. Care 2023, 77, 154352. [CrossRef]
8. Karukappadath, R.M.; Sirbu, D.; Zaky, A. Drug-resistant bacteria in the critically ill: Patterns and mechanisms of resistance and potential remedies. Front. Antibiot. 2023, 2, 1145190. [CrossRef]
9. Paterson, D.L. The Challenge of Treating Superbugs. Semin. Respir. Crit. Care Med. 2015, 36, 1–2. [CrossRef]
10. Magiorakos, A.P.; Srinivasan, A.; Carey, R.B.; Carmeli, Y.; Falagas, M.E.; Giske, C.G.; Harbarth, S.; Hindler, J.F.; Kahlmeter, G.; Olsson-Liljequist, B.; et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: An international expert proposal for interim standard definitions for acquired resistance. Clin. Microbiol. Infect. 2012, 18, 268–281.
11. Angele, M.K.; Faist, E. Clinical review: Immunodepression in the surgical patient and increased susceptibility to infection. Crit.Care 2002, 6, 298. [CrossRef]
12. DeWaele, J.J.; Boelens, J.; Leroux-Roels, I. Multidrug-resistant bacteria in ICU: Fact or myth. Curr. Opin. Anaesthesiol. 2020, 33,156–161. [PubMed]
13. Bassetti, M.; Righi, E.; Vena, A.; Graziano, E.; Russo, A.; Peghin, M. Risk stratification and treatment of ICU-acquired pneumonia caused by multidrug- resistant/extensively drug-resistant/pandrug-resistant bacteria. Curr. Opin. Crit. Care 2018, 24, 385–393.
[CrossRef] [PubMed]
14. The Abdominal Sepsis Study (AbSeS) Group on behalf of the Trials Group of the European Society of Intensive Care Medicine; Blot, S.; Antonelli, M.; Arvaniti, K.; Blot, K.; Creagh-Brown, B.; de Lange, D.; De Waele, J.; Deschepper, M.; Dikmen, Y.; et al. Epidemiology of intra-abdominal infection and sepsis in critically ill patients: “AbSeS”, a multinational observational cohort study and ESICM Trials Group Project. Intensive Care Med. 2019, 45, 1703–1717. [CrossRef]
15. Bassetti, S.; Tschudin-Sutter, S.; Egli, A.; Osthoff, M. Optimizing antibiotic therapies to reduce the risk of bacterial resistance. Eur. J. Intern. Med. 2022, 99, 7–12. [PubMed]
J. Pers. Med. 2024, 14, 106 31 of 37
16. Wunderink, R.G.; Srinivasan, A.; Barie, P.S.; Chastre, J.; Dela Cruz, C.S.; Douglas, I.S.; Ecklund, M.; Evans, S.E.; Evans, S.R.; Gerlach, A.T.; et al. Antibiotic Stewardship in the Intensive Care Unit. An Official American Thoracic SocietyWorkshop Report in Collaboration with the AACN, CHEST, CDC, and SCCM. Ann. Am. Thorac. Soc. 2020, 17, 531–540.
17. De Waele, J.J.; Dhaese, S. Antibiotic stewardship in sepsis management: Toward a balanced use of antibiotics for the severely ill patient. Expert Rev. Anti Infect. Ther. 2019, 17, 89–97. [CrossRef]
18. Shrestha, J.; Zahra, F.; Cannady, J. Antimicrobial Stewardship. In StatPearls; StatPearls Publishing: Treasure Island, FL, USA, 2023. Available online: http://www.ncbi.nlm.nih.gov/books/NBK572068/ (accessed on 29 August 2023).
19. Srinivasan, A. Antibiotic stewardship: Why we must, how we can. Cleve Clin. J. Med. 2017, 84, 673–679.
20. Damiani, E.; Donati, A.; Serafini, G.; Rinaldi, L.; Adrario, E.; Pelaia, P.; Busani, S.; Girardis, M. Effect of performance improvement programs on compliance with sepsis bundles and mortality: A systematic review and meta-analysis of observational studies.PLoS ONE 2015, 10, e0125827.
21. Schinkel, M.; Nanayakkara, P.W.B.; Wiersinga, W.J. Sepsis Performance Improvement Programs: From Evidence Toward Clinical Implementation. Crit. Care 2022, 26, 77. [CrossRef]
22. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado, F.R.; Mcintyre, L.; Ostermann, N.; Prescott, H.C.; et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021.Intensive Care Med. 2021, 47, 1181–1247. [CrossRef] [PubMed]
23. Méndez, R.; Figuerola, A.; Chicot, M.; Barrios, A.; Pascual, N.; Ramasco, F.; Rodríguez, D.; García, I.; vonWernitz, A.; Zurita, N.;et al. Sepsis Code: Dodging mortality in a tertiary hospital. Rev. Esp. Quimioter. 2022, 35, 43–49. [CrossRef] [PubMed]
24. Mensa, J.; Barberán, J.; Ferrer, R.; Borges, M.; Rascado, P.; Maseda, E.; Oliver, A.; Marco, F.; Adalia, R.; Aguilar, G.; et al.Recommendations for antibiotic selection for severe nosocomial infections. Rev. Esp. Quimioter. 2021, 34, 511–524. [PubMed]
25. Peri, A.M.; Stewart, A.; Hume, A.; Irwin, A.; Harris, P.N.A. New Microbiological Techniques for the Diagnosis of Bacterial Infections and Sepsis in ICU Including Point of Care. Curr. Infect. Dis. Rep. 2021, 23, 12. [CrossRef] [PubMed]
26. Tamma, P.D.; Miller, M.A.; Cosgrove, S.E. Rethinking How Antibiotics Are Prescribed: Incorporating the 4 Moments of Antibiotic Decision Making Into Clinical Practice. JAMA 2019, 321, 139–140. [CrossRef]
27. Timsit, J.F.; Bassetti, M.; Cremer, O.; Daikos, G.; de Waele, J.; Kallil, A.; Kipnis, E.; Kollef, M.; Laupland, K.; Paiva, J.-A.; et al. Rationalizing antimicrobial therapy in the ICU: A narrative review. Intensive Care Med. 2019, 45, 172–189. [CrossRef] [PubMed]
28. Princess, I.; Vadala, R. Clinical Microbiology in the Intensive Care Unit: Time for Intensivists to Rejuvenate this Lost Art. Indian J. Crit. Care Med. 2021, 25, 566–574. [PubMed]
29. Gupta, E.; Saxena, J.; Kumar, S.; Sharma, U.; Rastogi, S.; Srivastava, V.K.; Kaushik, S.; Jyoti, A. Fast Track Diagnostic Tools for Clinical Management of Sepsis: Paradigm Shift from Conventional to Advanced Methods. Diagnostics 2023, 13, 277.
30. Gerace, E.; Mancuso, G.; Midiri, A.; Poidomani, S.; Zummo, S.; Biondo, C. Recent Advances in the Use of Molecular Methods for the Diagnosis of Bacterial Infections. Pathogens 2022, 11, 663.
31. Hansen, G.T. Point-of-Care Testing in Microbiology: A Mechanism for Improving Patient Outcomes. Clin. Chem. 2020, 66, 124–137.[CrossRef]
32. Kowalska-Krochmal, B.; Dudek-Wicher, R. The Minimum Inhibitory Concentration of Antibiotics: Methods, Interpretation,Clinical Relevance. Pathogens 2021, 10, 165. [PubMed]
33. Nabal Díaz, S.G.; Algara Robles, O.; García-Lechuz Moya, J.M. New definitions of susceptibility categories EUCAST 2019: Clinic application. Rev. Esp. Quim. 2022, 35 (Suppl. S3), 84–88. [CrossRef] [PubMed]
34. Drlica, K.; Zhao, X. Mutant Selection Window Hypothesis Updated. Clin. Infect. Dis. 2007, 44, 681–688. [CrossRef] [PubMed]
35. Zhao, X.; Drlica, K. Restricting the selection of antibiotic-resistant mutant bacteria: Measurement and potential use of the mutant selection window. J. Infect. Dis. 2002, 185, 561–565. [CrossRef]
36. Mensa, J.; Barberán, J.; Soriano, A.; Llinares, P.; Marco, F.; Cantón, R.; Bou, G.; González Del Castillo, J.; Maseda, E.; Azanza, J.R.; et al. Antibiotic selection in the treatment of acute invasive infections by Pseudomonas aeruginosa: Guidelines by the Spanish Society of Chemotherapy. Rev. Esp. Quimioter. 2018, 31, 78–100. [PubMed]
37. Schlebusch, S.; Graham, R.M.A.; Jennison, A.V.; Lassig-Smith, M.M.; Harris, P.N.A.; Lipman, J.; Ó Cuív, P.; Paterson, D.L. Standard rectal swabs as a surrogate sample for gut microbiome monitoring in intensive care. BMC Microbiol. 2022, 22, 99. [CrossRef]
38. Montero, J.G.; Lerma, F.Á.; Galleymore, P.R.; Martínez, M.P.; Rocha, L.Á.; Gaite, F.B.; Rodríguez, J.A.; González, M.C.; Moreno, I.F.; Baño, J.R.; et al. Combatting resistance in intensive care: The multimodal approach of the Spanish ICU «Zero Resistance» program. Crit. Care 2015, 19, 114. [CrossRef]
39. Roberts, J.A.; Taccone, F.S.; Lipman, J. Understanding PK/PD. Intensive Care Med. 2016, 42, 1797–1800. [CrossRef]
40. Roberts, J.A.; Paul, S.K.; Akova, M.; Bassetti, M.; De Waele, J.J.; Dimopoulos, G.; Kaukonen, K.-M.; Koulenti, D.; Martin, C.; Montravers, P.; et al. DALI: Defining antibiotic levels in intensive care unit patients: Are current _-lactam antibiotic doses
sufficient for critically ill patients? Clin. Infect. Dis. 2014, 58, 1072–1083. [CrossRef]
41. Guilhaumou, R.; Benaboud, S.; Bennis, Y.; Dahyot-Fizelier, C.; Dailly, E.; Gandia, P.; Goutelle, S.; Lefeuvre, S.; Mongardon, N.;Roger, C.; et al. Optimization of the treatment with beta-lactam antibiotics in critically ill patients—Guidelines from the French
Society of Pharmacology and Therapeutics (Société Française de Pharmacologie et Thérapeutique—SFPT) and the French Society
of Anaesthesia and Intensive Care Medicine (Société Française d’Anesthésie et Réanimation—SFAR). Crit. Care 2019, 23, 104.
J. Pers. Med. 2024, 14, 106 32 of 37
42. Hong, L.T.; Downes, K.J.; FakhriRavari, A.; Abdul-Mutakabbir, J.C.; Kuti, J.L.; Jorgensen, S.; Young, D.C.; Alshaer, M.H.; Bassetti, M.; Bonomo, R.A.; et al. International consensus recommendations for the use of prolonged-infusion beta-lactam antibiotics:Endorsed by the American College of Clinical Pharmacy, British Society for Antimicrobial Chemotherapy, Cystic Fibrosis Foundation, European Society of Clinical Microbiology and Infectious Diseases, Infectious Diseases Society of America, Society of Critical Care Medicine, and Society of Infectious Diseases Pharmacists: An executive summary. Pharmacotherapy 2023, 43, 736–739.
[PubMed]
43. Tang, R.; Luo, R.;Wu, B.;Wang, F.; Song, H.; Chen, X. Effectiveness and safety of adjunctive inhaled antibiotics for ventilatorassociated pneumonia: A systematic review and meta-analysis of randomized controlled trials. J. Crit. Care 2021, 65, 133–139. [CrossRef]
44. Kalil, A.C.; Metersky, M.L.; Klompas, M.; Muscedere, J.; Sweeney, D.A.; Palmer, L.B.; Napolitano, L.M.; O’Grady, N.P.; Bartlett, J.G.; Carratalà, J.; et al. Management of Adults with Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin. Infect. Dis. 2016, 63, e61–e111. [CrossRef]
45. Tablan, O.C.; Anderson, L.J.; Besser, R.; Bridges, C.; Hajjeh, R.; CDC; Healthcare Infection Control Practices Advisory Committee. Guidelines for preventing health-care-associated pneumonia, 2003: Recommendations of CDC and the Healthcare Infection Control Practices Advisory Committee. Morb. Mortal. Wkly. Rep. Recomm. Rep. 2004, 53, 1–179.
46. Rello, J.; Solé-Lleonart, C.; Rouby, J.J.; Chastre, J.; Blot, S.; Poulakou, G.; Luyt, C.-E.; Riera, J.; Palmer, L.B.; Pereira, J.M.; et al. Use of nebulized antimicrobials for the treatment of respiratory infections in invasively mechanically ventilated adults: A position paper from the European Society of Clinical Microbiology and Infectious Diseases. Clin. Microbiol. Infect. 2017, 23, 629–639. [CrossRef] [PubMed]
47. Gorham, J.; Taccone, F.S.; Hites, M. How to Use Nebulized Antibiotics in Severe Respiratory Infections. Antibiotics 2023, 12, 267. [CrossRef] [PubMed]
48. Abdul-Aziz, M.H.; Alffenaar, J.W.C.; Bassetti, M.; Bracht, H.; Dimopoulos, G.; Marriott, D.; Neely, M.N.; Paiva, J.-A.; Pea, F.; Sjovall, F.; et al. Antimicrobial therapeutic drug monitoring in critically ill adult patients: A Position Paper. Intensive Care Med.2020, 46, 1127–1153. [CrossRef]
49. Shi, A.X.; Qu, Q.; Zhuang, H.H.; Teng, X.Q.; Xu,W.X.; Liu, Y.P.; Xiao, Y.W.; Qu, J. Individualized antibiotic dosage regimens for patients with augmented renal clearance. Front. Pharmacol. 2023, 14, 1137975. [CrossRef]
50. Shenoy, E.S.; Macy, E.; Rowe, T.; Blumenthal, K.G. Evaluation and Management of Penicillin Allergy: A Review. JAMA 2019, 321, 188–199.
51. Stone, C.A.; Trubiano, J.; Coleman, D.T.; Rukasin, C.R.F.; Phillips, E.J. The challenge of de-labeling penicillin allergy. Allergy 2020,75, 273–288.
52. Caruso, C.; Valluzzi, R.L.; Colantuono, S.; Gaeta, F.; Romano, A. _-Lactam Allergy and Cross-Reactivity: A Clinician’s Guide to Selecting an Alternative Antibiotic. J. Asthma Allergy 2021, 14, 31–46. [CrossRef] [PubMed]
53. Alvarez-Cuesta, E.; Madrigal-Burgaleta, R.; Broyles, A.D.; Cuesta-Herranz, J.; Guzman-Melendez, M.A.; Maciag, M.C.; Phillips, E.J.; Trubiano, J.A.;Wong , J.T.; Ansotegui, I. Standards for practical intravenous rapid drug desensitization & delabeling: AWAO committee statement. World Allergy Organ. J. 2022, 15, 100640. [PubMed]
54. Savic, L.; Ardern-Jones, M.; Avery, A.; Cook, T.; Denman, S.; Farooque, S.; Garcez, T.; Gold, R.; Jay, N.; Krishna, M.T.; et al. BSACI guideline for the set-up of penicillin allergy de-labelling services by non-allergists working in a hospital setting. Clin. Exp. Allergy 2022, 52, 1135–1141. [PubMed]
55. Trubiano, J.A.; Vogrin, S.; Chua, K.Y.L.; Bourke, J.; Yun, J.; Douglas, A.; Stone, A.C.; Yu, R.; Lauren, G.; Holmes, N.E.; et al. Development and Validation of a Penicillin Allergy Clinical Decision Rule. JAMA Intern. Med. 2020, 180, 745–752. [CrossRef] [PubMed]
56. Courtemanche, J.; Baril, L.; Clément, A.; Bédard, M.A.; Plourde, M.; Émond, M. Is it possible to identify patients at low risk of having a true penicillin allergy? Can. J. Emerg. Med. 2022, 24, 366–368. [CrossRef]
57. Trubiano, J.A. A Risk-Based Approach to Penicillin Allergy. Immunol. Allergy Clin. North Am. 2022, 42, 375–389. [CrossRef]
58. Holmes, M.D.; Vo, N.; Rafeq, R.; Byrne, D.; King, M. Administration of _-lactam antibiotics to patients with reported penicillin allergy in the emergency department. Am. J. Emerg. Med. 2023, 68, 119–123.
59. Pulcini, C.; Bush, K.; Craig, W.A.; Frimodt-Møller, N.; Grayson, M.L.; Mouton, J.W.; Turnidge, J.; Harbarth, S.; Gyssens, I.C.; ESCMID Study Group for Antibiotic Policies. Forgotten antibiotics: An inventory in Europe, the United States, Canada, and Australia. Clin. Infect. Dis. 2012, 54, 268–274. [CrossRef]
60. El-Sayed Ahmed, M.A.E.G.; Zhong, L.L.; Shen, C.; Yang, Y.; Doi, Y.; Tian, G.B. Colistin and its role in the Era of antibiotic resistance: An extended review (2000–2019). Emerg. Microbes Infect. 2020, 9, 868–885. [CrossRef]
61. Múñez Rubio, E.; Ramos Martínez, A.; Fernández Cruz, A. Fosfomycin in antimicrobial stewardship programs. Rev. Esp. Quimioter. 2019, 32 (Suppl. S1), 62–66.
62. Rychlíˇcková, J.; Kubíˇcková, V.; Suk, P.; Urbánek, K. Challenges of Colistin Use in ICU and Therapeutic Drug Monitoring: A Literature Review. Antibiotics 2023, 12, 437.
63. Brown, G.R. Cotrimoxazole—Optimal dosing in the critically ill. Ann. Intensive Care 2014, 4, 13. [CrossRef] [PubMed]
64. Tamma, P.D.; Aitken, S.L.; Bonomo, R.A.; Mathers, A.J.; van Duin, D.; Clancy, C.J. Infectious Diseases Society of America 2023 Guidance on the Treatment of Antimicrobial Resistant Gram-Negative Infections. Clin. Infect. Dis. 2023, ciad428. [CrossRef] [PubMed]
65. Yaghoubi, S.; Zekiy, A.O.; Krutova, M.; Gholami, M.; Kouhsari, E.; Sholeh, M.; Ghafouri, Z.; Maleki, F. Tigecycline antibacterial activity, clinical effectiveness, and mechanisms and epidemiology of resistance: Narrative review. Eur. J. Clin. Microbiol. Infect. Dis. 2022, 41, 1003–1022. [CrossRef] [PubMed]
66. De Pascale, G.; Lisi, L.; Ciotti, G.M.P.; Vallecoccia, M.S.; Cutuli, S.L.; Cascarano, L.; Gelormini, C.; Bello, G.; Montini, L.; Carelli, S.;et al. Pharmacokinetics of high-dose tigecycline in critically ill patients with severe infections. Ann. Intensive Care 2020, 10, 94.
67. Infectious Diseases Society of America (IDSA); Spellberg, B.; Blaser, M.; Guidos, R.J.; Boucher, H.W.; Bradley, J.S. Combating antimicrobial resistance: Policy recommendations to save lives. Clin. Infect. Dis. 2011, 52 (Suppl. S5), S397–S428.
68. Brown, N.M.; Goodman, A.L.; Horner, C.; Jenkins, A.; Brown, E.M. Treatment of methicillin-resistant Staphylococcus aureus (MRSA): Updated guidelines from the UK. JAC Antimicrob. Resist. 2021, 3, dlaa114. [CrossRef]
69. Habib, G.; Lancellotti, P.; Antunes, M.J.; Bongiorni, M.G.; Casalta, J.P.; Del Zotti, F.; Dulgheru, R.; El Khoury, G.; Erba, P.A.; Iung, B.; et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective
Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur. Heart J. 2015, 36, 3075–3128.
70. Infectious Diseases Society of America. The 10 x ’20 Initiative: Pursuing a global commitment to develop 10 new antibacterial drugs by 2020. Clin. Infect. Dis. 2010, 50, 1081–1083.
71. Hetzler, L.; Kollef, M.H.; Yuenger, V.; Micek, S.T.; Betthauser, K.D. New antimicrobial treatment options for severe Gram-negative infections. Curr. Opin. Crit. Care 2022, 28, 522–533.
72. Clancy, C.J.; Nguyen, M.H. Management of Highly Resistant Gram-Negative Infections in the Intensive Care Unit in the Era of Novel Antibiotics. Infect. Dis. Clin. N. Am. 2022, 36, 791–823. [CrossRef] [PubMed]
73. Shirley, M. Ceftazidime-Avibactam: A Review in the Treatment of Serious Gram-Negative Bacterial Infections. Drugs 2018, 78,675–692. [CrossRef]
74. Matesanz, M.; Mensa, J. Ceftazidime-Avibactam. Rev. Esp. Quimioter. 2021, 34 (Suppl. S1), 38–40. [CrossRef]
75. Pintado, V.; Ruiz-Garbajosa, P.; Aguilera-Alonso, D.; Baquero-Artigao, F.; Bou, G.; Cantón, R.; Grau, S.; Gutiérrez-Gutiérrez, B.;Larrosa, N.; Machuca, I.; et al. Executive summary of the consensus document of the Spanish Society of Infectious Diseases and Clinical Microbiology (SEIMC) on the diagnosis and antimicrobial treatment of infections due to carbapenem-resistant
Gram-negative bacteria. Enferm. Infecc. Microbiol. Clin. 2023, 41, 360–370. [CrossRef]
76. Paul, M.; Carrara, E.; Retamar, P.; Tängdén, T.; Bitterman, R.; Bonomo, R.A.; deWaele, J.; Daikos, G.L.; Akova, M.; Harbarth, S.;et al. European Society of Clinical Microbiology and Infectious Diseases (ESCMID) guidelines for the treatment of infections caused by multidrug-resistant Gram-negative bacilli (endorsed by European society of intensive care medicine). Clin. Microbiol. Infect. 2022, 28, 521–547. [CrossRef]
77. Bassetti, M.; Garau, J. Current and future perspectives in the treatment of multidrug-resistant Gram-negative infections. J. Antimicrob. Chemother. 2021, 76 (Suppl. S4), iv23–iv37. [PubMed]
78. Soriano, A.; Carmeli, Y.; Omrani, A.S.; Moore, L.S.P.; Tawadrous, M.; Irani, P. Ceftazidime-Avibactam for the Treatment of Serious Gram-Negative Infections with Limited Treatment Options: A Systematic Literature Review. Infect. Dis. Ther. 2021, 10, 1989–2034.
[CrossRef]
79. Soriano, A.; Montravers, P.; Bassetti, M.; Klyasova, G.; Daikos, G.; Irani, P.; Stone, G.; Chambers, R.; Peeters, P.; Shah, M.; et al.The Use and Effectiveness of Ceftazidime–Avibactam in Real-World Clinical Practice: EZTEAM Study. Infect. Dis. Ther. 2023, 12, 891–917.
80. Swaminathan, S.; Routray, A.; Mane, A. Early and Appropriate Use of Ceftazidime-Avibactam in the Management of Multidrug-Resistant Gram-Negative Bacterial Infections in the Indian Scenario. Cureus 2022, 14, e28283. [CrossRef]
81. Jorgensen, S.C.J.; Trinh, T.D.; Zasowski, E.J.; Lagnf, A.M.; Bhatia, S.; Melvin, S.M.; E Steed, M.; Simon, S.P.; Estrada, S.J.; Morrisette, T.; et al. Real-World Experience with Ceftazidime-Avibactam for Multidrug-Resistant Gram-Negative Bacterial Infections. Open
Forum Infect. Dis. 2019, 6, ofz522.
82. Castón, J.J.; Cano, A.; Pérez-Camacho, I.; Aguado, J.M.; Carratalá, J.; Ramasco, F.; Soriano, A.; Pintado, V.; Castelo-Corral, L.; Sousa, A.; et al. Impact of ceftazidime/avibactam versus best available therapy on mortality from infections caused by carbapenemase-producing Enterobacterales (CAVICOR study). J. Antimicrob. Chemother. 2022, 77, 1452–1460. [CrossRef] [PubMed]
83. Mikhail, S.; Singh, N.B.; Kebriaei, R.; Rice, S.A.; Stamper, K.C.; Castanheira, M.; Rybak, M.J. Evaluation of the Synergy of Ceftazidime-Avibactam in Combination with Meropenem, Amikacin, Aztreonam, Colistin, or Fosfomycin against Well-Characterized Multidrug-Resistant Klebsiella pneumoniae and Pseudomonas aeruginosa. Antimicrob. Agents Chemother. 2019, 63,
e00779-19. [PubMed]
84. Wang, L.T.; Lin, W.T.; Lai, C.C.; Wang, Y.H.; Chen, C.H.; Chang, Y.T.; Chen, C.-H.; Wang, C.-Y. The safety of ceftolozanetazobactam for the treatment of acute bacterial infections: A systemic review and meta-analysis. Ther. Adv. Drug Saf. 2021, 12, 20420986211027096. [CrossRef] [PubMed]
85. Candel, F.J.; del Castillo, J.G.; Jiménez, A.J.; Matesanz, M. Ceftolozane-tazobactam in nosocomial pneumonia. Rev. Esp. Quimioter. 2022, 35 (Suppl. S1), 35–39. [CrossRef] [PubMed]
86. Timsit, J.F.; Huntington, J.A.; Wunderink, R.G.; Shime, N.; Kollef, M.H.; Kivistik, Ü.; Nováˇcek, M.; Réa-Neto, A.; Martin-Loeches 9, I.; Yu, B.; et al. Ceftolozane/tazobactam versus meropenem in patients with ventilated hospital-acquired bacterial pneumonia: Subset analysis of the ASPECT-NP randomized, controlled phase 3 trial. Crit. Care 2021, 25, 290. [CrossRef]
87. Puzniak, L.; Dillon, R.; Palmer, T.; Collings, H.; Enstone, A. Real-world use of ceftolozane/tazobactam: A systematic literature review. Antimicrob. Resist. Infect. Control 2021, 10, 68. [CrossRef]
88. Sansone, P.; Giaccari, L.G.; Coppolino, F.; Aurilio, C.; Barbarisi, A.; Passavanti, M.B.; Pota, V.; Pace, M.C. Cefiderocol for Carbapenem-Resistant Bacteria: Handle with Care! A Review of the Real-World Evidence. Antibiotics 2022, 11, 904.
89. Maseda, E.; Suárez de la Rica, A. The role of cefiderocol in clinical practice. Rev. Esp. Quimioter. 2022, 35 (Suppl. S2), 39–44. [CrossRef]
90. Bassetti, M.; Echols, R.; Matsunaga, Y.; Ariyasu, M.; Doi, Y.; Ferrer, R.; Lodise, T.P.; Naas, T.; Niki, Y.; Paterson, D.L.; et al. Efficacy and safety of cefiderocol or best available therapy for the treatment of serious infections caused by carbapenem-resistant Gram-negative bacteria (CREDIBLE-CR): A randomised, open-label, multicentre, pathogen-focused, descriptive, phase 3 trial. Lancet Infect. Dis. 2021, 21, 226–240. [CrossRef]
91. Viale, P.; Sandrock, C.E.; Ramirez, P.; Rossolini, G.M.; Lodise, T.P. Treatment of critically ill patients with cefiderocol for infections caused by multidrug-resistant pathogens: Review of the evidence. Ann. Intensive Care 2023, 13, 52. [CrossRef]
92. Corcione, S.; Lupia, T.; Maraolo, A.E.; Mornese Pinna, S.; Gentile, I.; De Rosa, F.G. Carbapenem-sparing strategy: Carbapenemase, treatment, and stewardship. Curr. Opin. Infect. Dis. 2019, 32, 663–673.
93. Jean, S.S.; Harnod, D.; Hsueh, P.R. Global Threat of Carbapenem-Resistant Gram-Negative Bacteria. Front. Cell Infect. Microbiol. 2022, 12, 823684.
94. Arulkumaran, N.; Routledge, M.; Schlebusch, S.; Lipman, J.; Conway Morris, A. Antimicrobial-associated harm in critical care: A narrative review. Intensive Care Med. 2020, 46, 225–235. [CrossRef] [PubMed]
95. Harris, P.N.A.; Tambyah, P.A.; Lye, D.C.; Mo, Y.; Lee, T.H.; Yilmaz, M.; Alenazi, T.H.; Arabi, Y.; Falcone, M.; Bassetti, M.; et al. Effect of Piperacillin-Tazobactam vs Meropenem on 30-Day Mortality for Patients with E. coli or Klebsiella pneumoniae Bloodstream Infection and Ceftriaxone Resistance: A Randomized Clinical Trial. JAMA 2018, 320, 984–994. [PubMed]
96. Montravers, P.; Bassetti, M. The ideal patient profile for new beta-lactam/beta-lactamase inhibitors. Curr. Opin. Infect. Dis. 2018,31, 587–593. [PubMed]
97. Kollef, M.H.; Shorr, A.F.; Bassetti, M.; Timsit, J.F.; Micek, S.T.; Michelson, A.P.; Garnacho-Montero, J. Timing of antibiotic therapy in the ICU. Crit. Care 2021, 25, 360.
98. DeWaele, J.J.; Schouten, J.; Beovic, B.; Tabah, A.; Leone, M. Antimicrobial de-escalation as part of antimicrobial stewardship in intensive care: No simple answers to simple questions—A viewpoint of experts. Intensive Care Med. 2020, 46, 236–244.
99. Strich, J.R.; Heil, E.L.; Masur, H. Considerations for Empiric Antimicrobial Therapy in Sepsis and Septic Shock in an Era of Antimicrobial Resistance. J. Infect. Dis. 2020, 222 (Suppl. S2), S119–S131.
100. Dequin, P.F.; Aubron, C.; Faure, H.; Garot, D.; Guillot, M.; Hamzaoui, O.; Lemiale, V.; Maizel, J.; Mootien, J.Y.; Osman, D.; et al. The place of new antibiotics for Gram-negative bacterial infections in intensive care: Report of a consensus conference. Ann. Intensive Care 2023, 13, 59.
101. Miller, W.D.; Keskey, R.; Alverdy, J.C. Sepsis and the Microbiome: A Vicious Cycle. J. Infect. Dis. 2020, 223 (Suppl. S3), S264–S269. [CrossRef]
102. Prechter, F.; Katzer, K.; Bauer, M.; Stallmach, A. Sleeping with the enemy: Clostridium difficile infection in the intensive care unit. Crit. Care 2017, 21, 260. [PubMed]
103. Morel, C.M.; de Kraker, M.E.A.; Harbarth, S.; The Enhanced Surveillance Expert Consensus Group (CANSORT-SCI). Surveillance of Resistance to New Antibiotics in an Era of Limited Treatment Options. Front. Med. 2021, 8, 652638.
104. Niederman, M.S.; Baron, R.M.; Bouadma, L.; Calandra, T.; Daneman, N.; DeWaele, J.; Kollef, M.H.; Lipman, J.; Nair, G.B. Initial antimicrobial management of sepsis. Crit. Care 2021, 25, 307.
105. Pea, F.; Viale, P. The antimicrobial therapy puzzle: Could pharmacokinetic-pharmacodynamic relationships be helpful in addressing the issue of appropriate pneumonia treatment in critically ill patients? Clin. Infect. Dis. 2006, 42, 1764–1771.
106. Kumar, A. An alternate pathophysiologic paradigm of sepsis and septic shock: Implications for optimizing antimicrobial therapy.Virulence 2014, 5, 80–97. [PubMed]
107. Danjean, M.; Hobson, C.A.; Gits-Muselli, M.; Courroux, C.; Monjault, A.; Bonacorsi, S.; Birgy, A. Evaluation of the inoculum effect of new antibiotics against carbapenem-resistant enterobacterales. Clin. Microbiol. Infect. 2022, 28, 1503.e1–1503.e3.
108. Heffernan, A.J.; Mohd Sazlly Lim, S.; Lipman, J.; Roberts, J.A. A personalised approach to antibiotic pharmacokinetics and pharmacodynamics in critically ill patients. Anaesth. Crit. Care Pain. Med. 2021, 40, 100970. [CrossRef]
109. Zaragoza, R.; Vidal-Cortés, P.; Aguilar, G.; Borges, M.; Diaz, E.; Ferrer, R.; Maseda, E.; Nieto, M.; Nuvials, F.X.; Ramirez, P.; et al. Update of the treatment of nosocomial pneumonia in the ICU. Crit. Care 2020, 24, 383. [CrossRef]
110. Di Franco, S.; Alfieri, A.; Fiore, M.; Fittipaldi, C.; Pota, V.; Coppolino, F.; Sansone, P.; Pace, M.C.; Passavanti, M.B. A Literature Overview of Secondary Peritonitis Due to Carbapenem-Resistant Enterobacterales (CRE) in Intensive Care Unit (ICU) Patients.Antibiotics 2022, 11, 1347.
111. Heidary, M.; Khosravi, A.D.; Khoshnood, S.; Nasiri, M.J.; Soleimani, S.; Goudarzi, M. Daptomycin. J. Antimicrob. Chemother. 2018,73, 1–11. [CrossRef]
112. Thomas-Rüddel, D.O.; Schlattmann, P.; Pletz, M.; Kurzai, O.; Bloos, F. Risk Factors for Invasive Candida Infection in Critically Ill Patients: A Systematic Review and Meta-analysis. Chest 2022, 161, 345–355. [PubMed]
113. Keane, S.; Geoghegan, P.; Povoa, P.; Nseir, S.; Rodriguez, A.; Martin-Loeches, I. Systematic review on the first line treatment of amphotericin B in critically ill adults with candidemia or invasive candidiasis. Expert Rev. Anti Infect. Ther. 2018, 16, 839–847.[CrossRef] [PubMed]
114. Burillo, A.; Bouza, E. Faster infection diagnostics for intensive care unit (ICU) patients. Expert Rev. Mol. Diagn. 2022, 22, 347–360. [CrossRef] [PubMed]
115. Méndez Hernández, R.; Ramasco Rueda, F. Biomarkers as Prognostic Predictors and Therapeutic Guide in Critically Ill Patients:Clinical Evidence. J. Pers. Med. 2023, 13, 333. [PubMed]
116. Vincent, J.L.; Bassetti, M.; François, B.; Karam, G.; Chastre, J.; Torres, A.; Roberts, J.A.; Taccone, F.S.; Rello, J.; Calandra, T.; et al.Advances in antibiotic therapy in the critically ill. Crit. Care 2016, 20, 133. [PubMed]
117. Ulldemolins, M.; Nuvials, X.; Palomar, M.; Masclans, J.R.; Rello, J. Appropriateness is critical. Crit. Care Clin. 2011, 27, 35–51.
118. Mahmoudi, L.; Niknam, R.; Mousavi, S.; Ahmadi, A.; Honarmand, H.; Ziaie, S.; Mojtahedzadeh, M. Optimal Aminoglycoside Therapy Following the Sepsis: How Much Is Too Much? Iran. J. Pharm. Res. 2013, 12, 261–269.
119. Kumar, A.; Roberts, D.; Wood, K.E.; Light, B.; Parrillo, J.E.; Sharma, S.; Suppes, R.; Feinstein, D.; Zanotti, S.; Taiberg, L.; et al.Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit. Care Med. 2006, 34, 1589. [CrossRef]
120. Ferrer, R.; Martin-Loeches, I.; Phillips, G.; Osborn, T.M.; Townsend, S.; Dellinger, R.P.; Artigas, A.; Schorr, C.; Levy, M.M. Empiric antibiotic treatment reduces mortality in severe sepsis and septic shock from the first hour: Results from a guideline-based
performance improvement program. Crit. Care Med. 2014, 42, 1749–1755.
121. Im, Y.; Kang, D.; Ko, R.E.; Lee, Y.J.; Lim, S.Y.; Park, S.; Na, S.J.; Chung, C.R.; Park, M.H.; Oh, D.K.; et al. Time-to-antibiotics and clinical outcomes in patients with sepsis and septic shock: A prospective nationwide multicenter cohort study. Crit. Care 2022,26, 19. [CrossRef]
122. Peltan, I.D.; Mitchell, K.H.; Rudd, K.E.; Mann, B.A.; Carlbom, D.J.; Hough, C.L.; Rea, T.D.; Brown, S.M. Physician Variation in Time to Antimicrobial Treatment for Septic Patients Presenting to the Emergency Department. Crit. Care Med. 2017, 45, 1011–1018.[CrossRef] [PubMed]
123. Roberts, R.J.; Alhammad, A.M.; Crossley, L.; Anketell, E.; Wood, L.; Schumaker, G.; Garpestad, E.; Devlin, J.W. A survey of critical care nurses’ practices and perceptions surrounding early intravenous antibiotic initiation during septic shock. Intensive Crit. Care Nurs. 2017, 41, 90–97. [CrossRef] [PubMed]
124. Pak, T.R.; Rhee, C.; Klompas, M. Timing and Spectrum of Antibiotic Treatment for Suspected Sepsis and Septic Shock: Why so Controversial? Infect. Dis. Clin. North Am. 2022, 36, 719–733. [CrossRef]
125. Rothrock, S.G.; Cassidy, D.D.; Barneck, M.; Schinkel, M.; Guetschow, B.; Myburgh, C.; Nguyen, L.; Earwood, R.; Nanayakkara, P.W.; Panday, R.S.N.; et al. Outcome of Immediate Versus Early Antibiotics in Severe Sepsis and Septic Shock: A Systematic Review and Meta-analysis. Ann. Emerg. Med. 2020, 76, 427–441. [CrossRef] [PubMed]
126. Rhee, C.; Chiotos, K.; Cosgrove, S.E.; Heil, E.L.; Kadri, S.S.; Kalil, A.C.; Gilbert, D.N.; Masur, H.; Septimus, E.J.; A Sweeney, D.; et al. Infectious Diseases Society of America Position Paper: Recommended Revisions to the National Severe Sepsis and Septic Shock Early Management Bundle (SEP-1) Sepsis Quality Measure. Clin. Infect. Dis. 2021, 72, 541–552. [CrossRef] [PubMed]
127. Weinberger, J.; Rhee, C.; Klompas, M. A Critical Analysis of the Literature on Time-to-Antibiotics in Suspected Sepsis. J. Infect. Dis. 2020, 222 (Suppl. S2), S110–S118.
128. Montravers, P.; Blot, S.; Dimopoulos, G.; Eckmann, C.; Eggimann, P.; Guirao, X.; Paiva, J.A.; Sganga, G.; De Waele, J. Therapeutic management of peritonitis: A comprehensive guide for intensivists. Intensive Care Med. 2016, 42, 1234–1247.
129. Ordoñez, C.A.; Caicedo, Y.; Parra, M.W.; Rodríguez-Holguín, F.; Serna, J.J.; Salcedo, A.; Franco, M.J.; Toro, L.E.; Pino, L.F.; Guzmán-Rodríguez, M.; et al. Evolution of damage control surgery in non-traumatic abdominal pathology: A light in the darkness. Colomb. Med. 2021, 52, e4194809. [CrossRef]
130. DeWaele, J.J.; Girardis, M.; Martin-Loeches, I. Source control in the management of sepsis and septic shock. Intensive Care Med.2022, 48, 1799–1802. [CrossRef]
131. De Pascale, G.; Antonelli, M.; Deschepper, M.; Arvaniti, K.; Blot, K.; Brown, B.C.; de Lange, D.; De Waele, J.; Dikmen, Y.;Dimopoulos, G.; et al. Poor timing and failure of source control are risk factors for mortality in critically ill patients with secondary peritonitis. Intensive Care Med. 2022, 48, 1593–1606. [CrossRef]
132. Obst, W.; Esser, T.; Kaasch, A.J.; Geginat, G.; Meyer, F.; Croner, R.S.; Keitel, V. The Need of Antimicrobial Stewardship in Post-Operative Infectious Complications of Abdominal Surgery. Visc. Med. 2022, 38, 345–353. [PubMed]
133. Maseda, E.; Suarez-de-la-Rica, A.; Anillo, V.; Tamayo, E.; García-Bernedo, C.A.; Ramasco, F.; Villagran, M.-J.; Maggi, G.; Gimenez, M.-J.; Aguilar, L.; et al. Procalcitonin-guided therapy may reduce length of antibiotic treatment in intensive care unit patients with secondary peritonitis: A multicenter retrospective study. J. Crit. Care 2015, 30, 537–542. [CrossRef] [PubMed]
134. For the DURAPOP Trial Group; Montravers, P.; Tubach, F.; Lescot, T.; Veber, B.; Esposito-Farèse, M.; Seguin, P.; Paugam, C.; Lepape, A.; Meistelman, C.; et al. Short-course antibiotic therapy for critically ill patients treated for postoperative intra-abdominal infection: The DURAPOP randomised clinical trial. Intensive Care Med. 2018, 44, 300–310. [CrossRef] [PubMed]
135. Bass, G.A.; Dzierba, A.L.; Taylor, B.; Lane-Fall, M.; Kaplan, L.J. Tertiary peritonitis: Considerations for complex team-based care. Eur. J. Trauma. Emerg. Surg. 2022, 48, 811–825. [PubMed]
136. Marques, H.S.; Araújo, G.R.L.; da Silva, F.A.F.; de Brito, B.B.; Versiani, P.V.D.; Caires, J.S.; Milet, T.d.C.; de Melo, F.F. Tertiary peritonitis: A disease that should not be ignored. World J. Clin. Cases 2021, 9, 2160–2169. [CrossRef] [PubMed]
137. Prest, J.; Nguyen, T.; Rajah, T.; Prest, A.B.; Sathananthan, M.; Jeganathan, N. Sepsis-Related Mortality Rates and Trends Based on Site of Infection. Crit. Care Explor. 2022, 4, e0775.
138. Cavaillon, J.; Singer, M.; Skirecki, T. Sepsis therapies: Learning from 30 years of failure of translational research to propose new leads. EMBO Mol. Med. 2020, 12, e10128. [CrossRef]
139. Baggs, J.; Jernigan, J.A.; Halpin, A.L.; Epstein, L.; Hatfield, K.M.; McDonald, L.C. Risk of Subsequent Sepsis within 90 Days after a Hospital Stay by Type of Antibiotic Exposure. Clin. Infect. Dis. 2018, 66, 1004–1012. [CrossRef]
140. Teshome, B.F.; Vouri, S.M.; Hampton, N.; Kollef, M.H.; Micek, S.T. Duration of Exposure to Antipseudomonal _-Lactam Antibiotics in the Critically Ill and Development of New Resistance. Pharmacotherapy 2019, 39, 261–270.
141. Raman, K.; Nailor, M.D.; Nicolau, D.P.; Aslanzadeh, J.; Nadeau, M.; Kuti, J.L. Early Antibiotic Discontinuation in Patients with Clinically Suspected Ventilator-Associated Pneumonia and Negative Quantitative Bronchoscopy Cultures. Crit. Care Med. 2013,41, 1656–1663.
142. Sawyer, R.G.; Claridge, J.A.; Nathens, A.B.; Rotstein, O.D.; Duane, T.M.; Evans, H.L.; Cook, C.H.; O’neill, P.J.; Mazuski, J.E.;Askari, R.; et al. Trial of Short-Course Antimicrobial Therapy for Intraabdominal Infection. N. Engl. J. Med. 2015, 372, 1996–2005.[CrossRef] [PubMed]
143. Yahav, D.; Franceschini, E.; Koppel, F.; Turjeman, A.; Babich, T.; Bitterman, R.; Neuberger, A.; Ghanem-Zoubi, N.; Santoro, A.; Eliakim-Raz, N.; et al. Seven Versus 14 Days of Antibiotic Therapy for Uncomplicated Gram-negative Bacteremia: A Noninferiority Randomized Controlled Trial. Clin. Infect. Dis. 2019, 69, 1091–1098. [PubMed]
144. Thorlacius-Ussing, L.; Andersen, C.Ø.; Frimodt-Møller, N.; Knudsen, I.J.D.; Lundgren, J.; Benfield, T.L. Efficacy of seven and fourteen days of antibiotic treatment in uncomplicated Staphylococcus aureus bacteremia (SAB7): Study protocol for a randomized controlled trial. Trials 2019, 20, 250.
145. Kim, C.J.; Song, K.H.; Park, K.H.; Kim, M.; Choe, P.G.; Oh M d et, a.l. Impact of antimicrobial treatment duration on outcome of Staphylococcus aureus bacteraemia: A cohort study. Clin. Microbiol. Infect. 2019, 25, 723–732. [CrossRef] [PubMed]
146. Chastre, J.;Wolff, M.; Fagon, J.Y.; Chevret, S.; Thomas, F.;Wermert, D.; Clementi, E.; Gonzalez, J.; Jusserand, D.; Asfar, D.; et al. Comparison of 8 vs 15 Days of Antibiotic Therapy for Ventilator-Associated Pneumonia in Adults: A Randomized Trial. JAMA 2003, 290, 2588. [CrossRef] [PubMed]
147. Bouglé, A.; Tuffet, S.; Federici, L.; Leone, M.; Monsel, A.; Dessalle, T.; Amour, J.; Dahyot-Fizelier, C.; Barbier, F.; Luyt, C.-E.; et al.Comparison of 8 versus 15 days of antibiotic therapy for Pseudomonas aeruginosa ventilator-associated pneumonia in adults: A randomized, controlled, open-label trial. Intensive Care Med. 2022, 48, 841–849.
148. Metersky, M.L.; Klompas, M.; Kalil, A.C. Less Is More: A 7-Day Course of Antibiotics Is the Evidence-Based Treatment for Pseudomonas aeruginosa Ventilator-Associated Pneumonia. Clin. Infect. Dis. 2023, 76, 750–752. [CrossRef]
149. Rouzé, A.; Martin-Loeches, I.; Povoa, P.; Makris, D.; Artigas, A.; Bouchereau, M.; Lambiotte, F.; Metzelard, M.; Cuchet, P.;Geronimi, C.B.; et al. Relationship between SARS-CoV-2 infection and the incidence of ventilator-associated lower respiratory tract infections: A European multicenter cohort study. Intensive Care Med. 2021, 47, 188–198. [CrossRef]
150. Assicot, M.; Bohuon, C.; Gendrel, D.; Raymond, J.; Carsin, H.; Guilbaud, J. High serum procalcitonin concentrations in patients with sepsis and infection. Lancet 1993, 341, 515–518.
151. Rau, B.; Krüger, C.M.; Schilling, M.K. Procalcitonin: Improved biochemical severity stratification and postoperative monitoring in severe abdominal inflammation and sepsis. Langenbeck’s Arch. Surg. 2004, 389, 134–144. [CrossRef]
152. Bouadma, L.; Luyt, C.E.; Tubach, F.; Cracco, C.; Alvarez, A.; Schwebel, C.; Schortgen, F.; Lasocki, S.; Veber, B.; Dehoux, M.; et al. Use of procalcitonin to reduce patients’ exposure to antibiotics in intensive care units (PRORATA trial): A multicentre randomised controlled trial. Lancet 2010, 375, 463–474. [PubMed]
153. De Jong, E.; Van Oers, J.A.; Beishuizen, A.; Vos, P.; Vermeijden,W.J.; Haas, L.E.; Loef, B.G.; Dormans, T.; van Melsen, G.C.; Kluiters, Y.C.; et al. Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients: A randomised, controlled, open-label trial. Lancet Infect. Dis. 2016, 16, 819–827. [PubMed]
154. Larsson, A.; Tydén, J.; Johansson, J.; Lipcsey, M.; Bergquist, M.; Kultima, K.; Mandic-Havelka, A. Calprotectin is superior to procalcitonin as a sepsis marker and predictor of 30-day mortality in intensive care patients. Scand. J. Clin. Lab. Investig. 2020, 80,156–161.
155. Parke, Å.; Unge, C.; Yu, D.; Sundén-Cullberg, J.; Strålin, K. Plasma calprotectin as an indicator of need of transfer to intensive care in patients with suspected sepsis at the emergency department. BMC Emerg. Med. 2023, 23, 16. [CrossRef]
156. Sartelli, M.; Chichom-Mefire, A.; Labricciosa, F.M.; Hardcastle, T.; Abu-Zidan, F.M.; Adesunkanmi, A.K.; Ansaloni, A.; Bala, M.; Balogh, Z.J.; Beltrán, M.A.; et al. The management of intra-abdominal infections from a global perspective: 2017 WSES guidelines for management of intra-abdominal infections. World J. Emerg. Surg. 2017, 12, 29. [CrossRef] [PubMed]
157. Zilberberg, M.D.; Shorr, A.F.; Micek, S.T.; Vazquez-Guillamet, C.; Kollef, M.H. Multi-drug resistance, inappropriate initial antibiotic therapy and mortality in Gram-negative severe sepsis and septic shock: A retrospective cohort study. Crit. Care 2014,18, 596.
158. Huang, C.T.; Tsai, Y.J.; Tsai, P.R.; Yu, C.J.; Ko,W.J. Severe Sepsis and Septic Shock: Timing of Septic Shock Onset Matters. Shock 2016, 45, 518–524. [CrossRef]
159. Vazquez-Guillamet, C.; Scolari, M.; Zilberberg, M.D.; Shorr, A.F.; Micek, S.T.; Kollef, M. Using the number needed to treat to assess appropriate antimicrobial therapy as a determinant of outcome in severe sepsis and septic shock. Crit. Care Med. 2014, 42, 2342–2349. [CrossRef]
160. Panidis, D.; Markantonis, S.L.; Boutzouka, E.; Karatzas, S.; Baltopoulos, G. Penetration of gentamicin into the alveolar lining fluid of critically ill patients with ventilator-associated pneumonia. Chest 2005, 128, 545–552. [CrossRef]
161. Tsuji, B.T.; Pogue, J.M.; Zavascki, A.P.; Paul, M.; Daikos, G.L.; Forrest, A.; Giacobbe, D.R.; Viscoli, C.; Giamarellou, H.; Karaiskos, I.; et al. International Consensus Guidelines for the Optimal Use of the Polymyxins: Endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti-infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and Society of Infectious Diseases Pharmacists (SIDP). Pharmacotherapy 2019, 39, 10–39.
162. Bassetti, M.; Peghin, M. How to manage KPC infections. Ther. Adv. Infect. Dis. 2020, 7, 2049936120912049. [PubMed]
163. Cano, A.; Gutiérrez-Gutiérrez, B.; Machuca, I.; Gracia-Ahufinger, I.; Pérez-Nadales, E.; Causse, M.; Castón, J.J.; Guzman-Puche,J.; Torre-Giménez, J.; Kindelán, K.; et al. Risks of Infection and Mortality among Patients Colonized with Klebsiella pneumoniae Carbapenemase-Producing K. pneumoniae: Validation of Scores and Proposal for Management. Clin. Infect. Dis. 2018, 66,1204–1210. [CrossRef] [PubMed]
164. Burillo, A.; Muñoz, P.; Bouza, E. Risk stratification for multidrug-resistant Gram-negative infections in ICU patients. Curr. Opin.Infect. Dis. 2019, 32, 626–637. [CrossRef] [PubMed]
165. Giannella, M.; Pascale, R.; Gutiérrez-Gutiérrez, B.; Cano, A.; Viale, P. The use of predictive scores in the management of patientswith carbapenem-resistant Klebsiella pneumoniae infection. Expert Rev. Anti Infect. Ther. 2019, 17, 265–273.
166. Wilson, G.M.; Suda, K.J.; Fitzpatrick, M.A.; Bartle, B.; Pfeiffer, C.D.; Jones, M.; Rubin, M.A.; Perencevich, E.; Evans, M.; Evans,C.T.; et al. Risk Factors Associated with Carbapenemase-Producing Carbapenem-Resistant Enterobacteriaceae Positive Cultures in a Cohort of US Veterans. Clin. Infect. Dis. 2021, 73, 1370–1378.
167. DeWaele, J.J.; Coccolini, F.; Lagunes, L.; Maseda, E.; Rausei, S.; Rubio-Perez, I.; Theodorakopoulou, M.; Arvanti, K. Optimized Treatment of Nosocomial Peritonitis. Antibiotics 2023, 12, 1711.
Источник фотоиллюстрации - www.freepik.com
[~DETAIL_TEXT] =>
Ramasco, F.; Méndez, R.;Suarez de la Rica, A.; González de Castro, R.; Maseda, E.
Sepsis Stewardship: The Puzzle of Antibiotic Therapy in the Context of Individualization of Decision Making
J. Pers. Med. 2024, 14, 106. doi.org/10.3390/jpm14010106
АБСТРАКТ:
Основным недавним изменением, наблюдаемым в области инфекций у пациентов в критическом состоянии , стало всеобщее осознание необходимости более эффективного использования противомикробных препаратов, особенно в наиболее серьезных случаях за пределами применения простых и эффективных формул или жестких протоколов. Увеличение числа резистентных микроорганизмов, количественное увеличение масштабов хирургических операций и интервенционных процедур у пациентов с самым высоким риском, а также появление в последние годы новых антибиотиков (некоторые из которых очень специфически направлены против определенных механизмов резистентности, а другие с более широким спектром действия) заставили нас сместить наши вопросы с «с чем бороться» на «как лечить». В последнее время ведутся споры о том, как лучше подходить к антибиотикотерапии при сепсисе. Индивидуально подобранная и скорректированная доза, момент введения, цель и выбор схемы лечения указываются как факторы, имеющие особое значение для больных в критическом состоянии, у которых частота резистентных микроорганизмов, особенно среди группы Enterobacterales усложнили выбор антибиотикотерапии, требуя постоянного обновления знаний и создания мультидисциплинарных команд для противостояния инфекциям, трудно поддающимся лечению. В этой статье мы рассмотрели феномен возникновения резистентности к антибактериальным препаратам и попытались поделиться некоторыми идеями, такими как управление антибактериальной терапией, сохранение карбапенемов, а также организационные, микробиологические, фармакологические и информационные инструменты, которые мы рассматривали наиболее полезные и эффективные для принятия индивидуальных решений, учитывающих феномен множественной лекарственной устойчивости. Поэтому самая большая проблема принятия решений в этом контексте заключается в определении эффективного, оптимального и сбалансированного эмпирического лечения антибиотиками.
1. Введение
Основным недавним изменением, наблюдаемым в области инфекций у пациентов в критическом состоянии, стало всеобщее осознание необходимости более эффективного использования противомикробных препаратов, помимо применения простых формул и жестких протоколов. Рост резистентных микроорганизмов и количественный рост масштабных операций и интервенционных процедур у пациентов из группы наиболее высокого риска, а также появление в последние годы значительного числа новых антибиотиков привели к тому, что мы сместили наши вопросы с «чем лечить?» на «как лечить?» [1]. Существуют некоторые разногласия относительно того, как лучше всего подходить к лечению антибиотиками в этих случаях. Индивидуализированная и скорректированная доза, время введения и выбор режима отмечаются как факторы, важные для исходов при тяжелых инфекциях [2]. Частота резистентных микроорганизмов, особенно среди группы энтеробактерий, а также альтернатив лечения антибиотиками усложнили выбор соответствующего лечения, требуя постоянного обновления знаний и создания мультидисциплинарных команд для борьбы с инфекциями, которые трудно поддаются лечению [3]. В этой статье мы рассмотрим феномен возникновения антибактериальной резистентности и попытаемся поделиться некоторыми идеями и организационными, микробиологическими, фармакологическими и информационными инструментами, которые мы считаем наиболее полезными и эффективными для индивидуализированной терапии и принятия решений с учетом текущего контекста множественной лекарственной устойчивости. Поэтому самая большая проблема принятия решений в этом контексте заключается в определении эффективного, оптимального и сбалансированного эмпирического лечения антибиотиками.
2. Актуальная проблема антимикробной резистентности
Устойчивость к противомикробным препаратам в настоящее время является одной из самых серьезных проблем в лечении пациентов в критическом состоянии. Одной из основных причин устойчивости к противомикробным препаратам является безответственное и чрезмерное использование антибиотиков в животноводстве, сельском хозяйстве, ветиринарии и здравоохранении. Этому выводу способствовала инициатива «Единое здоровье», созданная Всемирной организацией здравоохранения (ВОЗ) (https://www.who.int/europe/initiatives/one-health (по состоянию на 15 января 2024 г), в рамках которой устойчивость к противомикробным препаратам считается наиболее актуальной чрезвычайной ситуацией в области общественного здравоохранения [4,5]. По оценкам, в 2019 году число смертей, связанных с устойчивостью к противомикробным препаратам, во всем мире составило 4,95 миллиона, из которых в общей сложности 1,27 миллиона были непосредственно связаны с устойчивостью к противомикробным препаратам, и, по оценкам, к 2050 году может быть достигнуто 10 миллионов смертей.Устойчивость к противомикробным препаратам среди грамположительных бактерий (GPB), по-видимому, стабилизируется или даже снижается, согласно недавнему исследованию, проведенному на пациентах с бактериемией, частота резистентности к грамотрицательным бактериям (GNB) растет и в настоящее время является причиной большинство случаев и смертей связаных с устойчивостью к противомикробным препаратам [6].
Однако тот факт, что существование инфекции, вызванной бактерией с множественной лекарственной устойчивостью, увеличивает смертность, является спорным. Влияние множественной лекарственной устойчивости на стоимость и продолжительность пребывания в больнице кажется очевидным, но строгое причинное влияние на смертность, несмотря на явную связь, является спорным. Существование неконтролируемых вмешивающихся факторов могло привести к выявлению такой связи в опубликованных исследованиях. Среди этих факторов можно выделить то, что, хотя множественная лекарственная устойчивость может сопровождаться терапевтической неудачей, в некоторых случаях такой неудачи не происходит. Однако использование более высоких доз и более продолжительное время лечения связано с появлением большего количества побочных эффектов, а также наблюдается более высокая распространенность колонизации и инфекций у пациентов с множественной лекарственной устойчивостью у пожилых пациентов и пациентов с ослабленным иммунитетом, что может привести к большему ограничению выбора препарата для лечения инфекций в отделениях интенсивной терапии (ОИТ) [7]. Эти данные делают устойчивость к противомикробным препаратам серьезной проблемой, требующей скоординированного глобального плана действий. ВОЗ разработала Global Action Plan for the Management of Antibiotic Resistance (GAP-AMR) и создала Global AntimicrobialResistance and Use Surveillance System (глобальную систему надзора за устойчивостью к противомикробным препаратам и их применением) для достижения целей программы. Среди основных ошибокк, с которыми мы сталкиваемся уже несколько лет, текущая проблема, как упоминалось ранее, сосредоточена на устойчивых GNB, сгруппированных вместе с некоторыми проблемными GPB под аббревиатурой ESKAPE [8,9].
Таким образом, во всем мире мы сталкиваемся с проблемой лечения супербактерий, и их распространенность в ОИТ трудно установить [9]. Для стандартизации терминологии в 2012 году множественная лекарственная устойчивость (MDR) определялась как приобретенная нечувствительность по крайней мере к одному препарату из трех или более категорий, экстремальная устойчивость определялась как нечувствительность по крайней мере к одному лекарственному средству во всех категориях, кроме двух или меньшего числа, и панрезистентность - как невосприимчивость всем агентам всех категорий [10]. Факторы риска множественной лекарственной устойчивости часто сосуществуют у пациентов в критическом состоянии и, тем более, в периоперационном контексте, когда реакция хозяина может быть девальвирована из-за нарушения функции иммунитета, вызванного острым или сопутствующими заболеваниями [11].
Основными индивидуальными факторами риска являются предыдущее воздействие антибиотиков в течение последних 90 дней, госпитализация в течение предыдущих 3 месяцев, длительная текущая госпитализация более 5 дней, наличие инвазивных устройств и предыдущая колонизация или инфекция микроорганизмами с множественной лекарственной устойчивостью. Местная эпидемиология с высокими показателями множественной лекарственной устойчивости является важным фактором риска, который необходимо учитывать [12]. Тяжесть заболевания как фактора риска множественной лекарственной устойчивости является спорным, хотя наличие септического шока является признанным фактором риска развития пневмонии с множественной лекарственной устойчивостью при нозокомиальной пневмонии и вентилятор-ассоциированной пневмонии как в европейских, так и в американских руководствах [13]. В недавнем многоцентровом исследовании, включавшем 2621 пациента в критическом состоянии с интраабдоминальным инфекции, не было различий в частоте множественной лекарственной устойчивости между группами пациентов с инфекциями с сепсисом или без него и с септическим шоком [14].
Стратегии, направленные на борьбу с устойчивостью к противомикробным препаратам, можно разделить на пять типов:
1. Профилактика снутрибольничных инфекций (инфекционный контроль в стационаре) и программы профилактики инфекций среди населения, основанные на гигиене и водопользовании;
2. Вакцинация как метод профилактики инфекции и ограничения применения антибиотиков;
3. Сокращение использования антибиотиков в немедицинских целях;
4. Увеличение инвестиций в разработку новых антибиотиков;
5. Сведение к минимуму длительность использования антибиотиков для лечения инфекций у человека. Именно этому последнему пункту способствует концепция рационального использования противомикробных препаратов (AMS ,СКАТ).
3. Управление противомикробными препаратами (СКАТ)
Целью СКАТ является правильное и эффективное назначение антибиотиков, позволяющее свести к минимуму возникновение резистентности, обеспечить устойчивое использование за счет оптимизации использования противомикробных препаратов в эмпирическом лечении и совершенствования таргетного лечения [15]. Однако в широком смысле программа такого типа должна преследовать цель создания «культуры инфекции», возглавляемой несколькими людьми, которые решающим образом влияют на быструю диагностику и правильное назначение противомикробных препаратов, на непрерывное обучение и внедрение новых методов диагнстики.Благодаря междисциплинарной философии работы эта программа не ограничивается созданием протоколов или членами команды. Существующие рекомендации относительно того, кто должен входить в состав ответственной группы, советуют, что группа должна состоять из экспертов или специалистов, более специализирующихся на инфекциях в ОИТ, микробиологов, фармакологов и врачи, специализирующиеся на инфекциях, независимо от их специальности [16]. Короче говоря, программы СКАТ, таким образом, приобретают значение «принятия на себя ответственности за то, за что вы не несете прямой ответственности» и, как было показано, улучшают исходы тяжелобольных пациентов с сепсисом, уменьшают возникновение резистентности в ОИТ и в больницах, значительно уменьшают ошибки и побочные эффекты, а также позволяют контролировать затраты [17–19]. Европейское общество интенсивной терапии (ESICM) создало очень интересную образовательную платформу под руководством Jan deWaele и Maurizio Cecconi для обучения созданию и развитию СКАТ (https://www.esicm.org/education/educational-initiatives/qualityimprovement). (по состоянию на 15 января 2024 г.).Реализация программы СКАТ начинается с выявления барьеров, которые мешают адекватному управлению инфекцией, в процессе постоянного совершенствования и поиска альянса с микробиологическими службами, рабочими группами по сепсису и т. д.
В этом смысле программы кодирования сепсиса (программы повышения эффективности лечения сепсиса) доказали свою эффективность в снижении смертности и являются еще одним примером важности вопроса «как» над вопросом «почему» [20,21]. Они были вдохновлены руководствами Surviving Sepsis Campaign (SSC) [22] и включают в себя набор клинических, организационных, аналитических и микробиологических инструментов, которые вместе с интенсивными обучающими и когнитивными средствами призваны улучшить результаты лечения сепсиса, определения приоритетов ухода [23]. Фокус этих программ ограничен первыми 24–36 часами оказания помощи пациентам с сепсисом и септическим шоком, и их философия включает оптимизацию и постоянное улучшение эмпирического лечения антибиотиками. Между этими типами моделей и программами СКАТ возникает все больше и больше координации, поскольку пациенты, которым наиболее срочно назначаются антибиотики, являются пациентами с сепсисом, и им требуется частая повторная оценка после первых 36–48 часов, чтобы провести деэскалацию, эскалацию или изменить их лечение. С этой целью важно знать местный уровень резистентности, используя местные рекомендации и рекомендации, опубликованные экспертами и научными обществами в качестве информационных материалов, чтобы иметь глубокие знания в области микробиологии, которые позволяют общаться с экспертами в нашей стране и больнице, и это позволяет нам улучшить фармакокинетические аспекты применения, учитывать возможную лекарственную аллергию и продвигать образовательные инициативы, направленные на более эффективное использование антибиотиков. В следующих разделах мы представим некоторые из этих инициатив, рассмотрим наиболее полезные классические концепции и предложим другие, более инновационные и авангардные аспекты [16].
3.1. "Начать умно" (Start Smart)
Эта модель подхода к тяжелой инфекции у пациентов в критическом состоянии включает в себя оптимизацию диагностики и стратегии деэскалации под эгидой программ СКАТ. Существование новых биомаркеров и быстрые микробиологические методы являются ключевым элементом этого нового подхода.
3.2. "Начни с умом, а затем сосредоточься"
Несколько лет назад правительство Соединенного Королевства выдвинуло лозунг “Start Smart and then focus” » https://www.gov.uk/government/publications/antimicrobialstewardship-start-smart-then-focus) (дата доступа: 17 январь 2024 г.), и мы считаем, что этот лозунг может быть хорошей моделью подхода к антибактериальной терапии сепсиса , поскольку разумное назначение антибиотиков тесно связано с персонализированным подходом, который не предусматривает одинаковое лечение всех очень серьезных случаев. Например, пациент с септическим шоком и с высокой бактериальной нагрузкой (при котором действует лозунг “hit fast and strong!” «ударить быстро и сильно!») не будет лечиться так же, как менее тяжелый случай, у которого есть подозрение на инфекцию, даже если оба могут быть госпитализированы в ОИТ [24].
Ключевые положения разумного начала антимикробной терапии включают:
Начинайте противомикробную терапию только при наличии явного подозрения или доказательства инфекции;
Имейте полное представление о лекарственной аллергии и других особенностях пациента;
Начинайте раннее и эффективное лечение пациентов с сепсисом и/или СШ;
Избегайте рутинного применения антибиотиков широкого спектра действия при лечении любой подозреваемой инфекции, не обращая внимания на сопутствующие клинические симптомы;
Будьте в курсе данных о местной микробиологии и моделях резистентности, преобладающих в отделении и стационарее;
По возможности получите посев перед началом терапии, принимая во внимание, что лечение не следует слишком сильно откладывать;
У тяжелобольных пациентов с септическим шоком используйте лучший из доступных антимикробных препаратов для устранения инфекции, а также контролируйте очаг, если это возможно, чтобы как можно скорее снизить бактериальную нагрузку [24].
Наконец, в качестве одного из самых ясных и твердых принципов «начинайте с умом» необходимо обеспечить документирование всех решений, связанных с инфекцией, в медицинской документации, поскольку очень часто лечение продолжается без необходимости, поскольку у врачей нет необходимой информации о причине начала приема этих антибиотиков, а также о том, когда они были начаты и как долго планируется продолжать их прием.Ситуация усугубляется, когда уход за пациентом передается от одного врача к другому в последовательные рабочие смены. Поэтому в записи рекомендуется указывать название антибиотика и его дозу, причину назначения, тяжесть заболевания, предполагаемую продолжительность лечения и дату оценки эффективности и коррекции (отмены) при необходимости.
3.3. «. . . А потом сосредоточься»: в чем это состоит
Вторая часть этого девиза напоминает нам об настоятельной необходимости пересмотреть клинический диагноз и рассмотреть возможность изменения, деэскалации или эскалации лечения. Благодаря современным достижениям в области быстрой микробиологической диагностики эта возможность может быть предоставлена менее, чем за 48 ч, что позволит принять решение о необходимости продолжения антибиотикотерапии теми же или другими антибиотиками и в какой дозе, а также задокументировать четкий план действий по принятию решения о назначении этих антибиотиков [25]. Каждый день необходимо задаться вопросом, адекватен ли антибиотик, оптимальна ли доза и нужен ли он пациенту [26].
Проблема лечения супербактерий: о чем следует думать, если АБТ неэффективна:
Позднее начало ;
Неподходящий спектр действия;
Неадекватный уровень в крови или недостаточное проникновение в очаг инфекции;
Наличие резистентных бактерий, не входящих в спектр назначенного антибиотика;
Наличие суперинфекции;
Неинфекционный источник лихорадки;
Очаг инфекции не контролируется должным образом.
4. Микробиология: ключевые понятия при сепсисе
Роль микробиологии при сепсисе является ключевой и требует от клиницистов наличия твердых микробиологических представлений, которые позволяют им правильно понимать информацию. Мы кратко рассмотрим некоторые моменты знаний, которые мы считаем важными в их ежедневном применении для улучшения результатов лечения [27,28].
4.1. Образцы и диагностические методы
Хорошая микробиологическая диагностика должна начинаться с правильного выбора клинического материала, предоставляемого в лабораторию; этот образец должен быть репрезентативным для подозреваемой инфекции, и при его обработке должны соблюдаться стандарты забора, отправки, документирования, и хранение.Микробиологическая культура продолжает оставаться эталонным методом, поскольку она не только позволяет охарактеризовать микроорганизмы, вызывающие инфекцию, но также позволяет провести соответствующие тесты на чувствительность к противомикробным препаратам выделенного образца. Однако необходимость быстрого получения результатов и технологический прогресс привели к развитию молекулярных методов, которые произвели революцию в микробиологической диагностике [29].
Среди быстрых методик в настоящее время выделяются две:
- MALDI-TOF : метод, основанный на масс-спектрометрии. MALDI-TOF в настоящее время позволяет идентифицировать микроорганизмы менее чем за 30 минут (ранее это занимало до 18 часов) посредством анализа их белкового профиля. Это, пожалуй, самый распространенный экспресс-метод [30].
- RT-PCR (полимеразная цепная реакция в реальном времени): молекулярный метод, позволяющий напрямую идентифицировать микробы в образце. Другие доступные молекулярные методы, по-видимому, сегодня менее распространены из-за их высокой стоимости [30], а системы быстрой микробиологической диагностики непосредственно на месте лечения (POC) становятся все более распространенными в ОИТ [31].
4.2. Минимальная ингибирующая концентрация (МИК)
При выполнении метода определения чувствительности к антибиотикам in vitro основная цель состоит в том, чтобы предсказать, можно ли лечить пациента с инфекцией, вызванной определенным микробом, антимикробным препаратом или следует выбрать другой вариант. Минимальная ингибирующая концентрация (МИК) определяется как самая низкая концентрация противомикробного препарата, которая подавляет рост микроорганизма после инкубации. МИК, следовательно, имеет решающее значение для подтверждения устойчивости микроорганизмов к противомикробному агенту, а также для мониторинга активности новых противомикробных агентов [32]. Классически мы знаем, что существуют антибиотики, зависящие как от времени, так и от концентрации. Антибиотики, зависящие от времени, считаются адекватными для лечения инфекции, вызванной бактерией, если при введении в дозах, считающихся терапевтическими (т. е. нетоксичными), они достигают концентрации в плазме в месте инфекции, по крайней мере, в четыре раза превышающей МИК в период между введениями. Концентрационно-зависимые антибиотики – это антибиотики, которые считаются адекватными для лечения инфекции, когда их пиковая концентрация в 10–12 раз превышает значение МИК. Для интерпретации тестов на чувствительность European Committee on Antimicrobial Susceptibility Testing (EUCAST) с 2019 года определил следующие категории [33]:
S: чувствительный. бактерия, ингибируемая in vitro концентрацией противомикробного препарата, что связано с высокой вероятностью терапевтического успеха.
I: (ранее промежуточная) чувствительность при увеличении экспозиции. В этом случае микроорганизм становится чувствительным при увеличении воздействия антибиотика; следовательно, существует высокая вероятность терапевтического успеха, поскольку воздействие агента увеличивается за счет корректировки режима дозирования или увеличения дозы препарата.
R: устойчивый. Лечение исследуемого микроорганизма данным антибиотиком имеет высокую вероятность терапевтической неудачи.
Чтобы включить противомикробный препарат в одну из этих категорий, требуется точка отсечения (BP), которая представляет собой МПК, определяющую включение в конкретную категорию. В настоящее время EUCAST определяет ВР в Европе и публикует их данные на веб-сайте с открытым доступом: http://www.eucast.org. (по состоянию на 17 января 2024 г.). По мере развития микробиологических, фармакокинетических, фармакодинамических и клинических знаний EUCAST периодически пересматривает BP и можно наблюдать, что ранее чувствительный микроорганизм с такой же МПК через год может быть определен как обладающий повышенной чувствительностью или даже как устойчивый.
МИК используется не только для определения концентрации противомикробного препарата, который будет получать пациент, но также и типа используемого противомикробного препарата, что позволяет снизить вероятность развития устойчивости микроорганизмов к конкретным противомикробным препаратам. Это не означает, что необходимо выбирать противомикробные препараты с более низким значением МИК, поскольку играют роль другие факторы, такие как фармакокинетика противомикробного препарата и концентрация, достигаемая в месте инфекции. Однако более низкое значение МИК приводит к более высокой вероятности достижения терапевтической цели и возможности меньшего развития механизмов токсичности и устойчивости, особенно мутационных. Важно отметить, что МИК определены для каждого микроорганизма в отношении каждого антибиотика; поэтому, строго говоря, тот факт, что один антибиотик имеет более низкую МИК, чем другой, для одного и того же микроорганизма, не имеет терапевтического значения. С другой стороны, ссылка на один и тот же антибиотик для определенного микроорганизма (например, МИК 1 г/мл или 8 г/мл), несмотря на то, что оба имеют «чувствительные» значения МИК, будет иметь терапевтические последствия. Продолжая пример, при МИК 8 г/мл для достижения оптимального лечения потребуется более высокая доза антибиотика, что может повысить токсичность или потребовать проведения продленной инфузии; для оценки второго чувствительного противомикробного препарата и принятия решения о его применении, синергизме и в некоторых случаях, может побудить к решению использовать другой антибиотик, несмотря на то, что этот другой антибиотик был классифицирован как «чувствительный», [33].
4.3. Концентрация антибиотика ,ингибирующая появление резистентных мутантов
"Профилактическая концентрация" (MPC) представляет собой МИК наименее чувствительного мутанта среди гетерогенной бактериальной популяции и представляет собой самую низкую концентрацию антибиотика, которая предотвращает или блокирует появление резистентных мутантов [34]. Существует окно концентраций, предотвращающее появление устойчивых мутантов. Подвергание бактериальной популяции действию противомикробного препарата обычно оказывает на нее пагубное воздействие, подавляя ее рост или вызывая ее гибель. Этот эффект не всегда очевиден, либо из-за наличия у микроба предшествующего механизма устойчивости, либо из-за появления устойчивых мутантов. Во время применения противомикробных препаратов отбор устойчивых мутантов может происходить динамически с течением времени. Это связано с дозой противомикробного препарата и частотой его применения, его фармакокинетикой в месте инфекции и временем, в течение которого достигаются концентрации, равные или превышающие MPC. Противомикробные препараты можно охарактеризовать как обладающие мутагенным действием и вызывающие мутации.
Однако устойчивые мутанты естественным образом обнаруживаются в бактериальных популяциях независимо от присутствия противомикробного препарата в окружающей среде. Каждая бактериальная популяция с разной частотой имеет устойчивые мутанты, сосуществующие с наиболее восприимчивой популяцией. При определенных обстоятельствах, когда бактериальная популяция подвергается действию противомикробного препарата, устойчивые мутанты могут стать доминантными, ингибируя наиболее чувствительную фракцию, но не устойчивых мутантов. Этот процесс известен как отбор устойчивых мутантов. В этих случаях вероятность отбора этих мутантов будет выше при неподходящем лечении, не адаптированном к фармакокинетическим/фармакодинамическим параметрам (Pk/Pd) и при использовании неадекватных доз [35]. МРС не является строго параметром антимикробной активности, который лучше определять по значению МИК и его правильной интерпретации; однако его можно использовать как таковое. Ее применение для ограничения или уменьшения селекции резистентных мутантов при использовании антимикробных препаратов с критериями Pk/Pd и, следовательно, для возможности избежать связанных с этим клинических неудач позволило бы предположить, что MPC является параметром активности. Кроме того, эта концепция имеет четкое клиническое применение и помогает определить наиболее подходящую дозу антимикробного препарата, по крайней мере, с точки зрения селекции мутантов, и дифференцирует антимикробные препараты, которые следует использовать при разработке рекомендаций по лечению и определению антимикробной политики [36
4.4. Важность ректального экссудата
В рамках микробиологических тестов у пациентов в критическом состоянии мы подчеркиваем роль, которую ректальный экссудат может играть в качестве эффективной и высокопродуктивной культуры для наблюдения, которая может определить, какой микроорганизм потенциально вызывает серьезную инфекцию и как действовать на основе результата. Результат этого теста, доступный через 24–36 часов, может быть очень полезен, когда микроорганизм-возбудитель не идентифицирован, чтобы помочь решить, что назначить в качестве окончательного эмпирического лечения антибиотиками. Большинство внутрибольничных инфекций являются эндогенными и происходят из микробиоты слизистых оболочек. Эта эндогенная инфекция возникает вследствие транслокации преобладающих аэробных микроорганизмов в слизистую оболочку кишечника, и вероятность диагностики зависит от плотности и площади колонизации. Значительное или неоднократное присутствие ГНБ в ректальном экссудате предполагает их избыточный рост в просвете кишечника, а связь между колонизацией кишечника и риском бактериемии, инфицирования микроорганизмами, продуцирующими карбапенемазы, или кандидемии, среди прочего, была подтверждена [37]. Состав кишечной микробиоты может измениться в течение 72 часов после появления нового микроорганизма или начала лечения антибиотиками; таким образом, определение микроорганизмов, составляющих эту микробиоту, и их чувствительности дает нам важные показатели, касающиеся возможной этиологии инфекций.
По этой причине рекомендуется активно искать наличие MDR у всех пациентов путем получения ректального экссудата, независимо от наличия получения культур из иного клинического материала. Это особенно актуально для пациентов с септическим шоком на момент поступления в ОИТ. Этот процесс следует проводить не реже одного раза в неделю на протяжении всего пребывания [24]. Аналогичным образом, при поступлении пациента в ОИТ необходимо заполнить «контрольный список» для выявления лиц с высоким риском носительства MDR, особенно устойчивых к карбапенемам [38].
Факторы риска носительства MDR :
1. Более 5 дней госпитализации в течение предшествующих 3 месяцев;
2. Пациенты, находящиеся в домах длительного ухода;
3. Известная колонизация или инфекция MDR ;
4. Продолжительность лечения антибиотиками более 1 недели в предыдущие 3 месяца (особенно цефалоспоринами третьего и четвертого поколений, хинолонами или карбапенемами);
5. Больные хронической почечной недостаточностью, находящиеся на диализе;
6. Больные с хронической патологией и высокой частотой MDR -инфекций (бронхоэктатическая болезнь, муковисцидоз и др.).
5. Фармакокинетика и фармакодинамика бета-лактамов
Учитывая нехватку эффективных лекарств против резистентных штаммов, Pk/Pd уделяется больше внимания при выборе антибиотиков и способах их введения [39]. Ввиду их важности и частоты использования мы сосредоточим внимание на изучении Pk/Pd бета-лактамов. Эти препараты зависят от времени: их антибактериальная эффективность связана с параметром, который учитывает время, когда их концентрации в плазме в четыре-восемь раз превышают МИК. По данным экспериментальных исследований и в зависимости от стабильности каждой коммерческой формы рекомендуется применять эти препараты в виде продленной инфузии продолжительностью от 1 до 4 часов или даже непрерывной инфузии, по крайней мере, когда рассматривается возможность лечения инфекций, вызванных MDR -возбудителями и это возможно из-за стабильности препарата. Хотя ожидаемая клиническая эффективность этого предложения не была продемонстрирована, либо из-за отсутствия эффекта, либо из-за недостаточного размера проведенных сравнительных исследований, либо даже из-за возможных методологических ошибок, такие влиятельные исследования, как DALI, продемонстрировавшие недостаточную экспозицию [40], и влияние врачебных сообществ сделали длительные инфузии бета-лактамов стандартом в ОИТ [41]. В этой связи интересно прокомментировать результаты недавнего РКИ с явно противоречивыми результатами по этой теме. Что касается меропенема, на сегодняшний день рекомендовано введение общей суточной фракционированной дозы, но при длительной инфузии в течение 3–4 ч. РКИ «Исследование MERCY» показало, что у пациентов в критическом состоянии с сепсисом или септическим шоком не было различий в смертности через 28 дней или в появлении резистентности между непрерывным инфузионным введением одного и того же препарата: доза 3 г в течение 24 ч и прерывистый прием (1 г каждые 8 ч, в течение 30–60 мин). Как указано в редакционной статье, сопровождающей исследование, поскольку инфузии не причиняют вреда и не влекут за собой дополнительных затрат, в рекомендациях трудно обсуждать даже опубликованы метаанализы, которые указывают на возможное снижение смертности [42]. Фактически, текущие консенсусные рекомендации нескольких обществ, хотя и признают низкий уровень доказательности, по-прежнему предполагают использование бета-лактамов с пролонгированной инфузией по сравнению с бета-лактамами с короткой инфузией у взрослых пациентов , особенно в случаях инфекции GNB [42].
Более того, в этом смысле существует интерес к введению антибиотиков не внутривенным путем для лечения определенных инфекций. Это относится к аэрозолям для профилактики и лечения респираторных инфекций, связанных с интубацией. Однако отсутствие достаточных РКИ [43], а также необходимость в специальных устройствах для правильной аэрозолизации означает, что аэрозолизация остается практикой, не рекомендованной Американским торакальным обществом (ATS), CDC и ESCMID [44–46]. Однако в клинической практике показания должны обсуждаться и персонализироваться для каждого случая. Хотя качественных клинических данных нет, существует большое количество экспериментальных данных о том, что у ослабленных пациентов с тяжелой пневмонией, вызванной бактериями с множественной лекарственной устойчивостью и с высоким риском неудачи лечения небулайзерная терапия антибиотиками может увеличить вероятность достижения очень высоких концентраций препарата в месте инфекции, что способствует терапевтическому успеху [47].
Несмотря на то, что до сих пор недостаточно доказательств в пользу новых бета-лактамов с ингибитором бета-лактамаз (BL-BLI), терапевтический лекарственный мониторинг (TDM) может решить определенные проблемы, если мы также будем помнить, что любой антибиотик имеет риск достижения «недостаточно стабильных» концентраций в плазме во время непрерывного инфузионного введения. Хотя постоянная или расширенная инфузия могут несколько снизить этот риск (поскольку во время введения будет, по крайней мере, легче достичь достаточных пиков в плазме), только TDM может подтвердить достижение желаемых уровней [48]. В отсутствие этого и благодаря широкому терапевтическому диапазону бета-лактамов у пациентов в критическом состоянии с высокими объемами распределения и возможным увеличением клиренса мы считаем, что предпочтительнее назначать самые высокие рекомендуемые дозы, а не отдавать предпочтение введению в более низких дозах [49].
6. Аллергия на бета-лактамы
Ярлык аллергии на бета-лактамы часто навешивается самими пациентами, и в большом количестве случаев из-за появления симптомов, которые даже не имеют основного иммунного механизма (диарея, головная боль и т. д.).Подсчитано, что этот термин применяется к 15% населения в целом и верен менее чем в 10% этих случаев (следовательно, только примерно к 1% населения) [50,51]. По этой причине важно заложить определенные основы, которые становятся все более необходимыми, чтобы не ограничивать использование группы антибиотиков, которая является первой линией лечения при многих инфекциях из-за ее более или менее широкого спектра действия, а также потому, что она недорогая и генерирует мало побочных эффектов для пациента. Строго говоря, истинной аллергией считаются только иммунологические реакции, опосредованные IgE (тип I по классификации Гелла и Кумбса). Проявления этих реакций разнообразны и обычно появляются в течение первого часа после введения препарата. Хотя не все эти реакции являются тяжелыми, наиболее тяжелые формы (анафилаксия и бронхоспазм) опасны для жизни и противопоказаны к последующему назначению препарата, вызвавшего их. Однако существуют и другие типы иммунологических реакций, опосредованных другими различными и иммунокомплексными антителами (реакции типа II и III) или Т-лимфоцитами (реакции типа IV), которые либо противопоказаны к такому введению, например: тяжелые кожные синдромы или могут потребовать осторожности и наблюдения при последующих введениях (например, цитопения). Теперь мы знаем, что бета-лактамы вызывают мало перекрестных реакций между собой из-за самого бета-лактамного кольца, а большинство перекрестных реакций происходит из-за сходства боковых цепей, которые являются общими для различных препаратов в группе, что делает такие перекрестные реакции частыми между отдельными бета-лактамными соединениями (например, между аминопенициллинами и аминоцефалоспоринами), но не между всеми из них [52]. Провокационная проба или пероральный тест по-прежнему являются золотым стандартом диагностики.Однако примечательно, что научные общества обычно считают скрининг по анамнезу недостаточным [53,54], в то время как многие авторы требуют его использования в экстренных случаях и предложить подход, который обеспечивает безопасное и немедленное введение препарата в тяжелых случаях, когда нет разумных альтернатив [55–58].
7. Что следует знать о старых антибиотиках
Интересное исследование, проведенное ESCMID в ряде европейских стран, США, Канаде и Австралии, показало, что такие препараты, как клоксациллин или азтреонам, доступны только примерно в половине этих стран, что не во всех из них был колистин, и только 5 из 38 имели препарат для внутривенного введения [59].Однако появление резистентности, особенно среди Г(-) бактерий, возродило интерес к использованию этого типа препарата с хорошей активностью против MDR -микробактерий, длительной историей применения и который, по данным данного исследования, был отодвинут на второй план из-за к токсичности, поскольку препарат имеет узкий спектр действия или по рыночным причинам [60]. Среди этих препаратов, проявляющих активность в отношении ГНБ, — фосфомицин, колистин и котримоксазол. Все они практически не обладают активностью в отношении анаэробов, а их активность в отношении Г (+) бактерий варьирует. Что касается фосфомицина, то, похоже, существует консенсус относительно его полезности только в качестве альтернативы нитрофурантоину или триметоприму-сульфаметоксазолу (TMP-SMX) при неосложненном цистите, вызванный GNB-продуцирующими бета-лактамазами расширенного спектра действия или карбапенемазами. В почечной паренхиме он не достигает достаточных концентраций, поэтому не рекомендуется в случаях осложненной инфекции мочевыводящих путей , бактериемии или других серьезных инфекционных заболеваниях иной локализации и должен применяться только если возбудителем является E. coli, поскольку K. pneumoniae и другие грамотрицательные возбудители инфекции являются частыми носителями гидролазы fosA, которая инактивирует препарат. Однако учитывая распространенность микроорганизмов с множественной лекарственной устойчивостью его использование возросло, особенно в сочетании с другими препаратами [61]. Колистин, обладающий известным нефротоксическим потенциалом и узким терапевтическим индексом, был ранее рекомендовался в схемах комбинированной АБТ для лечения карбапенемазы, продуцирующей GNB или Pseudomonas aeruginosa MDR, но наличие нового BL-BLI и растущее увеличение резистентности к колистину вследствие его применения в последние годы. способствовал тому, что от этой практики практику рекомендовали воздержаться. В настоящее время колистин практически выведен из употребления. для лечения инфекций, вызванных Acinetobacter baumannii, а также в случаях резистентности или непереносимость нового BL-BLI [62].
Котримоксазол играет ключевую роль при ИМП (осложненных или нет), как вызванных энтеробактериями, продуцирующими ESBL, так и резистентными к карбапенемам. Он теряет свою эффективность против Pseudomonas aeruginosa, но восстанавливает свою эффективность против стенотрофомонас мальтофилия, против которой он является одним из методов лечения [63]. Однако, как и в случае с колистином, в ОИТ часто показано использование альтернатив, таких как цефидерокол или комбинация цефтазидима/авибактама с азтреонамом [64]. Тигециклин обладает широким спектром активности, что делает его привлекательным вариантом лечения MDR-инфекции [65]. Однако сообщалось, что в некоторых случаях он может привести к неэффективности лечения, если его использовать в качестве монотерапии, поскольку он является бактериостатическим антибиотиком [66]. Таким образом, эти альтернативы, как правило, не следует рекомендовать для текущего эмпирического использования, а также, в контексте септического шока, в отделениях с высоким уровнем резистентности. Что касается Г (+) бактерий для лечения этих инфекций также стоит упомянуть TMP-SMX (дешевого и востребованного препарата для последовательного лечения), а также рифампицина и клиндамицина.Ни один из них не представлен в качестве препарата выбора по сравнению к более эффективным альтернативам, таким как ванкомицин, линезолид и даптомицин. TMP-SMX, по-видимому, рекомендуется только при инфекциях, требующих длительного лечения (бактериемия и внутрибольничная пневмония), а также при выявлении чувствительности к нему микроба [68]. Рифампицин и клиндамицин рекомендуются только в составе комбинированного режима в сочетании с лечением первой линии при определенных состояниях, таких как остеомиелит, некротическая пневмония, менингит и, особенно, в случае рифампицина, эндокардита протезированного клапана, за счет потенциально более сильного эффекта эрадикации рифампицина на материал протеза [69]. Наконец, стоит отметить потенциальную роль хинупристина-дальфопристина в альтернативном лечении инфекций, вызванных E. faecium, когда этот микроорганизм проявляет устойчивость к ванкомицину, линезолиду и даптомицину [59].
8. Что нужно знать о новых антибиотиках
Инициативы «10 антибиотиков к 2020 году», предложенные администрацией Обамы и способствующие патентованию новых противомикробных препаратов, позволили нам стать свидетелями в последние годы появления новых антибиотиков, которые улучшили арсенал, доступный для лечения инфекций, вызванных MDR-возбудителями и разумное использование которых повышает эффективность значение существования программ СКАТ [70]. Всесторонний обзор новых антибиотиков выходит за рамки данного обзора, и в литературе имеются очень хорошие обзоры, как специфические, так и генерические [71,72]. По этой причине, прежде чем перейти к более конкретным рекомендациям, мы кратко рассмотрим некоторые характеристики новых антибиотиков. Мы остановимся подробнее на цефтазидиме/авибактаме ввиду уже существующего клинического опыта и профиля цефтазидима/авибактама для эмпирического лечения в контексте множественной лекарственной устойчивости. Кроме того, более кратко, мы выскажем несколько интересных соображений относительно цефтолозана/тазобактама и цефидерокола. В Таб 1 показаны новые и наиболее важные препараты, которые уже имеются на рынке или сроко появятсяя на рынке, а также некоторые их ключевые характеристики, такие как доза и спектр действия.


8.1. Цефтазидим/Авибактам
Цефтазидим/авибактам представляет собой комбинацию существующего цефалоспорина цефтазидима (ингибитора синтеза бактериальной клеточной стенки, вызывающего гибель клеток) и нового ингибитора авибактама (инактиватора некоторых бета-лактамаз путем ковалентного ацилирования бета-лактамаз и которое само по себе не обладает антибактериальными свойствами). Добавление авибактама восстанавливает активность цефтазидима in vitro в отношении значительного числа бета-лактамаз, включая ферменты класса А по классификации Амблера (ESBL и карбапенемазы K. pneumoniae (KPCs), ферменты класса C (Amp C) и некоторыеферменты класса D (карбапенемазы OXA-48). Он не проявляет активности в присутствии ферментов класса В (металло-ß-лактамаз) [73]. Таким образом, он обладает спектром антипсевдомонадного действия цефтазидима и активен в отношении других ГНБ в целом и в отношении Enterobacterales в частности. Однако он не проявляет активности в отношении Acinetobacter, Stenotropomonas maltophilia, или анаэробы (при этом стоит напомнить, что необходимо дополнить препаратов с антианаэроной активностью при оИАИ). Антибиотик зарегистрирован FDA и EMA для лечения осложненных внутрибрюшных инфекций, осложненных инфекций мочевыводящих путей, внутрибольничной пневмонии и пневмонии, связанной с искусственной вентиляцией легких [74]. Эффективность цефтазидима/авибактама подтверждена значительными клиническими данными, и различные общества и эксперты рекомендуют его использование в качестве первой альтернативы при таргетном лечении инфекций, вызванных энтеробактериями, продуцирующими карбапенемазы, такими как OXA-48 или KPC, а также его альтернативное применение в качестве отдельного препарата или в сочетании с другими препаратами в других ситуациях, связанных с инфекцией Pseudomonas или карбапенемазами, кроме упомянутые выше [64,75–77].Реальные данные также указывают на благоприятные результаты, даже при инфекциях MDR5. [78]. Мы выделим EZTEAM, в которую вошли 569 пациентов в 11 странах, получавших лечение в первой или второй линии цефтазидимом/авибактамом, со всеми типами тяжелой инфекции, в из которых 89,3% были устойчивы к карбапенемам [79].
Что касается важности раннего введения препарата, то его использование в течение 48 часов после начала инфекции было связано с лучшими клиническими результатами [80]. Примером может служить исследование Jorgensen et al., в которое были включены 203 пациента с МDR-инфекциями, 117 из которых были устойчивыми к карбапенемам Enterobacterales (CRE) или Pseudomonas [81]. Из 203 пациентов 91 получил цефтазидим/авибактам в течение 48 часов от начала инфекции. Показатель клинического успеха, когда лечение было начато в течение 48 часов, составил 33,3%, а неудача — 18,6%. Каждые 24 часа отсрочки введения цефтазидима/авибактама значительно ухудшала результаты, тогда как регрессионная модель клинической неудачи показала, что цефтазидим/авибактам, введенный в течение 48 часов после сбора культуры, имел защитный эффект (ОШ: 0,409). Наша группа участвовала в другом интересном исследовании по оценке возможных преимуществ комбинации цефтазидим/авибактам при эмпирическом лечении [82]. В этом ретроспективном исследовании с участием 339 пациентов лечение цефтазидимом/авибактамом при инфекциях, продуцирующих карбапенемазу OXA-48 и KPC, сравнивали с лучшей доступной терапией, которая включала, среди прочего, карбапенемы с тигециклином, колистином или фосфомицином. Мы заметили, что лечение цефтазидимом/авибактамом было связано с более длительной выживаемостью. Интересно, что у наиболее тяжело больных пациентов результаты лечения цефтазидимом/авибактамом в монотерапии были лучше. Подобные исследования, а также другие исследования реальной практики подчеркивают преимущества использования цефтазидима/авибактама на ранней стадии сепсиса и у наиболее тяжелых пациентов.
По этой причине испанский консенсус оценивает тяжесть по шкале Чарльсона, среди прочего для принятия решения об эмпирической антибиотикотерапии и включает цефтазидим/авибактам в качестве одного из основных антибиотиков в эмпирическом лечении, аналогично меропенему, учитывая его очень широкий спектр действия в отношении МЛУ-ГНБ, а также его бактерицидную и синергическую способность [24]. Что касается синергизма, то очень интересно проанализировать его в контексте внутрибольничных инфекций в отделениях с большим количеством MDR-инфекций. Был изучен синергизм цефтазидима/авибактама с меропенемом, амикацином, азтреонамом, колистином и фосфомицином против мультирезистентных Klebsiella pneumoniae и Pseudomonas aeruginosa, что привело к полезной ассоциации, значительно снижающей бактериальную нагрузку в логарифмической форме и, в случае, меропенема и азтреонама, восстанавливая их активность в отношении этих микроорганизмов [83]. Таким образом, комбинация цефтазидима/авибактама и меропенема может иметь смысл при наличии MDR-микроорганизмов у пациентов с септическим шоком и высокой бактериальной нагрузкой.
8.2. Цефтолозан/Тазобактам
Цефтолозан/тазобактам — новый антибиотик, состоящий из нового цефалоспорина, связанного с тазобактамом, известным ингибитором β-лактамаз. Цефтолозан/тазобактам активен в отношении Pseudomonas aeruginosa MDR, в том числе устойчивых к карбапенемам, и против энтеробактерий, продуцирующих ESBL. Однако в случае CRE он не активен. Препарат одобрен FDA и EMA для лечения внутрибрюшных инфекций, осложненных инфекций мочевыводящих путей, а также внутрибольничных и вентилятор-ассоциированных пневмоний [84]. Отсутствие активности в отношении CRE ограничивает эмпирическое использование цефтолозана/тазобактама в некоторых ситуациях. Однако когда фокусом подозрения на сепсис является нозокомиальная пневмония, ее эмпирические результаты очень хорошие, и в этой ситуации его можно рекомендовать в качестве эмпирического лечения [85].Особо следует отметить исследование Timsit, являющееся частью ключевого исследование по показаниям к применению цефтолозан/тазобактам при пневмонии (ASPECT), в котором сравнивалась эффективность с точки зрения смертности дозы цефтолозана/тазобактама в дозе 3 г и меропенема при внутрибольничной пневмонии и вентилятор-ассоциированной пневмонии. Результаты были значительно лучше у пациентов, получавших цефтолозан/тазобактам, особенно в группе пневмонии, требующей искусственной вентиляции легких [86]. Это важно, учитывая, что пациенты с внутрибольничной пневмонией, у которых развивается дыхательная недостаточность настолько тяжелая, что требуется искусственная вентиляция легких, считаются наиболее клинически тяжелым подтипом с худшими исходами. Его практическое использование у пациентов в критическом состоянии также было подтверждено при различных типах инфекций, особенно в контексте инфекции Pseudomonas [87].
8.3. Цефидерокол
Цефидерокол представляет собой сидерофор цефалоспорина катехолового типа с очень мощной активностью in vitro против лекарственно-устойчивых CRE и неферментирующихо GNB. Он использует путь комплекса сидерофор-железо для проникновения через грамотрицательные мембраны посредством механизма, который сравнивали со знаменитым троянским конем. Попав внутрь бактерии, цефидерокол отделяется от железа и связывается с пенициллинсвязывающими белками, ингибируя синтез пептидогликана [88]. Этот антибиотик, по-видимому, более устойчив к гидролизу многих β-лактамаз и карбапенемаз. Его спектр действия — в принципе, самый широкий из антибиотиков, продаваемых для лечения ГНБ, включая антибиотики с множественной лекарственной устойчивостью и особенно продуценты металло-бета-лактамаз — привел к большим ожиданиям в отношении этого препарата [89]. Однако в амбициозном исследовании CREDIBLE-CR20 фазы 3, сравнивающем цефидерокол с лучшим доступным лечением (выбранным исследователем, с комбинацией до трех препаратов) при лечении тяжелых инфекций, вызванных GNB MDR и CRE, результаты были следующими: в обеих группах были получены одинаковые показатели клинического излечения, а смертность была численно выше в подгруппе пациентов с инфекцией Acinetobacter baumannii, получавших цефидерокол. Однако в этой подгруппе наблюдалась систематическая ошибка отбора, поскольку у этих пациентов чаще был шок, что ставит вопрос, были ли результаты хуже по этой причине [90]. Антибиотик был одобрен FDA и EMA для лечения GNB-инфекций, когда другие методы лечения могут оказаться неэффективными, а в реальной жизни результаты применения цефидерокола очень эффективны против карбапенемаз, продуцирующих Acinetobacter, Stenotropomonas, Pseudomonas и Enterobacterales [91].
9. Передовые подходы к новым антибиотикам
9.1. Сохранение карбапенемов
Концепция экономии карбапенема направлена на сохранение этого типа антибиотиков и разумное использование новых препаратов, которые могут участвовать в этой стратегии, принимая во внимание соответствующие меры инфекционного контроля и профилактики в рамках СКАТ [92]. Карбапенемы являются отличными антибиотиками и мощным оружием против устойчивых к лекарствам грамотрицательных бактерий из-за их широкого спектра действия, бактерицидного действия и способности преодолевать многие виды устойчивости.Их чрезмерное использование в условиях отсутствия на сегодняшний день безопасных альтернатив, особенно при эмпирическом лечении, породило проблему резистентности к карбапенемам [93].
Колонизация кишечника является основным резервуаром устойчивых к карбапенемам GNB (CRE) среди пациентов в критическом состоянии, а кишечная транслокация связана с повышенным риском участия CRE при последующих инфекциях. Неудивительно, что чрезмерное использование карбапенемов является одним из важнейших факторов, определяющих приобретение CRE, и связано с более высоким уровнем суперинфекции по сравнению с лечением без карбапенемов. При лечении карбапенемами существует повышенный риск развития резистентности из-за давления, оказываемого карбапенемами. на чувствительные штаммы, предоставляя устойчивым штаммам возможность их преодоления [94].
Среди стратегий, используемых для сохранения карбапенемов, выделим следующие [3]:
1. Оценка показаний к использованию карбапенемов при отсутствии явного риска MDR-возбудителей;
2. Установление того, у каких пациентов пиперациллин тазобактам все еще может играть важную роль, даже несмотря на отрицательные результаты исследования MERINO [95];
3. Оценка использования новых бета-лактамных антибиотиков и новых ингибиторов бета-лактамаз, применение которых уже имеется значительный клинический опыт, в качестве альтернативы карбапенемам при эмпирическом лечении пациентов с септическим шоком, особенно при наличии риска множественной лекарственной устойчивости в контексте ESBL и CRE [77];
4. Оценка комбинированного использования альтернатив на основе небета-лактамных препаратов и старых антибиотиков по некоторым показаниям [96];
5. Корректировка продолжительности терапии карбапенемами. Недавние данные показывают, что краткосрочное лечение (<10 дней) Enterobacterales не ухудшает клинические исходы [97];
6. Оценка роли деэскалации после тщательного микробиологического контроля, связанного с клинической оценкой в рамках СКАТа, для снижения потребности в продлении эмпирической терапии карбапенемами [98].
Сохранение карбапенемов (хотя карбапенемы по-прежнему должны занимать центральное место в антимикробной терапии пациентов в критическом состоянии) жизненно важно для успеха в улучшении результатов лечения септического шока. Использование новых бета-лактамов и ингибиторов бета-лактамов в программах управления антимикробной терапией и деэскалации, принимая во внимание желание сократить использование карбапенемов, представляют собой лучший курс действий в настоящем и, будем надеяться, в будущем, особенно в контексте распространенности трудно поддающихся лечению патогенов, таких как ESBL иCRE и устойчивость к Pseudomonas и Acinetobacter (Table 2) [27].

9.2. Роль новых антибиотиков в эмпирическом лечении нозокомиального сепсиса и септического шока
Несомненно, к наиболее сложным и противоречивым вопросам лечения сепсиса относятся определение персонализированной эмпирической терапии антибиотиками и определение роли новых антибиотиков в этой схеме [99].
Хотя таргетная терапия против ГНБ не лишена противоречий, сегодня у нас есть несколько рекомендаций по таргетному лечению против микроорганизмов с множественной лекарственной устойчивостью (продуцентов ESBL и/или карбапенемов, трудно поддающихся лечению Pseudomonas или других проблемных микроорганизмов, таких как Ацинетобактер или Стенотрофомонас). Эти рекомендации очень сбалансированы и показательны и имеют очень схожую основу, часто основанную на современных мнениях экспертов или опубликованных данных с использованием методологии GRADE. [64,75,76].
Помимо различий, связанных с позиционированием конкретных препаратов из-за противоречивых исследований и роли, которую в предыдущие годы играли старые антибиотики, используемые для лечения MDR-инфекций, позиционирование антибиотиков особенно вышеупомянутые препараты, которые были предметом многочисленных публикаций и последовательного клинического опыта, таких как цефтазидим/авибактам или цефтолозан/тазобактам очень четкое.
В то же время к новым молекулам, таким как цефидерокол или карбапенемы, связанные с ингибиторами бета-лактамаз, относятся консервативно, ожидая результатов в реальных условиях. Вместе с конкретными рекомендациями и консенсусом по лечению основных инфекционных синдромов, связанных с сепсисом (внутрибольничная пневмония, вентилятор-ассоциированная пневмония, вторичный и третичный перитонит, бактериемия, связанная с другими инфекциями, или инфекция мочевыводящих путей), эти новые молекулы могут оказать очень важную помощь при принятии решения об эмпирической терапии в рамках политики СКАТ при ситуациях высокой степени тяжести и риска смерти
Между тем, новые молекулы, такие как цефидерокол или карбапенемы, связанные с ингибиторами бета-лактамаз, лечатся консервативно, пока мы ожидаем реальных результатов. Вместе с конкретными руководящими принципами и консенсусом по Для лечения основных инфекционных синдромов, связанных с сепсисом (госпитальная пневмония, вентилятор-ассоциированная пневмония, вторичный и третичный перитонит, бактериемия, связанная с другими инфекциями или инфекциями мочевыводящих путей), эти новые молекулы могут оказывают очень важную когнитивную помощь при принятии решения об эмпирической терапии в рамках политики СКАТ в сценариях высокой тяжести и риска смерти.
Прежде чем приступить к обсуждению темы эмпирического лечения антибиотиками пациентов с септическим шоком нозокомиального происхождения, мы должны контекстуализировать это с имеющимися данными. Это область, в которой существует несколько теоретических моделей, все они поддерживаются. доказательствами, но не одинакового качества, которые защищены тщательно продуманными обоснованиями. Мы можем разделить эти модели на две категории, определяемые двумя консенсусами, упомянутыми выше. Одна из них — более консервативная французская модель, которая позиционирует использование новых антибиотиков в эмпирическом лечении и даже не под эгидой сохранения карбапенемов [100]. Другая модель иллюстрируется испанским консенсусом, который выступает за эмпирическое использование новых антибиотиков из-за их эффективности против MDR в контексте острой необходимости применения правильного лечения с первого раза, особенно при наличии факторов риска, связанных с инфекцией. и пациентом [24]. В этой области баланс колеблется между увеличением вероятности применения правильного эмпирического лечения и формированием резистентности, связанной с чрезмерным использованием новых антибиотиков.
Однако в литературе и, в частности, между этими двумя французскими и испанскими консенсусными руководствами есть некоторые общие положения [24,100]:
1. В случае септического шока в эмпирическом лечении допускается применение новых антибиотиков, особенно в случаях высокой локальной доли MDR и у носителей MDR -возбудителей в культурах эпидемиологического надзора, особенно если это ректальный экссудат;
2. Такие стратегии, как быстрая микробиологическая диагностика, деэскалация и сокращение продолжительности антибиотикотерапии, настоятельно рекомендуются для того, чтобы избежать побочных эффектов, связанных с чрезмерным использованием антибиотиков, независимо от выбранной схемы широкого спектра действия.
Представляется очевидным, что в данном сценарии интенсивной терапии и сепсиса имеет место чрезмерное использование антибиотиков, поскольку существует значительный процент пациентов, которым назначаются антибиотики широкого спектра действия, а инфекция не проявляется. Кроме того, эмпирические рекомендации часто сохраняются в течение длительного времени либо из-за отсутствия экспресс-тестов, либо из-за отсутствия СКАТ, которые требует ежедневной оценки лечения [94].
Такое злоупотребление имеет свои последствия.
Мы укажем некоторые из основных или тех, к которым в настоящее время имеется наибольший интерес:
1. Воздействие на микробиоту пациента, селекция MDR-бактерий и уничтожение привычной флоры, необходимой для жизнедеятельности, в том числе связанных с пищеварением и гомеостазом в целом [101];
2. Заражение Clostridium difficile [102];
3. Повышенная вероятность устойчивости к новым антибиотикам, которые можно приберечь для особых ситуаций, когда карбапенемы неэффективны [103]. Проблема в том, что во многих сценариях карбапенемы уже имеют высокий процент устойчивости, превышающий 20–25%. Это нельзя обобщать, существуют географические и местные различия, но это очень распространено [93]. Фактом всех эпидемиологических исследований в ОИТ является повышенное влияние микробов GNB MDR [77].
Когда дело доходит до принятия решения об эмпирической терапии в этом сценарии сепсиса и септического шока, как мы уже обсуждали, важно признать, что, хотя это и континуум, это две разные сущности. Существует разумный консенсус в отношении того, что в контексте сепсиса, который протекает без шока, можно подождать несколько часов, чтобы выбрать лучшее лечение, подтвердить наличие инфекции, получить соответствующие посевы и выбрать разумные антибиотики, которые, конечно, также могут включать карбапенемы и новые антибиотики [77]. Диапазон выбора антибиотиков в этом случае шире, а потребность в широте охвата может быть ниже. Те же рекомендации SSC указывают на необходимость обеспечить покрытие от MRSA или покрытие двумя антипсевдомонадаными препаратами, хотя, при отсутствии шока, можно не покрывать MRSA и назначать один антибиотик с антисинегнойной активностью [22].
Однако все это меняется при двух ситуациях:
1. У больных с шоком и тяжелыми сопутствующими заболеваниями;
2. У пациентов со значительными факторами риска развития MDR-бактерий, колонизированных MDR или поступивших в отделение с высоким процентом резистентности (порогом которого считается 20%). У пациентов с шоком и/или в условиях высокой вероятности инфицирования микроорганизмом с MDR или колонизации MDR существует консенсус в отношении выбора эмпирического лечения, охватывающего, в зависимости от очага инфекции, все возможные микробы, которые могли вызвать состояния, включая те вероятные MDRвозбудители, с наибольшей вероятностью успеха и вводимыми в наиболее оптимальных возможных дозах и формах [100].
По этой причине и в зависимости от контекста эмпирическая схема лечения антибиотиками должна включать в себя [104]
1. Защита от MRSA в целом и от энтерококка, если он возникает на фоне внутрибрюшной инфекции;
2. Защита от GNB, особенно трудно поддающихся лечению Pseudomonas и MDR GNB в целом (продуценты ESBL и карбапенемов, в частности), с использованием как минимум двух препаратов в течение первых 48 часов;
3. Оценка необходимости противогрибкового лечения, особенно при внутрибрюшной инфекции с факторами риска инвазивного кандидоза.
10. Рекомендации по эмпирическому лечению антибиотиками пациентов с септическим шоком
10.1. Предварительные соображения
При выборе эмпирического руководства в каждом сценарии, чтобы попытаться персонализировать лечение, мы должны учитывать загадку Pea и Viale [105]. Лечение антибиотиками тяжелобольных пациентов похоже на детскую головоломку, состоящую из нескольких частей, которые объединены в единое целое для содействия клиническому излечению и предотвращению развития резистентности: антибиотик и/или противогрибковый препарат и его свойства, место инфекции, ответственный возбудитель и его восприимчивость к лечению (МИК), атакже патофизиология пациента (Figure 1).

На эмпирические рекомендации большое влияние будет оказывать очаг инфекции, поскольку он может варьировать, например, от пневмонии или внутрибрюшной инфекции. Что касается важности снижения бактериальной нагрузки, интересно знать, как бактериальная нагрузка влияет на эффект антибиотиков, напоминая, что когда бактериальная нагрузка очень высока, цефтазидим/авибактам может быть наименее подвержен влиянию в этом контексте [106,107] . Наконец, как отмечают Bassetti и Montravers важным фактором является оценка местной распространенности инфекций с MDR [96]. Если процент устойчивости к карбапенемам превышает 20%, стратегия эмпирического лечения антибиотиками с использованием новых антибиотиков будет иметь смысл даже в случаях сепсиса, а не только при септическом шоке.
Таким образом, при принятии решения относительно первоначального эмпирического лечения антибиотиками пациентов с септическим шоком следует учитывать следующие предпосылки:
1. Бактериальная нагрузка в очаге инфекции обычно высокая. Чем выше бактериальная нагрузка в очаге инфекции, тем выше концентрация антибиотика, необходимая для подавления роста микроорганизма и тем больше вероятность выделения устойчивые мутанты, если введенная доза недостаточна. Воздействие антибиотика, необходимое для подавления возникновения резистентности, должно поддерживаться выше окна отбора мутантов. Контроль очага с помощью хирургического вмешательства или дренирования имеет важное значение, чтобы уменьшить бактериальную нагрузку, когда это возможно.
2. Поскольку мы не знаем микроорганизмы, вызывающие инфекцию, или характер их чувствительности к антибиотикам, мы можем ориентироваться на предполагаемый источник или на контрольные культуры, особенно ректальный экссудат в течение предыдущих 48–72 часов [99].
3. На решение влияет местная экология MDR бактерий. Высокий процент устойчивости к карбапенемам заставляет рассмотреть возможность применения новых антибиотиков [77].
4. Эмпирическое лечение должно быть активным против всех потенциально вовлеченных микроорганизмов и, по возможности, должно включать бета-лактамный антибиотик из-за его эффективности, спектра действия и бактерицидного действия. Среди доступных в настоящее время β-лактамных антибиотиков наиболее в случае любой вспышки из-за их антибактериального спектра и вероятности достижения оптимального уровня Pk/Pd против MDR -ГНБ рекомендуется использовать цефтазидим/авибактам и меропенем. В зависимости от очага инфекции и колонизации может потребоваться персонализация и могут существовать альтернативы: например, при внутрибольничной пневмонии мы могли бы включить цефтолозан/тазобактам, а если пациент колонизирован микробами, продуцирующими металло-бета-лактамазу, или стенотрофомонас мы могли бы использовать цефидерокол [77].
5. Фармакокинетика применения антибиотиков при сепсисе будет сильно зависеть от индивидуальных особенностей тяжелобольного пациента [108].
6. Пациент в состоянии шока подвергается риску необратимых повреждений, поэтому необходимо срочно снизить бактериальную нагрузку и контролировать иммунный ответ, одновременно используя органную поддержку.
7. Первоначальная эмпирическая терапия пациентов с септическим шоком и пневмонией должна включать два антибиотика и основываться на факторах риска для MDR возбудителей, обсуждавшихся выше, с первоначальным подходом, основанным на терапии широкого спектра действия, с последующим снижением дозы, если MDRвозбудители исключены [109].
8. Осложненная внутрибрюшная инфекция обычно полимикробная, нередко с участием ГНБ, анаэробов и энтерококков. Начальная эмпирическая терапия пациентов с септическим шоком в таких условиях должна включать бета-лактамы с ингибитором бета-лактамаз или карбапенем, а также покрытие от анаэробов, если бета-лактам не покрывает их, от энтерококков, если инфекция носит нозокомиальный характер, а у некоторых пациентов с факторами риска следует добавить дополнительное покрытие для видов Candida, отличных от Candida. альбиканс. В этой ситуации крайне важно контролировать источник, получать качественные образцы и быстро их обрабатывать [110].
9. Против Г (+) бактерий можно использовать даптомицин, линезолид, тедизолид или ванкомицин. Выбор зависит от локализации инфекции, функции почек и необходимости одновременного применения других нефротоксичных препаратов. Следует напомнить, что даптомицин не проявляют активность в легких [111].
10. Грибковая инфекция составляет 5% сепсиса. Чаще всего это вызвано Candida spp. и может быть предсказан по конкретным показателям, таким как Candida Score, а также по эпидемиологическим , микробиологическим данным и биомаркерам. Факторы риска частично совпадают с другими в ОИТ. Часто необходима профилактика и эмпирическая терапия, и эхинокандины предпочтительнее при Candida, но некоторые штаммы становятся устойчивыми, поэтому в некоторых случаях, таких как внутрибрюшная инфекция или случаи, когда трудно поддающиеся лечению, подходящей альтернативой может быть липосомальный амфотерицин B [112,113].
11 Соответствующие посевы следует всегда получать в зависимости от очага инфекции (посевы крови, ректальный экссудат или другие посевы для наблюдения, в зависимости от ситуации) перед началом или вскоре после первоначального эмпирического лечения антибиотиками. Сигнал тревоги, например, код сепсиса, должен быть активирован, чтобы обеспечить обработку проб с помощью систем быстрой микробиологической идентификации, и, если возможно, дежурный микробиолог должен быть предупрежден и с ним можно было взаимодействовать [28].
12. Через первые 24–48 ч лечение следует пересмотреть на предмет снижения бактериальной нагрузки и клинического улучшения. Методы быстрой диагностики позволят нам оценить отсутствие или присутствие энтеробактерий, продуцирующих БЛРС, или карбапенемазы, резистентность P. aeruginosa, MRSA, а также низкое значение -D-глюкана или его позитивность, что позволит сузить спектр антибиотиков или предположить необходимость изменения лечения [114].
13. Следует предусмотреть краткосрочное лечение. Биомаркеры, такие как прокальцитонин могут помочь нам в применении коротких схем лечения антибиотиками [115].
10.2. Индивидуализация антибиотикотерапии у пациентов в критическом состоянии
Хотя основные проблемы в условиях высокой распространенности резистентных штаммов заключаются в том, чтобы избежать задержки диагностики путем быстрого выявления микроорганизмов и особенностей их чувствительности, адекватное лечение осложняется особенностями наиболее тяжелобольных пациентов, у которых, помимо других симптомов, наблюдаются изменения внеклеточного объема, функции почек и иммунитета. Таким образом, тяжесть их состояния не только приводит к более высокому уровню смертности сама по себе, но также влияет на клинический ответ на антимикробное лечение. Если мы добавим к этому разногласия относительно имеющихся данных по другим аспектам антимикробного лечения, таким как использование комбинированной терапии, продолжительность лечения, сложность деэскалации и существующие средства на каждом рабочем месте в отношении клинического лечения,. лабораторных и организационных моментов, несомненно, не будет единого размера, подходящего всем, и хорошим началом будет персонализация лечения с учетом клинических особенностей. обстоятельства и микробиологические данные каждого пациента и каждого центра [116]. В чем тогда будет заключаться индивидуализация лечения антибиотиками пациентов в критическом состоянии, чтобы добиться максимальной эффективности? «Оптимизация» ищет лучший способ выполнить какое-либо действие или улучшить производительность чего-либо. «Эффективность» определяется как способность достигать желаемого или ожидаемого эффекта. «Индивидуализировать» значит приписать кому-то или чему-то характеристики, которые отличают его от других. Поскольку нашей основной первоначальной целью должна быть быстрая элиминация возбудителя, нашим приоритетом становится достижение максимальной эффективности лечения антибиотиками у каждого пациента. Хотя в литературе часто говорится об охвате антибиотиками, появляются новые доказательства того, что предполагают, что чувствительность микроорганизма к антибиотику in vitro имеет решающее значение и что знания этой чувствительности недостаточно для достижения наилучших результатов. Таким образом, фиксированные схемы лечения, независимо от места заражения и патофизиологического состояния пациентов, могут не дать ожидаемых результатов и оказаться неэффективными. С этой целью мы выделим, как предлагают разные авторы, эти разные уровни успеха на Figure 2 [117,118].

(а) Соответствующий (подходящий,приемлемый): определяется чувствительностью in vitro к возбудителю и ранним назначением противоинфекционного лечения. То, что соответствует опубликованному консенсусу и руководящим принципам, также считается приемлемым.
(b) Адекватный: в дополнение к «подходящим» характеристикам уровень успеха считается адекватным, если применяются и принимаются во внимание фармакокинетические и фармакодинамические стратегии, такие как более короткие интервалы введения, оценка физико-химических характеристик при подходе к различным местаминфекции, мониторинг уровней, избежание взаимодействий и т. д.
(c) Оптимальный: в дополнение к «подходящим и адекватным» характеристикам этот уровень успеха заключается во введении дозы, которая позволяет проникнуть в очаг инфекции в эффективной концентрации для ликвидации инфекции.
У пациентов в критическом состоянии вероятность получения недостаточных концентраций препарата для микроорганизмов, чувствительных in vitro, но с МИК, очень близкой к пороговому пределу, иногда наблюдается отсутствие эффективности in vivo, что приводит к терапевтической неудаче и возникновение устойчивости.Трудно достичь оптимальных схем лечения антибиотиками у пациентов в критическом состоянии без существенного изменения дозирования [39,105].
10.3. Раннее лечение антибиотиками у пациентов с септическим шоком
Современный стандарт назначения антибиотиков пациентам в критическом состоянии основан на раннем лечении и предполагает введение препаратов менее, чем за час после установления диагноза у наиболее тяжелых пациентов или при септическом шоке [22]. Хотя большая часть доступных данных не извлечена из клинических исследований, из-за очевидных этических трудностей с возможностью рандомизировать отсрочку лечения антибиотиками, начиная с публикации в 2006 году классического ретроспективного обсервационного исследования (в котором Кумар показал, что среди 2154 пациентов при септическом шоке на каждый час задержки антимикробной терапии наблюдалось среднее снижение выживаемости на 7,6%), все руководства настоятельно рекомендуют эту стратегию раннего начала антибактериальной терапии [119]. Последующие крупные наблюдательные исследования подтвердили эти результаты. Одно из них, многоцентровое международное исследование с данными 17 990 пациентов с септическим шоком, получавших антибиотики, подтвердило, что задержка в назначении антибиотиков связана с более высокой внутрибольничной смертностью [120]. В этом исследовании наблюдалось линейное увеличение риска смертности на каждый час задержки введения антибиотика с первого по шестой час после идентификации диагноза. Недавно, используя новые определения сепсиса, исследование 3035 пациентов показало, что у пациентов с септическим шоком назначение антибиотиков широкого спектра действия в течение 1 часа после установления диагноза снижает внутрибольничную смертность. Однако у пациентов с сепсисом без шока связь между введением антибиотиков в течение 1 ч и внутрибольничной смертностью не была статистически значимой. В моделях линейной регрессии, ограниченных пациентами, получившими антибиотики в течение первых 3 часов, у пациентов с септическим шоком наблюдался повышенный риск смертности на каждый час задержки введения антибиотиков, но у пациентов без шока такой тенденции не наблюдалось [121].
Это правда, что врачи не намеренно откладывают назначение антибиотиков широкого спектра действия, но верно также и то, что существуют трудности с быстрой постановкой диагноза и что может быть трудно распознать всех пациентов с высоким риском. В более тяжелых случаях, при большом количестве сопутствующих заболеваний и более четкими симптомами инфекции врачам зачастую проще назначить антибиотики раньше [122]. Кроме того, в больницах могут существовать организационные правила, которые могут препятствовать раннему назначению антибиотиков [123].
Барьеры для раннего назначения антибиотиков:
Отсутствие знаний;
Отсутствие правильной оценки тяжести и позднее распознавание сепсиса;
Повышенная нагрузка на персонал;
Трансфер больного (в операционную, на анализы и т.п.);
Возможны атипичные проявления без лихорадки и спутанности сознания;
Задержки из-за других диагностических тестов и медленного сбора проб для микробиологического исследования;
MDR-инфекции и нераспознавание факторов риска MDR ;
Ожидание проведения посева крови перед введением антибиотика;
Очень важно не понимать, что давать неподходящий антибиотик - это все равно что не давать никакого или даже хуже.
Не указан порядок введения антибиотиков и какой антибиотик широкого спектра действия является «ключевым»;
Необходимость получения разрешения на назначение препарата у другого специалиста, заведующего отделением или аптеки перед началом лечения.
Подход, позволяющий избежать задержки в назначении антибиотиков:
Наличие артериальной гипотензии у пациента с подозрением на инфекцию следует расценивать как септический шок при отсутствии альтернативного объяснения; Невозможность перевезти или транспортировать пациента до начала лечения антибиотиками;
Если в таких ситуациях требуется назначение антибиотика, необходимо обеспечить его немедленное введение (сообщалось, что задержка с момента назначения лечения до момента его введения может составлять в среднем до 3 часов);
Комбинированные схемы лечения следует назначать в первую очередь с основным антибиотиком (самого широкого спектра действия);
Содействуйте образованию, обучению и командной работе, чтобы сократить время администрирования.
Ранняя антимикробная терапия может иметь негативное влияние с точки зрения токсичности и затрат, особенно при менее тяжелых инфекциях и сепсисе без шока, а также может способствовать задержке постановки диагноза у некоторых первоначально неинфицированных пациентов, таких как хирургические пациенты в критическом состоянии, в которым особенно трудно отличить последствия воспалительной реакции, вызванной хирургическим вмешательством или другими патологическими обстоятельствами, от реакции, вызванной инфекцией. В последнее время большее значение придается также влиянию лечения антибиотиками в ОИТ на микробиоту, его влиянию а на иммунитет и исход пациентов, а также стратегиям поддержания регулярной кишечной флоры, но это выходит за рамки данного обзора.
Реальность такова, что литература о связи между временем начала лечения антибиотиками и смертностью при сепсисе противоречива, почти исключительно носит наблюдательный характер и имеет высокий риск систематической ошибки. Источники систематической ошибки включают отсутствие дифференциации между сепсисом и септическим шоком, недостаточная корректировка с учетом потенциальных искажающих факторов и сочетание высокого роста смертности, связанного с поздней диагностикой заболевания [124].
Недавние метаанализы не дали окончательных результатов в отношении пользы лечения антибиотиками, поэтому, строго с точки зрения научных данных, нельзя рекомендовать чрезвычайно быстрое введение антибиотиков, по крайней мере, при сепсисе; однако, возможно, это это не так при септическом шоке [125]. Тем не менее, тот факт, что антибиотик следует назначать в первые несколько часов, по-прежнему является обязательным в рекомендациях SSC, хотя это и привело к критике со стороны IDSA по поводу преждевременного использования у пациентов без шока [126]. В будущем, возможно, потребуется уточнить, каково истинное определение понятия «ранний», каков временной интервал, в течение которого назначение антибиотиков является наиболее эффективным в борьбе с бременем инфекции, и как интерпретировать спектр тяжести, крайней срочности и скорости, необходимой для введения антибиотиков. По-видимому, существует достаточно сильная связь между ежечасным приемом антибиотиков и смертностью от септического шока, но менее выраженная связь для сепсиса без шока. Имеются данные, показывающие, что интервалы введения антибиотиков до 90 минут у пациентов с сепсисом без шока не имеют значения. По-видимому, риск повышенной смертности у пациентов с сепсисом без шока возрастает примерно через 3-5 ч до начала применения антибиотиков и в последующем, однако данные, позволяющие точно определить влияние интервалов от 3 до 5 ч, немногочисленны и несовершенны. В случае септического шока, несмотря на то что в большинстве исследований имеются многочисленные погрешности, а линейная связь между задержкой и смертностью явно является статистической ассоциацией и результатом, в частности, неиспользования в анализе сбивающих факторов, представляется, что оперативность начала течения более важна [127].
Учитывая то, что было сказано ранеер, возможно, в настоящее время хорошей отправной точкой было бы продолжение быстрого введения антибиотиков, например, всегда в течение первых 3 часов, как это было предложено IDSA. Однако, следует приложить усилия быстро поставить диагноз до введения препарата (или, по крайней мере, получить ранние и выгодные образцы) и иметь достаточно времени для размышлений и консультаций, если необходимо, по выбору оптимальной антимикробной схемы для каждого пациента. В наиболее тяжелых случаях септического шока целесообразно, чтобы оптимальное время введения препарата наступило до третьего часа и ближе к первому часу, поскольку быстрое снижение бактериальной нагрузки за счет контроля над очагом инфекции и адекватной и ранней антибиотикотерапии являются ключевым моментом.
10.4. Важность контроля очага инфекции в хирургических отделениях
Лечение инфекции в ОИТ у хирургических пациентов представляет свои собственные проблемы, поскольку, как и в других условиях, диагностика часто затруднена, а множественная лекарственная устойчивость и фармакокинетические изменения представляют собой проблемы. Необходимость контролировать очаг инфекции хирургическим и/или чрескожным дренирование усложняет ситуацию [128]. Восстановление анатомии и функции одинаково важно и может быть выполнено одномоментно, хотя иногда это бывает затруднительным. Как правило, меры по контролю очага инфекции не следует откладывать, за исключением тех ситуаций, когда предпочтительнее отграничение нежизнеспособных тканей, например, при инфицированном некротическом панкреатите или в ситуациях, когда доступ к источнику инфекции затруднен. В настоящее время возобновился интерес к так называемой хирургии контроля повреждений при внутрибрюшной инфекции, которая включает первоначальный контроль инфекции с использованием "открытого живота", чтобы облегчить последующую санацию брюшной полости и свести к минимуму риск компартмент-синдрома [129]. Окончательная анатомическая реконструкция будет выполнена позже, через 24–72 часа. При таком подходе выбор системы временного закрытия брюшной полости представляется важным, при этом терапия отрицательным давлением является распространенным вариантом, поскольку она приводит к меньшему количеству свищей, меньшему количеству абсцессов и более высокой выживаемости [129]. В руководствах SSC рекомендуется определить анатомический источник инфекции, который может потребовать контроля и устранить его как можно скорее с логистической и медицинской точки зрения. Подход должен быть индивидуализированным: визуализирующие исследования очень важны и не должны ограничиваться брюшной полостью [130]. Нет смысла откладывать такой контроль, если нет значительных метаболических или коагуляционных изменений или если у пациента очень нестабильная гемодинамика. Выбор подходящего времени для хирургического контроля очага является предметом дискуссий, и следует соблюдать междисциплинарный подход, руководствуясь тяжестью инфекции, темпами ухудшения состояния пациента, предполагаемым источником инфекции. Есть отдельные данные, свидетельствующих о том, что при наиболее тяжелых инфекциях контроль очага инфекции дает лучшие результаты, если его проводить через 2–6 ч после постановки диагноза [131].
Концепция управления заключается в создании бригад, занимающихся контролем очага, с доступностью диагностических и терапевтических методов, включая интервенционную радиологию, 24 часа в сутки, что может помочь выбрать более подходящее лечение и реализовать хирургические стратегии, улучшающие исходы у этих пациентов [132].
Хирургические инфекции, в частности инфекции брюшной полости, являются наиболее сложными среди нозокомиальных инфекций: они связаны с более длительным пребыванием в стационаре, большим количеством пациентов в состоянии шока, более частым развитием почечной недостаточности и более высокой смертностью. Их микробиологическая картина обычно полимикробна с незначительным присутствием грибов, трудностями в определении патогенной роли каждого из них и их вклада в общее состояние пациента, а также растущим присутствием организмов с множественной лекарственной устойчивостью, особенно карбапенемазопродуцирующих организмов [110].
Воспаление, связанное с хирургической травмой, означает, что традиционные критерии системной воспалительной реакции присутствуют регулярно и, следовательно, малопригодны для диагностики инфекционного процесса, как и аналитические маркеры инфекции. Точно так же мало пользы приносят измерения лейкоцитоза, величины PCT (хотя повышение последнего, удваивающее его исходное значение в первые 24 ч после операции, может помочь предупредить о неадекватности контроля очага инфекции) или другие признаки, такие как гипотония или олигурия, которые могут быть связаны с послеоперационными осложнениями неинфекционного происхождения [133]. Все это усложняет процесс принятия решения о том, начинать или не начинать антибиотикотерапию и какими препаратами. Кроме того, если тяжелое состояние пациента персистирует, деэскалация также будет затруднена. Если предполагается отличный контроль, антибиотикотерапия абдоминальной инфекции должна быть ограничена 3-5 днями.
Это продемонстрировано при нозокомиальных инфекциях, даже у пациентов с APACHE > 10, без увеличения числа релапаротомий или повышения смертности [134]. Таким образом, клиническая настороженность по-прежнему остается лучшим оружием для контроля возможной неудачи в борьбе с очагом инфекции. Добавление параметров органной дисфункции (SOFA score) может выявить пациентов, которым потребуется дополнительный контроль очага инфекции. Методы визуализации, такие как УЗИ и КТ, также очень важны в данном случае, поскольку они добавляют возможность чрескожного дренирования абсцессов, сопровождающихся развитием органной дисфункции, при наличии постоянного квалифицированного персонала [135].
Оценка остаточной инфекции после контроля очага инфекции может помочь оценить роль определенных вмешательств и корректировать антибиотикотерапию. Для этих целей под остаточной инфекцией обычно понимают неполное чрескожное дренирование абсцесса или остаточные некротические ткани, который невозможно удалить, а под продолжающейся контаминацией понимают источник инфекции (например, перфорацию, которая не может трансформироваться в фистулу и продолжает дренироваться в брюшную полость) [136].
10.5. Оптимизация лечения антибиотиками согласно гипотезе Кумара
В связи с актуальностью для современной концепции сепсиса и возможного значения при выборе и назначении антибиотикотерапии, мы посвятим раздел комментариям теории Кумара [106]. После того, как с появлением пенициллина произошло снижение смертности от инфекционных причин, абсолютные показатели смертности остаются постоянными и сегодня, несмотря на появление новых противомикробных препаратов. Это связано с более высокой распространенностью резистентных микроорганизмов, более высокой частотой сепсиса среди пожилых людей и существованием более агрессивных микроорганизмов [137]. Другие поддерживающие меры и методы лечения, не связанные с антибиотиками, были подвергнуты сомнению после десятков исследований.Гипотеза Кумара заключается в том, что протестированные методы лечения оказались безуспешными, поскольку процесс заболевания не был правильно интерпретирован [138]. Альтернативная патофизиологическая модель, предложенная Кумаром, предполагает существенное значение бактериальной нагрузки как основного фактора дисфункции органов и, следовательно, предполагает, что именно бактериальная нагрузка должна определять схему лечения антибиотиками при сепсисе. Тогда ключом к улучшению результатов может стать скорейшее снижение этого бремени на основе более эффективного применения доступных антибиотиков и других стратегий, направленных на эту цель. Поэтому раннее введение и использование бактерицидных препаратов становится основополагающим в этой модели.
Микробиологическая модель сепсиса, как и иммунологическая модель, не способны полностью объяснить патофизиологию заболевания. Это понятно, если учесть ключевой элемент смертности при сепсисе - концепцию необратимого шока, которая предполагает, что шок, независимо от его этиологии, можно переживать лишь ограниченное время и что после его возникновения он становится необратимым, с неизбежным прогрессированием до хронического критического заболевания или смерти, если не обратить его вспять в течение короткого периода времени. Параллельным понятием в реанимации является гемодинамическая нестабильность.Эта концепция связана с «золотым часом», демонстрируемым при травматическом геморрагическом шоке, но применима и к различным формам критических состояний.
Концептуальная модель, включающая ключевые элементы модели сепсиса, должна учитывать следующее:
Во-первых, понимание того, что существует порог, при достижении которого медиаторы воспаления будут ассоциироваться с клеточной дисфункцией и повреждением тканей, проявляющимся как септический шок, и что этот порог может варьировать у разных людей: у лиц с плохим сердечно-легочным резервом шок разовьется раньше и на более низких уровнях клеточной дисфункции или повреждения тканей, в то время как молодым, здоровым пациентам может потребоваться значительно более высокая степень воспаления, чтобы достичь того же порога шока.
Во-вторых, появление нового элемента, такого как наличие шока, обычно проявляющегося в виде рецидивирующей или стойкой гипотензии, особенно если он проявляется плохой перфузией, которая не восстанавливается, и гемодинамической некогерентностью, в свою очередь, ставит пациентов на путь к необратимому повреждению органов. В какой-то неопределенный момент после возникновения гипотонии, в зависимости от степени гипотонии, влияния сопутствующих заболеваний и генотипа пациента, у пациента будет высокий риск развития хронического критического заболевания или смерти.
Из-за генетических вариаций хозяина и возбудителя, а также клинической изменчивости инфекции, точный момент, когда сепсис становится необратимым для каждого пациента, сегодня не может быть известен заранее;тем не менее, прогрессирование будет одинаковым для всех пациентов, которые его достигнут. Согласно модели Кумара, в основе септического шока лежит микробная нагрузка. Скорость достижения ее снижения до субкритического порога после начала инфекции будет иметь первостепенное значение для выживания, сводя таким образом к минимуму период, в течение которого существует достаточно микроорганизмов для возникновения шока, ограничивая риск достижения точки, когда выздоровление уже невозможно (Figures 3 и 4).


Эта модель позволяет предположить, что септический шок и сепсис - это две разные сущности, а не разновидности одного и того же заболевания. Основное различие между ними заключается во времени, отведенном для наступления необратимой и невосстановимой органной недостаточности. Простой факт наблюдения в обоих случаях клинических проявлений гипотонии, лактат-ацидоза и исчерпания компенсаторных реакций, а также значительные различия в уровне смертности при септическом шоке (более 40%) и сепсисе (около 10%) заставляют нас думать об этих двух состояниях, по мнению Кумара, как о разных явлениях.
Таким образом, согласно этой модели, важными факторами, которые следует учитывать при уменьшении бактериальной нагрузки при септическом шоке, являются:
1. Ранняя антимикробная терапия:
2. Антимикробная активность:
Обеспечить бактерицидную противомикробную активность;
Оптимизировать фармакокинетические показатели (препараты, зависящие от времени; и концентрационно-зависимые антибиотики)
Используйте комбинированную терапию с антибиотиками, имеющими разные механизмы действия.
3. Дополнительная терапия: контроль очага и инфузионная терапия для обеспечения перфузии и гемодинамической стабильности.
10.6. Продолжительность лечения антибиотиками в рамках программ управления АБТ
В рамках программ управления существует несколько причин попытаться сократить продолжительность лечения антибиотиками. Изменения в микробиоте усиливаются с каждым днем лечения антибиотиками. Последствия этого изменения недостаточно изучены, но оно может способствовать увеличению риска сепсиса в последующие месяцы [139]. Повышенная частота побочных эффектов также является поводом для беспокойства, включая появление резистентности к противомикробным препаратам, острой почечной недостаточности или инфекций, вызванных C. difficile. С каждым днем продления лечения антибиотиками риск увеличивается [140]. Что касается раннего прекращения лечения антибиотиками, мы должны учитывать две разные ситуации. С одной стороны, у пациентов с подозрением на инфекцию, у которых культуры, выделенные до начала лечения антибиотиками, отрицательны или демонстрируют незначительную контаминацию, лечение антибиотиками должно быть прекращено.
У пациентов с подозрением на вентилятор-ассоциированную пневмонию, но с отрицательным результатом БАЛж, Raman et al. предложили раннее прекращение лечения антибиотиками, не обнаружив различий в смертности (4 дня лечения против 9 дней). Между тем, появление бактерий с множественной лекарственной устойчивостью было явно менее частым в группе краткосрочного лечения. (7,5% против 35,7%) [141]. У пациентов в критическом состоянии с микробиологическим подтверждением инфекции имеются данные, свидетельствующие о не меньшей эффективности коротких схем лечения по сравнению с длительным лечением, главным образом при нозокомиальных пневмониях, связанных с искусственной вентиляцией легких и послеоперационной внутрибрюшной инфекции, при этом в большинстве случаев достаточно 7-дневного лечения антибиотиками [134]. Клиническое исследование, проведенное на пациентах с осложненной внутрибрюшной инфекцией (это не были исключительно тяжелобольные пациенты), показало даже, что продолжительность лечения антибиотиками можно безопасно сократить до 3–5 дней при условии адекватного контроля очага инфекции [142]. В исследовании, проведенном у гемодинамически стабильных пациентов с ГНБ-бактериемией, Yahav et al.продемонстрировали не меньшую эффективность короткого режима лечения (8 дней) по сравнению с длительным режимом лечения (14 дней) [143]. При неосложненной стафилококковой бактериемии, текущие рекомендации по-прежнему указывают на необходимость 14-дневного лечения антибиотиками, но в настоящее время проводятся клинические исследования. сравнивая продолжительность 7 дней с 14 днями [144], а также существуют обсервационные исследования, подтверждающие использование короткого режима у пациентов с бактериемией, вызванной S. aureus, при отсутствии эндокардита, отдаленных метастатических очагов или наличия имплантов [145]
Chastre et al . не обнаружили различий в смертности при краткосрочном лечении у пациентов с вентилятор-ассоциированной пневмонией или в частоте рецидивов инфекции, за исключением пневмонии, вызванной P. aeruginosa, которая была выше в группе краткосрочного лечения [146]. В недавнем клиническом исследовании, которое было остановлено из-за отсутствия набора пациентов, сравнивали продолжительность лечения 8 и 15 дней у пациентов с вентилятор-ассоциированной пневмонией. вызываемый P. aeruginosa. Эти исследователи не смогли продемонстрировать не меньшую эффективность короткого режима лечения с точки зрения первичного результата в виде рецидива легочной инфекции и смертности [147]. Несмотря на эти результаты, оптимальная продолжительность лечения антибиотиками 7 дней можно установить даже при инфекциях, вызванных P. aeruginosa, поскольку потенциальная польза от продления лечения антибиотиками, вероятно, перевешивается вредом, вызванным ненужным продлением терапии [148]. У пациентов, поступившие в ОИТ в связи с COVID-19, вероятно, должны принимать индивидуальные решения, а в некоторых случаях может потребоваться продление лечения антибиотиками из-за очень высокого уровня вторичных инфекций и рецидива [149]. Использование биомаркеров также может помочь сократить продолжительность лечения антибиотиками у пациентов в критическом состоянии. ПКТ является биомаркером, уровень которого увеличивается в основном во время бактериальных инфекций, но также, в меньшей степени, при воспалительной реакции или хирургической травме [150,151]. Несколько клинических исследований показали, что продолжительность лечения антибиотиками с корректировкой ПКТ можно безопасно сократить у пациентов в критическом состоянии. Исследования, в которых участвовало большинство пациентов, проводились Bouadma et al. и De Jong et al. Bouadma et al. продемонстрировали, что у пациентов было больше дней без антибиотиков в группе ПКТ, в которой лечение антибиотиками прекращалось, когда уровень ПКТ составлял менее 0,5 нг/мл или снижался как минимум на 80% от пиковой концентрации [152]. De Jong et al. продемонстрировал у 1575 пациентов в критическом состоянии, что использование того же протокола позволило сократить среднюю продолжительность лечения антибиотиками до 5 дней по сравнению с 7 днями в контрольной группе и даже обнаружило снижение 28-дневной смертности [153]. Обсервационное исследование показало, что у критических послеоперационных пациентов с вторичным перитонитом алгоритм на основе ПКТ может быть полезен для сокращения продолжительности лечения антибиотиками (5,1 дней против 10,2) [133]. Недавно было высказано предположение, что кальпротектин может превосходить прокальцитонин в качестве биомаркера при сепсисе и индикатора необходимости интенсивной терапии у этих пациентов [154,155]. Наша общая рекомендация по продолжительности лечения антибиотиками у пациентов в критическом состоянии составляет 7 дней, которую можно дополнительно сократитьвод контролем динамики ПКТ. В случае абдоминальной инфекции при адекватном контроле очага продолжительность АБТ может составлять 5–7 дней [156].
10.7. Инструменты для принятия обоснованных решений
Среди инструментов, доступных для улучшения оказания помощи больным с инфекциями в критическом состоянии, есть обучающие средства, ярким примером которых являются опубликованные рекомендации по лечению антибиотиками. Мы выделим два из них: рекомендации Mensa (Испания) и Sanford (США).
11. Резюме по индивидуализации лечения антибиотиками у пациентов в критическом состоянии
Различные исследования подтверждают взаимосвязь между задержкой начала адекватного лечения антибиотиками и смертностью [97,119]. При инфекциях, вызванных Г(-) бактериями ненадлежащее лечение антибиотиками увеличивало риск смертности почти в четыре раза [157]. Кроме того, необходимость быстро определить правильное лечение антибиотиками чрезвычайно важно у пациентов с сепсисом или септическим шоком, у которых даже при адекватном лечении антибиотиками смертность может достигать от 27% до 40% у пациентов с множественными сопутствующими заболеваниями и низкми функциональными резервами, а также у пациентов с иммуносупрессией [158].
Несмотря на важность этих данных, реальность такова, что частота неадекватного лечения антибиотиками остается, по данным Vázquez-Guillamet et al., почти у 30% пациентов с сепсисом или септическим шоком, и, по данным этих авторов, число пациентов, которым потребуется соответствующее противомикробное лечение для спасения жизни равно пяти [159]. Наиболее важным фактором, предрасполагающим пациента к неадекватному лечению антибиотиками, является инфекция, вызванная микроорганизмами с множественной лекарственной устойчивостью [157]. Знание местной эпидемиологии необходимо для начала соответствующего эмпирического лечения. Знание общего уровня резистентности Г (-) бактерий к карбапенемам, имеющего эпидемиологическое значение, в каждом отделении и больнице можно использовать в качестве индикатора риска для пациента с наличием колонизации или инфицирования этими микроорганизмами. Как обсуждалось ранее, порог устойчивости к карбапенемам в 10–20% считается достаточным для инициации лечения новыми противомикробными препаратами, направленным на сбережение карбапенемов. Карбапенемы можно использовать, если частота резистентности составляет менее 10–20%, поскольку сами по себе они являются очень хорошими антибиотиками [96].
Большинство внутрибольничных инфекций вызываются представителями эндогенной микробиоты поверхностей слизистых оболочек путем транслокации или инвазии преобладающих микроорганизмов. в зависимости от плотности бактериальной популяции. Следовательно, знание колонизирующей флоры и характера ее чувствительности к противомикробным препаратам может иметь важное значение при выборе первоначального эмпирического лечения. По всем этим причинам казалось бы разумным проводить контрольные посевы при поступлении в ОИТ и в дальнейшем один-два раза в неделю, хотя нельзя исключать изменения в составе микробиоты до возникновения эпизода сепсиса. Альтернативной стратегией является получение полуколичественного ректального, глоточного и мазка слизистой оболочки носа во время сепсиса. Также важно оценить локализацию очага инфекции. У пациентов с факторами риска карбапенем-резистентного ГНБ следует рассмотреть возможность использования новых антибиотиков, когда ожидается, что клиническая эффективность возможных альтернатив будет субоптимальной, как в случае с полимиксинами и/или аминогликозидами у пациентов с пневмонией [160, 161]
Однако принятие решения об использовании активного эмпирического лечения при CRE-инфекциях может быть трудным для клинициста. Были опубликованы и проверены шкалы для прогнозирования индивидуального риска развития бактериемии у пациентов, колонизированных этими микроорганизмами [162–165]. Эти шкалы имеют свои ограничения в том смысле, что они валидированы в эпидемиологических условиях для конкретной группы пациентов и не обязательно могут воспроизводится в различных клинических ситуациях, что приводит к высокой отрицательной , но ограниченной положительной прогностической ценности.
В любом случае крайне важно начать раннее эмпирическое лечение антибиотиками, при котором нет права на ошибку у пациентов с нозокомиальной инфекцией и септическим шоком, у пациентов с сепсисом и низкими функциональными резервамии или у пациентов с подавленным иммунитетом. Для этих типов пациентов и для тех, у кого из-за местной экологии, индивидуального анамнеза колонизации, предшествующей инфекции и факторов риска CRE, таких как наличие множественных сопутствующих заболеваний, лучшим вариантом было бы начать активное эмпирическое лечение против CRE (в течение 24–36 часов и с использованием информации, полученной от культур) [166] — можно принять решение об окончательном эмпирическом или таргетном лечении и избежать ненужного чрезмерного использования этих антибиотиков. Нам нужны антибиотики, активные против как можно большего количества Г(-) бактерий, устойчивых к к карбапенемам. В зависимости от очага инфекции следует добавлять противомикробные препараты, активные в отношении Г (+) бактерий (даптомицин, линезолид, ванкомицин) и анаэробов, как в случай внутрибрюшной инфекции (тигециклин или метронидазол) [167]. На Figure 5 графически суммированы возможные факторы, определяющие выбор новых антибиотиков при эмпирическом и целенаправленном антимикробном лечении карбапенем-резистентных Г(-) бактерий при нозокомиальной инфекции. Принимая во внимание, что до недавнего времени у нас не было полностью эффективных и хорошо переносимых противомикробных средств против этого типа инфекции, необходимо оптимизировать использование новых антибиотиков, гарантируя пациентам наилучшее доступное лечение, одновременно отодвигая сроки появления и распространения устойчивости к ним.

12. Выводы
Проблемы лечения антибиотиками при сепсисе включают в себя адекватные программы управления, основанные на знаниях об инфекциях в ОИТ и в контексте мультирезистентных микроорганизмов, особенно грамотрицательных микроорганизмов, основанных на сбережении карбапенемов, а также эмпирическом и рациональном использовании новых антибиотиков.
References
1. Cortegiani, A.; Antonelli, M.; Falcone, M.; Giarratano, A.; Girardis, M.; Leone, M.; Pea, F.; Stefani, S.; Vaggi, B.; Viale, P. Rationale and clinical application of antimicrobial stewardship principles in the intensive care unit: A multidisciplinary statement. J. Anesth. Analg. Crit. Care 2023, 3, 11. [CrossRef] [PubMed]
2. Liebchen, U.; Briegel, J.; Brinkmann, A.; Frey, O.; Wicha, S.G. Individualised dosing of antibiotics in ICU patients: Timing, target and model selection matter. Intensive Care Med. 2023, 49, 475–476. [PubMed]
3. Yoo, J.H. The Infinity War: How to Cope with Carbapenem-resistant Enterobacteriaceae. J. Korean Med. Sci. 2018, 33, e255. [CrossRef] [PubMed]
4. Tang, K.W.K.; Millar, B.C.; Moore, J.E. Antimicrobial Resistance (AMR). Br. J. Biomed. Sci. 2023, 80, 11387. [CrossRef] [PubMed]
5. Llor, C.; Bjerrum, L. Antimicrobial resistance: Risk associated with antibiotic overuse and initiatives to reduce the problem. Ther.Adv. Drug Saf. 2014, 5, 229–241. [PubMed]
6. Diekema, D.J.; Hsueh, P.R.; Mendes, R.E.; Pfaller, M.A.; Rolston, K.V.; Sader, H.S.; Jones, R.N. The Microbiology of Bloodstream Infection: 20-Year Trends from the SENTRY Antimicrobial Surveillance Program. Antimicrob. Agents Chemother. 2019, 63, e00355-19.
[PubMed]
7. Leone, M.; Duclos, G.; Lakbar, I.; Martin-Loeches, I.; Einav, S. Antimicrobial resistance and outcome in the critically ill patient: An opinion paper. J. Crit. Care 2023, 77, 154352. [CrossRef]
8. Karukappadath, R.M.; Sirbu, D.; Zaky, A. Drug-resistant bacteria in the critically ill: Patterns and mechanisms of resistance and potential remedies. Front. Antibiot. 2023, 2, 1145190. [CrossRef]
9. Paterson, D.L. The Challenge of Treating Superbugs. Semin. Respir. Crit. Care Med. 2015, 36, 1–2. [CrossRef]
10. Magiorakos, A.P.; Srinivasan, A.; Carey, R.B.; Carmeli, Y.; Falagas, M.E.; Giske, C.G.; Harbarth, S.; Hindler, J.F.; Kahlmeter, G.; Olsson-Liljequist, B.; et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: An international expert proposal for interim standard definitions for acquired resistance. Clin. Microbiol. Infect. 2012, 18, 268–281.
11. Angele, M.K.; Faist, E. Clinical review: Immunodepression in the surgical patient and increased susceptibility to infection. Crit.Care 2002, 6, 298. [CrossRef]
12. DeWaele, J.J.; Boelens, J.; Leroux-Roels, I. Multidrug-resistant bacteria in ICU: Fact or myth. Curr. Opin. Anaesthesiol. 2020, 33,156–161. [PubMed]
13. Bassetti, M.; Righi, E.; Vena, A.; Graziano, E.; Russo, A.; Peghin, M. Risk stratification and treatment of ICU-acquired pneumonia caused by multidrug- resistant/extensively drug-resistant/pandrug-resistant bacteria. Curr. Opin. Crit. Care 2018, 24, 385–393.
[CrossRef] [PubMed]
14. The Abdominal Sepsis Study (AbSeS) Group on behalf of the Trials Group of the European Society of Intensive Care Medicine; Blot, S.; Antonelli, M.; Arvaniti, K.; Blot, K.; Creagh-Brown, B.; de Lange, D.; De Waele, J.; Deschepper, M.; Dikmen, Y.; et al. Epidemiology of intra-abdominal infection and sepsis in critically ill patients: “AbSeS”, a multinational observational cohort study and ESICM Trials Group Project. Intensive Care Med. 2019, 45, 1703–1717. [CrossRef]
15. Bassetti, S.; Tschudin-Sutter, S.; Egli, A.; Osthoff, M. Optimizing antibiotic therapies to reduce the risk of bacterial resistance. Eur. J. Intern. Med. 2022, 99, 7–12. [PubMed]
J. Pers. Med. 2024, 14, 106 31 of 37
16. Wunderink, R.G.; Srinivasan, A.; Barie, P.S.; Chastre, J.; Dela Cruz, C.S.; Douglas, I.S.; Ecklund, M.; Evans, S.E.; Evans, S.R.; Gerlach, A.T.; et al. Antibiotic Stewardship in the Intensive Care Unit. An Official American Thoracic SocietyWorkshop Report in Collaboration with the AACN, CHEST, CDC, and SCCM. Ann. Am. Thorac. Soc. 2020, 17, 531–540.
17. De Waele, J.J.; Dhaese, S. Antibiotic stewardship in sepsis management: Toward a balanced use of antibiotics for the severely ill patient. Expert Rev. Anti Infect. Ther. 2019, 17, 89–97. [CrossRef]
18. Shrestha, J.; Zahra, F.; Cannady, J. Antimicrobial Stewardship. In StatPearls; StatPearls Publishing: Treasure Island, FL, USA, 2023. Available online: http://www.ncbi.nlm.nih.gov/books/NBK572068/ (accessed on 29 August 2023).
19. Srinivasan, A. Antibiotic stewardship: Why we must, how we can. Cleve Clin. J. Med. 2017, 84, 673–679.
20. Damiani, E.; Donati, A.; Serafini, G.; Rinaldi, L.; Adrario, E.; Pelaia, P.; Busani, S.; Girardis, M. Effect of performance improvement programs on compliance with sepsis bundles and mortality: A systematic review and meta-analysis of observational studies.PLoS ONE 2015, 10, e0125827.
21. Schinkel, M.; Nanayakkara, P.W.B.; Wiersinga, W.J. Sepsis Performance Improvement Programs: From Evidence Toward Clinical Implementation. Crit. Care 2022, 26, 77. [CrossRef]
22. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado, F.R.; Mcintyre, L.; Ostermann, N.; Prescott, H.C.; et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021.Intensive Care Med. 2021, 47, 1181–1247. [CrossRef] [PubMed]
23. Méndez, R.; Figuerola, A.; Chicot, M.; Barrios, A.; Pascual, N.; Ramasco, F.; Rodríguez, D.; García, I.; vonWernitz, A.; Zurita, N.;et al. Sepsis Code: Dodging mortality in a tertiary hospital. Rev. Esp. Quimioter. 2022, 35, 43–49. [CrossRef] [PubMed]
24. Mensa, J.; Barberán, J.; Ferrer, R.; Borges, M.; Rascado, P.; Maseda, E.; Oliver, A.; Marco, F.; Adalia, R.; Aguilar, G.; et al.Recommendations for antibiotic selection for severe nosocomial infections. Rev. Esp. Quimioter. 2021, 34, 511–524. [PubMed]
25. Peri, A.M.; Stewart, A.; Hume, A.; Irwin, A.; Harris, P.N.A. New Microbiological Techniques for the Diagnosis of Bacterial Infections and Sepsis in ICU Including Point of Care. Curr. Infect. Dis. Rep. 2021, 23, 12. [CrossRef] [PubMed]
26. Tamma, P.D.; Miller, M.A.; Cosgrove, S.E. Rethinking How Antibiotics Are Prescribed: Incorporating the 4 Moments of Antibiotic Decision Making Into Clinical Practice. JAMA 2019, 321, 139–140. [CrossRef]
27. Timsit, J.F.; Bassetti, M.; Cremer, O.; Daikos, G.; de Waele, J.; Kallil, A.; Kipnis, E.; Kollef, M.; Laupland, K.; Paiva, J.-A.; et al. Rationalizing antimicrobial therapy in the ICU: A narrative review. Intensive Care Med. 2019, 45, 172–189. [CrossRef] [PubMed]
28. Princess, I.; Vadala, R. Clinical Microbiology in the Intensive Care Unit: Time for Intensivists to Rejuvenate this Lost Art. Indian J. Crit. Care Med. 2021, 25, 566–574. [PubMed]
29. Gupta, E.; Saxena, J.; Kumar, S.; Sharma, U.; Rastogi, S.; Srivastava, V.K.; Kaushik, S.; Jyoti, A. Fast Track Diagnostic Tools for Clinical Management of Sepsis: Paradigm Shift from Conventional to Advanced Methods. Diagnostics 2023, 13, 277.
30. Gerace, E.; Mancuso, G.; Midiri, A.; Poidomani, S.; Zummo, S.; Biondo, C. Recent Advances in the Use of Molecular Methods for the Diagnosis of Bacterial Infections. Pathogens 2022, 11, 663.
31. Hansen, G.T. Point-of-Care Testing in Microbiology: A Mechanism for Improving Patient Outcomes. Clin. Chem. 2020, 66, 124–137.[CrossRef]
32. Kowalska-Krochmal, B.; Dudek-Wicher, R. The Minimum Inhibitory Concentration of Antibiotics: Methods, Interpretation,Clinical Relevance. Pathogens 2021, 10, 165. [PubMed]
33. Nabal Díaz, S.G.; Algara Robles, O.; García-Lechuz Moya, J.M. New definitions of susceptibility categories EUCAST 2019: Clinic application. Rev. Esp. Quim. 2022, 35 (Suppl. S3), 84–88. [CrossRef] [PubMed]
34. Drlica, K.; Zhao, X. Mutant Selection Window Hypothesis Updated. Clin. Infect. Dis. 2007, 44, 681–688. [CrossRef] [PubMed]
35. Zhao, X.; Drlica, K. Restricting the selection of antibiotic-resistant mutant bacteria: Measurement and potential use of the mutant selection window. J. Infect. Dis. 2002, 185, 561–565. [CrossRef]
36. Mensa, J.; Barberán, J.; Soriano, A.; Llinares, P.; Marco, F.; Cantón, R.; Bou, G.; González Del Castillo, J.; Maseda, E.; Azanza, J.R.; et al. Antibiotic selection in the treatment of acute invasive infections by Pseudomonas aeruginosa: Guidelines by the Spanish Society of Chemotherapy. Rev. Esp. Quimioter. 2018, 31, 78–100. [PubMed]
37. Schlebusch, S.; Graham, R.M.A.; Jennison, A.V.; Lassig-Smith, M.M.; Harris, P.N.A.; Lipman, J.; Ó Cuív, P.; Paterson, D.L. Standard rectal swabs as a surrogate sample for gut microbiome monitoring in intensive care. BMC Microbiol. 2022, 22, 99. [CrossRef]
38. Montero, J.G.; Lerma, F.Á.; Galleymore, P.R.; Martínez, M.P.; Rocha, L.Á.; Gaite, F.B.; Rodríguez, J.A.; González, M.C.; Moreno, I.F.; Baño, J.R.; et al. Combatting resistance in intensive care: The multimodal approach of the Spanish ICU «Zero Resistance» program. Crit. Care 2015, 19, 114. [CrossRef]
39. Roberts, J.A.; Taccone, F.S.; Lipman, J. Understanding PK/PD. Intensive Care Med. 2016, 42, 1797–1800. [CrossRef]
40. Roberts, J.A.; Paul, S.K.; Akova, M.; Bassetti, M.; De Waele, J.J.; Dimopoulos, G.; Kaukonen, K.-M.; Koulenti, D.; Martin, C.; Montravers, P.; et al. DALI: Defining antibiotic levels in intensive care unit patients: Are current _-lactam antibiotic doses
sufficient for critically ill patients? Clin. Infect. Dis. 2014, 58, 1072–1083. [CrossRef]
41. Guilhaumou, R.; Benaboud, S.; Bennis, Y.; Dahyot-Fizelier, C.; Dailly, E.; Gandia, P.; Goutelle, S.; Lefeuvre, S.; Mongardon, N.;Roger, C.; et al. Optimization of the treatment with beta-lactam antibiotics in critically ill patients—Guidelines from the French
Society of Pharmacology and Therapeutics (Société Française de Pharmacologie et Thérapeutique—SFPT) and the French Society
of Anaesthesia and Intensive Care Medicine (Société Française d’Anesthésie et Réanimation—SFAR). Crit. Care 2019, 23, 104.
J. Pers. Med. 2024, 14, 106 32 of 37
42. Hong, L.T.; Downes, K.J.; FakhriRavari, A.; Abdul-Mutakabbir, J.C.; Kuti, J.L.; Jorgensen, S.; Young, D.C.; Alshaer, M.H.; Bassetti, M.; Bonomo, R.A.; et al. International consensus recommendations for the use of prolonged-infusion beta-lactam antibiotics:Endorsed by the American College of Clinical Pharmacy, British Society for Antimicrobial Chemotherapy, Cystic Fibrosis Foundation, European Society of Clinical Microbiology and Infectious Diseases, Infectious Diseases Society of America, Society of Critical Care Medicine, and Society of Infectious Diseases Pharmacists: An executive summary. Pharmacotherapy 2023, 43, 736–739.
[PubMed]
43. Tang, R.; Luo, R.;Wu, B.;Wang, F.; Song, H.; Chen, X. Effectiveness and safety of adjunctive inhaled antibiotics for ventilatorassociated pneumonia: A systematic review and meta-analysis of randomized controlled trials. J. Crit. Care 2021, 65, 133–139. [CrossRef]
44. Kalil, A.C.; Metersky, M.L.; Klompas, M.; Muscedere, J.; Sweeney, D.A.; Palmer, L.B.; Napolitano, L.M.; O’Grady, N.P.; Bartlett, J.G.; Carratalà, J.; et al. Management of Adults with Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin. Infect. Dis. 2016, 63, e61–e111. [CrossRef]
45. Tablan, O.C.; Anderson, L.J.; Besser, R.; Bridges, C.; Hajjeh, R.; CDC; Healthcare Infection Control Practices Advisory Committee. Guidelines for preventing health-care-associated pneumonia, 2003: Recommendations of CDC and the Healthcare Infection Control Practices Advisory Committee. Morb. Mortal. Wkly. Rep. Recomm. Rep. 2004, 53, 1–179.
46. Rello, J.; Solé-Lleonart, C.; Rouby, J.J.; Chastre, J.; Blot, S.; Poulakou, G.; Luyt, C.-E.; Riera, J.; Palmer, L.B.; Pereira, J.M.; et al. Use of nebulized antimicrobials for the treatment of respiratory infections in invasively mechanically ventilated adults: A position paper from the European Society of Clinical Microbiology and Infectious Diseases. Clin. Microbiol. Infect. 2017, 23, 629–639. [CrossRef] [PubMed]
47. Gorham, J.; Taccone, F.S.; Hites, M. How to Use Nebulized Antibiotics in Severe Respiratory Infections. Antibiotics 2023, 12, 267. [CrossRef] [PubMed]
48. Abdul-Aziz, M.H.; Alffenaar, J.W.C.; Bassetti, M.; Bracht, H.; Dimopoulos, G.; Marriott, D.; Neely, M.N.; Paiva, J.-A.; Pea, F.; Sjovall, F.; et al. Antimicrobial therapeutic drug monitoring in critically ill adult patients: A Position Paper. Intensive Care Med.2020, 46, 1127–1153. [CrossRef]
49. Shi, A.X.; Qu, Q.; Zhuang, H.H.; Teng, X.Q.; Xu,W.X.; Liu, Y.P.; Xiao, Y.W.; Qu, J. Individualized antibiotic dosage regimens for patients with augmented renal clearance. Front. Pharmacol. 2023, 14, 1137975. [CrossRef]
50. Shenoy, E.S.; Macy, E.; Rowe, T.; Blumenthal, K.G. Evaluation and Management of Penicillin Allergy: A Review. JAMA 2019, 321, 188–199.
51. Stone, C.A.; Trubiano, J.; Coleman, D.T.; Rukasin, C.R.F.; Phillips, E.J. The challenge of de-labeling penicillin allergy. Allergy 2020,75, 273–288.
52. Caruso, C.; Valluzzi, R.L.; Colantuono, S.; Gaeta, F.; Romano, A. _-Lactam Allergy and Cross-Reactivity: A Clinician’s Guide to Selecting an Alternative Antibiotic. J. Asthma Allergy 2021, 14, 31–46. [CrossRef] [PubMed]
53. Alvarez-Cuesta, E.; Madrigal-Burgaleta, R.; Broyles, A.D.; Cuesta-Herranz, J.; Guzman-Melendez, M.A.; Maciag, M.C.; Phillips, E.J.; Trubiano, J.A.;Wong , J.T.; Ansotegui, I. Standards for practical intravenous rapid drug desensitization & delabeling: AWAO committee statement. World Allergy Organ. J. 2022, 15, 100640. [PubMed]
54. Savic, L.; Ardern-Jones, M.; Avery, A.; Cook, T.; Denman, S.; Farooque, S.; Garcez, T.; Gold, R.; Jay, N.; Krishna, M.T.; et al. BSACI guideline for the set-up of penicillin allergy de-labelling services by non-allergists working in a hospital setting. Clin. Exp. Allergy 2022, 52, 1135–1141. [PubMed]
55. Trubiano, J.A.; Vogrin, S.; Chua, K.Y.L.; Bourke, J.; Yun, J.; Douglas, A.; Stone, A.C.; Yu, R.; Lauren, G.; Holmes, N.E.; et al. Development and Validation of a Penicillin Allergy Clinical Decision Rule. JAMA Intern. Med. 2020, 180, 745–752. [CrossRef] [PubMed]
56. Courtemanche, J.; Baril, L.; Clément, A.; Bédard, M.A.; Plourde, M.; Émond, M. Is it possible to identify patients at low risk of having a true penicillin allergy? Can. J. Emerg. Med. 2022, 24, 366–368. [CrossRef]
57. Trubiano, J.A. A Risk-Based Approach to Penicillin Allergy. Immunol. Allergy Clin. North Am. 2022, 42, 375–389. [CrossRef]
58. Holmes, M.D.; Vo, N.; Rafeq, R.; Byrne, D.; King, M. Administration of _-lactam antibiotics to patients with reported penicillin allergy in the emergency department. Am. J. Emerg. Med. 2023, 68, 119–123.
59. Pulcini, C.; Bush, K.; Craig, W.A.; Frimodt-Møller, N.; Grayson, M.L.; Mouton, J.W.; Turnidge, J.; Harbarth, S.; Gyssens, I.C.; ESCMID Study Group for Antibiotic Policies. Forgotten antibiotics: An inventory in Europe, the United States, Canada, and Australia. Clin. Infect. Dis. 2012, 54, 268–274. [CrossRef]
60. El-Sayed Ahmed, M.A.E.G.; Zhong, L.L.; Shen, C.; Yang, Y.; Doi, Y.; Tian, G.B. Colistin and its role in the Era of antibiotic resistance: An extended review (2000–2019). Emerg. Microbes Infect. 2020, 9, 868–885. [CrossRef]
61. Múñez Rubio, E.; Ramos Martínez, A.; Fernández Cruz, A. Fosfomycin in antimicrobial stewardship programs. Rev. Esp. Quimioter. 2019, 32 (Suppl. S1), 62–66.
62. Rychlíˇcková, J.; Kubíˇcková, V.; Suk, P.; Urbánek, K. Challenges of Colistin Use in ICU and Therapeutic Drug Monitoring: A Literature Review. Antibiotics 2023, 12, 437.
63. Brown, G.R. Cotrimoxazole—Optimal dosing in the critically ill. Ann. Intensive Care 2014, 4, 13. [CrossRef] [PubMed]
64. Tamma, P.D.; Aitken, S.L.; Bonomo, R.A.; Mathers, A.J.; van Duin, D.; Clancy, C.J. Infectious Diseases Society of America 2023 Guidance on the Treatment of Antimicrobial Resistant Gram-Negative Infections. Clin. Infect. Dis. 2023, ciad428. [CrossRef] [PubMed]
65. Yaghoubi, S.; Zekiy, A.O.; Krutova, M.; Gholami, M.; Kouhsari, E.; Sholeh, M.; Ghafouri, Z.; Maleki, F. Tigecycline antibacterial activity, clinical effectiveness, and mechanisms and epidemiology of resistance: Narrative review. Eur. J. Clin. Microbiol. Infect. Dis. 2022, 41, 1003–1022. [CrossRef] [PubMed]
66. De Pascale, G.; Lisi, L.; Ciotti, G.M.P.; Vallecoccia, M.S.; Cutuli, S.L.; Cascarano, L.; Gelormini, C.; Bello, G.; Montini, L.; Carelli, S.;et al. Pharmacokinetics of high-dose tigecycline in critically ill patients with severe infections. Ann. Intensive Care 2020, 10, 94.
67. Infectious Diseases Society of America (IDSA); Spellberg, B.; Blaser, M.; Guidos, R.J.; Boucher, H.W.; Bradley, J.S. Combating antimicrobial resistance: Policy recommendations to save lives. Clin. Infect. Dis. 2011, 52 (Suppl. S5), S397–S428.
68. Brown, N.M.; Goodman, A.L.; Horner, C.; Jenkins, A.; Brown, E.M. Treatment of methicillin-resistant Staphylococcus aureus (MRSA): Updated guidelines from the UK. JAC Antimicrob. Resist. 2021, 3, dlaa114. [CrossRef]
69. Habib, G.; Lancellotti, P.; Antunes, M.J.; Bongiorni, M.G.; Casalta, J.P.; Del Zotti, F.; Dulgheru, R.; El Khoury, G.; Erba, P.A.; Iung, B.; et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective
Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur. Heart J. 2015, 36, 3075–3128.
70. Infectious Diseases Society of America. The 10 x ’20 Initiative: Pursuing a global commitment to develop 10 new antibacterial drugs by 2020. Clin. Infect. Dis. 2010, 50, 1081–1083.
71. Hetzler, L.; Kollef, M.H.; Yuenger, V.; Micek, S.T.; Betthauser, K.D. New antimicrobial treatment options for severe Gram-negative infections. Curr. Opin. Crit. Care 2022, 28, 522–533.
72. Clancy, C.J.; Nguyen, M.H. Management of Highly Resistant Gram-Negative Infections in the Intensive Care Unit in the Era of Novel Antibiotics. Infect. Dis. Clin. N. Am. 2022, 36, 791–823. [CrossRef] [PubMed]
73. Shirley, M. Ceftazidime-Avibactam: A Review in the Treatment of Serious Gram-Negative Bacterial Infections. Drugs 2018, 78,675–692. [CrossRef]
74. Matesanz, M.; Mensa, J. Ceftazidime-Avibactam. Rev. Esp. Quimioter. 2021, 34 (Suppl. S1), 38–40. [CrossRef]
75. Pintado, V.; Ruiz-Garbajosa, P.; Aguilera-Alonso, D.; Baquero-Artigao, F.; Bou, G.; Cantón, R.; Grau, S.; Gutiérrez-Gutiérrez, B.;Larrosa, N.; Machuca, I.; et al. Executive summary of the consensus document of the Spanish Society of Infectious Diseases and Clinical Microbiology (SEIMC) on the diagnosis and antimicrobial treatment of infections due to carbapenem-resistant
Gram-negative bacteria. Enferm. Infecc. Microbiol. Clin. 2023, 41, 360–370. [CrossRef]
76. Paul, M.; Carrara, E.; Retamar, P.; Tängdén, T.; Bitterman, R.; Bonomo, R.A.; deWaele, J.; Daikos, G.L.; Akova, M.; Harbarth, S.;et al. European Society of Clinical Microbiology and Infectious Diseases (ESCMID) guidelines for the treatment of infections caused by multidrug-resistant Gram-negative bacilli (endorsed by European society of intensive care medicine). Clin. Microbiol. Infect. 2022, 28, 521–547. [CrossRef]
77. Bassetti, M.; Garau, J. Current and future perspectives in the treatment of multidrug-resistant Gram-negative infections. J. Antimicrob. Chemother. 2021, 76 (Suppl. S4), iv23–iv37. [PubMed]
78. Soriano, A.; Carmeli, Y.; Omrani, A.S.; Moore, L.S.P.; Tawadrous, M.; Irani, P. Ceftazidime-Avibactam for the Treatment of Serious Gram-Negative Infections with Limited Treatment Options: A Systematic Literature Review. Infect. Dis. Ther. 2021, 10, 1989–2034.
[CrossRef]
79. Soriano, A.; Montravers, P.; Bassetti, M.; Klyasova, G.; Daikos, G.; Irani, P.; Stone, G.; Chambers, R.; Peeters, P.; Shah, M.; et al.The Use and Effectiveness of Ceftazidime–Avibactam in Real-World Clinical Practice: EZTEAM Study. Infect. Dis. Ther. 2023, 12, 891–917.
80. Swaminathan, S.; Routray, A.; Mane, A. Early and Appropriate Use of Ceftazidime-Avibactam in the Management of Multidrug-Resistant Gram-Negative Bacterial Infections in the Indian Scenario. Cureus 2022, 14, e28283. [CrossRef]
81. Jorgensen, S.C.J.; Trinh, T.D.; Zasowski, E.J.; Lagnf, A.M.; Bhatia, S.; Melvin, S.M.; E Steed, M.; Simon, S.P.; Estrada, S.J.; Morrisette, T.; et al. Real-World Experience with Ceftazidime-Avibactam for Multidrug-Resistant Gram-Negative Bacterial Infections. Open
Forum Infect. Dis. 2019, 6, ofz522.
82. Castón, J.J.; Cano, A.; Pérez-Camacho, I.; Aguado, J.M.; Carratalá, J.; Ramasco, F.; Soriano, A.; Pintado, V.; Castelo-Corral, L.; Sousa, A.; et al. Impact of ceftazidime/avibactam versus best available therapy on mortality from infections caused by carbapenemase-producing Enterobacterales (CAVICOR study). J. Antimicrob. Chemother. 2022, 77, 1452–1460. [CrossRef] [PubMed]
83. Mikhail, S.; Singh, N.B.; Kebriaei, R.; Rice, S.A.; Stamper, K.C.; Castanheira, M.; Rybak, M.J. Evaluation of the Synergy of Ceftazidime-Avibactam in Combination with Meropenem, Amikacin, Aztreonam, Colistin, or Fosfomycin against Well-Characterized Multidrug-Resistant Klebsiella pneumoniae and Pseudomonas aeruginosa. Antimicrob. Agents Chemother. 2019, 63,
e00779-19. [PubMed]
84. Wang, L.T.; Lin, W.T.; Lai, C.C.; Wang, Y.H.; Chen, C.H.; Chang, Y.T.; Chen, C.-H.; Wang, C.-Y. The safety of ceftolozanetazobactam for the treatment of acute bacterial infections: A systemic review and meta-analysis. Ther. Adv. Drug Saf. 2021, 12, 20420986211027096. [CrossRef] [PubMed]
85. Candel, F.J.; del Castillo, J.G.; Jiménez, A.J.; Matesanz, M. Ceftolozane-tazobactam in nosocomial pneumonia. Rev. Esp. Quimioter. 2022, 35 (Suppl. S1), 35–39. [CrossRef] [PubMed]
86. Timsit, J.F.; Huntington, J.A.; Wunderink, R.G.; Shime, N.; Kollef, M.H.; Kivistik, Ü.; Nováˇcek, M.; Réa-Neto, A.; Martin-Loeches 9, I.; Yu, B.; et al. Ceftolozane/tazobactam versus meropenem in patients with ventilated hospital-acquired bacterial pneumonia: Subset analysis of the ASPECT-NP randomized, controlled phase 3 trial. Crit. Care 2021, 25, 290. [CrossRef]
87. Puzniak, L.; Dillon, R.; Palmer, T.; Collings, H.; Enstone, A. Real-world use of ceftolozane/tazobactam: A systematic literature review. Antimicrob. Resist. Infect. Control 2021, 10, 68. [CrossRef]
88. Sansone, P.; Giaccari, L.G.; Coppolino, F.; Aurilio, C.; Barbarisi, A.; Passavanti, M.B.; Pota, V.; Pace, M.C. Cefiderocol for Carbapenem-Resistant Bacteria: Handle with Care! A Review of the Real-World Evidence. Antibiotics 2022, 11, 904.
89. Maseda, E.; Suárez de la Rica, A. The role of cefiderocol in clinical practice. Rev. Esp. Quimioter. 2022, 35 (Suppl. S2), 39–44. [CrossRef]
90. Bassetti, M.; Echols, R.; Matsunaga, Y.; Ariyasu, M.; Doi, Y.; Ferrer, R.; Lodise, T.P.; Naas, T.; Niki, Y.; Paterson, D.L.; et al. Efficacy and safety of cefiderocol or best available therapy for the treatment of serious infections caused by carbapenem-resistant Gram-negative bacteria (CREDIBLE-CR): A randomised, open-label, multicentre, pathogen-focused, descriptive, phase 3 trial. Lancet Infect. Dis. 2021, 21, 226–240. [CrossRef]
91. Viale, P.; Sandrock, C.E.; Ramirez, P.; Rossolini, G.M.; Lodise, T.P. Treatment of critically ill patients with cefiderocol for infections caused by multidrug-resistant pathogens: Review of the evidence. Ann. Intensive Care 2023, 13, 52. [CrossRef]
92. Corcione, S.; Lupia, T.; Maraolo, A.E.; Mornese Pinna, S.; Gentile, I.; De Rosa, F.G. Carbapenem-sparing strategy: Carbapenemase, treatment, and stewardship. Curr. Opin. Infect. Dis. 2019, 32, 663–673.
93. Jean, S.S.; Harnod, D.; Hsueh, P.R. Global Threat of Carbapenem-Resistant Gram-Negative Bacteria. Front. Cell Infect. Microbiol. 2022, 12, 823684.
94. Arulkumaran, N.; Routledge, M.; Schlebusch, S.; Lipman, J.; Conway Morris, A. Antimicrobial-associated harm in critical care: A narrative review. Intensive Care Med. 2020, 46, 225–235. [CrossRef] [PubMed]
95. Harris, P.N.A.; Tambyah, P.A.; Lye, D.C.; Mo, Y.; Lee, T.H.; Yilmaz, M.; Alenazi, T.H.; Arabi, Y.; Falcone, M.; Bassetti, M.; et al. Effect of Piperacillin-Tazobactam vs Meropenem on 30-Day Mortality for Patients with E. coli or Klebsiella pneumoniae Bloodstream Infection and Ceftriaxone Resistance: A Randomized Clinical Trial. JAMA 2018, 320, 984–994. [PubMed]
96. Montravers, P.; Bassetti, M. The ideal patient profile for new beta-lactam/beta-lactamase inhibitors. Curr. Opin. Infect. Dis. 2018,31, 587–593. [PubMed]
97. Kollef, M.H.; Shorr, A.F.; Bassetti, M.; Timsit, J.F.; Micek, S.T.; Michelson, A.P.; Garnacho-Montero, J. Timing of antibiotic therapy in the ICU. Crit. Care 2021, 25, 360.
98. DeWaele, J.J.; Schouten, J.; Beovic, B.; Tabah, A.; Leone, M. Antimicrobial de-escalation as part of antimicrobial stewardship in intensive care: No simple answers to simple questions—A viewpoint of experts. Intensive Care Med. 2020, 46, 236–244.
99. Strich, J.R.; Heil, E.L.; Masur, H. Considerations for Empiric Antimicrobial Therapy in Sepsis and Septic Shock in an Era of Antimicrobial Resistance. J. Infect. Dis. 2020, 222 (Suppl. S2), S119–S131.
100. Dequin, P.F.; Aubron, C.; Faure, H.; Garot, D.; Guillot, M.; Hamzaoui, O.; Lemiale, V.; Maizel, J.; Mootien, J.Y.; Osman, D.; et al. The place of new antibiotics for Gram-negative bacterial infections in intensive care: Report of a consensus conference. Ann. Intensive Care 2023, 13, 59.
101. Miller, W.D.; Keskey, R.; Alverdy, J.C. Sepsis and the Microbiome: A Vicious Cycle. J. Infect. Dis. 2020, 223 (Suppl. S3), S264–S269. [CrossRef]
102. Prechter, F.; Katzer, K.; Bauer, M.; Stallmach, A. Sleeping with the enemy: Clostridium difficile infection in the intensive care unit. Crit. Care 2017, 21, 260. [PubMed]
103. Morel, C.M.; de Kraker, M.E.A.; Harbarth, S.; The Enhanced Surveillance Expert Consensus Group (CANSORT-SCI). Surveillance of Resistance to New Antibiotics in an Era of Limited Treatment Options. Front. Med. 2021, 8, 652638.
104. Niederman, M.S.; Baron, R.M.; Bouadma, L.; Calandra, T.; Daneman, N.; DeWaele, J.; Kollef, M.H.; Lipman, J.; Nair, G.B. Initial antimicrobial management of sepsis. Crit. Care 2021, 25, 307.
105. Pea, F.; Viale, P. The antimicrobial therapy puzzle: Could pharmacokinetic-pharmacodynamic relationships be helpful in addressing the issue of appropriate pneumonia treatment in critically ill patients? Clin. Infect. Dis. 2006, 42, 1764–1771.
106. Kumar, A. An alternate pathophysiologic paradigm of sepsis and septic shock: Implications for optimizing antimicrobial therapy.Virulence 2014, 5, 80–97. [PubMed]
107. Danjean, M.; Hobson, C.A.; Gits-Muselli, M.; Courroux, C.; Monjault, A.; Bonacorsi, S.; Birgy, A. Evaluation of the inoculum effect of new antibiotics against carbapenem-resistant enterobacterales. Clin. Microbiol. Infect. 2022, 28, 1503.e1–1503.e3.
108. Heffernan, A.J.; Mohd Sazlly Lim, S.; Lipman, J.; Roberts, J.A. A personalised approach to antibiotic pharmacokinetics and pharmacodynamics in critically ill patients. Anaesth. Crit. Care Pain. Med. 2021, 40, 100970. [CrossRef]
109. Zaragoza, R.; Vidal-Cortés, P.; Aguilar, G.; Borges, M.; Diaz, E.; Ferrer, R.; Maseda, E.; Nieto, M.; Nuvials, F.X.; Ramirez, P.; et al. Update of the treatment of nosocomial pneumonia in the ICU. Crit. Care 2020, 24, 383. [CrossRef]
110. Di Franco, S.; Alfieri, A.; Fiore, M.; Fittipaldi, C.; Pota, V.; Coppolino, F.; Sansone, P.; Pace, M.C.; Passavanti, M.B. A Literature Overview of Secondary Peritonitis Due to Carbapenem-Resistant Enterobacterales (CRE) in Intensive Care Unit (ICU) Patients.Antibiotics 2022, 11, 1347.
111. Heidary, M.; Khosravi, A.D.; Khoshnood, S.; Nasiri, M.J.; Soleimani, S.; Goudarzi, M. Daptomycin. J. Antimicrob. Chemother. 2018,73, 1–11. [CrossRef]
112. Thomas-Rüddel, D.O.; Schlattmann, P.; Pletz, M.; Kurzai, O.; Bloos, F. Risk Factors for Invasive Candida Infection in Critically Ill Patients: A Systematic Review and Meta-analysis. Chest 2022, 161, 345–355. [PubMed]
113. Keane, S.; Geoghegan, P.; Povoa, P.; Nseir, S.; Rodriguez, A.; Martin-Loeches, I. Systematic review on the first line treatment of amphotericin B in critically ill adults with candidemia or invasive candidiasis. Expert Rev. Anti Infect. Ther. 2018, 16, 839–847.[CrossRef] [PubMed]
114. Burillo, A.; Bouza, E. Faster infection diagnostics for intensive care unit (ICU) patients. Expert Rev. Mol. Diagn. 2022, 22, 347–360. [CrossRef] [PubMed]
115. Méndez Hernández, R.; Ramasco Rueda, F. Biomarkers as Prognostic Predictors and Therapeutic Guide in Critically Ill Patients:Clinical Evidence. J. Pers. Med. 2023, 13, 333. [PubMed]
116. Vincent, J.L.; Bassetti, M.; François, B.; Karam, G.; Chastre, J.; Torres, A.; Roberts, J.A.; Taccone, F.S.; Rello, J.; Calandra, T.; et al.Advances in antibiotic therapy in the critically ill. Crit. Care 2016, 20, 133. [PubMed]
117. Ulldemolins, M.; Nuvials, X.; Palomar, M.; Masclans, J.R.; Rello, J. Appropriateness is critical. Crit. Care Clin. 2011, 27, 35–51.
118. Mahmoudi, L.; Niknam, R.; Mousavi, S.; Ahmadi, A.; Honarmand, H.; Ziaie, S.; Mojtahedzadeh, M. Optimal Aminoglycoside Therapy Following the Sepsis: How Much Is Too Much? Iran. J. Pharm. Res. 2013, 12, 261–269.
119. Kumar, A.; Roberts, D.; Wood, K.E.; Light, B.; Parrillo, J.E.; Sharma, S.; Suppes, R.; Feinstein, D.; Zanotti, S.; Taiberg, L.; et al.Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit. Care Med. 2006, 34, 1589. [CrossRef]
120. Ferrer, R.; Martin-Loeches, I.; Phillips, G.; Osborn, T.M.; Townsend, S.; Dellinger, R.P.; Artigas, A.; Schorr, C.; Levy, M.M. Empiric antibiotic treatment reduces mortality in severe sepsis and septic shock from the first hour: Results from a guideline-based
performance improvement program. Crit. Care Med. 2014, 42, 1749–1755.
121. Im, Y.; Kang, D.; Ko, R.E.; Lee, Y.J.; Lim, S.Y.; Park, S.; Na, S.J.; Chung, C.R.; Park, M.H.; Oh, D.K.; et al. Time-to-antibiotics and clinical outcomes in patients with sepsis and septic shock: A prospective nationwide multicenter cohort study. Crit. Care 2022,26, 19. [CrossRef]
122. Peltan, I.D.; Mitchell, K.H.; Rudd, K.E.; Mann, B.A.; Carlbom, D.J.; Hough, C.L.; Rea, T.D.; Brown, S.M. Physician Variation in Time to Antimicrobial Treatment for Septic Patients Presenting to the Emergency Department. Crit. Care Med. 2017, 45, 1011–1018.[CrossRef] [PubMed]
123. Roberts, R.J.; Alhammad, A.M.; Crossley, L.; Anketell, E.; Wood, L.; Schumaker, G.; Garpestad, E.; Devlin, J.W. A survey of critical care nurses’ practices and perceptions surrounding early intravenous antibiotic initiation during septic shock. Intensive Crit. Care Nurs. 2017, 41, 90–97. [CrossRef] [PubMed]
124. Pak, T.R.; Rhee, C.; Klompas, M. Timing and Spectrum of Antibiotic Treatment for Suspected Sepsis and Septic Shock: Why so Controversial? Infect. Dis. Clin. North Am. 2022, 36, 719–733. [CrossRef]
125. Rothrock, S.G.; Cassidy, D.D.; Barneck, M.; Schinkel, M.; Guetschow, B.; Myburgh, C.; Nguyen, L.; Earwood, R.; Nanayakkara, P.W.; Panday, R.S.N.; et al. Outcome of Immediate Versus Early Antibiotics in Severe Sepsis and Septic Shock: A Systematic Review and Meta-analysis. Ann. Emerg. Med. 2020, 76, 427–441. [CrossRef] [PubMed]
126. Rhee, C.; Chiotos, K.; Cosgrove, S.E.; Heil, E.L.; Kadri, S.S.; Kalil, A.C.; Gilbert, D.N.; Masur, H.; Septimus, E.J.; A Sweeney, D.; et al. Infectious Diseases Society of America Position Paper: Recommended Revisions to the National Severe Sepsis and Septic Shock Early Management Bundle (SEP-1) Sepsis Quality Measure. Clin. Infect. Dis. 2021, 72, 541–552. [CrossRef] [PubMed]
127. Weinberger, J.; Rhee, C.; Klompas, M. A Critical Analysis of the Literature on Time-to-Antibiotics in Suspected Sepsis. J. Infect. Dis. 2020, 222 (Suppl. S2), S110–S118.
128. Montravers, P.; Blot, S.; Dimopoulos, G.; Eckmann, C.; Eggimann, P.; Guirao, X.; Paiva, J.A.; Sganga, G.; De Waele, J. Therapeutic management of peritonitis: A comprehensive guide for intensivists. Intensive Care Med. 2016, 42, 1234–1247.
129. Ordoñez, C.A.; Caicedo, Y.; Parra, M.W.; Rodríguez-Holguín, F.; Serna, J.J.; Salcedo, A.; Franco, M.J.; Toro, L.E.; Pino, L.F.; Guzmán-Rodríguez, M.; et al. Evolution of damage control surgery in non-traumatic abdominal pathology: A light in the darkness. Colomb. Med. 2021, 52, e4194809. [CrossRef]
130. DeWaele, J.J.; Girardis, M.; Martin-Loeches, I. Source control in the management of sepsis and septic shock. Intensive Care Med.2022, 48, 1799–1802. [CrossRef]
131. De Pascale, G.; Antonelli, M.; Deschepper, M.; Arvaniti, K.; Blot, K.; Brown, B.C.; de Lange, D.; De Waele, J.; Dikmen, Y.;Dimopoulos, G.; et al. Poor timing and failure of source control are risk factors for mortality in critically ill patients with secondary peritonitis. Intensive Care Med. 2022, 48, 1593–1606. [CrossRef]
132. Obst, W.; Esser, T.; Kaasch, A.J.; Geginat, G.; Meyer, F.; Croner, R.S.; Keitel, V. The Need of Antimicrobial Stewardship in Post-Operative Infectious Complications of Abdominal Surgery. Visc. Med. 2022, 38, 345–353. [PubMed]
133. Maseda, E.; Suarez-de-la-Rica, A.; Anillo, V.; Tamayo, E.; García-Bernedo, C.A.; Ramasco, F.; Villagran, M.-J.; Maggi, G.; Gimenez, M.-J.; Aguilar, L.; et al. Procalcitonin-guided therapy may reduce length of antibiotic treatment in intensive care unit patients with secondary peritonitis: A multicenter retrospective study. J. Crit. Care 2015, 30, 537–542. [CrossRef] [PubMed]
134. For the DURAPOP Trial Group; Montravers, P.; Tubach, F.; Lescot, T.; Veber, B.; Esposito-Farèse, M.; Seguin, P.; Paugam, C.; Lepape, A.; Meistelman, C.; et al. Short-course antibiotic therapy for critically ill patients treated for postoperative intra-abdominal infection: The DURAPOP randomised clinical trial. Intensive Care Med. 2018, 44, 300–310. [CrossRef] [PubMed]
135. Bass, G.A.; Dzierba, A.L.; Taylor, B.; Lane-Fall, M.; Kaplan, L.J. Tertiary peritonitis: Considerations for complex team-based care. Eur. J. Trauma. Emerg. Surg. 2022, 48, 811–825. [PubMed]
136. Marques, H.S.; Araújo, G.R.L.; da Silva, F.A.F.; de Brito, B.B.; Versiani, P.V.D.; Caires, J.S.; Milet, T.d.C.; de Melo, F.F. Tertiary peritonitis: A disease that should not be ignored. World J. Clin. Cases 2021, 9, 2160–2169. [CrossRef] [PubMed]
137. Prest, J.; Nguyen, T.; Rajah, T.; Prest, A.B.; Sathananthan, M.; Jeganathan, N. Sepsis-Related Mortality Rates and Trends Based on Site of Infection. Crit. Care Explor. 2022, 4, e0775.
138. Cavaillon, J.; Singer, M.; Skirecki, T. Sepsis therapies: Learning from 30 years of failure of translational research to propose new leads. EMBO Mol. Med. 2020, 12, e10128. [CrossRef]
139. Baggs, J.; Jernigan, J.A.; Halpin, A.L.; Epstein, L.; Hatfield, K.M.; McDonald, L.C. Risk of Subsequent Sepsis within 90 Days after a Hospital Stay by Type of Antibiotic Exposure. Clin. Infect. Dis. 2018, 66, 1004–1012. [CrossRef]
140. Teshome, B.F.; Vouri, S.M.; Hampton, N.; Kollef, M.H.; Micek, S.T. Duration of Exposure to Antipseudomonal _-Lactam Antibiotics in the Critically Ill and Development of New Resistance. Pharmacotherapy 2019, 39, 261–270.
141. Raman, K.; Nailor, M.D.; Nicolau, D.P.; Aslanzadeh, J.; Nadeau, M.; Kuti, J.L. Early Antibiotic Discontinuation in Patients with Clinically Suspected Ventilator-Associated Pneumonia and Negative Quantitative Bronchoscopy Cultures. Crit. Care Med. 2013,41, 1656–1663.
142. Sawyer, R.G.; Claridge, J.A.; Nathens, A.B.; Rotstein, O.D.; Duane, T.M.; Evans, H.L.; Cook, C.H.; O’neill, P.J.; Mazuski, J.E.;Askari, R.; et al. Trial of Short-Course Antimicrobial Therapy for Intraabdominal Infection. N. Engl. J. Med. 2015, 372, 1996–2005.[CrossRef] [PubMed]
143. Yahav, D.; Franceschini, E.; Koppel, F.; Turjeman, A.; Babich, T.; Bitterman, R.; Neuberger, A.; Ghanem-Zoubi, N.; Santoro, A.; Eliakim-Raz, N.; et al. Seven Versus 14 Days of Antibiotic Therapy for Uncomplicated Gram-negative Bacteremia: A Noninferiority Randomized Controlled Trial. Clin. Infect. Dis. 2019, 69, 1091–1098. [PubMed]
144. Thorlacius-Ussing, L.; Andersen, C.Ø.; Frimodt-Møller, N.; Knudsen, I.J.D.; Lundgren, J.; Benfield, T.L. Efficacy of seven and fourteen days of antibiotic treatment in uncomplicated Staphylococcus aureus bacteremia (SAB7): Study protocol for a randomized controlled trial. Trials 2019, 20, 250.
145. Kim, C.J.; Song, K.H.; Park, K.H.; Kim, M.; Choe, P.G.; Oh M d et, a.l. Impact of antimicrobial treatment duration on outcome of Staphylococcus aureus bacteraemia: A cohort study. Clin. Microbiol. Infect. 2019, 25, 723–732. [CrossRef] [PubMed]
146. Chastre, J.;Wolff, M.; Fagon, J.Y.; Chevret, S.; Thomas, F.;Wermert, D.; Clementi, E.; Gonzalez, J.; Jusserand, D.; Asfar, D.; et al. Comparison of 8 vs 15 Days of Antibiotic Therapy for Ventilator-Associated Pneumonia in Adults: A Randomized Trial. JAMA 2003, 290, 2588. [CrossRef] [PubMed]
147. Bouglé, A.; Tuffet, S.; Federici, L.; Leone, M.; Monsel, A.; Dessalle, T.; Amour, J.; Dahyot-Fizelier, C.; Barbier, F.; Luyt, C.-E.; et al.Comparison of 8 versus 15 days of antibiotic therapy for Pseudomonas aeruginosa ventilator-associated pneumonia in adults: A randomized, controlled, open-label trial. Intensive Care Med. 2022, 48, 841–849.
148. Metersky, M.L.; Klompas, M.; Kalil, A.C. Less Is More: A 7-Day Course of Antibiotics Is the Evidence-Based Treatment for Pseudomonas aeruginosa Ventilator-Associated Pneumonia. Clin. Infect. Dis. 2023, 76, 750–752. [CrossRef]
149. Rouzé, A.; Martin-Loeches, I.; Povoa, P.; Makris, D.; Artigas, A.; Bouchereau, M.; Lambiotte, F.; Metzelard, M.; Cuchet, P.;Geronimi, C.B.; et al. Relationship between SARS-CoV-2 infection and the incidence of ventilator-associated lower respiratory tract infections: A European multicenter cohort study. Intensive Care Med. 2021, 47, 188–198. [CrossRef]
150. Assicot, M.; Bohuon, C.; Gendrel, D.; Raymond, J.; Carsin, H.; Guilbaud, J. High serum procalcitonin concentrations in patients with sepsis and infection. Lancet 1993, 341, 515–518.
151. Rau, B.; Krüger, C.M.; Schilling, M.K. Procalcitonin: Improved biochemical severity stratification and postoperative monitoring in severe abdominal inflammation and sepsis. Langenbeck’s Arch. Surg. 2004, 389, 134–144. [CrossRef]
152. Bouadma, L.; Luyt, C.E.; Tubach, F.; Cracco, C.; Alvarez, A.; Schwebel, C.; Schortgen, F.; Lasocki, S.; Veber, B.; Dehoux, M.; et al. Use of procalcitonin to reduce patients’ exposure to antibiotics in intensive care units (PRORATA trial): A multicentre randomised controlled trial. Lancet 2010, 375, 463–474. [PubMed]
153. De Jong, E.; Van Oers, J.A.; Beishuizen, A.; Vos, P.; Vermeijden,W.J.; Haas, L.E.; Loef, B.G.; Dormans, T.; van Melsen, G.C.; Kluiters, Y.C.; et al. Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients: A randomised, controlled, open-label trial. Lancet Infect. Dis. 2016, 16, 819–827. [PubMed]
154. Larsson, A.; Tydén, J.; Johansson, J.; Lipcsey, M.; Bergquist, M.; Kultima, K.; Mandic-Havelka, A. Calprotectin is superior to procalcitonin as a sepsis marker and predictor of 30-day mortality in intensive care patients. Scand. J. Clin. Lab. Investig. 2020, 80,156–161.
155. Parke, Å.; Unge, C.; Yu, D.; Sundén-Cullberg, J.; Strålin, K. Plasma calprotectin as an indicator of need of transfer to intensive care in patients with suspected sepsis at the emergency department. BMC Emerg. Med. 2023, 23, 16. [CrossRef]
156. Sartelli, M.; Chichom-Mefire, A.; Labricciosa, F.M.; Hardcastle, T.; Abu-Zidan, F.M.; Adesunkanmi, A.K.; Ansaloni, A.; Bala, M.; Balogh, Z.J.; Beltrán, M.A.; et al. The management of intra-abdominal infections from a global perspective: 2017 WSES guidelines for management of intra-abdominal infections. World J. Emerg. Surg. 2017, 12, 29. [CrossRef] [PubMed]
157. Zilberberg, M.D.; Shorr, A.F.; Micek, S.T.; Vazquez-Guillamet, C.; Kollef, M.H. Multi-drug resistance, inappropriate initial antibiotic therapy and mortality in Gram-negative severe sepsis and septic shock: A retrospective cohort study. Crit. Care 2014,18, 596.
158. Huang, C.T.; Tsai, Y.J.; Tsai, P.R.; Yu, C.J.; Ko,W.J. Severe Sepsis and Septic Shock: Timing of Septic Shock Onset Matters. Shock 2016, 45, 518–524. [CrossRef]
159. Vazquez-Guillamet, C.; Scolari, M.; Zilberberg, M.D.; Shorr, A.F.; Micek, S.T.; Kollef, M. Using the number needed to treat to assess appropriate antimicrobial therapy as a determinant of outcome in severe sepsis and septic shock. Crit. Care Med. 2014, 42, 2342–2349. [CrossRef]
160. Panidis, D.; Markantonis, S.L.; Boutzouka, E.; Karatzas, S.; Baltopoulos, G. Penetration of gentamicin into the alveolar lining fluid of critically ill patients with ventilator-associated pneumonia. Chest 2005, 128, 545–552. [CrossRef]
161. Tsuji, B.T.; Pogue, J.M.; Zavascki, A.P.; Paul, M.; Daikos, G.L.; Forrest, A.; Giacobbe, D.R.; Viscoli, C.; Giamarellou, H.; Karaiskos, I.; et al. International Consensus Guidelines for the Optimal Use of the Polymyxins: Endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti-infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and Society of Infectious Diseases Pharmacists (SIDP). Pharmacotherapy 2019, 39, 10–39.
162. Bassetti, M.; Peghin, M. How to manage KPC infections. Ther. Adv. Infect. Dis. 2020, 7, 2049936120912049. [PubMed]
163. Cano, A.; Gutiérrez-Gutiérrez, B.; Machuca, I.; Gracia-Ahufinger, I.; Pérez-Nadales, E.; Causse, M.; Castón, J.J.; Guzman-Puche,J.; Torre-Giménez, J.; Kindelán, K.; et al. Risks of Infection and Mortality among Patients Colonized with Klebsiella pneumoniae Carbapenemase-Producing K. pneumoniae: Validation of Scores and Proposal for Management. Clin. Infect. Dis. 2018, 66,1204–1210. [CrossRef] [PubMed]
164. Burillo, A.; Muñoz, P.; Bouza, E. Risk stratification for multidrug-resistant Gram-negative infections in ICU patients. Curr. Opin.Infect. Dis. 2019, 32, 626–637. [CrossRef] [PubMed]
165. Giannella, M.; Pascale, R.; Gutiérrez-Gutiérrez, B.; Cano, A.; Viale, P. The use of predictive scores in the management of patientswith carbapenem-resistant Klebsiella pneumoniae infection. Expert Rev. Anti Infect. Ther. 2019, 17, 265–273.
166. Wilson, G.M.; Suda, K.J.; Fitzpatrick, M.A.; Bartle, B.; Pfeiffer, C.D.; Jones, M.; Rubin, M.A.; Perencevich, E.; Evans, M.; Evans,C.T.; et al. Risk Factors Associated with Carbapenemase-Producing Carbapenem-Resistant Enterobacteriaceae Positive Cultures in a Cohort of US Veterans. Clin. Infect. Dis. 2021, 73, 1370–1378.
167. DeWaele, J.J.; Coccolini, F.; Lagunes, L.; Maseda, E.; Rausei, S.; Rubio-Perez, I.; Theodorakopoulou, M.; Arvanti, K. Optimized Treatment of Nosocomial Peritonitis. Antibiotics 2023, 12, 1711.
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 17.07.2024 00:01:00
[~DATE_ACTIVE_FROM] => 17.07.2024 00:01:00
[ACTIVE_FROM_X] => 2024-07-17 00:01:00
[~ACTIVE_FROM_X] => 2024-07-17 00:01:00
[ACTIVE_FROM] => 17.07.2024 00:01:00
[~ACTIVE_FROM] => 17.07.2024 00:01:00
[SHOW_COUNTER] => 837
[~SHOW_COUNTER] => 837
[ID] => 8449
[~ID] => 8449
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => html
[~PREVIEW_TEXT_TYPE] => html
[TIMESTAMP_X] => 11.11.2024 13:59:29
[~TIMESTAMP_X] => 11.11.2024 13:59:29
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/upravlenie-sepsisom-zagadka-antibiotikoterapii-v-kontekste-individualizatsii-prinyatiya-resheniy/
[~DETAIL_PAGE_URL] => /library/articles/upravlenie-sepsisom-zagadka-antibiotikoterapii-v-kontekste-individualizatsii-prinyatiya-resheniy/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => upravlenie-sepsisom-zagadka-antibiotikoterapii-v-kontekste-individualizatsii-prinyatiya-resheniy
[~CODE] => upravlenie-sepsisom-zagadka-antibiotikoterapii-v-kontekste-individualizatsii-prinyatiya-resheniy
[EXTERNAL_ID] => 8449
[~EXTERNAL_ID] => 8449
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 17 июля 2024
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Управление сепсисом: загадка антибиотикотерапии в контексте индивидуализации принятия решений
[PREVIEW_PICTURE] => Array
(
[ID] => 5693
[TIMESTAMP_X] => 11.11.2024 13:59:29
[MODULE_ID] => iblock
[HEIGHT] => 3200
[WIDTH] => 5600
[FILE_SIZE] => 6003396
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/827/vz25xno5q9t4bw672gsnvomq4uiv9k8r
[FILE_NAME] => microorganism-magnified-science-reveals-nature-complex-workings-generated-by-ai.jpg
[ORIGINAL_NAME] => microorganism-magnified-science-reveals-nature-complex-workings-generated-by-ai.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 3f432ffa6514691a95c68d79ad520cc6
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/827/vz25xno5q9t4bw672gsnvomq4uiv9k8r/microorganism-magnified-science-reveals-nature-complex-workings-generated-by-ai.jpg
[UNSAFE_SRC] => /upload/iblock/827/vz25xno5q9t4bw672gsnvomq4uiv9k8r/microorganism-magnified-science-reveals-nature-complex-workings-generated-by-ai.jpg
[SAFE_SRC] => /upload/iblock/827/vz25xno5q9t4bw672gsnvomq4uiv9k8r/microorganism-magnified-science-reveals-nature-complex-workings-generated-by-ai.jpg
[ALT] => Управление сепсисом: загадка антибиотикотерапии в контексте индивидуализации принятия решений
[TITLE] => Управление сепсисом: загадка антибиотикотерапии в контексте индивидуализации принятия решений
)
[DETAIL_TEXT] =>
Ramasco, F.; Méndez, R.;Suarez de la Rica, A.; González de Castro, R.; Maseda, E.
Sepsis Stewardship: The Puzzle of Antibiotic Therapy in the Context of Individualization of Decision Making
J. Pers. Med. 2024, 14, 106. doi.org/10.3390/jpm14010106
АБСТРАКТ:
Основным недавним изменением, наблюдаемым в области инфекций у пациентов в критическом состоянии , стало всеобщее осознание необходимости более эффективного использования противомикробных препаратов, особенно в наиболее серьезных случаях за пределами применения простых и эффективных формул или жестких протоколов. Увеличение числа резистентных микроорганизмов, количественное увеличение масштабов хирургических операций и интервенционных процедур у пациентов с самым высоким риском, а также появление в последние годы новых антибиотиков (некоторые из которых очень специфически направлены против определенных механизмов резистентности, а другие с более широким спектром действия) заставили нас сместить наши вопросы с «с чем бороться» на «как лечить». В последнее время ведутся споры о том, как лучше подходить к антибиотикотерапии при сепсисе. Индивидуально подобранная и скорректированная доза, момент введения, цель и выбор схемы лечения указываются как факторы, имеющие особое значение для больных в критическом состоянии, у которых частота резистентных микроорганизмов, особенно среди группы Enterobacterales усложнили выбор антибиотикотерапии, требуя постоянного обновления знаний и создания мультидисциплинарных команд для противостояния инфекциям, трудно поддающимся лечению. В этой статье мы рассмотрели феномен возникновения резистентности к антибактериальным препаратам и попытались поделиться некоторыми идеями, такими как управление антибактериальной терапией, сохранение карбапенемов, а также организационные, микробиологические, фармакологические и информационные инструменты, которые мы рассматривали наиболее полезные и эффективные для принятия индивидуальных решений, учитывающих феномен множественной лекарственной устойчивости. Поэтому самая большая проблема принятия решений в этом контексте заключается в определении эффективного, оптимального и сбалансированного эмпирического лечения антибиотиками.
1. Введение
Основным недавним изменением, наблюдаемым в области инфекций у пациентов в критическом состоянии, стало всеобщее осознание необходимости более эффективного использования противомикробных препаратов, помимо применения простых формул и жестких протоколов. Рост резистентных микроорганизмов и количественный рост масштабных операций и интервенционных процедур у пациентов из группы наиболее высокого риска, а также появление в последние годы значительного числа новых антибиотиков привели к тому, что мы сместили наши вопросы с «чем лечить?» на «как лечить?» [1]. Существуют некоторые разногласия относительно того, как лучше всего подходить к лечению антибиотиками в этих случаях. Индивидуализированная и скорректированная доза, время введения и выбор режима отмечаются как факторы, важные для исходов при тяжелых инфекциях [2]. Частота резистентных микроорганизмов, особенно среди группы энтеробактерий, а также альтернатив лечения антибиотиками усложнили выбор соответствующего лечения, требуя постоянного обновления знаний и создания мультидисциплинарных команд для борьбы с инфекциями, которые трудно поддаются лечению [3]. В этой статье мы рассмотрим феномен возникновения антибактериальной резистентности и попытаемся поделиться некоторыми идеями и организационными, микробиологическими, фармакологическими и информационными инструментами, которые мы считаем наиболее полезными и эффективными для индивидуализированной терапии и принятия решений с учетом текущего контекста множественной лекарственной устойчивости. Поэтому самая большая проблема принятия решений в этом контексте заключается в определении эффективного, оптимального и сбалансированного эмпирического лечения антибиотиками.
2. Актуальная проблема антимикробной резистентности
Устойчивость к противомикробным препаратам в настоящее время является одной из самых серьезных проблем в лечении пациентов в критическом состоянии. Одной из основных причин устойчивости к противомикробным препаратам является безответственное и чрезмерное использование антибиотиков в животноводстве, сельском хозяйстве, ветиринарии и здравоохранении. Этому выводу способствовала инициатива «Единое здоровье», созданная Всемирной организацией здравоохранения (ВОЗ) (https://www.who.int/europe/initiatives/one-health (по состоянию на 15 января 2024 г), в рамках которой устойчивость к противомикробным препаратам считается наиболее актуальной чрезвычайной ситуацией в области общественного здравоохранения [4,5]. По оценкам, в 2019 году число смертей, связанных с устойчивостью к противомикробным препаратам, во всем мире составило 4,95 миллиона, из которых в общей сложности 1,27 миллиона были непосредственно связаны с устойчивостью к противомикробным препаратам, и, по оценкам, к 2050 году может быть достигнуто 10 миллионов смертей.Устойчивость к противомикробным препаратам среди грамположительных бактерий (GPB), по-видимому, стабилизируется или даже снижается, согласно недавнему исследованию, проведенному на пациентах с бактериемией, частота резистентности к грамотрицательным бактериям (GNB) растет и в настоящее время является причиной большинство случаев и смертей связаных с устойчивостью к противомикробным препаратам [6].
Однако тот факт, что существование инфекции, вызванной бактерией с множественной лекарственной устойчивостью, увеличивает смертность, является спорным. Влияние множественной лекарственной устойчивости на стоимость и продолжительность пребывания в больнице кажется очевидным, но строгое причинное влияние на смертность, несмотря на явную связь, является спорным. Существование неконтролируемых вмешивающихся факторов могло привести к выявлению такой связи в опубликованных исследованиях. Среди этих факторов можно выделить то, что, хотя множественная лекарственная устойчивость может сопровождаться терапевтической неудачей, в некоторых случаях такой неудачи не происходит. Однако использование более высоких доз и более продолжительное время лечения связано с появлением большего количества побочных эффектов, а также наблюдается более высокая распространенность колонизации и инфекций у пациентов с множественной лекарственной устойчивостью у пожилых пациентов и пациентов с ослабленным иммунитетом, что может привести к большему ограничению выбора препарата для лечения инфекций в отделениях интенсивной терапии (ОИТ) [7]. Эти данные делают устойчивость к противомикробным препаратам серьезной проблемой, требующей скоординированного глобального плана действий. ВОЗ разработала Global Action Plan for the Management of Antibiotic Resistance (GAP-AMR) и создала Global AntimicrobialResistance and Use Surveillance System (глобальную систему надзора за устойчивостью к противомикробным препаратам и их применением) для достижения целей программы. Среди основных ошибокк, с которыми мы сталкиваемся уже несколько лет, текущая проблема, как упоминалось ранее, сосредоточена на устойчивых GNB, сгруппированных вместе с некоторыми проблемными GPB под аббревиатурой ESKAPE [8,9].
Таким образом, во всем мире мы сталкиваемся с проблемой лечения супербактерий, и их распространенность в ОИТ трудно установить [9]. Для стандартизации терминологии в 2012 году множественная лекарственная устойчивость (MDR) определялась как приобретенная нечувствительность по крайней мере к одному препарату из трех или более категорий, экстремальная устойчивость определялась как нечувствительность по крайней мере к одному лекарственному средству во всех категориях, кроме двух или меньшего числа, и панрезистентность - как невосприимчивость всем агентам всех категорий [10]. Факторы риска множественной лекарственной устойчивости часто сосуществуют у пациентов в критическом состоянии и, тем более, в периоперационном контексте, когда реакция хозяина может быть девальвирована из-за нарушения функции иммунитета, вызванного острым или сопутствующими заболеваниями [11].
Основными индивидуальными факторами риска являются предыдущее воздействие антибиотиков в течение последних 90 дней, госпитализация в течение предыдущих 3 месяцев, длительная текущая госпитализация более 5 дней, наличие инвазивных устройств и предыдущая колонизация или инфекция микроорганизмами с множественной лекарственной устойчивостью. Местная эпидемиология с высокими показателями множественной лекарственной устойчивости является важным фактором риска, который необходимо учитывать [12]. Тяжесть заболевания как фактора риска множественной лекарственной устойчивости является спорным, хотя наличие септического шока является признанным фактором риска развития пневмонии с множественной лекарственной устойчивостью при нозокомиальной пневмонии и вентилятор-ассоциированной пневмонии как в европейских, так и в американских руководствах [13]. В недавнем многоцентровом исследовании, включавшем 2621 пациента в критическом состоянии с интраабдоминальным инфекции, не было различий в частоте множественной лекарственной устойчивости между группами пациентов с инфекциями с сепсисом или без него и с септическим шоком [14].
Стратегии, направленные на борьбу с устойчивостью к противомикробным препаратам, можно разделить на пять типов:
1. Профилактика снутрибольничных инфекций (инфекционный контроль в стационаре) и программы профилактики инфекций среди населения, основанные на гигиене и водопользовании;
2. Вакцинация как метод профилактики инфекции и ограничения применения антибиотиков;
3. Сокращение использования антибиотиков в немедицинских целях;
4. Увеличение инвестиций в разработку новых антибиотиков;
5. Сведение к минимуму длительность использования антибиотиков для лечения инфекций у человека. Именно этому последнему пункту способствует концепция рационального использования противомикробных препаратов (AMS ,СКАТ).
3. Управление противомикробными препаратами (СКАТ)
Целью СКАТ является правильное и эффективное назначение антибиотиков, позволяющее свести к минимуму возникновение резистентности, обеспечить устойчивое использование за счет оптимизации использования противомикробных препаратов в эмпирическом лечении и совершенствования таргетного лечения [15]. Однако в широком смысле программа такого типа должна преследовать цель создания «культуры инфекции», возглавляемой несколькими людьми, которые решающим образом влияют на быструю диагностику и правильное назначение противомикробных препаратов, на непрерывное обучение и внедрение новых методов диагнстики.Благодаря междисциплинарной философии работы эта программа не ограничивается созданием протоколов или членами команды. Существующие рекомендации относительно того, кто должен входить в состав ответственной группы, советуют, что группа должна состоять из экспертов или специалистов, более специализирующихся на инфекциях в ОИТ, микробиологов, фармакологов и врачи, специализирующиеся на инфекциях, независимо от их специальности [16]. Короче говоря, программы СКАТ, таким образом, приобретают значение «принятия на себя ответственности за то, за что вы не несете прямой ответственности» и, как было показано, улучшают исходы тяжелобольных пациентов с сепсисом, уменьшают возникновение резистентности в ОИТ и в больницах, значительно уменьшают ошибки и побочные эффекты, а также позволяют контролировать затраты [17–19]. Европейское общество интенсивной терапии (ESICM) создало очень интересную образовательную платформу под руководством Jan deWaele и Maurizio Cecconi для обучения созданию и развитию СКАТ (https://www.esicm.org/education/educational-initiatives/qualityimprovement). (по состоянию на 15 января 2024 г.).Реализация программы СКАТ начинается с выявления барьеров, которые мешают адекватному управлению инфекцией, в процессе постоянного совершенствования и поиска альянса с микробиологическими службами, рабочими группами по сепсису и т. д.
В этом смысле программы кодирования сепсиса (программы повышения эффективности лечения сепсиса) доказали свою эффективность в снижении смертности и являются еще одним примером важности вопроса «как» над вопросом «почему» [20,21]. Они были вдохновлены руководствами Surviving Sepsis Campaign (SSC) [22] и включают в себя набор клинических, организационных, аналитических и микробиологических инструментов, которые вместе с интенсивными обучающими и когнитивными средствами призваны улучшить результаты лечения сепсиса, определения приоритетов ухода [23]. Фокус этих программ ограничен первыми 24–36 часами оказания помощи пациентам с сепсисом и септическим шоком, и их философия включает оптимизацию и постоянное улучшение эмпирического лечения антибиотиками. Между этими типами моделей и программами СКАТ возникает все больше и больше координации, поскольку пациенты, которым наиболее срочно назначаются антибиотики, являются пациентами с сепсисом, и им требуется частая повторная оценка после первых 36–48 часов, чтобы провести деэскалацию, эскалацию или изменить их лечение. С этой целью важно знать местный уровень резистентности, используя местные рекомендации и рекомендации, опубликованные экспертами и научными обществами в качестве информационных материалов, чтобы иметь глубокие знания в области микробиологии, которые позволяют общаться с экспертами в нашей стране и больнице, и это позволяет нам улучшить фармакокинетические аспекты применения, учитывать возможную лекарственную аллергию и продвигать образовательные инициативы, направленные на более эффективное использование антибиотиков. В следующих разделах мы представим некоторые из этих инициатив, рассмотрим наиболее полезные классические концепции и предложим другие, более инновационные и авангардные аспекты [16].
3.1. "Начать умно" (Start Smart)
Эта модель подхода к тяжелой инфекции у пациентов в критическом состоянии включает в себя оптимизацию диагностики и стратегии деэскалации под эгидой программ СКАТ. Существование новых биомаркеров и быстрые микробиологические методы являются ключевым элементом этого нового подхода.
3.2. "Начни с умом, а затем сосредоточься"
Несколько лет назад правительство Соединенного Королевства выдвинуло лозунг “Start Smart and then focus” » https://www.gov.uk/government/publications/antimicrobialstewardship-start-smart-then-focus) (дата доступа: 17 январь 2024 г.), и мы считаем, что этот лозунг может быть хорошей моделью подхода к антибактериальной терапии сепсиса , поскольку разумное назначение антибиотиков тесно связано с персонализированным подходом, который не предусматривает одинаковое лечение всех очень серьезных случаев. Например, пациент с септическим шоком и с высокой бактериальной нагрузкой (при котором действует лозунг “hit fast and strong!” «ударить быстро и сильно!») не будет лечиться так же, как менее тяжелый случай, у которого есть подозрение на инфекцию, даже если оба могут быть госпитализированы в ОИТ [24].
Ключевые положения разумного начала антимикробной терапии включают:
Начинайте противомикробную терапию только при наличии явного подозрения или доказательства инфекции;
Имейте полное представление о лекарственной аллергии и других особенностях пациента;
Начинайте раннее и эффективное лечение пациентов с сепсисом и/или СШ;
Избегайте рутинного применения антибиотиков широкого спектра действия при лечении любой подозреваемой инфекции, не обращая внимания на сопутствующие клинические симптомы;
Будьте в курсе данных о местной микробиологии и моделях резистентности, преобладающих в отделении и стационарее;
По возможности получите посев перед началом терапии, принимая во внимание, что лечение не следует слишком сильно откладывать;
У тяжелобольных пациентов с септическим шоком используйте лучший из доступных антимикробных препаратов для устранения инфекции, а также контролируйте очаг, если это возможно, чтобы как можно скорее снизить бактериальную нагрузку [24].
Наконец, в качестве одного из самых ясных и твердых принципов «начинайте с умом» необходимо обеспечить документирование всех решений, связанных с инфекцией, в медицинской документации, поскольку очень часто лечение продолжается без необходимости, поскольку у врачей нет необходимой информации о причине начала приема этих антибиотиков, а также о том, когда они были начаты и как долго планируется продолжать их прием.Ситуация усугубляется, когда уход за пациентом передается от одного врача к другому в последовательные рабочие смены. Поэтому в записи рекомендуется указывать название антибиотика и его дозу, причину назначения, тяжесть заболевания, предполагаемую продолжительность лечения и дату оценки эффективности и коррекции (отмены) при необходимости.
3.3. «. . . А потом сосредоточься»: в чем это состоит
Вторая часть этого девиза напоминает нам об настоятельной необходимости пересмотреть клинический диагноз и рассмотреть возможность изменения, деэскалации или эскалации лечения. Благодаря современным достижениям в области быстрой микробиологической диагностики эта возможность может быть предоставлена менее, чем за 48 ч, что позволит принять решение о необходимости продолжения антибиотикотерапии теми же или другими антибиотиками и в какой дозе, а также задокументировать четкий план действий по принятию решения о назначении этих антибиотиков [25]. Каждый день необходимо задаться вопросом, адекватен ли антибиотик, оптимальна ли доза и нужен ли он пациенту [26].
Проблема лечения супербактерий: о чем следует думать, если АБТ неэффективна:
Позднее начало ;
Неподходящий спектр действия;
Неадекватный уровень в крови или недостаточное проникновение в очаг инфекции;
Наличие резистентных бактерий, не входящих в спектр назначенного антибиотика;
Наличие суперинфекции;
Неинфекционный источник лихорадки;
Очаг инфекции не контролируется должным образом.
4. Микробиология: ключевые понятия при сепсисе
Роль микробиологии при сепсисе является ключевой и требует от клиницистов наличия твердых микробиологических представлений, которые позволяют им правильно понимать информацию. Мы кратко рассмотрим некоторые моменты знаний, которые мы считаем важными в их ежедневном применении для улучшения результатов лечения [27,28].
4.1. Образцы и диагностические методы
Хорошая микробиологическая диагностика должна начинаться с правильного выбора клинического материала, предоставляемого в лабораторию; этот образец должен быть репрезентативным для подозреваемой инфекции, и при его обработке должны соблюдаться стандарты забора, отправки, документирования, и хранение.Микробиологическая культура продолжает оставаться эталонным методом, поскольку она не только позволяет охарактеризовать микроорганизмы, вызывающие инфекцию, но также позволяет провести соответствующие тесты на чувствительность к противомикробным препаратам выделенного образца. Однако необходимость быстрого получения результатов и технологический прогресс привели к развитию молекулярных методов, которые произвели революцию в микробиологической диагностике [29].
Среди быстрых методик в настоящее время выделяются две:
- MALDI-TOF : метод, основанный на масс-спектрометрии. MALDI-TOF в настоящее время позволяет идентифицировать микроорганизмы менее чем за 30 минут (ранее это занимало до 18 часов) посредством анализа их белкового профиля. Это, пожалуй, самый распространенный экспресс-метод [30].
- RT-PCR (полимеразная цепная реакция в реальном времени): молекулярный метод, позволяющий напрямую идентифицировать микробы в образце. Другие доступные молекулярные методы, по-видимому, сегодня менее распространены из-за их высокой стоимости [30], а системы быстрой микробиологической диагностики непосредственно на месте лечения (POC) становятся все более распространенными в ОИТ [31].
4.2. Минимальная ингибирующая концентрация (МИК)
При выполнении метода определения чувствительности к антибиотикам in vitro основная цель состоит в том, чтобы предсказать, можно ли лечить пациента с инфекцией, вызванной определенным микробом, антимикробным препаратом или следует выбрать другой вариант. Минимальная ингибирующая концентрация (МИК) определяется как самая низкая концентрация противомикробного препарата, которая подавляет рост микроорганизма после инкубации. МИК, следовательно, имеет решающее значение для подтверждения устойчивости микроорганизмов к противомикробному агенту, а также для мониторинга активности новых противомикробных агентов [32]. Классически мы знаем, что существуют антибиотики, зависящие как от времени, так и от концентрации. Антибиотики, зависящие от времени, считаются адекватными для лечения инфекции, вызванной бактерией, если при введении в дозах, считающихся терапевтическими (т. е. нетоксичными), они достигают концентрации в плазме в месте инфекции, по крайней мере, в четыре раза превышающей МИК в период между введениями. Концентрационно-зависимые антибиотики – это антибиотики, которые считаются адекватными для лечения инфекции, когда их пиковая концентрация в 10–12 раз превышает значение МИК. Для интерпретации тестов на чувствительность European Committee on Antimicrobial Susceptibility Testing (EUCAST) с 2019 года определил следующие категории [33]:
S: чувствительный. бактерия, ингибируемая in vitro концентрацией противомикробного препарата, что связано с высокой вероятностью терапевтического успеха.
I: (ранее промежуточная) чувствительность при увеличении экспозиции. В этом случае микроорганизм становится чувствительным при увеличении воздействия антибиотика; следовательно, существует высокая вероятность терапевтического успеха, поскольку воздействие агента увеличивается за счет корректировки режима дозирования или увеличения дозы препарата.
R: устойчивый. Лечение исследуемого микроорганизма данным антибиотиком имеет высокую вероятность терапевтической неудачи.
Чтобы включить противомикробный препарат в одну из этих категорий, требуется точка отсечения (BP), которая представляет собой МПК, определяющую включение в конкретную категорию. В настоящее время EUCAST определяет ВР в Европе и публикует их данные на веб-сайте с открытым доступом: http://www.eucast.org. (по состоянию на 17 января 2024 г.). По мере развития микробиологических, фармакокинетических, фармакодинамических и клинических знаний EUCAST периодически пересматривает BP и можно наблюдать, что ранее чувствительный микроорганизм с такой же МПК через год может быть определен как обладающий повышенной чувствительностью или даже как устойчивый.
МИК используется не только для определения концентрации противомикробного препарата, который будет получать пациент, но также и типа используемого противомикробного препарата, что позволяет снизить вероятность развития устойчивости микроорганизмов к конкретным противомикробным препаратам. Это не означает, что необходимо выбирать противомикробные препараты с более низким значением МИК, поскольку играют роль другие факторы, такие как фармакокинетика противомикробного препарата и концентрация, достигаемая в месте инфекции. Однако более низкое значение МИК приводит к более высокой вероятности достижения терапевтической цели и возможности меньшего развития механизмов токсичности и устойчивости, особенно мутационных. Важно отметить, что МИК определены для каждого микроорганизма в отношении каждого антибиотика; поэтому, строго говоря, тот факт, что один антибиотик имеет более низкую МИК, чем другой, для одного и того же микроорганизма, не имеет терапевтического значения. С другой стороны, ссылка на один и тот же антибиотик для определенного микроорганизма (например, МИК 1 г/мл или 8 г/мл), несмотря на то, что оба имеют «чувствительные» значения МИК, будет иметь терапевтические последствия. Продолжая пример, при МИК 8 г/мл для достижения оптимального лечения потребуется более высокая доза антибиотика, что может повысить токсичность или потребовать проведения продленной инфузии; для оценки второго чувствительного противомикробного препарата и принятия решения о его применении, синергизме и в некоторых случаях, может побудить к решению использовать другой антибиотик, несмотря на то, что этот другой антибиотик был классифицирован как «чувствительный», [33].
4.3. Концентрация антибиотика ,ингибирующая появление резистентных мутантов
"Профилактическая концентрация" (MPC) представляет собой МИК наименее чувствительного мутанта среди гетерогенной бактериальной популяции и представляет собой самую низкую концентрацию антибиотика, которая предотвращает или блокирует появление резистентных мутантов [34]. Существует окно концентраций, предотвращающее появление устойчивых мутантов. Подвергание бактериальной популяции действию противомикробного препарата обычно оказывает на нее пагубное воздействие, подавляя ее рост или вызывая ее гибель. Этот эффект не всегда очевиден, либо из-за наличия у микроба предшествующего механизма устойчивости, либо из-за появления устойчивых мутантов. Во время применения противомикробных препаратов отбор устойчивых мутантов может происходить динамически с течением времени. Это связано с дозой противомикробного препарата и частотой его применения, его фармакокинетикой в месте инфекции и временем, в течение которого достигаются концентрации, равные или превышающие MPC. Противомикробные препараты можно охарактеризовать как обладающие мутагенным действием и вызывающие мутации.
Однако устойчивые мутанты естественным образом обнаруживаются в бактериальных популяциях независимо от присутствия противомикробного препарата в окружающей среде. Каждая бактериальная популяция с разной частотой имеет устойчивые мутанты, сосуществующие с наиболее восприимчивой популяцией. При определенных обстоятельствах, когда бактериальная популяция подвергается действию противомикробного препарата, устойчивые мутанты могут стать доминантными, ингибируя наиболее чувствительную фракцию, но не устойчивых мутантов. Этот процесс известен как отбор устойчивых мутантов. В этих случаях вероятность отбора этих мутантов будет выше при неподходящем лечении, не адаптированном к фармакокинетическим/фармакодинамическим параметрам (Pk/Pd) и при использовании неадекватных доз [35]. МРС не является строго параметром антимикробной активности, который лучше определять по значению МИК и его правильной интерпретации; однако его можно использовать как таковое. Ее применение для ограничения или уменьшения селекции резистентных мутантов при использовании антимикробных препаратов с критериями Pk/Pd и, следовательно, для возможности избежать связанных с этим клинических неудач позволило бы предположить, что MPC является параметром активности. Кроме того, эта концепция имеет четкое клиническое применение и помогает определить наиболее подходящую дозу антимикробного препарата, по крайней мере, с точки зрения селекции мутантов, и дифференцирует антимикробные препараты, которые следует использовать при разработке рекомендаций по лечению и определению антимикробной политики [36
4.4. Важность ректального экссудата
В рамках микробиологических тестов у пациентов в критическом состоянии мы подчеркиваем роль, которую ректальный экссудат может играть в качестве эффективной и высокопродуктивной культуры для наблюдения, которая может определить, какой микроорганизм потенциально вызывает серьезную инфекцию и как действовать на основе результата. Результат этого теста, доступный через 24–36 часов, может быть очень полезен, когда микроорганизм-возбудитель не идентифицирован, чтобы помочь решить, что назначить в качестве окончательного эмпирического лечения антибиотиками. Большинство внутрибольничных инфекций являются эндогенными и происходят из микробиоты слизистых оболочек. Эта эндогенная инфекция возникает вследствие транслокации преобладающих аэробных микроорганизмов в слизистую оболочку кишечника, и вероятность диагностики зависит от плотности и площади колонизации. Значительное или неоднократное присутствие ГНБ в ректальном экссудате предполагает их избыточный рост в просвете кишечника, а связь между колонизацией кишечника и риском бактериемии, инфицирования микроорганизмами, продуцирующими карбапенемазы, или кандидемии, среди прочего, была подтверждена [37]. Состав кишечной микробиоты может измениться в течение 72 часов после появления нового микроорганизма или начала лечения антибиотиками; таким образом, определение микроорганизмов, составляющих эту микробиоту, и их чувствительности дает нам важные показатели, касающиеся возможной этиологии инфекций.
По этой причине рекомендуется активно искать наличие MDR у всех пациентов путем получения ректального экссудата, независимо от наличия получения культур из иного клинического материала. Это особенно актуально для пациентов с септическим шоком на момент поступления в ОИТ. Этот процесс следует проводить не реже одного раза в неделю на протяжении всего пребывания [24]. Аналогичным образом, при поступлении пациента в ОИТ необходимо заполнить «контрольный список» для выявления лиц с высоким риском носительства MDR, особенно устойчивых к карбапенемам [38].
Факторы риска носительства MDR :
1. Более 5 дней госпитализации в течение предшествующих 3 месяцев;
2. Пациенты, находящиеся в домах длительного ухода;
3. Известная колонизация или инфекция MDR ;
4. Продолжительность лечения антибиотиками более 1 недели в предыдущие 3 месяца (особенно цефалоспоринами третьего и четвертого поколений, хинолонами или карбапенемами);
5. Больные хронической почечной недостаточностью, находящиеся на диализе;
6. Больные с хронической патологией и высокой частотой MDR -инфекций (бронхоэктатическая болезнь, муковисцидоз и др.).
5. Фармакокинетика и фармакодинамика бета-лактамов
Учитывая нехватку эффективных лекарств против резистентных штаммов, Pk/Pd уделяется больше внимания при выборе антибиотиков и способах их введения [39]. Ввиду их важности и частоты использования мы сосредоточим внимание на изучении Pk/Pd бета-лактамов. Эти препараты зависят от времени: их антибактериальная эффективность связана с параметром, который учитывает время, когда их концентрации в плазме в четыре-восемь раз превышают МИК. По данным экспериментальных исследований и в зависимости от стабильности каждой коммерческой формы рекомендуется применять эти препараты в виде продленной инфузии продолжительностью от 1 до 4 часов или даже непрерывной инфузии, по крайней мере, когда рассматривается возможность лечения инфекций, вызванных MDR -возбудителями и это возможно из-за стабильности препарата. Хотя ожидаемая клиническая эффективность этого предложения не была продемонстрирована, либо из-за отсутствия эффекта, либо из-за недостаточного размера проведенных сравнительных исследований, либо даже из-за возможных методологических ошибок, такие влиятельные исследования, как DALI, продемонстрировавшие недостаточную экспозицию [40], и влияние врачебных сообществ сделали длительные инфузии бета-лактамов стандартом в ОИТ [41]. В этой связи интересно прокомментировать результаты недавнего РКИ с явно противоречивыми результатами по этой теме. Что касается меропенема, на сегодняшний день рекомендовано введение общей суточной фракционированной дозы, но при длительной инфузии в течение 3–4 ч. РКИ «Исследование MERCY» показало, что у пациентов в критическом состоянии с сепсисом или септическим шоком не было различий в смертности через 28 дней или в появлении резистентности между непрерывным инфузионным введением одного и того же препарата: доза 3 г в течение 24 ч и прерывистый прием (1 г каждые 8 ч, в течение 30–60 мин). Как указано в редакционной статье, сопровождающей исследование, поскольку инфузии не причиняют вреда и не влекут за собой дополнительных затрат, в рекомендациях трудно обсуждать даже опубликованы метаанализы, которые указывают на возможное снижение смертности [42]. Фактически, текущие консенсусные рекомендации нескольких обществ, хотя и признают низкий уровень доказательности, по-прежнему предполагают использование бета-лактамов с пролонгированной инфузией по сравнению с бета-лактамами с короткой инфузией у взрослых пациентов , особенно в случаях инфекции GNB [42].
Более того, в этом смысле существует интерес к введению антибиотиков не внутривенным путем для лечения определенных инфекций. Это относится к аэрозолям для профилактики и лечения респираторных инфекций, связанных с интубацией. Однако отсутствие достаточных РКИ [43], а также необходимость в специальных устройствах для правильной аэрозолизации означает, что аэрозолизация остается практикой, не рекомендованной Американским торакальным обществом (ATS), CDC и ESCMID [44–46]. Однако в клинической практике показания должны обсуждаться и персонализироваться для каждого случая. Хотя качественных клинических данных нет, существует большое количество экспериментальных данных о том, что у ослабленных пациентов с тяжелой пневмонией, вызванной бактериями с множественной лекарственной устойчивостью и с высоким риском неудачи лечения небулайзерная терапия антибиотиками может увеличить вероятность достижения очень высоких концентраций препарата в месте инфекции, что способствует терапевтическому успеху [47].
Несмотря на то, что до сих пор недостаточно доказательств в пользу новых бета-лактамов с ингибитором бета-лактамаз (BL-BLI), терапевтический лекарственный мониторинг (TDM) может решить определенные проблемы, если мы также будем помнить, что любой антибиотик имеет риск достижения «недостаточно стабильных» концентраций в плазме во время непрерывного инфузионного введения. Хотя постоянная или расширенная инфузия могут несколько снизить этот риск (поскольку во время введения будет, по крайней мере, легче достичь достаточных пиков в плазме), только TDM может подтвердить достижение желаемых уровней [48]. В отсутствие этого и благодаря широкому терапевтическому диапазону бета-лактамов у пациентов в критическом состоянии с высокими объемами распределения и возможным увеличением клиренса мы считаем, что предпочтительнее назначать самые высокие рекомендуемые дозы, а не отдавать предпочтение введению в более низких дозах [49].
6. Аллергия на бета-лактамы
Ярлык аллергии на бета-лактамы часто навешивается самими пациентами, и в большом количестве случаев из-за появления симптомов, которые даже не имеют основного иммунного механизма (диарея, головная боль и т. д.).Подсчитано, что этот термин применяется к 15% населения в целом и верен менее чем в 10% этих случаев (следовательно, только примерно к 1% населения) [50,51]. По этой причине важно заложить определенные основы, которые становятся все более необходимыми, чтобы не ограничивать использование группы антибиотиков, которая является первой линией лечения при многих инфекциях из-за ее более или менее широкого спектра действия, а также потому, что она недорогая и генерирует мало побочных эффектов для пациента. Строго говоря, истинной аллергией считаются только иммунологические реакции, опосредованные IgE (тип I по классификации Гелла и Кумбса). Проявления этих реакций разнообразны и обычно появляются в течение первого часа после введения препарата. Хотя не все эти реакции являются тяжелыми, наиболее тяжелые формы (анафилаксия и бронхоспазм) опасны для жизни и противопоказаны к последующему назначению препарата, вызвавшего их. Однако существуют и другие типы иммунологических реакций, опосредованных другими различными и иммунокомплексными антителами (реакции типа II и III) или Т-лимфоцитами (реакции типа IV), которые либо противопоказаны к такому введению, например: тяжелые кожные синдромы или могут потребовать осторожности и наблюдения при последующих введениях (например, цитопения). Теперь мы знаем, что бета-лактамы вызывают мало перекрестных реакций между собой из-за самого бета-лактамного кольца, а большинство перекрестных реакций происходит из-за сходства боковых цепей, которые являются общими для различных препаратов в группе, что делает такие перекрестные реакции частыми между отдельными бета-лактамными соединениями (например, между аминопенициллинами и аминоцефалоспоринами), но не между всеми из них [52]. Провокационная проба или пероральный тест по-прежнему являются золотым стандартом диагностики.Однако примечательно, что научные общества обычно считают скрининг по анамнезу недостаточным [53,54], в то время как многие авторы требуют его использования в экстренных случаях и предложить подход, который обеспечивает безопасное и немедленное введение препарата в тяжелых случаях, когда нет разумных альтернатив [55–58].
7. Что следует знать о старых антибиотиках
Интересное исследование, проведенное ESCMID в ряде европейских стран, США, Канаде и Австралии, показало, что такие препараты, как клоксациллин или азтреонам, доступны только примерно в половине этих стран, что не во всех из них был колистин, и только 5 из 38 имели препарат для внутривенного введения [59].Однако появление резистентности, особенно среди Г(-) бактерий, возродило интерес к использованию этого типа препарата с хорошей активностью против MDR -микробактерий, длительной историей применения и который, по данным данного исследования, был отодвинут на второй план из-за к токсичности, поскольку препарат имеет узкий спектр действия или по рыночным причинам [60]. Среди этих препаратов, проявляющих активность в отношении ГНБ, — фосфомицин, колистин и котримоксазол. Все они практически не обладают активностью в отношении анаэробов, а их активность в отношении Г (+) бактерий варьирует. Что касается фосфомицина, то, похоже, существует консенсус относительно его полезности только в качестве альтернативы нитрофурантоину или триметоприму-сульфаметоксазолу (TMP-SMX) при неосложненном цистите, вызванный GNB-продуцирующими бета-лактамазами расширенного спектра действия или карбапенемазами. В почечной паренхиме он не достигает достаточных концентраций, поэтому не рекомендуется в случаях осложненной инфекции мочевыводящих путей , бактериемии или других серьезных инфекционных заболеваниях иной локализации и должен применяться только если возбудителем является E. coli, поскольку K. pneumoniae и другие грамотрицательные возбудители инфекции являются частыми носителями гидролазы fosA, которая инактивирует препарат. Однако учитывая распространенность микроорганизмов с множественной лекарственной устойчивостью его использование возросло, особенно в сочетании с другими препаратами [61]. Колистин, обладающий известным нефротоксическим потенциалом и узким терапевтическим индексом, был ранее рекомендовался в схемах комбинированной АБТ для лечения карбапенемазы, продуцирующей GNB или Pseudomonas aeruginosa MDR, но наличие нового BL-BLI и растущее увеличение резистентности к колистину вследствие его применения в последние годы. способствовал тому, что от этой практики практику рекомендовали воздержаться. В настоящее время колистин практически выведен из употребления. для лечения инфекций, вызванных Acinetobacter baumannii, а также в случаях резистентности или непереносимость нового BL-BLI [62].
Котримоксазол играет ключевую роль при ИМП (осложненных или нет), как вызванных энтеробактериями, продуцирующими ESBL, так и резистентными к карбапенемам. Он теряет свою эффективность против Pseudomonas aeruginosa, но восстанавливает свою эффективность против стенотрофомонас мальтофилия, против которой он является одним из методов лечения [63]. Однако, как и в случае с колистином, в ОИТ часто показано использование альтернатив, таких как цефидерокол или комбинация цефтазидима/авибактама с азтреонамом [64]. Тигециклин обладает широким спектром активности, что делает его привлекательным вариантом лечения MDR-инфекции [65]. Однако сообщалось, что в некоторых случаях он может привести к неэффективности лечения, если его использовать в качестве монотерапии, поскольку он является бактериостатическим антибиотиком [66]. Таким образом, эти альтернативы, как правило, не следует рекомендовать для текущего эмпирического использования, а также, в контексте септического шока, в отделениях с высоким уровнем резистентности. Что касается Г (+) бактерий для лечения этих инфекций также стоит упомянуть TMP-SMX (дешевого и востребованного препарата для последовательного лечения), а также рифампицина и клиндамицина.Ни один из них не представлен в качестве препарата выбора по сравнению к более эффективным альтернативам, таким как ванкомицин, линезолид и даптомицин. TMP-SMX, по-видимому, рекомендуется только при инфекциях, требующих длительного лечения (бактериемия и внутрибольничная пневмония), а также при выявлении чувствительности к нему микроба [68]. Рифампицин и клиндамицин рекомендуются только в составе комбинированного режима в сочетании с лечением первой линии при определенных состояниях, таких как остеомиелит, некротическая пневмония, менингит и, особенно, в случае рифампицина, эндокардита протезированного клапана, за счет потенциально более сильного эффекта эрадикации рифампицина на материал протеза [69]. Наконец, стоит отметить потенциальную роль хинупристина-дальфопристина в альтернативном лечении инфекций, вызванных E. faecium, когда этот микроорганизм проявляет устойчивость к ванкомицину, линезолиду и даптомицину [59].
8. Что нужно знать о новых антибиотиках
Инициативы «10 антибиотиков к 2020 году», предложенные администрацией Обамы и способствующие патентованию новых противомикробных препаратов, позволили нам стать свидетелями в последние годы появления новых антибиотиков, которые улучшили арсенал, доступный для лечения инфекций, вызванных MDR-возбудителями и разумное использование которых повышает эффективность значение существования программ СКАТ [70]. Всесторонний обзор новых антибиотиков выходит за рамки данного обзора, и в литературе имеются очень хорошие обзоры, как специфические, так и генерические [71,72]. По этой причине, прежде чем перейти к более конкретным рекомендациям, мы кратко рассмотрим некоторые характеристики новых антибиотиков. Мы остановимся подробнее на цефтазидиме/авибактаме ввиду уже существующего клинического опыта и профиля цефтазидима/авибактама для эмпирического лечения в контексте множественной лекарственной устойчивости. Кроме того, более кратко, мы выскажем несколько интересных соображений относительно цефтолозана/тазобактама и цефидерокола. В Таб 1 показаны новые и наиболее важные препараты, которые уже имеются на рынке или сроко появятсяя на рынке, а также некоторые их ключевые характеристики, такие как доза и спектр действия.


8.1. Цефтазидим/Авибактам
Цефтазидим/авибактам представляет собой комбинацию существующего цефалоспорина цефтазидима (ингибитора синтеза бактериальной клеточной стенки, вызывающего гибель клеток) и нового ингибитора авибактама (инактиватора некоторых бета-лактамаз путем ковалентного ацилирования бета-лактамаз и которое само по себе не обладает антибактериальными свойствами). Добавление авибактама восстанавливает активность цефтазидима in vitro в отношении значительного числа бета-лактамаз, включая ферменты класса А по классификации Амблера (ESBL и карбапенемазы K. pneumoniae (KPCs), ферменты класса C (Amp C) и некоторыеферменты класса D (карбапенемазы OXA-48). Он не проявляет активности в присутствии ферментов класса В (металло-ß-лактамаз) [73]. Таким образом, он обладает спектром антипсевдомонадного действия цефтазидима и активен в отношении других ГНБ в целом и в отношении Enterobacterales в частности. Однако он не проявляет активности в отношении Acinetobacter, Stenotropomonas maltophilia, или анаэробы (при этом стоит напомнить, что необходимо дополнить препаратов с антианаэроной активностью при оИАИ). Антибиотик зарегистрирован FDA и EMA для лечения осложненных внутрибрюшных инфекций, осложненных инфекций мочевыводящих путей, внутрибольничной пневмонии и пневмонии, связанной с искусственной вентиляцией легких [74]. Эффективность цефтазидима/авибактама подтверждена значительными клиническими данными, и различные общества и эксперты рекомендуют его использование в качестве первой альтернативы при таргетном лечении инфекций, вызванных энтеробактериями, продуцирующими карбапенемазы, такими как OXA-48 или KPC, а также его альтернативное применение в качестве отдельного препарата или в сочетании с другими препаратами в других ситуациях, связанных с инфекцией Pseudomonas или карбапенемазами, кроме упомянутые выше [64,75–77].Реальные данные также указывают на благоприятные результаты, даже при инфекциях MDR5. [78]. Мы выделим EZTEAM, в которую вошли 569 пациентов в 11 странах, получавших лечение в первой или второй линии цефтазидимом/авибактамом, со всеми типами тяжелой инфекции, в из которых 89,3% были устойчивы к карбапенемам [79].
Что касается важности раннего введения препарата, то его использование в течение 48 часов после начала инфекции было связано с лучшими клиническими результатами [80]. Примером может служить исследование Jorgensen et al., в которое были включены 203 пациента с МDR-инфекциями, 117 из которых были устойчивыми к карбапенемам Enterobacterales (CRE) или Pseudomonas [81]. Из 203 пациентов 91 получил цефтазидим/авибактам в течение 48 часов от начала инфекции. Показатель клинического успеха, когда лечение было начато в течение 48 часов, составил 33,3%, а неудача — 18,6%. Каждые 24 часа отсрочки введения цефтазидима/авибактама значительно ухудшала результаты, тогда как регрессионная модель клинической неудачи показала, что цефтазидим/авибактам, введенный в течение 48 часов после сбора культуры, имел защитный эффект (ОШ: 0,409). Наша группа участвовала в другом интересном исследовании по оценке возможных преимуществ комбинации цефтазидим/авибактам при эмпирическом лечении [82]. В этом ретроспективном исследовании с участием 339 пациентов лечение цефтазидимом/авибактамом при инфекциях, продуцирующих карбапенемазу OXA-48 и KPC, сравнивали с лучшей доступной терапией, которая включала, среди прочего, карбапенемы с тигециклином, колистином или фосфомицином. Мы заметили, что лечение цефтазидимом/авибактамом было связано с более длительной выживаемостью. Интересно, что у наиболее тяжело больных пациентов результаты лечения цефтазидимом/авибактамом в монотерапии были лучше. Подобные исследования, а также другие исследования реальной практики подчеркивают преимущества использования цефтазидима/авибактама на ранней стадии сепсиса и у наиболее тяжелых пациентов.
По этой причине испанский консенсус оценивает тяжесть по шкале Чарльсона, среди прочего для принятия решения об эмпирической антибиотикотерапии и включает цефтазидим/авибактам в качестве одного из основных антибиотиков в эмпирическом лечении, аналогично меропенему, учитывая его очень широкий спектр действия в отношении МЛУ-ГНБ, а также его бактерицидную и синергическую способность [24]. Что касается синергизма, то очень интересно проанализировать его в контексте внутрибольничных инфекций в отделениях с большим количеством MDR-инфекций. Был изучен синергизм цефтазидима/авибактама с меропенемом, амикацином, азтреонамом, колистином и фосфомицином против мультирезистентных Klebsiella pneumoniae и Pseudomonas aeruginosa, что привело к полезной ассоциации, значительно снижающей бактериальную нагрузку в логарифмической форме и, в случае, меропенема и азтреонама, восстанавливая их активность в отношении этих микроорганизмов [83]. Таким образом, комбинация цефтазидима/авибактама и меропенема может иметь смысл при наличии MDR-микроорганизмов у пациентов с септическим шоком и высокой бактериальной нагрузкой.
8.2. Цефтолозан/Тазобактам
Цефтолозан/тазобактам — новый антибиотик, состоящий из нового цефалоспорина, связанного с тазобактамом, известным ингибитором β-лактамаз. Цефтолозан/тазобактам активен в отношении Pseudomonas aeruginosa MDR, в том числе устойчивых к карбапенемам, и против энтеробактерий, продуцирующих ESBL. Однако в случае CRE он не активен. Препарат одобрен FDA и EMA для лечения внутрибрюшных инфекций, осложненных инфекций мочевыводящих путей, а также внутрибольничных и вентилятор-ассоциированных пневмоний [84]. Отсутствие активности в отношении CRE ограничивает эмпирическое использование цефтолозана/тазобактама в некоторых ситуациях. Однако когда фокусом подозрения на сепсис является нозокомиальная пневмония, ее эмпирические результаты очень хорошие, и в этой ситуации его можно рекомендовать в качестве эмпирического лечения [85].Особо следует отметить исследование Timsit, являющееся частью ключевого исследование по показаниям к применению цефтолозан/тазобактам при пневмонии (ASPECT), в котором сравнивалась эффективность с точки зрения смертности дозы цефтолозана/тазобактама в дозе 3 г и меропенема при внутрибольничной пневмонии и вентилятор-ассоциированной пневмонии. Результаты были значительно лучше у пациентов, получавших цефтолозан/тазобактам, особенно в группе пневмонии, требующей искусственной вентиляции легких [86]. Это важно, учитывая, что пациенты с внутрибольничной пневмонией, у которых развивается дыхательная недостаточность настолько тяжелая, что требуется искусственная вентиляция легких, считаются наиболее клинически тяжелым подтипом с худшими исходами. Его практическое использование у пациентов в критическом состоянии также было подтверждено при различных типах инфекций, особенно в контексте инфекции Pseudomonas [87].
8.3. Цефидерокол
Цефидерокол представляет собой сидерофор цефалоспорина катехолового типа с очень мощной активностью in vitro против лекарственно-устойчивых CRE и неферментирующихо GNB. Он использует путь комплекса сидерофор-железо для проникновения через грамотрицательные мембраны посредством механизма, который сравнивали со знаменитым троянским конем. Попав внутрь бактерии, цефидерокол отделяется от железа и связывается с пенициллинсвязывающими белками, ингибируя синтез пептидогликана [88]. Этот антибиотик, по-видимому, более устойчив к гидролизу многих β-лактамаз и карбапенемаз. Его спектр действия — в принципе, самый широкий из антибиотиков, продаваемых для лечения ГНБ, включая антибиотики с множественной лекарственной устойчивостью и особенно продуценты металло-бета-лактамаз — привел к большим ожиданиям в отношении этого препарата [89]. Однако в амбициозном исследовании CREDIBLE-CR20 фазы 3, сравнивающем цефидерокол с лучшим доступным лечением (выбранным исследователем, с комбинацией до трех препаратов) при лечении тяжелых инфекций, вызванных GNB MDR и CRE, результаты были следующими: в обеих группах были получены одинаковые показатели клинического излечения, а смертность была численно выше в подгруппе пациентов с инфекцией Acinetobacter baumannii, получавших цефидерокол. Однако в этой подгруппе наблюдалась систематическая ошибка отбора, поскольку у этих пациентов чаще был шок, что ставит вопрос, были ли результаты хуже по этой причине [90]. Антибиотик был одобрен FDA и EMA для лечения GNB-инфекций, когда другие методы лечения могут оказаться неэффективными, а в реальной жизни результаты применения цефидерокола очень эффективны против карбапенемаз, продуцирующих Acinetobacter, Stenotropomonas, Pseudomonas и Enterobacterales [91].
9. Передовые подходы к новым антибиотикам
9.1. Сохранение карбапенемов
Концепция экономии карбапенема направлена на сохранение этого типа антибиотиков и разумное использование новых препаратов, которые могут участвовать в этой стратегии, принимая во внимание соответствующие меры инфекционного контроля и профилактики в рамках СКАТ [92]. Карбапенемы являются отличными антибиотиками и мощным оружием против устойчивых к лекарствам грамотрицательных бактерий из-за их широкого спектра действия, бактерицидного действия и способности преодолевать многие виды устойчивости.Их чрезмерное использование в условиях отсутствия на сегодняшний день безопасных альтернатив, особенно при эмпирическом лечении, породило проблему резистентности к карбапенемам [93].
Колонизация кишечника является основным резервуаром устойчивых к карбапенемам GNB (CRE) среди пациентов в критическом состоянии, а кишечная транслокация связана с повышенным риском участия CRE при последующих инфекциях. Неудивительно, что чрезмерное использование карбапенемов является одним из важнейших факторов, определяющих приобретение CRE, и связано с более высоким уровнем суперинфекции по сравнению с лечением без карбапенемов. При лечении карбапенемами существует повышенный риск развития резистентности из-за давления, оказываемого карбапенемами. на чувствительные штаммы, предоставляя устойчивым штаммам возможность их преодоления [94].
Среди стратегий, используемых для сохранения карбапенемов, выделим следующие [3]:
1. Оценка показаний к использованию карбапенемов при отсутствии явного риска MDR-возбудителей;
2. Установление того, у каких пациентов пиперациллин тазобактам все еще может играть важную роль, даже несмотря на отрицательные результаты исследования MERINO [95];
3. Оценка использования новых бета-лактамных антибиотиков и новых ингибиторов бета-лактамаз, применение которых уже имеется значительный клинический опыт, в качестве альтернативы карбапенемам при эмпирическом лечении пациентов с септическим шоком, особенно при наличии риска множественной лекарственной устойчивости в контексте ESBL и CRE [77];
4. Оценка комбинированного использования альтернатив на основе небета-лактамных препаратов и старых антибиотиков по некоторым показаниям [96];
5. Корректировка продолжительности терапии карбапенемами. Недавние данные показывают, что краткосрочное лечение (<10 дней) Enterobacterales не ухудшает клинические исходы [97];
6. Оценка роли деэскалации после тщательного микробиологического контроля, связанного с клинической оценкой в рамках СКАТа, для снижения потребности в продлении эмпирической терапии карбапенемами [98].
Сохранение карбапенемов (хотя карбапенемы по-прежнему должны занимать центральное место в антимикробной терапии пациентов в критическом состоянии) жизненно важно для успеха в улучшении результатов лечения септического шока. Использование новых бета-лактамов и ингибиторов бета-лактамов в программах управления антимикробной терапией и деэскалации, принимая во внимание желание сократить использование карбапенемов, представляют собой лучший курс действий в настоящем и, будем надеяться, в будущем, особенно в контексте распространенности трудно поддающихся лечению патогенов, таких как ESBL иCRE и устойчивость к Pseudomonas и Acinetobacter (Table 2) [27].

9.2. Роль новых антибиотиков в эмпирическом лечении нозокомиального сепсиса и септического шока
Несомненно, к наиболее сложным и противоречивым вопросам лечения сепсиса относятся определение персонализированной эмпирической терапии антибиотиками и определение роли новых антибиотиков в этой схеме [99].
Хотя таргетная терапия против ГНБ не лишена противоречий, сегодня у нас есть несколько рекомендаций по таргетному лечению против микроорганизмов с множественной лекарственной устойчивостью (продуцентов ESBL и/или карбапенемов, трудно поддающихся лечению Pseudomonas или других проблемных микроорганизмов, таких как Ацинетобактер или Стенотрофомонас). Эти рекомендации очень сбалансированы и показательны и имеют очень схожую основу, часто основанную на современных мнениях экспертов или опубликованных данных с использованием методологии GRADE. [64,75,76].
Помимо различий, связанных с позиционированием конкретных препаратов из-за противоречивых исследований и роли, которую в предыдущие годы играли старые антибиотики, используемые для лечения MDR-инфекций, позиционирование антибиотиков особенно вышеупомянутые препараты, которые были предметом многочисленных публикаций и последовательного клинического опыта, таких как цефтазидим/авибактам или цефтолозан/тазобактам очень четкое.
В то же время к новым молекулам, таким как цефидерокол или карбапенемы, связанные с ингибиторами бета-лактамаз, относятся консервативно, ожидая результатов в реальных условиях. Вместе с конкретными рекомендациями и консенсусом по лечению основных инфекционных синдромов, связанных с сепсисом (внутрибольничная пневмония, вентилятор-ассоциированная пневмония, вторичный и третичный перитонит, бактериемия, связанная с другими инфекциями, или инфекция мочевыводящих путей), эти новые молекулы могут оказать очень важную помощь при принятии решения об эмпирической терапии в рамках политики СКАТ при ситуациях высокой степени тяжести и риска смерти
Между тем, новые молекулы, такие как цефидерокол или карбапенемы, связанные с ингибиторами бета-лактамаз, лечатся консервативно, пока мы ожидаем реальных результатов. Вместе с конкретными руководящими принципами и консенсусом по Для лечения основных инфекционных синдромов, связанных с сепсисом (госпитальная пневмония, вентилятор-ассоциированная пневмония, вторичный и третичный перитонит, бактериемия, связанная с другими инфекциями или инфекциями мочевыводящих путей), эти новые молекулы могут оказывают очень важную когнитивную помощь при принятии решения об эмпирической терапии в рамках политики СКАТ в сценариях высокой тяжести и риска смерти.
Прежде чем приступить к обсуждению темы эмпирического лечения антибиотиками пациентов с септическим шоком нозокомиального происхождения, мы должны контекстуализировать это с имеющимися данными. Это область, в которой существует несколько теоретических моделей, все они поддерживаются. доказательствами, но не одинакового качества, которые защищены тщательно продуманными обоснованиями. Мы можем разделить эти модели на две категории, определяемые двумя консенсусами, упомянутыми выше. Одна из них — более консервативная французская модель, которая позиционирует использование новых антибиотиков в эмпирическом лечении и даже не под эгидой сохранения карбапенемов [100]. Другая модель иллюстрируется испанским консенсусом, который выступает за эмпирическое использование новых антибиотиков из-за их эффективности против MDR в контексте острой необходимости применения правильного лечения с первого раза, особенно при наличии факторов риска, связанных с инфекцией. и пациентом [24]. В этой области баланс колеблется между увеличением вероятности применения правильного эмпирического лечения и формированием резистентности, связанной с чрезмерным использованием новых антибиотиков.
Однако в литературе и, в частности, между этими двумя французскими и испанскими консенсусными руководствами есть некоторые общие положения [24,100]:
1. В случае септического шока в эмпирическом лечении допускается применение новых антибиотиков, особенно в случаях высокой локальной доли MDR и у носителей MDR -возбудителей в культурах эпидемиологического надзора, особенно если это ректальный экссудат;
2. Такие стратегии, как быстрая микробиологическая диагностика, деэскалация и сокращение продолжительности антибиотикотерапии, настоятельно рекомендуются для того, чтобы избежать побочных эффектов, связанных с чрезмерным использованием антибиотиков, независимо от выбранной схемы широкого спектра действия.
Представляется очевидным, что в данном сценарии интенсивной терапии и сепсиса имеет место чрезмерное использование антибиотиков, поскольку существует значительный процент пациентов, которым назначаются антибиотики широкого спектра действия, а инфекция не проявляется. Кроме того, эмпирические рекомендации часто сохраняются в течение длительного времени либо из-за отсутствия экспресс-тестов, либо из-за отсутствия СКАТ, которые требует ежедневной оценки лечения [94].
Такое злоупотребление имеет свои последствия.
Мы укажем некоторые из основных или тех, к которым в настоящее время имеется наибольший интерес:
1. Воздействие на микробиоту пациента, селекция MDR-бактерий и уничтожение привычной флоры, необходимой для жизнедеятельности, в том числе связанных с пищеварением и гомеостазом в целом [101];
2. Заражение Clostridium difficile [102];
3. Повышенная вероятность устойчивости к новым антибиотикам, которые можно приберечь для особых ситуаций, когда карбапенемы неэффективны [103]. Проблема в том, что во многих сценариях карбапенемы уже имеют высокий процент устойчивости, превышающий 20–25%. Это нельзя обобщать, существуют географические и местные различия, но это очень распространено [93]. Фактом всех эпидемиологических исследований в ОИТ является повышенное влияние микробов GNB MDR [77].
Когда дело доходит до принятия решения об эмпирической терапии в этом сценарии сепсиса и септического шока, как мы уже обсуждали, важно признать, что, хотя это и континуум, это две разные сущности. Существует разумный консенсус в отношении того, что в контексте сепсиса, который протекает без шока, можно подождать несколько часов, чтобы выбрать лучшее лечение, подтвердить наличие инфекции, получить соответствующие посевы и выбрать разумные антибиотики, которые, конечно, также могут включать карбапенемы и новые антибиотики [77]. Диапазон выбора антибиотиков в этом случае шире, а потребность в широте охвата может быть ниже. Те же рекомендации SSC указывают на необходимость обеспечить покрытие от MRSA или покрытие двумя антипсевдомонадаными препаратами, хотя, при отсутствии шока, можно не покрывать MRSA и назначать один антибиотик с антисинегнойной активностью [22].
Однако все это меняется при двух ситуациях:
1. У больных с шоком и тяжелыми сопутствующими заболеваниями;
2. У пациентов со значительными факторами риска развития MDR-бактерий, колонизированных MDR или поступивших в отделение с высоким процентом резистентности (порогом которого считается 20%). У пациентов с шоком и/или в условиях высокой вероятности инфицирования микроорганизмом с MDR или колонизации MDR существует консенсус в отношении выбора эмпирического лечения, охватывающего, в зависимости от очага инфекции, все возможные микробы, которые могли вызвать состояния, включая те вероятные MDRвозбудители, с наибольшей вероятностью успеха и вводимыми в наиболее оптимальных возможных дозах и формах [100].
По этой причине и в зависимости от контекста эмпирическая схема лечения антибиотиками должна включать в себя [104]
1. Защита от MRSA в целом и от энтерококка, если он возникает на фоне внутрибрюшной инфекции;
2. Защита от GNB, особенно трудно поддающихся лечению Pseudomonas и MDR GNB в целом (продуценты ESBL и карбапенемов, в частности), с использованием как минимум двух препаратов в течение первых 48 часов;
3. Оценка необходимости противогрибкового лечения, особенно при внутрибрюшной инфекции с факторами риска инвазивного кандидоза.
10. Рекомендации по эмпирическому лечению антибиотиками пациентов с септическим шоком
10.1. Предварительные соображения
При выборе эмпирического руководства в каждом сценарии, чтобы попытаться персонализировать лечение, мы должны учитывать загадку Pea и Viale [105]. Лечение антибиотиками тяжелобольных пациентов похоже на детскую головоломку, состоящую из нескольких частей, которые объединены в единое целое для содействия клиническому излечению и предотвращению развития резистентности: антибиотик и/или противогрибковый препарат и его свойства, место инфекции, ответственный возбудитель и его восприимчивость к лечению (МИК), атакже патофизиология пациента (Figure 1).

На эмпирические рекомендации большое влияние будет оказывать очаг инфекции, поскольку он может варьировать, например, от пневмонии или внутрибрюшной инфекции. Что касается важности снижения бактериальной нагрузки, интересно знать, как бактериальная нагрузка влияет на эффект антибиотиков, напоминая, что когда бактериальная нагрузка очень высока, цефтазидим/авибактам может быть наименее подвержен влиянию в этом контексте [106,107] . Наконец, как отмечают Bassetti и Montravers важным фактором является оценка местной распространенности инфекций с MDR [96]. Если процент устойчивости к карбапенемам превышает 20%, стратегия эмпирического лечения антибиотиками с использованием новых антибиотиков будет иметь смысл даже в случаях сепсиса, а не только при септическом шоке.
Таким образом, при принятии решения относительно первоначального эмпирического лечения антибиотиками пациентов с септическим шоком следует учитывать следующие предпосылки:
1. Бактериальная нагрузка в очаге инфекции обычно высокая. Чем выше бактериальная нагрузка в очаге инфекции, тем выше концентрация антибиотика, необходимая для подавления роста микроорганизма и тем больше вероятность выделения устойчивые мутанты, если введенная доза недостаточна. Воздействие антибиотика, необходимое для подавления возникновения резистентности, должно поддерживаться выше окна отбора мутантов. Контроль очага с помощью хирургического вмешательства или дренирования имеет важное значение, чтобы уменьшить бактериальную нагрузку, когда это возможно.
2. Поскольку мы не знаем микроорганизмы, вызывающие инфекцию, или характер их чувствительности к антибиотикам, мы можем ориентироваться на предполагаемый источник или на контрольные культуры, особенно ректальный экссудат в течение предыдущих 48–72 часов [99].
3. На решение влияет местная экология MDR бактерий. Высокий процент устойчивости к карбапенемам заставляет рассмотреть возможность применения новых антибиотиков [77].
4. Эмпирическое лечение должно быть активным против всех потенциально вовлеченных микроорганизмов и, по возможности, должно включать бета-лактамный антибиотик из-за его эффективности, спектра действия и бактерицидного действия. Среди доступных в настоящее время β-лактамных антибиотиков наиболее в случае любой вспышки из-за их антибактериального спектра и вероятности достижения оптимального уровня Pk/Pd против MDR -ГНБ рекомендуется использовать цефтазидим/авибактам и меропенем. В зависимости от очага инфекции и колонизации может потребоваться персонализация и могут существовать альтернативы: например, при внутрибольничной пневмонии мы могли бы включить цефтолозан/тазобактам, а если пациент колонизирован микробами, продуцирующими металло-бета-лактамазу, или стенотрофомонас мы могли бы использовать цефидерокол [77].
5. Фармакокинетика применения антибиотиков при сепсисе будет сильно зависеть от индивидуальных особенностей тяжелобольного пациента [108].
6. Пациент в состоянии шока подвергается риску необратимых повреждений, поэтому необходимо срочно снизить бактериальную нагрузку и контролировать иммунный ответ, одновременно используя органную поддержку.
7. Первоначальная эмпирическая терапия пациентов с септическим шоком и пневмонией должна включать два антибиотика и основываться на факторах риска для MDR возбудителей, обсуждавшихся выше, с первоначальным подходом, основанным на терапии широкого спектра действия, с последующим снижением дозы, если MDRвозбудители исключены [109].
8. Осложненная внутрибрюшная инфекция обычно полимикробная, нередко с участием ГНБ, анаэробов и энтерококков. Начальная эмпирическая терапия пациентов с септическим шоком в таких условиях должна включать бета-лактамы с ингибитором бета-лактамаз или карбапенем, а также покрытие от анаэробов, если бета-лактам не покрывает их, от энтерококков, если инфекция носит нозокомиальный характер, а у некоторых пациентов с факторами риска следует добавить дополнительное покрытие для видов Candida, отличных от Candida. альбиканс. В этой ситуации крайне важно контролировать источник, получать качественные образцы и быстро их обрабатывать [110].
9. Против Г (+) бактерий можно использовать даптомицин, линезолид, тедизолид или ванкомицин. Выбор зависит от локализации инфекции, функции почек и необходимости одновременного применения других нефротоксичных препаратов. Следует напомнить, что даптомицин не проявляют активность в легких [111].
10. Грибковая инфекция составляет 5% сепсиса. Чаще всего это вызвано Candida spp. и может быть предсказан по конкретным показателям, таким как Candida Score, а также по эпидемиологическим , микробиологическим данным и биомаркерам. Факторы риска частично совпадают с другими в ОИТ. Часто необходима профилактика и эмпирическая терапия, и эхинокандины предпочтительнее при Candida, но некоторые штаммы становятся устойчивыми, поэтому в некоторых случаях, таких как внутрибрюшная инфекция или случаи, когда трудно поддающиеся лечению, подходящей альтернативой может быть липосомальный амфотерицин B [112,113].
11 Соответствующие посевы следует всегда получать в зависимости от очага инфекции (посевы крови, ректальный экссудат или другие посевы для наблюдения, в зависимости от ситуации) перед началом или вскоре после первоначального эмпирического лечения антибиотиками. Сигнал тревоги, например, код сепсиса, должен быть активирован, чтобы обеспечить обработку проб с помощью систем быстрой микробиологической идентификации, и, если возможно, дежурный микробиолог должен быть предупрежден и с ним можно было взаимодействовать [28].
12. Через первые 24–48 ч лечение следует пересмотреть на предмет снижения бактериальной нагрузки и клинического улучшения. Методы быстрой диагностики позволят нам оценить отсутствие или присутствие энтеробактерий, продуцирующих БЛРС, или карбапенемазы, резистентность P. aeruginosa, MRSA, а также низкое значение -D-глюкана или его позитивность, что позволит сузить спектр антибиотиков или предположить необходимость изменения лечения [114].
13. Следует предусмотреть краткосрочное лечение. Биомаркеры, такие как прокальцитонин могут помочь нам в применении коротких схем лечения антибиотиками [115].
10.2. Индивидуализация антибиотикотерапии у пациентов в критическом состоянии
Хотя основные проблемы в условиях высокой распространенности резистентных штаммов заключаются в том, чтобы избежать задержки диагностики путем быстрого выявления микроорганизмов и особенностей их чувствительности, адекватное лечение осложняется особенностями наиболее тяжелобольных пациентов, у которых, помимо других симптомов, наблюдаются изменения внеклеточного объема, функции почек и иммунитета. Таким образом, тяжесть их состояния не только приводит к более высокому уровню смертности сама по себе, но также влияет на клинический ответ на антимикробное лечение. Если мы добавим к этому разногласия относительно имеющихся данных по другим аспектам антимикробного лечения, таким как использование комбинированной терапии, продолжительность лечения, сложность деэскалации и существующие средства на каждом рабочем месте в отношении клинического лечения,. лабораторных и организационных моментов, несомненно, не будет единого размера, подходящего всем, и хорошим началом будет персонализация лечения с учетом клинических особенностей. обстоятельства и микробиологические данные каждого пациента и каждого центра [116]. В чем тогда будет заключаться индивидуализация лечения антибиотиками пациентов в критическом состоянии, чтобы добиться максимальной эффективности? «Оптимизация» ищет лучший способ выполнить какое-либо действие или улучшить производительность чего-либо. «Эффективность» определяется как способность достигать желаемого или ожидаемого эффекта. «Индивидуализировать» значит приписать кому-то или чему-то характеристики, которые отличают его от других. Поскольку нашей основной первоначальной целью должна быть быстрая элиминация возбудителя, нашим приоритетом становится достижение максимальной эффективности лечения антибиотиками у каждого пациента. Хотя в литературе часто говорится об охвате антибиотиками, появляются новые доказательства того, что предполагают, что чувствительность микроорганизма к антибиотику in vitro имеет решающее значение и что знания этой чувствительности недостаточно для достижения наилучших результатов. Таким образом, фиксированные схемы лечения, независимо от места заражения и патофизиологического состояния пациентов, могут не дать ожидаемых результатов и оказаться неэффективными. С этой целью мы выделим, как предлагают разные авторы, эти разные уровни успеха на Figure 2 [117,118].

(а) Соответствующий (подходящий,приемлемый): определяется чувствительностью in vitro к возбудителю и ранним назначением противоинфекционного лечения. То, что соответствует опубликованному консенсусу и руководящим принципам, также считается приемлемым.
(b) Адекватный: в дополнение к «подходящим» характеристикам уровень успеха считается адекватным, если применяются и принимаются во внимание фармакокинетические и фармакодинамические стратегии, такие как более короткие интервалы введения, оценка физико-химических характеристик при подходе к различным местаминфекции, мониторинг уровней, избежание взаимодействий и т. д.
(c) Оптимальный: в дополнение к «подходящим и адекватным» характеристикам этот уровень успеха заключается во введении дозы, которая позволяет проникнуть в очаг инфекции в эффективной концентрации для ликвидации инфекции.
У пациентов в критическом состоянии вероятность получения недостаточных концентраций препарата для микроорганизмов, чувствительных in vitro, но с МИК, очень близкой к пороговому пределу, иногда наблюдается отсутствие эффективности in vivo, что приводит к терапевтической неудаче и возникновение устойчивости.Трудно достичь оптимальных схем лечения антибиотиками у пациентов в критическом состоянии без существенного изменения дозирования [39,105].
10.3. Раннее лечение антибиотиками у пациентов с септическим шоком
Современный стандарт назначения антибиотиков пациентам в критическом состоянии основан на раннем лечении и предполагает введение препаратов менее, чем за час после установления диагноза у наиболее тяжелых пациентов или при септическом шоке [22]. Хотя большая часть доступных данных не извлечена из клинических исследований, из-за очевидных этических трудностей с возможностью рандомизировать отсрочку лечения антибиотиками, начиная с публикации в 2006 году классического ретроспективного обсервационного исследования (в котором Кумар показал, что среди 2154 пациентов при септическом шоке на каждый час задержки антимикробной терапии наблюдалось среднее снижение выживаемости на 7,6%), все руководства настоятельно рекомендуют эту стратегию раннего начала антибактериальной терапии [119]. Последующие крупные наблюдательные исследования подтвердили эти результаты. Одно из них, многоцентровое международное исследование с данными 17 990 пациентов с септическим шоком, получавших антибиотики, подтвердило, что задержка в назначении антибиотиков связана с более высокой внутрибольничной смертностью [120]. В этом исследовании наблюдалось линейное увеличение риска смертности на каждый час задержки введения антибиотика с первого по шестой час после идентификации диагноза. Недавно, используя новые определения сепсиса, исследование 3035 пациентов показало, что у пациентов с септическим шоком назначение антибиотиков широкого спектра действия в течение 1 часа после установления диагноза снижает внутрибольничную смертность. Однако у пациентов с сепсисом без шока связь между введением антибиотиков в течение 1 ч и внутрибольничной смертностью не была статистически значимой. В моделях линейной регрессии, ограниченных пациентами, получившими антибиотики в течение первых 3 часов, у пациентов с септическим шоком наблюдался повышенный риск смертности на каждый час задержки введения антибиотиков, но у пациентов без шока такой тенденции не наблюдалось [121].
Это правда, что врачи не намеренно откладывают назначение антибиотиков широкого спектра действия, но верно также и то, что существуют трудности с быстрой постановкой диагноза и что может быть трудно распознать всех пациентов с высоким риском. В более тяжелых случаях, при большом количестве сопутствующих заболеваний и более четкими симптомами инфекции врачам зачастую проще назначить антибиотики раньше [122]. Кроме того, в больницах могут существовать организационные правила, которые могут препятствовать раннему назначению антибиотиков [123].
Барьеры для раннего назначения антибиотиков:
Отсутствие знаний;
Отсутствие правильной оценки тяжести и позднее распознавание сепсиса;
Повышенная нагрузка на персонал;
Трансфер больного (в операционную, на анализы и т.п.);
Возможны атипичные проявления без лихорадки и спутанности сознания;
Задержки из-за других диагностических тестов и медленного сбора проб для микробиологического исследования;
MDR-инфекции и нераспознавание факторов риска MDR ;
Ожидание проведения посева крови перед введением антибиотика;
Очень важно не понимать, что давать неподходящий антибиотик - это все равно что не давать никакого или даже хуже.
Не указан порядок введения антибиотиков и какой антибиотик широкого спектра действия является «ключевым»;
Необходимость получения разрешения на назначение препарата у другого специалиста, заведующего отделением или аптеки перед началом лечения.
Подход, позволяющий избежать задержки в назначении антибиотиков:
Наличие артериальной гипотензии у пациента с подозрением на инфекцию следует расценивать как септический шок при отсутствии альтернативного объяснения; Невозможность перевезти или транспортировать пациента до начала лечения антибиотиками;
Если в таких ситуациях требуется назначение антибиотика, необходимо обеспечить его немедленное введение (сообщалось, что задержка с момента назначения лечения до момента его введения может составлять в среднем до 3 часов);
Комбинированные схемы лечения следует назначать в первую очередь с основным антибиотиком (самого широкого спектра действия);
Содействуйте образованию, обучению и командной работе, чтобы сократить время администрирования.
Ранняя антимикробная терапия может иметь негативное влияние с точки зрения токсичности и затрат, особенно при менее тяжелых инфекциях и сепсисе без шока, а также может способствовать задержке постановки диагноза у некоторых первоначально неинфицированных пациентов, таких как хирургические пациенты в критическом состоянии, в которым особенно трудно отличить последствия воспалительной реакции, вызванной хирургическим вмешательством или другими патологическими обстоятельствами, от реакции, вызванной инфекцией. В последнее время большее значение придается также влиянию лечения антибиотиками в ОИТ на микробиоту, его влиянию а на иммунитет и исход пациентов, а также стратегиям поддержания регулярной кишечной флоры, но это выходит за рамки данного обзора.
Реальность такова, что литература о связи между временем начала лечения антибиотиками и смертностью при сепсисе противоречива, почти исключительно носит наблюдательный характер и имеет высокий риск систематической ошибки. Источники систематической ошибки включают отсутствие дифференциации между сепсисом и септическим шоком, недостаточная корректировка с учетом потенциальных искажающих факторов и сочетание высокого роста смертности, связанного с поздней диагностикой заболевания [124].
Недавние метаанализы не дали окончательных результатов в отношении пользы лечения антибиотиками, поэтому, строго с точки зрения научных данных, нельзя рекомендовать чрезвычайно быстрое введение антибиотиков, по крайней мере, при сепсисе; однако, возможно, это это не так при септическом шоке [125]. Тем не менее, тот факт, что антибиотик следует назначать в первые несколько часов, по-прежнему является обязательным в рекомендациях SSC, хотя это и привело к критике со стороны IDSA по поводу преждевременного использования у пациентов без шока [126]. В будущем, возможно, потребуется уточнить, каково истинное определение понятия «ранний», каков временной интервал, в течение которого назначение антибиотиков является наиболее эффективным в борьбе с бременем инфекции, и как интерпретировать спектр тяжести, крайней срочности и скорости, необходимой для введения антибиотиков. По-видимому, существует достаточно сильная связь между ежечасным приемом антибиотиков и смертностью от септического шока, но менее выраженная связь для сепсиса без шока. Имеются данные, показывающие, что интервалы введения антибиотиков до 90 минут у пациентов с сепсисом без шока не имеют значения. По-видимому, риск повышенной смертности у пациентов с сепсисом без шока возрастает примерно через 3-5 ч до начала применения антибиотиков и в последующем, однако данные, позволяющие точно определить влияние интервалов от 3 до 5 ч, немногочисленны и несовершенны. В случае септического шока, несмотря на то что в большинстве исследований имеются многочисленные погрешности, а линейная связь между задержкой и смертностью явно является статистической ассоциацией и результатом, в частности, неиспользования в анализе сбивающих факторов, представляется, что оперативность начала течения более важна [127].
Учитывая то, что было сказано ранеер, возможно, в настоящее время хорошей отправной точкой было бы продолжение быстрого введения антибиотиков, например, всегда в течение первых 3 часов, как это было предложено IDSA. Однако, следует приложить усилия быстро поставить диагноз до введения препарата (или, по крайней мере, получить ранние и выгодные образцы) и иметь достаточно времени для размышлений и консультаций, если необходимо, по выбору оптимальной антимикробной схемы для каждого пациента. В наиболее тяжелых случаях септического шока целесообразно, чтобы оптимальное время введения препарата наступило до третьего часа и ближе к первому часу, поскольку быстрое снижение бактериальной нагрузки за счет контроля над очагом инфекции и адекватной и ранней антибиотикотерапии являются ключевым моментом.
10.4. Важность контроля очага инфекции в хирургических отделениях
Лечение инфекции в ОИТ у хирургических пациентов представляет свои собственные проблемы, поскольку, как и в других условиях, диагностика часто затруднена, а множественная лекарственная устойчивость и фармакокинетические изменения представляют собой проблемы. Необходимость контролировать очаг инфекции хирургическим и/или чрескожным дренирование усложняет ситуацию [128]. Восстановление анатомии и функции одинаково важно и может быть выполнено одномоментно, хотя иногда это бывает затруднительным. Как правило, меры по контролю очага инфекции не следует откладывать, за исключением тех ситуаций, когда предпочтительнее отграничение нежизнеспособных тканей, например, при инфицированном некротическом панкреатите или в ситуациях, когда доступ к источнику инфекции затруднен. В настоящее время возобновился интерес к так называемой хирургии контроля повреждений при внутрибрюшной инфекции, которая включает первоначальный контроль инфекции с использованием "открытого живота", чтобы облегчить последующую санацию брюшной полости и свести к минимуму риск компартмент-синдрома [129]. Окончательная анатомическая реконструкция будет выполнена позже, через 24–72 часа. При таком подходе выбор системы временного закрытия брюшной полости представляется важным, при этом терапия отрицательным давлением является распространенным вариантом, поскольку она приводит к меньшему количеству свищей, меньшему количеству абсцессов и более высокой выживаемости [129]. В руководствах SSC рекомендуется определить анатомический источник инфекции, который может потребовать контроля и устранить его как можно скорее с логистической и медицинской точки зрения. Подход должен быть индивидуализированным: визуализирующие исследования очень важны и не должны ограничиваться брюшной полостью [130]. Нет смысла откладывать такой контроль, если нет значительных метаболических или коагуляционных изменений или если у пациента очень нестабильная гемодинамика. Выбор подходящего времени для хирургического контроля очага является предметом дискуссий, и следует соблюдать междисциплинарный подход, руководствуясь тяжестью инфекции, темпами ухудшения состояния пациента, предполагаемым источником инфекции. Есть отдельные данные, свидетельствующих о том, что при наиболее тяжелых инфекциях контроль очага инфекции дает лучшие результаты, если его проводить через 2–6 ч после постановки диагноза [131].
Концепция управления заключается в создании бригад, занимающихся контролем очага, с доступностью диагностических и терапевтических методов, включая интервенционную радиологию, 24 часа в сутки, что может помочь выбрать более подходящее лечение и реализовать хирургические стратегии, улучшающие исходы у этих пациентов [132].
Хирургические инфекции, в частности инфекции брюшной полости, являются наиболее сложными среди нозокомиальных инфекций: они связаны с более длительным пребыванием в стационаре, большим количеством пациентов в состоянии шока, более частым развитием почечной недостаточности и более высокой смертностью. Их микробиологическая картина обычно полимикробна с незначительным присутствием грибов, трудностями в определении патогенной роли каждого из них и их вклада в общее состояние пациента, а также растущим присутствием организмов с множественной лекарственной устойчивостью, особенно карбапенемазопродуцирующих организмов [110].
Воспаление, связанное с хирургической травмой, означает, что традиционные критерии системной воспалительной реакции присутствуют регулярно и, следовательно, малопригодны для диагностики инфекционного процесса, как и аналитические маркеры инфекции. Точно так же мало пользы приносят измерения лейкоцитоза, величины PCT (хотя повышение последнего, удваивающее его исходное значение в первые 24 ч после операции, может помочь предупредить о неадекватности контроля очага инфекции) или другие признаки, такие как гипотония или олигурия, которые могут быть связаны с послеоперационными осложнениями неинфекционного происхождения [133]. Все это усложняет процесс принятия решения о том, начинать или не начинать антибиотикотерапию и какими препаратами. Кроме того, если тяжелое состояние пациента персистирует, деэскалация также будет затруднена. Если предполагается отличный контроль, антибиотикотерапия абдоминальной инфекции должна быть ограничена 3-5 днями.
Это продемонстрировано при нозокомиальных инфекциях, даже у пациентов с APACHE > 10, без увеличения числа релапаротомий или повышения смертности [134]. Таким образом, клиническая настороженность по-прежнему остается лучшим оружием для контроля возможной неудачи в борьбе с очагом инфекции. Добавление параметров органной дисфункции (SOFA score) может выявить пациентов, которым потребуется дополнительный контроль очага инфекции. Методы визуализации, такие как УЗИ и КТ, также очень важны в данном случае, поскольку они добавляют возможность чрескожного дренирования абсцессов, сопровождающихся развитием органной дисфункции, при наличии постоянного квалифицированного персонала [135].
Оценка остаточной инфекции после контроля очага инфекции может помочь оценить роль определенных вмешательств и корректировать антибиотикотерапию. Для этих целей под остаточной инфекцией обычно понимают неполное чрескожное дренирование абсцесса или остаточные некротические ткани, который невозможно удалить, а под продолжающейся контаминацией понимают источник инфекции (например, перфорацию, которая не может трансформироваться в фистулу и продолжает дренироваться в брюшную полость) [136].
10.5. Оптимизация лечения антибиотиками согласно гипотезе Кумара
В связи с актуальностью для современной концепции сепсиса и возможного значения при выборе и назначении антибиотикотерапии, мы посвятим раздел комментариям теории Кумара [106]. После того, как с появлением пенициллина произошло снижение смертности от инфекционных причин, абсолютные показатели смертности остаются постоянными и сегодня, несмотря на появление новых противомикробных препаратов. Это связано с более высокой распространенностью резистентных микроорганизмов, более высокой частотой сепсиса среди пожилых людей и существованием более агрессивных микроорганизмов [137]. Другие поддерживающие меры и методы лечения, не связанные с антибиотиками, были подвергнуты сомнению после десятков исследований.Гипотеза Кумара заключается в том, что протестированные методы лечения оказались безуспешными, поскольку процесс заболевания не был правильно интерпретирован [138]. Альтернативная патофизиологическая модель, предложенная Кумаром, предполагает существенное значение бактериальной нагрузки как основного фактора дисфункции органов и, следовательно, предполагает, что именно бактериальная нагрузка должна определять схему лечения антибиотиками при сепсисе. Тогда ключом к улучшению результатов может стать скорейшее снижение этого бремени на основе более эффективного применения доступных антибиотиков и других стратегий, направленных на эту цель. Поэтому раннее введение и использование бактерицидных препаратов становится основополагающим в этой модели.
Микробиологическая модель сепсиса, как и иммунологическая модель, не способны полностью объяснить патофизиологию заболевания. Это понятно, если учесть ключевой элемент смертности при сепсисе - концепцию необратимого шока, которая предполагает, что шок, независимо от его этиологии, можно переживать лишь ограниченное время и что после его возникновения он становится необратимым, с неизбежным прогрессированием до хронического критического заболевания или смерти, если не обратить его вспять в течение короткого периода времени. Параллельным понятием в реанимации является гемодинамическая нестабильность.Эта концепция связана с «золотым часом», демонстрируемым при травматическом геморрагическом шоке, но применима и к различным формам критических состояний.
Концептуальная модель, включающая ключевые элементы модели сепсиса, должна учитывать следующее:
Во-первых, понимание того, что существует порог, при достижении которого медиаторы воспаления будут ассоциироваться с клеточной дисфункцией и повреждением тканей, проявляющимся как септический шок, и что этот порог может варьировать у разных людей: у лиц с плохим сердечно-легочным резервом шок разовьется раньше и на более низких уровнях клеточной дисфункции или повреждения тканей, в то время как молодым, здоровым пациентам может потребоваться значительно более высокая степень воспаления, чтобы достичь того же порога шока.
Во-вторых, появление нового элемента, такого как наличие шока, обычно проявляющегося в виде рецидивирующей или стойкой гипотензии, особенно если он проявляется плохой перфузией, которая не восстанавливается, и гемодинамической некогерентностью, в свою очередь, ставит пациентов на путь к необратимому повреждению органов. В какой-то неопределенный момент после возникновения гипотонии, в зависимости от степени гипотонии, влияния сопутствующих заболеваний и генотипа пациента, у пациента будет высокий риск развития хронического критического заболевания или смерти.
Из-за генетических вариаций хозяина и возбудителя, а также клинической изменчивости инфекции, точный момент, когда сепсис становится необратимым для каждого пациента, сегодня не может быть известен заранее;тем не менее, прогрессирование будет одинаковым для всех пациентов, которые его достигнут. Согласно модели Кумара, в основе септического шока лежит микробная нагрузка. Скорость достижения ее снижения до субкритического порога после начала инфекции будет иметь первостепенное значение для выживания, сводя таким образом к минимуму период, в течение которого существует достаточно микроорганизмов для возникновения шока, ограничивая риск достижения точки, когда выздоровление уже невозможно (Figures 3 и 4).


Эта модель позволяет предположить, что септический шок и сепсис - это две разные сущности, а не разновидности одного и того же заболевания. Основное различие между ними заключается во времени, отведенном для наступления необратимой и невосстановимой органной недостаточности. Простой факт наблюдения в обоих случаях клинических проявлений гипотонии, лактат-ацидоза и исчерпания компенсаторных реакций, а также значительные различия в уровне смертности при септическом шоке (более 40%) и сепсисе (около 10%) заставляют нас думать об этих двух состояниях, по мнению Кумара, как о разных явлениях.
Таким образом, согласно этой модели, важными факторами, которые следует учитывать при уменьшении бактериальной нагрузки при септическом шоке, являются:
1. Ранняя антимикробная терапия:
2. Антимикробная активность:
Обеспечить бактерицидную противомикробную активность;
Оптимизировать фармакокинетические показатели (препараты, зависящие от времени; и концентрационно-зависимые антибиотики)
Используйте комбинированную терапию с антибиотиками, имеющими разные механизмы действия.
3. Дополнительная терапия: контроль очага и инфузионная терапия для обеспечения перфузии и гемодинамической стабильности.
10.6. Продолжительность лечения антибиотиками в рамках программ управления АБТ
В рамках программ управления существует несколько причин попытаться сократить продолжительность лечения антибиотиками. Изменения в микробиоте усиливаются с каждым днем лечения антибиотиками. Последствия этого изменения недостаточно изучены, но оно может способствовать увеличению риска сепсиса в последующие месяцы [139]. Повышенная частота побочных эффектов также является поводом для беспокойства, включая появление резистентности к противомикробным препаратам, острой почечной недостаточности или инфекций, вызванных C. difficile. С каждым днем продления лечения антибиотиками риск увеличивается [140]. Что касается раннего прекращения лечения антибиотиками, мы должны учитывать две разные ситуации. С одной стороны, у пациентов с подозрением на инфекцию, у которых культуры, выделенные до начала лечения антибиотиками, отрицательны или демонстрируют незначительную контаминацию, лечение антибиотиками должно быть прекращено.
У пациентов с подозрением на вентилятор-ассоциированную пневмонию, но с отрицательным результатом БАЛж, Raman et al. предложили раннее прекращение лечения антибиотиками, не обнаружив различий в смертности (4 дня лечения против 9 дней). Между тем, появление бактерий с множественной лекарственной устойчивостью было явно менее частым в группе краткосрочного лечения. (7,5% против 35,7%) [141]. У пациентов в критическом состоянии с микробиологическим подтверждением инфекции имеются данные, свидетельствующие о не меньшей эффективности коротких схем лечения по сравнению с длительным лечением, главным образом при нозокомиальных пневмониях, связанных с искусственной вентиляцией легких и послеоперационной внутрибрюшной инфекции, при этом в большинстве случаев достаточно 7-дневного лечения антибиотиками [134]. Клиническое исследование, проведенное на пациентах с осложненной внутрибрюшной инфекцией (это не были исключительно тяжелобольные пациенты), показало даже, что продолжительность лечения антибиотиками можно безопасно сократить до 3–5 дней при условии адекватного контроля очага инфекции [142]. В исследовании, проведенном у гемодинамически стабильных пациентов с ГНБ-бактериемией, Yahav et al.продемонстрировали не меньшую эффективность короткого режима лечения (8 дней) по сравнению с длительным режимом лечения (14 дней) [143]. При неосложненной стафилококковой бактериемии, текущие рекомендации по-прежнему указывают на необходимость 14-дневного лечения антибиотиками, но в настоящее время проводятся клинические исследования. сравнивая продолжительность 7 дней с 14 днями [144], а также существуют обсервационные исследования, подтверждающие использование короткого режима у пациентов с бактериемией, вызванной S. aureus, при отсутствии эндокардита, отдаленных метастатических очагов или наличия имплантов [145]
Chastre et al . не обнаружили различий в смертности при краткосрочном лечении у пациентов с вентилятор-ассоциированной пневмонией или в частоте рецидивов инфекции, за исключением пневмонии, вызванной P. aeruginosa, которая была выше в группе краткосрочного лечения [146]. В недавнем клиническом исследовании, которое было остановлено из-за отсутствия набора пациентов, сравнивали продолжительность лечения 8 и 15 дней у пациентов с вентилятор-ассоциированной пневмонией. вызываемый P. aeruginosa. Эти исследователи не смогли продемонстрировать не меньшую эффективность короткого режима лечения с точки зрения первичного результата в виде рецидива легочной инфекции и смертности [147]. Несмотря на эти результаты, оптимальная продолжительность лечения антибиотиками 7 дней можно установить даже при инфекциях, вызванных P. aeruginosa, поскольку потенциальная польза от продления лечения антибиотиками, вероятно, перевешивается вредом, вызванным ненужным продлением терапии [148]. У пациентов, поступившие в ОИТ в связи с COVID-19, вероятно, должны принимать индивидуальные решения, а в некоторых случаях может потребоваться продление лечения антибиотиками из-за очень высокого уровня вторичных инфекций и рецидива [149]. Использование биомаркеров также может помочь сократить продолжительность лечения антибиотиками у пациентов в критическом состоянии. ПКТ является биомаркером, уровень которого увеличивается в основном во время бактериальных инфекций, но также, в меньшей степени, при воспалительной реакции или хирургической травме [150,151]. Несколько клинических исследований показали, что продолжительность лечения антибиотиками с корректировкой ПКТ можно безопасно сократить у пациентов в критическом состоянии. Исследования, в которых участвовало большинство пациентов, проводились Bouadma et al. и De Jong et al. Bouadma et al. продемонстрировали, что у пациентов было больше дней без антибиотиков в группе ПКТ, в которой лечение антибиотиками прекращалось, когда уровень ПКТ составлял менее 0,5 нг/мл или снижался как минимум на 80% от пиковой концентрации [152]. De Jong et al. продемонстрировал у 1575 пациентов в критическом состоянии, что использование того же протокола позволило сократить среднюю продолжительность лечения антибиотиками до 5 дней по сравнению с 7 днями в контрольной группе и даже обнаружило снижение 28-дневной смертности [153]. Обсервационное исследование показало, что у критических послеоперационных пациентов с вторичным перитонитом алгоритм на основе ПКТ может быть полезен для сокращения продолжительности лечения антибиотиками (5,1 дней против 10,2) [133]. Недавно было высказано предположение, что кальпротектин может превосходить прокальцитонин в качестве биомаркера при сепсисе и индикатора необходимости интенсивной терапии у этих пациентов [154,155]. Наша общая рекомендация по продолжительности лечения антибиотиками у пациентов в критическом состоянии составляет 7 дней, которую можно дополнительно сократитьвод контролем динамики ПКТ. В случае абдоминальной инфекции при адекватном контроле очага продолжительность АБТ может составлять 5–7 дней [156].
10.7. Инструменты для принятия обоснованных решений
Среди инструментов, доступных для улучшения оказания помощи больным с инфекциями в критическом состоянии, есть обучающие средства, ярким примером которых являются опубликованные рекомендации по лечению антибиотиками. Мы выделим два из них: рекомендации Mensa (Испания) и Sanford (США).
11. Резюме по индивидуализации лечения антибиотиками у пациентов в критическом состоянии
Различные исследования подтверждают взаимосвязь между задержкой начала адекватного лечения антибиотиками и смертностью [97,119]. При инфекциях, вызванных Г(-) бактериями ненадлежащее лечение антибиотиками увеличивало риск смертности почти в четыре раза [157]. Кроме того, необходимость быстро определить правильное лечение антибиотиками чрезвычайно важно у пациентов с сепсисом или септическим шоком, у которых даже при адекватном лечении антибиотиками смертность может достигать от 27% до 40% у пациентов с множественными сопутствующими заболеваниями и низкми функциональными резервами, а также у пациентов с иммуносупрессией [158].
Несмотря на важность этих данных, реальность такова, что частота неадекватного лечения антибиотиками остается, по данным Vázquez-Guillamet et al., почти у 30% пациентов с сепсисом или септическим шоком, и, по данным этих авторов, число пациентов, которым потребуется соответствующее противомикробное лечение для спасения жизни равно пяти [159]. Наиболее важным фактором, предрасполагающим пациента к неадекватному лечению антибиотиками, является инфекция, вызванная микроорганизмами с множественной лекарственной устойчивостью [157]. Знание местной эпидемиологии необходимо для начала соответствующего эмпирического лечения. Знание общего уровня резистентности Г (-) бактерий к карбапенемам, имеющего эпидемиологическое значение, в каждом отделении и больнице можно использовать в качестве индикатора риска для пациента с наличием колонизации или инфицирования этими микроорганизмами. Как обсуждалось ранее, порог устойчивости к карбапенемам в 10–20% считается достаточным для инициации лечения новыми противомикробными препаратами, направленным на сбережение карбапенемов. Карбапенемы можно использовать, если частота резистентности составляет менее 10–20%, поскольку сами по себе они являются очень хорошими антибиотиками [96].
Большинство внутрибольничных инфекций вызываются представителями эндогенной микробиоты поверхностей слизистых оболочек путем транслокации или инвазии преобладающих микроорганизмов. в зависимости от плотности бактериальной популяции. Следовательно, знание колонизирующей флоры и характера ее чувствительности к противомикробным препаратам может иметь важное значение при выборе первоначального эмпирического лечения. По всем этим причинам казалось бы разумным проводить контрольные посевы при поступлении в ОИТ и в дальнейшем один-два раза в неделю, хотя нельзя исключать изменения в составе микробиоты до возникновения эпизода сепсиса. Альтернативной стратегией является получение полуколичественного ректального, глоточного и мазка слизистой оболочки носа во время сепсиса. Также важно оценить локализацию очага инфекции. У пациентов с факторами риска карбапенем-резистентного ГНБ следует рассмотреть возможность использования новых антибиотиков, когда ожидается, что клиническая эффективность возможных альтернатив будет субоптимальной, как в случае с полимиксинами и/или аминогликозидами у пациентов с пневмонией [160, 161]
Однако принятие решения об использовании активного эмпирического лечения при CRE-инфекциях может быть трудным для клинициста. Были опубликованы и проверены шкалы для прогнозирования индивидуального риска развития бактериемии у пациентов, колонизированных этими микроорганизмами [162–165]. Эти шкалы имеют свои ограничения в том смысле, что они валидированы в эпидемиологических условиях для конкретной группы пациентов и не обязательно могут воспроизводится в различных клинических ситуациях, что приводит к высокой отрицательной , но ограниченной положительной прогностической ценности.
В любом случае крайне важно начать раннее эмпирическое лечение антибиотиками, при котором нет права на ошибку у пациентов с нозокомиальной инфекцией и септическим шоком, у пациентов с сепсисом и низкими функциональными резервамии или у пациентов с подавленным иммунитетом. Для этих типов пациентов и для тех, у кого из-за местной экологии, индивидуального анамнеза колонизации, предшествующей инфекции и факторов риска CRE, таких как наличие множественных сопутствующих заболеваний, лучшим вариантом было бы начать активное эмпирическое лечение против CRE (в течение 24–36 часов и с использованием информации, полученной от культур) [166] — можно принять решение об окончательном эмпирическом или таргетном лечении и избежать ненужного чрезмерного использования этих антибиотиков. Нам нужны антибиотики, активные против как можно большего количества Г(-) бактерий, устойчивых к к карбапенемам. В зависимости от очага инфекции следует добавлять противомикробные препараты, активные в отношении Г (+) бактерий (даптомицин, линезолид, ванкомицин) и анаэробов, как в случай внутрибрюшной инфекции (тигециклин или метронидазол) [167]. На Figure 5 графически суммированы возможные факторы, определяющие выбор новых антибиотиков при эмпирическом и целенаправленном антимикробном лечении карбапенем-резистентных Г(-) бактерий при нозокомиальной инфекции. Принимая во внимание, что до недавнего времени у нас не было полностью эффективных и хорошо переносимых противомикробных средств против этого типа инфекции, необходимо оптимизировать использование новых антибиотиков, гарантируя пациентам наилучшее доступное лечение, одновременно отодвигая сроки появления и распространения устойчивости к ним.

12. Выводы
Проблемы лечения антибиотиками при сепсисе включают в себя адекватные программы управления, основанные на знаниях об инфекциях в ОИТ и в контексте мультирезистентных микроорганизмов, особенно грамотрицательных микроорганизмов, основанных на сбережении карбапенемов, а также эмпирическом и рациональном использовании новых антибиотиков.
References
1. Cortegiani, A.; Antonelli, M.; Falcone, M.; Giarratano, A.; Girardis, M.; Leone, M.; Pea, F.; Stefani, S.; Vaggi, B.; Viale, P. Rationale and clinical application of antimicrobial stewardship principles in the intensive care unit: A multidisciplinary statement. J. Anesth. Analg. Crit. Care 2023, 3, 11. [CrossRef] [PubMed]
2. Liebchen, U.; Briegel, J.; Brinkmann, A.; Frey, O.; Wicha, S.G. Individualised dosing of antibiotics in ICU patients: Timing, target and model selection matter. Intensive Care Med. 2023, 49, 475–476. [PubMed]
3. Yoo, J.H. The Infinity War: How to Cope with Carbapenem-resistant Enterobacteriaceae. J. Korean Med. Sci. 2018, 33, e255. [CrossRef] [PubMed]
4. Tang, K.W.K.; Millar, B.C.; Moore, J.E. Antimicrobial Resistance (AMR). Br. J. Biomed. Sci. 2023, 80, 11387. [CrossRef] [PubMed]
5. Llor, C.; Bjerrum, L. Antimicrobial resistance: Risk associated with antibiotic overuse and initiatives to reduce the problem. Ther.Adv. Drug Saf. 2014, 5, 229–241. [PubMed]
6. Diekema, D.J.; Hsueh, P.R.; Mendes, R.E.; Pfaller, M.A.; Rolston, K.V.; Sader, H.S.; Jones, R.N. The Microbiology of Bloodstream Infection: 20-Year Trends from the SENTRY Antimicrobial Surveillance Program. Antimicrob. Agents Chemother. 2019, 63, e00355-19.
[PubMed]
7. Leone, M.; Duclos, G.; Lakbar, I.; Martin-Loeches, I.; Einav, S. Antimicrobial resistance and outcome in the critically ill patient: An opinion paper. J. Crit. Care 2023, 77, 154352. [CrossRef]
8. Karukappadath, R.M.; Sirbu, D.; Zaky, A. Drug-resistant bacteria in the critically ill: Patterns and mechanisms of resistance and potential remedies. Front. Antibiot. 2023, 2, 1145190. [CrossRef]
9. Paterson, D.L. The Challenge of Treating Superbugs. Semin. Respir. Crit. Care Med. 2015, 36, 1–2. [CrossRef]
10. Magiorakos, A.P.; Srinivasan, A.; Carey, R.B.; Carmeli, Y.; Falagas, M.E.; Giske, C.G.; Harbarth, S.; Hindler, J.F.; Kahlmeter, G.; Olsson-Liljequist, B.; et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: An international expert proposal for interim standard definitions for acquired resistance. Clin. Microbiol. Infect. 2012, 18, 268–281.
11. Angele, M.K.; Faist, E. Clinical review: Immunodepression in the surgical patient and increased susceptibility to infection. Crit.Care 2002, 6, 298. [CrossRef]
12. DeWaele, J.J.; Boelens, J.; Leroux-Roels, I. Multidrug-resistant bacteria in ICU: Fact or myth. Curr. Opin. Anaesthesiol. 2020, 33,156–161. [PubMed]
13. Bassetti, M.; Righi, E.; Vena, A.; Graziano, E.; Russo, A.; Peghin, M. Risk stratification and treatment of ICU-acquired pneumonia caused by multidrug- resistant/extensively drug-resistant/pandrug-resistant bacteria. Curr. Opin. Crit. Care 2018, 24, 385–393.
[CrossRef] [PubMed]
14. The Abdominal Sepsis Study (AbSeS) Group on behalf of the Trials Group of the European Society of Intensive Care Medicine; Blot, S.; Antonelli, M.; Arvaniti, K.; Blot, K.; Creagh-Brown, B.; de Lange, D.; De Waele, J.; Deschepper, M.; Dikmen, Y.; et al. Epidemiology of intra-abdominal infection and sepsis in critically ill patients: “AbSeS”, a multinational observational cohort study and ESICM Trials Group Project. Intensive Care Med. 2019, 45, 1703–1717. [CrossRef]
15. Bassetti, S.; Tschudin-Sutter, S.; Egli, A.; Osthoff, M. Optimizing antibiotic therapies to reduce the risk of bacterial resistance. Eur. J. Intern. Med. 2022, 99, 7–12. [PubMed]
J. Pers. Med. 2024, 14, 106 31 of 37
16. Wunderink, R.G.; Srinivasan, A.; Barie, P.S.; Chastre, J.; Dela Cruz, C.S.; Douglas, I.S.; Ecklund, M.; Evans, S.E.; Evans, S.R.; Gerlach, A.T.; et al. Antibiotic Stewardship in the Intensive Care Unit. An Official American Thoracic SocietyWorkshop Report in Collaboration with the AACN, CHEST, CDC, and SCCM. Ann. Am. Thorac. Soc. 2020, 17, 531–540.
17. De Waele, J.J.; Dhaese, S. Antibiotic stewardship in sepsis management: Toward a balanced use of antibiotics for the severely ill patient. Expert Rev. Anti Infect. Ther. 2019, 17, 89–97. [CrossRef]
18. Shrestha, J.; Zahra, F.; Cannady, J. Antimicrobial Stewardship. In StatPearls; StatPearls Publishing: Treasure Island, FL, USA, 2023. Available online: http://www.ncbi.nlm.nih.gov/books/NBK572068/ (accessed on 29 August 2023).
19. Srinivasan, A. Antibiotic stewardship: Why we must, how we can. Cleve Clin. J. Med. 2017, 84, 673–679.
20. Damiani, E.; Donati, A.; Serafini, G.; Rinaldi, L.; Adrario, E.; Pelaia, P.; Busani, S.; Girardis, M. Effect of performance improvement programs on compliance with sepsis bundles and mortality: A systematic review and meta-analysis of observational studies.PLoS ONE 2015, 10, e0125827.
21. Schinkel, M.; Nanayakkara, P.W.B.; Wiersinga, W.J. Sepsis Performance Improvement Programs: From Evidence Toward Clinical Implementation. Crit. Care 2022, 26, 77. [CrossRef]
22. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado, F.R.; Mcintyre, L.; Ostermann, N.; Prescott, H.C.; et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021.Intensive Care Med. 2021, 47, 1181–1247. [CrossRef] [PubMed]
23. Méndez, R.; Figuerola, A.; Chicot, M.; Barrios, A.; Pascual, N.; Ramasco, F.; Rodríguez, D.; García, I.; vonWernitz, A.; Zurita, N.;et al. Sepsis Code: Dodging mortality in a tertiary hospital. Rev. Esp. Quimioter. 2022, 35, 43–49. [CrossRef] [PubMed]
24. Mensa, J.; Barberán, J.; Ferrer, R.; Borges, M.; Rascado, P.; Maseda, E.; Oliver, A.; Marco, F.; Adalia, R.; Aguilar, G.; et al.Recommendations for antibiotic selection for severe nosocomial infections. Rev. Esp. Quimioter. 2021, 34, 511–524. [PubMed]
25. Peri, A.M.; Stewart, A.; Hume, A.; Irwin, A.; Harris, P.N.A. New Microbiological Techniques for the Diagnosis of Bacterial Infections and Sepsis in ICU Including Point of Care. Curr. Infect. Dis. Rep. 2021, 23, 12. [CrossRef] [PubMed]
26. Tamma, P.D.; Miller, M.A.; Cosgrove, S.E. Rethinking How Antibiotics Are Prescribed: Incorporating the 4 Moments of Antibiotic Decision Making Into Clinical Practice. JAMA 2019, 321, 139–140. [CrossRef]
27. Timsit, J.F.; Bassetti, M.; Cremer, O.; Daikos, G.; de Waele, J.; Kallil, A.; Kipnis, E.; Kollef, M.; Laupland, K.; Paiva, J.-A.; et al. Rationalizing antimicrobial therapy in the ICU: A narrative review. Intensive Care Med. 2019, 45, 172–189. [CrossRef] [PubMed]
28. Princess, I.; Vadala, R. Clinical Microbiology in the Intensive Care Unit: Time for Intensivists to Rejuvenate this Lost Art. Indian J. Crit. Care Med. 2021, 25, 566–574. [PubMed]
29. Gupta, E.; Saxena, J.; Kumar, S.; Sharma, U.; Rastogi, S.; Srivastava, V.K.; Kaushik, S.; Jyoti, A. Fast Track Diagnostic Tools for Clinical Management of Sepsis: Paradigm Shift from Conventional to Advanced Methods. Diagnostics 2023, 13, 277.
30. Gerace, E.; Mancuso, G.; Midiri, A.; Poidomani, S.; Zummo, S.; Biondo, C. Recent Advances in the Use of Molecular Methods for the Diagnosis of Bacterial Infections. Pathogens 2022, 11, 663.
31. Hansen, G.T. Point-of-Care Testing in Microbiology: A Mechanism for Improving Patient Outcomes. Clin. Chem. 2020, 66, 124–137.[CrossRef]
32. Kowalska-Krochmal, B.; Dudek-Wicher, R. The Minimum Inhibitory Concentration of Antibiotics: Methods, Interpretation,Clinical Relevance. Pathogens 2021, 10, 165. [PubMed]
33. Nabal Díaz, S.G.; Algara Robles, O.; García-Lechuz Moya, J.M. New definitions of susceptibility categories EUCAST 2019: Clinic application. Rev. Esp. Quim. 2022, 35 (Suppl. S3), 84–88. [CrossRef] [PubMed]
34. Drlica, K.; Zhao, X. Mutant Selection Window Hypothesis Updated. Clin. Infect. Dis. 2007, 44, 681–688. [CrossRef] [PubMed]
35. Zhao, X.; Drlica, K. Restricting the selection of antibiotic-resistant mutant bacteria: Measurement and potential use of the mutant selection window. J. Infect. Dis. 2002, 185, 561–565. [CrossRef]
36. Mensa, J.; Barberán, J.; Soriano, A.; Llinares, P.; Marco, F.; Cantón, R.; Bou, G.; González Del Castillo, J.; Maseda, E.; Azanza, J.R.; et al. Antibiotic selection in the treatment of acute invasive infections by Pseudomonas aeruginosa: Guidelines by the Spanish Society of Chemotherapy. Rev. Esp. Quimioter. 2018, 31, 78–100. [PubMed]
37. Schlebusch, S.; Graham, R.M.A.; Jennison, A.V.; Lassig-Smith, M.M.; Harris, P.N.A.; Lipman, J.; Ó Cuív, P.; Paterson, D.L. Standard rectal swabs as a surrogate sample for gut microbiome monitoring in intensive care. BMC Microbiol. 2022, 22, 99. [CrossRef]
38. Montero, J.G.; Lerma, F.Á.; Galleymore, P.R.; Martínez, M.P.; Rocha, L.Á.; Gaite, F.B.; Rodríguez, J.A.; González, M.C.; Moreno, I.F.; Baño, J.R.; et al. Combatting resistance in intensive care: The multimodal approach of the Spanish ICU «Zero Resistance» program. Crit. Care 2015, 19, 114. [CrossRef]
39. Roberts, J.A.; Taccone, F.S.; Lipman, J. Understanding PK/PD. Intensive Care Med. 2016, 42, 1797–1800. [CrossRef]
40. Roberts, J.A.; Paul, S.K.; Akova, M.; Bassetti, M.; De Waele, J.J.; Dimopoulos, G.; Kaukonen, K.-M.; Koulenti, D.; Martin, C.; Montravers, P.; et al. DALI: Defining antibiotic levels in intensive care unit patients: Are current _-lactam antibiotic doses
sufficient for critically ill patients? Clin. Infect. Dis. 2014, 58, 1072–1083. [CrossRef]
41. Guilhaumou, R.; Benaboud, S.; Bennis, Y.; Dahyot-Fizelier, C.; Dailly, E.; Gandia, P.; Goutelle, S.; Lefeuvre, S.; Mongardon, N.;Roger, C.; et al. Optimization of the treatment with beta-lactam antibiotics in critically ill patients—Guidelines from the French
Society of Pharmacology and Therapeutics (Société Française de Pharmacologie et Thérapeutique—SFPT) and the French Society
of Anaesthesia and Intensive Care Medicine (Société Française d’Anesthésie et Réanimation—SFAR). Crit. Care 2019, 23, 104.
J. Pers. Med. 2024, 14, 106 32 of 37
42. Hong, L.T.; Downes, K.J.; FakhriRavari, A.; Abdul-Mutakabbir, J.C.; Kuti, J.L.; Jorgensen, S.; Young, D.C.; Alshaer, M.H.; Bassetti, M.; Bonomo, R.A.; et al. International consensus recommendations for the use of prolonged-infusion beta-lactam antibiotics:Endorsed by the American College of Clinical Pharmacy, British Society for Antimicrobial Chemotherapy, Cystic Fibrosis Foundation, European Society of Clinical Microbiology and Infectious Diseases, Infectious Diseases Society of America, Society of Critical Care Medicine, and Society of Infectious Diseases Pharmacists: An executive summary. Pharmacotherapy 2023, 43, 736–739.
[PubMed]
43. Tang, R.; Luo, R.;Wu, B.;Wang, F.; Song, H.; Chen, X. Effectiveness and safety of adjunctive inhaled antibiotics for ventilatorassociated pneumonia: A systematic review and meta-analysis of randomized controlled trials. J. Crit. Care 2021, 65, 133–139. [CrossRef]
44. Kalil, A.C.; Metersky, M.L.; Klompas, M.; Muscedere, J.; Sweeney, D.A.; Palmer, L.B.; Napolitano, L.M.; O’Grady, N.P.; Bartlett, J.G.; Carratalà, J.; et al. Management of Adults with Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin. Infect. Dis. 2016, 63, e61–e111. [CrossRef]
45. Tablan, O.C.; Anderson, L.J.; Besser, R.; Bridges, C.; Hajjeh, R.; CDC; Healthcare Infection Control Practices Advisory Committee. Guidelines for preventing health-care-associated pneumonia, 2003: Recommendations of CDC and the Healthcare Infection Control Practices Advisory Committee. Morb. Mortal. Wkly. Rep. Recomm. Rep. 2004, 53, 1–179.
46. Rello, J.; Solé-Lleonart, C.; Rouby, J.J.; Chastre, J.; Blot, S.; Poulakou, G.; Luyt, C.-E.; Riera, J.; Palmer, L.B.; Pereira, J.M.; et al. Use of nebulized antimicrobials for the treatment of respiratory infections in invasively mechanically ventilated adults: A position paper from the European Society of Clinical Microbiology and Infectious Diseases. Clin. Microbiol. Infect. 2017, 23, 629–639. [CrossRef] [PubMed]
47. Gorham, J.; Taccone, F.S.; Hites, M. How to Use Nebulized Antibiotics in Severe Respiratory Infections. Antibiotics 2023, 12, 267. [CrossRef] [PubMed]
48. Abdul-Aziz, M.H.; Alffenaar, J.W.C.; Bassetti, M.; Bracht, H.; Dimopoulos, G.; Marriott, D.; Neely, M.N.; Paiva, J.-A.; Pea, F.; Sjovall, F.; et al. Antimicrobial therapeutic drug monitoring in critically ill adult patients: A Position Paper. Intensive Care Med.2020, 46, 1127–1153. [CrossRef]
49. Shi, A.X.; Qu, Q.; Zhuang, H.H.; Teng, X.Q.; Xu,W.X.; Liu, Y.P.; Xiao, Y.W.; Qu, J. Individualized antibiotic dosage regimens for patients with augmented renal clearance. Front. Pharmacol. 2023, 14, 1137975. [CrossRef]
50. Shenoy, E.S.; Macy, E.; Rowe, T.; Blumenthal, K.G. Evaluation and Management of Penicillin Allergy: A Review. JAMA 2019, 321, 188–199.
51. Stone, C.A.; Trubiano, J.; Coleman, D.T.; Rukasin, C.R.F.; Phillips, E.J. The challenge of de-labeling penicillin allergy. Allergy 2020,75, 273–288.
52. Caruso, C.; Valluzzi, R.L.; Colantuono, S.; Gaeta, F.; Romano, A. _-Lactam Allergy and Cross-Reactivity: A Clinician’s Guide to Selecting an Alternative Antibiotic. J. Asthma Allergy 2021, 14, 31–46. [CrossRef] [PubMed]
53. Alvarez-Cuesta, E.; Madrigal-Burgaleta, R.; Broyles, A.D.; Cuesta-Herranz, J.; Guzman-Melendez, M.A.; Maciag, M.C.; Phillips, E.J.; Trubiano, J.A.;Wong , J.T.; Ansotegui, I. Standards for practical intravenous rapid drug desensitization & delabeling: AWAO committee statement. World Allergy Organ. J. 2022, 15, 100640. [PubMed]
54. Savic, L.; Ardern-Jones, M.; Avery, A.; Cook, T.; Denman, S.; Farooque, S.; Garcez, T.; Gold, R.; Jay, N.; Krishna, M.T.; et al. BSACI guideline for the set-up of penicillin allergy de-labelling services by non-allergists working in a hospital setting. Clin. Exp. Allergy 2022, 52, 1135–1141. [PubMed]
55. Trubiano, J.A.; Vogrin, S.; Chua, K.Y.L.; Bourke, J.; Yun, J.; Douglas, A.; Stone, A.C.; Yu, R.; Lauren, G.; Holmes, N.E.; et al. Development and Validation of a Penicillin Allergy Clinical Decision Rule. JAMA Intern. Med. 2020, 180, 745–752. [CrossRef] [PubMed]
56. Courtemanche, J.; Baril, L.; Clément, A.; Bédard, M.A.; Plourde, M.; Émond, M. Is it possible to identify patients at low risk of having a true penicillin allergy? Can. J. Emerg. Med. 2022, 24, 366–368. [CrossRef]
57. Trubiano, J.A. A Risk-Based Approach to Penicillin Allergy. Immunol. Allergy Clin. North Am. 2022, 42, 375–389. [CrossRef]
58. Holmes, M.D.; Vo, N.; Rafeq, R.; Byrne, D.; King, M. Administration of _-lactam antibiotics to patients with reported penicillin allergy in the emergency department. Am. J. Emerg. Med. 2023, 68, 119–123.
59. Pulcini, C.; Bush, K.; Craig, W.A.; Frimodt-Møller, N.; Grayson, M.L.; Mouton, J.W.; Turnidge, J.; Harbarth, S.; Gyssens, I.C.; ESCMID Study Group for Antibiotic Policies. Forgotten antibiotics: An inventory in Europe, the United States, Canada, and Australia. Clin. Infect. Dis. 2012, 54, 268–274. [CrossRef]
60. El-Sayed Ahmed, M.A.E.G.; Zhong, L.L.; Shen, C.; Yang, Y.; Doi, Y.; Tian, G.B. Colistin and its role in the Era of antibiotic resistance: An extended review (2000–2019). Emerg. Microbes Infect. 2020, 9, 868–885. [CrossRef]
61. Múñez Rubio, E.; Ramos Martínez, A.; Fernández Cruz, A. Fosfomycin in antimicrobial stewardship programs. Rev. Esp. Quimioter. 2019, 32 (Suppl. S1), 62–66.
62. Rychlíˇcková, J.; Kubíˇcková, V.; Suk, P.; Urbánek, K. Challenges of Colistin Use in ICU and Therapeutic Drug Monitoring: A Literature Review. Antibiotics 2023, 12, 437.
63. Brown, G.R. Cotrimoxazole—Optimal dosing in the critically ill. Ann. Intensive Care 2014, 4, 13. [CrossRef] [PubMed]
64. Tamma, P.D.; Aitken, S.L.; Bonomo, R.A.; Mathers, A.J.; van Duin, D.; Clancy, C.J. Infectious Diseases Society of America 2023 Guidance on the Treatment of Antimicrobial Resistant Gram-Negative Infections. Clin. Infect. Dis. 2023, ciad428. [CrossRef] [PubMed]
65. Yaghoubi, S.; Zekiy, A.O.; Krutova, M.; Gholami, M.; Kouhsari, E.; Sholeh, M.; Ghafouri, Z.; Maleki, F. Tigecycline antibacterial activity, clinical effectiveness, and mechanisms and epidemiology of resistance: Narrative review. Eur. J. Clin. Microbiol. Infect. Dis. 2022, 41, 1003–1022. [CrossRef] [PubMed]
66. De Pascale, G.; Lisi, L.; Ciotti, G.M.P.; Vallecoccia, M.S.; Cutuli, S.L.; Cascarano, L.; Gelormini, C.; Bello, G.; Montini, L.; Carelli, S.;et al. Pharmacokinetics of high-dose tigecycline in critically ill patients with severe infections. Ann. Intensive Care 2020, 10, 94.
67. Infectious Diseases Society of America (IDSA); Spellberg, B.; Blaser, M.; Guidos, R.J.; Boucher, H.W.; Bradley, J.S. Combating antimicrobial resistance: Policy recommendations to save lives. Clin. Infect. Dis. 2011, 52 (Suppl. S5), S397–S428.
68. Brown, N.M.; Goodman, A.L.; Horner, C.; Jenkins, A.; Brown, E.M. Treatment of methicillin-resistant Staphylococcus aureus (MRSA): Updated guidelines from the UK. JAC Antimicrob. Resist. 2021, 3, dlaa114. [CrossRef]
69. Habib, G.; Lancellotti, P.; Antunes, M.J.; Bongiorni, M.G.; Casalta, J.P.; Del Zotti, F.; Dulgheru, R.; El Khoury, G.; Erba, P.A.; Iung, B.; et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective
Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur. Heart J. 2015, 36, 3075–3128.
70. Infectious Diseases Society of America. The 10 x ’20 Initiative: Pursuing a global commitment to develop 10 new antibacterial drugs by 2020. Clin. Infect. Dis. 2010, 50, 1081–1083.
71. Hetzler, L.; Kollef, M.H.; Yuenger, V.; Micek, S.T.; Betthauser, K.D. New antimicrobial treatment options for severe Gram-negative infections. Curr. Opin. Crit. Care 2022, 28, 522–533.
72. Clancy, C.J.; Nguyen, M.H. Management of Highly Resistant Gram-Negative Infections in the Intensive Care Unit in the Era of Novel Antibiotics. Infect. Dis. Clin. N. Am. 2022, 36, 791–823. [CrossRef] [PubMed]
73. Shirley, M. Ceftazidime-Avibactam: A Review in the Treatment of Serious Gram-Negative Bacterial Infections. Drugs 2018, 78,675–692. [CrossRef]
74. Matesanz, M.; Mensa, J. Ceftazidime-Avibactam. Rev. Esp. Quimioter. 2021, 34 (Suppl. S1), 38–40. [CrossRef]
75. Pintado, V.; Ruiz-Garbajosa, P.; Aguilera-Alonso, D.; Baquero-Artigao, F.; Bou, G.; Cantón, R.; Grau, S.; Gutiérrez-Gutiérrez, B.;Larrosa, N.; Machuca, I.; et al. Executive summary of the consensus document of the Spanish Society of Infectious Diseases and Clinical Microbiology (SEIMC) on the diagnosis and antimicrobial treatment of infections due to carbapenem-resistant
Gram-negative bacteria. Enferm. Infecc. Microbiol. Clin. 2023, 41, 360–370. [CrossRef]
76. Paul, M.; Carrara, E.; Retamar, P.; Tängdén, T.; Bitterman, R.; Bonomo, R.A.; deWaele, J.; Daikos, G.L.; Akova, M.; Harbarth, S.;et al. European Society of Clinical Microbiology and Infectious Diseases (ESCMID) guidelines for the treatment of infections caused by multidrug-resistant Gram-negative bacilli (endorsed by European society of intensive care medicine). Clin. Microbiol. Infect. 2022, 28, 521–547. [CrossRef]
77. Bassetti, M.; Garau, J. Current and future perspectives in the treatment of multidrug-resistant Gram-negative infections. J. Antimicrob. Chemother. 2021, 76 (Suppl. S4), iv23–iv37. [PubMed]
78. Soriano, A.; Carmeli, Y.; Omrani, A.S.; Moore, L.S.P.; Tawadrous, M.; Irani, P. Ceftazidime-Avibactam for the Treatment of Serious Gram-Negative Infections with Limited Treatment Options: A Systematic Literature Review. Infect. Dis. Ther. 2021, 10, 1989–2034.
[CrossRef]
79. Soriano, A.; Montravers, P.; Bassetti, M.; Klyasova, G.; Daikos, G.; Irani, P.; Stone, G.; Chambers, R.; Peeters, P.; Shah, M.; et al.The Use and Effectiveness of Ceftazidime–Avibactam in Real-World Clinical Practice: EZTEAM Study. Infect. Dis. Ther. 2023, 12, 891–917.
80. Swaminathan, S.; Routray, A.; Mane, A. Early and Appropriate Use of Ceftazidime-Avibactam in the Management of Multidrug-Resistant Gram-Negative Bacterial Infections in the Indian Scenario. Cureus 2022, 14, e28283. [CrossRef]
81. Jorgensen, S.C.J.; Trinh, T.D.; Zasowski, E.J.; Lagnf, A.M.; Bhatia, S.; Melvin, S.M.; E Steed, M.; Simon, S.P.; Estrada, S.J.; Morrisette, T.; et al. Real-World Experience with Ceftazidime-Avibactam for Multidrug-Resistant Gram-Negative Bacterial Infections. Open
Forum Infect. Dis. 2019, 6, ofz522.
82. Castón, J.J.; Cano, A.; Pérez-Camacho, I.; Aguado, J.M.; Carratalá, J.; Ramasco, F.; Soriano, A.; Pintado, V.; Castelo-Corral, L.; Sousa, A.; et al. Impact of ceftazidime/avibactam versus best available therapy on mortality from infections caused by carbapenemase-producing Enterobacterales (CAVICOR study). J. Antimicrob. Chemother. 2022, 77, 1452–1460. [CrossRef] [PubMed]
83. Mikhail, S.; Singh, N.B.; Kebriaei, R.; Rice, S.A.; Stamper, K.C.; Castanheira, M.; Rybak, M.J. Evaluation of the Synergy of Ceftazidime-Avibactam in Combination with Meropenem, Amikacin, Aztreonam, Colistin, or Fosfomycin against Well-Characterized Multidrug-Resistant Klebsiella pneumoniae and Pseudomonas aeruginosa. Antimicrob. Agents Chemother. 2019, 63,
e00779-19. [PubMed]
84. Wang, L.T.; Lin, W.T.; Lai, C.C.; Wang, Y.H.; Chen, C.H.; Chang, Y.T.; Chen, C.-H.; Wang, C.-Y. The safety of ceftolozanetazobactam for the treatment of acute bacterial infections: A systemic review and meta-analysis. Ther. Adv. Drug Saf. 2021, 12, 20420986211027096. [CrossRef] [PubMed]
85. Candel, F.J.; del Castillo, J.G.; Jiménez, A.J.; Matesanz, M. Ceftolozane-tazobactam in nosocomial pneumonia. Rev. Esp. Quimioter. 2022, 35 (Suppl. S1), 35–39. [CrossRef] [PubMed]
86. Timsit, J.F.; Huntington, J.A.; Wunderink, R.G.; Shime, N.; Kollef, M.H.; Kivistik, Ü.; Nováˇcek, M.; Réa-Neto, A.; Martin-Loeches 9, I.; Yu, B.; et al. Ceftolozane/tazobactam versus meropenem in patients with ventilated hospital-acquired bacterial pneumonia: Subset analysis of the ASPECT-NP randomized, controlled phase 3 trial. Crit. Care 2021, 25, 290. [CrossRef]
87. Puzniak, L.; Dillon, R.; Palmer, T.; Collings, H.; Enstone, A. Real-world use of ceftolozane/tazobactam: A systematic literature review. Antimicrob. Resist. Infect. Control 2021, 10, 68. [CrossRef]
88. Sansone, P.; Giaccari, L.G.; Coppolino, F.; Aurilio, C.; Barbarisi, A.; Passavanti, M.B.; Pota, V.; Pace, M.C. Cefiderocol for Carbapenem-Resistant Bacteria: Handle with Care! A Review of the Real-World Evidence. Antibiotics 2022, 11, 904.
89. Maseda, E.; Suárez de la Rica, A. The role of cefiderocol in clinical practice. Rev. Esp. Quimioter. 2022, 35 (Suppl. S2), 39–44. [CrossRef]
90. Bassetti, M.; Echols, R.; Matsunaga, Y.; Ariyasu, M.; Doi, Y.; Ferrer, R.; Lodise, T.P.; Naas, T.; Niki, Y.; Paterson, D.L.; et al. Efficacy and safety of cefiderocol or best available therapy for the treatment of serious infections caused by carbapenem-resistant Gram-negative bacteria (CREDIBLE-CR): A randomised, open-label, multicentre, pathogen-focused, descriptive, phase 3 trial. Lancet Infect. Dis. 2021, 21, 226–240. [CrossRef]
91. Viale, P.; Sandrock, C.E.; Ramirez, P.; Rossolini, G.M.; Lodise, T.P. Treatment of critically ill patients with cefiderocol for infections caused by multidrug-resistant pathogens: Review of the evidence. Ann. Intensive Care 2023, 13, 52. [CrossRef]
92. Corcione, S.; Lupia, T.; Maraolo, A.E.; Mornese Pinna, S.; Gentile, I.; De Rosa, F.G. Carbapenem-sparing strategy: Carbapenemase, treatment, and stewardship. Curr. Opin. Infect. Dis. 2019, 32, 663–673.
93. Jean, S.S.; Harnod, D.; Hsueh, P.R. Global Threat of Carbapenem-Resistant Gram-Negative Bacteria. Front. Cell Infect. Microbiol. 2022, 12, 823684.
94. Arulkumaran, N.; Routledge, M.; Schlebusch, S.; Lipman, J.; Conway Morris, A. Antimicrobial-associated harm in critical care: A narrative review. Intensive Care Med. 2020, 46, 225–235. [CrossRef] [PubMed]
95. Harris, P.N.A.; Tambyah, P.A.; Lye, D.C.; Mo, Y.; Lee, T.H.; Yilmaz, M.; Alenazi, T.H.; Arabi, Y.; Falcone, M.; Bassetti, M.; et al. Effect of Piperacillin-Tazobactam vs Meropenem on 30-Day Mortality for Patients with E. coli or Klebsiella pneumoniae Bloodstream Infection and Ceftriaxone Resistance: A Randomized Clinical Trial. JAMA 2018, 320, 984–994. [PubMed]
96. Montravers, P.; Bassetti, M. The ideal patient profile for new beta-lactam/beta-lactamase inhibitors. Curr. Opin. Infect. Dis. 2018,31, 587–593. [PubMed]
97. Kollef, M.H.; Shorr, A.F.; Bassetti, M.; Timsit, J.F.; Micek, S.T.; Michelson, A.P.; Garnacho-Montero, J. Timing of antibiotic therapy in the ICU. Crit. Care 2021, 25, 360.
98. DeWaele, J.J.; Schouten, J.; Beovic, B.; Tabah, A.; Leone, M. Antimicrobial de-escalation as part of antimicrobial stewardship in intensive care: No simple answers to simple questions—A viewpoint of experts. Intensive Care Med. 2020, 46, 236–244.
99. Strich, J.R.; Heil, E.L.; Masur, H. Considerations for Empiric Antimicrobial Therapy in Sepsis and Septic Shock in an Era of Antimicrobial Resistance. J. Infect. Dis. 2020, 222 (Suppl. S2), S119–S131.
100. Dequin, P.F.; Aubron, C.; Faure, H.; Garot, D.; Guillot, M.; Hamzaoui, O.; Lemiale, V.; Maizel, J.; Mootien, J.Y.; Osman, D.; et al. The place of new antibiotics for Gram-negative bacterial infections in intensive care: Report of a consensus conference. Ann. Intensive Care 2023, 13, 59.
101. Miller, W.D.; Keskey, R.; Alverdy, J.C. Sepsis and the Microbiome: A Vicious Cycle. J. Infect. Dis. 2020, 223 (Suppl. S3), S264–S269. [CrossRef]
102. Prechter, F.; Katzer, K.; Bauer, M.; Stallmach, A. Sleeping with the enemy: Clostridium difficile infection in the intensive care unit. Crit. Care 2017, 21, 260. [PubMed]
103. Morel, C.M.; de Kraker, M.E.A.; Harbarth, S.; The Enhanced Surveillance Expert Consensus Group (CANSORT-SCI). Surveillance of Resistance to New Antibiotics in an Era of Limited Treatment Options. Front. Med. 2021, 8, 652638.
104. Niederman, M.S.; Baron, R.M.; Bouadma, L.; Calandra, T.; Daneman, N.; DeWaele, J.; Kollef, M.H.; Lipman, J.; Nair, G.B. Initial antimicrobial management of sepsis. Crit. Care 2021, 25, 307.
105. Pea, F.; Viale, P. The antimicrobial therapy puzzle: Could pharmacokinetic-pharmacodynamic relationships be helpful in addressing the issue of appropriate pneumonia treatment in critically ill patients? Clin. Infect. Dis. 2006, 42, 1764–1771.
106. Kumar, A. An alternate pathophysiologic paradigm of sepsis and septic shock: Implications for optimizing antimicrobial therapy.Virulence 2014, 5, 80–97. [PubMed]
107. Danjean, M.; Hobson, C.A.; Gits-Muselli, M.; Courroux, C.; Monjault, A.; Bonacorsi, S.; Birgy, A. Evaluation of the inoculum effect of new antibiotics against carbapenem-resistant enterobacterales. Clin. Microbiol. Infect. 2022, 28, 1503.e1–1503.e3.
108. Heffernan, A.J.; Mohd Sazlly Lim, S.; Lipman, J.; Roberts, J.A. A personalised approach to antibiotic pharmacokinetics and pharmacodynamics in critically ill patients. Anaesth. Crit. Care Pain. Med. 2021, 40, 100970. [CrossRef]
109. Zaragoza, R.; Vidal-Cortés, P.; Aguilar, G.; Borges, M.; Diaz, E.; Ferrer, R.; Maseda, E.; Nieto, M.; Nuvials, F.X.; Ramirez, P.; et al. Update of the treatment of nosocomial pneumonia in the ICU. Crit. Care 2020, 24, 383. [CrossRef]
110. Di Franco, S.; Alfieri, A.; Fiore, M.; Fittipaldi, C.; Pota, V.; Coppolino, F.; Sansone, P.; Pace, M.C.; Passavanti, M.B. A Literature Overview of Secondary Peritonitis Due to Carbapenem-Resistant Enterobacterales (CRE) in Intensive Care Unit (ICU) Patients.Antibiotics 2022, 11, 1347.
111. Heidary, M.; Khosravi, A.D.; Khoshnood, S.; Nasiri, M.J.; Soleimani, S.; Goudarzi, M. Daptomycin. J. Antimicrob. Chemother. 2018,73, 1–11. [CrossRef]
112. Thomas-Rüddel, D.O.; Schlattmann, P.; Pletz, M.; Kurzai, O.; Bloos, F. Risk Factors for Invasive Candida Infection in Critically Ill Patients: A Systematic Review and Meta-analysis. Chest 2022, 161, 345–355. [PubMed]
113. Keane, S.; Geoghegan, P.; Povoa, P.; Nseir, S.; Rodriguez, A.; Martin-Loeches, I. Systematic review on the first line treatment of amphotericin B in critically ill adults with candidemia or invasive candidiasis. Expert Rev. Anti Infect. Ther. 2018, 16, 839–847.[CrossRef] [PubMed]
114. Burillo, A.; Bouza, E. Faster infection diagnostics for intensive care unit (ICU) patients. Expert Rev. Mol. Diagn. 2022, 22, 347–360. [CrossRef] [PubMed]
115. Méndez Hernández, R.; Ramasco Rueda, F. Biomarkers as Prognostic Predictors and Therapeutic Guide in Critically Ill Patients:Clinical Evidence. J. Pers. Med. 2023, 13, 333. [PubMed]
116. Vincent, J.L.; Bassetti, M.; François, B.; Karam, G.; Chastre, J.; Torres, A.; Roberts, J.A.; Taccone, F.S.; Rello, J.; Calandra, T.; et al.Advances in antibiotic therapy in the critically ill. Crit. Care 2016, 20, 133. [PubMed]
117. Ulldemolins, M.; Nuvials, X.; Palomar, M.; Masclans, J.R.; Rello, J. Appropriateness is critical. Crit. Care Clin. 2011, 27, 35–51.
118. Mahmoudi, L.; Niknam, R.; Mousavi, S.; Ahmadi, A.; Honarmand, H.; Ziaie, S.; Mojtahedzadeh, M. Optimal Aminoglycoside Therapy Following the Sepsis: How Much Is Too Much? Iran. J. Pharm. Res. 2013, 12, 261–269.
119. Kumar, A.; Roberts, D.; Wood, K.E.; Light, B.; Parrillo, J.E.; Sharma, S.; Suppes, R.; Feinstein, D.; Zanotti, S.; Taiberg, L.; et al.Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit. Care Med. 2006, 34, 1589. [CrossRef]
120. Ferrer, R.; Martin-Loeches, I.; Phillips, G.; Osborn, T.M.; Townsend, S.; Dellinger, R.P.; Artigas, A.; Schorr, C.; Levy, M.M. Empiric antibiotic treatment reduces mortality in severe sepsis and septic shock from the first hour: Results from a guideline-based
performance improvement program. Crit. Care Med. 2014, 42, 1749–1755.
121. Im, Y.; Kang, D.; Ko, R.E.; Lee, Y.J.; Lim, S.Y.; Park, S.; Na, S.J.; Chung, C.R.; Park, M.H.; Oh, D.K.; et al. Time-to-antibiotics and clinical outcomes in patients with sepsis and septic shock: A prospective nationwide multicenter cohort study. Crit. Care 2022,26, 19. [CrossRef]
122. Peltan, I.D.; Mitchell, K.H.; Rudd, K.E.; Mann, B.A.; Carlbom, D.J.; Hough, C.L.; Rea, T.D.; Brown, S.M. Physician Variation in Time to Antimicrobial Treatment for Septic Patients Presenting to the Emergency Department. Crit. Care Med. 2017, 45, 1011–1018.[CrossRef] [PubMed]
123. Roberts, R.J.; Alhammad, A.M.; Crossley, L.; Anketell, E.; Wood, L.; Schumaker, G.; Garpestad, E.; Devlin, J.W. A survey of critical care nurses’ practices and perceptions surrounding early intravenous antibiotic initiation during septic shock. Intensive Crit. Care Nurs. 2017, 41, 90–97. [CrossRef] [PubMed]
124. Pak, T.R.; Rhee, C.; Klompas, M. Timing and Spectrum of Antibiotic Treatment for Suspected Sepsis and Septic Shock: Why so Controversial? Infect. Dis. Clin. North Am. 2022, 36, 719–733. [CrossRef]
125. Rothrock, S.G.; Cassidy, D.D.; Barneck, M.; Schinkel, M.; Guetschow, B.; Myburgh, C.; Nguyen, L.; Earwood, R.; Nanayakkara, P.W.; Panday, R.S.N.; et al. Outcome of Immediate Versus Early Antibiotics in Severe Sepsis and Septic Shock: A Systematic Review and Meta-analysis. Ann. Emerg. Med. 2020, 76, 427–441. [CrossRef] [PubMed]
126. Rhee, C.; Chiotos, K.; Cosgrove, S.E.; Heil, E.L.; Kadri, S.S.; Kalil, A.C.; Gilbert, D.N.; Masur, H.; Septimus, E.J.; A Sweeney, D.; et al. Infectious Diseases Society of America Position Paper: Recommended Revisions to the National Severe Sepsis and Septic Shock Early Management Bundle (SEP-1) Sepsis Quality Measure. Clin. Infect. Dis. 2021, 72, 541–552. [CrossRef] [PubMed]
127. Weinberger, J.; Rhee, C.; Klompas, M. A Critical Analysis of the Literature on Time-to-Antibiotics in Suspected Sepsis. J. Infect. Dis. 2020, 222 (Suppl. S2), S110–S118.
128. Montravers, P.; Blot, S.; Dimopoulos, G.; Eckmann, C.; Eggimann, P.; Guirao, X.; Paiva, J.A.; Sganga, G.; De Waele, J. Therapeutic management of peritonitis: A comprehensive guide for intensivists. Intensive Care Med. 2016, 42, 1234–1247.
129. Ordoñez, C.A.; Caicedo, Y.; Parra, M.W.; Rodríguez-Holguín, F.; Serna, J.J.; Salcedo, A.; Franco, M.J.; Toro, L.E.; Pino, L.F.; Guzmán-Rodríguez, M.; et al. Evolution of damage control surgery in non-traumatic abdominal pathology: A light in the darkness. Colomb. Med. 2021, 52, e4194809. [CrossRef]
130. DeWaele, J.J.; Girardis, M.; Martin-Loeches, I. Source control in the management of sepsis and septic shock. Intensive Care Med.2022, 48, 1799–1802. [CrossRef]
131. De Pascale, G.; Antonelli, M.; Deschepper, M.; Arvaniti, K.; Blot, K.; Brown, B.C.; de Lange, D.; De Waele, J.; Dikmen, Y.;Dimopoulos, G.; et al. Poor timing and failure of source control are risk factors for mortality in critically ill patients with secondary peritonitis. Intensive Care Med. 2022, 48, 1593–1606. [CrossRef]
132. Obst, W.; Esser, T.; Kaasch, A.J.; Geginat, G.; Meyer, F.; Croner, R.S.; Keitel, V. The Need of Antimicrobial Stewardship in Post-Operative Infectious Complications of Abdominal Surgery. Visc. Med. 2022, 38, 345–353. [PubMed]
133. Maseda, E.; Suarez-de-la-Rica, A.; Anillo, V.; Tamayo, E.; García-Bernedo, C.A.; Ramasco, F.; Villagran, M.-J.; Maggi, G.; Gimenez, M.-J.; Aguilar, L.; et al. Procalcitonin-guided therapy may reduce length of antibiotic treatment in intensive care unit patients with secondary peritonitis: A multicenter retrospective study. J. Crit. Care 2015, 30, 537–542. [CrossRef] [PubMed]
134. For the DURAPOP Trial Group; Montravers, P.; Tubach, F.; Lescot, T.; Veber, B.; Esposito-Farèse, M.; Seguin, P.; Paugam, C.; Lepape, A.; Meistelman, C.; et al. Short-course antibiotic therapy for critically ill patients treated for postoperative intra-abdominal infection: The DURAPOP randomised clinical trial. Intensive Care Med. 2018, 44, 300–310. [CrossRef] [PubMed]
135. Bass, G.A.; Dzierba, A.L.; Taylor, B.; Lane-Fall, M.; Kaplan, L.J. Tertiary peritonitis: Considerations for complex team-based care. Eur. J. Trauma. Emerg. Surg. 2022, 48, 811–825. [PubMed]
136. Marques, H.S.; Araújo, G.R.L.; da Silva, F.A.F.; de Brito, B.B.; Versiani, P.V.D.; Caires, J.S.; Milet, T.d.C.; de Melo, F.F. Tertiary peritonitis: A disease that should not be ignored. World J. Clin. Cases 2021, 9, 2160–2169. [CrossRef] [PubMed]
137. Prest, J.; Nguyen, T.; Rajah, T.; Prest, A.B.; Sathananthan, M.; Jeganathan, N. Sepsis-Related Mortality Rates and Trends Based on Site of Infection. Crit. Care Explor. 2022, 4, e0775.
138. Cavaillon, J.; Singer, M.; Skirecki, T. Sepsis therapies: Learning from 30 years of failure of translational research to propose new leads. EMBO Mol. Med. 2020, 12, e10128. [CrossRef]
139. Baggs, J.; Jernigan, J.A.; Halpin, A.L.; Epstein, L.; Hatfield, K.M.; McDonald, L.C. Risk of Subsequent Sepsis within 90 Days after a Hospital Stay by Type of Antibiotic Exposure. Clin. Infect. Dis. 2018, 66, 1004–1012. [CrossRef]
140. Teshome, B.F.; Vouri, S.M.; Hampton, N.; Kollef, M.H.; Micek, S.T. Duration of Exposure to Antipseudomonal _-Lactam Antibiotics in the Critically Ill and Development of New Resistance. Pharmacotherapy 2019, 39, 261–270.
141. Raman, K.; Nailor, M.D.; Nicolau, D.P.; Aslanzadeh, J.; Nadeau, M.; Kuti, J.L. Early Antibiotic Discontinuation in Patients with Clinically Suspected Ventilator-Associated Pneumonia and Negative Quantitative Bronchoscopy Cultures. Crit. Care Med. 2013,41, 1656–1663.
142. Sawyer, R.G.; Claridge, J.A.; Nathens, A.B.; Rotstein, O.D.; Duane, T.M.; Evans, H.L.; Cook, C.H.; O’neill, P.J.; Mazuski, J.E.;Askari, R.; et al. Trial of Short-Course Antimicrobial Therapy for Intraabdominal Infection. N. Engl. J. Med. 2015, 372, 1996–2005.[CrossRef] [PubMed]
143. Yahav, D.; Franceschini, E.; Koppel, F.; Turjeman, A.; Babich, T.; Bitterman, R.; Neuberger, A.; Ghanem-Zoubi, N.; Santoro, A.; Eliakim-Raz, N.; et al. Seven Versus 14 Days of Antibiotic Therapy for Uncomplicated Gram-negative Bacteremia: A Noninferiority Randomized Controlled Trial. Clin. Infect. Dis. 2019, 69, 1091–1098. [PubMed]
144. Thorlacius-Ussing, L.; Andersen, C.Ø.; Frimodt-Møller, N.; Knudsen, I.J.D.; Lundgren, J.; Benfield, T.L. Efficacy of seven and fourteen days of antibiotic treatment in uncomplicated Staphylococcus aureus bacteremia (SAB7): Study protocol for a randomized controlled trial. Trials 2019, 20, 250.
145. Kim, C.J.; Song, K.H.; Park, K.H.; Kim, M.; Choe, P.G.; Oh M d et, a.l. Impact of antimicrobial treatment duration on outcome of Staphylococcus aureus bacteraemia: A cohort study. Clin. Microbiol. Infect. 2019, 25, 723–732. [CrossRef] [PubMed]
146. Chastre, J.;Wolff, M.; Fagon, J.Y.; Chevret, S.; Thomas, F.;Wermert, D.; Clementi, E.; Gonzalez, J.; Jusserand, D.; Asfar, D.; et al. Comparison of 8 vs 15 Days of Antibiotic Therapy for Ventilator-Associated Pneumonia in Adults: A Randomized Trial. JAMA 2003, 290, 2588. [CrossRef] [PubMed]
147. Bouglé, A.; Tuffet, S.; Federici, L.; Leone, M.; Monsel, A.; Dessalle, T.; Amour, J.; Dahyot-Fizelier, C.; Barbier, F.; Luyt, C.-E.; et al.Comparison of 8 versus 15 days of antibiotic therapy for Pseudomonas aeruginosa ventilator-associated pneumonia in adults: A randomized, controlled, open-label trial. Intensive Care Med. 2022, 48, 841–849.
148. Metersky, M.L.; Klompas, M.; Kalil, A.C. Less Is More: A 7-Day Course of Antibiotics Is the Evidence-Based Treatment for Pseudomonas aeruginosa Ventilator-Associated Pneumonia. Clin. Infect. Dis. 2023, 76, 750–752. [CrossRef]
149. Rouzé, A.; Martin-Loeches, I.; Povoa, P.; Makris, D.; Artigas, A.; Bouchereau, M.; Lambiotte, F.; Metzelard, M.; Cuchet, P.;Geronimi, C.B.; et al. Relationship between SARS-CoV-2 infection and the incidence of ventilator-associated lower respiratory tract infections: A European multicenter cohort study. Intensive Care Med. 2021, 47, 188–198. [CrossRef]
150. Assicot, M.; Bohuon, C.; Gendrel, D.; Raymond, J.; Carsin, H.; Guilbaud, J. High serum procalcitonin concentrations in patients with sepsis and infection. Lancet 1993, 341, 515–518.
151. Rau, B.; Krüger, C.M.; Schilling, M.K. Procalcitonin: Improved biochemical severity stratification and postoperative monitoring in severe abdominal inflammation and sepsis. Langenbeck’s Arch. Surg. 2004, 389, 134–144. [CrossRef]
152. Bouadma, L.; Luyt, C.E.; Tubach, F.; Cracco, C.; Alvarez, A.; Schwebel, C.; Schortgen, F.; Lasocki, S.; Veber, B.; Dehoux, M.; et al. Use of procalcitonin to reduce patients’ exposure to antibiotics in intensive care units (PRORATA trial): A multicentre randomised controlled trial. Lancet 2010, 375, 463–474. [PubMed]
153. De Jong, E.; Van Oers, J.A.; Beishuizen, A.; Vos, P.; Vermeijden,W.J.; Haas, L.E.; Loef, B.G.; Dormans, T.; van Melsen, G.C.; Kluiters, Y.C.; et al. Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients: A randomised, controlled, open-label trial. Lancet Infect. Dis. 2016, 16, 819–827. [PubMed]
154. Larsson, A.; Tydén, J.; Johansson, J.; Lipcsey, M.; Bergquist, M.; Kultima, K.; Mandic-Havelka, A. Calprotectin is superior to procalcitonin as a sepsis marker and predictor of 30-day mortality in intensive care patients. Scand. J. Clin. Lab. Investig. 2020, 80,156–161.
155. Parke, Å.; Unge, C.; Yu, D.; Sundén-Cullberg, J.; Strålin, K. Plasma calprotectin as an indicator of need of transfer to intensive care in patients with suspected sepsis at the emergency department. BMC Emerg. Med. 2023, 23, 16. [CrossRef]
156. Sartelli, M.; Chichom-Mefire, A.; Labricciosa, F.M.; Hardcastle, T.; Abu-Zidan, F.M.; Adesunkanmi, A.K.; Ansaloni, A.; Bala, M.; Balogh, Z.J.; Beltrán, M.A.; et al. The management of intra-abdominal infections from a global perspective: 2017 WSES guidelines for management of intra-abdominal infections. World J. Emerg. Surg. 2017, 12, 29. [CrossRef] [PubMed]
157. Zilberberg, M.D.; Shorr, A.F.; Micek, S.T.; Vazquez-Guillamet, C.; Kollef, M.H. Multi-drug resistance, inappropriate initial antibiotic therapy and mortality in Gram-negative severe sepsis and septic shock: A retrospective cohort study. Crit. Care 2014,18, 596.
158. Huang, C.T.; Tsai, Y.J.; Tsai, P.R.; Yu, C.J.; Ko,W.J. Severe Sepsis and Septic Shock: Timing of Septic Shock Onset Matters. Shock 2016, 45, 518–524. [CrossRef]
159. Vazquez-Guillamet, C.; Scolari, M.; Zilberberg, M.D.; Shorr, A.F.; Micek, S.T.; Kollef, M. Using the number needed to treat to assess appropriate antimicrobial therapy as a determinant of outcome in severe sepsis and septic shock. Crit. Care Med. 2014, 42, 2342–2349. [CrossRef]
160. Panidis, D.; Markantonis, S.L.; Boutzouka, E.; Karatzas, S.; Baltopoulos, G. Penetration of gentamicin into the alveolar lining fluid of critically ill patients with ventilator-associated pneumonia. Chest 2005, 128, 545–552. [CrossRef]
161. Tsuji, B.T.; Pogue, J.M.; Zavascki, A.P.; Paul, M.; Daikos, G.L.; Forrest, A.; Giacobbe, D.R.; Viscoli, C.; Giamarellou, H.; Karaiskos, I.; et al. International Consensus Guidelines for the Optimal Use of the Polymyxins: Endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti-infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and Society of Infectious Diseases Pharmacists (SIDP). Pharmacotherapy 2019, 39, 10–39.
162. Bassetti, M.; Peghin, M. How to manage KPC infections. Ther. Adv. Infect. Dis. 2020, 7, 2049936120912049. [PubMed]
163. Cano, A.; Gutiérrez-Gutiérrez, B.; Machuca, I.; Gracia-Ahufinger, I.; Pérez-Nadales, E.; Causse, M.; Castón, J.J.; Guzman-Puche,J.; Torre-Giménez, J.; Kindelán, K.; et al. Risks of Infection and Mortality among Patients Colonized with Klebsiella pneumoniae Carbapenemase-Producing K. pneumoniae: Validation of Scores and Proposal for Management. Clin. Infect. Dis. 2018, 66,1204–1210. [CrossRef] [PubMed]
164. Burillo, A.; Muñoz, P.; Bouza, E. Risk stratification for multidrug-resistant Gram-negative infections in ICU patients. Curr. Opin.Infect. Dis. 2019, 32, 626–637. [CrossRef] [PubMed]
165. Giannella, M.; Pascale, R.; Gutiérrez-Gutiérrez, B.; Cano, A.; Viale, P. The use of predictive scores in the management of patientswith carbapenem-resistant Klebsiella pneumoniae infection. Expert Rev. Anti Infect. Ther. 2019, 17, 265–273.
166. Wilson, G.M.; Suda, K.J.; Fitzpatrick, M.A.; Bartle, B.; Pfeiffer, C.D.; Jones, M.; Rubin, M.A.; Perencevich, E.; Evans, M.; Evans,C.T.; et al. Risk Factors Associated with Carbapenemase-Producing Carbapenem-Resistant Enterobacteriaceae Positive Cultures in a Cohort of US Veterans. Clin. Infect. Dis. 2021, 73, 1370–1378.
167. DeWaele, J.J.; Coccolini, F.; Lagunes, L.; Maseda, E.; Rausei, S.; Rubio-Perez, I.; Theodorakopoulou, M.; Arvanti, K. Optimized Treatment of Nosocomial Peritonitis. Antibiotics 2023, 12, 1711.
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 17.07.2024 00:01:00
[ACTIVE_FROM] => 17.07.2024 00:01:00
[SHOW_COUNTER] => 837
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829906
[VALUE] => Клинические рекомендации, Сепсис, Антибиотикотерапия
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Клинические рекомендации, Сепсис, Антибиотикотерапия
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829907
[VALUE] => Управление сепсисом: загадка антибиотикотерапии в контексте индивидуализации принятия решений
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Управление сепсисом: загадка антибиотикотерапии в контексте индивидуализации принятия решений
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830387
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829913
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829909
[1] => 829910
[2] => 829911
[3] => 829912
)
[VALUE] => Array
(
[0] => sepsis
[1] => klinicheskierekomendatsii
[2] => Antibakterial'naya terapiya
[3] => statia
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
[1] => klinicheskierekomendatsii
[2] => Antibakterial'naya terapiya
[3] => statia
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830387
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829913
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [
8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829909
[1] => 829910
[2] => 829911
[3] => 829912
)
[VALUE] => Array
(
[0] => sepsis
[1] => klinicheskierekomendatsii
[2] => Antibakterial'naya terapiya
[3] => statia
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
[1] => klinicheskierekomendatsii
[2] => Antibakterial'naya terapiya
[3] => statia
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Сепсис
[1] => Клинические рекомендации
[2] => Антибактериальная терапия
[3] => Статья
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 13.08.2025 01:26:24
[~TIMESTAMP_X] => 13.08.2025 01:26:24
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[FULLTEXT_INDEX] => N
[~FULLTEXT_INDEX] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Управление сепсисом: загадка антибиотикотерапии в контексте индивидуализации принятия решений
[BROWSER_TITLE] => Управление сепсисом: загадка антибиотикотерапии в контексте индивидуализации принятия решений
[KEYWORDS] => Клинические рекомендации, Сепсис, Антибиотикотерапия
[DESCRIPTION] =>
)
)







