Терапевтический потенциал микробиоты кишечника
Bassetti et al. Critical Care (2020) 24:105
Обзор
Терапевтический потенциал микробиоты кишечника в менеджменте сепсиса
Перевод оригинальной статьи «Therapeutic Potential of the Gut Microbiota in the Management of Sepsis»
Авторы Matteo Bassetti, Alessandra Bandera, Andrea Gori
Ключевые слова: микробиота, микробиом, дисбиоз, сепсис
Введение
За последние 20 лет в области микробиологии и инфекционных заболеваний благодаря открытию комплексного взаимодействия между хозяином, его иммунной системой, его микробиомом с разнообразнми патогенами, произошел сдвиг парадигмы. Фактически развитие метагеномики, метатранскриптомики, метапротеомики и метаболомики привело ученых к открытию еще одной генетической композиции у человека и ее внутренней структуры. Микробиом человека определяется, как коллективный геном, состоящий из геномов миллионов бактерий, вирусов и грибов и это все существует в каждом человеке с момента его рождения [1]. Желудочно-кишечный тракт человека, к примеру, содержит триллион бактерий, что формирует комплексную экосистему, известную сегодня как микробиота кишечника, и состояние этой микробиоты напрямую связано с состоянием здоровья человека и с его болезнями, особенно это касается госпитализированных пациентов [2]. Резидентская микробиота может соревноваться с патогенами за пространство, метаболиты и нутриенты, и может ингибировать патогены регуляцией иммунного ответа [хозяина]. Пертурбации этих механизмов могут привести к развитию инфекции, а вместе с терапией антибиотиками представлять наиболее частую причину дисрегуляции микробиома [3].
Взаимодействие между сепсисом и микробиомом определяется как «не до конца понимаемое дву-направленное взаимодействие». Одни доказательства свидетельствуют о том, что разнообразная и сбалансированная микробиота кишечника обладает возможностью усиливать иммунный ответ как на энтеральные (локальные) патогены, так и на системные, а нарушение баланса потенциально ведет к увеличению чувствительности к сепсису. Другие доказательства свидетельствуют о том, сам по себе состав микробиоты кишечника может быть поврежден сепсисом и методами его лечения, однако клинические последствия такой разбалансировки микробиома требуют дальнейших клинических исследований. В этой работе мы предоставляем обзор механизмов, с помощью которых микробиота кишечника влияет как на чувствительность к сепсису, так и на клинические исходы. После этого мы опишем потенциальные терапевтические эффекты вмешательств на микробиом кишечника в условиях сепсиса и у пациентов, находящихся в критическом состоянии.
Механизм развития дисбиоза при сепсисе
За последние годы резидентная микрофлора кишечника была идентифицирована, как ключевой фактор в исполнении большинства функций, таких как усвоение пищи, продукция гормонов и развитие иммунной системы. Более того, было показано, что нарушения микробиоты кишечника, называемые термином «дисбиоз», могут быть ответственны за чувствительность хозяина к инфекции.
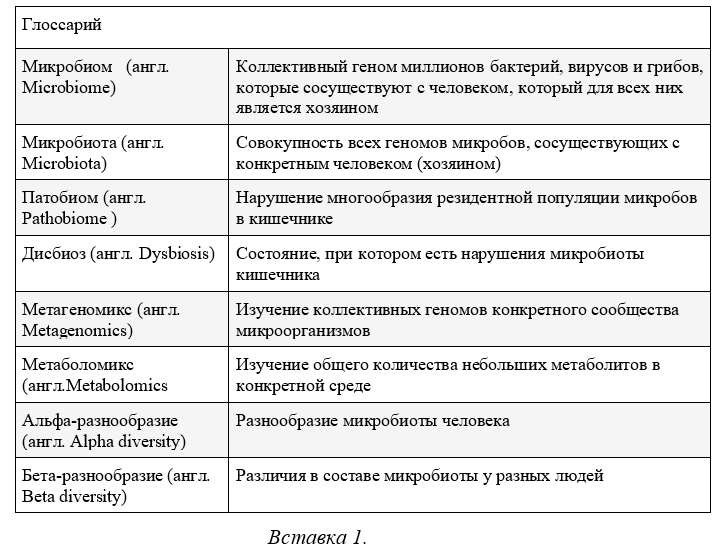
В общем и целом, микробиота кишечника представлена тремя основными доменами жизни: бактериями, археями и эукариотами. Микробиота кишечника человека имеет большое разнообразие видов бактерий - около 200 доминирующих видов и 1000 не доминирующих видов, а их состав варьируются от человека к человеку. Разнообразие микробиоты человека известно как альфа-разнообразие, тогда как различный состав микробиоты между людьми называется бета-разнообразием. Четыре типа представляют большинство членов микробиоты: Bacteroidetes, Firmicutes, Actinobacteria и Proteobacteria, причем первая и последняя составляют более 90% бактериальной популяции толстой кишки. Тип bacteroidetes состоит из грамотрицательных палочковидных бактерий, которые переваривают сложные полисахариды с выделением летучих короткоцепочечных жирных кислот и регулируют рост эпителиальных клеток кишечника, а также дифференциацию и стимуляцию иммунной системы. Тип Firmicutes состоит в основном из грамположительных бактерий, которые могут образовывать эндоспоры (класс Clostridia). Эти бактерии выделяют бутират, способствуя этим здоровью кишечного эпителия, и индуцируют Т-регуляторные клетки толстой кишки. Однако эти типы содержат клинически значимых представителей, таких как Bacteroides fragilis, Clostridium perfringens, Clostridium difficile, Enterococcus spp. и Streptococcus spp., которые при дисбиозе кишечника могут вызвать сепсис и летальный исход [2]. Поскольку состав микробиоты кишечника индивидуален для каждого человека, дисбиоз можно интерпретировать как относительное изменение состава комменсальной микробиоты человека, которое может быть: (1) потерей полезной микробиоты, (2) увеличением патогенной микробиоты или (3) снижением разнообразия микробиоты. Несколько механизмов, присутствующих при дисфункции кишечного барьера, можно рассматривать как результат и причину развития сепсиса, включая сюда повышенную проницаемость слизистой оболочки кишечника, отек тканей, снижение перфузии, нарушение регуляции коагуляции тканей, сдвиг микробиома кишечника, апоптотическое повреждение эпителия слизистой оболочки и бактериальную транслокацию. При сепсисе перфузия слизистой оболочки кишечника снижается, что приводит к нарушению барьерной функции слизистой оболочки с увеличением проницаемости [4]. Трансмиграция бактерий и эндотоксина может вызывать соответствующие системные эффекты, вызывая иммунный ответ в местной лимфоидной ткани, ассоциированной с кишечником (англ. gutassociated lymphoid tissue или GALT), которая, в свою очередь, активирует Toll-подобный рецептор 4 (англ. Toll-like receptor или TLR) и прайминг нейтрофилов, вызывая тем самым удаленное повреждение легких, что объясняет развитие острого респираторного дистресс-синдрома (ОРДС) при сепсисе [5]. Нарушение регуляции между различными резидентными бактериальными популяциями в кишечнике может привести к состоянию, называемому «патобиом», который в конечном итоге нарушает регуляцию иммунной системы [6] (Вставка 1). И действительно, у тяжелобольных пациентов гипоксическое повреждение, нарушение проницаемости эпителия, нарушение моторики кишечника и лечение вазопрессорами, парентеральное питание и опиоиды способствуют размножению патобионтов, включая сюда и бактерии с множественной лекарственной устойчивостью (англ. multidrug-resistant или MDR) [8]. Обычно микробиом кишечника пациентов с сепсисом в отделении интенсивной терапии (ОИТ) показывает потерю микробного богатства и разнообразия, доминирование одного таксона (часто потенциального патогена) и потерю специфичности участка кишечника (в контексте содержания определенной микрофлоры) с выделением одного и того же микроорганизма в нескольких участках кишечника [9]. Продолжительность дисбиоза в ОИТ, клинические последствия дисбиоза и фенотипы пациентов в критическом состоянии, более склонных к его развитию, все это аспекты, требующие уточнения.
Дисбиоз как потенциальный фактор риска при сепсисе
Обычно предполагается, что летальность от сепсиса связана с дисрегуляцией иммунного ответа, а возбудитель, послуживший причиной сепсиса, уже не привлекает к себе внимания и остается как бы в стороне [10]. И поскольку здоровая микробиота кишечника показывает свои защитные эффекты и предупреждает колонизацию бактериями с множественной лекарственной устойчивостью, некоторые исследователи высказали предположение, что сдвиг состава микробиоты потенциально может указать на пациентов, находящихся в состоянии иммуносупрессии и у которых риск развития сепсиса намного повышается.
У животных моделей - мыши, которых кормили вызывающей ожирение Западной диетой, богатой жиром и сахаром, но бедной волокнами - было показано, что они становились чувствительными к летальному сепсису с полиорганным повреждением после введения антибиотиков и после причинения им стерильной хирургической травмы, которая в других условиях была бы обратима. Анализ же микробиоты этих моделей показал, что такая Западная диета ведет к потере Bacteroidetes, увеличению Proteobacteria и даже к развитию очевидной резистентности к антибиотикам, развивающейся еще до введения антибиотиков. В этой прекрасной работе ясно показано, как сочетание выбранной диеты, антибиотиков и хирургической травмы может оказать свое отрицательное влияние на микробиом и привести к развитию сепсиса с органным повреждением даже при отсутствии экзогенного патогена [11]. Подобное недавнее исследование, проведенное Napier and colleagues на модели сепсиса, вызванного липополисахаридом (ЛПС), подтвердило влияние Западной диеты на течение болезни и исходы сепсиса, но не показало наличие какой-либо взаимосвязи с микробиомом. Также они показали, что мыши, получавшие Западную диету, имели более высокий исходный уровень воспаления и признаки связанного с сепсисом иммунопаралича по сравнению с мышами, получавшими стандартную пищу, богатую клетчаткой. У мышей с Западной диетой при сепсисе также был повышенный уровень нейтрофилов в крови, некоторые из них со «старым» фенотипом, по сравнению с мышами, получавшими стандартную диету, обогащенную клетчаткой. Важно отметить, что авторы также обнаружили зависимое от Западной диеты увеличение тяжести сепсиса и более высокую смертность, что не зависело от микробиома, предположив при этом о наличии прямого влияния диеты на регуляцию врожденной иммунной системы, механизм которого неизвестен [12]. Несколько ограниченных (по мощности) клинических исследований пациентов с сепсисом показали изменения в структуре микробиоты на исходном уровне. В недавнем исследовании различия в микробиоте кишечника и в уровне ЛПС в плазме оценивались у 32 пациентов, перенесших спленэктомию, а результаты сравнивались с контрольной группой, состоящей из 42 здоровых людей. Группа спленэктомии была разделена на три подгруппы в зависимости от продолжительности послеоперационного периода. Существенные различия наблюдались в составе микробиоты кишечника, измеренного с помощью секвенирования гена 16s рРНК, в отношении относительной численности бактерий 2 типов, 7 семейств и 15 родов. Уровень ЛПС был значительно выше в группе спленэктомии, чем в контрольной группе, и был отрицательно связан с пятью семействами бактерий с низкой численностью. Интересно, что степень изменения микробиоты кишечника увеличивалась с увеличением продолжительности послеоперационного периода [13]. Следующее исследование показало, что пациенты, перенесшие аллогенную трансплантацию костного мозга, и у которых развился вызванный антибиотиками дисбиоз, имели в 5–9 раз повышенный риск инфекции кровотока и сепсиса [14]. Эти наблюдения нашли свое подтверждение в ретроспективном когортном исследовании более 10 000 пожилых пациентов в Соединенных Штатах, которое показало, что дисбиоз был связан с более чем трехкратным увеличением частоты последующей госпитализации по поводу сепсиса [15]. Baggs et al. [16] недавно показали, что длительное воздействие антибиотиков, дополнительных классов антибиотиков и антибиотиков широкого спектра действия во время госпитализации связано с дозо-зависимым увеличением риска развития сепсиса. Эта связь не была обнаружена для других причин повторной госпитализации, что позволяет предположить, что воздействие антибиотиков и последующее развитие сепсиса связано с истощением микробиома, а не с тяжестью заболевания.
Таким образом, все больше и больше доказательств указывают на то, что разрушение микробиоты кишечника может увеличить риск развития сепсиса. Будущие инновации, направленные на восстановление или защиту микробиоты кишечника от разрушения, могут стать возможным подходом к предотвращению сепсиса, особенно в уязвимых группах населения.
Микробиота кишечника как предиктор клинического исхода при сепсисе
Предполагается, что переход микробиома в патобиом является той движущей силой, что приводит к тяжелым исходам и увеличивает летальность от сепсиса, по крайней мере, частично из-за способности вторгшихся бактерий действовать как антигены и, таким образом, модулировать иммунный ответ хозяина.
В различных исследованиях на животных моделях уже показано влияние микробиома кишечника на исход сепсиса. В недавно проведенном и очень хорошо спланированном исследовании была подвергнута анализу эволюция сепсиса у генетически идентичных мышей одного и того же возраста и пола, но полученных от разных производителей. Всем им была проведена перевязка и пункция слепой кишки (англ. cecal ligation and puncture или CLP), наиболее часто используемая модель сепсиса [17]. Бета-разнообразие микробиома, измеренное на фекалиях мышей из двух разных лабораторий, показало не только значительные различия но и, что более важно, мыши из первой лаборатории имели значительно более высокую смертность после CLP по сравнению с мышами из второй лаборатории (90% против 53%). Также были обнаружены различия в иммунных фенотипах селезеночных лимфоцитов или лимфоцитов Пейера. Чтобы проверить, являются ли различия в микробиоме ответственными за разные результаты, мышей, полученных из разных лабораторий, содержали вместе в течение 3 недель, после чего состав микробиоты у таких живущих вместе мышей стал аналогичным. Интересно то, что такие мыши имели одинаковую выживаемость, независимо от их происхождения, а различия в иммунном фенотипе исчезли. Этот элегантный эксперимент ясно показывает, что микробиом играет решающую роль в выживании и в иммунном ответе хозяина на сепсис, представляя тем самым потенциальную цель для терапевтического вмешательства.
Результаты клинических исследований также согласуются с наблюдениями о том, что на результаты при сепсисе может оказывать влияние нарушения микробиоты. В условиях ОИТ Shimizu et al. [6] количественно измеряли изменения в микробиоте кишечника у пациентов с синдромом системного воспалительного ответа (англ. systemic inflammatory response syndrome или SIRS) и обнаружили, что у таких пациентов было в 100–10 000 раз меньше анаэробов, включая Bifidobacterium и Lactobacillus, и в 100 раз больше бактерий Staphylococcus по сравнению со здоровыми добровольцами. Важным результатом этого исследования было то, что доминантным фактором, ассоциированным при сепсисе с летальностью и осложнениями, было количество облигатных анаэробов. Для изучения эффектов от динамики микробиома кишечника в одном одно-центровом исследовании провели проспективный анализ 12 пациентов ОИТ и показали, что изменения микробиома кишечника могут быть связаны с прогнозом исхода у пациента [18]. Действительно, пропорция Bacteroidetes и Firmicutes значительно изменяется во время нахождения пациента в ОИТ, а экстремальные изменения соотношения Bacteroides/Firmicutes были обнаружены у всех пациентов с неблагоприятным прогнозом, предполагая тем самым наличие корреляции между изменениями состава микробиоты кишечники и клиническими исходами при сепсисе [18].
Klingensmith and Coopersmith выдвинули гипотезу о том, что именно кишечник является «двигателем» синдрома полиорганной дисфункции (англ. multiple organ dysfunction syndrome или MODS) [19]. И эта гипотеза подтверждается доказательствами как со стороны животных моделей, так и при исследованиях ОРДС у человека, когда микробиота легких обогащена бактериями, переместившимися из кишечника (транслокация). Важно то, что наличие таких бактерий, как Bacteroides spp, связано со степенью системного и локального воспаления [20]. Более того, предварительные исследования на мышах и у пациентов, умерших от сепсиса, предполагают, что транслокация микробов из кишечника может быть связана с развитием нейро-воспаления при сепсисе [21]. Конечно, все эти наблюдения подтверждают то, что дисбиоз, наблюдаемый при сепсисе, потенциально может способствовать усилению воспаления и, как следствие, неблагоприятному клиническому исходу. Тем не менее, необходимы хорошо спланированные клинические исследования на людях, поскольку наши текущие знания о последствиях дисбиоза, связанного с ОИТ, в клинической практике ограничены.
Модуляция микробиоты как потенциального лечебного иммунного питания
Пробиотики рассматриваются как живые микроорганизмы, которые при достаточном их количестве могут оказать положительное влияние на иммунитет человека. Наиболее часто используемыми являются Lactobacillus и Bifidobacterium. Пробиотики все больше применяются и все больше изучаются в разных клинических условиях. Есть гипотеза о том, что пробиотики снижают риск болезни за счет конкурентного с патогенами связывания нутриентов, за счет продукции бактерицинов, что убивают патогены, за счет синтеза IgA, что поддерживает иммунную систему и снижает воспаление. Пребиотики рассматриваются, как не подлежащие перевариванию ингредиенты пищи, что положительно влияют на состояние хозяина, стимулируя рост и/или активность определенных видов бактерий, населяющих кишечник. Синбиотики рассматриваются, как сочетания пробиотиков с пребиотиками.
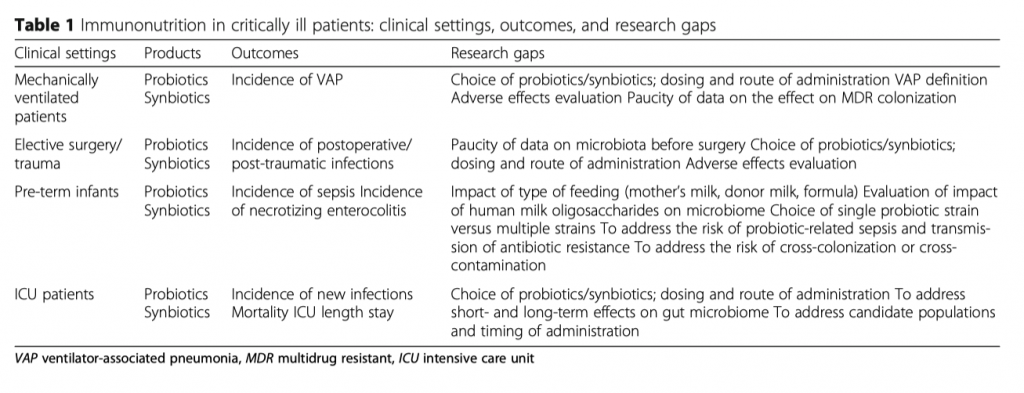
В контексте модели сепсиса и пациентов ОИТ пробиотики изучались в терминах эволюции сепсиса и последующих результатов. Chen and coauthors сообщили, что назначение с профилактической целью пробиотиков мышам с сепсисом эффективно снизило летальность [22]. Совсем недавнее исследование, проведенное на модели мышей с сепсисом, конкретно показало, что после начала сепсиса появлялись условно-патогенные микроорганизмы кишечника, такие как Staphylococcaceae и Enterococcaceae, с одновременным исчезновением полезных Prevotellaceae [23]. Относительное обилие потенциально патогенных комменсалов было связано с серьезными иммунными ответами во время сепсиса, сопровождалось более высокими уровнями периферических провоспалительных цитокинов, апоптозом эпителиальных клеток кишечника и нарушением плотных контактов (англ. tight junctions). Интересно, что у животных, которым предварительно назначались Lactobacillus rhamnosus GG, количество условно-патогенных микроорганизмов уменьшилось или даже исчезло в то время, как количество полезных бактерий, таких как Verrucomicrobiaceae, увеличилось, что способствовало ингибированию апоптоза эпителиальных клеток кишечника и образованию плотных контактов. Более того, в новой модели кишечника in vitro для изучения патогенности Candida, введение микробиоты антагонистических лактобацилл стало важным фактором защиты от некротического повреждения, вызванного C. albicans, с зависимостью от времени, дозы и вида [24]. Применение пребиотиков/пробиотиков/синбиотиков в клинических исследованиях в ОИТ изучалось во множестве небольших исследований в разных популяциях пациентов (см. Таб. 1) для профилактики инфекционных осложнений, особенно в послеоперационном периоде и у пациентов, находящихся на искусственной вентиляции легких; в целях улучшения клинических исходов при сепсисе; для восстановления комменсалов в кишечнике после сепсиса в целях профилактики поздних инфекционных осложнений и снижения летальности.
Применение пробиотиков и синбиотиков уже показало снижение инфекционных осложнений, а мета-анализы полагают, что их применение в целях предупреждения инфекций как в послеоперационном периоде, так и у пациентов, находящихся на ИВЛ, безопасно и эффективно [26]. Вместе с тем растут опасения, связанные как режимом дозирования пробиотиков, так и с тем, что все проведенные исследования были небольшими. Morrow et al. [28] в своем исследовании 138 пациентов ОИТ сообщили о существенном снижении частоты развития вентилятор-ассоциированной пневмонии (ВАП) у пациентов, получавших L.rhamnosus GG, по сравнению с контрольной группой (19.1% vs. 40.0%). Более того, применение пробиотиков значительно снизило орофарингеальную колонизацию и колонизацию желудка патогенами [27]. В тоже время, другие исследования не показывают какой-либо существенной разницы в возникновении ВАП в ОИТ. В недавнем рандомизированном контролируемом исследовании изучались эффекты от профилактического назначения синбиотиков пациентам с сепсисом, находящимся на ИВЛ, на состояние микробиоты и частоту инцидентов инфекционных осложнений в виде энтерита, ВАП и бактеремии. Семьдесят два пациента закончили исследование из которых 35 пациентов получили синбиотики, а 37 пациентов их не получили. В группе синбиотика инциденты в виде энтерита и ВАП случались значительно реже, чем в группе контроля. Но вот инциденты с бактериемией, а также и летальность, между группами существенно не различались [29]. В настоящий момент мы ждем результатов большого рандомизированного плацебо-контролируемого исследования [30], направленного на установление эффектов от L.rhamnosus GG на частоту инцидентов с ВАП и на другие важные клинические результаты (инфекции, вызванные C. difficile, вторичные инфекции, диарея) у пациентов, находящихся в критическом состоянии, которым проводится ИВЛ (Clinicaltrials.gov Identifier: NCT02462590).
В нескольких исследованиях оценивали роль пробиотиков в других популяциях, например у недоношенных детей и у детей с недостаточным весом, и не нашли различий в инцидентах с сепсисом и летальностью, что указывает на то, что потенциальные эффекты в виде восстановления микробиоты не идут единообразно для разных групп населения и для разных условий [31, 32]. Но вот что интересно, в недавнем рандомизированном двойном слепом, плацебо-контролируемом исследовании тестировали пероральную форму синбиотика (Lactobacillus plantarum в сочетании с олигосахаридами фруктов) у здоровых, доношенных детей в Индии и это исследование было прервано из-за снижения на 40% летальности и сепсиса в группе лечения [33].
Последний рубеж в контексте иммунного питания - разработка следующей генерации пробиотиков, способных селективно ингибировать специфические патогены типа C. difficile или полирезистентных бактерий в целях применения таких пробиотиков у целевой популяции для поддержания устойчивости к колонизации и предотвращения инфекционных осложнений и сепсиса [34].
Трансплантация фекальной микробиоты
Трансплантация фекальной микробиоты (англ. Fecal microbiota transplantation или FMT) заключается во введении фекального материала, полученного от здорового донора, в кишечный тракт пациента с повреждённой микробиотой для восстановления ее функции. Клинический интерес к такому методу лечения возродился в 2013 году после публикации результатов рандомизированного контролируемого исследования, показавшего существенное превосходство FMT над стандартной терапией рецидива инфекции, вызванной C. difficile [35]. Основываясь на абсолютном количестве представленных бактерий, FMT считается наиболее мощным инструментом иммуномодуляции. На животных моделях только лишь одно применение FMT способно восстановить сообщество бактерий в цекальных криптах, которые играют роль резервуара для бактерий комменсалов, восстанавливающих интестинальный эпителий. Скрипты также очень важны для защиты интестинальных стволовых клеток и для сохранения иммунологического пути, при котором увеличивается экспрессия Nod-подобных и Toll-подобных рецепторов. Истощение микроорганизмов комменсалов в криптах ускоряет пролиферацию патогенов, что приводит к тяжелому воспалению и нарушениям гомеостаза. Другая возможная польза от FMT может заключаться в том, что помимо перемещения бактерий, перемещаются и другие продукты, такие как коротко-цепочечные жирные кислоты, желчные кислоты, эукариоты, прокариотические вирусы, также представленные в экосистеме кишечника, что все вместе ведет к полному восстановлению гомеостаза [36].
Обоснований для применения FMT при критических состояниях более чем достаточно, но для окончательного решения недостаточно исследований. Мы верим, что FMT может быть полезен у пациентов, находящихся в критическом состоянии, в двух направлениях: (1) для восстановления микробиоты после ОИТ-индуцированного дисбиоза и (2) для деколонизации полирезистентной патогенной флоры в кишечнике. Фактически, введение большого количества бактерий комменсалов может обратить вспять доминирование резистентных патобионтов и даже снизить количество генов устойчивости к антибиотикам, присутствующие в микробиоме (т.н.резистом) [37]. Но на сегодня описано только пять случаев, в которых FMT применялся в ОИТ в целях устранения нарушений микробиоты. Все эти случаи показали, что лечение FMT приводило к успешному разрешению дисбиоза с последующим улучшением клинических результатов. Также, в некоторых случаях было отмечено крутое снижение воспалительных медиаторов и нормализация соотношений Th1/Th2 и Th1/Th17 после применения FMT. Но помимо трудностей с экстраполяцией данных, полученных из клинических случаев, на всю популяцию ОИТ, мы все еще далеки от убедительных доказательств того, что применение FMT при критических заболеваниях несет в себе пользу. Но, опираясь на многообещающие результаты от применения FMT при лечении C. difficile, необходимо провести клинические исследования для внедрения в практику подхода, нацеленного на микробиоту.
Колонизация полирезистентной микрофлорой является ведущей причиной осложнений при сепсисе, особенно это касается пациентов ОИТ [38]. И здесь применение FMT изучалось в различных сериях случаев, в ретроспективных и проспективных исследованиях, проливших свет на безопасность и эффективность такого подхода [39]. Однако, полученные результаты с трудом поддаются анализу из-за высокого риска систематической ошибки в небольших исследованиях, но в недавнем обзоре, в котором рассматривались только исследования с низким и умеренным риском систематической ошибки, был описан уровень эрадикации от 37,5% до 87,5% [40]. Но все же, мы не можем полагаться на результаты разных исследований по причине различий в популяции пациентов. Большую часть выделенных микроорганизмов до начала FMT составили: резистентная к карбапенемам Enterobacteriaceae [CRE], резистентные к ванкомицину Enterococci [VRE] и продуцирующие β-лактамазы расширенного спектра бактерии [ESBL], включая сюда Pseudomonas, а также метициллин-резистентный S. aureus [MRSA] и Acinetobacter. К тому же была большая разница в путях введения, выборе донора, длительности последующего наблюдения [39]. Недавнее рандомизированное контролируемое исследование показало, что у пациентов, которые принимали не всасывающиеся пероральные антибиотики с последующей FMT, немного снизилась колонизация ESBL и CRE по сравнению с контрольной группой, но без существенной статистической разницы. Такие неблагоприятные результаты в большей степени могут быть связаны с дизайном исследования - два разных пути введения FMT в группе вмешательства и применение антибиотиков могли повлиять на носительство в группе вмешательства, а также на результаты могло повлиять и раннее прекращение исследования [41]. И здесь важно отметить, что до сих пор ни одно из опубликованных исследований не проводилось у пациентов в ОИТ. В настоящее время проводится только одно пилотное исследование среди пациентов ОИТ с предварительным включением 10 пациентов на ИВЛ и с колонизацией MDR (Clinicaltrials. gov Identifier: NCT03350178).
Тем не менее, остается множество нерешенных проблем, особенно это касается пациентов в ОИТ, и в первую очередь, растет озабоченность по поводу самой технологии трансплантации фекальной микробиоты - трансмиссия патогенов, режим дозирования, пути введения, безопасность в долгосрочной перспективе. К тому же остаются нерешенными вопросы клинической практики и самый главный из них - мы не знаем ту специфическую часть популяции пациентов ОИТ с сепсисом, которой применение FMT принесет наибольшую пользу, а также необходимое время для применения, особенно это важно при одновременном назначении антибиотиков из-за возможного обнуления эффекта от трансплантации фекальной микробиоты.
Суспензия микробиоты, как переносчик фекального фильтрата (англ. fecal filtrate transfer или FFT), по-видимому, поддерживает способность стимулировать ответы хозяина через рецепторы распознавания образов, позволяя изменять экологические ниши для роста содержащихся в FMT полезных бактерий или даже для успешной новой колонизации этими бактериями [42]. И такая характеристика, при условии создания капсулы для перорального введения, может увеличить шансы на успешное применение FMT даже во время лечения антибиотиками, снижая также потенциальный риск инстилляции большого количества бактерий среди пациентов с ослабленным иммунитетом.
Более того, необходимо понять, какой путь введения будет лучшим - колоноскопия или клизма или назогастральный зонд. Что лучше - аутологичная трансплантация или гетерологичная? Рандомизированное исследование показало, что введение FMT в назогастральный зонд было менее эффективным по сравнению с введением FMT при колоноскопии [43]. Мнение экспертов склоняется к колоноскопии из-за возможности осмотра толстой кишки и доставки большего количества FMT непосредственно к патологическому сегменту кишечника [44]. В тоже время в другом рандомизированном исследовании показана сравнимая с колоноскопией эффективность от приема капсул [45]. И, наконец, необходимо внести ясность в вопрос о том, какой же из трансплантатов, аутологичный или гетерологичный, будет наиболее эффективен у пациентов ОИТ в попытке предотвратить развитие инфекций у пациентов с дисбиозом.
И в заключение мы верим, что потенциальная польза, что принесет применение FMT в отношении контроля за полирезистентными бактериями и C. difficile, подтвердится в исследованиях этого многообещающего подхода при лечении пациентов в ОИТ.
Заключение и перспективы
Несмотря на впечатляющие достижения в изучении микробиома, все еще существует огромный пробел в наших знаниях относительно микроорганизмов, обитающих за пределами кишечника, и относительно взаимодействия бактерий с вирусами, археями, гельминтами, грибами и простейшими, которые влияют друг на друга и на организм человека, а также как все эти процессы регулируются иммунной системой. В контексте тяжелобольных пациентов с сепсисом нам необходимы крупные когортные исследования людей, результаты которых с наибольшей точностью определят состав микробиоты до, во время и после эпизода сепсиса для того, чтобы определить защищающие комменсалы и микробиоту, потенциально связанных с повышенной восприимчивостью и худшим исходом.
В то же время новые возможности в лечении, нацеленные на конкретное инфекционное заболевание, получают все большее распространение в клинической практике, включая сюда пробиотики, индивидуализированную микробиомную терапию и выбор конкретного пополнения комменсалов. В этих условиях исследования на людях и рандомизированные клинические испытания являются сложной задачей, но все же имеют фундаментальное значение для преобразования фундаментальных исследований в инновационные парадигмы.
References
1. Harris VC, Haak BW, Boele van Hensbroek M, et al. The intestinal microbiome in infectious diseases: the clinical relevance of a rapidly emerging field. Open Forum Infect Dis. 2017;4:3.
2. Kim S, Covington A, Pamer EG. The intestinal microbiota: antibiotics, colonization resistance, and enteric pathogens. Immunol Rev. 2017;279:90–105.
3. Buffie CG, Pamer EG. Microbiota-mediated colonization resistance against intestinal pathogens. Nat Rev Immunol. 2013;13:790–801.
4. Hausser F, Chakraborty S, Halbgebauer R, et al. Challenge to the intestinal mucosa during sepsis. Front Immunol. 2019;10:891.
5. Dickson RP, Pamer EG, Newstead MV, et al. Enrichment of the lung microbiome with the gut bacteria in sepsis and the acute respiratory distress syndrome. Nat Microbiol. 2016;1:16113.
6. Shimizu K, Ogura H, Hamasaki T, et al. Altered gut flora are associated with septic complications and death in critically ill patients with systemic inflammatory response syndrome. Dig Dis Sci. 2011;56:1171–7.
7. Akram K, Sweeney DA. The microbiome of the critically ill patient. Curr Opin Crit Care. 2018;24:49–54.
8. Donskey CJ. Antibiotic regimens and intestinal colonization with antibioticresistant Gram-negative bacilli. Clin Infect Dis. 2006;43:S62–9.
9. Yeh A, Rogers MB, Firek B, et al. Dysbiosis across multiple body sites in critically ill adult surgical patients. Shock. 2016;46:649–54.
10. Alverdy JC, Krezalek MA. Collapse of the microbiome, emergence of the pathobiome and the immunopathology of sepsis. Crit Care Med. 2017;45:337–47.
11. Hyoju SK, Zaborin A, Keskey R, et al. Mice fed an obesogenic western diet, administered antibiotics, and subjected to a sterile surgical procedure develop lethal septicemia with multidrug resistant pathobionts. mBio. 2019;10:e00903–19.
12. Napier BA, Andres-Terre M, Massis LM, et al. Western diet regulates immune status and the response to LPS-driven sepsis independent of diet-associated microbiome. Proc Natl Acad Sci U S A. 2019;116:3688–94.
13. Zhu H, Liu S, Li S, et al. Altered gut microbiota after traumatic splenectomy is associated with endotoxemia. Emerg Microbes Infect. 2018;7:1–10.
14. Taur Y, Xavier JB, Lipuma L, et al. Intestinal domination and the risk of bacteremia in patients undergoing allogeneic hematopoietic stem cell transplantation. Clin Infect Dis. 2012;55:905–14.
15. Prescott HC, Dickson RP, Rogers MA, et al. Hospitalization type and subsequent severe sepsis. Am J Respir Crit Care Med. 2015;192:581–8.
16. Baggs J, Jernigan JA, Halpin AL, et al. Risk of subsequent sepsis within 90 days after hospital stay by type of antibiotic exposure. Clin Infect Dis. 2018;66:1004–12.
17. Fay KT, Klingensmith NJ, Chen CW, et al. The gut microbiome alters immunophenotype and survival from sepsis. FASEB J. 2019;33:11258–69.
18. Ojima M, Motooka D, Shimizu K, et al. Metagenomic analysis reveals dynamic changes of whole gut microbiota in the acute phase of intensive care unit patients. Dig Dis Sci. 2016;61:1628–34.
19. Klingensmith NJ, Coopersmith CM. The gut as the motor of multiple organ dysfunction in critical illness. Crit Care Clin. 2016;32:203–12.
20. Dickson RP, Singer BH, Newstead MW, et al. Enrichment of the lung microbiome with gut bacteria in sepsis and the acute respiratory distress syndrome. Nat Microbiol. 2016;1:16113.
21. Singer BH, Dickson RP, Denstaedt SJ, et al. Bacterial dissemination to the brain in sepsis. Am J Respir Crit Care Med. 2018;197:747–56.
22. Chen L, Xu K, Gui Q, et al. Probiotic pre-administration reduces mortality in a mouse model of cecal ligation and puncture-induced sepsis. Exp Ther Med. 2016;12:1836–42.
23. Chen L, Li H, Li J, et al. Lactobacillus rhamnosus GC treatment improves intestinal permeability and modulates microbiota dysbiosis in an experimental model of sepsis. Int J Mol Med. 2019;43:1139–48.
24. Graf K, Last A, Gratz R, et al. Keeping Candida commensal—How lactobacilli antagonize pathogenicity of Candida albicans in an in vitro gut model. Dis Model Mech. 2019;14:dmm039719.
25. Manzanares W, Lemieux M, Langlois PL, Wischmeyer PE. Probiotic and synbiotic therapy in critical illness: a systematic review and meta-analysis. Crit Care. 2016;20:262.
26. Kasatpibal N, Whitney JD, Saokaew S, Kengkla K, Heitkemper MM, Apisarnthanarak A. Effectiveness of probiotic, prebiotic, and synbiotic therapies in reducing postoperative complications: a systematic review and network meta-analysis. Clin Infect Dis. 2017;64:S153–60.
27. Morrow LE, Kollef MH, Casale TB. Probiotic prophylaxis of ventilatorassociated pneumonia: a blinded, randomized, controlled trial. Am J Respir Crit Care Med. 2010;182:1058–64.
28. Knight DJ, Gardiner D, Banks A, et al. Effect of synbiotic therapy on the incidence of ventilator associated pneumonia in critically ill patients: a randomised, double-blind, placebo- controlled trial. Intensive Care Med. 2009;35:854–61.
29. Shimizu K, Yamada T, Ogura H, et al. Synbiotics modulate gut microbiota and reduce enteritis and ventilator-associated pneumonia in patients with sepsis: a randomized controlled trial. Crit Care. 2018;22:239.
30. Johnstone J, Heels-Ansdell D, Thabane L, et al. For the PROSPECT Investigators and the Canadian Critical Care Trials Group. Evaluating probiotics for the prevention of ventilator-associated pneumonia: a randomised placebo-controlled multicentre trial protocol and statistical analysis plan for PROSPECT. BMJ Open. 2019;9:e025228.
31. Jacobs SE, Tobin JM, Opie GF, et al. Probiotic effects on late-onset sepsis in very preterm infants: a randomized controlled trial. Pediatrics. 2013;132:1055–62.
32. Costeloe K, Hardy P, Juszczak E, Wilks M, Millar MR. Bifidobacterium breve BBG-001 in very preterm infants: a randomised controlled phase 3 trial. Lancet. 2016;387:649–60.
33. Panigrahi P, Parida S, Nanda NC, et al. A randomized synbiotic trial to prevent sepsis among infants in rural India. Nature. 2017;548:407–12.
34. Pamer EG. Resurrecting the intestinal microbiota to combat antibioticresistant pathogens. Science. 2016;352:535–8.
35. Kelly CR, Ihunnah C, Fisher M, et al. Fecal microbiota transplant for treatment of Clostridium difficile infection in immunocompromised patients. Am J Gastroenterol. 2014;109:1065–71.
36. Van Nood E, Speelman P, Nieuwdorp M, et al. Fecal microbiota transplantation: facts and controversies. Curr Opin Gastroenterol. 2014;30:34–9.
37. Li Q, Wang C, Tang C, et al. Successful treatment of severe sepsis and diarrhea after vagotomy utilizing fecal microbiota transplantation: a case report. Crit Care. 2015;19:37.
38. Wang Z, Qin RR, Huang L, et al. Risk factors for carbapenem-resistant Klebsiella pneumoniae infection and mortality of Klebsiella pneumoniae infection. Chin Med J. 2018;131:56–62.
39. Gargiullo L, Del Chierico F, D’Argenio P, et al. Gut microbiota modulation for multidrug resistant organism decolonization: present and future perspectives. Front Microbiol. 2019;1704:10.
40. Saha S, Tariq R, Tosh PK, et al. Faecal microbiota transplantation for eradicating carriage of multidrug resistant organisms: a systematic review. Clin Microbiol Infect. 2019;25:958–61.
41. Huttner BD, De Lastours V, Wassenberg M, et al. A 5-day course of oral antibiotics followed by faecal transplantation to eradicate carriage of multidrug-resistant Enterobacteriaceae: a randomized clinical trial. Clin Microbiol Infect. 2019;25:830–8.
42. Ott SJ, Waetzig GH, Rehman A. Efficacy of sterile fecal filtrate transfer for treating patients with Clostrodium difficile infection. Gastroenterology. 2017;152:799–811.
43. Gundacker ND, Tamhane A, Walker JB, et al. Comparative effectiveness of faecal microbiota transplant by route of administration. J Hosp Infect. 2017;96:349–52.
44. Ramai D, Zakhia K, Ofosu A, et al. Fecal microbiota transplantation: donor relation, fresh or frozen, delivery methods, cost effectiveness. Ann Gastroenterol. 2019;32:30–8.
45. Kao D, Roach B, Silva M, et al. Effect of oral capsule- vs colonoscopydelivered fecal microbiota transplantation on recurrent Clostridium difficile infection: a randomized clinical trial. JAMA. 2017;318:1985–93.
Bassetti et al. Critical Care (2020) 24:105