Array
(
[NAME] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса
[~NAME] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса
[PREVIEW_PICTURE] => Array
(
[ID] => 5615
[TIMESTAMP_X] => 11.11.2024 14:06:54
[MODULE_ID] => iblock
[HEIGHT] => 3648
[WIDTH] => 4475
[FILE_SIZE] => 405291
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/728/3l4yab8wn7ssm3i60315unrv49br2zke
[FILE_NAME] => preventive-coronavirus-vaccine-syringe.jpg
[ORIGINAL_NAME] => preventive-coronavirus-vaccine-syringe.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 2a798903703e87c10fb649076eb02d36
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/728/3l4yab8wn7ssm3i60315unrv49br2zke/preventive-coronavirus-vaccine-syringe.jpg
[UNSAFE_SRC] => /upload/iblock/728/3l4yab8wn7ssm3i60315unrv49br2zke/preventive-coronavirus-vaccine-syringe.jpg
[SAFE_SRC] => /upload/iblock/728/3l4yab8wn7ssm3i60315unrv49br2zke/preventive-coronavirus-vaccine-syringe.jpg
[ALT] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса
[TITLE] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса
)
[~PREVIEW_PICTURE] => 5615
[DETAIL_TEXT] => Roberson S, Nwosu S, Collar E et al. for the VICTAS Investigators
Association of Vitamin C, Thiamine, and Hydrocortisone Infusion With Long-term Cognitive, Psychological, and Functional Outcomes in Sepsis Survivors A Secondary Analysis of the Vitamin C, Thiamine, and Steroids in Sepsis Randomized Clinical Trial
Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса
Вторичный анализ использования витамина С, тиамина и стероидов в рандомизированном клиническом исследовании сепсиса
JAMA Network Open. 2023;6(2):e230380. doi:10.1001/jamanetworkopen.2023.0380
Абстракт
Сепсис связан с долгосрочными когнитивными нарушениями и худшими психологическими и функциональными последствиями. Потенциальные механизмы включают внутримозговой окислительный стресс и воспаление, однако мало что известно о влиянии ранней антиоксидантной и противовоспалительной терапии на когнитивные, психологические и функциональные исходы у выживших после сепсиса.
ЦЕЛЬ
Описать наблюдаемые различия в долгосрочных когнитивных, психологических и функциональных результатах приема витамина С, тиамина и гидрокортизона между экспериментальной и контрольной группами в рандомизированном клиническом исследовании Vitamin C, Thiamine, and Steroids in Sepsis (VICTAS).
В этом предварительно заданном вторичном анализе представлены 6-месячные результаты многоцентрового двойного слепого плацебо-контролируемого рандомизированного клинического исследования VICTAS, которое проводилось в период с августа 2018 г. по июль 2019 г. Взрослые пациенты с сепсис-индуцированной респираторной и / или с сердечно-сосудистой дисфункцией, которые дожили до выписки или 30-го дня, были набраны из 43 ОИТ в США. Участники были рандомизированы 1:1 либо в группу вмешательства, либо в контрольную группу. Когнитивные, психологические и функциональные результаты через 6 месяцев после рандомизации оценивались по телефону до января 2020 года. Анализ данных проводился в период с февраля 2021 года по декабрь 2022 года.
Группа вмешательства получала внутривенно витамин С (1,5 г), гидрохлорид тиамина (100 мг) и сукцинат гидрокортизона натрия (50 мг) каждые 6 часов в течение 96 часов или до смерти или выписки из ОИТ. Контрольная группа получала плацебо.
Когнитивные способности, риск посттравматического стрессового расстройства и депрессии, а также функциональное состояние оценивались с использованием набора стандартизированных инструментов, которые использовали во время часового телефонного разговора через 6 месяцев после рандомизации.
После исключения, раннего вывода и смерти в окончательную выборку вошли 213 участников (медиана [IQR] возраста 57 [47–67] лет; 112 мужчин [52,6%]), которые прошли оценку отдаленных результатов и были рандомизированы. либо в группу вмешательства (n = 108), либо в контрольную группу (n = 105). Группа вмешательства имела более низкие показатели непосредственной памяти (скорректированное ОШ [aOR], 0,49; 95% ДИ,0,26–0,89), более высокие шансы посттравматического стрессового расстройства (aOR, 3,51; 95% ДИ, 1,18–10,40) и более низкие шансы получения психиатрической помощи (aOR, 0,38; 95% CI, 0,16–0,89). Других статистически значимых различий в когнитивных, психологических и функциональных результатах между двумя группами обнаружено не было.
У выживших после сепсиса лечение витамином С, тиамином и гидрокортизоном не улучшило или не ухудшило когнитивные, психологические и функциональные результаты через 6 месяцев по сравнению с пациентами, получавшими плацебо. Эти результаты ставят под сомнение гипотезу о том, что антиоксидантная и противовоспалительная терапия во время критического состояния смягчает развитие долгосрочных когнитивных, психологических и функциональных нарушений у пациентов, переживших сепсис.
Введение
Сепсис — это системная воспалительная реакция на инфекцию, которая часто приводит к полиорганной недостаточности, повышению смертности и долгосрочным когнитивным и функциональным нарушениям.1,2 Из почти 2 миллионов случаев сепсиса в США ежегодно почти 55% требуют лечения в отделении интенсивной терапии (ОРИТ) и от 20% до 30% умирают.3 Выжившие после сепсиса имеют в 3-4 раза больший риск когнитивных нарушений от умеренной до тяжелой степени по сравнению с пациентами, госпитализированными без сепсиса.4 Выжившие после сепсиса также подвергаются большему риску развития синдрома после интенсивной терапии (ПИТ), совокупность симптомов, приводящих к долгосрочному когнитивному и психологическому ухудшению, а также к ухудшению качества жизни. 4-7 В то время как раннее назначение антибиотиков, гемодинамическая поддержка, инфузионная терапия и контроль источника инфекции были связаны с улучшением смертности 8,9когнитивные, психологические и функциональные нарушения, связанные с сепсисом, остаются серьезной проблемой общественного здравоохранения.10,11
Предполагается, что когнитивные нарушения после сепсиса являются результатом сочетания оксидативного стресса и длительного нейровоспаления, возникающего в результате начальной системной воспалительной реакции. Увеличение количества активных форм кислорода вызывает клеточное повреждение, которое в сочетании с постоянной активацией микроглии может способствовать дисфункции гематоэнцефалического барьера, потере синапсов и гибели нейронов.12-15 Витамин C является мощным антиоксидантом и может предотвратить снижение когнитивных способностей после сепсиса, защищая клетки от окислительного повреждения липидов.16,17
Люди - одни из немногих млекопитающих, которые не могут синтезировать витамин С эндогенно18 и подвержены риску истощения витамина С во время сепсиса.19-21 Как витамин С, так и гидрокортизон были связаны со снижением маркеров острого воспаления у пациентов с сепсисом 22,23 и могут действовать синергетически для предотвращения эндотелиальной дисфункции и восстановления функции эндотелия.24-26 Неблагоприятные когнитивные и психические эффекты дефицита витамина С у людей были признаны на протяжении веков.27Тиамин, со своей стороны , также часто недостаточен при сепсисе.28 Дефицит тиамина увеличивает маркеры воспаления29 и связан с когнитивными нарушениями 30 Эти данные свидетельствуют о том, что комбинация витамина С, гидрокортизона и тиамина может защитить пациентов от постсептических когнитивных нарушений. Кроме того, некоторые исследования предполагают преимущество в выживаемости при использовании того же терапевтического подхода.28
Тем не менее, из 5 крупных рандомизированных клинических испытаний 23,31-34 все, кроме одного, не смогли продемонстрировать улучшение выживаемости при терапии на основе витамина С. Хотя в одном из этих испытаний изучалось качество жизни через 6 месяцев,34 ни в одном исследовании на сегодняшний день не оценивалось влияние этих методов лечения на постсептические когнитивные и психологические исходы. Многоцентровое двойное слепое плацебо-контролируемое рандомизированное клиническое исследование витамина С, тиамина и стероидов при сепсисе (VICTAS) было проведено в период с августа 2018 г. по июль 2019 г. для проверки гипотезы о том, что эта комбинированная терапия улучшит клинически важные исходы у пациентов с сепсисом с индуцированной дыхательной и/или сердечно-сосудистой недостаточностью.35 Исследование было разработано априори для оценки основной цели воздействия на смертность и количество дней без ИВЛ и вазопрессоров, на которые, как было показано, схема лечения не влияла.36 Кроме того, испытание было разработано для вторичной цели изучения влияния этой комбинированной терапии на когнитивный, психологический и функциональный статус при 6-месячном наблюдении за участниками интервенционной и контрольной групп, что было в центре внимания этого вторичного анализа. 37 Мы предположили, что среди выживших после сепсиса, нуждающихся в вазопрессорной поддержке или ИВЛ, раннее лечение высокими дозами витамина С, тиамина и гидрокортизона улучшает когнитивные функции, психологические симптомы и функциональное состояние через 6 месяцев после рандомизации.
Методы
Детали протокола и анализа исследования VICTAS.35-37 Вкратце, взрослых пациентов с острой дыхательной и/или сердечной дисфункцией вследствие сепсиса, нуждавшихся в ИВЛ или вазопрессорной поддержке, набирали в 43 больницах США. Участники были рандомизированы 1:1 либо в группу вмешательства, либо в контрольную группу. Участники, исследователи и персонал исследовательской группы, ответственный за оценку результатов, не знали о распределении лечения. Испытание VICTAS, включая этот предварительно определенный вторичный анализ, было одобрено институциональным наблюдательным советом Johns HopkinsHospital. Участники или их законные представители предоставили письменное информированное согласие до регистрации и рандомизации. Мы следовали рекомендациям по составлению сводных стандартов отчетности об испытаниях (CONSORT).
Вмешательство состояло из внутривенного введения витамина С (1,5 г), гидрохлорида тиамина (100 мг) и сукцината гидрокортизона натрия (50 мг), которые вводились в течение 4 часов после рандомизации и каждые 6 часов после этого в течение 96 часов или до смерти или выписки изОРИТ в зависимости от того, что произошло раньше. Участники контрольной группы получали плацебо-инъекции соответствующего по объему физиологического раствора с той же частотой. Участников можно было лечить открытыми кортикостероидами, если клиницисты сочли это целесообразным; в случаях суточных доз, превышающих или равных 200 мг гидрокортизона (или эквивалента), аптека отказывалась от исследуемого гидрокортизона или соответствующего плацебо. Обученный исследовательский персонал ежедневно оценивал участников на наличие делирия в течение периода вмешательства, используя метод оценки спутанности сознания для ОРИТ в сочетании с Ричмондской шкалой возбуждения-седации. Все остальное клиническое ведение участников, включая энтеральное введение витаминов и питание, оставалось на усмотрение врачей.
Оценка долгосрочных результатов
При выписке или через 30 дней, в зависимости от того, что произошло раньше, участников приглашали на последующее телефонное интервью через 6 месяцев после рандомизации. Приглашение не требовало отдельного информированного согласия от основного исследования, но требовало выражения готовности участником или представителем участника связаться примерно через 6 месяцев. Чтобы облегчить долгосрочное удержание когорты, мы использовали период наблюдения от 5 до 8 месяцев. Последующие оценки проводились до января 2020 года.
Во время последующего телефонного интервью мы использовали ранее валидированный38 ряд инструментов когнитивной оценки, включая следующие: метод оценки спутанности сознания по телефону39 для оценки бреда; телефонное интервью для определения когнитивного статуса40 для оценки общей когнитивной функции; Шкала интеллекта взрослых Векслера, четвертое издание, субтест на объем цифр для оценки внимания и объема рабочей памяти; Шкала памяти Вешлера, четвертое издание, логическая память I и II для изучения немедленной и отсроченной памяти соответственно; Шкала интеллекта взрослых Векслера, четвертое издание, субтест сходства для оценки языковой концептуализации и словесной абстракции; контролируемый устный ассоциативный тест для оценки беглости речи; и тест завершения предложения Хейлинга для оценки торможения реакции как формы исполнительной функции. Более высокие баллы по этим инструментам указывают на лучшие результаты. Полное описание этих оценок, их соответствующих систем подсчета баллов и интерпретации результатов представлены в eAppendix 1 in Supplement 1. Для оценки психологического статуса мы использовали опросник посттравматического стрессового расстройства из 8 пунктов (PTSD-8)41 и Информационную систему измерения исходов, сообщаемых пациентами и краткую форму по депрессии 6 пунктов (PROMIS-6) (Patient-Reported Outcomes Measurement Information System Depression 6-item Short Form).42. Скрининг посттравматического стрессового расстройства (ПТСР) был привязан к опыту пребывания в ОИТ, и участники считались страдающими ПТСР, если они сообщали о наличии у них 3 или более баллов по шкале PTSD-8 в трех из 4 категорий симптомов.41
Участники считались страдающими депрессией, если общий уровень симптомов по PROMIS-6 превышало Т-балл 60, что соответствует умеренной депрессии по обычно используемым показателям депрессии.43 Более высокие баллы по PTSD-8 и PROMIS-6 указывают на худшие результаты. Эти инструменты и их критерии оценки более подробно описаны в eAppendix 1 inSupplement 1.
Мы использовали Katz Activities of Daily Living Scale 44 и Опросник функциональной активности45 для оценки базовой и функциональной деятельности в повседневной жизни соответственно. Более высокие баллы по этим инструментам указывают на худшие результаты. Мы использовали EuroQoL 5-Dimensions 3-Level (EQ-5D-3L)46 для оценки общего качества жизни, связанного со здоровьем. Более высокий балл по EQ-5D-3L отражает лучшие результаты. Мы включили дополнительные стандартизированные вопросы для оценки обращения за медицинской помощью после выписки47 (eAppendix 1 в Supplement 1).
Телефонные интервью длились около 60 минут. В случаях, когда участник не мог или не желал пройти официальную когнитивную и психологическую оценку по телефону (например, из-за болезни, чрезмерной усталости или когнитивного ухудшения), данные о функциональном состоянии и использовании медицинских услуг собирались у назначенного представителя пациента. Причины невозможности участия в индивидуальных оценках были зафиксированы.
Статистический анализ
Категориальные переменные сообщались с использованием частот и пропорций. Непрерывные переменные были указаны как средние значения с SD или медианы с IQR. Участники были проанализированы в соответствии с группой, в которую они были рандомизированы (т. е. группа вмешательства или контроль). Сравнение между группами, с двусторонними значениямиP использовали многомерную логистическую регрессию пропорциональных шансов для порядковых результатов и бинарную логистическую регрессию для дихотомических результатов.
Мы скорректировали следующие ковариаты: возраст, пол, раса и этническая принадлежность (определяемые по самоотчету или наблюдениям исследователя), уровень образования, оценка острого состояния и хронического состояния здоровья по версии II, наличие диабета, сопутствующие неврологические или сердечно-сосудистые заболевания, количество дней ИВЛ и продолжительность пребывания в ОРИТ. P < 0,05 считалось статистически значимым. Для стандартизированных когнитивных оценок в статистическом анализе использовались баллы по шкале.
Этот вторичный анализ сообщал о ключевой вторичной цели исследования VICTAS. Испытание было явно направлено на достижение основной цели и было прекращено в административном порядке после набора 501 участника. Вторичный анализ был определен априори с целью описать величину различий между группами, а не сосредоточиться на проверке гипотез. Таким образом, поправки на множественность не вносились, и сообщалось о скорректированных размерах эффекта (т. е. об отношении шансов [ОШ]) с 95% ДИ. Для устранения недостающих данных о ковариатах использовалась множественная интерполяция на основе прогнозируемого среднего соответствия.
Приблизительно одна треть участников, опрошенных при последующем наблюдении, не смогли или не захотели выполнить полный набор когнитивных и психологических тестов (eAppendix 2 and eTable 2 in Supplement 1 описываются показатели прохождения отдельных тестов). Менее чем 7% включенных участников, которые не смогли пройти данную оценку из-за когнитивных нарушений, была присвоена самая низкая возможная оценка. Все остальные отсутствующие данные считались полностью случайными. Все анализы проводились в период с февраля 2021 г. по декабрь 2022 г. с использованием R версии 3.4.3 (R Foundation for Statistical Computing).
Результаты
Блок-схема регистрации, рандомизации и последующего наблюдения за участниками исследования VICTAS представлена на Figure 1. Из 501 рандомизированного участника 198 (39,5%) умерли до проведения оценки долгосрочных результатов (196 умерли в течение 180 дней после рандомизации и 2 умерли через 180 дней после рандомизации, но до того, как закончилось их 5-8-месячное окно наблюдения). Из оставшихся 303 участников 4 (1,3%) выбыли из исследования, а 40 (13,2%) не согласились на последующую оценку. Из 285 участников, доступных для последующего наблюдения, 32 (11,2%) не могли быть охвачены в течение 5–8-месячного окна последующего наблюдения, а 13 (4,6%) имели укороченное окно последующего наблюдения из-за административного прекращения исследования. Один участник был исключен в административном порядке из-за лишения свободы, а 26 (9,1%) отказались от оценки при последующем наблюдении.
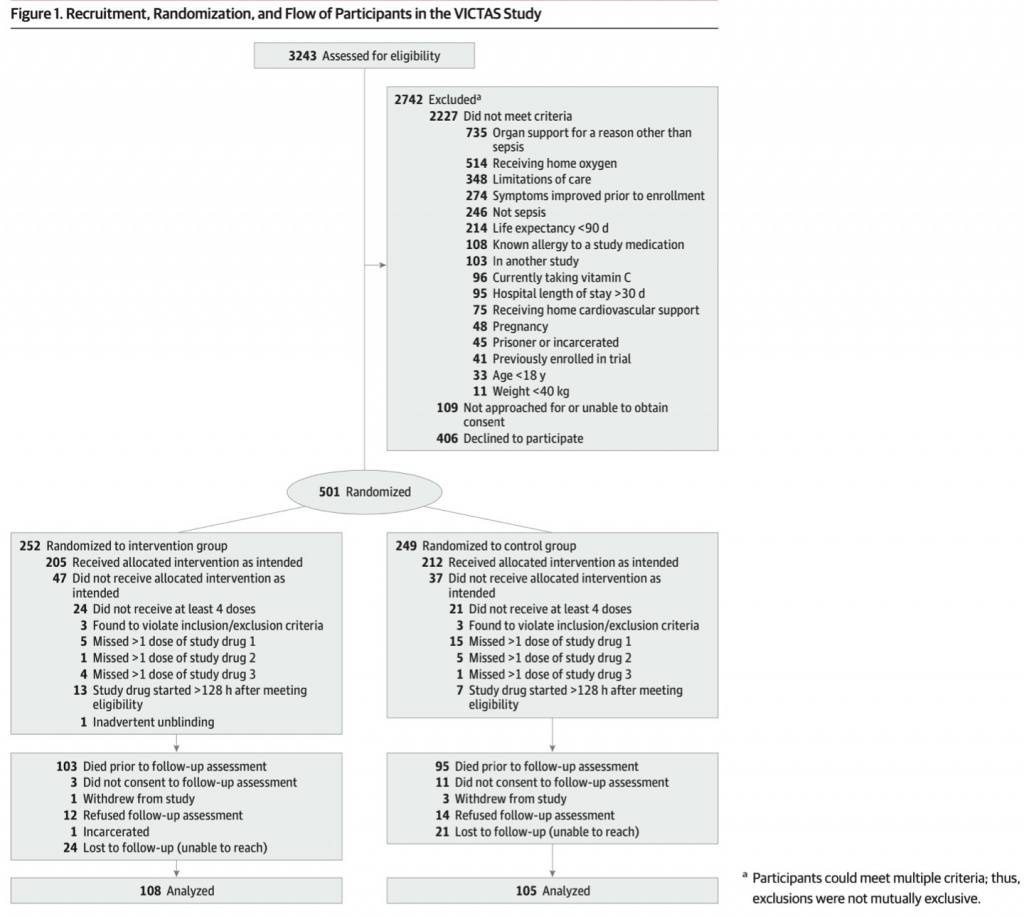
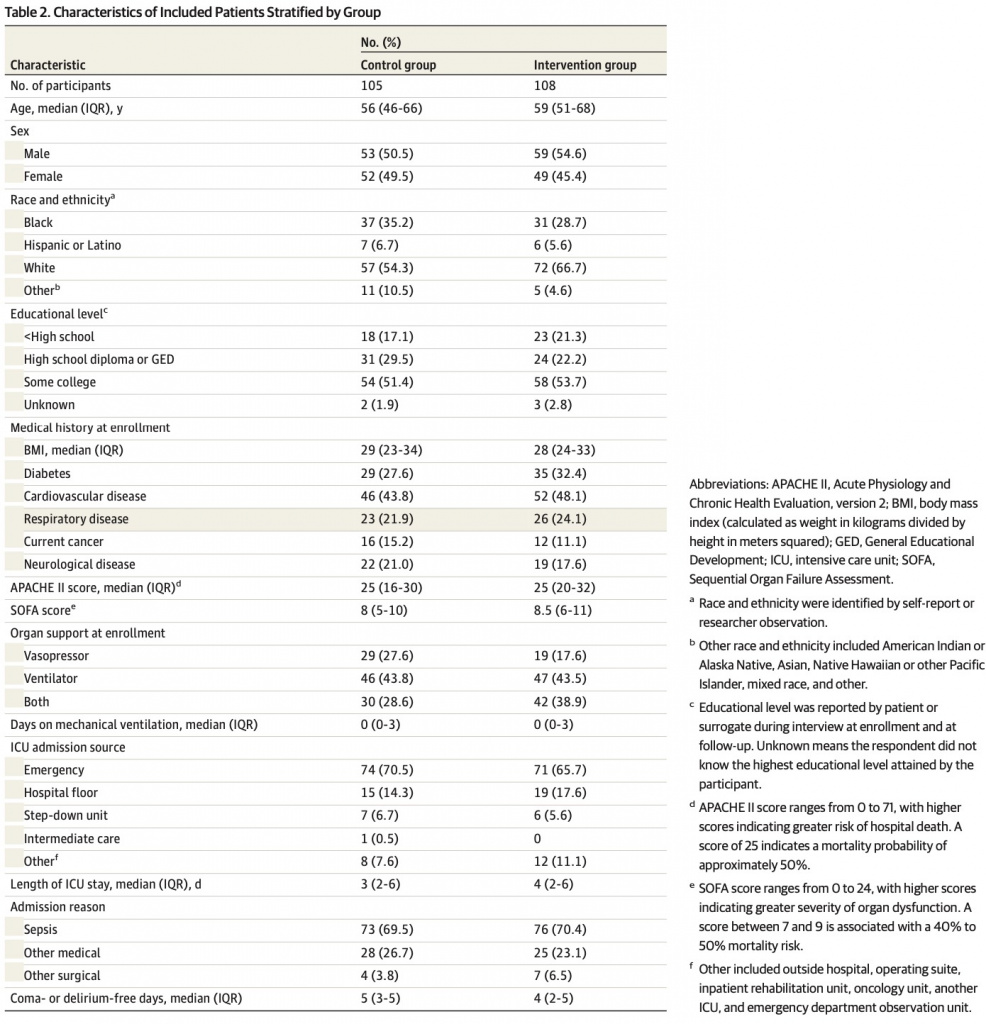
Окончательная выборка включала 213 участников, из которых 108 были рандомизированы в группу вмешательства, а 105 — в контрольную группу. Характеристики включенных участников описаны в Table 1 and eTable 1 in Supplement 1, наряду с умершими участниками и теми, для которых результаты были недоступны (например, из-за отказа или потери для последующего наблюдения). Включенные участники имели средний возраст (IQR) 57 (47-67) лет и состояли из 101 женщины (47,4%) и 112 мужчин (52,6%). Данные были представлены представителями участников только в 39 случаях (18,3%). Группа вмешательства и контрольная группа имели сопоставимые характеристики (Table 2), за исключением того, что в группу вмешательства входило больше белых участников, чем в контрольную группу (72 [66,7%] против 57 [54,3%]). 157 участников (73,7%) в группе последующего наблюдения, 72 (68,6%) в контрольной группе и 85 (78,7%) в группе вмешательства получали норадреналин парентерально.
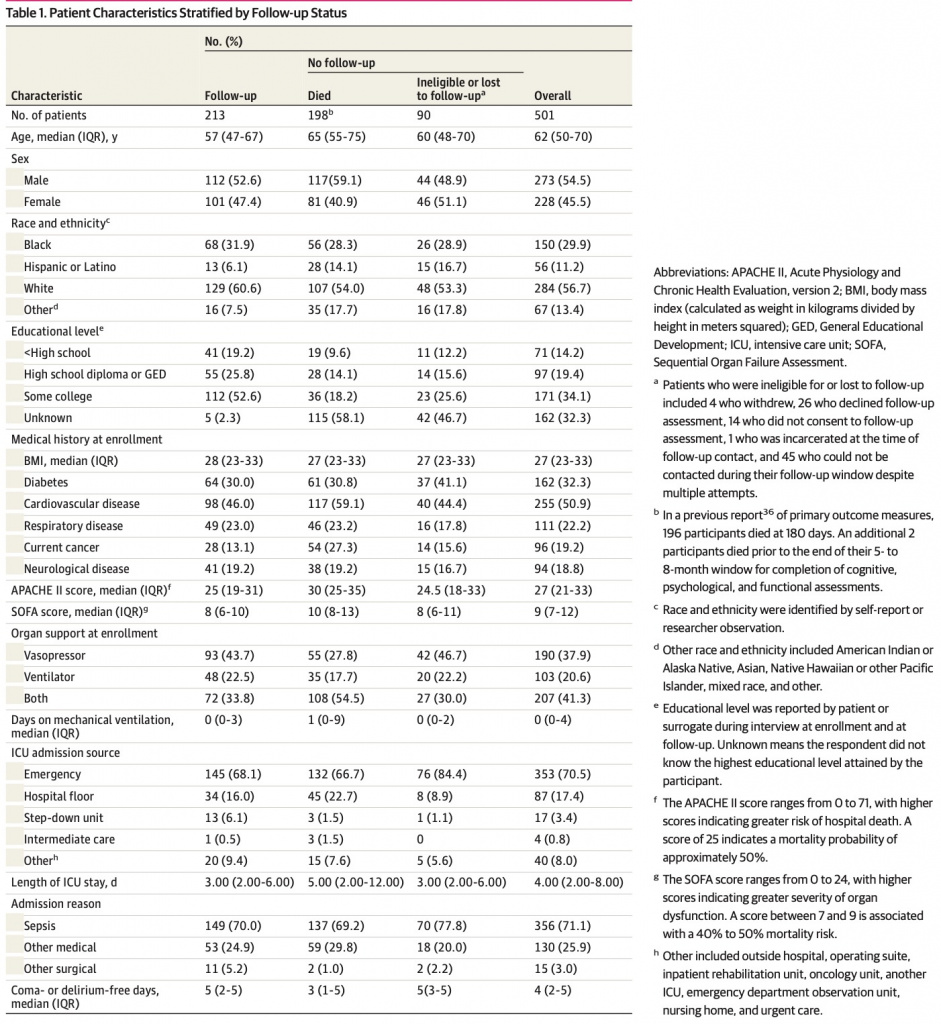
Шестьдесят шесть пациентов (31,0%) в контрольной когорте (32 пациента [30,5%] из контрольной группы и 34 [31,5%] из группы вмешательства) получали кортикостероиды в открытом доступе, находясь в ОРИТ.
Когнитивные результаты
Когнитивные результаты через 6 месяцев представлены в eTable 3 in Supplement 1, а эффекты лечения обобщены на Figure 2 и eAppendix 3 в Supplement 1. Ни один из участников, прошедших когнитивная оценку не имели делирий во время оценки.
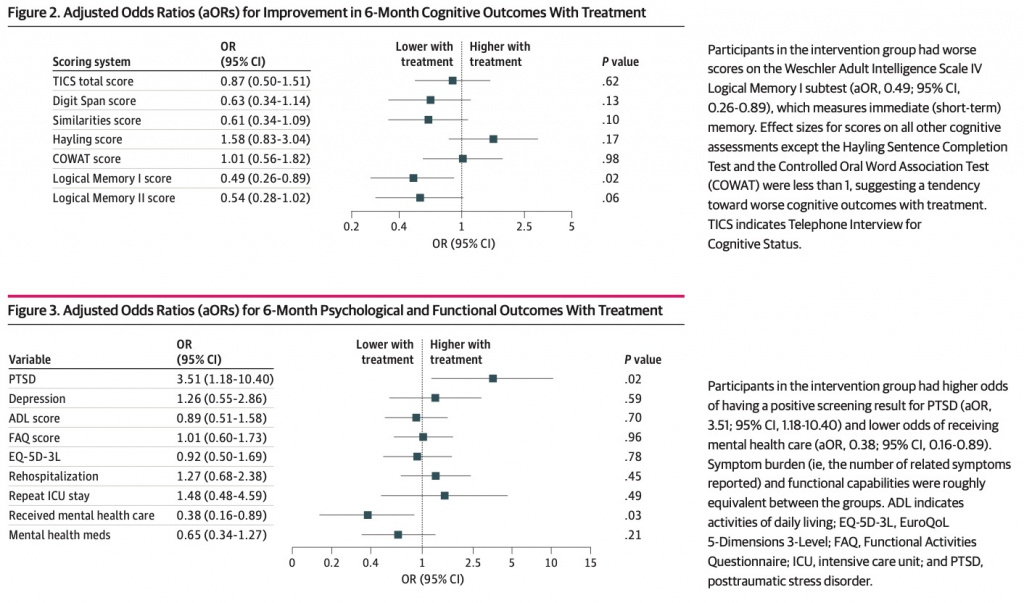
Лечение витамином С, тиамином и гидрокортизоном, как правило, ассоциировалось с ухудшением когнитивных функций со статистически значимым ухудшением непосредственной памяти (оценка логической памяти I; скорректированное ОШ [aOR], 0,49; 95% ДИ, 0,26–0,89; P= 0,02). ) (Figure 2 ). Точечная оценка эффекта лечения была ниже 1 для всех других когнитивных оценок (диапазон 0,49–0,87), за исключением теста завершения предложения Хейлинга (aOR, 1,58; 95% ДИ, 0,83–3,04; P = 0,17) и ассоциации контролируемой устной речи. Тест (aOR, 1,01; 95% ДИ, 0,56–1,82; P = 0,98) (Figure 2). Полный анализ случаев показал аналогичные размеры эффекта для всех когнитивных результатов (eAppendix 4 и eTable 4 в Supplement 1).
Психологические и функциональные результаты
ОШ для неблагоприятных психологических и функциональных исходов показаны на Figure 3, а подсчеты для каждой группы приведены в eTable 3 в Supplement 1, а вероятности представлены на графике в eAppendix 3 в Supplement 1.
Мы обнаружили посттравматическое стрессовое расстройство у 10 из 105 (9,5%) участников контрольной группы и 18 из 108 (16,7%) участников группы вмешательства (eTable 3 в Supplement 1). Лечение витамином С, тиамином и гидрокортизоном ассоциировалось с увеличением вероятности посттравматического стрессового расстройства (aOR, 3,51; 95% ДИ, 1,18–10,40; P = 0,02) (рис. 3). Депрессия выявлена у 50 из 142 (35,2%) участников, прошедших ПРОМИС-6. Статистических данных о влиянии лечения на депрессию не было (aOR, 1,26; 95% ДИ, 0,55–2,86; P = 0,59) (Figure 3).
Функциональный статус не отличался между экспериментальной и контрольной группами. ОШ составляло 0,89 (95% ДИ, 0,51–1,58; P = 0,70) для шкалы ежедневной активности Каца, 1,01 (95% ДИ, 0,60–1,73;P = 0,96) для опросника функциональной активности и 0,92 (95% ДИ, 0,50–1,69; P = 0,78) для общего состояния здоровья по EQ-5D-3L. Полный анализ психологических и функциональных результатов дал аналогичные результаты (eAppendix 4 и eTable 4 в Supplement1).
Вероятность повторной госпитализации была одинаковой между экспериментальной и контрольной группами (aOR, 1,09; 95% ДИ, 0,56–2,12; P = 0,79) (eTable 4 в Supplement 1). У участников группы вмешательства были более низкие шансы, чем у участников контрольной группы, получить официальную психиатрическую или психологическую помощь в течение 6 месяцев после выписки (aOR, 0,38; 95% ДИ, 0,16–0,89; P = 0,03) (Figure 3). В группе вмешательства также были более низкие шансы, чем в контрольной группе, сообщить об использовании лекарств для лечения депрессии или тревоги, хотя это различие не было статистически значимым (aOR, 0,65; 95% ДИ, 0,34–1,27; P = 0,21) (Figure 3).
Обсуждение
В предварительно заданном вторичном анализе выживших после сепсиса в исследованииVICTAS мы не обнаружили доказательств положительного влияния раннего лечения витамином С, тиамином и гидрокортизоном на когнитивные, психологические и функциональные исходы через 6 месяцев. Напротив, у участников группы вмешательства были более низкие показатели непосредственной памяти и более высокие шансы посттравматического стрессового расстройства по сравнению с участниками контрольной группы. Эти результаты опровергают гипотезу о том, что антиоксидантная и противовоспалительная терапия во время критического состояния может уменьшить развитие долговременной инвалидности, связанной с ПИТС, у выживших после сепсиса. Отсутствие положительного эффекта согласуется с результатами предыдущих рандомизированных клинических исследований, в которых не было выявлено снижения смертности и других исходов в стационаре при терапии витамином С.23,31-34.
The cognitive scores of both the intervention and control groups were similar in magnitude to those reported in other cohorts of ICU survivors.47,48 The median differences in scores for the cognitive assessments were 1 to 2 points on scales ranging from 0 to 10 or 20 (range of 0-100 in Controlled Oral Word Association Test), reflecting a relatively modest potential effect of the intervention on 6-month cognitive outcome. The rates of depression, PTSD, and functional disability were also commensurate with those previously reported49,50 and consistent with the outcomes typically observed in PICS.51-53
Тем не менее, наблюдение возможных долгосрочных негативных последствий у участников группы вмешательства является сигналом, который требует осторожности. Меньшее количество участников в группе вмешательства, чем в контрольной группе, получали психиатрическую помощь, несмотря на то, что у этих участников чаще демонстрировалось возможное посттравматическое стрессовое расстройство. Будущие исследования, оценивающие связь между неотложным лечением и долгосрочными результатами, должны рассмотреть вопрос о том, является ли интеркуррентная терапия смешанным фактором или исходом сама по себе.
Когнитивные баллы как в группе вмешательства, так и в контрольной группе были аналогичны тем, о которых сообщалось в других когортах выживших в отделении интенсивной терапии. (диапазон 0–100 в тесте контролируемых устных словесных ассоциаций), что отражает относительно скромный потенциальный эффект вмешательства на когнитивный результат через 6 месяцев. Частота депрессии, посттравматического стрессового расстройства и функциональных нарушений также соответствовала ранее сообщавшимся 49,50 и соответствовала исходам, обычно наблюдаемым при ПИТ-синдроме 51-53.
Может ли терапия на основе антиоксидантов действительно играть роль в повышенном риске неблагоприятных когнитивных, психологических и функциональных последствий у выживших после сепсиса? Повышенные шансы посттравматического стрессового расстройства, которые наблюдались в группе вмешательства, возможно, были в меньшей степени опосредованы ролью витамина С в качестве антиоксиданта и в большей степени его модуляцией метаболизма нейротрансмиттеров в головном мозге. Витамин С способствует превращению дофамина в норадреналин 54,55. Последний нейромедиатор является основным проводником locus coeruleus, который опосредует физические и эмоциональные реакции на стресс 56,57 и способствует консолидации аверсивных воспоминаний.58,59 Блокада рецепторов норадреналина обеспечивает угасание у животных, подвергающихся стрессовым воздействиям,60 подтверждая гипотезу о том, что передача норадреналина играет важную роль в патогенезе посттравматического стрессового расстройства.61 Если профилактика дефицита витамина С во время сепсиса сохраняет метаболизм норадреналина, возможно, что этот процесс повлиял на силу формирования аверсивных воспоминаний во время стрессового пребывания в ОИТ, что привело к более высоким шансам посттравматического стрессового расстройства. Совместное введение гидрокортизона с норэпинефрином потенцирует реакции памяти о страхе62 и, возможно, действовало синергетически, увеличивая риск посттравматического стрессового расстройства у участников исследования VICTAS.
В качестве альтернативы могли играть роль экзогенные норадреналин и/или кортикостероиды. Апостериорный обзор клинических данных показал, что 73,7% участников последующего наблюдения (68,6% в контрольной группе и 78,7% в группе вмешательства) получали норадреналин парентерально; 31,0% получали сопутствующую открытую терапию кортикостероидами. Дифференциальную роль экзогенных и эндогенных нейротрансмиттеров в патогенезе посттравматического стрессового расстройства еще предстоит выяснить. Более низкий уровень психиатрической помощи и более высокий уровень повторной госпитализации в группе вмешательства также могли повлиять на риск посттравматического стрессового расстройства.
Независимо от того, связана ли разница в исходах между группами напрямую с лечением, наблюдаемая частота посттравматического стрессового расстройства (13,1% [28 из 213 участников группы отдаленного наблюдения) была выше, чем распространенность в прошлом году от 3,5% до 6,1% в популяции населения в целом 63,64, оказывая дальнейшую поддержку рекомендациям Society of Critical Care Medicine по скринингу посттравматического стрессового расстройства и других симптомов, связанных с ПИТ-синдромом, после пребывания в ОРИТ.65
Предполагаемые механизмы снижения когнитивных функций после сепсиса включают внутримозговой окислительный стресс, воспаление и эндотелиальную дисфункцию.66 Витамин С, гидрокортизон и тиамин защищают нейроны от окислительного повреждения и останавливают системную воспалительную реакцию, и, таким образом, ожидается, что они уменьшат бремя долговременных неврологических нарушений. 16 Тем не менее, мы не обнаружили клинических доказательства такого эффекта в этом испытании. Возможно, что доза, время или продолжительность терапии были недостаточными для обеспечения адекватной клеточной защиты. Вмешательство было ограничено пребыванием в ОИТ (в среднем 3 дня среди контрольной когорты). Модели сепсиса на мышах позволяют предположить, что, хотя истощение запасов витамина С происходит в остром периоде болезни,19 существуют различные фазы нейровоспалительной реакции после перенесенного заболевания.67 Долговременные эффекты наблюдаются в центральной нервной системе после постоянной активации клеток микроглии.68,69 Индивидуумы могут зависеть от длительного восполнения запасов витамина С в течение всего периода восстановления, чтобы противодействовать окислительной нагрузке и защитить от посттравматического снижения когнитивных функций. Будущие исследования с длительным приемом витамина С после сепсиса могут проверить эту гипотезу.
Future studies evaluating the effect of acute therapeutic measures on long-term cognitive and psychiatric outcomes should track adherence to Society of Critical Care Medicine guidelines on the management of pain, agitation, and delirium.73
Длительность пребывания в ОРИТ с использованием опиатов или нервно-мышечной блокадой может способствовать возникновению психиатрических симптомов после критического состояния.70 Бензодиазепины являются факторами повышенного риска делирия в ОРИТ,71 что также связано с долгосрочными когнитивными нарушениями. 47 Ежедневное прерывание седации ограничивает этот риск. Будущие исследования, оценивающие влияние неотложных терапевтических мер на долгосрочные когнитивные и психические исходы, должны отслеживать соблюдение руководящих принципов Society of Critical Care Medicine в отношении боли, возбуждения и делирия.73
Ограничения
Это исследование имеет несколько ограничений. Во-первых, интерпретация была ограничена теми, кто пережил сепсис. Как выживаемость повлияла на интерпретацию результатов, было неясно, хотя понимание различий в исходах, о которых сообщают пациенты, на основе выживаемости остается ценным. Во-вторых, распространенной проблемой среди исследований когнитивных и психологических исходов после критического заболевания является незапланированный характер включения и, как следствие, сложность адекватной оценки преморбидных когнитивных и психологических расстройств. Несмотря на рандомизацию, у участников группы последующего наблюдения могут быть исходные различия в когнитивных показателях, которые нельзя количественно оценить или контролировать в анализе. Мы не собирали исходные когнитивные или психологические данные, что требует осторожной интерпретации результатов.
В-третьих, 40 из 303 подходящих участников (13,2%) не согласились на последующую оценку. Тот факт, что участники испытаний не были автоматически включены в этот вторичный анализ и должны были выразить готовность участвовать, мог увеличить отсев. Кроме того, исследование VICTAS было прекращено в административном порядке из-за прекращения финансирования, что привело к сокращению окна последующего наблюдения для небольшой части (4,6%) подходящих участников. Тем не менее, мы смогли получить по крайней мере частичную последующую оценку примерно 85% подходящих участников, и эти выжившие после сепсиса не отличались по характеристикам от тех, кто выбыл, отказался от оценки или в конечном итоге был потерян для последующего наблюдения. Некоторые участники не смогли или не захотели выполнить несколько оценок, а процент отсутствующих данных для нескольких оценок достиг почти 25%. Среди участников, которые были включены в группу последующего наблюдения, наиболее распространенной причиной невыполнения оценки был отказ пациента (eTable 2 в Supplement 1). Частота отсутствующих данных была одинаковой между группой вмешательства и контрольной группой, и отдельный анализ с использованием подхода полного случая дал аналогичные результаты. Эти наблюдения показывают, что показатели завершения не оказали существенного влияния на общие выводы. В-четвертых, в прагматических целях мы выбрали инструменты краткого скрининга в качестве меры психологического результата. Хотя эти инструменты хорошо приняты и обладают высокой чувствительностью и специфичностью для выявления посттравматического стрессового расстройства и депрессии, формальная диагностика требует углубленной оценки квалифицированным специалистом в области психического здоровья.
Выводы
В исследовании VICTAS у выживших после сепсиса, получавших раннее лечение витамином С, тиамином и гидрокортизоном в ОРИТ, когнитивные, психологические и функциональные исходы через 6 месяцев наблюдения либо не изменились, либо были хуже, чем у пациентов, получавших плацебо. Эти результаты не поддерживают антиоксидантную и противовоспалительную терапию и предполагают, что антиоксидантная и противовоспалительная терапия не смягчает развитие долгосрочных когнитивных, психологических и функциональных нарушений у пациентов с сепсисом, которым требуется использование вазопрессоров или респираторная поддержка в ОРИТ.
Дополнительно:
Ссылка на документ с дополнительными данными исследования - часть 1 (Supplementary 1)
Ссылка на документ с дополнительными данными исследования - часть 2 (Supplementary 2)
REFERENCES
1. Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801-810. doi:10.1001/jama.2016.0287
2. Buchman TG, Simpson SQ, Sciarretta KL, et al. Sepsis among Medicare beneficiaries: 1. the burdens of sepsis, 2012-2018. Crit Care Med. 2020;48(3):276-288. doi:10.1097/CCM.0000000000004224
3. Rhee C, Dantes R, Epstein L, et al; CDC Prevention Epicenter Program. Incidence and trends of sepsis in US hospitals using clinical vs claims data, 2009-2014. JAMA. 2017;318(13):1241-1249. doi:10.1001/jama.2017.13836
4. Iwashyna TJ, Ely EW, Smith DM, Langa KM. Long-term cognitive impairment and functional disability among survivors of severe sepsis. JAMA. 2010;304(16):1787-1794. doi:10.1001/jama.2010.1553
5. Yende S, Austin S, Rhodes A, et al. Long-term quality of life among survivors of severe sepsis: analyses of two international trials. Crit Care Med. 2016;44(8):1461-1467. doi:10.1097/CCM.0000000000001658
6. Winters BD, Eberlein M, Leung J, Needham DM, Pronovost PJ, Sevransky JE. Long-term mortality and quality of life in sepsis: a systematic review. Crit Care Med. 2010;38(5):1276-1283. doi:10.1097/CCM.0b013e3181d8cc1d
7. Semmler A, Widmann CN, Okulla T, et al. Persistent cognitive impairment, hippocampal atrophy and EEG changes in sepsis survivors. J Neurol Neurosurg Psychiatry. 2013;84(1):62-69. doi:10.1136/jnnp-2012-302883
8. Rhodes A, Evans LE, Alhazzani W, et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock: 2016. Crit Care Med. 2017;45(3):486-552. doi:10.1097/CCM.0000000000002255
9. Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock 2021. Crit Care Med. 2021;49(11):e1063-e1143. doi:10.1097/CCM.0000000000005337
10. Needham DM, Davidson J, Cohen H, et al. Improving long-term outcomes after discharge from intensive care unit: report from a stakeholders’ conference. Crit Care Med. 2012;40(2):502-509. doi:10.1097/CCM. 0b013e318232da75
11. Marshall JC. Why have clinical trials in sepsis failed? Trends Mol Med. 2014;20(4):195-203. doi:10.1016/j. molmed.2014.01.007
12. Hernandes MS, D’Avila JC, Trevelin SC, et al. The role of Nox2-derived ROS in the development of cognitive impairment after sepsis. J Neuroinflammation. 2014;11:36. doi:10.1186/1742-2094-11-36
13. Wu Y, Dissing-Olesen L, MacVicar BA, Stevens B. Microglia: dynamic mediators of synapse development and plasticity. Trends Immunol. 2015;36(10):605-613. doi:10.1016/j.it.2015.08.008
14. Lochhead JJ, McCaffrey G, Quigley CE, et al. Oxidative stress increases blood-brain barrier permeability and induces alterations in occludin during hypoxia-reoxygenation. J Cereb Blood Flow Metab. 2010;30(9):1625-1636. doi:10.1038/jcbfm.2010.29
15. Galea I. The blood-brain barrier in systemic infection and inflammation. Cell Mol Immunol. 2021;18(11): 2489-2501. doi:10.1038/s41423-021-00757-x
16. Harrison FE, Bowman GL, Polidori MC. Ascorbic acid and the brain: rationale for the use against cognitive decline. Nutrients. 2014;6(4):1752-1781. doi:10.3390/nu6041752
17. Ferrada L, Barahona MJ, Salazar K, Vandenabeele P, Nualart F. Vitamin C controls neuronal necroptosis under oxidative stress. Redox Biol. 2020;29:101408. doi:10.1016/j.redox.2019.101408
18. Burns JJ. Missing step in man, monkey and guinea pig required for the biosynthesis of L-ascorbic acid. Nature. 1957;180(4585):553. doi:10.1038/180553a0
19. Consoli DC, Jesse JJ, Klimo KR, et al. A cecal slurry mouse model of sepsis leads to acute consumption of vitamin C in the brain. Nutrients. 2020;12(4):911. doi:10.3390/nu12040911
20. Armour J, Tyml K, Lidington D, Wilson JX. Ascorbate prevents microvascular dysfunction in the skeletal muscle of the septic rat. J Appl Physiol (1985). 2001;90(3):795-803. doi:10.1152/jappl.2001.90.3.795
21. Carr AC, Rosengrave PC, Bayer S, Chambers S, Mehrtens J, Shaw GM. Hypovitaminosis C and vitamin C deficiency in critically ill patients despite recommended enteral and parenteral intakes. Crit Care. 2017;21(1):300. doi:10.1186/s13054-017-1891-y
22. Kaufmann I, Briegel J, Schliephake F, et al. Stress doses of hydrocortisone in septic shock: beneficial effects on opsonization-dependent neutrophil functions. Intensive Care Med. 2008;34(2):344-349. doi:10.1007/s00134- 007-0868-8
23. Fowler AA III, Truwit JD, Hite RD, et al. Effect of vitamin C infusion on organ failure and biomarkers of inflammation and vascular injury in patients with sepsis and severe acute respiratory failure: the CITRIS-ALI randomized clinical trial. JAMA. 2019;322(13):1261-1270. doi:10.1001/jama.2019.11825
24. Barabutis N, Khangoora V, Marik PE, Catravas JD. Hydrocortisone and ascorbic acid synergistically prevent and repair lipopolysaccharide-induced pulmonary endothelial barrier dysfunction. Chest. 2017;152(5):954-962. doi: 10.1016/j.chest.2017.07.014
25. Parker WH, Rhea EM, Qu ZC, Hecker MR, May JM. Intracellular ascorbate tightens the endothelial permeability barrier through Epac1 and the tubulin cytoskeleton. Am J Physiol Cell Physiol. 2016;311(4):C652-C662. doi:10.1152/ ajpcell.00076.2016
26. Kuck JL, Bastarache JA, Shaver CM, et al. Ascorbic acid attenuates endothelial permeability triggered by cell- free hemoglobin. Biochem Biophys Res Commun. 2018;495(1):433-437. doi:10.1016/j.bbrc.2017.11.058
27. Plevin D, Galletly C. The neuropsychiatric effects of vitamin C deficiency: a systematic review. BMC Psychiatry. 2020;20(1):315. doi:10.1186/s12888-020-02730-w
28. Marik PE, Khangoora V, Rivera R, Hooper MH, Catravas J. Hydrocortisone, vitamin C, and thiamine for the treatment of severe sepsis and septic shock: a retrospective before-after study. Chest. 2017;151(6):1229-1238. doi: 10.1016/j.chest.2016.11.036
29. de Andrade JAA, Gayer CRM, Nogueira NPA, et al. The effect of thiamine deficiency on inflammation, oxidative stress and cellular migration in an experimental model of sepsis. J Inflamm (Lond). 2014;11:11. doi:10.1186/1476- 9255-11-11
30. Gibson GE, Hirsch JA, Fonzetti P, Jordan BD, Cirio RT, Elder J. Vitamin B1 (thiamine) and dementia. AnnNY Acad Sci. 2016;1367(1):21-30. doi:10.1111/nyas.13031
31. Fujii T, Luethi N, Young PJ, et al; VITAMINS Trial Investigators. Effect of vitamin C, hydrocortisone, and thiamine vs hydrocortisone alone on time alive and free of vasopressor support among patients with septic shock: the VITAMINS randomized clinical trial. JAMA. 2020;323(5):423-431. doi:10.1001/jama.2019.22176
32. Moskowitz A, Huang DT, Hou PC, et al; ACTS Clinical Trial Investigators. Effect of ascorbic acid, corticosteroids, and thiamine on organ injury in septic shock: the ACTS randomized clinical trial. JAMA. 2020;324(7):642-650. doi:10.1001/jama.2020.11946
33. Hwang SY, Ryoo SM, Park JE, et al; Korean Shock Society (KoSS). Combination therapy of vitamin C and thiamine for septic shock: a multi-centre, double-blinded randomized, controlled study. Intensive Care Med. 2020;46(11):2015-2025. doi:10.1007/s00134-020-06191-3
34. Lamontagne F, Masse MH, Menard J, et al; LOVIT Investigators and the Canadian Critical Care Trials Group. Intravenous vitamin C in adults with sepsis in the intensive care unit. N Engl J Med. 2022;386(25):2387-2398. doi: 10.1056/NEJMoa2200644
35. Hager DN, Hooper MH, Bernard GR, et al. The Vitamin C, Thiamine and Steroids in Sepsis (VICTAS) protocol: a prospective, multi-center, double-blind, adaptive sample size, randomized, placebo-controlled, clinical trial. Trials. 2019;20(1):197. doi:10.1186/s13063-019-3254-2
36. Sevransky JE, Rothman RE, Hager DN, et al; VICTAS Investigators. Effect of vitamin C, thiamine, and hydrocortisone on ventilator- and vasopressor-free days in patients with sepsis: the VICTAS randomized clinical trial. JAMA. 2021;325(8):742-750. doi:10.1001/jama.2020.24505
37. Lindsell CJ, McGlothlin A, Nwosu S, et al. Update to the Vitamin C, Thiamine and Steroids in Sepsis (VICTAS) protocol: statistical analysis plan for a prospective, multicenter, double-blind, adaptive sample size, randomized, placebo-controlled, clinical trial. Trials. 2019;20(1):670. doi:10.1186/s13063-019-3775-8
38. Christie JD, Biester RC, Taichman DB, et al. Formation and validation of a telephone battery to assess cognitive function in acute respiratory distress syndrome survivors. J Crit Care. 2006;21(2):125-132. doi:10.1016/j.jcrc.2005. 11.004
39. Marcantonio ER, Michaels M, Resnick NM. Diagnosing delirium by telephone. J Gen Intern Med. 1998;13(9): 621-623. doi:10.1046/j.1525-1497.1998.00185.x
40. Brandt J, Spencer M, Folstein MF. The telephone interview for cognitive status. Neuropsychiatry Neuropsychol Behav Neurol. 1988;1(2):111-117.
41. Hansen M, Andersen TE, Armour C, Elklit A, Palic S, Mackrill T. PTSD-8: a short PTSD inventory. Clin Pract Epidemiol Ment Health. 2010;6:101-108. doi:10.2174/1745017901006010101
42. Cella D, Riley W, Stone A, et al; PROMIS Cooperative Group. The Patient-Reported Outcomes Measurement Information System (PROMIS) developed and tested its first wave of adult self-reported health outcome item banks: 2005-2008. J Clin Epidemiol. 2010;63(11):1179-1194. doi:10.1016/j.jclinepi.2010.04.011
43. Choi SW, Schalet B, Cook KF, Cella D. Establishing a common metric for depressive symptoms: linking the BDI-II, CES-D, and PHQ-9 to PROMIS depression. Psychol Assess. 2014;26(2):513-527. doi:10.1037/a0035768
44. Katz S, Ford AB, Moskowitz RW, Jackson BA, Jaffe MW. Studies of illness in the aged—the index of ADL:
a standardized measure of biological and psychosocial function. JAMA. 1963;185:914-919. doi:10.1001/jama.1963. 03060120024016
45. Pfeffer RI, Kurosaki TT, Harrah CH Jr, Chance JM, Filos S. Measurement of functional activities in older adults in the community. J Gerontol. 1982;37(3):323-329. doi:10.1093/geronj/37.3.323
46. Rabin R, de Charro F. EQ-5D: a measure of health status from the EuroQol Group. Ann Med. 2001;33(5): 337-343. doi:10.3109/07853890109002087
47. Pandharipande PP, Girard TD, Jackson JC, et al; BRAIN-ICU Study Investigators. Long-term cognitive impairment after critical illness. N Engl J Med. 2013;369(14):1306-1316. doi:10.1056/NEJMoa1301372
48. Sukantarat KT, Burgess PW, Williamson RC, Brett SJ. Prolonged cognitive dysfunction in survivors of critical illness. Anaesthesia. 2005;60(9):847-853. doi:10.1111/j.1365-2044.2005.04148.x
49. Hopkins RO, Weaver LK, Pope D, Orme JF, Bigler ED, Larson-Lohr V. Neuropsychological sequelae and impaired health status in survivors of severe acute respiratory distress syndrome. Am J Respir Crit Care Med. 1999; 160(1):50-56. doi:10.1164/ajrccm.160.1.9708059
50. Jackson JC, Pandharipande PP, Girard TD, et al; Bringing to Light the Risk Factors and Incidence of Neuropsychological Dysfunction in ICU Survivors (BRAIN-ICU) Study Investigators. Depression, post-traumatic stress disorder, and functional disability in survivors of critical illness in the BRAIN-ICU study: a longitudinal cohort study. Lancet Respir Med. 2014;2(5):369-379. doi:10.1016/S2213-2600(14)70051-7
51. Rawal G, Yadav S, Kumar R. Post-intensive care syndrome: an overview. J Transl Int Med. 2017;5(2):90-92. doi: 10.1515/jtim-2016-0016
52. Marra A, Pandharipande PP, Girard TD, et al. Co-occurrence of post-intensive care syndrome problems among 406 survivors of critical illness. Crit Care Med. 2018;46(9):1393-1401. doi:10.1097/CCM.0000000000003218
53. Jutte JE, Erb CT, Jackson JC. Physical, cognitive, and psychological disability following critical illness: what is the risk? Semin Respir Crit Care Med. 2015;36(6):943-958. doi:10.1055/s-0035-1566002
54. Diliberto EJ Jr, Allen PL. Mechanism of dopamine-beta-hydroxylation: semidehydroascorbate as the enzyme oxidation product of ascorbate. J Biol Chem. 1981;256(7):3385-3393. doi:10.1016/S0021-9258(19)69620-1
55. Harrison FE, May JM. Vitamin C function in the brain: vital role of the ascorbate transporter SVCT2. Free Radic Biol Med. 2009;46(6):719-730. doi:10.1016/j.freeradbiomed.2008.12.018
56. McCall JG, Al-Hasani R, Siuda ER, et al. CRH engagement of the locus coeruleus noradrenergic system mediates stress-induced anxiety. Neuron. 2015;87(3):605-620. doi:10.1016/j.neuron.2015.07.002
57. Daviu N, Bruchas MR, Moghaddam B, Sandi C, Beyeler A. Neurobiological links between stress and anxiety.
Neurobiol Stress. 2019;11:100191. doi:10.1016/j.ynstr.2019.100191
58. Roozendaal B, Castello NA, Vedana G, Barsegyan A, McGaugh JL. Noradrenergic activation of the basolateral amygdala modulates consolidation of object recognition memory. Neurobiol Learn Mem. 2008;90(3):576-579. doi:10.1016/j.nlm.2008.06.010
59. Sara SJ, Bouret S. Orienting and reorienting: the locus coeruleus mediates cognition through arousal. Neuron. 2012;76(1):130-141. doi:10.1016/j.neuron.2012.09.011
60. Fitzgerald PJ, Giustino TF, Seemann JR, Maren S. Noradrenergic blockade stabilizes prefrontal activity and enables fear extinction under stress. Proc Natl Acad SciUS A. 2015;112(28):E3729-E3737. doi:10.1073/pnas. 1500682112
61. Giustino TF, Maren S. Noradrenergic modulation of fear conditioning and extinction. Front Behav Neurosci. 2018;12:43. doi:10.3389/fnbeh.2018.00043
62. Gazarini L, Stern CA, Takahashi RN, Bertoglio LJ. Interactions of noradrenergic, glucocorticoid and endocannabinoid systems intensify and generalize fear memory traces. Neuroscience. 2022;497:118-133. doi:10. 1016/j.neuroscience.2021.09.012
63. Kessler RC, Chiu WT, Demler O, Merikangas KR, Walters EE. Prevalence, severity, and comorbidity of 12-month DSM-IV disorders in the National Comorbidity Survey Replication. Arch Gen Psychiatry. 2005;62(6):617-627. doi: 10.1001/archpsyc.62.6.617
64. Goldstein RB, Smith SM, Chou SP, et al. The epidemiology of DSM-5 posttraumatic stress disorder in the United States: results from the National Epidemiologic Survey on Alcohol and Related Conditions-III. Soc Psychiatry Psychiatr Epidemiol. 2016;51(8):1137-1148. doi:10.1007/s00127-016-1208-5
65. Mikkelsen ME, Still M, Anderson BJ, et al. Society of Critical Care Medicine’s International Consensus Conference on Prediction and Identification of Long-Term Impairments After Critical Illness. Crit Care Med. 2020; 48(11):1670-1679. doi:10.1097/CCM.0000000000004586
66. Widmann CN, Heneka MT. Long-term cerebral consequences of sepsis. Lancet Neurol. 2014;13(6):630-636. doi:10.1016/S1474-4422(14)70017-1
67. Hoogland IC, Houbolt C, van Westerloo DJ, van Gool WA, van de Beek D. Systemic inflammation and microglial activation: systematic review of animal experiments. J Neuroinflammation. 2015;12:114. doi:10.1186/s12974-015- 0332-6
68. Witcher KG, Eiferman DS, Godbout JP. Priming the inflammatory pump of the CNS after traumatic brain injury.
Trends Neurosci. 2015;38(10):609-620. doi:10.1016/j.tins.2015.08.002
69. Muscat SM, Barrientos RM. The perfect cytokine storm: how peripheral immune challenges impact brain plasticity & memory function in aging. Brain Plast. 2021;7(1):47-60. doi:10.3233/BPL-210127
70. Huang M, Parker AM, Bienvenu OJ, et al; National Institutes of Health, National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome Network. Psychiatric symptoms in acute respiratory distress syndrome survivors: a 1-year national multicenter study. Crit Care Med. 2016;44(5):954-965. doi:10.1097/CCM. 0000000000001621
71. Pandharipande P, Shintani A, Peterson J, et al. Lorazepam is an independent risk factor for transitioning to delirium in intensive care unit patients. Anesthesiology. 2006;104(1):21-26. doi:10.1097/00000542- 200601000-00005
72. Bourenne J, Hraiech S, Roch A, Gainnier M, Papazian L, Forel JM. Sedation and neuromuscular blocking agents in acute respiratory distress syndrome. Ann Transl Med. 2017;5(14):291. doi:10.21037/atm.2017.07.19
73. Devlin JW, Skrobik Y, Gélinas C, et al. Clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Crit Care Med. 2018;46 (9):e825-e873. doi:10.1097/CCM.0000000000003299
Источник фотоиллюстрации - www.freepik.com
[~DETAIL_TEXT] => Roberson S, Nwosu S, Collar E et al. for the VICTAS Investigators
Association of Vitamin C, Thiamine, and Hydrocortisone Infusion With Long-term Cognitive, Psychological, and Functional Outcomes in Sepsis Survivors A Secondary Analysis of the Vitamin C, Thiamine, and Steroids in Sepsis Randomized Clinical Trial
Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса
Вторичный анализ использования витамина С, тиамина и стероидов в рандомизированном клиническом исследовании сепсиса
JAMA Network Open. 2023;6(2):e230380. doi:10.1001/jamanetworkopen.2023.0380
Абстракт
Сепсис связан с долгосрочными когнитивными нарушениями и худшими психологическими и функциональными последствиями. Потенциальные механизмы включают внутримозговой окислительный стресс и воспаление, однако мало что известно о влиянии ранней антиоксидантной и противовоспалительной терапии на когнитивные, психологические и функциональные исходы у выживших после сепсиса.
ЦЕЛЬ
Описать наблюдаемые различия в долгосрочных когнитивных, психологических и функциональных результатах приема витамина С, тиамина и гидрокортизона между экспериментальной и контрольной группами в рандомизированном клиническом исследовании Vitamin C, Thiamine, and Steroids in Sepsis (VICTAS).
В этом предварительно заданном вторичном анализе представлены 6-месячные результаты многоцентрового двойного слепого плацебо-контролируемого рандомизированного клинического исследования VICTAS, которое проводилось в период с августа 2018 г. по июль 2019 г. Взрослые пациенты с сепсис-индуцированной респираторной и / или с сердечно-сосудистой дисфункцией, которые дожили до выписки или 30-го дня, были набраны из 43 ОИТ в США. Участники были рандомизированы 1:1 либо в группу вмешательства, либо в контрольную группу. Когнитивные, психологические и функциональные результаты через 6 месяцев после рандомизации оценивались по телефону до января 2020 года. Анализ данных проводился в период с февраля 2021 года по декабрь 2022 года.
Группа вмешательства получала внутривенно витамин С (1,5 г), гидрохлорид тиамина (100 мг) и сукцинат гидрокортизона натрия (50 мг) каждые 6 часов в течение 96 часов или до смерти или выписки из ОИТ. Контрольная группа получала плацебо.
Когнитивные способности, риск посттравматического стрессового расстройства и депрессии, а также функциональное состояние оценивались с использованием набора стандартизированных инструментов, которые использовали во время часового телефонного разговора через 6 месяцев после рандомизации.
После исключения, раннего вывода и смерти в окончательную выборку вошли 213 участников (медиана [IQR] возраста 57 [47–67] лет; 112 мужчин [52,6%]), которые прошли оценку отдаленных результатов и были рандомизированы. либо в группу вмешательства (n = 108), либо в контрольную группу (n = 105). Группа вмешательства имела более низкие показатели непосредственной памяти (скорректированное ОШ [aOR], 0,49; 95% ДИ,0,26–0,89), более высокие шансы посттравматического стрессового расстройства (aOR, 3,51; 95% ДИ, 1,18–10,40) и более низкие шансы получения психиатрической помощи (aOR, 0,38; 95% CI, 0,16–0,89). Других статистически значимых различий в когнитивных, психологических и функциональных результатах между двумя группами обнаружено не было.
У выживших после сепсиса лечение витамином С, тиамином и гидрокортизоном не улучшило или не ухудшило когнитивные, психологические и функциональные результаты через 6 месяцев по сравнению с пациентами, получавшими плацебо. Эти результаты ставят под сомнение гипотезу о том, что антиоксидантная и противовоспалительная терапия во время критического состояния смягчает развитие долгосрочных когнитивных, психологических и функциональных нарушений у пациентов, переживших сепсис.
Введение
Сепсис — это системная воспалительная реакция на инфекцию, которая часто приводит к полиорганной недостаточности, повышению смертности и долгосрочным когнитивным и функциональным нарушениям.1,2 Из почти 2 миллионов случаев сепсиса в США ежегодно почти 55% требуют лечения в отделении интенсивной терапии (ОРИТ) и от 20% до 30% умирают.3 Выжившие после сепсиса имеют в 3-4 раза больший риск когнитивных нарушений от умеренной до тяжелой степени по сравнению с пациентами, госпитализированными без сепсиса.4 Выжившие после сепсиса также подвергаются большему риску развития синдрома после интенсивной терапии (ПИТ), совокупность симптомов, приводящих к долгосрочному когнитивному и психологическому ухудшению, а также к ухудшению качества жизни. 4-7 В то время как раннее назначение антибиотиков, гемодинамическая поддержка, инфузионная терапия и контроль источника инфекции были связаны с улучшением смертности 8,9когнитивные, психологические и функциональные нарушения, связанные с сепсисом, остаются серьезной проблемой общественного здравоохранения.10,11
Предполагается, что когнитивные нарушения после сепсиса являются результатом сочетания оксидативного стресса и длительного нейровоспаления, возникающего в результате начальной системной воспалительной реакции. Увеличение количества активных форм кислорода вызывает клеточное повреждение, которое в сочетании с постоянной активацией микроглии может способствовать дисфункции гематоэнцефалического барьера, потере синапсов и гибели нейронов.12-15 Витамин C является мощным антиоксидантом и может предотвратить снижение когнитивных способностей после сепсиса, защищая клетки от окислительного повреждения липидов.16,17
Люди - одни из немногих млекопитающих, которые не могут синтезировать витамин С эндогенно18 и подвержены риску истощения витамина С во время сепсиса.19-21 Как витамин С, так и гидрокортизон были связаны со снижением маркеров острого воспаления у пациентов с сепсисом 22,23 и могут действовать синергетически для предотвращения эндотелиальной дисфункции и восстановления функции эндотелия.24-26 Неблагоприятные когнитивные и психические эффекты дефицита витамина С у людей были признаны на протяжении веков.27Тиамин, со своей стороны , также часто недостаточен при сепсисе.28 Дефицит тиамина увеличивает маркеры воспаления29 и связан с когнитивными нарушениями 30 Эти данные свидетельствуют о том, что комбинация витамина С, гидрокортизона и тиамина может защитить пациентов от постсептических когнитивных нарушений. Кроме того, некоторые исследования предполагают преимущество в выживаемости при использовании того же терапевтического подхода.28
Тем не менее, из 5 крупных рандомизированных клинических испытаний 23,31-34 все, кроме одного, не смогли продемонстрировать улучшение выживаемости при терапии на основе витамина С. Хотя в одном из этих испытаний изучалось качество жизни через 6 месяцев,34 ни в одном исследовании на сегодняшний день не оценивалось влияние этих методов лечения на постсептические когнитивные и психологические исходы. Многоцентровое двойное слепое плацебо-контролируемое рандомизированное клиническое исследование витамина С, тиамина и стероидов при сепсисе (VICTAS) было проведено в период с августа 2018 г. по июль 2019 г. для проверки гипотезы о том, что эта комбинированная терапия улучшит клинически важные исходы у пациентов с сепсисом с индуцированной дыхательной и/или сердечно-сосудистой недостаточностью.35 Исследование было разработано априори для оценки основной цели воздействия на смертность и количество дней без ИВЛ и вазопрессоров, на которые, как было показано, схема лечения не влияла.36 Кроме того, испытание было разработано для вторичной цели изучения влияния этой комбинированной терапии на когнитивный, психологический и функциональный статус при 6-месячном наблюдении за участниками интервенционной и контрольной групп, что было в центре внимания этого вторичного анализа. 37 Мы предположили, что среди выживших после сепсиса, нуждающихся в вазопрессорной поддержке или ИВЛ, раннее лечение высокими дозами витамина С, тиамина и гидрокортизона улучшает когнитивные функции, психологические симптомы и функциональное состояние через 6 месяцев после рандомизации.
Методы
Детали протокола и анализа исследования VICTAS.35-37 Вкратце, взрослых пациентов с острой дыхательной и/или сердечной дисфункцией вследствие сепсиса, нуждавшихся в ИВЛ или вазопрессорной поддержке, набирали в 43 больницах США. Участники были рандомизированы 1:1 либо в группу вмешательства, либо в контрольную группу. Участники, исследователи и персонал исследовательской группы, ответственный за оценку результатов, не знали о распределении лечения. Испытание VICTAS, включая этот предварительно определенный вторичный анализ, было одобрено институциональным наблюдательным советом Johns HopkinsHospital. Участники или их законные представители предоставили письменное информированное согласие до регистрации и рандомизации. Мы следовали рекомендациям по составлению сводных стандартов отчетности об испытаниях (CONSORT).
Вмешательство состояло из внутривенного введения витамина С (1,5 г), гидрохлорида тиамина (100 мг) и сукцината гидрокортизона натрия (50 мг), которые вводились в течение 4 часов после рандомизации и каждые 6 часов после этого в течение 96 часов или до смерти или выписки изОРИТ в зависимости от того, что произошло раньше. Участники контрольной группы получали плацебо-инъекции соответствующего по объему физиологического раствора с той же частотой. Участников можно было лечить открытыми кортикостероидами, если клиницисты сочли это целесообразным; в случаях суточных доз, превышающих или равных 200 мг гидрокортизона (или эквивалента), аптека отказывалась от исследуемого гидрокортизона или соответствующего плацебо. Обученный исследовательский персонал ежедневно оценивал участников на наличие делирия в течение периода вмешательства, используя метод оценки спутанности сознания для ОРИТ в сочетании с Ричмондской шкалой возбуждения-седации. Все остальное клиническое ведение участников, включая энтеральное введение витаминов и питание, оставалось на усмотрение врачей.
Оценка долгосрочных результатов
При выписке или через 30 дней, в зависимости от того, что произошло раньше, участников приглашали на последующее телефонное интервью через 6 месяцев после рандомизации. Приглашение не требовало отдельного информированного согласия от основного исследования, но требовало выражения готовности участником или представителем участника связаться примерно через 6 месяцев. Чтобы облегчить долгосрочное удержание когорты, мы использовали период наблюдения от 5 до 8 месяцев. Последующие оценки проводились до января 2020 года.
Во время последующего телефонного интервью мы использовали ранее валидированный38 ряд инструментов когнитивной оценки, включая следующие: метод оценки спутанности сознания по телефону39 для оценки бреда; телефонное интервью для определения когнитивного статуса40 для оценки общей когнитивной функции; Шкала интеллекта взрослых Векслера, четвертое издание, субтест на объем цифр для оценки внимания и объема рабочей памяти; Шкала памяти Вешлера, четвертое издание, логическая память I и II для изучения немедленной и отсроченной памяти соответственно; Шкала интеллекта взрослых Векслера, четвертое издание, субтест сходства для оценки языковой концептуализации и словесной абстракции; контролируемый устный ассоциативный тест для оценки беглости речи; и тест завершения предложения Хейлинга для оценки торможения реакции как формы исполнительной функции. Более высокие баллы по этим инструментам указывают на лучшие результаты. Полное описание этих оценок, их соответствующих систем подсчета баллов и интерпретации результатов представлены в eAppendix 1 in Supplement 1. Для оценки психологического статуса мы использовали опросник посттравматического стрессового расстройства из 8 пунктов (PTSD-8)41 и Информационную систему измерения исходов, сообщаемых пациентами и краткую форму по депрессии 6 пунктов (PROMIS-6) (Patient-Reported Outcomes Measurement Information System Depression 6-item Short Form).42. Скрининг посттравматического стрессового расстройства (ПТСР) был привязан к опыту пребывания в ОИТ, и участники считались страдающими ПТСР, если они сообщали о наличии у них 3 или более баллов по шкале PTSD-8 в трех из 4 категорий симптомов.41
Участники считались страдающими депрессией, если общий уровень симптомов по PROMIS-6 превышало Т-балл 60, что соответствует умеренной депрессии по обычно используемым показателям депрессии.43 Более высокие баллы по PTSD-8 и PROMIS-6 указывают на худшие результаты. Эти инструменты и их критерии оценки более подробно описаны в eAppendix 1 inSupplement 1.
Мы использовали Katz Activities of Daily Living Scale 44 и Опросник функциональной активности45 для оценки базовой и функциональной деятельности в повседневной жизни соответственно. Более высокие баллы по этим инструментам указывают на худшие результаты. Мы использовали EuroQoL 5-Dimensions 3-Level (EQ-5D-3L)46 для оценки общего качества жизни, связанного со здоровьем. Более высокий балл по EQ-5D-3L отражает лучшие результаты. Мы включили дополнительные стандартизированные вопросы для оценки обращения за медицинской помощью после выписки47 (eAppendix 1 в Supplement 1).
Телефонные интервью длились около 60 минут. В случаях, когда участник не мог или не желал пройти официальную когнитивную и психологическую оценку по телефону (например, из-за болезни, чрезмерной усталости или когнитивного ухудшения), данные о функциональном состоянии и использовании медицинских услуг собирались у назначенного представителя пациента. Причины невозможности участия в индивидуальных оценках были зафиксированы.
Статистический анализ
Категориальные переменные сообщались с использованием частот и пропорций. Непрерывные переменные были указаны как средние значения с SD или медианы с IQR. Участники были проанализированы в соответствии с группой, в которую они были рандомизированы (т. е. группа вмешательства или контроль). Сравнение между группами, с двусторонними значениямиP использовали многомерную логистическую регрессию пропорциональных шансов для порядковых результатов и бинарную логистическую регрессию для дихотомических результатов.
Мы скорректировали следующие ковариаты: возраст, пол, раса и этническая принадлежность (определяемые по самоотчету или наблюдениям исследователя), уровень образования, оценка острого состояния и хронического состояния здоровья по версии II, наличие диабета, сопутствующие неврологические или сердечно-сосудистые заболевания, количество дней ИВЛ и продолжительность пребывания в ОРИТ. P < 0,05 считалось статистически значимым. Для стандартизированных когнитивных оценок в статистическом анализе использовались баллы по шкале.
Этот вторичный анализ сообщал о ключевой вторичной цели исследования VICTAS. Испытание было явно направлено на достижение основной цели и было прекращено в административном порядке после набора 501 участника. Вторичный анализ был определен априори с целью описать величину различий между группами, а не сосредоточиться на проверке гипотез. Таким образом, поправки на множественность не вносились, и сообщалось о скорректированных размерах эффекта (т. е. об отношении шансов [ОШ]) с 95% ДИ. Для устранения недостающих данных о ковариатах использовалась множественная интерполяция на основе прогнозируемого среднего соответствия.
Приблизительно одна треть участников, опрошенных при последующем наблюдении, не смогли или не захотели выполнить полный набор когнитивных и психологических тестов (eAppendix 2 and eTable 2 in Supplement 1 описываются показатели прохождения отдельных тестов). Менее чем 7% включенных участников, которые не смогли пройти данную оценку из-за когнитивных нарушений, была присвоена самая низкая возможная оценка. Все остальные отсутствующие данные считались полностью случайными. Все анализы проводились в период с февраля 2021 г. по декабрь 2022 г. с использованием R версии 3.4.3 (R Foundation for Statistical Computing).
Результаты
Блок-схема регистрации, рандомизации и последующего наблюдения за участниками исследования VICTAS представлена на Figure 1. Из 501 рандомизированного участника 198 (39,5%) умерли до проведения оценки долгосрочных результатов (196 умерли в течение 180 дней после рандомизации и 2 умерли через 180 дней после рандомизации, но до того, как закончилось их 5-8-месячное окно наблюдения). Из оставшихся 303 участников 4 (1,3%) выбыли из исследования, а 40 (13,2%) не согласились на последующую оценку. Из 285 участников, доступных для последующего наблюдения, 32 (11,2%) не могли быть охвачены в течение 5–8-месячного окна последующего наблюдения, а 13 (4,6%) имели укороченное окно последующего наблюдения из-за административного прекращения исследования. Один участник был исключен в административном порядке из-за лишения свободы, а 26 (9,1%) отказались от оценки при последующем наблюдении.

Окончательная выборка включала 213 участников, из которых 108 были рандомизированы в группу вмешательства, а 105 — в контрольную группу. Характеристики включенных участников описаны в Table 1 and eTable 1 in Supplement 1, наряду с умершими участниками и теми, для которых результаты были недоступны (например, из-за отказа или потери для последующего наблюдения). Включенные участники имели средний возраст (IQR) 57 (47-67) лет и состояли из 101 женщины (47,4%) и 112 мужчин (52,6%). Данные были представлены представителями участников только в 39 случаях (18,3%). Группа вмешательства и контрольная группа имели сопоставимые характеристики (Table 2), за исключением того, что в группу вмешательства входило больше белых участников, чем в контрольную группу (72 [66,7%] против 57 [54,3%]). 157 участников (73,7%) в группе последующего наблюдения, 72 (68,6%) в контрольной группе и 85 (78,7%) в группе вмешательства получали норадреналин парентерально.

Шестьдесят шесть пациентов (31,0%) в контрольной когорте (32 пациента [30,5%] из контрольной группы и 34 [31,5%] из группы вмешательства) получали кортикостероиды в открытом доступе, находясь в ОРИТ.

Когнитивные результаты
Когнитивные результаты через 6 месяцев представлены в eTable 3 in Supplement 1, а эффекты лечения обобщены на Figure 2 и eAppendix 3 в Supplement 1. Ни один из участников, прошедших когнитивная оценку не имели делирий во время оценки.

Лечение витамином С, тиамином и гидрокортизоном, как правило, ассоциировалось с ухудшением когнитивных функций со статистически значимым ухудшением непосредственной памяти (оценка логической памяти I; скорректированное ОШ [aOR], 0,49; 95% ДИ, 0,26–0,89; P= 0,02). ) (Figure 2 ). Точечная оценка эффекта лечения была ниже 1 для всех других когнитивных оценок (диапазон 0,49–0,87), за исключением теста завершения предложения Хейлинга (aOR, 1,58; 95% ДИ, 0,83–3,04; P = 0,17) и ассоциации контролируемой устной речи. Тест (aOR, 1,01; 95% ДИ, 0,56–1,82; P = 0,98) (Figure 2). Полный анализ случаев показал аналогичные размеры эффекта для всех когнитивных результатов (eAppendix 4 и eTable 4 в Supplement 1).
Психологические и функциональные результаты
ОШ для неблагоприятных психологических и функциональных исходов показаны на Figure 3, а подсчеты для каждой группы приведены в eTable 3 в Supplement 1, а вероятности представлены на графике в eAppendix 3 в Supplement 1.
Мы обнаружили посттравматическое стрессовое расстройство у 10 из 105 (9,5%) участников контрольной группы и 18 из 108 (16,7%) участников группы вмешательства (eTable 3 в Supplement 1). Лечение витамином С, тиамином и гидрокортизоном ассоциировалось с увеличением вероятности посттравматического стрессового расстройства (aOR, 3,51; 95% ДИ, 1,18–10,40; P = 0,02) (рис. 3). Депрессия выявлена у 50 из 142 (35,2%) участников, прошедших ПРОМИС-6. Статистических данных о влиянии лечения на депрессию не было (aOR, 1,26; 95% ДИ, 0,55–2,86; P = 0,59) (Figure 3).
Функциональный статус не отличался между экспериментальной и контрольной группами. ОШ составляло 0,89 (95% ДИ, 0,51–1,58; P = 0,70) для шкалы ежедневной активности Каца, 1,01 (95% ДИ, 0,60–1,73;P = 0,96) для опросника функциональной активности и 0,92 (95% ДИ, 0,50–1,69; P = 0,78) для общего состояния здоровья по EQ-5D-3L. Полный анализ психологических и функциональных результатов дал аналогичные результаты (eAppendix 4 и eTable 4 в Supplement1).
Вероятность повторной госпитализации была одинаковой между экспериментальной и контрольной группами (aOR, 1,09; 95% ДИ, 0,56–2,12; P = 0,79) (eTable 4 в Supplement 1). У участников группы вмешательства были более низкие шансы, чем у участников контрольной группы, получить официальную психиатрическую или психологическую помощь в течение 6 месяцев после выписки (aOR, 0,38; 95% ДИ, 0,16–0,89; P = 0,03) (Figure 3). В группе вмешательства также были более низкие шансы, чем в контрольной группе, сообщить об использовании лекарств для лечения депрессии или тревоги, хотя это различие не было статистически значимым (aOR, 0,65; 95% ДИ, 0,34–1,27; P = 0,21) (Figure 3).
Обсуждение
В предварительно заданном вторичном анализе выживших после сепсиса в исследованииVICTAS мы не обнаружили доказательств положительного влияния раннего лечения витамином С, тиамином и гидрокортизоном на когнитивные, психологические и функциональные исходы через 6 месяцев. Напротив, у участников группы вмешательства были более низкие показатели непосредственной памяти и более высокие шансы посттравматического стрессового расстройства по сравнению с участниками контрольной группы. Эти результаты опровергают гипотезу о том, что антиоксидантная и противовоспалительная терапия во время критического состояния может уменьшить развитие долговременной инвалидности, связанной с ПИТС, у выживших после сепсиса. Отсутствие положительного эффекта согласуется с результатами предыдущих рандомизированных клинических исследований, в которых не было выявлено снижения смертности и других исходов в стационаре при терапии витамином С.23,31-34.
The cognitive scores of both the intervention and control groups were similar in magnitude to those reported in other cohorts of ICU survivors.47,48 The median differences in scores for the cognitive assessments were 1 to 2 points on scales ranging from 0 to 10 or 20 (range of 0-100 in Controlled Oral Word Association Test), reflecting a relatively modest potential effect of the intervention on 6-month cognitive outcome. The rates of depression, PTSD, and functional disability were also commensurate with those previously reported49,50 and consistent with the outcomes typically observed in PICS.51-53
Тем не менее, наблюдение возможных долгосрочных негативных последствий у участников группы вмешательства является сигналом, который требует осторожности. Меньшее количество участников в группе вмешательства, чем в контрольной группе, получали психиатрическую помощь, несмотря на то, что у этих участников чаще демонстрировалось возможное посттравматическое стрессовое расстройство. Будущие исследования, оценивающие связь между неотложным лечением и долгосрочными результатами, должны рассмотреть вопрос о том, является ли интеркуррентная терапия смешанным фактором или исходом сама по себе.
Когнитивные баллы как в группе вмешательства, так и в контрольной группе были аналогичны тем, о которых сообщалось в других когортах выживших в отделении интенсивной терапии. (диапазон 0–100 в тесте контролируемых устных словесных ассоциаций), что отражает относительно скромный потенциальный эффект вмешательства на когнитивный результат через 6 месяцев. Частота депрессии, посттравматического стрессового расстройства и функциональных нарушений также соответствовала ранее сообщавшимся 49,50 и соответствовала исходам, обычно наблюдаемым при ПИТ-синдроме 51-53.
Может ли терапия на основе антиоксидантов действительно играть роль в повышенном риске неблагоприятных когнитивных, психологических и функциональных последствий у выживших после сепсиса? Повышенные шансы посттравматического стрессового расстройства, которые наблюдались в группе вмешательства, возможно, были в меньшей степени опосредованы ролью витамина С в качестве антиоксиданта и в большей степени его модуляцией метаболизма нейротрансмиттеров в головном мозге. Витамин С способствует превращению дофамина в норадреналин 54,55. Последний нейромедиатор является основным проводником locus coeruleus, который опосредует физические и эмоциональные реакции на стресс 56,57 и способствует консолидации аверсивных воспоминаний.58,59 Блокада рецепторов норадреналина обеспечивает угасание у животных, подвергающихся стрессовым воздействиям,60 подтверждая гипотезу о том, что передача норадреналина играет важную роль в патогенезе посттравматического стрессового расстройства.61 Если профилактика дефицита витамина С во время сепсиса сохраняет метаболизм норадреналина, возможно, что этот процесс повлиял на силу формирования аверсивных воспоминаний во время стрессового пребывания в ОИТ, что привело к более высоким шансам посттравматического стрессового расстройства. Совместное введение гидрокортизона с норэпинефрином потенцирует реакции памяти о страхе62 и, возможно, действовало синергетически, увеличивая риск посттравматического стрессового расстройства у участников исследования VICTAS.
В качестве альтернативы могли играть роль экзогенные норадреналин и/или кортикостероиды. Апостериорный обзор клинических данных показал, что 73,7% участников последующего наблюдения (68,6% в контрольной группе и 78,7% в группе вмешательства) получали норадреналин парентерально; 31,0% получали сопутствующую открытую терапию кортикостероидами. Дифференциальную роль экзогенных и эндогенных нейротрансмиттеров в патогенезе посттравматического стрессового расстройства еще предстоит выяснить. Более низкий уровень психиатрической помощи и более высокий уровень повторной госпитализации в группе вмешательства также могли повлиять на риск посттравматического стрессового расстройства.
Независимо от того, связана ли разница в исходах между группами напрямую с лечением, наблюдаемая частота посттравматического стрессового расстройства (13,1% [28 из 213 участников группы отдаленного наблюдения) была выше, чем распространенность в прошлом году от 3,5% до 6,1% в популяции населения в целом 63,64, оказывая дальнейшую поддержку рекомендациям Society of Critical Care Medicine по скринингу посттравматического стрессового расстройства и других симптомов, связанных с ПИТ-синдромом, после пребывания в ОРИТ.65
Предполагаемые механизмы снижения когнитивных функций после сепсиса включают внутримозговой окислительный стресс, воспаление и эндотелиальную дисфункцию.66 Витамин С, гидрокортизон и тиамин защищают нейроны от окислительного повреждения и останавливают системную воспалительную реакцию, и, таким образом, ожидается, что они уменьшат бремя долговременных неврологических нарушений. 16 Тем не менее, мы не обнаружили клинических доказательства такого эффекта в этом испытании. Возможно, что доза, время или продолжительность терапии были недостаточными для обеспечения адекватной клеточной защиты. Вмешательство было ограничено пребыванием в ОИТ (в среднем 3 дня среди контрольной когорты). Модели сепсиса на мышах позволяют предположить, что, хотя истощение запасов витамина С происходит в остром периоде болезни,19 существуют различные фазы нейровоспалительной реакции после перенесенного заболевания.67 Долговременные эффекты наблюдаются в центральной нервной системе после постоянной активации клеток микроглии.68,69 Индивидуумы могут зависеть от длительного восполнения запасов витамина С в течение всего периода восстановления, чтобы противодействовать окислительной нагрузке и защитить от посттравматического снижения когнитивных функций. Будущие исследования с длительным приемом витамина С после сепсиса могут проверить эту гипотезу.
Future studies evaluating the effect of acute therapeutic measures on long-term cognitive and psychiatric outcomes should track adherence to Society of Critical Care Medicine guidelines on the management of pain, agitation, and delirium.73
Длительность пребывания в ОРИТ с использованием опиатов или нервно-мышечной блокадой может способствовать возникновению психиатрических симптомов после критического состояния.70 Бензодиазепины являются факторами повышенного риска делирия в ОРИТ,71 что также связано с долгосрочными когнитивными нарушениями. 47 Ежедневное прерывание седации ограничивает этот риск. Будущие исследования, оценивающие влияние неотложных терапевтических мер на долгосрочные когнитивные и психические исходы, должны отслеживать соблюдение руководящих принципов Society of Critical Care Medicine в отношении боли, возбуждения и делирия.73
Ограничения
Это исследование имеет несколько ограничений. Во-первых, интерпретация была ограничена теми, кто пережил сепсис. Как выживаемость повлияла на интерпретацию результатов, было неясно, хотя понимание различий в исходах, о которых сообщают пациенты, на основе выживаемости остается ценным. Во-вторых, распространенной проблемой среди исследований когнитивных и психологических исходов после критического заболевания является незапланированный характер включения и, как следствие, сложность адекватной оценки преморбидных когнитивных и психологических расстройств. Несмотря на рандомизацию, у участников группы последующего наблюдения могут быть исходные различия в когнитивных показателях, которые нельзя количественно оценить или контролировать в анализе. Мы не собирали исходные когнитивные или психологические данные, что требует осторожной интерпретации результатов.
В-третьих, 40 из 303 подходящих участников (13,2%) не согласились на последующую оценку. Тот факт, что участники испытаний не были автоматически включены в этот вторичный анализ и должны были выразить готовность участвовать, мог увеличить отсев. Кроме того, исследование VICTAS было прекращено в административном порядке из-за прекращения финансирования, что привело к сокращению окна последующего наблюдения для небольшой части (4,6%) подходящих участников. Тем не менее, мы смогли получить по крайней мере частичную последующую оценку примерно 85% подходящих участников, и эти выжившие после сепсиса не отличались по характеристикам от тех, кто выбыл, отказался от оценки или в конечном итоге был потерян для последующего наблюдения. Некоторые участники не смогли или не захотели выполнить несколько оценок, а процент отсутствующих данных для нескольких оценок достиг почти 25%. Среди участников, которые были включены в группу последующего наблюдения, наиболее распространенной причиной невыполнения оценки был отказ пациента (eTable 2 в Supplement 1). Частота отсутствующих данных была одинаковой между группой вмешательства и контрольной группой, и отдельный анализ с использованием подхода полного случая дал аналогичные результаты. Эти наблюдения показывают, что показатели завершения не оказали существенного влияния на общие выводы. В-четвертых, в прагматических целях мы выбрали инструменты краткого скрининга в качестве меры психологического результата. Хотя эти инструменты хорошо приняты и обладают высокой чувствительностью и специфичностью для выявления посттравматического стрессового расстройства и депрессии, формальная диагностика требует углубленной оценки квалифицированным специалистом в области психического здоровья.
Выводы
В исследовании VICTAS у выживших после сепсиса, получавших раннее лечение витамином С, тиамином и гидрокортизоном в ОРИТ, когнитивные, психологические и функциональные исходы через 6 месяцев наблюдения либо не изменились, либо были хуже, чем у пациентов, получавших плацебо. Эти результаты не поддерживают антиоксидантную и противовоспалительную терапию и предполагают, что антиоксидантная и противовоспалительная терапия не смягчает развитие долгосрочных когнитивных, психологических и функциональных нарушений у пациентов с сепсисом, которым требуется использование вазопрессоров или респираторная поддержка в ОРИТ.
Дополнительно:
Ссылка на документ с дополнительными данными исследования - часть 1 (Supplementary 1)
Ссылка на документ с дополнительными данными исследования - часть 2 (Supplementary 2)
REFERENCES
1. Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801-810. doi:10.1001/jama.2016.0287
2. Buchman TG, Simpson SQ, Sciarretta KL, et al. Sepsis among Medicare beneficiaries: 1. the burdens of sepsis, 2012-2018. Crit Care Med. 2020;48(3):276-288. doi:10.1097/CCM.0000000000004224
3. Rhee C, Dantes R, Epstein L, et al; CDC Prevention Epicenter Program. Incidence and trends of sepsis in US hospitals using clinical vs claims data, 2009-2014. JAMA. 2017;318(13):1241-1249. doi:10.1001/jama.2017.13836
4. Iwashyna TJ, Ely EW, Smith DM, Langa KM. Long-term cognitive impairment and functional disability among survivors of severe sepsis. JAMA. 2010;304(16):1787-1794. doi:10.1001/jama.2010.1553
5. Yende S, Austin S, Rhodes A, et al. Long-term quality of life among survivors of severe sepsis: analyses of two international trials. Crit Care Med. 2016;44(8):1461-1467. doi:10.1097/CCM.0000000000001658
6. Winters BD, Eberlein M, Leung J, Needham DM, Pronovost PJ, Sevransky JE. Long-term mortality and quality of life in sepsis: a systematic review. Crit Care Med. 2010;38(5):1276-1283. doi:10.1097/CCM.0b013e3181d8cc1d
7. Semmler A, Widmann CN, Okulla T, et al. Persistent cognitive impairment, hippocampal atrophy and EEG changes in sepsis survivors. J Neurol Neurosurg Psychiatry. 2013;84(1):62-69. doi:10.1136/jnnp-2012-302883
8. Rhodes A, Evans LE, Alhazzani W, et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock: 2016. Crit Care Med. 2017;45(3):486-552. doi:10.1097/CCM.0000000000002255
9. Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock 2021. Crit Care Med. 2021;49(11):e1063-e1143. doi:10.1097/CCM.0000000000005337
10. Needham DM, Davidson J, Cohen H, et al. Improving long-term outcomes after discharge from intensive care unit: report from a stakeholders’ conference. Crit Care Med. 2012;40(2):502-509. doi:10.1097/CCM. 0b013e318232da75
11. Marshall JC. Why have clinical trials in sepsis failed? Trends Mol Med. 2014;20(4):195-203. doi:10.1016/j. molmed.2014.01.007
12. Hernandes MS, D’Avila JC, Trevelin SC, et al. The role of Nox2-derived ROS in the development of cognitive impairment after sepsis. J Neuroinflammation. 2014;11:36. doi:10.1186/1742-2094-11-36
13. Wu Y, Dissing-Olesen L, MacVicar BA, Stevens B. Microglia: dynamic mediators of synapse development and plasticity. Trends Immunol. 2015;36(10):605-613. doi:10.1016/j.it.2015.08.008
14. Lochhead JJ, McCaffrey G, Quigley CE, et al. Oxidative stress increases blood-brain barrier permeability and induces alterations in occludin during hypoxia-reoxygenation. J Cereb Blood Flow Metab. 2010;30(9):1625-1636. doi:10.1038/jcbfm.2010.29
15. Galea I. The blood-brain barrier in systemic infection and inflammation. Cell Mol Immunol. 2021;18(11): 2489-2501. doi:10.1038/s41423-021-00757-x
16. Harrison FE, Bowman GL, Polidori MC. Ascorbic acid and the brain: rationale for the use against cognitive decline. Nutrients. 2014;6(4):1752-1781. doi:10.3390/nu6041752
17. Ferrada L, Barahona MJ, Salazar K, Vandenabeele P, Nualart F. Vitamin C controls neuronal necroptosis under oxidative stress. Redox Biol. 2020;29:101408. doi:10.1016/j.redox.2019.101408
18. Burns JJ. Missing step in man, monkey and guinea pig required for the biosynthesis of L-ascorbic acid. Nature. 1957;180(4585):553. doi:10.1038/180553a0
19. Consoli DC, Jesse JJ, Klimo KR, et al. A cecal slurry mouse model of sepsis leads to acute consumption of vitamin C in the brain. Nutrients. 2020;12(4):911. doi:10.3390/nu12040911
20. Armour J, Tyml K, Lidington D, Wilson JX. Ascorbate prevents microvascular dysfunction in the skeletal muscle of the septic rat. J Appl Physiol (1985). 2001;90(3):795-803. doi:10.1152/jappl.2001.90.3.795
21. Carr AC, Rosengrave PC, Bayer S, Chambers S, Mehrtens J, Shaw GM. Hypovitaminosis C and vitamin C deficiency in critically ill patients despite recommended enteral and parenteral intakes. Crit Care. 2017;21(1):300. doi:10.1186/s13054-017-1891-y
22. Kaufmann I, Briegel J, Schliephake F, et al. Stress doses of hydrocortisone in septic shock: beneficial effects on opsonization-dependent neutrophil functions. Intensive Care Med. 2008;34(2):344-349. doi:10.1007/s00134- 007-0868-8
23. Fowler AA III, Truwit JD, Hite RD, et al. Effect of vitamin C infusion on organ failure and biomarkers of inflammation and vascular injury in patients with sepsis and severe acute respiratory failure: the CITRIS-ALI randomized clinical trial. JAMA. 2019;322(13):1261-1270. doi:10.1001/jama.2019.11825
24. Barabutis N, Khangoora V, Marik PE, Catravas JD. Hydrocortisone and ascorbic acid synergistically prevent and repair lipopolysaccharide-induced pulmonary endothelial barrier dysfunction. Chest. 2017;152(5):954-962. doi: 10.1016/j.chest.2017.07.014
25. Parker WH, Rhea EM, Qu ZC, Hecker MR, May JM. Intracellular ascorbate tightens the endothelial permeability barrier through Epac1 and the tubulin cytoskeleton. Am J Physiol Cell Physiol. 2016;311(4):C652-C662. doi:10.1152/ ajpcell.00076.2016
26. Kuck JL, Bastarache JA, Shaver CM, et al. Ascorbic acid attenuates endothelial permeability triggered by cell- free hemoglobin. Biochem Biophys Res Commun. 2018;495(1):433-437. doi:10.1016/j.bbrc.2017.11.058
27. Plevin D, Galletly C. The neuropsychiatric effects of vitamin C deficiency: a systematic review. BMC Psychiatry. 2020;20(1):315. doi:10.1186/s12888-020-02730-w
28. Marik PE, Khangoora V, Rivera R, Hooper MH, Catravas J. Hydrocortisone, vitamin C, and thiamine for the treatment of severe sepsis and septic shock: a retrospective before-after study. Chest. 2017;151(6):1229-1238. doi: 10.1016/j.chest.2016.11.036
29. de Andrade JAA, Gayer CRM, Nogueira NPA, et al. The effect of thiamine deficiency on inflammation, oxidative stress and cellular migration in an experimental model of sepsis. J Inflamm (Lond). 2014;11:11. doi:10.1186/1476- 9255-11-11
30. Gibson GE, Hirsch JA, Fonzetti P, Jordan BD, Cirio RT, Elder J. Vitamin B1 (thiamine) and dementia. AnnNY Acad Sci. 2016;1367(1):21-30. doi:10.1111/nyas.13031
31. Fujii T, Luethi N, Young PJ, et al; VITAMINS Trial Investigators. Effect of vitamin C, hydrocortisone, and thiamine vs hydrocortisone alone on time alive and free of vasopressor support among patients with septic shock: the VITAMINS randomized clinical trial. JAMA. 2020;323(5):423-431. doi:10.1001/jama.2019.22176
32. Moskowitz A, Huang DT, Hou PC, et al; ACTS Clinical Trial Investigators. Effect of ascorbic acid, corticosteroids, and thiamine on organ injury in septic shock: the ACTS randomized clinical trial. JAMA. 2020;324(7):642-650. doi:10.1001/jama.2020.11946
33. Hwang SY, Ryoo SM, Park JE, et al; Korean Shock Society (KoSS). Combination therapy of vitamin C and thiamine for septic shock: a multi-centre, double-blinded randomized, controlled study. Intensive Care Med. 2020;46(11):2015-2025. doi:10.1007/s00134-020-06191-3
34. Lamontagne F, Masse MH, Menard J, et al; LOVIT Investigators and the Canadian Critical Care Trials Group. Intravenous vitamin C in adults with sepsis in the intensive care unit. N Engl J Med. 2022;386(25):2387-2398. doi: 10.1056/NEJMoa2200644
35. Hager DN, Hooper MH, Bernard GR, et al. The Vitamin C, Thiamine and Steroids in Sepsis (VICTAS) protocol: a prospective, multi-center, double-blind, adaptive sample size, randomized, placebo-controlled, clinical trial. Trials. 2019;20(1):197. doi:10.1186/s13063-019-3254-2
36. Sevransky JE, Rothman RE, Hager DN, et al; VICTAS Investigators. Effect of vitamin C, thiamine, and hydrocortisone on ventilator- and vasopressor-free days in patients with sepsis: the VICTAS randomized clinical trial. JAMA. 2021;325(8):742-750. doi:10.1001/jama.2020.24505
37. Lindsell CJ, McGlothlin A, Nwosu S, et al. Update to the Vitamin C, Thiamine and Steroids in Sepsis (VICTAS) protocol: statistical analysis plan for a prospective, multicenter, double-blind, adaptive sample size, randomized, placebo-controlled, clinical trial. Trials. 2019;20(1):670. doi:10.1186/s13063-019-3775-8
38. Christie JD, Biester RC, Taichman DB, et al. Formation and validation of a telephone battery to assess cognitive function in acute respiratory distress syndrome survivors. J Crit Care. 2006;21(2):125-132. doi:10.1016/j.jcrc.2005. 11.004
39. Marcantonio ER, Michaels M, Resnick NM. Diagnosing delirium by telephone. J Gen Intern Med. 1998;13(9): 621-623. doi:10.1046/j.1525-1497.1998.00185.x
40. Brandt J, Spencer M, Folstein MF. The telephone interview for cognitive status. Neuropsychiatry Neuropsychol Behav Neurol. 1988;1(2):111-117.
41. Hansen M, Andersen TE, Armour C, Elklit A, Palic S, Mackrill T. PTSD-8: a short PTSD inventory. Clin Pract Epidemiol Ment Health. 2010;6:101-108. doi:10.2174/1745017901006010101
42. Cella D, Riley W, Stone A, et al; PROMIS Cooperative Group. The Patient-Reported Outcomes Measurement Information System (PROMIS) developed and tested its first wave of adult self-reported health outcome item banks: 2005-2008. J Clin Epidemiol. 2010;63(11):1179-1194. doi:10.1016/j.jclinepi.2010.04.011
43. Choi SW, Schalet B, Cook KF, Cella D. Establishing a common metric for depressive symptoms: linking the BDI-II, CES-D, and PHQ-9 to PROMIS depression. Psychol Assess. 2014;26(2):513-527. doi:10.1037/a0035768
44. Katz S, Ford AB, Moskowitz RW, Jackson BA, Jaffe MW. Studies of illness in the aged—the index of ADL:
a standardized measure of biological and psychosocial function. JAMA. 1963;185:914-919. doi:10.1001/jama.1963. 03060120024016
45. Pfeffer RI, Kurosaki TT, Harrah CH Jr, Chance JM, Filos S. Measurement of functional activities in older adults in the community. J Gerontol. 1982;37(3):323-329. doi:10.1093/geronj/37.3.323
46. Rabin R, de Charro F. EQ-5D: a measure of health status from the EuroQol Group. Ann Med. 2001;33(5): 337-343. doi:10.3109/07853890109002087
47. Pandharipande PP, Girard TD, Jackson JC, et al; BRAIN-ICU Study Investigators. Long-term cognitive impairment after critical illness. N Engl J Med. 2013;369(14):1306-1316. doi:10.1056/NEJMoa1301372
48. Sukantarat KT, Burgess PW, Williamson RC, Brett SJ. Prolonged cognitive dysfunction in survivors of critical illness. Anaesthesia. 2005;60(9):847-853. doi:10.1111/j.1365-2044.2005.04148.x
49. Hopkins RO, Weaver LK, Pope D, Orme JF, Bigler ED, Larson-Lohr V. Neuropsychological sequelae and impaired health status in survivors of severe acute respiratory distress syndrome. Am J Respir Crit Care Med. 1999; 160(1):50-56. doi:10.1164/ajrccm.160.1.9708059
50. Jackson JC, Pandharipande PP, Girard TD, et al; Bringing to Light the Risk Factors and Incidence of Neuropsychological Dysfunction in ICU Survivors (BRAIN-ICU) Study Investigators. Depression, post-traumatic stress disorder, and functional disability in survivors of critical illness in the BRAIN-ICU study: a longitudinal cohort study. Lancet Respir Med. 2014;2(5):369-379. doi:10.1016/S2213-2600(14)70051-7
51. Rawal G, Yadav S, Kumar R. Post-intensive care syndrome: an overview. J Transl Int Med. 2017;5(2):90-92. doi: 10.1515/jtim-2016-0016
52. Marra A, Pandharipande PP, Girard TD, et al. Co-occurrence of post-intensive care syndrome problems among 406 survivors of critical illness. Crit Care Med. 2018;46(9):1393-1401. doi:10.1097/CCM.0000000000003218
53. Jutte JE, Erb CT, Jackson JC. Physical, cognitive, and psychological disability following critical illness: what is the risk? Semin Respir Crit Care Med. 2015;36(6):943-958. doi:10.1055/s-0035-1566002
54. Diliberto EJ Jr, Allen PL. Mechanism of dopamine-beta-hydroxylation: semidehydroascorbate as the enzyme oxidation product of ascorbate. J Biol Chem. 1981;256(7):3385-3393. doi:10.1016/S0021-9258(19)69620-1
55. Harrison FE, May JM. Vitamin C function in the brain: vital role of the ascorbate transporter SVCT2. Free Radic Biol Med. 2009;46(6):719-730. doi:10.1016/j.freeradbiomed.2008.12.018
56. McCall JG, Al-Hasani R, Siuda ER, et al. CRH engagement of the locus coeruleus noradrenergic system mediates stress-induced anxiety. Neuron. 2015;87(3):605-620. doi:10.1016/j.neuron.2015.07.002
57. Daviu N, Bruchas MR, Moghaddam B, Sandi C, Beyeler A. Neurobiological links between stress and anxiety.
Neurobiol Stress. 2019;11:100191. doi:10.1016/j.ynstr.2019.100191
58. Roozendaal B, Castello NA, Vedana G, Barsegyan A, McGaugh JL. Noradrenergic activation of the basolateral amygdala modulates consolidation of object recognition memory. Neurobiol Learn Mem. 2008;90(3):576-579. doi:10.1016/j.nlm.2008.06.010
59. Sara SJ, Bouret S. Orienting and reorienting: the locus coeruleus mediates cognition through arousal. Neuron. 2012;76(1):130-141. doi:10.1016/j.neuron.2012.09.011
60. Fitzgerald PJ, Giustino TF, Seemann JR, Maren S. Noradrenergic blockade stabilizes prefrontal activity and enables fear extinction under stress. Proc Natl Acad SciUS A. 2015;112(28):E3729-E3737. doi:10.1073/pnas. 1500682112
61. Giustino TF, Maren S. Noradrenergic modulation of fear conditioning and extinction. Front Behav Neurosci. 2018;12:43. doi:10.3389/fnbeh.2018.00043
62. Gazarini L, Stern CA, Takahashi RN, Bertoglio LJ. Interactions of noradrenergic, glucocorticoid and endocannabinoid systems intensify and generalize fear memory traces. Neuroscience. 2022;497:118-133. doi:10. 1016/j.neuroscience.2021.09.012
63. Kessler RC, Chiu WT, Demler O, Merikangas KR, Walters EE. Prevalence, severity, and comorbidity of 12-month DSM-IV disorders in the National Comorbidity Survey Replication. Arch Gen Psychiatry. 2005;62(6):617-627. doi: 10.1001/archpsyc.62.6.617
64. Goldstein RB, Smith SM, Chou SP, et al. The epidemiology of DSM-5 posttraumatic stress disorder in the United States: results from the National Epidemiologic Survey on Alcohol and Related Conditions-III. Soc Psychiatry Psychiatr Epidemiol. 2016;51(8):1137-1148. doi:10.1007/s00127-016-1208-5
65. Mikkelsen ME, Still M, Anderson BJ, et al. Society of Critical Care Medicine’s International Consensus Conference on Prediction and Identification of Long-Term Impairments After Critical Illness. Crit Care Med. 2020; 48(11):1670-1679. doi:10.1097/CCM.0000000000004586
66. Widmann CN, Heneka MT. Long-term cerebral consequences of sepsis. Lancet Neurol. 2014;13(6):630-636. doi:10.1016/S1474-4422(14)70017-1
67. Hoogland IC, Houbolt C, van Westerloo DJ, van Gool WA, van de Beek D. Systemic inflammation and microglial activation: systematic review of animal experiments. J Neuroinflammation. 2015;12:114. doi:10.1186/s12974-015- 0332-6
68. Witcher KG, Eiferman DS, Godbout JP. Priming the inflammatory pump of the CNS after traumatic brain injury.
Trends Neurosci. 2015;38(10):609-620. doi:10.1016/j.tins.2015.08.002
69. Muscat SM, Barrientos RM. The perfect cytokine storm: how peripheral immune challenges impact brain plasticity & memory function in aging. Brain Plast. 2021;7(1):47-60. doi:10.3233/BPL-210127
70. Huang M, Parker AM, Bienvenu OJ, et al; National Institutes of Health, National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome Network. Psychiatric symptoms in acute respiratory distress syndrome survivors: a 1-year national multicenter study. Crit Care Med. 2016;44(5):954-965. doi:10.1097/CCM. 0000000000001621
71. Pandharipande P, Shintani A, Peterson J, et al. Lorazepam is an independent risk factor for transitioning to delirium in intensive care unit patients. Anesthesiology. 2006;104(1):21-26. doi:10.1097/00000542- 200601000-00005
72. Bourenne J, Hraiech S, Roch A, Gainnier M, Papazian L, Forel JM. Sedation and neuromuscular blocking agents in acute respiratory distress syndrome. Ann Transl Med. 2017;5(14):291. doi:10.21037/atm.2017.07.19
73. Devlin JW, Skrobik Y, Gélinas C, et al. Clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Crit Care Med. 2018;46 (9):e825-e873. doi:10.1097/CCM.0000000000003299
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 03.04.2024
[~DATE_ACTIVE_FROM] => 03.04.2024
[ACTIVE_FROM_X] => 2024-04-03 00:00:00
[~ACTIVE_FROM_X] => 2024-04-03 00:00:00
[ACTIVE_FROM] => 03.04.2024
[~ACTIVE_FROM] => 03.04.2024
[SHOW_COUNTER] => 569
[~SHOW_COUNTER] => 569
[ID] => 8435
[~ID] => 8435
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 11.11.2024 14:06:54
[~TIMESTAMP_X] => 11.11.2024 14:06:54
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/svyaz-infuzii-vitamina-s-tiamina-i-gidrokortizona-s-dolgosrochnymi-kognitivnymi-psikhologicheskimi-i/
[~DETAIL_PAGE_URL] => /library/articles/svyaz-infuzii-vitamina-s-tiamina-i-gidrokortizona-s-dolgosrochnymi-kognitivnymi-psikhologicheskimi-i/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => svyaz-infuzii-vitamina-s-tiamina-i-gidrokortizona-s-dolgosrochnymi-kognitivnymi-psikhologicheskimi-i
[~CODE] => svyaz-infuzii-vitamina-s-tiamina-i-gidrokortizona-s-dolgosrochnymi-kognitivnymi-psikhologicheskimi-i
[EXTERNAL_ID] => 8435
[~EXTERNAL_ID] => 8435
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 3 апреля 2024
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса
[PREVIEW_PICTURE] => Array
(
[ID] => 5615
[TIMESTAMP_X] => 11.11.2024 14:06:54
[MODULE_ID] => iblock
[HEIGHT] => 3648
[WIDTH] => 4475
[FILE_SIZE] => 405291
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/728/3l4yab8wn7ssm3i60315unrv49br2zke
[FILE_NAME] => preventive-coronavirus-vaccine-syringe.jpg
[ORIGINAL_NAME] => preventive-coronavirus-vaccine-syringe.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 2a798903703e87c10fb649076eb02d36
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/728/3l4yab8wn7ssm3i60315unrv49br2zke/preventive-coronavirus-vaccine-syringe.jpg
[UNSAFE_SRC] => /upload/iblock/728/3l4yab8wn7ssm3i60315unrv49br2zke/preventive-coronavirus-vaccine-syringe.jpg
[SAFE_SRC] => /upload/iblock/728/3l4yab8wn7ssm3i60315unrv49br2zke/preventive-coronavirus-vaccine-syringe.jpg
[ALT] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса
[TITLE] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса
)
[DETAIL_TEXT] => Roberson S, Nwosu S, Collar E et al. for the VICTAS Investigators
Association of Vitamin C, Thiamine, and Hydrocortisone Infusion With Long-term Cognitive, Psychological, and Functional Outcomes in Sepsis Survivors A Secondary Analysis of the Vitamin C, Thiamine, and Steroids in Sepsis Randomized Clinical Trial
Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса
Вторичный анализ использования витамина С, тиамина и стероидов в рандомизированном клиническом исследовании сепсиса
JAMA Network Open. 2023;6(2):e230380. doi:10.1001/jamanetworkopen.2023.0380
Абстракт
Сепсис связан с долгосрочными когнитивными нарушениями и худшими психологическими и функциональными последствиями. Потенциальные механизмы включают внутримозговой окислительный стресс и воспаление, однако мало что известно о влиянии ранней антиоксидантной и противовоспалительной терапии на когнитивные, психологические и функциональные исходы у выживших после сепсиса.
ЦЕЛЬ
Описать наблюдаемые различия в долгосрочных когнитивных, психологических и функциональных результатах приема витамина С, тиамина и гидрокортизона между экспериментальной и контрольной группами в рандомизированном клиническом исследовании Vitamin C, Thiamine, and Steroids in Sepsis (VICTAS).
В этом предварительно заданном вторичном анализе представлены 6-месячные результаты многоцентрового двойного слепого плацебо-контролируемого рандомизированного клинического исследования VICTAS, которое проводилось в период с августа 2018 г. по июль 2019 г. Взрослые пациенты с сепсис-индуцированной респираторной и / или с сердечно-сосудистой дисфункцией, которые дожили до выписки или 30-го дня, были набраны из 43 ОИТ в США. Участники были рандомизированы 1:1 либо в группу вмешательства, либо в контрольную группу. Когнитивные, психологические и функциональные результаты через 6 месяцев после рандомизации оценивались по телефону до января 2020 года. Анализ данных проводился в период с февраля 2021 года по декабрь 2022 года.
Группа вмешательства получала внутривенно витамин С (1,5 г), гидрохлорид тиамина (100 мг) и сукцинат гидрокортизона натрия (50 мг) каждые 6 часов в течение 96 часов или до смерти или выписки из ОИТ. Контрольная группа получала плацебо.
Когнитивные способности, риск посттравматического стрессового расстройства и депрессии, а также функциональное состояние оценивались с использованием набора стандартизированных инструментов, которые использовали во время часового телефонного разговора через 6 месяцев после рандомизации.
После исключения, раннего вывода и смерти в окончательную выборку вошли 213 участников (медиана [IQR] возраста 57 [47–67] лет; 112 мужчин [52,6%]), которые прошли оценку отдаленных результатов и были рандомизированы. либо в группу вмешательства (n = 108), либо в контрольную группу (n = 105). Группа вмешательства имела более низкие показатели непосредственной памяти (скорректированное ОШ [aOR], 0,49; 95% ДИ,0,26–0,89), более высокие шансы посттравматического стрессового расстройства (aOR, 3,51; 95% ДИ, 1,18–10,40) и более низкие шансы получения психиатрической помощи (aOR, 0,38; 95% CI, 0,16–0,89). Других статистически значимых различий в когнитивных, психологических и функциональных результатах между двумя группами обнаружено не было.
У выживших после сепсиса лечение витамином С, тиамином и гидрокортизоном не улучшило или не ухудшило когнитивные, психологические и функциональные результаты через 6 месяцев по сравнению с пациентами, получавшими плацебо. Эти результаты ставят под сомнение гипотезу о том, что антиоксидантная и противовоспалительная терапия во время критического состояния смягчает развитие долгосрочных когнитивных, психологических и функциональных нарушений у пациентов, переживших сепсис.
Введение
Сепсис — это системная воспалительная реакция на инфекцию, которая часто приводит к полиорганной недостаточности, повышению смертности и долгосрочным когнитивным и функциональным нарушениям.1,2 Из почти 2 миллионов случаев сепсиса в США ежегодно почти 55% требуют лечения в отделении интенсивной терапии (ОРИТ) и от 20% до 30% умирают.3 Выжившие после сепсиса имеют в 3-4 раза больший риск когнитивных нарушений от умеренной до тяжелой степени по сравнению с пациентами, госпитализированными без сепсиса.4 Выжившие после сепсиса также подвергаются большему риску развития синдрома после интенсивной терапии (ПИТ), совокупность симптомов, приводящих к долгосрочному когнитивному и психологическому ухудшению, а также к ухудшению качества жизни. 4-7 В то время как раннее назначение антибиотиков, гемодинамическая поддержка, инфузионная терапия и контроль источника инфекции были связаны с улучшением смертности 8,9когнитивные, психологические и функциональные нарушения, связанные с сепсисом, остаются серьезной проблемой общественного здравоохранения.10,11
Предполагается, что когнитивные нарушения после сепсиса являются результатом сочетания оксидативного стресса и длительного нейровоспаления, возникающего в результате начальной системной воспалительной реакции. Увеличение количества активных форм кислорода вызывает клеточное повреждение, которое в сочетании с постоянной активацией микроглии может способствовать дисфункции гематоэнцефалического барьера, потере синапсов и гибели нейронов.12-15 Витамин C является мощным антиоксидантом и может предотвратить снижение когнитивных способностей после сепсиса, защищая клетки от окислительного повреждения липидов.16,17
Люди - одни из немногих млекопитающих, которые не могут синтезировать витамин С эндогенно18 и подвержены риску истощения витамина С во время сепсиса.19-21 Как витамин С, так и гидрокортизон были связаны со снижением маркеров острого воспаления у пациентов с сепсисом 22,23 и могут действовать синергетически для предотвращения эндотелиальной дисфункции и восстановления функции эндотелия.24-26 Неблагоприятные когнитивные и психические эффекты дефицита витамина С у людей были признаны на протяжении веков.27Тиамин, со своей стороны , также часто недостаточен при сепсисе.28 Дефицит тиамина увеличивает маркеры воспаления29 и связан с когнитивными нарушениями 30 Эти данные свидетельствуют о том, что комбинация витамина С, гидрокортизона и тиамина может защитить пациентов от постсептических когнитивных нарушений. Кроме того, некоторые исследования предполагают преимущество в выживаемости при использовании того же терапевтического подхода.28
Тем не менее, из 5 крупных рандомизированных клинических испытаний 23,31-34 все, кроме одного, не смогли продемонстрировать улучшение выживаемости при терапии на основе витамина С. Хотя в одном из этих испытаний изучалось качество жизни через 6 месяцев,34 ни в одном исследовании на сегодняшний день не оценивалось влияние этих методов лечения на постсептические когнитивные и психологические исходы. Многоцентровое двойное слепое плацебо-контролируемое рандомизированное клиническое исследование витамина С, тиамина и стероидов при сепсисе (VICTAS) было проведено в период с августа 2018 г. по июль 2019 г. для проверки гипотезы о том, что эта комбинированная терапия улучшит клинически важные исходы у пациентов с сепсисом с индуцированной дыхательной и/или сердечно-сосудистой недостаточностью.35 Исследование было разработано априори для оценки основной цели воздействия на смертность и количество дней без ИВЛ и вазопрессоров, на которые, как было показано, схема лечения не влияла.36 Кроме того, испытание было разработано для вторичной цели изучения влияния этой комбинированной терапии на когнитивный, психологический и функциональный статус при 6-месячном наблюдении за участниками интервенционной и контрольной групп, что было в центре внимания этого вторичного анализа. 37 Мы предположили, что среди выживших после сепсиса, нуждающихся в вазопрессорной поддержке или ИВЛ, раннее лечение высокими дозами витамина С, тиамина и гидрокортизона улучшает когнитивные функции, психологические симптомы и функциональное состояние через 6 месяцев после рандомизации.
Методы
Детали протокола и анализа исследования VICTAS.35-37 Вкратце, взрослых пациентов с острой дыхательной и/или сердечной дисфункцией вследствие сепсиса, нуждавшихся в ИВЛ или вазопрессорной поддержке, набирали в 43 больницах США. Участники были рандомизированы 1:1 либо в группу вмешательства, либо в контрольную группу. Участники, исследователи и персонал исследовательской группы, ответственный за оценку результатов, не знали о распределении лечения. Испытание VICTAS, включая этот предварительно определенный вторичный анализ, было одобрено институциональным наблюдательным советом Johns HopkinsHospital. Участники или их законные представители предоставили письменное информированное согласие до регистрации и рандомизации. Мы следовали рекомендациям по составлению сводных стандартов отчетности об испытаниях (CONSORT).
Вмешательство состояло из внутривенного введения витамина С (1,5 г), гидрохлорида тиамина (100 мг) и сукцината гидрокортизона натрия (50 мг), которые вводились в течение 4 часов после рандомизации и каждые 6 часов после этого в течение 96 часов или до смерти или выписки изОРИТ в зависимости от того, что произошло раньше. Участники контрольной группы получали плацебо-инъекции соответствующего по объему физиологического раствора с той же частотой. Участников можно было лечить открытыми кортикостероидами, если клиницисты сочли это целесообразным; в случаях суточных доз, превышающих или равных 200 мг гидрокортизона (или эквивалента), аптека отказывалась от исследуемого гидрокортизона или соответствующего плацебо. Обученный исследовательский персонал ежедневно оценивал участников на наличие делирия в течение периода вмешательства, используя метод оценки спутанности сознания для ОРИТ в сочетании с Ричмондской шкалой возбуждения-седации. Все остальное клиническое ведение участников, включая энтеральное введение витаминов и питание, оставалось на усмотрение врачей.
Оценка долгосрочных результатов
При выписке или через 30 дней, в зависимости от того, что произошло раньше, участников приглашали на последующее телефонное интервью через 6 месяцев после рандомизации. Приглашение не требовало отдельного информированного согласия от основного исследования, но требовало выражения готовности участником или представителем участника связаться примерно через 6 месяцев. Чтобы облегчить долгосрочное удержание когорты, мы использовали период наблюдения от 5 до 8 месяцев. Последующие оценки проводились до января 2020 года.
Во время последующего телефонного интервью мы использовали ранее валидированный38 ряд инструментов когнитивной оценки, включая следующие: метод оценки спутанности сознания по телефону39 для оценки бреда; телефонное интервью для определения когнитивного статуса40 для оценки общей когнитивной функции; Шкала интеллекта взрослых Векслера, четвертое издание, субтест на объем цифр для оценки внимания и объема рабочей памяти; Шкала памяти Вешлера, четвертое издание, логическая память I и II для изучения немедленной и отсроченной памяти соответственно; Шкала интеллекта взрослых Векслера, четвертое издание, субтест сходства для оценки языковой концептуализации и словесной абстракции; контролируемый устный ассоциативный тест для оценки беглости речи; и тест завершения предложения Хейлинга для оценки торможения реакции как формы исполнительной функции. Более высокие баллы по этим инструментам указывают на лучшие результаты. Полное описание этих оценок, их соответствующих систем подсчета баллов и интерпретации результатов представлены в eAppendix 1 in Supplement 1. Для оценки психологического статуса мы использовали опросник посттравматического стрессового расстройства из 8 пунктов (PTSD-8)41 и Информационную систему измерения исходов, сообщаемых пациентами и краткую форму по депрессии 6 пунктов (PROMIS-6) (Patient-Reported Outcomes Measurement Information System Depression 6-item Short Form).42. Скрининг посттравматического стрессового расстройства (ПТСР) был привязан к опыту пребывания в ОИТ, и участники считались страдающими ПТСР, если они сообщали о наличии у них 3 или более баллов по шкале PTSD-8 в трех из 4 категорий симптомов.41
Участники считались страдающими депрессией, если общий уровень симптомов по PROMIS-6 превышало Т-балл 60, что соответствует умеренной депрессии по обычно используемым показателям депрессии.43 Более высокие баллы по PTSD-8 и PROMIS-6 указывают на худшие результаты. Эти инструменты и их критерии оценки более подробно описаны в eAppendix 1 inSupplement 1.
Мы использовали Katz Activities of Daily Living Scale 44 и Опросник функциональной активности45 для оценки базовой и функциональной деятельности в повседневной жизни соответственно. Более высокие баллы по этим инструментам указывают на худшие результаты. Мы использовали EuroQoL 5-Dimensions 3-Level (EQ-5D-3L)46 для оценки общего качества жизни, связанного со здоровьем. Более высокий балл по EQ-5D-3L отражает лучшие результаты. Мы включили дополнительные стандартизированные вопросы для оценки обращения за медицинской помощью после выписки47 (eAppendix 1 в Supplement 1).
Телефонные интервью длились около 60 минут. В случаях, когда участник не мог или не желал пройти официальную когнитивную и психологическую оценку по телефону (например, из-за болезни, чрезмерной усталости или когнитивного ухудшения), данные о функциональном состоянии и использовании медицинских услуг собирались у назначенного представителя пациента. Причины невозможности участия в индивидуальных оценках были зафиксированы.
Статистический анализ
Категориальные переменные сообщались с использованием частот и пропорций. Непрерывные переменные были указаны как средние значения с SD или медианы с IQR. Участники были проанализированы в соответствии с группой, в которую они были рандомизированы (т. е. группа вмешательства или контроль). Сравнение между группами, с двусторонними значениямиP использовали многомерную логистическую регрессию пропорциональных шансов для порядковых результатов и бинарную логистическую регрессию для дихотомических результатов.
Мы скорректировали следующие ковариаты: возраст, пол, раса и этническая принадлежность (определяемые по самоотчету или наблюдениям исследователя), уровень образования, оценка острого состояния и хронического состояния здоровья по версии II, наличие диабета, сопутствующие неврологические или сердечно-сосудистые заболевания, количество дней ИВЛ и продолжительность пребывания в ОРИТ. P < 0,05 считалось статистически значимым. Для стандартизированных когнитивных оценок в статистическом анализе использовались баллы по шкале.
Этот вторичный анализ сообщал о ключевой вторичной цели исследования VICTAS. Испытание было явно направлено на достижение основной цели и было прекращено в административном порядке после набора 501 участника. Вторичный анализ был определен априори с целью описать величину различий между группами, а не сосредоточиться на проверке гипотез. Таким образом, поправки на множественность не вносились, и сообщалось о скорректированных размерах эффекта (т. е. об отношении шансов [ОШ]) с 95% ДИ. Для устранения недостающих данных о ковариатах использовалась множественная интерполяция на основе прогнозируемого среднего соответствия.
Приблизительно одна треть участников, опрошенных при последующем наблюдении, не смогли или не захотели выполнить полный набор когнитивных и психологических тестов (eAppendix 2 and eTable 2 in Supplement 1 описываются показатели прохождения отдельных тестов). Менее чем 7% включенных участников, которые не смогли пройти данную оценку из-за когнитивных нарушений, была присвоена самая низкая возможная оценка. Все остальные отсутствующие данные считались полностью случайными. Все анализы проводились в период с февраля 2021 г. по декабрь 2022 г. с использованием R версии 3.4.3 (R Foundation for Statistical Computing).
Результаты
Блок-схема регистрации, рандомизации и последующего наблюдения за участниками исследования VICTAS представлена на Figure 1. Из 501 рандомизированного участника 198 (39,5%) умерли до проведения оценки долгосрочных результатов (196 умерли в течение 180 дней после рандомизации и 2 умерли через 180 дней после рандомизации, но до того, как закончилось их 5-8-месячное окно наблюдения). Из оставшихся 303 участников 4 (1,3%) выбыли из исследования, а 40 (13,2%) не согласились на последующую оценку. Из 285 участников, доступных для последующего наблюдения, 32 (11,2%) не могли быть охвачены в течение 5–8-месячного окна последующего наблюдения, а 13 (4,6%) имели укороченное окно последующего наблюдения из-за административного прекращения исследования. Один участник был исключен в административном порядке из-за лишения свободы, а 26 (9,1%) отказались от оценки при последующем наблюдении.

Окончательная выборка включала 213 участников, из которых 108 были рандомизированы в группу вмешательства, а 105 — в контрольную группу. Характеристики включенных участников описаны в Table 1 and eTable 1 in Supplement 1, наряду с умершими участниками и теми, для которых результаты были недоступны (например, из-за отказа или потери для последующего наблюдения). Включенные участники имели средний возраст (IQR) 57 (47-67) лет и состояли из 101 женщины (47,4%) и 112 мужчин (52,6%). Данные были представлены представителями участников только в 39 случаях (18,3%). Группа вмешательства и контрольная группа имели сопоставимые характеристики (Table 2), за исключением того, что в группу вмешательства входило больше белых участников, чем в контрольную группу (72 [66,7%] против 57 [54,3%]). 157 участников (73,7%) в группе последующего наблюдения, 72 (68,6%) в контрольной группе и 85 (78,7%) в группе вмешательства получали норадреналин парентерально.

Шестьдесят шесть пациентов (31,0%) в контрольной когорте (32 пациента [30,5%] из контрольной группы и 34 [31,5%] из группы вмешательства) получали кортикостероиды в открытом доступе, находясь в ОРИТ.

Когнитивные результаты
Когнитивные результаты через 6 месяцев представлены в eTable 3 in Supplement 1, а эффекты лечения обобщены на Figure 2 и eAppendix 3 в Supplement 1. Ни один из участников, прошедших когнитивная оценку не имели делирий во время оценки.

Лечение витамином С, тиамином и гидрокортизоном, как правило, ассоциировалось с ухудшением когнитивных функций со статистически значимым ухудшением непосредственной памяти (оценка логической памяти I; скорректированное ОШ [aOR], 0,49; 95% ДИ, 0,26–0,89; P= 0,02). ) (Figure 2 ). Точечная оценка эффекта лечения была ниже 1 для всех других когнитивных оценок (диапазон 0,49–0,87), за исключением теста завершения предложения Хейлинга (aOR, 1,58; 95% ДИ, 0,83–3,04; P = 0,17) и ассоциации контролируемой устной речи. Тест (aOR, 1,01; 95% ДИ, 0,56–1,82; P = 0,98) (Figure 2). Полный анализ случаев показал аналогичные размеры эффекта для всех когнитивных результатов (eAppendix 4 и eTable 4 в Supplement 1).
Психологические и функциональные результаты
ОШ для неблагоприятных психологических и функциональных исходов показаны на Figure 3, а подсчеты для каждой группы приведены в eTable 3 в Supplement 1, а вероятности представлены на графике в eAppendix 3 в Supplement 1.
Мы обнаружили посттравматическое стрессовое расстройство у 10 из 105 (9,5%) участников контрольной группы и 18 из 108 (16,7%) участников группы вмешательства (eTable 3 в Supplement 1). Лечение витамином С, тиамином и гидрокортизоном ассоциировалось с увеличением вероятности посттравматического стрессового расстройства (aOR, 3,51; 95% ДИ, 1,18–10,40; P = 0,02) (рис. 3). Депрессия выявлена у 50 из 142 (35,2%) участников, прошедших ПРОМИС-6. Статистических данных о влиянии лечения на депрессию не было (aOR, 1,26; 95% ДИ, 0,55–2,86; P = 0,59) (Figure 3).
Функциональный статус не отличался между экспериментальной и контрольной группами. ОШ составляло 0,89 (95% ДИ, 0,51–1,58; P = 0,70) для шкалы ежедневной активности Каца, 1,01 (95% ДИ, 0,60–1,73;P = 0,96) для опросника функциональной активности и 0,92 (95% ДИ, 0,50–1,69; P = 0,78) для общего состояния здоровья по EQ-5D-3L. Полный анализ психологических и функциональных результатов дал аналогичные результаты (eAppendix 4 и eTable 4 в Supplement1).
Вероятность повторной госпитализации была одинаковой между экспериментальной и контрольной группами (aOR, 1,09; 95% ДИ, 0,56–2,12; P = 0,79) (eTable 4 в Supplement 1). У участников группы вмешательства были более низкие шансы, чем у участников контрольной группы, получить официальную психиатрическую или психологическую помощь в течение 6 месяцев после выписки (aOR, 0,38; 95% ДИ, 0,16–0,89; P = 0,03) (Figure 3). В группе вмешательства также были более низкие шансы, чем в контрольной группе, сообщить об использовании лекарств для лечения депрессии или тревоги, хотя это различие не было статистически значимым (aOR, 0,65; 95% ДИ, 0,34–1,27; P = 0,21) (Figure 3).
Обсуждение
В предварительно заданном вторичном анализе выживших после сепсиса в исследованииVICTAS мы не обнаружили доказательств положительного влияния раннего лечения витамином С, тиамином и гидрокортизоном на когнитивные, психологические и функциональные исходы через 6 месяцев. Напротив, у участников группы вмешательства были более низкие показатели непосредственной памяти и более высокие шансы посттравматического стрессового расстройства по сравнению с участниками контрольной группы. Эти результаты опровергают гипотезу о том, что антиоксидантная и противовоспалительная терапия во время критического состояния может уменьшить развитие долговременной инвалидности, связанной с ПИТС, у выживших после сепсиса. Отсутствие положительного эффекта согласуется с результатами предыдущих рандомизированных клинических исследований, в которых не было выявлено снижения смертности и других исходов в стационаре при терапии витамином С.23,31-34.
The cognitive scores of both the intervention and control groups were similar in magnitude to those reported in other cohorts of ICU survivors.47,48 The median differences in scores for the cognitive assessments were 1 to 2 points on scales ranging from 0 to 10 or 20 (range of 0-100 in Controlled Oral Word Association Test), reflecting a relatively modest potential effect of the intervention on 6-month cognitive outcome. The rates of depression, PTSD, and functional disability were also commensurate with those previously reported49,50 and consistent with the outcomes typically observed in PICS.51-53
Тем не менее, наблюдение возможных долгосрочных негативных последствий у участников группы вмешательства является сигналом, который требует осторожности. Меньшее количество участников в группе вмешательства, чем в контрольной группе, получали психиатрическую помощь, несмотря на то, что у этих участников чаще демонстрировалось возможное посттравматическое стрессовое расстройство. Будущие исследования, оценивающие связь между неотложным лечением и долгосрочными результатами, должны рассмотреть вопрос о том, является ли интеркуррентная терапия смешанным фактором или исходом сама по себе.
Когнитивные баллы как в группе вмешательства, так и в контрольной группе были аналогичны тем, о которых сообщалось в других когортах выживших в отделении интенсивной терапии. (диапазон 0–100 в тесте контролируемых устных словесных ассоциаций), что отражает относительно скромный потенциальный эффект вмешательства на когнитивный результат через 6 месяцев. Частота депрессии, посттравматического стрессового расстройства и функциональных нарушений также соответствовала ранее сообщавшимся 49,50 и соответствовала исходам, обычно наблюдаемым при ПИТ-синдроме 51-53.
Может ли терапия на основе антиоксидантов действительно играть роль в повышенном риске неблагоприятных когнитивных, психологических и функциональных последствий у выживших после сепсиса? Повышенные шансы посттравматического стрессового расстройства, которые наблюдались в группе вмешательства, возможно, были в меньшей степени опосредованы ролью витамина С в качестве антиоксиданта и в большей степени его модуляцией метаболизма нейротрансмиттеров в головном мозге. Витамин С способствует превращению дофамина в норадреналин 54,55. Последний нейромедиатор является основным проводником locus coeruleus, который опосредует физические и эмоциональные реакции на стресс 56,57 и способствует консолидации аверсивных воспоминаний.58,59 Блокада рецепторов норадреналина обеспечивает угасание у животных, подвергающихся стрессовым воздействиям,60 подтверждая гипотезу о том, что передача норадреналина играет важную роль в патогенезе посттравматического стрессового расстройства.61 Если профилактика дефицита витамина С во время сепсиса сохраняет метаболизм норадреналина, возможно, что этот процесс повлиял на силу формирования аверсивных воспоминаний во время стрессового пребывания в ОИТ, что привело к более высоким шансам посттравматического стрессового расстройства. Совместное введение гидрокортизона с норэпинефрином потенцирует реакции памяти о страхе62 и, возможно, действовало синергетически, увеличивая риск посттравматического стрессового расстройства у участников исследования VICTAS.
В качестве альтернативы могли играть роль экзогенные норадреналин и/или кортикостероиды. Апостериорный обзор клинических данных показал, что 73,7% участников последующего наблюдения (68,6% в контрольной группе и 78,7% в группе вмешательства) получали норадреналин парентерально; 31,0% получали сопутствующую открытую терапию кортикостероидами. Дифференциальную роль экзогенных и эндогенных нейротрансмиттеров в патогенезе посттравматического стрессового расстройства еще предстоит выяснить. Более низкий уровень психиатрической помощи и более высокий уровень повторной госпитализации в группе вмешательства также могли повлиять на риск посттравматического стрессового расстройства.
Независимо от того, связана ли разница в исходах между группами напрямую с лечением, наблюдаемая частота посттравматического стрессового расстройства (13,1% [28 из 213 участников группы отдаленного наблюдения) была выше, чем распространенность в прошлом году от 3,5% до 6,1% в популяции населения в целом 63,64, оказывая дальнейшую поддержку рекомендациям Society of Critical Care Medicine по скринингу посттравматического стрессового расстройства и других симптомов, связанных с ПИТ-синдромом, после пребывания в ОРИТ.65
Предполагаемые механизмы снижения когнитивных функций после сепсиса включают внутримозговой окислительный стресс, воспаление и эндотелиальную дисфункцию.66 Витамин С, гидрокортизон и тиамин защищают нейроны от окислительного повреждения и останавливают системную воспалительную реакцию, и, таким образом, ожидается, что они уменьшат бремя долговременных неврологических нарушений. 16 Тем не менее, мы не обнаружили клинических доказательства такого эффекта в этом испытании. Возможно, что доза, время или продолжительность терапии были недостаточными для обеспечения адекватной клеточной защиты. Вмешательство было ограничено пребыванием в ОИТ (в среднем 3 дня среди контрольной когорты). Модели сепсиса на мышах позволяют предположить, что, хотя истощение запасов витамина С происходит в остром периоде болезни,19 существуют различные фазы нейровоспалительной реакции после перенесенного заболевания.67 Долговременные эффекты наблюдаются в центральной нервной системе после постоянной активации клеток микроглии.68,69 Индивидуумы могут зависеть от длительного восполнения запасов витамина С в течение всего периода восстановления, чтобы противодействовать окислительной нагрузке и защитить от посттравматического снижения когнитивных функций. Будущие исследования с длительным приемом витамина С после сепсиса могут проверить эту гипотезу.
Future studies evaluating the effect of acute therapeutic measures on long-term cognitive and psychiatric outcomes should track adherence to Society of Critical Care Medicine guidelines on the management of pain, agitation, and delirium.73
Длительность пребывания в ОРИТ с использованием опиатов или нервно-мышечной блокадой может способствовать возникновению психиатрических симптомов после критического состояния.70 Бензодиазепины являются факторами повышенного риска делирия в ОРИТ,71 что также связано с долгосрочными когнитивными нарушениями. 47 Ежедневное прерывание седации ограничивает этот риск. Будущие исследования, оценивающие влияние неотложных терапевтических мер на долгосрочные когнитивные и психические исходы, должны отслеживать соблюдение руководящих принципов Society of Critical Care Medicine в отношении боли, возбуждения и делирия.73
Ограничения
Это исследование имеет несколько ограничений. Во-первых, интерпретация была ограничена теми, кто пережил сепсис. Как выживаемость повлияла на интерпретацию результатов, было неясно, хотя понимание различий в исходах, о которых сообщают пациенты, на основе выживаемости остается ценным. Во-вторых, распространенной проблемой среди исследований когнитивных и психологических исходов после критического заболевания является незапланированный характер включения и, как следствие, сложность адекватной оценки преморбидных когнитивных и психологических расстройств. Несмотря на рандомизацию, у участников группы последующего наблюдения могут быть исходные различия в когнитивных показателях, которые нельзя количественно оценить или контролировать в анализе. Мы не собирали исходные когнитивные или психологические данные, что требует осторожной интерпретации результатов.
В-третьих, 40 из 303 подходящих участников (13,2%) не согласились на последующую оценку. Тот факт, что участники испытаний не были автоматически включены в этот вторичный анализ и должны были выразить готовность участвовать, мог увеличить отсев. Кроме того, исследование VICTAS было прекращено в административном порядке из-за прекращения финансирования, что привело к сокращению окна последующего наблюдения для небольшой части (4,6%) подходящих участников. Тем не менее, мы смогли получить по крайней мере частичную последующую оценку примерно 85% подходящих участников, и эти выжившие после сепсиса не отличались по характеристикам от тех, кто выбыл, отказался от оценки или в конечном итоге был потерян для последующего наблюдения. Некоторые участники не смогли или не захотели выполнить несколько оценок, а процент отсутствующих данных для нескольких оценок достиг почти 25%. Среди участников, которые были включены в группу последующего наблюдения, наиболее распространенной причиной невыполнения оценки был отказ пациента (eTable 2 в Supplement 1). Частота отсутствующих данных была одинаковой между группой вмешательства и контрольной группой, и отдельный анализ с использованием подхода полного случая дал аналогичные результаты. Эти наблюдения показывают, что показатели завершения не оказали существенного влияния на общие выводы. В-четвертых, в прагматических целях мы выбрали инструменты краткого скрининга в качестве меры психологического результата. Хотя эти инструменты хорошо приняты и обладают высокой чувствительностью и специфичностью для выявления посттравматического стрессового расстройства и депрессии, формальная диагностика требует углубленной оценки квалифицированным специалистом в области психического здоровья.
Выводы
В исследовании VICTAS у выживших после сепсиса, получавших раннее лечение витамином С, тиамином и гидрокортизоном в ОРИТ, когнитивные, психологические и функциональные исходы через 6 месяцев наблюдения либо не изменились, либо были хуже, чем у пациентов, получавших плацебо. Эти результаты не поддерживают антиоксидантную и противовоспалительную терапию и предполагают, что антиоксидантная и противовоспалительная терапия не смягчает развитие долгосрочных когнитивных, психологических и функциональных нарушений у пациентов с сепсисом, которым требуется использование вазопрессоров или респираторная поддержка в ОРИТ.
Дополнительно:
Ссылка на документ с дополнительными данными исследования - часть 1 (Supplementary 1)
Ссылка на документ с дополнительными данными исследования - часть 2 (Supplementary 2)
REFERENCES
1. Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801-810. doi:10.1001/jama.2016.0287
2. Buchman TG, Simpson SQ, Sciarretta KL, et al. Sepsis among Medicare beneficiaries: 1. the burdens of sepsis, 2012-2018. Crit Care Med. 2020;48(3):276-288. doi:10.1097/CCM.0000000000004224
3. Rhee C, Dantes R, Epstein L, et al; CDC Prevention Epicenter Program. Incidence and trends of sepsis in US hospitals using clinical vs claims data, 2009-2014. JAMA. 2017;318(13):1241-1249. doi:10.1001/jama.2017.13836
4. Iwashyna TJ, Ely EW, Smith DM, Langa KM. Long-term cognitive impairment and functional disability among survivors of severe sepsis. JAMA. 2010;304(16):1787-1794. doi:10.1001/jama.2010.1553
5. Yende S, Austin S, Rhodes A, et al. Long-term quality of life among survivors of severe sepsis: analyses of two international trials. Crit Care Med. 2016;44(8):1461-1467. doi:10.1097/CCM.0000000000001658
6. Winters BD, Eberlein M, Leung J, Needham DM, Pronovost PJ, Sevransky JE. Long-term mortality and quality of life in sepsis: a systematic review. Crit Care Med. 2010;38(5):1276-1283. doi:10.1097/CCM.0b013e3181d8cc1d
7. Semmler A, Widmann CN, Okulla T, et al. Persistent cognitive impairment, hippocampal atrophy and EEG changes in sepsis survivors. J Neurol Neurosurg Psychiatry. 2013;84(1):62-69. doi:10.1136/jnnp-2012-302883
8. Rhodes A, Evans LE, Alhazzani W, et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock: 2016. Crit Care Med. 2017;45(3):486-552. doi:10.1097/CCM.0000000000002255
9. Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock 2021. Crit Care Med. 2021;49(11):e1063-e1143. doi:10.1097/CCM.0000000000005337
10. Needham DM, Davidson J, Cohen H, et al. Improving long-term outcomes after discharge from intensive care unit: report from a stakeholders’ conference. Crit Care Med. 2012;40(2):502-509. doi:10.1097/CCM. 0b013e318232da75
11. Marshall JC. Why have clinical trials in sepsis failed? Trends Mol Med. 2014;20(4):195-203. doi:10.1016/j. molmed.2014.01.007
12. Hernandes MS, D’Avila JC, Trevelin SC, et al. The role of Nox2-derived ROS in the development of cognitive impairment after sepsis. J Neuroinflammation. 2014;11:36. doi:10.1186/1742-2094-11-36
13. Wu Y, Dissing-Olesen L, MacVicar BA, Stevens B. Microglia: dynamic mediators of synapse development and plasticity. Trends Immunol. 2015;36(10):605-613. doi:10.1016/j.it.2015.08.008
14. Lochhead JJ, McCaffrey G, Quigley CE, et al. Oxidative stress increases blood-brain barrier permeability and induces alterations in occludin during hypoxia-reoxygenation. J Cereb Blood Flow Metab. 2010;30(9):1625-1636. doi:10.1038/jcbfm.2010.29
15. Galea I. The blood-brain barrier in systemic infection and inflammation. Cell Mol Immunol. 2021;18(11): 2489-2501. doi:10.1038/s41423-021-00757-x
16. Harrison FE, Bowman GL, Polidori MC. Ascorbic acid and the brain: rationale for the use against cognitive decline. Nutrients. 2014;6(4):1752-1781. doi:10.3390/nu6041752
17. Ferrada L, Barahona MJ, Salazar K, Vandenabeele P, Nualart F. Vitamin C controls neuronal necroptosis under oxidative stress. Redox Biol. 2020;29:101408. doi:10.1016/j.redox.2019.101408
18. Burns JJ. Missing step in man, monkey and guinea pig required for the biosynthesis of L-ascorbic acid. Nature. 1957;180(4585):553. doi:10.1038/180553a0
19. Consoli DC, Jesse JJ, Klimo KR, et al. A cecal slurry mouse model of sepsis leads to acute consumption of vitamin C in the brain. Nutrients. 2020;12(4):911. doi:10.3390/nu12040911
20. Armour J, Tyml K, Lidington D, Wilson JX. Ascorbate prevents microvascular dysfunction in the skeletal muscle of the septic rat. J Appl Physiol (1985). 2001;90(3):795-803. doi:10.1152/jappl.2001.90.3.795
21. Carr AC, Rosengrave PC, Bayer S, Chambers S, Mehrtens J, Shaw GM. Hypovitaminosis C and vitamin C deficiency in critically ill patients despite recommended enteral and parenteral intakes. Crit Care. 2017;21(1):300. doi:10.1186/s13054-017-1891-y
22. Kaufmann I, Briegel J, Schliephake F, et al. Stress doses of hydrocortisone in septic shock: beneficial effects on opsonization-dependent neutrophil functions. Intensive Care Med. 2008;34(2):344-349. doi:10.1007/s00134- 007-0868-8
23. Fowler AA III, Truwit JD, Hite RD, et al. Effect of vitamin C infusion on organ failure and biomarkers of inflammation and vascular injury in patients with sepsis and severe acute respiratory failure: the CITRIS-ALI randomized clinical trial. JAMA. 2019;322(13):1261-1270. doi:10.1001/jama.2019.11825
24. Barabutis N, Khangoora V, Marik PE, Catravas JD. Hydrocortisone and ascorbic acid synergistically prevent and repair lipopolysaccharide-induced pulmonary endothelial barrier dysfunction. Chest. 2017;152(5):954-962. doi: 10.1016/j.chest.2017.07.014
25. Parker WH, Rhea EM, Qu ZC, Hecker MR, May JM. Intracellular ascorbate tightens the endothelial permeability barrier through Epac1 and the tubulin cytoskeleton. Am J Physiol Cell Physiol. 2016;311(4):C652-C662. doi:10.1152/ ajpcell.00076.2016
26. Kuck JL, Bastarache JA, Shaver CM, et al. Ascorbic acid attenuates endothelial permeability triggered by cell- free hemoglobin. Biochem Biophys Res Commun. 2018;495(1):433-437. doi:10.1016/j.bbrc.2017.11.058
27. Plevin D, Galletly C. The neuropsychiatric effects of vitamin C deficiency: a systematic review. BMC Psychiatry. 2020;20(1):315. doi:10.1186/s12888-020-02730-w
28. Marik PE, Khangoora V, Rivera R, Hooper MH, Catravas J. Hydrocortisone, vitamin C, and thiamine for the treatment of severe sepsis and septic shock: a retrospective before-after study. Chest. 2017;151(6):1229-1238. doi: 10.1016/j.chest.2016.11.036
29. de Andrade JAA, Gayer CRM, Nogueira NPA, et al. The effect of thiamine deficiency on inflammation, oxidative stress and cellular migration in an experimental model of sepsis. J Inflamm (Lond). 2014;11:11. doi:10.1186/1476- 9255-11-11
30. Gibson GE, Hirsch JA, Fonzetti P, Jordan BD, Cirio RT, Elder J. Vitamin B1 (thiamine) and dementia. AnnNY Acad Sci. 2016;1367(1):21-30. doi:10.1111/nyas.13031
31. Fujii T, Luethi N, Young PJ, et al; VITAMINS Trial Investigators. Effect of vitamin C, hydrocortisone, and thiamine vs hydrocortisone alone on time alive and free of vasopressor support among patients with septic shock: the VITAMINS randomized clinical trial. JAMA. 2020;323(5):423-431. doi:10.1001/jama.2019.22176
32. Moskowitz A, Huang DT, Hou PC, et al; ACTS Clinical Trial Investigators. Effect of ascorbic acid, corticosteroids, and thiamine on organ injury in septic shock: the ACTS randomized clinical trial. JAMA. 2020;324(7):642-650. doi:10.1001/jama.2020.11946
33. Hwang SY, Ryoo SM, Park JE, et al; Korean Shock Society (KoSS). Combination therapy of vitamin C and thiamine for septic shock: a multi-centre, double-blinded randomized, controlled study. Intensive Care Med. 2020;46(11):2015-2025. doi:10.1007/s00134-020-06191-3
34. Lamontagne F, Masse MH, Menard J, et al; LOVIT Investigators and the Canadian Critical Care Trials Group. Intravenous vitamin C in adults with sepsis in the intensive care unit. N Engl J Med. 2022;386(25):2387-2398. doi: 10.1056/NEJMoa2200644
35. Hager DN, Hooper MH, Bernard GR, et al. The Vitamin C, Thiamine and Steroids in Sepsis (VICTAS) protocol: a prospective, multi-center, double-blind, adaptive sample size, randomized, placebo-controlled, clinical trial. Trials. 2019;20(1):197. doi:10.1186/s13063-019-3254-2
36. Sevransky JE, Rothman RE, Hager DN, et al; VICTAS Investigators. Effect of vitamin C, thiamine, and hydrocortisone on ventilator- and vasopressor-free days in patients with sepsis: the VICTAS randomized clinical trial. JAMA. 2021;325(8):742-750. doi:10.1001/jama.2020.24505
37. Lindsell CJ, McGlothlin A, Nwosu S, et al. Update to the Vitamin C, Thiamine and Steroids in Sepsis (VICTAS) protocol: statistical analysis plan for a prospective, multicenter, double-blind, adaptive sample size, randomized, placebo-controlled, clinical trial. Trials. 2019;20(1):670. doi:10.1186/s13063-019-3775-8
38. Christie JD, Biester RC, Taichman DB, et al. Formation and validation of a telephone battery to assess cognitive function in acute respiratory distress syndrome survivors. J Crit Care. 2006;21(2):125-132. doi:10.1016/j.jcrc.2005. 11.004
39. Marcantonio ER, Michaels M, Resnick NM. Diagnosing delirium by telephone. J Gen Intern Med. 1998;13(9): 621-623. doi:10.1046/j.1525-1497.1998.00185.x
40. Brandt J, Spencer M, Folstein MF. The telephone interview for cognitive status. Neuropsychiatry Neuropsychol Behav Neurol. 1988;1(2):111-117.
41. Hansen M, Andersen TE, Armour C, Elklit A, Palic S, Mackrill T. PTSD-8: a short PTSD inventory. Clin Pract Epidemiol Ment Health. 2010;6:101-108. doi:10.2174/1745017901006010101
42. Cella D, Riley W, Stone A, et al; PROMIS Cooperative Group. The Patient-Reported Outcomes Measurement Information System (PROMIS) developed and tested its first wave of adult self-reported health outcome item banks: 2005-2008. J Clin Epidemiol. 2010;63(11):1179-1194. doi:10.1016/j.jclinepi.2010.04.011
43. Choi SW, Schalet B, Cook KF, Cella D. Establishing a common metric for depressive symptoms: linking the BDI-II, CES-D, and PHQ-9 to PROMIS depression. Psychol Assess. 2014;26(2):513-527. doi:10.1037/a0035768
44. Katz S, Ford AB, Moskowitz RW, Jackson BA, Jaffe MW. Studies of illness in the aged—the index of ADL:
a standardized measure of biological and psychosocial function. JAMA. 1963;185:914-919. doi:10.1001/jama.1963. 03060120024016
45. Pfeffer RI, Kurosaki TT, Harrah CH Jr, Chance JM, Filos S. Measurement of functional activities in older adults in the community. J Gerontol. 1982;37(3):323-329. doi:10.1093/geronj/37.3.323
46. Rabin R, de Charro F. EQ-5D: a measure of health status from the EuroQol Group. Ann Med. 2001;33(5): 337-343. doi:10.3109/07853890109002087
47. Pandharipande PP, Girard TD, Jackson JC, et al; BRAIN-ICU Study Investigators. Long-term cognitive impairment after critical illness. N Engl J Med. 2013;369(14):1306-1316. doi:10.1056/NEJMoa1301372
48. Sukantarat KT, Burgess PW, Williamson RC, Brett SJ. Prolonged cognitive dysfunction in survivors of critical illness. Anaesthesia. 2005;60(9):847-853. doi:10.1111/j.1365-2044.2005.04148.x
49. Hopkins RO, Weaver LK, Pope D, Orme JF, Bigler ED, Larson-Lohr V. Neuropsychological sequelae and impaired health status in survivors of severe acute respiratory distress syndrome. Am J Respir Crit Care Med. 1999; 160(1):50-56. doi:10.1164/ajrccm.160.1.9708059
50. Jackson JC, Pandharipande PP, Girard TD, et al; Bringing to Light the Risk Factors and Incidence of Neuropsychological Dysfunction in ICU Survivors (BRAIN-ICU) Study Investigators. Depression, post-traumatic stress disorder, and functional disability in survivors of critical illness in the BRAIN-ICU study: a longitudinal cohort study. Lancet Respir Med. 2014;2(5):369-379. doi:10.1016/S2213-2600(14)70051-7
51. Rawal G, Yadav S, Kumar R. Post-intensive care syndrome: an overview. J Transl Int Med. 2017;5(2):90-92. doi: 10.1515/jtim-2016-0016
52. Marra A, Pandharipande PP, Girard TD, et al. Co-occurrence of post-intensive care syndrome problems among 406 survivors of critical illness. Crit Care Med. 2018;46(9):1393-1401. doi:10.1097/CCM.0000000000003218
53. Jutte JE, Erb CT, Jackson JC. Physical, cognitive, and psychological disability following critical illness: what is the risk? Semin Respir Crit Care Med. 2015;36(6):943-958. doi:10.1055/s-0035-1566002
54. Diliberto EJ Jr, Allen PL. Mechanism of dopamine-beta-hydroxylation: semidehydroascorbate as the enzyme oxidation product of ascorbate. J Biol Chem. 1981;256(7):3385-3393. doi:10.1016/S0021-9258(19)69620-1
55. Harrison FE, May JM. Vitamin C function in the brain: vital role of the ascorbate transporter SVCT2. Free Radic Biol Med. 2009;46(6):719-730. doi:10.1016/j.freeradbiomed.2008.12.018
56. McCall JG, Al-Hasani R, Siuda ER, et al. CRH engagement of the locus coeruleus noradrenergic system mediates stress-induced anxiety. Neuron. 2015;87(3):605-620. doi:10.1016/j.neuron.2015.07.002
57. Daviu N, Bruchas MR, Moghaddam B, Sandi C, Beyeler A. Neurobiological links between stress and anxiety.
Neurobiol Stress. 2019;11:100191. doi:10.1016/j.ynstr.2019.100191
58. Roozendaal B, Castello NA, Vedana G, Barsegyan A, McGaugh JL. Noradrenergic activation of the basolateral amygdala modulates consolidation of object recognition memory. Neurobiol Learn Mem. 2008;90(3):576-579. doi:10.1016/j.nlm.2008.06.010
59. Sara SJ, Bouret S. Orienting and reorienting: the locus coeruleus mediates cognition through arousal. Neuron. 2012;76(1):130-141. doi:10.1016/j.neuron.2012.09.011
60. Fitzgerald PJ, Giustino TF, Seemann JR, Maren S. Noradrenergic blockade stabilizes prefrontal activity and enables fear extinction under stress. Proc Natl Acad SciUS A. 2015;112(28):E3729-E3737. doi:10.1073/pnas. 1500682112
61. Giustino TF, Maren S. Noradrenergic modulation of fear conditioning and extinction. Front Behav Neurosci. 2018;12:43. doi:10.3389/fnbeh.2018.00043
62. Gazarini L, Stern CA, Takahashi RN, Bertoglio LJ. Interactions of noradrenergic, glucocorticoid and endocannabinoid systems intensify and generalize fear memory traces. Neuroscience. 2022;497:118-133. doi:10. 1016/j.neuroscience.2021.09.012
63. Kessler RC, Chiu WT, Demler O, Merikangas KR, Walters EE. Prevalence, severity, and comorbidity of 12-month DSM-IV disorders in the National Comorbidity Survey Replication. Arch Gen Psychiatry. 2005;62(6):617-627. doi: 10.1001/archpsyc.62.6.617
64. Goldstein RB, Smith SM, Chou SP, et al. The epidemiology of DSM-5 posttraumatic stress disorder in the United States: results from the National Epidemiologic Survey on Alcohol and Related Conditions-III. Soc Psychiatry Psychiatr Epidemiol. 2016;51(8):1137-1148. doi:10.1007/s00127-016-1208-5
65. Mikkelsen ME, Still M, Anderson BJ, et al. Society of Critical Care Medicine’s International Consensus Conference on Prediction and Identification of Long-Term Impairments After Critical Illness. Crit Care Med. 2020; 48(11):1670-1679. doi:10.1097/CCM.0000000000004586
66. Widmann CN, Heneka MT. Long-term cerebral consequences of sepsis. Lancet Neurol. 2014;13(6):630-636. doi:10.1016/S1474-4422(14)70017-1
67. Hoogland IC, Houbolt C, van Westerloo DJ, van Gool WA, van de Beek D. Systemic inflammation and microglial activation: systematic review of animal experiments. J Neuroinflammation. 2015;12:114. doi:10.1186/s12974-015- 0332-6
68. Witcher KG, Eiferman DS, Godbout JP. Priming the inflammatory pump of the CNS after traumatic brain injury.
Trends Neurosci. 2015;38(10):609-620. doi:10.1016/j.tins.2015.08.002
69. Muscat SM, Barrientos RM. The perfect cytokine storm: how peripheral immune challenges impact brain plasticity & memory function in aging. Brain Plast. 2021;7(1):47-60. doi:10.3233/BPL-210127
70. Huang M, Parker AM, Bienvenu OJ, et al; National Institutes of Health, National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome Network. Psychiatric symptoms in acute respiratory distress syndrome survivors: a 1-year national multicenter study. Crit Care Med. 2016;44(5):954-965. doi:10.1097/CCM. 0000000000001621
71. Pandharipande P, Shintani A, Peterson J, et al. Lorazepam is an independent risk factor for transitioning to delirium in intensive care unit patients. Anesthesiology. 2006;104(1):21-26. doi:10.1097/00000542- 200601000-00005
72. Bourenne J, Hraiech S, Roch A, Gainnier M, Papazian L, Forel JM. Sedation and neuromuscular blocking agents in acute respiratory distress syndrome. Ann Transl Med. 2017;5(14):291. doi:10.21037/atm.2017.07.19
73. Devlin JW, Skrobik Y, Gélinas C, et al. Clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Crit Care Med. 2018;46 (9):e825-e873. doi:10.1097/CCM.0000000000003299
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 03.04.2024
[ACTIVE_FROM] => 03.04.2024
[SHOW_COUNTER] => 569
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829714
[VALUE] => Сепсис, инфузия витаминов, витамин С, тиамин, гидрокортизон
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Сепсис, инфузия витаминов, витамин С, тиамин, гидрокортизон
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829716
[VALUE] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса Вторичный анализ использования витамина С, тиамина и стероидов в рандомизированном клиническом исследовании сепсиса
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса Вторичный анализ использования витамина С, тиамина и стероидов в рандомизированном клиническом исследовании сепсиса
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829715
[VALUE] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса Вторичный анализ использования витамина С, тиамина и стероидов в рандомизированном клиническом исследовании сепсиса
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса Вторичный анализ использования витамина С, тиамина и стероидов в рандомизированном клиническом исследовании сепсиса
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830400
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829722
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829718
[1] => 829719
[2] => 829720
[3] => 829721
)
[VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => sepsis
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => sepsis
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830400
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829722
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829718
[1] => 829719
[2] => 829720
[3] => 829721
)
[VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => sepsis
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => sepsis
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Критические состояния
[2] => Интенсивная терапия
[3] => Сепсис
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 13.08.2025 01:26:24
[~TIMESTAMP_X] => 13.08.2025 01:26:24
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[FULLTEXT_INDEX] => N
[~FULLTEXT_INDEX] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса
[BROWSER_TITLE] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса Вторичный анализ использования витамина С, тиамина и стероидов в рандомизированном клиническом исследовании сепсиса
[KEYWORDS] => Сепсис, инфузия витаминов, витамин С, тиамин, гидрокортизон
[DESCRIPTION] => Связь инфузии витамина С, тиамина и гидрокортизона с долгосрочными когнитивными, психологическими и функциональными результатами у выживших после сепсиса Вторичный анализ использования витамина С, тиамина и стероидов в рандомизированном клиническом исследовании сепсиса
)
)



