Стратегия интенсивной терапии, основанная на уровне лактата
Kattan et al. Ann. Intensive Care (2020)
Стратегия интенсивной терапии, основанная на уровне лактата, может ассоциироваться с высокой летальностью у пациентов с септическим шоком при нормальном времени ре-заполнения капилляра: «a post hoc» анализ исследования ANDROMEDA-SHOCK
Перевод оригинальной статьи «A lactate-targeted resuscitation strategy may be associated with higher mortality in patients with septic shock and normal capillary refill time: a post hoc analysis of the ANDROMEDA-SHOCK study»
Keywords: Septic shock, Sepsis, Early resuscitation, Capillary refill time, Lactate, Peripheral perfusion
Ключевые слова: септический шок, сепсис, ранняя реанимация, время резаполнения капилляра, лактат, периферическая перфузия
Введение
ANDROMEDA-SHOCK - рандомизированное контролируемое исследование, в котором сравнивались две стратегии интенсивной терапии/реанимации раннего септического шока, одна из которых основывалась на таком показателе, как время ре-заполнения капилляра (англ. capillary refill time ил CRT), а вторая - на целевом показателе уровня лактата (англ.actate-targeted или LT) [1] и в этом исследовании была показана меньшая летальность, существенно меньшая органная дисфункция и интенсивность терапии в группе CRT. Последующий Байесовский анализ поддержал выводы о лучшей выживаемости пациентов в группе CRT [2].
Показатель CRT зависит от потока, поэтому улучшение системного кровотока достаточно быстро приводит к нормализации CRT [3-6]. Более того, оценка CRT происходит намного быстрее, и реанимация может быть остановлена намного раньше по сравнению реанимацией, где конечной точкой служит уровень лактата из-за медленной кинетики его восстановления до нормальных цифр даже у выживших от сепсиса пациентов [7,8]. CRT - первая перфузионная переменная, достигающая значительного улучшения ко второму часу интенсивной терапии [3], а у 70% пациентов, переживших септический шок, время ре-заполнения капилляра приходило к нормальному значению через два часа [7]. Нормальное значение CRT ко второму часу интенсивной инфузионной терапии ассоциируется со снижением на 15% риска наступления летального исхода [3, 4]. Более того, в одном из пилотных исследований показано, что проведение инфузионной терапии у пациентов с септическим шоком может быть безопасно остановлено в случае нормализации периферической перфузии, а нормализация периферической перфузии, в свою очередь, ассоциируется с меньшими проявлениями органной дисфункции [9]. В исследовании ANDROMEDA-SHOCK в течении 8 часов периода вмешательства показатель CRT оценивался каждые тридцать минут, а лактат - каждые два часа [10, 11]. Соответственно, с учетом опубликованных данных, первой временной точкой, в которой можно было сравнить влияние проводимой интенсивной терапии между двумя исследуемыми группами, было окончание 2-ого часа с начала проведения интенсивной терапии/реанимации (T2). Таким образом, состояние CRT к концу второго часа интенсивной терапии может иметь прогностическую ценность в контексте принятия решения о дальнейшем проведении интенсивной терапии [3, 4]. Более низкая летальность и более низкая выраженность органной дисфункции, наблюдаемая в группе CRT, заслуживает дальнейших исследований. В конце концов, нормальное время ре-заполнения капилляра у пациентов с септическим шоком и с гипрелактатемией сигнализирует нам о наличии источника лактата, не связанного с гипоперфузией тканей, и проведение потенциально опасной интенсивной инфузионной терапии здесь, вероятно, не требуется [5]. На самом деле, существует несколько альтернативных объяснений персистирующей гиперлактатемии [12]. Гиперлактатемия, связанная со стрессом, запускается с помощью нейрогуморального ответа на сепсис, что порождает продукцию лактата в скелетной мускулатуре посредством стимуляции бета-2 эпинефрина. Такой лактат играет роль метаболического шаттла, снабжая энергией другие органы, и данный процесс может быть заблокирован специфическими вмешательствами [13, 14]. С другой стороны, Tapia et al. [15] показали тяжелые нарушения клиренса эндогенного лактата сразу же после индукции тяжелого эндотоксического шока в эксперименте, и авторы полагают, что потенциальным объяснением такого результата может быть блокада метаболизма.
Мы выдвинули следующую гипотезу - пациенты с септическим шоком по критериям Сепсис-3 и с нормальным CRT, рандомизированные на время «0» в группу «Лактат», имели большую летальность по сравнению с пациентами, которые были рандомизированны сразу в группу CRT. Нашей основной целью было установить, а действительно ли пациенты с септическим шоком у которых было нормальное время ре-заполнения капилляра через два часа (Т2) показали более высокую летальность и более тяжелые проявления органной дисфункции, будучи рандомизированны в группу «Лактат» (время «0»), чем те, которые были рандомизированны сразу же в группу CRT. Следующей целью нашего исследования стала попытка установить, действительно ли пациенты с септическим шоком и с нормальным CRT на второй час получили больше терапевтических вмешательств после рандомизации их в группу «Лактат» в начале лечения (время «0») по сравнению с пациентами, которые сразу были рандомизированны в группу CRT.
Для достижения наших целей мы провели post hoc анализ базы данных исследования the ANDROMEDA-SHOCK
Материалы и методы
Сбор и обработка данных
Пациенты исследования ANDROMEDA-SHOCK соответствовали критериям SEPSIS-3 [16] (наличие инфекции или подозрение на нее, опасная для жизни дисфункция органов, необходимость использования вазопрессоров для поддержания среднего артериального давления (САД) > 65 мм Hg и уровень лактата > 2 ммоль/л). Показатель CRT в качестве критерия включения не применялся.
Подробный протокол исследования ANDROMEDA-SHOCK, включая пошаговые интервенционные процедуры, смотри [10, 11]. Вкратце, в течение 8-часового периода вмешательства целью для группы CRT была нормализация CRT (нормальное значение ≤ 3 с по оценке с помощью стандартизированной методики), а целью для группы «Лактат» была нормализация уровня лактата (нормальные значения ≤ 2 ммоль/л) или снижение уровня лактата на 20% каждые 2 часа. После начальной инфузии жидкости и норэпинефрина (NE) для достижения и поддержания среднего артериального давления (САД) ≥ 65 мм Hg. Лечение в обеих группах проводилось с использованием идентичного последовательного протоколированного подхода.
В обеих группах первым шагом была оценка чувствительности к жидкости, с целью чего пациентам, что показывали реакцию, переливали 500 мл кристаллоидов каждые 30 минут до тех пор, пока цель не была достигнута или не был достигнут предел безопасности (по уровню центрального венозного давления), или пациент перестал показывать реакцию на жидкость, в зависимости от того, что наступит раньше. В качестве второго шага был проведен вазопрессорный тест у пациентов с хронической гипертонией, у которых целевые показатели путем инфузионной терапии достигнуты не были. Режим дозирования NE временно увеличивался до достижения САД от 80 до 85 мм Hg c последующей повторной оценкой CRT или лактата через один или два часа соответственно. Если цель была достигнута, этот уровень САД сохранялся на протяжении всего периода вмешательства. Третий шаг заключался в использовании низких доз добутамина или милринона. Пациенты снова были повторно оценены через один или два часа в группах CRT и «Лактат», соответственно. Если конечные точки по-прежнему не были достигнуты или возникла проблема безопасности, введение инотропов прекращалось.
Мы изучили взаимосвязь между состоянием CRT через 2 часа после рандомизации (T2) с клиническими характеристиками, вмешательствами и исходами, включая сюда летальность через 28 дней, для всей когорты и в соответствии с распределением исследуемых групп. Затем мы проанализировали влияние рандомизации в обеих группах на пациентов с нормальным СРТ на Т2. Наконец, мы провели такой же анализ в группе достижения целевых показателей лактата (нормализация или снижение на 20%) на T2.
Основным результатом этого исследования была общая летальность через 28 дней. Вторичные исходы включали в себя: оценку степени тяжести по APACHE II [17], индекс Чарлсона [18] и ежедневную последовательную оценку степени органной недостаточности (SOFA) [19]. Тяжесть гемодинамических нарушений и интенсивность терапии оценивались путем изменения показателей перфузии с течением времени, включая лактат, CRT, сатурацию кислорода в центральной вене (ScvO2), центральный венозно-артериальный градиент pCO2 (P (cv-a) CO2) или dCO2), режим дозирования вазопрессоров, общее количество болюсов жидкости и баланс жидкости.
Поскольку терапевтические вмешательства проводились в соответствии с заранее определенным протоколом, который включал поэтапный подход к устранению гипоперфузии, мы разработали комбинированный результат, который включал в себя каждый шаг интенсивной терапии, управляемый протоколом, и предпринятый лечащими врачами. Каждые 500 мл болюсного введения жидкости, вазопрессорный тест или тест с использованием инотропа считали реанимационным действием с числовым значением 1, а общее количество действий для каждого пациента суммировалось. Наконец, были зарегистрированы и другие клинически значимые исходы, такие как необходимость в искусственной вентиляции легких (ИВЛ), заместительной почечной терапии (ЗПТ), а также в интенсивной терапии и продолжительности пребывания в больнице.
Для переменных с ненормальным распределением использовались непараметрические тесты. Соответственно, описательная статистика представлена в виде медианы [межквартильный интервал 25–75] или процентов (%). При необходимости использовались тесты Mann – Whitney U, Kruskal – Wallis, Chisquare и Fisher’s.
Данные анализировались с помощью программных продуктов Minitab v17 (Minitab Inc, State College, PA) и Graphpad Prism (Graphpad Softwares, La Joya, CA). Значение р < 0.05 считалось статистически значимым.
Результаты
Исследование ANDROMEDA-SHOCK включило в себя 424 пациента, чьи основные характеристики показаны в дополнительном файле 1. Как ранее сообщалось [1], только у 378 пациентов был доступны данные на время Т2, так что именно эта подгруппа была использована для анализа.
Влияние нормального CRT на Т2
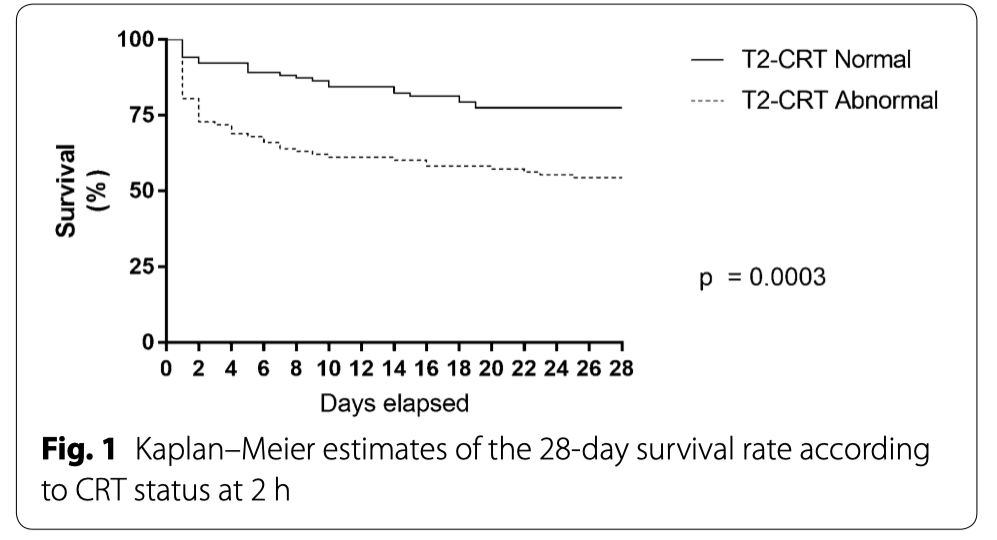
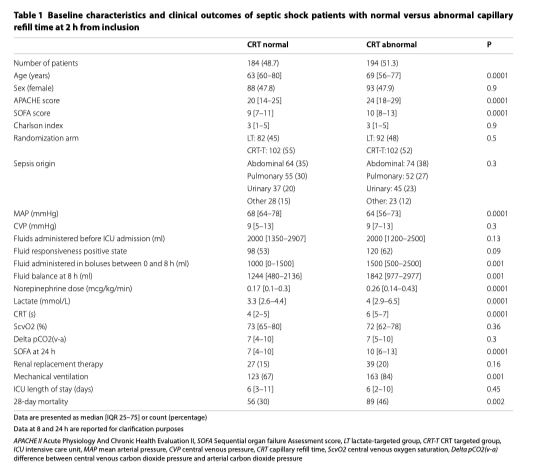
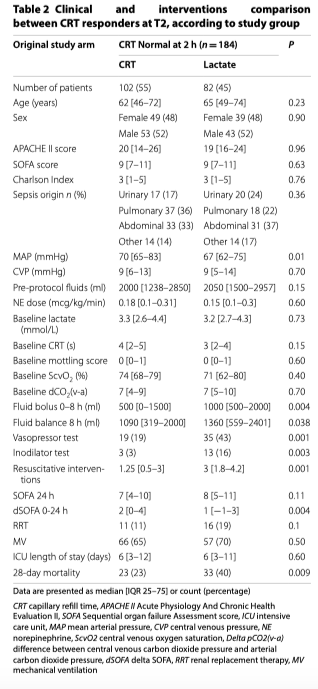
После двух часов интенсивной терапии в ОИТ по протоколу у 49% пациентов (184/378) наблюдалась нормальное СРТ (Таблица 1). Независимо от рандомизации по группам, эти пациенты получали меньше реанимационных вмешательств, имели более низкий балл SOFA через 24 часа (7 [4–10] против 10 [6–13], p = 0,0001) и показывали более низкую летальность через 28 дней (30% против 46%, p = 0,002) по сравнению с пациентами с патологическим CRT на T2 (Таблица 1, Рис. 1, дополнительный файл 2).
Нормальное CRT и группа рандомизации на T2
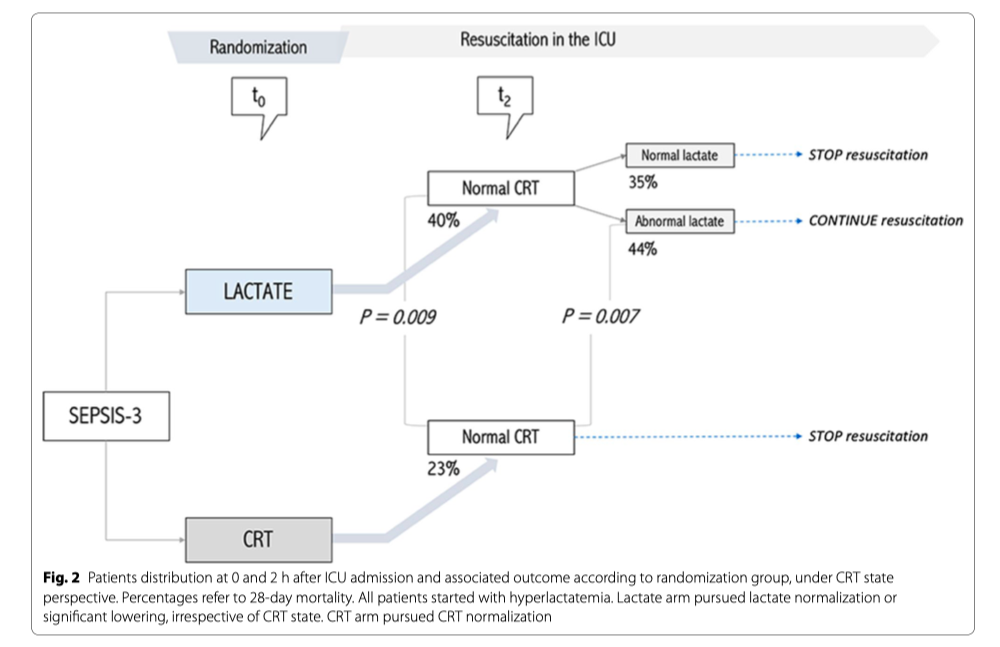
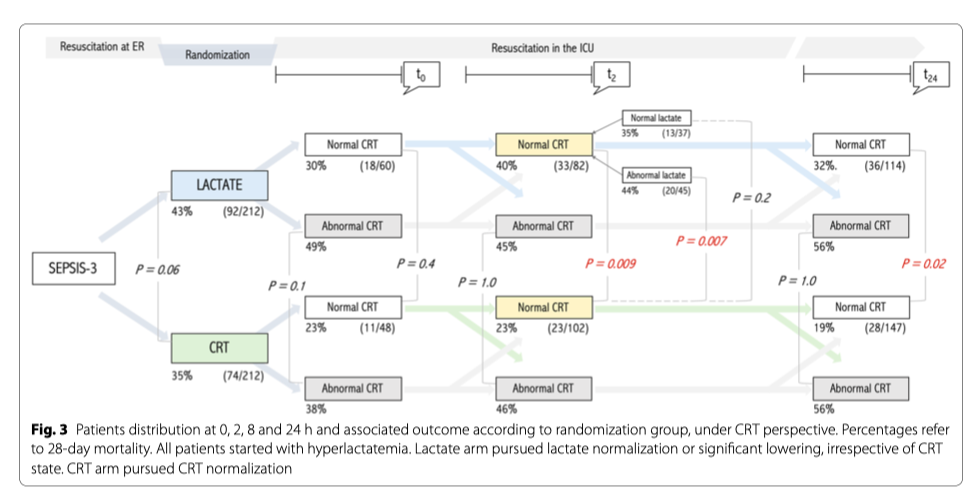
Пациенты с нормальным CRT на T2, рандомизированные в группу «Лактат», показывали значительно более высокую летальность, чем пациенты с нормальным CRT в T2, которые были рандомизированны в группу CRT (40 против 23%, p = 0,009) (Таблица 2, Рисунки 2 и 3). В конце периода вмешательства эти пациенты также получили значительно больше поддерживающей терапии и реанимационных вмешательств (жидкость, вазопрессоры и инотропы) (Таблица 2). Эта разница была в основном обусловлена пациентами в группе «Лактат», которые не достигли конечной точки реанимации на T2 (44 против 23%, p = 0,007) (Таблица 2, Рисунки 2 и 3) и такое «недостижение» сохранялась в конце протокола на T8 (35 против 34%, p = 0,055) и на T24 (32 против 19%, p = 0,02) (Рис. 3). На рисунке 3 также показаны различия между пациентами, у которых сохранялась аномальное CRT в разные моменты времени, в соответствии с группой рандомизации. Более того, многомерная логистическая регрессия пациентов с нормальным CRT на T2, включая клинически значимые переменные на исходном уровне (APACHE-II, исходный лактат, жидкости, введенные с момента экстренной госпитализации до T2, источник инфекции и группа рандомизации), подтвердила, что отнесение к группе «Лактат» служило статистически значимой детерминантой 28-дневной летальности (OR 3,3; 95% CI [1,5-7,1]); р = 0,003). В той же регрессии APACHE II (OR 1,1; 95% CI [1,0–1,2]); p <0,001) и наличие источника инфекции в легких (OR 4,2; 95% CI [1,7-10,6]; p = 0,002) значительно повлияли на летальность через 28 дней.
Достижение конечной точки по уровню лактата и группа рандомизации на T2
Пациенты с нормальным или снижением уровня лактата на 20% на время T2 не показали статистически значимой разницы в летальности (25 против 33%, p = 0,4), по шкале APACHE-II (20 [17–27] против 19 [16–25], p = 0,6) и по количеству реанимационных вмешательств (2 [1–4] против 2 [1–4], p = 0,85) при сравнении с группой рандомизации.
Дискуссия
Наши результаты позволяют предполагать, что у пациентов с септическим шоком, которые показывают нормальную периферическую перфузию сразу после начала интенсивной терапии по протоколу, клинические исходы могут быть более худшими тогда, когда стратегия интенсивной терапии основана на показателе уровня лактата. Фактически, в нашем анализе эти пациенты показали более высокую летальность, получая при этом больше вмешательств, таких, как введение жидкости и/или вазоактивных агентов при том, что снижение лактата у них было медленным, а высокий уровень лактата не был связан с гипоперфузией [12, 21]. Ранее проведенное исследование показало, что пациенты с септическим шоком и гиперлактатемией, но без признаков гипоперфузии, о чем свидетельствуют такие показатели, как ScvO2, dCO2 или ЗПТ, показывают более низкую летальность и требуют меньше интервенционных терапевтических вмешательств [5]. И в этом смысле, наши результаты подтверждают безопасность отказа от дальнейшей агрессивной интенсивной терапии у пациентов с септическим шоком, у которых нормальное время ре-заполнение капилляра. Более того, использование уровня лактата в качестве терапевтической мишени у пациентов с септическим шоком без гипоперфузии представляется подходом, несущим вред, поскольку такая практика связана с намного большим количеством вмешательств и более высокой летальностью.
Пациентам с септическим шоком, поступающим с гипотензией и гипоперфузией, в общем и целом, интенсивная терапия проводится введением жидкости, а управляется по целенаправленным конечным точкам [20, 22]. Однако после острого периода часть пациентов показывает чистый положительный баланс жидкости [22, 23] даже несмотря на то, что практика введения жидкости сильно различается во всем мире [24]. А мы знаем, что перегрузка жидкостью является клинической проблемой [25]. Важность перегрузки жидкостью и водного баланса нельзя недооценивать, поскольку это ключевой фактор, определяющий более высокую заболеваемость и смертность у тяжелобольных пациентов [22, 25–30]. Согласно нашим результатам, представляется, что после начала проведения интенсивной терапии по протоколу именно правильно выбранная цель определяет интенсивность дальнейших вмешательств. Действительно, пациенты с нормальным CRT через 2 часа, но рандомизированные в группу, где целью интенсивной терапии служил уровень лактата, получали больше жидкости.
В дополнение к выше сказанному, эти пациенты подвергались, в соответствии с протоколом, большему количеству интервенций, что увеличивало расходы на проведение чрезмерной интенсивной терапии [27, 30–32]. Следует отметить, что пациенты, рандомизированные в группу «Лактат», у которых восстанавливалось нормальное CRT, для достижения целевого уровня лактата также подвергались большему количеству тестов на вазопрессоры и инотропы. В самом деле, хотя пациенты, ранее страдавшие артериальной гипертензией, и могут извлечь выгоду из более высоких целевых значений САД, обязательное увеличение дозы NE для достижения этого уровня было связано с повышенным риском развития аритмий [33]. Ранее уже было высказано предположение о негативном влиянии избыточной катехоламиновой поддержки при септическом шоке [34], так что отказ от этих препаратов в группе CRT, возможно, способствовал улучшению результатов. Но данное предположение следует прояснить в ходе дальнейших исследований.
Здесь следует сделать предостережение, так как в момент T0 пациенты с нормальным CRT, рандомизированные в группу «Лактат», не показали, в общем и целом, значительно более высокой летальности по сравнению с пациентами, рандомизированными в группу CRT. Это может противоречить концепции более высокой летальности, связанной с избытком реанимационных вмешательств, поскольку пациенты группы СРТ с нормальным временем ре-заполнения капилляра должны получать меньше вмешательств, чем пациенты с нормальным временем ре-заполнения капилляра, рандомизированные в группу с высоким содержанием лактата. Кроме того, летальность пациентов с нормальным CRT в группе «Лактат» увеличилась с 30 до 40% в период с T0 до T2, вероятно, из-за пациентов с аномальным CRT на исходном уровне, но который впоследствии нормализовался. Согласно протоколу, эти пациенты должны были получить некоторые реанимационные мероприятия, даже если они были рандомизированны в группу CRT вместо группы «Лактат». Этот результат может опровергнуть постулат о том, что некоторое превышение летальности было связано с превышением вмешательств в группе «Лактат», однако, согласно протоколу, они должны были быть одинаковыми в обеих группах. Другие факторы могли сыграть свою роль, так как рандомизация на исходном уровне не была стратифицирована по значениям CRT, а тязесть состояния пациентов в подгруппе с нормальным CRT в группе «Лактат» могла быть более тяжелой, чем у пациентов в подгруппе с нормальным CRT в группе CRT.
Данное исследование представляет новые идеи в попытке понять различия в исходах, показанные в оригинальном исследовании ANDROMEDA-SHOCK [1] и после последующего Байесовского ре-анализа этих же данных [2]. Нормализация периферической перфузии может быть лучшей конечной точкой при проведении интенсивной терапии, чем лактат. Конечно, поскольку пациенты не различались по демографии, ранее введенной жидкости, источнику сепсиса, тяжести сопутствующей патологии, то именно рандомизация в группу, где лечение основывалось на уровне лактата, могла определить более высокий риск смерти.
На данном этапе клиническое значение наших результатов может быть выражено только в виде гипотезы. Во-первых, выбранная цель интенсивной терапии может сильно повлиять на интенсивность введения жидкостей или вазоактивных агентов, поскольку потенциальные цели, такие как CRT или лактат, не эквивалентны. Во-вторых, наши результаты подтверждают выводы предыдущего пилотного исследования относительно безопасности отказа от интенсивной инфузионной терапии у пациентов с септическим шоком с нормальным временем ре-заполнения капилляра [9] даже тогда, когда у них еще сохраняется гиперлактатемия. В-третьих, наши данные также подтверждают концепцию «гиперлактатемии, не связанной с гипоперфузией", как предполагали предыдущие обсервационные исследования [5, 7].
«Гиперлактатемия, не связанная с гипоперфузией» может представлять собой менее тяжелую дисфункцию кровообращения, вызванную сепсисом, и которую можно лечить более консервативно. В-четвертых, использование лактата в качестве цели интенсивной терапии без учета состояния периферической перфузии может быть потенциально вредным. Как следствие, следует с осторожностью и индивидуально рассматривать дальнейшие шаги при реанимации пациентов с септическим шоком, у которых CRT уже нормализовалось. Наконец, при планировании будущих рандомизированных контролируемых исследований, а какая же цель интенсивной терапии септического шока окажется наилучшей, следует учитывать потенциальные клинические фенотипы, полученные на основе мультимодального мониторинга перфузии, что также заслуживает дальнейшего исследования.
Ограничения
Это исследование имеет некоторые ограничения. Во-первых, это апостериорный анализ оригинального исследования с другим дизайном. Следовательно, предположение о том, что пациенты с септическим шоком с нормальным временем ре-заполнения капилляра могут иметь более высокую летальность тогда, когда все стремление направлено на нормализацию уровня лактата в качестве цели, является только гипотезой. Во-вторых, существует противоречие между экспертами, часть из которых не признают CRT как идеального маркера перфузии [35], поскольку применение его требует обучения персонала и стандартизации. CRT может быть трудно применить в некоторых клинических сценариях, таких как переохлаждение, хирургическое вмешательство, васкулит и т.д. Недавно были предложены новые методы дальнейшей стандартизации измерения CRT [36, 37], но для начала их следует протестировать в соответствующих сценариях.
Выводы
Пациенты с септическим шоком и с нормальным временем ре-заполнения капилляра на исходном уровне получали больше терапевтических вмешательств и имели больше нарушений функции органов при отнесении их к группе, где стратегия лечения основывалась на показателе уровня лактата. Это могло быть связано с худшими результатами.
References
1. Hernandez G, Ospina‑Tascon G, Petri Damiani L, Estenssoro E, Dubin A, Hurtado J, et al. Effect of a resuscitation strategy targeting peripheral perfusion status vs serum lactate levels on 28‑day mortality among patients with septic shock The ANDROMEDA‑SHOCK Randomized Clinical Trial. JAMA. 2019;321:654–64.
2. Zampieri FG, Damiani LP, Bakker J, Ospina‑Tascón GA, Castro R, Cavalcanti AB, et al. Effect of a resuscitation strategy targeting peripheral perfusion status vs serum lactate levels on 28‑day mortality among patients with septic shock: a bayesian reanalysis of the ANDROMEDA‑SHOCK Trial. Am J Respir Crit Care Med. 2019. https://doi.org/10.1164/rccm.201905‑0968OC.
3. Hernandez G, Pedreros C, Veas E, Bruhn A, Romero C, Rovegno M, et al. Evolution of peripheral vs metabolic perfusion parameters during septic shock resuscitation a clinical‑physiologic study. J Crit Care. 2012;27:283–8.
4. Lara B, Enberg L, Ortega M, Leon P, Kripper C, Aguilera P, et al. Capillary refill time during fluid resuscitation in patients with sepsis‑related hyperlactatemia at the emergency department is related to mortality. PLoS ONE. 2017;12:e0188548.
5. Alegría L, Vera M, Dreyse J, Castro R, Carpio D, Henriquez C, et al. A hypoperfusion context may aid to interpret hyperlactatemia in sepsis‑3 septic shock patients: a proof‑of‑concept study. Ann Intensive Care. 2017;7:29.
6. JacquetLagrèze M, Bouhamri N, Portran P, Schweizer R, Baudin F, Lilot M, et al. Capillary refill time variation induced by passive leg raising predicts capillary refill time response to volume expansion. Crit Care. 2019;23:281.
7. Hernandez G, Luengo C, Bruhn A, Kattan E, Friedman G, OspinaTascon G, et al. When to stop septic shock resuscitation: clues from a dynamic perfusion monitoring. Ann Intensive Care. 2014;4:30.
8. Bakker J, de Backer D, Hernandez G. Lactate‑guided resuscitation saves lives: we are not sure. Intensive Care Med. 2016;42:472–4.
9. van Genderen ME, Engels N, van der Valk RJP, Lima A, Klijn E, Bakker J, et al. Early peripheral perfusion–guided fluid therapy in patients with septic shock. Am J Respir Crit Care Med. 2015;191:477–80.
10. Hernández G, Cavalcanti AB, Ospina‑Tascón G, Zampieri FG, Dubin A, Hurtado FJ, et al. Early goal‑directed therapy using a physiological holistic view: the ANDROMEDA‑SHOCK—a randomized controlled trial. Ann Intensive Care. 2018;8:52.
11. Hernández G, Cavalcanti AB, Ospina‑Tascón G, Dubin A, Hurtado FJ, Damiani LP, et al. Statistical analysis plan for early goal‑directed therapy using a physiological holistic view–The andromeda‑shock: a randomized controlled trial. Rev Bras Ter Intensiva. 2018;30:253–63.
12. Hernandez G, Bellomo R, Bakker J. The ten pitfalls of lactate clearance in sepsis. Intensive Care Med. 2019;45:82–5.
13. Levy B, Perez P, Gibot S, Gerard A. Increased muscle‑to‑serum lactate gradient predicts progression towards septic shock in septic patients. Intensive Care Med. 2010;36:1703–9.
14. Levy B, Gibot S, Franck P, Cravoisy A, Bollaert PE. Relation between muscle Na + K + ATPase activity and raised lactate concentrations in septic shock: a prospective study. Lancet. 2005;365:871–5.
15. Tapia P, Soto D, Bruhn A, Alegría L, Jarufe N, Luengo C, et al. Impairment of exogenous lactate clearance in experimental hyperdynamic septic shock is not related to total liver hypoperfusion. Crit Care. 2015;19:188.
16. Singer M, Deustchman C, Warren Seymour C, Shankar‑Hari M, Annane D, Bauer M, et al. The third international consensus definitions for sepsis and septic shock (Sepsis‑3). JAMA. 2016;315:801–10.
17. Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II: a severity of disease classification system. Crit Care Med. 1985;13:818–29.
18. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis England. 1987;40:373–83.
19. Vincent JL, Moreno R, Takala J, Willatts S, De Mendonça A, Bruining H, et al. The SOFA (Sepsis‑related Organ Failure Assessment) score to describe organ dysfunction/failure. Intensive Care Med. 1996;22:707–10.
20. Rhodes A, Evans L, Alhazzani W, Levy M, Antonelli M, Ferrer R, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Crit Care Med. 2017;45:486–552.
21. Hernandez G, Bruhn A, Castro R, Regueira T. The holistic view on perfusion monitoring in septic shock. Curr Opin Crit Care. 2012;18:280–6.
22. Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, et al. Earlygoal directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med. 2001;345:1368–77.
23. Li D, Wang X, Liu D. Association between elevated central venous pressure and outcomes in critically ill patients. Ann Intensive Care. 2017;7:83.
24. Cecconi M, Hofer C, Teboul JL, Pettila V, Wilkman E, Molnar Z, et al. Fluid challenges in intensive care: the FENICE study: a global inception cohort study. Intensive Care Med. 2015;41:1529–37.
25. Malbrain MLNG, Chiumello D, Pelosi P, Bihari D, Innes R, Ranieri VM, et al. Incidence and prognosis of intraabdominal hypertension in a mixed population of critically ill patients: a multiple‑center epidemiological study. Crit Care Med. 2005;33:315–22.
26. Wiedemann HP, Wheeler AP, Bernard GR, Thompson BT, Hayden D, DeBoisblanc B, et al. Comparison of two fluid‑management strategies in acute lung injury. N Engl J Med. 2006;354:2564–75.
27. Bagshaw SM, Brophy PD, Cruz D, Ronco C. Fluid balance as a biomarker : impact of fluid overload on outcome in critically ill patients with acute kidney injury. Crit Care. 2008;12:1–3.
28. Cecconi M, De Backer D, Antonelli M, Beale R, Bakker J, Hofer C, et al. Consensus on circulatory shock and hemodynamic monitoring Task force of the European Society of Intensive Care Medicine. Intensive Care Med. 2014;40:1795–815.
29. Dres M, Teboul JL, Anguel N, Guerin L, Richard C, Monnet X. Passive leg raising performed before a spontaneous breathing trial predicts weaning‑induced cardiac dysfunction. Intensive Care Med. 2015;41:487–94.
30. Payen D, de Pont AC, Sakr Y, Spies C, Reinhart K, Vincent JL. A positive fluid balance is associated with a worse outcome in patients with acute renal failure. Crit Care. 2008;12:1–7.
31. Malbrain MLNG, Van Regenmortel N, Saugel B, De Tavernier B, Van Gaal PJ, Joannes‑Boyau O, et al. Principles of fluid management and stewardship in septic shock: it is time to consider the four D’s and the four phases of fluid therapy. Ann Intensive Care. 2018;8:66.
32. Boyd JH, Forbes J, Nakada TA, Walley KR, Russell JA, Frcp C, et al. Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med. 2011;39:259–65.
Kattan et al. Ann. Intensive Care (2020)