Сравнение культуро-негативного и культуро-позитивного сепсиса и септического шока: систематический обзор и мета-анализ
Li et al. Crit Care (2021) 25:167
Исследование
Сравнение культуро-негативного и культуро-позитивного сепсиса и септического шока: систематический обзор и мета-анализ
Перевод оригинальной статьи «Comparison of culture-negative and culture-positive sepsis or septic shock: a systematic review and meta-analysis»
Авторы: Yuting Li, Jianxing Guo, Hongmei Yang, Hongxiang Li, Yangyang Shen and Dong Zhang
Department of Intensive Care Unit, The First Hospital of Jilin University, Changchun 130021, Jilin, China
Keywords: Culture-negative, Culture-positive, Sepsis, Septic shock, Clinical outcomes, Meta-analysis
Ключевые слова: культуро-негативный, культуро-позитивный, сепсис, септический шок, клинические исходы, мета-анализ
Ключевые сообщения
• Ни положительные, ни отрицательные микробиологические посевы никаким образом не ассоциируются с летальностью от сепсиса и септического шока;
• Пациенты с положительным (позитивным) посевом крови проводят в отделении интенсивной терапии (ОИТ) столько же времени, сколько и пациенты с отрицательным (негативным) микробиологическим посевом, при этом у них также на различаются ни потребности в искусственной вентиляции легких, ни потребности в почечно-заместительной терапии;
• Длительность госпитализации и длительность искусственной (механической) вентиляции легких у пациентов с положительными микробиологическими посевами были больше, чем у пациентов с сепсисом, но с отрицательными микробиологическими посевами.
Введение
Частота случаев развития сепсиса и септического шока во всем мире за последнее десятилетие неудержимо растет, а заболеваемость и летальность остается непомерно высокой [1]. Даже сейчас летальность от сепсиса и септического шока колеблется между 20 и 40% в зависимости от тяжести заболевания [2, 3]. За последние два десятилетия неоднократно обновлялись клинические руководства и протоколы лечения сепсиса. В них настоятельно рекомендуется проведение эмпирической терапии антибиотиками широкого спектра действия, но при этом несколько исследований показывают, что своевременная и эффективная терапия антибиотиками снижает летальность у пациентов с сепсисом [4].
Согласно Третьим международным согласительным определениям сепсиса и септического шока (Сепсис-3), сепсис определяется как угрожающая жизни органная дисфункция, вызванная дисрегуляцией иммунного ответа (ответа хозяина) на инфекцию. Пациент с септическим шоком может быть выявлен благодаря следующей клинической конструкции - персиститирующая гипотензия, требующая введения вазопрессоров для поддержания среднего артериального давления на уровне ≥ 65 мм Hg, и уровень сывороточного лактата, равный 2 ммоль/л или более, и все это несмотря на адекватную жидкостную реанимацию (интенсивную инфузионную терапию) [5]. Развитие сепсиса происходит благодаря широкому спектру источников и микроорганизмов, и только часть микроорганизмов может быть выделена. Сепсис/септический шок без документального подтверждения инфекции называют культуро-негативным сепсисом/септическим шоком. Диагностика культуро-негативного сепсиса основывается на клинической картине септического шока в отсутствие положительных культур в посевах крови, мокроты, физиологических жидкостях или в других тканях. В предыдущих исследованиях было показано, что пропорция пациентов, у которых диагностируется культуро-негативный сепсис, составляет 28–49% от всех пациентов с сепсисом [6 - 8]. Культуро-негативный сепсис создает особые проблемы и для клиницистов, и для микробиологов, и ставит под сомнение обоснованность сегодняшних определений сепсиса [9].
Как сепсис, так и септический шок, обладают высочайшей гетерогенностью, поражая пациентов с разнообразными клиническими состояниями. Существует вероятность того, что случаи сепсиса/септического шока с отрицательными результатами микробиологических посевов могут фундаментально отличаться от сепсиса/септического шока с положительными микробиологическими посевами в отношении патофизиологии, эпидемиологии и ответа на проводимую терапию [10]. Летальность и другие клинические исходы у пациентов с культуро-негативным сепсисом и у пациентов с культуро-положительным сепсисом документируются непоследовательно и являются весьма противоречивыми. Исходя из этого, мы провели мета-анализ результатов опубликованных когортных исследований для сравнения клинических исходов при культуро-негативном и культуро-позитивным сепсисом/септическим шоком.
Методы
Этот систематический обзор и мета-анализ проведен в согласии с руководящими принципами «the Preferred Reporting Items for Systematic Reviews and Meta-Analyses» (PRISMA) [11]. Этического одобрения не требовалось, так как это есть обзор уже опубликованной литературы.
Стратегия поиска
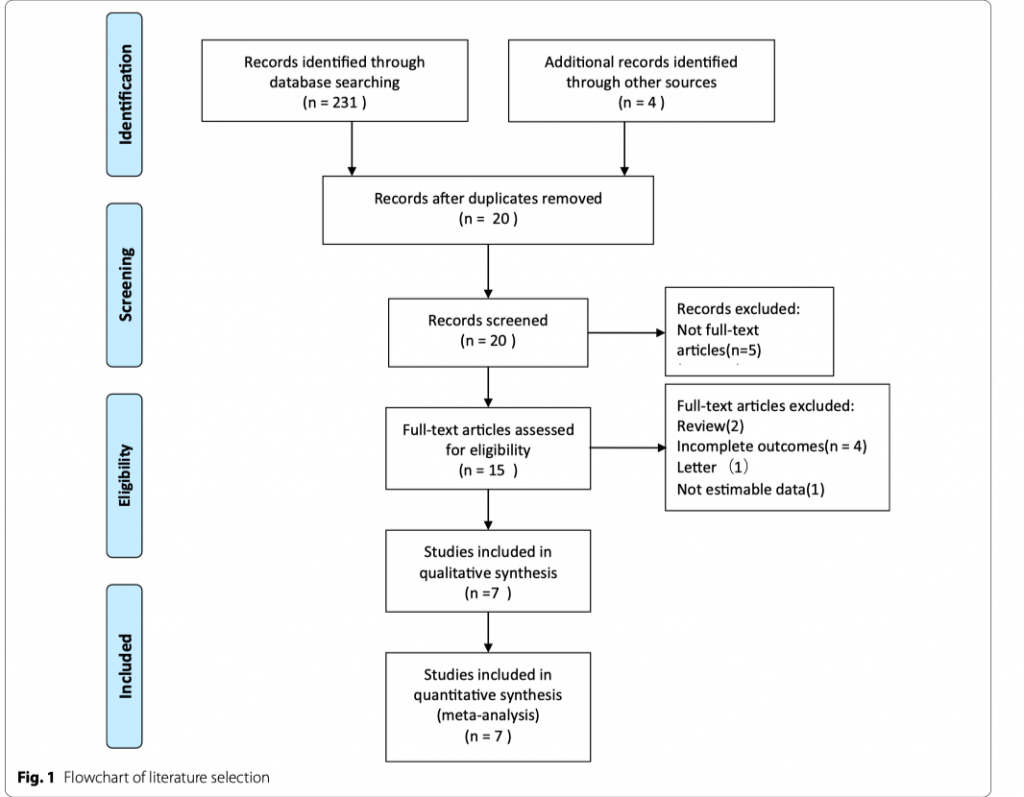
Мы проводили поиск в базах данных исследований PubMed, Cochrane и Embase до 01 января 2021 года по следующим терминам: культуро-положительный, культуро-отрицательный, сепсис, тяжелый сепсис, септический шок. Поиск был немного скорректирован в соответствии с различающимися требованиями баз данных. Также были рассмотрены личные файлы авторов и списки литературы соответствующих обзорных статей. Блок-схема стратегий поиска представлена на Рисунке 1.
Типы показателей клинических исходов
Первичным клиническим исходом была летальность от всех причин, летальность от всех причин, включая сюда госпитальную летальность, 28 дневная летальность, 90 дневная летальность. Вторичными исходами стали длительность нахождения пациента в ОИТ, длительность нахождения пациента в госпитале, потребность в искусственной (механической) вентиляции легких, длительность механической вентиляции и потребность в проведении почечно-заместительной терапии. Средневзвешенные значения были рассчитаны исходя из количества пациентов в исследовании.
Выбор исследования
Критериями включения были следующие: 1) проспективное или ретроспективное когортное исследование; 2) пациенты с сепсисом или септическим шоком; 3) все авторы сообщили наш первичный исход - летальность от всех причин; 4) ясное сравнение культуро-негативных пациентов с культуро-позитивными с клинически релевантными вторичными исходами. Мы исключили исследования с неподдающимися оценкам данными [12] и без ясного и понятного сравнения исходов. Также мы исключили письма и обзоры.
Оценка качества
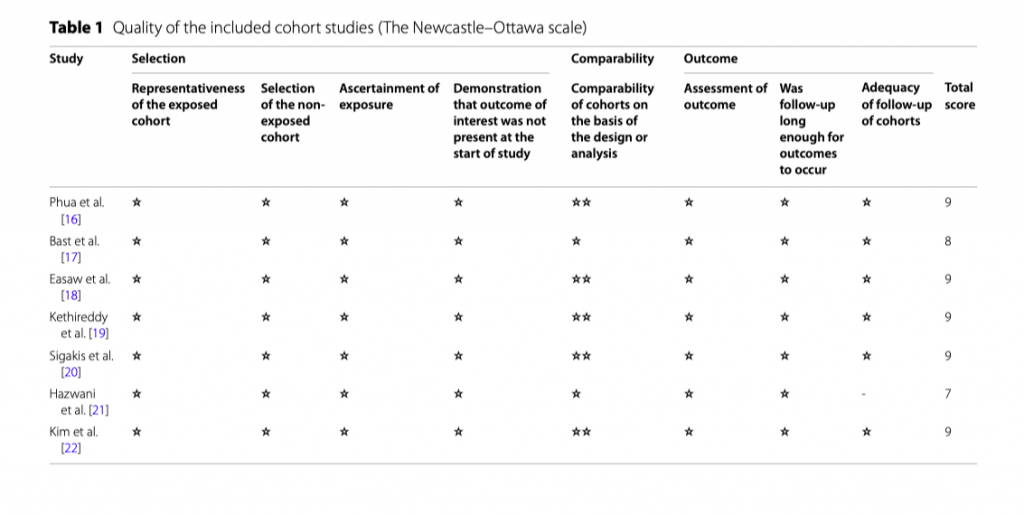
Два рецензента (YL и JG) независимо друг от друга провели оценку качества. Качество исследований оценивали с помощью шкалы Newcastle-Ottawa (NOS) для когортных исследований [13]. NOS присваивает максимум 9 баллов в зависимости от качества отбора, сопоставимости и результатов когортных исследуемых популяций. Качество исследования было определено как плохое (0–3), удовлетворительное (4–6) или хорошее (7–9). Качество включенных когортных исследований представлено в Таблице 1.
Статистический анализ
Статистический анализ проводился с помощью Review Manager Version 5.3 (RevMan, The Cochrane Collaboration, Oxford, UK). Отношение шансов (Odds ratio или OR) с 95% доверительными интервалами (confidence intervals или CIs) были рассчитаны для дихотомических переменных. Для непрерывных переменных, как эффективный результат, были использованы средняя разница (mean difference или MD) и 95% CI. Для объединения исследований со значимой гетерогенностью, что определялось с помощью критерия Chi-квадрат (P < 0.10) и индекса несогласованности (I 2 ≥ 50%), использовалась модель со случайным эффектом [14]. Некоторые из выбранных непрерывных переменных были представлены медианой (межквартильный размах или interquartile range). Мы рассчитали их среднее значение и стандартное отклонение в соответствии с размером выборки с помощью калькулятора [15], а затем выполнили мета-анализ. Значение P <0,05 было установлено как порог статистической значимости.
Результаты
Характеристика исследований
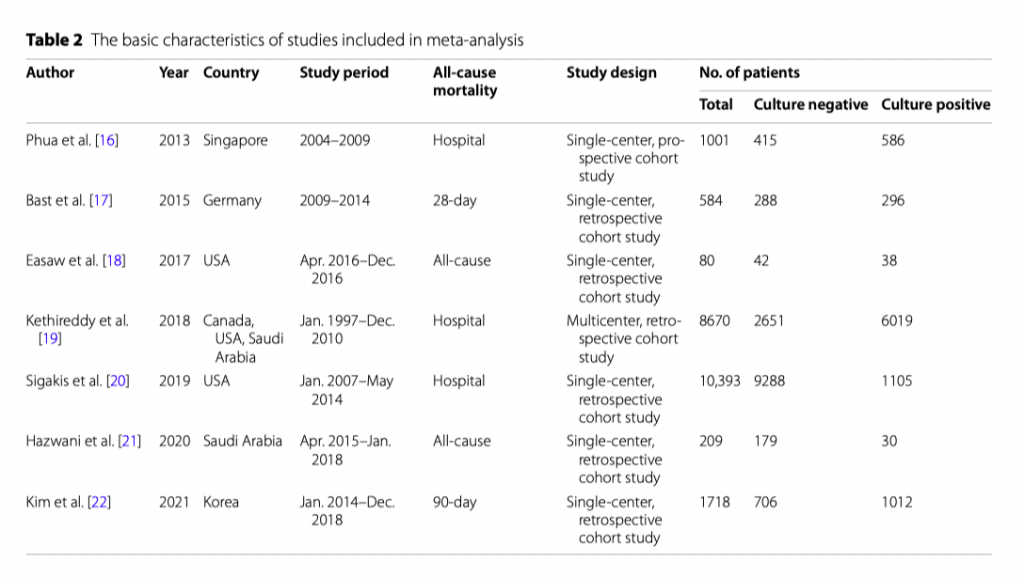
Стратегия поиска помогла в идентификации 235 исследований, данные были получены из семи когортных исследований, включивших в себя 22 655 пациентов (Таблица 2) [16 - 22]. Характеристики включенных исследований представлены в Таблице 2. Все эти исследования были опубликованы в период между 2013 и 2021 гг. Среди этих исследований два были проведены в США, по одному исследованию было проведено в Сингапуре, Германии, Саудовской Аравии, Корее и еще одно исследование было проведено в Канаде, США и Саудовской Аравии. Шесть исследований были одно-центровыми и одно - многоцентровым. Пропорция пациентов с положительными посевами (культуро-позитивные) с сепсисом и септическим шоком составила около 40.1% (9086/22655). Средний процент эпизодов сепсиса с отрицательными посевами (культуро-негативный) составил 49,3%, но были большие различия между исследованиями - от минимума в 30.6% до максимума в 89.4% с межквартильным размахом в 41.1–52.5%.
Первичный исход
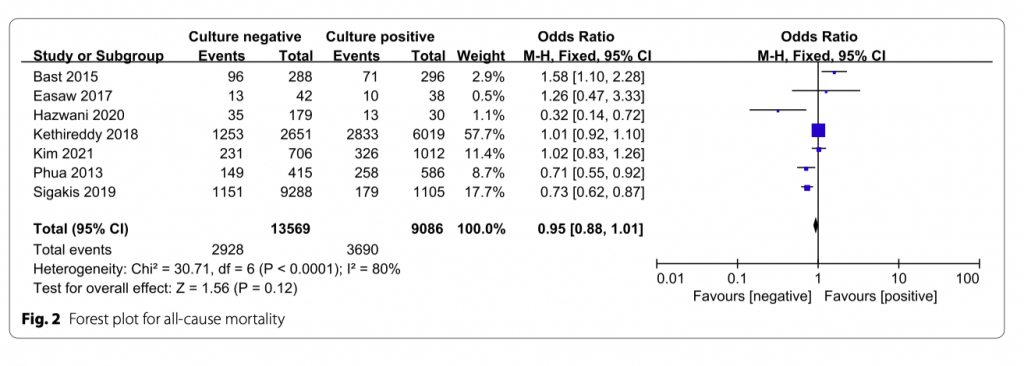
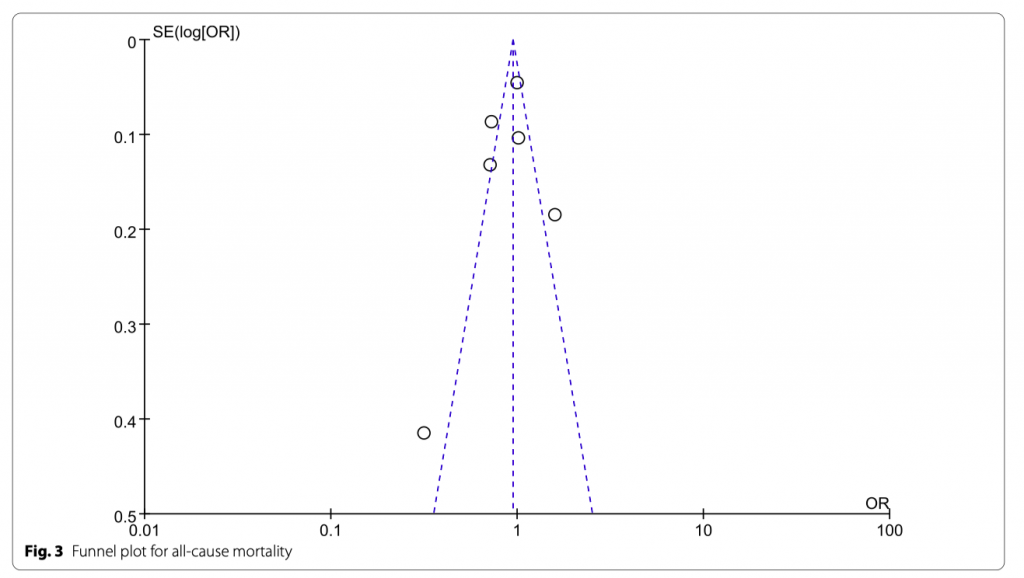
Всего было включено семь исследований, количество пациентов 22 655, летальность от всех причин около 29,2% (2928/13569 в культуро-негативной группе и 3690/9086 в культуро-позитивной группе. Не было существенной разницы между группами в летальности от всех причин (OR = 0.95; 95% CI, 0.88 to 1.01; P = 0.12; Chi- 2 = 30.71; I 2 = 80%) (Рис. 2). Оценка систематической ошибки публикации представлена на Рисунке 3.
Вторичные исходы
Длительность нахождения пациента в ОИТ
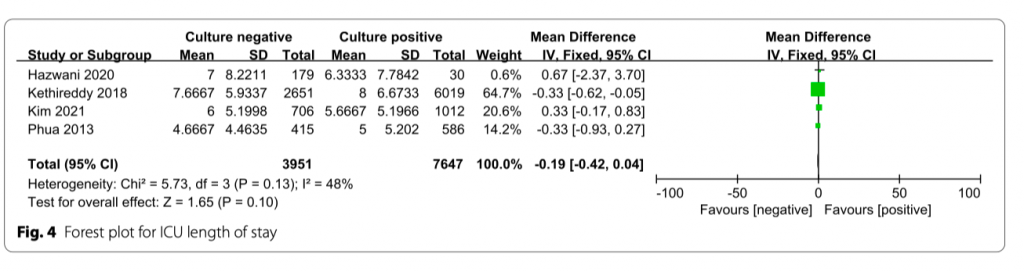
В четырех исследованиях проводилась оценка длительности нахождения пациента в ОИТ (дни). Не было значительной статистической разницы в длительности нахождения пациента в ОИТ между двумя группами (MD = − 0.19;95% CI, − 0.42 to 0.04; P = 0.10; Chi = 5.73; I 2 = 48%) (Рис. 4).
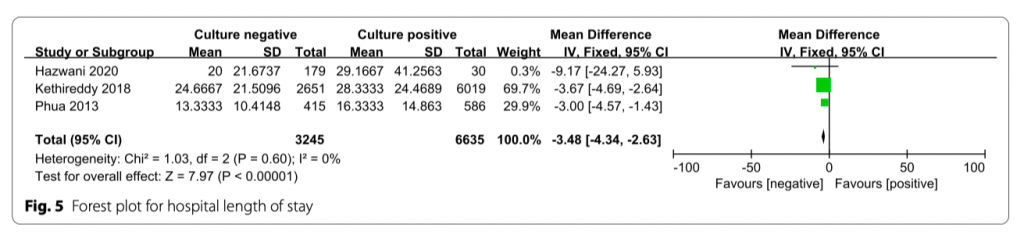
Длительность нахождения пациента в госпитале
В трех исследованиях анализировался данный показатель (дни). Длительность нахождения пациента в госпитале у пациентов в культуро-позитивной группе была выше по сравнению с пациентами из культуро-негативной группы (MD = − 3.48;95% CI, − 4.34 to − 2.63; P < 0.00001; Chi- 2 = 1.03; I 2 = 0%) (Рис. 5).
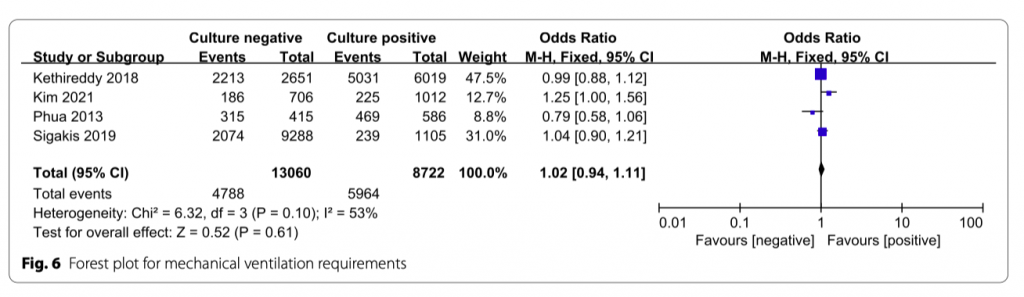
Потребность в механической вентиляции
Данный показатель изучался в четырех исследованиях. Не было значимой статистической разницы между двумя группами (OR = 1.02; 95% CI, 0.94 to 1.11; P = 0.61; Chi 2 = 6.32; I 2 = 53%) (Рис. 6).
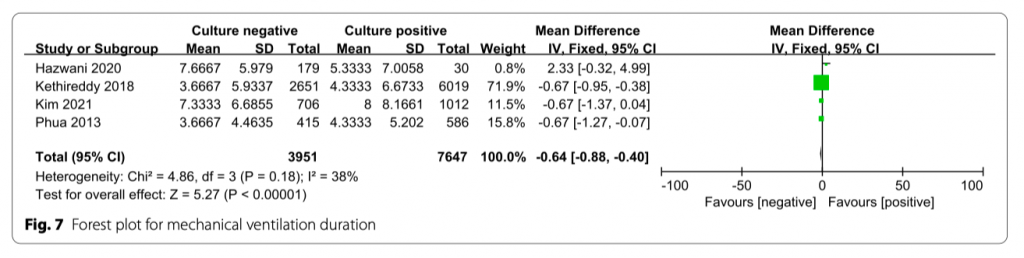
Длительность механической вентиляции
В четырех из включенных исследований оценивалась длительность механической вентиляции (дни). Механическая вентиляция легких в культурно-позитивной группе была более длительной по сравнению с культуро-негативной группой (MD = − 0.64;95% CI, − 0.88 to − 0.4; P < 0.00001;Chi2 2 = 4.86; I = 38%) (Рис. 7).
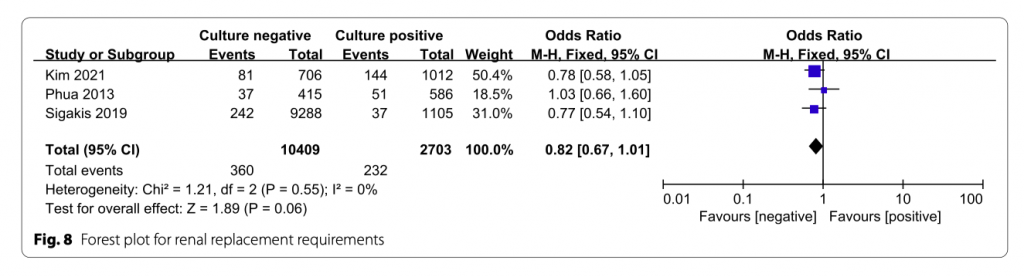
Потребность в проведении почечно-заместительной терапии
В трех исследованиях оценивалась потребность в почечно-заместительной терапии. Не было выявлено значительной статистической разницы между двумя группами (OR = 0.82; 95% CI, 0.67 to 1.01; P = 0.06; Chi- 2 = 1.21; I 2 = 0%) (Рис. 8).
Обсуждение
Данный систематический обзор и мета-анализ семи исследований, включивший в себя 22 655 пациентов, сравнил клинические исходы при культуро-положительном сепсисе и септическом шоке с клиническими исходами при культуро-отрицательном сепсисе и септическом шоке. Мы нашли, что только у 40.1% пациентов с сепсисом и септическим шоком микробиологические посевы с положительным результатом. Вне зависимости от того, были ли микробиологические посевы положительными или отрицательными, летальность не различалась. Летальность от всех причин составила 29.2% и мы не нашли какой либо существенной статистической разницы между культуро-негативной группой и культуро-положительной группой. Клиническая картина, лабораторные показатели и жизненно важные показатели имели только одно четкое различие между пациентами и это различие было в результатах микробиологических посевов - отрицательный или положительный, и независимо от результата посева все пациенты в обеих группах имели в основном схожие факторы риска смерти [20].
Какие причины могут лежать в основе того, что при наличии клинического синдрома сепсиса и септического шока микробиологические посевы остаются отрицательными (стерильными)? Во-первых, пациенты могли получать эмпирическую терапию антибиотиками до развития сепсиса или септического шока [23]. Наиболее важным предиктором отрицательного микробиологического посева является рецепт на антибиотики, выписанный за предыдущие 48 часов [20]. Во-вторых, могла вырасти пропорция пациентов с сепсисом и септическим шоком, который вызывается атипичными патогенами, такими как грибы и вирусы [24, 25]. Микробиологически зарегистрированные инфекции могут включать в себя некультивируемые патогены, такие как вирусы, паразиты и, возможно, грибы. Следует признать, что вирусные/грибковые/паразитарные инфекции могут не сильно отличаться от инфекций с положительным посевом с точки зрения эффективной точной и адекватной противомикробной терапии. Стандартными микробиологическими методами по разным причинам часто не удается идентифицировать микроорганизм, что может быть связанно либо с техническими проблемами, либо с самим микроорганизмом. Многообещающие результаты показали исследования, в которых для идентификации патогенов использовался метод полимеразной цепной реакции (ПЦР), которая способна обнаружить дезоксирибонуклеиновую кислоту (ДНК) патогена в крови пациентов с сепсисом, что помогает в идентификации потенциально значимых грибов и бактерий, не определяемых в крови с помощью микробиологического метода [26, 27].
Помимо летальности от всех причин, как культуро-негативные, так и культуро-положительные пациенты с сепсисом и септическим шоком, в нашем мета-анализе показали практически одинаковые результаты в отношении длительности госпитализации в ОИТ, в потребности в механической вентиляции и в почечно-заместительной терапии. При этом, такие показатели, как длительность самой госпитализации и длительность механической вентиляции у пациентов в культуро-положительной группе оказались выше, чем в культуро-отрицательной группе. Такие различия, скорее всего связаны с различиями в популяции пациентов, в пропорции источников инфекции и с резистентностью бактерий к антибиотикам. Более длительная механическая вентиляция легких и более длительная госпитализация, что наблюдается в культуро-положительной группе пациентов, может быть объяснена более частым возникновением факторов риска, таких как пожилой и старческий возраст, большая пропорция злокачественных новообразований и более высокая оценка по шкале APACHE II (Acute Physiology and Chronic Health Evaluation II Score). К тому же гетерогенность свойственна не только синдрому сепсиса/септического шока. Источник инфекции также может различаться от пациента к пациенту, что вносит свою лепту в различия между группами. Предыдущие ретроспективные исследования показали, что культуро-позитивные пациенты с внутрибрюшной и легочной инфекциями ассоциируются с неблагоприятным клиническим исходом [31, 32]. И наоборот, инфекции мочевыводящего тракта ассоциируются с лучшими клиническими исходами [33]. Мы полагаем, что отрицательный результат микробиологического посева может отражать восприимчивость к назначенным изначально схемам антибиотиков, что и приводит к менее тяжелому течению заболевания. Кроме того, клинические исходы могут быть связаны не только с источниками инфекции, но и с лечением сепсиса и септического шока.
Каково значение результатов нашего мета-анализа? Клиническое руководство «the Surviving Sepsis Campaign» рекомендует раннее введение антибиотиков широкого спектра действия в целях улучшения клинических исходов как при культуро-негативном, так и при культуро-позитивном сепсисе [34]. Каждый час задержки в проведении антибактериальной терапии после проявления клинической картины септического шока приводит к увеличению летальности [35]. Во многих национальных клинических рекомендациях ранняя антимикробная терапия у культуро-негативных пациентов с сепсисом считается уместной. Для того, чтобы выяснить являются ли микробиологические посевы истинно-положительными или истинно-отрицательными, следует более широко использовать мультиплексную полимеразную цепную реакцию [36, 37]. Если и в этом случае патогены не обнаружены, следует применять интервенционные лабораторные тесты для эскалации антибактериальной терапии, ее продолжения, сужения спектра антибиотиков или для прекращения антибактериальной терапии, но все это следует делать в сочетании с поиском других, возможно, не инфекционных причин [38].
В нашем мета-анализе есть несколько ограничений. Первое - очень небольшое количество включенных в него когортных исследований. Видимо, необходимо провести в будущем большое клиническое исследование для подтверждения наших результатов. Второе - достаточно много вторичных исходов, таких как длительность госпитализации в ОИТ, длительность госпитализации, потребности в механической вентиляции, длительность механической вентиляции и потребность в проведении почечно-заместительной терапии, не включены во все исследования, которые изучались в нашем мета-анализе. Третье - среди всех включенных в мета-анализ исследованиях наблюдалась значительная неоднородность. Очень неоднородная популяция была включена как ретроспективные, так и в проспективные когортные исследования. Четвертое - предполагаемый источник инфекции может быть значительным модификатором эффекта - некоторые источники инфекции имеют высокую частоту положительных микробиологических посевов, но низкую летальность (особенно инфекции мочевыводящего тракта), а другие - низкую частоту положительных микробиологических посевов, но высокую летальность (особенно легочные инфекции). Тем не менее, не все из включенных в наш мета-анализ исследований специализировались на предполагаемом источнике инфекции. Совсем в небольшом количестве исследований представлено сравнение культуро-негативного и культуро-позитивного сепсиса со стратификацией по источнику инфекции. Пятое - в связи с ограничениями включенных в мета-анализ исследований, наш первичный исход в виде летальности от всех причин включал в себя госпитальную летальность, 28 дневную летальность и 90 дневную летальность. Как мы все понимаем, эти все показатели не взаимозаменяемы и зависят от летальности в каждом конкретном исследовании, включенным в мета-анализ. Тем самым, к нашим результатам следует относится с осторожностью.
Выводы
В нашем мета-анализе мы нашли, что только у 40.1% пациентов с сепсисом и септическим шоком имеются положительные микробиологические посевы. Но был ли микробиологический посев положительным или отрицательным никак не влияет на летальность от сепсиса или септического шока. Ранее применение антибактериальной терапии целесообразно и у пациентов с отрицательными микробиологическими посевами, если эта рекомендация содержится в национальных клинических рекомендациях по лечению сепсиса и септического шока. К тому же, у пациентов с положительными микробиологическими посевами длительность нахождения в ОИТ, потребности в проведении искусственной вентиляции легких и в почечно-заместительной терапии такие же, как и пациентов с отрицательными результатами микробиологических посевов. Но наши результаты показывают, что у пациентов с положительными микробиологическими посевами несколько выше как длительность нахождения в госпитале, так и длительность искусственной вентиляции легких, по сравнению с пациентами, у которых результаты микробиологических посевов отрицательные. Для того, чтобы подтвердить наши результаты, требуется проведение большого клинического исследования.
Список литературы
1. Rudd KE, Johnson SC, Agesa KM, Shackelford KA, Tsoi D, Kievlan DR, Colombara DV, Ikuta KS, Kissoon N, Finfer S, et al. Global, regional, and national sepsis incidence and mortality, 1990–2017: analysis for the Global Burden of Disease Study. Lancet. 2020;395(10219):200–11.
2. Leligdowicz A, Dodek PM, Norena M, Wong H, Kumar A, Kumar A, Cooperative Antimicrobial Therapy of Septic Shock Database Research Group. Association between source of infection and hospital mortality in patients who have septic shock. Am J Respir Crit Care Med. 2014;189(10):1204–13.
3. Liu V, Escobar GJ, Greene JD, Soule J, Whippy A, Angus DC, Iwashyna TJ. Hospital deaths in patients with sepsis from 2 independent cohorts. JAMA. 2014;312(1):90–2.
4. Seymour CW, Gesten F, Prescott HC, Friedrich ME, Iwashyna TJ, Phillips GS, Lemeshow S, Osborn T, Terry KM, Levy MM. Time to treatment and mortality during mandated emergency care for sepsis. N Engl J Med. 2017;376(23):2235–44.
5. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, Bellomo R, Bernard GR, Chiche JD, Coopersmith CM, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016;315(8):801–10.
6. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, Kumar A, Sevransky JE, Sprung CL, Nunnally ME, et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. 2017;43(3):304–77.
7. Kumar A, Ellis P, Arabi Y, Roberts D, Light B, Parrillo JE, Dodek P, Wood G, Kumar A, Simon D, Cooperative Antimicrobial Therapy of Septic Shock Database Research Group, et al. Initiation of inappropriate antimicrobial therapy results in a fivefold reduction of survival in human septic shock. Chest. 2009;136(5):1237–48.
8. Rannikko J, Syrjänen J, Seiskari T, Aittoniemi J, Huttunen R. Sepsis-related mortality in 497 cases with blood culture-positive sepsis in an emergency department. Int J Infect Dis. 2017;58:52–7.
9. de Prost N, Razazi K, Brun-Buisson C. Unrevealing culture-negative severe sepsis. Crit Care. 2013;17(5):1001.
10. Rangel-Frausto MS, Pittet D, Costigan M, Hwang T, Davis CS, Wenzel RP. The natural history of the systemic inflammatory response syndrome (SIRS). A prospective study. JAMA. 1995;273(2):117–23.
11. Moher D, Liberati A, Tetzlaff J, Altman DG, PRISMA Group. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA Statement. Open Med. 2009;3(3):e123–30.
12. Gupta S, Sakhuja A, Kumar G, McGrath E, Nanchal RS, Kashani KB. Culture-negative severe sepsis: nationwide trends and outcomes. Chest. 2016;150(6):1251–9.
13. Wells GA, Shea BJ, O’connell D, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of non-randomized studies in meta-analysis. Appl Eng Agric. 2014;18:727–34.
14. Biggerstaff BJ, Jackson D. The exact distribution of Cochran’s heterogeneity statistic in one-way random effects meta-analysis. Stat Med. 2008;27(29):6093–110.
15. Wan X, Wang W, Liu J, Tong T. Estimating the sample mean and standard deviation from the sample size, median, range and/or interquartile range. BMC Med Res Methodol. 2014;14:135.
16. Phua J, Ngerng W, See K, Tay C, Kiong T, Lim H, Chew M, Yip H, Tan A, Khalizah H, et al. Characteristics and outcomes of culture-negative versus culture-positive severe sepsis. Crit Care. 2013;17(5):R202.
17. Bast J, Scheer C, Rehberg S, Fuchs C, Vollmer M, Balau V, Kuhn SO, Hahnenkamp K, Gruendling M. Mortality of blood-culture-positive vs. bloodculture-negative patients with severe sepsis and septic shock. Infection. 2015;43:S58–9.
18. Easaw SM, Kaul V, Gupta J, Alex L, Warshawsky M. Factors affecting mortality and length of stay among patients with culture positive or culture negative severe sepsis. Chest. 2017;152(4):A412.
19. Kethireddy S, Bilgili B, Sees A, Kirchner HL, Ofoma UR, Light RB, Mirzanejad Y, Maki D, Kumar A, Layon AJ, Cooperative Antimicrobial Therapy of Septic Shock (CATSS) Database Research Group, et al. Culture-negative septic shock compared with culture-positive septic shock: a retrospective cohort study. Crit Care Med. 2018;46(4):506–12.
20. Sigakis MJG, Jewell E, Maile MD, Cinti SK, Bateman BT, Engoren M. Culture-negative and culture-positive sepsis: a comparison of characteristics and outcomes. Anesth Analg. 2019;129(5):1300–9.
21. Hazwani TR, Kazzaz YM, Alsugheir S, Aldelaijan S, Alsugheir F, Alali H, Alsadoon A, Alhamwah M, Alsubaiel S, Alomar B, et al. Association between culture-negative versus culture-positive sepsis and outcomes of patients admitted to the pediatric intensive care unit. Cureus. 2020;12(8):e9981.
22. Kim JS, Kim YJ, Kim WY. Characteristics and clinical outcomes of culturenegative and culture-positive septic shock: a single-center retrospective cohort study. Crit Care. 2021;25(1):11.
23. Scheer CS, Fuchs C, Gründling M, Vollmer M, Bast J, Bohnert JA, Zimmermann K, Hahnenkamp K, Rehberg S, Kuhn SO. Impact of antibiotic administration on blood culture positivity at the beginning of sepsis: a prospective clinical cohort study. Clin Microbiol Infect. 2019;25(3):326–31.
24. Lin GL, McGinley JP, Drysdale SB, Pollard AJ. Epidemiology and immune pathogenesis of viral sepsis. Front Immunol. 2018;9:2147.
25. Delaloye J, Calandra T. Invasive candidiasis as a cause of sepsis in the critically ill patient. Virulence. 2014;5(1):161–9.
26. Bloos F, Sachse S, Kortgen A, Pletz MW, Lehmann M, Straube E, Riedemann NC, Reinhart K, Bauer M. Evaluation of a polymerase chain reaction assay for pathogen detection in septic patients under routine condition: an observational study. PLoS ONE. 2012;7(9):e46003.
27. Bloos F, Hinder F, Becker K, Sachse S, Mekontso Dessap A, Straube E, Cattoir V, Brun-Buisson C, Reinhart K, Peters G, et al. A multicenter trial to compare blood culture with polymerase chain reaction in severe human sepsis. Intensive Care Med. 2010;36(2):241–7.
28. Koslow M, Epstein Shochet G, Matveychuk A, Israeli-Shani L, Guber A, Shitrit D. The role of bacterial culture by bronchoscopy in patients with lung cancer: a prospective study. J Thorac Dis. 2017;9(12):5300–5.
29. Cohen J, Brun-Buisson C, Torres A, Jorgensen J. Diagnosis of infection in sepsis: an evidence-based review. Crit Care Med. 2004;32(11 Suppl):S466–94.
30. Vincent JL, Opal SM, Marshall JC, Tracey KJ. Sepsis definitions: time for change. Lancet. 2013;381(9868):774–5.
31. Labelle AJ, Arnold H, Reichley RM, Micek ST, Kollef MH. A comparison of culture-positive and culture-negative health-care-associated pneumonia. Chest. 2010;137(5):1130–7.
32. Karvellas CJ, Abraldes JG, Zepeda-Gomez S, Moffat DC, Mirzanejad Y, Vazquez-Grande G, Esfahani EK, Kumar A, Cooperative Antimicrobial Therapy of Septic Shock (CATSS) Database Research Group. The impact of delayed biliary decompression and anti-microbial therapy in 260 patients with cholangitis-associated septic shock. Aliment Pharmacol Ther. 2016;44(7):755–66.
33. Abe T, Ogura H, Kushimoto S, Shiraishi A, Sugiyama T, Deshpande GA, Uchida M, Nagata I, Saitoh D, Fujishima S, JAAM FORECAST group, et al. Variations in infection sites and mortality rates among patients in intensive care units with severe sepsis and septic shock in Japan. J Intensive Care. 2019;7:28.
34. Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, Sevransky JE, Sprung CL, Douglas IS, Jaeschke R, Surviving Sepsis Campaign Guidelines Committee including the Pediatric Subgroup, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41(2):580–637.
35. Kumar A, Roberts D, Wood KE, Light B, Parrillo JE, Sharma S, Suppes R, Feinstein D, Zanotti S, Taiberg L, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med. 2006;34(6):1589–96.
36. Dark PM, Dean P, Warhurst G. Bench-to-bedside review: the promise of rapid infection diagnosis during sepsis using polymerase chain reactionbased pathogen detection. Crit Care. 2009;13(4):217.
37. Lisboa T, Waterer G, Rello J. We should be measuring genomic bacterial load and virulence factors. Crit Care Med. 2010;38(10 Suppl):S656–62.
38. Heenen S, Jacobs F, Vincent JL. Antibiotic strategies in severe nosocomial sepsis: why do we not de-escalate more often? Crit Care Med. 2012;40(5):1404–9.
Li et al. Crit Care (2021) 25:167