Array
(
[NAME] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
[~NAME] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
[PREVIEW_PICTURE] => Array
(
[ID] => 5352
[TIMESTAMP_X] => 11.11.2024 15:04:53
[MODULE_ID] => iblock
[HEIGHT] => 834
[WIDTH] => 1000
[FILE_SIZE] => 107663
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/82e/l0br2fvpn5pu3rpmm0q56z2b01hfguuc
[FILE_NAME] => 3d-illustration-red-blood-cells-scientific-medical-concept.jpg
[ORIGINAL_NAME] => 3d-illustration-red-blood-cells-scientific-medical-concept.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 44cb122bff6776d124253123f6adaf8f
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/82e/l0br2fvpn5pu3rpmm0q56z2b01hfguuc/3d-illustration-red-blood-cells-scientific-medical-concept.jpg
[UNSAFE_SRC] => /upload/iblock/82e/l0br2fvpn5pu3rpmm0q56z2b01hfguuc/3d-illustration-red-blood-cells-scientific-medical-concept.jpg
[SAFE_SRC] => /upload/iblock/82e/l0br2fvpn5pu3rpmm0q56z2b01hfguuc/3d-illustration-red-blood-cells-scientific-medical-concept.jpg
[ALT] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
[TITLE] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
)
[~PREVIEW_PICTURE] => 5352
[DETAIL_TEXT] =>
Tsantes, A.G.; Parastatidou, S.; Tsantes, E.A.; Bonova, E.; Tsante, K.A.; Mantzios, P.G.; Vaiopoulos,A.G.; Tsalas, S.; Konstantinidi, A.; Houhoula, D.; et al. Sepsis-Induced Coagulopathy: An Update on Pathophysiology, Biomarkers, and Current Guidelines.
Life 2023, 13, 350. doi.org/10.3390/life13020350
Абстракт: между воспалением и коагуляцией возникают значительные перекрестные взаимодействия. Таким образом, коагулопатия часто встречается при сепсисе, потенциально ухудшая прогноз. Вначале у пациентов с сепсисом наблюдается протромботическое состояние за счет активации внешнего пути коагуляции, индуцированного цитокинами, подавления антикоагуляции и нарушения фибринолиза. На поздних стадиях сепсиса при развитии диссеминированного внутрисосудистого свертывания крови (ДВС-синдром) наступает гипокоагуляция. Традиционные лабораторные признаки сепсиса, включая тромбоцитопению, увеличение протромбинового времени (ПТВ) и продуктов деградации фибрина (ПДФ), а также снижение фибриногена, обнаруживаются только на поздних стадиях сепсиса. Недавно введенное определение сепсис-индуцированной коагулопатии (SIC) направлено на выявление пациентов на более ранней стадии, когда изменения коагуляционного статуса еще обратимы.
Нетрадиционные анализы, такие как измерение уровня антикоагулянтных белков, а также вискозиметрия обнаружили многообещающую чувствительность и специфичность в выявлении пациентов с риском развития ДВС, что позволяет своевременно проводить коррекцию нарушений гемостаза. В данном обзоре изложены современные представления о патофизиологических механизмах и возможностях диагностики ДВС-синдрома.
Ключевые слова: сепсис; коагуляция; диссеминированное внутрисосудистое свертывание; сепсис-индуцированная коагулопатия; лабораторная оценка; методические рекомендации
1. Введение
Традиционное определение сепсиса — синдром системной воспалительной реакции, вызванный инфекцией. В 2016 году это определение было обновлено Третьим международным консенсусом определений сепсиса и септического шока до «угрожающей жизни дисфункции органов, вызванной дисфункциональным ответом организма на инфекцию» [1]. Текущая концепция подчеркивает риск тяжелого течения заболевания и смертности из-за нерегулируемого ответа на инфекцию а не из-за самой инфекции. Органная дисфункция определяется как увеличение балла по шкале sequential organ failure assessment (SOFA) не менее чем на 2 балла. За последние несколько лет наше понимание механизмов и патофизиологии сепсиса значительно улучшилось, а современные и более эффективные диагностические инструменты находятся в стадии разработки (Figure 1). Однако патобиология сепсиса до конца не выяснена, и не существует золотого стандарта в диагностике. Сепсис - это сложный клинический синдром с распространенностью примерно 2,5 на 1000 человек в западном мире и ежегодным ростом на 8,7% за последние 20 лет, что частично связано со старением населения [2]. Ежегодно диагностируется 19 миллионов случаев сепсиса и почти 5 миллионов смертей, что делает его одной из основных причин смертности во всем мире [3].
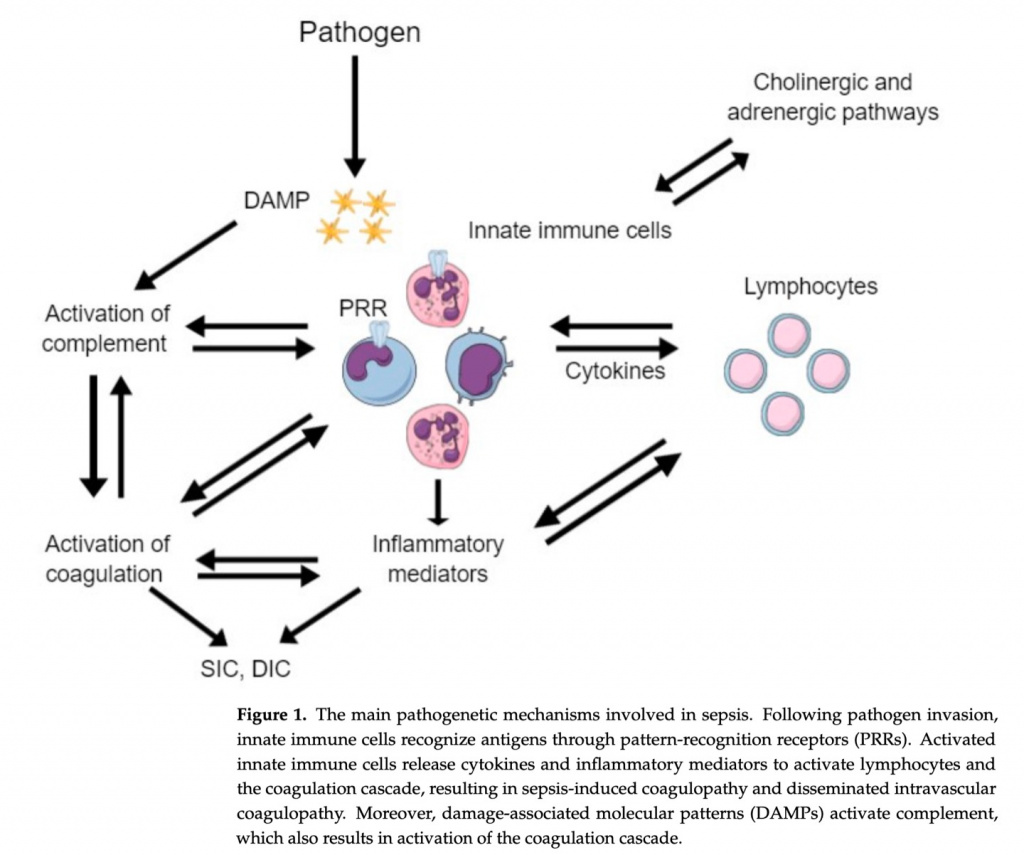
Инфекция и, в частности, сепсис вызывают множественные и сложные нарушения во многих системах, включая коагуляционный каскад. У подавляющего большинства пациентов с сепсисом наблюдаются нарушения гемостаза, варьирующие от субклинической коагулопатии до молниеносного ДВС-синдрома [4]. На начальных стадиях инфекции коагуляция действует как естественный защитный механизм, пытаясь локализовать патоген и предотвратить его распространение в системный кровоток. Однако при запущенных и тяжелых инфекциях, таких как сепсис, массовая продукция и выброс в кровоток воспалительных цитокинов приводит к чрезмерной активации процесса свертывания крови, нарушению фибринолиза и подавлению антикоагуляции [5]. Баланс гемостаза при сепсисе значительно нарушен. Процесс коагуляции активируется, а антикоагулянтные механизмы, включая фибринолиз и антикоагулянтные факторы, подавляются (Figure 2). Следовательно, пациенты с сепсисом склонны к протромботическому состоянию через четыре основных механизма: активация внешнего пути, цитокин-индуцированное усиление коагуляции, подавление антикоагулянтных путей и нарушение фибринолиза [6]. Лабораторная оценка нарушений гемостаза при сепсисе основана на стандартных тестах, включая абсолютное количество тромбоцитов, ПТВ, международное нормализованное отношение (МНО), ПДФ, уровень d-димеров и фибриногена, а также нетрадиционные анализы, включая измерение уровней белков-антикоагулянтов и исследования вязкости крови [2].

В этом обзоре изложены современные представления о патофизиологических механизмах коагулопатии, вызванной сепсисом, и диагностических возможностях ее выявления с акцентом на потенциальные представляющие интерес биомаркеры и соответствующие существующие руководства. Это исследование направлено на обзор современной литературы по следующим ключевым вопросам: (1) Каковы основные патогенетические механизмы, участвующие в развитии сепсис-индуцированной коагулопатии (SIC)? (2) Каковы диагностические критерии SIC? (3) Есть ли последние достижения в лабораторной оценке и лечении SIC?
2. Нарушения гемостаза при сепсисе
Путь тканевого фактора является начальным и основным триггером активации свертывания крови при сепсисе. Тканевой фактор располагается в эндотелии сосудов, и его попадание в кровоток при повреждении эндотелия приводит к активации внешнего пути свертывания крови [5]. Однако это не основной активирующий механизм при сепсисе. Тканевой фактор также присутствует в моноцитах и других циркулирующих макрофагах. В случае инфекции эти клетки активируются через паттерн-распознающие рецепторы (PRRs) патоген-ассоциированными молекулярными паттернами (PAMPs) и молекулярным паттернам, ассоциированным с повреждением (DAMPs) [7]. PAMPs представляют собой молекулы, которые циркулируют после уничтожения патогенов или могут высвобождаться живыми патогенами, в то время как DAMPs представляют собой клеточные компоненты хозяина, высвобождаемые при лизисе клеток. PAMPs и DAMPs распознаются и связываются со специфическими поверхностными PRRs в моноцитах и макрофагах. После распознавания PAMPs/DAMPs с помощью PRRs на поверхности моноцитов и макрофагов, эти клетки активируются и высвобождают цитокины и хемокины, которые впоследствии активируют нейтрофилы, тромбоциты и эндотелиальные клетки. Более того, активированные моноциты высвобождают внеклеточные везикулы, которые экспрессируют на своей поверхности прокоагулянтный тканевой фактор и фосфатидилсерин.
Таким образом, тканевой фактор высвобождается в кровоток и активируется внешний путь свертывания крови. Нейтрофилы также играют важную роль в активации каскада свертывания посредством экспрессии тканевого фактора и высвобождения химических медиаторов и белков. Другим важным механизмом, посредством которого нейтрофилы активируют каскад свертывания крови, является высвобождение нейтрофильных внеклеточных ловушек (NETs). NETs представляют собой частицы, состоящие из гистонов, прокоагулянтной ДНК и других DAMP, высвобождаемых после вторжения патогена для ограничения инфекции. Однако эти NETs обладают высокой протромботической активностью, способствуя прокоагулянтному состоянию при инфекции.
Активация коагуляции дополнительно усиливается за счет высвобождения воспалительных цитокинов и антигенных продуктов [2]. Бактериальные эндотоксины, представляющие собой циркулирующие фрагменты клеточной стенки бактерий, являются мощными стимулами для активации коагуляционного каскада и ДВС-синдрома, особенно при грамотрицательных инфекциях. Эндотоксины связываются с моноцитами и эндотелиальными клетками, что приводит к высвобождению цитокинов, индуцирующих коагуляцию, и запуску путей тканевого фактора [8]. Эндотоксины в этом случае либо связываются с ассоциированными с мембраной PRRs или Toll-подобными рецепторами этих клеток, либо, если они присутствуют в цитозоле, связываются и обнаруживаются каспазой 11.
На ранних стадиях сепсиса активации свертывания противодействуют три антикоагулянтных пути: антитромбин, протеин С и ингибитор пути тканевого фактора [2]. По мере прогрессирования сепсиса эти три механизма нарушаются, что приводит к состоянию гиперкоагуляции. В частности, антитромбин, важный антикоагулянтный механизм, который ингибирует тромбин и фактор Ха, снижается при сепсисе из-за сниженного синтеза и повышенной деградации под действием протеаз и нейтрофильных эластаз [6]. Нормальная активация протеина С опосредована комплексом тромбин-тромбомодулин на эндотелиальных клетках, что приводит к ингибированию факторов Va и VIIIa. Кроме того, рецептор эндотелиального протеина С (EPCR) экспрессируется на поверхности эндотелиальных клеток и дополнительно усиливает активацию протеина С [9]. Однако при сепсисе уровень протеина С снижается. Наконец, ингибитор пути тканевого фактора (TFPI) инактивирует комплекс тканевого фактора-фактора VIIa и производится несколькими клетками, включая эндотелиальные клетки, но его уровень снижается при сепсисе, что приводит к дисрегуляции инактивации комплекса тканевого фактора-фактора VIIa.
При сепсисе фибринолитическая активность зависит от баланса между тканевым активатором плазминогена (t-PA) и ингибитором тканевого активатора плазминогена PAI-1 [10]. T-PAоблегчает фибринолиз посредством деградации фибрина плазмином, в то время как PAI-1 ингибирует фибринолиз. В ранней транзиторной фазе сепсиса фибринолиз повышен из-за превращения плазминогена в плазмин под действием усиленного действия t-PA. Впоследствии происходит нарушение фибринолиза по мере увеличения PAI-1, повышения уровня тромбин-активируемого ингибитора фибринолиза (TAFI) и уровня ядерных продуктов в плазме. Нарушение фибринолиза способствует гиперкоагуляционному состоянию, наблюдаемому при сепсисе [11]. Поскольку коагуляция служит защитным механизмом, бактериальные патогены заключаются в фибриновую сеть в месте инфекции, что ограничивает их распространение в соседние ткани и системный кровоток. В этом плане нарушение фибринолиза в определенной степени полезно, но также имеет негативные последствия [12]. Распространение возбудителей в другие ткани предотвращается за счет нарушения притока к этим тканям кислорода, что приводит к гипоксии.
3. Перекрестное взаимодействие воспаления и гемостаза
При сепсисе развивается двунаправленное взаимодействие между воспалением и коагуляцией, что приводит к самоподдерживающемуся циклу (Figure 3) [2]. Присутствуют высокие уровни провоспалительных медиаторов, большинство из которых, включая фактор некроза опухоли-а (ФНО-а) и интерлейкин-6 (ИЛ-6), индуцируют коагуляционный каскад. В то же время различные гемостатические факторы дополнительно поддерживают и усиливают воспалительный процесс. Белки коагуляции взаимодействуют с клеточными рецепторами, что приводит к модификации путей воспаления [5]. Это регулирующее действие в значительной степени опосредуется активируемыми протеазами рецепторами (PARs) [13]. PARs - это трансмембранные рецепторы, активируемые в основном тромбином и другими факторами коагуляции, которые вызывают высвобождение провоспалительных цитокинов [14]. Кроме того, происходит взаимодействие между гемостазом и комплементом, который играет важную роль в развитии ДВС [15]. Между антикоагулянтными факторами и медиаторами воспаления также существуют значительные перекрестные взаимодействия [5]. Антитромбин напрямую связывается с воспалительными клетками и подавляет экспрессию рецепторов цитокинов. Кроме того, было показано, что активированный протеин С подавляет эндотоксин-индуцированную продукцию TNF-α, IL-1β, IL-6 и IL-8 моноцитами и макрофагами. Ингибирование активации лейкоцитов может быть еще одной ролью активированного протеина С [16].

4. Сепсис-индуцированная коагулопатия и диссеминированная внутрисосудистая коагуляция
ДВС-синдром характеризуется дисфункциональной системной активацией коагуляционного каскада, приводящей к избыточным тромботическим и геморрагическим осложнениям в результате внутрисосудистого образования фибрина, микроангиопатического тромбоза и последующего истощения факторов свертывания крови и тромбоцитов [5]. Клинически выраженные нарушения гемостаза встречаются примерно у 50-70% пациентов с сепсисом, в то время как у 35% этих пациентов развивается ДВС-синдром [17]. Более трех десятилетий назад Научный подкомитет Международного общества тромбоза и гемостаза по ДВС (ISTH DICSSC) определил это состояние как «приобретенный синдром, характеризующийся внутрисосудистой активацией коагуляции с потерей локализации, возникающий по разным причинам» [18]. Хотя ДВС-синдром вызывается различными фоновыми заболеваниями, включая сепсис и неинфекционные причины, такие как травмы и злокачественные новообразования, общим признаком ДВС-синдрома является системная активация коагуляции. Эта активация индуцируется повреждением эндотелия и может привести к тканевой сосудистой гипоперфузии и последующей полиорганной недостаточности [19]. Коагулопатия у пациентов с сепсисом прогрессирует от изначально компенсированного нарушения системы гемостаза, называемого неявным ДВС-синдромом, до явного ДВС-синдрома, состояния полной декомпенсации свертывания крови [20].
Первые диагностические критерии ДВС-синдрома были введены в 1983 году Министерством здравоохранения и социального обеспечения Японии. Они включали как клинические характеристики, так и лабораторные показатели, такие как количество тромбоцитов, ПТФ, ПДФ и фибриноген [21]. Позднее ISTH DIC SSC рекомендовал критерии диагностики явного ДВС-синдрома, ориентируясь на лабораторные параметры [18]. Впервые в критерии были включены D-димеры, при этом значимость количества тромбоцитов была снижена, а значимость маркеров, связанных с фибрином, повышена. Согласно критериям ISTH DIC SSC, повышенные уровни ПДФ или d-димеров, снижение количества тромбоцитов, удлинение ПТВ и снижение уровня фибриногена соответствуют явному ДВС-синдрому (Table 1). Также использовались другие системы оценки ДВС, в том числе диагностические критерии ДВС Japanese Association forAcute Medicine (JAAM) [22]. Количество тромбоцитов, концентрация ПДФ, ПТВ и системная воспалительная реакция входят в число критериев ДВС JAAM.
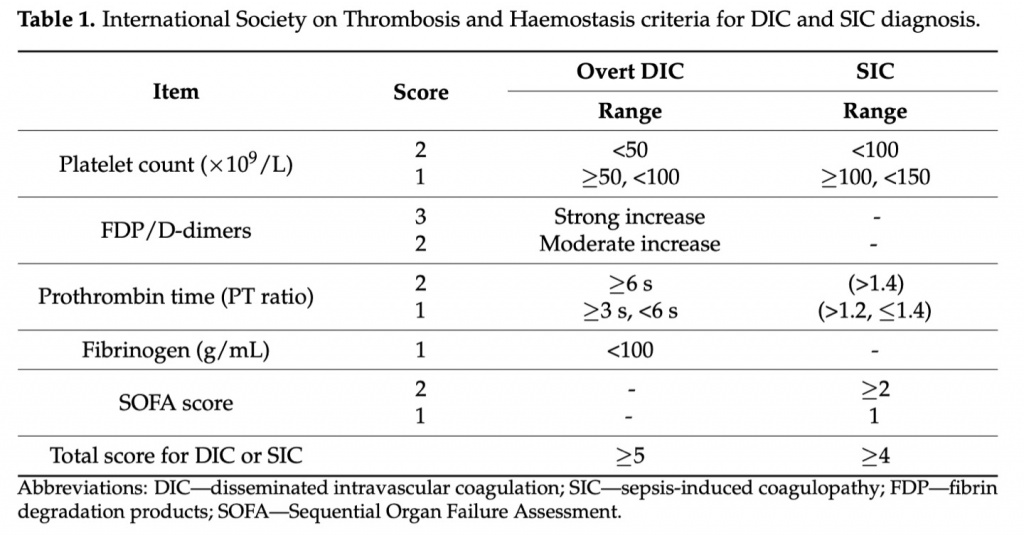
Сепсис представляет собой состояние, при котором своевременная диагностика и начало лечения имеют первостепенное значение. Шкала ДВС показала хорошую прогностическую ценность для смертности; однако к моменту ее обнаружения пациенты уже находятся на далеко зашедшей и необратимой стадии коагулопатии, выходящей за оптимальные сроки для коррекции [23]. Раннее выявление пациентов с сепсис-ассоциированной коагулопатией до прогрессирования этой фазы гемостатического расстройства было бы идеальным для начала лечения антикоагулянтами [24]. Так, подкомитет ISTH DIC предложил простые диагностические критерии сепсис-индуцированной коагулопатии (SIC), состоящие всего из трех параметров: количество тромбоцитов, ПТВ или МНО и балл по шкале SOFA [25]. Наличие сепсиса подтверждается включением оценки по шкале SOFA, отражающей обновленное определение сепсиса. ДВС-синдром, связанный с сепсисом, характеризуется нарушением фибринолиза в результате избыточной продукции PAI-1 [26,27]. Это потенциально приводит к протромботическому состоянию и дисфункции органов из-за гипоперфузии тканей [28,29]. Напротив, при «несептическом» ДВС-синдроме подавление фибринолиза происходит редко и часто возникают системные кровотечения [30]. Таким образом, снижение уровня фибриногена не является обычным или специфичным признаком сепсиса, в отличие от тромбоцитопении и удлинения ПТВ. Наконец, ПДФ и d-димеры не были включены в оценку сепсис-индуцированной коагулопатии, так как у них не было выявлено их корреляции с тяжестью сепсиса [31].
При сравнении систем оценки явного ДВС-синдрома ISTH и сепсис-индуцированной коагулопатии (SIC) стало очевидным, что показатель SIC в два раза более чувствителен, чем показатель явного ДВС-синдрома, и что SIC всегда предшествует явному ДВС-синдрому [32]. Оценка SIC также была подтверждена критериями Japanese Association for Acute Medicine (JAAM) и продемонстрировала схожую прогностическую ценность [33].
Диагностика как сепсис-индуцированной коагулопатии, так и явного ДВС-синдрома может быть полезной для выявления пациентов, которым будет полезно терапевтическое вмешательство с применением антикоагулянтов [34]. ISTH разработал «двухступенчатую» последовательную систему оценки для выявления пациентов с сепсис-ассоциированной коагулопатией (Table 1). Первоначально пациенты проходят скрининг по шкале сепсис-индуцированной коагулопатии, и, если критерии сепсис-индуцированной коагулопатии обнаруживают, затем рассчитывается оценка по шкале ДВС. Такой подход может увеличить возможность своевременного выявления подходящих кандидатов на антикоагулянтную терапию[21].
In case of sepsis, well-established findings emerge on conventional coagulation assays. These findings include thrombocytopenia, prolongation of PT, increased levels of FDPs, and reduced fibrinogen levels. Such abnormalities often present in the setting of DIC and are not usually observed before its development, during the initial stages of sepsis.
5. Традиционные гемостатические тесты и маркеры при сепсисе
В случае сепсиса появляются хорошо известные результаты обычных анализов коагуляции. Эти результаты включают тромбоцитопению, удлинение ПТ, повышение уровня ПДФ и снижение уровня фибриногена. Такие нарушения часто возникают при ДВС-синдроме и обычно не наблюдаются до его развития, на начальных стадиях сепсиса.
5.1. Тромбоцитопения
Сепсис обычно связан с тромбоцитопенией, несмотря на высвобождение провоспалительных медиаторов и тромбопоэтина, которые индуцируют продукцию тромбоцитов [35,36]. У подавляющего большинства пациентов с сепсисом развивается тромбоцитопения, признанный независимый предиктор неблагоприятных исходов при сепсисе [37,38]. В ранней фазе сепсиса тромбоциты после их активации агрегируют с лейкоцитами с образованием тромбоцитарно-лейкоцитарных агрегатов, что приводит к усилению секвестрации в селезенке [39]. Более того, инфекции могут стимулировать активацию и агрегацию тромбоцитов и вызывать тромбоцитопению либо напрямую, либо через разрушение клеток, воспаление и образование тромбов [40].
Фагоцитоз предшественников тромбоцитов моноцитами под воздействием макрофагального колониестимулирующего фактора (М-КСФ) еще больше способствует снижению количества тромбоцитов. Кроме того, при сепсисе наблюдается измененное производство тромбоцитов со значительным высвобождением клеток-предшественников, а фракция незрелых тромбоцитов (IPF) хорошо коррелирует с показателями тяжести сепсиса [41].
5.2. Продукты деградации фибрина (ПДФ)
Оценка биомаркеров, связанных с фибрином, включает тесты, выявляющие ПДФ, такие как d-димеры, и анализы, выявляющие продукты образования предшественников фибрина на промежуточной стадии между фибриногеном и конечным стабильным фибрином, такие как растворимые мономеры фибрина.
ПДФ, такие как белковые фрагменты X, Y и D, являются результатом деградации трех компонентов цикла фибриноген-фибрин: исходного фибриногена, растворимого предшественника фибрина и сшитого фибрина — конечной стабильной формы фибрина. ПДФ обнаруживают у 99% пациентов с сепсисом. Однако этим тестам не хватает специфичности, поскольку они не могут различать продукты деградации, происходящие из конечного сшитого фибрина, промежуточного растворимого фибрина или исходного фибриногена [42]. Уровни ПДФ измеряются с помощью иммуноферментного анализа ELISA или методом латексной агглютинации, что позволяет проводить «прикроватную» оценку.
D-димеры также являются продуктами деградации фибрина, но они образуются только в результате протеолиза конечного сшитого фибрина, и на их уровень не влияют продукты деградации фибриногена [5]. Следовательно, d-димеры являются наиболее специфическим маркером среди продуктов деградации фибрина для оценки ДВС-синдрома. Обнаружение d-димеров указывает на то, что тромбин индуцирует превращение фибриногена в мономер фибрина и что фибрин сшивается активированным фактором XIII и впоследствии расщепляется плазмином [43].
Хотя d-димеры являются ПДФ и связаны с фибринолизом, их высокие уровни отражают сопутствующую активацию свертывания [44]. Следовательно, d-димеры могут указывать на повышенное образование, а не на деградацию фибрина. Фактически, повышенные уровни d-димеров наблюдаются при тромбозах и также включаются в шкалу ДВС-синдрома, где тяжелый сепсис коррелирует с гипофибринолизом. Таким образом, при сепсисе d-димеры повышены как из-за активации коагуляционного каскада, так и из-за гиперфибринолиза, наблюдаемого на ранней стадии инфекции. Однако при далеко зашедшем сепсисе d-димеры могут быть нормальными. Это связано со значительным ингибированием фибринолиза, что предотвращает образование d-димеров, несмотря на повышенное образование фибрина. Имеются данные о том, что использование d-димеров для диагностики ДВС-синдрома и стратификации риска при тяжелом сепсисе может вводить в заблуждение, поскольку нормальные уровни d-димеров ассоциировались с более высокими показателями смертности [43,44].
С другой стороны, растворимые мономеры фибрина могут быть эффективными маркерами внутрисосудистого образования фибрина при ДВС-синдроме [45]. Уровни растворимых мономеров фибрина в плазме отражают внутрисосудистое образование фибрина и не зависят от внесосудистого образования фибрина, которое может сопровождать местное воспаление или травму. Доступные клинические испытания показывают, что растворимые мономеры фибрина, превышающие пороговый уровень, позволяют поставить точный диагноз ДВС-синдрома. На сегодняшний день нет надежного теста для количественного определения уровней растворимого фибрина.
5.3. Фибриноген
В целом, низкий уровень фибриногена в сыворотке крови считается основным показателем нарушения коагуляции при сепсисе [46]. Однако фибриноген является реагентом острой фазы, и его уровень повышается из-за воспаления. В результате уровень фибриногена может оставаться в пределах нормального референсного диапазона в течение длительного периода времени после его постоянного употребления. Последовательные измерения фибриногена могут быть более полезными, с более высокой диагностической точностью [47].
5.4. Стандартные коагуляционные тесты
Стандартные коагуляционные тесты, включая ПТВ и активированное частичное тромбопластиновое время (аЧТВ), традиционно использовались для оценки системы гемостаза [48]. Тем не менее они не в полной мере отражают гемостатическое расстройство, вызванное сепсисом [49]. Аномальные значения стандартных тестов коагуляции наблюдаются только в позднем течении сепсиса, когда развивается гипокоагуляция, выявляемая этими тестами. Кроме того, они оценивают часть гемостатического механизма, так как они основаны на плазматических компонентах системы свертывания, в то время как решающий вклад клеточных компонентов не оценивается. Стандартные коагуляционные тесты в первую очередь оценивают активность прокоагулянтных факторов без учета одновременной активации антикоагулянтного механизма.
6. Нетрадиционные гемостатические тесты и маркеры при сепсисе
Для диагностики нарушений свертывания крови, связанных с сепсисом, применялись нетрадиционные тесты.
6.1. Визкозиметрические тесты
Тромбоэластография (ТЭГ) и ротационная тромбоэластометрия (РОТЭМ) представляют собой тесты, которые обеспечивают всестороннюю оценку процесса гемостаза от инициации коагуляции и образования сгустка до его растворения и фибринолиза [50,51]. С помощью этих методов оценивается вклад как плазматического, так и клеточного компонентов коагуляции. Визкозиметрические тесты могут быть полезны для заполнения пробелов в стандартных тестах на коагуляцию при оценке гемостатического статуса пациентов с сепсисом [49]. Таким образом, многочисленные исследования были сосредоточены на использовании данных тестов для выявления гемостатических изменений, сопровождающих сепсис. Также были проведены исследования в субпопуляциях, включая педиатрических и неонатальных пациентов с сепсисом [52–54]. Распространенность септических больных с нарушениями гемостаза, выявленными с помощью ТЭГ/РОТЭМ, колебалась от 43 до 100% [55]. Существует неоднородность в дизайне, проведении и результатах исследований [56,57]. Сообщалось как о гипокоагуляции, так и о гиперкоагуляции, что отражает патофизиологию коагулопатии при сепсисе и ДВС-синдроме. Как динамический процесс, коагулопатия, связанная с сепсисом, развивается быстро, и время проведения тестирования сильно влияет на результаты ТЭГ/РОТЭМ. Последовательные измерения могут более точно отображать развитие сепсис-индуцированной коагулопатии, от гиперкоагуляции на ранних стадиях до последующего развития ДВС-синдрома и гипокоагуляции. Вязкоупругие тесты также могут выявить нарушение фибринолиза, как сообщалось в нескольких исследованиях у пациентов с сепсисом [55,58].
Анализы вязкости могут обнаружить раннюю активацию свертывания крови, которая приводит к гиперкоагуляции, когда результаты стандартных тестов на коагуляцию все еще находятся в пределах нормы [55]. Ротационная тромбоэластометрия (РОТЭМ) использовалась для дифференцировки пациентов с сепсисом с нормальной свертываемостью, гиперкоагуляцией и гипокоагуляцией. Как гипокоагуляционный, так и гиперкоагуляционный гемостатический профиль в РОТЭМ коррелировал со значительно более высоким риском смертности [59]. В другом исследовании пациенты с явным ДВС-синдромом показали профиль гипокоагуляции в РОТЭМ, в то время как пациенты с сепсисом без явного ДВС-синдрома имели тенденцию к гиперкоагуляции [60].
TEG parameters have been used for the development of a score to predict DIC [62]. Furthermore, ROTEM clotting time (CT) variable correlated strongly with the JAAM DIC score and performed well in predicting DIC [63].
У всех этих пациентов были аномальные стандартные тесты на коагуляцию, и использование ротационной тромбоэластометрии могло помочь предотвратить прокоагулянтные вмешательства у пациентов с гиперкоагуляционным статусом, не выявляемым стандартными тестами на коагуляцию. Сто пациентов с сепсисом, тяжелым сепсисом или септическим шоком были обследованы с помощью ротационйно тромбоэластометрии [61]. Максимальная плотность сгустка (MCF) была выше в группах с сепсисом и тяжелым сепсисом по сравнению с контрольной группой здоровых лиц. При септическом шоке наблюдали нормальную максимальную плотность и пролонгированное образование сгустка. Эти результаты указывают на гиперкоагуляцию у пациентов с сепсисом или тяжелым сепсисом и на гипокоагуляцию в более поздней фазе септического шока.
Интересно, что фибринолитическая активность положительно коррелировала с 28-дневной смертностью. Параметры тромбоэластографии использовались для разработки оценки для прогнозирования ДВС-синдрома [62]. Кроме того, переменная времени свертывания крови РОТЭМ сильно коррелировала с оценкой ДВС-синдрома Japanese Association for Acute Medicine хорошо показала себя в прогнозировании ДВС [63].
Недавний метаанализ пришел к выводу, что тесты вязкоупругости надежны и полезны для прогнозирования ДВС-синдрома, связанного с сепсисом, и оценки риска смертности при тяжелом сепсисе [56]. Представляется, что как профиль гипокоагуляции, так и переход к гипокоагуляции могут выявить пациентов с риском развития ДВС-синдрома. Комбинация обычны тестов коагуляции и показателей вискозиметрии могут оптимизировать выявление и лечение ДВС-синдрома, а также улучшить выживаемость и исход.
6.2. Измерение нуклеарных компонентов
Сепсис вызывает активацию и повреждение клеток и последующее высвобождение нуклеарных компонентов в кровоток [15], которые включают бокс-протеин-1 группы высокой подвижности (HMGB1), нуклеосомы, гистоны, бесклеточную ДНК и внеклеточные ловушки нейтрофилов (NETs). Нуклеарные компоненты могут напрямую запускать экспрессию тканевого фактора в макрофагах и эндотелиальных клетках. Экспрессия тканевого фактора и последующая активация внешнего пути коагуляции опосредуется активацией рецепторов TLR2/4 и путей ядерного фактора-каппа B (NF-κB) и белка-активатора 1 (AP-1) [64]. HMGB1 служит маркером повреждения клеток, воспаления и тромбоза [65]. Действуя на окружающие клетки через рецепторы, он опосредует миграцию лейкоцитов и продукцию провоспалительных цитокинов [66]. HMGB1 также способствует экспрессии тканевого фактора на поверхности моноцитов и снижает антикоагулянтную активность тромбомодулина, способствуя таким образом тромбозу микрососудов. Высокие уровни HMGB1 наблюдались у пациентов с сепсисом и ДВС-синдромом и связаны с плохим прогнозом и повышенной смертностью [67].
Нуклеосомы представляют собой комплексы, образованные из 147 пар оснований ДНК, расположенных вокруг белкового ядра гистонов [68]. Нуклеосомы высвобождаются в кровоток при апоптотической гибели клеток [69]. Сообщалось о повышенных уровнях нуклеосом при различных состояниях, включая злокачественные новообразования, церебральный инсульт, сепсис и септический шок [70]. Повышенный уровень гистонов в плазме крови наблюдается у больных с сепсисом и ДВС-синдромом и положительно коррелирует со смертностью [71]. В доклинической модели внеклеточные гистоны запускали агрегацию тромбоцитов, приводя к коагулопатии потребления, тромбозу и кровотечению. Протромботическое действие гистонов ингибируется рекомбинантным тромбомодулином, который используется в терапевтических целях при ДВС-синдроме. Помимо того, что уровни гистонов являются биомаркерами повреждения эндотелия и активации гемостаза, они связаны с показателями по шкале SOFA[72]. Бесклеточная ДНК плазмы продемонстрировала высокую прогностическую ценность у пациентов с тяжелым сепсисом, превосходящую полиорганную дисфункцию и оценку по шкале APACHE II [73]. NET представляют собой внеклеточные компоненты нейтрофилов, образованные ДНК, гистонами и гранулярными белками, и проявляют значительные протромботические и провоспалительные свойства [74].
6.3. Измерение антикоагулянтных белков
Антитромбин является одним из важнейших физиологических антикоагулянтов и ингибирует внутренние (фактор XIa), внешние (фактор VIIa) и общие пути свертывания крови (фактор Ха, тромбин). При сепсисе и ДВС-синдроме уровни антитромбина снижаются из-за сниженного синтеза, повышенной деградации нейтрофильной эластазой и избыточного потребления в результате повышенного образования тромбина [75]. Снижение уровня антитромбина связано с тяжестью заболевания при сепсис-индуцированном ДВС-синдроме [76]. Сообщалось о снижении активности антитромбина ниже 80% у пациентов с сепсисом без полиорганной дисфункции [77]. Этот уровень достигает 60% у пациентов с полиорганной дисфункцией, тогда как прогрессирование ДВС-синдрома приводит к дальнейшему снижению активности антитромбина примерно до 40%. Повышенная смертность была продемонстрирована при низком уровне антитромбина у взрослых и детей с сепсисом [78,79].
Другой антикоагулянтный белок, протеин С, естественным образом активируется для ингибирования образования тромбина как внешним, так и внутренним путями [6]. Сепсис характеризуется истощением протеина С и нарушением продукции активированного протеина С, что делает их уровни потенциальными прогностическими биомаркерами в этой ситуации [80]. Активированный протеин С связывается со своим эндотелиальным рецептором (EPCR), который высвобождается в кровоток после повреждения клеток. Этот растворимый EPCR также изучался как показатель прогрессирования заболевания и исхода у пациентов с сепсисом [81].
Тромбомодулин представляет собой антикоагулянтный белок, продуцируемый эндотелиальными клетками, и связывается с тромбином, превращая протеин С в его активированную форму [82]. Тромбомодулин играет ключевую противовоспалительную, антикоагулянтную и антифибринолитическую роль. Он ингибирует адгезию лейкоцитов к эндотелиальным клеткам, предотвращает активацию комплемента, изменяет генерацию цитокинов и разрушает HMGB1 [83]. Тромбомодулин расщепляется нейтрофильной эластазой и циркулирует в растворимой форме [84]. Высокий уровень тромбомодулина в плазме коррелирует с повышенной смертностью у пациентов с сепсисом и ДВС-синдромом [85]. При сепсис-индуцированном ДВС-синдроме наблюдается повышение уровня растворимого тромбомодулина в плазме с сопутствующим снижением эндотелиального поверхностного тромбомодулина [86].
Природный антикоагулянт - ингибитор пути тканевого фактора (TFPI) ингибирует активацию тканевого фактора и внешний путь свертывания крови. Истощение TFPI связано с повышенной предрасположенностью к развитию ДВС-синдрома [6]. TFPI связывается с эндотелиальными гепариноподобными молекулами, и его циркулирующие уровни ниже по сравнению с антитромбином и активированным протеином С. Более того, значительная часть TFPIинактивируется путем связывания с липопротеином. Следовательно, TFPI не стал чувствительным маркером ДВС-синдрома.
6.4. Другие представляющие интерес маркеры
Комплекс тромбин-антитромбин (ТАТ) является маркером образования тромбина, который можно использовать для выявления пациентов с ДВС-синдромом, поскольку избыточное образование тромбина является ключевым признаком этого состояния [46]. Сообщалось о более высоких уровнях ТАТ у пациентов с ДВС-синдромом при поступлении или у тех, у кого развился ДВС-синдром, по сравнению с пациентами без ДВС-синдрома [87]. Повышенные уровни ТАТ коррелировали с повышенной смертностью у пациентов с сепсисом [26]. Комбинация ТАТ с другими маркерами имеет более высокую прогностическую ценность, чем каждая молекула в отдельности.
Хотя фибринолиз нарушен при сепсис-индуцированном ДВС-синдроме, это не определяется текущими параметрами коагуляции. Антифибринолитический белок PAI-1 широко исследовался в качестве потенциального маркера гипофибринолиза у септических пациентов с ДВС-синдромом [46]. Уровни PAH-1 могут идентифицировать пациентов с ДВС-синдромом и прогнозировать развитие ДВС-синдрома [88,89]. Как и в случае с TAT, сочетание PAI-1 с другими биомаркерами повышало эффективность PAI-1 [26]. Высокий PAI-1 был связан с повышенным риском смертности [90].
Эндогенный тромбиновый потенциал — анализ, указывающий на образование тромбина, также оценивали при сепсисе. Результаты были противоречивыми, и необходимы дальнейшие исследования. Однако недавние данные свидетельствуют о корреляции между усилением тяжести инфекции и снижением способности к образованию тромбина [91]. Этот биомаркер, возможно, может служить для прогнозирования развития полиорганной дисфункции и неблагоприятного исхода у пациентов с сепсисом [92].
Фрагмент протромбина 1.2 (F1.2) представляет собой пептид, образующийся при превращении протромбина в тромбин [93]. Его использование в качестве маркера образования тромбина было опубликовано и включено в критерии ДВС-синдрома Японского общества тромбоза и гемостаза (JSTH) [94].
ADAMTS-13 представляет собой расщепляющую фактор фон Виллебранда протеазу, которая регулирует размер мультимеров фактора фон Виллебранда [95]. Расщепление мультимеров фон Виллебранда снижает их протромботические свойства, поскольку более крупные молекулы обладают повышенной гемостатической способностью [96]. Дефицит ADAMTS-13, приводящий к формированию сверхбольших мультимеров фактора фон Виллебранда и тромботической микроангиопатии при сепсисе, был связан с тяжестью сепсиса и неблагоприятным прогнозом.
Четырнадцать традиционных и нетрадиционных биомаркеров, включая число тромбоцитов, протромбиновое время, аЧТВ, фибриноген, ПДФ, ТАТ, протеин С, плазминоген и PAI-1, были оценены для ранней диагностики ДВС-синдрома в исследовании Koyama et al. [26]. ТАТ, ИАП-1 и протеин С при поступлении хорошо дифференцировали пациентов с явным ДВС-синдромом и без него, в то время как ТАТ и ИАП-1 также были значимыми предикторами 28-дневной смертности. Помимо предсказания прогноза, определенные маркеры могут дополнительно использоваться для мониторинга лечения пациентов с ДВС-синдромом [15]. Кроме того, некоторые из них, включая антитромбин и рекомбинантный растворимый тромбомодулин, также были изучены и использованы для лечения ДВС-синдрома.
7. От руководств к клинической практике
В настоящее время не существует устоявшейся терапии сепсис-индуцированной коагулопатии. Недавно были опубликованы рекомендации Surviving Sepsis Campaign по лечению сепсиса и септического шока [97]. На основании этих рекомендаций фармакологическая тромбопрофилактика низкомолекулярным гепарином настоятельно рекомендуется пациентам с сепсисом или септическим шоком. Более того, в последних рекомендациях Japanese SurvivingSepsis Campaign от 2020 г. рекомендуется раннее выявление ДВС-синдрома, а использование антикоагулянтов при сепсис-ассоциированном ДВС-синдроме носит характер слабой рекомендации [98].
Было оценено несколько стратегий лечения сепсис-индуцированной коагулопатии, в основном направленных на подавление протромботических эффектов, таких как введение гепарина/гепариноидов или белков-антикоагулянтов (Table 2) [99, 100]. Эффективность рекомбинантного тромбомодулина при сепсис-индуцированной коагулопатии была недавно оценена в многонациональном рандомизированном контролируемом исследовании III фазы (включая пациентов с числом тромбоцитов < 50 109/л и протромбиновым временем > 1,4). Авторы этого исследования сообщили, что 28-дневная смертность уменьшилась на 2,6% у 800 пациентов с сепсисом, хотя эта разница в уровне смертности не была статистически значимой. [101].

За последние несколько лет несколько антикоагулянтов, в том числе антитромбин, были испытаны в попытке снизить смертность у пациентов с сепсисом; однако в значительной степени они не доказали свою эффективность [101]. Однако следует отметить, что все эти исследования были нацелены на пациентов с сепсисом, а не на пациентов с сепсис-индуцированной коагулопатии. Использование антитромбина не рекомендуется международными рекомендациями по сепсису. Напротив, постфактум анализ баз данных показал благотворное влияние антикоагулянтов на определенные подгруппы пациентов с сепсисом с ДВС-синдромом [102]. Возможное объяснение этого несоответствия заключается в неоднородности пациентов и сроках лечения антикоагулянтами в крупномасштабных исследованиях. Принципы персонифицированной медицины следует применять для выбора подходящих кандидатов на антикоагулянтную терапию среди пациентов с сепсисом.
8. Выводы
В этом обновленном обзоре объединены все современные знания о патогенезе сепсис-индуцированной коагулопатии, а также все последние обновления, касающиеся диагностических критериев сепсис-индуцированной коагулопатии, основанные на данных международных научных обществ. Кроме того, этот всеобъемлющий обзор включает подробное обсуждение всех традиционных и нетрадиционных биомаркеров сепсис-индуцированной коагулопатии. Сепсис-индуцированная коагулопатия часто осложняет течение болезни, обусловливает потенциально неблагоприятные исходы и повышенную смертность. Гиперкоагуляция является хорошо установленным патофизиологическим признаком сепсис-индуцированной коагулопатии со сдвигом в сторону гипокоагуляции только на поздних стадиях сепсиса, после развития ДВС-синдрома. Традиционные тесты на коагуляцию могут выявить гипокоагуляцию на поздней стадии, но не чувствительны к выявлению данных изменений на ранней стадии. Существует пробел в диагностике расстройств гемостаза при сепсисе. Определение сепсис-индуцированной коагулопатии было введено, чтобы помочь идентифицировать нарушения коагуляции у пациентов с сепсисом до установления ДВС-синдрома, на ранних стадиях, которые можно было бы обратить вспять с помощью терапевтических вмешательств. В этом контексте изучение новых специализированных тестов, таких как тромбоэластометрия, имеет важное значение для пациентов с тяжелым сепсисом, поскольку это может обосновать раннее лечение в фазу гиперкоагуляции. Необходимы дальнейшие исследования диагностических биомаркеров и их потенциальных комбинаций для повышения точности диагностики.
References
1. Singer, M.; Deutschman, C.S.; Seymour, C.W.; Shankar-Hari, M.; Annane, D.; Bauer, M.; Bellomo, R.; Bernard, G.R.; Chiche, J.-D.; Coopersmith, C.M.; et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315, 801–810.[CrossRef]
2. Giustozzi, M.; Ehrlinder, H.; Bongiovanni, D.; Borovac, J.A.; Guerreiro, R.A.; Ga˛secka, A.; Papakonstantinou, P.E.; Parker, W.A. Coagulopathy and sepsis: Pathophysiology, clinical manifestations and treatment. Blood Rev. 2021, 50, 100864. [CrossRef] [PubMed]
3. Martin, G.S.; Mannino, D.M.; Eaton, S.; Moss, M. The Epidemiology of Sepsis in the United States from 1979 through 2000. N. Engl. J. Med. 2003, 348, 1546–1554. [CrossRef] [PubMed]
4. Cecconi, M.; Evans, L.; Levy, M.; Rhodes, A. Sepsis and septic shock. Lancet 2018, 392, 75–87.[CrossRef]
5. Levi, M.; van der Poll, T. Coagulation and sepsis. Thromb. Res. 2017, 149, 38–44. [CrossRef][PubMed]
6. Sungurlu, S.; Kuppy, J.; Balk, R.A. Role of Antithrombin III and Tissue Factor Pathway in thePathogenesis of Sepsis. Crit. Care Clin. 2020, 36, 255–265. [CrossRef] [PubMed]
7. Denning, N.-L.; Aziz, M.; Gurien, S.D.; Wang, P. DAMPs and NETs in Sepsis. Front. Immunol.2019, 10, 2536. [CrossRef] [PubMed]
8. Levi, M.; van der Poll, T. Inflammation and coagulation. Crit. Care Med. 2010, 38, S26–S34.[CrossRef]
9. Levi, M.; Poll, T. Coagulation in patients with severe sepsis. Semin. Thromb. Hemost. 2015, 41,9–15. [CrossRef]
10. Gando, S. Role of Fibrinolysis in Sepsis. Semin. Thromb. Hemost. 2013, 39, 392–399.[CrossRef]
11. Degen, J.L.; Bugge, T.H.; Goguen, J.D. Fibrin and fibrinolysis in infection and host defense. J. Thromb. Haemost. 2007, 5, 24–31. [CrossRef] [PubMed]
12. Bergmann, S.; Hammerschmidt, S. Fibrinolysis and host response in bacterial infections.Thromb. Haemost. 2007, 98, 512–520. [CrossRef]
13. Petros, S.; Kliem, P.; Siegemund, T. Thrombin generation in severe sepsis. Thromb. Res. 2012,129, 797–800. [CrossRef]
14. Coughlin, S.R. Thrombin signalling and protease-activated receptors. Nature 2000, 407, 258–264. [CrossRef] [PubMed]
15. Iba, T.; Ito, T.; Maruyama, I.; Jilma, B.; Brenner, T.; Müller, M.C.; Juffermans, N.P.; Thachil, J. Potential diagnostic markers for disseminated intravascular coagulation of sepsis. Blood Rev.2016, 30, 149–155. [CrossRef]
16. Yuksel, M.; Okajima, K.; Uchiba, M.; Horiuchi, S.; Okabe, H. Activated protein C inhibits lipopolysaccharide-induced tumor necrosis factor-alpha production by inhibiting activation of both nuclear factor-kappa B and activator protein-1 in human monocytes. Thromb. Haemost.2002, 88, 267–273. [CrossRef] [PubMed]
17. Wheeler, A.P.; Bernard, G.R. Treating Patients with Severe Sepsis. N. Engl. J. Med. 1999, 340,207–214. [CrossRef] [PubMed]
18. Taylor, F.B.; Toh, C.H.; Hoots, W.K.; Wada, H.; Levi, M. Towards definition, clinical andlaboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb.Haemost. 2001, 86, 1327–1330. [CrossRef]
19. Gando, S.; Levi, M.; Toh, C.H. Disseminated intravascular coagulation. Nat. Rev. Dis. Primers2016, 2, 16037. [CrossRef]
20. Iba, T.; Levy, J.H. Sepsis-induced Coagulopathy and Disseminated Intravascular Coagulation. Anesthesiology 2020, 132, 1238–1245. [CrossRef]
21. Iba, T.; Levy, J.H.; Warkentin, T.E.; Thachil, J.; van der Poll, T.; Levi, M. Diagnosis and management of sepsis-induced coagulopathy and disseminated intravascular coagulation. J.Thromb. Haemost. 2019, 17, 1989–1994. [CrossRef] [PubMed]
22. Gando, S.; Iba, T.; Eguchi, Y.; Ohtomo, Y.; Okamoto, K.; Koseki, K.; Mayumi, T.; Murata, A.; Ikeda, T.; Ishikura, H.; et al. A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: Comparing current criteria. Crit. Care Med. 2006, 34, 625–631. [CrossRef] [PubMed]
23. Levi, M.; Sivapalaratnam, S. Disseminated intravascular coagulation: An update on pathogenesisand diagnosis. Expert Rev.
Hematol. 2018, 11, 663–672. [CrossRef] [PubMed]
24. Iba, T.; Levi, M.; Levy, J.H. Sepsis-Induced Coagulopathy and Disseminated Intravascular Coagulation. Semin. Thromb. Hemost.
2020, 46, 089–095. [CrossRef]
25. Iba, T.; Di Nisio, M.; Levy, J.H.; Kitamura, N.; Thachil, J. New criteria for sepsis-inducedcoagulopathy (SIC) following the revised sepsis definition: A retrospective analysis of anationwide survey. BMJ Open 2017, 7, e017046. [CrossRef]
26. Koyama, K.; Madoiwa, S.; Nunomiya, S.; Koinuma, T.; Wada, M.; Sakata, A.; Ohmori, T.;Mimuro, J.; Sakata, Y. Combination of thrombin-antithrombin complex, plasminogen activatorinhibitor-1, and protein C activity for early identification of severe coagulopathy in initial phaseof sepsis: A prospective observational study. Crit. Care 2014, 18, R13. [CrossRef] [PubMed]
27. Hack, C.E. Fibrinolysis in Disseminated Intravascular Coagulation. Semin. Thromb. Hemost.2001, 27, 633–638. [CrossRef]
28. Engelmann, B.; Massberg, S. Thrombosis as an intravascular effector of innate immunity. Nat. Rev. Immunol. 2013, 13, 34–45. [CrossRef]
29. Schmitt, F.C.F.; Manolov, V.; Morgenstern, J.; Fleming, T.; Heitmeier, S.; Uhle, F.; Al-Saeedi, M.;Hackert, T.; Bruckner, T.; Schöchl, H.; et al. Acute fibrinolysis shutdown occurs early in septic shock and is associated with increased morbidity and mortality: Results of an observational pilotstudy. Ann. Intensive Care 2019, 9, 19. [CrossRef]
30. Asakura, H. Classifying types of disseminated intravascular coagulation: Clinical and animalmodels. J. Intensive Care 2014, 2, 20.
[CrossRef]
31. Iba, T.; Di Nisio, M.; Thachil, J.; Wada, H.; Asakura, H.; Sato, K.; Saitoh, D. A Proposal of the Modification of Japanese Society on Thrombosis and Hemostasis (JSTH) Disseminated Intravascular Coagulation (DIC) Diagnostic Criteria for Sepsis-Associated DIC. Clin. Appl.Thromb. 2018, 24, 439–445. [CrossRef]
32. Iba, T.; Arakawa, M.; Di Nisio, M.; Gando, S.; Anan, H.; Sato, K.; Ueki, Y.; Levy, J.H.; Thachil, J. Newly Proposed Sepsis-Induced Coagulopathy Precedes International Society on Thrombosisand Haemostasis Overt-Disseminated Intravascular Coagulation and Predicts High Mortality. J.Intensive Care Med. 2020, 35, 643–649. [CrossRef] [PubMed]
33. Iba, T.; Arakawa, M.; Levy, J.H.; Yamakawa, K.; Koami, H.; Hifumi, T.; Sato, K. Sepsis-Induced Coagulopathy and Japanese Association for Acute Medicine DIC in Coagulopathic Patients with Decreased Antithrombin and Treated by Antithrombin. Clin. Appl. Thromb. 2018, 24, 1020–1026. [CrossRef] [PubMed]
34. Yamakawa, K.; Yoshimura, J.; Ito, T.; Hayakawa, M.; Hamasaki, T.; Fujimi, S. External Validation of the Two Newly Proposed Criteria for Assessing Coagulopathy in Sepsis. Thromb.Haemost. 2019, 119, 203–212. [CrossRef] [PubMed]
35. Folman, C.C.; Linthorst, G.E.; van Mourik, J.; van Willigen, G.; de Jonge, E.; Levi, M.; von dem Borne, A.E. Platelets release thrombopoietin (Tpo) upon activation: Another regulatory loop in thrombocytopoiesis? Thromb. Haemost. 2000, 83, 923–930. [CrossRef]
36. Shannon, O. The role of platelets in sepsis. Res. Pract. Thromb. Haemost. 2020, 5, 27–37.[CrossRef]
37. Venkata, C.; Kashyap, R.; Farmer, J.C.; Afessa, B. Thrombocytopenia in adult patients withsepsis: Incidence, risk factors, and its association with clinical outcome. J. Intensive Care 2013,1, 9. [CrossRef] [PubMed]
38. Vanderschueren, S.; De Weerdt, A.; Malbrain, M.; Vankersschaever, D.; Frans, E.; Wilmer, A.;Bobbaers, H. Thrombocytopenia and prognosis in intensive care. Crit. Care Med. 2000, 28,1871–1876. [CrossRef]
39. Gawaz, M.; Fateh-Moghadam, S.; Pilz, G.; Gurland, H.-J.; Werdan, K. Platelet activation andinteraction with leucocytes in patients with sepsis or multiple organ failure. Eur. J. Clin.Investig. 1995, 25, 843–851. [CrossRef]
40. Hamzeh-Cognasse, H.; Damien, P.; Chabert, A.; Pozzetto, B.; Cognasse, F.; Garraud, O.Platelets and Infections—Complex Interactions with Bacteria. Front. Immunol. 2015, 6, 82.[CrossRef]
41. Hubert, R.M.E.; Rodrigues, M.V.; Andreguetto, B.D.; Santos, T.M.; Gilberti, M.D.F.P.; de Castro,V.; Annichino-Bizzacchi, J.M.; Dragosavac, D.; Carvalho-Filho, M.A.; De Paula, E.V. Association of the immature platelet fraction with sepsis diagnosis and severity. Sci. Rep. 2015,5, srep08019. [CrossRef] [PubMed]
42. Horan, J.T.; Francis, C.W. Fibrin Degradation Products, Fibrin Monomer and Soluble Fibrin in Disseminated Intravascular Coagulation. Semin. Thromb. Hemost. 2001, 27, 657–666.[CrossRef] [PubMed]
43. Semeraro, F.; Ammollo, C.T.; Caironi, P.; Masson, S.; Latini, R.; Panigada, M.; Colucci, M. Low D-dimer levels in sepsis: Good or bad? Thromb. Res. 2019, 174, 13–15. [CrossRef]
44. Favresse, J.; Lippi, G.; Roy, P.M.; Chatelain, B.; Jacqmin, H.; Ten Cate, H.; Mullier, F. D-dimer:Preanalytical, analytical, postanalytical variables, and clinical applications. Crit. Rev. Clin. Lab.Sci. 2018, 55, 548–577. [CrossRef]
45. Toh, J.M.; Ken-Dror, G.; Downey, C.; Abrams, S.T. The clinical utility of fibrin-relatedbiomarkers in sepsis. Blood Coagul. Fibrinolysis 2013, 24, 839–843. [CrossRef]
46. Adelborg, K.; Larsen, J.B.; Hvas, A. Disseminated intravascular coagulation: Epidemiology,biomarkers, and management. Br. J. Haematol. 2021, 192, 803–818. [CrossRef] [PubMed]
47. Levi, M.; Meijers, J.C. DIC: Which laboratory tests are most useful. Blood Rev. 2011, 25, 33–37.[CrossRef]
48. Kamal, A.H.; Tefferi, A.; Pruthi, R.K. How to Interpret and Pursue an Abnormal Prothrombin Time, Activated Partial Thrombo- plastin Time, and Bleeding Time in Adults. Mayo Clin. Proc.2007, 82, 864–873. [CrossRef]
49. Scarlatescu, E.; Juffermans, N.P.; Thachil, J. The current status of viscoelastic testing in septiccoagulopathy. Thromb. Res. 2019,
183, 146–152. [CrossRef]
50. Görlinger, K.; Pérez-Ferrer, A.; Dirkmann, D.; Saner, F.; Maegele, M.; Calatayud, Á.A.P.; Kim, T.-Y. The role of evidence-based algorithms for rotational thromboelastometry-guided bleedingmanagement. Korean J. Anesthesiol. 2019, 72, 297–322. [CrossRef]
51. Georgiadou, P.; Sokou, R.; Tsantes, A.G.; Parastatidou, S.; Konstantinidi, A.; Houhoula, D.;Kokoris, S.; Iacovidou, N.; Tsantes,
A.E. The Non-Activated Thromboelastometry (NATEM) Assay’s Application among Adults andNeonatal/Pediatric Population: A Systematic Review. Diagnostics 2022, 12, 658. [CrossRef][PubMed]
52. Sokou, R.; Ioakeimidis, G.; Piovani, D.; Parastatidou, S.; Konstantinidi, A.; Tsantes, A.G.;Lampridou, M.; Houhoula, D.; Iacovidou, N.; Kokoris, S.; et al. Development and validation of asepsis diagnostic scoring model for neonates with suspected sepsis. Front. Pediatr. 2022, 10,1004727. [CrossRef] [PubMed]
53. Sokou, R.; Tritzali, M.; Piovani, D.; Konstantinidi, A.; Tsantes, A.G.; Ioakeimidis, G.; Lampridou, M.; Parastatidou, S.; Iacovidou, N.; Kokoris, S.; et al. Comparative Performance ofFour Established Neonatal Disease Scoring Systems in Predicting In-Hospital Mortality and thePotential Role of Thromboelastometry. Diagnostics 2021, 11, 1955. [CrossRef] [PubMed]
54. Tsantes, A.G.; Sokou, R.; Konstantinidi, A.; Ioakeimidis, G.; Lampridou, M.; Parastatidou, S.;Theodoraki, M.; Piovani, D.; Iliodromiti, Z.; Boutsikou, T.; et al. Rotational Thromboelastometry in Neonates Admitted to a Neonatal Intensive Care Unit: A Large Cross-sectional Study. Semin.Thromb. Hemost. 2021, 47, 875–884. [CrossRef] [PubMed]
55. Müller, M.C.; Meijers, J.C.; Vroom, M.B.; Juffermans, N.P. Utility of thromboelastography and/or thromboelastometry in adults with sepsis: A systematic review. Crit. Care 2014, 18, R30.[CrossRef] [PubMed]
56. Hu, Y.L.; McRae, H.L.; Refaai, M.A. Efficacy of viscoelastic hemostatic assay testing in patients with sepsis-induced disseminated intravascular coagulation. Eur. J. Haematol. 2021, 106, 873–875. [CrossRef]
57. Katsaras, G.; Sokou, R.; Tsantes, A.G.; Piovani, D.; Bonovas, S.; Konstantinidi, A.; Ioakeimidis,G.; Parastatidou, S.; Gialamprinou, D.; Makrogianni, A.; et al. The use of thromboelastography (TEG) and rotational thromboelastometry (ROTEM) in neonates: A systematic review. Eur. J.Pediatr. 2021, 180, 3455–3470. [CrossRef]
58. Lampridou, M.; Sokou, R.; Tsantes, A.G.; Theodoraki, M.; Konstantinidi, A.; Ioakeimidis, G.; Bonovas, S.; Politou, M.; Valsami, S.; Iliodromiti, Z.; et al. ROTEM diagnostic capacity formeasuring fibrinolysis in neonatal sepsis. Thromb. Res. 2020, 192, 103–108. [CrossRef]
59. Adamik, B.; Gozdzik, W.; Jakubczyk, D.; Welna, M.; Kübler, A. Coagulation abnormalities identified by thromboelastometry in patients with severe sepsis: The relationship to endotoxemiaand mortality. Blood Coagul. Fibrinolysis 2017, 28, 163–170. [CrossRef]
60. Sivula, M.; Pettilä, V.; Niemi, T.T.; Varpula, M.; Kuitunen, A.H. Thromboelastometry inpatients with severe sepsis and dissemi- nated intravascular coagulation. Blood Coagul.Fibrinolysis 2009, 20, 419–426. [CrossRef]
61. Davies, G.R.; Lawrence, M.; Pillai, S.; Mills, G.M.; Aubrey, R.; Thomas, D.; Williams, R.;Morris, K.; Evans, P.A. The effect of sepsis and septic shock on the viscoelastic properties of clot quality and mass using rotational thromboelastometry: A prospective observational study. J.Crit. Care 2018, 44, 7–11. [CrossRef] [PubMed]
62. Sharma, P.; Saxena, R. A Novel Thromboelastographic Score to Identify Overt DisseminatedIntravascular Coagulation Resulting in a Hypocoagulable State. Am. J. Clin. Pathol. 2010, 134,97–102. [CrossRef] [PubMed]
63. Koami, H.; Sakamoto, Y.; Ohta, M.; Goto, A.; Narumi, S.; Imahase, H.; Inoue, S. Can rotational thromboelastometry predict septic disseminated intravascular coagulation? Blood Coagul.Fibrinolysis 2015, 26, 778–783. [CrossRef]
64. Li, Y.; Wan, D.; Luo, X.; Song, T.; Wang, Y.; Yu, Q.; Jiang, L.; Liao, R.; Zhao, W.; Su, B.Circulating Histones in Sepsis: Potential Outcome Predictors and Therapeutic Targets. Front.Immunol. 2021, 12, 650184. [CrossRef] [PubMed]
65. Andersson, U.; Tracey, K.J. HMGB1 Is a Therapeutic Target for Sterile Inflammation andInfection. Annu. Rev. Immunol. 2011, 29,
139–162. [CrossRef]
66. Ito, T.; Kawahara, K.; Nakamura, T.; Yamada, S.; Nakamura, T.; Abeyama, K.; Hashiguchi, T.; Maruyama, I. High-mobility group box 1 protein promotes development of microvascularthrombosis in rats. J. Thromb. Haemost. 2007, 5, 109–116. [CrossRef]
67. Hatada, T.; Nobori, T.; Okabayashi, K.; Maruyama, K.; Abe, Y.; Uemoto, S.; Yamada, S.;Maruyama, I.; Wada, H. Plasma concentrations and importance of high mobility group box protein in the prognosis of organ failure in patients with disseminated intravascular coagulation.Thromb. Haemost. 2005, 94, 975–979. [CrossRef] [PubMed]
68. Morimont, L.; Dechamps, M.; David, C.; Bouvy, C.; Gillot, C.; Haguet, H.; Favresse, J.;Ronvaux, L.; Candiracci, J.; Herzog, M.; et al. NETosis and Nucleosome Biomarkers in Septic Shock and Critical COVID-19 Patients: An Observational Study. Biomolecules 2022, 12, 1038.[CrossRef]
69. Chen, Q.; Ye, L.; Jin, Y.; Zhang, N.; Lou, T.; Qiu, Z.; Jin, Y.; Cheng, B.; Fang, X. Circulatingnucleosomes as a predictor of sepsis and organ dysfunction in critically ill patients. Int. J. Infect.Dis. 2012, 16, e558–e564. [CrossRef]
70. Xu, J.; Zhang, X.; Pelayo, R.; Monestier, M.; Ammollo, C.T.; Semeraro, F.; Taylor, F.B.; Esmon, N.L.; Lupu, F.; Esmon, C.T. Extracellular histones are major mediators of death in sepsis. Nat.Med. 2009, 15, 1318–1321. [CrossRef]
71. Nakahara, M.; Ito, T.; Kawahara, K.-I.; Yamamoto, M.; Nagasato, T.; Shrestha, B.; Yamada, S.;Miyauchi, T.; Higuchi, K.; Takenaka, T.; et al. Recombinant Thrombomodulin Protects Miceagainst Histone-Induced Lethal Thromboembolism. PLoS ONE 2013, 8, e75961. [CrossRef][PubMed]
72. Abrams, S.T.; Zhang, N.; Manson, J.; Liu, T.; Dart, C.; Baluwa, F.; Toh, C.H. Circulating histones are mediators of trauma-associated lung injury. Am. J. Respir. Crit. Care Med. 2013,187, 160–169. [CrossRef] [PubMed]
73. Dwivedi, D.J.; Toltl, L.J.; Swystun, L.L.; Pogue, J.; Liaw, K.-L.; Weitz, J.I.; Cook, D.J.; Fox-Robichaud, A.E.; Liaw, P.C.; Canadian Critical Care Translational Biology Group. Prognosticutility and characterization of cell-free DNA in patients with severe sepsis. Crit. Care 2012, 16,R151. [CrossRef] [PubMed]
74. Iba, T.; Levy, J.H. Inflammation and thrombosis: Roles of neutrophils, platelets and endothelial cells and their interactions in thrombus formation during sepsis. J. Thromb. Haemost. 2018, 16, 231–241. [CrossRef]
75. Levi, M.; de Jonge, E.; van der Poll, T. Rationale for restoration of physiological anticoagulantpathways in patients with sepsis and disseminated intravascular coagulation. Crit. Care Med.2001, 29, S90–S94. [CrossRef]
76. Levi, M.M.; Toh, C.H.; Thachil, J.; Watson, H.G. Guidelines for the diagnosis and management of disseminated intravascular coagulation. British Committee for Standards in Haematology. Br.J. Haematol. 2009, 145, 24–33. [CrossRef]
77. Iba, T.; Kidokoro, A.; Yagi, Y. The Role of the Endothelium in Changes in ProcoagulantActivity in Sepsis. J. Am. Coll. Surg. 1998,
187, 321–329. [CrossRef]
78. Warren, B.L.; Eid, A.; Singer, P.; Pillay, S.S.; Carl, P.; Novak, I.; Chalupa, P.; Atherstone, A.; Pénzes, I.; Kübler, A.; et al. High-dose antithrombin III in severe sepsis: A randomizedcontrolled trial. JAMA 2001, 286, 1869–1878. [CrossRef]
79. Niederwanger, C.; Hell, T.; Hofer, S.; Salvador, C.; Michel, M.; Schenk, B.; Treml, B.; Bachler, M. Antithrombin deficiency is associated with mortality and impaired organ function in septicpediatric patients: A retrospective study. PeerJ 2018, 6, e5538. [CrossRef]
80. Martí-Carvajal, A.J.; Solà, I.; Gluud, C.; Lathyris, D.; Anand, V. Human recombinant protein C for severe sepsis and septic shock in adult and paediatric patients. Cochrane Database Syst. Rev.2012, 12, CD004388. [CrossRef]
81. Guitton, C.; Gérard, N.; Sébille, V.; Bretonnière, C.; Zambon, O.; Villers, D.; Charreau, B. Early rise in circulating endothelial protein C receptor correlates with poor outcome in severe sepsis.Intensive Care Med. 2011, 37, 950–956. [CrossRef]
82. Huang, M.; Cai, S.; Su, J. The Pathogenesis of Sepsis and Potential Therapeutic Targets. Int. J. Mol. Sci. 2019, 20, 5376. [CrossRef] [PubMed]
83. Conway, E.M. Thrombomodulin and its role in inflammation. Semin. Immunopathol. 2011, 34,107–125. [CrossRef] [PubMed]
84. Furuno, T.; Mitsuyama, T.; Hidaka, K.; Tanaka, T.; Hara, N. The Role of Neutrophil Elastase in Human Pulmonary Artery Endothelial Cell Injury. Int. Arch. Allergy Immunol. 1997, 112, 262–269. [CrossRef] [PubMed]
85. Kinasewitz, G.T.; Yan, S.B.; Basson, B.; Comp, P.; Russell, J.A.; Cariou, A.; Um, S.L.; Utterback, B.; Laterre, P.-F.; Dhainaut, J.-F. Universal changes in biomarkers of coagulation andinflammation occur in patients with severe sepsis, regardless of causative micro-organism [ISRCTN74215569]. Crit. Care 2004, 8, R82–R90. [CrossRef]
86. Boehme, M.W.; Deng, Y.; Raeth, U.; Bierhaus, A.; Ziegler, R.; Stremmel, W.; Nawroth, P.P. Release of thrombomodulin from endothelial cells by concerted action of TNF-alpha andneutrophils: In vivo and in vitro studies. Immunology 1996, 87, 134–140.
87. Kushimoto, S.; Wada, H.; Kawasugi, K.; Okamoto, K.; Uchiyama, T.; Seki, Y.; Hatada, T.; Imai,H.; Nobori, T.; Subcommittee,
J.S.O.T.H. Increased Ratio of Soluble Fibrin Formation/Thrombin Generation in Patients WithDIC. Clin. Appl. Thromb. 2012, 18, 628–632. [CrossRef]
88. Mei, H.; Jiang, Y.; Luo, L.; Huang, R.; Su, L.; Hou, M.; Wang, X.; Deng, J.; Hu, Y. Evaluation the combined diagnostic value of TAT, PIC, tPAIC, and sTM in disseminated intravascular coagulation: A multi-center prospective observational study. Thromb. Res. 2018, 173, 20–26.[CrossRef]
89. Hoshino, K.; Kitamura, T.; Nakamura, Y.; Irie, Y.; Matsumoto, N.; Kawano, Y.; Ishikura, H. Usefulness of plasminogen activator inhibitor-1 as a predictive marker of mortality in sepsis. J.Intensive Care 2017, 5, 67. [CrossRef]
90. Tipoe, T.L.; Wu, W.K.K.; Chung, L.; Gong, M.; Dong, M.; Liu, T.; Roever, L.; Ho, J.; Wong, M.C.S.; Chan, M.T.V.; et al. Plasminogen Activator Inhibitor 1 for Predicting Sepsis Severity and Mortality Outcomes: A Systematic Review and Meta-Analysis. Front. Immunol. 2018, 9,1218. [CrossRef]
91. Elad, B.; Avraham, G.; Schwartz, N.; Elias, A.; Elias, M. Role of a thrombin generation assay inthe prediction of infection severity.
Sci. Rep. 2021, 11, 7814. [CrossRef]
92. Mihajlovic, D.; Brkic, S.; Lendak, D.; Mikic, A.N.; Draskovic, B.; Mitic, G. Endogenousthrombin potential as marker of procoagulant response that can be useful in early stage of sepsis.Blood Coagul. Fibrinolysis 2017, 28, 460–467. [CrossRef] [PubMed]
93. Levi, M.; Vincent, J.-L.; Tanaka, K.; Radford, A.H.; Kayanoki, T.; Fineberg, D.A.;Hoppensteadt, D.; Fareed, J. Effect of a Recombinant Human Soluble Thrombomodulin onBaseline Coagulation Biomarker Levels and Mortality Outcome in Patients with Sepsis-Associated Coagulopathy. Crit. Care Med. 2020, 48, 1140–1147. [CrossRef] [PubMed]
94. Asakura, H.; Takahashi, H.; Uchiyama, T.; Eguchi, Y.; Okamoto, K.; Kawasugi, K.; Madoiwa, S.; Wada, H.; DIC Subcommittee of the Japanese Society on Thrombosis and Hemostasis.Proposal for new diagnostic criteria for DIC from the Japanese Society on Thrombosis andHemostasis. Thromb. J. 2016, 14, 42. [CrossRef] [PubMed]
95. Zheng, X.; Chung, D.; Takayama, T.K.; Majerus, E.M.; Sadler, J.E.; Fujikawa, K. Structure of von Willebrand Factor-cleaving Protease (ADAMTS13), a Metalloprotease Involved in Thrombotic Thrombocytopenic Purpura. J. Biol. Chem. 2001, 276, 41059– 41063. [CrossRef]
96. Levi, M.; Scully, M.; Singer, M. The role of ADAMTS -13 in the coagulopathy of sepsis. J. Thromb. Haemost. 2018, 16, 646–651. [CrossRef]
97. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado, F.R.; Mcintyre, L.; Ostermann, M.; Prescott, H.C.; et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021. Intensive Care Med.2021, 47, 1181–1247. [CrossRef]
98. Egi, M.; Ogura, H.; Yatabe, T.; Atagi, K.; Inoue, S.; Iba, T.; Kakihana, Y.; Kawasaki, T.; Kushimoto, S.; Kuroda, Y.; et al. The Japanese Clinical Practice Guidelines for Management of Sepsis and Septic Shock 2020 (J-SSCG 2020). Acute Med. Surg. 2021, 8, 53. [CrossRef]
99. Inata, Y. Should we treat sepsis-induced DIC with anticoagulants? J. Intensive Care 2020, 8, 18.[CrossRef]
100. Kienast, J.; Juers, M.; Wiedermann, C.J.; Hoffmann, J.N.; Ostermann, H.; Strauss, R.; Keinecke, H.-O.; Warren, B.L.; Opal, S.M.; The KyberSept Investigators. Treatment effects of high-dose antithrombin without concomitant heparin in patients with severe sepsis with or withoutdisseminated intravascular coagulation. J. Thromb. Haemost. 2006, 4, 90–97. [CrossRef]
101. Vincent, J.L.; Francois, B.; Zabolotskikh, I.; Daga, M.K.; Lascarrou, J.B.; Kirov, M.Y.;SCARLET Trial Group. Effect of a recombinant human soluble thrombomodulin on mortality in patients with sepsis-associated coagulopathy: The SCARLET randomized clinical trial. JAMA2019, 321, 1993–2002. [CrossRef] [PubMed]
102. Scarlatescu, E.; Tomescu, D.; Arama, S.S. Review. Anticoagulant Therapy in Sepsis. TheImportance of Timing. J. Crit. Care Med.
2017, 3, 63–69. [CrossRef] [PubMed]
Источник фотоиллюстрации - www.freepik.com
[~DETAIL_TEXT] =>
Tsantes, A.G.; Parastatidou, S.; Tsantes, E.A.; Bonova, E.; Tsante, K.A.; Mantzios, P.G.; Vaiopoulos,A.G.; Tsalas, S.; Konstantinidi, A.; Houhoula, D.; et al. Sepsis-Induced Coagulopathy: An Update on Pathophysiology, Biomarkers, and Current Guidelines.
Life 2023, 13, 350. doi.org/10.3390/life13020350
Абстракт: между воспалением и коагуляцией возникают значительные перекрестные взаимодействия. Таким образом, коагулопатия часто встречается при сепсисе, потенциально ухудшая прогноз. Вначале у пациентов с сепсисом наблюдается протромботическое состояние за счет активации внешнего пути коагуляции, индуцированного цитокинами, подавления антикоагуляции и нарушения фибринолиза. На поздних стадиях сепсиса при развитии диссеминированного внутрисосудистого свертывания крови (ДВС-синдром) наступает гипокоагуляция. Традиционные лабораторные признаки сепсиса, включая тромбоцитопению, увеличение протромбинового времени (ПТВ) и продуктов деградации фибрина (ПДФ), а также снижение фибриногена, обнаруживаются только на поздних стадиях сепсиса. Недавно введенное определение сепсис-индуцированной коагулопатии (SIC) направлено на выявление пациентов на более ранней стадии, когда изменения коагуляционного статуса еще обратимы.
Нетрадиционные анализы, такие как измерение уровня антикоагулянтных белков, а также вискозиметрия обнаружили многообещающую чувствительность и специфичность в выявлении пациентов с риском развития ДВС, что позволяет своевременно проводить коррекцию нарушений гемостаза. В данном обзоре изложены современные представления о патофизиологических механизмах и возможностях диагностики ДВС-синдрома.
Ключевые слова: сепсис; коагуляция; диссеминированное внутрисосудистое свертывание; сепсис-индуцированная коагулопатия; лабораторная оценка; методические рекомендации
1. Введение
Традиционное определение сепсиса — синдром системной воспалительной реакции, вызванный инфекцией. В 2016 году это определение было обновлено Третьим международным консенсусом определений сепсиса и септического шока до «угрожающей жизни дисфункции органов, вызванной дисфункциональным ответом организма на инфекцию» [1]. Текущая концепция подчеркивает риск тяжелого течения заболевания и смертности из-за нерегулируемого ответа на инфекцию а не из-за самой инфекции. Органная дисфункция определяется как увеличение балла по шкале sequential organ failure assessment (SOFA) не менее чем на 2 балла. За последние несколько лет наше понимание механизмов и патофизиологии сепсиса значительно улучшилось, а современные и более эффективные диагностические инструменты находятся в стадии разработки (Figure 1). Однако патобиология сепсиса до конца не выяснена, и не существует золотого стандарта в диагностике. Сепсис - это сложный клинический синдром с распространенностью примерно 2,5 на 1000 человек в западном мире и ежегодным ростом на 8,7% за последние 20 лет, что частично связано со старением населения [2]. Ежегодно диагностируется 19 миллионов случаев сепсиса и почти 5 миллионов смертей, что делает его одной из основных причин смертности во всем мире [3].

Инфекция и, в частности, сепсис вызывают множественные и сложные нарушения во многих системах, включая коагуляционный каскад. У подавляющего большинства пациентов с сепсисом наблюдаются нарушения гемостаза, варьирующие от субклинической коагулопатии до молниеносного ДВС-синдрома [4]. На начальных стадиях инфекции коагуляция действует как естественный защитный механизм, пытаясь локализовать патоген и предотвратить его распространение в системный кровоток. Однако при запущенных и тяжелых инфекциях, таких как сепсис, массовая продукция и выброс в кровоток воспалительных цитокинов приводит к чрезмерной активации процесса свертывания крови, нарушению фибринолиза и подавлению антикоагуляции [5]. Баланс гемостаза при сепсисе значительно нарушен. Процесс коагуляции активируется, а антикоагулянтные механизмы, включая фибринолиз и антикоагулянтные факторы, подавляются (Figure 2). Следовательно, пациенты с сепсисом склонны к протромботическому состоянию через четыре основных механизма: активация внешнего пути, цитокин-индуцированное усиление коагуляции, подавление антикоагулянтных путей и нарушение фибринолиза [6]. Лабораторная оценка нарушений гемостаза при сепсисе основана на стандартных тестах, включая абсолютное количество тромбоцитов, ПТВ, международное нормализованное отношение (МНО), ПДФ, уровень d-димеров и фибриногена, а также нетрадиционные анализы, включая измерение уровней белков-антикоагулянтов и исследования вязкости крови [2].

В этом обзоре изложены современные представления о патофизиологических механизмах коагулопатии, вызванной сепсисом, и диагностических возможностях ее выявления с акцентом на потенциальные представляющие интерес биомаркеры и соответствующие существующие руководства. Это исследование направлено на обзор современной литературы по следующим ключевым вопросам: (1) Каковы основные патогенетические механизмы, участвующие в развитии сепсис-индуцированной коагулопатии (SIC)? (2) Каковы диагностические критерии SIC? (3) Есть ли последние достижения в лабораторной оценке и лечении SIC?
2. Нарушения гемостаза при сепсисе
Путь тканевого фактора является начальным и основным триггером активации свертывания крови при сепсисе. Тканевой фактор располагается в эндотелии сосудов, и его попадание в кровоток при повреждении эндотелия приводит к активации внешнего пути свертывания крови [5]. Однако это не основной активирующий механизм при сепсисе. Тканевой фактор также присутствует в моноцитах и других циркулирующих макрофагах. В случае инфекции эти клетки активируются через паттерн-распознающие рецепторы (PRRs) патоген-ассоциированными молекулярными паттернами (PAMPs) и молекулярным паттернам, ассоциированным с повреждением (DAMPs) [7]. PAMPs представляют собой молекулы, которые циркулируют после уничтожения патогенов или могут высвобождаться живыми патогенами, в то время как DAMPs представляют собой клеточные компоненты хозяина, высвобождаемые при лизисе клеток. PAMPs и DAMPs распознаются и связываются со специфическими поверхностными PRRs в моноцитах и макрофагах. После распознавания PAMPs/DAMPs с помощью PRRs на поверхности моноцитов и макрофагов, эти клетки активируются и высвобождают цитокины и хемокины, которые впоследствии активируют нейтрофилы, тромбоциты и эндотелиальные клетки. Более того, активированные моноциты высвобождают внеклеточные везикулы, которые экспрессируют на своей поверхности прокоагулянтный тканевой фактор и фосфатидилсерин.
Таким образом, тканевой фактор высвобождается в кровоток и активируется внешний путь свертывания крови. Нейтрофилы также играют важную роль в активации каскада свертывания посредством экспрессии тканевого фактора и высвобождения химических медиаторов и белков. Другим важным механизмом, посредством которого нейтрофилы активируют каскад свертывания крови, является высвобождение нейтрофильных внеклеточных ловушек (NETs). NETs представляют собой частицы, состоящие из гистонов, прокоагулянтной ДНК и других DAMP, высвобождаемых после вторжения патогена для ограничения инфекции. Однако эти NETs обладают высокой протромботической активностью, способствуя прокоагулянтному состоянию при инфекции.
Активация коагуляции дополнительно усиливается за счет высвобождения воспалительных цитокинов и антигенных продуктов [2]. Бактериальные эндотоксины, представляющие собой циркулирующие фрагменты клеточной стенки бактерий, являются мощными стимулами для активации коагуляционного каскада и ДВС-синдрома, особенно при грамотрицательных инфекциях. Эндотоксины связываются с моноцитами и эндотелиальными клетками, что приводит к высвобождению цитокинов, индуцирующих коагуляцию, и запуску путей тканевого фактора [8]. Эндотоксины в этом случае либо связываются с ассоциированными с мембраной PRRs или Toll-подобными рецепторами этих клеток, либо, если они присутствуют в цитозоле, связываются и обнаруживаются каспазой 11.
На ранних стадиях сепсиса активации свертывания противодействуют три антикоагулянтных пути: антитромбин, протеин С и ингибитор пути тканевого фактора [2]. По мере прогрессирования сепсиса эти три механизма нарушаются, что приводит к состоянию гиперкоагуляции. В частности, антитромбин, важный антикоагулянтный механизм, который ингибирует тромбин и фактор Ха, снижается при сепсисе из-за сниженного синтеза и повышенной деградации под действием протеаз и нейтрофильных эластаз [6]. Нормальная активация протеина С опосредована комплексом тромбин-тромбомодулин на эндотелиальных клетках, что приводит к ингибированию факторов Va и VIIIa. Кроме того, рецептор эндотелиального протеина С (EPCR) экспрессируется на поверхности эндотелиальных клеток и дополнительно усиливает активацию протеина С [9]. Однако при сепсисе уровень протеина С снижается. Наконец, ингибитор пути тканевого фактора (TFPI) инактивирует комплекс тканевого фактора-фактора VIIa и производится несколькими клетками, включая эндотелиальные клетки, но его уровень снижается при сепсисе, что приводит к дисрегуляции инактивации комплекса тканевого фактора-фактора VIIa.
При сепсисе фибринолитическая активность зависит от баланса между тканевым активатором плазминогена (t-PA) и ингибитором тканевого активатора плазминогена PAI-1 [10]. T-PAоблегчает фибринолиз посредством деградации фибрина плазмином, в то время как PAI-1 ингибирует фибринолиз. В ранней транзиторной фазе сепсиса фибринолиз повышен из-за превращения плазминогена в плазмин под действием усиленного действия t-PA. Впоследствии происходит нарушение фибринолиза по мере увеличения PAI-1, повышения уровня тромбин-активируемого ингибитора фибринолиза (TAFI) и уровня ядерных продуктов в плазме. Нарушение фибринолиза способствует гиперкоагуляционному состоянию, наблюдаемому при сепсисе [11]. Поскольку коагуляция служит защитным механизмом, бактериальные патогены заключаются в фибриновую сеть в месте инфекции, что ограничивает их распространение в соседние ткани и системный кровоток. В этом плане нарушение фибринолиза в определенной степени полезно, но также имеет негативные последствия [12]. Распространение возбудителей в другие ткани предотвращается за счет нарушения притока к этим тканям кислорода, что приводит к гипоксии.
3. Перекрестное взаимодействие воспаления и гемостаза
При сепсисе развивается двунаправленное взаимодействие между воспалением и коагуляцией, что приводит к самоподдерживающемуся циклу (Figure 3) [2]. Присутствуют высокие уровни провоспалительных медиаторов, большинство из которых, включая фактор некроза опухоли-а (ФНО-а) и интерлейкин-6 (ИЛ-6), индуцируют коагуляционный каскад. В то же время различные гемостатические факторы дополнительно поддерживают и усиливают воспалительный процесс. Белки коагуляции взаимодействуют с клеточными рецепторами, что приводит к модификации путей воспаления [5]. Это регулирующее действие в значительной степени опосредуется активируемыми протеазами рецепторами (PARs) [13]. PARs - это трансмембранные рецепторы, активируемые в основном тромбином и другими факторами коагуляции, которые вызывают высвобождение провоспалительных цитокинов [14]. Кроме того, происходит взаимодействие между гемостазом и комплементом, который играет важную роль в развитии ДВС [15]. Между антикоагулянтными факторами и медиаторами воспаления также существуют значительные перекрестные взаимодействия [5]. Антитромбин напрямую связывается с воспалительными клетками и подавляет экспрессию рецепторов цитокинов. Кроме того, было показано, что активированный протеин С подавляет эндотоксин-индуцированную продукцию TNF-α, IL-1β, IL-6 и IL-8 моноцитами и макрофагами. Ингибирование активации лейкоцитов может быть еще одной ролью активированного протеина С [16].

4. Сепсис-индуцированная коагулопатия и диссеминированная внутрисосудистая коагуляция
ДВС-синдром характеризуется дисфункциональной системной активацией коагуляционного каскада, приводящей к избыточным тромботическим и геморрагическим осложнениям в результате внутрисосудистого образования фибрина, микроангиопатического тромбоза и последующего истощения факторов свертывания крови и тромбоцитов [5]. Клинически выраженные нарушения гемостаза встречаются примерно у 50-70% пациентов с сепсисом, в то время как у 35% этих пациентов развивается ДВС-синдром [17]. Более трех десятилетий назад Научный подкомитет Международного общества тромбоза и гемостаза по ДВС (ISTH DICSSC) определил это состояние как «приобретенный синдром, характеризующийся внутрисосудистой активацией коагуляции с потерей локализации, возникающий по разным причинам» [18]. Хотя ДВС-синдром вызывается различными фоновыми заболеваниями, включая сепсис и неинфекционные причины, такие как травмы и злокачественные новообразования, общим признаком ДВС-синдрома является системная активация коагуляции. Эта активация индуцируется повреждением эндотелия и может привести к тканевой сосудистой гипоперфузии и последующей полиорганной недостаточности [19]. Коагулопатия у пациентов с сепсисом прогрессирует от изначально компенсированного нарушения системы гемостаза, называемого неявным ДВС-синдромом, до явного ДВС-синдрома, состояния полной декомпенсации свертывания крови [20].
Первые диагностические критерии ДВС-синдрома были введены в 1983 году Министерством здравоохранения и социального обеспечения Японии. Они включали как клинические характеристики, так и лабораторные показатели, такие как количество тромбоцитов, ПТФ, ПДФ и фибриноген [21]. Позднее ISTH DIC SSC рекомендовал критерии диагностики явного ДВС-синдрома, ориентируясь на лабораторные параметры [18]. Впервые в критерии были включены D-димеры, при этом значимость количества тромбоцитов была снижена, а значимость маркеров, связанных с фибрином, повышена. Согласно критериям ISTH DIC SSC, повышенные уровни ПДФ или d-димеров, снижение количества тромбоцитов, удлинение ПТВ и снижение уровня фибриногена соответствуют явному ДВС-синдрому (Table 1). Также использовались другие системы оценки ДВС, в том числе диагностические критерии ДВС Japanese Association forAcute Medicine (JAAM) [22]. Количество тромбоцитов, концентрация ПДФ, ПТВ и системная воспалительная реакция входят в число критериев ДВС JAAM.

Сепсис представляет собой состояние, при котором своевременная диагностика и начало лечения имеют первостепенное значение. Шкала ДВС показала хорошую прогностическую ценность для смертности; однако к моменту ее обнаружения пациенты уже находятся на далеко зашедшей и необратимой стадии коагулопатии, выходящей за оптимальные сроки для коррекции [23]. Раннее выявление пациентов с сепсис-ассоциированной коагулопатией до прогрессирования этой фазы гемостатического расстройства было бы идеальным для начала лечения антикоагулянтами [24]. Так, подкомитет ISTH DIC предложил простые диагностические критерии сепсис-индуцированной коагулопатии (SIC), состоящие всего из трех параметров: количество тромбоцитов, ПТВ или МНО и балл по шкале SOFA [25]. Наличие сепсиса подтверждается включением оценки по шкале SOFA, отражающей обновленное определение сепсиса. ДВС-синдром, связанный с сепсисом, характеризуется нарушением фибринолиза в результате избыточной продукции PAI-1 [26,27]. Это потенциально приводит к протромботическому состоянию и дисфункции органов из-за гипоперфузии тканей [28,29]. Напротив, при «несептическом» ДВС-синдроме подавление фибринолиза происходит редко и часто возникают системные кровотечения [30]. Таким образом, снижение уровня фибриногена не является обычным или специфичным признаком сепсиса, в отличие от тромбоцитопении и удлинения ПТВ. Наконец, ПДФ и d-димеры не были включены в оценку сепсис-индуцированной коагулопатии, так как у них не было выявлено их корреляции с тяжестью сепсиса [31].
При сравнении систем оценки явного ДВС-синдрома ISTH и сепсис-индуцированной коагулопатии (SIC) стало очевидным, что показатель SIC в два раза более чувствителен, чем показатель явного ДВС-синдрома, и что SIC всегда предшествует явному ДВС-синдрому [32]. Оценка SIC также была подтверждена критериями Japanese Association for Acute Medicine (JAAM) и продемонстрировала схожую прогностическую ценность [33].
Диагностика как сепсис-индуцированной коагулопатии, так и явного ДВС-синдрома может быть полезной для выявления пациентов, которым будет полезно терапевтическое вмешательство с применением антикоагулянтов [34]. ISTH разработал «двухступенчатую» последовательную систему оценки для выявления пациентов с сепсис-ассоциированной коагулопатией (Table 1). Первоначально пациенты проходят скрининг по шкале сепсис-индуцированной коагулопатии, и, если критерии сепсис-индуцированной коагулопатии обнаруживают, затем рассчитывается оценка по шкале ДВС. Такой подход может увеличить возможность своевременного выявления подходящих кандидатов на антикоагулянтную терапию[21].
In case of sepsis, well-established findings emerge on conventional coagulation assays. These findings include thrombocytopenia, prolongation of PT, increased levels of FDPs, and reduced fibrinogen levels. Such abnormalities often present in the setting of DIC and are not usually observed before its development, during the initial stages of sepsis.
5. Традиционные гемостатические тесты и маркеры при сепсисе
В случае сепсиса появляются хорошо известные результаты обычных анализов коагуляции. Эти результаты включают тромбоцитопению, удлинение ПТ, повышение уровня ПДФ и снижение уровня фибриногена. Такие нарушения часто возникают при ДВС-синдроме и обычно не наблюдаются до его развития, на начальных стадиях сепсиса.
5.1. Тромбоцитопения
Сепсис обычно связан с тромбоцитопенией, несмотря на высвобождение провоспалительных медиаторов и тромбопоэтина, которые индуцируют продукцию тромбоцитов [35,36]. У подавляющего большинства пациентов с сепсисом развивается тромбоцитопения, признанный независимый предиктор неблагоприятных исходов при сепсисе [37,38]. В ранней фазе сепсиса тромбоциты после их активации агрегируют с лейкоцитами с образованием тромбоцитарно-лейкоцитарных агрегатов, что приводит к усилению секвестрации в селезенке [39]. Более того, инфекции могут стимулировать активацию и агрегацию тромбоцитов и вызывать тромбоцитопению либо напрямую, либо через разрушение клеток, воспаление и образование тромбов [40].
Фагоцитоз предшественников тромбоцитов моноцитами под воздействием макрофагального колониестимулирующего фактора (М-КСФ) еще больше способствует снижению количества тромбоцитов. Кроме того, при сепсисе наблюдается измененное производство тромбоцитов со значительным высвобождением клеток-предшественников, а фракция незрелых тромбоцитов (IPF) хорошо коррелирует с показателями тяжести сепсиса [41].
5.2. Продукты деградации фибрина (ПДФ)
Оценка биомаркеров, связанных с фибрином, включает тесты, выявляющие ПДФ, такие как d-димеры, и анализы, выявляющие продукты образования предшественников фибрина на промежуточной стадии между фибриногеном и конечным стабильным фибрином, такие как растворимые мономеры фибрина.
ПДФ, такие как белковые фрагменты X, Y и D, являются результатом деградации трех компонентов цикла фибриноген-фибрин: исходного фибриногена, растворимого предшественника фибрина и сшитого фибрина — конечной стабильной формы фибрина. ПДФ обнаруживают у 99% пациентов с сепсисом. Однако этим тестам не хватает специфичности, поскольку они не могут различать продукты деградации, происходящие из конечного сшитого фибрина, промежуточного растворимого фибрина или исходного фибриногена [42]. Уровни ПДФ измеряются с помощью иммуноферментного анализа ELISA или методом латексной агглютинации, что позволяет проводить «прикроватную» оценку.
D-димеры также являются продуктами деградации фибрина, но они образуются только в результате протеолиза конечного сшитого фибрина, и на их уровень не влияют продукты деградации фибриногена [5]. Следовательно, d-димеры являются наиболее специфическим маркером среди продуктов деградации фибрина для оценки ДВС-синдрома. Обнаружение d-димеров указывает на то, что тромбин индуцирует превращение фибриногена в мономер фибрина и что фибрин сшивается активированным фактором XIII и впоследствии расщепляется плазмином [43].
Хотя d-димеры являются ПДФ и связаны с фибринолизом, их высокие уровни отражают сопутствующую активацию свертывания [44]. Следовательно, d-димеры могут указывать на повышенное образование, а не на деградацию фибрина. Фактически, повышенные уровни d-димеров наблюдаются при тромбозах и также включаются в шкалу ДВС-синдрома, где тяжелый сепсис коррелирует с гипофибринолизом. Таким образом, при сепсисе d-димеры повышены как из-за активации коагуляционного каскада, так и из-за гиперфибринолиза, наблюдаемого на ранней стадии инфекции. Однако при далеко зашедшем сепсисе d-димеры могут быть нормальными. Это связано со значительным ингибированием фибринолиза, что предотвращает образование d-димеров, несмотря на повышенное образование фибрина. Имеются данные о том, что использование d-димеров для диагностики ДВС-синдрома и стратификации риска при тяжелом сепсисе может вводить в заблуждение, поскольку нормальные уровни d-димеров ассоциировались с более высокими показателями смертности [43,44].
С другой стороны, растворимые мономеры фибрина могут быть эффективными маркерами внутрисосудистого образования фибрина при ДВС-синдроме [45]. Уровни растворимых мономеров фибрина в плазме отражают внутрисосудистое образование фибрина и не зависят от внесосудистого образования фибрина, которое может сопровождать местное воспаление или травму. Доступные клинические испытания показывают, что растворимые мономеры фибрина, превышающие пороговый уровень, позволяют поставить точный диагноз ДВС-синдрома. На сегодняшний день нет надежного теста для количественного определения уровней растворимого фибрина.
5.3. Фибриноген
В целом, низкий уровень фибриногена в сыворотке крови считается основным показателем нарушения коагуляции при сепсисе [46]. Однако фибриноген является реагентом острой фазы, и его уровень повышается из-за воспаления. В результате уровень фибриногена может оставаться в пределах нормального референсного диапазона в течение длительного периода времени после его постоянного употребления. Последовательные измерения фибриногена могут быть более полезными, с более высокой диагностической точностью [47].
5.4. Стандартные коагуляционные тесты
Стандартные коагуляционные тесты, включая ПТВ и активированное частичное тромбопластиновое время (аЧТВ), традиционно использовались для оценки системы гемостаза [48]. Тем не менее они не в полной мере отражают гемостатическое расстройство, вызванное сепсисом [49]. Аномальные значения стандартных тестов коагуляции наблюдаются только в позднем течении сепсиса, когда развивается гипокоагуляция, выявляемая этими тестами. Кроме того, они оценивают часть гемостатического механизма, так как они основаны на плазматических компонентах системы свертывания, в то время как решающий вклад клеточных компонентов не оценивается. Стандартные коагуляционные тесты в первую очередь оценивают активность прокоагулянтных факторов без учета одновременной активации антикоагулянтного механизма.
6. Нетрадиционные гемостатические тесты и маркеры при сепсисе
Для диагностики нарушений свертывания крови, связанных с сепсисом, применялись нетрадиционные тесты.
6.1. Визкозиметрические тесты
Тромбоэластография (ТЭГ) и ротационная тромбоэластометрия (РОТЭМ) представляют собой тесты, которые обеспечивают всестороннюю оценку процесса гемостаза от инициации коагуляции и образования сгустка до его растворения и фибринолиза [50,51]. С помощью этих методов оценивается вклад как плазматического, так и клеточного компонентов коагуляции. Визкозиметрические тесты могут быть полезны для заполнения пробелов в стандартных тестах на коагуляцию при оценке гемостатического статуса пациентов с сепсисом [49]. Таким образом, многочисленные исследования были сосредоточены на использовании данных тестов для выявления гемостатических изменений, сопровождающих сепсис. Также были проведены исследования в субпопуляциях, включая педиатрических и неонатальных пациентов с сепсисом [52–54]. Распространенность септических больных с нарушениями гемостаза, выявленными с помощью ТЭГ/РОТЭМ, колебалась от 43 до 100% [55]. Существует неоднородность в дизайне, проведении и результатах исследований [56,57]. Сообщалось как о гипокоагуляции, так и о гиперкоагуляции, что отражает патофизиологию коагулопатии при сепсисе и ДВС-синдроме. Как динамический процесс, коагулопатия, связанная с сепсисом, развивается быстро, и время проведения тестирования сильно влияет на результаты ТЭГ/РОТЭМ. Последовательные измерения могут более точно отображать развитие сепсис-индуцированной коагулопатии, от гиперкоагуляции на ранних стадиях до последующего развития ДВС-синдрома и гипокоагуляции. Вязкоупругие тесты также могут выявить нарушение фибринолиза, как сообщалось в нескольких исследованиях у пациентов с сепсисом [55,58].
Анализы вязкости могут обнаружить раннюю активацию свертывания крови, которая приводит к гиперкоагуляции, когда результаты стандартных тестов на коагуляцию все еще находятся в пределах нормы [55]. Ротационная тромбоэластометрия (РОТЭМ) использовалась для дифференцировки пациентов с сепсисом с нормальной свертываемостью, гиперкоагуляцией и гипокоагуляцией. Как гипокоагуляционный, так и гиперкоагуляционный гемостатический профиль в РОТЭМ коррелировал со значительно более высоким риском смертности [59]. В другом исследовании пациенты с явным ДВС-синдромом показали профиль гипокоагуляции в РОТЭМ, в то время как пациенты с сепсисом без явного ДВС-синдрома имели тенденцию к гиперкоагуляции [60].
TEG parameters have been used for the development of a score to predict DIC [62]. Furthermore, ROTEM clotting time (CT) variable correlated strongly with the JAAM DIC score and performed well in predicting DIC [63].
У всех этих пациентов были аномальные стандартные тесты на коагуляцию, и использование ротационной тромбоэластометрии могло помочь предотвратить прокоагулянтные вмешательства у пациентов с гиперкоагуляционным статусом, не выявляемым стандартными тестами на коагуляцию. Сто пациентов с сепсисом, тяжелым сепсисом или септическим шоком были обследованы с помощью ротационйно тромбоэластометрии [61]. Максимальная плотность сгустка (MCF) была выше в группах с сепсисом и тяжелым сепсисом по сравнению с контрольной группой здоровых лиц. При септическом шоке наблюдали нормальную максимальную плотность и пролонгированное образование сгустка. Эти результаты указывают на гиперкоагуляцию у пациентов с сепсисом или тяжелым сепсисом и на гипокоагуляцию в более поздней фазе септического шока.
Интересно, что фибринолитическая активность положительно коррелировала с 28-дневной смертностью. Параметры тромбоэластографии использовались для разработки оценки для прогнозирования ДВС-синдрома [62]. Кроме того, переменная времени свертывания крови РОТЭМ сильно коррелировала с оценкой ДВС-синдрома Japanese Association for Acute Medicine хорошо показала себя в прогнозировании ДВС [63].
Недавний метаанализ пришел к выводу, что тесты вязкоупругости надежны и полезны для прогнозирования ДВС-синдрома, связанного с сепсисом, и оценки риска смертности при тяжелом сепсисе [56]. Представляется, что как профиль гипокоагуляции, так и переход к гипокоагуляции могут выявить пациентов с риском развития ДВС-синдрома. Комбинация обычны тестов коагуляции и показателей вискозиметрии могут оптимизировать выявление и лечение ДВС-синдрома, а также улучшить выживаемость и исход.
6.2. Измерение нуклеарных компонентов
Сепсис вызывает активацию и повреждение клеток и последующее высвобождение нуклеарных компонентов в кровоток [15], которые включают бокс-протеин-1 группы высокой подвижности (HMGB1), нуклеосомы, гистоны, бесклеточную ДНК и внеклеточные ловушки нейтрофилов (NETs). Нуклеарные компоненты могут напрямую запускать экспрессию тканевого фактора в макрофагах и эндотелиальных клетках. Экспрессия тканевого фактора и последующая активация внешнего пути коагуляции опосредуется активацией рецепторов TLR2/4 и путей ядерного фактора-каппа B (NF-κB) и белка-активатора 1 (AP-1) [64]. HMGB1 служит маркером повреждения клеток, воспаления и тромбоза [65]. Действуя на окружающие клетки через рецепторы, он опосредует миграцию лейкоцитов и продукцию провоспалительных цитокинов [66]. HMGB1 также способствует экспрессии тканевого фактора на поверхности моноцитов и снижает антикоагулянтную активность тромбомодулина, способствуя таким образом тромбозу микрососудов. Высокие уровни HMGB1 наблюдались у пациентов с сепсисом и ДВС-синдромом и связаны с плохим прогнозом и повышенной смертностью [67].
Нуклеосомы представляют собой комплексы, образованные из 147 пар оснований ДНК, расположенных вокруг белкового ядра гистонов [68]. Нуклеосомы высвобождаются в кровоток при апоптотической гибели клеток [69]. Сообщалось о повышенных уровнях нуклеосом при различных состояниях, включая злокачественные новообразования, церебральный инсульт, сепсис и септический шок [70]. Повышенный уровень гистонов в плазме крови наблюдается у больных с сепсисом и ДВС-синдромом и положительно коррелирует со смертностью [71]. В доклинической модели внеклеточные гистоны запускали агрегацию тромбоцитов, приводя к коагулопатии потребления, тромбозу и кровотечению. Протромботическое действие гистонов ингибируется рекомбинантным тромбомодулином, который используется в терапевтических целях при ДВС-синдроме. Помимо того, что уровни гистонов являются биомаркерами повреждения эндотелия и активации гемостаза, они связаны с показателями по шкале SOFA[72]. Бесклеточная ДНК плазмы продемонстрировала высокую прогностическую ценность у пациентов с тяжелым сепсисом, превосходящую полиорганную дисфункцию и оценку по шкале APACHE II [73]. NET представляют собой внеклеточные компоненты нейтрофилов, образованные ДНК, гистонами и гранулярными белками, и проявляют значительные протромботические и провоспалительные свойства [74].
6.3. Измерение антикоагулянтных белков
Антитромбин является одним из важнейших физиологических антикоагулянтов и ингибирует внутренние (фактор XIa), внешние (фактор VIIa) и общие пути свертывания крови (фактор Ха, тромбин). При сепсисе и ДВС-синдроме уровни антитромбина снижаются из-за сниженного синтеза, повышенной деградации нейтрофильной эластазой и избыточного потребления в результате повышенного образования тромбина [75]. Снижение уровня антитромбина связано с тяжестью заболевания при сепсис-индуцированном ДВС-синдроме [76]. Сообщалось о снижении активности антитромбина ниже 80% у пациентов с сепсисом без полиорганной дисфункции [77]. Этот уровень достигает 60% у пациентов с полиорганной дисфункцией, тогда как прогрессирование ДВС-синдрома приводит к дальнейшему снижению активности антитромбина примерно до 40%. Повышенная смертность была продемонстрирована при низком уровне антитромбина у взрослых и детей с сепсисом [78,79].
Другой антикоагулянтный белок, протеин С, естественным образом активируется для ингибирования образования тромбина как внешним, так и внутренним путями [6]. Сепсис характеризуется истощением протеина С и нарушением продукции активированного протеина С, что делает их уровни потенциальными прогностическими биомаркерами в этой ситуации [80]. Активированный протеин С связывается со своим эндотелиальным рецептором (EPCR), который высвобождается в кровоток после повреждения клеток. Этот растворимый EPCR также изучался как показатель прогрессирования заболевания и исхода у пациентов с сепсисом [81].
Тромбомодулин представляет собой антикоагулянтный белок, продуцируемый эндотелиальными клетками, и связывается с тромбином, превращая протеин С в его активированную форму [82]. Тромбомодулин играет ключевую противовоспалительную, антикоагулянтную и антифибринолитическую роль. Он ингибирует адгезию лейкоцитов к эндотелиальным клеткам, предотвращает активацию комплемента, изменяет генерацию цитокинов и разрушает HMGB1 [83]. Тромбомодулин расщепляется нейтрофильной эластазой и циркулирует в растворимой форме [84]. Высокий уровень тромбомодулина в плазме коррелирует с повышенной смертностью у пациентов с сепсисом и ДВС-синдромом [85]. При сепсис-индуцированном ДВС-синдроме наблюдается повышение уровня растворимого тромбомодулина в плазме с сопутствующим снижением эндотелиального поверхностного тромбомодулина [86].
Природный антикоагулянт - ингибитор пути тканевого фактора (TFPI) ингибирует активацию тканевого фактора и внешний путь свертывания крови. Истощение TFPI связано с повышенной предрасположенностью к развитию ДВС-синдрома [6]. TFPI связывается с эндотелиальными гепариноподобными молекулами, и его циркулирующие уровни ниже по сравнению с антитромбином и активированным протеином С. Более того, значительная часть TFPIинактивируется путем связывания с липопротеином. Следовательно, TFPI не стал чувствительным маркером ДВС-синдрома.
6.4. Другие представляющие интерес маркеры
Комплекс тромбин-антитромбин (ТАТ) является маркером образования тромбина, который можно использовать для выявления пациентов с ДВС-синдромом, поскольку избыточное образование тромбина является ключевым признаком этого состояния [46]. Сообщалось о более высоких уровнях ТАТ у пациентов с ДВС-синдромом при поступлении или у тех, у кого развился ДВС-синдром, по сравнению с пациентами без ДВС-синдрома [87]. Повышенные уровни ТАТ коррелировали с повышенной смертностью у пациентов с сепсисом [26]. Комбинация ТАТ с другими маркерами имеет более высокую прогностическую ценность, чем каждая молекула в отдельности.
Хотя фибринолиз нарушен при сепсис-индуцированном ДВС-синдроме, это не определяется текущими параметрами коагуляции. Антифибринолитический белок PAI-1 широко исследовался в качестве потенциального маркера гипофибринолиза у септических пациентов с ДВС-синдромом [46]. Уровни PAH-1 могут идентифицировать пациентов с ДВС-синдромом и прогнозировать развитие ДВС-синдрома [88,89]. Как и в случае с TAT, сочетание PAI-1 с другими биомаркерами повышало эффективность PAI-1 [26]. Высокий PAI-1 был связан с повышенным риском смертности [90].
Эндогенный тромбиновый потенциал — анализ, указывающий на образование тромбина, также оценивали при сепсисе. Результаты были противоречивыми, и необходимы дальнейшие исследования. Однако недавние данные свидетельствуют о корреляции между усилением тяжести инфекции и снижением способности к образованию тромбина [91]. Этот биомаркер, возможно, может служить для прогнозирования развития полиорганной дисфункции и неблагоприятного исхода у пациентов с сепсисом [92].
Фрагмент протромбина 1.2 (F1.2) представляет собой пептид, образующийся при превращении протромбина в тромбин [93]. Его использование в качестве маркера образования тромбина было опубликовано и включено в критерии ДВС-синдрома Японского общества тромбоза и гемостаза (JSTH) [94].
ADAMTS-13 представляет собой расщепляющую фактор фон Виллебранда протеазу, которая регулирует размер мультимеров фактора фон Виллебранда [95]. Расщепление мультимеров фон Виллебранда снижает их протромботические свойства, поскольку более крупные молекулы обладают повышенной гемостатической способностью [96]. Дефицит ADAMTS-13, приводящий к формированию сверхбольших мультимеров фактора фон Виллебранда и тромботической микроангиопатии при сепсисе, был связан с тяжестью сепсиса и неблагоприятным прогнозом.
Четырнадцать традиционных и нетрадиционных биомаркеров, включая число тромбоцитов, протромбиновое время, аЧТВ, фибриноген, ПДФ, ТАТ, протеин С, плазминоген и PAI-1, были оценены для ранней диагностики ДВС-синдрома в исследовании Koyama et al. [26]. ТАТ, ИАП-1 и протеин С при поступлении хорошо дифференцировали пациентов с явным ДВС-синдромом и без него, в то время как ТАТ и ИАП-1 также были значимыми предикторами 28-дневной смертности. Помимо предсказания прогноза, определенные маркеры могут дополнительно использоваться для мониторинга лечения пациентов с ДВС-синдромом [15]. Кроме того, некоторые из них, включая антитромбин и рекомбинантный растворимый тромбомодулин, также были изучены и использованы для лечения ДВС-синдрома.
7. От руководств к клинической практике
В настоящее время не существует устоявшейся терапии сепсис-индуцированной коагулопатии. Недавно были опубликованы рекомендации Surviving Sepsis Campaign по лечению сепсиса и септического шока [97]. На основании этих рекомендаций фармакологическая тромбопрофилактика низкомолекулярным гепарином настоятельно рекомендуется пациентам с сепсисом или септическим шоком. Более того, в последних рекомендациях Japanese SurvivingSepsis Campaign от 2020 г. рекомендуется раннее выявление ДВС-синдрома, а использование антикоагулянтов при сепсис-ассоциированном ДВС-синдроме носит характер слабой рекомендации [98].
Было оценено несколько стратегий лечения сепсис-индуцированной коагулопатии, в основном направленных на подавление протромботических эффектов, таких как введение гепарина/гепариноидов или белков-антикоагулянтов (Table 2) [99, 100]. Эффективность рекомбинантного тромбомодулина при сепсис-индуцированной коагулопатии была недавно оценена в многонациональном рандомизированном контролируемом исследовании III фазы (включая пациентов с числом тромбоцитов < 50 109/л и протромбиновым временем > 1,4). Авторы этого исследования сообщили, что 28-дневная смертность уменьшилась на 2,6% у 800 пациентов с сепсисом, хотя эта разница в уровне смертности не была статистически значимой. [101].

За последние несколько лет несколько антикоагулянтов, в том числе антитромбин, были испытаны в попытке снизить смертность у пациентов с сепсисом; однако в значительной степени они не доказали свою эффективность [101]. Однако следует отметить, что все эти исследования были нацелены на пациентов с сепсисом, а не на пациентов с сепсис-индуцированной коагулопатии. Использование антитромбина не рекомендуется международными рекомендациями по сепсису. Напротив, постфактум анализ баз данных показал благотворное влияние антикоагулянтов на определенные подгруппы пациентов с сепсисом с ДВС-синдромом [102]. Возможное объяснение этого несоответствия заключается в неоднородности пациентов и сроках лечения антикоагулянтами в крупномасштабных исследованиях. Принципы персонифицированной медицины следует применять для выбора подходящих кандидатов на антикоагулянтную терапию среди пациентов с сепсисом.
8. Выводы
В этом обновленном обзоре объединены все современные знания о патогенезе сепсис-индуцированной коагулопатии, а также все последние обновления, касающиеся диагностических критериев сепсис-индуцированной коагулопатии, основанные на данных международных научных обществ. Кроме того, этот всеобъемлющий обзор включает подробное обсуждение всех традиционных и нетрадиционных биомаркеров сепсис-индуцированной коагулопатии. Сепсис-индуцированная коагулопатия часто осложняет течение болезни, обусловливает потенциально неблагоприятные исходы и повышенную смертность. Гиперкоагуляция является хорошо установленным патофизиологическим признаком сепсис-индуцированной коагулопатии со сдвигом в сторону гипокоагуляции только на поздних стадиях сепсиса, после развития ДВС-синдрома. Традиционные тесты на коагуляцию могут выявить гипокоагуляцию на поздней стадии, но не чувствительны к выявлению данных изменений на ранней стадии. Существует пробел в диагностике расстройств гемостаза при сепсисе. Определение сепсис-индуцированной коагулопатии было введено, чтобы помочь идентифицировать нарушения коагуляции у пациентов с сепсисом до установления ДВС-синдрома, на ранних стадиях, которые можно было бы обратить вспять с помощью терапевтических вмешательств. В этом контексте изучение новых специализированных тестов, таких как тромбоэластометрия, имеет важное значение для пациентов с тяжелым сепсисом, поскольку это может обосновать раннее лечение в фазу гиперкоагуляции. Необходимы дальнейшие исследования диагностических биомаркеров и их потенциальных комбинаций для повышения точности диагностики.
References
1. Singer, M.; Deutschman, C.S.; Seymour, C.W.; Shankar-Hari, M.; Annane, D.; Bauer, M.; Bellomo, R.; Bernard, G.R.; Chiche, J.-D.; Coopersmith, C.M.; et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315, 801–810.[CrossRef]
2. Giustozzi, M.; Ehrlinder, H.; Bongiovanni, D.; Borovac, J.A.; Guerreiro, R.A.; Ga˛secka, A.; Papakonstantinou, P.E.; Parker, W.A. Coagulopathy and sepsis: Pathophysiology, clinical manifestations and treatment. Blood Rev. 2021, 50, 100864. [CrossRef] [PubMed]
3. Martin, G.S.; Mannino, D.M.; Eaton, S.; Moss, M. The Epidemiology of Sepsis in the United States from 1979 through 2000. N. Engl. J. Med. 2003, 348, 1546–1554. [CrossRef] [PubMed]
4. Cecconi, M.; Evans, L.; Levy, M.; Rhodes, A. Sepsis and septic shock. Lancet 2018, 392, 75–87.[CrossRef]
5. Levi, M.; van der Poll, T. Coagulation and sepsis. Thromb. Res. 2017, 149, 38–44. [CrossRef][PubMed]
6. Sungurlu, S.; Kuppy, J.; Balk, R.A. Role of Antithrombin III and Tissue Factor Pathway in thePathogenesis of Sepsis. Crit. Care Clin. 2020, 36, 255–265. [CrossRef] [PubMed]
7. Denning, N.-L.; Aziz, M.; Gurien, S.D.; Wang, P. DAMPs and NETs in Sepsis. Front. Immunol.2019, 10, 2536. [CrossRef] [PubMed]
8. Levi, M.; van der Poll, T. Inflammation and coagulation. Crit. Care Med. 2010, 38, S26–S34.[CrossRef]
9. Levi, M.; Poll, T. Coagulation in patients with severe sepsis. Semin. Thromb. Hemost. 2015, 41,9–15. [CrossRef]
10. Gando, S. Role of Fibrinolysis in Sepsis. Semin. Thromb. Hemost. 2013, 39, 392–399.[CrossRef]
11. Degen, J.L.; Bugge, T.H.; Goguen, J.D. Fibrin and fibrinolysis in infection and host defense. J. Thromb. Haemost. 2007, 5, 24–31. [CrossRef] [PubMed]
12. Bergmann, S.; Hammerschmidt, S. Fibrinolysis and host response in bacterial infections.Thromb. Haemost. 2007, 98, 512–520. [CrossRef]
13. Petros, S.; Kliem, P.; Siegemund, T. Thrombin generation in severe sepsis. Thromb. Res. 2012,129, 797–800. [CrossRef]
14. Coughlin, S.R. Thrombin signalling and protease-activated receptors. Nature 2000, 407, 258–264. [CrossRef] [PubMed]
15. Iba, T.; Ito, T.; Maruyama, I.; Jilma, B.; Brenner, T.; Müller, M.C.; Juffermans, N.P.; Thachil, J. Potential diagnostic markers for disseminated intravascular coagulation of sepsis. Blood Rev.2016, 30, 149–155. [CrossRef]
16. Yuksel, M.; Okajima, K.; Uchiba, M.; Horiuchi, S.; Okabe, H. Activated protein C inhibits lipopolysaccharide-induced tumor necrosis factor-alpha production by inhibiting activation of both nuclear factor-kappa B and activator protein-1 in human monocytes. Thromb. Haemost.2002, 88, 267–273. [CrossRef] [PubMed]
17. Wheeler, A.P.; Bernard, G.R. Treating Patients with Severe Sepsis. N. Engl. J. Med. 1999, 340,207–214. [CrossRef] [PubMed]
18. Taylor, F.B.; Toh, C.H.; Hoots, W.K.; Wada, H.; Levi, M. Towards definition, clinical andlaboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb.Haemost. 2001, 86, 1327–1330. [CrossRef]
19. Gando, S.; Levi, M.; Toh, C.H. Disseminated intravascular coagulation. Nat. Rev. Dis. Primers2016, 2, 16037. [CrossRef]
20. Iba, T.; Levy, J.H. Sepsis-induced Coagulopathy and Disseminated Intravascular Coagulation. Anesthesiology 2020, 132, 1238–1245. [CrossRef]
21. Iba, T.; Levy, J.H.; Warkentin, T.E.; Thachil, J.; van der Poll, T.; Levi, M. Diagnosis and management of sepsis-induced coagulopathy and disseminated intravascular coagulation. J.Thromb. Haemost. 2019, 17, 1989–1994. [CrossRef] [PubMed]
22. Gando, S.; Iba, T.; Eguchi, Y.; Ohtomo, Y.; Okamoto, K.; Koseki, K.; Mayumi, T.; Murata, A.; Ikeda, T.; Ishikura, H.; et al. A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: Comparing current criteria. Crit. Care Med. 2006, 34, 625–631. [CrossRef] [PubMed]
23. Levi, M.; Sivapalaratnam, S. Disseminated intravascular coagulation: An update on pathogenesisand diagnosis. Expert Rev.
Hematol. 2018, 11, 663–672. [CrossRef] [PubMed]
24. Iba, T.; Levi, M.; Levy, J.H. Sepsis-Induced Coagulopathy and Disseminated Intravascular Coagulation. Semin. Thromb. Hemost.
2020, 46, 089–095. [CrossRef]
25. Iba, T.; Di Nisio, M.; Levy, J.H.; Kitamura, N.; Thachil, J. New criteria for sepsis-inducedcoagulopathy (SIC) following the revised sepsis definition: A retrospective analysis of anationwide survey. BMJ Open 2017, 7, e017046. [CrossRef]
26. Koyama, K.; Madoiwa, S.; Nunomiya, S.; Koinuma, T.; Wada, M.; Sakata, A.; Ohmori, T.;Mimuro, J.; Sakata, Y. Combination of thrombin-antithrombin complex, plasminogen activatorinhibitor-1, and protein C activity for early identification of severe coagulopathy in initial phaseof sepsis: A prospective observational study. Crit. Care 2014, 18, R13. [CrossRef] [PubMed]
27. Hack, C.E. Fibrinolysis in Disseminated Intravascular Coagulation. Semin. Thromb. Hemost.2001, 27, 633–638. [CrossRef]
28. Engelmann, B.; Massberg, S. Thrombosis as an intravascular effector of innate immunity. Nat. Rev. Immunol. 2013, 13, 34–45. [CrossRef]
29. Schmitt, F.C.F.; Manolov, V.; Morgenstern, J.; Fleming, T.; Heitmeier, S.; Uhle, F.; Al-Saeedi, M.;Hackert, T.; Bruckner, T.; Schöchl, H.; et al. Acute fibrinolysis shutdown occurs early in septic shock and is associated with increased morbidity and mortality: Results of an observational pilotstudy. Ann. Intensive Care 2019, 9, 19. [CrossRef]
30. Asakura, H. Classifying types of disseminated intravascular coagulation: Clinical and animalmodels. J. Intensive Care 2014, 2, 20.
[CrossRef]
31. Iba, T.; Di Nisio, M.; Thachil, J.; Wada, H.; Asakura, H.; Sato, K.; Saitoh, D. A Proposal of the Modification of Japanese Society on Thrombosis and Hemostasis (JSTH) Disseminated Intravascular Coagulation (DIC) Diagnostic Criteria for Sepsis-Associated DIC. Clin. Appl.Thromb. 2018, 24, 439–445. [CrossRef]
32. Iba, T.; Arakawa, M.; Di Nisio, M.; Gando, S.; Anan, H.; Sato, K.; Ueki, Y.; Levy, J.H.; Thachil, J. Newly Proposed Sepsis-Induced Coagulopathy Precedes International Society on Thrombosisand Haemostasis Overt-Disseminated Intravascular Coagulation and Predicts High Mortality. J.Intensive Care Med. 2020, 35, 643–649. [CrossRef] [PubMed]
33. Iba, T.; Arakawa, M.; Levy, J.H.; Yamakawa, K.; Koami, H.; Hifumi, T.; Sato, K. Sepsis-Induced Coagulopathy and Japanese Association for Acute Medicine DIC in Coagulopathic Patients with Decreased Antithrombin and Treated by Antithrombin. Clin. Appl. Thromb. 2018, 24, 1020–1026. [CrossRef] [PubMed]
34. Yamakawa, K.; Yoshimura, J.; Ito, T.; Hayakawa, M.; Hamasaki, T.; Fujimi, S. External Validation of the Two Newly Proposed Criteria for Assessing Coagulopathy in Sepsis. Thromb.Haemost. 2019, 119, 203–212. [CrossRef] [PubMed]
35. Folman, C.C.; Linthorst, G.E.; van Mourik, J.; van Willigen, G.; de Jonge, E.; Levi, M.; von dem Borne, A.E. Platelets release thrombopoietin (Tpo) upon activation: Another regulatory loop in thrombocytopoiesis? Thromb. Haemost. 2000, 83, 923–930. [CrossRef]
36. Shannon, O. The role of platelets in sepsis. Res. Pract. Thromb. Haemost. 2020, 5, 27–37.[CrossRef]
37. Venkata, C.; Kashyap, R.; Farmer, J.C.; Afessa, B. Thrombocytopenia in adult patients withsepsis: Incidence, risk factors, and its association with clinical outcome. J. Intensive Care 2013,1, 9. [CrossRef] [PubMed]
38. Vanderschueren, S.; De Weerdt, A.; Malbrain, M.; Vankersschaever, D.; Frans, E.; Wilmer, A.;Bobbaers, H. Thrombocytopenia and prognosis in intensive care. Crit. Care Med. 2000, 28,1871–1876. [CrossRef]
39. Gawaz, M.; Fateh-Moghadam, S.; Pilz, G.; Gurland, H.-J.; Werdan, K. Platelet activation andinteraction with leucocytes in patients with sepsis or multiple organ failure. Eur. J. Clin.Investig. 1995, 25, 843–851. [CrossRef]
40. Hamzeh-Cognasse, H.; Damien, P.; Chabert, A.; Pozzetto, B.; Cognasse, F.; Garraud, O.Platelets and Infections—Complex Interactions with Bacteria. Front. Immunol. 2015, 6, 82.[CrossRef]
41. Hubert, R.M.E.; Rodrigues, M.V.; Andreguetto, B.D.; Santos, T.M.; Gilberti, M.D.F.P.; de Castro,V.; Annichino-Bizzacchi, J.M.; Dragosavac, D.; Carvalho-Filho, M.A.; De Paula, E.V. Association of the immature platelet fraction with sepsis diagnosis and severity. Sci. Rep. 2015,5, srep08019. [CrossRef] [PubMed]
42. Horan, J.T.; Francis, C.W. Fibrin Degradation Products, Fibrin Monomer and Soluble Fibrin in Disseminated Intravascular Coagulation. Semin. Thromb. Hemost. 2001, 27, 657–666.[CrossRef] [PubMed]
43. Semeraro, F.; Ammollo, C.T.; Caironi, P.; Masson, S.; Latini, R.; Panigada, M.; Colucci, M. Low D-dimer levels in sepsis: Good or bad? Thromb. Res. 2019, 174, 13–15. [CrossRef]
44. Favresse, J.; Lippi, G.; Roy, P.M.; Chatelain, B.; Jacqmin, H.; Ten Cate, H.; Mullier, F. D-dimer:Preanalytical, analytical, postanalytical variables, and clinical applications. Crit. Rev. Clin. Lab.Sci. 2018, 55, 548–577. [CrossRef]
45. Toh, J.M.; Ken-Dror, G.; Downey, C.; Abrams, S.T. The clinical utility of fibrin-relatedbiomarkers in sepsis. Blood Coagul. Fibrinolysis 2013, 24, 839–843. [CrossRef]
46. Adelborg, K.; Larsen, J.B.; Hvas, A. Disseminated intravascular coagulation: Epidemiology,biomarkers, and management. Br. J. Haematol. 2021, 192, 803–818. [CrossRef] [PubMed]
47. Levi, M.; Meijers, J.C. DIC: Which laboratory tests are most useful. Blood Rev. 2011, 25, 33–37.[CrossRef]
48. Kamal, A.H.; Tefferi, A.; Pruthi, R.K. How to Interpret and Pursue an Abnormal Prothrombin Time, Activated Partial Thrombo- plastin Time, and Bleeding Time in Adults. Mayo Clin. Proc.2007, 82, 864–873. [CrossRef]
49. Scarlatescu, E.; Juffermans, N.P.; Thachil, J. The current status of viscoelastic testing in septiccoagulopathy. Thromb. Res. 2019,
183, 146–152. [CrossRef]
50. Görlinger, K.; Pérez-Ferrer, A.; Dirkmann, D.; Saner, F.; Maegele, M.; Calatayud, Á.A.P.; Kim, T.-Y. The role of evidence-based algorithms for rotational thromboelastometry-guided bleedingmanagement. Korean J. Anesthesiol. 2019, 72, 297–322. [CrossRef]
51. Georgiadou, P.; Sokou, R.; Tsantes, A.G.; Parastatidou, S.; Konstantinidi, A.; Houhoula, D.;Kokoris, S.; Iacovidou, N.; Tsantes,
A.E. The Non-Activated Thromboelastometry (NATEM) Assay’s Application among Adults andNeonatal/Pediatric Population: A Systematic Review. Diagnostics 2022, 12, 658. [CrossRef][PubMed]
52. Sokou, R.; Ioakeimidis, G.; Piovani, D.; Parastatidou, S.; Konstantinidi, A.; Tsantes, A.G.;Lampridou, M.; Houhoula, D.; Iacovidou, N.; Kokoris, S.; et al. Development and validation of asepsis diagnostic scoring model for neonates with suspected sepsis. Front. Pediatr. 2022, 10,1004727. [CrossRef] [PubMed]
53. Sokou, R.; Tritzali, M.; Piovani, D.; Konstantinidi, A.; Tsantes, A.G.; Ioakeimidis, G.; Lampridou, M.; Parastatidou, S.; Iacovidou, N.; Kokoris, S.; et al. Comparative Performance ofFour Established Neonatal Disease Scoring Systems in Predicting In-Hospital Mortality and thePotential Role of Thromboelastometry. Diagnostics 2021, 11, 1955. [CrossRef] [PubMed]
54. Tsantes, A.G.; Sokou, R.; Konstantinidi, A.; Ioakeimidis, G.; Lampridou, M.; Parastatidou, S.;Theodoraki, M.; Piovani, D.; Iliodromiti, Z.; Boutsikou, T.; et al. Rotational Thromboelastometry in Neonates Admitted to a Neonatal Intensive Care Unit: A Large Cross-sectional Study. Semin.Thromb. Hemost. 2021, 47, 875–884. [CrossRef] [PubMed]
55. Müller, M.C.; Meijers, J.C.; Vroom, M.B.; Juffermans, N.P. Utility of thromboelastography and/or thromboelastometry in adults with sepsis: A systematic review. Crit. Care 2014, 18, R30.[CrossRef] [PubMed]
56. Hu, Y.L.; McRae, H.L.; Refaai, M.A. Efficacy of viscoelastic hemostatic assay testing in patients with sepsis-induced disseminated intravascular coagulation. Eur. J. Haematol. 2021, 106, 873–875. [CrossRef]
57. Katsaras, G.; Sokou, R.; Tsantes, A.G.; Piovani, D.; Bonovas, S.; Konstantinidi, A.; Ioakeimidis,G.; Parastatidou, S.; Gialamprinou, D.; Makrogianni, A.; et al. The use of thromboelastography (TEG) and rotational thromboelastometry (ROTEM) in neonates: A systematic review. Eur. J.Pediatr. 2021, 180, 3455–3470. [CrossRef]
58. Lampridou, M.; Sokou, R.; Tsantes, A.G.; Theodoraki, M.; Konstantinidi, A.; Ioakeimidis, G.; Bonovas, S.; Politou, M.; Valsami, S.; Iliodromiti, Z.; et al. ROTEM diagnostic capacity formeasuring fibrinolysis in neonatal sepsis. Thromb. Res. 2020, 192, 103–108. [CrossRef]
59. Adamik, B.; Gozdzik, W.; Jakubczyk, D.; Welna, M.; Kübler, A. Coagulation abnormalities identified by thromboelastometry in patients with severe sepsis: The relationship to endotoxemiaand mortality. Blood Coagul. Fibrinolysis 2017, 28, 163–170. [CrossRef]
60. Sivula, M.; Pettilä, V.; Niemi, T.T.; Varpula, M.; Kuitunen, A.H. Thromboelastometry inpatients with severe sepsis and dissemi- nated intravascular coagulation. Blood Coagul.Fibrinolysis 2009, 20, 419–426. [CrossRef]
61. Davies, G.R.; Lawrence, M.; Pillai, S.; Mills, G.M.; Aubrey, R.; Thomas, D.; Williams, R.;Morris, K.; Evans, P.A. The effect of sepsis and septic shock on the viscoelastic properties of clot quality and mass using rotational thromboelastometry: A prospective observational study. J.Crit. Care 2018, 44, 7–11. [CrossRef] [PubMed]
62. Sharma, P.; Saxena, R. A Novel Thromboelastographic Score to Identify Overt DisseminatedIntravascular Coagulation Resulting in a Hypocoagulable State. Am. J. Clin. Pathol. 2010, 134,97–102. [CrossRef] [PubMed]
63. Koami, H.; Sakamoto, Y.; Ohta, M.; Goto, A.; Narumi, S.; Imahase, H.; Inoue, S. Can rotational thromboelastometry predict septic disseminated intravascular coagulation? Blood Coagul.Fibrinolysis 2015, 26, 778–783. [CrossRef]
64. Li, Y.; Wan, D.; Luo, X.; Song, T.; Wang, Y.; Yu, Q.; Jiang, L.; Liao, R.; Zhao, W.; Su, B.Circulating Histones in Sepsis: Potential Outcome Predictors and Therapeutic Targets. Front.Immunol. 2021, 12, 650184. [CrossRef] [PubMed]
65. Andersson, U.; Tracey, K.J. HMGB1 Is a Therapeutic Target for Sterile Inflammation andInfection. Annu. Rev. Immunol. 2011, 29,
139–162. [CrossRef]
66. Ito, T.; Kawahara, K.; Nakamura, T.; Yamada, S.; Nakamura, T.; Abeyama, K.; Hashiguchi, T.; Maruyama, I. High-mobility group box 1 protein promotes development of microvascularthrombosis in rats. J. Thromb. Haemost. 2007, 5, 109–116. [CrossRef]
67. Hatada, T.; Nobori, T.; Okabayashi, K.; Maruyama, K.; Abe, Y.; Uemoto, S.; Yamada, S.;Maruyama, I.; Wada, H. Plasma concentrations and importance of high mobility group box protein in the prognosis of organ failure in patients with disseminated intravascular coagulation.Thromb. Haemost. 2005, 94, 975–979. [CrossRef] [PubMed]
68. Morimont, L.; Dechamps, M.; David, C.; Bouvy, C.; Gillot, C.; Haguet, H.; Favresse, J.;Ronvaux, L.; Candiracci, J.; Herzog, M.; et al. NETosis and Nucleosome Biomarkers in Septic Shock and Critical COVID-19 Patients: An Observational Study. Biomolecules 2022, 12, 1038.[CrossRef]
69. Chen, Q.; Ye, L.; Jin, Y.; Zhang, N.; Lou, T.; Qiu, Z.; Jin, Y.; Cheng, B.; Fang, X. Circulatingnucleosomes as a predictor of sepsis and organ dysfunction in critically ill patients. Int. J. Infect.Dis. 2012, 16, e558–e564. [CrossRef]
70. Xu, J.; Zhang, X.; Pelayo, R.; Monestier, M.; Ammollo, C.T.; Semeraro, F.; Taylor, F.B.; Esmon, N.L.; Lupu, F.; Esmon, C.T. Extracellular histones are major mediators of death in sepsis. Nat.Med. 2009, 15, 1318–1321. [CrossRef]
71. Nakahara, M.; Ito, T.; Kawahara, K.-I.; Yamamoto, M.; Nagasato, T.; Shrestha, B.; Yamada, S.;Miyauchi, T.; Higuchi, K.; Takenaka, T.; et al. Recombinant Thrombomodulin Protects Miceagainst Histone-Induced Lethal Thromboembolism. PLoS ONE 2013, 8, e75961. [CrossRef][PubMed]
72. Abrams, S.T.; Zhang, N.; Manson, J.; Liu, T.; Dart, C.; Baluwa, F.; Toh, C.H. Circulating histones are mediators of trauma-associated lung injury. Am. J. Respir. Crit. Care Med. 2013,187, 160–169. [CrossRef] [PubMed]
73. Dwivedi, D.J.; Toltl, L.J.; Swystun, L.L.; Pogue, J.; Liaw, K.-L.; Weitz, J.I.; Cook, D.J.; Fox-Robichaud, A.E.; Liaw, P.C.; Canadian Critical Care Translational Biology Group. Prognosticutility and characterization of cell-free DNA in patients with severe sepsis. Crit. Care 2012, 16,R151. [CrossRef] [PubMed]
74. Iba, T.; Levy, J.H. Inflammation and thrombosis: Roles of neutrophils, platelets and endothelial cells and their interactions in thrombus formation during sepsis. J. Thromb. Haemost. 2018, 16, 231–241. [CrossRef]
75. Levi, M.; de Jonge, E.; van der Poll, T. Rationale for restoration of physiological anticoagulantpathways in patients with sepsis and disseminated intravascular coagulation. Crit. Care Med.2001, 29, S90–S94. [CrossRef]
76. Levi, M.M.; Toh, C.H.; Thachil, J.; Watson, H.G. Guidelines for the diagnosis and management of disseminated intravascular coagulation. British Committee for Standards in Haematology. Br.J. Haematol. 2009, 145, 24–33. [CrossRef]
77. Iba, T.; Kidokoro, A.; Yagi, Y. The Role of the Endothelium in Changes in ProcoagulantActivity in Sepsis. J. Am. Coll. Surg. 1998,
187, 321–329. [CrossRef]
78. Warren, B.L.; Eid, A.; Singer, P.; Pillay, S.S.; Carl, P.; Novak, I.; Chalupa, P.; Atherstone, A.; Pénzes, I.; Kübler, A.; et al. High-dose antithrombin III in severe sepsis: A randomizedcontrolled trial. JAMA 2001, 286, 1869–1878. [CrossRef]
79. Niederwanger, C.; Hell, T.; Hofer, S.; Salvador, C.; Michel, M.; Schenk, B.; Treml, B.; Bachler, M. Antithrombin deficiency is associated with mortality and impaired organ function in septicpediatric patients: A retrospective study. PeerJ 2018, 6, e5538. [CrossRef]
80. Martí-Carvajal, A.J.; Solà, I.; Gluud, C.; Lathyris, D.; Anand, V. Human recombinant protein C for severe sepsis and septic shock in adult and paediatric patients. Cochrane Database Syst. Rev.2012, 12, CD004388. [CrossRef]
81. Guitton, C.; Gérard, N.; Sébille, V.; Bretonnière, C.; Zambon, O.; Villers, D.; Charreau, B. Early rise in circulating endothelial protein C receptor correlates with poor outcome in severe sepsis.Intensive Care Med. 2011, 37, 950–956. [CrossRef]
82. Huang, M.; Cai, S.; Su, J. The Pathogenesis of Sepsis and Potential Therapeutic Targets. Int. J. Mol. Sci. 2019, 20, 5376. [CrossRef] [PubMed]
83. Conway, E.M. Thrombomodulin and its role in inflammation. Semin. Immunopathol. 2011, 34,107–125. [CrossRef] [PubMed]
84. Furuno, T.; Mitsuyama, T.; Hidaka, K.; Tanaka, T.; Hara, N. The Role of Neutrophil Elastase in Human Pulmonary Artery Endothelial Cell Injury. Int. Arch. Allergy Immunol. 1997, 112, 262–269. [CrossRef] [PubMed]
85. Kinasewitz, G.T.; Yan, S.B.; Basson, B.; Comp, P.; Russell, J.A.; Cariou, A.; Um, S.L.; Utterback, B.; Laterre, P.-F.; Dhainaut, J.-F. Universal changes in biomarkers of coagulation andinflammation occur in patients with severe sepsis, regardless of causative micro-organism [ISRCTN74215569]. Crit. Care 2004, 8, R82–R90. [CrossRef]
86. Boehme, M.W.; Deng, Y.; Raeth, U.; Bierhaus, A.; Ziegler, R.; Stremmel, W.; Nawroth, P.P. Release of thrombomodulin from endothelial cells by concerted action of TNF-alpha andneutrophils: In vivo and in vitro studies. Immunology 1996, 87, 134–140.
87. Kushimoto, S.; Wada, H.; Kawasugi, K.; Okamoto, K.; Uchiyama, T.; Seki, Y.; Hatada, T.; Imai,H.; Nobori, T.; Subcommittee,
J.S.O.T.H. Increased Ratio of Soluble Fibrin Formation/Thrombin Generation in Patients WithDIC. Clin. Appl. Thromb. 2012, 18, 628–632. [CrossRef]
88. Mei, H.; Jiang, Y.; Luo, L.; Huang, R.; Su, L.; Hou, M.; Wang, X.; Deng, J.; Hu, Y. Evaluation the combined diagnostic value of TAT, PIC, tPAIC, and sTM in disseminated intravascular coagulation: A multi-center prospective observational study. Thromb. Res. 2018, 173, 20–26.[CrossRef]
89. Hoshino, K.; Kitamura, T.; Nakamura, Y.; Irie, Y.; Matsumoto, N.; Kawano, Y.; Ishikura, H. Usefulness of plasminogen activator inhibitor-1 as a predictive marker of mortality in sepsis. J.Intensive Care 2017, 5, 67. [CrossRef]
90. Tipoe, T.L.; Wu, W.K.K.; Chung, L.; Gong, M.; Dong, M.; Liu, T.; Roever, L.; Ho, J.; Wong, M.C.S.; Chan, M.T.V.; et al. Plasminogen Activator Inhibitor 1 for Predicting Sepsis Severity and Mortality Outcomes: A Systematic Review and Meta-Analysis. Front. Immunol. 2018, 9,1218. [CrossRef]
91. Elad, B.; Avraham, G.; Schwartz, N.; Elias, A.; Elias, M. Role of a thrombin generation assay inthe prediction of infection severity.
Sci. Rep. 2021, 11, 7814. [CrossRef]
92. Mihajlovic, D.; Brkic, S.; Lendak, D.; Mikic, A.N.; Draskovic, B.; Mitic, G. Endogenousthrombin potential as marker of procoagulant response that can be useful in early stage of sepsis.Blood Coagul. Fibrinolysis 2017, 28, 460–467. [CrossRef] [PubMed]
93. Levi, M.; Vincent, J.-L.; Tanaka, K.; Radford, A.H.; Kayanoki, T.; Fineberg, D.A.;Hoppensteadt, D.; Fareed, J. Effect of a Recombinant Human Soluble Thrombomodulin onBaseline Coagulation Biomarker Levels and Mortality Outcome in Patients with Sepsis-Associated Coagulopathy. Crit. Care Med. 2020, 48, 1140–1147. [CrossRef] [PubMed]
94. Asakura, H.; Takahashi, H.; Uchiyama, T.; Eguchi, Y.; Okamoto, K.; Kawasugi, K.; Madoiwa, S.; Wada, H.; DIC Subcommittee of the Japanese Society on Thrombosis and Hemostasis.Proposal for new diagnostic criteria for DIC from the Japanese Society on Thrombosis andHemostasis. Thromb. J. 2016, 14, 42. [CrossRef] [PubMed]
95. Zheng, X.; Chung, D.; Takayama, T.K.; Majerus, E.M.; Sadler, J.E.; Fujikawa, K. Structure of von Willebrand Factor-cleaving Protease (ADAMTS13), a Metalloprotease Involved in Thrombotic Thrombocytopenic Purpura. J. Biol. Chem. 2001, 276, 41059– 41063. [CrossRef]
96. Levi, M.; Scully, M.; Singer, M. The role of ADAMTS -13 in the coagulopathy of sepsis. J. Thromb. Haemost. 2018, 16, 646–651. [CrossRef]
97. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado, F.R.; Mcintyre, L.; Ostermann, M.; Prescott, H.C.; et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021. Intensive Care Med.2021, 47, 1181–1247. [CrossRef]
98. Egi, M.; Ogura, H.; Yatabe, T.; Atagi, K.; Inoue, S.; Iba, T.; Kakihana, Y.; Kawasaki, T.; Kushimoto, S.; Kuroda, Y.; et al. The Japanese Clinical Practice Guidelines for Management of Sepsis and Septic Shock 2020 (J-SSCG 2020). Acute Med. Surg. 2021, 8, 53. [CrossRef]
99. Inata, Y. Should we treat sepsis-induced DIC with anticoagulants? J. Intensive Care 2020, 8, 18.[CrossRef]
100. Kienast, J.; Juers, M.; Wiedermann, C.J.; Hoffmann, J.N.; Ostermann, H.; Strauss, R.; Keinecke, H.-O.; Warren, B.L.; Opal, S.M.; The KyberSept Investigators. Treatment effects of high-dose antithrombin without concomitant heparin in patients with severe sepsis with or withoutdisseminated intravascular coagulation. J. Thromb. Haemost. 2006, 4, 90–97. [CrossRef]
101. Vincent, J.L.; Francois, B.; Zabolotskikh, I.; Daga, M.K.; Lascarrou, J.B.; Kirov, M.Y.;SCARLET Trial Group. Effect of a recombinant human soluble thrombomodulin on mortality in patients with sepsis-associated coagulopathy: The SCARLET randomized clinical trial. JAMA2019, 321, 1993–2002. [CrossRef] [PubMed]
102. Scarlatescu, E.; Tomescu, D.; Arama, S.S. Review. Anticoagulant Therapy in Sepsis. TheImportance of Timing. J. Crit. Care Med.
2017, 3, 63–69. [CrossRef] [PubMed]
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 20.09.2023
[~DATE_ACTIVE_FROM] => 20.09.2023
[ACTIVE_FROM_X] => 2023-09-20 00:00:00
[~ACTIVE_FROM_X] => 2023-09-20 00:00:00
[ACTIVE_FROM] => 20.09.2023
[~ACTIVE_FROM] => 20.09.2023
[SHOW_COUNTER] => 4007
[~SHOW_COUNTER] => 4007
[ID] => 8367
[~ID] => 8367
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 11.11.2024 15:04:53
[~TIMESTAMP_X] => 11.11.2024 15:04:53
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/sepsis-indutsirovannaya-koagulopatiya-obnovlennaya-informatsiya-o-patofiziologii-biomarkerakh-i-teku/
[~DETAIL_PAGE_URL] => /library/articles/sepsis-indutsirovannaya-koagulopatiya-obnovlennaya-informatsiya-o-patofiziologii-biomarkerakh-i-teku/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => sepsis-indutsirovannaya-koagulopatiya-obnovlennaya-informatsiya-o-patofiziologii-biomarkerakh-i-teku
[~CODE] => sepsis-indutsirovannaya-koagulopatiya-obnovlennaya-informatsiya-o-patofiziologii-biomarkerakh-i-teku
[EXTERNAL_ID] => 8367
[~EXTERNAL_ID] => 8367
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 20 сентября 2023
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
[PREVIEW_PICTURE] => Array
(
[ID] => 5352
[TIMESTAMP_X] => 11.11.2024 15:04:53
[MODULE_ID] => iblock
[HEIGHT] => 834
[WIDTH] => 1000
[FILE_SIZE] => 107663
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/82e/l0br2fvpn5pu3rpmm0q56z2b01hfguuc
[FILE_NAME] => 3d-illustration-red-blood-cells-scientific-medical-concept.jpg
[ORIGINAL_NAME] => 3d-illustration-red-blood-cells-scientific-medical-concept.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 44cb122bff6776d124253123f6adaf8f
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/82e/l0br2fvpn5pu3rpmm0q56z2b01hfguuc/3d-illustration-red-blood-cells-scientific-medical-concept.jpg
[UNSAFE_SRC] => /upload/iblock/82e/l0br2fvpn5pu3rpmm0q56z2b01hfguuc/3d-illustration-red-blood-cells-scientific-medical-concept.jpg
[SAFE_SRC] => /upload/iblock/82e/l0br2fvpn5pu3rpmm0q56z2b01hfguuc/3d-illustration-red-blood-cells-scientific-medical-concept.jpg
[ALT] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
[TITLE] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
)
[DETAIL_TEXT] =>
Tsantes, A.G.; Parastatidou, S.; Tsantes, E.A.; Bonova, E.; Tsante, K.A.; Mantzios, P.G.; Vaiopoulos,A.G.; Tsalas, S.; Konstantinidi, A.; Houhoula, D.; et al. Sepsis-Induced Coagulopathy: An Update on Pathophysiology, Biomarkers, and Current Guidelines.
Life 2023, 13, 350. doi.org/10.3390/life13020350
Абстракт: между воспалением и коагуляцией возникают значительные перекрестные взаимодействия. Таким образом, коагулопатия часто встречается при сепсисе, потенциально ухудшая прогноз. Вначале у пациентов с сепсисом наблюдается протромботическое состояние за счет активации внешнего пути коагуляции, индуцированного цитокинами, подавления антикоагуляции и нарушения фибринолиза. На поздних стадиях сепсиса при развитии диссеминированного внутрисосудистого свертывания крови (ДВС-синдром) наступает гипокоагуляция. Традиционные лабораторные признаки сепсиса, включая тромбоцитопению, увеличение протромбинового времени (ПТВ) и продуктов деградации фибрина (ПДФ), а также снижение фибриногена, обнаруживаются только на поздних стадиях сепсиса. Недавно введенное определение сепсис-индуцированной коагулопатии (SIC) направлено на выявление пациентов на более ранней стадии, когда изменения коагуляционного статуса еще обратимы.
Нетрадиционные анализы, такие как измерение уровня антикоагулянтных белков, а также вискозиметрия обнаружили многообещающую чувствительность и специфичность в выявлении пациентов с риском развития ДВС, что позволяет своевременно проводить коррекцию нарушений гемостаза. В данном обзоре изложены современные представления о патофизиологических механизмах и возможностях диагностики ДВС-синдрома.
Ключевые слова: сепсис; коагуляция; диссеминированное внутрисосудистое свертывание; сепсис-индуцированная коагулопатия; лабораторная оценка; методические рекомендации
1. Введение
Традиционное определение сепсиса — синдром системной воспалительной реакции, вызванный инфекцией. В 2016 году это определение было обновлено Третьим международным консенсусом определений сепсиса и септического шока до «угрожающей жизни дисфункции органов, вызванной дисфункциональным ответом организма на инфекцию» [1]. Текущая концепция подчеркивает риск тяжелого течения заболевания и смертности из-за нерегулируемого ответа на инфекцию а не из-за самой инфекции. Органная дисфункция определяется как увеличение балла по шкале sequential organ failure assessment (SOFA) не менее чем на 2 балла. За последние несколько лет наше понимание механизмов и патофизиологии сепсиса значительно улучшилось, а современные и более эффективные диагностические инструменты находятся в стадии разработки (Figure 1). Однако патобиология сепсиса до конца не выяснена, и не существует золотого стандарта в диагностике. Сепсис - это сложный клинический синдром с распространенностью примерно 2,5 на 1000 человек в западном мире и ежегодным ростом на 8,7% за последние 20 лет, что частично связано со старением населения [2]. Ежегодно диагностируется 19 миллионов случаев сепсиса и почти 5 миллионов смертей, что делает его одной из основных причин смертности во всем мире [3].

Инфекция и, в частности, сепсис вызывают множественные и сложные нарушения во многих системах, включая коагуляционный каскад. У подавляющего большинства пациентов с сепсисом наблюдаются нарушения гемостаза, варьирующие от субклинической коагулопатии до молниеносного ДВС-синдрома [4]. На начальных стадиях инфекции коагуляция действует как естественный защитный механизм, пытаясь локализовать патоген и предотвратить его распространение в системный кровоток. Однако при запущенных и тяжелых инфекциях, таких как сепсис, массовая продукция и выброс в кровоток воспалительных цитокинов приводит к чрезмерной активации процесса свертывания крови, нарушению фибринолиза и подавлению антикоагуляции [5]. Баланс гемостаза при сепсисе значительно нарушен. Процесс коагуляции активируется, а антикоагулянтные механизмы, включая фибринолиз и антикоагулянтные факторы, подавляются (Figure 2). Следовательно, пациенты с сепсисом склонны к протромботическому состоянию через четыре основных механизма: активация внешнего пути, цитокин-индуцированное усиление коагуляции, подавление антикоагулянтных путей и нарушение фибринолиза [6]. Лабораторная оценка нарушений гемостаза при сепсисе основана на стандартных тестах, включая абсолютное количество тромбоцитов, ПТВ, международное нормализованное отношение (МНО), ПДФ, уровень d-димеров и фибриногена, а также нетрадиционные анализы, включая измерение уровней белков-антикоагулянтов и исследования вязкости крови [2].

В этом обзоре изложены современные представления о патофизиологических механизмах коагулопатии, вызванной сепсисом, и диагностических возможностях ее выявления с акцентом на потенциальные представляющие интерес биомаркеры и соответствующие существующие руководства. Это исследование направлено на обзор современной литературы по следующим ключевым вопросам: (1) Каковы основные патогенетические механизмы, участвующие в развитии сепсис-индуцированной коагулопатии (SIC)? (2) Каковы диагностические критерии SIC? (3) Есть ли последние достижения в лабораторной оценке и лечении SIC?
2. Нарушения гемостаза при сепсисе
Путь тканевого фактора является начальным и основным триггером активации свертывания крови при сепсисе. Тканевой фактор располагается в эндотелии сосудов, и его попадание в кровоток при повреждении эндотелия приводит к активации внешнего пути свертывания крови [5]. Однако это не основной активирующий механизм при сепсисе. Тканевой фактор также присутствует в моноцитах и других циркулирующих макрофагах. В случае инфекции эти клетки активируются через паттерн-распознающие рецепторы (PRRs) патоген-ассоциированными молекулярными паттернами (PAMPs) и молекулярным паттернам, ассоциированным с повреждением (DAMPs) [7]. PAMPs представляют собой молекулы, которые циркулируют после уничтожения патогенов или могут высвобождаться живыми патогенами, в то время как DAMPs представляют собой клеточные компоненты хозяина, высвобождаемые при лизисе клеток. PAMPs и DAMPs распознаются и связываются со специфическими поверхностными PRRs в моноцитах и макрофагах. После распознавания PAMPs/DAMPs с помощью PRRs на поверхности моноцитов и макрофагов, эти клетки активируются и высвобождают цитокины и хемокины, которые впоследствии активируют нейтрофилы, тромбоциты и эндотелиальные клетки. Более того, активированные моноциты высвобождают внеклеточные везикулы, которые экспрессируют на своей поверхности прокоагулянтный тканевой фактор и фосфатидилсерин.
Таким образом, тканевой фактор высвобождается в кровоток и активируется внешний путь свертывания крови. Нейтрофилы также играют важную роль в активации каскада свертывания посредством экспрессии тканевого фактора и высвобождения химических медиаторов и белков. Другим важным механизмом, посредством которого нейтрофилы активируют каскад свертывания крови, является высвобождение нейтрофильных внеклеточных ловушек (NETs). NETs представляют собой частицы, состоящие из гистонов, прокоагулянтной ДНК и других DAMP, высвобождаемых после вторжения патогена для ограничения инфекции. Однако эти NETs обладают высокой протромботической активностью, способствуя прокоагулянтному состоянию при инфекции.
Активация коагуляции дополнительно усиливается за счет высвобождения воспалительных цитокинов и антигенных продуктов [2]. Бактериальные эндотоксины, представляющие собой циркулирующие фрагменты клеточной стенки бактерий, являются мощными стимулами для активации коагуляционного каскада и ДВС-синдрома, особенно при грамотрицательных инфекциях. Эндотоксины связываются с моноцитами и эндотелиальными клетками, что приводит к высвобождению цитокинов, индуцирующих коагуляцию, и запуску путей тканевого фактора [8]. Эндотоксины в этом случае либо связываются с ассоциированными с мембраной PRRs или Toll-подобными рецепторами этих клеток, либо, если они присутствуют в цитозоле, связываются и обнаруживаются каспазой 11.
На ранних стадиях сепсиса активации свертывания противодействуют три антикоагулянтных пути: антитромбин, протеин С и ингибитор пути тканевого фактора [2]. По мере прогрессирования сепсиса эти три механизма нарушаются, что приводит к состоянию гиперкоагуляции. В частности, антитромбин, важный антикоагулянтный механизм, который ингибирует тромбин и фактор Ха, снижается при сепсисе из-за сниженного синтеза и повышенной деградации под действием протеаз и нейтрофильных эластаз [6]. Нормальная активация протеина С опосредована комплексом тромбин-тромбомодулин на эндотелиальных клетках, что приводит к ингибированию факторов Va и VIIIa. Кроме того, рецептор эндотелиального протеина С (EPCR) экспрессируется на поверхности эндотелиальных клеток и дополнительно усиливает активацию протеина С [9]. Однако при сепсисе уровень протеина С снижается. Наконец, ингибитор пути тканевого фактора (TFPI) инактивирует комплекс тканевого фактора-фактора VIIa и производится несколькими клетками, включая эндотелиальные клетки, но его уровень снижается при сепсисе, что приводит к дисрегуляции инактивации комплекса тканевого фактора-фактора VIIa.
При сепсисе фибринолитическая активность зависит от баланса между тканевым активатором плазминогена (t-PA) и ингибитором тканевого активатора плазминогена PAI-1 [10]. T-PAоблегчает фибринолиз посредством деградации фибрина плазмином, в то время как PAI-1 ингибирует фибринолиз. В ранней транзиторной фазе сепсиса фибринолиз повышен из-за превращения плазминогена в плазмин под действием усиленного действия t-PA. Впоследствии происходит нарушение фибринолиза по мере увеличения PAI-1, повышения уровня тромбин-активируемого ингибитора фибринолиза (TAFI) и уровня ядерных продуктов в плазме. Нарушение фибринолиза способствует гиперкоагуляционному состоянию, наблюдаемому при сепсисе [11]. Поскольку коагуляция служит защитным механизмом, бактериальные патогены заключаются в фибриновую сеть в месте инфекции, что ограничивает их распространение в соседние ткани и системный кровоток. В этом плане нарушение фибринолиза в определенной степени полезно, но также имеет негативные последствия [12]. Распространение возбудителей в другие ткани предотвращается за счет нарушения притока к этим тканям кислорода, что приводит к гипоксии.
3. Перекрестное взаимодействие воспаления и гемостаза
При сепсисе развивается двунаправленное взаимодействие между воспалением и коагуляцией, что приводит к самоподдерживающемуся циклу (Figure 3) [2]. Присутствуют высокие уровни провоспалительных медиаторов, большинство из которых, включая фактор некроза опухоли-а (ФНО-а) и интерлейкин-6 (ИЛ-6), индуцируют коагуляционный каскад. В то же время различные гемостатические факторы дополнительно поддерживают и усиливают воспалительный процесс. Белки коагуляции взаимодействуют с клеточными рецепторами, что приводит к модификации путей воспаления [5]. Это регулирующее действие в значительной степени опосредуется активируемыми протеазами рецепторами (PARs) [13]. PARs - это трансмембранные рецепторы, активируемые в основном тромбином и другими факторами коагуляции, которые вызывают высвобождение провоспалительных цитокинов [14]. Кроме того, происходит взаимодействие между гемостазом и комплементом, который играет важную роль в развитии ДВС [15]. Между антикоагулянтными факторами и медиаторами воспаления также существуют значительные перекрестные взаимодействия [5]. Антитромбин напрямую связывается с воспалительными клетками и подавляет экспрессию рецепторов цитокинов. Кроме того, было показано, что активированный протеин С подавляет эндотоксин-индуцированную продукцию TNF-α, IL-1β, IL-6 и IL-8 моноцитами и макрофагами. Ингибирование активации лейкоцитов может быть еще одной ролью активированного протеина С [16].

4. Сепсис-индуцированная коагулопатия и диссеминированная внутрисосудистая коагуляция
ДВС-синдром характеризуется дисфункциональной системной активацией коагуляционного каскада, приводящей к избыточным тромботическим и геморрагическим осложнениям в результате внутрисосудистого образования фибрина, микроангиопатического тромбоза и последующего истощения факторов свертывания крови и тромбоцитов [5]. Клинически выраженные нарушения гемостаза встречаются примерно у 50-70% пациентов с сепсисом, в то время как у 35% этих пациентов развивается ДВС-синдром [17]. Более трех десятилетий назад Научный подкомитет Международного общества тромбоза и гемостаза по ДВС (ISTH DICSSC) определил это состояние как «приобретенный синдром, характеризующийся внутрисосудистой активацией коагуляции с потерей локализации, возникающий по разным причинам» [18]. Хотя ДВС-синдром вызывается различными фоновыми заболеваниями, включая сепсис и неинфекционные причины, такие как травмы и злокачественные новообразования, общим признаком ДВС-синдрома является системная активация коагуляции. Эта активация индуцируется повреждением эндотелия и может привести к тканевой сосудистой гипоперфузии и последующей полиорганной недостаточности [19]. Коагулопатия у пациентов с сепсисом прогрессирует от изначально компенсированного нарушения системы гемостаза, называемого неявным ДВС-синдромом, до явного ДВС-синдрома, состояния полной декомпенсации свертывания крови [20].
Первые диагностические критерии ДВС-синдрома были введены в 1983 году Министерством здравоохранения и социального обеспечения Японии. Они включали как клинические характеристики, так и лабораторные показатели, такие как количество тромбоцитов, ПТФ, ПДФ и фибриноген [21]. Позднее ISTH DIC SSC рекомендовал критерии диагностики явного ДВС-синдрома, ориентируясь на лабораторные параметры [18]. Впервые в критерии были включены D-димеры, при этом значимость количества тромбоцитов была снижена, а значимость маркеров, связанных с фибрином, повышена. Согласно критериям ISTH DIC SSC, повышенные уровни ПДФ или d-димеров, снижение количества тромбоцитов, удлинение ПТВ и снижение уровня фибриногена соответствуют явному ДВС-синдрому (Table 1). Также использовались другие системы оценки ДВС, в том числе диагностические критерии ДВС Japanese Association forAcute Medicine (JAAM) [22]. Количество тромбоцитов, концентрация ПДФ, ПТВ и системная воспалительная реакция входят в число критериев ДВС JAAM.

Сепсис представляет собой состояние, при котором своевременная диагностика и начало лечения имеют первостепенное значение. Шкала ДВС показала хорошую прогностическую ценность для смертности; однако к моменту ее обнаружения пациенты уже находятся на далеко зашедшей и необратимой стадии коагулопатии, выходящей за оптимальные сроки для коррекции [23]. Раннее выявление пациентов с сепсис-ассоциированной коагулопатией до прогрессирования этой фазы гемостатического расстройства было бы идеальным для начала лечения антикоагулянтами [24]. Так, подкомитет ISTH DIC предложил простые диагностические критерии сепсис-индуцированной коагулопатии (SIC), состоящие всего из трех параметров: количество тромбоцитов, ПТВ или МНО и балл по шкале SOFA [25]. Наличие сепсиса подтверждается включением оценки по шкале SOFA, отражающей обновленное определение сепсиса. ДВС-синдром, связанный с сепсисом, характеризуется нарушением фибринолиза в результате избыточной продукции PAI-1 [26,27]. Это потенциально приводит к протромботическому состоянию и дисфункции органов из-за гипоперфузии тканей [28,29]. Напротив, при «несептическом» ДВС-синдроме подавление фибринолиза происходит редко и часто возникают системные кровотечения [30]. Таким образом, снижение уровня фибриногена не является обычным или специфичным признаком сепсиса, в отличие от тромбоцитопении и удлинения ПТВ. Наконец, ПДФ и d-димеры не были включены в оценку сепсис-индуцированной коагулопатии, так как у них не было выявлено их корреляции с тяжестью сепсиса [31].
При сравнении систем оценки явного ДВС-синдрома ISTH и сепсис-индуцированной коагулопатии (SIC) стало очевидным, что показатель SIC в два раза более чувствителен, чем показатель явного ДВС-синдрома, и что SIC всегда предшествует явному ДВС-синдрому [32]. Оценка SIC также была подтверждена критериями Japanese Association for Acute Medicine (JAAM) и продемонстрировала схожую прогностическую ценность [33].
Диагностика как сепсис-индуцированной коагулопатии, так и явного ДВС-синдрома может быть полезной для выявления пациентов, которым будет полезно терапевтическое вмешательство с применением антикоагулянтов [34]. ISTH разработал «двухступенчатую» последовательную систему оценки для выявления пациентов с сепсис-ассоциированной коагулопатией (Table 1). Первоначально пациенты проходят скрининг по шкале сепсис-индуцированной коагулопатии, и, если критерии сепсис-индуцированной коагулопатии обнаруживают, затем рассчитывается оценка по шкале ДВС. Такой подход может увеличить возможность своевременного выявления подходящих кандидатов на антикоагулянтную терапию[21].
In case of sepsis, well-established findings emerge on conventional coagulation assays. These findings include thrombocytopenia, prolongation of PT, increased levels of FDPs, and reduced fibrinogen levels. Such abnormalities often present in the setting of DIC and are not usually observed before its development, during the initial stages of sepsis.
5. Традиционные гемостатические тесты и маркеры при сепсисе
В случае сепсиса появляются хорошо известные результаты обычных анализов коагуляции. Эти результаты включают тромбоцитопению, удлинение ПТ, повышение уровня ПДФ и снижение уровня фибриногена. Такие нарушения часто возникают при ДВС-синдроме и обычно не наблюдаются до его развития, на начальных стадиях сепсиса.
5.1. Тромбоцитопения
Сепсис обычно связан с тромбоцитопенией, несмотря на высвобождение провоспалительных медиаторов и тромбопоэтина, которые индуцируют продукцию тромбоцитов [35,36]. У подавляющего большинства пациентов с сепсисом развивается тромбоцитопения, признанный независимый предиктор неблагоприятных исходов при сепсисе [37,38]. В ранней фазе сепсиса тромбоциты после их активации агрегируют с лейкоцитами с образованием тромбоцитарно-лейкоцитарных агрегатов, что приводит к усилению секвестрации в селезенке [39]. Более того, инфекции могут стимулировать активацию и агрегацию тромбоцитов и вызывать тромбоцитопению либо напрямую, либо через разрушение клеток, воспаление и образование тромбов [40].
Фагоцитоз предшественников тромбоцитов моноцитами под воздействием макрофагального колониестимулирующего фактора (М-КСФ) еще больше способствует снижению количества тромбоцитов. Кроме того, при сепсисе наблюдается измененное производство тромбоцитов со значительным высвобождением клеток-предшественников, а фракция незрелых тромбоцитов (IPF) хорошо коррелирует с показателями тяжести сепсиса [41].
5.2. Продукты деградации фибрина (ПДФ)
Оценка биомаркеров, связанных с фибрином, включает тесты, выявляющие ПДФ, такие как d-димеры, и анализы, выявляющие продукты образования предшественников фибрина на промежуточной стадии между фибриногеном и конечным стабильным фибрином, такие как растворимые мономеры фибрина.
ПДФ, такие как белковые фрагменты X, Y и D, являются результатом деградации трех компонентов цикла фибриноген-фибрин: исходного фибриногена, растворимого предшественника фибрина и сшитого фибрина — конечной стабильной формы фибрина. ПДФ обнаруживают у 99% пациентов с сепсисом. Однако этим тестам не хватает специфичности, поскольку они не могут различать продукты деградации, происходящие из конечного сшитого фибрина, промежуточного растворимого фибрина или исходного фибриногена [42]. Уровни ПДФ измеряются с помощью иммуноферментного анализа ELISA или методом латексной агглютинации, что позволяет проводить «прикроватную» оценку.
D-димеры также являются продуктами деградации фибрина, но они образуются только в результате протеолиза конечного сшитого фибрина, и на их уровень не влияют продукты деградации фибриногена [5]. Следовательно, d-димеры являются наиболее специфическим маркером среди продуктов деградации фибрина для оценки ДВС-синдрома. Обнаружение d-димеров указывает на то, что тромбин индуцирует превращение фибриногена в мономер фибрина и что фибрин сшивается активированным фактором XIII и впоследствии расщепляется плазмином [43].
Хотя d-димеры являются ПДФ и связаны с фибринолизом, их высокие уровни отражают сопутствующую активацию свертывания [44]. Следовательно, d-димеры могут указывать на повышенное образование, а не на деградацию фибрина. Фактически, повышенные уровни d-димеров наблюдаются при тромбозах и также включаются в шкалу ДВС-синдрома, где тяжелый сепсис коррелирует с гипофибринолизом. Таким образом, при сепсисе d-димеры повышены как из-за активации коагуляционного каскада, так и из-за гиперфибринолиза, наблюдаемого на ранней стадии инфекции. Однако при далеко зашедшем сепсисе d-димеры могут быть нормальными. Это связано со значительным ингибированием фибринолиза, что предотвращает образование d-димеров, несмотря на повышенное образование фибрина. Имеются данные о том, что использование d-димеров для диагностики ДВС-синдрома и стратификации риска при тяжелом сепсисе может вводить в заблуждение, поскольку нормальные уровни d-димеров ассоциировались с более высокими показателями смертности [43,44].
С другой стороны, растворимые мономеры фибрина могут быть эффективными маркерами внутрисосудистого образования фибрина при ДВС-синдроме [45]. Уровни растворимых мономеров фибрина в плазме отражают внутрисосудистое образование фибрина и не зависят от внесосудистого образования фибрина, которое может сопровождать местное воспаление или травму. Доступные клинические испытания показывают, что растворимые мономеры фибрина, превышающие пороговый уровень, позволяют поставить точный диагноз ДВС-синдрома. На сегодняшний день нет надежного теста для количественного определения уровней растворимого фибрина.
5.3. Фибриноген
В целом, низкий уровень фибриногена в сыворотке крови считается основным показателем нарушения коагуляции при сепсисе [46]. Однако фибриноген является реагентом острой фазы, и его уровень повышается из-за воспаления. В результате уровень фибриногена может оставаться в пределах нормального референсного диапазона в течение длительного периода времени после его постоянного употребления. Последовательные измерения фибриногена могут быть более полезными, с более высокой диагностической точностью [47].
5.4. Стандартные коагуляционные тесты
Стандартные коагуляционные тесты, включая ПТВ и активированное частичное тромбопластиновое время (аЧТВ), традиционно использовались для оценки системы гемостаза [48]. Тем не менее они не в полной мере отражают гемостатическое расстройство, вызванное сепсисом [49]. Аномальные значения стандартных тестов коагуляции наблюдаются только в позднем течении сепсиса, когда развивается гипокоагуляция, выявляемая этими тестами. Кроме того, они оценивают часть гемостатического механизма, так как они основаны на плазматических компонентах системы свертывания, в то время как решающий вклад клеточных компонентов не оценивается. Стандартные коагуляционные тесты в первую очередь оценивают активность прокоагулянтных факторов без учета одновременной активации антикоагулянтного механизма.
6. Нетрадиционные гемостатические тесты и маркеры при сепсисе
Для диагностики нарушений свертывания крови, связанных с сепсисом, применялись нетрадиционные тесты.
6.1. Визкозиметрические тесты
Тромбоэластография (ТЭГ) и ротационная тромбоэластометрия (РОТЭМ) представляют собой тесты, которые обеспечивают всестороннюю оценку процесса гемостаза от инициации коагуляции и образования сгустка до его растворения и фибринолиза [50,51]. С помощью этих методов оценивается вклад как плазматического, так и клеточного компонентов коагуляции. Визкозиметрические тесты могут быть полезны для заполнения пробелов в стандартных тестах на коагуляцию при оценке гемостатического статуса пациентов с сепсисом [49]. Таким образом, многочисленные исследования были сосредоточены на использовании данных тестов для выявления гемостатических изменений, сопровождающих сепсис. Также были проведены исследования в субпопуляциях, включая педиатрических и неонатальных пациентов с сепсисом [52–54]. Распространенность септических больных с нарушениями гемостаза, выявленными с помощью ТЭГ/РОТЭМ, колебалась от 43 до 100% [55]. Существует неоднородность в дизайне, проведении и результатах исследований [56,57]. Сообщалось как о гипокоагуляции, так и о гиперкоагуляции, что отражает патофизиологию коагулопатии при сепсисе и ДВС-синдроме. Как динамический процесс, коагулопатия, связанная с сепсисом, развивается быстро, и время проведения тестирования сильно влияет на результаты ТЭГ/РОТЭМ. Последовательные измерения могут более точно отображать развитие сепсис-индуцированной коагулопатии, от гиперкоагуляции на ранних стадиях до последующего развития ДВС-синдрома и гипокоагуляции. Вязкоупругие тесты также могут выявить нарушение фибринолиза, как сообщалось в нескольких исследованиях у пациентов с сепсисом [55,58].
Анализы вязкости могут обнаружить раннюю активацию свертывания крови, которая приводит к гиперкоагуляции, когда результаты стандартных тестов на коагуляцию все еще находятся в пределах нормы [55]. Ротационная тромбоэластометрия (РОТЭМ) использовалась для дифференцировки пациентов с сепсисом с нормальной свертываемостью, гиперкоагуляцией и гипокоагуляцией. Как гипокоагуляционный, так и гиперкоагуляционный гемостатический профиль в РОТЭМ коррелировал со значительно более высоким риском смертности [59]. В другом исследовании пациенты с явным ДВС-синдромом показали профиль гипокоагуляции в РОТЭМ, в то время как пациенты с сепсисом без явного ДВС-синдрома имели тенденцию к гиперкоагуляции [60].
TEG parameters have been used for the development of a score to predict DIC [62]. Furthermore, ROTEM clotting time (CT) variable correlated strongly with the JAAM DIC score and performed well in predicting DIC [63].
У всех этих пациентов были аномальные стандартные тесты на коагуляцию, и использование ротационной тромбоэластометрии могло помочь предотвратить прокоагулянтные вмешательства у пациентов с гиперкоагуляционным статусом, не выявляемым стандартными тестами на коагуляцию. Сто пациентов с сепсисом, тяжелым сепсисом или септическим шоком были обследованы с помощью ротационйно тромбоэластометрии [61]. Максимальная плотность сгустка (MCF) была выше в группах с сепсисом и тяжелым сепсисом по сравнению с контрольной группой здоровых лиц. При септическом шоке наблюдали нормальную максимальную плотность и пролонгированное образование сгустка. Эти результаты указывают на гиперкоагуляцию у пациентов с сепсисом или тяжелым сепсисом и на гипокоагуляцию в более поздней фазе септического шока.
Интересно, что фибринолитическая активность положительно коррелировала с 28-дневной смертностью. Параметры тромбоэластографии использовались для разработки оценки для прогнозирования ДВС-синдрома [62]. Кроме того, переменная времени свертывания крови РОТЭМ сильно коррелировала с оценкой ДВС-синдрома Japanese Association for Acute Medicine хорошо показала себя в прогнозировании ДВС [63].
Недавний метаанализ пришел к выводу, что тесты вязкоупругости надежны и полезны для прогнозирования ДВС-синдрома, связанного с сепсисом, и оценки риска смертности при тяжелом сепсисе [56]. Представляется, что как профиль гипокоагуляции, так и переход к гипокоагуляции могут выявить пациентов с риском развития ДВС-синдрома. Комбинация обычны тестов коагуляции и показателей вискозиметрии могут оптимизировать выявление и лечение ДВС-синдрома, а также улучшить выживаемость и исход.
6.2. Измерение нуклеарных компонентов
Сепсис вызывает активацию и повреждение клеток и последующее высвобождение нуклеарных компонентов в кровоток [15], которые включают бокс-протеин-1 группы высокой подвижности (HMGB1), нуклеосомы, гистоны, бесклеточную ДНК и внеклеточные ловушки нейтрофилов (NETs). Нуклеарные компоненты могут напрямую запускать экспрессию тканевого фактора в макрофагах и эндотелиальных клетках. Экспрессия тканевого фактора и последующая активация внешнего пути коагуляции опосредуется активацией рецепторов TLR2/4 и путей ядерного фактора-каппа B (NF-κB) и белка-активатора 1 (AP-1) [64]. HMGB1 служит маркером повреждения клеток, воспаления и тромбоза [65]. Действуя на окружающие клетки через рецепторы, он опосредует миграцию лейкоцитов и продукцию провоспалительных цитокинов [66]. HMGB1 также способствует экспрессии тканевого фактора на поверхности моноцитов и снижает антикоагулянтную активность тромбомодулина, способствуя таким образом тромбозу микрососудов. Высокие уровни HMGB1 наблюдались у пациентов с сепсисом и ДВС-синдромом и связаны с плохим прогнозом и повышенной смертностью [67].
Нуклеосомы представляют собой комплексы, образованные из 147 пар оснований ДНК, расположенных вокруг белкового ядра гистонов [68]. Нуклеосомы высвобождаются в кровоток при апоптотической гибели клеток [69]. Сообщалось о повышенных уровнях нуклеосом при различных состояниях, включая злокачественные новообразования, церебральный инсульт, сепсис и септический шок [70]. Повышенный уровень гистонов в плазме крови наблюдается у больных с сепсисом и ДВС-синдромом и положительно коррелирует со смертностью [71]. В доклинической модели внеклеточные гистоны запускали агрегацию тромбоцитов, приводя к коагулопатии потребления, тромбозу и кровотечению. Протромботическое действие гистонов ингибируется рекомбинантным тромбомодулином, который используется в терапевтических целях при ДВС-синдроме. Помимо того, что уровни гистонов являются биомаркерами повреждения эндотелия и активации гемостаза, они связаны с показателями по шкале SOFA[72]. Бесклеточная ДНК плазмы продемонстрировала высокую прогностическую ценность у пациентов с тяжелым сепсисом, превосходящую полиорганную дисфункцию и оценку по шкале APACHE II [73]. NET представляют собой внеклеточные компоненты нейтрофилов, образованные ДНК, гистонами и гранулярными белками, и проявляют значительные протромботические и провоспалительные свойства [74].
6.3. Измерение антикоагулянтных белков
Антитромбин является одним из важнейших физиологических антикоагулянтов и ингибирует внутренние (фактор XIa), внешние (фактор VIIa) и общие пути свертывания крови (фактор Ха, тромбин). При сепсисе и ДВС-синдроме уровни антитромбина снижаются из-за сниженного синтеза, повышенной деградации нейтрофильной эластазой и избыточного потребления в результате повышенного образования тромбина [75]. Снижение уровня антитромбина связано с тяжестью заболевания при сепсис-индуцированном ДВС-синдроме [76]. Сообщалось о снижении активности антитромбина ниже 80% у пациентов с сепсисом без полиорганной дисфункции [77]. Этот уровень достигает 60% у пациентов с полиорганной дисфункцией, тогда как прогрессирование ДВС-синдрома приводит к дальнейшему снижению активности антитромбина примерно до 40%. Повышенная смертность была продемонстрирована при низком уровне антитромбина у взрослых и детей с сепсисом [78,79].
Другой антикоагулянтный белок, протеин С, естественным образом активируется для ингибирования образования тромбина как внешним, так и внутренним путями [6]. Сепсис характеризуется истощением протеина С и нарушением продукции активированного протеина С, что делает их уровни потенциальными прогностическими биомаркерами в этой ситуации [80]. Активированный протеин С связывается со своим эндотелиальным рецептором (EPCR), который высвобождается в кровоток после повреждения клеток. Этот растворимый EPCR также изучался как показатель прогрессирования заболевания и исхода у пациентов с сепсисом [81].
Тромбомодулин представляет собой антикоагулянтный белок, продуцируемый эндотелиальными клетками, и связывается с тромбином, превращая протеин С в его активированную форму [82]. Тромбомодулин играет ключевую противовоспалительную, антикоагулянтную и антифибринолитическую роль. Он ингибирует адгезию лейкоцитов к эндотелиальным клеткам, предотвращает активацию комплемента, изменяет генерацию цитокинов и разрушает HMGB1 [83]. Тромбомодулин расщепляется нейтрофильной эластазой и циркулирует в растворимой форме [84]. Высокий уровень тромбомодулина в плазме коррелирует с повышенной смертностью у пациентов с сепсисом и ДВС-синдромом [85]. При сепсис-индуцированном ДВС-синдроме наблюдается повышение уровня растворимого тромбомодулина в плазме с сопутствующим снижением эндотелиального поверхностного тромбомодулина [86].
Природный антикоагулянт - ингибитор пути тканевого фактора (TFPI) ингибирует активацию тканевого фактора и внешний путь свертывания крови. Истощение TFPI связано с повышенной предрасположенностью к развитию ДВС-синдрома [6]. TFPI связывается с эндотелиальными гепариноподобными молекулами, и его циркулирующие уровни ниже по сравнению с антитромбином и активированным протеином С. Более того, значительная часть TFPIинактивируется путем связывания с липопротеином. Следовательно, TFPI не стал чувствительным маркером ДВС-синдрома.
6.4. Другие представляющие интерес маркеры
Комплекс тромбин-антитромбин (ТАТ) является маркером образования тромбина, который можно использовать для выявления пациентов с ДВС-синдромом, поскольку избыточное образование тромбина является ключевым признаком этого состояния [46]. Сообщалось о более высоких уровнях ТАТ у пациентов с ДВС-синдромом при поступлении или у тех, у кого развился ДВС-синдром, по сравнению с пациентами без ДВС-синдрома [87]. Повышенные уровни ТАТ коррелировали с повышенной смертностью у пациентов с сепсисом [26]. Комбинация ТАТ с другими маркерами имеет более высокую прогностическую ценность, чем каждая молекула в отдельности.
Хотя фибринолиз нарушен при сепсис-индуцированном ДВС-синдроме, это не определяется текущими параметрами коагуляции. Антифибринолитический белок PAI-1 широко исследовался в качестве потенциального маркера гипофибринолиза у септических пациентов с ДВС-синдромом [46]. Уровни PAH-1 могут идентифицировать пациентов с ДВС-синдромом и прогнозировать развитие ДВС-синдрома [88,89]. Как и в случае с TAT, сочетание PAI-1 с другими биомаркерами повышало эффективность PAI-1 [26]. Высокий PAI-1 был связан с повышенным риском смертности [90].
Эндогенный тромбиновый потенциал — анализ, указывающий на образование тромбина, также оценивали при сепсисе. Результаты были противоречивыми, и необходимы дальнейшие исследования. Однако недавние данные свидетельствуют о корреляции между усилением тяжести инфекции и снижением способности к образованию тромбина [91]. Этот биомаркер, возможно, может служить для прогнозирования развития полиорганной дисфункции и неблагоприятного исхода у пациентов с сепсисом [92].
Фрагмент протромбина 1.2 (F1.2) представляет собой пептид, образующийся при превращении протромбина в тромбин [93]. Его использование в качестве маркера образования тромбина было опубликовано и включено в критерии ДВС-синдрома Японского общества тромбоза и гемостаза (JSTH) [94].
ADAMTS-13 представляет собой расщепляющую фактор фон Виллебранда протеазу, которая регулирует размер мультимеров фактора фон Виллебранда [95]. Расщепление мультимеров фон Виллебранда снижает их протромботические свойства, поскольку более крупные молекулы обладают повышенной гемостатической способностью [96]. Дефицит ADAMTS-13, приводящий к формированию сверхбольших мультимеров фактора фон Виллебранда и тромботической микроангиопатии при сепсисе, был связан с тяжестью сепсиса и неблагоприятным прогнозом.
Четырнадцать традиционных и нетрадиционных биомаркеров, включая число тромбоцитов, протромбиновое время, аЧТВ, фибриноген, ПДФ, ТАТ, протеин С, плазминоген и PAI-1, были оценены для ранней диагностики ДВС-синдрома в исследовании Koyama et al. [26]. ТАТ, ИАП-1 и протеин С при поступлении хорошо дифференцировали пациентов с явным ДВС-синдромом и без него, в то время как ТАТ и ИАП-1 также были значимыми предикторами 28-дневной смертности. Помимо предсказания прогноза, определенные маркеры могут дополнительно использоваться для мониторинга лечения пациентов с ДВС-синдромом [15]. Кроме того, некоторые из них, включая антитромбин и рекомбинантный растворимый тромбомодулин, также были изучены и использованы для лечения ДВС-синдрома.
7. От руководств к клинической практике
В настоящее время не существует устоявшейся терапии сепсис-индуцированной коагулопатии. Недавно были опубликованы рекомендации Surviving Sepsis Campaign по лечению сепсиса и септического шока [97]. На основании этих рекомендаций фармакологическая тромбопрофилактика низкомолекулярным гепарином настоятельно рекомендуется пациентам с сепсисом или септическим шоком. Более того, в последних рекомендациях Japanese SurvivingSepsis Campaign от 2020 г. рекомендуется раннее выявление ДВС-синдрома, а использование антикоагулянтов при сепсис-ассоциированном ДВС-синдроме носит характер слабой рекомендации [98].
Было оценено несколько стратегий лечения сепсис-индуцированной коагулопатии, в основном направленных на подавление протромботических эффектов, таких как введение гепарина/гепариноидов или белков-антикоагулянтов (Table 2) [99, 100]. Эффективность рекомбинантного тромбомодулина при сепсис-индуцированной коагулопатии была недавно оценена в многонациональном рандомизированном контролируемом исследовании III фазы (включая пациентов с числом тромбоцитов < 50 109/л и протромбиновым временем > 1,4). Авторы этого исследования сообщили, что 28-дневная смертность уменьшилась на 2,6% у 800 пациентов с сепсисом, хотя эта разница в уровне смертности не была статистически значимой. [101].

За последние несколько лет несколько антикоагулянтов, в том числе антитромбин, были испытаны в попытке снизить смертность у пациентов с сепсисом; однако в значительной степени они не доказали свою эффективность [101]. Однако следует отметить, что все эти исследования были нацелены на пациентов с сепсисом, а не на пациентов с сепсис-индуцированной коагулопатии. Использование антитромбина не рекомендуется международными рекомендациями по сепсису. Напротив, постфактум анализ баз данных показал благотворное влияние антикоагулянтов на определенные подгруппы пациентов с сепсисом с ДВС-синдромом [102]. Возможное объяснение этого несоответствия заключается в неоднородности пациентов и сроках лечения антикоагулянтами в крупномасштабных исследованиях. Принципы персонифицированной медицины следует применять для выбора подходящих кандидатов на антикоагулянтную терапию среди пациентов с сепсисом.
8. Выводы
В этом обновленном обзоре объединены все современные знания о патогенезе сепсис-индуцированной коагулопатии, а также все последние обновления, касающиеся диагностических критериев сепсис-индуцированной коагулопатии, основанные на данных международных научных обществ. Кроме того, этот всеобъемлющий обзор включает подробное обсуждение всех традиционных и нетрадиционных биомаркеров сепсис-индуцированной коагулопатии. Сепсис-индуцированная коагулопатия часто осложняет течение болезни, обусловливает потенциально неблагоприятные исходы и повышенную смертность. Гиперкоагуляция является хорошо установленным патофизиологическим признаком сепсис-индуцированной коагулопатии со сдвигом в сторону гипокоагуляции только на поздних стадиях сепсиса, после развития ДВС-синдрома. Традиционные тесты на коагуляцию могут выявить гипокоагуляцию на поздней стадии, но не чувствительны к выявлению данных изменений на ранней стадии. Существует пробел в диагностике расстройств гемостаза при сепсисе. Определение сепсис-индуцированной коагулопатии было введено, чтобы помочь идентифицировать нарушения коагуляции у пациентов с сепсисом до установления ДВС-синдрома, на ранних стадиях, которые можно было бы обратить вспять с помощью терапевтических вмешательств. В этом контексте изучение новых специализированных тестов, таких как тромбоэластометрия, имеет важное значение для пациентов с тяжелым сепсисом, поскольку это может обосновать раннее лечение в фазу гиперкоагуляции. Необходимы дальнейшие исследования диагностических биомаркеров и их потенциальных комбинаций для повышения точности диагностики.
References
1. Singer, M.; Deutschman, C.S.; Seymour, C.W.; Shankar-Hari, M.; Annane, D.; Bauer, M.; Bellomo, R.; Bernard, G.R.; Chiche, J.-D.; Coopersmith, C.M.; et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016, 315, 801–810.[CrossRef]
2. Giustozzi, M.; Ehrlinder, H.; Bongiovanni, D.; Borovac, J.A.; Guerreiro, R.A.; Ga˛secka, A.; Papakonstantinou, P.E.; Parker, W.A. Coagulopathy and sepsis: Pathophysiology, clinical manifestations and treatment. Blood Rev. 2021, 50, 100864. [CrossRef] [PubMed]
3. Martin, G.S.; Mannino, D.M.; Eaton, S.; Moss, M. The Epidemiology of Sepsis in the United States from 1979 through 2000. N. Engl. J. Med. 2003, 348, 1546–1554. [CrossRef] [PubMed]
4. Cecconi, M.; Evans, L.; Levy, M.; Rhodes, A. Sepsis and septic shock. Lancet 2018, 392, 75–87.[CrossRef]
5. Levi, M.; van der Poll, T. Coagulation and sepsis. Thromb. Res. 2017, 149, 38–44. [CrossRef][PubMed]
6. Sungurlu, S.; Kuppy, J.; Balk, R.A. Role of Antithrombin III and Tissue Factor Pathway in thePathogenesis of Sepsis. Crit. Care Clin. 2020, 36, 255–265. [CrossRef] [PubMed]
7. Denning, N.-L.; Aziz, M.; Gurien, S.D.; Wang, P. DAMPs and NETs in Sepsis. Front. Immunol.2019, 10, 2536. [CrossRef] [PubMed]
8. Levi, M.; van der Poll, T. Inflammation and coagulation. Crit. Care Med. 2010, 38, S26–S34.[CrossRef]
9. Levi, M.; Poll, T. Coagulation in patients with severe sepsis. Semin. Thromb. Hemost. 2015, 41,9–15. [CrossRef]
10. Gando, S. Role of Fibrinolysis in Sepsis. Semin. Thromb. Hemost. 2013, 39, 392–399.[CrossRef]
11. Degen, J.L.; Bugge, T.H.; Goguen, J.D. Fibrin and fibrinolysis in infection and host defense. J. Thromb. Haemost. 2007, 5, 24–31. [CrossRef] [PubMed]
12. Bergmann, S.; Hammerschmidt, S. Fibrinolysis and host response in bacterial infections.Thromb. Haemost. 2007, 98, 512–520. [CrossRef]
13. Petros, S.; Kliem, P.; Siegemund, T. Thrombin generation in severe sepsis. Thromb. Res. 2012,129, 797–800. [CrossRef]
14. Coughlin, S.R. Thrombin signalling and protease-activated receptors. Nature 2000, 407, 258–264. [CrossRef] [PubMed]
15. Iba, T.; Ito, T.; Maruyama, I.; Jilma, B.; Brenner, T.; Müller, M.C.; Juffermans, N.P.; Thachil, J. Potential diagnostic markers for disseminated intravascular coagulation of sepsis. Blood Rev.2016, 30, 149–155. [CrossRef]
16. Yuksel, M.; Okajima, K.; Uchiba, M.; Horiuchi, S.; Okabe, H. Activated protein C inhibits lipopolysaccharide-induced tumor necrosis factor-alpha production by inhibiting activation of both nuclear factor-kappa B and activator protein-1 in human monocytes. Thromb. Haemost.2002, 88, 267–273. [CrossRef] [PubMed]
17. Wheeler, A.P.; Bernard, G.R. Treating Patients with Severe Sepsis. N. Engl. J. Med. 1999, 340,207–214. [CrossRef] [PubMed]
18. Taylor, F.B.; Toh, C.H.; Hoots, W.K.; Wada, H.; Levi, M. Towards definition, clinical andlaboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb.Haemost. 2001, 86, 1327–1330. [CrossRef]
19. Gando, S.; Levi, M.; Toh, C.H. Disseminated intravascular coagulation. Nat. Rev. Dis. Primers2016, 2, 16037. [CrossRef]
20. Iba, T.; Levy, J.H. Sepsis-induced Coagulopathy and Disseminated Intravascular Coagulation. Anesthesiology 2020, 132, 1238–1245. [CrossRef]
21. Iba, T.; Levy, J.H.; Warkentin, T.E.; Thachil, J.; van der Poll, T.; Levi, M. Diagnosis and management of sepsis-induced coagulopathy and disseminated intravascular coagulation. J.Thromb. Haemost. 2019, 17, 1989–1994. [CrossRef] [PubMed]
22. Gando, S.; Iba, T.; Eguchi, Y.; Ohtomo, Y.; Okamoto, K.; Koseki, K.; Mayumi, T.; Murata, A.; Ikeda, T.; Ishikura, H.; et al. A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: Comparing current criteria. Crit. Care Med. 2006, 34, 625–631. [CrossRef] [PubMed]
23. Levi, M.; Sivapalaratnam, S. Disseminated intravascular coagulation: An update on pathogenesisand diagnosis. Expert Rev.
Hematol. 2018, 11, 663–672. [CrossRef] [PubMed]
24. Iba, T.; Levi, M.; Levy, J.H. Sepsis-Induced Coagulopathy and Disseminated Intravascular Coagulation. Semin. Thromb. Hemost.
2020, 46, 089–095. [CrossRef]
25. Iba, T.; Di Nisio, M.; Levy, J.H.; Kitamura, N.; Thachil, J. New criteria for sepsis-inducedcoagulopathy (SIC) following the revised sepsis definition: A retrospective analysis of anationwide survey. BMJ Open 2017, 7, e017046. [CrossRef]
26. Koyama, K.; Madoiwa, S.; Nunomiya, S.; Koinuma, T.; Wada, M.; Sakata, A.; Ohmori, T.;Mimuro, J.; Sakata, Y. Combination of thrombin-antithrombin complex, plasminogen activatorinhibitor-1, and protein C activity for early identification of severe coagulopathy in initial phaseof sepsis: A prospective observational study. Crit. Care 2014, 18, R13. [CrossRef] [PubMed]
27. Hack, C.E. Fibrinolysis in Disseminated Intravascular Coagulation. Semin. Thromb. Hemost.2001, 27, 633–638. [CrossRef]
28. Engelmann, B.; Massberg, S. Thrombosis as an intravascular effector of innate immunity. Nat. Rev. Immunol. 2013, 13, 34–45. [CrossRef]
29. Schmitt, F.C.F.; Manolov, V.; Morgenstern, J.; Fleming, T.; Heitmeier, S.; Uhle, F.; Al-Saeedi, M.;Hackert, T.; Bruckner, T.; Schöchl, H.; et al. Acute fibrinolysis shutdown occurs early in septic shock and is associated with increased morbidity and mortality: Results of an observational pilotstudy. Ann. Intensive Care 2019, 9, 19. [CrossRef]
30. Asakura, H. Classifying types of disseminated intravascular coagulation: Clinical and animalmodels. J. Intensive Care 2014, 2, 20.
[CrossRef]
31. Iba, T.; Di Nisio, M.; Thachil, J.; Wada, H.; Asakura, H.; Sato, K.; Saitoh, D. A Proposal of the Modification of Japanese Society on Thrombosis and Hemostasis (JSTH) Disseminated Intravascular Coagulation (DIC) Diagnostic Criteria for Sepsis-Associated DIC. Clin. Appl.Thromb. 2018, 24, 439–445. [CrossRef]
32. Iba, T.; Arakawa, M.; Di Nisio, M.; Gando, S.; Anan, H.; Sato, K.; Ueki, Y.; Levy, J.H.; Thachil, J. Newly Proposed Sepsis-Induced Coagulopathy Precedes International Society on Thrombosisand Haemostasis Overt-Disseminated Intravascular Coagulation and Predicts High Mortality. J.Intensive Care Med. 2020, 35, 643–649. [CrossRef] [PubMed]
33. Iba, T.; Arakawa, M.; Levy, J.H.; Yamakawa, K.; Koami, H.; Hifumi, T.; Sato, K. Sepsis-Induced Coagulopathy and Japanese Association for Acute Medicine DIC in Coagulopathic Patients with Decreased Antithrombin and Treated by Antithrombin. Clin. Appl. Thromb. 2018, 24, 1020–1026. [CrossRef] [PubMed]
34. Yamakawa, K.; Yoshimura, J.; Ito, T.; Hayakawa, M.; Hamasaki, T.; Fujimi, S. External Validation of the Two Newly Proposed Criteria for Assessing Coagulopathy in Sepsis. Thromb.Haemost. 2019, 119, 203–212. [CrossRef] [PubMed]
35. Folman, C.C.; Linthorst, G.E.; van Mourik, J.; van Willigen, G.; de Jonge, E.; Levi, M.; von dem Borne, A.E. Platelets release thrombopoietin (Tpo) upon activation: Another regulatory loop in thrombocytopoiesis? Thromb. Haemost. 2000, 83, 923–930. [CrossRef]
36. Shannon, O. The role of platelets in sepsis. Res. Pract. Thromb. Haemost. 2020, 5, 27–37.[CrossRef]
37. Venkata, C.; Kashyap, R.; Farmer, J.C.; Afessa, B. Thrombocytopenia in adult patients withsepsis: Incidence, risk factors, and its association with clinical outcome. J. Intensive Care 2013,1, 9. [CrossRef] [PubMed]
38. Vanderschueren, S.; De Weerdt, A.; Malbrain, M.; Vankersschaever, D.; Frans, E.; Wilmer, A.;Bobbaers, H. Thrombocytopenia and prognosis in intensive care. Crit. Care Med. 2000, 28,1871–1876. [CrossRef]
39. Gawaz, M.; Fateh-Moghadam, S.; Pilz, G.; Gurland, H.-J.; Werdan, K. Platelet activation andinteraction with leucocytes in patients with sepsis or multiple organ failure. Eur. J. Clin.Investig. 1995, 25, 843–851. [CrossRef]
40. Hamzeh-Cognasse, H.; Damien, P.; Chabert, A.; Pozzetto, B.; Cognasse, F.; Garraud, O.Platelets and Infections—Complex Interactions with Bacteria. Front. Immunol. 2015, 6, 82.[CrossRef]
41. Hubert, R.M.E.; Rodrigues, M.V.; Andreguetto, B.D.; Santos, T.M.; Gilberti, M.D.F.P.; de Castro,V.; Annichino-Bizzacchi, J.M.; Dragosavac, D.; Carvalho-Filho, M.A.; De Paula, E.V. Association of the immature platelet fraction with sepsis diagnosis and severity. Sci. Rep. 2015,5, srep08019. [CrossRef] [PubMed]
42. Horan, J.T.; Francis, C.W. Fibrin Degradation Products, Fibrin Monomer and Soluble Fibrin in Disseminated Intravascular Coagulation. Semin. Thromb. Hemost. 2001, 27, 657–666.[CrossRef] [PubMed]
43. Semeraro, F.; Ammollo, C.T.; Caironi, P.; Masson, S.; Latini, R.; Panigada, M.; Colucci, M. Low D-dimer levels in sepsis: Good or bad? Thromb. Res. 2019, 174, 13–15. [CrossRef]
44. Favresse, J.; Lippi, G.; Roy, P.M.; Chatelain, B.; Jacqmin, H.; Ten Cate, H.; Mullier, F. D-dimer:Preanalytical, analytical, postanalytical variables, and clinical applications. Crit. Rev. Clin. Lab.Sci. 2018, 55, 548–577. [CrossRef]
45. Toh, J.M.; Ken-Dror, G.; Downey, C.; Abrams, S.T. The clinical utility of fibrin-relatedbiomarkers in sepsis. Blood Coagul. Fibrinolysis 2013, 24, 839–843. [CrossRef]
46. Adelborg, K.; Larsen, J.B.; Hvas, A. Disseminated intravascular coagulation: Epidemiology,biomarkers, and management. Br. J. Haematol. 2021, 192, 803–818. [CrossRef] [PubMed]
47. Levi, M.; Meijers, J.C. DIC: Which laboratory tests are most useful. Blood Rev. 2011, 25, 33–37.[CrossRef]
48. Kamal, A.H.; Tefferi, A.; Pruthi, R.K. How to Interpret and Pursue an Abnormal Prothrombin Time, Activated Partial Thrombo- plastin Time, and Bleeding Time in Adults. Mayo Clin. Proc.2007, 82, 864–873. [CrossRef]
49. Scarlatescu, E.; Juffermans, N.P.; Thachil, J. The current status of viscoelastic testing in septiccoagulopathy. Thromb. Res. 2019,
183, 146–152. [CrossRef]
50. Görlinger, K.; Pérez-Ferrer, A.; Dirkmann, D.; Saner, F.; Maegele, M.; Calatayud, Á.A.P.; Kim, T.-Y. The role of evidence-based algorithms for rotational thromboelastometry-guided bleedingmanagement. Korean J. Anesthesiol. 2019, 72, 297–322. [CrossRef]
51. Georgiadou, P.; Sokou, R.; Tsantes, A.G.; Parastatidou, S.; Konstantinidi, A.; Houhoula, D.;Kokoris, S.; Iacovidou, N.; Tsantes,
A.E. The Non-Activated Thromboelastometry (NATEM) Assay’s Application among Adults andNeonatal/Pediatric Population: A Systematic Review. Diagnostics 2022, 12, 658. [CrossRef][PubMed]
52. Sokou, R.; Ioakeimidis, G.; Piovani, D.; Parastatidou, S.; Konstantinidi, A.; Tsantes, A.G.;Lampridou, M.; Houhoula, D.; Iacovidou, N.; Kokoris, S.; et al. Development and validation of asepsis diagnostic scoring model for neonates with suspected sepsis. Front. Pediatr. 2022, 10,1004727. [CrossRef] [PubMed]
53. Sokou, R.; Tritzali, M.; Piovani, D.; Konstantinidi, A.; Tsantes, A.G.; Ioakeimidis, G.; Lampridou, M.; Parastatidou, S.; Iacovidou, N.; Kokoris, S.; et al. Comparative Performance ofFour Established Neonatal Disease Scoring Systems in Predicting In-Hospital Mortality and thePotential Role of Thromboelastometry. Diagnostics 2021, 11, 1955. [CrossRef] [PubMed]
54. Tsantes, A.G.; Sokou, R.; Konstantinidi, A.; Ioakeimidis, G.; Lampridou, M.; Parastatidou, S.;Theodoraki, M.; Piovani, D.; Iliodromiti, Z.; Boutsikou, T.; et al. Rotational Thromboelastometry in Neonates Admitted to a Neonatal Intensive Care Unit: A Large Cross-sectional Study. Semin.Thromb. Hemost. 2021, 47, 875–884. [CrossRef] [PubMed]
55. Müller, M.C.; Meijers, J.C.; Vroom, M.B.; Juffermans, N.P. Utility of thromboelastography and/or thromboelastometry in adults with sepsis: A systematic review. Crit. Care 2014, 18, R30.[CrossRef] [PubMed]
56. Hu, Y.L.; McRae, H.L.; Refaai, M.A. Efficacy of viscoelastic hemostatic assay testing in patients with sepsis-induced disseminated intravascular coagulation. Eur. J. Haematol. 2021, 106, 873–875. [CrossRef]
57. Katsaras, G.; Sokou, R.; Tsantes, A.G.; Piovani, D.; Bonovas, S.; Konstantinidi, A.; Ioakeimidis,G.; Parastatidou, S.; Gialamprinou, D.; Makrogianni, A.; et al. The use of thromboelastography (TEG) and rotational thromboelastometry (ROTEM) in neonates: A systematic review. Eur. J.Pediatr. 2021, 180, 3455–3470. [CrossRef]
58. Lampridou, M.; Sokou, R.; Tsantes, A.G.; Theodoraki, M.; Konstantinidi, A.; Ioakeimidis, G.; Bonovas, S.; Politou, M.; Valsami, S.; Iliodromiti, Z.; et al. ROTEM diagnostic capacity formeasuring fibrinolysis in neonatal sepsis. Thromb. Res. 2020, 192, 103–108. [CrossRef]
59. Adamik, B.; Gozdzik, W.; Jakubczyk, D.; Welna, M.; Kübler, A. Coagulation abnormalities identified by thromboelastometry in patients with severe sepsis: The relationship to endotoxemiaand mortality. Blood Coagul. Fibrinolysis 2017, 28, 163–170. [CrossRef]
60. Sivula, M.; Pettilä, V.; Niemi, T.T.; Varpula, M.; Kuitunen, A.H. Thromboelastometry inpatients with severe sepsis and dissemi- nated intravascular coagulation. Blood Coagul.Fibrinolysis 2009, 20, 419–426. [CrossRef]
61. Davies, G.R.; Lawrence, M.; Pillai, S.; Mills, G.M.; Aubrey, R.; Thomas, D.; Williams, R.;Morris, K.; Evans, P.A. The effect of sepsis and septic shock on the viscoelastic properties of clot quality and mass using rotational thromboelastometry: A prospective observational study. J.Crit. Care 2018, 44, 7–11. [CrossRef] [PubMed]
62. Sharma, P.; Saxena, R. A Novel Thromboelastographic Score to Identify Overt DisseminatedIntravascular Coagulation Resulting in a Hypocoagulable State. Am. J. Clin. Pathol. 2010, 134,97–102. [CrossRef] [PubMed]
63. Koami, H.; Sakamoto, Y.; Ohta, M.; Goto, A.; Narumi, S.; Imahase, H.; Inoue, S. Can rotational thromboelastometry predict septic disseminated intravascular coagulation? Blood Coagul.Fibrinolysis 2015, 26, 778–783. [CrossRef]
64. Li, Y.; Wan, D.; Luo, X.; Song, T.; Wang, Y.; Yu, Q.; Jiang, L.; Liao, R.; Zhao, W.; Su, B.Circulating Histones in Sepsis: Potential Outcome Predictors and Therapeutic Targets. Front.Immunol. 2021, 12, 650184. [CrossRef] [PubMed]
65. Andersson, U.; Tracey, K.J. HMGB1 Is a Therapeutic Target for Sterile Inflammation andInfection. Annu. Rev. Immunol. 2011, 29,
139–162. [CrossRef]
66. Ito, T.; Kawahara, K.; Nakamura, T.; Yamada, S.; Nakamura, T.; Abeyama, K.; Hashiguchi, T.; Maruyama, I. High-mobility group box 1 protein promotes development of microvascularthrombosis in rats. J. Thromb. Haemost. 2007, 5, 109–116. [CrossRef]
67. Hatada, T.; Nobori, T.; Okabayashi, K.; Maruyama, K.; Abe, Y.; Uemoto, S.; Yamada, S.;Maruyama, I.; Wada, H. Plasma concentrations and importance of high mobility group box protein in the prognosis of organ failure in patients with disseminated intravascular coagulation.Thromb. Haemost. 2005, 94, 975–979. [CrossRef] [PubMed]
68. Morimont, L.; Dechamps, M.; David, C.; Bouvy, C.; Gillot, C.; Haguet, H.; Favresse, J.;Ronvaux, L.; Candiracci, J.; Herzog, M.; et al. NETosis and Nucleosome Biomarkers in Septic Shock and Critical COVID-19 Patients: An Observational Study. Biomolecules 2022, 12, 1038.[CrossRef]
69. Chen, Q.; Ye, L.; Jin, Y.; Zhang, N.; Lou, T.; Qiu, Z.; Jin, Y.; Cheng, B.; Fang, X. Circulatingnucleosomes as a predictor of sepsis and organ dysfunction in critically ill patients. Int. J. Infect.Dis. 2012, 16, e558–e564. [CrossRef]
70. Xu, J.; Zhang, X.; Pelayo, R.; Monestier, M.; Ammollo, C.T.; Semeraro, F.; Taylor, F.B.; Esmon, N.L.; Lupu, F.; Esmon, C.T. Extracellular histones are major mediators of death in sepsis. Nat.Med. 2009, 15, 1318–1321. [CrossRef]
71. Nakahara, M.; Ito, T.; Kawahara, K.-I.; Yamamoto, M.; Nagasato, T.; Shrestha, B.; Yamada, S.;Miyauchi, T.; Higuchi, K.; Takenaka, T.; et al. Recombinant Thrombomodulin Protects Miceagainst Histone-Induced Lethal Thromboembolism. PLoS ONE 2013, 8, e75961. [CrossRef][PubMed]
72. Abrams, S.T.; Zhang, N.; Manson, J.; Liu, T.; Dart, C.; Baluwa, F.; Toh, C.H. Circulating histones are mediators of trauma-associated lung injury. Am. J. Respir. Crit. Care Med. 2013,187, 160–169. [CrossRef] [PubMed]
73. Dwivedi, D.J.; Toltl, L.J.; Swystun, L.L.; Pogue, J.; Liaw, K.-L.; Weitz, J.I.; Cook, D.J.; Fox-Robichaud, A.E.; Liaw, P.C.; Canadian Critical Care Translational Biology Group. Prognosticutility and characterization of cell-free DNA in patients with severe sepsis. Crit. Care 2012, 16,R151. [CrossRef] [PubMed]
74. Iba, T.; Levy, J.H. Inflammation and thrombosis: Roles of neutrophils, platelets and endothelial cells and their interactions in thrombus formation during sepsis. J. Thromb. Haemost. 2018, 16, 231–241. [CrossRef]
75. Levi, M.; de Jonge, E.; van der Poll, T. Rationale for restoration of physiological anticoagulantpathways in patients with sepsis and disseminated intravascular coagulation. Crit. Care Med.2001, 29, S90–S94. [CrossRef]
76. Levi, M.M.; Toh, C.H.; Thachil, J.; Watson, H.G. Guidelines for the diagnosis and management of disseminated intravascular coagulation. British Committee for Standards in Haematology. Br.J. Haematol. 2009, 145, 24–33. [CrossRef]
77. Iba, T.; Kidokoro, A.; Yagi, Y. The Role of the Endothelium in Changes in ProcoagulantActivity in Sepsis. J. Am. Coll. Surg. 1998,
187, 321–329. [CrossRef]
78. Warren, B.L.; Eid, A.; Singer, P.; Pillay, S.S.; Carl, P.; Novak, I.; Chalupa, P.; Atherstone, A.; Pénzes, I.; Kübler, A.; et al. High-dose antithrombin III in severe sepsis: A randomizedcontrolled trial. JAMA 2001, 286, 1869–1878. [CrossRef]
79. Niederwanger, C.; Hell, T.; Hofer, S.; Salvador, C.; Michel, M.; Schenk, B.; Treml, B.; Bachler, M. Antithrombin deficiency is associated with mortality and impaired organ function in septicpediatric patients: A retrospective study. PeerJ 2018, 6, e5538. [CrossRef]
80. Martí-Carvajal, A.J.; Solà, I.; Gluud, C.; Lathyris, D.; Anand, V. Human recombinant protein C for severe sepsis and septic shock in adult and paediatric patients. Cochrane Database Syst. Rev.2012, 12, CD004388. [CrossRef]
81. Guitton, C.; Gérard, N.; Sébille, V.; Bretonnière, C.; Zambon, O.; Villers, D.; Charreau, B. Early rise in circulating endothelial protein C receptor correlates with poor outcome in severe sepsis.Intensive Care Med. 2011, 37, 950–956. [CrossRef]
82. Huang, M.; Cai, S.; Su, J. The Pathogenesis of Sepsis and Potential Therapeutic Targets. Int. J. Mol. Sci. 2019, 20, 5376. [CrossRef] [PubMed]
83. Conway, E.M. Thrombomodulin and its role in inflammation. Semin. Immunopathol. 2011, 34,107–125. [CrossRef] [PubMed]
84. Furuno, T.; Mitsuyama, T.; Hidaka, K.; Tanaka, T.; Hara, N. The Role of Neutrophil Elastase in Human Pulmonary Artery Endothelial Cell Injury. Int. Arch. Allergy Immunol. 1997, 112, 262–269. [CrossRef] [PubMed]
85. Kinasewitz, G.T.; Yan, S.B.; Basson, B.; Comp, P.; Russell, J.A.; Cariou, A.; Um, S.L.; Utterback, B.; Laterre, P.-F.; Dhainaut, J.-F. Universal changes in biomarkers of coagulation andinflammation occur in patients with severe sepsis, regardless of causative micro-organism [ISRCTN74215569]. Crit. Care 2004, 8, R82–R90. [CrossRef]
86. Boehme, M.W.; Deng, Y.; Raeth, U.; Bierhaus, A.; Ziegler, R.; Stremmel, W.; Nawroth, P.P. Release of thrombomodulin from endothelial cells by concerted action of TNF-alpha andneutrophils: In vivo and in vitro studies. Immunology 1996, 87, 134–140.
87. Kushimoto, S.; Wada, H.; Kawasugi, K.; Okamoto, K.; Uchiyama, T.; Seki, Y.; Hatada, T.; Imai,H.; Nobori, T.; Subcommittee,
J.S.O.T.H. Increased Ratio of Soluble Fibrin Formation/Thrombin Generation in Patients WithDIC. Clin. Appl. Thromb. 2012, 18, 628–632. [CrossRef]
88. Mei, H.; Jiang, Y.; Luo, L.; Huang, R.; Su, L.; Hou, M.; Wang, X.; Deng, J.; Hu, Y. Evaluation the combined diagnostic value of TAT, PIC, tPAIC, and sTM in disseminated intravascular coagulation: A multi-center prospective observational study. Thromb. Res. 2018, 173, 20–26.[CrossRef]
89. Hoshino, K.; Kitamura, T.; Nakamura, Y.; Irie, Y.; Matsumoto, N.; Kawano, Y.; Ishikura, H. Usefulness of plasminogen activator inhibitor-1 as a predictive marker of mortality in sepsis. J.Intensive Care 2017, 5, 67. [CrossRef]
90. Tipoe, T.L.; Wu, W.K.K.; Chung, L.; Gong, M.; Dong, M.; Liu, T.; Roever, L.; Ho, J.; Wong, M.C.S.; Chan, M.T.V.; et al. Plasminogen Activator Inhibitor 1 for Predicting Sepsis Severity and Mortality Outcomes: A Systematic Review and Meta-Analysis. Front. Immunol. 2018, 9,1218. [CrossRef]
91. Elad, B.; Avraham, G.; Schwartz, N.; Elias, A.; Elias, M. Role of a thrombin generation assay inthe prediction of infection severity.
Sci. Rep. 2021, 11, 7814. [CrossRef]
92. Mihajlovic, D.; Brkic, S.; Lendak, D.; Mikic, A.N.; Draskovic, B.; Mitic, G. Endogenousthrombin potential as marker of procoagulant response that can be useful in early stage of sepsis.Blood Coagul. Fibrinolysis 2017, 28, 460–467. [CrossRef] [PubMed]
93. Levi, M.; Vincent, J.-L.; Tanaka, K.; Radford, A.H.; Kayanoki, T.; Fineberg, D.A.;Hoppensteadt, D.; Fareed, J. Effect of a Recombinant Human Soluble Thrombomodulin onBaseline Coagulation Biomarker Levels and Mortality Outcome in Patients with Sepsis-Associated Coagulopathy. Crit. Care Med. 2020, 48, 1140–1147. [CrossRef] [PubMed]
94. Asakura, H.; Takahashi, H.; Uchiyama, T.; Eguchi, Y.; Okamoto, K.; Kawasugi, K.; Madoiwa, S.; Wada, H.; DIC Subcommittee of the Japanese Society on Thrombosis and Hemostasis.Proposal for new diagnostic criteria for DIC from the Japanese Society on Thrombosis andHemostasis. Thromb. J. 2016, 14, 42. [CrossRef] [PubMed]
95. Zheng, X.; Chung, D.; Takayama, T.K.; Majerus, E.M.; Sadler, J.E.; Fujikawa, K. Structure of von Willebrand Factor-cleaving Protease (ADAMTS13), a Metalloprotease Involved in Thrombotic Thrombocytopenic Purpura. J. Biol. Chem. 2001, 276, 41059– 41063. [CrossRef]
96. Levi, M.; Scully, M.; Singer, M. The role of ADAMTS -13 in the coagulopathy of sepsis. J. Thromb. Haemost. 2018, 16, 646–651. [CrossRef]
97. Evans, L.; Rhodes, A.; Alhazzani, W.; Antonelli, M.; Coopersmith, C.M.; French, C.; Machado, F.R.; Mcintyre, L.; Ostermann, M.; Prescott, H.C.; et al. Surviving sepsis campaign: International guidelines for management of sepsis and septic shock 2021. Intensive Care Med.2021, 47, 1181–1247. [CrossRef]
98. Egi, M.; Ogura, H.; Yatabe, T.; Atagi, K.; Inoue, S.; Iba, T.; Kakihana, Y.; Kawasaki, T.; Kushimoto, S.; Kuroda, Y.; et al. The Japanese Clinical Practice Guidelines for Management of Sepsis and Septic Shock 2020 (J-SSCG 2020). Acute Med. Surg. 2021, 8, 53. [CrossRef]
99. Inata, Y. Should we treat sepsis-induced DIC with anticoagulants? J. Intensive Care 2020, 8, 18.[CrossRef]
100. Kienast, J.; Juers, M.; Wiedermann, C.J.; Hoffmann, J.N.; Ostermann, H.; Strauss, R.; Keinecke, H.-O.; Warren, B.L.; Opal, S.M.; The KyberSept Investigators. Treatment effects of high-dose antithrombin without concomitant heparin in patients with severe sepsis with or withoutdisseminated intravascular coagulation. J. Thromb. Haemost. 2006, 4, 90–97. [CrossRef]
101. Vincent, J.L.; Francois, B.; Zabolotskikh, I.; Daga, M.K.; Lascarrou, J.B.; Kirov, M.Y.;SCARLET Trial Group. Effect of a recombinant human soluble thrombomodulin on mortality in patients with sepsis-associated coagulopathy: The SCARLET randomized clinical trial. JAMA2019, 321, 1993–2002. [CrossRef] [PubMed]
102. Scarlatescu, E.; Tomescu, D.; Arama, S.S. Review. Anticoagulant Therapy in Sepsis. TheImportance of Timing. J. Crit. Care Med.
2017, 3, 63–69. [CrossRef] [PubMed]
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 20.09.2023
[ACTIVE_FROM] => 20.09.2023
[SHOW_COUNTER] => 4007
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 828881
[VALUE] => сепсис; коагуляция; диссеминированное внутрисосудистое свертывание; сепсис-индуцированная коагулопатия; лабораторная оценка методические рекомендации
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => сепсис; коагуляция; диссеминированное внутрисосудистое свертывание; сепсис-индуцированная коагулопатия; лабораторная оценка методические рекомендации
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 828883
[VALUE] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 828882
[VALUE] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830441
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828889
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828885
[1] => 828886
[2] => 828887
[3] => 828888
[4] => 828903
)
[VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => Krovotecheniya i koagulopatii
[4] => Koagulyatsiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => Krovotecheniya i koagulopatii
[4] => Koagulyatsiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830441
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828889
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828885
[1] => 828886
[2] => 828887
[3] => 828888
[4] => 828903
)
[VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => Krovotecheniya i koagulopatii
[4] => Koagulyatsiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => kriticheskiesostoyaniya
[2] => intensivnayaterapiya
[3] => Krovotecheniya i koagulopatii
[4] => Koagulyatsiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Критические состояния
[2] => Интенсивная терапия
[3] => Кровотечения и коагулопатии
[4] => Коагуляция
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 13.08.2025 01:26:24
[~TIMESTAMP_X] => 13.08.2025 01:26:24
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[FULLTEXT_INDEX] => N
[~FULLTEXT_INDEX] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
[BROWSER_TITLE] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
[KEYWORDS] => сепсис; коагуляция; диссеминированное внутрисосудистое свертывание; сепсис-индуцированная коагулопатия; лабораторная оценка методические рекомендации
[DESCRIPTION] => Сепсис-индуцированная коагулопатия: обновленная информация о патофизиологии, биомаркерах и текущих рекомендациях
)
)




