Сепсис ассоциируется с повреждением митохондриальной ДНК и снижением митохондриальной массы в почках
van der Slikke et al. Crit Care (2021) 25:36
Исследование
Сепсис ассоциируется с повреждением митохондриальной ДНК и снижением митохондриальной массы в почках у пациентов с сепсис-индуцированным ОПП
Перевод оригинальной статьи «Sepsis is associated with mitochondrial DNA damage and a reduced mitochondrial mass in the kidney of patients with sepsis-AKI»
Авторы: Elisabeth C. van der Slikke, Hjalmar R. Bouma
Department of Clinical Pharmacy and Pharmacology, University of Groningen, University Medical Center Groningen, P.O. Box 30.001, EB70, 9700 RB Groningen, The Netherlands.
Department of Critical Care, University of Groningen, University Medical Center Groningen, Groningen, The Netherlands.
Department of Pathology and Medical Biology, Medical Biology Section, University of Groningen, University Medical Center Groningen, Groningen, The Netherlands. Department of Internal Medicine, University of Groningen, University Medical Center Groningen, Groningen, The Netherlands.
Keywords: Sepsis, Acute kidney injury, Reactive oxygen species, Mitochondria
Ключевые слова: острое повреждение почек, активные формы кислорода, митохондрия
Введение
Сепсис определяется как нарушенный иммунный ответ (англ. host response или ответ хозяина) на инфекцию, что ведет к расстройству органного гомеостаза, полиорганной недостаточности и, в конечном итоге, к смерти пациентов [1]. Летальность и заболеваемость, связанная с сепсисом и септическим шоком, остается высокой. Госпитальная летальность составляет 20-30% для сепсиса и 40-60% для септического шока [1, 2].
Несмотря на широкомасштабные исследования, патофизиология сепсиса до конца на раскрыта и, как результат, мы не имеем на сегодня терапевтических возможностей для прямого воздействия на молекулярные механизмы развития органной дисфункции, а существующая терапия ограничена контролем за источником инфекции (антибиотики и дренирование) и поддержкой функции органов [1–4]. Почти у 60% пациентов с сепсисом развивается острое почечное повреждение (ОПП), что делает сепсис основной причиной развития ОПП в отделениях интенсивной терапии (ОИТ) [5, 6]. В случае своего развития ОПП приводит к повреждению функции и других органов, тем самым увеличивая летальность [5, 6]. Все это делает сепсис-индуцируемое ОПП (сепсис-ОПП) серьезной проблемой для общественного здравоохранения.
В последнее время растет наше понимание о той важной роли, что играют митохондрии в патогенезе сепсис-ОПП [7-9]. Здоровье митохондрии является необходимым условием для поддержания почечного гомеостаза, особенно в условиях метаболических нарушений, вызванных сепсисом [2, 7, 8]. Недостаточность функции митохондрий при сепсисе приводит к истощению АТФ и увеличивает продукцию активных форм кислорода (АФК), что все вместе ведет к расстройству гомеостаза клеток с последующей органной дисфункцией [10]. При сепсисе низкий уровень АТФ, увеличение биомаркеров митохондриальной дисфункции и снижение антиоксидантной защиты связано с неблагоприятным течением заболевания, что показала аутопсия скелетной мускулатуры у 16 пациентов, находящихся в критическом состоянии, по сравнению с 10 здоровыми, того же возраста пациентами, которым проводились плановые оперативные вмешательства по поводу перелома шейки бедра [11]. На животных моделях (крысы) показано, что при сепсисе повреждаются белки митохондрий и ДНК в клетках печени и сердца [12, 13], а дальнейшее повреждение функции митохондрий приводит к формированию порочного круга, при котором продукция АФК только растет [12-14]. И наоборот, биогенез митохондрий связан с улучшением выживаемости при септическом шоке [11], а экспериментальные модели сепсис-ОПП показывают важность восстановления функции митохондрий для восстановления функции почек и выживаемости [15-19].
К сожалению, на сегодняшний день точные молекулярные механизмы повреждения митохондрий при сепсисе и, собственно, патогенез сепсис-ОПП остаются неизвестными, что делает невозможным разработку целевой молекулярной профилактики (предупреждение развития) и терапии сепсис-ОПП, откладывая на неопределенный срок решение задачи в виде улучшения выживаемости пациентов с сепсис-ОПП.
Высокие метаболические расходы при сепсисе ведут к увеличению продукции АФК митохондриями. Мы выдвинули гипотезу, что повреждение митохондриальной ДНК при сепсисе приводит к митохондриальной дисфункции, что является значимым как для краткосрочных исходов, так и, возможно, для долгосрочных исходов при сепсис-ОПП. Также мы изучили экспрессию мРНК в механизмах поддержания функции митохондрий и окисление митохондриальной ДНК (мтДНК) и ее целостность при биопсии почек у пациентов с сепсис-ОПП и у здоровых субъектов. Следующим нашим шагом стала валидация полученных результатов in vitro, индуцируя человеческие клетки эндотелия пупочной вены (англ. human umbilical vein endothelial cells [HUVECs]) липополисахаридом (ЛПС) в течение 48 часов для имитации сепсиса.
Материалы и методы
Пациенты
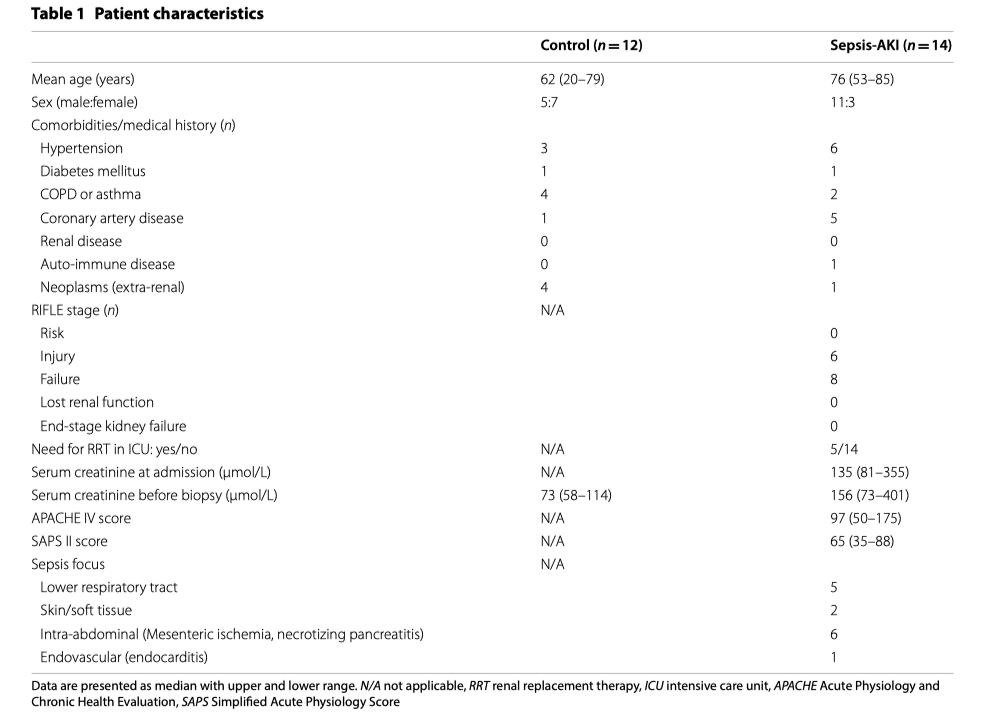
Мы взяли посмертные почечные биопсии у 14 пациентов, причиной смерти которых стал сепсис и ОПП, в течение 24 -150 минут после смерти. Бралась биопсия коркового вещества почек. Сразу после биопсии материал подвергался быстрому замораживанию жидким азотом и хранился при температуре -80°C до момента анализа. Такой метод позволил нам избавиться от нежелательных повреждений образца некрозом и аутолизисом. Диагноз септического шока у пациентов ставился согласно внутренним определениям сепсиса при наличии гипотензии, несмотря на адекватную интенсивную инфузионную терапию [20]. ОПП классифицировалась согласно критериям RIFLE [21]. Тяжесть заболевания определялась на момент поступления пациента в ОИТ с помощью шкалы APACHE IV и шкалы SAPS II [22, 23]. Информированное согласие получалось до момента взятия биопсии во время встречи с родственниками пациента до или сразу после его смерти. Контрольную группу составили пациенты, которым выполнялись плановые оперативные вмешательства в виде нефрэктомии по поводу почечно-клеточной карциномы (ПКК). В ходе оперативного вмешательства бралась биопсия из здорового отдела коркового вещества как можно дальше от карциномы. В последующем образец подвергался анализу со стороны патолога и только после этого признавался взятым у здорового субъекта. Детальное описание взятия биопсии почек описано в другой публикации [24]. Все пациенты, с сепсисом и без оного, были взрослыми, 18 лет и старше. Пациенты с ранее существовавшим хроническим заболеванием почек, с обострением аутоиммунных заболеваний с вовлечением почек и лечением лекарственными препаратами иммунно-супрессивного действия были исключены из исследования. Исследование было одобрено the Medical Ethics Review Committee медицинского цента университета города Гронинген (Нидерланды). Характеристики пациентов и лабораторные данные представлены в Таблице 1.
Клетки
Человеческие эндотелиальные клетки пупочной вены и среда для них были получены от UMCG Endothelial Cell Facility. Вкратце, первичные изоляты пуповины смешивали и затем культивировали на культуральной среде HUVEC, состоящей из RPMI 1640 (Lonza, Breda, The Netherlands) с добавлением 20% инактивированной нагреванием фетальной телячьей сыворотки (ThermoFisher, Waltham, MA), 2 mM l-глютамина (Life Technologies, Carlsbad, CA), 5 Ед/мл гепарина (Leo Pharmaceutical Products, The Netherlands), 1% пенициллин/стрептомицин (Sigma-Aldrich, St. Louis, MI) и 50 мкг/мл фактора роста EC (SigmaAldrich). Клетки помещали в 6-луночные культуральные планшеты (Corning, St. Louis, MI) и при 80%-ной конфлюэнтности клетки стимулировали 10 мкг/мл липополисахарида (ЛПС) E. coli 0111: B4 (Sigma-Aldrich) в течение 48 часов.
Выделение ДНК
Общую ДНК выделяли с целью проведения полимеразной цепной реакции (ПЦР) и определения повреждения митохондриальной ДНК. ДНК была выделена из биопсии почек у восьми контрольных субъектов и двенадцати пациентов с сепсисом и ОПП. Сначала из биоптатов почек делали срезы толщиной 5 мкм. Образцы были предварительно обработаны 500 мкл коллагеназы V (300 Ед/мл; Sigma-Aldrich, Darmstadt, Germany), инкубированы при температуре 37°C в течение 3 часов с перемешиванием каждые 30 мин. Далее было добавлено 500 мкл RPMI (ThermoFisher, Paisly, UK) с последующей центрифугацией в течение 10 мин с нагрузкой 20 000 G при комнатной температуре. После этого был использован Rapid Sample Concentrator (RSC) blood DNA kit (Promega, Madison, USA) для выделения гранул ДНК с помощью Maxwell 16 MDx AS3000 (Promega). ДНК из HUVECs была выделена с помощью Nucleospin DNA kit (MACHEREY–NAGEL, GmbH & Co. KG, Germany), согласно протоколу производителя.
Количественная оценка митохондриальной массы и повреждения ДНК
Количественная оценка митохондриальной массы и повреждение ДНК митохондрий устанавливались с помощью количественной полимеразной цепной реакции (кПЦР). Праймеры олигонуклеотидов (Sigma-Aldrich; Table 2) разрабатывались с помощью программного обеспечения «Clone Manager 9» с подтверждением эффективности, кривых плавления и температуры, используя для этого «CFX384- Real-Time system» (Biorad, California, USA). Амплификация ДНК проводилась при следующих температурных профилях: две минуты при 95°C, далее шли 40 циклов при температуре 95°C в течение 15 сек., 60 °C в течение 30 сек., 72°C в течение 30 сек. Все реакции проводили дважды, а полученные значения порогового цикла (англ. threshold cycle [Ct]) усредняли. Количество мтДНК рассчитывалось с использованием средних уровней митохондриальных генов: НАДН дегидрогеназа 1 (НД1), НАДН дегидрогеназа 4 (НД4), НАДН дегидрогеназа 6 (НД6), цитохром С оксидаза I (COX1), цитохром В (CYTB) и D-loop, деленных на количество ядерного гена бета 2-микроглобулина, используя для этого метод 2 − ∆∆Ct.
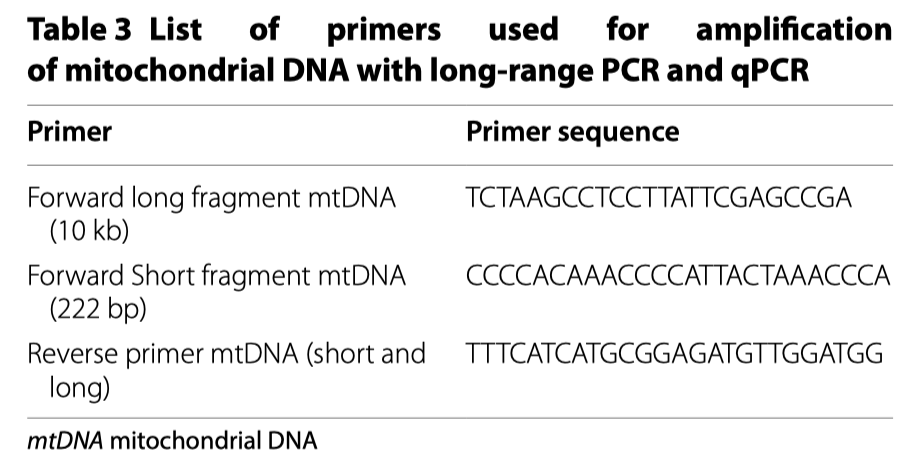
Повреждение митохондриальной ДНК оценивали с помощью кПЦР для определения короткой (около 200 пар нуклеотидов [п.н.]) части мтДНК и с помощью длинной ПЦР для определения длиной (около 10 п.н) части мтДНК. Сначала относительное количество каждого митохондриального гена было определено с помощью qПЦР и разделено на количество ядерного гена B2M, используя для этого метод 2 − ∆∆Ct. Затем проводилась длинная ПЦР с помощью TaKaRa LA Taq DNA polymerase kit (Takara Bio, Kusatsu, Japan) для амплификации матрицы мтДНК, простирающейся от гена ND5 к гену ND1, что составляет более двух третей митохондриального генома. Короткий фрагмент ДНК, состоящий из 222 пар нуклеотидов, амплифицировался qПЦР для использования в качестве референсного образца (Таб. 3). Длинный фрагмент амплифицировали с помощью T100 Thermal Cycler (Biorad, Калифорния, США), используя следующий тепловой профиль: 94°C в течение 1 мин, затем 18 циклов по 15 с при 94°C и 12 мин при 64°C, заканчивая процесс 10 мин при 72°C. Короткий фрагмент амплифицировали с использованием следующего термического профиля: 95°C в течение 2 минут, затем 40 циклов при 95°C в течение 15 секунд и 60°C в течение 30 секунд. Оба продукта ПЦР разделяли и визуализировали на 1% агарозном геле (45 мин, 100 В), а их интенсивность анализировали с помощью ImageJ [25]. Для количественной оценки повреждения мтДНК рассчитывали соотношение короткого и длинного фрагментов. Из-за ограниченного количества материала образцы ДНК от шести контрольных субъектов и двенадцати пациентов с сепсис-ОПП подвергались ПЦР с дальним диапазоном, тогда как образцы от семи контрольных субъектов и двенадцати пациентов с сепсис-ОПП подвергались количественной ПЦР.
Выделение РНК и количественный анализ экспрессии генов
В начале общая РНК была выделена у двенадцати субъектов из группы контроля и у двенадцати пациентов с сепсис-ОПП для обратной транскрипции методом количественной полимеразной цепной реакции (ОТ-ПЦР). РНК из криообразцов выделяли с помощью the RNeasy Mini Plus Kit (Qiagen, Leusden, The Netherlands), согласно протоколу производителя. Целостность РНК определялась методом электрофореза в геле и РНК неизменно находили неповрежденной. Количество и чистота РНК измерялись с помощью спектрофотометра ND-1000 UV–Vis (NanoDrop Technologies, Rockland, DE). ДНК, комплементарная РНК, (кДНК) была синтезирована согласно [26]. РНК из человеческих клеток эндотелия пупочной вены выделялась с помощью Nucleospin RNA kit (MACHEREY–NAGEL). Предварительно клетки обрабатывались TRIzol и только после этого выделялась РНК.
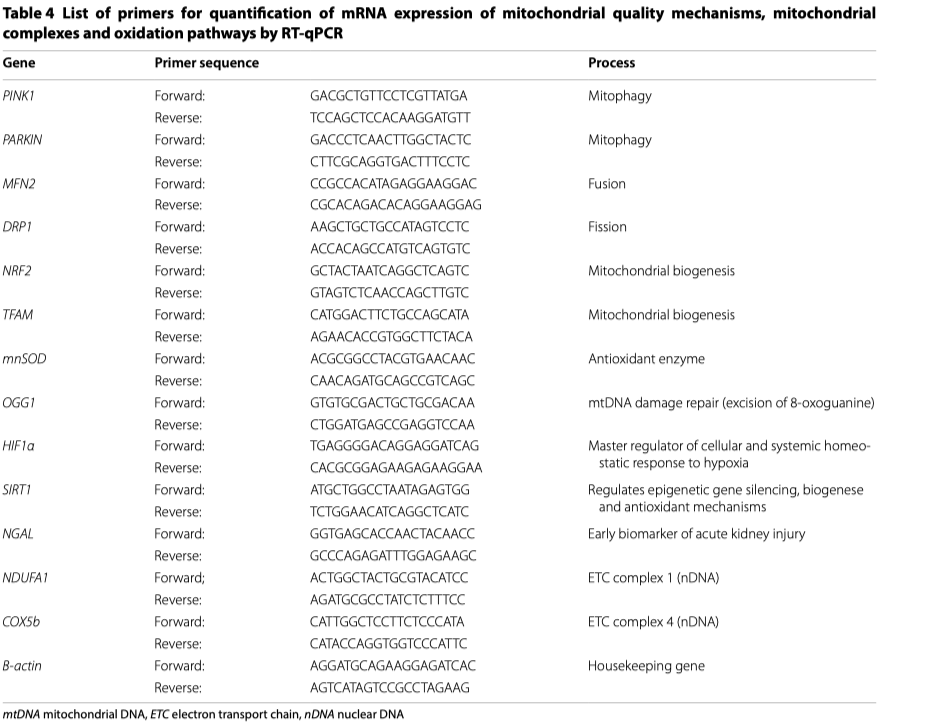
Далее с помощью программного обеспечения «Clone Manager 9» были созданы праймеры олигонуклотида (Sigma-Aldrich; Table 4) и валидированы оценкой эффективности, кривой плавления и температурной кривой, используя для этого ОТ-ПЦР. Амплификация ОТ-ПЦР проводилась на следующих температурных профилях: 95°C в течение 2 минут, далее 40 циклов при температуре 95°C в течение 15 секунд, затем 60°C в течение 30 секунд и окончание при температуре 72°C в течение 30 секунд. Все реакции проводили дважды, а полученные значения порогового цикла (Ct) усредняли. Экспрессию гена (мРНК) нормализовали, используя для этого бета-актин, а относительное количество рассчитывали по формуле 2 − ∆∆Ct.
Иммуногистохимический анализ
Окисление ДНК оценивалось с помощью иммуногистохимического анализа 8-оксогуанина (8-oxoG) на фиксированных формалином парафиновых срезах почек. После этого срезы депарафинизировались ксиленом и регидратировались этанолом различной крепости (70—100%) и дистиллированной водой. По окончании вышеописанного процесса извлекался эпитоп, используя для этого нагревание и цитратный буфер (рН 6) для извлечения антигена.
Активности эндогенных пероксидаз блокировалась путем инкубации срезов в 3% перекиси водорода. После промывки срезы инкубировали с антителом 8-oxoG человека (Abcam, Cambridge, UK), разведенном 1:400 в растворе антител (5% фетальная телячья сыворотка), в течение одного часа при комнатной температуре. После промывания срезы инкубировали с кроличьими вторичными антителами против IgG мыши (Southern Biotech, Birmingham, USA), разведенными 1: 100 в растворе антител с 2% нормальной сывороткой человека (NHS) в течение 45 мин при комнатной температуре. После промывания срезы были инкубированы с помеченными пероксидазой антителами anti-rabbit horse radish (EnVision kit, DAKO Cytomation, Glostrup, Denmark). Активность пероксидазы определялась с помощью 3-амино-9етилкарбазола (АЕС), после чего срезы окрашивали гематоксилином Майера (Merck, Darmstadt, Germany) перед установкой в «Aquatex mounting agent» (Merck). Визуализация окрашивания 8-oxoG производилась с помощью цветной камеры Leica DCF295 (Leica, Heerbrugg, Switzerland), а печать снимков проводилась с помощью программного обеспечения Leica software application suite (LAS version 4, Leica).
Иммунофлюоресцентный анализ
Окисление ДНК и митохондрий в срезах почек оценивали с помощью иммунофлюоресцентного анализа трансфокации внешней мембраны митохондрии (Translocase Of Outer Mitochondrial Membrane [TOM20]) и 8-oxoG. Коротко, все срезы были осушены потоком воздуха, фиксированы в ледяном растворе ацетона в течение 10 минут, промыты телячьей сывороткой с восстановлением проницаемости с помощью 0.25% раствора Triton-X-100 в течение 10 минут. После всего этого срезы были инкубированы на один час при комнатной температуре в присутствии первичных 8-oxoG антител (Novus Biologicals, Abingdon, Oxon), разведенных 1:75 в 1% растворе бычьего альбумина (BSA) в телячьей сыворотке (PBS), затем промыты PBS и снова инкубированы на 30 минут со вторичными антителами Donkey anti-Goat (ThermoFisher), разведенных 1:100 в 1% PBS/BSA. Далее срезы были инкубированы на один час при комнатной температуре с первичными антителами TOM20 (Santa Cruz, Dallas, USA), разведенных в 1% PBS/BSA, после чего последовало промывание PBS и инкубация на тридцать минут со вторичными антителами Donkey anti-Rabbit IgG (ThermoFisher), разведенных в 1% PBS/BSA. Срезы были установлены в Vectashield with DAPI (Vector Laboratories Inc., Burlingame, CA, USA), а визуализация проходила с помощью микроскопа Leica DM2000(Leica, Amsterdam, Netherlands). Локализация определялась с помощью программного обеспечения «ImageJ».
Статистический анализ и представление данных
Статистический анализ выполняли с помощью IBM SPSS 23.0 для Windows (IBM Corp., Armonk, N.Y., USA) и GraphPad Prism Software версии 7.02 (GraphPad Prism software Inc., San Diego, CA, USA). Двусторонние U-тесты Манна-Уитни использовались для расчета статистических различий между группами (с использованием программного обеспечения GraphPad Prism), тогда как корреляции между выбранными группами оценивались с помощью тестов Спирмана Rho в IBM SPSS. Р <0,05 считалось значимым отличием. Данные представлены в виде медианы с верхним и нижним диапазонами. Рисунки были сделаны с помощью GraphPad Prism (GraphPad Prism software Inc.), столбцы представляют собой медианное значение, а каждая точка представляет человека.
Результаты
Популяция исследования
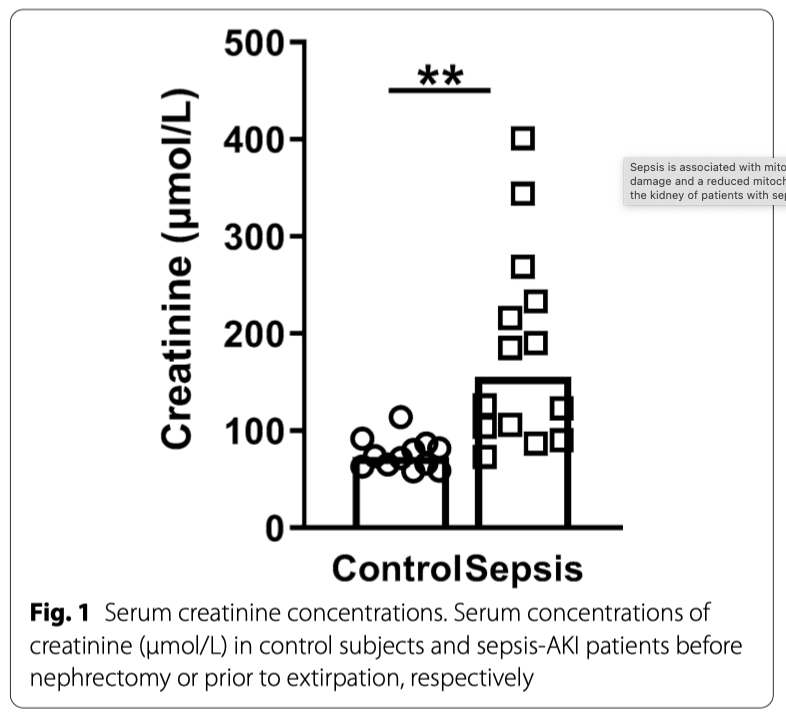
Исследованию поверглись биопсии почек от четырнадцати пациентов с сепсис-ОПП и двенадцати субъектов, составивших контрольную группу. У шести пациентов с сепсис-ОПП была внутрибрюшная инфекция, у пяти пациентов была инфекция нижних дыхательных путей, у двух пациентов - инфекция кожи и мягких тканей и один пациент страдал бактериальным эндокардитом. Медиана возраста пациентов с сепсис-ОПП составила 76 (53-85) лет, медиана возраста контрольной группы 62 (20-79) года (Таб.1). Соотношение мужчины-женщины 11:3 и 5:7 для группы сепсис-ОПП и контрольной группы, соответственно. По критериям RIFLE шесть пациентов были отнесены к стадии Injury и восемь к стадии Failure. Пяти пациентам потребовалось проведение почечно-заместительной терапии в ОИТ. Клинические характеристики представлены в Таблице 1, а концентрации сывороточного креатинина в обеих группах представлены на Рисунке 1.
Сепсис-ОПП ассоциируется с окислительным стрессом почек
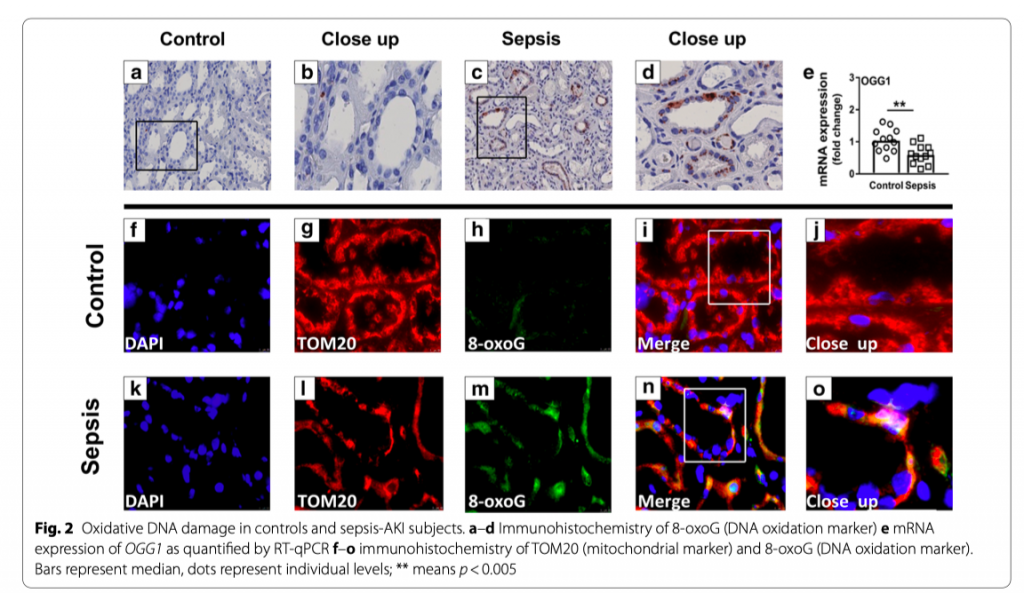
Для того, чтобы выяснить, действительно ли сепсис-ОПП ведет к окислению ДНК, мы провели окрашивание 8-oxoG и количественно оценили экспрессию фермента репарации (англ. the base-excision repair enzyme) 8-оксогуанин ДНК гликосилаза (OGG1) в биопсийном материале почек. Окрашивание 8-oxoG, основного мутагенного продукта, что возникает в результате воздействия активных форм кислорода, было представлено в нескольких эпителиальных клетках почечных канальцев у всех пациентов с сепсис-ОПП, но этого не наблюдалось в контрольной группе (Рис. 2a–d). Экспрессия OGG1, первичного фермента, ответственного за эксцизию 8-oxoG, у пациентов с сепсисом была резко снижена (p < 0.005; Рис. 2e). Флюоросцентное окрашивание митохондриального маркера TOM20 и 8-oxoG показало их совместную локализацию, что подразумевает окисление митохондриальной ДНК (Рис. 2j, o).
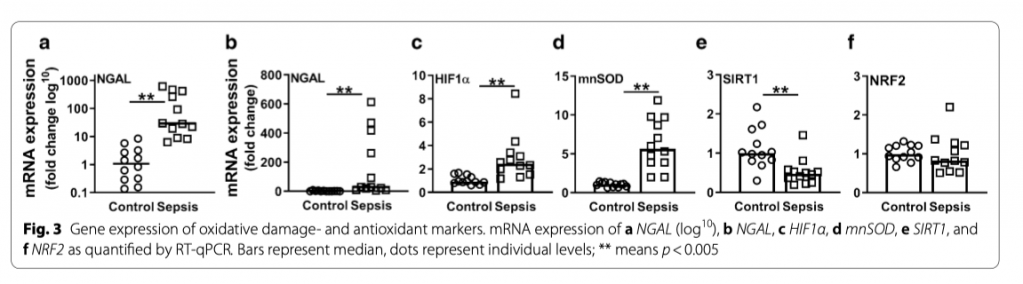
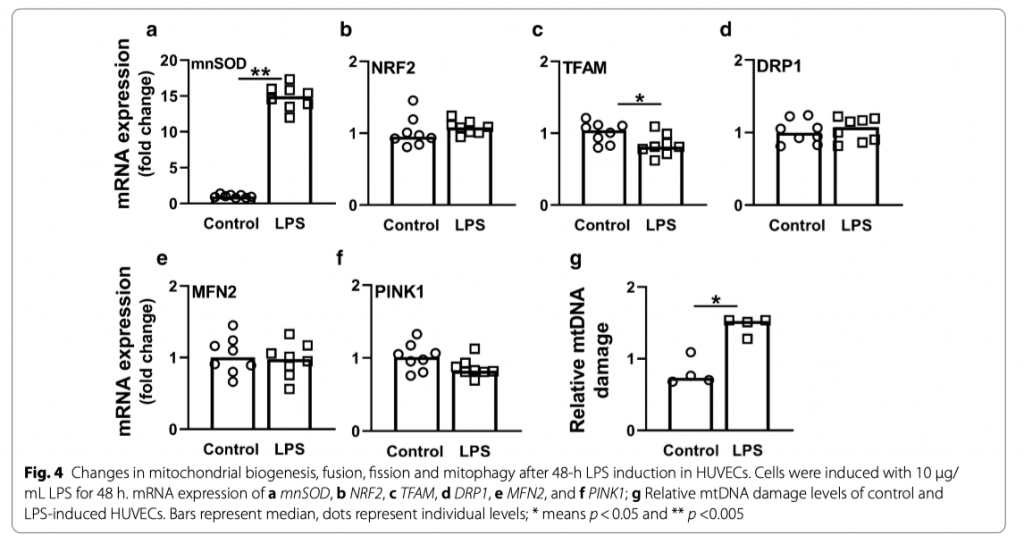
Для подтверждения поражения почек при сепсис-ОПП, мы количественно определили экспрессию мРНК липокаина, связанного с желатиназой нейтрофилов (англ. neutrophil gelatinase-associated lipocalin [NGAL]), как маркера почечного повреждения и окислительного стресса [26]. Пациенты с сепсисом показали значительное усиление регуляции NGAL (p < 0.001; Рис. 3a, b). К тому же, пациенты с сепсис-ОПП показали увеличение экспрессии гипоксия-индуцируемого фактора 1-альфа (HIF1α), главного датчика кислорода в клетке, и супероксидисмутазы марганца (mnSOD), ключевого антиоксидантного фермента, что предполагает активацию ответа на окислительный стресс (оба p < 0.001; Fig. 3c, d). Уровень mnSOD положительно коррелирует с NGAL and HIFα (R = 0.858 and R = 0.921, соответственно, оба p < 0.001). И наоборот, у пациентов с сепсис-ОПП снижается экспрессия мРНК сиртуина 1 ( Sirtuin 1 [SIRT1]), вовлеченного в процессы ингибирования окислительного стресса и биогенеза, по сравнению с контрольной группой(p < 0.01; Рис. 3e), при том, что уровень NRF2, важного регулятора экспрессии антиоксидантных белков, между группами не отличался (Рис. 3f). Экспрессия mnSOD в HUVECs значительно повышалась после 48 часов индукции ЛПС по сравнению с группой контроля (p < 0.001, Fig 4a) и опять же и здесь уровень NRF2 между группами не различался (Рис. 4b)
Взятое все вместе показывает, что у пациентов с сепсис-ОПП увеличивается уровень окислительного стресса в виде увеличение уровня 8-oxoG в эндотелиальных клетках почечных канальцев и увеличение экспрессии мРНК путей защиты от окислительного стресса.
Сепсис-ОПП ассоциируется с повреждением ДНК митохондрий в почках
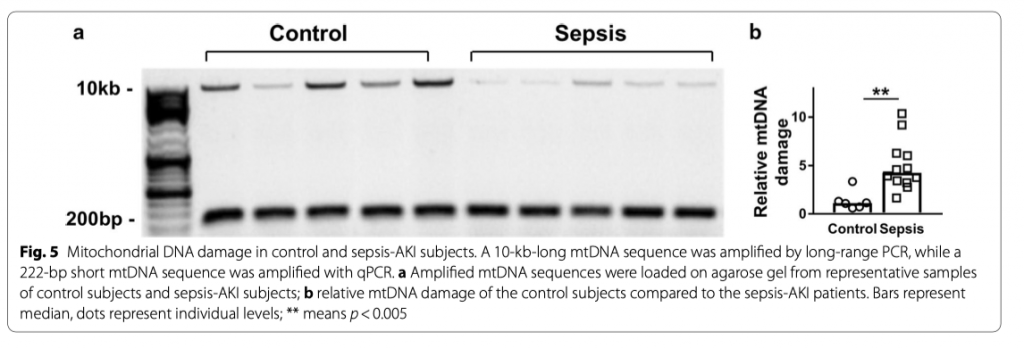
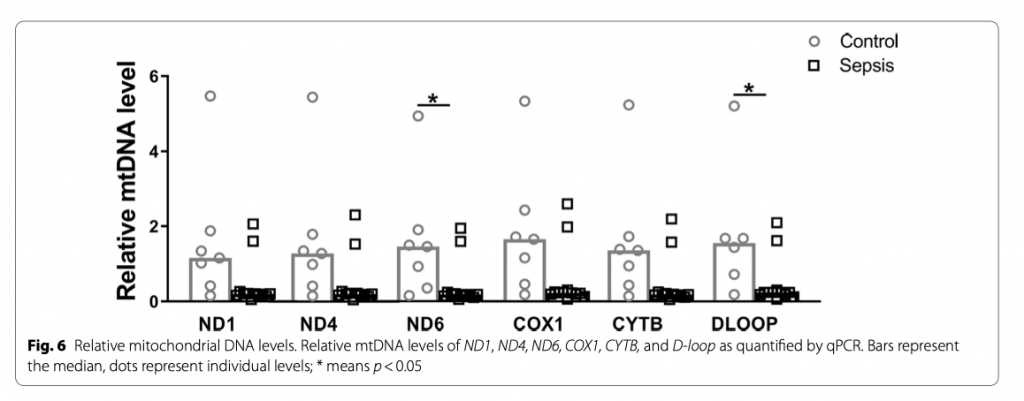
Целостность мтДНК является критическим условием для поддержания нормальной функции митохондрий [27]. Для изучения того, действительно ли при сепсис-ОПП повреждается целостность мтДНК, мы измерили степень повреждения мтДНК с помощью ПЦР длинных фрагментов (long-range PCR) и количественно оценили соотношение между длинными и короткими фрагментами мтДНК, предполагая, что более высокое соотношение указывает на повреждение мтДНК (Рис. 5a). Оказалось, что у пациентов с сепсис-ОПП повреждение мтДНК намного выраженее по сравнению с контрольной группой (p < 0.01, Рис. 5b). Уровень повреждения мтДНК положительно коррелировал с экспрессией mnSOD и HIF1α, маркеров окислительного стресса, и с маркером почечного повреждения NGAL (R = 0.77, R = 0.68 и R = 0.89, соответственно, все p < 0.01) и отрицательно коррелировал с OGG1 и маркером биогенеза митохондриальным фактором транскрипции А (mitochondrial transcription factor A [TFAM]) (R = − 0.51 and R = − 0.65, соответственно, оба p < 0.05). Однако повреждение мтДНК никаким образом не коррелировало с тяжестью критического заболевания, определенного с помощью шкал APACHE IV и SAPSII. Более того, у пациентов с сепсис-ОПП определялся более низкие уровни митохондриальных генов ND6 и D-loop при том, что уровни генов ND1, ND4, COX1 и CYTB между группами не различались (возможно это связано с небольшим размером выборки и ошибкой 2 типа) (Рис. 6). Далее мы изучили повреждение мтДНК в HUVECs после индуцированния их ЛПС в течение 48 часов. Мы нашли увеличение повреждения мтДНК после 48 часовой индукции (Рис. 4g). Все вместе наши результаты показывают, что сепсис ассоциируется с повреждением мтДНК.
Митохондриальный контроль качества не компенсирует повреждение мтДНК
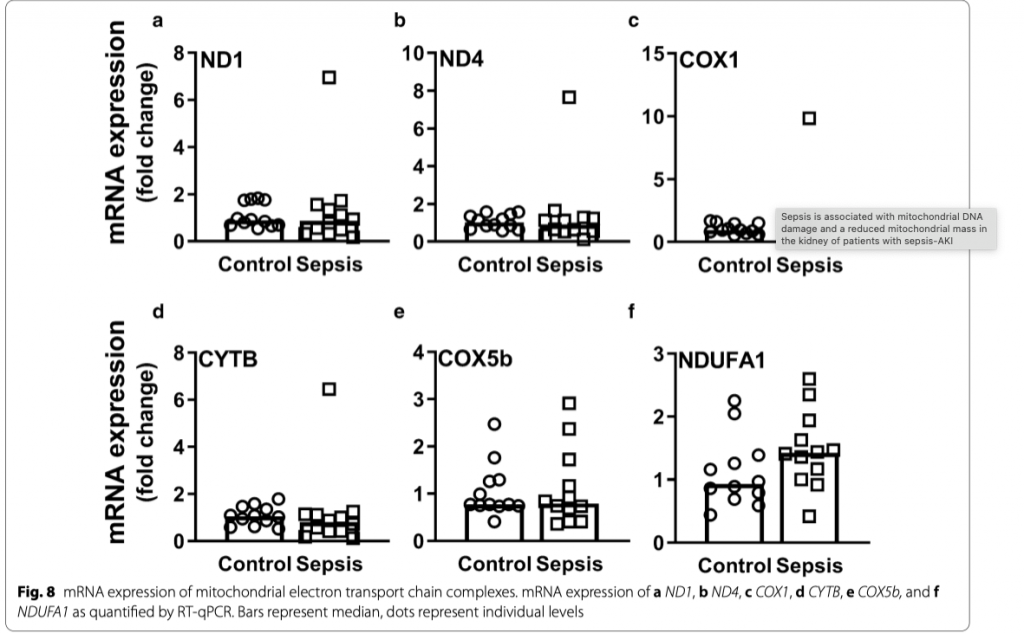
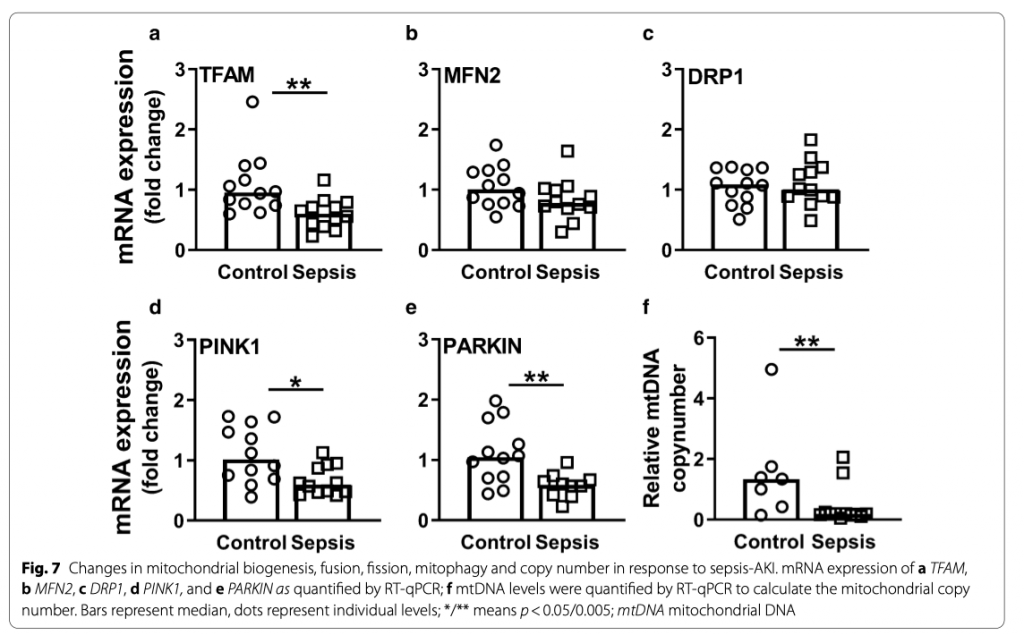
Для оценки митохондриального контроля качества, важнейшего механизма поддержания нормальной функции пула митохондрий и биогенеза, митофагии, деления и синтеза [28], мы измерили мРНК экспрессию генов, вовлеченых в эти процессы. Экспрессия маркера биогенеза TFAM у пациентов с сепсис-ОПП была ниже по сравнению с контрольной группой (p < 0.01; Рис. 7a). Несмотря на то, что сепсис-ОПП ведет к нарушению целостности мтДНК, мы не нашли влияния на мРНК экспрессию митохондриальных генов, кодирующих ключевые компоненты комплекса митохондриальной цепи транспорта кислорода (к примеру, ND1, ND4, COX1, CYTB, COX5b and NDUFA1) (Рис. 8). Далее, мы не нашли, что сепсис-ОПП влияет на мРНК экспрессию маркеров митохондриального деления и синтеза, а именно митофузина 2 (MFN2) и белка, связанного с динамином 1 (DRP1) (Рис. 7b, c), при этом сохранялась корреляция между ними (R = 0.58, p < 0.01). У пациентов с сепсис-ОПП была снижена мРНК экспрессия PTEN индуцированной киназой 1 (PINK1) и PARKIN, ключевых компонентов регуляции митофагии и, тем самым, играющих важную роль в восстановлении поврежденных митохондрий, по сравнению с группой контроля (p < 0.05 and p < 0.01, соответственно; Рис. 7d, e). Экспрессия PINK1 коррелирует с экспрессией PARKIN (R = 0.56, p < 0.01). Соответственно, 48 часовая индукция ЛПС HUVECs вызывала снижение мРНК экспрессии TFAM, но не изменяло экспрессию MFN2, DRP1 или PINK1 (Рис. 4c–f). Все эти данные позволяют предположить, что у пациентов с сепсис-ОПП не имеется компенсаторных механизмов, позволяющих улучшить состояние митохондриального контроля качества.
Сепсис-ОПП вызывает снижение массы митохондрий
Основываясь на увеличении уровней антиоксидантных маркеров и на снижении уровней маркеров биогенеза митохондрий, мы выдвинули гипотезу о том, что у пациентов с сепсис-ОПП снижается митохондриальная масса, что связано с увеличением влияния окислительного стресса на фоне нарушенного контроля качества митохондрий. Для оценки митохондриальной массы мы определили количество копий митохондрий путем расчета отношения между экспрессий митохондриальных генов и ядерным геном В2М. В соответствии с повышением коэффициента митохондриального повреждения, уровни митохондриального ДНК были снижены у пациентов с сепсис-ОПП по сравнению с контрольной группой, что и указывает на снижение митохондриальной массы (p < 0.05; Fig. 7f). Таким образом, при сепсис-ОПП увеличивается коэффициент повреждения митохондриального ДНК со снижением митохондриальной массы и эти процессы идут в условиях отсутствия маркеров митохондриального контроля качества.
Обсуждение
Сепсис ведет к увеличению уровня АФК, что является частью чрезмерного иммунного ответа, направленного на уничтожение бактерий [1, 27, 29]. В свою очередь, АФК могут вызвать вторичное повреждение в виде окисления белков, жиров и ДНК [12, 13]. Последующее повреждение мтДНК может привести к нарушениям в функционировании митохондрий, что тоже приводит к увеличению продукции АФК [27, 29]. Действительно ли этот процесс лежит в основе патофизиологии сепсис-ОПП, все еще остается неизвестным. В этой работе мы показали, что у пациентов с сепсис-ОПП имеется чрезмерное увеличение регуляции экспрессии мРНК маркеров, отвечающих за формирование ответа на окислительный стресс в почках, но все это ведет к более высокому окислению мтДНК, его повреждению и снижению количества митохондрий в почках. К тому же мы не нашли свидетельств тому, что в условиях митохондриального повреждения включаются механизмы митохондриального контроля качества, что приводит к развитию постоянной дисфункции митохондрий при сепсис-ОПП. Все вместе, наши данные показывают ключевой механизм, что ведет к повреждению митохондрий, в патофизиологии сепсис-ОПП.
То, как клетки взаимодействуют с АФК в условиях воспаления, во многом объясняет различия между выжившими и не-выжившими, долгосрочные осложнения и летальность среди пациентов с сепсисом [30]. Стимуляция NGAL, mnSOD и HIF1α указывает на окислительный стресс почек и их повреждение [31-33]. Самым первым маркером почечного повреждения является чрезмерная регуляция экспрессии NGAL [34], как это было показано в биопсиях почек, полученных от пациентов с сепсис-ОПП. Увеличение экспрессии NGAL вызывается АФК в целях подавления роста бактерий и модулирования воспалительного ответа [31]. К тому же NGAL активирует антиоксидантный механизм защиты, что приводит к усилению регуляции mnSOD, что было ранее показано in vitro [31]. Соответственно, мы нашли положительную корреляцию между экспрессией NGAL и экспрессией mnSOD в биопсийном материале почек. Важность усиления экспрессии mnSOD при сепсисе подтверждена на животных моделях сепсиса (мыши), когда высокая экспрессия mnSOD предупреждала истощение АТФ с последующей летальностью [33, 35, 36]. Мы также нашли увеличение экспрессии гена mnSOD у пациентов с сепсис-ОПП в сравнении с контрольной группой. Усиление регуляции HIF1α переводит митохондрии с аэробного дыхания на анаэробный, тем самым снижая проявления окислительного стресса [32]. Высокие уровни экспрессии HIF1α были обнаружены в клетках цельной крови у пациентов с септическим шоком [37], что согласуется с нашими результатами, а именно с увеличением экспрессии в почках у пациентов с сепсис-ОПП. И наоборот, mnSOD and HIF1α, экспрессия SIRT1, которые вовлечены в процессы ингибирования окислительного стресса и супрессию биогенеза и митофагии [38, 39] находятся в условиях сниженной регуляции у пациентов с сепсис-ОПП. Получается, что сепсис-ОПП ассоциируется с усилением регуляции генов, кодирующих молекулы, что вовлечены в процессы ингибирования воспаления и антиоксидантной защиты в почках.
По сравнению с контрольной группой, у пациентов с сепсис-ОПП обнаруживается усиление регуляции мРНК экспрессии маркеров окислительного повреждения и большие уровни повреждения ДНК митохондрий. Впрочем, и 48 часовая индукция ЛПС HUVECs вызывает усиление экспрессии mnSOD и повреждение мтДНК. И пусть несколько исследований и показали увеличение биомаркеров, что позволило предположить о наличии митохондриальной дисфункции при сепсисе [10, 11, 15], по нашему мнению на сегодня только одно исследование показало повреждение мтДНК у пациентов с сепсисом на основании истощения мтДНК, определённого с помощью RT-qPCR в моноцитах и лимфоцитах [40]. Наше же исследование прямо указывает на наличие повреждения мтДНК в септических почках. В то время как повреждение мтДНК в моноцитах и лимфоцитах коррелирует со шкалой APACHE, мы такой корреляции не нашли, что может быть объяснено небольшим размером выборки. Наши наблюдения повреждения мтДНК в почках у пациентов с сепсис-ОПП лежат в одной плоскости результатами, полученными на экспериментальных животных моделях сепсиса, которые показали глубокое повреждение мтДНК в скелетной мускулатуре и 50% истощение мтДНК в клетках печени [9, 41].
Повреждение мтДНК при сепсис-ОПП ассоциируется с увеличением окисления ДНК (к примеру, 8-oxoG), а иммунофлуоресцентное окрашивание показывает локализацию окисления как в ядерной ДНК, так и в митохондриальной ДНК. В полном соответствии с этим наблюдением сепсис у мышей также ведет к аккумуляции 8-oxoG в митохондрии с последующим развитием митохондриальной дисфункции [42]. Таким образом, митохондриальная дисфункция ведет к увеличению окислительного стресса, а окисление мтДНК и ее повреждение нарушает функцию митохондрии, что все вместе может играть ключевую роль в патофизиологии сепсис-ОПП.
Митохондриальный механизм контроля качества, что включает в себя биогенез (производство новых митохондрий), деление/синтез митохондрии и митофагию (удаление поврежденных митохондрий) может противодействовать повреждению митохондрий и последующему развитию дисфункции [7, 8, 43]. Однако у пациентов с сепсис-ОПП снижена мРНК экспрессия TFAM (маркер биогенеза), PINK и PARKIN (маркеры митофагии), но нет изменений в мРНК экспрессии MFN2 DRP1 (маркеры деления и синтеза). HUVECs, индуцированные ЛПС в течение 48 часов, показали аналогичные паттерны со снижением TFAM и без изменений PINK, MFN2 или DRP1. Подобные нашим результаты были показаны в другом исследовании, когда сепсис ассоциировался с увеличением мРНК экспрессии и уровня белков TFAM в скелетной мускулатуре, предполагая тем самым наличие биогенеза и снижения массы митохондрий [11]. Адекватная компенсация митохондриального повреждения может играть важную роль на клинические исходы при сепсисе, как например уровень PGC1α (Peroxisome Proliferator-activated Receptor Gamma Coactivator 1-alpha), маркера биогенеза, ассоциируется с выживаемостью при сепсисе [11]. ЛПС-индуцированные мыши с ОПП ухудшаются при снижении мРНК экспрессии PGC1α в мозговом слое почек, тогда как усиление экспрессии PGC1α приводит к восстановлению функции почек [15]. Защитная роль митофагии показана у мышей с дефицитом PARK2, у которых имеется деградация функции митохондрий и нарушения сократимости миокарда при сепсисе [44]. К тому же ингибиция митофагии у мышей увеличивает их чувствительность к развитию полиорганной недостаточности и смерти от сепсиса [44, 45]. В нашем исследовании мы нашли снижение экспрессии PINK1 и PARKIN, основных регуляторов митофагии, в септических почках, что позволяет предположить нарушение процессов удаления поврежденных митохондрий. И наконец, мы нашли отсутствие изменений в мРНК экспрессии DRP1 или MFN2 (маркеров деления и синтеза) в биопсиях почек или в HUVECs, подвергнутых воздействию ЛРС. Соответственно, деление и синтез не отличаются у пациентов с сепсисом и в контрольной группе [46]. В тоже время, учитывая то, что PINK1 и PARKIN принимают участие в деградации MFN2 и активации DRP1 для предотвращения синтеза, но при этом способствуя делению [47, 48], мы не можем сделать однозначный вывод о том, что уровни белка или активность PINK1 и PARKIN, а следовательно, деление и синтез, остаются неизменными при сепсисе. Можно сказать, что при сепсисе имеется повреждение мтДНК, при этом не наблюдается усиления экспрессии генов, кодирующих процессы контроля качества митохондрий.
Сила нашего исследования заключается в использовании прямых посмертных биопсий почек, взятых сразу после смерти пациента с сепсис-ОПП, и прямых биопсий почек, взятых во время оперативного вмешательства (группа контроля). Такой подход позволил нам напрямую исследовать эффекты от сепсиса на митохондрии почек в отличие от других исследований, в которых повреждение митохондрий изучалось с помощью непрямых суррогатных маркеров в виде мочи и/или крови. Вместе с тем мы должны были проводить такой анализ только у не-выживших пациентов, которые представляют самых тяжелых пациентов ОИТ просто потому, что невозможно получить одобрение этического комитета на взятие прижизненных биопсий почек у пациентов с сепсис-ОПП. Посмертные изменения мРНК экспрессии, возможно, и следует принять к рассмотрению при интерпретации наших данных, но вряд ли это будет иметь большое значение, учитывая то, что биопсии брались сразу после смерти (в течение 24—150 минут), а почка, как известно, является наименее чувствительным органом к изменениям целостности РНК и экспрессии генов в течение 24 часов после наступления смерти [49]. Наконец, у нас нет уверенности в том, могла ли почечно-клеточная карцинома (ПКК) повлиять на митохондриальную массу или на уровень ДНК в окружающих опухоль здоровых тканях. Известно, что в тканях, пораженных ПКК, количество копий мтДНК, содержание мтДНК и активность митохондриальных ферментов снижается [50, 51]. Более того, снижение уровней и массы митохондриальной ДНК находится в прямой зависимости от агрессивности ПКК, но в здоровых тканях той же почки таких изменений на наблюдается [52, 53]. Следовательно, в отличие от эффектов опухоли на митохондриальную массу и ДНК в самой опухоли, в здоровых тканях подобного не происходит. Но даже если на массу митохондрий и ДНК в окружающих опухоль здоровых тканях был бы оказан такой эффект от опухоли, это никак бы не отобразилось, в виде недооценки, на эффектах от сепсиса, тем самым, не ставя наши результаты под сомнение.
Выводы
Наши результаты проливают новый свет на вклад митохондрий в патофизиологию сепсис-ОПП. Мы обнаружили, что сепсис индуцирует окислительное повреждение ядерной ДНК и митохондриальной ДНК при полном отсутствии каких-либо признаков активации механизмов контроля качества митохондрий, что приводит к снижению массы митохондрий в септических почках. Эти результаты имеют клиническое значение потому, что сепсис является одной из основных причин развития ОПП и смерти пациентов, находящихся в критическом состоянии. Разобщение молекулярных механизмов, приводящих к митохондриальной дисфункции при сепсис-ОПП, является необходимой информацией для разработки новых целей терапии, направленной на предупреждение развития ОПП и его лечения, что, в итоге, приведет к улучшению выживаемости. Поскольку до настоящего времени остается неизвестным, возможно ли восстановление мтДНК у пациентов, переживших сепсис, наши результаты могут иметь прямое отношение к отдаленным исходам сепсиса. Учитывая роль митохондрий в патофизиологии сепсис-ОПП, терапевтические стратегии, напрямую направленные на восстановление функции митохондрий, на ограничение влияния окислительного стресса, на активацию механизмов контроля качества митохондрий, приведут к снижению степени повреждения мтДНК и, в конечном итоге, к предупреждению развития ОПП при сепсисе.

van der Slikke et al. Crit Care (2021) 25:36