Array
(
[NAME] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
[~NAME] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
[PREVIEW_PICTURE] => Array
(
[ID] => 5649
[TIMESTAMP_X] => 11.11.2024 14:05:00
[MODULE_ID] => iblock
[HEIGHT] => 563
[WIDTH] => 1000
[FILE_SIZE] => 90811
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/90a/szw0ytw7ycjh5qtwox2jjshr16b8mypf
[FILE_NAME] => close-up-hands-typing-keyboard.jpg
[ORIGINAL_NAME] => close-up-hands-typing-keyboard.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 3565b762b614ed4452be092f171f0b68
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/90a/szw0ytw7ycjh5qtwox2jjshr16b8mypf/close-up-hands-typing-keyboard.jpg
[UNSAFE_SRC] => /upload/iblock/90a/szw0ytw7ycjh5qtwox2jjshr16b8mypf/close-up-hands-typing-keyboard.jpg
[SAFE_SRC] => /upload/iblock/90a/szw0ytw7ycjh5qtwox2jjshr16b8mypf/close-up-hands-typing-keyboard.jpg
[ALT] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
[TITLE] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
)
[~PREVIEW_PICTURE] => 5649
[DETAIL_TEXT] =>
Young PJ, Devaux A, Li Q et al. and Myburgh JA on behalf of the SuDDICU Australia Investigators and the Australian and New Zealand Intensive Care Society Clinical Trials Group
Selective digestive tract decontamination in critically ill adults with acute brain injuries: a post hoc analysis of a randomized clinical trial
Intensive Care Med
doi.org/10.1007/s00134-023-07261-y
Абстракт
Целью данного исследования было определить, снижает ли селективная деконтаминация пищеварительного тракта (SDD) внутрибольничную смертность у взрослых в критическом состоянии на искусственной вентиляции легких (ИВЛ), поступивших в отделение интенсивной терапии (ОИТ) с острыми повреждениями головного мозга. Мы провели апостериорный анализ перекрестного кластерного рандомизированного клинического исследования.ОИТ были случайным образом распределены для принятия или не принятия стратегии SDD в течение двух чередующихся 12-месячных периодов, разделенных трехмесячным перерывом между периодами. Пациенты в группе SDD (n = 2791; 968, поступившие в отделение интенсивной терапии с острой черепно-мозговой травмой) получали 6-часовую аппликацию пероральной пасты и введение желудочной суспензии, содержащей колистин, тобрамицин и нистатин, на время ИВЛ плюс 4-дневный курс внутривенного введения антибиотика подходящего противомикробного спектра. Пациенты контрольной группы (n = 3191; 1093, поступивших в отделения интенсивной терапии с острой черепно-мозговой травмой) получали стандартную помощь. Первичным результатом была внутрибольничная смертность в течение 90 дней. Оценивали четыре вторичных клинических исхода: смерть в ОИТ, в также отсутствие ИВЛ, перевод из ОРИТ и выписка из стационар на 90-день. Из 2061 пациента с острыми черепно-мозговыми травмами (средний возраст 55,8 года; 36,4% женщины) все завершили исследование. У пациентов с острой черепно-мозговой травмой в группах SDD и стандартной помощи зарегистрировано 313/968 (32,3%) и 415/1093 (38%) случаев смерти в стационаре (нескорректированное отношение шансов [OR], 0,76, 95% доверительный интервал [ ДИ] 0,63–0,92; р = 0,004). Использование SDD было связано со статистически значимым улучшением четырех вторичных клинических исходов по сравнению со стандартным лечением. В этом апостериорном анализе рандомизированного клинического исследования у пациентов в критическом состоянии с острыми травмами головного мозга, получающих искусственную вентиляцию легких, использование SDD значительно снизило внутрибольничную смертность у пациентов по сравнению со стандартным лечением без SDD. Эти выводы требуют подтверждения.
Ключевые слова: Селективная деконтаминация пищеварительного тракта, острая черепно-мозговая травма, ИВЛ, Смертность.
Введение
Селективная деконтаминация пищеварительного тракта (SDD), состоящая из пероральной антибиотической пасты и желудочной суспензии антибиотика в сочетании с коротким курсом внутривенного введения антибиотиков, широко изучалась у пациентов в критическом состоянии [1]. В недавно опубликованном исследовании «Селективная деконтаминация пищеварительного тракта в отделении интенсивной терапии» (SuDDICU) госпитальная смертность существенно не отличалась для пациентов, получавших SDD и стандартную помощь [2]. Когда данные этого и других рандомизированных клинических исследований были объединены в байесовский метаанализ было показано, что апостериорная вероятность того, что SDD была связана со снижением госпитальной смертности по сравнению со стандартным лечением, составила 99,3% [1].Остается неясным, было ли снижение смертности, связанное с SDD [2], преимуществом в конкретной подгруппе или подгруппах. Пациенты с острыми черепно-мозговыми травмами или состояниями со сниженным уровнем сознания и нарушениями рефлексов дыхательных путей подвергаются риску аспирации, что может приводить к инфекции нижних дыхательных путей или вентилятор-ассоциированной пневмонии [1, 3, 4]. Вентилятор-ассоциированная пневмония может привести к лихорадке, гипоксемии и нарушению вентиляции, которые являются признанными причинами вторичного повреждения головного мозга [4], что потенциально может привести к дополнительным смертям. Поскольку SDD представляет собой стратегию инфекционного контроля, предназначенную для предотвращения вентилятор-ассоциированной пневмонии, она может оказаться особенно полезной для этой группы пациентов. Чтобы оценить возможность того, что SDD принесет пользу пациентам, поступившим в ОИТ с острыми повреждениями головного мозга, был проведен апостериорный анализ подгрупп с использованием данных исследования SuDDICU.
Методы
Этическое одобрение исследования SuDDICU Australia было получено от комитетов по этике исследований на людях и отделов управления исследованиями в каждом исследовательском центре. Поскольку SDD было реализовано как вмешательство во всем ОИТ, отказ от индивидуального согласия пациента был получен от каждого ведущего комитета по этике исследований на людях в соответствии с юридическими требованиями. Для пациентов в группе стандартного лечения был получен отказ от согласия, поскольку вмешательство не проводилось. Поскольку для анализа этой подгруппы не было получено новых данных, дополнительное этическое одобрение не требовалось. Протокол исследования и план статистического анализа [5], а также первичные данные [2] перекрестного кластерного рандомизированного клинического исследования SuDDICU были опубликованы. ранее.
Исследование SuDDICU Australia проводилось в 19 ОИТ в 17 больницах Австралии с мая 2017 года по ноябрь 2021 года. Подходящими ОИТ были соматические и хирургические ОИТ, способные лечить взрослых на ИВЛ и реализовать SDD у всех подходящих пациентов. Подходящие пациенты были переведены на ИВЛ (либо при поступлении в ОИТ, либо во время нахождения в ОИТ), и ожидалось, что они будут оставаться на ИВЛ по крайней мере до второго дня после включения в исследование. Пациенты, которым первоначально не предполагалось, что потребуется два дня ИВЛ, были повторно обследованы и включены в исследование, если впоследствии были соблюдены критерии отбора. Для этого апостериорного анализа подгрупп пациенты с острой черепно-мозговой травмой при поступлении в ОИТ были оценены по шкале APACHE)-III [7]. К пациентам с острой черепно-мозговой травмой были отнесены следующие диагнозы: остановка сердца; внутримозговое кровоизлияние; субарахноидальное кровоизлияние; инсульт; инфекция головного мозга; неврологическое новообразование; кома; субдуральная гематома; травматическое повреждение мозга; и эпидуральная гематома. У всех остальных пациентов не было острой черепно-мозговой травмы. ОИТ были рандомизированы для принятия стратегии SDD или для продолжения стандартного лечения в течение двух чередующихся 12-месячных периодов, разделенных 3-месячным перерывом между периодами. Полная информация о рандомизации, стратифицированная по количеству коек в ОИТ в исследовательском центре, изложена в протоколе и манускрипте исследования SuDDICU [2].
Вмешательства
SDD включало (i) местное применение 0,5 г пасты для перорального применения, содержащей 10 мг колистина, 10 мг тобрамицина и 125 000 международных единиц нистатина, на слизистую оболочку щек и ротоглотки каждые 6 часов; (ii) введение каждые шесть часов 10 мл желудочной суспензии, содержащей 100 мг колистина, 80 мг тобрамицина и 2 × 106 международных единиц нистатина, в верхние отделы желудочно-кишечного тракта через желудочный или постпилорический зонд; (iii) 4-дневный курс внутривенного введения антибиотика, соответствующего SDD, который включал цефалоспорин третьего поколения или ципрофлоксацин, если только больной не лечился указанными антибиотиками с активностью против грамотрицательных бактерий в течение первых 4 дней после включения, и в этом случае дополнительный антибиотики не применялись. Паста и суспензия SDD были произведены компанией Verita Pharma® (Сидней, Австралия) по лицензии George Institutefor Global Health в соответствии со стандартами надлежащей производственной практики, утвержденными Therapeutic Goods Administration of Australia . Подробности приготовления препарата для SDD описаны ранее [2]. Пероральную пасту SDD и желудочную суспензию вводили как можно скорее после соответствия критериям отбора и продолжали до экстубации или 90-го дня, в зависимости от того, что наступило раньше. Все остальные методы лечения, включая использование профилактических или терапевтических антибиотиков, находились на усмотрении лечащих врачей.
Данные, собранные на исходном уровне, включали демографические данные, диагноз при поступлении в ОИТ, оценку по шкале APACHE (оценка тяжести заболевания варьируется от 0 до 71 [APACHE-II] [8] или от 0 до 299 [APACHE-III] [9], причем более высокие баллы указывают на повышенный риск смерти) и специфические факторы риска инфекции, включая предшествующий прием перорального хлоргексидина и внутривенных антибиотиков. Для пациентов, находившихся в ОИТ в период а SDD, ежедневные данные, документирующие введение пероральной пасты SDD и желудочной суспензии, собирались в течение продолжительности ИВЛ до 90 дней и приема антибиотиков, совместимых с SDD, в течение 5 дней. Соблюдение режима применения местных компонентов SDD оценивалось как доля пациентов, получавших хотя бы одну подходящую дозу SDD ежедневно в течение периода ИВЛ. Дозы всех внутривенных антибиотиков собирались в течение 28 дней и были представлены как суточные дозы, определенные Всемирной организацией здравоохранения [10]. Данные, записываемые ежедневно в течение 90 дней, включали продолжительность ИВЛ, пребывания в ОИТ и стационаре, все новые микроорганизмы, выделенные из крови и другого материалар, любые новые положительные тесты на Clostridioides difficile и новый антибиотикоустойчивые культуры, как описано ранее [2].Подробности проверки и мониторинга исходных данных представлены в ESM.
Критерии оценки
Первичным результатом была внутрибольничная смертность от всех причин в течение 90 дней с момента включения в исследование во время госпитализации. Клиническими вторичными исходами были смертность в ОИТ, количество дней, прожитых без искусственной вентиляции легких, вне ОИТ и стационара в течение 90 дней. Вторичные микробиологические результаты представляли собой результаты всех новых культур крови;частота новых положительных результатов тестов на Clostridioides difficile; выделение микроорганизмов устойчивых к антибиотикам, а также общую длительность использования антибиотиков.
Статистический анализ
Этот анализ подгрупп проводился с использованием того же плана статистического анализа, который использовался в основном анализе SuDDICU [2]. Пациенты были проанализированы в своей группе рандомизации, независимо от приверженности лечению, с использованием всех доступных данных. Первичный результат смерти в больнице в течение 90 дней анализировали с использованием модели иерархической логистической регрессии индивидуального уровня, включающей как случайный кластерный эффект, так и случайный эффект кластерного периода. Эффект вмешательства оценивался как отношение шансов (ОШ) смерти и 95% доверительный интервал (ДИ) со степенями свободы, скорректированными поправкой Kenward-Roger [11].Абсолютную разницу частоты событий также оценивали с помощью линейной регрессии на уровне кластера, взвешенной пропорционально обратной биномиальной дисперсии для каждого периода кластера. Смертность вОИТ оценивалась аналогичным образом.
Количество дней жизни и дней без ИВЛ, вне ОИТ и выписки из стационара в течение 90 дней анализировали с использованием модели иерархической линейной регрессии с поправкой Kenward-Roger. Эффекты вмешательства были представлены как скорректированные средние различия и 95% ДИ. Время выписки из ОИТ и стационара суммировали по подгруппам с использованием функций кумулятивной заболеваемости, рассматривая смертность как конкурирующий риск, с отсечкой на 90-й день. Эффекты вмешательства оценивались как отношения рисков (ОР) и 95% ДИ, полученные на основе модели Кокса, специфичной для причины, с фиксированным эффектом лечения и контролем случайного эффекта. Во всех анализах неоднородность ответа на лечение у пациентов с острой черепно-мозговой травмой и без нее оценивалась путем добавления переменной подгруппы, а также ее взаимодействия с вмешательством в основной модели анализа. Чтобы оценить возможность неоднородности влияния лечения на внутрибольничную смертность в подгруппе пациентов с острыми травмами головного мозга, подгруппа была разделена на три взаимоисключающие категории и установлена взаимосвязь между распределением лечения и категорией. Этими категориями были: (i) черепно-мозговая травма (определяемая как APACHEIII диагноз травмы головы, субдуральной гематомы и субдуральной/эпидуральной гематомы при поступлении в отделение интенсивной терапии; (ii) субарахноидальное кровоизлияние и инсульт (определяемая как APACHE-III диагноз внутримозгового кровоизлияния при поступлении в отделение ОИТ; субарахноидальныйкровоизлияние; инсульт; внутримозговое кровоизлияние) и (iii) другие повреждения головного мозга (определяемые как APACHE-III диагнозы при поступлении в отделение интенсивной терапии: остановка сердца; инфекция головного мозга; неврологическое новообразование; судороги; другое неврологическое заболевание; кома). Неоднородность влияния лечения на внутрибольничную смертность основывалась на том, получали ли пациенты внутривенные антибиотики на исходном уровне. Микробиологические исходы анализировались с помощью долей пациентов, у которых произошло хотя бы одно событие в каждом кластерном периоде. Эти пропорции моделировались с помощью взвешенной линейной регрессии, где значения вычислялись с помощью обратной дисперсии для каждого кластерного периода. Все эти анализы проводились без каких-либо корректировок. Все статистические тесты проводились с определением двухстороннего уровня 0,05. Поскольку все анализы, проведенные в данном исследовании, являются post hoc, они рассматривались как исследовательские. Статистический анализ проводился с использованием программного обеспечения SAS (версия 9.4) (Cary NC, USA ).
Полученные результаты
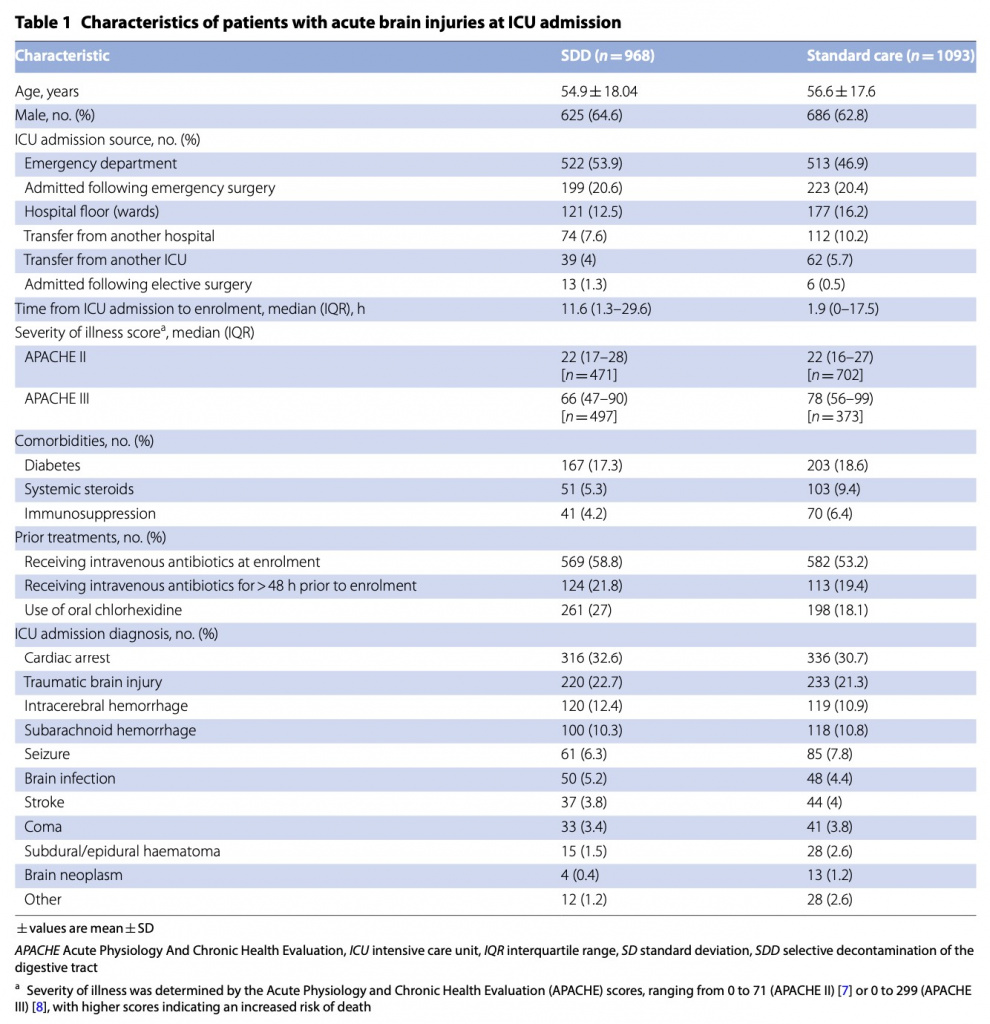
Всего было включено 5982 взрослых на искусственной вентиляции легких, из них 2061 (средний возраст 55,8 лет; 36,4% женщины) имели острую черепно-мозговую травму или повреждение головного мозга по другой причине.В первый период вмешательства в исследование были включены 1019 пациентов с острой мозговой травмой, из них 388 (38,1%) в группе SDD и 631 (61,9%) в группе стандартной помощи. Во второй период вмешательства было включено 1042 пациента с острой мозговой травмой, из них 580 (55,7%) в группу SDD и 462 (44,3%) в группу стандартной помощи. Первичный результат был доступен для всех 968 пациентов в группе SDD и для всех 1093 пациентов в группе стандартной помощи (рис. 1). Исходные характеристики пациентов с острыми мозговыми травмами, распределенных в группы SDD и группы стандартной помощи, были схожими (таблица 1), за исключением того, что время от поступления в ОИТ до включения в исследование составляло в среднем 11,6 часа (интерквартильный диапазон [IQR] 1,3–29,6 часа) в SDD. группе и медиане 1,9 часа (IQR 0–17,5 часа) в группе стандартного лечения; Пероральный хлоргексидин применялся у 261/968 (27%) пациентов в группе SDD и у 198/1093 (18,1%) в группе стандартной терапии, а системные стероиды применялись у 51/968 (5,3%) в группе SDD и у 103 пациентов. /1093 (9,4%) в группе стандартного лечения. Среди пациентов с острыми черепно-мозговыми травмами в группе SDD доля днейИВЛ, когда пациенты получали как пероральную пасту SDD, так и желудочную суспензию, составила 93,1% (рис. 1, ESM). Данные о введении каждого компонента SDD показаны в электронной таблице 1, ESM и долях пациентов, получающих SDD-антибиотики, в SDD и группе стандартной помощи показаны на eFigure2, ESM.
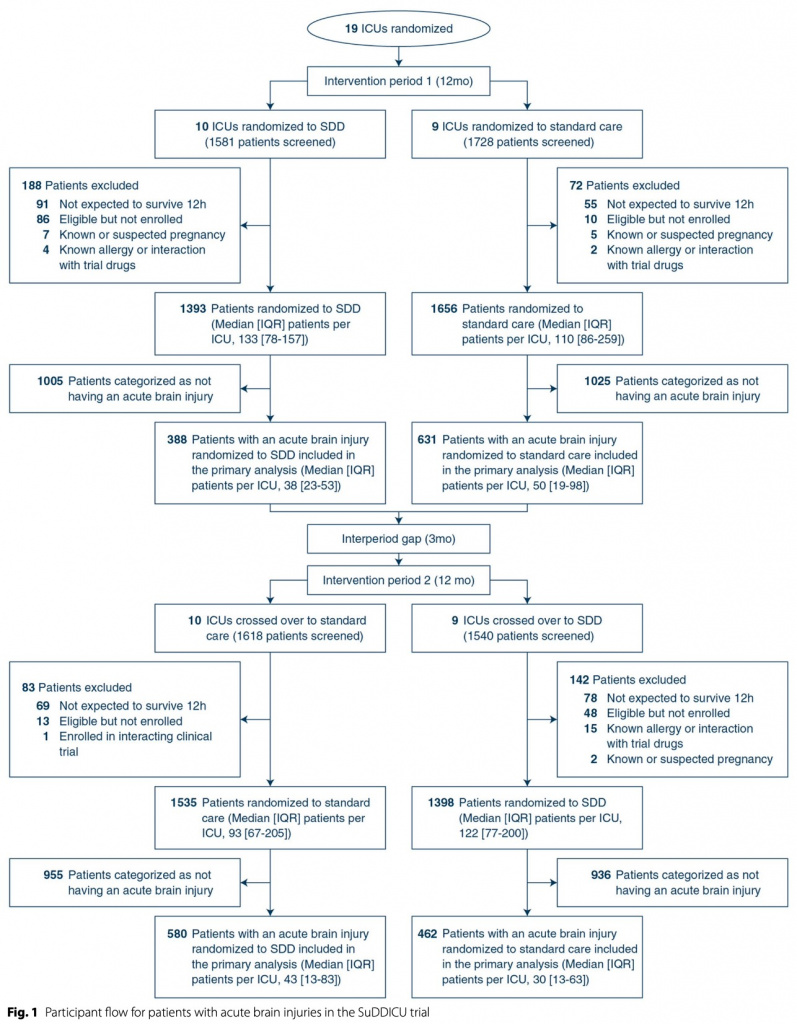
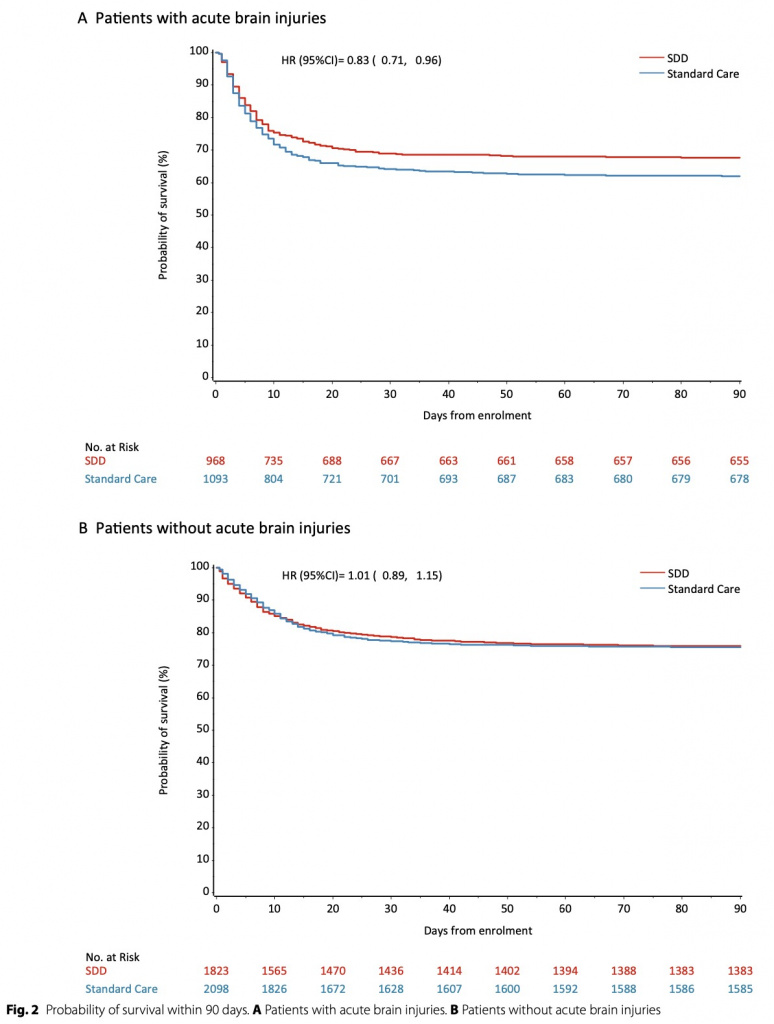
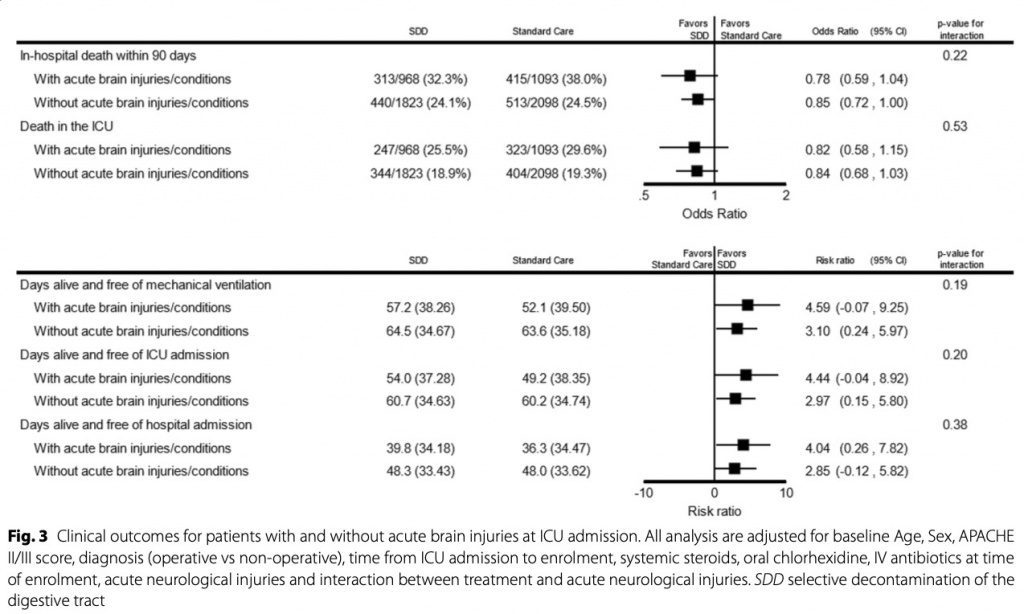
При оценке на день 90 после включения умерли 313 (32,3%) из 968, распределенных в группу SDD, и 415 (38%) из 1093, - в группе стандартной помощи (средняя разница - 6,2%, 95% ДИ от - 8,9 до - 3,5%; ОШ 0,76, 95% ДИ 0,63–0,92; p = 0,004). Результаты были схожими после поправки на исходный возраст, пол, оценку APACHE II/III и диагноз (ОШ 0,74; 95% ДИ 0,57–0,97; p = 0,03), но не были значимыми после добавления времени от поступления в ОИТ до включения, системных стероидов, перорального приема. хлоргексидина и введение внутривенно антибиотиков на момент включения в исследование (ОШ 0,78; 95% ДИ 0,59–1,04; p = 0,08). (Table 2). Соответствующие отношения риска для времени до смерти при SDD по сравнению со стандартной помощью составили 0,83 (95% ДИ 0,71–0,96) и 1,01 (95% ДИ 0,89–1,15) для пациентов с острыми мозговыми травмами и без них соответственно (Table . 2a, b). . Значительной гетерогенности во влиянии SDD на смертность у пациентов с (ОШ 0,78, 95% ДИ 0,59–1,04, р = 0,08) и без (ОШ 0,85, 95% ДИ 0,72–1,00, р = 0,05) острых мозговых травм соответственно не выявлено (p = 0,22) (Fig. 3, eTable2, ESM). Не было значительной разницы в смертности между группами SDD и стандартной помощи между пациентами с черепно-мозговой травмой и субарахноидальным кровоизлиянием или между инсультом и другими повреждениями головного мозга (eTable 3, ESM); или на основании получения или нет внутривенной антибактериальной терапии на исходном уровне (eTable 3, ESM). Причины смерти пациентов с острыми мозговыми травмами по группам лечения представлены в eTable 4 ESM.
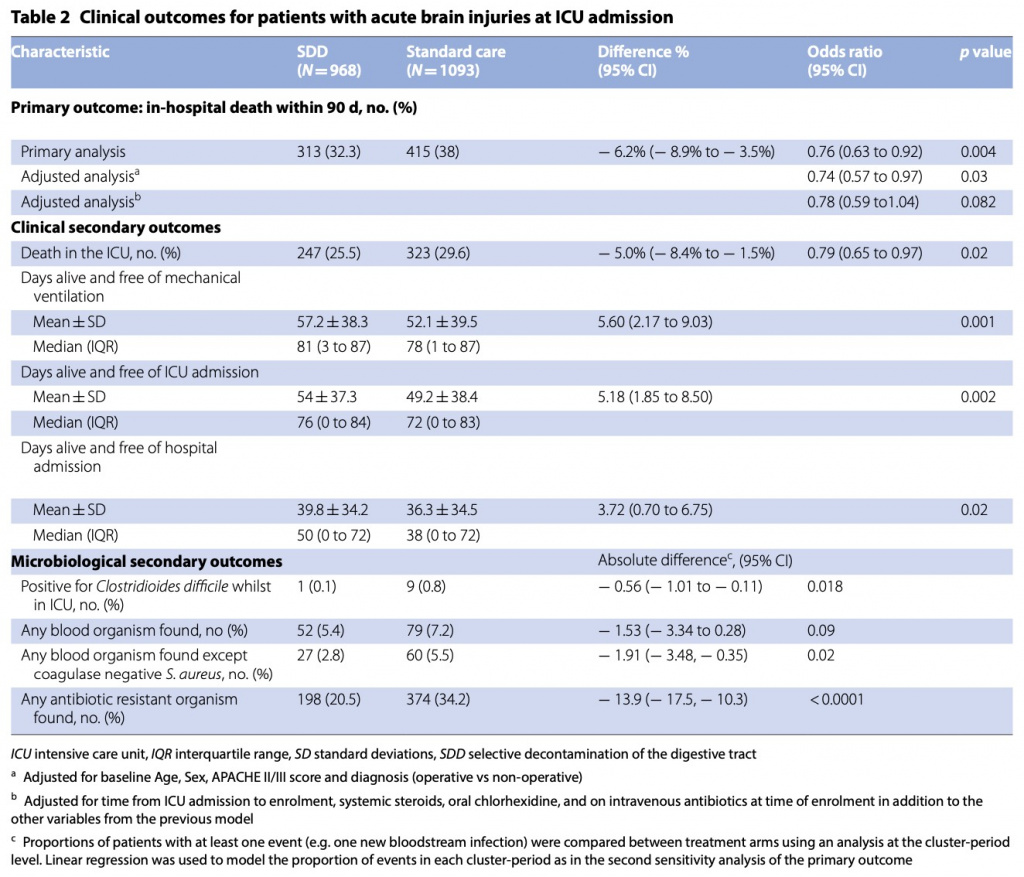
Из четырех клинических вторичных исходов (смерть в отделении интенсивной терапии, дни жизни и отсутствия ИВЛ, дни жизни и отсутствия госпитализации в ОИТ и дни жизни и дни без госпитализации) наблюдались статистически значимые различия в пользу группы SDD у больных с острым повреждением мозга (Table 2).
Соответствующие отношения риска для дней жизни и отсутствия ИВЛ с SDD по сравнению со стандартной помощью составили 1,11 (95% ДИ 1,01–1,22) и 1,1 (95% ДИ 1,03–1,18) для пациентов с острыми травмами головного мозга и без них соответственно (eFigure 3а и 3в, ESM). Соответствующие отношения риска для живых дней без ОИТ с SDD по сравнению со стандартным лечением составили 1,1 (95% ДИ 0,99–1,22) и 1,03 (95% ДИ 0,96–1,11) для пациентов с острыми мозговыми травмами и без них соответственно (eFigure 4a и 4в, ESM).Соответствующие отношения риска для живых и выписанных из больницы с SDD по сравнению со стандартным лечением составили 1,06 (95% ДИ 0,94–1,18) и 1 (95% ДИ 0,93–1,07) для пациентов с острыми мозговыми травмами и без них соответственно (eFigure 5a и 5в, ESM) . Не было значительной гетерогенности в влиянии SDD на четыре вторичных клинических исхода у пациентов с острыми травмами головного мозга и без них (eTable2 и eFigure 3, ESM).
Микробиологические вторичные исходы
В группе SDD по сравнению с группой стандартной терапии наблюдалось статистически значимое снижение доли пациентов, у которых были культивированы новые микроорганизмы, устойчивые к антибиотикам (20,5% против 34,2%; абсолютная разница – 13,9 процентных пунктов; 95% ДИ – от 17,5 до − 10,3); для новых положительных культур крови, за исключением коагулазонегативных Staphylococcus (2,8% против 5,5%; абсолютная разница — 1,9 процентных пункта, 95% ДИ от — 3,5 до — 0,4) и для новых положительных результатов тестов на Clostridioides difficile (0,1% против 0,8%; абсолютная разница — 0,6 процентных пункта, 95% ДИ от – 1 до – 0,1) (Table 2). Среди пациентов с острыми повреждениями мозга в группах SDD и стандартной помощи соответственно количество пациентов с собранными культурами крови составило 552 (57%) против 713 (65,2%), а количество пациентов с другими культурами составило 229 ( 23,7%) против 411 (37,6%). Данные о конкретных микроорганизмах, выращенных из образцов крови, а также о новых устойчивых к антибиотикам организмах, выращенных из образцов, не являющихся кровью, из групп SDD и групп стандартного ухода, показаны в eTable 5, ESM. Новые микроорганизмы, устойчивые к антибиотикам, были культивированы из дыхательных путей у 115 из 968 (11,9%) и 275 из 1093 (25,2%) пациентов, распределенных в группы SDD и стандартной помощи соответственно.
Средние кумулятивные суточные определенные дозы в течение первых 28 дней всех внутривенных антибиотиков и внутривенных антибиотиков, не вводимых в рамках схемы лечения SDD, показаны на eFigure 6, ESM.Совокупные установленные суточные дозы каждого класса антибиотиков также показаны на eFigure 7, ESM.Среди пациентов с острыми мозговыми травмами ежедневно определенные дозы антибиотиков, вводимые в течение первых семи дней после включения в исследование, были значительно выше в группе SDD по сравнению с группой стандартной терапии (eFigure 8, ESM), хотя установленные ежедневно дозы в течение первых 28 дней после включения между двумя группами существенно не отличались (eFigure 9, ESM). Инфекции Clostridioides difficile возникли у 1 из 968 (0,1%) пациентов в группе SDD и у 9 из 1093 (0,8%) пациентов в группе стандартной терапии. Другие нежелательные и серьезные нежелательные явления были редки (eTable 6, ESM).
Обсуждение
В этом post hoc анализе, проведенном на основе данных перекрестного кластерного рандомизированного клинического исследования, использование SDD в подгруппе взрослых больных в критическом состоянии с острыми травмами или другими повреждениями головного мозга, находящихся на ИВЛ, было связано со статистически значимым снижением внутрибольничной смертности по сравнению со стандартным лечением без SDD. Использование SDD было связано со значительным снижением смертности в ОИТ, продолжительности ИВЛ и продолжительности пребывания в ОИТ и стационаре, а также с более низкими показателями новых инфекций кровотока и новых культур антибиотикоустойчивых организмов. У пациентов без острых черепно-мозговых травм и состояний, которые составили около двух третей участников исследования SuDDICU, не было отмечено существенных различий в клинических исходах между группами SDD и стандартным лечением.
За исключением одного небольшого исследования [12], пациенты с острыми травмами головного мозга не были в центре внимания клинических исследований по оценке SDD [1]. Предыдущие рандомизированные клинические исследования показали, что внутривенная антибиотикопрофилактика может снизить частоту вентилятор-ассоциированной пневмонии в пациентов после остановки сердца [13, 14] и с другими повреждениями головного мозга в ОИТ [15, 16]. Эти исследования профилактического применения антибиотиков не были сосредоточены на таких важных для пациентов исходах, как смертность. В этой большой подгруппе, состоящей почти из 2000 пациентов с острыми травмами головного мозга в рамках прагматичного рандомизированного клинического исследования, SDD было связано с улучшением нескольких исходов, ориентированных на пациента. Снижение смертности на 5,7 процентных пункта соответствует числу пациентов, которых необходимо лечить, равному 18, чтобы избежать одной смерти. Это клинически важный размер эффекта в популяции пациентов с контрольным уровнем смертности 38 процентных пунктов. Превосходное соблюдение протокола было достигнуто благодаря более чем 90 процентным пунктам подходящих доз стандартных коммерческих препаратов SDD, введенных на время искусственной вентиляции легких. В отличие от общей популяции исследования SuDDICU [2], пациенты с острыми травмами головного мозга, которые были распределены в SDD, получали значительно больше ежедневных определенных доз антибиотиков в первые 7 дней по сравнению с пациентами, получавшими стандартную помощь.
Хотя SDD было связано с более низкими показателями новых инфекций, которые могли смягчить потенциальные причины вторичного повреждения головного мозга, данные о показателях деятельности мозга, таких как внутричерепное давление, типы, продолжительность и интенсивность церебральной терапии или оценки долгосрочных функциональных результатов, не были доступны для подтверждения или опровержения предполагаемых механизмов пользы. Хотя вентилятор-ассоциированная пневмония является частой причиной инфекций, приобретенных в ОИТ [17], конкретные данные о диагнозе или источнике инфекции или влиянии вентилятор-ассоциированной пневмонии на дыхательную функцию не были доступны для анализа, хотя обнаружена более низкая частота устойчивых микроорганизмов из дыхательных путей у пациентов при проведении SDD.
Этот анализ подгрупп имеет некоторые ограничения. Во-первых, вмешательство не было слепым и, следовательно, подвержено систематической ошибке, хотя это было смягчено объективным первичным результатом и принятием SDD в качестве стандартной помощи, предоставляемой всем подходящим пациентам в течение периода вмешательства. Во-вторых, мы сообщили о первичных диагнозах при поступлении в отделение интенсивной терапии, определяющих наличие острой черепно-мозговой травмы, что могло привести к неправильной классификации некоторых пациентов. В-третьих, хотя основной результат был сообщен с использованием заранее заданного нескорректированного анализа, скорректированный анализ, учитывающий исходные дисбалансы, одинаково важен для последующего анализа. Хотя статистически значимые различия в основных результатах были потеряны после корректировки исходных дисбалансов, величина и направление эффекта существенно не отличались.
В-четвертых, хотя умеренное снижение смертности при SDD, наблюдаемое у пациентов с острыми повреждениями головного мозга, согласуется с гипотезой нашего исследования и с положительными эффектами SDD, наблюдаемыми в вторичных клинических исходах, вероятность того, что эффект лечения на дифференциальные причины смерти будет больше, чем мы наблюдали. неправдоподобно. Соответственно, отсутствие статистически значимой гетерогенности эффекта лечения в нашем исследовании может быть связано с низкой статистической мощностью. В-пятых, этот анализ был основан на гипотезах и не был заранее указан перед первичным испытанием. Хотя совокупные данные свидетельствуют о том, что использование SDD связано со снижением госпитальной смертности [1], этот апостериорный анализ данных исследования SuDDICU предполагает, что этот эффект может быть обусловлен в первую очередь пользой для пациентов с острыми травмами головного мозга и другие пациенты могут иметь небольшую пользу или вообще не иметь пользы от SDD. Прежде чем внедрять в клиническую практику, эти результаты должны быть подтверждены посредством анализа данных на уровне пациентов из других исследований или новых рандомизированных клинических исследований.
Заключение
Среди пациентов в критическом состоянии на ИВЛ, SDD значительно снизила внутрибольничную смертность пациентов с острыми повреждениями головного мозга по сравнению со стандартной помощью. Однако результаты апостериорного анализа этой популяции пациентов требуют подтверждения.
Ссылка на документ с дополнительными данными исследования (Supplementary).
References
1. Hammond NE, Myburgh J, Seppelt I et al (2022) Association between selective decontamination of the digestive tract and in-hospital mortality in intensive care unit patients receiving mechanical ventilation: a systematic review and meta-analysis. JAMA 328(19):1922–1934. https:// doi. org/10. 1001/ jama. 2022. 19709
2. The SuDDICU Investigators for the Australian and New Zealand Intensive Care Society Clinical Trials Group. Effect of selective decontamination of the digestive tract on hospital mortality in critically ill patients receiving mechanical ventilation: a randomized clinical trial. JAMA. 2022;328(19):1911–1921. https:// doi. org/ 10. 1001/ jama. 2022. 17927
3. Bonten MJ, Kollef MH, Hall JB (2004) Risk factors for ventilator-associated pneumonia: from epidemiology to patient management. Clin Infect Dis 38(8):1141–1149. https:// doi. org/ 10. 1086/ 383039
4. Ewig S, Torres A, El-Ebiary M et al (1999) Bacterial colonization patterns in mechanically ventilated patients with traumatic and medical head injury. Incidence, risk factors, and association with ventilator-associated pneumonia. Am J Respir Crit Care Med 159(1):188–198. https:// doi. org/10. 1164/ ajrccm. 159.1. 98030 97
5. The SuDDICU Investigators (2021) Protocol summary and statistical analysis plan for the Selective Decontamination of the Digestive Tract in Intensive Care Unit Patients (SuDDICU) crossover, cluster randomised controlled trial. Crit Care Resusc 23(2):183–193
6. Campbell MK, Elbourne DR, Altman DG et al (2004) CONSORT statement: extension to cluster randomised trials. BMJ 328(7441):702–708. https://doi. org/ 10. 1136/ bmj. 328. 7441. 702
7. ANZICS Centre for Outcome and Resource Evaluation. APD Data Dictionary. Version 6.1. April 2022 https:// www. anzics. com. au/ wp- conte nt/ uploads/ 2021/ 03/ ANZICS- APD- Data- Dicti onary. pdf.
8. Knaus WA, Draper EA, Wagner DP, Zimmerman JE (1985) APACHE II: a severity of disease classification system. Crit Care Med 13(10):818–829
9. Knaus WA, Wagner DP, Draper EA et al (1991) The APACHE III prognostic system. Risk prediction of hospital mortality for critically ill hospitalized adults. Chest 100(6):1619–1636. https:// doi. org/ 10. 1378/ chest. 100.6. 1619
10. World Health Organization. Defined daily dose (DDD). Accessed 3rd July, 2023. https:// www. who. int/ tools/ atc- ddd- toolk it/ about- ddd.
11. Kenward MGRJH (2009) An improved approximation to the precision of fixed effects from restricted maximum likelihood. Comput Stat Data Anal 53:2583–2595
12. Korinek AM, Laisne MJ, Nicolas MH, Raskine L, Deroin V, Sanson-Lepors MJ (1993) Selective decontamination of the digestive tract in neurosurgical intensive care unit patients: a double-blind, randomized, placebo-controlled study. Crit Care Med 21(10):1466–1473. https:// doi. org/ 10. 1097/00003 246- 19931 0000- 00013
13. Ribaric SF, Turel M, Knafelj R et al (2017) Prophylactic versus clinically driven antibiotics in comatose survivors of out-of-hospital cardiac arrest—a randomized pilot study. Resuscitation 111:103–109. https:// doi. org/ 10. 1016/j. resus citat ion. 2016. 11. 025
14. Francois B, Cariou A, Clere-Jehl R et al (2019) Prevention of early ventilator-associated pneumonia after cardiac arrest. N Engl J Med 381(19):1831–1842. https:// doi. org/ 10. 1056/ NEJMo a1812 379
15. Sirvent JM, Torres A, El-Ebiary M, Castro P, de Batlle J, Bonet A (1997) Protective effect of intravenously administered cefuroxime against nosocomial pneumonia in patients with structural coma. Am J Respir Crit Care Med 155(5):1729–1734. https:// doi. org/ 10. 1164/ ajrccm. 155.5. 9154884
16. Acquarolo A, Urli T, Perone G, Giannotti C, Candiani A, Latronico N (2005) Antibiotic prophylaxis of early onset pneumonia in critically ill comatose patients. A randomized study. Int Care Med 31(4):510–516. https:// doi.org/ 10. 1007/ s00134- 005- 2585-5
17. Vincent JL, Rello J, Marshall J et al (2009) International study of the prevalence and outcomes of infection in intensive care units. JAMA 302(21):2323–2329. https:// doi. org/ 10. 1001/ jama. 2009. 1754
Источник фотоиллюстрации - www.freepik.com
[~DETAIL_TEXT] =>
Young PJ, Devaux A, Li Q et al. and Myburgh JA on behalf of the SuDDICU Australia Investigators and the Australian and New Zealand Intensive Care Society Clinical Trials Group
Selective digestive tract decontamination in critically ill adults with acute brain injuries: a post hoc analysis of a randomized clinical trial
Intensive Care Med
doi.org/10.1007/s00134-023-07261-y
Абстракт
Целью данного исследования было определить, снижает ли селективная деконтаминация пищеварительного тракта (SDD) внутрибольничную смертность у взрослых в критическом состоянии на искусственной вентиляции легких (ИВЛ), поступивших в отделение интенсивной терапии (ОИТ) с острыми повреждениями головного мозга. Мы провели апостериорный анализ перекрестного кластерного рандомизированного клинического исследования.ОИТ были случайным образом распределены для принятия или не принятия стратегии SDD в течение двух чередующихся 12-месячных периодов, разделенных трехмесячным перерывом между периодами. Пациенты в группе SDD (n = 2791; 968, поступившие в отделение интенсивной терапии с острой черепно-мозговой травмой) получали 6-часовую аппликацию пероральной пасты и введение желудочной суспензии, содержащей колистин, тобрамицин и нистатин, на время ИВЛ плюс 4-дневный курс внутривенного введения антибиотика подходящего противомикробного спектра. Пациенты контрольной группы (n = 3191; 1093, поступивших в отделения интенсивной терапии с острой черепно-мозговой травмой) получали стандартную помощь. Первичным результатом была внутрибольничная смертность в течение 90 дней. Оценивали четыре вторичных клинических исхода: смерть в ОИТ, в также отсутствие ИВЛ, перевод из ОРИТ и выписка из стационар на 90-день. Из 2061 пациента с острыми черепно-мозговыми травмами (средний возраст 55,8 года; 36,4% женщины) все завершили исследование. У пациентов с острой черепно-мозговой травмой в группах SDD и стандартной помощи зарегистрировано 313/968 (32,3%) и 415/1093 (38%) случаев смерти в стационаре (нескорректированное отношение шансов [OR], 0,76, 95% доверительный интервал [ ДИ] 0,63–0,92; р = 0,004). Использование SDD было связано со статистически значимым улучшением четырех вторичных клинических исходов по сравнению со стандартным лечением. В этом апостериорном анализе рандомизированного клинического исследования у пациентов в критическом состоянии с острыми травмами головного мозга, получающих искусственную вентиляцию легких, использование SDD значительно снизило внутрибольничную смертность у пациентов по сравнению со стандартным лечением без SDD. Эти выводы требуют подтверждения.
Ключевые слова: Селективная деконтаминация пищеварительного тракта, острая черепно-мозговая травма, ИВЛ, Смертность.
Введение
Селективная деконтаминация пищеварительного тракта (SDD), состоящая из пероральной антибиотической пасты и желудочной суспензии антибиотика в сочетании с коротким курсом внутривенного введения антибиотиков, широко изучалась у пациентов в критическом состоянии [1]. В недавно опубликованном исследовании «Селективная деконтаминация пищеварительного тракта в отделении интенсивной терапии» (SuDDICU) госпитальная смертность существенно не отличалась для пациентов, получавших SDD и стандартную помощь [2]. Когда данные этого и других рандомизированных клинических исследований были объединены в байесовский метаанализ было показано, что апостериорная вероятность того, что SDD была связана со снижением госпитальной смертности по сравнению со стандартным лечением, составила 99,3% [1].Остается неясным, было ли снижение смертности, связанное с SDD [2], преимуществом в конкретной подгруппе или подгруппах. Пациенты с острыми черепно-мозговыми травмами или состояниями со сниженным уровнем сознания и нарушениями рефлексов дыхательных путей подвергаются риску аспирации, что может приводить к инфекции нижних дыхательных путей или вентилятор-ассоциированной пневмонии [1, 3, 4]. Вентилятор-ассоциированная пневмония может привести к лихорадке, гипоксемии и нарушению вентиляции, которые являются признанными причинами вторичного повреждения головного мозга [4], что потенциально может привести к дополнительным смертям. Поскольку SDD представляет собой стратегию инфекционного контроля, предназначенную для предотвращения вентилятор-ассоциированной пневмонии, она может оказаться особенно полезной для этой группы пациентов. Чтобы оценить возможность того, что SDD принесет пользу пациентам, поступившим в ОИТ с острыми повреждениями головного мозга, был проведен апостериорный анализ подгрупп с использованием данных исследования SuDDICU.
Методы
Этическое одобрение исследования SuDDICU Australia было получено от комитетов по этике исследований на людях и отделов управления исследованиями в каждом исследовательском центре. Поскольку SDD было реализовано как вмешательство во всем ОИТ, отказ от индивидуального согласия пациента был получен от каждого ведущего комитета по этике исследований на людях в соответствии с юридическими требованиями. Для пациентов в группе стандартного лечения был получен отказ от согласия, поскольку вмешательство не проводилось. Поскольку для анализа этой подгруппы не было получено новых данных, дополнительное этическое одобрение не требовалось. Протокол исследования и план статистического анализа [5], а также первичные данные [2] перекрестного кластерного рандомизированного клинического исследования SuDDICU были опубликованы. ранее.
Исследование SuDDICU Australia проводилось в 19 ОИТ в 17 больницах Австралии с мая 2017 года по ноябрь 2021 года. Подходящими ОИТ были соматические и хирургические ОИТ, способные лечить взрослых на ИВЛ и реализовать SDD у всех подходящих пациентов. Подходящие пациенты были переведены на ИВЛ (либо при поступлении в ОИТ, либо во время нахождения в ОИТ), и ожидалось, что они будут оставаться на ИВЛ по крайней мере до второго дня после включения в исследование. Пациенты, которым первоначально не предполагалось, что потребуется два дня ИВЛ, были повторно обследованы и включены в исследование, если впоследствии были соблюдены критерии отбора. Для этого апостериорного анализа подгрупп пациенты с острой черепно-мозговой травмой при поступлении в ОИТ были оценены по шкале APACHE)-III [7]. К пациентам с острой черепно-мозговой травмой были отнесены следующие диагнозы: остановка сердца; внутримозговое кровоизлияние; субарахноидальное кровоизлияние; инсульт; инфекция головного мозга; неврологическое новообразование; кома; субдуральная гематома; травматическое повреждение мозга; и эпидуральная гематома. У всех остальных пациентов не было острой черепно-мозговой травмы. ОИТ были рандомизированы для принятия стратегии SDD или для продолжения стандартного лечения в течение двух чередующихся 12-месячных периодов, разделенных 3-месячным перерывом между периодами. Полная информация о рандомизации, стратифицированная по количеству коек в ОИТ в исследовательском центре, изложена в протоколе и манускрипте исследования SuDDICU [2].
Вмешательства
SDD включало (i) местное применение 0,5 г пасты для перорального применения, содержащей 10 мг колистина, 10 мг тобрамицина и 125 000 международных единиц нистатина, на слизистую оболочку щек и ротоглотки каждые 6 часов; (ii) введение каждые шесть часов 10 мл желудочной суспензии, содержащей 100 мг колистина, 80 мг тобрамицина и 2 × 106 международных единиц нистатина, в верхние отделы желудочно-кишечного тракта через желудочный или постпилорический зонд; (iii) 4-дневный курс внутривенного введения антибиотика, соответствующего SDD, который включал цефалоспорин третьего поколения или ципрофлоксацин, если только больной не лечился указанными антибиотиками с активностью против грамотрицательных бактерий в течение первых 4 дней после включения, и в этом случае дополнительный антибиотики не применялись. Паста и суспензия SDD были произведены компанией Verita Pharma® (Сидней, Австралия) по лицензии George Institutefor Global Health в соответствии со стандартами надлежащей производственной практики, утвержденными Therapeutic Goods Administration of Australia . Подробности приготовления препарата для SDD описаны ранее [2]. Пероральную пасту SDD и желудочную суспензию вводили как можно скорее после соответствия критериям отбора и продолжали до экстубации или 90-го дня, в зависимости от того, что наступило раньше. Все остальные методы лечения, включая использование профилактических или терапевтических антибиотиков, находились на усмотрении лечащих врачей.
Данные, собранные на исходном уровне, включали демографические данные, диагноз при поступлении в ОИТ, оценку по шкале APACHE (оценка тяжести заболевания варьируется от 0 до 71 [APACHE-II] [8] или от 0 до 299 [APACHE-III] [9], причем более высокие баллы указывают на повышенный риск смерти) и специфические факторы риска инфекции, включая предшествующий прием перорального хлоргексидина и внутривенных антибиотиков. Для пациентов, находившихся в ОИТ в период а SDD, ежедневные данные, документирующие введение пероральной пасты SDD и желудочной суспензии, собирались в течение продолжительности ИВЛ до 90 дней и приема антибиотиков, совместимых с SDD, в течение 5 дней. Соблюдение режима применения местных компонентов SDD оценивалось как доля пациентов, получавших хотя бы одну подходящую дозу SDD ежедневно в течение периода ИВЛ. Дозы всех внутривенных антибиотиков собирались в течение 28 дней и были представлены как суточные дозы, определенные Всемирной организацией здравоохранения [10]. Данные, записываемые ежедневно в течение 90 дней, включали продолжительность ИВЛ, пребывания в ОИТ и стационаре, все новые микроорганизмы, выделенные из крови и другого материалар, любые новые положительные тесты на Clostridioides difficile и новый антибиотикоустойчивые культуры, как описано ранее [2].Подробности проверки и мониторинга исходных данных представлены в ESM.
Критерии оценки
Первичным результатом была внутрибольничная смертность от всех причин в течение 90 дней с момента включения в исследование во время госпитализации. Клиническими вторичными исходами были смертность в ОИТ, количество дней, прожитых без искусственной вентиляции легких, вне ОИТ и стационара в течение 90 дней. Вторичные микробиологические результаты представляли собой результаты всех новых культур крови;частота новых положительных результатов тестов на Clostridioides difficile; выделение микроорганизмов устойчивых к антибиотикам, а также общую длительность использования антибиотиков.
Статистический анализ
Этот анализ подгрупп проводился с использованием того же плана статистического анализа, который использовался в основном анализе SuDDICU [2]. Пациенты были проанализированы в своей группе рандомизации, независимо от приверженности лечению, с использованием всех доступных данных. Первичный результат смерти в больнице в течение 90 дней анализировали с использованием модели иерархической логистической регрессии индивидуального уровня, включающей как случайный кластерный эффект, так и случайный эффект кластерного периода. Эффект вмешательства оценивался как отношение шансов (ОШ) смерти и 95% доверительный интервал (ДИ) со степенями свободы, скорректированными поправкой Kenward-Roger [11].Абсолютную разницу частоты событий также оценивали с помощью линейной регрессии на уровне кластера, взвешенной пропорционально обратной биномиальной дисперсии для каждого периода кластера. Смертность вОИТ оценивалась аналогичным образом.
Количество дней жизни и дней без ИВЛ, вне ОИТ и выписки из стационара в течение 90 дней анализировали с использованием модели иерархической линейной регрессии с поправкой Kenward-Roger. Эффекты вмешательства были представлены как скорректированные средние различия и 95% ДИ. Время выписки из ОИТ и стационара суммировали по подгруппам с использованием функций кумулятивной заболеваемости, рассматривая смертность как конкурирующий риск, с отсечкой на 90-й день. Эффекты вмешательства оценивались как отношения рисков (ОР) и 95% ДИ, полученные на основе модели Кокса, специфичной для причины, с фиксированным эффектом лечения и контролем случайного эффекта. Во всех анализах неоднородность ответа на лечение у пациентов с острой черепно-мозговой травмой и без нее оценивалась путем добавления переменной подгруппы, а также ее взаимодействия с вмешательством в основной модели анализа. Чтобы оценить возможность неоднородности влияния лечения на внутрибольничную смертность в подгруппе пациентов с острыми травмами головного мозга, подгруппа была разделена на три взаимоисключающие категории и установлена взаимосвязь между распределением лечения и категорией. Этими категориями были: (i) черепно-мозговая травма (определяемая как APACHEIII диагноз травмы головы, субдуральной гематомы и субдуральной/эпидуральной гематомы при поступлении в отделение интенсивной терапии; (ii) субарахноидальное кровоизлияние и инсульт (определяемая как APACHE-III диагноз внутримозгового кровоизлияния при поступлении в отделение ОИТ; субарахноидальныйкровоизлияние; инсульт; внутримозговое кровоизлияние) и (iii) другие повреждения головного мозга (определяемые как APACHE-III диагнозы при поступлении в отделение интенсивной терапии: остановка сердца; инфекция головного мозга; неврологическое новообразование; судороги; другое неврологическое заболевание; кома). Неоднородность влияния лечения на внутрибольничную смертность основывалась на том, получали ли пациенты внутривенные антибиотики на исходном уровне. Микробиологические исходы анализировались с помощью долей пациентов, у которых произошло хотя бы одно событие в каждом кластерном периоде. Эти пропорции моделировались с помощью взвешенной линейной регрессии, где значения вычислялись с помощью обратной дисперсии для каждого кластерного периода. Все эти анализы проводились без каких-либо корректировок. Все статистические тесты проводились с определением двухстороннего уровня 0,05. Поскольку все анализы, проведенные в данном исследовании, являются post hoc, они рассматривались как исследовательские. Статистический анализ проводился с использованием программного обеспечения SAS (версия 9.4) (Cary NC, USA ).
Полученные результаты
Всего было включено 5982 взрослых на искусственной вентиляции легких, из них 2061 (средний возраст 55,8 лет; 36,4% женщины) имели острую черепно-мозговую травму или повреждение головного мозга по другой причине.В первый период вмешательства в исследование были включены 1019 пациентов с острой мозговой травмой, из них 388 (38,1%) в группе SDD и 631 (61,9%) в группе стандартной помощи. Во второй период вмешательства было включено 1042 пациента с острой мозговой травмой, из них 580 (55,7%) в группу SDD и 462 (44,3%) в группу стандартной помощи. Первичный результат был доступен для всех 968 пациентов в группе SDD и для всех 1093 пациентов в группе стандартной помощи (рис. 1). Исходные характеристики пациентов с острыми мозговыми травмами, распределенных в группы SDD и группы стандартной помощи, были схожими (таблица 1), за исключением того, что время от поступления в ОИТ до включения в исследование составляло в среднем 11,6 часа (интерквартильный диапазон [IQR] 1,3–29,6 часа) в SDD. группе и медиане 1,9 часа (IQR 0–17,5 часа) в группе стандартного лечения; Пероральный хлоргексидин применялся у 261/968 (27%) пациентов в группе SDD и у 198/1093 (18,1%) в группе стандартной терапии, а системные стероиды применялись у 51/968 (5,3%) в группе SDD и у 103 пациентов. /1093 (9,4%) в группе стандартного лечения. Среди пациентов с острыми черепно-мозговыми травмами в группе SDD доля днейИВЛ, когда пациенты получали как пероральную пасту SDD, так и желудочную суспензию, составила 93,1% (рис. 1, ESM). Данные о введении каждого компонента SDD показаны в электронной таблице 1, ESM и долях пациентов, получающих SDD-антибиотики, в SDD и группе стандартной помощи показаны на eFigure2, ESM.


При оценке на день 90 после включения умерли 313 (32,3%) из 968, распределенных в группу SDD, и 415 (38%) из 1093, - в группе стандартной помощи (средняя разница - 6,2%, 95% ДИ от - 8,9 до - 3,5%; ОШ 0,76, 95% ДИ 0,63–0,92; p = 0,004). Результаты были схожими после поправки на исходный возраст, пол, оценку APACHE II/III и диагноз (ОШ 0,74; 95% ДИ 0,57–0,97; p = 0,03), но не были значимыми после добавления времени от поступления в ОИТ до включения, системных стероидов, перорального приема. хлоргексидина и введение внутривенно антибиотиков на момент включения в исследование (ОШ 0,78; 95% ДИ 0,59–1,04; p = 0,08). (Table 2). Соответствующие отношения риска для времени до смерти при SDD по сравнению со стандартной помощью составили 0,83 (95% ДИ 0,71–0,96) и 1,01 (95% ДИ 0,89–1,15) для пациентов с острыми мозговыми травмами и без них соответственно (Table . 2a, b). . Значительной гетерогенности во влиянии SDD на смертность у пациентов с (ОШ 0,78, 95% ДИ 0,59–1,04, р = 0,08) и без (ОШ 0,85, 95% ДИ 0,72–1,00, р = 0,05) острых мозговых травм соответственно не выявлено (p = 0,22) (Fig. 3, eTable2, ESM). Не было значительной разницы в смертности между группами SDD и стандартной помощи между пациентами с черепно-мозговой травмой и субарахноидальным кровоизлиянием или между инсультом и другими повреждениями головного мозга (eTable 3, ESM); или на основании получения или нет внутривенной антибактериальной терапии на исходном уровне (eTable 3, ESM). Причины смерти пациентов с острыми мозговыми травмами по группам лечения представлены в eTable 4 ESM.


Из четырех клинических вторичных исходов (смерть в отделении интенсивной терапии, дни жизни и отсутствия ИВЛ, дни жизни и отсутствия госпитализации в ОИТ и дни жизни и дни без госпитализации) наблюдались статистически значимые различия в пользу группы SDD у больных с острым повреждением мозга (Table 2).
Соответствующие отношения риска для дней жизни и отсутствия ИВЛ с SDD по сравнению со стандартной помощью составили 1,11 (95% ДИ 1,01–1,22) и 1,1 (95% ДИ 1,03–1,18) для пациентов с острыми травмами головного мозга и без них соответственно (eFigure 3а и 3в, ESM). Соответствующие отношения риска для живых дней без ОИТ с SDD по сравнению со стандартным лечением составили 1,1 (95% ДИ 0,99–1,22) и 1,03 (95% ДИ 0,96–1,11) для пациентов с острыми мозговыми травмами и без них соответственно (eFigure 4a и 4в, ESM).Соответствующие отношения риска для живых и выписанных из больницы с SDD по сравнению со стандартным лечением составили 1,06 (95% ДИ 0,94–1,18) и 1 (95% ДИ 0,93–1,07) для пациентов с острыми мозговыми травмами и без них соответственно (eFigure 5a и 5в, ESM) . Не было значительной гетерогенности в влиянии SDD на четыре вторичных клинических исхода у пациентов с острыми травмами головного мозга и без них (eTable2 и eFigure 3, ESM).

Микробиологические вторичные исходы
В группе SDD по сравнению с группой стандартной терапии наблюдалось статистически значимое снижение доли пациентов, у которых были культивированы новые микроорганизмы, устойчивые к антибиотикам (20,5% против 34,2%; абсолютная разница – 13,9 процентных пунктов; 95% ДИ – от 17,5 до − 10,3); для новых положительных культур крови, за исключением коагулазонегативных Staphylococcus (2,8% против 5,5%; абсолютная разница — 1,9 процентных пункта, 95% ДИ от — 3,5 до — 0,4) и для новых положительных результатов тестов на Clostridioides difficile (0,1% против 0,8%; абсолютная разница — 0,6 процентных пункта, 95% ДИ от – 1 до – 0,1) (Table 2). Среди пациентов с острыми повреждениями мозга в группах SDD и стандартной помощи соответственно количество пациентов с собранными культурами крови составило 552 (57%) против 713 (65,2%), а количество пациентов с другими культурами составило 229 ( 23,7%) против 411 (37,6%). Данные о конкретных микроорганизмах, выращенных из образцов крови, а также о новых устойчивых к антибиотикам организмах, выращенных из образцов, не являющихся кровью, из групп SDD и групп стандартного ухода, показаны в eTable 5, ESM. Новые микроорганизмы, устойчивые к антибиотикам, были культивированы из дыхательных путей у 115 из 968 (11,9%) и 275 из 1093 (25,2%) пациентов, распределенных в группы SDD и стандартной помощи соответственно.
Средние кумулятивные суточные определенные дозы в течение первых 28 дней всех внутривенных антибиотиков и внутривенных антибиотиков, не вводимых в рамках схемы лечения SDD, показаны на eFigure 6, ESM.Совокупные установленные суточные дозы каждого класса антибиотиков также показаны на eFigure 7, ESM.Среди пациентов с острыми мозговыми травмами ежедневно определенные дозы антибиотиков, вводимые в течение первых семи дней после включения в исследование, были значительно выше в группе SDD по сравнению с группой стандартной терапии (eFigure 8, ESM), хотя установленные ежедневно дозы в течение первых 28 дней после включения между двумя группами существенно не отличались (eFigure 9, ESM). Инфекции Clostridioides difficile возникли у 1 из 968 (0,1%) пациентов в группе SDD и у 9 из 1093 (0,8%) пациентов в группе стандартной терапии. Другие нежелательные и серьезные нежелательные явления были редки (eTable 6, ESM).
Обсуждение
В этом post hoc анализе, проведенном на основе данных перекрестного кластерного рандомизированного клинического исследования, использование SDD в подгруппе взрослых больных в критическом состоянии с острыми травмами или другими повреждениями головного мозга, находящихся на ИВЛ, было связано со статистически значимым снижением внутрибольничной смертности по сравнению со стандартным лечением без SDD. Использование SDD было связано со значительным снижением смертности в ОИТ, продолжительности ИВЛ и продолжительности пребывания в ОИТ и стационаре, а также с более низкими показателями новых инфекций кровотока и новых культур антибиотикоустойчивых организмов. У пациентов без острых черепно-мозговых травм и состояний, которые составили около двух третей участников исследования SuDDICU, не было отмечено существенных различий в клинических исходах между группами SDD и стандартным лечением.
За исключением одного небольшого исследования [12], пациенты с острыми травмами головного мозга не были в центре внимания клинических исследований по оценке SDD [1]. Предыдущие рандомизированные клинические исследования показали, что внутривенная антибиотикопрофилактика может снизить частоту вентилятор-ассоциированной пневмонии в пациентов после остановки сердца [13, 14] и с другими повреждениями головного мозга в ОИТ [15, 16]. Эти исследования профилактического применения антибиотиков не были сосредоточены на таких важных для пациентов исходах, как смертность. В этой большой подгруппе, состоящей почти из 2000 пациентов с острыми травмами головного мозга в рамках прагматичного рандомизированного клинического исследования, SDD было связано с улучшением нескольких исходов, ориентированных на пациента. Снижение смертности на 5,7 процентных пункта соответствует числу пациентов, которых необходимо лечить, равному 18, чтобы избежать одной смерти. Это клинически важный размер эффекта в популяции пациентов с контрольным уровнем смертности 38 процентных пунктов. Превосходное соблюдение протокола было достигнуто благодаря более чем 90 процентным пунктам подходящих доз стандартных коммерческих препаратов SDD, введенных на время искусственной вентиляции легких. В отличие от общей популяции исследования SuDDICU [2], пациенты с острыми травмами головного мозга, которые были распределены в SDD, получали значительно больше ежедневных определенных доз антибиотиков в первые 7 дней по сравнению с пациентами, получавшими стандартную помощь.
Хотя SDD было связано с более низкими показателями новых инфекций, которые могли смягчить потенциальные причины вторичного повреждения головного мозга, данные о показателях деятельности мозга, таких как внутричерепное давление, типы, продолжительность и интенсивность церебральной терапии или оценки долгосрочных функциональных результатов, не были доступны для подтверждения или опровержения предполагаемых механизмов пользы. Хотя вентилятор-ассоциированная пневмония является частой причиной инфекций, приобретенных в ОИТ [17], конкретные данные о диагнозе или источнике инфекции или влиянии вентилятор-ассоциированной пневмонии на дыхательную функцию не были доступны для анализа, хотя обнаружена более низкая частота устойчивых микроорганизмов из дыхательных путей у пациентов при проведении SDD.
Этот анализ подгрупп имеет некоторые ограничения. Во-первых, вмешательство не было слепым и, следовательно, подвержено систематической ошибке, хотя это было смягчено объективным первичным результатом и принятием SDD в качестве стандартной помощи, предоставляемой всем подходящим пациентам в течение периода вмешательства. Во-вторых, мы сообщили о первичных диагнозах при поступлении в отделение интенсивной терапии, определяющих наличие острой черепно-мозговой травмы, что могло привести к неправильной классификации некоторых пациентов. В-третьих, хотя основной результат был сообщен с использованием заранее заданного нескорректированного анализа, скорректированный анализ, учитывающий исходные дисбалансы, одинаково важен для последующего анализа. Хотя статистически значимые различия в основных результатах были потеряны после корректировки исходных дисбалансов, величина и направление эффекта существенно не отличались.
В-четвертых, хотя умеренное снижение смертности при SDD, наблюдаемое у пациентов с острыми повреждениями головного мозга, согласуется с гипотезой нашего исследования и с положительными эффектами SDD, наблюдаемыми в вторичных клинических исходах, вероятность того, что эффект лечения на дифференциальные причины смерти будет больше, чем мы наблюдали. неправдоподобно. Соответственно, отсутствие статистически значимой гетерогенности эффекта лечения в нашем исследовании может быть связано с низкой статистической мощностью. В-пятых, этот анализ был основан на гипотезах и не был заранее указан перед первичным испытанием. Хотя совокупные данные свидетельствуют о том, что использование SDD связано со снижением госпитальной смертности [1], этот апостериорный анализ данных исследования SuDDICU предполагает, что этот эффект может быть обусловлен в первую очередь пользой для пациентов с острыми травмами головного мозга и другие пациенты могут иметь небольшую пользу или вообще не иметь пользы от SDD. Прежде чем внедрять в клиническую практику, эти результаты должны быть подтверждены посредством анализа данных на уровне пациентов из других исследований или новых рандомизированных клинических исследований.
Заключение
Среди пациентов в критическом состоянии на ИВЛ, SDD значительно снизила внутрибольничную смертность пациентов с острыми повреждениями головного мозга по сравнению со стандартной помощью. Однако результаты апостериорного анализа этой популяции пациентов требуют подтверждения.
Ссылка на документ с дополнительными данными исследования (Supplementary).
References
1. Hammond NE, Myburgh J, Seppelt I et al (2022) Association between selective decontamination of the digestive tract and in-hospital mortality in intensive care unit patients receiving mechanical ventilation: a systematic review and meta-analysis. JAMA 328(19):1922–1934. https:// doi. org/10. 1001/ jama. 2022. 19709
2. The SuDDICU Investigators for the Australian and New Zealand Intensive Care Society Clinical Trials Group. Effect of selective decontamination of the digestive tract on hospital mortality in critically ill patients receiving mechanical ventilation: a randomized clinical trial. JAMA. 2022;328(19):1911–1921. https:// doi. org/ 10. 1001/ jama. 2022. 17927
3. Bonten MJ, Kollef MH, Hall JB (2004) Risk factors for ventilator-associated pneumonia: from epidemiology to patient management. Clin Infect Dis 38(8):1141–1149. https:// doi. org/ 10. 1086/ 383039
4. Ewig S, Torres A, El-Ebiary M et al (1999) Bacterial colonization patterns in mechanically ventilated patients with traumatic and medical head injury. Incidence, risk factors, and association with ventilator-associated pneumonia. Am J Respir Crit Care Med 159(1):188–198. https:// doi. org/10. 1164/ ajrccm. 159.1. 98030 97
5. The SuDDICU Investigators (2021) Protocol summary and statistical analysis plan for the Selective Decontamination of the Digestive Tract in Intensive Care Unit Patients (SuDDICU) crossover, cluster randomised controlled trial. Crit Care Resusc 23(2):183–193
6. Campbell MK, Elbourne DR, Altman DG et al (2004) CONSORT statement: extension to cluster randomised trials. BMJ 328(7441):702–708. https://doi. org/ 10. 1136/ bmj. 328. 7441. 702
7. ANZICS Centre for Outcome and Resource Evaluation. APD Data Dictionary. Version 6.1. April 2022 https:// www. anzics. com. au/ wp- conte nt/ uploads/ 2021/ 03/ ANZICS- APD- Data- Dicti onary. pdf.
8. Knaus WA, Draper EA, Wagner DP, Zimmerman JE (1985) APACHE II: a severity of disease classification system. Crit Care Med 13(10):818–829
9. Knaus WA, Wagner DP, Draper EA et al (1991) The APACHE III prognostic system. Risk prediction of hospital mortality for critically ill hospitalized adults. Chest 100(6):1619–1636. https:// doi. org/ 10. 1378/ chest. 100.6. 1619
10. World Health Organization. Defined daily dose (DDD). Accessed 3rd July, 2023. https:// www. who. int/ tools/ atc- ddd- toolk it/ about- ddd.
11. Kenward MGRJH (2009) An improved approximation to the precision of fixed effects from restricted maximum likelihood. Comput Stat Data Anal 53:2583–2595
12. Korinek AM, Laisne MJ, Nicolas MH, Raskine L, Deroin V, Sanson-Lepors MJ (1993) Selective decontamination of the digestive tract in neurosurgical intensive care unit patients: a double-blind, randomized, placebo-controlled study. Crit Care Med 21(10):1466–1473. https:// doi. org/ 10. 1097/00003 246- 19931 0000- 00013
13. Ribaric SF, Turel M, Knafelj R et al (2017) Prophylactic versus clinically driven antibiotics in comatose survivors of out-of-hospital cardiac arrest—a randomized pilot study. Resuscitation 111:103–109. https:// doi. org/ 10. 1016/j. resus citat ion. 2016. 11. 025
14. Francois B, Cariou A, Clere-Jehl R et al (2019) Prevention of early ventilator-associated pneumonia after cardiac arrest. N Engl J Med 381(19):1831–1842. https:// doi. org/ 10. 1056/ NEJMo a1812 379
15. Sirvent JM, Torres A, El-Ebiary M, Castro P, de Batlle J, Bonet A (1997) Protective effect of intravenously administered cefuroxime against nosocomial pneumonia in patients with structural coma. Am J Respir Crit Care Med 155(5):1729–1734. https:// doi. org/ 10. 1164/ ajrccm. 155.5. 9154884
16. Acquarolo A, Urli T, Perone G, Giannotti C, Candiani A, Latronico N (2005) Antibiotic prophylaxis of early onset pneumonia in critically ill comatose patients. A randomized study. Int Care Med 31(4):510–516. https:// doi.org/ 10. 1007/ s00134- 005- 2585-5
17. Vincent JL, Rello J, Marshall J et al (2009) International study of the prevalence and outcomes of infection in intensive care units. JAMA 302(21):2323–2329. https:// doi. org/ 10. 1001/ jama. 2009. 1754
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 29.05.2024
[~DATE_ACTIVE_FROM] => 29.05.2024
[ACTIVE_FROM_X] => 2024-05-29 00:00:00
[~ACTIVE_FROM_X] => 2024-05-29 00:00:00
[ACTIVE_FROM] => 29.05.2024
[~ACTIVE_FROM] => 29.05.2024
[SHOW_COUNTER] => 494
[~SHOW_COUNTER] => 494
[ID] => 8440
[~ID] => 8440
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 11.11.2024 14:05:00
[~TIMESTAMP_X] => 11.11.2024 14:05:00
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/selektivnaya-dekontaminatsiya-pishchevaritelnogo-trakta-u-vzroslykh-v-kriticheskom-sostoyanii-s-ostr/
[~DETAIL_PAGE_URL] => /library/articles/selektivnaya-dekontaminatsiya-pishchevaritelnogo-trakta-u-vzroslykh-v-kriticheskom-sostoyanii-s-ostr/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => selektivnaya-dekontaminatsiya-pishchevaritelnogo-trakta-u-vzroslykh-v-kriticheskom-sostoyanii-s-ostr
[~CODE] => selektivnaya-dekontaminatsiya-pishchevaritelnogo-trakta-u-vzroslykh-v-kriticheskom-sostoyanii-s-ostr
[EXTERNAL_ID] => 8440
[~EXTERNAL_ID] => 8440
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 29 мая 2024
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
[PREVIEW_PICTURE] => Array
(
[ID] => 5649
[TIMESTAMP_X] => 11.11.2024 14:05:00
[MODULE_ID] => iblock
[HEIGHT] => 563
[WIDTH] => 1000
[FILE_SIZE] => 90811
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/90a/szw0ytw7ycjh5qtwox2jjshr16b8mypf
[FILE_NAME] => close-up-hands-typing-keyboard.jpg
[ORIGINAL_NAME] => close-up-hands-typing-keyboard.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 3565b762b614ed4452be092f171f0b68
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/90a/szw0ytw7ycjh5qtwox2jjshr16b8mypf/close-up-hands-typing-keyboard.jpg
[UNSAFE_SRC] => /upload/iblock/90a/szw0ytw7ycjh5qtwox2jjshr16b8mypf/close-up-hands-typing-keyboard.jpg
[SAFE_SRC] => /upload/iblock/90a/szw0ytw7ycjh5qtwox2jjshr16b8mypf/close-up-hands-typing-keyboard.jpg
[ALT] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
[TITLE] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
)
[DETAIL_TEXT] =>
Young PJ, Devaux A, Li Q et al. and Myburgh JA on behalf of the SuDDICU Australia Investigators and the Australian and New Zealand Intensive Care Society Clinical Trials Group
Selective digestive tract decontamination in critically ill adults with acute brain injuries: a post hoc analysis of a randomized clinical trial
Intensive Care Med
doi.org/10.1007/s00134-023-07261-y
Абстракт
Целью данного исследования было определить, снижает ли селективная деконтаминация пищеварительного тракта (SDD) внутрибольничную смертность у взрослых в критическом состоянии на искусственной вентиляции легких (ИВЛ), поступивших в отделение интенсивной терапии (ОИТ) с острыми повреждениями головного мозга. Мы провели апостериорный анализ перекрестного кластерного рандомизированного клинического исследования.ОИТ были случайным образом распределены для принятия или не принятия стратегии SDD в течение двух чередующихся 12-месячных периодов, разделенных трехмесячным перерывом между периодами. Пациенты в группе SDD (n = 2791; 968, поступившие в отделение интенсивной терапии с острой черепно-мозговой травмой) получали 6-часовую аппликацию пероральной пасты и введение желудочной суспензии, содержащей колистин, тобрамицин и нистатин, на время ИВЛ плюс 4-дневный курс внутривенного введения антибиотика подходящего противомикробного спектра. Пациенты контрольной группы (n = 3191; 1093, поступивших в отделения интенсивной терапии с острой черепно-мозговой травмой) получали стандартную помощь. Первичным результатом была внутрибольничная смертность в течение 90 дней. Оценивали четыре вторичных клинических исхода: смерть в ОИТ, в также отсутствие ИВЛ, перевод из ОРИТ и выписка из стационар на 90-день. Из 2061 пациента с острыми черепно-мозговыми травмами (средний возраст 55,8 года; 36,4% женщины) все завершили исследование. У пациентов с острой черепно-мозговой травмой в группах SDD и стандартной помощи зарегистрировано 313/968 (32,3%) и 415/1093 (38%) случаев смерти в стационаре (нескорректированное отношение шансов [OR], 0,76, 95% доверительный интервал [ ДИ] 0,63–0,92; р = 0,004). Использование SDD было связано со статистически значимым улучшением четырех вторичных клинических исходов по сравнению со стандартным лечением. В этом апостериорном анализе рандомизированного клинического исследования у пациентов в критическом состоянии с острыми травмами головного мозга, получающих искусственную вентиляцию легких, использование SDD значительно снизило внутрибольничную смертность у пациентов по сравнению со стандартным лечением без SDD. Эти выводы требуют подтверждения.
Ключевые слова: Селективная деконтаминация пищеварительного тракта, острая черепно-мозговая травма, ИВЛ, Смертность.
Введение
Селективная деконтаминация пищеварительного тракта (SDD), состоящая из пероральной антибиотической пасты и желудочной суспензии антибиотика в сочетании с коротким курсом внутривенного введения антибиотиков, широко изучалась у пациентов в критическом состоянии [1]. В недавно опубликованном исследовании «Селективная деконтаминация пищеварительного тракта в отделении интенсивной терапии» (SuDDICU) госпитальная смертность существенно не отличалась для пациентов, получавших SDD и стандартную помощь [2]. Когда данные этого и других рандомизированных клинических исследований были объединены в байесовский метаанализ было показано, что апостериорная вероятность того, что SDD была связана со снижением госпитальной смертности по сравнению со стандартным лечением, составила 99,3% [1].Остается неясным, было ли снижение смертности, связанное с SDD [2], преимуществом в конкретной подгруппе или подгруппах. Пациенты с острыми черепно-мозговыми травмами или состояниями со сниженным уровнем сознания и нарушениями рефлексов дыхательных путей подвергаются риску аспирации, что может приводить к инфекции нижних дыхательных путей или вентилятор-ассоциированной пневмонии [1, 3, 4]. Вентилятор-ассоциированная пневмония может привести к лихорадке, гипоксемии и нарушению вентиляции, которые являются признанными причинами вторичного повреждения головного мозга [4], что потенциально может привести к дополнительным смертям. Поскольку SDD представляет собой стратегию инфекционного контроля, предназначенную для предотвращения вентилятор-ассоциированной пневмонии, она может оказаться особенно полезной для этой группы пациентов. Чтобы оценить возможность того, что SDD принесет пользу пациентам, поступившим в ОИТ с острыми повреждениями головного мозга, был проведен апостериорный анализ подгрупп с использованием данных исследования SuDDICU.
Методы
Этическое одобрение исследования SuDDICU Australia было получено от комитетов по этике исследований на людях и отделов управления исследованиями в каждом исследовательском центре. Поскольку SDD было реализовано как вмешательство во всем ОИТ, отказ от индивидуального согласия пациента был получен от каждого ведущего комитета по этике исследований на людях в соответствии с юридическими требованиями. Для пациентов в группе стандартного лечения был получен отказ от согласия, поскольку вмешательство не проводилось. Поскольку для анализа этой подгруппы не было получено новых данных, дополнительное этическое одобрение не требовалось. Протокол исследования и план статистического анализа [5], а также первичные данные [2] перекрестного кластерного рандомизированного клинического исследования SuDDICU были опубликованы. ранее.
Исследование SuDDICU Australia проводилось в 19 ОИТ в 17 больницах Австралии с мая 2017 года по ноябрь 2021 года. Подходящими ОИТ были соматические и хирургические ОИТ, способные лечить взрослых на ИВЛ и реализовать SDD у всех подходящих пациентов. Подходящие пациенты были переведены на ИВЛ (либо при поступлении в ОИТ, либо во время нахождения в ОИТ), и ожидалось, что они будут оставаться на ИВЛ по крайней мере до второго дня после включения в исследование. Пациенты, которым первоначально не предполагалось, что потребуется два дня ИВЛ, были повторно обследованы и включены в исследование, если впоследствии были соблюдены критерии отбора. Для этого апостериорного анализа подгрупп пациенты с острой черепно-мозговой травмой при поступлении в ОИТ были оценены по шкале APACHE)-III [7]. К пациентам с острой черепно-мозговой травмой были отнесены следующие диагнозы: остановка сердца; внутримозговое кровоизлияние; субарахноидальное кровоизлияние; инсульт; инфекция головного мозга; неврологическое новообразование; кома; субдуральная гематома; травматическое повреждение мозга; и эпидуральная гематома. У всех остальных пациентов не было острой черепно-мозговой травмы. ОИТ были рандомизированы для принятия стратегии SDD или для продолжения стандартного лечения в течение двух чередующихся 12-месячных периодов, разделенных 3-месячным перерывом между периодами. Полная информация о рандомизации, стратифицированная по количеству коек в ОИТ в исследовательском центре, изложена в протоколе и манускрипте исследования SuDDICU [2].
Вмешательства
SDD включало (i) местное применение 0,5 г пасты для перорального применения, содержащей 10 мг колистина, 10 мг тобрамицина и 125 000 международных единиц нистатина, на слизистую оболочку щек и ротоглотки каждые 6 часов; (ii) введение каждые шесть часов 10 мл желудочной суспензии, содержащей 100 мг колистина, 80 мг тобрамицина и 2 × 106 международных единиц нистатина, в верхние отделы желудочно-кишечного тракта через желудочный или постпилорический зонд; (iii) 4-дневный курс внутривенного введения антибиотика, соответствующего SDD, который включал цефалоспорин третьего поколения или ципрофлоксацин, если только больной не лечился указанными антибиотиками с активностью против грамотрицательных бактерий в течение первых 4 дней после включения, и в этом случае дополнительный антибиотики не применялись. Паста и суспензия SDD были произведены компанией Verita Pharma® (Сидней, Австралия) по лицензии George Institutefor Global Health в соответствии со стандартами надлежащей производственной практики, утвержденными Therapeutic Goods Administration of Australia . Подробности приготовления препарата для SDD описаны ранее [2]. Пероральную пасту SDD и желудочную суспензию вводили как можно скорее после соответствия критериям отбора и продолжали до экстубации или 90-го дня, в зависимости от того, что наступило раньше. Все остальные методы лечения, включая использование профилактических или терапевтических антибиотиков, находились на усмотрении лечащих врачей.
Данные, собранные на исходном уровне, включали демографические данные, диагноз при поступлении в ОИТ, оценку по шкале APACHE (оценка тяжести заболевания варьируется от 0 до 71 [APACHE-II] [8] или от 0 до 299 [APACHE-III] [9], причем более высокие баллы указывают на повышенный риск смерти) и специфические факторы риска инфекции, включая предшествующий прием перорального хлоргексидина и внутривенных антибиотиков. Для пациентов, находившихся в ОИТ в период а SDD, ежедневные данные, документирующие введение пероральной пасты SDD и желудочной суспензии, собирались в течение продолжительности ИВЛ до 90 дней и приема антибиотиков, совместимых с SDD, в течение 5 дней. Соблюдение режима применения местных компонентов SDD оценивалось как доля пациентов, получавших хотя бы одну подходящую дозу SDD ежедневно в течение периода ИВЛ. Дозы всех внутривенных антибиотиков собирались в течение 28 дней и были представлены как суточные дозы, определенные Всемирной организацией здравоохранения [10]. Данные, записываемые ежедневно в течение 90 дней, включали продолжительность ИВЛ, пребывания в ОИТ и стационаре, все новые микроорганизмы, выделенные из крови и другого материалар, любые новые положительные тесты на Clostridioides difficile и новый антибиотикоустойчивые культуры, как описано ранее [2].Подробности проверки и мониторинга исходных данных представлены в ESM.
Критерии оценки
Первичным результатом была внутрибольничная смертность от всех причин в течение 90 дней с момента включения в исследование во время госпитализации. Клиническими вторичными исходами были смертность в ОИТ, количество дней, прожитых без искусственной вентиляции легких, вне ОИТ и стационара в течение 90 дней. Вторичные микробиологические результаты представляли собой результаты всех новых культур крови;частота новых положительных результатов тестов на Clostridioides difficile; выделение микроорганизмов устойчивых к антибиотикам, а также общую длительность использования антибиотиков.
Статистический анализ
Этот анализ подгрупп проводился с использованием того же плана статистического анализа, который использовался в основном анализе SuDDICU [2]. Пациенты были проанализированы в своей группе рандомизации, независимо от приверженности лечению, с использованием всех доступных данных. Первичный результат смерти в больнице в течение 90 дней анализировали с использованием модели иерархической логистической регрессии индивидуального уровня, включающей как случайный кластерный эффект, так и случайный эффект кластерного периода. Эффект вмешательства оценивался как отношение шансов (ОШ) смерти и 95% доверительный интервал (ДИ) со степенями свободы, скорректированными поправкой Kenward-Roger [11].Абсолютную разницу частоты событий также оценивали с помощью линейной регрессии на уровне кластера, взвешенной пропорционально обратной биномиальной дисперсии для каждого периода кластера. Смертность вОИТ оценивалась аналогичным образом.
Количество дней жизни и дней без ИВЛ, вне ОИТ и выписки из стационара в течение 90 дней анализировали с использованием модели иерархической линейной регрессии с поправкой Kenward-Roger. Эффекты вмешательства были представлены как скорректированные средние различия и 95% ДИ. Время выписки из ОИТ и стационара суммировали по подгруппам с использованием функций кумулятивной заболеваемости, рассматривая смертность как конкурирующий риск, с отсечкой на 90-й день. Эффекты вмешательства оценивались как отношения рисков (ОР) и 95% ДИ, полученные на основе модели Кокса, специфичной для причины, с фиксированным эффектом лечения и контролем случайного эффекта. Во всех анализах неоднородность ответа на лечение у пациентов с острой черепно-мозговой травмой и без нее оценивалась путем добавления переменной подгруппы, а также ее взаимодействия с вмешательством в основной модели анализа. Чтобы оценить возможность неоднородности влияния лечения на внутрибольничную смертность в подгруппе пациентов с острыми травмами головного мозга, подгруппа была разделена на три взаимоисключающие категории и установлена взаимосвязь между распределением лечения и категорией. Этими категориями были: (i) черепно-мозговая травма (определяемая как APACHEIII диагноз травмы головы, субдуральной гематомы и субдуральной/эпидуральной гематомы при поступлении в отделение интенсивной терапии; (ii) субарахноидальное кровоизлияние и инсульт (определяемая как APACHE-III диагноз внутримозгового кровоизлияния при поступлении в отделение ОИТ; субарахноидальныйкровоизлияние; инсульт; внутримозговое кровоизлияние) и (iii) другие повреждения головного мозга (определяемые как APACHE-III диагнозы при поступлении в отделение интенсивной терапии: остановка сердца; инфекция головного мозга; неврологическое новообразование; судороги; другое неврологическое заболевание; кома). Неоднородность влияния лечения на внутрибольничную смертность основывалась на том, получали ли пациенты внутривенные антибиотики на исходном уровне. Микробиологические исходы анализировались с помощью долей пациентов, у которых произошло хотя бы одно событие в каждом кластерном периоде. Эти пропорции моделировались с помощью взвешенной линейной регрессии, где значения вычислялись с помощью обратной дисперсии для каждого кластерного периода. Все эти анализы проводились без каких-либо корректировок. Все статистические тесты проводились с определением двухстороннего уровня 0,05. Поскольку все анализы, проведенные в данном исследовании, являются post hoc, они рассматривались как исследовательские. Статистический анализ проводился с использованием программного обеспечения SAS (версия 9.4) (Cary NC, USA ).
Полученные результаты
Всего было включено 5982 взрослых на искусственной вентиляции легких, из них 2061 (средний возраст 55,8 лет; 36,4% женщины) имели острую черепно-мозговую травму или повреждение головного мозга по другой причине.В первый период вмешательства в исследование были включены 1019 пациентов с острой мозговой травмой, из них 388 (38,1%) в группе SDD и 631 (61,9%) в группе стандартной помощи. Во второй период вмешательства было включено 1042 пациента с острой мозговой травмой, из них 580 (55,7%) в группу SDD и 462 (44,3%) в группу стандартной помощи. Первичный результат был доступен для всех 968 пациентов в группе SDD и для всех 1093 пациентов в группе стандартной помощи (рис. 1). Исходные характеристики пациентов с острыми мозговыми травмами, распределенных в группы SDD и группы стандартной помощи, были схожими (таблица 1), за исключением того, что время от поступления в ОИТ до включения в исследование составляло в среднем 11,6 часа (интерквартильный диапазон [IQR] 1,3–29,6 часа) в SDD. группе и медиане 1,9 часа (IQR 0–17,5 часа) в группе стандартного лечения; Пероральный хлоргексидин применялся у 261/968 (27%) пациентов в группе SDD и у 198/1093 (18,1%) в группе стандартной терапии, а системные стероиды применялись у 51/968 (5,3%) в группе SDD и у 103 пациентов. /1093 (9,4%) в группе стандартного лечения. Среди пациентов с острыми черепно-мозговыми травмами в группе SDD доля днейИВЛ, когда пациенты получали как пероральную пасту SDD, так и желудочную суспензию, составила 93,1% (рис. 1, ESM). Данные о введении каждого компонента SDD показаны в электронной таблице 1, ESM и долях пациентов, получающих SDD-антибиотики, в SDD и группе стандартной помощи показаны на eFigure2, ESM.


При оценке на день 90 после включения умерли 313 (32,3%) из 968, распределенных в группу SDD, и 415 (38%) из 1093, - в группе стандартной помощи (средняя разница - 6,2%, 95% ДИ от - 8,9 до - 3,5%; ОШ 0,76, 95% ДИ 0,63–0,92; p = 0,004). Результаты были схожими после поправки на исходный возраст, пол, оценку APACHE II/III и диагноз (ОШ 0,74; 95% ДИ 0,57–0,97; p = 0,03), но не были значимыми после добавления времени от поступления в ОИТ до включения, системных стероидов, перорального приема. хлоргексидина и введение внутривенно антибиотиков на момент включения в исследование (ОШ 0,78; 95% ДИ 0,59–1,04; p = 0,08). (Table 2). Соответствующие отношения риска для времени до смерти при SDD по сравнению со стандартной помощью составили 0,83 (95% ДИ 0,71–0,96) и 1,01 (95% ДИ 0,89–1,15) для пациентов с острыми мозговыми травмами и без них соответственно (Table . 2a, b). . Значительной гетерогенности во влиянии SDD на смертность у пациентов с (ОШ 0,78, 95% ДИ 0,59–1,04, р = 0,08) и без (ОШ 0,85, 95% ДИ 0,72–1,00, р = 0,05) острых мозговых травм соответственно не выявлено (p = 0,22) (Fig. 3, eTable2, ESM). Не было значительной разницы в смертности между группами SDD и стандартной помощи между пациентами с черепно-мозговой травмой и субарахноидальным кровоизлиянием или между инсультом и другими повреждениями головного мозга (eTable 3, ESM); или на основании получения или нет внутривенной антибактериальной терапии на исходном уровне (eTable 3, ESM). Причины смерти пациентов с острыми мозговыми травмами по группам лечения представлены в eTable 4 ESM.


Из четырех клинических вторичных исходов (смерть в отделении интенсивной терапии, дни жизни и отсутствия ИВЛ, дни жизни и отсутствия госпитализации в ОИТ и дни жизни и дни без госпитализации) наблюдались статистически значимые различия в пользу группы SDD у больных с острым повреждением мозга (Table 2).
Соответствующие отношения риска для дней жизни и отсутствия ИВЛ с SDD по сравнению со стандартной помощью составили 1,11 (95% ДИ 1,01–1,22) и 1,1 (95% ДИ 1,03–1,18) для пациентов с острыми травмами головного мозга и без них соответственно (eFigure 3а и 3в, ESM). Соответствующие отношения риска для живых дней без ОИТ с SDD по сравнению со стандартным лечением составили 1,1 (95% ДИ 0,99–1,22) и 1,03 (95% ДИ 0,96–1,11) для пациентов с острыми мозговыми травмами и без них соответственно (eFigure 4a и 4в, ESM).Соответствующие отношения риска для живых и выписанных из больницы с SDD по сравнению со стандартным лечением составили 1,06 (95% ДИ 0,94–1,18) и 1 (95% ДИ 0,93–1,07) для пациентов с острыми мозговыми травмами и без них соответственно (eFigure 5a и 5в, ESM) . Не было значительной гетерогенности в влиянии SDD на четыре вторичных клинических исхода у пациентов с острыми травмами головного мозга и без них (eTable2 и eFigure 3, ESM).

Микробиологические вторичные исходы
В группе SDD по сравнению с группой стандартной терапии наблюдалось статистически значимое снижение доли пациентов, у которых были культивированы новые микроорганизмы, устойчивые к антибиотикам (20,5% против 34,2%; абсолютная разница – 13,9 процентных пунктов; 95% ДИ – от 17,5 до − 10,3); для новых положительных культур крови, за исключением коагулазонегативных Staphylococcus (2,8% против 5,5%; абсолютная разница — 1,9 процентных пункта, 95% ДИ от — 3,5 до — 0,4) и для новых положительных результатов тестов на Clostridioides difficile (0,1% против 0,8%; абсолютная разница — 0,6 процентных пункта, 95% ДИ от – 1 до – 0,1) (Table 2). Среди пациентов с острыми повреждениями мозга в группах SDD и стандартной помощи соответственно количество пациентов с собранными культурами крови составило 552 (57%) против 713 (65,2%), а количество пациентов с другими культурами составило 229 ( 23,7%) против 411 (37,6%). Данные о конкретных микроорганизмах, выращенных из образцов крови, а также о новых устойчивых к антибиотикам организмах, выращенных из образцов, не являющихся кровью, из групп SDD и групп стандартного ухода, показаны в eTable 5, ESM. Новые микроорганизмы, устойчивые к антибиотикам, были культивированы из дыхательных путей у 115 из 968 (11,9%) и 275 из 1093 (25,2%) пациентов, распределенных в группы SDD и стандартной помощи соответственно.
Средние кумулятивные суточные определенные дозы в течение первых 28 дней всех внутривенных антибиотиков и внутривенных антибиотиков, не вводимых в рамках схемы лечения SDD, показаны на eFigure 6, ESM.Совокупные установленные суточные дозы каждого класса антибиотиков также показаны на eFigure 7, ESM.Среди пациентов с острыми мозговыми травмами ежедневно определенные дозы антибиотиков, вводимые в течение первых семи дней после включения в исследование, были значительно выше в группе SDD по сравнению с группой стандартной терапии (eFigure 8, ESM), хотя установленные ежедневно дозы в течение первых 28 дней после включения между двумя группами существенно не отличались (eFigure 9, ESM). Инфекции Clostridioides difficile возникли у 1 из 968 (0,1%) пациентов в группе SDD и у 9 из 1093 (0,8%) пациентов в группе стандартной терапии. Другие нежелательные и серьезные нежелательные явления были редки (eTable 6, ESM).
Обсуждение
В этом post hoc анализе, проведенном на основе данных перекрестного кластерного рандомизированного клинического исследования, использование SDD в подгруппе взрослых больных в критическом состоянии с острыми травмами или другими повреждениями головного мозга, находящихся на ИВЛ, было связано со статистически значимым снижением внутрибольничной смертности по сравнению со стандартным лечением без SDD. Использование SDD было связано со значительным снижением смертности в ОИТ, продолжительности ИВЛ и продолжительности пребывания в ОИТ и стационаре, а также с более низкими показателями новых инфекций кровотока и новых культур антибиотикоустойчивых организмов. У пациентов без острых черепно-мозговых травм и состояний, которые составили около двух третей участников исследования SuDDICU, не было отмечено существенных различий в клинических исходах между группами SDD и стандартным лечением.
За исключением одного небольшого исследования [12], пациенты с острыми травмами головного мозга не были в центре внимания клинических исследований по оценке SDD [1]. Предыдущие рандомизированные клинические исследования показали, что внутривенная антибиотикопрофилактика может снизить частоту вентилятор-ассоциированной пневмонии в пациентов после остановки сердца [13, 14] и с другими повреждениями головного мозга в ОИТ [15, 16]. Эти исследования профилактического применения антибиотиков не были сосредоточены на таких важных для пациентов исходах, как смертность. В этой большой подгруппе, состоящей почти из 2000 пациентов с острыми травмами головного мозга в рамках прагматичного рандомизированного клинического исследования, SDD было связано с улучшением нескольких исходов, ориентированных на пациента. Снижение смертности на 5,7 процентных пункта соответствует числу пациентов, которых необходимо лечить, равному 18, чтобы избежать одной смерти. Это клинически важный размер эффекта в популяции пациентов с контрольным уровнем смертности 38 процентных пунктов. Превосходное соблюдение протокола было достигнуто благодаря более чем 90 процентным пунктам подходящих доз стандартных коммерческих препаратов SDD, введенных на время искусственной вентиляции легких. В отличие от общей популяции исследования SuDDICU [2], пациенты с острыми травмами головного мозга, которые были распределены в SDD, получали значительно больше ежедневных определенных доз антибиотиков в первые 7 дней по сравнению с пациентами, получавшими стандартную помощь.
Хотя SDD было связано с более низкими показателями новых инфекций, которые могли смягчить потенциальные причины вторичного повреждения головного мозга, данные о показателях деятельности мозга, таких как внутричерепное давление, типы, продолжительность и интенсивность церебральной терапии или оценки долгосрочных функциональных результатов, не были доступны для подтверждения или опровержения предполагаемых механизмов пользы. Хотя вентилятор-ассоциированная пневмония является частой причиной инфекций, приобретенных в ОИТ [17], конкретные данные о диагнозе или источнике инфекции или влиянии вентилятор-ассоциированной пневмонии на дыхательную функцию не были доступны для анализа, хотя обнаружена более низкая частота устойчивых микроорганизмов из дыхательных путей у пациентов при проведении SDD.
Этот анализ подгрупп имеет некоторые ограничения. Во-первых, вмешательство не было слепым и, следовательно, подвержено систематической ошибке, хотя это было смягчено объективным первичным результатом и принятием SDD в качестве стандартной помощи, предоставляемой всем подходящим пациентам в течение периода вмешательства. Во-вторых, мы сообщили о первичных диагнозах при поступлении в отделение интенсивной терапии, определяющих наличие острой черепно-мозговой травмы, что могло привести к неправильной классификации некоторых пациентов. В-третьих, хотя основной результат был сообщен с использованием заранее заданного нескорректированного анализа, скорректированный анализ, учитывающий исходные дисбалансы, одинаково важен для последующего анализа. Хотя статистически значимые различия в основных результатах были потеряны после корректировки исходных дисбалансов, величина и направление эффекта существенно не отличались.
В-четвертых, хотя умеренное снижение смертности при SDD, наблюдаемое у пациентов с острыми повреждениями головного мозга, согласуется с гипотезой нашего исследования и с положительными эффектами SDD, наблюдаемыми в вторичных клинических исходах, вероятность того, что эффект лечения на дифференциальные причины смерти будет больше, чем мы наблюдали. неправдоподобно. Соответственно, отсутствие статистически значимой гетерогенности эффекта лечения в нашем исследовании может быть связано с низкой статистической мощностью. В-пятых, этот анализ был основан на гипотезах и не был заранее указан перед первичным испытанием. Хотя совокупные данные свидетельствуют о том, что использование SDD связано со снижением госпитальной смертности [1], этот апостериорный анализ данных исследования SuDDICU предполагает, что этот эффект может быть обусловлен в первую очередь пользой для пациентов с острыми травмами головного мозга и другие пациенты могут иметь небольшую пользу или вообще не иметь пользы от SDD. Прежде чем внедрять в клиническую практику, эти результаты должны быть подтверждены посредством анализа данных на уровне пациентов из других исследований или новых рандомизированных клинических исследований.
Заключение
Среди пациентов в критическом состоянии на ИВЛ, SDD значительно снизила внутрибольничную смертность пациентов с острыми повреждениями головного мозга по сравнению со стандартной помощью. Однако результаты апостериорного анализа этой популяции пациентов требуют подтверждения.
Ссылка на документ с дополнительными данными исследования (Supplementary).
References
1. Hammond NE, Myburgh J, Seppelt I et al (2022) Association between selective decontamination of the digestive tract and in-hospital mortality in intensive care unit patients receiving mechanical ventilation: a systematic review and meta-analysis. JAMA 328(19):1922–1934. https:// doi. org/10. 1001/ jama. 2022. 19709
2. The SuDDICU Investigators for the Australian and New Zealand Intensive Care Society Clinical Trials Group. Effect of selective decontamination of the digestive tract on hospital mortality in critically ill patients receiving mechanical ventilation: a randomized clinical trial. JAMA. 2022;328(19):1911–1921. https:// doi. org/ 10. 1001/ jama. 2022. 17927
3. Bonten MJ, Kollef MH, Hall JB (2004) Risk factors for ventilator-associated pneumonia: from epidemiology to patient management. Clin Infect Dis 38(8):1141–1149. https:// doi. org/ 10. 1086/ 383039
4. Ewig S, Torres A, El-Ebiary M et al (1999) Bacterial colonization patterns in mechanically ventilated patients with traumatic and medical head injury. Incidence, risk factors, and association with ventilator-associated pneumonia. Am J Respir Crit Care Med 159(1):188–198. https:// doi. org/10. 1164/ ajrccm. 159.1. 98030 97
5. The SuDDICU Investigators (2021) Protocol summary and statistical analysis plan for the Selective Decontamination of the Digestive Tract in Intensive Care Unit Patients (SuDDICU) crossover, cluster randomised controlled trial. Crit Care Resusc 23(2):183–193
6. Campbell MK, Elbourne DR, Altman DG et al (2004) CONSORT statement: extension to cluster randomised trials. BMJ 328(7441):702–708. https://doi. org/ 10. 1136/ bmj. 328. 7441. 702
7. ANZICS Centre for Outcome and Resource Evaluation. APD Data Dictionary. Version 6.1. April 2022 https:// www. anzics. com. au/ wp- conte nt/ uploads/ 2021/ 03/ ANZICS- APD- Data- Dicti onary. pdf.
8. Knaus WA, Draper EA, Wagner DP, Zimmerman JE (1985) APACHE II: a severity of disease classification system. Crit Care Med 13(10):818–829
9. Knaus WA, Wagner DP, Draper EA et al (1991) The APACHE III prognostic system. Risk prediction of hospital mortality for critically ill hospitalized adults. Chest 100(6):1619–1636. https:// doi. org/ 10. 1378/ chest. 100.6. 1619
10. World Health Organization. Defined daily dose (DDD). Accessed 3rd July, 2023. https:// www. who. int/ tools/ atc- ddd- toolk it/ about- ddd.
11. Kenward MGRJH (2009) An improved approximation to the precision of fixed effects from restricted maximum likelihood. Comput Stat Data Anal 53:2583–2595
12. Korinek AM, Laisne MJ, Nicolas MH, Raskine L, Deroin V, Sanson-Lepors MJ (1993) Selective decontamination of the digestive tract in neurosurgical intensive care unit patients: a double-blind, randomized, placebo-controlled study. Crit Care Med 21(10):1466–1473. https:// doi. org/ 10. 1097/00003 246- 19931 0000- 00013
13. Ribaric SF, Turel M, Knafelj R et al (2017) Prophylactic versus clinically driven antibiotics in comatose survivors of out-of-hospital cardiac arrest—a randomized pilot study. Resuscitation 111:103–109. https:// doi. org/ 10. 1016/j. resus citat ion. 2016. 11. 025
14. Francois B, Cariou A, Clere-Jehl R et al (2019) Prevention of early ventilator-associated pneumonia after cardiac arrest. N Engl J Med 381(19):1831–1842. https:// doi. org/ 10. 1056/ NEJMo a1812 379
15. Sirvent JM, Torres A, El-Ebiary M, Castro P, de Batlle J, Bonet A (1997) Protective effect of intravenously administered cefuroxime against nosocomial pneumonia in patients with structural coma. Am J Respir Crit Care Med 155(5):1729–1734. https:// doi. org/ 10. 1164/ ajrccm. 155.5. 9154884
16. Acquarolo A, Urli T, Perone G, Giannotti C, Candiani A, Latronico N (2005) Antibiotic prophylaxis of early onset pneumonia in critically ill comatose patients. A randomized study. Int Care Med 31(4):510–516. https:// doi.org/ 10. 1007/ s00134- 005- 2585-5
17. Vincent JL, Rello J, Marshall J et al (2009) International study of the prevalence and outcomes of infection in intensive care units. JAMA 302(21):2323–2329. https:// doi. org/ 10. 1001/ jama. 2009. 1754
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 29.05.2024
[ACTIVE_FROM] => 29.05.2024
[SHOW_COUNTER] => 494
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829804
[VALUE] => Селективная деконтаминация пищеварительного тракта, острая черепно-мозговая травма, ИВЛ, Смертность
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Селективная деконтаминация пищеварительного тракта, острая черепно-мозговая травма, ИВЛ, Смертность
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829806
[VALUE] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 829805
[VALUE] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830395
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829812
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829808
[1] => 829809
[2] => 829810
[3] => 829811
[4] => 829815
[5] => 829816
)
[VALUE] => Array
(
[0] => statia
[1] => issledovanie
[2] => intensivnayaterapiya
[3] => ivl
[4] => Selektivnaya decontaminacia pishevaritelnogo trakta
[5] => Ostrava cherepno-mozgovaya travma
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
[5] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => issledovanie
[2] => intensivnayaterapiya
[3] => ivl
[4] => Selektivnaya decontaminacia pishevaritelnogo trakta
[5] => Ostrava cherepno-mozgovaya travma
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
[5] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830395
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829812
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829808
[1] => 829809
[2] => 829810
[3] => 829811
[4] => 829815
[5] => 829816
)
[VALUE] => Array
(
[0] => statia
[1] => issledovanie
[2] => intensivnayaterapiya
[3] => ivl
[4] => Selektivnaya decontaminacia pishevaritelnogo trakta
[5] => Ostrava cherepno-mozgovaya travma
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
[5] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => issledovanie
[2] => intensivnayaterapiya
[3] => ivl
[4] => Selektivnaya decontaminacia pishevaritelnogo trakta
[5] => Ostrava cherepno-mozgovaya travma
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
[5] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Исследование
[2] => Интенсивная терапия
[3] => ИВЛ
[4] => Селективная деконтаминация пищеварительного тракта
[5] => острая черепно-мозговая травма
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 13.08.2025 01:26:24
[~TIMESTAMP_X] => 13.08.2025 01:26:24
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[FULLTEXT_INDEX] => N
[~FULLTEXT_INDEX] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
[BROWSER_TITLE] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
[KEYWORDS] => Селективная деконтаминация пищеварительного тракта, острая черепно-мозговая травма, ИВЛ, Смертность
[DESCRIPTION] => Селективная деконтаминация пищеварительного тракта у взрослых в критическом состоянии с острыми повреждениями головного мозга: апостериорный анализ рандомизированного клинического исследования
)
)




