Сахарный диабет 2 типа и сепсис: современные представления, очевидные факты и недостающие доказательства
Acta Diabetologica
Обзор
Сахарный диабет 2 типа и сепсис: современные представления, очевидные факты и недостающие доказательства
Перевод оригинальной статьи «Type 2 diabetes mellitus and sepsis: state of the art, certainties and missing evidence»
Авторы: Elisa Costantini, Massimiliano Carlin, Massimo Porta, Maria Felice Brizzi
Department of Medical Sciences, University of Turin, Corso Dogliotti 14, 10126 Turin, Italy
Azienda Ospedaliera Universitaria Città Della Salute E Della Scienza, Turin, Italy
Keywords: Type 2 diabetes mellitus, Sepsis, Immune dysfunction, Glycemic control, Organ dysfunction, Mortality
Ключевые слова: сахарный диабет 2 типа, сепсис, иммунная дисфункция, контроль гликемии,
органная дисфункция, летальность
Введение
Сепсис определяется как «жизнеугрожающая органная дисфункция, вызванная дисрегуляцией иммунного ответа на инфекцию», и представляет собой ведущую причину смерти во всем мире, когда летальность составляет> 10% [1]. В 2017 году среди 50 миллионов случаев сепсиса в мире, 11 миллионов привели к смерти пациента, что в общем и целом, составило 20% от всех причин смерти [2]. В общей популяции пациентов с сепсисом превалирует септический шок, который развивается у 8–10% пациентов отделений интенсивной терапии (ОИТ), а летальность от септического шока остается невероятно высокой (около 40%) [3]. Все большее возрастание в популяции доли пациентов старческого возраста с чрезмерным влиянием выраженной сопутствующей патологии, физиологической дряхлости (хрупкости) и «старением» иммунной системы позволяет нам прогнозировать увеличение летальности от сепсиса в следующие два десятилетия [5].
Глобализация также вносит свою лепту - более широкое распространение западной диеты и западного образа жизни привело к росту заболеваемости сахарным диабетом 2 типа и мы ожидаем, что в ближайшем будущем не менее 700 миллионов человек будут страдать от сахарного диабета 2 типа, что практически означает достижение пандемического порога [6]. Даже сейчас связанные с сахарным диабетом 2 типа осложнения являются ведущими причинами госпитализаций, инвалидности и смертности [7, 8].
Несмотря на продолжающиеся споры [9 -11], становится все труднее не заметить, что пациенты с диабетом имеют более высокий риск инфицирования [9, 12 - 17], в 2 - 6 раз более высокий риск развития сепсиса по сравнению со своими ровесниками, у которых диабета нет [12, 17] и намного большую заболеваемость и летальность от сепсиса по сравнению с пациентами, у которых нет диабета [12, 15, 18, 19]. Пациенты с диабетом имеют больший риск колонизации резистентными патогенами, включая сюда метициллин-резистентный Staphylococcus aureus (MRSA), по сравнению с пациентами без диабета [20]. Все эти соображения лишь подтверждают вывод о том, что сахарный диабет 2 типа становится все более частой сопутствующей патологией среди пациентов с сепсисом [21, 22]. Фактически, в течение 25 летнего периода исследований (1997–2003), сепсис развился у 12,5 миллионов из 930 миллионов пациентов, госпитализированных в ОИТ, при этом диабет, как сопутствующая патология, определился в 17% случаев [21]. К тому же пациенты с диабетом составляют самую большую популяцию, страдающую осложнениями после сепсиса, и в которой наблюдается наиболее высокая смертность [15].
Несмотря на все те улучшения в диагностике и лечении сепсиса, достигнутые за последние годы, сочетание диабета и сепсиса остается самым дорогостоящим и летальным во всем мире [3, 11, 14].
Данная работа имеет своей целью показать наши текущие знания о следующем: 1) влияние диабета и сепсиса на состояние иммунной системы; 2) воздействие диабета на риск возникновения сепсиса и на клинические исходы; 3) оптимальная цель при контроле уровня глюкозы в крови у пациента с диабетом и сепсисом.
Был проведен поиск в базах данных MEDLINE/PubMed, окончание которого пришлось на декабрь 2020 года. При поиске использовались следующие термины: сахарный диабет И сепсис И следующие: процессы иммунной системы, гликированный гемоглобин, инсулин, гипогликемические агенты, метморфин, производные сульфонилмочевины, тиазолидиндионы, инкретин, синдром полиорганной недостаточности, повреждение легких, острый респираторный дистресс-синдром, острое повреждение почек, глюкоза крови, летальность.
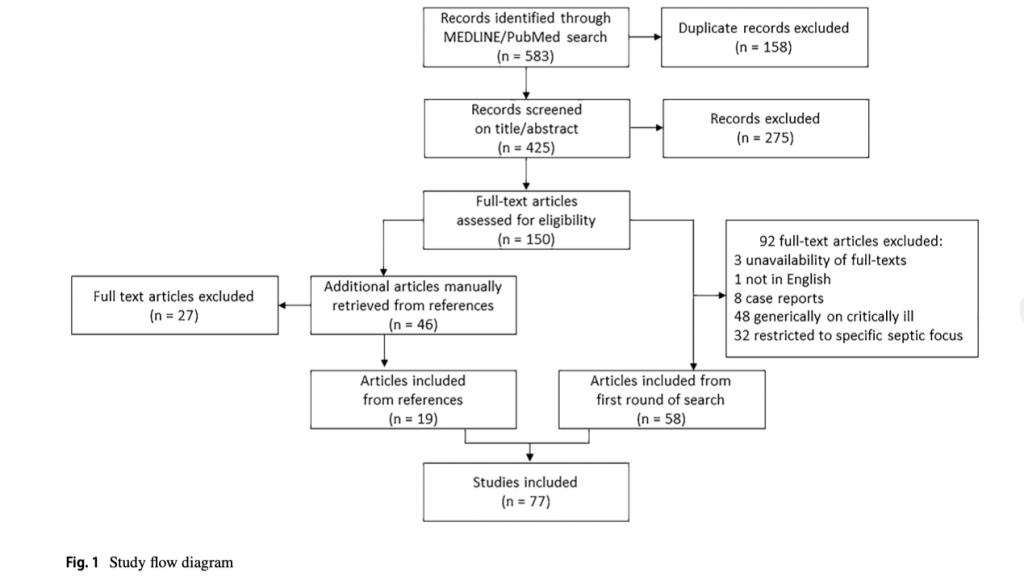
Первоначально были включены все типы публикаций и статей, связанных с исследованиями на людях. Из 583 записей, полученных в результате первоначального поиска в базе данных, после удаления дубликатов осталось 425 работ. После мануальной оценки заголовка/аннотациидля полнотекстовой оценки на соответствие критериям осталось 150 работ. Были исключены: статьи без полного текста или написанные не на английском языке, истории болезни и исследования с участием пациентов в критическом состоянии или пациентов с определенным инфекционным очагом. На основании этих критериев исключения были оставлены 58 работ (исключены 92 работы). Еще 46 статей были выявлены путем ручного поиска среди ссылок, цитируемых в ранее отобранных работах, и дополнительно оценены на соответствие критериям включения, что привело к включению еще 19 статей и к исключению 27 работ. В конечном итоге, в качественный анализ было включено 77 исследований (Рис. 1).
Взаимодействие между сахарным диабетом 2 типа и сепсисом
Сахарный диабет 2 типа является комплексным клиническим синдромом, который характеризуется персистирующей гипергликемией, ассоциированной со снижением секреции инсулина и чувствительности к нему [13]. Некоторые метаболические нарушения, включая сюда воспаление и резистентность к инсулину, вызванные как хронической, так и стрессовой гипергликемией, а также ожирение и липидемия, дополнительно способствуют снижению адекватной реакции на инфекцию.
В свою очередь сепсис оказывает глобальное влияние на иммунную систему, повреждая генерацию, функциональность клеток врожденной и приобретенной иммунной системы, снижая время их жизни, тем самым приводя в беспорядок иммунный гомеостаз [23].
В настоящее время молекулярная сеть, что способствует ухудшению клинических исходов у пациентов с сепсисом и сахарным диабетом 2 типа остается неизвестной [15]. На рисунке 2 приведены наши текущие знания о механизмах развития сепсиса и об эффектах хронической гипергликемии, и как все это вместе влияет на иммунную систему, приводя к неблагоприятным клиническим исходам [13, 15].
Преморбидные модификаторы риска развития сепсиса
Длительность гликемического контроля и риск развития сепсиса
Гликированный гемоглобин (HbA1c) - специфическое соединение гемоглобина эритроцитов с глюкозой, концентрация которого отражает среднее содержание глюкозы в крови за период около трех месяцев. Наиболее широко используется как маркер состояния регуляции уровня глюкозы и служит основанием для определения риска развития осложнений сахарного диабета 2 типа [11, 24]. При гликемии на фоне сепсиса показатель гликированного гемоглобина позволяет дифференцировать пациентов на тех, у кого высокий уровень глюкозы обусловлен стрессом и на тех, у которых сахарный диабет ранее не был диагностирован [25].
Только в нескольких исследованиях изучалась связь между гликемией и инфекционными осложнениями [26, 27]. Недавний обзор эпидемиологических исследований высокого качества [26] показал наличие связи между высоким уровнем HbA1c (> 7–8% или> 53–64 ммоль/моль) и резким, в 1.5 - 3.5 раза, увеличением риска инфекции у пациентов с сахарным диабетом. Тем не менее, результаты этого исследования все еще обсуждаются по причинам недостаточной его мощности и имеющихся вопросов к влиянию искажающих факторов.
Еще одно крупномасштабное ретроспективное когортное исследование [27], которое включило в себя более 150 000 пациентов, среди которых около 85 000 пациентов с диабетом (в большинстве своем с сахарным диабетом 2 типа), подтвердило сильную связь между недостаточным гликемическим контролем и высоким риском развития тяжелой инфекции (но не сепсиса). В частности, пациенты с диабетом показали более высокий риск госпитализации по поводу инфекций по сравнению с людьми, не страдающими диабетом, независимо от гликемического контроля (частота сепсиса была повышена даже среди пациентов с HbA1c <6% или 42 ммоль/моль). У пациентов с диабетом недостаточный метаболический контроль был связан с трехкратным риском госпитализации. В целом, 15,7% смертей, связанных с инфекциями, 16,5% госпитализаций, связанных с инфекциями, 6,8% инфекций, требующих рецепта врача, и до 20% случаев сепсиса были связаны со значением HbA1c, отличным от 6-7% (42-53 ммоль/моль). В частности, коэффициент заболеваемости сепсисом варьировался от 1,2 (для HbA1c ≥ 7% или 53 ммоль/моль) до 3,64 (для HbA1c ≥ 11% или 97 ммоль/моль). Стоит обратить внимание на то, что даже жесткий метаболический контроль (HbA1c <6% или 42 ммоль/моль) был связан с повышенным риском инфекций у пожилых людей, среди которых инфекционный риск и неблагоприятные исходы всегда выше и такое состояние дел наблюдается во всем мире. Авторы предположили, что у пожилых пациентов менее строгий гликемический контроль (до 8% HbA1c; 64 ммоль/моль) может быть полезным в то время, как более жесткий контроль будет связан с дополнительными рисками [27]. Так что несмотря на то, что данные свидетельствуют в пользу строгого гликемического контроля, у пожилых пациентов и у пациентов старческого возраста требуются дополнительные исследования [26, 227].
Влияние инсулина и других антидиабетических лекарственных средств на частоту развития сепсиса и смертность.
Как для инсулина, так и для других не-инсулиновых сахароснижающих препаратов достаточно подробно подтверждены иммуномодуляторные эффекты, из чего можно предположить наличие положительного влияния этих препаратов на пациентов с диабетом и сепсисом [9, 11, 28–32].
Инсулин может защищать от чрезмерной активации иммунной системы за счет предотвращения неблагоприятного воздействия на иммунные функции повышенного уровня глюкозы в крови, оказывая тем самым прямые и косвенные противовоспалительные эффекты [9, 28]. Но этого не было подтверждено в двух больших обсервационных исследованиях, в которых не удалось выявить различия в летальности, связанные с предыдущим лечением инсулином. В первом из них, где изучались пациенты, находящиеся в критическом состоянии (из них 7% ранее проводилось лечение инсулином по поводу диабета), выявило, что у ранее лечившихся инсулином диабетиков состояние было более тяжелым, однако это никак не сказалось на летальности. В другом проспективном обсервационном исследовании [34], включившим в себя пациентов ОИТ с сепсисом в сочетании с диабетом или без оного, прогрессирование заболевания и летальность у пациентов с сепсисом и диабетом была подобной таковой у пациентов с сепсисом, но без диабета, даже несмотря не лечение инсулином.
Как показали преклинические исследования, у некоторых не-инсулиновых глюкозоснижающих лекарственных препаратов имеются иммуномодулирующие эффекты. В частности, метформин может оказывать важные плейотропные эффекты, включая регуляцию метаболизма лактата и АМФ-активируемую протеинкиназу, а также оказывать противовоспалительное, антиэндотоксемическое, вазоактивное и противомикробное действие [31].
Тиазолидиндионы (ТЗД) увеличивают миграцию нейтрофилов, что предполагает потенциальную пользу в виде модуляции воспалительного ответа и улучшение исходов у пациентов с сепсисом [11]. Противовоспалительное действие и иммуномодуляторные эффекты могут быть и у гормонов инкретинов, так как они тоже вовлечены в воспалительный ответ [30, 32, 35]. Преклинические модели сепсиса показали, что терапия, в основе которой лежат инкретины, снижает активацию иммунных клеток, ингибирует выпуск провоспалительных цитокинов, снижает органную дисфункцию и летальность [32]. Несмотря на то, что терапия, основанная на ведении инкретинов, при сепсисе еще не исследовалась, можно предполагать, что как инкретины [32], так и ингибиторы DPP4 [35] могут оказывать положительные плейотропные эффекты на воспаление и иммуномодуляцию. И напротив, в доклинических исследованиях было обнаружено, что опосредованные стимулятором секреции инсулина нецелевые эффекты, вызванные ингибированием аденозинтрифосфат-чувствительного калиевого канала в β-клетках, ослабляют иммунный ответ на вторжение патогенов [29].
Большое исследование «случай-контроль», в котором анализу было подвергнуто влияние текущего лечения не-инсулиновыми агентами на частоту развития сепсиса [29], показало, что метформин может оказывать устойчивое влияние на частоту госпитализаций по поводу сепсиса. В отличие от меглитинида, введение ТЗД также было обратно связано с возникновением сепсиса. Лечение сульфонилмочевиной и ингибиторами DPP4 никак не было связано с изменением частоты развития сепсиса. В своем недавнем мета-анализе Liang et al. [31] связали лечение метформином со снижением летальности у пациентов с диабетом и сепсисом. Тем не менее, несмотря на интерес, надежность этого наблюдения ограничена относительно небольшим размером выборки. Более недавнее и более крупное популяционное когортное исследование [36] показало, что лечение метформином не имеет значимой связи ни с риском сепсиса, ни с 30-дневной летальностью от сепсиса у пациентов с диабетом. Хотя некоторые небольшие клинические испытания с участием пациентов, находящихся в критическом состоянии, показали потенциальные преимущества в контроле гликемии с помощью инфузии инкретина, эти исследования включали в себя смешанные популяции и имели ограниченную силу [32].
Таким образом, связь между лечением инсулином или не-инсулиновыми снижающими глюкозу агентами перед госпитализацией и риском развития сепсиса и его исходом остается спорной. Степень гликемического контроля, а не антидиабетическая терапия, может объяснить риск и смертность от сепсиса. Фактически, в небольшом обсервационном исследовании [37] было показано, что HbA1c является независимым прогностическим фактором госпитальной летальности и длительностью госпитализации пациентов с диабетом и сепсисом в то время, как никаких различий в результатах, связанных с предшествующим антидиабетическим лечением, обнаружено не было.
Так что необходимы дальнейшие клинические исследования, в которые были направлены на изучение потенциальной пользы от антидиабетических препаратов в когортах больных сепсисом.
Оптимальный контроль уровня глюкозы в крови при сепсисе
Ухудшение состояния пациента с сепсисом ассоциируется с изменениями уровней циркулирующих инсулина и кортизола, что приводит к резким изменениям уровня глюкозы в крови, повреждению органов и активации иммунной системы [38]. Наряду с хорошо нам известными эффектами стресс-индуцированной гипергликемии, гипогликемия также может отражать патологический острый стресс-ответ. И действительно, гипогликемия в большинстве случаев связана с сепсисом и рассматривается как эпифеномен тяжелой органной недостаточности, предшествующей смерти. Несмотря на то, что механизмы и взаимодействия между гипогликемией и тяжестью состояния пациентов с сепсисом все еще обсуждаются, есть предположение, что здесь важную роль играют воспалительные цитокины [39].
При критических состояниях нарушения гликемического контроля приводят к более тяжелому течению заболевания и к более неблагоприятным прогнозам [39 41]. Более того, сам по себе диабет может модулировать взаимосвязи между дисгликемией и летальностью при сепсисе [40]. К примеру, риск летальности, ассоциированный с гипогликемией, ниже у пациентов с диабетом, нежели у пациентов без диабета [42] и на этот риск не оказывают влияния ни гипергликемия [39], ни резкие колебания уровня глюкозы в крови [43].
Несмотря на строгую рекомендацию по раннему введению инсулина, все еще обсуждаются вопросы мониторинга уровня глюкозы и лечения стресс-индуцированной гипергликемии [41, 44].
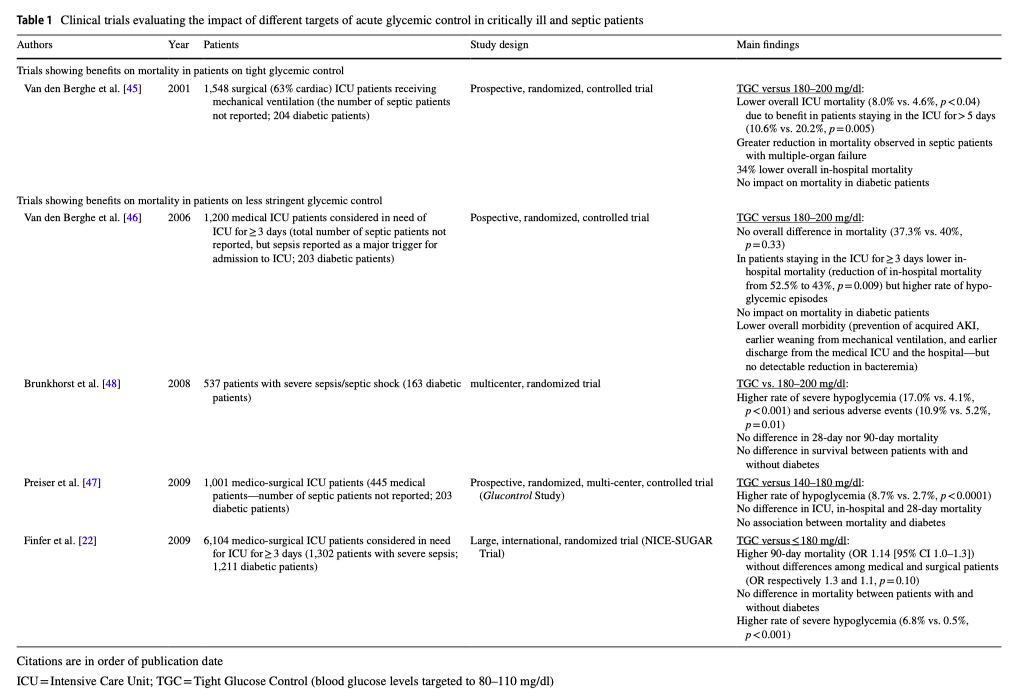
В нескольких больших исследованиях изучался оптимальный контроль уровня глюкозы в крови у пациентов, находящихся в критическом состоянии, включая сюда и пациентов с сепсисом [22, 45–47]. Но при этом только в нескольких небольших исследованиях основной упор делался на пациентах с сепсисом [48, 49], но без диабета. В таблице 1 показаны основные клинические исследования, в которых изучалось влияние различных целей контроля уровня глюкозы у пациентов, находящихся в критическом состоянии, и у пациентов с сепсисом. Первыми, кто стал изучать влияние достижения выбранных целей при инсулинотерапии, стали Van den Berghe et al. [45]. Свою работу они сделали в хирургическом отделении интенсивной терапии (ОИТ), распределяя случайным образом поступающих пациентов на тех, кому проводилась интенсивная инсулинотерапия (целевое значение уровня глюкозы в крови 80–110 мг/дл), и на тех, кому проводилась обычная инсулинотерапия с целевым показателем глюкозы крови, равным 180–200 мг/дл. Несмотря на то, что в этом исследовании не было указаний на пациентов с сепсисом, интенсивная инсулинотерапия привела к снижению эпизодов развития нозокомиальной септицемии примерно на 46% и к снижению пропорции пациентов, которым требовалась продолженная антибактериальная терапия. В частности, более строгий контроль уровня глюкозы в крови, когда целевым значением становится уровень глюкозы ниже 110 мг/дл, привел к снижению заболеваемости и летальности (снижение относительного риска летальности в ОИТ на 43%). Но все же этот результат был получен в подгруппе пациентов, которые находились в ОИТ пять и более дней и у кардиохирургических пациентов, которые ранее, до оперативного вмешательства, получили внутривенную инфузию глюкозы с целью нутритивной поддержки. В следующем исследовании у пациентов терапевтического ОИТ та же группа исследователей [46] не смогла подтвердить преимущества строгого контроля уровня глюкозы в отношении смертности в общей популяции постольку, поскольку показало, что строгий контроль уровня глюкозы снижает летальность только у тех пациентов, которые остаются в ОИТ на три и более дней. Более того, вызывает беспокойство высокая частота событий с гипогликемией (более чем в шесть раз по сравнению с предыдущим исследованием) в данной популяции пациентов. A post hoc анализ [50] объединенных данных этих двух исследований [45, 46] дополнительно подтвердил, что строгий контроль глюкозы несет в себе значительные риски развития гипогликемии (что случается в 11.3% у пациентов со строгим контролем глюкозы против 1.8% у пациентов со стандартным контролем глюкозы, p < 0.0001). В то же время, даже если гипогликемия и не была связана с ранней смертью и/или неврологическими последствиями, сообщалось о более высоком риске смерти. Наконец, объединенные данные показали, что строгий контроль уровня глюкозы значительно снижает заболеваемость и смертность в смешанных терапевтических/хирургических отделениях интенсивной терапии (особенно у пациентов, находящихся в отделении интенсивной терапии не менее 3 дней). Кроме того, сообщалось, что все подгруппы пациентов, в том числе госпитализированные по поводу сепсиса, получают пользу от строгого контроля уровня глюкозы. Вот только для пациентов с сахарным диабетом не сообщалось об улучшении выживаемости. Объяснение отсутствия пользы от строгого контроля уровня глюкозы у пациентов с диабетом, возможно, кроется в быстрой нормализация уровня глюкозы в крови, а не в гипогликемии.
Но все же дальнейшие исследования не подтвердили пользы от строгого контроля глюкозы [22, 46–48], хотя различия в дизайне исследований, в селекции пациентов, в нутриционной поддержке, в целевых показателях уровня глюкозы и методов измерения глюкозы приводят к большим сложностям при сравнении полученных в них результатов [41]. Достаточно сказать, что одно из исследований, в которое специально включались пациенты с тяжелым сепсисом [48] не только не показало какой-либо пользы от строгого контроля глюкозы в контексте сепсиса как у пациентов с диабетом, так и у пациентов без диабета, но и было остановлено по соображениям безопасности по причине резкого роста тяжелых гипогликемических состояний. Следующие два исследования, включивших в себя смешанную, хирургические и не хирургические, популяцию пациентов ОИТ, исследование «the Glucontrol» [47] и исследование «NICE-SUGAR» (the Normoglycemia in Intensive Care Evaluation—Survival Using Glucose Algorithm Regulation) [22], сообщили о высокой частоте гипогликемии в группе строгого контроля глюкозы. Первое исследование было преждевременно остановлено из-за высокого уровня непреднамеренных нарушений протокола, но в нем не было обнаружено различий в летальности от строгого контроля глюкозы, а второе исследование показало, что менее строгий гликемический контроль приводит к более низкому уровню летальности, независимо от того, есть диабет или нет. И, наконец, недавний мета-анализ, проведенный Yamada et al. [51] признал отсутствие клинической пользы от строгого гликемического контроля в контексте летальности, сообщая при этом об увеличении частоты гипогликемии в группе строгого гликемического контроля как у пациентов с диабетом, так и у пациентов без диабета по сравнению с группами умеренного (140–180 мг/дл) и очень умеренного (180 - 220 мг/дл) контроля.
Взаимоотношения между гликемическим контролем и летальностью можно описать с помощью U-образной кривой (пациенты с низким и высоким уровнем глюкозы имеют худшие исходы по сравнению с пациентами, у которых уровень глюкозы нормальный/умеренно высокий) и позволяет сделать предположение о том, что умеренно высокий уровень глюкозы может представлять собой идеальную цель у пациентов с диабетом [9, 15, 52]. Но действительно ли данный эффект связан с таким уровнем глюкозы или здесь есть вмешивающиеся факторы, вызывающие развитие гипогликемии с последующими неблагоприятными исходами, все еще обсуждается [52]. Также следует иметь в виду, что взаимосвязь между длительным периодом уровня глюкозы между 70 и 140 мг/дл и снижением летальности, относится только к пациентам без диабета. Пациенты с диабетом такой взаимосвязи не показывают [53].
Текущие клинические руководства рекомендуют целевое значение уровня глюкозы у пациентов, находящихся в критическом состоянии, равное 140 -180 мг/дл, даже несмотря на диабет в анамнезе [54, 55]. Для пациентов с диабетом была постулирована специфическое целевое значение уровня глюкозы [44, 56, 57] и некоторые исследования предположили, что менее строгий гликемический контроль (к примеру целевой уровень глюкозы, равный 180 -250 мг/дл) может принести пользу пациентам с преморбидной хронической гипергликемией (уровень HbA1c > 7% или > 53 ммоль/моль). Но сразу же стало расти беспокойство, что при таком либеральном подходе у пациентов с диабетом повышается риск инфекции, глюкозурии и полинейропатии [58]. На основании всех этих наблюдений Egi et al. [58] предложили принять единый целевой уровень глюкозы в крови для пациентов с диабетом и без него (≤ 180 мг/дл) по крайней мере до получения результатов рандомизированного контрольного исследования LUCID (Liberal GlUcose Control in Critically Ill Patients with Preexisting Type 2 Diabetes trial) [59 ], результаты которого расскажут нам о рисках и преимуществах более либеральных стратегий контроля глюкозы.
Возможно, избежать гипогликемии при проведении инсулинотерапии пациентам с тяжелым сепсисом и септическим шоком помогут замкнутые системы контроля глюкозы (англ. closed-loop glucose control systems) [60].
Острая органная дисфункция при сепсисе
Органная дисфункция у пациентов с сепсисом и диабетом впервые была изучена в когорте, состоящей из 12.5 миллионов человек, госпитализированных с сепсисом в период с 1979 по 2003 гг. Среди этой когорты у 2 миллионов человек диагностировали диабет [21]. Это исследование выявило, что пациенты с диабетом в меньшей степени подвержены развитию острого повреждения легких (9% против 14%, p <0.05) независимо от источника инфекции, но в большей степени были подвержены острому почечному повреждению (13% против 7%, p <0.05) по сравнению с пациентами без диабета. Не было найдено разницы в развитии дисфункции других органов (сердечно-сосудистая недостаточность случилась у 4% пациентов от всей популяции в то время, как гематологические, метаболические дисфункции и дисфункция центральной нервной системы случились у 6% от всей популяции).
Как при сепсисе, так и при хронической гипергликемии, повреждается гликокаликс, что связано с избыточной продукцией активных форм кислорода и воспалительных медиаторов, с дальнейшим повреждением микроциркуляции, что и ведет, в итоге, к органному повреждению [62].
Недавнее ретроспективное обсервационное исследование [61] поддержало наличие связи между преморбидной хронической гипергликемии и прогрессированием органной дисфункции у пациентов с сепсисом. Авторы показали, что если при поступлении пациента в ОИТ уровень HbA1 был равен 6.5% и выше, то это независимо ассоциировалось с прогрессированием печеночной и почечной недостаточности в течение последующих 72 часов, а также с летальностью. Единственный позитивный тренд касался течения и прогрессирования легочной и сердечной дисфункции, а также коагулопатии.
Высокий риск развития острого повреждения почек у пациентов с диабетом подтвердился в большом национальном ретроспективном исследовании [63] и в недавнем мета-анализе [14].
Острое повреждение легких
Острое повреждение легких (англ. Acute Lung Injury или ALI) и острый респираторный дистресс-синдром (ОРДС) очень распространены среди пациентов, находящихся в критическом состоянии, и представляют собой угрозу жизни. Защитная роль диабета против развития ALI/ОРДС была хорошо показана в различных когортах пациентов, находящихся в критическом состоянии, и у пациентов с сепсисом [28, 63–67]. Но недавно такая защитная роль диабета была подвергнута сомнению благодаря мета-анализу Wang et al. [14], в котором было показано, что частота развития респираторной дисфункции у пациентов с диабетом и без диабета практически не отличается. К тому же, так и не был определён механизм, по которому реализуется предполагаемый защитный эффект. Среди предложенных объяснений - нарушение функции нейтрофилов и изменение нейтрофил-эндотелиального взаимодействия [68], иммуномодулирующие эффекты, опосредованные гипергликемией и приводящие к нарушенному ответу на опосредованное эндотоксином повреждение [28, 68], а также наличие ожирения и связанные с дислипидемией метаболические эффекты [28]. Наконец, некоторые потенциальные защитные эффекты могут быть результатом более раннего и более тщательного медицинского наблюдения пациентов с диабетом и противовоспалительных свойств противодиабетических препаратов, включая инсулин, ТЗД и метформин [21]. Точно так же остается неизвестным, а может ли диабет вносить свою лепту в развитие других органных дисфункций при сепсисе, таких как острое повреждение почек [66].
Острое повреждение почек (ОПП)
ОПП развивается у одной четвертой от всех пациентов с сепсисом и у половины из тех, у кого есть бактеремия или шок [69]. У пациентов с диабетом, согласно данным обсервационных исследований, частота развития ОПП колеблется от 27% [63] до 73% [70].
Несмотря на то, что диабет является установленным фактором риска как для ОПП [21, 33], так и для сепсиса [9, 12-16], а также и независимым фактором риска развития персистирующей почечной дисфункции у пациентов отделений интенсивной терапии с сепсисом в случае развития у них ОПП [70], влияние диабета на увеличение риска ОПП все еще обсуждается.
В самом деле, в проспективном одно-центровом исследовании [71] увеличение уровня сывороточного креатинина в первые сутки госпитализации в ОИТ пациентов с сепсисом ассоциировалось с развитием ОПП, но у всех этих пациентов не было диабета. В недавнем большом многоцентровом исследовании, включившим в себя пациентов с тяжелым сепсисом или с септическим шоком, диабет не был связан с развитием ОПП или с необходимостью в проведении почечно-заместительной терапии [70]. Но несмотря на все эти вышеприведенные результаты и на широкую гетерогенность данных, пытающихся связать инциденты ОПП с пациентами, у которых сепсис развился на фоне диабета, вышеупомянутый мета-анализ [14] подтвердил, что частота развития ОПП определенно увеличивается на более чем 50% у пациентов с сепсисом и диабетом по сравнению с пациентами с сепсисом, но без диабета.
Летальность и сепсис
Уязвимость пациентов с сахарным диабетом 2 типа перед инфекцией и сепсисом очень широко и подробно описана в литературе [9, 12–17], но неоднозначные результаты эпидемиологических исследований ставят под сомнение связь между диабетом и более высоким рисками развития инфекционных осложнений и летальности [9 - 11].
Объяснить такие неоднозначные результаты можно различиями в популяции (включая сюда отсутствие стратификации на типы диабета, различные корректировки на сопутствующую патологию, этиологию сепсиса и тяжесть течения заболевания), режимы введения лекарственных препаратов для контроля уровня глюкозы и методы оценки клинических исходов [10, 11].
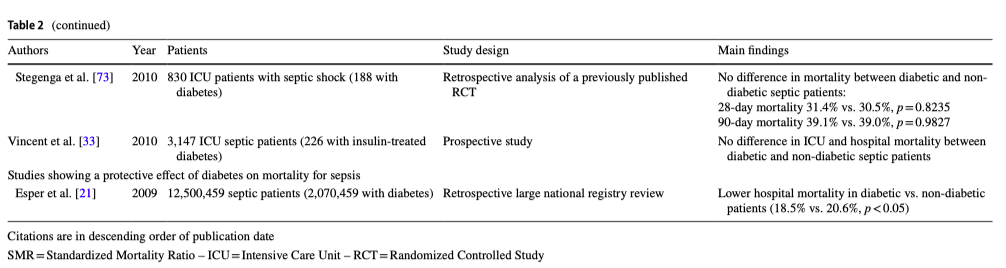
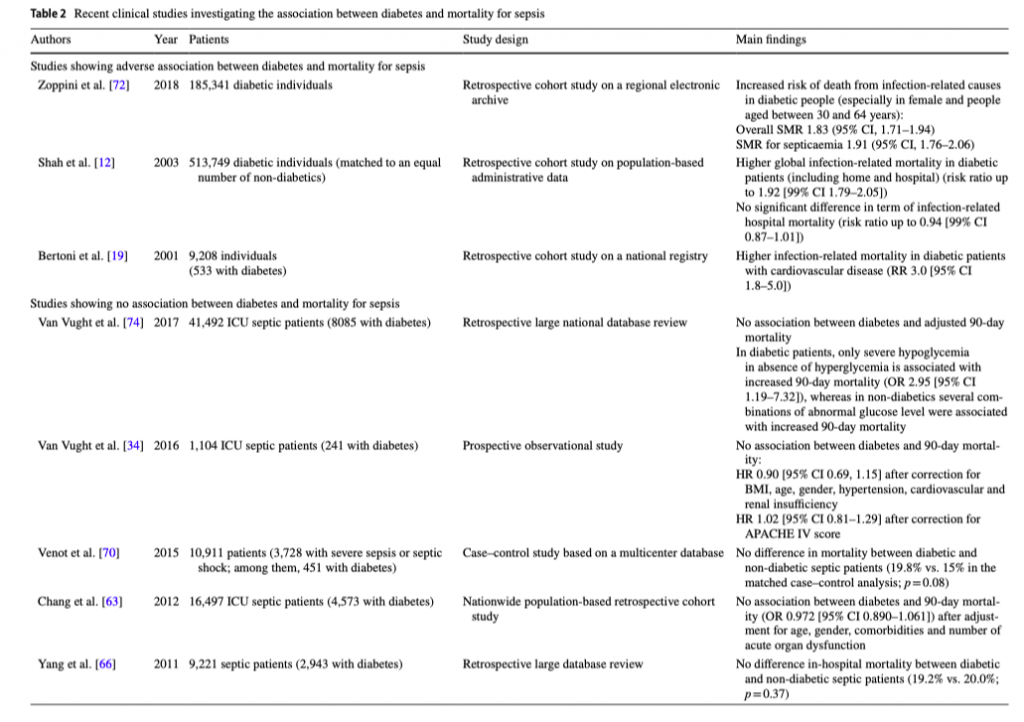
В таблице 2 представлены недавние клинические исследования, в которых изучались связи между диабетом и летальностью при сепсисе. Среди них определенное внимание вызывает очень большое обсервационное исследование [72], в котором показано, что у пациентов с диабетом более высокая летальность от инфекционных заболеваний (что сохраняется даже после корректировки на сопутствующую патологию) и в два раза более высокий риск смерти от сепсиса по сравнению с общей популяцией. В дополнение к этому два больших ретроспективных когортных исследования [12, 19] показали большую летальность от инфекционных причин у пациентов с диабетом по сравнению с пациентами без диабета. Но вот другие исследования [33, 34, 63, 66, 70, 73, 74] показали отсутствие таких связей, а Esper et al. [21] даже сообщили о лучшей выживаемости пациентов с диабетом.
В немногих обсервационных исследованиях, в которых изучалась связь между преморбидным гликемическим состоянием и клиническими исходами при сепсисе, было показано, что уровень HbA1c на момент госпитализации у пациентов с диабетом и сепсисом имеет прямую корреляцию с госпитальной летальностью [37, 61].
Однако, результаты, полученные Tayek et al. [75], впервые сообщают о глобальном улучшении летальности при диабетическом состоянии и эти результаты нашли свое подтверждение в мета-анализе, проведенном Wang et al. [14], в котором показано, что диабет не только не связан с неблагоприятными исходами у пациентов с сепсисом, но и приносит пользу.
На самом деле, некоторые исследования показали заметную связь между гипергликемией и летальностью, но это относилось к пациентам без диабета, и можно предположить, что острая гипергликемия может вызывать патофизиологические эффекты, различающиеся по своим последствиям у пациентов с диабетом и у пациентов без диабета. Таким образом, действительно ли связь между гипергликемией и летальностью у пациентов без диабета обусловлена индуцированными гипергликемией токсическими эффектами или все же летальность определяется тяжестью самого заболевания, требует дальнейшего уточнения [9]. Несмотря на то, что механизмы защитного эффекта при диабете остаются непонятыми, было высказано предположение о том, что предшествующее воздействие высокого уровня глюкозы приводит к улучшению адаптационных возможностей иммунитета, что и обеспечивает положительные эффекты [9, 14, 75]. В этом контексте была изучена роль воспаления. В частности, Stegenga et al. [73] сообщили о сопоставимых уровнях цитокинов и прокоагулянтных ответов у пациентов с диабетом и без диабета, находящихся в критическом состоянии с сепсисом в то время, как другое исследование выявило более высокие уровни маркеров активации эндотелиальных клеток у пациентов с диабетом и септическим шоком по сравнению с пациентами без диабета [76]. Также возможными факторами защиты от сепсиса у пациентов с излишней массой тела и диабетом были названы благоприятные эффекты от введения инсулина и уже имеющаяся адаптация к окислительному стрессу [9].
Выводы
Во всем мире сепсис сохраняет свою позицию как ведущая причина возрастающей смертности, а диабет все чаще становится одной из сопутствующих патологий у пациентов с сепсисом. Несмотря на то, что высокий риск развития инфекции у пациентов с диабетом очень хорошо задокументирован, влияние диабета на клинические исходы при сепсисе, а также механизмы, лежащие в основе такого влияния, все еще бурно обсуждаются.
Критическими вопросами, которые требуют пояснения, являются вопросы влияния диабета и сепсиса на иммунную систему, роль гликемического контроля и потенциальная роль противодиабетического лечения на возникновение сепсиса и на клинические исходы у пациентов с диабетом и сепсисом, включая сюда риск развития острого повреждения почек и риск развития ОРДС. Кроме всего этого, и рекомендации по целевым значениям уровня гликемии при сепсисе не имеют под собой твердых оснований.
Дальнейшие крупномасштабные проспективные исследования, рандомизированные контролируемые исследования, в которые бы включались пациенты с диабетом и сепсисом, а не просто пациенты с сепсисом, смогли бы внести некоторую ясность в эти нерешенные вопросы, включая сюда и баланс риска/пользы от более либерального гликемического контроля.
И наконец, в процессе исследования находятся интересные и сложные варианты терапии, включая сюда иммуномодулирующие подходы, направленные на патофизиологические пути, что активируются сахарным диабетом 2 типа и сепсисом, и это может в будущем предоставить нам клинические преимущества.

Список литературы
1. Singer M, Deutschman CS, Seymour C et al (2016) The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA 315:801–810. https:// doi. org/ 10. 1001/ jama. 2016.0287
2. Rudd KE, Johnson SC, Agesa KM et al (2020) Global, regional, and national sepsis incidence and mortality, 1990–2017: analysis for the global burden of disease study. Lancet 395:200–211. https://doi.org/10.1016/S0140-6736(19)32989-7
3. Vincent JL, Jones G, David S et al (2019) Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis. Crit Care 23:1–11. https://doi.org/10. 1186/s13054-019-2478-6
4. Martin GS, Mannino DM, Moss M (2006) The effect of age on the development and outcome of adult sepsis. Crit Care Med 34:15–21. https://doi.org/10.1097/01.ccm.0000194535.82812.ba
5. Kahn JM, Le T, Angus DC et al (2015) The epidemiology of chronic critical illness in the United States. Crit Care Med 43:282–287. https://doi.org/10.1097/CCM.0000000000000710
6. Zimmet P, Alberti KGMM, Shaw J (2001) Global and societal implications of the diabetes epidemic. Nature 414:782–787. https://doi.org/10.1038/414782a
7. Bhutani J, Bhutani S (2014) Worldwide burden of diabetes. Indian J Endocrinol Metab 18:868–870. https://doi.org/10.4103/22308210.141388
8. Monge L, Gnavi R, Carnà P et al (2020) Incidence of hospitalization and mortality in patients with diabetic foot regardless of amputation: a population study. Acta Diabetol 57:221–228. https://doi.org/10.1007/s00592-019-01412-8
9. Schuetz P, Castro P, Shapiro NI (2011) Diabetes and sepsis: preclinical findings and clinical relevance. Diabetes Care 34:771–778. https://doi.org/10.2337/dc10-1185
10. Koh GCKW, Peacock SJ, Van Der PT, Wiersinga WJ (2012) The impact of diabetes on the pathogenesis of sepsis. Eur J Clin Microbiol Infect Dis 31:379–388. https://doi.org/10.1007/ s10096-011-1337-4
11. Trevelin SC, Carlos D, Beretta M et al (2017) Diabetes mellitus and sepsis: a challenging association. Shock 47:276–287. https:// doi.org/10.1097/SHK.0000000000000778
12. Shah BR, Hux JE (2003) Quantifying the risk of infectious diseases for people with diabetes. Diabetes Care 26:510–513. https:// doi.org/10.2337/diacare.26.2.510
13. Tiwari S, Pratyush DD, Gahlot A, Singh SK (2011) Sepsis in diabetes: a bad duo. Diabetes Metab Syndr Clin Res Rev 5:222–227. https://doi.org/10.1016/j.dsx.2012.02.026
14. Wang Z, Ren J, Wang G et al (2017) Association between diabetes mellitus and outcomes of patients with sepsis: a meta-analysis. Med Sci Monit 23:3546–3555. https://doi.org/10.12659/MSM. 903144
15. Frydrych LM, Fattahi F, He K et al (2017) Diabetes and sepsis: risk, recurrence, and ruination. Front Endocrinol (Lausanne) 8:1–22. https://doi.org/10.3389/fendo.2017.00271
16. Muller LMAJ, Gorter KJ, Hak E et al (2005) Increased risk of common infections in patients with type 1 and type 2 diabetes mellitus. Clin Infect Dis 41:281–288. https:// doi. org/ 10. 1086/ 431587
17. Laupland KB, Gregson DB, Zygun DA et al (2004) Severe bloodstream infections: a population-based assessment. Crit Care Med 32:992–997. https://doi.org/10.1097/01.CCM.0000119424.31648. 1E
18. Frydrych LM, Bian G, O’Lone DE et al (2018) Obesity and type 2 diabetes mellitus drive immune dysfunction, infection development, and sepsis mortality. J Leukoc Biol 104:525–534. https:// doi.org/10.1002/JLB.5VMR0118-021RR
19. Bertoni AG, Saydah S, Brancati FL (2001) Diabetes and the risk of infection-related mortality in the U.S. Diabetes Care 24:10441049. https://doi.org/10.2337/diacare.24.6.1044
20. Stacey HJ, Clements CS, Welburn SC, Jones JD (2019) The prevalence of methicillin-resistant Staphylococcus aureus among diabetic patients: a meta-analysis. Acta Diabetol 56:907–921. https:// doi.org/10.1007/s00592-019-01301-0
21. Esper AM, Moss M, Martin GS (2009) The effect of diabetes mellitus on organ dysfunction with sepsis: an epidemiological study. Crit Care 13:9–14. https://doi.org/10.1186/cc7717
22. Finfer A, Chittock D, Su S et al (2009) Intensive versus conventional glucose control in critically ill patients. N Engl J Med 360:1283–1297. https://doi.org/10.1056/NEJMoa0810625
23. Bosmann M, Ward PA (2013) The inflammatory response in sepsis. Trends Immunol 34:129–136. https://doi.org/10.1016/j.it. 2012.09.004
24. Goldstein DE, Little RR, Lorenz RA et al (2004) Tests of glycemia in diabetes. Diabetes Care 27:1761–1773. https://doi.org/10.2337/ diacare.27.7.1761
25. Braithwaite SS (2010) Through the eyes of the A1C: a call to reexamine stress hyperglycemia. Crit Care Med 38:717–719. https:// doi.org/10.1097/CCM.0b013e3181cc8c6a
26. Pearson-Stuttard J, Blundell S, Harris T et al (2016) Diabetes and infection: assessing the association with glycaemic control in population-based studies. Lancet Diabetes Endocrinol 4:148–158. https://doi.org/10.1016/S2213-8587(15)00379-4
27. Critchley JA, Carey IM, Harris T et al (2018) Glycemic control and risk of infections among people with type 1 or type 2 diabetes in a large primary care cohort study. Diabetes Care 41:2127–2135. https://doi.org/10.2337/dc18-0287
28. Honiden S, Gong M (2009) Diabetes, insulin, and development of acute lung injury. Crit Care Med 37:2455–2464.
29. Shih CJ, Wu YL, Chao PW et al (2015) Association between use of oral anti-diabetic drugs and the risk of sepsis: a nested casecontrol study. Sci Rep 5:1–7. https://doi.org/10.1038/srep15260
30. Perl SH, Bloch O, Zelnic-Yuval D et al (2018) Sepsis-induced activation of endogenous GLP-1 system is enhanced in type 2 diabetes. Diabetes Metab Res Rev 34:1–8. https://doi.org/10.1002/ dmrr.2982
31. Liang H, Ding X, Li L et al (2019) Association of preadmission metformin use and mortality in patients with sepsis and diabetes mellitus: a systematic review and meta-analysis of cohort studies. Crit Care 23:1–9. https://doi.org/10.1186/s13054-019-2346-4
32. Shah FA, Mahmud H, Gallego-Martin T et al (2019) Therapeutic effects of endogenous incretin hormones and exogenous incretinbased medications in sepsis. J Clin Endocrinol Metab 104:52745284. https://doi.org/10.1210/jc.2019-00296
33. Vincent J, Preiser J, Sprung C et al (2010) Insulin-treated diabetes is not associated with increased mortality in critically ill patients. Crit Care Med 14:1–8. https://doi.org/10.1097/CCM.0000000000 002590
34. Van Vught LA, Scicluna BP, Hoogendijk AJ et al (2016) Association of diabetes and diabetes treatment with the host response in critically ill sepsis patients. Crit Care 20:1–15. https://doi.org/10. 1186/s13054-016-1429-8
35. Pantanetti P, Cangelosi G, Ambrosio G (2020) Potential role of incretins in diabetes and COVID-19 infection: a hypothesis worth exploring. Intern Emerg Med 15:779–782. https://doi.org/10.1007/s11739-020-02389-x
36. Oh T, Song I (2020) Association between prior metformin therapy and sepsis in diabetes patients: a nationwide sample cohort study. J Anesth 34:358–366. https://doi.org/10.1007/s00540-020-02753-3
37. Gornik I, Gornik O, Gašparović V (2007) HbA1c is outcome predictor in diabetic patients with sepsis. Diabetes Res Clin Pract 77:120–125. https://doi.org/10.1016/j.diabres.2006.10.017
38. Maitra SR, Wojnar MM, Lang CH (2000) Alterations in tissue glucose uptake during the hyperglycemic and hypoglycemic phases of sepsis. Shock 13:379–385. https:// doi. org/ 10. 1097/ 00024382-200005000-00006
39. Kushimoto S, Abe T, Ogura H et al (2020) Impact of blood glucose abnormalities on outcomes and disease severity in patients with severe sepsis: an analysis from a multicenter, prospective survey of severe sepsis. PLoS ONE 15:1–15. https://doi.org/10. 1371/journal.pone.0229919
40. Krinsley JS, Egi M, Kiss A et al (2013) Diabetic status and the relation of the three domains of glycemic control to mortality in critically ill patients: an international multicenter cohort study. Crit Care 17:1–17. https://doi.org/10.1186/cc12547
41. Stoudt K, Chawla S (2019) Don’t sugar coat it: glycemic control in the ICU. J Intensive Care Med 34:889–896. https://doi.org/10. 1177/0885066618801748
42. Egi M, Bellomo R, Stachowski E et al (2008) Blood glucose concentration and outcome of critical illness: the impact of diabetes. Crit Care Med 36:2249–2255. https://doi.org/10.1097/CCM. 0b013e318181039a
43. Krinsley JS (2009) Glycemic variability and mortality in critically ill patients: the impact of diabetes. J Diabetes Sci Technol 3:1292–1301. https://doi.org/10.1177/193229680900300609
44. Abdelmalak BB, Lansang MC (2013) Revisiting tight glycemic control in perioperative and critically ill patients: when one size may not fit all. J Clin Anesth 25:499–507. https:// doi. org/ 10. 1016/j.jclinane.2012.09.006
45. Van den Berghe G, Wouters P, Weekers F et al (2001) Intensive insulin therapy in critically ill patients. N Engl J Med 345:1359–1367
46. Van den Berghe G, Wilmer A, Hermans G et al (2006) Intensive insulin therapy in the medical ICU. N Engl J Med 354:449–461
47. Preiser JC, Devos P, Ruiz-Santana S et al (2009) A prospective randomised multi-centre controlled trial on tight glucose control by intensive insulin therapy in adult intensive care units: the glucontrol study. Intensive Care Med 35:1738–1748.
48. Brunkhorst FM, Engel C, Bloos F et al (2008) Intensive insulin therapy and pentastarch resuscitation in severe sepsis. N Engl J Med 358:125–139. https://doi.org/10.1177/175114370800900121
49. Song F, Zhong LJ, Han L et al (2014) Intensive insulin therapy for septic patients: a meta-analysis of randomized controlled trials. Biomed Res Int. https://doi.org/10.1155/2014/698265
50. Van den Berghe G, Wilmer A, Milants I et al (2006) Intensive insulin therapy in mixed medical/surgical intensive care unitsbenefit versus harm. Diabetes 55:3151–3159. https://doi.org/10. 2337/db06-0855
51. Yamada T, Shojima N, Noma H et al (2017) Glycemic control, mortality, and hypoglycemia in critically ill patients: a systematic review and network meta-analysis of randomized controlled trials. Intensive Care Med 43:1–15. https:// doi. org/ 10. 1007/ s00134-016-4523-0
52. Park JI, Bae E, Kim YL et al (2015) Glycemic control and mortality in diabetic patients undergoing dialysis focusing on the effects of age and dialysis type: a prospective cohort study in Korea. PLoS ONE 10:1–14. https://doi.org/10.1371/journal.pone.01360 85
53. Krinsley JS, Preiser JC (2015) Time in blood glucose range 70 to 140 mg/dl > 80% is strongly associated with increased survival in non-diabetic critically ill adults. Crit Care 19:1–11. https://doi. org/10.1186/s13054-015-0908-7
54. Rhodes A, Evans LE, Alhazzani W et al (2017) Surviving sepsis campaign: International guidelines for management of sepsis and septic shock: 2016. Intensive Care Med 43:304–377. https://doi. org/10.1007/s00134-017-4683-6
55. American Diabete Association (2020) Standards of medical care in diabetes—2020. Diabetes Care 43:S195. https:// doi. org/ 10. 2337/dc20-S002
56. Hirasawa H, Oda S, Nakamura M (2009) Blood glucose control in patients with severe sepsis and septic shock. World J Gastroenterol 15:4132–4136. https://doi.org/10.3748/wjg.15.4132
57. Egi M, Krinsley JS, Maurer P et al (2016) Pre-morbid glycemic control modifies the interaction between acute hypoglycemia and mortality. Intensive Care Med 42:562–571. https://doi. org/ 10. 1007/s00134-016-4216-8
58. Egi M (2018) Acute glycemic control in diabetics. How sweet is optimal? Con: just as sweet as in nondiabetic is better. J Intensive Care 6:1–3. https://doi.org/10.1186/s40560-018-0336-2
59. Poole AP, Finnis ME, Anstey J et al (2020) Study protocol and statistical analysis plan for the liberal glucose control in critically Ill patients with pre-existing type 2 diabetes (LUCID) trial. Crit care Resusc 22:133–141
60. Salinas PD, Mendez CE (2019) Glucose management technologies for the critically ill. J Diabetes Sci Technol 13:682–690. https:// doi.org/10.1177/1932296818822838
61. Lee YS, Min KH, Lee SY et al (2019) The value of glycated hemoglobin as predictor of organ dysfunction in patients with sepsis. PLoS ONE 14:1–13. https://doi.org/10.1371/JOURNAL. PONE.0216397
62. Moutzouri AG, Athanassiou GA, Dimitropoulou D et al (2008) Severe sepsis and diabetes mellitus have additive effects on red blood cell deformability. J Infect 57:147–151. https://doi.org/10. 1016/j.jinf.2008.04.004
63. Chang CW, Kok VC, Tseng TC et al (2012) Diabetic patients with severe sepsis admitted to intensive care Unit do not fare worse than non-diabetic patients: a nationwide population-based cohort study. PLoS ONE 7:1–10. https://doi.org/10.1371/journal.pone. 0050729
64. Moss M, Guidot D, Steinberg K et al (2000) Diabetic patients have a decreased incidence of acute respiratory distress syndrome. Crit Care Med 28:2187–2192. https://doi.org/10.1097/00003246200007000-00001
65. Gong MN, Thompson BT, Williams P et al (2005) Clinical predictors of and mortality in acute respiratory distress syndrome: potential role of red cell transfusion. Crit Care Med. https://doi. org/10.1097/01.CCM.0000165566.82925.14
66. Yang Y, Abdul Salam ZH, Ong BC, Yang KS (2011) Respiratory dysfunction in patients with sepsis: protective effect of diabetes mellitus. Am J Crit Care 20:e41-47. https://doi.org/10.4037/ajcc2 011391
67. Yu S, Christiani D, Thompson B et al (2013) Role of diabetes in the development of acute respiratory distress syndrome. Crit Care Med 41:2720–2732. https://doi.org/10.1097/CCM.0b013 e318298a2eb
68. Alexiewicz JM, Kumar D, Smogorzewski M et al (1995) Polymorphonuclear leukocytes in non-insulin-dependent diabetes mellitus: abnormalities in metabolism and function. Ann Intern Med 123:919–924. https://doi.org/10.7326/0003-4819-123-12-19951 2150-00004
69. Schrier RW, Wang W (2004) Acute renal failure and sepsis. N Engl J Med 351:159–169. https://doi.org/10.1056/nejmra032401
70. Venot M, Weis L, Clec’h C et al (2015) Acute kidney injury in severe sepsis and septic shock in patients with and without diabetes mellitus: a multicenter study. PLoS One 10:1–10. https://doi. org/10.1371/journal.pone.0127411
71. Yegenaga I, Hoste E, Van Biesen W et al (2004) Clinical characteristics of patients developing ARF due to sepsis/systemic inflammatory response ryndrome: results of a prospective study. Am J Kidney Dis 43:817–824. https://doi.org/10.1053/j.ajkd.2003.12. 045
72. Zoppini G, Fedeli U, Schievano E et al (2018) Mortality from infectious diseases in diabetes. Nutr Metab Cardiovasc Dis 28:444–450. https://doi.org/10.1016/j.numecd.2017.12.007
73. Stegenga ME, Vincent JL, Vail GM et al (2010) Diabetes does not alter mortality or hemostatic and inflammatory responses in patients with severe sepsis. Crit Care Med 38:539–545. https:// doi.org/10.1097/CCM.0b013e3181c02726
74. Van Vught LA, Holman R, De Jonge E et al (2017) Diabetes is not associated with increased 90-day mortality risk in critically ill patients with sepsis. Crit Care Med 45:e1026–e1035. https:// doi.org/10.1097/CCM.0000000000002590
75. Tayek CJ, Tayek JA (2012) Diabetes patients and non-diabetic patients intensive care unit and hospital mortality risks associated with sepsis. World J Diabetes 3:29–34. https://doi.org/10.4239/ wjd.v3.i2.29
76. Schuetz P, Yano K, Sorasaki M et al (2011) Influence of diabetes on endothelial cell response during sepsis. Diabetologia 54:9961003. https://doi.org/10.1007/s00125-011-2059-y
77. Goldfine AB, Fonseca V, Shoelson SE (2011) Therapeutic approaches to target inflammation in type 2 diabetes. Clin Chem 57:162–167. https://doi.org/10.1373/clinchem.2010.148833
Acta Diabetologica