Роль молекулярных паттернов, ассоциированных с повреждением, в септическом остром повреждении почек
Frontiers in Immunology | www.frontiersin.org
March 2021 | Volume 12 | Article 606622
doi: 10.3389/fimmu.2021.606622
Роль молекулярных паттернов, ассоциированных с повреждением, в септическом остром повреждении почек: от повреждения к восстановлению
Перевод оригинальной статьи «Role of Damage-Associated Molecular Patterns in Septic Acute Kidney Injury, From Injury to Recovery»
Авторы: Pierre-Olivier Ludes, Charles de Roquetaillade, Benjamin Glenn Chousterman, Julien Pottecher, Alexandre Mebazaa
Department of Anesthesiology and Intensive Care, Hautepierre Hospital, Strasbourg University Hospital, Strasbourg, France,
EA 3072, Mitochondrie Stress Oxydant et Protection Musculaire, Faculté de Médecine, FRU 6702, Fédération de Médecine Translationnelle de Strasbourg (FMTS), Strasbourg, France,
Department of Anesthesiology and Critical Care, Hôpital Lariboisière, DMU Parabol, APHP.Nord, Paris, France, 4 Inserm U942 MASCOT, Université de Paris, Paris, France
Keywords: DAMPs, clinical features, precision medicine, kidney recovery, acute kidney injury, sepsis, therapeutic targets
Ключевые слова: DAMPs, клинические особенности, точная медицина, восстановление почек, острое почечное повреждение, сепсис, терапевтические цели
Молекулярные паттерны, связанные с повреждением (англ. Damage-Associated Molecular Patterns)
Молекулярные паттерны, связанные с повреждением (DAMPs), относятся к эндогенным молекулам, высвобождение которых обусловлено клеточным стрессом или с тканевым повреждением. DAMPs экспрессируются либо на плазматической мембране стрессовых клеток, либо секретируются стрессовыми клетками. Также высвобождение DAMPs в клеточную среду может быть пассивным в случае гибели клеток в результате повреждения плазматической мембраны клетки или при повреждении экстрацеллюлярного матрикса клетки [1]. DAMPs также включают в себя и сигналы повреждения, которые связаны с пертурбациями тканевого гомеостаза (механический стресс, гипоксия, нехватка нутриентов) и могут служить сигналом патологического стресса [2]. Уже описаны самые разнообразные DAMPs, генерация которых происходит из различных источников. Имеется несколько подходов к классификации DAMPs, одни из которых основаны на их суб-локализации, а другие - на их химической составляющей [3, 4]. В значительной части имеющейся на сегодня литературе сообщается о роли DAMPs не только в патогенезе острого повреждения почек (ОПП), но в восстановление функции почек.
Острое повреждение почек
Острое повреждение почек характеризуется быстрым снижением функции почек, как со стороны гломерулярной фильтрации, так и со стороны клубочковой фильтрации, что все вместе ведет к накоплению отходов метаболизма и токсинов. ОПП может также оказывать неблагоприятное влияние в виде дисфункции отдаленных органов и наиболее часто такое влияние оказывается на сердечно-сосудистую систему [5]. К наиболее частым причинам развития ОПП можно отнести сепсис, синдром ишемии-реперфузии (СИР), воздействие определенных лекарственных средств, а также и эндогенную нефротоксичность, причиной которой может послужить рабдомиолиз. Установлено, что каждый год во всем мире два миллиона людей умирают от ОПП, а распространённость ОПП все время растет [6 -9]. Летальность от ОПП в отделениях интенсивной терапии остается высокой, по разным оценкам от 50 до 80%, а очень большая пропорция выживших пациентов (30 - 70%) с ОПП в последующем страдают от хронической болезни почек (ХБП) и терминальной стадии почечной недостаточности, что требует проведения программного гемодиализа [10].
Воспаление является одним из основных триггеров как возникновения ОПП, так и дальнейшего нарастания тяжести ОПП. С воспалением также связаны такие факторы, как патогенные бактерии, токсины, ишемия, травма, аутоиммунные заболевания [11]. Повреждение и гибель клеток почечных канальцев есть ключевой фактор развития ОПП и ведет к нарушению клубочковой фильтрации, воспалению и дисфункции сосудов. Восстановление функции почек после ОПП характеризуется регенерацией клеток почечных канальцев [12, 13]. Потеря почечной функции связана со смертью тубулярных клеток, что, в свою очередь, ассоциируется с высвобождением DAMPs, таких как белок HMGB1 (англ. high mobility group box one), который не только стимулирует воспалительные реакции, но и усиливает их, что еще больше повреждает ткани [14].
В дополнение к такому немедленному эффекту, в который вовлечена система врожденного иммунитета, DAMPs также активирует рецепторы молекулярных паттернов, ассоциированных с патогенами (PAMPs), расположенных на циркулирующих клетках иммунной системы. Таким образом, DAMPs не только инициирует, но и усиливает ответ иммунной системы путем активации toll-like рецепторов (TLRs) [15, 16]. Активация TLRs приводит к активации клеток, презентующих антиген (англ.antigen presenting cells или APCs), что усиливает презентацию антигена дендритными клетками и В-клетками. В итоге, благодаря описанному выше механизму, увеличивается выработка антител, что способствует развитию заболеваний почек в виде иммунного гломерулонефрита или васкулита с антинейтрофильными цитоплазматическими антителами (англ. anti-neutrophil cytoplasmic antibody или ANCA), по своей сути являющиеся аутоиммунными заболеваниями [15, 17, 18].
В данном обзоре мы сначала кратко опишем текущие наши знания о патофизиологии сепсис-индуцированного ОПП, особенно в части критической роли, что играет здесь воспаление и на развитие ОПП, и на восстановление функции почек. Мы детально рассмотрим механизмы генерации DAMPs и их высвобождение во время ОПП, роль DAMPs в инициации иммунного ответа и в потере функции почек. В конце обзора мы обсудим недавние результаты, показывающие роль DAMPs в регенерации почек после повреждения, а также возможные перспективные терапевтические стратегии, которые позволят несколько смягчить отрицательное влияние DAMPs на функцию почек.
Патофизиология сепсис-индуцированного ОПП
Патофизиология сепсис-индуцированного ОПП тщательно исследуется. Детальное описание можно увидеть здесь [19 - 21]. Но несмотря на десятилетия интенсивного изучения ОПП, полного понимания процесса еще не достигнуто. Достаточно долго считалось, что в основе патофизиологии сепсис-индуцированного ОПП лежат нарушения гемодинамики, но только сейчас мы начинаем понимать роль острого воспаления, приводящего к повреждению клубочков и к структурным изменениям [23 - 25].
Влияние перфузии
Макроциркуляция
Нарушения микроциркуляции
Первоначально считалось, что центральную роль в развитии сепсис-индуцированного ОПП играет сепсис по причине того, что именно сепсис ассоциируется с глубокими нарушениями макроциркуляции (шок), что и приводит к нарушению перфузии почек. Однако свидетельства этому очень и очень скудные [27], подтверждением тому могут служить животные модели сепсиса, у которых почечный кровоток при сепсисе остается нормальным, а иногда и повышается [22, 28]. Однако и у этих моделей развивается ОПП, несмотря на нормальный или даже повышенный почечный кровоток [29]. У людей стратегия, направленная на улучшение доставки и потребления кислорода, не показала своей пользы в контексте снижения летальности [27], а применение катехоламинов для улучшения транспорта кислорода ассоциируется с увеличением частоты развития органного повреждения и смертью [30]. Подобным образом, наблюдательные исследования показали, что предпочтение к ингибиторам ангиотензин-превращающего фермента (англ. angiotensin-converting enzyme inhibitors или ACEIs) или введение пациентам с септическим шоком блокаторов рецепторов ангиотензина (англ. angiotensin-receptor blockers или ARBs) никак не влияет на частоту развития ОПП или смерть [31]. То же самое было показано в рандомизированных клинических исследованиях, в которых изучались эффекты от введения нестероидных противовоспалительных препаратов (англ. non-steroidal anti-inflammatory drugs или NSAIDs) [32]. И это несмотря на то, что эти молекулы (ACEIs, ARBs и NSAIDs) хорошо известны своим сильным гемодинамическим влиянием на кровоток в почечных артериолах, когда ACEIs и ARBs снижают скорость клубочковой фильтрации, а NSAIDs снижают почечный кровоток.
Микрососуды и эндотелиальная дисфункция
Дисфункция микроциркуляции определяется как повреждение клеточных компонентов микрососудов, включая сюда клетки эндотелия, клетки гладкомышечной ткани и пул, состоящий из клеток крови [33].
У эритроцитов снижается способность к деформации, что вместе с активацией лейкоцитов увеличивает агрегацию [33]. У септических пациентов не было описано увеличение адгезии для межклеточного взаимодействия на поверхности нейтрофилов. И наконец, диссеминированное внутрисосудистое свертывание, что часто встречается у пациентов с сепсисом, также способствует дисфункции микроциркуляции [34].
Прогрессирующий системный дисбаланс гемодинамики при сепсисе вызывает дисфункцию микрососудов в почках и нарушения кислородного гомеостаза. Дефицит кислорода приводит к оксидативному стрессу и гипоксемии. Снижение кислорода в тканях почек ухудшает условия для продукции АТФ, необходимого для обеспечения работы Na + /K + насоса, и снижает реабсорбцию Na в проксимальных канальцах [35]. Клетки паренхимы переходят с аэробного гликолиза на анаэробный, производя при этом большее количество активных форм кислорода, или АФК (англ. reactive oxygen species или ROS), что, в свою очередь, приводит к повреждению клеток и развитию эндотелиальной дисфункции [36]. Дисфункция микрососудов и оксидативный стресс играют важную роль в сепсис-индуцированном ОПП. Ассоциация между дисфункцией микрососудов в почках и продукцией активных форм кислорода была изучена на животных моделях сепсиса [37] и, именно она приводила к развитию гипоксии с последующей генерацией оксидантов [37].
Подобные изменения микрососудов могут происходить и при нормальном почечном кровотоке [38], что предполагает большую гетерогенность причин снижения перфузии в тканях почек [39]. Поскольку почка представляет собой инкапсулированный орган, перегрузка жидкостью с последующим отеком эндотелия и тканей не имеют явной клинической картины, но эти состояния, вовремя не выявленные, способны усугубить нарушение перфузии в контексте сепсиса [40, 41].
Структурные поражения
Гибель клеток почек (апоптоз)
Апоптоз или запрограммированная смерть клеток высвобождает очень небольшое количество DAMPs. Более того, поглощение апоптотического дебриса фагоцитами, в общем и целом, больше запускает противовоспалительный фентотип [42]. Регуляция гибели клеток инициируется различными путями. При внутреннем пути клеточный стресс приводит к увеличению проницаемости внешней мембраны митохондрий, что приводит к выпуску апоптогенных факторов, включая сюда цитохром С, и последующим связыванием Apaf-1 для активации каспазы-9 [43]. При внешнем пути легирование рецепторов гибели клеток приводит к набору адаптерных белков с последующей активацией каспазы-8 [44]. Стресс эндоплазматического ретикулюма активирует каспазу-12 [45] и каспазу-2, могущими быть инициаторами апоптоза [46].
Тем не менее, при определённых условиях клетки, подвергнутые апоптозу, могут вызывать воспалительный ответ и быть ответственными за дальнейшее повреждение [47]. Избавление от апоптотического дебриса, чем занимаются моноциты или макрофаги, играет критическую роль в восстановлении почечной функции, а сам процесс избавления от дебриса называется эффероцитоз [42]. Утеря возможности эффероцитоза приводит к нарушению восстановления почек и к их фиброзу [48]. Гистологические исследования действительно выявили небольшой апоптоз тубулярных клеток при септическом ОПП [22, 49, 50]. И наоборот, в экспериментальных моделях использование человеческих клеток эпителия почечных канальцев in vitro в условиях отсутствия гипоперфузии или гипоксии, плазма, собранная у пациентов с тяжелым сепсисом и септическим шоком, могла индуцировать апоптоз и функциональные нарушения в тубулярных клетках и подоцитах [51].
Регулируемый некроз
Регулируемый некроз (РН) ведет к разрушению целостности клеточной мембраны. Самое важное отличие от апоптоза в том, что при РН происходит высвобождение DAMPs со стимуляцией иммуногенности - процесса, который при апоптозе отсутствует [52]. Генетически регулируемый некроз определяет программируемую гибель клетки (независимо от причины), при которой происходит разрушение плазматической мембраны изнутри (ферроптоз) или снаружи (некроптоз или пироптоз). Термины ферроптоз, некроптоз и пироптоз определяют генетические подпрограммы РН, при этом только некроптоз вовлечен в процесс сепсис-индуцированного ОПП [53].
Ферроптоз представляет собой некроз, который характеризуется накоплением продуктов перекисного окисления липидов и активных форм кислорода (АФК), полученных при окислении железа. Окисленное железо является известным фактором риска развития ОПП в клинически значимых условиях [54].
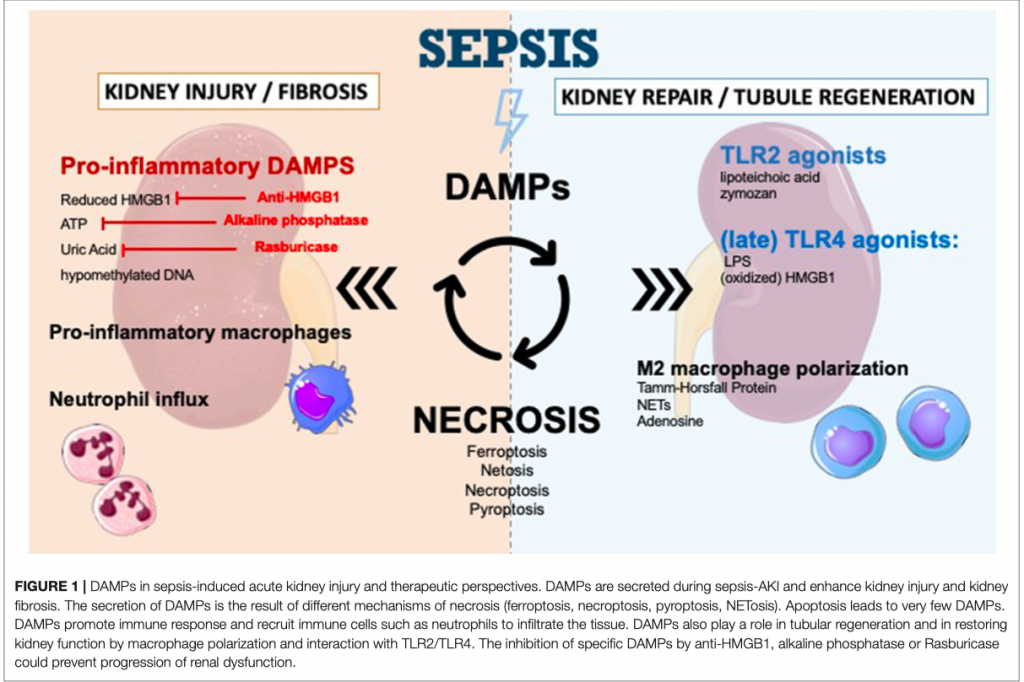
Некроптоз опосредуется белком, подобным домену киназы смешанного происхождения (англ. a mixed lineage kinase domain like protein или MLKL). Активация MLKL при его фосфорилировании (pMLKL) рецептор-взаимодействующей протеинкиназой-3 (RIPK3) запускает некроптоз с высвобождением внутриклеточных компонентов [56]. Фосфорилирование MLKL является важным медиатором некроптоза, но его недостаточно, чтобы вызвать гибель клеток. Рецепторы смерти, такие как рецептор 1 факторов некроза опухолей (TNFR1) и Fas, принадлежащие к суперсемейству TNFR рецепторов плазматической мембраны, могут опосредовать некроптоз [57]. Sureshbabu et al. [53] показали, что у мышей с полимикробным септическим состоянием RIPK3 не только способствует развитию сепсис-индуцированного ОПП, но и усугубляет повреждение канальцев почек независимо от классических путей MLKL-зависимого некроптоза (Рисунок 1). Они также наблюдали повышенные уровни RIPK3 в моче и плазме у пациентов с ОПП, вызванной сепсисом.
Пироптоз опосредуется газдермином D, который расщепляется каспазой, а также и про-интерлейкином-1бета и про-интерлейкином18. Целью газдермина D является фосфатидилинозитол 4,5-бифосфат (англ. phosphatidylinositol 4,5-biphosphate или PIP2). Тогда, когда концентрация связанного с PIP2 газдермина D становится критичной, чрезмерная экструзия мембраны приводит к ее разрушению [58].
Повреждение почечных канальцев
Ключевым звеном в патофизиологии сепсис-индуцированного ОПП является повреждение почечных канальцев. Клетки почечных канальцев очень чувствительны к состоянию микроциркуляции и воспалению, что и определяет их как потенциальных жертв сепсиса [59]. Но вот у людей патологические исследования фактически не выявили больших очагов апоптоза клеток почечных канальцев, что дает возможность предположить, что эти клетки способны ингибировать процессы, ведущие к апоптозу. Выяснилось, что клетки почечных канальцев способны резко снижать свой метаболизм [60] или даже останавливать свой клеточный цикл [61] для того, чтобы ограничить повреждение и обеспечить последующее восстановление. Именно отсутствие «перепрограммирования» такого адаптивного ответа может быть связано с развитием фиброза почек и ХБП [60, 61].
Воспаление и цитокиновый шторм
Несколько групп исследователей уже показали явные ассоциации между уровнями таких цитокинов, как интерлейкины (IL), особенно IL-6 и IL-10, и фактора ингибирования миграции с развитием сепсис-индуцированного ОПП [62]. Адгезия и инфильтрация лейкоцитов в ткани почек проявляется снижением почечной функции и ведет к ОПП [63].
Недавние экспериментальные данные, наряду с предыдущими гистологическими исследованиями, пролили свет на важность рекрутмента лейкоцитов и воспаления, как центрального механизма развития сепсис-индуцированного ОПП [64]. Гистологические исследования показали, что в отличие от ишемии-реперфузии, которая характеризуется апоптозом и некрозом клеток эпителия почечных канальцев, сепсис-индуцированное ОПП характеризуется обратимым повреждением клеток эпителия канальцев, а случаи некроза редки [20, 49]. Эти же исследования показали очень выраженную инфильтрацию лейкоцитов в ткани почек при сепсисе, в основном за счет моноцитов [49].
Общепризнано, что сепсис является синдромом, в основе которого лежит системное воспаление, вызванное инфекционным агентом. Процесс этот имеет тенденцию к расширению, приводя к развитию органного повреждения. В частности, ОПП развивается в основном из-за водорастворимых факторов, попадающих в системный кровоток [65]. В первую очередь процесс запускается цитокинами и массивным высвобождением в циркуляцию DAMPs и PAMPs. Именно DAMPs и PAMPs не только запускают системное воспаление, они его еще и усугубляют [66]. Несмотря на то, что сублетальное повреждение может быть обратимым, гибель клеток почечных канальцев может запустить дополнительное высвобождение DAMPs, что еще больше усиливает воспаление [14]. Такой каскад называется некровоспалением (англ. necroinflammation) после первичного повреждения, и именно он участвует в развитии почечного повреждения, усугубляя ситуацию еще и инфильтрацией клеток иммунной системы в ткани почек [67]. Результаты части проведенных исследований показали, что уровень DAMPs коррелировал с выживаемостью при сепсисе [68, 69].
Молекулярные паттерны, ассоциированные с повреждением, являются центральными эффекторами в патофизиологии сепсис-индуцированного ОПП. Именно они способствуют нарушениям макро- и микроциркуляции, развитию эндотелиальной дисфункции, рекрутменту лейкоцитов и повреждению почечных канальцев, создавая тем самым идеальную среду для развития воспаления. Сохраняясь в циркуляции, даже после устранения бактериального патогена, они способны поддерживать повреждения в течение очень долгого времени. Это показали Sursal et al. [70] в своем исследовании на приматах (но не на людях), когда в отличие от PAMPs (оцениваемых путем измерения циркулирующей бактериальной 16SDNA), которые быстро исчезали из кровотока, циркуляция DAMPs (оцениваемой путем измерения циркулирующей митохондриальной ДНК) продолжалась еще очень долго. Данные наблюдения предполагают центральную роль DAMPs в генерации и поддержании синдрома системного воспалительного ответа при сепсисе [70, 71].
Взятые все вместе, последние результаты свидетельствуют в пользу того, что центральную роль в патофизиологии ОПП при сепсисе играют воспаление и инфильтрация лейкоцитов [62, 72]. Вместе со своей основной функцией, определять и сигнализировать об опасности, DAMPs занимают еще и ведущую роль в развитии сепсис-индуцированного повреждения почек.
Источник DAMPs при сепсис-индуцированом ОПП
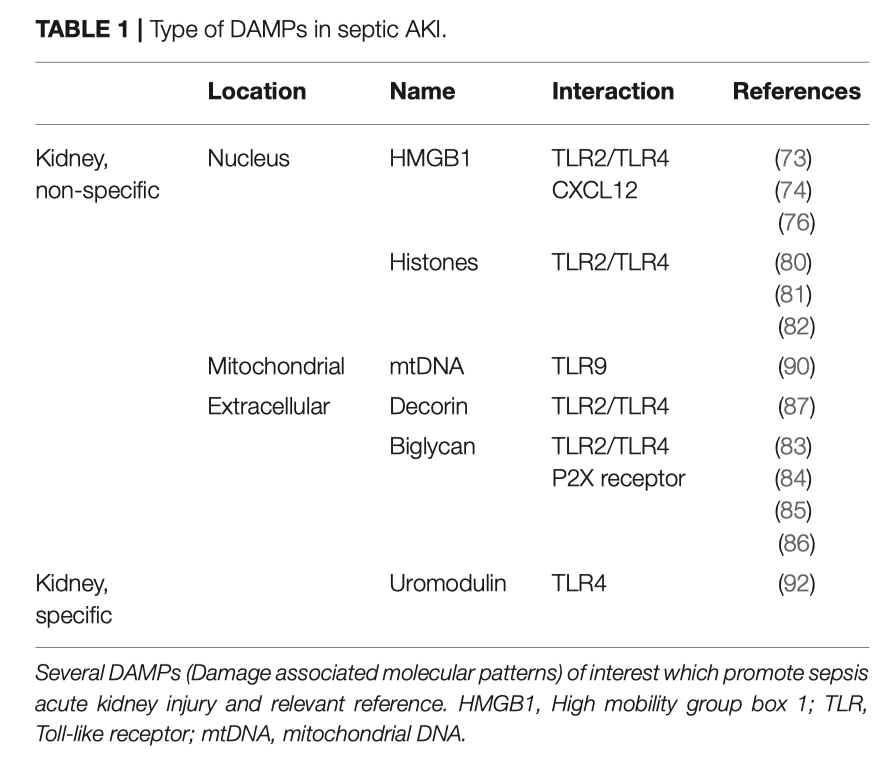
Все DAMPs, вовлеченные в развитие сепсис-индуцированного ОПП показаны в Таблице 1.
Неспецифичеcкие для почек DAMPs
HMGB1 (High Mobility Group Box One)
HMGB1 представляет собой внутриядерный белок, участвующий в сепсисе и ОПП. После высвобождения из стромальных или иммунных клеток, HMGB1 взаимодействует с различными рецепторами, расположенными на клеточной поверхности, включая сюда TLR2 и TLR4. Наиболее изученными являются его провоспалительные свойства [73].
HMGB1 может усиливать воспаление за счет положительной обратной связи во время вызванного сепсисом ОПП. HMGB1, как известно, представляет собой воспалительный цитокин, появляющийся поздно во время сепсиса. Однако, когда септический эпизод осложняет длительная хроническая болезнь почек, HMGB1 представляет собой рано появляющийся цитокин, который измеряется в плазме в течение 6 часов у мышиных моделей сепсиса [74]. Наблюдения на животных моделях сепсиса в сочетании с ОПП предполагают, что почечный клиренс HMGB1 при ХБП снижается и, более того, небольшого высвобождения HMGB1 достаточно для того, чтобы вызвать значительное увеличение его концентрации в плазме. Таким образом, время высвобождения HMGB1 зависит от степени почечной недостаточности в начале сепсиса [74].
Также было показано, что этот DAMP может обладать и регулирующими функциями. HMGB1 представляет собой окислительно-восстановительный DAMP, содержащий три цистеина, что дает ему возможность участвовать в окислительно-восстановительных реакциях [75]. В зависимости от уровня окисления, три изоформы HMGB1 могут сосуществовать на разных уровнях, тем самым они обладают способностью вызывать различные типы иммунных реакций. Полностью восстановленный HMGB1 связывается с хемокином CXCL12, который дополнительно связывается с рецептором CXCR4 (76). Kazama et al. [77] на мышиной модели показали, что терминальное окисление HMGB1, которое может быть индуцировано высокой продукцией АФК митохондриями, является достаточным и необходимым условием для инактивации иммуностимулирующих эффектов HMGB1. Терминальное окисление HMGB1 может придавать HMGB1 дополнительные свойства в виде снижения активности иммунной системы после апоптоза.
Несмотря на достаточно долгую уверенность в том, что во время апоптоза HMGB1 захватывается внутри ядра, недавно было показано, что окисленный HMGB1 легко высвобождается из апоптотических клеток [77] и вызывает толерантность [78]. Кроме того, макрофаги после фагоцитоза апоптотического дебриса могут активно высвобождать HMGB1 [79], что ставит под сомнение концепцию апоптоза как «тихой смерти».
Гистоны
Подобно HMGB1, гистоны являются внутриклеточными и внутриядерными белками, принимающие участие в компактизации (упаковка) ДНК. Физиологическая роль гистонов - обеспечение гомеостаза, но эти белки также ведут себя как DAMPs, активируя TLR2/TLR4 и, тем самым, индуцируя системное воспаление [80, 81]. Xu et al. [82] обнаружили гистоны в циркуляции гиббонов, инфицированных Escherichia coli, а увеличение уровня гистонов в циркуляции сопровождалось развитием дисфункции почек. Более того, эти авторы еще показали, что введение антител к гистонам приводит к снижению летальности у мышей, которые служили моделями сепсиса (липополисахаридная модель, модель TNF и модель CLP) [82].
Бигликан
Бигликан является внеклеточным DAMP, вовлеченным в повреждение почек в результате ишемии/реперфузии и при сепсисе, путем активации NRLP3 инфламасомы через рецепторы TLR2/TLR4 и P2X [83 - 85]. Schaefer et al. [85] показали, что на ранней стадии сепсиса, вызванного ЛПС или зимосаном, уровень TNF-α в сыворотке крови был значительно ниже у мышей с дефицитом бигликана по сравнению с дикими мышами. Ранее эти же авторы наблюдали сверхэкспрессию биклигана с одновременным увеличением количества инфильтрирующих клеток в модели почечного воспаления [86].
Декорин
Декорин является внеклеточным DAMP, вовлеченным в процессы развития септического ОПП, который активирует TLR2/TLR4. Merline et al. [87] измеряли циркулирующий декорин в пробах плазмы крови, взятых у пациентов с сепсисом, вызванном грам-положительной и грам-отрицательной инфекцией. Иммуноблот и ELISA анализ показали увеличение уровней декорина у пациентов с сепсисом по сравнению со здоровыми людьми. Авторы в эксперименте вызывали ЛПС сепсис у нокаут-декориновых мышей и показали, что декорин в большей степени локализуется в непосредственной близости от макрофагов в легких. Подобное было замечено и у макрофагов брюшины, которые в присутствии ЛПС увеличивали экспрессию декориновой мРНК с увеличением секреции декорина через 30 минут после введения ЛПС. Тем не менее, секретируют ли декорин макрофаги почечных канальцев, еще следует изучить.
Внеклеточные ДНК
Внеклеточные ДНК относятся к DAMP, участвующих в почечном повреждении при ишемии/реперфузии. ДНК из некротизированных клеток приводят к активации тромбоцитов, принимают участие во взаимодействиях между тромобоцитами и гранулоцитами, а также в формации нейтрофильных экстрацеллюлярных ловушек, что все вместе приводит к развитию почечного воспаления и увеличивает почечное повреждение [88].
Shi et al. [89] на мышиных моделях (эмболия почечной артерии кристаллом холестерола) уже показали, что органное повреждение в этом случае ассоциируется с формацией нейтрофильных экстрацеллюлярных ловушек и высвобождением ДНК, в большей степени из эндотелиальных клеток почек.
Более специфичную картину показали Tsuji et al. [90], а именно роль митохондриальной ДНК (mtDNA) при TLR9-ассоциированном септическом ОПП. Их результаты на CPL моделях диких мышей и мышей с нокаутом TLR9, позволяют предположить, что mtDNA активирует TLR9, вызывая тем самым продукцию цитокинов с последующим повреждением почек при полимикробном сепсисе.
DAMPs, специфичные для почек
Уромодулин
Уромодулин, известный еще как белок Tamm-Horsfall, секретируется в толстой восходящей части дистального почечного канальца. Является адгезивным белком, образующим частицы, которые покрывают многие элементы в дистальных канальцах - клеточные и гранулярные. Покрытие бактерий и воспалительных цитокинов способствует их устранению [91]. Внутри просвета канальцев уромодулин иммунологически неактивен. Однако при повреждении канальцев уромодулин просачивается в интерстициальный компартмент и становится DAMP, активируя интерстициальные дендритные клетки через TLR4 [92]. В дендритных клетках NLRP3 инфламасома активируется фагоцитозом с эндосомной дестабилизацией в ответ на присутствие уромодулина в интерстиции. Врожденный иммунитет при повреждении канальцев, в конечном итоге, активируется высвобождением IL-1β [93].
Роль DAMPs в почечном повреждении и воспалении
Некоторые исследования показывают, что одними из самых сильных триггеров воспаления являются провоспалительные агенты микробного происхождения. Однако многие типы стерильных стимулов, включая сюда травму, ишемию, стресс и факторы окружающей среды, вызывают состояние воспаления, свободного от патогенов, которое называется «стерильным воспалением» [94].
Острое повреждение тканей является триггером (спусковым крючком) притока нейтрофилов. Следом идет увеличение адгезионной способности циркулирующих моноцитов и активация эндотелиальных поверхностей с последующей экстравазацией в интерстициальный компартмент [95]. Поврежденные клетки высвобождают DAMP - HMGB1, АТФ, мочевую кислоту и гипометилированную ДНК [96, 97]. Провоспалительный фенотип макрофагов способствует секреции цитокинов, хемокинов, АФК и других провоспалительных медиаторов [98]. Провоспалительные макрофаги высвобождают матриксные металлопротеиназы, что обеспечивает их миграцию через базальные мембраны и межклеточные сети межклеточного матрикса. Получающиеся в результате небольшие пептиды внеклеточного матрикса могут действовать как иммуностимулирующие DAMP через TLR и поддерживать провоспалительное состояние [99]. Провоспалительные макрофаги выделяют большое количество TNF-α [100]. В тоже время связь между воспалением и развитием повреждения почек при сепсисе не получила адекватного объяснения. Подавление механизма воспаления, такого как адгезия лейкоцитов и инфильтрация в почки, улучшает функцию почек при ОПП, вызванной сепсисом [101]. Более того, у мышей с ОПП, вызванной сепсисом, ингибирование воспалительных цитокинов и окислительный стресс в дендритных клетках и нейтрофилах улучшают функцию почек [102].
Роль DAMPs в регенерации и восстановлении почек
Последние данные предполагают, что DAMPs могут способствовать регенерации канальцев после повреждения, а не только потенциировать почечное повреждение и воспаление [103].
Сепсис есть воспаление, а воспаление усиливает почечную недостаточность и приводит к повреждению тканей. Из этого следует, что высвобождается большее количество остатков некротических клеток [12, 104]. Например, мыши, лишенные HMGB1, защищены от постишемической острой почечной недостаточности из-за того, что некроз клеток почечных канальцев больше не вызывает постишемическое воспаление почек и повреждение канальцев [105]. Более того, недавние исследования подчеркнули роль DAMP в регенерации после ОПП [106, 107].
Молекулярные механизмы, приводящие к восстановлению после ОПП
Восстановление после острого повреждения почечных канальцев до настоящего времени полностью не совсем понятен. В процесс восстановления вовлечены рекрутмент и реполяризация лейкоцитов, которые служат важным источником сигнальных и паракринных факторов роста. Преобладающий механизм восстановления после ОПП - гипертрофия сохраненных клеток через эндоцикл [108], распространенного варианта клеточного цикла, при котором клетки последовательно дублируют геномную ДНК без разделения своей хромосомы во время митоза [109]. Восстановление, управляемое пролиферацией и дифференциацией прогениторных клеток, не выглядит основным механизмом [108, 110]. Нарушения в этих процессах приводит к недостаточному восстановление, что в будущем может привести к развитию ХБП. Понимание механизмов, приводящих к развитию ОПП и последующей ХБП, очень важно в целях идентификации потенциальных целей терапии. И большее внимание следует уделить роли DAMPs и рецепторов к ним.
Роль DAMPs в поляризации моноцитов/макрофагов
Во время фазы повреждения DAMPs и другие цитокины стимулируют переход моноцитов из фенотипа М0 в фенотип М1, который, являясь провоспалительным, вызывает воспаление и повреждение тканей [111]. Со временем моноциты эволюционируют до М2 фенотипа, который обладает уже противовоспалительным действием [111]. Истощение макрофагов и дендритных клеток в фазе восстановления несет ответственность за задержку восстановления [112, 113], а переход от фенотипа М1 к фенотипу М2 становится жизненно необходимым для регенерации почек, поддерживая пролиферацию клеток почечных канальцев и их функциональное восстановление [114, 115]. Но этот механизм не до конца понятен, но есть мнение, что в него вовлечены сигнальные пути DAMP. К примеру, нейтрофильные экстрацеллюлярные ловушки могут индуцировать переход к фенотипу М2 [106] в то время, когда аденозин поддерживает переход к противовоспалительным и ангиогенным М2 макрофагам, связываясь с рецепторами аденозина А2 (Рисунок 1) [107]. Micanovic and colleagues в своем недавнем исследовании нашли, что протеин Tamm-Horsfall может послужить триггером М2 поляризации макрофагов и снизить воспаление [116]. Но других исследований, которые были бы нацелены на изучение роли сигнальных DAMP в М2 поляризации макрофагов при септическом шоке, на сегодняшний момент не имеется.
Рецепторы распознавания паттернов
Врожденная иммунная система является важнейшим модулятором воспалительного ответа при инфекции и восстановлении тканей. Она представляет собой первую линию защиты хозяина, которая активируется с помощью нескольких классов рецепторов, распознававших паттерны, таких как мембранные рецепторы TLRs [117].
Агонисты TLR2
Почечные клетки-прогениторы (англ. Renal progenitor cells или RPCs), играют противоречивую роль в функциональном восстановлении почек. Maeshima et al.[118] исследовали роль этих клеток в «концепции регенерации почечных канальцев» после повреждения. RPC представляют собой коммитированные (клетка, приобретшая на ранних этапах развития способность дифференцироваться только в определенные типы клеток, т. е. уже определившаяся с областью своей специализации, но еще не дошедшая до последней стадии дифференцировки) клеток почечных канальцев, которые проявляют устойчивость к апоптотическим стимулам и проявляют регенеративный потенциал при повреждении ткани канальцев. Sallustio et al. [119] предположили, что после повреждения агонисты TLR2 DAMP (липотейхоевая кислота или зимозан) могут вызывать дифференциацию RPC, тем самым ускоряя процесс регенерации канальцев (Рис. 1). Следуя той же идее, в нескольких исследованиях сообщалось об использовании стромальных клеток костного мозга для частичной защиты почек от повреждений [120, 121]. Однако точная роль агонистов TLR2 в восстановлении почек в контексте сепсиса еще предстоит исследовать.
Агонисты TLR4
Роль TLR4 в управлении регенерации почек была показана совсем недавно. В in vitro модели ишемии/реперфузии Kulkarni et al. [122] показали, что сразу после повреждения стимуляция, вызванная TLR4, приводит к высвобождению IL-22 из дендритных клеток и макрофагов, что, в свою очередь, оказывается стимулом для начала регенерации почек. IL-22 является недавно открытым цитокином, принадлежащим к суперсемейству IL-10 [123], но его роль в повреждении почек и в последующей их регенерации все еще изучается, как, впрочем, и его точный вклад в процессы повреждения и регенерации почек при сепсис-индуцированном ОПП. В модели перитониального сепсиса Weber and colleagues показали, что блокирование IL-22 приводит к снижению органного повреждения и бактериальной нагрузке [124]. Такие расхождения результатов можно объяснить различным временем стимуляции IL-22. Действительно, достаточно давно известно, что стимуляция, опосредованная TLR4, играет роль в развитии повреждения почек во время острой фазы [125]. Недавние результаты показали, что блокирование TLR4 во время фазы восстановления может задержать регенерацию почечных канальцев (Рис. 1) [122]. Точные механизмы, с помощью которых передача сигналов TLR4 может опосредовать воспаление или регенерацию в зависимости от времени, еще предстоит выяснить.
Терапевтические перспективы
Молекулярные паттерны повреждения могут как способствовать снижению тяжести ОПП, так и ухудшать его течение, одновременно с этим быть вовлеченными в процессы регенерации ткани почек после повреждения. Модуляция сигнальных путей DAMP в целях контроля за иммунным ответом, как это показано на Рисунке 1, является полем для дальнейших исследований.
Анти-HMGB1
Начиная с того момента, когда внеклеточный HMGB1 был определён, как поздний провоспалительный медиатор при сепсисе, несколько исследований сосредоточили свои усилия на модуляции сигналов HMGB1, ведущих к снижению сепсис-индуцированного воспаления [126. 127]. В in vivo моделях сепсиса было показано, что HMGB1 может быть найден после 8 часов от первых клинических проявлений сепсиса, а его пиковые концентрации приходятся в период между 16 и 32 часами [128]. В CPL моделях сепсиса мыши, получившие лечение антителами к HMGB1, имели существенно более низкую летальность по сравнению с мышами CPL, которые такого лечения не получали [129]. Более важно то, что в этом исследовании было показано, что позднее введение антител к HMGB1 оказывало положительное влияние на течение шока, что делает такую стратегию интересной для лечения сепсиса у людей. Некоторые исследования показали, что терапевтическое вмешательство, нацеленное на воспаление, индуцированное HMGB1, может улучшить выживаемость животных моделей [130, 131]. В то же время, ни одно из этих исследований специально не оценивало степень воспаления в почках и частоту развития ОПП. Так что в настоящее время, несмотря на многообещающие результаты, мы можем констатировать, что эффективность применения такого подхода в клинической практике еще следует оценить.
Щелочная фосфатаза
Щелочная фосфатаза - эндогенный фермент, который оказывает детоксифицирующее действие путем дефосфорилирования как внеклеточного АТФ [132], так и эндотоксина [133], что и позволило предположить о терапевтических перспективах при лечении сепсис-индуцированного ОПП. Рекомбинантная щелочная фосфатаза уже показала свои возможности на доклинической фазе исследования [134], однако в рандомизированном контролируемом исследовании с участием 301 пациента лечение рекомбинантной щелочной фосфатазой не привело к значительному улучшению функции почек в краткосрочной перспективе [135]. Необходимы дополнительные исследования для того, чтобы прояснить влияние щелочной фосфатазы на долгосрочное восстановление почек, а также и на другие клинические исходы.
Расбуриказа (англ. Rasburicase)
Целеполагание на генерацию мочевой кислоты может представлять особый интерес при лечении сепсис-индуцированного ОПП. Механизм, за счет которого при сепсисе увеличивается уровень мочевой кислоты, остается не до конца ясным. Тяжелый сепсис сопровождается ишемией или гипоксией во многих органах, включая сюда и почки, что может активировать ксантиноксидазу в эндотелии с последующей продукцией мочевой кислоты [136].
В действительности при физиологических состояниях большая часть мочевой кислоты (2/3) экскретируется в мочу, а оставшаяся 1/3 экскретируется в кишечник. Избыточное высвобождение мочевой кислоты может послужить триггером воспалительного ответа, тем самым усилить ОПП. В свою очередь, ОПП со сниженным темпом диуреза может увеличить поступление мочевой кислоты в кровоток в связи с утратой экскреции ее в мочу [137]. В нескольких исследованиях пытались связать увеличение уровня мочевой кислоты в плазме и прогноз, и было сообщено об увеличении риска развития ОПП среди пациентов с увеличенным уровнем мочевой кислоты в крови [136, 138]. Но другие исследования, в которых использовался многофакторный анализ, не подтвердили вышеприведенные результаты [139]. И все же, мочевая кислота может вызвать ОПП благодаря множеству механизмов, от прямого токсического воздействия на почечные канальцы или индуцированной кристаллами нефропатии, до непрямого воздействия в виде высвобождения вазоактивных медиаторов и оксидативного стресса [136]. Так что в перспективе, терапия, направленная на снижение уровня мочевой кислоты при сепсисе, может представлять собой определенный интерес.
Заключение
В этом обзоре мы стремились предоставить подробную информацию о выявленных на сегодня DAMPs. Мы описали решающую роль этих DAMPs в развитии септического ОПП как как на начальном этапе, так в последующем в виде усиления патофизиологического воспалительного процесса. Кроме того, мы подчеркнули самые последние данные о восстановлении почечной функции после ОПП.
Фактически любой, отличный от нормального, уровень метаболита может быть DAMPs, но только сложные аналитические исследования могут выявить полный профиль DAMPs при множестве клинический состояниях, включая сюда и сепсис-индуцированное ОПП. Мы можем ожидать, что в скором времени может появиться терапевтическое вмешательство, направленное на ослабление передачи сигналов DAMPs при сильном стрессе. Но такое вмешательство, безусловно, не может сравниться по эффективности с предотвращением самой генерации DAMPs. И здесь важнейшее значение продолжает иметь устранение воспалительного агента [140] или контроль за источником.
Список литературы
1. Rubartelli A, Lotze MT. Inside, outside, upside down: damage-associated molecular-pattern molecules (DAMPs) and redox. Trends Immunol. (2007) 28:429–36. doi: 10.1016/j.it.2007.08.004
2. Gallo PM, Gallucci S. The dendritic cell response to classic, emerging, and homeostatic danger signals. implications for autoimmunity. Front Immunol. (2013) 4:138. doi: 10.3389/fimmu.2013.00138
3. Garg AD, Galluzzi L, Apetoh L, Baert T, Birge RB, Bravo-San Pedro JM, et al.
molecular and translational classifications of DAMPs in immunogenic cell death. Front Immunol. (2015) 6:588. doi: 10.3389/fimmu.2015.00588
4. Land WG, Agostinis P, Gasser S, Garg AD, Linkermann A. Transplantation and damage-associated molecular patterns (DAMPs). Am J Transplant. (2016) 16:3338–61. doi: 10.1111/ajt.13963
5. Yap SC, Lee HT, Warner DS. Acute kidney injury and extrarenal organ dysfunction new concepts and experimental evidence. Anesthesiology. (2012) 116:1139–48. doi: 10.1097/ALN.0b013e31824f951b
6. Mehta RL, Burdmann EA, Cerdá J, Feehally J, Finkelstein F, GarcíaGarcía G, et al. Recognition and management of acute kidney injury in the International Society of Nephrology 0by25 Global Snapshot: a multinational cross-sectional study. Lancet. (2016) 387:2017–25. doi: 10.1016/S0140-6736(16)30240-9
7. Bouchard J, Mehta RL. Acute kidney injury in western countries. Kidney Dis. (2016) 2:103–10. doi: 10.1159/000445091
8. Hsu RK, McCulloch CE, Dudley RA, Lo LJ, Hsu C. Temporal changes in incidence of dialysis-requiring AKI. J Am Soc Nephrol. (2012) 24:37–42. doi: 10.1681/ASN.2012080800
9. Lameire NH, Bagga A, Cruz D, De Maeseneer J, Endre Z, Kellum JA, et al.
Acute kidney injury: an increasing global concern. Lancet. (2013) 382:170–9. doi: 10.1016/S0140-6736(13)60647-9
10. Heung M, Faubel S, Watnick S, Cruz DN, Koyner JL, Mour G, et al. Outpatient dialysis for patients with AKI: a policy approach to improving care. Clin J Am Soc Nephrol. (2015) 10:1868–74. doi: 10.2215/CJN.02290215
11. Matzinger P. Tolerance, danger, and the extended family. Annu Rev Immunol. (1994) 12:991–1045. doi: 10.1146/annurev.iy.12.040194.005015
12. Bonventre JV, Yang L. Cellular pathophysiology of ischemic acute kidney injury. J Clin Invest. (2011) 121:4210–21. doi: 10.1172/JCI45161
13. Zarjou A, Agarwal A. Sepsis and acute kidney injury. J Am Soc Nephrol. (2011) 22:999–1006. doi: 10.1681/ASN.2010050484
14. Ratliff BB, Rabadi MM, Vasko R, Yasuda K, Goligorsky MS. Messengers without borders: mediators of systemic inflammatory response in AKI. J Am Soc Nephrol. (2013) 24:529–36. doi: 10.1681/ASN.2012060633
15. Marshak-Rothstein A, Rifkin IR. Immunologically active autoantigens: the role of toll-like receptors in the development of chronic inflammatory disease. Annu Rev Immunol. (2007) 25:419–41. doi: 10.1146/annurev.immunol.22.012703.104514
16. Waldner H. The role of innate immune responses in autoimmune disease development. Autoimmun Rev. (2009) 8:400–4. doi: 10.1016/j.autrev.2008.12.019
17. Rock KL, Latz E, Ontiveros F, Kono H. The sterile inflammatory response. Annu Rev Immunol. (2010) 28:321–42. doi: 10.1146/annurev-immunol-030409-101311
18. Anders H-J, Banas B, Schlöndorff D. Signaling danger: toll-like receptors and their potential roles in kidney disease. J Am Soc Nephrol. (2004) 15:854–67. doi: 10.1097/01.ASN.0000121781.89599.16
19. Zarbock A, Gomez H, Kellum JA. Sepsis-induced AKI revisited: pathophysiology, prevention and future therapies. Curr Opin Crit Care. (2014) 20:588–95. doi: 10.1097/MCC.0000000000000153
20. Takasu O, Gaut JP, Watanabe E, To K, Fagley RE, Sato B, et al. Mechanisms of cardiac and renal dysfunction in patients dying of sepsis. Am J Respir Crit Care Med. (2013) 187:509–17. doi: 10.1164/rccm.201211-1983OC
21. Gomez H, Ince C, De Backer D, Pickkers P, Payen D, Hotchkiss J, et al. A Unified theory of sepsis-induced acute kidney injury: inflammation, microcirculatory dysfunction, bioenergetics and the tubular cell adaptation to injury. Shock Augusta Ga. (2014) 41:3–11. doi: 10.1097/SHK.0000000000000052
22. Maiden MJ, Otto S, Brealey JK, Finnis ME, Chapman MJ, Kuchel TR, et al. Structure and function of the kidney in septic shock. A prospective controlled experimental study. Am J Respir Crit Care Med. (2016) 194:692–700. doi: 10.1164/rccm.201511-2285OC
23. Fani F, Regolisti G, Delsante M, Cantaluppi V, Castellano G, Gesualdo L, et al. Recent advances in the pathogenetic mechanisms of sepsis-associated acute kidney injury. J Nephrol. (2018) 31:351–9. doi: 10.1007/s40620-017-0452-4
24. Bellomo R, Kellum JA, Ronco C, Wald R, Martensson J, Maiden M, et al. Acute kidney injury in sepsis. Intensive Care Med. (2017) 43:816–28. doi: 10.1007/s00134-017-4755-7
25. Dellepiane S, Marengo M, Cantaluppi V. Detrimental cross-talk between sepsis and acute kidney injury: new pathogenic mechanisms, early biomarkers and targeted therapies. Crit Care. (2016) 20:61. doi: 10.1186/s13054-016-1219-3
26. Schrier RW, Abebe KZ, Perrone RD, Torres VE, Braun WE, Steinman TI, et al. Blood pressure in early autosomal dominant polycystic kidney disease. N Engl J Med. (2014) 371:2255–66. doi: 10.1056/NEJMoa14 02685
27. Prowle JR, Ishikawa K, May CN, Bellomo R. Renal blood flow during acute renal failure in man. Blood Purif. (2009) 28:216–25. doi: 10.1159/000230813
28. Di Giantomasso D, May CN, Bellomo R. Vital organ blood flow during hyperdynamic sepsis. Chest. (2003) 124:1053–9. doi: 10.1378/chest.124.3.1053
29. Chvojka J, Sykora R, Krouzecky A, Radej J, Varnerova V, Karvunidis T, et al. Renal haemodynamic, microcirculatory, metabolic and histopathological responses to peritonitis-induced septic shock in pigs. Crit Care Lond Engl. (2008) 12:R164. doi: 10.1186/cc7164
30. Hayes MA, Timmins AC, Yau EH, Palazzo M, Hinds CJ, Watson D. Elevation of systemic oxygen delivery in the treatment of critically ill patients. N Engl J Med. (1994) 330:1717–22. doi: 10.1056/NEJM1994061633 02404
31. de Roquetaillade C, Jamme M, Charpentier J, Chiche J-D, Cariou A, Mira J-P, et al. Hemodynamic impact of cardiovascular antihypertensive medications in patients with sepsis-related acute circulatory failure. Shock Augusta Ga. (2020) 54:315–20. doi: 10.1097/SHK.0000000000001524
32. Bernard GR, Wheeler AP, Russell JA, Schein R, Summer WR, Steinberg KP, et al. The effects of ibuprofen on the physiology and survival of patients with sepsis. The Ibuprofen in Sepsis Study Group. N Engl J Med. (1997) 336:912–8. doi: 10.1056/NEJM199703273361303
33. Lehr H-A, Bittinger F, Kirkpatrick CJ. Microcirculatory dysfunction in sepsis: a pathogenetic basis for therapy? J Pathol. (2000) 190:373–86. doi: 10.1002/(SICI)1096-9896(200002)190:3<373::AID-PATH593>3.0.CO;2-3
34. Christ F, Gamble J, Gartside IB, Kox WJ. Increased microvascular water permeability in patients with septic shock, assessed with venous congestion plethysmography (VCP). Intensive Care Med. (1998) 24:18–27. doi: 10.1007/s001340050509
35. Evans RG, Ince C, Joles JA, Smith DW, May CN, O’Connor PM, et al. Haemodynamic influences on kidney oxygenation: clinical implications of integrative physiology. Clin Exp Pharmacol Physiol. (2013) 40:106–22. doi: 10.1111/1440-1681.12031
36. Exline MC, Crouser ED. Mitochondrial mechanisms of sepsis-induced organ failure. Front Biosci J Virtual Libr. (2008) 13:5030–41.
37. Wang Z, Holthoff JH, Seely KA, Pathak E, Spencer HJ, Gokden N, et al. Development of oxidative stress in the peritubular capillary microenvironment mediates sepsis-induced renal microcirculatory failure and acute kidney injury. Am J Pathol. (2012) 180:505–16. doi: 10.1016/j.ajpath.2011.10.011
38. Bezemer R, Legrand M, Klijn E, Heger M, Post ICJH, Gulik TM van, et al. Real-time assessment of renal cortical microvascular perfusion heterogeneities using near-infrared laser speckle imaging. Opt Express. (2010) 18:15054–61. doi: 10.1364/OE.18.015054
39. Yan R, van Meurs M, Popa ER, Li R, Zwiers PJ, Zijlstra JG, et al. Early heterogenic response of renal microvasculature to hemorrhagic shock/resuscitation and the influence of NF-κB pathway blockade. Shock Augusta Ga. (2019) 51:200–12. doi: 10.1097/SHK.0000000000001126
40. Legrand M, Dupuis C, Simon C, Gayat E, Mateo J, Lukaszewicz A-C, et al. Association between systemic hemodynamics and septic acute kidney injury in critically ill patients: a retrospective observational study. Crit Care. (2013) 17:R278. doi: 10.1186/cc13133
41. Prowle JR, Kirwan CJ, Bellomo R. Fluid management for the prevention and attenuation of acute kidney injury. Nat Rev Nephrol. (2014) 10:37–47. doi: 10.1038/nrneph.2013.232
42. Zhang S, Weinberg S, DeBerge M, Gainullina A, Schipma M, Kinchen JM, et al. Efferocytosis fuels requirements of fatty acid oxidation and the electron transport chain to polarize macrophages for tissue repair. Cell Metab. (2019) 29:443–56.e5. doi: 10.1016/j.cmet.2018.12.004
43. Franklin EE, Robertson JD. Requirement of Apaf-1 for mitochondrial events and the cleavage or activation of all procaspases during genotoxic stress-induced apoptosis. Biochem J. (2007) 405(Pt 1):115–22. doi: 10.1042/BJ20061576
44. Ashkenazi A, Dixit VM. Death receptors: signaling and modulation. Science.
(1998) 281:1305–8. doi: 10.1126/science.281.5381.1305
45. Nakagawa T, Zhu H, Morishima N, Li E, Xu J, Yankner BA, et al. Caspase12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid-β. Nature. (2000) 403:98–103. doi: 10.1038/47513
46. Lassus P, Opitz-Araya X, Lazebnik Y. Requirement for Caspase-2 in stress-induced apoptosis before mitochondrial permeabilization. Science. (2002) 297:1352–4. doi: 10.1126/science.1074721
47. Huebener P, Pradere J-P, Hernandez C, Gwak G-Y, Caviglia JM, Mu X, et al.
The HMGB1/RAGE axis triggers neutrophil-mediated injury amplification following necrosis. Clin Invest. (2015) 125:539–50 doi: 10.1172/JCI76887
48. Morioka S, Maueröder C, Ravichandran KS. Living on the edge: efferocytosis at the interface of homeostasis and pathology. Immunity. (2019) 50:1149–62. doi: 10.1016/j.immuni.2019.04.018
49. Lerolle N, Nochy D, Guérot E, Bruneval P, Fagon J-Y, Diehl J-L, et al. Histopathology of septic shock induced acute kidney injury: apoptosis and leukocytic infiltration. Intensive Care Med. (2010) 36:471–8. doi: 10.1007/s00134-009-1723-x
50. Kosaka J, Lankadeva YR, May CN, Bellomo R. Histopathology of septic acute kidney injury: a systematic review of experimental data. Crit Care Med. (2016) 44:e897–903. doi: 10.1097/CCM.0000000000001735
51. Mariano F, Cantaluppi V, Stella M, Romanazzi GM, Assenzio B, Cairo M, et al. Circulating plasma factors induce tubular and glomerular alterations in septic burns patients. Crit Care. (2008) 12:R42. doi: 10.1186/cc6848
52. Sarhan M, von Mässenhausen A, Hugo C, Oberbauer R, Linkermann A. Immunological consequences of kidney cell death. Cell Death Dis. (2018) 9:114. doi: 10.1038/s41419-017-0057-9
53. Sureshbabu A, Patino E, Ma KC, Laursen K, Finkelsztein EJ, Akchurin O, et al. RIPK3 promotes sepsis-induced acute kidney injury via mitochondrial dysfunction. JCI Insight. (2018) 3:e98411. doi: 10.1172/jci.insight.98411
54. Leaf DE, Rajapurkar M, Lele SS, Mukhopadhyay B, Rawn JD, Frendl G, et al. Increased plasma catalytic iron in patients may mediate acute kidney injury and death following cardiac surgery. Kidney Int. (2015) 87:1046–54. doi: 10.1038/ki.2014.374
55. Yang WS, Stockwell BR. Ferroptosis: death by lipid peroxidation. Trends Cell Biol. (2016) 26:165–76. doi: 10.1016/j.tcb.2015.10.014
56. Yoon S, Kovalenko A, Bogdanov K, Wallach D. MLKL, the protein that mediates necroptosis, also regulates endosomal trafficking and extracellular vesicle generation. Immunity. (2017) 47:51–65.e7. doi: 10.1016/j.immuni.2017.06.001
57. Zhou W, Yuan J. Necroptosis in health and diseases. Semin Cell Dev Biol. (2014) 35:14–23. doi: 10.1016/j.semcdb.2014.07.013
58. Ding J, Wang K, Liu W, She Y, Sun Q, Shi J, et al. Pore-forming activity and structural autoinhibition of the gasdermin family. Nature. (2016) 535:111–6. doi: 10.1038/nature18590
59. Ostermann M, Liu K. Pathophysiology of AKI. Best Pract Res Clin Anaesthesiol. (2017) 31:305–14. doi: 10.1016/j.bpa.2017.09.001
60. Simon N, Hertig A. Alteration of fatty acid oxidation in tubular epithelial cells: from acute kidney injury to renal fibrogenesis. Front Med. (2015) 2:52. doi: 10.3389/fmed.2015.00052
61. Yang L, Besschetnova TY, Brooks CR, Shah JV, Bonventre JV. Epithelial cell cycle arrest in G2/M mediates kidney fibrosis after injury. Nat Med. (2010) 16:535–43. doi: 10.1038/nm.2144
62. Payen D, Lukaszewicz A-C, Legrand M, Gayat E, Faivre V, Megarbane B, et al. A multicentre study of acute kidney injury in severe sepsis and septic shock: association with inflammatory phenotype and HLA genotype. PLoS ONE. (2012) 7:e35838. doi: 10.1371/journal.pone.0035838
63. Imig JD, Ryan MJ. Immune and inflammatory role in renal disease. Compr Physiol. (2013) 3:957–76. doi: 10.1002/cphy.c120028
64. Herter JM, Rossaint J, Spieker T, Zarbock A. Adhesion molecules involved in neutrophil recruitment during sepsis-induced acute kidney injury. J Innate Immun. (2014) 6:597–606. doi: 10.1159/000358238
65. Umbro I, Gentile G, Tinti F, Muiesan P, Mitterhofer AP. Recent advances in pathophysiology and biomarkers of sepsis-induced acute kidney injury. J Infect. (2016) 72:131–42. doi: 10.1016/j.jinf.2015.11.008
66. Tang D, Kang R, Coyne CB, Zeh HJ, Lotze MT. PAMPs and DAMPs: signal 0s that spur autophagy and immunity. Immunol Rev. (2012) 249:158–75. doi: 10.1111/j.1600-065X.2012.01146.x
67. Tonnus W, Gembardt F, Latk M, Parmentier S, Hugo C, Bornstein SR, et al. The clinical relevance of necroinflammation—highlighting the importance of acute kidney injury and the adrenal glands. Cell Death Differ. (2019) 26:68–82. doi: 10.1038/s41418-018-0193-5
68. Sundén-Cullberg J, Norrby-Teglund A, Rouhiainen A, Rauvala H, Herman G, Tracey KJ, et al. Persistent elevation of high mobility group box-1 protein (HMGB1) in patients with severe sepsis and septic shock. Crit Care Med. (2005) 33:564–73. doi: 10.1097/01.CCM.0000155991.88802.4D
69. Ekaney ML, Otto GP, Sossdorf M, Sponholz C, Boehringer M, Loesche W, et al. Impact of plasma histones in human sepsis and their contribution to cellular injury and inflammation. Crit Care. (2014) 18:543. doi: 10.1186/s13054-014-0543-8
70. Sursal T, Stearns-Kurosawa DJ, Itagaki K, Oh S-Y, Sun S, Kurosawa S, et al. Plasma bacterial and mitochondrial DNA distinguish bacterial sepsis from sterile SIRS and quantify inflammatory tissue injury in nonhuman primates. Shock Augusta Ga. (2013) 39:55–62. doi: 10.1097/SHK.0b013e3182 76f4ca
71. Gentile LF, Moldawer LL. DAMPS, PAMPS and the origins of SIRS in bacterial sepsis. Shock Augusta Ga. (2013) 39:113–4. doi: 10.1097/SHK.0b013e318277109c
72. Murugan R, Karajala-Subramanyam V, Lee M, Yende S, Kong L, Carter M, et al. Acute kidney injury in non-severe pneumonia is associated with an increased immune response and lower survival. Kidney Int. (2010) 77:527–35. doi: 10.1038/ki.2009.502
73. Messmer D, Yang H, Telusma G, Knoll F, Li J, Messmer B, et al. High mobility group box protein 1: an endogenous signal for dendritic cell maturation and Th1 polarization. J Immunol. (2004) 173:307–13. doi: 10.4049/jimmunol.173.1.307
74. Leelahavanichkul A, Huang Y, Hu X, Zhou H, Tsuji T, Chen R, et al. Chronic kidney disease-induced HMGB1 elevation worsens sepsis and sepsis-induced acute kidney injury. Kidney Int. (2011) 80:1198–211. doi: 10.1038/ki.2011.261
75. Vénéreau E, Ceriotti C, Bianchi ME. DAMPs from cell death to new life. Front Immunol. (2015) 6:422. doi: 10.3389/fimmu.2015.00422
76. Schiraldi M, Raucci A, Muñoz LM, Livoti E, Celona B, Venereau E, et al. HMGB1 promotes recruitment of inflammatory cells to damaged tissues by forming a complex with CXCL12 and signaling via CXCR4. J Exp Med. (2012) 209:551–63. doi: 10.1084/jem.20111739
77. Kazama H, Ricci J-E, Herndon JM, Hoppe G, Green DR, Ferguson TA. Induction of immunological tolerance by apoptotic cells requires caspasedependent oxidation of high-mobility group box-1 protein. Immunity. (2008) 29:21–32. doi: 10.1016/j.immuni.2008.05.013
78. Bell CW, Jiang W, Reich CF, Pisetsky DS. The extracellular release of HMGB1 during apoptotic cell death. Am J Physiol Cell Physiol. (2006) 291:C1318–25. doi: 10.1152/ajpcell.00616.2005
79. Qin S, Wang H, Yuan R, Li H, Ochani M, Ochani K, et al. Role of HMGB1 in apoptosis-mediated sepsis lethality. J Exp Med. (2006) 203:1637–42. doi: 10.1084/jem.20052203
80. Allam R, Scherbaum CR, Darisipudi MN, Mulay SR, Hägele H, Lichtnekert J, et al. Histones from dying renal cells aggravate kidney injury via TLR2 and TLR4. J Am Soc Nephrol. (2012) 23:1375–88. doi: 10.1681/ASN.2011111077
81. Nakazawa D, Kumar SV, Marschner J, Desai J, Holderied A, Rath L, et al. Histones and neutrophil extracellular traps enhance tubular necrosis and remote organ injury in ischemic AKI. J Am Soc Nephrol. (2017) 28:1753–68. doi: 10.1681/ASN.2016080925
82. Xu J, Zhang X, Pelayo R, Monestier M, Ammollo CT, Semeraro F, et al. Extracellular histones are major mediators of death in sepsis. Nat Med. (2009) 15:1318–21. doi: 10.1038/nm.2053
83. Moreth K, Frey H, Hubo M, Zeng-Brouwers J, Nastase M-V, Hsieh LTH, et al. Biglycan-triggered TLR-2- and TLR-4-signaling exacerbates the pathophysiology of ischemic acute kidney injury. Matrix Biol J Int Soc Matrix Biol. (2014) 35:143–51. doi: 10.1016/j.matbio.2014.01.010
84. Babelova A, Moreth K, Tsalastra-Greul W, Zeng-Brouwers J, Eickelberg O, Young MF, et al. Biglycan, a danger signal that activates the NLRP3 inflammasome via Toll-like and P2X receptors. J Biol Chem. (2009) 284:24035–48. doi: 10.1074/jbc.M109.014266
85. Schaefer L, Babelova A, Kiss E, Hausser H-J, Baliova M, Krzyzankova M, et al.
The matrix component biglycan is proinflammatory and signals throughToll-like receptors 4 and 2 in macrophages. J Clin Invest. (2005) 115:2223–33. doi: 10.1172/JCI23755
86. Schaefer L, Macakova K, Raslik I, Micegova M, Gröne H-J, Schönherr E, et al. Absence of decorin adversely influences tubulointerstitial fibrosis of the obstructed kidney by enhanced apoptosis and increased inflammatory reaction. Am J Pathol. (2002) 160:1181–91. doi: 10.1016/S0002-9440(10)64937-1
87. Merline R, Moreth K, Beckmann J, Nastase MV, Zeng-Brouwers J, Tralhão JG, et al. Signaling by the matrix proteoglycan decorin controls inflammation and cancer through PDCD4 and microRNA-21. Sci Signal. (2011) 4:ra75. doi: 10.1126/scisignal.2001868
88. Jansen MPB, Pulskens WP, Butter LM, Florquin S, Juffermans NP, Roelofs JJTH, et al. Mitochondrial DNA is released in urine of SIRS patients with acute kidney injury and correlates with severity of renal dysfunction. Shock. (2018) 49:301–10. doi: 10.1097/SHK.0000000000000967
89. Shi C, Kim T, Steiger S, Mulay SR, Klinkhammer BM, Bäuerle T, et al. Crystal clots as therapeutic target in cholesterol crystal embolism. Circ Res. (2020) 126:e37–52. doi: 10.1161/CIRCRESAHA.119.315625
90. Tsuji N, Tsuji T, Ohashi N, Kato A, Fujigaki Y, Yasuda H. Role of mitochondrial DNA in septic AKI via Toll-like receptor 9. J Am Soc Nephrol. (2016) 27:2009–20. doi: 10.1681/ASN.2015040376
91. El-Achkar TM, Wu XR. Uromodulin in kidney injury: an instigator, bystander, or protector? Am J Kidney Dis. (2012) 59:452–61. doi: 10.1053/j.ajkd.2011.10.054
92. Säemann MD, Weichhart T, Zeyda M, Staffler G, Schunn M, Stuhlmeier KM, et al. Tamm-Horsfall glycoprotein links innate immune cell activation with adaptive immunity via a Toll-like receptor-4–dependent mechanism. J Clin Invest. (2005) 115:468–75. doi: 10.1172/JCI200522720
93. Darisipudi MN, Thomasova D, Mulay SR, Brech D, Noessner E, Liapis H, et al. Uromodulin triggers IL-1β-dependent innate immunity via the NLRP3 inflammasome. J Am Soc Nephrol. (2012) 23:1783–9. doi: 10.1681/ASN.2012040338
94. Feldman N, Rotter-Maskowitz A, Okun E. DAMPs as mediators of sterile inflammation in aging-related pathologies. Ageing Res Rev. (2015) 24:29–39. doi: 10.1016/j.arr.2015.01.003
95. Muller William A. Mechanisms of transendothelial migration of leukocytes. Circ Res. (2009) 105:223–30. doi: 10.1161/CIRCRESAHA.109.200717
96. Anders H-J. Toll-like receptors and danger signaling in kidney injury. J Am Soc Nephrol. (2010) 21:1270–4. doi: 10.1681/ASN.2010030233
97. McDonald B, Pittman K, Menezes GB, Hirota SA, Slaba I, Waterhouse CCM, et al. Intravascular danger signals guide neutrophils to sites of sterile inflammation. Science. (2010) 330:362–6. doi: 10.1126/science.1195491
98. Krausgruber T, Blazek K, Smallie T, Alzabin S, Lockstone H, Sahgal N, et al. IRF5 promotes inflammatory macrophage polarization and T H 1-T H 17 responses. Nat Immunol. (2011) 12:231–8. doi: 10.1038/ni.1990
99. Sorokin L. The impact of the extracellular matrix on inflammation. Nat Rev Immunol. (2010) 10:712–23. doi: 10.1038/nri2852
100. Anders H-J, Ryu M. Renal microenvironments and macrophage phenotypes determine progression or resolution of renal inflammation and fibrosis. Kidney Int. (2011) 80:915–25. doi: 10.1038/ki.2011.217
101. Singbartl K, Bishop JV, Wen X, Murugan R, Chandra S, Filippi M-D, et al. Differential effects of kidney–lung cross-talk during acute kidney injury and bacterial pneumonia. Kidney Int. (2011) 80:633–44. doi: 10.1038/ki.2011.20
102. Al-Harbi NO, Nadeem A, Ahmad SF, Alanazi MM, Aldossari AA, Alasmari F. Amelioration of sepsis-induced acute kidney injury through inhibition of inflammatory cytokines and oxidative stress in dendritic cells and neutrophils respectively in mice: role of spleen tyrosine kinase signaling. Biochimie. (2019) 158:102–10. doi: 10.1016/j.biochi.2018.12.014
103. Anders H-J, Schaefer L. Beyond tissue injury—damage-associated molecular patterns, Toll-like receptors, and inflammasomes also drive regeneration and fibrosis. J Am Soc Nephrol. (2014) 25:1387–400. doi: 10.1681/ASN.2014010117
104. Mulay SR, Linkermann A, Anders H-J. Necroinflammation in kidney disease. J Am Soc Nephrol. (2016) 27:27–39. doi: 10.1681/ASN.2015040405
105. Wu H, Ma J, Wang P, Corpuz TM, Panchapakesan U, Wyburn KR, et al. HMGB1 contributes to kidney ischemia reperfusion injury. J Am Soc Nephrol. (2010) 21:1878–90. doi: 10.1681/ASN.2009 101048
106. Nakazawa D, Shida H, Kusunoki Y, Miyoshi A, Nishio S, Tomaru U, et al.
The responses of macrophages in interaction with neutrophils that undergo NETosis. J Autoimmun. (2016) 67:19–28. doi: 10.1016/j.jaut.2015.08.018
107. Leibovich SJ, Chen J-F, Pinhal-Enfield G, Belem PC, Elson G, Rosania A, et al.
Synergistic up-regulation of vascular endothelial growth factor expression in murine macrophages by adenosine A2A receptor agonists and endotoxin. Am J Pathol. (2002) 160:2231–44. doi: 10.1016/S0002-9440(10)61170-4
108. Lazzeri E, Angelotti ML, Peired A, Conte C, Marschner JA, Maggi L, et al. Endocycle-related tubular cell hypertrophy and progenitor proliferation recover renal function after acute kidney injury. Nat Commun. (2018) 9:1344. doi: 10.1038/s41467-018-03753-4
109. Edgar BA, Zielke N, Gutierrez C. Endocycles: a recurrent evolutionary innovation for post-mitotic cell growth. Nat Rev Mol Cell Biol. (2014) 15:197–210. doi: 10.1038/nrm3756
110. Liu KD. Molecular mechanisms of recovery from acute renal failure. Crit Care Med. (2003) 31(8 Suppl.):S572–81. doi: 10.1097/01.CCM.0000081592.36382.BC
111. Meng X-M, Tang PM-K, Li J, Lan HY. Macrophage phenotype in kidney injury and repair. Kidney Dis. (2015) 1:138–46. doi: 10.1159/000431214
112. Lee S, Huen S, Nishio H, Nishio S, Lee HK, Choi B-S, et al. Distinct macrophage phenotypes contribute to kidney injury and repair. J Am Soc Nephrol. (2011) 22:317–26. doi: 10.1681/ASN.2009060615
113. Werner S, Grose R. Regulation of wound healing by growth factors and cytokines. Physiol Rev. (2003) 83:835–70. doi: 10.1152/physrev.2003.83.3.835
114. Li X, Mu G, Song C, Zhou L, He L, Jin Q, et al. Role of M2 Macrophages in sepsis-induced acute kidney injury. Shock. (2018) 50:233–9. doi: 10.1097/SHK.0000000000001006
115. Zhang M-Z, Yao B, Wang S, Fan X, Wu G, Yang H, et al. Intrarenal dopamine deficiency leads to hypertension and decreased longevity in mice. J Clin Invest. (2011) 121:2845–54. doi: 10.1172/JCI57324
116. Micanovic R, Khan S, Janosevic D, Lee ME, Hato T, Srour EF, et al. Tammhorsfall protein regulates mononuclear phagocytes in the kidney. J Am Soc Nephrol. (2018) 29:841–56. doi: 10.1681/ASN.2017040409
117. Wang Y, Zhang Y. Kidney and innate immunity. Immunol Lett. (2017) 183:73–8. doi: 10.1016/j.imlet.2017.01.011
118. Angelotti ML, Ronconi E, Ballerini L, Peired A, Mazzinghi B, Sagrinati C, et al. Characterization of renal progenitors committed toward tubular lineage and their regenerative potential in renal tubular injury. Stem Cells. (2012) 30:1714–25. doi: 10.1002/stem.1130
119. Sallustio F, Benedictis LD, Castellano G, Zaza G, Loverre A, Costantino V, et al. TLR2 plays a role in the activation of human resident renal stem/progenitor cells. FASEB J. (2010) 24:514–25. doi: 10.1096/fj.09-136481
120. Morigi M, Imberti B, Zoja C, Corna D, Tomasoni S, Abbate M, et al. Mesenchymal stem cells are renotropic, helping to repair the kidney and improve function in acute renal failure. J Am Soc Nephrol. (2004) 15:1794–804. doi: 10.1097/01.ASN.0000128974.07460.34
121. Humphreys BD, Bonventre JV. Mesenchymal stem cells in acute kidney injury. Annu Rev Med. (2008) 59:311–25. doi: 10.1146/annurev.med.59.061506.154239
122. Kulkarni OP, Hartter I, Mulay SR, Hagemann J, Darisipudi MN, Kumar VR S, et al. Toll-like receptor 4–induced IL-22 accelerates kidney regeneration. J Am Soc Nephrol. (2014) 25:978–89. doi: 10.1681/ASN.2013050528
123. Dudakov JA, Hanash AM, van den Brink MRM. Interleukin-22: immunobiology and pathology. Annu Rev Immunol. (2015) 33:747–85. doi: 10.1146/annurev-immunol-032414-112123
124. Weber GF, Schlautkötter S, Kaiser-Moore S, Altmayr F, Holzmann B, Weighardt H. Inhibition of interleukin-22 attenuates bacterial load and organ failure during acute polymicrobial sepsis. Infect Immun. (2007) 75:1690–7. doi: 10.1128/IAI.01564-06
125. Anderberg SB, Luther T, Frithiof R. Physiological aspects of Toll-like receptor 4 activation in sepsis-induced acute kidney injury. Acta Physiol. (2017) 219:575–90. doi: 10.1111/apha.12798
126. Yang H, Wang H, Andersson U. Targeting inflammation driven by HMGB1. Front Immunol. (2020) 11:484. doi: 10.3389/fimmu.2020.00484
127. Gentile LF, Moldawer LL. HMGB1 as a therapeutic target for sepsis: it’s all in the timing! Expert Opin Ther Targets. (2014) 18:243–5. doi: 10.1517/14728222.2014.883380
128. Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, et al.
HMG-1 as a late mediator of endotoxin lethality in mice. Science. (1999) 285:248–51. doi: 10.1126/science.285.5425.248
129. Yang H, Ochani M, Li J, Qiang X, Tanovic M, Harris HE, et al. Reversing established sepsis with antagonists of endogenous high-mobility group box 1. Proc Natl Acad Sci USA. (2004) 101:296–301. doi: 10.1073/pnas.24346 51100
130. Yang H, Wang H, Ju Z, Ragab AA, Lundbäck P, Long W, et al. MD-2 is required for disulfide HMGB1–dependent TLR4 signaling. J Exp Med. (2015) 212:5–14. doi: 10.1084/jem.20141318
131. Li W, Ashok M, Li J, Yang H, Sama AE, Wang H. A major ingredient of green tea rescues mice from lethal sepsis partly by inhibiting HMGB1. PLoS ONE. (2007) 2:e1153. doi: 10.1371/journal.pone.0001153
132. Picher M, Burch LH, Hirsh AJ, Spychala J, Boucher RC. Ecto 5 -nucleotidase and nonspecific alkaline phosphatase two AMP-hydrolysing ectoenzymes with distinct roles in human airways. J Biol Chem. (2003) 278:13468–79. doi: 10.1074/jbc.M300569200
133. Koyama I, Matsunaga T, Harada T, Hokari S, Komoda T. Alkaline phosphatases reduce toxicity of lipopolysaccharides in vivo and in vitro through dephosphorylation. Clin Biochem. (2002) 35:455–61. doi: 10.1016/S0009-9120(02)00330-2
134. Peters E, Masereeuw R, Pickkers P. The potential of alkaline phosphatase as a treatment for sepsis-associated acute kidney injury. Nephron Clin Pract. (2014) 127:144–8. doi: 10.1159/000363256
135. Pickkers P, Mehta RL, Murray PT, Joannidis M, Molitoris BA, Kellum JA, et al. Effect of human recombinant alkaline phosphatase on 7-day creatinine clearance in patients with sepsis-associated acute kidney injury: a randomized clinical trial. JAMA. (2018) 320:1998–2009. doi: 10.1001/jama.2018.14283
136. Akbar SR, Long DM, Hussain K, Alhajhusain A, Ahmed US, Iqbal HI, et al. Hyperuricemia: an early marker for severity of illness in sepsis. Int J Nephrol. (2015) 2015:301021. doi: 10.1155/2015/301021
137. Hahn K, Kanbay M, Lanaspa MA, Johnson RJ, Ejaz AA. Serum uric acid and acute kidney injury: a mini review. J Adv Res. (2017) 8:529–36. doi: 10.1016/j.jare.2016.09.006
138. Pehlivanlar-Kucuk M, Kucuk AO, Ozturk CE, Er MC, Ulger F. The association between serum uric acid level and prognosis in critically ill patients, uric acid as a prognosis predictor. Clin Lab. (2018) 64:1491–500. doi: 10.7754/Clin.Lab.2018.180334
139. Srivastava A, Palsson R, Leaf DE, Higuera A, Chen ME, Palacios P, et al. Uric acid and acute kidney injury in the critically ill. Kidney Med. (2019) 1:21–30. doi: 10.1016/j.xkme.2019.01.003
140. Patel S. Danger-associated molecular patterns (DAMPs): the derivatives and triggers of inflammation. Curr Allergy Asthma Rep. (2018) 18:63. doi: 10.1007/s11882-018-0817-3
Frontiers in Immunology | www.frontiersin.org