Array
(
[NAME] => Разработка и проверка новых субфенотипов сепсиса с использованием траекторий основных показателей жизнедеятельности
[~NAME] => Разработка и проверка новых субфенотипов сепсиса с использованием траекторий основных показателей жизнедеятельности
[PREVIEW_PICTURE] => Array
(
[ID] => 5078
[TIMESTAMP_X] => 11.11.2024 15:27:09
[MODULE_ID] => iblock
[HEIGHT] => 493
[WIDTH] => 877
[FILE_SIZE] => 62434
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/c7f/kr12k42mpv5wevsmw1y8gxbxoa85v84l
[FILE_NAME] => closeup-scientist-doctor-looking-into-medical-microscope-analyzing-blood-sample-during-scientific-experiment-biochemistry-laboratory-researcher-man-developing-vaccine-against-covid19.jpg
[ORIGINAL_NAME] => closeup-scientist-doctor-looking-into-medical-microscope-analyzing-blood-sample-during-scientific-experiment-biochemistry-laboratory-researcher-man-developing-vaccine-against-covid19.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => f3132976644484bae4ca12e8bf5e0457
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/c7f/kr12k42mpv5wevsmw1y8gxbxoa85v84l/closeup-scientist-doctor-looking-into-medical-microscope-analyzing-blood-sample-during-scientific-experiment-biochemistry-laboratory-researcher-man-developing-vaccine-against-covid19.jpg
[UNSAFE_SRC] => /upload/iblock/c7f/kr12k42mpv5wevsmw1y8gxbxoa85v84l/closeup-scientist-doctor-looking-into-medical-microscope-analyzing-blood-sample-during-scientific-experiment-biochemistry-laboratory-researcher-man-developing-vaccine-against-covid19.jpg
[SAFE_SRC] => /upload/iblock/c7f/kr12k42mpv5wevsmw1y8gxbxoa85v84l/closeup-scientist-doctor-looking-into-medical-microscope-analyzing-blood-sample-during-scientific-experiment-biochemistry-laboratory-researcher-man-developing-vaccine-against-covid19.jpg
[ALT] => Разработка и проверка новых субфенотипов сепсиса с использованием траекторий основных показателей жизнедеятельности
[TITLE] => Разработка и проверка новых субфенотипов сепсиса с использованием траекторий основных показателей жизнедеятельности
)
[~PREVIEW_PICTURE] => 5078
[DETAIL_TEXT] =>
Bhavani SV, Semle M, Qian ET et al. Development and validation of novel sepsis subphenotypes using trajectories ofvital signs.
Разработка и проверка новых субфенотипов сепсиса с использованием траекторий основных показателей жизнедеятельности.
Intensive Care Med https://doi.org/10.1007/s00134-022-06890-z
Абстракт
Сепсис является гетерогенным синдромом, и идентификация субфенотипов имеет важное значение. В этом исследовании использовались траектории основных показателей жизнедеятельности для разработки и проверки субфенотипов и изучалось взаимодействие субфенотипов с лечением на основании данных рандомизированных контролируемых испытаний. Были включены все пациенты с подозрением на инфекцию, поступившие в четыре академических госпиталя Emory Healthcare в период с 2014–2017 гг. (основная группа) и 2018–2019 гг. (группа сравнения). Групповое моделирование траектории применялось к показателям жизненно важных функций с первых 8 часов госпитализации для разработки и проверки субфенотипов на основании траекторий жизненно важных функций. Ассоциации между субфенотипами и исходами оценивались у пациентов с сепсисом. Взаимодействие между субфенотипом и лечением сбалансированными кристаллоидами по сравнению с физиологическим раствором было проверено во вторичном анализе SMART (Isotonic Solutions and Major AdverseRenal Events Trial). Включено 12 473 пациента с подозрением на инфекцию в основную группу и 8256 пациентов в группу сравнения, и было обнаружено 4 субфенотипа жизненно важных функций. В группе А (N=3483, 28%) выявлены гипертермия, тахикардия, тахипноэ и гипотензия. В группе В (N=1578, 13%) была гипертермия, тахикардия, тахипноэ (не такие выраженная, как группа А) , а также гипертенизия. Группы C (N= 4044, 32%) и D(N= 3368, 27%) имели более низкую температуру, частоту сердечных сокращений и частоту дыхания, причем группа C была нормотензивной, а группа D гипотензивной. Среди 6919 пациентов с сепсисом группы А и В были моложе, а группы С и D — старше. В группе А была самая низкая распространенность застойной сердечной недостаточности, гипертонии, сахарного диабета и хронической болезни почек, в то время как в группе В была самая высокая распространенность данных состояний. В группах A и D чаще всего использовались вазопрессоры (p < 0,001 для всех вышеприведенных анализов). В логистической регрессии 30-дневная смертность была значительно выше в группах А и D (p < 0,001 и p = 0,03 соответственно). В исследовании SMART субфенотип значительно модифицировал эффект лечения (p = 0,03). Группа D имела значительно более низкие шансы смертности при использовании сбалансированных кристаллоидов по сравнению с физиологическим раствором (отношение шансов (ОШ) 0,39, 95% доверительный интервал (ДИ) 0,23–0,67, р <0,001). Субфенотипы сепсиса, основанные на траектории основных показателей жизнедеятельности, были одинаковыми в когортах, имели различные исходы и разные ответы на лечение сбалансированными кристаллоидами по сравнению с физиологическим раствором.
Take‐home message
В многоцентровом ретроспективном анализе 20 729 госпитализированных пациентов с подозрением на инфекцию были выявлены четыре субфенотипа, соответствующие различным траекториям основных показателей жизнедеятельности в течение первых 8 часов госпитализации. Эти субфенотипы траектории жизненно важных функций имели различные исходные клинические характеристики, лабораторные отклонения, профили дисфункции органов и исходы. Во вторичном анализе рандомизированного контрольного исследования SMARTсубфенотип значительно изменил влияние внутривенного введения жидкости на смертность. Четыре субфенотипа сепсиса, основанные на общедоступных показателях жизненно важных функций, могут иметь разный ответ на лечение и могут способствовать точному включению в последующие клинические исследования.
Введение
Сепсис представляет собой гетерогенный синдром, характеризующийся нерегулируемой реакцией хозяина на инфекцию, что ежегодно приводит к 270 000 смертей и расходам на лечение в госпитальном секторе США на сумму 60 миллиардов долларов [1–3]. Десятилетия клинических испытаний не выявили методов лечения, которые бы постоянно приносили пользу пациентам с сепсисом в целом [4]. Предполагается, что эти отрицательные результаты возникают из-за вариабельности реакции пациентов на лечение [5]. Таким образом, разделение гетерогенного синдрома сепсиса на отдельные «физиологические интересующие состояния» может привести к прецизионной терапии, нацеленной на корригируемые симптомы [6].
Предыдущие исследования выявили от двух до шести подфенотипов сепсиса путем применения неконтролируемых подходов, таких как анализ k-средних и латентного класса, к клиническим данным и биомаркерам из электронных медицинских карт и рандомизированных контрольных исследований [7–11]. Большинство исследований идентифицировали субфенотипы с использованием статических измерений биомаркеров или основных показателей жизнедеятельности. Однако сепсис представляет собой динамический процесс с биологическими и физиологическими реакциями, которые развиваются от нескольких минут до нескольких часов [12–14]. Эта «временная нестабильность» сепсиса предполагает, что статические данные лабораторных и жизненно важных органов могут не идентифицировать субфенотипы, которые динамически изменяются во времени [15–19].
Использование лонгитюдных данных может более точно идентифицировать субфенотипы сепсиса, которые различаются по клиническим характеристикам, исходам и ответам на лечение [20–24]. Кроме того, рутинные измерения у постели больного, такие как показатели жизненно важных функций, могут позволить повысить точность оценки при включении пациента в клинические испытания.
Большинство моделей субфенотипов разрабатываются с использованием данных пациентов, поступивших в отделение неотложной помощи с установленной дисфункцией органов и сепсисом. Однако это исключает информативные данные о пациента с инфекцией, у которых позже во время госпитализации разовьется сепсис. Чтобы разработать модель субфенотипа для предполагаемого внедрения в отделение неотложной помощи, модель в идеале должна быть обобщаемой и применимой ко всем пациентам с инфекцией, потому что на момент представления будет неясно, какие пациенты в дальнейшем будут соответствовать формальным критериям сепсиса. Это исследование было разработано с учетом перспективного внедрения, и поэтому мы решили разработать и проверить модель субфенотипа сепсиса у всех пациентов с подозрением на инфекцию, а затем оценить эффективность модели конкретно у пациентов с сепсисом.
Цели этого исследования состояли в том, чтобы: (1) разработать и обосновать динамические субфенотипы у пациентов с инфекцией с использованием показателей жизнедеятельности (температура, частота сердечных сокращений, частота дыхания и артериальное давление), измеренных в течение первых 8 часов госпитализации; (2) оценить клинические характеристики и исходы субфенотипов жизненно важных функций у пациентов с сепсисом; (3) проверить, изменяет ли субфенотип влияние лечения сбалансированными кристаллоидами по сравнению с физиологическим раствором на смертность у пациентов с сепсисом, используя данные рандомизированного контролируемого исследования [25].
Методы
Дизайн исследования
Первая часть исследования представляла собой ретроспективное обсервационное исследование, проведенное в системе Emory Healthcare для разработки и проверки субфенотипов траектории жизненно важных функций. Вторая часть исследования представляла собой вторичный анализ данных на уровне пациентов, полученных в ходе исследования SMART, проведенного в Vanderbilt University Medical Center. Ретроспективное обсервационное исследование было одобрено Emory Institutional Review Board с отказом от информированного согласия, а вторичный анализ обезличенных данных из РКИ был сочтен Emory IRB исследованием без участия людей (STUDY00001815).
Изучаемая когорта
В обсервационном исследовании все взрослые пациенты, поступившие через отделение неотложной помощи в четыре больницы системы Emory Healthcare в период с января 2014 г. по декабрь 2019 г., имели право на включение в исследование. Пациенты с подозрением на инфекцию были идентифицированы в электронной медицинской карте на основании использования антибиотиков (перорально или парентерально) и сбора культур биологических жидкостей (кровь, моча или спинномозговая жидкость) для микробиологического исследования [8], при этом когорта дополнительно ограничивалась пациентами, которые получали антибиотики в течение 6 часов после поступления. Пациенты, которые умерли или были выписаны в течение первых 8 часов, были исключены, поскольку при анализе использовались показатели жизненно важных функций в первые 8 часов госпитализации. Пациенты, переведенные в другие больницы, были исключены из-за неполной информации о результатах. Наконец, пациенты с менее, чем тремя полными наборами показателей жизнедеятельности в первые 8 часов, были исключены, поскольку разработка модели требует многократных измерений.
Многоцентровые когорты пациентов с подозрением на инфекцию были разделены на обучающую и валидационную выборки по годам поступления, причем госпитализированные в период с 2014 по 2017 г. были разделены на обучающие, а госпитализированные в период с 2018 по 2019 г. — на валидационные.
Разная во времени когорта валидации была разработана для имитации предполагаемой реализации модели субфенотипа в четырех больницах для проверки обобщаемости. Учитывая цель эмулировать проспективное внедрение, когда у нас не было бы информации о том, будет ли пациент соответствовать формальным критериям сепсиса, мы разработали и утвердили модель субфенотипа для всех пациентов, поступающих в отделение неотложной помощи с подозрением на инфекцию.
Измерение основных показателей жизнедеятельности
Были включены оральная температура, частота сердечных сокращений, частота дыхания, систолическое и диастолическое артериальное давление за первые 8 часов поступления в стационар. Ошибочные записи основных показателей жизнедеятельности были идентифицированы и исключены в соответствии с предыдущими публикациями [26]. Данные о жизненно важных показателях были разделены на восемь часовых блоков времени. Для отсутствующих показателей жизнедеятельности (т. е. показателей жизнедеятельности, измеренных в определенный час) процесс условного исчисления не применялся, поскольку описанный ниже алгоритм групповой траекторной модели (GBTM) обрабатывает отсутствующие данные посредством оценки правдоподобия. Если в течение 1 часа были доступны несколько измерений, для анализа использовалось среднее значение. Все жизненные показатели в обучающей и валидационной когорте были стандартизированы по среднему значению и стандартному отклонению этого жизненного показателя в этой когорте.
Разработка и проверка групповой модели траектории
Алгоритм GBTM был применен к данным жизненно важных органов в обучающей когорте. GBTMпредставляет собой приложение моделирования конечных данных и используется для идентификации групп людей, следующих по сходным траекториям переменных во времени [27, 28]. Алгоритм вычисляет базовые коэффициенты для полиномиальных функций, описывающих траектории основных показателей жизнедеятельности во времени для каждой из групп. Перед подгонкой модели мы использовали тестирование отношения правдоподобия, чтобы определить наиболее подходящую полиномиальную форму для каждого жизненно важного признака (т. е. линейную или квадратичную). Используя GBTM, мы заранее определили выбранные полиномиальные формы для каждого жизненно важного признака и протестировали двух-, трех-, четырех-, пяти- и шестигрупповые модели. Полученные модели с разным количеством субфенотипов сравнивались с использованием: (1) байесовских информационных критериев (BIC) — показателя того, насколько хорошо модель соответствует данным, со штрафом за возрастающую сложность, и (2) распределения по подгруппам — если один или более субфенотипов содержали менее пяти процентов когорты, модель не подходила для отбора.
После выбора оптимальной модели пациентам присваивался субфенотип, для которого у них была наибольшая вероятность принадлежности к группе. Соответствие модели оценивали путем обеспечения того, чтобы средняя апостериорная вероятность принадлежности к группе составляла ≥ 70% для всех субфенотипов. Согласованность между полной 8-часовой моделью и экономными моделями с данными о жизненно важных показателях за 1–7 часов оценивалась для проверки того, достаточно ли для классификации меньшего количества измерений основных показателей жизнедеятельности. Затем к проверочным данным была применена полная 8-часовая обучающая модель: субфенотипы определяются набором из пяти уникальных полиномиальных функций, описывающих каждый жизненный показатель как функцию времени от поступления в больницу (т. е. температура = β
0 + β
1 Время + β
2 Время
2). Как и в предыдущей работе, пациенты в когорте проверки были классифицированы по траектории субфенотипа, которая привела к наименьшей среднеквадратичной ошибке [22, 23].
Эффективность модели у пациентов с сепсисом в когортах обучения и проверки
Пациенты с сепсисом были идентифицированы из общей когорты инфицированных пациентов с помощью шкалы SOFA с показателем ≥ 2 в первые 24 часа после поступления. Различия в демографии, сопутствующих заболеваниях и клинических характеристиках между субфенотипами у пациентов с сепсисом сравнивались с использованием дисперсионного анализа (ANOVA) или критерия хи-квадрат, в зависимости от ситуации. Субфенотипы сепсиса оценивались на предмет связи с необходимостью заместительной почечной терапии, искусственной вентиляции легких, вазопрессоров, инотропов и 30-дневной госпитальной летальности. Вышеуказанные анализы были повторены для (1) общей когорты пациентов с инфекцией, (2) пациентов с подозрением на инфекцию, отвечающих ≥ 2 критериям синдрома системного воспалительного ответа (SIRS) в первые 24 часа, и (3) пациентов с подозрением на инфекцию и менее 3 наборов основных показателей жизнедеятельности в первые 8 часов.
Связь субфенотипов с лабораторными показателями
Лабораторные показатели первых 24 часов госпитализации сравнивались между субфенотипами: количество лейкоцитов (WBC), абсолютное количество нейтрофилов, абсолютное количество лимфоцитов, соотношение нейтрофилов к лимфоцитам, С-реактивный белок (СРБ), скорость оседания эритроцитов (СОЭ), гемоглобин, тромбоциты, международное нормализованное отношение (МНО), креатинин сыворотки, альбумин, общий билирубин, B-натрийуретический пептид (BNP) и молочная кислота. Если у пациента было несколько лабораторных измерений, использовалось максимальное значение за первые 24 часа госпитализации (для гемоглобина, тромбоцитов и альбумина использовалось минимальное значение). Для отсутствующих лабораторных показателей не использовался процесс условного исчисления. Лабораторные значения сравнивали между субфенотипами с помощью ANOVA. С учетом предварительно заданного набора из 14 лабораторных тестов все значимые тесты были скорректированы для множественного тестирования с использованием поправки Бонферрони.
Мы проверили, значительно ли добавление лабораторных значений к модели GBTM изменило определение субфенотипов по сравнению с моделью оценки только жизненно важных функций.
Ассоциация субфенотипов со смертностью
Первичным прогностическим исходом была 30-дневная госпитальная летальность. Логистическая регрессия была выполнена для оценки связи между субфенотипами и 30-дневной смертностью с поправкой на возраст, пол, расу и сопутствующие заболевания (застойная сердечная недостаточность, хроническое заболевание легких, сахарный диабет, гипертония, хроническое заболевание почек, заболевание печени и метастатическое рак). Референтной группой служил наиболее распространенный субфенотип в общей когорте.
Неоднородность лечебного эффекта при внутривенном введении жидкостей
Исследование SMART представляло собой кластерно-рандомизированное кластерно-перекрестное исследование, в котором сравнивали сбалансированные кристаллоиды и физиологический раствор у взрослых в критическом состоянии, госпитализированных в Медицинский центр Университета Вандербильта [25]. Во вторичном анализе исследования SMART модель траектории жизненно важных функций была применена к жизненно важным показателям с первых 8 часов госпитализации для пациентов, включенных в исследование с диагнозом сепсис. Мы исключили пациентов, переведенных из других больниц, и тех, кто был переведен в отделение интенсивной терапии (ОИТ) более, чем через 72 часа после госпитализации. Жизненные показатели, используемые для классификации подфенотипов, были ограничены жизненно важными показателями, измеренными до введения исследуемой жидкости (учитывая, что сама по себе жидкость может изменить траекторию основных показателей жизнедеятельности). Жизненно важные показатели были стандартизированы по среднему значению и стандартному отклонению исходных данных, а пациенты были классифицированы по траектории субфенотипа, которая привела к наименьшей среднеквадратичной ошибке [22, 23]. Клинические характеристики и исходы сравнивались между субфенотипами.
Первичный результат (30-дневная госпитальная смертность) в каждом субфенотипе сравнивался между группами лечения сбалансированными кристаллоидами и физиологическим раствором с поправкой на предварительно определенные исходные ковариаты [25, 29]. Гетерогенность эффекта лечения (HTE) была проверена в модели, включающей исходные ковариаты, субфенотипы, назначение лечения и условия взаимодействия между субфенотипом и назначением лечения. P-значения для HTE были рассчитаны с использованием теста отношения правдоподобия между вложенной моделью без условий взаимодействия и полной моделью с условиями взаимодействия. Имитационное исследование было проведено для проверки возможности применения модели траектории жизненно важных органов при точном зачислении в режиме реального времени в исследовании SMART (Suppleentary Methods).
Результаты
Ретроспективная когорта включала 20 729 пациентов с подозрением на инфекцию, которые получали антибиотики в течение 6 часов после поступления в больницу, из них 12 473 пациента из обучающей когорты (поступившей в период с 2014 по 2017 год) и 8256 пациентов из проверочной когорты (поступившей в период с 2018 по 2019 год) (Supplementary Fig. 1). Модель траектории с 4 группами имела самый высокий BIC среди моделей с адекватным распределением подгрупп (Supplementary Table 1) и имела среднюю апостериорную вероятность принадлежности к группе > 90% для всех субфенотипов. Представлена важность отдельных жизненно показателей в окончательной модели траектории (Supplementary Table 2).
Пациенты группы А (N = 3483, 28%) имели гипертермию, тахикардию и тахипноэ, относительную гипотензию. В группе Б (N = 1578, 13%) также была гипертермия, тахикардия и тахипноэ, но не столь выраженные, как в группе А, и была гипертензия. Группа C (N = 4044, 32%) и группа D (N = 3368, 27%) имели более низкую температуру, частоту сердечных сокращений и частоту дыхания, при этом группа C была нормотензивной, а группа D — наиболее гипотензивным субфенотипом. Формы траектории в когорте валидации были аналогичны когорте обучения (Fig. 1).
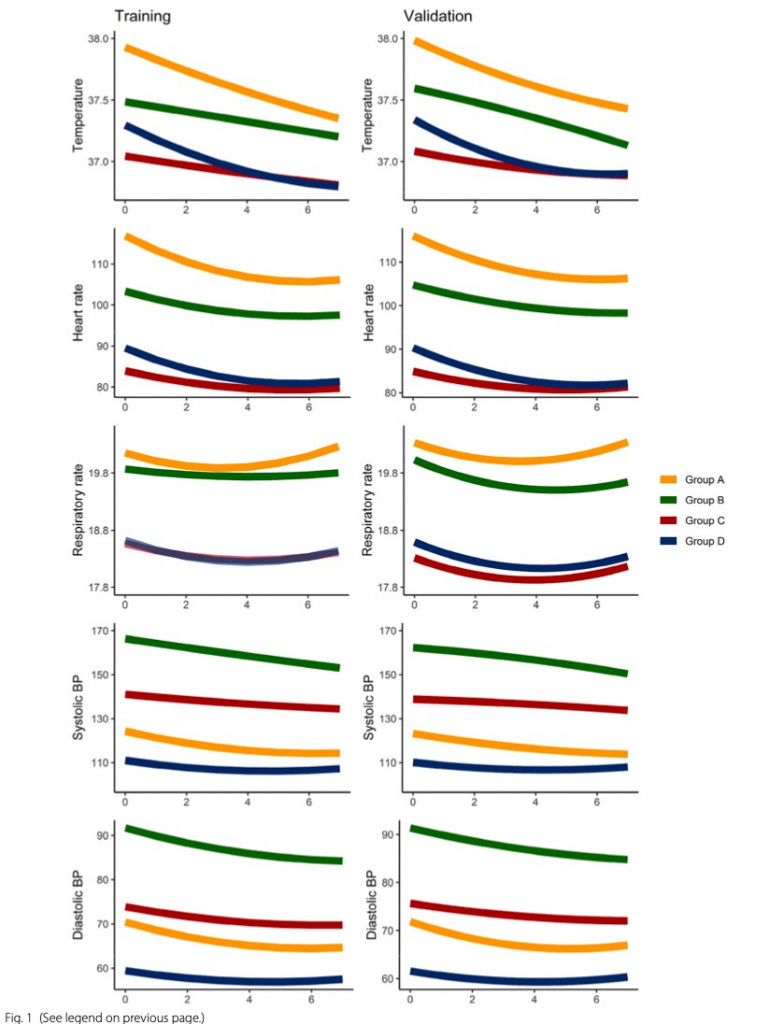

Одни только базовые показатели жизнедеятельности имели точность 69,6% в прогнозировании принадлежности к субфенотипу по сравнению с полной 8-часовой моделью, но каждый дополнительный час показателей жизнедеятельности значительно повышал точность (Supplementary Fig. 2).
В обучающей когорте было 6919 пациентов, отвечающих критериям сепсиса (определяемым как SOFA ≥ 2 в первые 24 часа). Группы A и B были моложе со средним возрастом 58 лет, тогда как группы C и D были старше со средним возрастом 70 и 69 лет соответственно (p < 0,001). Исходная распространенность сопутствующих заболеваний значительно различалась между субфенотипами (p < 0,001): в группе А была самая низкая распространенность застойной сердечной недостаточности (26%), артериальной гипертензии (59%), сахарного диабета (31%) и хронической болезни почек. 29%), но самая высокая распространенность метастатического рака (10%). В группе В была самая высокая распространенность застойной сердечной недостаточности (40%), артериальной гипертензии (91%) и хронической болезни почек (57%). Госпитализация в ОИТ была выше в группах A, B и D (39%, 33% и 33%), чем в группе C (22%) (p < 0,001). Потребность в заместительной почечной терапии во время госпитализации была самой высокой в группе В (p < 0,001). Использование вазопрессоров было выше в группах A и D, а использование инотропов было самым высоким в группе D (p < 0,001). 30-дневная госпитальная летальность значительно различалась между субфенотипами (p = 0,02): 3,8% для группы A, 2,2% для группы B, 2,4% для группы C и 3,7% для группы D (Table 1).
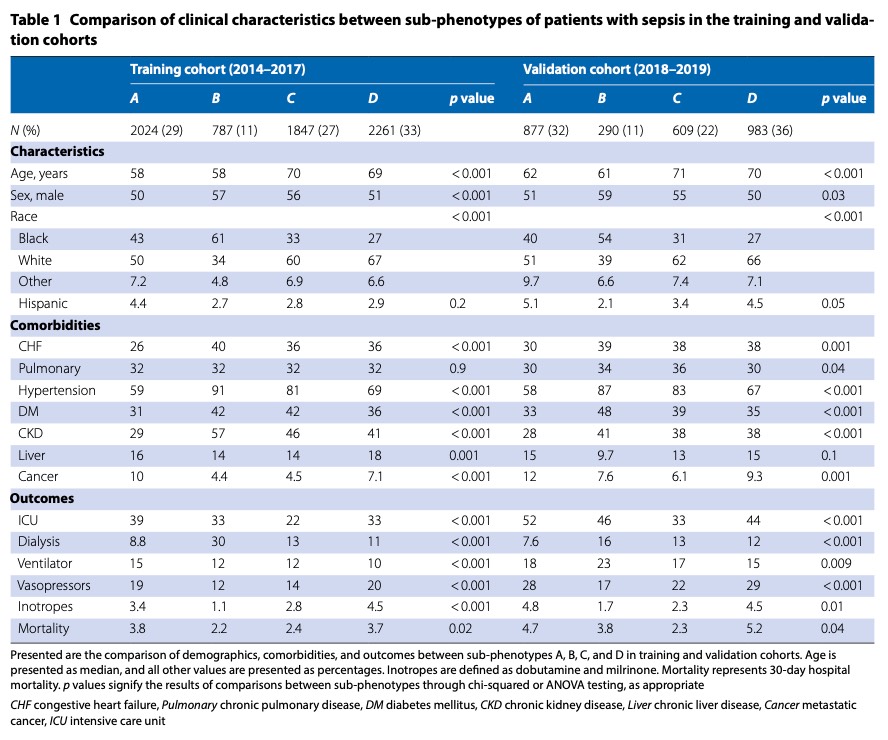
Среди 2759 пациентов с сепсисом в валидационной когорте относительное распределение демографических данных, сопутствующих заболеваний и исходов субфенотипов было таким же, как и в обучающей когорте (Table 1). В валидационной когорте госпитализация в ОИТ была выше в группах A, B и D по сравнению с группой C (p < 0,001); потребность в заместительной почечной терапии была самой высокой в группе В (p < 0,001); использование вазопрессоров было выше в группах А и D (p < 0,001). Смертность в субфенотипах составила 4,7% для группы А, 3,8% для группы В, 2,3% для группы С и 5,2% для группы D (р = 0,04). Относительное распределение характеристик субфенотипа также было сходным в общей когорте инфицированных пациентов и при различных критериях включения (Supplementary Tables 3–5).
Связь субфенотипов с лабораторными значениями
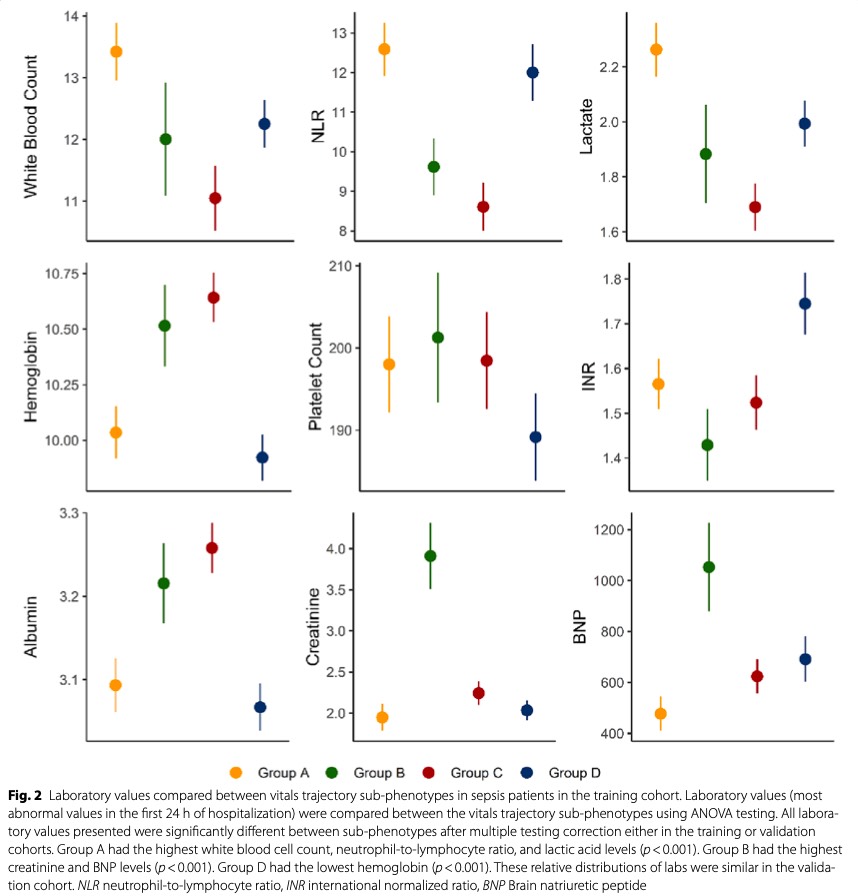
Несколько лабораторных маркеров значительно различались между 4 субфенотипами как в обучающей, так и в проверочной когортах. В обучающей когорте группа А имела самое высокое количество лейкоцитов, отношение нейтрофилов к лимфоцитам и уровень молочной кислоты (p < 0,001) (Fig. 2); Группа В имела самый высокий уровень креатинина и BNP в сыворотке крови (p < 0,001); В группах А и D альбумин был ниже (p < 0,001); В группе D был самый низкий гемоглобин (p < 0,001). Относительное распределение лабораторных значений было сходным в проверочной когорте (Supplementary Fig. 3, Supplementary Tables 6 & 7). Добавление лабораторных маркеров существенно не изменило принадлежность к субфенотипу (Supplementary Table 8).
Ассоциация субфенотипов со смертностью
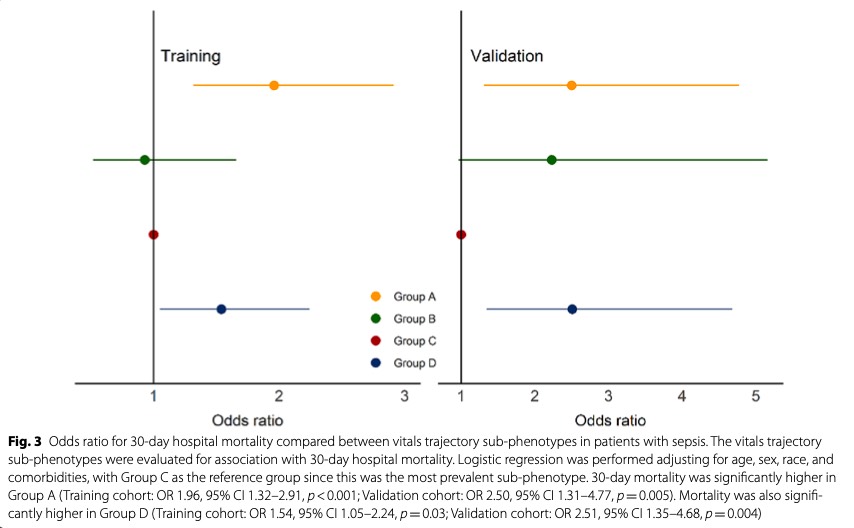
В логистической регрессии с поправкой на возраст, и сопутствующие заболевания в группе C в проверочной когорте, 30-дневная смертность была значительно выше, чем в группе A (обучающая когорта: отношение шансов (ОШ) 1,96, 95% доверительный интервал (ДИ) 1,32– 2,91, р < 0,001; когорта проверки: ОШ 2,50, 95% ДИ 1,31–4,77, р = 0,005). Смертность также была значительно выше в группе D (обучающая когорта: ОШ 1,54, 95% ДИ 1,05–2,24, р = 0,03; проверочная когорта: ОШ 2,51,95% ДИ 1,35–4,68, р = 0,004) (Fig. 3).
 Неоднородность лечебного эффекта при внутривенном введении жидкостей
Неоднородность лечебного эффекта при внутривенном введении жидкостей
Из 1641 пациента с сепсисом в исследовании SMART 368 были исключены из-за отсутствия документально подтвержденных показателей жизнедеятельности до введения жидкости, 285 — из-за перевода из других больниц и 154 — из-за госпитализации более чем за 72 часа до включения в исследование. Критерии включения в когорту исследования SMART сравнивались с когортами наблюдения в Supplementary Table 9. 834 пациента исследования были разделены на 4 субфенотипа: группа A (N = 319, 38%), группа B (93, 11%). , группа C (100, 12%) и группа D (322, 39%). В соответствии с нашими первичными результатами группа A была самой молодой, а группа D — самой старшей (медиана 53 года против 63 лет, p <0,001). В группе А была самая низкая распространенность застойной сердечной недостаточности, артериальной гипертензии и хронической болезни почек. Группы B и D имели исходно высокую распространенность застойной сердечной недостаточности и хронической болезни почек. 30-дневная госпитальная летальность значительно различалась между субфенотипами (p = 0,02): группа A (21%), группа B (14%), группа C (22%) и группа D (28%) (SupplementaryTables 10 and 11).
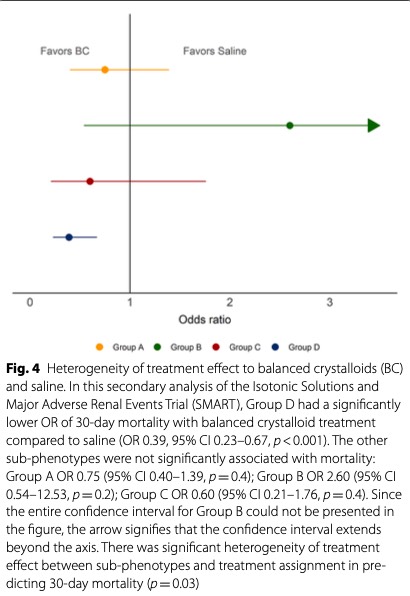
В логистической регрессии группа D имела значительно более низкое ОШ 30-дневной смертности при использовании сбалансированных кристаллоидов по сравнению с физиологическим раствором (ОШ 0,39, 95% ДИ 0,23–0,67, p <0,001) (Fig. 4). Отмечалась значительная гетерогенность результата лечения между субфенотипом и назначением лечения при прогнозировании 30-дневной смертности (p = 0,03). В анализе чувствительности, ограниченном пациентами с полным набором из 3 показателей жизнедеятельности до введения жидкости (N = 335), сохранялась значительная HTE (p = 0,04) с более низким OR смертности при использовании сбалансированных кристаллоидов в группе D (OR 0,35, 95 % ДИ 0,15–0,79, р = 0,01). В 1000 симуляционных экспериментах по классификации исследуемых пациентов в реальном времени 607 экспериментов выявили достаточно значительное преимущество в отношении смертности от сбалансированных кристаллоидов в группе D, чтобы гарантировать досрочное прекращение клинического испытания (разница в смертности> 10% при значении p <0,05) (Supplementary Table 12).
Обсуждение
Мы представляем новые динамические субфенотипы, разработанные и подтвержденные с использованием универсально доступных показателей жизнедеятельности широкой группы пациентов, поступающих в отделение неотложной помощи с подозрением на инфекцию. Субфенотипы демонстрируют сильную обобщаемость у пациентов с сепсисом в обучающей когорте и разной во времени проверочной когорте, а также у пациентов в критическом состоянии с сепсисом в когорте РКИ из другого учреждения. Субфенотипы имеют различные исходные характеристики, лабораторные отклонения и характер дисфункции органов. Наконец, субфенотипы демонстрируют значительно различающиеся ответы на сбалансированные кристаллоиды и физиологический раствор, что позволяет предположить, что эти субфенотипы могут играть роль в персонифицированном подходе у больных с сепсисом.
Будет ли у пациента с инфекцией развиваться органная дисфункция и сепсис, часто неясно при поступлении в отделение неотложной помощи. Субдфенотипы траекторий жизненно важных функций были разработаны на широкой когорте пациентов с подозрением на инфекцию, чтобы модель можно было применить к пациентам с установленным сепсисом или без него на момент поступления. Используя эту обобщенную модель субфенотипа, мы получили надежные результаты с аналогичным распределением клинических характеристик субфенотипа и исходов у пациентов с инфекцией, пациентов с сепсисом, пациентов, отвечающих критериям SIRS, пациентов со скудными данными о показателях жизнедеятельности и пациентов с сепсисом в ОИТ.
Предыдущие исследования по подтипированию острого респираторного дистресс-синдрома (ОРДС) и сепсиса выявили от двух до шести субфенотипов, при этом в некоторых исследованиях использовались транскриптомные данные, а в других — клинические данные из электронных медицинских карт и РКИ [7, 30]. Calfee et al. выявили два последовательных субфенотипа ОРДС в нескольких исследованиях с различиями в воспалительных биомаркерах и ответах на лечение [31]. При сепсисе наблюдается большая вариабельность клинических субфенотипов. Seymour et al. идентифицировали четыре субфенотипа с использованием лабораторных и витальных данных, но эти субфенотипы не имели значительного взаимодействия с лечением в РКИ [8]. Shankar-Hari et al. идентифицировали два субфенотипа в исследовании VANISH и три субфенотипа в исследовании LeoPARDS, используя клинические данные и данные биомаркеров, с постоянным гипервоспалительным субфенотипом, связанным с более высокой смертностью, но без гетерогенности результатов лечения [7]. Gardlund et al. сообщили о шести субфенотипах септического шока, используя исследование PROWESS Shock Study без различий в эффектах лечения между группами [11].
Отсутствие различий в лечении больных с различными субфенотипами сепсиса может быть связано с отсутствием статистической мощности, дизайном клинических испытаний (объяснительным, а не прагматическим) или истинным отсутствием гетерогенности результатов лечения [7, 32]. Отличительными преимуществами наших клинических субфенотипов являются: (1) использование рутинных измерений у постели больного, (2) использование измерений в динамике (3) идентификация гетерогенности результатов лечения по типу используемых инфузионных растворов.
Сепсис — это динамический процесс, характеризующийся быстро развивающимися физиологическими реакциями, которые не могут быть адекватно зафиксированы статическими измерениями [14, 33]. По сравнению с традиционными методами статической кластеризации, GBTM имеет то преимущество, что моделирует динамическую эволюцию физиологии с течением времени. Кроме того, субфенотипы GBTM представлены клинически интерпретируемыми траекториями клинических переменных. Когда GBTM применяли к нашей когорте, мы обнаружили, что группа А представляла собой субфенотип гипертермии, тахикардии, тахипноэ и гипотензии. Группа А имела высокий уровень лактата, количество лейкоцитов и отношение нейтрофилов к лимфоцитам. В группе В были гипертермия, тахикардия и тахипноэ, но не в такой степени, как в группе А.
Кроме того, у этих пациентов была артериальная гипертензия и высокая распространенность исходных сопутствующих заболеваний, включая застойную сердечную недостаточность и хроническую болезнь почек. Группы C и D имели более низкую температуру, частоту сердечных сокращений и частоту дыхания. Группа С была нормотензивной, в то время как группа D была наиболее гипотензивным субфенотипом. Группы A и Dимели более высокое отношение шансов смертности как в обучающих, так и в проверочных когортах по сравнению с группой C (считавшейся контрольной группой, поскольку она была преобладающим субфенотипом).
Одним из наиболее распространенных вмешательств при сепсисе является внутривенное введение жидкостей. Имеются данные о том, что динамические жизненные показатели могут определять стратегии инфузионной терапии [34–36]. При вторичном анализе исследования SMART мы обнаружили значительную неоднородность лечебного эффекта сбалансированных кристаллоидов по сравнению с физиологическим раствором для субфенотипов. Группа D (с низкой температурой, частотой сердечных сокращений и частотой дыхания и гипотензией) имела наибольшую пользу от сбалансированных кристаллоидов по сравнению с физиологическим раствором со значительно более низкой 30-дневной госпитальной смертностью. В будущих клинических испытаниях группа D может стать целевым субфенотипом для точного включения в исследование, где сравнивают сбалансированные кристаллоиды и физиологический раствор. Разработка этой модели траектории потребовала трех наборов основных показателей жизнедеятельности в течение первых 8 часов. Однако модель можно применять в режиме реального времени без использования всех 8 часов для классификации субфенотипов. Возможность применения в режиме реального времени была продемонстрирована с помощью симуляционного исследования, в котором пациенты в исследовании SMART были отнесены к группе D, если они соответствовали заранее определенному порогу вероятности.
Мы обнаружили, что большинство смоделированных испытаний приводили к раннему прекращению лечения из-за обнаружения клинически и статистически значимого преимущества сбалансированных кристаллоидов в отношении смертности в группе D.
Исследование имеет несколько ограничений. Во-первых, ретроспективный характер исследования ограничивает анализ причинно-следственных связей. Во-вторых, вторичный анализ РКИ может быть недостаточным для выявления гетерогенного ответа на лечение. В-третьих, исследование SALT-ED может служить дополнительной когортой для оценки субфенотипической модификации эффекта лечения у пациентов, которые были госпитализированы в ОИТ. В-четвертых, временные субфенотипы могут быть изменены путем лечения в пределах окна субфенотипирования. В-пятых, лабораторные маркеры были собраны в соответствии с клиническими показаниями, что привело к отсутствию полных данных. В-шестых, вариабельность измерения частоты дыхания может возникать из-за метода измерения (прикроватные мониторы по сравнению с визуальными измерениями). Наконец, эти данные нельзя экстраполировать на пациентов с внутрибольничными инфекциями.
Субфенотипы траектории жизненно важных функций с отчетливыми клиническими характеристиками и профилями дисфункции органов отражают динамическую сложность сепсиса. Эти субфенотипы могут по-разному реагировать на стратегии лечения сепсиса. Наконец, субфенотипы могут быть использованы для точного включения в будущие клинические испытания и могут сыграть роль в переходе от универсального подхода к подходу прецизионной медицины в лечении сепсиса.
Ссылка на документ с дополнительными данными исследования (Supplementary)
References
1. Buchman TG et al (2020) Sepsis among medicare beneficiaries: 3 the methods, models, and forecasts of sepsis,2012–2018. Critical Care Med 48:302–318.
https://doi.org/10.1097/ccm.0000000000004225
2. Rhee C et al (2017) Incidence and trends of sepsis in US Hospitals using clinical vs claims data, 2009–2014.JAMA 318:1241–1249.
https://doi.org/ 10.1001/jama.2017.13836
3. Singer M et al (2016) The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA315:801–810.
https://doi.org/10. 1001/jama.2016.0287
4. Santacruz CA, Pereira AJ, Celis E, Vincent J-L (2019) Which multicenter ran- domized controlled trials in criticalcare medicine have shown reduced mortality? A systematic review. Crit Care Med 47:1680–1691.
https://doi.org/10.1097/ccm.0000000000004000
5. Prescott HC, Calfee CS, Thompson BT, Angus DC, Liu VX (2016) Toward smarter lumping and smarter splitting:rethinking strategies for sepsis and acute respiratory distress syndrome clinical trial design. Am J Respir Crit Care Med194:147–155.
https://doi.org/10.1164/rccm.201512-2544CP
6. Maslove DM et al (2022) Redefining critical illness. Nat Med 28:1141– 1148.
https://doi.org/10.1038/s41591-022-01843-x
7. Shankar-Hari M et al (2021) Defining phenotypes and treatment effect heterogeneity to inform acute respiratorydistress syndrome and sepsis trials: secondary analyses of three RCTs. Efficacy Mech Eval 8:1–104
8. Seymour CW et al (2019) Derivation, validation, and potential treatment implications of novel clinical phenotypes for sepsis. JAMA 321:2003– 2017.
https://doi.org/10.1001/jama.2019.5791
9. Zhang Z, Zhang G, Goyal H, Mo L, Hong Y (2018) Identification of sub- classes of sepsis that showed different clinical outcomes and responses to amount of fluid resuscitation: a latent profile analysis. Crit Care 22:347.
https://doi.org/10.1186/s13054-018-2279-3
10. Knox DB, Lanspa MJ, Kuttler KG, Brewer SC, Brown SM (2015) Pheno- typic clusters within sepsis-associatedmultiple organ dysfunction syndrome. Intensive Care Med 41:814–822.
https://doi.org/10.1007/ s00134-015-3764-7
11. Gårdlund B et al (2018) Six subphenotypes in septic shock: latent class analysis of the PROWESS Shock study. J Crit Care 47:70–79.
https://doi. org/10.1016/j.jcrc.2018.06.012
12. Cazalis MA et al (2014) Early and dynamic changes in gene expression in septic shock patients: a genome-wideapproach. Intensive Care Med Exp 2:20.
https://doi.org/10.1186/s40635-014-0020-3
13. Maslove DM, Wong HR (2014) Gene expression profiling in sepsis: timing, tissue, and translationalconsiderations. Trends Mol Med 20:204–213.
https://doi.org/10.1016/j.molmed.2014.01.006
14. Namas RA, Vodovotz Y (2016) From static to dynamic: a sepsis-specific dynamic model from clinical criteria in polytrauma patients. Ann Transl Med 4:492.
https://doi.org/10.21037/atm.2016.11.72
15. Reddy K et al (2020) Subphenotypes in critical care: translation into clinical practice. Lancet Respir Med 8:631–643.
https://doi.org/10.1016/ S2213-2600(20)30124-7
16. Kwan A, Hubank M, Rashid A, Klein N, Peters MJ (2013) Transcriptional instability during evolving sepsis may limit biomarker based risk stratifica- tion. PLoS ONE 8:e60501.
https://doi.org/10.1371/journal.pone.0060501
17. Wong HR et al (2018) Endotype transitions during the acute phase of pediatric septic shock reflect changing risk and treatment response. Crit Care Med 46:e242–e249.
https://doi.org/10.1097/ccm.0000000000 002932
18. Hollen MK et al (2019) Myeloid-derived suppressor cell function and epigenetic expression evolves over timeafter surgical sepsis. Crit Care 23:355.
https://doi.org/10.1186/s13054-019-2628-x
19. Sweeney TE, Shidham A, Wong HR, Khatri P (2015) A comprehensive time-course-based multicohort analysis of sepsis and sterile inflamma- tion reveals a robust diagnostic gene set. Sci Transl Med 7:287ra271.
https://doi.org/10.1126/scitranslmed.aaa5993
20. Bhavani SV et al (2019) Identifying novel sepsis subphenotypes using temperature trajectories. Am J Respir CritCare Med.
https://doi.org/10. 1164/rccm.201806-1197OC
21. Bhavani SV, Huang ES, Verhoef PA, Churpek MM (2020) Novel temperature trajectory subphenotypes in COVID-19. Chest.
https://doi.org/10.1016/j. chest.2020.07.027
22. Bhavani SV et al (2022) Coronavirus disease 2019 temperature trajectories correlate with hyperinflammatory andhypercoagulable subphenotypes. Crit Care Med 50:212–223.
https://doi.org/10.1097/ccm.0000000000 005397
23. Bhavani SV et al (2020) Temperature trajectory subphenotypes cor- relate with immune responses in patients withsepsis. Crit Care Med 48:1645–1653.
https://doi.org/10.1097/ccm.0000000000004610
24 Yehya N et al (2021) Temperature trajectory sub-phenotypes and the immuno-inflammatory response in pediatricsepsis. Shock.
https://doi. org/10.1097/shk.0000000000001906
25. Semler MW et al (2018) Balanced crystalloids versus saline in critically ill adults. N Engl J Med 378:829–839.
https://doi.org/10.1056/NEJMoa1711 584
26. Churpek MM, Zadravecz FJ, Winslow C, Howell MD, Edelson DP (2015) Incidence and prognostic value of thesystemic inflammatory response syndrome and organ dysfunctions in ward patients. Am J Respir Crit Care Med 192:958–964.
https://doi.org/10.1164/rccm.201502-0275OC
27. Nagin DS, Jones BL, Passos VL, Tremblay RE (2018) Group-based multi- trajectory modeling. Stat Methods MedRes 27:2015–2023.
https://doi. org/10.1177/0962280216673085
28. Nagin DS, Odgers CL (2010) Group-based trajectory modeling in clinical research. Annu Rev Clin Psychol6:109–138.
https://doi.org/10.1146/annur ev.clinpsy.121208.131413
29 Brown RM et al (2019) Balanced crystalloids versus saline in sepsis. A secondary analysis of the SMART clinicaltrial. Am J Respir Crit Care Med 200:1487–1495.
https://doi.org/10.1164/rccm.201903-0557OC
30. Stanski NL, Wong HR (2020) Prognostic and predictive enrich- ment in sepsis. Nat Rev Nephrol 16:20–31.
https://doi.org/10.1038/ s41581-019-0199-3
31. Calfee CS et al (2014) Subphenotypes in acute respiratory distress syn- drome: latent class analysis of data fromtwo randomised controlled trials. Lancet Respir Med 2:611–620.
https://doi.org/10.1016/S2213-2600(14) 70097-9
32. Santhakumaran S et al (2019) Heterogeneity of treatment effect by baseline risk of mortality in critically ill patients:re-analysis of three recent sepsis and ARDS randomised controlled trials. Crit Care 23:156.
https://doi.org/10.1186/s13054-019-2446-1
33. Mayaud L et al (2013) Dynamic data during hypotensive episode improves mortality predictions among patientswith sepsis and hypoten- sion. Crit Care Med 41:954–962.
https://doi.org/10.1097/CCM.0b013 e3182772adb
34. Gu Q, Prasad V, Heldt T (2019) Characterizing fluid response and sepsis progression in emergency departmentpatients. In: Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEEEngineering in Medicine and Biology Society. Annual International Conference
https://doi.org/10.1109/embc.2019.8856521
35. Prasad V, Lynch JC, Filbin MR, Reisner AT, Heldt T (2019) Clustering blood pressure trajectories in septic shock in the emergency department. In: Annual International Conference of the IEEE Engineering in Medicine and BiologySociety. IEEE Engineering in Medicine and Biology Society. Annual International Conference, 494–497,doi:
https://doi.org/10.1109/ embc.2019.8857191
36. Brown SM et al (2016) Multi-complexity measures of heart rate variability and the effect of vasopressor titration: a prospective cohort study of patients with septic shock. BMC Infect Dis 16:551.
https://doi.org/10. 1186/s12879-016-1896-1
Источник фотоиллюстрации - www.freepik.com
[~DETAIL_TEXT] =>
Bhavani SV, Semle M, Qian ET et al. Development and validation of novel sepsis subphenotypes using trajectories ofvital signs.
Разработка и проверка новых субфенотипов сепсиса с использованием траекторий основных показателей жизнедеятельности.
Intensive Care Med https://doi.org/10.1007/s00134-022-06890-z
Абстракт
Сепсис является гетерогенным синдромом, и идентификация субфенотипов имеет важное значение. В этом исследовании использовались траектории основных показателей жизнедеятельности для разработки и проверки субфенотипов и изучалось взаимодействие субфенотипов с лечением на основании данных рандомизированных контролируемых испытаний. Были включены все пациенты с подозрением на инфекцию, поступившие в четыре академических госпиталя Emory Healthcare в период с 2014–2017 гг. (основная группа) и 2018–2019 гг. (группа сравнения). Групповое моделирование траектории применялось к показателям жизненно важных функций с первых 8 часов госпитализации для разработки и проверки субфенотипов на основании траекторий жизненно важных функций. Ассоциации между субфенотипами и исходами оценивались у пациентов с сепсисом. Взаимодействие между субфенотипом и лечением сбалансированными кристаллоидами по сравнению с физиологическим раствором было проверено во вторичном анализе SMART (Isotonic Solutions and Major AdverseRenal Events Trial). Включено 12 473 пациента с подозрением на инфекцию в основную группу и 8256 пациентов в группу сравнения, и было обнаружено 4 субфенотипа жизненно важных функций. В группе А (N=3483, 28%) выявлены гипертермия, тахикардия, тахипноэ и гипотензия. В группе В (N=1578, 13%) была гипертермия, тахикардия, тахипноэ (не такие выраженная, как группа А) , а также гипертенизия. Группы C (N= 4044, 32%) и D(N= 3368, 27%) имели более низкую температуру, частоту сердечных сокращений и частоту дыхания, причем группа C была нормотензивной, а группа D гипотензивной. Среди 6919 пациентов с сепсисом группы А и В были моложе, а группы С и D — старше. В группе А была самая низкая распространенность застойной сердечной недостаточности, гипертонии, сахарного диабета и хронической болезни почек, в то время как в группе В была самая высокая распространенность данных состояний. В группах A и D чаще всего использовались вазопрессоры (p < 0,001 для всех вышеприведенных анализов). В логистической регрессии 30-дневная смертность была значительно выше в группах А и D (p < 0,001 и p = 0,03 соответственно). В исследовании SMART субфенотип значительно модифицировал эффект лечения (p = 0,03). Группа D имела значительно более низкие шансы смертности при использовании сбалансированных кристаллоидов по сравнению с физиологическим раствором (отношение шансов (ОШ) 0,39, 95% доверительный интервал (ДИ) 0,23–0,67, р <0,001). Субфенотипы сепсиса, основанные на траектории основных показателей жизнедеятельности, были одинаковыми в когортах, имели различные исходы и разные ответы на лечение сбалансированными кристаллоидами по сравнению с физиологическим раствором.
Take‐home message
В многоцентровом ретроспективном анализе 20 729 госпитализированных пациентов с подозрением на инфекцию были выявлены четыре субфенотипа, соответствующие различным траекториям основных показателей жизнедеятельности в течение первых 8 часов госпитализации. Эти субфенотипы траектории жизненно важных функций имели различные исходные клинические характеристики, лабораторные отклонения, профили дисфункции органов и исходы. Во вторичном анализе рандомизированного контрольного исследования SMARTсубфенотип значительно изменил влияние внутривенного введения жидкости на смертность. Четыре субфенотипа сепсиса, основанные на общедоступных показателях жизненно важных функций, могут иметь разный ответ на лечение и могут способствовать точному включению в последующие клинические исследования.
Введение
Сепсис представляет собой гетерогенный синдром, характеризующийся нерегулируемой реакцией хозяина на инфекцию, что ежегодно приводит к 270 000 смертей и расходам на лечение в госпитальном секторе США на сумму 60 миллиардов долларов [1–3]. Десятилетия клинических испытаний не выявили методов лечения, которые бы постоянно приносили пользу пациентам с сепсисом в целом [4]. Предполагается, что эти отрицательные результаты возникают из-за вариабельности реакции пациентов на лечение [5]. Таким образом, разделение гетерогенного синдрома сепсиса на отдельные «физиологические интересующие состояния» может привести к прецизионной терапии, нацеленной на корригируемые симптомы [6].
Предыдущие исследования выявили от двух до шести подфенотипов сепсиса путем применения неконтролируемых подходов, таких как анализ k-средних и латентного класса, к клиническим данным и биомаркерам из электронных медицинских карт и рандомизированных контрольных исследований [7–11]. Большинство исследований идентифицировали субфенотипы с использованием статических измерений биомаркеров или основных показателей жизнедеятельности. Однако сепсис представляет собой динамический процесс с биологическими и физиологическими реакциями, которые развиваются от нескольких минут до нескольких часов [12–14]. Эта «временная нестабильность» сепсиса предполагает, что статические данные лабораторных и жизненно важных органов могут не идентифицировать субфенотипы, которые динамически изменяются во времени [15–19].
Использование лонгитюдных данных может более точно идентифицировать субфенотипы сепсиса, которые различаются по клиническим характеристикам, исходам и ответам на лечение [20–24]. Кроме того, рутинные измерения у постели больного, такие как показатели жизненно важных функций, могут позволить повысить точность оценки при включении пациента в клинические испытания.
Большинство моделей субфенотипов разрабатываются с использованием данных пациентов, поступивших в отделение неотложной помощи с установленной дисфункцией органов и сепсисом. Однако это исключает информативные данные о пациента с инфекцией, у которых позже во время госпитализации разовьется сепсис. Чтобы разработать модель субфенотипа для предполагаемого внедрения в отделение неотложной помощи, модель в идеале должна быть обобщаемой и применимой ко всем пациентам с инфекцией, потому что на момент представления будет неясно, какие пациенты в дальнейшем будут соответствовать формальным критериям сепсиса. Это исследование было разработано с учетом перспективного внедрения, и поэтому мы решили разработать и проверить модель субфенотипа сепсиса у всех пациентов с подозрением на инфекцию, а затем оценить эффективность модели конкретно у пациентов с сепсисом.
Цели этого исследования состояли в том, чтобы: (1) разработать и обосновать динамические субфенотипы у пациентов с инфекцией с использованием показателей жизнедеятельности (температура, частота сердечных сокращений, частота дыхания и артериальное давление), измеренных в течение первых 8 часов госпитализации; (2) оценить клинические характеристики и исходы субфенотипов жизненно важных функций у пациентов с сепсисом; (3) проверить, изменяет ли субфенотип влияние лечения сбалансированными кристаллоидами по сравнению с физиологическим раствором на смертность у пациентов с сепсисом, используя данные рандомизированного контролируемого исследования [25].
Методы
Дизайн исследования
Первая часть исследования представляла собой ретроспективное обсервационное исследование, проведенное в системе Emory Healthcare для разработки и проверки субфенотипов траектории жизненно важных функций. Вторая часть исследования представляла собой вторичный анализ данных на уровне пациентов, полученных в ходе исследования SMART, проведенного в Vanderbilt University Medical Center. Ретроспективное обсервационное исследование было одобрено Emory Institutional Review Board с отказом от информированного согласия, а вторичный анализ обезличенных данных из РКИ был сочтен Emory IRB исследованием без участия людей (STUDY00001815).
Изучаемая когорта
В обсервационном исследовании все взрослые пациенты, поступившие через отделение неотложной помощи в четыре больницы системы Emory Healthcare в период с января 2014 г. по декабрь 2019 г., имели право на включение в исследование. Пациенты с подозрением на инфекцию были идентифицированы в электронной медицинской карте на основании использования антибиотиков (перорально или парентерально) и сбора культур биологических жидкостей (кровь, моча или спинномозговая жидкость) для микробиологического исследования [8], при этом когорта дополнительно ограничивалась пациентами, которые получали антибиотики в течение 6 часов после поступления. Пациенты, которые умерли или были выписаны в течение первых 8 часов, были исключены, поскольку при анализе использовались показатели жизненно важных функций в первые 8 часов госпитализации. Пациенты, переведенные в другие больницы, были исключены из-за неполной информации о результатах. Наконец, пациенты с менее, чем тремя полными наборами показателей жизнедеятельности в первые 8 часов, были исключены, поскольку разработка модели требует многократных измерений.
Многоцентровые когорты пациентов с подозрением на инфекцию были разделены на обучающую и валидационную выборки по годам поступления, причем госпитализированные в период с 2014 по 2017 г. были разделены на обучающие, а госпитализированные в период с 2018 по 2019 г. — на валидационные.
Разная во времени когорта валидации была разработана для имитации предполагаемой реализации модели субфенотипа в четырех больницах для проверки обобщаемости. Учитывая цель эмулировать проспективное внедрение, когда у нас не было бы информации о том, будет ли пациент соответствовать формальным критериям сепсиса, мы разработали и утвердили модель субфенотипа для всех пациентов, поступающих в отделение неотложной помощи с подозрением на инфекцию.
Измерение основных показателей жизнедеятельности
Были включены оральная температура, частота сердечных сокращений, частота дыхания, систолическое и диастолическое артериальное давление за первые 8 часов поступления в стационар. Ошибочные записи основных показателей жизнедеятельности были идентифицированы и исключены в соответствии с предыдущими публикациями [26]. Данные о жизненно важных показателях были разделены на восемь часовых блоков времени. Для отсутствующих показателей жизнедеятельности (т. е. показателей жизнедеятельности, измеренных в определенный час) процесс условного исчисления не применялся, поскольку описанный ниже алгоритм групповой траекторной модели (GBTM) обрабатывает отсутствующие данные посредством оценки правдоподобия. Если в течение 1 часа были доступны несколько измерений, для анализа использовалось среднее значение. Все жизненные показатели в обучающей и валидационной когорте были стандартизированы по среднему значению и стандартному отклонению этого жизненного показателя в этой когорте.
Разработка и проверка групповой модели траектории
Алгоритм GBTM был применен к данным жизненно важных органов в обучающей когорте. GBTMпредставляет собой приложение моделирования конечных данных и используется для идентификации групп людей, следующих по сходным траекториям переменных во времени [27, 28]. Алгоритм вычисляет базовые коэффициенты для полиномиальных функций, описывающих траектории основных показателей жизнедеятельности во времени для каждой из групп. Перед подгонкой модели мы использовали тестирование отношения правдоподобия, чтобы определить наиболее подходящую полиномиальную форму для каждого жизненно важного признака (т. е. линейную или квадратичную). Используя GBTM, мы заранее определили выбранные полиномиальные формы для каждого жизненно важного признака и протестировали двух-, трех-, четырех-, пяти- и шестигрупповые модели. Полученные модели с разным количеством субфенотипов сравнивались с использованием: (1) байесовских информационных критериев (BIC) — показателя того, насколько хорошо модель соответствует данным, со штрафом за возрастающую сложность, и (2) распределения по подгруппам — если один или более субфенотипов содержали менее пяти процентов когорты, модель не подходила для отбора.
После выбора оптимальной модели пациентам присваивался субфенотип, для которого у них была наибольшая вероятность принадлежности к группе. Соответствие модели оценивали путем обеспечения того, чтобы средняя апостериорная вероятность принадлежности к группе составляла ≥ 70% для всех субфенотипов. Согласованность между полной 8-часовой моделью и экономными моделями с данными о жизненно важных показателях за 1–7 часов оценивалась для проверки того, достаточно ли для классификации меньшего количества измерений основных показателей жизнедеятельности. Затем к проверочным данным была применена полная 8-часовая обучающая модель: субфенотипы определяются набором из пяти уникальных полиномиальных функций, описывающих каждый жизненный показатель как функцию времени от поступления в больницу (т. е. температура = β
0 + β
1 Время + β
2 Время
2). Как и в предыдущей работе, пациенты в когорте проверки были классифицированы по траектории субфенотипа, которая привела к наименьшей среднеквадратичной ошибке [22, 23].
Эффективность модели у пациентов с сепсисом в когортах обучения и проверки
Пациенты с сепсисом были идентифицированы из общей когорты инфицированных пациентов с помощью шкалы SOFA с показателем ≥ 2 в первые 24 часа после поступления. Различия в демографии, сопутствующих заболеваниях и клинических характеристиках между субфенотипами у пациентов с сепсисом сравнивались с использованием дисперсионного анализа (ANOVA) или критерия хи-квадрат, в зависимости от ситуации. Субфенотипы сепсиса оценивались на предмет связи с необходимостью заместительной почечной терапии, искусственной вентиляции легких, вазопрессоров, инотропов и 30-дневной госпитальной летальности. Вышеуказанные анализы были повторены для (1) общей когорты пациентов с инфекцией, (2) пациентов с подозрением на инфекцию, отвечающих ≥ 2 критериям синдрома системного воспалительного ответа (SIRS) в первые 24 часа, и (3) пациентов с подозрением на инфекцию и менее 3 наборов основных показателей жизнедеятельности в первые 8 часов.
Связь субфенотипов с лабораторными показателями
Лабораторные показатели первых 24 часов госпитализации сравнивались между субфенотипами: количество лейкоцитов (WBC), абсолютное количество нейтрофилов, абсолютное количество лимфоцитов, соотношение нейтрофилов к лимфоцитам, С-реактивный белок (СРБ), скорость оседания эритроцитов (СОЭ), гемоглобин, тромбоциты, международное нормализованное отношение (МНО), креатинин сыворотки, альбумин, общий билирубин, B-натрийуретический пептид (BNP) и молочная кислота. Если у пациента было несколько лабораторных измерений, использовалось максимальное значение за первые 24 часа госпитализации (для гемоглобина, тромбоцитов и альбумина использовалось минимальное значение). Для отсутствующих лабораторных показателей не использовался процесс условного исчисления. Лабораторные значения сравнивали между субфенотипами с помощью ANOVA. С учетом предварительно заданного набора из 14 лабораторных тестов все значимые тесты были скорректированы для множественного тестирования с использованием поправки Бонферрони.
Мы проверили, значительно ли добавление лабораторных значений к модели GBTM изменило определение субфенотипов по сравнению с моделью оценки только жизненно важных функций.
Ассоциация субфенотипов со смертностью
Первичным прогностическим исходом была 30-дневная госпитальная летальность. Логистическая регрессия была выполнена для оценки связи между субфенотипами и 30-дневной смертностью с поправкой на возраст, пол, расу и сопутствующие заболевания (застойная сердечная недостаточность, хроническое заболевание легких, сахарный диабет, гипертония, хроническое заболевание почек, заболевание печени и метастатическое рак). Референтной группой служил наиболее распространенный субфенотип в общей когорте.
Неоднородность лечебного эффекта при внутривенном введении жидкостей
Исследование SMART представляло собой кластерно-рандомизированное кластерно-перекрестное исследование, в котором сравнивали сбалансированные кристаллоиды и физиологический раствор у взрослых в критическом состоянии, госпитализированных в Медицинский центр Университета Вандербильта [25]. Во вторичном анализе исследования SMART модель траектории жизненно важных функций была применена к жизненно важным показателям с первых 8 часов госпитализации для пациентов, включенных в исследование с диагнозом сепсис. Мы исключили пациентов, переведенных из других больниц, и тех, кто был переведен в отделение интенсивной терапии (ОИТ) более, чем через 72 часа после госпитализации. Жизненные показатели, используемые для классификации подфенотипов, были ограничены жизненно важными показателями, измеренными до введения исследуемой жидкости (учитывая, что сама по себе жидкость может изменить траекторию основных показателей жизнедеятельности). Жизненно важные показатели были стандартизированы по среднему значению и стандартному отклонению исходных данных, а пациенты были классифицированы по траектории субфенотипа, которая привела к наименьшей среднеквадратичной ошибке [22, 23]. Клинические характеристики и исходы сравнивались между субфенотипами.
Первичный результат (30-дневная госпитальная смертность) в каждом субфенотипе сравнивался между группами лечения сбалансированными кристаллоидами и физиологическим раствором с поправкой на предварительно определенные исходные ковариаты [25, 29]. Гетерогенность эффекта лечения (HTE) была проверена в модели, включающей исходные ковариаты, субфенотипы, назначение лечения и условия взаимодействия между субфенотипом и назначением лечения. P-значения для HTE были рассчитаны с использованием теста отношения правдоподобия между вложенной моделью без условий взаимодействия и полной моделью с условиями взаимодействия. Имитационное исследование было проведено для проверки возможности применения модели траектории жизненно важных органов при точном зачислении в режиме реального времени в исследовании SMART (Suppleentary Methods).
Результаты
Ретроспективная когорта включала 20 729 пациентов с подозрением на инфекцию, которые получали антибиотики в течение 6 часов после поступления в больницу, из них 12 473 пациента из обучающей когорты (поступившей в период с 2014 по 2017 год) и 8256 пациентов из проверочной когорты (поступившей в период с 2018 по 2019 год) (Supplementary Fig. 1). Модель траектории с 4 группами имела самый высокий BIC среди моделей с адекватным распределением подгрупп (Supplementary Table 1) и имела среднюю апостериорную вероятность принадлежности к группе > 90% для всех субфенотипов. Представлена важность отдельных жизненно показателей в окончательной модели траектории (Supplementary Table 2).
Пациенты группы А (N = 3483, 28%) имели гипертермию, тахикардию и тахипноэ, относительную гипотензию. В группе Б (N = 1578, 13%) также была гипертермия, тахикардия и тахипноэ, но не столь выраженные, как в группе А, и была гипертензия. Группа C (N = 4044, 32%) и группа D (N = 3368, 27%) имели более низкую температуру, частоту сердечных сокращений и частоту дыхания, при этом группа C была нормотензивной, а группа D — наиболее гипотензивным субфенотипом. Формы траектории в когорте валидации были аналогичны когорте обучения (Fig. 1).


Одни только базовые показатели жизнедеятельности имели точность 69,6% в прогнозировании принадлежности к субфенотипу по сравнению с полной 8-часовой моделью, но каждый дополнительный час показателей жизнедеятельности значительно повышал точность (Supplementary Fig. 2).

В обучающей когорте было 6919 пациентов, отвечающих критериям сепсиса (определяемым как SOFA ≥ 2 в первые 24 часа). Группы A и B были моложе со средним возрастом 58 лет, тогда как группы C и D были старше со средним возрастом 70 и 69 лет соответственно (p < 0,001). Исходная распространенность сопутствующих заболеваний значительно различалась между субфенотипами (p < 0,001): в группе А была самая низкая распространенность застойной сердечной недостаточности (26%), артериальной гипертензии (59%), сахарного диабета (31%) и хронической болезни почек. 29%), но самая высокая распространенность метастатического рака (10%). В группе В была самая высокая распространенность застойной сердечной недостаточности (40%), артериальной гипертензии (91%) и хронической болезни почек (57%). Госпитализация в ОИТ была выше в группах A, B и D (39%, 33% и 33%), чем в группе C (22%) (p < 0,001). Потребность в заместительной почечной терапии во время госпитализации была самой высокой в группе В (p < 0,001). Использование вазопрессоров было выше в группах A и D, а использование инотропов было самым высоким в группе D (p < 0,001). 30-дневная госпитальная летальность значительно различалась между субфенотипами (p = 0,02): 3,8% для группы A, 2,2% для группы B, 2,4% для группы C и 3,7% для группы D (Table 1).

Среди 2759 пациентов с сепсисом в валидационной когорте относительное распределение демографических данных, сопутствующих заболеваний и исходов субфенотипов было таким же, как и в обучающей когорте (Table 1). В валидационной когорте госпитализация в ОИТ была выше в группах A, B и D по сравнению с группой C (p < 0,001); потребность в заместительной почечной терапии была самой высокой в группе В (p < 0,001); использование вазопрессоров было выше в группах А и D (p < 0,001). Смертность в субфенотипах составила 4,7% для группы А, 3,8% для группы В, 2,3% для группы С и 5,2% для группы D (р = 0,04). Относительное распределение характеристик субфенотипа также было сходным в общей когорте инфицированных пациентов и при различных критериях включения (Supplementary Tables 3–5).
Связь субфенотипов с лабораторными значениями
Несколько лабораторных маркеров значительно различались между 4 субфенотипами как в обучающей, так и в проверочной когортах. В обучающей когорте группа А имела самое высокое количество лейкоцитов, отношение нейтрофилов к лимфоцитам и уровень молочной кислоты (p < 0,001) (Fig. 2); Группа В имела самый высокий уровень креатинина и BNP в сыворотке крови (p < 0,001); В группах А и D альбумин был ниже (p < 0,001); В группе D был самый низкий гемоглобин (p < 0,001). Относительное распределение лабораторных значений было сходным в проверочной когорте (Supplementary Fig. 3, Supplementary Tables 6 & 7). Добавление лабораторных маркеров существенно не изменило принадлежность к субфенотипу (Supplementary Table 8).
Ассоциация субфенотипов со смертностью
В логистической регрессии с поправкой на возраст, и сопутствующие заболевания в группе C в проверочной когорте, 30-дневная смертность была значительно выше, чем в группе A (обучающая когорта: отношение шансов (ОШ) 1,96, 95% доверительный интервал (ДИ) 1,32– 2,91, р < 0,001; когорта проверки: ОШ 2,50, 95% ДИ 1,31–4,77, р = 0,005). Смертность также была значительно выше в группе D (обучающая когорта: ОШ 1,54, 95% ДИ 1,05–2,24, р = 0,03; проверочная когорта: ОШ 2,51,95% ДИ 1,35–4,68, р = 0,004) (Fig. 3).
 Неоднородность лечебного эффекта при внутривенном введении жидкостей
Неоднородность лечебного эффекта при внутривенном введении жидкостей
Из 1641 пациента с сепсисом в исследовании SMART 368 были исключены из-за отсутствия документально подтвержденных показателей жизнедеятельности до введения жидкости, 285 — из-за перевода из других больниц и 154 — из-за госпитализации более чем за 72 часа до включения в исследование. Критерии включения в когорту исследования SMART сравнивались с когортами наблюдения в Supplementary Table 9. 834 пациента исследования были разделены на 4 субфенотипа: группа A (N = 319, 38%), группа B (93, 11%). , группа C (100, 12%) и группа D (322, 39%). В соответствии с нашими первичными результатами группа A была самой молодой, а группа D — самой старшей (медиана 53 года против 63 лет, p <0,001). В группе А была самая низкая распространенность застойной сердечной недостаточности, артериальной гипертензии и хронической болезни почек. Группы B и D имели исходно высокую распространенность застойной сердечной недостаточности и хронической болезни почек. 30-дневная госпитальная летальность значительно различалась между субфенотипами (p = 0,02): группа A (21%), группа B (14%), группа C (22%) и группа D (28%) (SupplementaryTables 10 and 11).
В логистической регрессии группа D имела значительно более низкое ОШ 30-дневной смертности при использовании сбалансированных кристаллоидов по сравнению с физиологическим раствором (ОШ 0,39, 95% ДИ 0,23–0,67, p <0,001) (Fig. 4). Отмечалась значительная гетерогенность результата лечения между субфенотипом и назначением лечения при прогнозировании 30-дневной смертности (p = 0,03). В анализе чувствительности, ограниченном пациентами с полным набором из 3 показателей жизнедеятельности до введения жидкости (N = 335), сохранялась значительная HTE (p = 0,04) с более низким OR смертности при использовании сбалансированных кристаллоидов в группе D (OR 0,35, 95 % ДИ 0,15–0,79, р = 0,01). В 1000 симуляционных экспериментах по классификации исследуемых пациентов в реальном времени 607 экспериментов выявили достаточно значительное преимущество в отношении смертности от сбалансированных кристаллоидов в группе D, чтобы гарантировать досрочное прекращение клинического испытания (разница в смертности> 10% при значении p <0,05) (Supplementary Table 12).
Обсуждение
Мы представляем новые динамические субфенотипы, разработанные и подтвержденные с использованием универсально доступных показателей жизнедеятельности широкой группы пациентов, поступающих в отделение неотложной помощи с подозрением на инфекцию. Субфенотипы демонстрируют сильную обобщаемость у пациентов с сепсисом в обучающей когорте и разной во времени проверочной когорте, а также у пациентов в критическом состоянии с сепсисом в когорте РКИ из другого учреждения. Субфенотипы имеют различные исходные характеристики, лабораторные отклонения и характер дисфункции органов. Наконец, субфенотипы демонстрируют значительно различающиеся ответы на сбалансированные кристаллоиды и физиологический раствор, что позволяет предположить, что эти субфенотипы могут играть роль в персонифицированном подходе у больных с сепсисом.
Будет ли у пациента с инфекцией развиваться органная дисфункция и сепсис, часто неясно при поступлении в отделение неотложной помощи. Субдфенотипы траекторий жизненно важных функций были разработаны на широкой когорте пациентов с подозрением на инфекцию, чтобы модель можно было применить к пациентам с установленным сепсисом или без него на момент поступления. Используя эту обобщенную модель субфенотипа, мы получили надежные результаты с аналогичным распределением клинических характеристик субфенотипа и исходов у пациентов с инфекцией, пациентов с сепсисом, пациентов, отвечающих критериям SIRS, пациентов со скудными данными о показателях жизнедеятельности и пациентов с сепсисом в ОИТ.

Предыдущие исследования по подтипированию острого респираторного дистресс-синдрома (ОРДС) и сепсиса выявили от двух до шести субфенотипов, при этом в некоторых исследованиях использовались транскриптомные данные, а в других — клинические данные из электронных медицинских карт и РКИ [7, 30]. Calfee et al. выявили два последовательных субфенотипа ОРДС в нескольких исследованиях с различиями в воспалительных биомаркерах и ответах на лечение [31]. При сепсисе наблюдается большая вариабельность клинических субфенотипов. Seymour et al. идентифицировали четыре субфенотипа с использованием лабораторных и витальных данных, но эти субфенотипы не имели значительного взаимодействия с лечением в РКИ [8]. Shankar-Hari et al. идентифицировали два субфенотипа в исследовании VANISH и три субфенотипа в исследовании LeoPARDS, используя клинические данные и данные биомаркеров, с постоянным гипервоспалительным субфенотипом, связанным с более высокой смертностью, но без гетерогенности результатов лечения [7]. Gardlund et al. сообщили о шести субфенотипах септического шока, используя исследование PROWESS Shock Study без различий в эффектах лечения между группами [11].
Отсутствие различий в лечении больных с различными субфенотипами сепсиса может быть связано с отсутствием статистической мощности, дизайном клинических испытаний (объяснительным, а не прагматическим) или истинным отсутствием гетерогенности результатов лечения [7, 32]. Отличительными преимуществами наших клинических субфенотипов являются: (1) использование рутинных измерений у постели больного, (2) использование измерений в динамике (3) идентификация гетерогенности результатов лечения по типу используемых инфузионных растворов.
Сепсис — это динамический процесс, характеризующийся быстро развивающимися физиологическими реакциями, которые не могут быть адекватно зафиксированы статическими измерениями [14, 33]. По сравнению с традиционными методами статической кластеризации, GBTM имеет то преимущество, что моделирует динамическую эволюцию физиологии с течением времени. Кроме того, субфенотипы GBTM представлены клинически интерпретируемыми траекториями клинических переменных. Когда GBTM применяли к нашей когорте, мы обнаружили, что группа А представляла собой субфенотип гипертермии, тахикардии, тахипноэ и гипотензии. Группа А имела высокий уровень лактата, количество лейкоцитов и отношение нейтрофилов к лимфоцитам. В группе В были гипертермия, тахикардия и тахипноэ, но не в такой степени, как в группе А.
Кроме того, у этих пациентов была артериальная гипертензия и высокая распространенность исходных сопутствующих заболеваний, включая застойную сердечную недостаточность и хроническую болезнь почек. Группы C и D имели более низкую температуру, частоту сердечных сокращений и частоту дыхания. Группа С была нормотензивной, в то время как группа D была наиболее гипотензивным субфенотипом. Группы A и Dимели более высокое отношение шансов смертности как в обучающих, так и в проверочных когортах по сравнению с группой C (считавшейся контрольной группой, поскольку она была преобладающим субфенотипом).
Одним из наиболее распространенных вмешательств при сепсисе является внутривенное введение жидкостей. Имеются данные о том, что динамические жизненные показатели могут определять стратегии инфузионной терапии [34–36]. При вторичном анализе исследования SMART мы обнаружили значительную неоднородность лечебного эффекта сбалансированных кристаллоидов по сравнению с физиологическим раствором для субфенотипов. Группа D (с низкой температурой, частотой сердечных сокращений и частотой дыхания и гипотензией) имела наибольшую пользу от сбалансированных кристаллоидов по сравнению с физиологическим раствором со значительно более низкой 30-дневной госпитальной смертностью. В будущих клинических испытаниях группа D может стать целевым субфенотипом для точного включения в исследование, где сравнивают сбалансированные кристаллоиды и физиологический раствор. Разработка этой модели траектории потребовала трех наборов основных показателей жизнедеятельности в течение первых 8 часов. Однако модель можно применять в режиме реального времени без использования всех 8 часов для классификации субфенотипов. Возможность применения в режиме реального времени была продемонстрирована с помощью симуляционного исследования, в котором пациенты в исследовании SMART были отнесены к группе D, если они соответствовали заранее определенному порогу вероятности.
Мы обнаружили, что большинство смоделированных испытаний приводили к раннему прекращению лечения из-за обнаружения клинически и статистически значимого преимущества сбалансированных кристаллоидов в отношении смертности в группе D.
Исследование имеет несколько ограничений. Во-первых, ретроспективный характер исследования ограничивает анализ причинно-следственных связей. Во-вторых, вторичный анализ РКИ может быть недостаточным для выявления гетерогенного ответа на лечение. В-третьих, исследование SALT-ED может служить дополнительной когортой для оценки субфенотипической модификации эффекта лечения у пациентов, которые были госпитализированы в ОИТ. В-четвертых, временные субфенотипы могут быть изменены путем лечения в пределах окна субфенотипирования. В-пятых, лабораторные маркеры были собраны в соответствии с клиническими показаниями, что привело к отсутствию полных данных. В-шестых, вариабельность измерения частоты дыхания может возникать из-за метода измерения (прикроватные мониторы по сравнению с визуальными измерениями). Наконец, эти данные нельзя экстраполировать на пациентов с внутрибольничными инфекциями.
Субфенотипы траектории жизненно важных функций с отчетливыми клиническими характеристиками и профилями дисфункции органов отражают динамическую сложность сепсиса. Эти субфенотипы могут по-разному реагировать на стратегии лечения сепсиса. Наконец, субфенотипы могут быть использованы для точного включения в будущие клинические испытания и могут сыграть роль в переходе от универсального подхода к подходу прецизионной медицины в лечении сепсиса.
Ссылка на документ с дополнительными данными исследования (Supplementary)
References
1. Buchman TG et al (2020) Sepsis among medicare beneficiaries: 3 the methods, models, and forecasts of sepsis,2012–2018. Critical Care Med 48:302–318.
https://doi.org/10.1097/ccm.0000000000004225
2. Rhee C et al (2017) Incidence and trends of sepsis in US Hospitals using clinical vs claims data, 2009–2014.JAMA 318:1241–1249.
https://doi.org/ 10.1001/jama.2017.13836
3. Singer M et al (2016) The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA315:801–810.
https://doi.org/10. 1001/jama.2016.0287
4. Santacruz CA, Pereira AJ, Celis E, Vincent J-L (2019) Which multicenter ran- domized controlled trials in criticalcare medicine have shown reduced mortality? A systematic review. Crit Care Med 47:1680–1691.
https://doi.org/10.1097/ccm.0000000000004000
5. Prescott HC, Calfee CS, Thompson BT, Angus DC, Liu VX (2016) Toward smarter lumping and smarter splitting:rethinking strategies for sepsis and acute respiratory distress syndrome clinical trial design. Am J Respir Crit Care Med194:147–155.
https://doi.org/10.1164/rccm.201512-2544CP
6. Maslove DM et al (2022) Redefining critical illness. Nat Med 28:1141– 1148.
https://doi.org/10.1038/s41591-022-01843-x
7. Shankar-Hari M et al (2021) Defining phenotypes and treatment effect heterogeneity to inform acute respiratorydistress syndrome and sepsis trials: secondary analyses of three RCTs. Efficacy Mech Eval 8:1–104
8. Seymour CW et al (2019) Derivation, validation, and potential treatment implications of novel clinical phenotypes for sepsis. JAMA 321:2003– 2017.
https://doi.org/10.1001/jama.2019.5791
9. Zhang Z, Zhang G, Goyal H, Mo L, Hong Y (2018) Identification of sub- classes of sepsis that showed different clinical outcomes and responses to amount of fluid resuscitation: a latent profile analysis. Crit Care 22:347.
https://doi.org/10.1186/s13054-018-2279-3
10. Knox DB, Lanspa MJ, Kuttler KG, Brewer SC, Brown SM (2015) Pheno- typic clusters within sepsis-associatedmultiple organ dysfunction syndrome. Intensive Care Med 41:814–822.
https://doi.org/10.1007/ s00134-015-3764-7
11. Gårdlund B et al (2018) Six subphenotypes in septic shock: latent class analysis of the PROWESS Shock study. J Crit Care 47:70–79.
https://doi. org/10.1016/j.jcrc.2018.06.012
12. Cazalis MA et al (2014) Early and dynamic changes in gene expression in septic shock patients: a genome-wideapproach. Intensive Care Med Exp 2:20.
https://doi.org/10.1186/s40635-014-0020-3
13. Maslove DM, Wong HR (2014) Gene expression profiling in sepsis: timing, tissue, and translationalconsiderations. Trends Mol Med 20:204–213.
https://doi.org/10.1016/j.molmed.2014.01.006
14. Namas RA, Vodovotz Y (2016) From static to dynamic: a sepsis-specific dynamic model from clinical criteria in polytrauma patients. Ann Transl Med 4:492.
https://doi.org/10.21037/atm.2016.11.72
15. Reddy K et al (2020) Subphenotypes in critical care: translation into clinical practice. Lancet Respir Med 8:631–643.
https://doi.org/10.1016/ S2213-2600(20)30124-7
16. Kwan A, Hubank M, Rashid A, Klein N, Peters MJ (2013) Transcriptional instability during evolving sepsis may limit biomarker based risk stratifica- tion. PLoS ONE 8:e60501.
https://doi.org/10.1371/journal.pone.0060501
17. Wong HR et al (2018) Endotype transitions during the acute phase of pediatric septic shock reflect changing risk and treatment response. Crit Care Med 46:e242–e249.
https://doi.org/10.1097/ccm.0000000000 002932
18. Hollen MK et al (2019) Myeloid-derived suppressor cell function and epigenetic expression evolves over timeafter surgical sepsis. Crit Care 23:355.
https://doi.org/10.1186/s13054-019-2628-x
19. Sweeney TE, Shidham A, Wong HR, Khatri P (2015) A comprehensive time-course-based multicohort analysis of sepsis and sterile inflamma- tion reveals a robust diagnostic gene set. Sci Transl Med 7:287ra271.
https://doi.org/10.1126/scitranslmed.aaa5993
20. Bhavani SV et al (2019) Identifying novel sepsis subphenotypes using temperature trajectories. Am J Respir CritCare Med.
https://doi.org/10. 1164/rccm.201806-1197OC
21. Bhavani SV, Huang ES, Verhoef PA, Churpek MM (2020) Novel temperature trajectory subphenotypes in COVID-19. Chest.
https://doi.org/10.1016/j. chest.2020.07.027
22. Bhavani SV et al (2022) Coronavirus disease 2019 temperature trajectories correlate with hyperinflammatory andhypercoagulable subphenotypes. Crit Care Med 50:212–223.
https://doi.org/10.1097/ccm.0000000000 005397
23. Bhavani SV et al (2020) Temperature trajectory subphenotypes cor- relate with immune responses in patients withsepsis. Crit Care Med 48:1645–1653.
https://doi.org/10.1097/ccm.0000000000004610
24 Yehya N et al (2021) Temperature trajectory sub-phenotypes and the immuno-inflammatory response in pediatricsepsis. Shock.
https://doi. org/10.1097/shk.0000000000001906
25. Semler MW et al (2018) Balanced crystalloids versus saline in critically ill adults. N Engl J Med 378:829–839.
https://doi.org/10.1056/NEJMoa1711 584
26. Churpek MM, Zadravecz FJ, Winslow C, Howell MD, Edelson DP (2015) Incidence and prognostic value of thesystemic inflammatory response syndrome and organ dysfunctions in ward patients. Am J Respir Crit Care Med 192:958–964.
https://doi.org/10.1164/rccm.201502-0275OC
27. Nagin DS, Jones BL, Passos VL, Tremblay RE (2018) Group-based multi- trajectory modeling. Stat Methods MedRes 27:2015–2023.
https://doi. org/10.1177/0962280216673085
28. Nagin DS, Odgers CL (2010) Group-based trajectory modeling in clinical research. Annu Rev Clin Psychol6:109–138.
https://doi.org/10.1146/annur ev.clinpsy.121208.131413
29 Brown RM et al (2019) Balanced crystalloids versus saline in sepsis. A secondary analysis of the SMART clinicaltrial. Am J Respir Crit Care Med 200:1487–1495.
https://doi.org/10.1164/rccm.201903-0557OC
30. Stanski NL, Wong HR (2020) Prognostic and predictive enrich- ment in sepsis. Nat Rev Nephrol 16:20–31.
https://doi.org/10.1038/ s41581-019-0199-3
31. Calfee CS et al (2014) Subphenotypes in acute respiratory distress syn- drome: latent class analysis of data fromtwo randomised controlled trials. Lancet Respir Med 2:611–620.
https://doi.org/10.1016/S2213-2600(14) 70097-9
32. Santhakumaran S et al (2019) Heterogeneity of treatment effect by baseline risk of mortality in critically ill patients:re-analysis of three recent sepsis and ARDS randomised controlled trials. Crit Care 23:156.
https://doi.org/10.1186/s13054-019-2446-1
33. Mayaud L et al (2013) Dynamic data during hypotensive episode improves mortality predictions among patientswith sepsis and hypoten- sion. Crit Care Med 41:954–962.
https://doi.org/10.1097/CCM.0b013 e3182772adb
34. Gu Q, Prasad V, Heldt T (2019) Characterizing fluid response and sepsis progression in emergency departmentpatients. In: Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEEEngineering in Medicine and Biology Society. Annual International Conference
https://doi.org/10.1109/embc.2019.8856521
35. Prasad V, Lynch JC, Filbin MR, Reisner AT, Heldt T (2019) Clustering blood pressure trajectories in septic shock in the emergency department. In: Annual International Conference of the IEEE Engineering in Medicine and BiologySociety. IEEE Engineering in Medicine and Biology Society. Annual International Conference, 494–497,doi:
https://doi.org/10.1109/ embc.2019.8857191
36. Brown SM et al (2016) Multi-complexity measures of heart rate variability and the effect of vasopressor titration: a prospective cohort study of patients with septic shock. BMC Infect Dis 16:551.
https://doi.org/10. 1186/s12879-016-1896-1
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 21.12.2022
[~DATE_ACTIVE_FROM] => 21.12.2022
[ACTIVE_FROM_X] => 2022-12-21 00:00:00
[~ACTIVE_FROM_X] => 2022-12-21 00:00:00
[ACTIVE_FROM] => 21.12.2022
[~ACTIVE_FROM] => 21.12.2022
[SHOW_COUNTER] => 866
[~SHOW_COUNTER] => 866
[ID] => 8320
[~ID] => 8320
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 11.11.2024 15:27:09
[~TIMESTAMP_X] => 11.11.2024 15:27:09
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/razrabotka-i-proverka-novykh-subfenotipov-sepsisa-s-ispolzovaniem-traektoriy-osnovnykh-pokazateley-zh/
[~DETAIL_PAGE_URL] => /library/articles/razrabotka-i-proverka-novykh-subfenotipov-sepsisa-s-ispolzovaniem-traektoriy-osnovnykh-pokazateley-zh/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => razrabotka-i-proverka-novykh-subfenotipov-sepsisa-s-ispolzovaniem-traektoriy-osnovnykh-pokazateley-zh
[~CODE] => razrabotka-i-proverka-novykh-subfenotipov-sepsisa-s-ispolzovaniem-traektoriy-osnovnykh-pokazateley-zh
[EXTERNAL_ID] => 8320
[~EXTERNAL_ID] => 8320
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 21 декабря 2022
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Разработка и проверка новых субфенотипов сепсиса с использованием траекторий основных показателей жизнедеятельности
[PREVIEW_PICTURE] => Array
(
[ID] => 5078
[TIMESTAMP_X] => 11.11.2024 15:27:09
[MODULE_ID] => iblock
[HEIGHT] => 493
[WIDTH] => 877
[FILE_SIZE] => 62434
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/c7f/kr12k42mpv5wevsmw1y8gxbxoa85v84l
[FILE_NAME] => closeup-scientist-doctor-looking-into-medical-microscope-analyzing-blood-sample-during-scientific-experiment-biochemistry-laboratory-researcher-man-developing-vaccine-against-covid19.jpg
[ORIGINAL_NAME] => closeup-scientist-doctor-looking-into-medical-microscope-analyzing-blood-sample-during-scientific-experiment-biochemistry-laboratory-researcher-man-developing-vaccine-against-covid19.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => f3132976644484bae4ca12e8bf5e0457
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/c7f/kr12k42mpv5wevsmw1y8gxbxoa85v84l/closeup-scientist-doctor-looking-into-medical-microscope-analyzing-blood-sample-during-scientific-experiment-biochemistry-laboratory-researcher-man-developing-vaccine-against-covid19.jpg
[UNSAFE_SRC] => /upload/iblock/c7f/kr12k42mpv5wevsmw1y8gxbxoa85v84l/closeup-scientist-doctor-looking-into-medical-microscope-analyzing-blood-sample-during-scientific-experiment-biochemistry-laboratory-researcher-man-developing-vaccine-against-covid19.jpg
[SAFE_SRC] => /upload/iblock/c7f/kr12k42mpv5wevsmw1y8gxbxoa85v84l/closeup-scientist-doctor-looking-into-medical-microscope-analyzing-blood-sample-during-scientific-experiment-biochemistry-laboratory-researcher-man-developing-vaccine-against-covid19.jpg
[ALT] => Разработка и проверка новых субфенотипов сепсиса с использованием траекторий основных показателей жизнедеятельности
[TITLE] => Разработка и проверка новых субфенотипов сепсиса с использованием траекторий основных показателей жизнедеятельности
)
[DETAIL_TEXT] =>
Bhavani SV, Semle M, Qian ET et al. Development and validation of novel sepsis subphenotypes using trajectories ofvital signs.
Разработка и проверка новых субфенотипов сепсиса с использованием траекторий основных показателей жизнедеятельности.
Intensive Care Med https://doi.org/10.1007/s00134-022-06890-z
Абстракт
Сепсис является гетерогенным синдромом, и идентификация субфенотипов имеет важное значение. В этом исследовании использовались траектории основных показателей жизнедеятельности для разработки и проверки субфенотипов и изучалось взаимодействие субфенотипов с лечением на основании данных рандомизированных контролируемых испытаний. Были включены все пациенты с подозрением на инфекцию, поступившие в четыре академических госпиталя Emory Healthcare в период с 2014–2017 гг. (основная группа) и 2018–2019 гг. (группа сравнения). Групповое моделирование траектории применялось к показателям жизненно важных функций с первых 8 часов госпитализации для разработки и проверки субфенотипов на основании траекторий жизненно важных функций. Ассоциации между субфенотипами и исходами оценивались у пациентов с сепсисом. Взаимодействие между субфенотипом и лечением сбалансированными кристаллоидами по сравнению с физиологическим раствором было проверено во вторичном анализе SMART (Isotonic Solutions and Major AdverseRenal Events Trial). Включено 12 473 пациента с подозрением на инфекцию в основную группу и 8256 пациентов в группу сравнения, и было обнаружено 4 субфенотипа жизненно важных функций. В группе А (N=3483, 28%) выявлены гипертермия, тахикардия, тахипноэ и гипотензия. В группе В (N=1578, 13%) была гипертермия, тахикардия, тахипноэ (не такие выраженная, как группа А) , а также гипертенизия. Группы C (N= 4044, 32%) и D(N= 3368, 27%) имели более низкую температуру, частоту сердечных сокращений и частоту дыхания, причем группа C была нормотензивной, а группа D гипотензивной. Среди 6919 пациентов с сепсисом группы А и В были моложе, а группы С и D — старше. В группе А была самая низкая распространенность застойной сердечной недостаточности, гипертонии, сахарного диабета и хронической болезни почек, в то время как в группе В была самая высокая распространенность данных состояний. В группах A и D чаще всего использовались вазопрессоры (p < 0,001 для всех вышеприведенных анализов). В логистической регрессии 30-дневная смертность была значительно выше в группах А и D (p < 0,001 и p = 0,03 соответственно). В исследовании SMART субфенотип значительно модифицировал эффект лечения (p = 0,03). Группа D имела значительно более низкие шансы смертности при использовании сбалансированных кристаллоидов по сравнению с физиологическим раствором (отношение шансов (ОШ) 0,39, 95% доверительный интервал (ДИ) 0,23–0,67, р <0,001). Субфенотипы сепсиса, основанные на траектории основных показателей жизнедеятельности, были одинаковыми в когортах, имели различные исходы и разные ответы на лечение сбалансированными кристаллоидами по сравнению с физиологическим раствором.
Take‐home message
В многоцентровом ретроспективном анализе 20 729 госпитализированных пациентов с подозрением на инфекцию были выявлены четыре субфенотипа, соответствующие различным траекториям основных показателей жизнедеятельности в течение первых 8 часов госпитализации. Эти субфенотипы траектории жизненно важных функций имели различные исходные клинические характеристики, лабораторные отклонения, профили дисфункции органов и исходы. Во вторичном анализе рандомизированного контрольного исследования SMARTсубфенотип значительно изменил влияние внутривенного введения жидкости на смертность. Четыре субфенотипа сепсиса, основанные на общедоступных показателях жизненно важных функций, могут иметь разный ответ на лечение и могут способствовать точному включению в последующие клинические исследования.
Введение
Сепсис представляет собой гетерогенный синдром, характеризующийся нерегулируемой реакцией хозяина на инфекцию, что ежегодно приводит к 270 000 смертей и расходам на лечение в госпитальном секторе США на сумму 60 миллиардов долларов [1–3]. Десятилетия клинических испытаний не выявили методов лечения, которые бы постоянно приносили пользу пациентам с сепсисом в целом [4]. Предполагается, что эти отрицательные результаты возникают из-за вариабельности реакции пациентов на лечение [5]. Таким образом, разделение гетерогенного синдрома сепсиса на отдельные «физиологические интересующие состояния» может привести к прецизионной терапии, нацеленной на корригируемые симптомы [6].
Предыдущие исследования выявили от двух до шести подфенотипов сепсиса путем применения неконтролируемых подходов, таких как анализ k-средних и латентного класса, к клиническим данным и биомаркерам из электронных медицинских карт и рандомизированных контрольных исследований [7–11]. Большинство исследований идентифицировали субфенотипы с использованием статических измерений биомаркеров или основных показателей жизнедеятельности. Однако сепсис представляет собой динамический процесс с биологическими и физиологическими реакциями, которые развиваются от нескольких минут до нескольких часов [12–14]. Эта «временная нестабильность» сепсиса предполагает, что статические данные лабораторных и жизненно важных органов могут не идентифицировать субфенотипы, которые динамически изменяются во времени [15–19].
Использование лонгитюдных данных может более точно идентифицировать субфенотипы сепсиса, которые различаются по клиническим характеристикам, исходам и ответам на лечение [20–24]. Кроме того, рутинные измерения у постели больного, такие как показатели жизненно важных функций, могут позволить повысить точность оценки при включении пациента в клинические испытания.
Большинство моделей субфенотипов разрабатываются с использованием данных пациентов, поступивших в отделение неотложной помощи с установленной дисфункцией органов и сепсисом. Однако это исключает информативные данные о пациента с инфекцией, у которых позже во время госпитализации разовьется сепсис. Чтобы разработать модель субфенотипа для предполагаемого внедрения в отделение неотложной помощи, модель в идеале должна быть обобщаемой и применимой ко всем пациентам с инфекцией, потому что на момент представления будет неясно, какие пациенты в дальнейшем будут соответствовать формальным критериям сепсиса. Это исследование было разработано с учетом перспективного внедрения, и поэтому мы решили разработать и проверить модель субфенотипа сепсиса у всех пациентов с подозрением на инфекцию, а затем оценить эффективность модели конкретно у пациентов с сепсисом.
Цели этого исследования состояли в том, чтобы: (1) разработать и обосновать динамические субфенотипы у пациентов с инфекцией с использованием показателей жизнедеятельности (температура, частота сердечных сокращений, частота дыхания и артериальное давление), измеренных в течение первых 8 часов госпитализации; (2) оценить клинические характеристики и исходы субфенотипов жизненно важных функций у пациентов с сепсисом; (3) проверить, изменяет ли субфенотип влияние лечения сбалансированными кристаллоидами по сравнению с физиологическим раствором на смертность у пациентов с сепсисом, используя данные рандомизированного контролируемого исследования [25].
Методы
Дизайн исследования
Первая часть исследования представляла собой ретроспективное обсервационное исследование, проведенное в системе Emory Healthcare для разработки и проверки субфенотипов траектории жизненно важных функций. Вторая часть исследования представляла собой вторичный анализ данных на уровне пациентов, полученных в ходе исследования SMART, проведенного в Vanderbilt University Medical Center. Ретроспективное обсервационное исследование было одобрено Emory Institutional Review Board с отказом от информированного согласия, а вторичный анализ обезличенных данных из РКИ был сочтен Emory IRB исследованием без участия людей (STUDY00001815).
Изучаемая когорта
В обсервационном исследовании все взрослые пациенты, поступившие через отделение неотложной помощи в четыре больницы системы Emory Healthcare в период с января 2014 г. по декабрь 2019 г., имели право на включение в исследование. Пациенты с подозрением на инфекцию были идентифицированы в электронной медицинской карте на основании использования антибиотиков (перорально или парентерально) и сбора культур биологических жидкостей (кровь, моча или спинномозговая жидкость) для микробиологического исследования [8], при этом когорта дополнительно ограничивалась пациентами, которые получали антибиотики в течение 6 часов после поступления. Пациенты, которые умерли или были выписаны в течение первых 8 часов, были исключены, поскольку при анализе использовались показатели жизненно важных функций в первые 8 часов госпитализации. Пациенты, переведенные в другие больницы, были исключены из-за неполной информации о результатах. Наконец, пациенты с менее, чем тремя полными наборами показателей жизнедеятельности в первые 8 часов, были исключены, поскольку разработка модели требует многократных измерений.
Многоцентровые когорты пациентов с подозрением на инфекцию были разделены на обучающую и валидационную выборки по годам поступления, причем госпитализированные в период с 2014 по 2017 г. были разделены на обучающие, а госпитализированные в период с 2018 по 2019 г. — на валидационные.
Разная во времени когорта валидации была разработана для имитации предполагаемой реализации модели субфенотипа в четырех больницах для проверки обобщаемости. Учитывая цель эмулировать проспективное внедрение, когда у нас не было бы информации о том, будет ли пациент соответствовать формальным критериям сепсиса, мы разработали и утвердили модель субфенотипа для всех пациентов, поступающих в отделение неотложной помощи с подозрением на инфекцию.
Измерение основных показателей жизнедеятельности
Были включены оральная температура, частота сердечных сокращений, частота дыхания, систолическое и диастолическое артериальное давление за первые 8 часов поступления в стационар. Ошибочные записи основных показателей жизнедеятельности были идентифицированы и исключены в соответствии с предыдущими публикациями [26]. Данные о жизненно важных показателях были разделены на восемь часовых блоков времени. Для отсутствующих показателей жизнедеятельности (т. е. показателей жизнедеятельности, измеренных в определенный час) процесс условного исчисления не применялся, поскольку описанный ниже алгоритм групповой траекторной модели (GBTM) обрабатывает отсутствующие данные посредством оценки правдоподобия. Если в течение 1 часа были доступны несколько измерений, для анализа использовалось среднее значение. Все жизненные показатели в обучающей и валидационной когорте были стандартизированы по среднему значению и стандартному отклонению этого жизненного показателя в этой когорте.
Разработка и проверка групповой модели траектории
Алгоритм GBTM был применен к данным жизненно важных органов в обучающей когорте. GBTMпредставляет собой приложение моделирования конечных данных и используется для идентификации групп людей, следующих по сходным траекториям переменных во времени [27, 28]. Алгоритм вычисляет базовые коэффициенты для полиномиальных функций, описывающих траектории основных показателей жизнедеятельности во времени для каждой из групп. Перед подгонкой модели мы использовали тестирование отношения правдоподобия, чтобы определить наиболее подходящую полиномиальную форму для каждого жизненно важного признака (т. е. линейную или квадратичную). Используя GBTM, мы заранее определили выбранные полиномиальные формы для каждого жизненно важного признака и протестировали двух-, трех-, четырех-, пяти- и шестигрупповые модели. Полученные модели с разным количеством субфенотипов сравнивались с использованием: (1) байесовских информационных критериев (BIC) — показателя того, насколько хорошо модель соответствует данным, со штрафом за возрастающую сложность, и (2) распределения по подгруппам — если один или более субфенотипов содержали менее пяти процентов когорты, модель не подходила для отбора.
После выбора оптимальной модели пациентам присваивался субфенотип, для которого у них была наибольшая вероятность принадлежности к группе. Соответствие модели оценивали путем обеспечения того, чтобы средняя апостериорная вероятность принадлежности к группе составляла ≥ 70% для всех субфенотипов. Согласованность между полной 8-часовой моделью и экономными моделями с данными о жизненно важных показателях за 1–7 часов оценивалась для проверки того, достаточно ли для классификации меньшего количества измерений основных показателей жизнедеятельности. Затем к проверочным данным была применена полная 8-часовая обучающая модель: субфенотипы определяются набором из пяти уникальных полиномиальных функций, описывающих каждый жизненный показатель как функцию времени от поступления в больницу (т. е. температура = β
0 + β
1 Время + β
2 Время
2). Как и в предыдущей работе, пациенты в когорте проверки были классифицированы по траектории субфенотипа, которая привела к наименьшей среднеквадратичной ошибке [22, 23].
Эффективность модели у пациентов с сепсисом в когортах обучения и проверки
Пациенты с сепсисом были идентифицированы из общей когорты инфицированных пациентов с помощью шкалы SOFA с показателем ≥ 2 в первые 24 часа после поступления. Различия в демографии, сопутствующих заболеваниях и клинических характеристиках между субфенотипами у пациентов с сепсисом сравнивались с использованием дисперсионного анализа (ANOVA) или критерия хи-квадрат, в зависимости от ситуации. Субфенотипы сепсиса оценивались на предмет связи с необходимостью заместительной почечной терапии, искусственной вентиляции легких, вазопрессоров, инотропов и 30-дневной госпитальной летальности. Вышеуказанные анализы были повторены для (1) общей когорты пациентов с инфекцией, (2) пациентов с подозрением на инфекцию, отвечающих ≥ 2 критериям синдрома системного воспалительного ответа (SIRS) в первые 24 часа, и (3) пациентов с подозрением на инфекцию и менее 3 наборов основных показателей жизнедеятельности в первые 8 часов.
Связь субфенотипов с лабораторными показателями
Лабораторные показатели первых 24 часов госпитализации сравнивались между субфенотипами: количество лейкоцитов (WBC), абсолютное количество нейтрофилов, абсолютное количество лимфоцитов, соотношение нейтрофилов к лимфоцитам, С-реактивный белок (СРБ), скорость оседания эритроцитов (СОЭ), гемоглобин, тромбоциты, международное нормализованное отношение (МНО), креатинин сыворотки, альбумин, общий билирубин, B-натрийуретический пептид (BNP) и молочная кислота. Если у пациента было несколько лабораторных измерений, использовалось максимальное значение за первые 24 часа госпитализации (для гемоглобина, тромбоцитов и альбумина использовалось минимальное значение). Для отсутствующих лабораторных показателей не использовался процесс условного исчисления. Лабораторные значения сравнивали между субфенотипами с помощью ANOVA. С учетом предварительно заданного набора из 14 лабораторных тестов все значимые тесты были скорректированы для множественного тестирования с использованием поправки Бонферрони.
Мы проверили, значительно ли добавление лабораторных значений к модели GBTM изменило определение субфенотипов по сравнению с моделью оценки только жизненно важных функций.
Ассоциация субфенотипов со смертностью
Первичным прогностическим исходом была 30-дневная госпитальная летальность. Логистическая регрессия была выполнена для оценки связи между субфенотипами и 30-дневной смертностью с поправкой на возраст, пол, расу и сопутствующие заболевания (застойная сердечная недостаточность, хроническое заболевание легких, сахарный диабет, гипертония, хроническое заболевание почек, заболевание печени и метастатическое рак). Референтной группой служил наиболее распространенный субфенотип в общей когорте.
Неоднородность лечебного эффекта при внутривенном введении жидкостей
Исследование SMART представляло собой кластерно-рандомизированное кластерно-перекрестное исследование, в котором сравнивали сбалансированные кристаллоиды и физиологический раствор у взрослых в критическом состоянии, госпитализированных в Медицинский центр Университета Вандербильта [25]. Во вторичном анализе исследования SMART модель траектории жизненно важных функций была применена к жизненно важным показателям с первых 8 часов госпитализации для пациентов, включенных в исследование с диагнозом сепсис. Мы исключили пациентов, переведенных из других больниц, и тех, кто был переведен в отделение интенсивной терапии (ОИТ) более, чем через 72 часа после госпитализации. Жизненные показатели, используемые для классификации подфенотипов, были ограничены жизненно важными показателями, измеренными до введения исследуемой жидкости (учитывая, что сама по себе жидкость может изменить траекторию основных показателей жизнедеятельности). Жизненно важные показатели были стандартизированы по среднему значению и стандартному отклонению исходных данных, а пациенты были классифицированы по траектории субфенотипа, которая привела к наименьшей среднеквадратичной ошибке [22, 23]. Клинические характеристики и исходы сравнивались между субфенотипами.
Первичный результат (30-дневная госпитальная смертность) в каждом субфенотипе сравнивался между группами лечения сбалансированными кристаллоидами и физиологическим раствором с поправкой на предварительно определенные исходные ковариаты [25, 29]. Гетерогенность эффекта лечения (HTE) была проверена в модели, включающей исходные ковариаты, субфенотипы, назначение лечения и условия взаимодействия между субфенотипом и назначением лечения. P-значения для HTE были рассчитаны с использованием теста отношения правдоподобия между вложенной моделью без условий взаимодействия и полной моделью с условиями взаимодействия. Имитационное исследование было проведено для проверки возможности применения модели траектории жизненно важных органов при точном зачислении в режиме реального времени в исследовании SMART (Suppleentary Methods).
Результаты
Ретроспективная когорта включала 20 729 пациентов с подозрением на инфекцию, которые получали антибиотики в течение 6 часов после поступления в больницу, из них 12 473 пациента из обучающей когорты (поступившей в период с 2014 по 2017 год) и 8256 пациентов из проверочной когорты (поступившей в период с 2018 по 2019 год) (Supplementary Fig. 1). Модель траектории с 4 группами имела самый высокий BIC среди моделей с адекватным распределением подгрупп (Supplementary Table 1) и имела среднюю апостериорную вероятность принадлежности к группе > 90% для всех субфенотипов. Представлена важность отдельных жизненно показателей в окончательной модели траектории (Supplementary Table 2).
Пациенты группы А (N = 3483, 28%) имели гипертермию, тахикардию и тахипноэ, относительную гипотензию. В группе Б (N = 1578, 13%) также была гипертермия, тахикардия и тахипноэ, но не столь выраженные, как в группе А, и была гипертензия. Группа C (N = 4044, 32%) и группа D (N = 3368, 27%) имели более низкую температуру, частоту сердечных сокращений и частоту дыхания, при этом группа C была нормотензивной, а группа D — наиболее гипотензивным субфенотипом. Формы траектории в когорте валидации были аналогичны когорте обучения (Fig. 1).


Одни только базовые показатели жизнедеятельности имели точность 69,6% в прогнозировании принадлежности к субфенотипу по сравнению с полной 8-часовой моделью, но каждый дополнительный час показателей жизнедеятельности значительно повышал точность (Supplementary Fig. 2).

В обучающей когорте было 6919 пациентов, отвечающих критериям сепсиса (определяемым как SOFA ≥ 2 в первые 24 часа). Группы A и B были моложе со средним возрастом 58 лет, тогда как группы C и D были старше со средним возрастом 70 и 69 лет соответственно (p < 0,001). Исходная распространенность сопутствующих заболеваний значительно различалась между субфенотипами (p < 0,001): в группе А была самая низкая распространенность застойной сердечной недостаточности (26%), артериальной гипертензии (59%), сахарного диабета (31%) и хронической болезни почек. 29%), но самая высокая распространенность метастатического рака (10%). В группе В была самая высокая распространенность застойной сердечной недостаточности (40%), артериальной гипертензии (91%) и хронической болезни почек (57%). Госпитализация в ОИТ была выше в группах A, B и D (39%, 33% и 33%), чем в группе C (22%) (p < 0,001). Потребность в заместительной почечной терапии во время госпитализации была самой высокой в группе В (p < 0,001). Использование вазопрессоров было выше в группах A и D, а использование инотропов было самым высоким в группе D (p < 0,001). 30-дневная госпитальная летальность значительно различалась между субфенотипами (p = 0,02): 3,8% для группы A, 2,2% для группы B, 2,4% для группы C и 3,7% для группы D (Table 1).

Среди 2759 пациентов с сепсисом в валидационной когорте относительное распределение демографических данных, сопутствующих заболеваний и исходов субфенотипов было таким же, как и в обучающей когорте (Table 1). В валидационной когорте госпитализация в ОИТ была выше в группах A, B и D по сравнению с группой C (p < 0,001); потребность в заместительной почечной терапии была самой высокой в группе В (p < 0,001); использование вазопрессоров было выше в группах А и D (p < 0,001). Смертность в субфенотипах составила 4,7% для группы А, 3,8% для группы В, 2,3% для группы С и 5,2% для группы D (р = 0,04). Относительное распределение характеристик субфенотипа также было сходным в общей когорте инфицированных пациентов и при различных критериях включения (Supplementary Tables 3–5).
Связь субфенотипов с лабораторными значениями
Несколько лабораторных маркеров значительно различались между 4 субфенотипами как в обучающей, так и в проверочной когортах. В обучающей когорте группа А имела самое высокое количество лейкоцитов, отношение нейтрофилов к лимфоцитам и уровень молочной кислоты (p < 0,001) (Fig. 2); Группа В имела самый высокий уровень креатинина и BNP в сыворотке крови (p < 0,001); В группах А и D альбумин был ниже (p < 0,001); В группе D был самый низкий гемоглобин (p < 0,001). Относительное распределение лабораторных значений было сходным в проверочной когорте (Supplementary Fig. 3, Supplementary Tables 6 & 7). Добавление лабораторных маркеров существенно не изменило принадлежность к субфенотипу (Supplementary Table 8).
Ассоциация субфенотипов со смертностью
В логистической регрессии с поправкой на возраст, и сопутствующие заболевания в группе C в проверочной когорте, 30-дневная смертность была значительно выше, чем в группе A (обучающая когорта: отношение шансов (ОШ) 1,96, 95% доверительный интервал (ДИ) 1,32– 2,91, р < 0,001; когорта проверки: ОШ 2,50, 95% ДИ 1,31–4,77, р = 0,005). Смертность также была значительно выше в группе D (обучающая когорта: ОШ 1,54, 95% ДИ 1,05–2,24, р = 0,03; проверочная когорта: ОШ 2,51,95% ДИ 1,35–4,68, р = 0,004) (Fig. 3).
 Неоднородность лечебного эффекта при внутривенном введении жидкостей
Неоднородность лечебного эффекта при внутривенном введении жидкостей
Из 1641 пациента с сепсисом в исследовании SMART 368 были исключены из-за отсутствия документально подтвержденных показателей жизнедеятельности до введения жидкости, 285 — из-за перевода из других больниц и 154 — из-за госпитализации более чем за 72 часа до включения в исследование. Критерии включения в когорту исследования SMART сравнивались с когортами наблюдения в Supplementary Table 9. 834 пациента исследования были разделены на 4 субфенотипа: группа A (N = 319, 38%), группа B (93, 11%). , группа C (100, 12%) и группа D (322, 39%). В соответствии с нашими первичными результатами группа A была самой молодой, а группа D — самой старшей (медиана 53 года против 63 лет, p <0,001). В группе А была самая низкая распространенность застойной сердечной недостаточности, артериальной гипертензии и хронической болезни почек. Группы B и D имели исходно высокую распространенность застойной сердечной недостаточности и хронической болезни почек. 30-дневная госпитальная летальность значительно различалась между субфенотипами (p = 0,02): группа A (21%), группа B (14%), группа C (22%) и группа D (28%) (SupplementaryTables 10 and 11).
В логистической регрессии группа D имела значительно более низкое ОШ 30-дневной смертности при использовании сбалансированных кристаллоидов по сравнению с физиологическим раствором (ОШ 0,39, 95% ДИ 0,23–0,67, p <0,001) (Fig. 4). Отмечалась значительная гетерогенность результата лечения между субфенотипом и назначением лечения при прогнозировании 30-дневной смертности (p = 0,03). В анализе чувствительности, ограниченном пациентами с полным набором из 3 показателей жизнедеятельности до введения жидкости (N = 335), сохранялась значительная HTE (p = 0,04) с более низким OR смертности при использовании сбалансированных кристаллоидов в группе D (OR 0,35, 95 % ДИ 0,15–0,79, р = 0,01). В 1000 симуляционных экспериментах по классификации исследуемых пациентов в реальном времени 607 экспериментов выявили достаточно значительное преимущество в отношении смертности от сбалансированных кристаллоидов в группе D, чтобы гарантировать досрочное прекращение клинического испытания (разница в смертности> 10% при значении p <0,05) (Supplementary Table 12).
Обсуждение
Мы представляем новые динамические субфенотипы, разработанные и подтвержденные с использованием универсально доступных показателей жизнедеятельности широкой группы пациентов, поступающих в отделение неотложной помощи с подозрением на инфекцию. Субфенотипы демонстрируют сильную обобщаемость у пациентов с сепсисом в обучающей когорте и разной во времени проверочной когорте, а также у пациентов в критическом состоянии с сепсисом в когорте РКИ из другого учреждения. Субфенотипы имеют различные исходные характеристики, лабораторные отклонения и характер дисфункции органов. Наконец, субфенотипы демонстрируют значительно различающиеся ответы на сбалансированные кристаллоиды и физиологический раствор, что позволяет предположить, что эти субфенотипы могут играть роль в персонифицированном подходе у больных с сепсисом.
Будет ли у пациента с инфекцией развиваться органная дисфункция и сепсис, часто неясно при поступлении в отделение неотложной помощи. Субдфенотипы траекторий жизненно важных функций были разработаны на широкой когорте пациентов с подозрением на инфекцию, чтобы модель можно было применить к пациентам с установленным сепсисом или без него на момент поступления. Используя эту обобщенную модель субфенотипа, мы получили надежные результаты с аналогичным распределением клинических характеристик субфенотипа и исходов у пациентов с инфекцией, пациентов с сепсисом, пациентов, отвечающих критериям SIRS, пациентов со скудными данными о показателях жизнедеятельности и пациентов с сепсисом в ОИТ.

Предыдущие исследования по подтипированию острого респираторного дистресс-синдрома (ОРДС) и сепсиса выявили от двух до шести субфенотипов, при этом в некоторых исследованиях использовались транскриптомные данные, а в других — клинические данные из электронных медицинских карт и РКИ [7, 30]. Calfee et al. выявили два последовательных субфенотипа ОРДС в нескольких исследованиях с различиями в воспалительных биомаркерах и ответах на лечение [31]. При сепсисе наблюдается большая вариабельность клинических субфенотипов. Seymour et al. идентифицировали четыре субфенотипа с использованием лабораторных и витальных данных, но эти субфенотипы не имели значительного взаимодействия с лечением в РКИ [8]. Shankar-Hari et al. идентифицировали два субфенотипа в исследовании VANISH и три субфенотипа в исследовании LeoPARDS, используя клинические данные и данные биомаркеров, с постоянным гипервоспалительным субфенотипом, связанным с более высокой смертностью, но без гетерогенности результатов лечения [7]. Gardlund et al. сообщили о шести субфенотипах септического шока, используя исследование PROWESS Shock Study без различий в эффектах лечения между группами [11].
Отсутствие различий в лечении больных с различными субфенотипами сепсиса может быть связано с отсутствием статистической мощности, дизайном клинических испытаний (объяснительным, а не прагматическим) или истинным отсутствием гетерогенности результатов лечения [7, 32]. Отличительными преимуществами наших клинических субфенотипов являются: (1) использование рутинных измерений у постели больного, (2) использование измерений в динамике (3) идентификация гетерогенности результатов лечения по типу используемых инфузионных растворов.
Сепсис — это динамический процесс, характеризующийся быстро развивающимися физиологическими реакциями, которые не могут быть адекватно зафиксированы статическими измерениями [14, 33]. По сравнению с традиционными методами статической кластеризации, GBTM имеет то преимущество, что моделирует динамическую эволюцию физиологии с течением времени. Кроме того, субфенотипы GBTM представлены клинически интерпретируемыми траекториями клинических переменных. Когда GBTM применяли к нашей когорте, мы обнаружили, что группа А представляла собой субфенотип гипертермии, тахикардии, тахипноэ и гипотензии. Группа А имела высокий уровень лактата, количество лейкоцитов и отношение нейтрофилов к лимфоцитам. В группе В были гипертермия, тахикардия и тахипноэ, но не в такой степени, как в группе А.
Кроме того, у этих пациентов была артериальная гипертензия и высокая распространенность исходных сопутствующих заболеваний, включая застойную сердечную недостаточность и хроническую болезнь почек. Группы C и D имели более низкую температуру, частоту сердечных сокращений и частоту дыхания. Группа С была нормотензивной, в то время как группа D была наиболее гипотензивным субфенотипом. Группы A и Dимели более высокое отношение шансов смертности как в обучающих, так и в проверочных когортах по сравнению с группой C (считавшейся контрольной группой, поскольку она была преобладающим субфенотипом).
Одним из наиболее распространенных вмешательств при сепсисе является внутривенное введение жидкостей. Имеются данные о том, что динамические жизненные показатели могут определять стратегии инфузионной терапии [34–36]. При вторичном анализе исследования SMART мы обнаружили значительную неоднородность лечебного эффекта сбалансированных кристаллоидов по сравнению с физиологическим раствором для субфенотипов. Группа D (с низкой температурой, частотой сердечных сокращений и частотой дыхания и гипотензией) имела наибольшую пользу от сбалансированных кристаллоидов по сравнению с физиологическим раствором со значительно более низкой 30-дневной госпитальной смертностью. В будущих клинических испытаниях группа D может стать целевым субфенотипом для точного включения в исследование, где сравнивают сбалансированные кристаллоиды и физиологический раствор. Разработка этой модели траектории потребовала трех наборов основных показателей жизнедеятельности в течение первых 8 часов. Однако модель можно применять в режиме реального времени без использования всех 8 часов для классификации субфенотипов. Возможность применения в режиме реального времени была продемонстрирована с помощью симуляционного исследования, в котором пациенты в исследовании SMART были отнесены к группе D, если они соответствовали заранее определенному порогу вероятности.
Мы обнаружили, что большинство смоделированных испытаний приводили к раннему прекращению лечения из-за обнаружения клинически и статистически значимого преимущества сбалансированных кристаллоидов в отношении смертности в группе D.
Исследование имеет несколько ограничений. Во-первых, ретроспективный характер исследования ограничивает анализ причинно-следственных связей. Во-вторых, вторичный анализ РКИ может быть недостаточным для выявления гетерогенного ответа на лечение. В-третьих, исследование SALT-ED может служить дополнительной когортой для оценки субфенотипической модификации эффекта лечения у пациентов, которые были госпитализированы в ОИТ. В-четвертых, временные субфенотипы могут быть изменены путем лечения в пределах окна субфенотипирования. В-пятых, лабораторные маркеры были собраны в соответствии с клиническими показаниями, что привело к отсутствию полных данных. В-шестых, вариабельность измерения частоты дыхания может возникать из-за метода измерения (прикроватные мониторы по сравнению с визуальными измерениями). Наконец, эти данные нельзя экстраполировать на пациентов с внутрибольничными инфекциями.
Субфенотипы траектории жизненно важных функций с отчетливыми клиническими характеристиками и профилями дисфункции органов отражают динамическую сложность сепсиса. Эти субфенотипы могут по-разному реагировать на стратегии лечения сепсиса. Наконец, субфенотипы могут быть использованы для точного включения в будущие клинические испытания и могут сыграть роль в переходе от универсального подхода к подходу прецизионной медицины в лечении сепсиса.
Ссылка на документ с дополнительными данными исследования (Supplementary)
References
1. Buchman TG et al (2020) Sepsis among medicare beneficiaries: 3 the methods, models, and forecasts of sepsis,2012–2018. Critical Care Med 48:302–318.
https://doi.org/10.1097/ccm.0000000000004225
2. Rhee C et al (2017) Incidence and trends of sepsis in US Hospitals using clinical vs claims data, 2009–2014.JAMA 318:1241–1249.
https://doi.org/ 10.1001/jama.2017.13836
3. Singer M et al (2016) The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA315:801–810.
https://doi.org/10. 1001/jama.2016.0287
4. Santacruz CA, Pereira AJ, Celis E, Vincent J-L (2019) Which multicenter ran- domized controlled trials in criticalcare medicine have shown reduced mortality? A systematic review. Crit Care Med 47:1680–1691.
https://doi.org/10.1097/ccm.0000000000004000
5. Prescott HC, Calfee CS, Thompson BT, Angus DC, Liu VX (2016) Toward smarter lumping and smarter splitting:rethinking strategies for sepsis and acute respiratory distress syndrome clinical trial design. Am J Respir Crit Care Med194:147–155.
https://doi.org/10.1164/rccm.201512-2544CP
6. Maslove DM et al (2022) Redefining critical illness. Nat Med 28:1141– 1148.
https://doi.org/10.1038/s41591-022-01843-x
7. Shankar-Hari M et al (2021) Defining phenotypes and treatment effect heterogeneity to inform acute respiratorydistress syndrome and sepsis trials: secondary analyses of three RCTs. Efficacy Mech Eval 8:1–104
8. Seymour CW et al (2019) Derivation, validation, and potential treatment implications of novel clinical phenotypes for sepsis. JAMA 321:2003– 2017.
https://doi.org/10.1001/jama.2019.5791
9. Zhang Z, Zhang G, Goyal H, Mo L, Hong Y (2018) Identification of sub- classes of sepsis that showed different clinical outcomes and responses to amount of fluid resuscitation: a latent profile analysis. Crit Care 22:347.
https://doi.org/10.1186/s13054-018-2279-3
10. Knox DB, Lanspa MJ, Kuttler KG, Brewer SC, Brown SM (2015) Pheno- typic clusters within sepsis-associatedmultiple organ dysfunction syndrome. Intensive Care Med 41:814–822.
https://doi.org/10.1007/ s00134-015-3764-7
11. Gårdlund B et al (2018) Six subphenotypes in septic shock: latent class analysis of the PROWESS Shock study. J Crit Care 47:70–79.
https://doi. org/10.1016/j.jcrc.2018.06.012
12. Cazalis MA et al (2014) Early and dynamic changes in gene expression in septic shock patients: a genome-wideapproach. Intensive Care Med Exp 2:20.
https://doi.org/10.1186/s40635-014-0020-3
13. Maslove DM, Wong HR (2014) Gene expression profiling in sepsis: timing, tissue, and translationalconsiderations. Trends Mol Med 20:204–213.
https://doi.org/10.1016/j.molmed.2014.01.006
14. Namas RA, Vodovotz Y (2016) From static to dynamic: a sepsis-specific dynamic model from clinical criteria in polytrauma patients. Ann Transl Med 4:492.
https://doi.org/10.21037/atm.2016.11.72
15. Reddy K et al (2020) Subphenotypes in critical care: translation into clinical practice. Lancet Respir Med 8:631–643.
https://doi.org/10.1016/ S2213-2600(20)30124-7
16. Kwan A, Hubank M, Rashid A, Klein N, Peters MJ (2013) Transcriptional instability during evolving sepsis may limit biomarker based risk stratifica- tion. PLoS ONE 8:e60501.
https://doi.org/10.1371/journal.pone.0060501
17. Wong HR et al (2018) Endotype transitions during the acute phase of pediatric septic shock reflect changing risk and treatment response. Crit Care Med 46:e242–e249.
https://doi.org/10.1097/ccm.0000000000 002932
18. Hollen MK et al (2019) Myeloid-derived suppressor cell function and epigenetic expression evolves over timeafter surgical sepsis. Crit Care 23:355.
https://doi.org/10.1186/s13054-019-2628-x
19. Sweeney TE, Shidham A, Wong HR, Khatri P (2015) A comprehensive time-course-based multicohort analysis of sepsis and sterile inflamma- tion reveals a robust diagnostic gene set. Sci Transl Med 7:287ra271.
https://doi.org/10.1126/scitranslmed.aaa5993
20. Bhavani SV et al (2019) Identifying novel sepsis subphenotypes using temperature trajectories. Am J Respir CritCare Med.
https://doi.org/10. 1164/rccm.201806-1197OC
21. Bhavani SV, Huang ES, Verhoef PA, Churpek MM (2020) Novel temperature trajectory subphenotypes in COVID-19. Chest.
https://doi.org/10.1016/j. chest.2020.07.027
22. Bhavani SV et al (2022) Coronavirus disease 2019 temperature trajectories correlate with hyperinflammatory andhypercoagulable subphenotypes. Crit Care Med 50:212–223.
https://doi.org/10.1097/ccm.0000000000 005397
23. Bhavani SV et al (2020) Temperature trajectory subphenotypes cor- relate with immune responses in patients withsepsis. Crit Care Med 48:1645–1653.
https://doi.org/10.1097/ccm.0000000000004610
24 Yehya N et al (2021) Temperature trajectory sub-phenotypes and the immuno-inflammatory response in pediatricsepsis. Shock.
https://doi. org/10.1097/shk.0000000000001906
25. Semler MW et al (2018) Balanced crystalloids versus saline in critically ill adults. N Engl J Med 378:829–839.
https://doi.org/10.1056/NEJMoa1711 584
26. Churpek MM, Zadravecz FJ, Winslow C, Howell MD, Edelson DP (2015) Incidence and prognostic value of thesystemic inflammatory response syndrome and organ dysfunctions in ward patients. Am J Respir Crit Care Med 192:958–964.
https://doi.org/10.1164/rccm.201502-0275OC
27. Nagin DS, Jones BL, Passos VL, Tremblay RE (2018) Group-based multi- trajectory modeling. Stat Methods MedRes 27:2015–2023.
https://doi. org/10.1177/0962280216673085
28. Nagin DS, Odgers CL (2010) Group-based trajectory modeling in clinical research. Annu Rev Clin Psychol6:109–138.
https://doi.org/10.1146/annur ev.clinpsy.121208.131413
29 Brown RM et al (2019) Balanced crystalloids versus saline in sepsis. A secondary analysis of the SMART clinicaltrial. Am J Respir Crit Care Med 200:1487–1495.
https://doi.org/10.1164/rccm.201903-0557OC
30. Stanski NL, Wong HR (2020) Prognostic and predictive enrich- ment in sepsis. Nat Rev Nephrol 16:20–31.
https://doi.org/10.1038/ s41581-019-0199-3
31. Calfee CS et al (2014) Subphenotypes in acute respiratory distress syn- drome: latent class analysis of data fromtwo randomised controlled trials. Lancet Respir Med 2:611–620.
https://doi.org/10.1016/S2213-2600(14) 70097-9
32. Santhakumaran S et al (2019) Heterogeneity of treatment effect by baseline risk of mortality in critically ill patients:re-analysis of three recent sepsis and ARDS randomised controlled trials. Crit Care 23:156.
https://doi.org/10.1186/s13054-019-2446-1
33. Mayaud L et al (2013) Dynamic data during hypotensive episode improves mortality predictions among patientswith sepsis and hypoten- sion. Crit Care Med 41:954–962.
https://doi.org/10.1097/CCM.0b013 e3182772adb
34. Gu Q, Prasad V, Heldt T (2019) Characterizing fluid response and sepsis progression in emergency departmentpatients. In: Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEEEngineering in Medicine and Biology Society. Annual International Conference
https://doi.org/10.1109/embc.2019.8856521
35. Prasad V, Lynch JC, Filbin MR, Reisner AT, Heldt T (2019) Clustering blood pressure trajectories in septic shock in the emergency department. In: Annual International Conference of the IEEE Engineering in Medicine and BiologySociety. IEEE Engineering in Medicine and Biology Society. Annual International Conference, 494–497,doi:
https://doi.org/10.1109/ embc.2019.8857191
36. Brown SM et al (2016) Multi-complexity measures of heart rate variability and the effect of vasopressor titration: a prospective cohort study of patients with septic shock. BMC Infect Dis 16:551.
https://doi.org/10. 1186/s12879-016-1896-1
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 21.12.2022
[ACTIVE_FROM] => 21.12.2022
[SHOW_COUNTER] => 866
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 828162
[VALUE] => сепсис, показатели жизнедеятельности, субфенотипы, внутривенные жидкости, фенотипы
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => сепсис, показатели жизнедеятельности, субфенотипы, внутривенные жидкости, фенотипы
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 828164
[VALUE] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 828163
[VALUE] => Разработка и проверка новых субфенотипов сепсиса
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Разработка и проверка новых субфенотипов сепсиса
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830459
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828170
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828166
[1] => 828167
[2] => 828694
)
[VALUE] => Array
(
[0] => sepsis
[1] => Infekcionnyj kontrol'
[2] => subfenotipysepsisa
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
[1] => Infekcionnyj kontrol'
[2] => subfenotipysepsisa
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830459
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828170
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828166
[1] => 828167
[2] => 828694
)
[VALUE] => Array
(
[0] => sepsis
[1] => Infekcionnyj kontrol'
[2] => subfenotipysepsisa
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
[1] => Infekcionnyj kontrol'
[2] => subfenotipysepsisa
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Сепсис
[1] => Инфекционный контроль
[2] => Субфенотипы сепсиса
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 03.07.2025 10:45:52
[~TIMESTAMP_X] => 03.07.2025 10:45:52
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[FULLTEXT_INDEX] => N
[~FULLTEXT_INDEX] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Разработка и проверка новых субфенотипов сепсиса с использованием траекторий основных показателей жизнедеятельности
[BROWSER_TITLE] => Разработка и проверка новых субфенотипов сепсиса
[KEYWORDS] => сепсис, показатели жизнедеятельности, субфенотипы, внутривенные жидкости, фенотипы
[DESCRIPTION] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
)
)





