Расчет объема циркулирующей плазмы (рОЦП) может быть простым в использовании клиническим инструментом для определения риска развития сепсиса или смерти у пациентов с лихорадкой
Journal of Critical Care
Расчет объема циркулирующей плазмы (рОЦП) может быть простым в использовании клиническим инструментом для определения риска развития сепсиса или смерти у пациентов с лихорадкой
Перевод оригинальной статьи «Estimated plasma volume status (ePVS) could be an easy-to-use clinical tool to determine the risk of sepsis or death in patients with fever»
Авторы: Gianni Turcato, Arian Zaboli, Laura Ciccariello, Norbert Pfeifer
Department of Emergency Medicine, Franz Tappeiner General Hospital of Merano, Azienda Sanitaria dell'Alto Adige, Merano, Italy
Keywords: Sepsis, Septic shock, Plasma volume, Emergency department, Fever
Ключевые слова: сепсис, септический шок, объем циркулирующей плазмы, отделение неотложной помощи, лихорадка
1. Введение
Лихорадка является частой причиной поступления пациентов в отделение неотложной помощи (англ. Emergency Department или ED) и в западных странах число таких поступлений составляет 5–10% всех визитов в ED [1]. В ряде случаев лихорадка может быть единственным симптомом быстрого развития воспалительных заболеваний, которые нарушают нормальную регуляцию микрососудистого русла и, тем самым, приводят к высокой летальности [1-4 ]. У значительной части пациентов, поступающих в ED с лихорадкой, может развиться септическое состояние [5]. Сепсис в настоящее время имеет уровень летальности приблизительно 22%, а у пациентов с септическим шоком летальность может достичь 40% [6,7]. Только у малого числа пациентов, у которых в последствии разовьется сепсис, имеются четкие его клинические проявления при поступлении в ED [8]. У пациентов с лихорадкой быстрое распознавание ухудшения состояния микрососудистого русла, что может привести к тяжелой системной недостаточности, может иметь решающее значение для ранней терапии и выживания пациента [9,10]. Оценка состояния ОЦП у пациента играет центральную роль в клиническом ведении сепсиса и септического шока [11]. В настоящее время существует несколько инструментов для оценки ОЦП на ранней стадии, которые, как правило, применяются только у пациентов с тяжелыми состояниями и которые в рутиной практике отделения неотложной помощи не применяются [12].
Duarte et al. [13] недавно предложили определять ОЦП у пациентов с сердечной недостаточностью, применяя для этого простую формулу на основе показателей гематокрита и гемоглобина. Эту информацию легко получить, имея данные общего анализа крови (ОАК). Расчетное состояние объема циркулирующей плазмы (рОЦП) было независимо связано с сердечно-сосудистыми исходами, повторной госпитализацией и смертью у пациентов с сердечной недостаточностью (СН) [14,15]. Chouihed et al. [16] в когорте исследования PARADISE, которая также состояла из пациентов с воспалительными заболеваниями (пневмония, ХОБЛ), обнаружили, что высокие значения рОЦП, полученные при поступлении в ED пациентов, страдающих одышкой, связаны с высокой вероятностью развития застойных явлений/перегрузки левых отделов, что ассоциировано с высокой внутрибольничной летальностью. Значение рОЦП, превышающее 5,12 дл/г, имело OR1,47 (1,04–2,09) для риска внутрибольничной смерти с улучшением стратификации риска более чем на 34%.
2. Методы
2. 1. Условия
Данное исследование является моно-центровым ретроспективным обсервационным исследованием, проведенным в отделении неотложной помощи the Franz Tappeiner General Hospital of Merano, Italy (70,000 посещений в год; 330 коек; 100,000 популяция; 2.4 миллиона туристов в год). Все пациенты поступали с температурой в период с 1 июня 2018 года по 30 мая 2019 года.
С 2013 года каждый пациент, поступивший в ED, подвергается процедуре сортировки, при которой используется стандартизованная Manchester Triage System (MTS). МТS определяет уровень приоритета пациента на основании основных симптомов. Основные симптомы и оценка сортировки являются неотъемлемой частью электронных карт ED и регистрируются для каждого пациента в базе данных ED.
2.2. Пациенты
Вся информация о пациентах с лихорадкой была взята из базы данных ED, использую для этого QlikView software (QlikTech, Pennsylvania, US).
Впоследствии, двумя врачами неотложной помощи посредством ручного просмотра записей ED, пациенты, которые не сдали образец крови во время поступления и те, у которых не было значений гематокрита или гемоглобина, а также пациенты-нерезиденты были исключены.
Исходные демографические характеристики, история болезни, клинические параметры, лабораторные результаты, лечение, полученное в ED, клинические карты в течение всего периода пребывания в стационаре и выписка были получены из электронных записей пациентов и включены в набор данных исследования.
2.3. Измерение рОЦП и клинические исходы
Оценка рОЦП проводилась на основании данных гематокрита и гемоглобина из ОАК, сделанного на момент поступления пациента в ED, по следующей формуле: рОЦП=100-Ht(%)/Hb(г/дл)
Согласно последним рекомендациям рОЦП был выражен в дл/г [17].
Основным результатом, подвергшемся оценке в исследовании, была 30-дневная летальность от всех причин.
Вторичным результатом исследования был диагноз сепсис или септический шок в течение 72 часов после оценки, проведенной в ED. Вторичный результат был реконструирован путем переоценки кодов выписки или смерти МКБ-9 с использованием определения сепсиса или септического шока, приведенного в 3-м международном консенсусном определении по сепсису и септическому шоку (Сепсис-3) [18].
2.4. Этические аспекты
Исследование было одобрено локальным этическим комитетом (Comitato etico per la sperimentazione clinica, Azienda Sanitaria dell'Alto Adige, Bolzano, Italia).
2.5. Статистический анализ (см.оригинал статьи)
3. Результаты
3.1. Оценка рОЦП
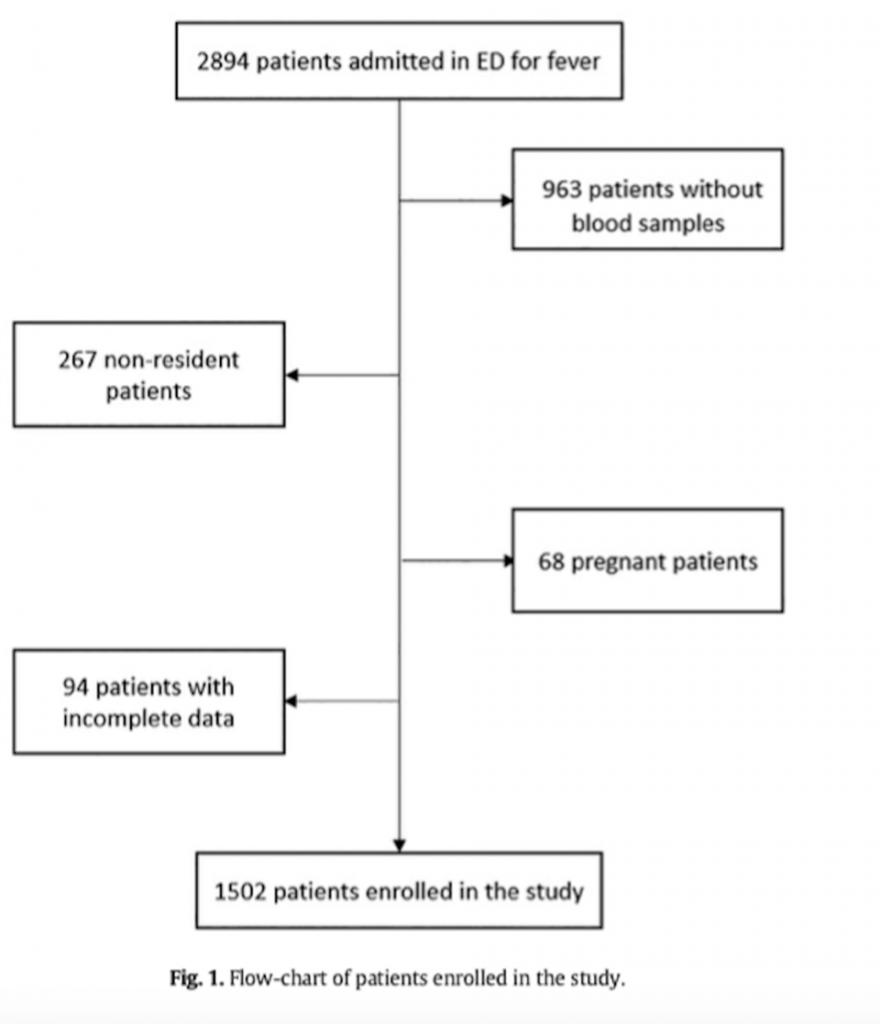
Во все время исследования (12 месяцев) в ED было осмотрено 2894 пациента (4.1% от ежегодных визитов) с лихорадкой. В исследование было включено 1502 пациента (Рис.1). Из 1502 пациентов ED с лихорадкой 51 (3.4%) умерли в течение 30-ти дней после поступления. Из них у 35.3% (18/51) причиной смерти стало прогрессирование сепсиса.
В исследуемой популяции средняя оценка рОЦП составила 4.53 дл/г (3.92 - 5.33). Ц пациентов, умерших в течение 30-ти дней после поступления в ED, медиана рОЦП составила 6.01 дл/г (5.12 - 6.94) против 4.49 (3.91 - 5.25) у выживших пациентов (p<.001).
Только 0.9% пациентов с рОЦП ниже значения медианы (7/748) умерли в течение 30-ти дней по сравнению с 5.8% (44/753) пациентов с рОЦП свыше значения медианы на момент поступления в ED (p<.001).
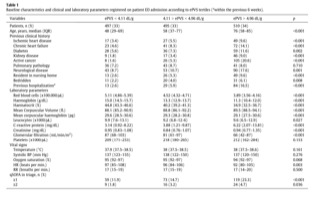
Распределение клинических особенностей пациентов согласно рОЦП описано в таблице 1.
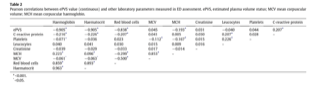
Пациенты в высшем тертиле (рОЦП>4.96 дл/г) имели большую оценку по шкале SOFA, более высокую коморбидность и больше нарушенных параметров при поступлении. Корреляции между оценкой рОЦП и другими лабораторными параметрами показаны в таблице 2. Помимо клинических и лабораторных показателей, собранных в ходе исследования, только гемоглобин и гематокрит представляли проблемы коллинеарности с рОЦП.
3.2. Включенные в исследование пациенты и 30-ти дневная летальность
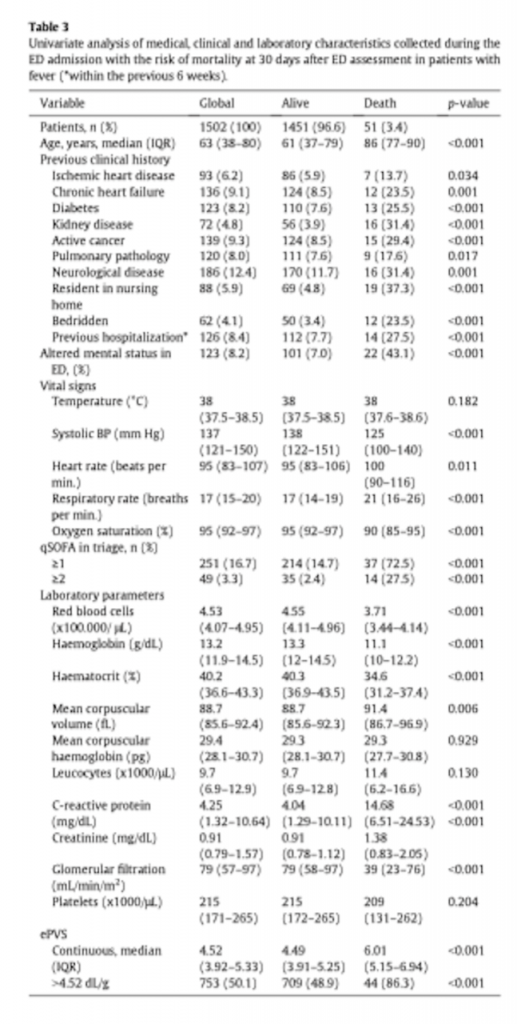
Одномерные сравнения между историей болезни, клиническими и лабораторными характеристиками с 30-дневной летальностью приведены в Таблице 3. Пациенты, которые умерли в течение 30 дней после первичной оценки в ED, были старше, имели больше сопутствующих заболеваний и имели худшие клинические и лабораторные параметры (Таблица 3).
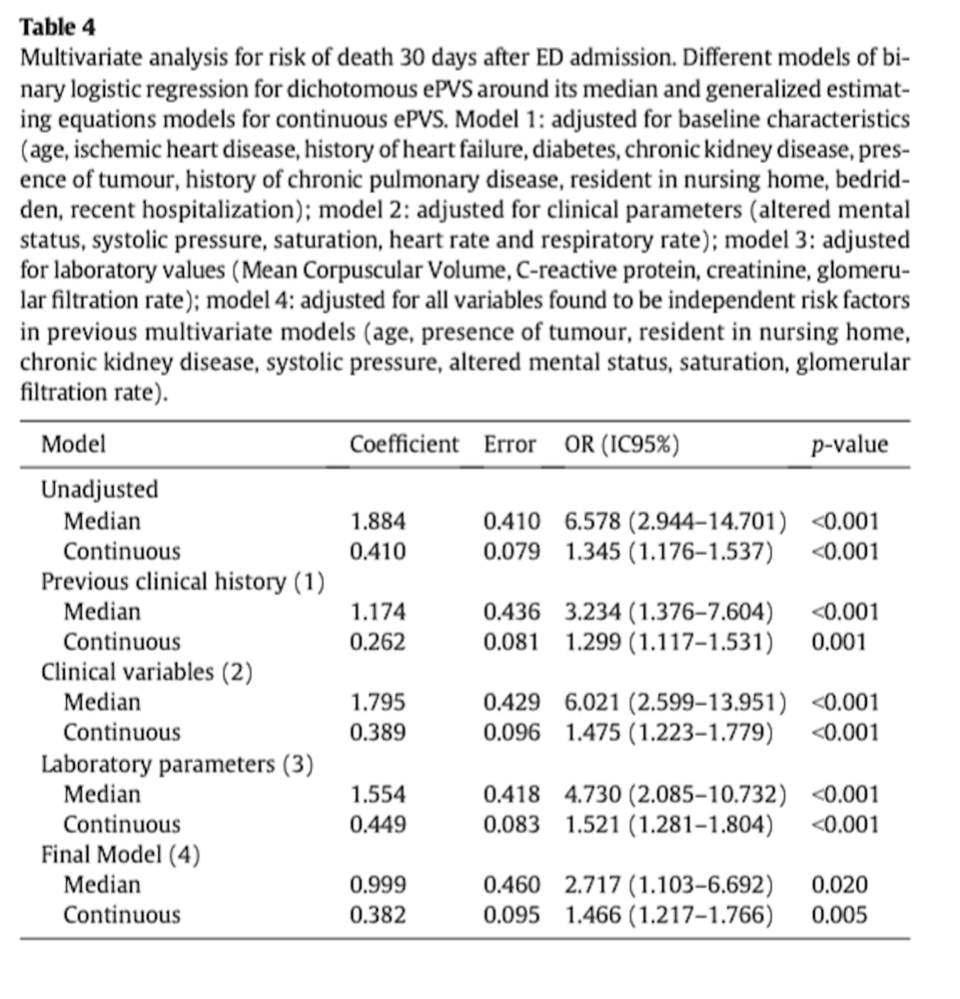
Многофакторный анализ с логистической регрессией показал, что рОЦП, выраженный в виде дихотомического значения (около среднего значения), после поправки на возможные анамнезы пациента, клинические или лабораторные вмешивающиеся факторы, стал сам по себе независимым фактором (Таблица 4). Значение рОЦП, превышающее 4,52 дл/г, представляло собой отношение шансов (OR) 2,717 (CI95%, 1,103–6,692; p = 0,020) для риска смерти через 30 дней даже после введения поправки на возраст, на заболевание почек, на наличие новообразования, на проживание в доме престарелых и/или прикованность к постели, на измененный психический статус при поступлении в ED, на уровень насыщения крови кислородом при поступлении в ED, на уровень систолического артериального давления при поступлении в ED и на скорость клубочковой фильтрации (Таблица 4).
Ценность среднего значения ePVS в улучшении прогностических показателей многомерной прогностической модели 30-дневной летальности с NRI 21,6% (CI95%, 19,4–43,9%; p <.001).
Кривая ROC рОЦП для 30-ти дневной летальности была 0,796 (CI95% 0.735–0.858, p <.001).
Многофакторная модель GEE подтвердила, что непрерывное (продолженное) изменение рОЦП для 30-дневной летальности имело скорректированное OR 1,466 (CI95%, 1,217–1,766, p = 0,005) (Таблица 4).
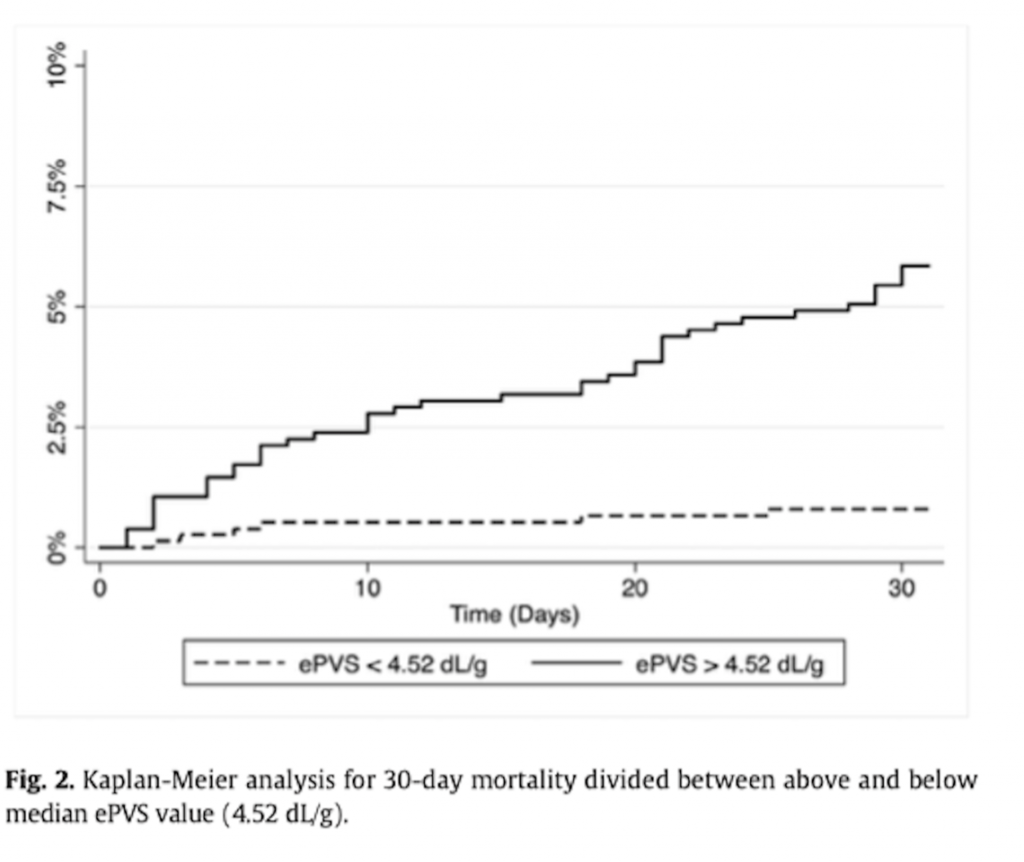
И наконец, кривая Kaplan–Meier подтвердила, что значение рОЦП свыше медианного значения ассоциируется с увеличением риска 30-ти дневной летальности по сравнению с остальной популяцией (log-rank test p<.001; Рис. 2).
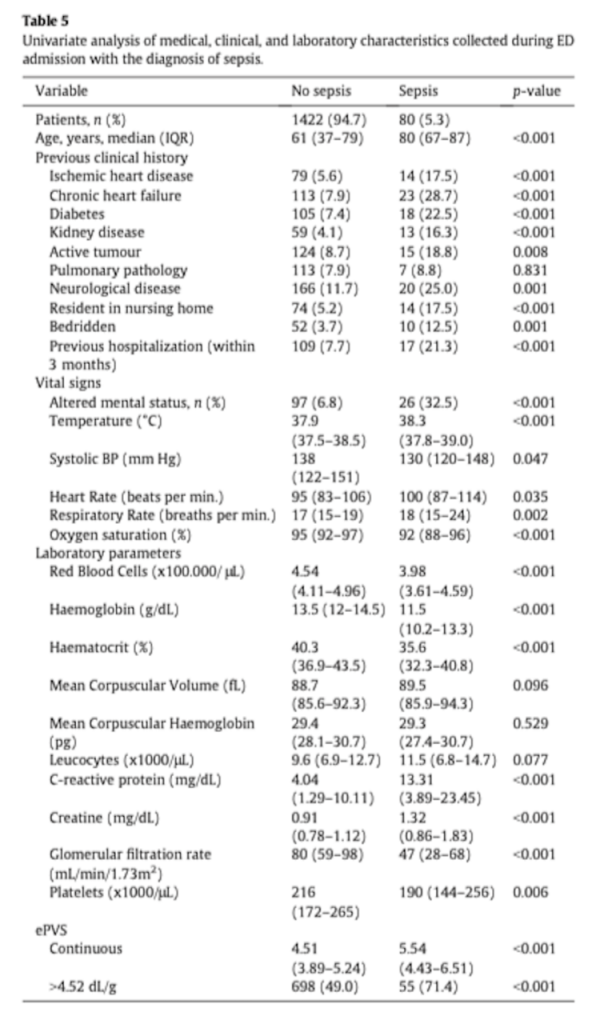
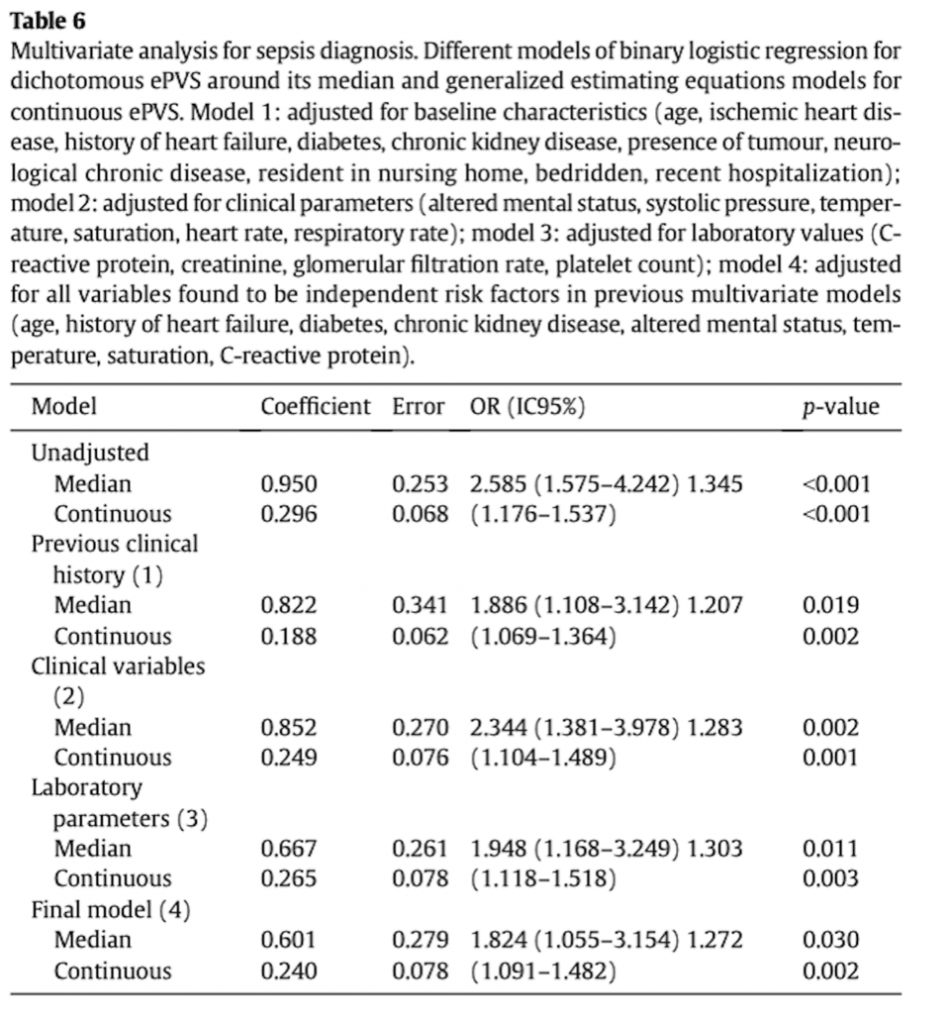
Многомерная логистическая модель показала, что рОЦП был независимым фактором риска развития сепсиса, а также и то, что значение рОЦП, превышающее медиану, имеет скорректированный OR 1,824 (CI95%, 1,055–3,154) (Таблица 6). Модели GEE также указывали, что для рОЦП, как непрерывной величины, существовала значительная связь с риском развития сепсиса (Таблица 6).
Добавление значения рОЦП к клинической и лабораторной оценке, выполненной в ED (многомерная модель 4, таблица 6), улучшило эффективность прогноза при диагностике сепсиса с NRI 19,7% (CI95% 14,3–35,9%, p<.001). Как показатель, рОЦП также улучшил прогнозирование при применении шкалы qSOFA при поступлении в ED на 22,5% (C95% 14–36,6%, p< .001), с увеличением кривой ROC qSOFA с 0,68 до 0,76 (p<.001). Наконец, кривая AUC для ROCs рОЦП при диагностике сепсиса составила 0,701 (CI95% 0,640–0,762, p<.001).
4. Дискуссия
В большой ретроспективной когорте пациентов, поступивших в ED с лихорадкой, показатель рОЦП, полученный после измерений гемоглобина и гематокрита в первом анализе крови, выполненного в ED, независимо ассоциировалась с 30-ти дневной летальностью даже после многомерной корректировки на историю болезни, клинические и лабораторные данные. Насколько нам известно, настоящее исследование является первым, проведенным с целью оценки возможной роли рОЦП в прогнозировании риска развития сепсиса или кратковременной летальности у пациентов с лихорадкой, поступающим в ED. Из-за того, что ОАК, как правило, относится к рутинному лабораторному тесту, данные которого доступны за небольшое время, а стоимость ОАК низка, рОЦП может стать дополнительным быстрым и полезным прогностическим инструментом при оценке рисков развития сепсиса и септического шока у пациентов, поступающих в ED с лихорадкой.
Риск развития сепсиса у пациентов с лихорадкой, по-видимому, не повышен. Но несмотря на это, начало септического процесса остается одним из наиболее серьезных состояний, наблюдаемых у пациентов с лихорадкой, поступающих в ED, а летальность у таких пациентов близка к 40% [7]. Если же сепсис развивается, то дизрегуляция микроциркуляции, вызванная системным воспалительным ответом, может, если не будет адекватно идентифицирована и подвергаться терапии, прогрессивно ухудшаться до сложных макрососудистых нарушений, которые необратимо изменят регуляцию объема циркулирующей плазмы, вызывая тем самым развитие у пациента шока [19,20]. Даже несмотря на то, что многие патофизиологические аспекты все еще неясны, все же одним из первых микроциркуляторных изменений во время сепсиса, по-видимому, является нарушение нормальной регуляции обмена транскапиллярной жидкости, что приводит к потере богатой белком жидкости из сосуда и, следовательно, к увеличению объема белка в интерстиции [4,21-23].
Недавние исследования показали, что оценка объема циркулирующей плазмы (ОЦП), как внутрисосудистой части внеклеточной жидкости, полученной из формулы Штрауса (англ.Strauss formula), где используются такие показатели как гемоглобин и гематокрит (рОЦП), может косвенно коррелировать со сдвигом объема плазмы на уровне интерстиция, что позволяет клинически использовать рОЦП для оценки тяжести микрососудистых процессов, описанных выше [14,15,24,25].
Насколько нам известно, настоящее исследование является первым, в котором оценивалась прогностическая роль рОЦП. Результаты у пациентов с лихорадкой, по-видимому, частично совпадают с сообщениями при СН, где показано, что высокие значения рОЦП независимо связаны с риском развития сепсиса и летальности. Но нет каких-либо других данных о пациентах с лихорадкой для того, чтобы сравнить с ними наши результаты. Тем не менее, в серии, о которой сообщили Chouihed et al.[16], более 60% пациентов имели инфекционный или воспалительный диагноз (пневмония, ХОБЛ).
Возможным объяснением наших результатов может быть повышенная проницаемость капилляров, возникающая при сепсисе. Повышенная проницаемость капилляров вызывает у этих пациентов диффузный отек, экссудативный выпот серозной полости, некардиогенный отек легких, гипотензию, а в более тяжелых случаях, гиповолемический шок с последующей полиорганной недостаточностью [21,28-30].
В настоящее время существует несколько прямых и косвенных методов расчета статуса циркулирующего объема плазмы/крови (ОЦП/ОЦК) у пациентов с подозрением на сепсис. Прямые методы слишком инвазивны и трудоемки, чтобы применять их в повседневной практике для каждого пациента с подозрением на сепсис. По этой причине в настоящее время невозможно оценить состояние ОЦП/ОЦК быстро при первом осмотре в ED. И здесь показатель рОЦП поможет улучшить идентификацию пациентов с исходно измененным микрососудистым кровотоком и указывать на пациентов с худшим прогнозом при первичном осмотре.
5. Выводы
Было обнаружено, что у пациентов с лихорадкой, поступивших в ED, показатель рОЦП, доступный сразу после получения данных ОАК, служит фактором риска 30-ти дневной летальности и развития сепсиса. Несмотря на эти данные, все таки необходимы дальнейшие проспективные исследования с получением доказательств как для подтверждения этих клинических результатов, так и для изучения патофизиологических причин повышенного уровня рОЦП, когда высокое значение рОЦП может быть дополнительным прогностическим инструментом, который добавляет важную информацию о серьезности заболевания для пациентов с лихорадкой.
[1] DeWitt S, Chavez SA, Perkins J, Long B, Koyfman A. Evaluation of fever in the emergency department. Am J Emerg Med 2017 Nov;35(11):1755–8. https://doi.org/10. 1016/j.ajem.2017.08.030 [Epub 2017 Aug 14].
[2] Walter EJ, Hanna-Jumma S, Carraretto M, Forni L. The pathophysiological basis and consequences of fever. Crit Care 2016 Jul 14;20(1):200. https://doi.org/10.1186/ s13054-016-1375-5.
[3] Sundén-Cullberg J, Rylance R, Svefors J, Norrby-Teglund A, Björk J, Inghammar M. Fever in the emergency department predicts survival of patients with severe Sepsis and septic shock admitted to the ICU. Crit Care Med 2017 Apr;45(4):591–9. https:// doi.org/10.1097/CCM.0000000000002249.
[4] Gustot T. Multiple organ failure in sepsis: prognosis and role of systemic inflammatory response. Curr Opin Crit Care 2011 Apr;17(2):153–9. https://doi.org/10.1097/ MCC.0b013e328344b446.
[5] Young PJ, Bellomo R. Fever in sepsis: is it cool to be hot? Crit Care 2014 Feb 13;18(1):109. https://doi.org/10.1186/cc13726.
[6] Stevenson EK, Rubenstein AR, Radin GT, Wiener RS, Walkey AJ. Two decades of mortality trends among patients with severe sepsis: a comparative meta-analysis*. Crit Care Med 2014 Mar;42(3):625–31. https://doi.org/10.1097/CCM. 0000000000000026.
[7] Vincent JL, Jones G, David S, Olariu E, Cadwell KK. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis. Crit Care 2019 May 31;23(1):196. https://doi.org/10.1186/s13054-019-2478-6.
[8] Macdonald SP, Williams JM, Shetty A, Bellomo R, Finfer S, Shapiro N, et al. Review article: sepsis in the emergency department - part 1: definitions and outcomes. Emerg Med Australas 2017 Dec;29(6):619–25. https://doi.org/10.1111/1742-6723. 12886 [Epub 2017 Nov 2].
[9] Landry J, Fowler LH. Early identification and management of the septic patient in the emergency department. Crit Care Nurs Clin North Am 2018 Sep;30(3):407–14. https://doi.org/10.1016/j.cnc.2018.05.009 [Epub 2018 Jun 18].
[10] Freund Y, Lemachatti N, Krastinova E, Van Laer M, Claessens YE, Avondo A, et al. Prognostic accuracy of Sepsis-3 criteria for in-hospital mortality among patients with suspected infection presenting to the emergency department. JAMA 2017 Jan 17;317(3):301–8. https://doi.org/10.1001/jama.2016.20329.
[11] Tigabu BM, Davari M, Kebriaeezadeh A, Mojtahedzadeh M. Fluid volume, fluid balance and patient outcome in severe sepsis and septic shock: a systematic review. J Crit Care 2018 Dec;48:153–9. https://doi.org/10.1016/j.jcrc.2018.08.018 [Epub 2018 Aug 20].
[12] Uchimido R, Schmidt EP, Shapiro NI. The glycocalyx: a novel diagnostic and therapeutic target in sepsis. Crit Care 2019;23:16. https://doi.org/10.1186/s13054-0182292-6. 30654825.
[13] Duarte K, Monnez JM, Albuisson E, Pitt B, Zannad F, Rossignol P. Prognostic value of estimated plasma volume in heart failure. JACC Heart Fail 2015 Nov;3(11):886–93. https://doi.org/10.1016/j.jchf.2015.06.014.
[14] Kobayashi M, Rossignol P, Ferreira JP, Aragão I, Paku Y, Iwasaki Y, et al. Prognostic value of estimated plasma volume in acute heart failure in three cohort studies. Clin Res Cardiol 2019 May;108(5):549–61. https://doi.org/10.1007/s00392-0181385-1 [Epub 2018 Oct 19].
[15] Huang CY, Lin TT, Wu YF, Chiang FT, Wu CK. Long-term prognostic value of estimated plasma volume in heart failure with preserved ejection fraction. Sci Rep 2019 Oct 7;9(1):14369. https://doi.org/10.1038/s41598-019-50427-2.
[16] Chouihed T, Rossignol P, Bassand A, Duarte K, Kobayashi M, Jaeger D, et al. Diagnostic and prognostic value of plasma volume status at emergency department admission in dyspneic patients: results from the PARADISE cohort. Clin Res Cardiol 2019 May;108(5):563–73. https://doi.org/10.1007/s00392-018-1388y [Epub 2018 Oct 28].
[17] Kobayashi M, Huttin O, Rossignol P, Girerd N. The unit of estimated plasma volume in patients with heart failure using the Strauss-derived Duarte formula is not liter but dL/g. J Card Fail 2019 Feb;25(2):140. https://doi.org/10.1016/j.cardfail.2018.12. 002 [Epub 2018 Dec 13].
[18] Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The third international consensus definitions for Sepsis and septic shock (Sepsis-3). JAMA 2016 Feb 23;315(8):801–10. https://doi.org/10.1001/jama.2016.0287.
[19] Simpson N, Lamontagne F, Shankar-Hari M. Septic shock resuscitation in the first hour. Curr Opin Crit Care 2017 Dec;23(6):561–6. https://doi.org/10.1097/MCC. 0000000000000460.
[20] Semler MW, Rice TW. Sepsis resuscitation: fluid choice and dose. Clin Chest Med 2016 Jun;37(2):241–50. https://doi.org/10.1016/j.ccm.2016.01.007 [Epub 2016 Mar 4].
[21] Margarson MP, Soni NC. Changes in serum albumin concentration and volume expanding effects following a bolus of albumin 20% in septic patients. Br J Anaesth 2004 Jun;92(6):821–6 [Epub 2004 Apr 2].
[22] Woodcock TE, Woodcock TM. Revised Starling equation and the glycocalyx model of transvascular fluid exchange: an improved paradigm for prescribing intravenous fluid therapy. Br J Anaesth 2012 Mar;108(3):384–94. https://doi.org/10.1093/bja/ aer515 [Epub 2012 Jan 29].
[23] Hotchkiss RS, Moldawer LL, Opal SM, Reinhart K, Turnbull IR, Vincent JL. Sepsis and septic shock. Nat Rev Dis Primers 2016 Jun 30;2:16045. https://doi.org/10.1038/ nrdp.2016.45.
[24] Hippensteel JA, Uchimido R, Tyler PD, Burke RC, Han X, Zhang F, et al. Intravenous fluid resuscitation is associated with septic endothelial glycocalyx degradation. Crit Care 2019 Jul 23;23(1):259. https://doi.org/10.1186/s13054-019-2534-2.
[25] Grodin JL, Philips S, Mullens W, Nijst P, Martens P, Fang JC, et al. Prognostic implications of plasma volume status estimates in heart failure with preserved ejection fraction: insights from TOPCAT. Eur J Heart Fail 2019 May;21(5):634–42. https://doi. org/10.1002/ejhf.1407 [Epub 2019 Feb 4].
[26] Boyle A, Sobotka PA. Redefining the therapeutic objective in decompensated heart failure: hemoconcentration as a surrogate for plasma refill rate. J Card Fail 2006 May;12(4):247–9.
[27] Marawan A, Qayyum R. Estimated plasma volume and mortality: analysis from NHANES 1999-2014. Clin Res Cardiol 2020 Feb 5. https://doi.org/10.1007/s00392020-01606-z.
[28] Siddall E, Khatri M, Radhakrishnan J. Capillary leak syndrome: etiologies, pathophysiology, and management. Kidney Int 2017 Jul;92(1):37–46. https://doi.org/10.1016/ j.kint.2016.11.029 [Epub 2017 Mar 17].
[29] Bateman RM, Sharpe MD, Jagger JE, Ellis CG. Sepsis impairs microvascular autoregulation and delays capillary response within hypoxic capillaries. Crit Care 2015 Nov 5; 19:389. https://doi.org/10.1186/s13054-015-1102-7.
[30] Chappell D, Jacob M, Paul O, Mehringer L, Newman W, Becker BF. Impaired glycocalyx barrier properties and increased capillary tube haematocrit. J Physiol 2008 Oct 1;586(19):4585–6. https://doi.org/10.1113/jphysiol.2008.160648 [Epub 2008 Aug 14].
[31] Rumbus Z, Matics R, Hegyi P, Zsiboras C, Szabo I, Illes A, et al. Fever is associated with reduced, hypothermia with increased mortality in septic patients: a meta-analysis of clinical trials. PLoS One 2017 Jan 12;12(1):e0170152. https://doi.org/10.1371/journal.pone.0170152 [eCollection 2017].
[32] Fudim M, Miller WL. Calculated estimates of plasma volume in patients with chronic heart failure-comparison with measured volumes. J Card Fail 2018 Sep;24(9):553–60. https://doi.org/10.1016/j.cardfail.2018.07.462 [Epub 2018 Aug 8].