Приоритеты исследований и нтенсивной инфузионной терапии и терапии вазопрессорами у взрослых пациентов
Lat et al. ICMx (2021) 9:10
Обзор
Кампания за выживание при сепсисе: приоритеты исследований интенсивной инфузионной терапии и терапии вазопрессорами у взрослых пациентов.
Перевод оригинальной статьи «The surviving sepsis campaign: fluid resuscitation and vasopressor therapy research priorities in adult patients»
Авторы: Ishaq Lat1, Craig M. Coopersmith, Daniel De Backer и Craig M. Coopersmith
Keywords: Fluid resuscitation, Sepsis, Septic shock, Vasoactive agents, Vasopressor
Ключевые слова: интенсивная инфузионная терапия, сепсис, септический шок, вазоактивные агенты, вазопрессоры
Введение
Кампания за выживание при сепсисе (англ. the Surviving Sepsis Campaign или SSC) - долговременно существующая инициатива Сообщества критической медицины и Европейского сообщества интенсивной медицины, созданная для улучшения выживаемости от сепсиса. SSC за время своего существования выпустило четыре клинических руководства [1-4], а следующее готовится к публикации в 2021 году. Несмотря на то, что, в общем и целом, рекомендации, содержащиеся в клинических руководствах, привели к улучшению клинических исходов [5 -7], все еще есть те области, имеющие важное клиническое значение и в которых пробелы в литературных данных не позволяют разработать намного более конкретные рекомендации.
В попытке определить приоритеты исследований сепсиса, SSC создала исследовательский комитет, в задачу которого входит разработка списка вопросов для будущих исследований, связанных с сепсисом. В результате в августе 2018 года состоялась совместная публикация Сообщества критической медицины и Европейского сообщества интенсивной медицины «Приоритеты исследований сепсиса и септического шока» [8, 9]. Этот первый документ представлял собой широкий обзор, в который вошло 26 вопросов в качестве приоритетов для изучения в будущем и с явным намерением опубликовать несколько статей для каждой области с более детальным описанием. Сегодняшняя публикация является второй в серии рукописей (предшествующая публикация была посвящена фундаментальным научным исследованиям), целью которых является более широкое рассмотрение трех исследовательских вопросов, связанных с интенсивной инфузионной терапией, вазоактивными агентами и терапии вазопрессорами.
Методы
Когда мы говорим о содержании статьи о первоначальных приоритетах исследований, то это содержание (контент) было разработано после того, как каждому члену комитета предлагалось определить вопросы, которые, по его мнению, были наиболее важными. Используя модифицированный подход Delphi, описанный в исходной статье, члены рабочей группы сосредоточились на исходных 88 предложениях к серии из 26 вопросов, посвященных всем областям, связанным с сепсисом. Сюда входили вопросы, связанные с клиническим ведением (как в руководствах SSC) и областями, которые выходили за рамки рекомендаций (фундаментальная наука, оценки состояния по шкалам, эпидемиология, долгосрочные результаты и т.д.). Все эти приоритетные направления исследований были представлены в оригинальной публикации [8, 9], в которой 26 вопросов были сгруппированы по тематическому сходству, при этом планировалось расширить каждый вопрос до уровня детализации, от чего в итоге отказались из-за нехватки места в исходной публикации. Из этого списка в 26 вопросов трем членам комитета, обладающим специальными знаниями в области интенсивной инфузионной терапии и вазопрессорной терапии, было поручено составить расширенные обзоры трех вопросов, связанных с указанной тематикой. В соответствии с существующими определениями септического шока, статья фокусируется на подгруппе сепсиса, в которой клеточные нарушения и нарушения кровообращения приводят к увеличению летальности. В попытке дополнить совокупный объем знаний о терапевтическом эффекте, окончательный список вопросов стал широким и исчерпывающим. В окончательной редакции вопросов принимала участия вся рабочая группа.
Краткий обзор
Рабочей группой выявлены три вопроса, касающихся проведения инфузионной терапии и терапии вазопрессорами:
1) Есть ли идеальные конечные точки для управления интенсивной инфузионной терапией и каким образом следует определять/титровать объем инфузии?
2) Есть ли оптимальный инфузионный раствор для интенсивной терапии сепсиса?
3) Каким видится оптимальный подход к выбору вазопрессора и режима его дозирования, а также к эскалации терапии вазопрессорами?
Формат каждого из трех вопросов напрямую отражает формат, что использовался в ранее опубликованном обзоре и в котором содержится более подробное описание методов. [8, 9]. Каждому автору был назначен только один вопрос для последующего обзора и обобщения. Презентация каждого вопроса сопровождалась критикой имеющихся на сегодня доказательств. Далее каждый автор показывал то, что до настоящего момента остается неизвестным и имеющим пробелы в наших текущих знаниях. Все исследовательские вопросы направлены на устранение имеющихся неопределенностей. Соответственно, клинические исходы могут нуждаться в уточнении и не ограничиваться только лишь летальностью, а предоставлять информацию заинтересованным сторонам о других представляющих интерес клинических исходах, таких как качество жизни, органная функция, использование ресурсов. И наконец, каждый автор завершил свою всеобъемлющую работу, предоставив список вопросов исследования, которые были сочтены заслуживающими дальнейшего изучения. Этот список вопросов был намеренно был задуман как исчерпывающий и авторы признают, что на эти вопросы, возможно, не будет ответа в ближайшее десятилетие, но их необходимо описать, чтобы предоставить план действий, согласно которому следует направить будущие исследования.
Вопрос 1: есть ли идеальные конечные точки для интенсивной инфузионной терапии и каким образом следует определять/титровать объем инфузии?
Что мы знаем
Обоснования для проведения интенсивной инфузионной терапии получены из множества экспериментальных и клинических исследований [10 - 15]. Интенсивная инфузионная терапия увеличивает сердечный выброс, как минимум на ранней стадии септического шока [13, 16]. Также, интенсивная инфузионная терапия увеличивает микроциркуляторную перфузию у пациентов с септическим шоком [17], что улучшает органную функцию [18].
Влияние интенсивной инфузионной терапии на клинические исходы менее очевидно и в большинстве своем поддерживается экспериментальными данными. Крупномасштабные интервенционные исследования, посвященные целенаправленной терапии, напрямую не касались количества, длительности или руководящих клинических переменных за исключением оксигенации центральной венозной крови (ScvО2). В пре-клинических моделях сепсиса интенсивная инфузионная терапия увеличивала выживание по сравнению с отсутствием таковой [11], но долгосрочные результаты с помощью исследований такого типа не могут подвергаться оценке. Конкретнее, введение жидкости парамедиками на догоспитальном этапе ассоциируется с улучшением исходов у пациентов с гипотензией [19], но такого положительного эффекта не наблюдается у пациентов с нормотензией и, более того, у таких пациентов инфузионная терапия может принести вред [20].
Несмотря на то, что ранняя инфузионная терапия приносит больше пользы по сравнению с отсроченной, оптимальный ее объем для каждого конкретного пациента различается. «Оптимальный объем» может означать то количество введенной жидкости, благодаря которому восстановилась перфузия конечных органов, но без вреда для их функции. Пациентам с подозрением на сепсис, у которых имеется гипотензия в течение одного часа или уровень лактата равен или превышает 4 ммоль/л, «Алгоритм 1-ого» часа рекомендует начальное введение кристаллоидов в объеме 30 мл/кг [21]. Но строгость данной рекомендации зиждется на очень низком уровне доказательств, когда сам объем в 30 мл/кг получен из простой статистической корреляции между летальностью и объемом проведенной инфузионной терапии [22]. Таким образом, определение оптимального объема жидкости при проведении инфузионной терапии остается критически важным вопросом, до настоящего времени остающегося без ответа. Анализ обширных баз данных предполагает, что ответ может напоминать U-образную кривую, где как ограничение, так и избыточный объем одинаково могут приносит вред пациенту. Наилучший ответ был получен тогда, когда интенсивную инфузионную терапию проводили с объемами от 15 до 45 мл/кг [22], но такой диапазон/разброс очень широк для применения в клинической практике. Более того, данные, полученные от 50 000 пациентов, показывают, что отсрочка в проведении инфузионной терапии не ассоциируется с увеличением риска смерти [6]. Одним из возможных объяснений может послужить «Время ноль» в этих исследованиях, которое устанавливалось как время обращения в больницу, а не время распознавания сепсиса. Также, польза от интенсивной инфузионной терапии может зависеть от тяжести основного заболевания в континууме сепсиса и от выраженности сопутствующей патологии [23 - 25].
Сразу же после начала инфузионной терапии большинство пациентов отвечает увеличение артериального давления, но со временем пропорция таких пациентов быстро снижается [26]. После начального болюса жидкости, на требуемый объем жидкости влияет достижение целевого значения артериального давления, но артериальное давление различается между пациентами, плюс к этому свое влияние оказывают такие факторы, как тяжесть исходной дегидратации, продолжающаяся потеря жидкости, тяжесть самого заболевания и сопутствующей патологии. Понимание того, когда необходимо продолжать инфузионную терапию и когда ее прекращать является критически важным из-за того, что избыточный объем инфузионной терапии приносит вред пациенту, что доказано в обсервационных исследованиях, когда положительный баланс жидкости приводит к неблагоприятным клиническим исходам [27, 28]. Мета-анализ девяти рандомизированных исследований, в которых сравнивались «низкий» и «высокий» объемы интенсивной инфузионной терапии, не нашел разницы в исходах [29], предположив при этом, что необходима индивидуализация инфузионной терапии. Длительность гемодинамических эффектов от введения жидкости определяется самим объемом инфузии, капиллярной утечкой и регуляцией гемодинамики (включая сюда стрессовый и не-стрессовый объемы), что приводит к разрешению компенсаторных механизмов, инициированных гиповолемией. Во многих исследованиях изучалось влияние инфузионной терапии на длительность гемодинамических эффектов от нее и практически все они пришли к выводу, что длительность этого эффекта никак не больше 2 часов [30]. Концептуально, инфузионная терапия улучшает сердечный выброс и тканевую перфузию. Но здесь очень важно отметить, что такой эффект наблюдается не во всех когортах пациентов. По существу, растет наше понимание в необходимости более индивидуализированного подхода к лечению. Интенсивная терапия «по рецепту» в гетерогенной группе пациентов не приведет к достижению конечных точек реанимации, поскольку различные потребности могут привести к тому, что одни пациенты получат слишком много жидкости тогда, как другим пациентам этого объема окажется недостаточно. Более того, несмотря на то, что обоснованием для начала инфузионной терапии является коррекция нарушений тканевой перфузии за счет улучшения сердечного выброса, на практике инфузионная терапия часто проводится с целью коррекции гипотонии или олигурии и это при том, что показатели тканевой перфузии, включая сюда и сердечный выброс, не оцениваются [31].
На сегодня нет наилучшего метода измерения, что покажет индивидуальную реакцию пациента на введение жидкости. Исторически сложилось так, что для управления инфузионной терапией применяются такие статические показатели, как внутрисосудистое давление (центральное венозное давление [ЦВД] и давление заклинивание легочной артерии), и показатели наполнения сердца (по данным эхокардиографии или транспульмонарной термодилюции). Однако прогностическая мощность этих переменных достаточно средняя, корректное предсказание клинического ответа на интенсивную инфузионную терапию возможно только с экстремальными значениями, что оставляет очень большую «серую зону» [32]. Нацеливание на определенные значения ЦВД может быть полезным тогда, когда другие, более надежные в контексте прогнозирования ответа на жидкость переменные, не применимы или недоступны. Однако тогда, когда такие переменные доступны, ЦВД более полезен для оценки потенциального риска от дальнейшего введения жидкости, чем как точный предиктор ответа на нагрузку жидкостью [33]. И наоборот, такие динамические переменные, как компрессия полой вены при прикроватном ультразвуковом исследовании, вариации пульсового давления и тест пассивного поднятия нижних конечностей намного более точны в прогнозировании увеличения сердечного выброса в ответ на введение жидкости. Но даже несмотря на физиологическое обоснование преимущества применения динамических переменных перед статическими в целях прогнозирования ответа на введение жидкости, все-таки доказательств того, что динамические показатели улучшают исходы, еще очень недостаточно [34].
Еще несколько показателей было предложено для определения оптимального объема интенсивной инфузионной терапии, а именно ScvO2, лактат, вено-артериальный градиент PСO2 и время ре-заполнения капилляров (РЗК). Примечательно, что в исследовании ANDROMEDA-SCHOCK пациенты были рандомизированны в группы, в одной из которых интенсивная инфузионная терапия проводилась под управлением времени ре-заполнения капилляров, а другая - под управлением лактата, и сравнивался риск смерти между этими группами [26, 35]. Важно учесть то, что у всех пациентов в исследовании ANDROMEDA на момент инициации интенсивной инфузионной терапии уже имелся увеличенный уровень лактата, что может указывать на большую вероятность того, что некоторые пациенты в группе «Лактат» получили излишнюю дополнительную инфузию в момент, когда тканевая перфузия, возможно, уже была восстановлена. Поскольку в этом исследовании не изучалось время РЗК отдельно от повышенного уровня лактата, эффективность интенсивной инфузионной терапии у пациентов, которым проводили мониторинг времени РЗК на фоне нормальных значений лактата, осталась неизвестной. Польза от терапии на основании лактата может заключаться в более раннем выявлении гипоперфузии у пациентов с нормальным артериальным давлением, у которых еще не развились признаки шока. Результаты исследования ANDROMEDA предполагают, что у пациентов с гипотензией, гиперлактатемией и снижением времени РЗК клиническая оценка времени РЗК приоритетна перед стратегией, в основе которой лежит уровень лактата. Но на ранних этапах шока может быть намного выгодней стратегия, основанная на уровне лактата, когда именно гиперлактатемия указывает на гипоперфузию, в отличие от более поздних этапов шока, когда, возможно, имеет значение клиренс лактата.
Концепция ограничения жидкости также изучена на ограниченном количестве исследований. Самое актуальное из них тестировало интенсивную инфузионную терапию согласно двум уровням физиологических параметров, на основании которых начиналась инфузия, и в группе ограничения для начала инфузионной терапии требовалось более выраженные изменения этих параметров [36]. Очень важным ограничением самого исследования было то, что введение жидкости начиналось без предварительной оценки ответной реакции на нагрузку жидкостью, что привело к избыточному введению жидкости в обеих группах. Отсутствие процедуры тестирования для определения чувствительности к нагрузке жидкостью будет увековечено в клинической практике до тех пор, пока основанием для прекращения инфузионной терапии будет отсутствие желаемого эффекта или ухудшение состояния. В дополнение некоторые предположили, что раннее введение вазопрессоров при сепсисе может помочь в ограничении инфузионной терапии за счет противодействия сепсис-индуцированной венозной дилатации. Конечно, венозная дилатация увеличивает не-стрессовый объем за счет стрессового объема и вазопрессоры могут помочь в ре-дистрибьюции объемов за счет увеличения венозного тонуса [37]. В экспериментальных исследованиях сепсиса раннее введение норэпинефрина в сочетании с интенсивной инфузионной терапией позволяет снизить объем инфузии при сохранении тканевой перфузии [38]. К сожалению, данные исследований взаимодействий между вазопрессорами и инфузионной терапией на человеке очень ограничены. В серии небольших исследований у пациентов с сепсисом, введение норэпинефрина увеличивает сердечный выброс за счет увеличения среднего системного давления (что отражает ре-дистрибьюцию крови из не-стрессового объема в стрессовый объем) [39] и показатели преднагрузки [40].
Чего мы не знаем - пробелы в нашем понимании - направление будущих исследований
1) Должны ли мы индивидуализировать начальный объем при проведении интенсивной инфузионной терапии и, если да, то как? Применение стандартного объема жидкости для всех пациентов с сепсисом идет в противоречие с другими областями управления сепсисом, где предпринимаются усилия для персонализации ухода там, где это возможно. Какие альтернативные стратегии могут быть использованы в клинической практике для индивидуализации начального объема при проведении интенсивной инфузионной терапии и что принесет максимальную пользу для пациента и снизит вред?
2) Какие переменные следует использовать для более тщательного подбора дозы интенсивной инфузионной терапии? Требуются более тщательные исследования, сравнивающие различные динамические и статические переменные для оценки реакции на нагрузку жидкостью. Кроме того, будет информативным тестирование различных динамических переменных в подгруппах пациентов с сепсисом. Исследования должны быть разработаны таким образом, чтобы в них был включены сразу несколько методов оценки реакции на нагрузку жидкостью.
3) Как определить оптимальную длительность интенсивной инфузионной терапии? Требуется проведение исследований, посвященных длительности проведения интенсивной инфузионной терапии сразу после идентификации сепсиса и септического шока, в которых основное внимание следует уделить изучению пользы и вреда от дополнительных видов терапии (к примеру, вазопрессоры) и их взаимодействие.
4) Какие переменные следует использовать как триггеры (спусковые крючки) начала интенсивной инфузионной терапии и де-эскалации интенсивной терапии? Касательно длительности проведения интенсивной инфузионной терапии - следует ли оценить стандартный набор физиологических переменных на предмет их применимости при решении вопроса о переходе от интенсивной терапии к ее де-эскалации?
5) Действительно ли комбинированный подход, при котором используются несколько показателей реакции на введение жидкости, лучше, чем применение для этой цели какого-либо одного показателя? Как расставить приоритеты из нескольких различных методов измерения в контексте помощи в принятии правильного решения?
6) В чем эффективность применения времени ре-заполнения капилляров как «гида» интенсивной терапии у пациентов с нормальным уровнем лактата? Будет ли иметь значение такой быстрый физиологический оценочный тест у пациентов без нарушения в уровне лактата?
7) Какова длительность эффекта от интенсивной инфузионной терапии? Признавая, что продолжительность положительного эффекта от интенсивной инфузионной терапии будем отличаться от пациента к пациенту, необходимы фармакокинетические популяционные исследования, результаты которых могут быть полезны для клиницистов при оценке терапевтических возможностей последующего ухода.
8) Действительно ли вазопрессоры ограничивают объем жидкости, требующейся для достижения гемодинамических целей? Если это так, то какое оптимальное соотношение жидкости и вазопрессоров? Определение того, а есть ли польза от применения политерапевтического подхода к ранней интенсивной инфузионной терапии, представляет особенный интерес, учитывая опасения по поводу чрезмерного введения жидкости. Политерапевтический подход при ранней интенсивной инфузионной терапии с введением вазопрессоров, использующий стандартизированную оценку переменных пациента, может быть более точным с позиции индивидуализации, тем самым максимизируя пользу и ограничивая побочные эффекты.
9) Есть ли необходимость в рестриктивной инфузионной терапии у пациентов с гипотензией или у пациентов с уровнем лактата равным или превышающим 4 ммоль/л? Попытки ограничить отрицательные эффекты от избыточного введения жидкости, но при этом сохранить максимально полезный эффект у пациентов с нарушениями перфузии, необходимо оценить в отдельных группах пациентов с септическим шоком.
10) Следует ли проводить начальную интенсивную инфузионную терапию в виде фиксированной дозы 30 мл/кг или начальную интенсивную терапию следует проводить меньшими аликвотами, но при условии повторной оценки состояния пациента и повторным введением болюса в случае необходимости? Хотя болюс 30 мл/кг сопряжен с риском как недостаточной инфузии, так и с риском избыточной инфузии, его преимущество заключается в том, что он относительно прост в применении, особенно в условиях ограниченных ресурсов, где невозможно получить дополнительные измерения. Введение меньших доз, повторяемых по мере необходимости в соответствии с гемодинамической оценкой, дает преимущество в виде более точного режима дозирования инфузионной терапии в точном соответствии с индивидуальными потребностями пациента. Риск, связанный с этим подходом, представляет собой добавление дополнительной сложности, отвлекая медицинскую бригаду от выполнения других важных задач при первоначальном ведении пациента с сепсисом и это при том, что в итоге такой подход приводит к сравнительно одинаковым введенным объемам.
11) Следует ли более тяжелому пациенту вводить больший объем жидкости при начальной интенсивной терапии? В континууме сепсиса и септического шока, следует ли пациентам с более тяжелыми физиологическими нарушениями вводить больший объем жидкости на начальном этапе интенсивной терапии для восстановления перфузии на клеточном уровне? Понимание того, что может существовать градиент дозы к начальному объему интенсивной инфузионной терапии, зависящий от тяжести шока, даст дополнительную информацию и, возможно, направит дальнейшие целенаправленные исследования в этой области.
12) Должны ли реанимационные мероприятия иметь различия в зависимости от групп пациентов, менее способных переносить большие объемы инфузии? Чтобы индивидуализировать лечение сепсиса для подгрупп с повышенным риском вреда от интенсивной инфузионной терапии, необходимы исследования, в которых бы проводилась оценка в подгруппах пациентов с определенными сопутствующими заболеваниями (сердечная недостаточность, аритмии, терминальная стадия почечной недостаточности). Идеальное исследование в этой области должно тестировать две стратегии интенсивной инфузионной терапии с многоуровневым определением степени тяжести при использовании триггерных переменных. При этом все болюсы жидкости должны быть одинакового объема и вводиться только после оценки чувствительности к жидкости. В идеале исследование должно быть стратифицировано по таким подгруппам, как сердечная недостаточность и заболевание почек.
13) Какой может быть оптимальная стратегия интенсивной инфузионной терапии в условиях ограниченных ресурсов? Подобные данные значительно различаются между странами с хорошими и ограниченными ресурсами [41]. К примеру, в странах Африки к югу от Сахары инфузионная терапия была связана с повышенным риском смерти. Понимание физиологии интенсивной инфузионной терапии при отсутствии адекватного мониторинга, проводить который возможно в отделениях интенсивной терапии в странах с более высокими ресурсами, является ключевым вопросом для значительной части населения мира. Разработка упрощенных стратегий для оценки состояния пациентов и проведения инфузионной терапии значительно улучшила бы качество оказываемой помощи.
Вопрос 2: какой раствор для инфузий является оптимальным при проведение интенсивной терапии септического шока?
Что мы знаем
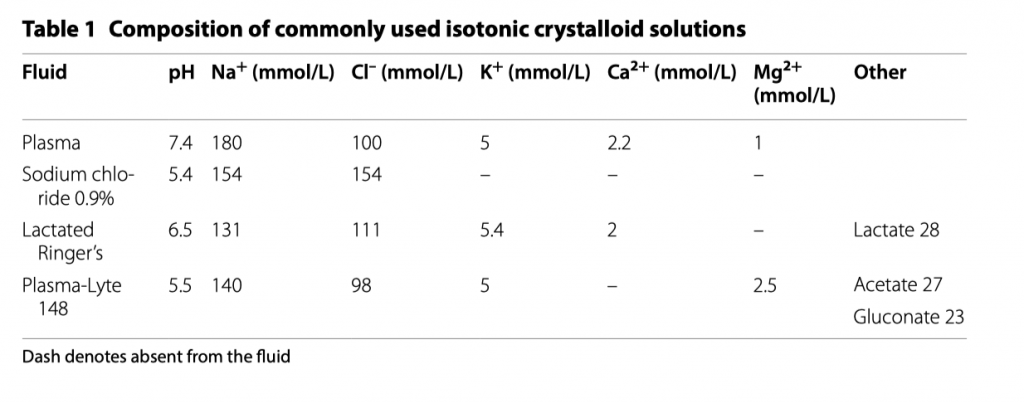
Текущее клиническое руководство SSC в качестве инфузионного раствора для начальной интенсивной терапии пациентов с сепсисом и септическим шоком и для последующего восстановления внутрисосудистого объема рекомендует растворы кристаллоидов (Таблица 2) [42]. При этом рекомендации касаются как буферных растворов, так и солевых растворов, основываясь на том, что отсутствуют убедительные данные о различиях в выживаемости [42]. Тем не менее, после публикации клинического руководства SSC, в исследовании SMART было сообщено о снижении частоты композитной конечной точки - тяжелые побочные эффекты со стороны почек, летальность, необходимость в проведении почечно-заместительной терапии, персистирующая дисфункция почек, у пациентов, находящихся в критическом состоянии, которым инфузионная терапия проводилась буферными растворами («Рингер-лактат»/«Рингер-ацетат/глюконат») по сравнению с солевыми растворами [43]. Общий результат этого знаменательно исследования - у одного из 94 пациентов ОИТ было предотвращено: почечно-заместительная терапия, персистирующая почечная дисфункция, смерть. Наиболее важно здесь то, что наибольшая разница в композитном исходе была замечена у пациентов с сепсисом, а это именно те пациенты, у которых объемы инфузии намного больше, что дает возможность нам предположить большую пользу для таких пациентов при переливании сбалансированных растворов, что было подтверждено при последующем анализе подгрупп [44]. Но все же обобщаемость результатов данного исследования остается неизвестной по причине того, что само исследование было одно-центровым и не ослепленным. Исследование SPLIT, в которое было включено 2 278 пациентов из четырех ОИТ Новой Зеландии сравнивало солевой раствор с ацетатным/глюконатным растворами [45]. Исследование не нашло разницы в 90 дневной частоте развития острого повреждения почек (ОПП) между двумя группами (point estimate, 0.4%; relative risk [RR], 1.04; p = 0.77), но в это исследование вошли пациенты после больших плановых оперативных вмешательств, которые изначально имеют намного меньший риск развития ОПП по сравнению с пациентами, находящимися в критическом состоянии. Аналогичный, но меньший эффект был обнаружен при сравнении физиологического раствора с буферными растворами в том же центре для некритически больных пациентов, поступивших из отделения неотложной помощи в общие больничные палаты [46]. При рассмотрении индивидуальных исходов, ориентированных на пациента, включая летальность и ОПП (а не комбинированный исход), недавние мета-анализы противоречат друг другу относительно того, превосходят ли сбалансированные кристаллоидные растворы физиологический раствор, как при критическом заболевании в целом, так и при сепсисе, в частности [47– 49]. Следует отметить, что исследования, в которых сравниваются буферные растворы с физиологическим раствором, как правило, в своем дизайне не учитывали газы артериальной крови и лабораторные данные. Можно потенциально критиковать продолжение введения физиологического раствора пациентам с гиперхлоремическим ацидозом, поскольку это отклоняется от современной практики многих клиницистов [50]. Точно так же ретроспективные исследования или исследования баз данных сообщают о последовательных эффектах снижения частоты внутрибольничной летальности, ОПП и необходимости в заместительной почечной терапии [51].
Недавний систематический анализ показал, что коллоиды более эффективны в достижении гемодинамических целей, чем кристаллоиды [52]. Однако коллоиды значительно дороже кристаллоидов, а крупномасштабных исследований, убедительно показывающих положительное влияние коллоидов на исходы, ориентированные на пациента, как не было, так и нет. Было бы несправедливо делать обобщение для всех коллоидов, где тип коллоида также влияет на результат. Самый простой пример - гидроксиэтилкрахмалы, которые связаны с более высокой степенью повреждения почек и более высоким возможным риском смерти, но не имеющих каких-либо явных преимуществ и поэтому не рекомендуются для использования при сепсисе [1, 53].
Существует множество исследований, в которых оценивались эффекты от введения альбумина пациентам, находящимся в критическом состоянии в целом и, более конкретно, при сепсисе и септическом шоке, либо в качестве первичного сравнения, либо в качестве анализа подгруппы более крупного исследования. Это привело к предложению SSC использовать альбумин в дополнение к кристаллоидам при начальной интенсивной инфузионной терапии и для последующего замещения внутрисосудистого объема у пациентов с сепсисом и септическим шоком тогда, когда пациентам требуется значительное количество кристаллоидов [42]. Эта рекомендация в значительной степени основана (1) на исследовании ALBIOS, в котором сообщалось, что применение альбумина может быть связано со снижением летальности в подгруппе пациентов с септическим шоком и гипоальбуминемией [54], и (2) на исследовании SAFE, которое не показало преимущества альбумина в отношении общей выживаемости пациентов, находящихся в критическом состоянии, но показало снижение летальности в подгруппе пациентов с сепсисом [55]. Важно отметить, что в исследовании ALBIOS альбумин вводили пациентам с сепсисом и гипоальбуминемией в попытке поддержать уровень сывороточного альбумина 30 г на литр или более. Кроме того, альбумин вводили в виде суточной дозы (до 300 мл 20% альбумина) в течение 7 дней. Напротив, недавнее одно-центровое исследование 360 пациентов с сепсисом и раком не показало положительного влияния на 30-дневную летальность от добавления альбумина [56]. Примечательно то, что исследования, сравнивающие коллоиды с кристаллоидами, использовали в качестве средства сравнения физиологический раствор. Если буферные растворы действительно превосходят физиологический раствор, потенциальные преимущества коллоидов, о которых сообщалось в предыдущих исследованиях, могли быть связаны с недостатками, связанными с самим физиологическим раствором, следовательно необходимы дополнительные исследования, возможно, в рамках трехстороннего исследования: группа физиологического раствора, группа буферных растворов и группа с альбумином. Исследования, оценивающие первичный тестовый альбумин в качестве поддерживающей жидкости, а не реанимационной жидкости, на этапах первоначальной реанимации, в первую очередь после кристаллоидов, оказались неэффективными. Наконец, нет крупномасштабных исследований, оценивающих альбумин как раствор для интенсивной инфузионной терапии, но с контролем гемодинамическими конечными точками.
Чего мы не знаем - пробелы в нашем понимании - направление будущих исследований
1) Существуют ли отдельные группы пациентов, в которых следует полностью избегать использования физиологического раствора? Было бы полезно проверить типы жидкостей в подгруппах пациентов для выявления вероятности побочных эффектов.
2) Существуют ли различия между буферными растворами? Действительно ли то, что «Рингер-лактат» имеет преимущества перед другими буферными (лактат/глюконат) растворами или наоборот?
3) В чем смысл добавления ацетата/глюконата в буферные растворы? К примеру, у пациентов в кардиохирургии сбалансированные ацетатные растворы имеют такие же гемодинамические эффекты, как у раствора «Лактат-Рингер» [57]. Но при этом значительная инфузия ацетата может вносить свой вклад в развитие вазоплегии и миокардиальной дисфункции у пациентов с дисфункцией почек [58, 59].
4) Недавние исследования предположили, что растворы для заместительной инфузионной терапии и растворы для разведения лекарственных средств могут служить причиной избыточного поступления хлора и, тем самым, влиять на водный баланс. Таким образом, выбор растворов для инфузии со сниженным количеством натрия/хлора может улучшить показатели водного баланса у пациентов в послеоперационном периоде [60], но подобных данных у больных с сепсисом не имеется. По существу - имеет ли смысл ограничить или даже полностью отказаться от применения растворов, содержащих хлор (включая сюда и сбалансированные растворы)? Примечательно, что этот вопрос особенно актуален с учетом недавних случаев прерывания цепочки поставок, что приводит к нехватке инфузионных растворов, что требует поисков им замены [61].
5) Действительно ли положительные почечные исходы ассоциируются с буферными растворами при сравнении их с физиологическим раствором и этот эффект обусловлен более низким содержанием хлора в буферных растворах Другими словами, токсичен ли хлорид сам по себе и эта токсичность имеет значение даже в отсутствие гиперхлоремии/ацидоза (в этом случает следует отдавать предпочтение растворам, свободным от хлора, а разведение лекарств физиологическим раствором следует всячески избегать, когда это возможно) или же такая девиация (отклонение) хлорида/рН вызвана большим количество введённого 0.9% NaCl (тщательный мониторинг может ограничить токсичность)? Смогут ли растворы лактата натрия послужить заменой физиологическому раствору и минимизировать повреждение почек?
6) Имеет ли альбумин преимущество перед буферными растворами кристаллоидов? Когда следует применять альбумин? В идеале сравнение альбумина со сбалансированными растворами кристаллоидов должно обязательно включать в себя подгруппы пациентов, представляющих наибольший интерес (хронические заболевания почек, цирроз).
7) Какие показания к применению альбумина - для коррекции гипоальбуминемии или для коррекции объема? Учитывая свойства коллоидного раствора альбумина, принесет ли применение альбумина большую пользу при лечении тяжелого шока, при котором требуются большие объемы инфузии? Или все же его применение ограничивается только лишь коррекцией гипоальбуминемии? Есть ли польза от введения альбумина при интенсивной инфузионной терапии и в чем она, особенно учитывая стоимость альбумина?
8) Какова оптимальная концентрация альбумина (4–5% or 20%)? В исследованиях изучались различные концентрации альбумина. В зависимости от предполагаемого механизма положительного эффекта при интенсивной инфузионной терапии (коррекция гипоальбуминемии по сравнению с увеличением внутрисосудистой жидкости) необходимы исследования, сравнивающие различные концентрации альбумина.
9) Может ли тяжесть течения сепсиса влиять на выбор инфузионного раствора для интенсивной терапии? В континууме сепсиса и септического шока, может ли пациент с более тяжелой формой шока получить пользу от комбинированного подхода - кристаллоиды и коллоиды, при проведении интенсивной инфузионной терапии?
10) Может ли такое условие, как имеющиеся ресурсы, играть роль в определении эффективности выбранного раствора для интенсивной терапии? Все исследования проводились там, где имеющиеся ресурсы не ограничивали выбор инфузионных растворов. Принимая во внимание данные, показывающие, что результаты интенсивной инфузионной терапии различаются между ресурсоемкими средами и средами с ограниченными ресурсами, возможно, что тип жидкости также может повлиять на результаты. Все это ведет к пониманию того, что выбор инфузионного раствора, вероятно, будет значительно более ограниченным в местах с ограниченными ресурсами и перед лицом непредсказуемого предложения.
Вопрос 3: каким может быть оптимальный подход при выборе вазопрессорной терапии, режимов дозирования и ее эскалации?
Что мы знаем
Среднее артериальное давление (САД) частично определяется передачей сигналов через семейства рецепторов, имеющих фармакологические различия. В настоящее время доступны вазопрессоры, которые работают, изменяя передачу сигналов через катехоламиновые рецепторы, рецепторы вазопрессина или воздействуя на систему ренин/ангиотензин.
Для лечения септического шока вазопрессором первой линии остается норэпинефрин [62]. Систематический обзор и мета-анализ 11 рандомизированных клинических исследований сообщил, что применение норэпинефрина приводит к снижению летальности (RR, 0.89; 95% CI, 0.810.98) и снижению риска развития аритмии (RR, 0.48; 95% CI, 0.40–0.58) в сравнении с допамином [63]. Опросы интенсивистов показывают их предпочтение к норэпинефрину, как к вазопрессору первой линии, что лишний раз отражает согласие практикующих врачей с текущими рекомендациями клинических руководств [64 - 66].
В исследованиях вазопрессина, либо как дополнительной терапии, либо как терапии первой линии, результаты противоречивые. Несмотря на то, что вазопрессин, при его применении вместе с норэпинефрином, никак не повлиял на летальность, анализ подгрупп показал потенциальную, и никак не ожидаемую, пользу в виде выживания пациентов с менее тяжелым течением септического шока (норэпинефрин менее 15 мкг/мин) [67]. Но последующее исследование не подтвердило такой результат даже несмотря на то, что применение вазопрессина снижало потребность в почечно-заместительной терапии по сравнению с норэпинефрином [68]. Существующий эффект снижения дозы норэпинефрина при одновременном с ним применением вазопрессина в дозе 0.01 - 0.03 Ед/мин привел к выпуску рекомендации о применении вазопрессина как дополнительной терапии [62].
Совсем недавно в рандомизированном клиническом исследовании у 321 пациента с вазодиляторным шоком, требующим введения норэпинефрина в дозе более чем 0.2 мкг/кг/мин, было проведено сравнение ангиотензина II с плацебо [69]. Ангиотензин II показал свою эффективность в достижении первичной конечной точки исследования - увеличение САД на 10 мм Hg или САД более 75 мм Hg, но не показал никакой разницы по отношению к выживаемости, вторичной точки исследования. Последующий анализ подгрупп этого исследования показал улучшение выживаемости 105 пациентов, которым на момент рандомизации требовалось проведение почечно-заместительной терапии, но этот результат требует подтверждения в будущем проспективном рандомизированном исследовании [70].
Помимо норэпинефрина, вазопрессина и ангиотензина II, оказывающих свое влияние различными путями, имеются и другие вазоактивные агенты, что могут оказывать воздействие на симпатическую систему путем влияния на альфа и бета рецепторы. В зависимости от клинического сценария дополнительная стимуляция альфа или бета рецепторов может оказывать как положительные, так и отрицательные эффекты. В этом контексте эпинефрин может рассматриваться как дополнительный агент для увеличения САД и снижения дозы норэпинефрина в случае рефрактерного шока [62]. Но даже несмотря на эффективное увеличение САД, эпинефрин не рекомендуется к применению как агент первой линии, потому что клинические исследования не показывают его пользу в контексте снижения летальности [71, 72], что было подтверждено в последующем мета-анализе исследований вазопрессоров [73]. Стоит отметить, что эпинефрин может увеличивать продукцию лактата, влияя на активность бета-2 рецепторов скелетной мускулатуры, что осложняет интерпретацию клиренса лактата и оценку перфузии. Фенилэфрин является селективным агонистом альфа-1 рецепторов, что может быть полезным при гипотензии с высоким выбросом. Но надо помнить о том, что фенилэфрин может вызвать спазм сосудов органов брюшной полости [74]. Очень важно следующее - в недавнем анализе эффектов, вызванных острой нехваткой (в национальном масштабе) норэпинефрина, показано, что замена норэпинефрина на фенилэфрин привела к увеличению летальности [75].
Допамин в низких дозах оказывает свое влияние через рецепторы допамина, при увеличении дозы допамин начинает оказывать влияние через альфа-рецепторы. В рандомизированном исследовании, где проводилось сравнение норэпинефрина с допамином, летальность не отличалась, однако применение допамина ассоциировалось с более высокой частотой развития аритмий, что является ограничением к применению допамина тогда, когда есть возможность применять другие вазоактивные агенты [76].
При применении вазопрессоров большую роль играет целевое значение артериального давления и этому вопросу было посвящено несколько исследований. Исследование SEPSIS-SPAM показало, что не было разницы в летальности при сравнении целевых значений САД 65 - 70 мм Hg и САД 80 - 85 мм Hg [78]. Более того, увеличение целевого значения САД у пациентов с хронической гипертензией приводило к снижению частоты проведения почечно-заместительной терапии. Но при этом целеполагание на более высокое значение САД ассоциировалось с более высокой частотой развития фибрилляции предсердий. Объединенный анализ показал, что более высокие значения целевого значения САД ассоциируются с более высокой летальностью тогда, когда терапия вазопрессорами продолжается более 6 часов [79]. Совсем недавнее рандомизированное исследование сравнило две группы - в первой целевое значение САД устанавливалось равным 60 - 65 мм Hg (группа разрешенного САД), а в другой САД определялся выбором врача, что допускало более индивидуальный подход. Исследование показало не только отсутствие разницы между группами в летальности, но в первой группе был тренд на улучшение выживаемости [80]. В группе разрешенного САД среднее значение было равным 66.7 мм Hg, во второй группе среднее значение САД было равным 72.6 мм Hg. «Исследование 65" было направлено на определение оптимального целевого значения САД в когорте пациентов, возраст которых составлял 65 лет и старше, путем рандомизации субъектов по стратегии разрешенной гипотензии (целевое значение САД 60-65 мм Hg) или обычного ухода в отделении интенсивной терапии для определения разницы в смертности от всех причин через 90 дней [80]. Исследование проводилось в ОИТ опытными врачами, а оценки делались после адекватной интенсивной инфузионной терапии. По завершении исследования не было разницы в летальности, хотя была заметная разница в точечной оценке (–2.85%; 95% CI, –6.75 to 1.05; p = 0.15). В подгруппе пациентов с хронической артериальной гипертензией (n = 1131) наблюдалась статистически значимая разница в пользу стратегии разрешенной гипотензии (adjusted odds ratio, 0.67; 95% CI, 0.51–0.88; p = 0.047).
Несмотря на то, что «Исследование 65» не дало окончательного результата, оно подтвердило логику, согласно которой для отдельных пациентов цели лечения должны быть персонализированы, а более низкое целевое значение САД может быть не только приемлемым, но и, как ни странно, принести пользу пожилым пациентам с хронической гипертензией в анамнезе.
Чего мы не знаем - пробелы в нашем понимании - направление будущих исследований
1) Следует ли персонализировать выбор вазопрессора в зависимости от характеристик пациента (к примеру, медицина на дому или хронические заболевания)? Процесса принятия решения об индивидуализации терапии вазопрессорами в настоящий момент времени не существует. Идентификация специфических факторов, характеризующих состояние пациента, и их влияние на органную дисфункцию и ответную реакцию на вазопрессоры, что позволило бы более точно определять цели перфузии, на сегодня в клинической практике не применяется [81]. Тем не менее, понимание того, что имеющиеся хронические заболевания так или иначе оказывают свое влияние на перфузию органов, встречает отсутствие доказательств того, как такое понимание можно использовать для управления вазопрессорной терапией, включая сюда и выбор вазопрессора.
2) Какой должна быть стартовая доза норэпинефрина?
3) Действительно ли норэпинефрин, как вазопрессор первой линии, является надлежащим выбором при сепсисе? Данные, свидетельствующие в пользу данной рекомендации, достаточно скудные. Имеется ли потенциальная польза от вазопрессина при его назначении в качестве препарата первой линии у пациентов с септическим шоком в более широкой популяции или в отобранных группах (к примеру, фибрилляция предсердий, хроническая болезнь почек)?
4) Какой агент может быть рассмотрен, как препарат для терапии второй линии, и влияет ли на этот выбор имеющиеся характеристики пациента?
5) Порог, при достижении которого необходимо принимать решение о назначении второго вазопрессорного агента - какой он? Исследования, в которых проводились сравнение дополнительных стратегий вазопрессорной терапии, применяли различные конечные точки. В значительной степени остается неизвестным, приводит ли дополнение к норэпинефрину другого вазопрессора к улучшению безопасности и выживаемости. Помимо выживаемости существуют и другие значимые клинически конечные точки - потребность в почечно-заместительной терапии, впервые выявленная аритмия, сердечная недостаточность, тромбоэмболия, некроз пальцев, качество жизни. Это важно понимать, поскольку добавление еще одного агента для снижения дозы норадреналина без улучшения выживаемости или уменьшения побочных эффектов приведет к увеличению затрат, возможно, без улучшения клинических исходов, ориентированных на пациента.
6) Что первично - интенсивная инфузионная терапия или терапия вазопрессорами? Или они должны идти вместе?
7) Когда необходимо начинать введение ангиотензина II? Несмотря на то, что исследование ATHOS-3 показало эффективность ангиотензина II как вазопрессора для увеличения артериального давления, остаются вопросы без ответов касательно роли ангиотензина II в клинической практике и, в первую очередь, отсутствие данных о потенциальной безопасности в связи высокой частотой развития тромбоэмболий по данным некоторых исследований. Несмотря на аргументы в пользу мультимодальной вазопрессорной терапии, необходимы дополнительные результаты и сравнительные данные для определения того, является ли ангиотензин II однозначно полезным в подгруппах пациентов (к примеру, у пациентов, которым требуется проведение почечно-заместительной терапии) или все-таки он потенциально вреден по сравнению со стратегиями, в которых этот агент не применяется.
8) Какова роль фенилэфрина, к примеру в менеджменте сепсиса?
9) Есть ли идеальное целевое значение САД у пациентов с сепсисом?
10) Каким образом хронические сопутствующие заболевания (гипертензия, ХПН) и лекарственная терапия этих хронических состояний оказывают свое влияние на целевое значение САД и на ответную реакцию на введение вазопрессоров?
11) Есть ли разница в затратах на лечение у разных стратегий терапии вазопрессорами? Несмотря на то, что традиционно стоимость лечения не является приоритетом, она остается очень существенным фактором тогда, когда полезность и эффективность оцениваются заинтересованными сторонами.
12) Как следует прекращать введение вазопрессоров?
Резюме
Представленный вашему вниманию
отчет расширяет клинические концепции, изложенные ранее в «Интенсивной инфузионной терапии и
терапии вазопрессорами»
(англ. Fluid Resuscitation and
Vasopressor Therapy), которые ранее были определены как приоритеты
Исследовательским комитетом SSC [8,
9]. Авторы стремились предоставить клиницистам и исследователям
подробный и информативный обзор неотложных вопросов, требующих исследования в
области стратегий интенсивной инфузионной терапии и применения вазопрессоров.
Оптимальные подходы к инфузионной терапии и к терапии вазопрессорами по мере
накопления знаний в этой области за последнее десятилетие развивались, что
потребовало переосмысления ранее поставленных вопросов. Мы надеемся, что этот
обзор послужит основой для планирования будущих исследований сепсиса и
септического шока.
References
1. Rhodes A, Evans LE, Alhazzani W et al (2017a) Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Crit Care Med 43:304–377
2. Dellinger RP, Levy MM, Rhodes A et al (2013) Surviving Sepsis Campaign Guidelines Committee including the pediatric subgroup: surviving sepsis campaign: International guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med 41:580–637
3. Dellinger RP, Levy MM, Carlet JM, et al; International Surviving Sepsis Campaign Guidelines Committee; American Association of Critical-Care Nurses; American College of Chest Physicians; American College of Emergency Physicians; Canadian Critical Care Society; European Society of Clinical Microbiology and Infectious Diseases; European Society of Intensive Care Medicine; European Respiratory Society; International Sepsis Forum; Japanese Association for Acute Medicine; Japanese Society of Intensive Care Medicine; Society of Critical Care Medicine; Society of Hospital Medicine; Surgical Infection Society (2008) World Federation of Societies of Intensive and Critical Care Medicine: Surviving sepsis campaign: International guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med 36:296–327
4. Dellinger RP, Carlet JM, Masur H et al (2004) Surviving Sepsis Campaign Management Guidelines Committee: surviving sepsis campaign guidelines for management of severe sepsis and septic shock. Crit Care Med 32:858–873
5. Levy MM, Rhodes A, Phillips GS et al (2015) Surviving sepsis campaign: association between performance metrics and outcomes in a 7.5-year study. Crit Care Med 43:3–12
6. Seymour CW, Gesten F, Prescott HC et al (2017) Time to treatment and mortality during mandated emergency care for sepsis. N Engl J Med 376:2235–2244
7. Levy MM, Gesten FC, Phillips GS et al (2018) Mortality changes associated with mandated public reporting for sepsis. The results of the New York state initiative. Am J Respir Crit Care Med 198:1406–1412
8. Coopersmith CM, De Backer D, Deutschman CS et al (2018a) Surviving sepsis campaign: research priorities for sepsis and septic shock. Intensive Care Med 44:1400–1426
9. Coopersmith CM, De Backer D, Deutschman CS et al (2018b) Surviving sepsis campaign: research priorities for sepsis and septic shock. Crit Care Med 46:1334–1356
10. Hollenberg SM, Dumasius A, Easington C et al (2001) Characterization of a hyperdynamic murine model of resuscitated sepsis using echocardiography. Am J Respir Crit Care Med 164:891–895
11. Zanotti-Cavazzoni SL, Guglielmi M, Parrillo JE et al (2009) Fluid resuscitation influences cardiovascular performance and mortality in a murine model of sepsis. Intensive Care Med 35:748–754
12. Cholley BP, Lang RM, Berger DS et al (1995) Alterations in systemic arterial mechanical properties during septic shock: role of fluid resuscitation. Am J Physiol 269:H375–H384
13. Gilbert EM, Haupt MT, Mandanas RY et al (1986) The effect of fluid loading, blood transfusion, and catecholamine infusion on oxygen delivery and consumption in patients with sepsis. Am Rev Respir Dis 134:873–878
14. Lewis AJ, Griepentrog JE, Zhang X et al (2018) Prompt administration of antibiotics and fluids in the treatment of sepsis: a murine trial. Crit Care Med 46:e426–e434
15. Seymour CW, Cooke CR, Heckbert SR et al (2014) Prehospital intravenous access and fluid resuscitation in severe sepsis: an observational cohort study. Crit Care 18:533
16. Pottecher J, Deruddre S, Teboul JL et al (2010) Both passive leg raising and intravascular volume expansion improve sublingual microcirculatory perfusion in severe sepsis and septic shock patients. Intensive Care Med 36:1867–1874
17. Ospina-Tascon G, Neves AP, Occhipinti G et al (2010) Effects of fluids on microvascular perfusion in patients with severe sepsis. Intensive Care Med 36:949–955
18. Pranskunas A, Koopmans M, Koetsier PM et al (2013) Microcirculatory blood flow as a tool to select ICU patients eligible for fluid therapy. Intensive Care Med 39:612–619
19. Lane DJ, Wunsch H, Saskin R et al (2018) Association between early intravenous fluids provided by paramedics and subsequent in-hospital mortality among patients with sepsis. JAMA Netw Open 1:e185845
20. Seymour CW, Cooke CR, Mikkelsen ME et al (2010) Out-of-hospital fluid in severe sepsis: effect on early resuscitation in the emergency department. Prehosp Emerg Care 14:145–152
21. Levy MM, Evans LE, Rhodes A (2018) The surviving sepsis campaign bundle: 2018 update. Crit Care Med 46:997–1000
22. Liu V, Morehouse JW, Soule J et al (2013) Fluid volume, lactate values, and mortality in sepsis patients with intermediate lactate values. Ann Am Thorac Soc 10:466–473
23. Leisman D, Wie B, Doerfler M et al (2016) Association of fluid resuscitation initiation within 30 minutes of severe sepsis and septic shock recognition with reduced mortality and length of stay. Ann Emerg Med 68:298–311
24. Leisman DE, Goldman C, Doerfler ME et al (2017) Patterns and outcomes associated with timeliness of initial crystalloid resuscitation in a prospective sepsis and septic shock cohort. Crit Care Med 45:1596–1606
25. Khan RA, Khan NA, Bauer SR et al (2020) Association between volume of fluid resuscitation and intubation in high-risk patients with sepsis, heart failure, end-stage renal disease, and cirrhosis. Chest 157:286–292
26. Hernández G, Ospina-Tascón GA, Damiani LP et al (2019) The ANDROMEDA SHOCK Investigators and the Latin America Intensive Care Network (LIVEN): Effect of a resuscitation strategy targeting peripheral perfusion status vs serum lactate levels on 28-day mortality among patients with septic shock: The ANDROMEDA-SHOCK randomized clinical trial. JAMA 321:654–664
27. Sakr Y, Rubatto Birri PN, Kotfis K et al (2017) Intensive Care Over Nations Investigators: higher fluid balance increases the risk of death from sepsis: results from a large international audit. Crit Care Med 45:386–394
28. Boyd JH, Forbes J, Nakada TA et al (2011) Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med 39:259–265
29. Meyhoff TS, Møller MH, Hjortrup PB et al (2020) Lower vs higher fluid volumes during initial management of sepsis: a systematic review with meta-analysis and trial sequential analysis. Chest 157:1478–1496
30. Nunes TS, Ladeira RT, Bafi AT et al (2014) Duration of hemodynamic effects of crystalloids in patients with circulatory shock after initial resuscitation. Ann Intensive Care 4:25
31. Cecconi M, Hofer C, Teboul JL et al (2015) FENICE Investigators; ESICM Trial Group: fluid challenges in intensive care: the FENICE study: a global inception cohort study. Intensive Care Med 41:1529–1537
32. Eskesen TG, Wetterslev M, Perner A (2016) Systematic review including re-analyses of 1148 individual data sets of central venous pressure as a predictor of fluid responsiveness. Intensive Care Med 42:324–332
33. De Backer D, Vincent JL (2018) Should we measure the central venous pressure to guide fluid management? Ten answers to 10 questions. Crit Care 22:43
34. Ehrman RR, Gallien JZ, Smith RK et al (2019) Resuscitation guided by volume responsiveness does not reduce mortality in sepsis: a meta-analysis. Crit Care Explor 1:e0015
35. Zampieri FG, Damiani LP, Bakker J et al (2020) Effect of a resuscitation strategy targeting peripheral perfusion status vs serum lactate levels on 28-day mortality among patients with septic shock: a Bayesian reanalysis of the ANDROMEDA-SHOCK trial. Am J Respir Crit Care Med 201:423–429
36. Hjortrup PB, Haase N, Bundgaard H et al (2016) CLASSIC Trial Group; Scandinavian Critical Care Trials Group: restricting volumes of resuscitation fluid in adults with septic shock after initial management: The CLASSIC randomised, parallel-group, multicentre feasibility trial. Intensive Care Med 42:1695–1705
37. Perner A, De Backer D (2014) Understanding hypovolaemia. Intensive Care Med 40:613–615
38. Sennoun N, Montemont C, Gibot S et al (2007) Comparative effects of early versus delayed use of norepinephrine in resuscitated endotoxic shock. Crit Care Med 35:1736–1740
39. Persichini R, Silva S, Teboul JL et al (2012) Effects of norepinephrine on mean systemic pressure and venous return in human septic shock. Crit Care Med 40:3146–3153
40. Hamzaoui O, Georger JF, Monnet X et al (2010) Early administration of norepinephrine increases cardiac preload and cardiac output in septic patients with life-threatening hypotension. Crit Care 14:R142
41. Cecconi M, Hernandez G, Dunser M et al (2019) Fluid administration for acute circulatory dysfunction using basic monitoring: narrative review and expert panel recommendations from an ESICM task force. Intensive Care Med 45:21–32
42. Rhodes A, Evans LE, Alhazzani W et al (2017b) Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med 43:304–377
43. Semler MW, Self WH, Wanderer JP et al (2018) SMART Investigators and the Pragmatic Critical Care Research Group: balanced crystalloids versus saline in critically ill adults. N Engl J Med 378:829–839
44. Brown RM, Wang L, Coston TD et al (2019) Balanced crystalloids versus saline in sepsis. A secondary analysis of the SMART clinical trial. Am J Respir Crit Care Med 200:1487–1495
45. Young P, Bailey M, Beasley R, SPLIT Investigators et al (2015) ANZICS CTG: effect of a buffered crystalloid solution vs saline on acute kidney injury among patients in the intensive care unit: the SPLIT randomized clinical trial. JAMA 314:1701–1710
46. Self WH, Semler MW, Wanderer JP et al (2018) SALT-ED Investigators: balanced crystalloids versus saline in noncritically ill adults. N Engl J Med 378:819–828
47. Hammond DA, Lam SW, Rech MA et al (2020) Balanced crystalloids versus saline in critically ill adults: a systematic review and meta-analysis. Ann Pharmacother 54:5–13
48. Xue M, Zhang X, Liu F et al (2019) Effects of chloride content of intravenous crystalloid solutions in critically ill adult patients: a meta-analysis with trial sequential analysis of randomized trials. Ann Intensive Care 9:30
49. Antequera Martín AM, Barea Mendoza JA, Muriel A et al (2019) Buffered solutions versus 0.9% saline for resuscitation in critically ill adults and children. Cochrane Database Syst Rev 7:012247
50. Vincent JL, De Backer D (2016) Saline versus balanced solutions: are clinical trials comparing two crystalloid solutions really needed? Crit Care 20:250
51. Yunos NM, Bellomo R, Hegarty C et al (2012) Association between a chloride-liberal vs chloride-restrictive intravenous fluid administration strategy and kidney injury in critically ill adults. JAMA 308:1566–1572
52. Martin GS, Bassett P (2019) Crystalloids vs colloids for fluid resuscitation in the intensive care unit: a systematic review and meta-analysis. J Crit Care 50:144–154
53. Müller RB, Haase N, Lange T et al (2015) Acute kidney injury with hydroxyethyl starch 130/0.42 in severe sepsis. Acta Anaesthesiol Scand 59:329–336
54. Caironi P, Tognoni G, Masson S et al (2014) ALBIOS Study Investigators: albumin replacement in patients with severe sepsis or septic shock. N Engl J Med 370:1412–1421
55. Finfer S, Bellomo R, Boyce N et al (2004) SAFE Study Investigators: a comparison of albumin and saline for fluid resuscitation in the intensive care unit. N Engl J Med 350:2247–2256
56. Park CHL, de Almeida JP, de Oliveira GQ et al (2019) Lactated ringer’s versus 4% albumin on lactated ringer’s in early sepsis therapy in cancer patients: a pilot single-center randomized trial. Crit Care Med 47:e798–e805
57. Pfortmueller CA, Faeh L, Müller M et al (2019) Fluid management in patients undergoing cardiac surgery: effects of an acetate- versus lactate-buffered balanced infusion solution on hemodynamic stability (HEMACETAT). Crit Care 23:159
58. Aizawa Y, Ohmori T, Imai K et al (1977) Depressant action of acetate upon the human cardiovascular system. Clin Nephrol 8:477–480
59. Vincent JL, Vanherweghem JL, Degaute JP et al (1982) Acetate-induced myocardial depression during hemodialysis for acute renal failure. Kidney Int 22:653–657
60. Van Regenmortel N, Hendrickx S, Roelant E et al (2019) 154 compared to 54 mmol per liter of sodium in intravenous maintenance fluid therapy for adult patients undergoing major thoracic surgery (TOPMAST): a single-center randomized controlled double-blind trial. Intensive Care Med 45:1422–1432
61. Mazer-Amirshahi M, Fox ER (2018) Saline shortages—many causes, no simple solution. N Engl J Med 378:1472–1474
62. Rhodes A, Evans LE, Alhazzani W et al (2017c) Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Crit Care Med 45:486–552
63. Avni T, Lador A, Lev S et al (2015) Vasopressors for the treatment of septic shock: systematic review and meta-analysis. PLoS ONE 10:e0129305
64. Scheeren TWL, Bakker J, De Backer D et al (2019) Current use of vasopressors in septic shock. Ann Intensive Care 9:20
65. Oldner A, Rossi P, Karason S et al (2003) Scandinavian Critical Care Trials Group: a practice survey on vasopressor and inotropic drug therapy in Scandinavian intensive care units. Acta Anaesthesiol Scand 47:693–701
66. Lamontagne F, Cook DJ, Adhikari NKJ et al (2011) Vasopressor administration and sepsis: a survey of Canadian intensivists. J Crit Care 26:532.e1-532.e7
67. Russell JA, Walley KR, Singer J et al (2008) VASST Investigators: vasopressin versus norepinephrine infusion in patients with septic shock. N Engl J Med 358:877–887
68. Gordon AC, Mason AJ, Thirunavukkarasu N et al (2016) VANISH Investigators: effect of early vasopressin vs norepinephrine on kidney failure in patients with septic shock: the VANISH randomized clinical trial. JAMA 316:509–518
69. Khanna A, English SW, Wang XS et al (2017) ATHOS-3 Investigators: angiotensin II for the treatment of vasodilatory shock. N Engl J Med 377:419–430
70. Tumlin JA, Murugan R, Deane AM et al (2018) Angiotensin II for the Treatment of High-Output Shock 3 (ATHOS-3) Investigators: outcomes in patients with vasodilatory shock and renal replacement therapy treated with intravenous angiotensin II. Crit Care Med 46:949–957
71. Annane D, Vignon P, Renault A et al (2007) CATS Study Group: norepinephrine plus dobutamine versus epinephrine alone for management of septic shock: a randomised trial. Lancet 370:676–684
72. Myburgh JA, Higgins A, Jovanovska A et al (2008) CAT Study investigators: a comparison of epinephrine and norepinephrine in critically ill patients. Intensive Care Med 34:2226–2234
73. Cheng L, Yan J, Han S et al (2019) Comparative efficacy of vasoactive medications in patients with septic shock: a network meta-analysis of randomized controlled trials. Crit Care 23:168
74. Morelli A, Ertmer C, Rehberg S et al (2008) Phenylephrine versus norepinephrine for initial hemodynamic support of patients with septic shock: a randomized, controlled trial. Crit Care 12:R143
75. Vail E, Gershengorn HB, Hua M et al (2017) Association between US norepinephrine shortage and mortality among patients with septic shock. JAMA 317:1433–1442
76. De Backer D, Biston P, Devriendt J et al (2010) SOAP II Investigators: comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med 362:779–789
77. Wu JY, Stollings JL, Wheeler AP et al (2017) Efficacy and outcomes after vasopressin guideline implementation in septic shock. Ann Pharmacother 51:13–20
78. Asfar P, Meziani F, Hamel JF et al (2014) SEPSISPAM Investigators: high versus low blood-pressure target in patients with septic shock. N Engl J Med 370:1583–1593
79. Lamontagne F, Day AG, Meade MO et al (2018) Pooled analysis of higher versus lower blood pressure targets for vasopressor therapy septic and vasodilatory shock. Intensive Care Med 44:12–21
80. Lamontagne F, Richards-Belle A, Thomas K et al (2020) Effect of reduced exposure to vasopressors on 90-day mortality in older critically ill patients with vasodilatory hypotension: a randomized clinical trial. JAMA 323:938–949
81. Lamontagne F, Cook DJ, Meade MO et al (2017) Vasopressor use for severe hypotension-a multicentre prospective observational study. PLoS ONE 12:e0167840
Lat et al. ICMx (2021) 9:10