Применение кортикостероида при тяжелой пневмонии в реальных условиях
Ceccato et al. Critical Care (2021) 25:432
Исследование
Применение кортикостероида при тяжелой пневмонии в реальных условиях: исследование по методу отбора подобного по вероятности (склонности)
Перевод оригинальной статьи: «Real-world corticosteroid use in severe pneumonia: a propensity-score-matched study»
А.Ceccato, A. Russo, E. Barbeta, P. Oscanoa, G. Tiseo4, A. Gabarrus, P. Di Giannatale, S. Nogas, C. Cilloniz, F. Menichetti, M. Ferrer, M. Niederman, M. Falcone, A. Torres
Ciber de Enfermedades Respiratorias (Ciberes, CB06/06/0028), Institut d’Investigacions Biomèdiques August Pi I Sunyer (IDIBAPS), University of Barcelona (UB), Barcelona, Spain.
Department of Public Health and Infectious Diseases, Policlinico Umberto I, “Sapienza” University of Rome, Rome, Italy.
Department of Pneumology, Institut Clinic de Respiratori, Hospital Clinic of Barcelona, Villarroel 170, 08036 Barcelona, Spain.
Infectious Diseases Unit, Department of Clinical and Experimental Medicine, University of Pisa, Pisa, Italy.
Department of Medical, Oral and Biotechnological Sciences, School of Medicine and Health Sciences, Section of Anesthesia Analgesia, Perioperative and Intensive Care, SS. Annunziata Hospital, Gabriele d’Annunzio University of Chieti-Pescara, Chieti, Italy.
Dipartimento Scienze Chirurgiche E Diagnostiche Integrate (DISC), Università Degli Studi Di Genova, Genova, Italy. 7 Division of Pulmonary and Critical Care Medicine, Weill Cornell Medical College, New York Presbyterian/Weill Cornell Medical Center, New York, NY, USA.
Keywords: Community-acquired pneumonia, Corticosteroids, Mortality
Ключевые слова: внебольничная пневмония, кортикостероиды, летальность
Введение
Внебольничная пневмония (community-acquired pneumonia [CAP]) в общемировом масштабе является лидирующей причиной смертности и заболеваемости даже несмотря на корректное применение антибиотиков [1, 2]. Тяжесть течения заболевания часто требует перевода пациента в отделение интенсивной терапии (ОИТ) [3, 4], но и это не снижает летальность [5]. Смерть при тяжелой внебольничной пневмонии следует за чрезмерным системным воспалительным ответом, при котором развиваются нарушения газообмена с дыхательной недостаточностью, сепсис и полиорганная недостаточность [6]. Конечно, антимикробная терапия (АМТ) высоко эффективна в снижении бактериальной нагрузки, вызванной легочной инфекцией [7], но АМТ не обладает способностью напрямую модулировать воспалительный ответ.
Плохие клинические результаты при тяжелой внебольничной пневмонии требуют поиска других, а не только основанных на АМТ, стратегий терапии. Кортикостероиды обладают очевидными возможностями в ингибировании экспрессии и активности цитокинов, вовлеченных в воспалительный ответ, ассоциированный с пневмонией [8]. Но их применение при лечении внебольничной пневмонии в рандомизированных клинических исследованиях показало разнонаправленные результаты в контексте летальности, что частично можно объяснить включением в исследования пациентов с тяжелым и не-тяжелым течением пневмонии [9]. И отсюда большое значение получает надлежащая селекция пациентов только с тяжелым течением внебольничной пневмонии, когда благоприятные эффекты кортикостероидов перевешивают их неблагоприятные эффекты [10, 11]. И действительно, анализ подгрупп пациентов, получавших терапию кортикостероидами при внебольничной пневмонии, показал улучшение выживаемости в основном у пациентов с тяжелым течением заболевания. К тому же вряд ли мы увидим улучшение клинических результатов в отношении летальности у пациентов с не-тяжелым течением внебольничной пневмонии, когда смертность в этой подгруппе пациентов и так невысока [12—18]. Понимание того, что рациональное звено в применении кортикостероидов заключается в снижении воспалительного ответа, приводит нас к заключению, что именно при чрезмерном воспалительном ответе можно получить наибольшую пользу от кортикостероидов. В рандомизированном клиническом исследовании пациентов с тяжелым течением внебольничной пневмонии и высокими уровнями С-реактивного белка (СРБ) применение кортикостероидов привело к намного меньшей радиографической прогрессии непрозрачности легочной ткани [19]. К сожалению, низкая мощность исследования не позволила оценить разницу и в летальности, и в других клинических исходах.
Наша гипотеза заключается в том, что кортикостероиды способны улучшить клинические исходы у пациентов с тяжелым течением внебольничной пневмонии и чрезмерным воспалительным ответом путем снижения легочного и системного воспаления. Соответственно, нашей целью стал анализ влияния кортикостероидов на летальность и другие клинические исходы у пациентов с тяжелым течением внебольничной пневмонии и чрезмерным воспалительным ответом.
Дизайн исследования и методы
Это было обсервационное многоцентровое исследование в реальных условиях, в котором использовались данные, полученные в двух проспективных когортах последовательных пациентов с внебольничной пневмонией, поступивших в «the Hospital Clinic of Barcelona», Испания (январь 2004 — декабрь 2019) и «the Policlinico Umberto I, “Sapienza” University of Rome», Италия (январь 2015 — декабрь 2017). Критерии включения были следующими: (а) взрослые пациенты ≥ 18 лет на момент постановки диагноза; (б) внебольничная пневмония, подтверждённая радиографически в сочетании с клиническими проявлениями (лихорадка, кашель, наличие мокроты, плеврит с болями в грудной клетке); (в) пациенты, поступившие в ОИТ; (г) пациенты с выраженным воспалительным ответом, определяемом как СРБ > 15 мг/ дл на момент поступления (основано на ранее проведенном исследовании [19]); (д) пациенты с основными критериями тяжести внебольничной пневмонии, согласно ATS/IDSA, как базовой линии [4]. Критерии исключения: (а) нахождение в госпитале более 48 часов в предыдущие 14 дней; (б) отсутствие полного списка клинических данных при наблюдении в течение 4—6 недель; (в) тяжелая иммуносупрессия, например, как это наблюдается после трансплантации, при ВИЧ-инфекции, при химиотерапии или при применении иммуносупрессивных лекарственных средств (> 20 мг преднизолона [или эквивалента] в день на протяжении 2-х недель и более); (г) подтвержденная вирусная инфекция; (е) применение гидрокортизона.
Этика
Этические комитеты «the Hospital Clinic of Barcelona» (Register: 5451) и «Policlinico Umberto I» (register: 4065) одобрили исследование и его публикации. Получение информированного согласия варьировалось по причине отсутствия вмешательства. Данные пациентов сохранялись тайне на всем протяжении исследования.
Сбор данных
Детальная информация о наличии сопутствующих заболеваний была получена из историй болезни. Клинические, лабораторные и радиографические характеристики записывались на момент поступления (описано в деталях в дополнительном файле 1: контент). Во время госпитализации записывались следующие данные: длительность госпитализации, необходимость в механической вентиляции (включая инвазивную и не-инвазивную), 30-дневную летальность. Тяжесть внебольничной пневмонии определялась согласно клиническим руководствам «the American Thoracic Society and Infectious Diseases Society of America (ATS/IDSA)» [20]. Для стратификации тяжести состояния использовались шкала последовательной оценки органной недостаточности (SOFA) [21] и индекс тяжести пневмонии (Pneumonia Severity Index [PSI]) [3].
Определения
Пациенты были сгруппированы согласно начальной терапии не тех, кто получил кортикостероиды (преднизон, метилпреднизолон, дексаметазон) и на тех, кто их получил кортикостероиды. Терапия кортикостероидами рассматривалась, как введение указанных кортикостероидов (преднизон или эквивалент в дозе 30 мг/день и более в первые 48 часов после поступления) в течение не менее 72-часов. Септический шок определялся согласно клиническому руководству ATS/ IDSA [4]. Эмпирическая антибиотикотерапия признавалась надлежащей в случае получения положительного микробиологического посева, выделенный патоген из которого показывал чувствительность in vitro хотя бы к одному из назначенных, согласно клиническому руководству ATS/IDSA, антимикробному препарату [4].
Исходы
Основной исход — 28-дневная летальность от всех причин. Вторичный исход — длительность госпитализации.
Статистический анализ
Мы сообщили о количестве и процентном соотношении пациентов в случае категориальных переменных, о медиане и первом/третьем квартиле для непрерывных переменных с не-нормальным распределением и о среднем и стандартном отклонении в случае непрерывных переменных с нормальным распределением. Категориальные переменные сравнивались с помощью точных тестов Chi-square или Fisher, непрерывные переменные сравнивались с помощью t-теста или непараметрических тестов Mann–Whitney U. Весь статистический анализ был проведен с помощью IBM SPSS Statistics, version 26.0 (IBM Corp., Armonk, NY, USA), статистическая значимость определялась при p <0.05 (двунаправленный).
Совпадение оценки склонности (Propensity score (PS) matching) [22, 23] использовалось для получения баланса между группами «кортикостероиды» (случай) и «не-кортикостероиды» (контроль).В общей популяции мы использовали сопоставление ближайших соседей 1:1 без замены в пределах ширины допуска совпадения 0,001; у пациентов с ИВЛ и/или шоком и у пациентов без ИВЛ и шока ширина допустимого отклонения была установлена на уровне 0,005. Выбор переменных для включения в расчет PS осуществлялся согласно методам Brookhart et al. [24] и мы включили только те, что были связаны с группой «случай» и с исходами (центр, возраст, пол, сахарный диабет 2 типа, ишемическая болезнь сердца, гипертензия, ХОБЛ, рак, шкала SOFA, септический шок, начальное надлежащее лечение). В общей популяции адекватное соответствие модели с дискриминацией и калибровкой PS было показано с помощью логистического моделирования, включающего коварианты (степень согласия, p = 0,792), а также у пациентов с ИВЛ и/или шоком (goodness-of-fit, p = 0.614) и у пациентов без ИВЛ и без шока (goodness-of-fit, p = 0.715). Мы провели исследовательский анализ в трех подгруппах — для пациентов только с септическим шоком, для пациентов только с потребностью в ИВЛ, для пациентов с септическим шоком и потребностью в ИВЛ (дополнительные сведения см. в Дополнительный файл 1: Контент). Множественное вменение [25] использовалось для отсутствующих ковариант в сопоставлении PS. Кривая выживаемости для пациентов с кортикостероидами или без них была получена с помощью метода Kaplan–Meier, после чего было проведено сравнение с помощью теста Gehan–Breslow–Wilcoxon test. Для 28-дневной летальности мы использовали COX-модели регрессии пропорциональных рисков [26]. Были рассчитаны отношения рисков (ОР) и 95% доверительные интервалы (95% ДИ).
Результаты
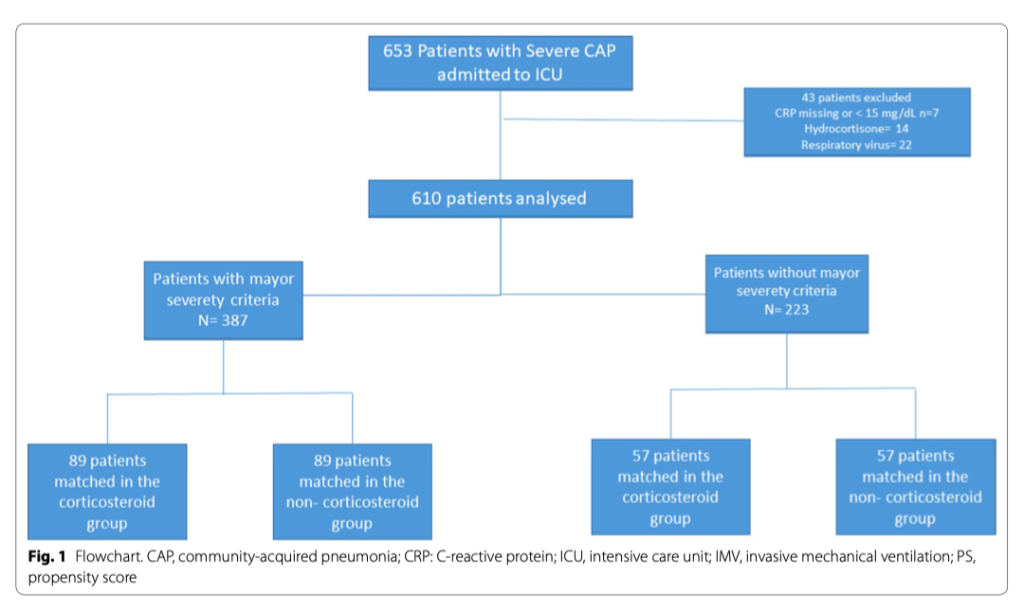
Среди 610 включенных пациентов, 198 (32%) получили кортикостероиды (Рис.1), а 387 пациентов имели основные критерии тяжести внебольничной пневмонии. Положительные микробиологические посевы были получены у 227 (55%) пациентов, которые не получали кортикостероиды, и у 99 (50%) пациентов, которые получали кортикостероиды. Наиболее часто высевался Streptococcus pneumoniae, менее часто — Staphylococcus aureus, Enterobacteriaceae и Haemophilus influenzae. Для общей популяции, до PS сравнения, лечение антибиотиками было признано надлежащим у 302 (92%) пациентов в группе «не-кортикостероид» и у 115 пациентов (86%) в группе «кортикостероид» (электронная таблица 1).
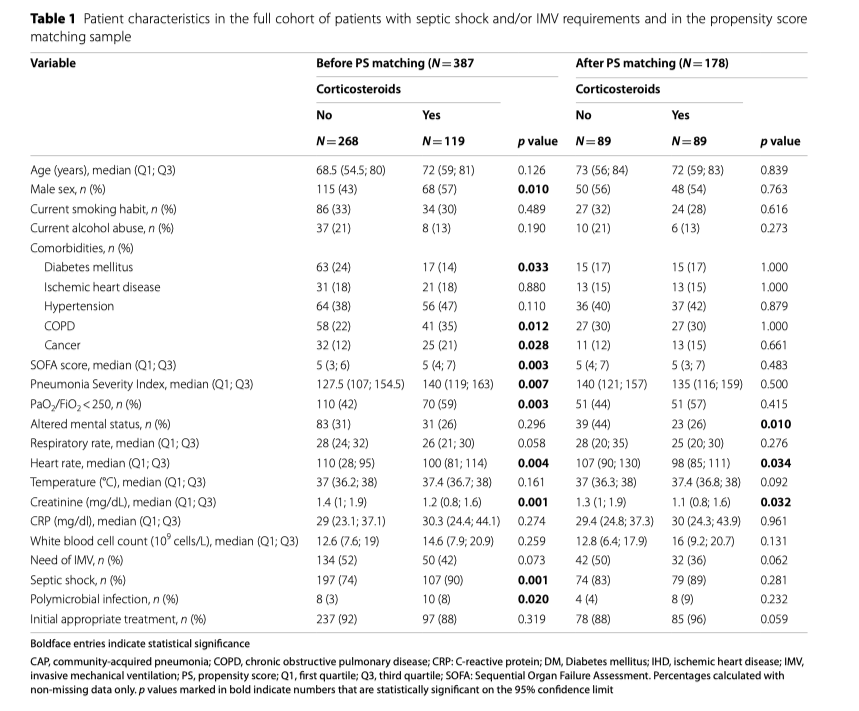
Основные исходные характеристики пациентов с большинством критериев тяжести внебольничной пневмонии описаны в таблице 1. Пациенты, получившие кортикостероиды, в большинстве своем были мужчинами, чаще имели сопутствующую патологию (сахарный диабет 2 типа, рак, ХОБЛ), показывали существенно более высокие оценки по шкале SOFA и PSI, более низкие значения PaO2/FiO2, более высокие значения частоты сердечных сокращений и уровня креатинина. Значимых различий по всем переменным исхода обнаружено не было.
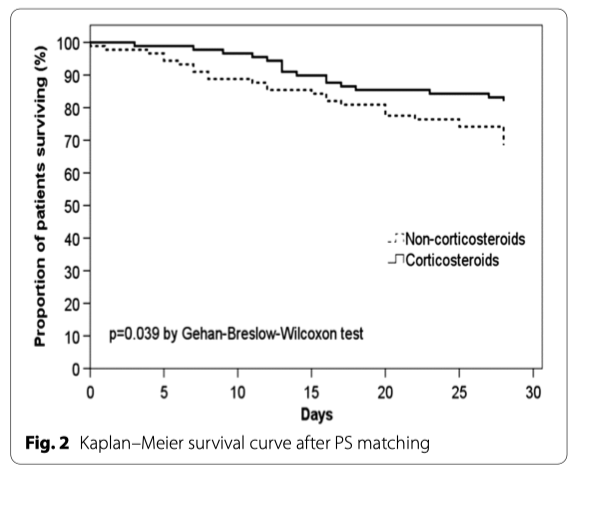
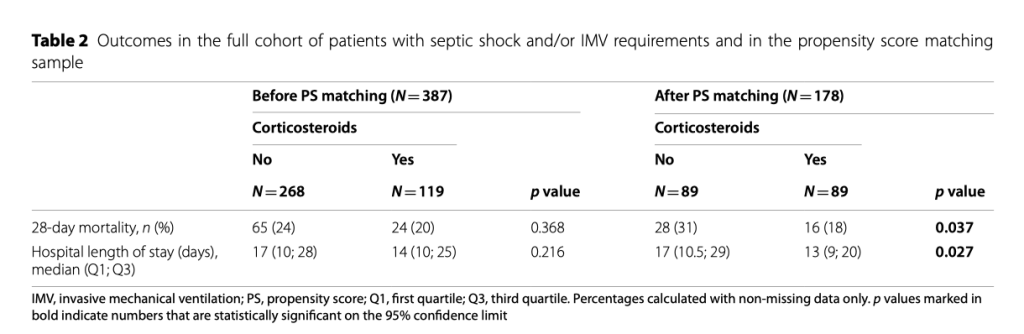
PS соответствие было проведено у пациентов с основными критериями тяжести внебольничной пневмонии, в результате которого было показано, что в каждой группе 89 пациентов имели существенные различия в ментальном статусе и в изменениях уровня креатинина. 28-дневная летальность была ниже у пациентов, которые получили кортикостероиды (16 пациентов [18%]), по сравнению с пациентами, которые не получили кортикостероиды (28 пациентов [31%]; p <0.05). Регрессионный Cox-анализ показал, что кортикостероиды снизили риск 28-дневной летальности: HR of 0.53 (95% CI 0.29–0.98). Кривые выживаемости Kaplan–Meier пациентов на ИВЛ и/или с шоком, показаны на рисунке 2. Для пациентов, которые не отвечали критериям тяжести внебольничной пневмонии, PS сравнение показало 57 пациентов на каждую группу. 28-дневная летальность между группами практически не отличалась - 16% (n=9) в группе «кортикостероид» против 18% (n=10) в группе «не-кортикостероид»; HR 0.88 (95% CI 0.32–2.36).
У всех пациентов, поступивших в ОИТ, был проведен анализ чувствительности, который не показал существенных различий между группами (eTable 2). Среди пациентов, которые получали кортикостероиды, снижение длительности госпитализации показали только пациенты с наиболее выраженной тяжестью внебольничной пневмонии согласно критериям тяжести (Таблица 2).
Обсуждение
В представленном исследовании выгоды в контексте летальности от применения кортикостероидов наблюдались среди наиболее тяжелых пациентов с внебольничной пневмонией. 28-дневная летальность при применении кортикостероидов у пациентов ОИТ с чрезмерным воспалительном ответом не имела отличий как при анализе склонности, так и вне этого анализа. Но при этом, когда анализу подверглись пациенты с септическим шоком или без него и которым проводилась механическая вентиляция легких, летальность существенно снижалась у тех пациентов, которые получали кортикостероиды. Эти данные, полученные в мультинациональном исследовании в реальных условиях, поддерживают результаты ранее проведенного мета-анализа.
Лечение внебольничной пневмонии кортикостероидами все еще имеет свои противоречия. Несмотря на то, в нескольких исследованиях было показано улучшение исходов, такие как снижение длительности госпитализации, снижение времени до стабилизации состояния пациентов [19, 27] или снижение рисков развития сердечно-сосудистых событий [28], только в одном исследовании было показано снижение летальности [29]. Это может быть связано с тем, что большинство исследований не имели статистической мощности для того, чтобы найти более существенные различия. Улучшение в контексте снижения летальности наблюдалось в нескольких мета-анализах, в основном при тяжелом течении внебольничной пневмонии [15, 16, 30, 32], но есть сомнения в невозможности репродукции полученных здесь результатов, а также в различиях исходных характеристик в двух из них [29, 33]. Основным ограничением этих исследований служит то, что для определения тяжести внебольничной пневмонии использовались различные критерии (например, госпитализация в ОИТ, критерии ATS/IDSA и септического шока, потребность в механической вентиляции, более высокие оценки по шкалам тяжести состояния). И такие различия привели к противоречивым предложениям в клинических руководствах для клинической практики. В то время как клинические руководства по диагностике и менеджменту недостаточности кортикостероидов, связанного с критическими заболеваниями, выпущенные «the Society of Critical Care Medicine» и «European Society of Intensive Care Medicine» рекомендуют отдавать предпочтение использованию кортикостероидов при лечении внебольничной пневмонии [34], клиническое руководство ATS/ IDSA по менеджменту внебольничной пневмонии продолжает выступать против применения кортикостероидов при лечении внебольничной пневмонии [4].
В нашем же исследовании мы позаботились о более тщательном отборе пациентов, а именно тех, кто получит пользу от применения кортикостероидов. Общепризнано, что кортикостероиды обладают иммуномодулирующей способностью при диспропорциональном воспалительном ответе и поэтому мы включили в исследование только тех пациентов, у которых чрезмерность воспалительного ответа можно было измерить (СРБ >15 мг/дл) [19, 35]. Мы исключили из исследования пациентов с вирусной пневмонией потому, что несколько анализов показали увеличение летальности при применении кортикостероидов у пациентов, госпитализированных с тяжелым течением гриппа [36], но и здесь имеются некоторые противоречия потому, что было показано, что дексаметазон снижает летальность у пациентов с COVID-19 [37, 38]. Также из нашего исследования мы исключили пациентов, которые получали гидрокортизон, основывая наше решение на результатах мета-анализа, показавшего отсутствие пользы от его применения в терминах «летальность» [39].
Мы нашли снижение летальности, ассоциированное с применением кортикостероидов, только у пациентов с наиболее тяжелым течением внебольничной пневмонии согласно критериям ATS/IDSA. Кортикостероиды были изучены при других тяжелых заболеваниях, таких как острый респираторный дистресс-синдром (ОРДС) [40] и септический шок, но полученные здесь результаты также вызывают новые вопросы. В последнем клиническом руководстве «Surviving Sepsis campaign» было заявлено, что показанием к назначению кортикостероидов при септическом шоке является не-достижение гемодинамической стабильности, несмотря на адекватно проведенную интенсивную инфузионную терапию и вазопрессорную поддержку [41]. Недавние положительные результаты при применении дексаметазона при ОРДС вновь оживили дебаты по поводу применения кортикостероидов в данных условиях [40]. Мы не нашил какой-либо разницы в 28-дневной летальности в специфической суб-популяции (септический шок или потребность в механической вентиляции) при анализе каждого отдельного случая, но количество пациентов в каждой группе было недостаточным для того, чтобы делать какие-либо далеко идущие выводы. Необходимы дальнейшие исследования для изучения того, действительно ли кортикостероиды снижают риск смерти при внебольничной пневмонии путем снижения легочного воспаления или за счет улучшения параметров гемодинамики.
Наиболее сильной стороной нашего исследования является то, что нам удалось воспроизвести в реальных и мультинациональных условиях результаты, что ранее были показаны только в мета-анализах. В то же время наше исследование имеет ряд ограничений. Первым из них можно назвать обсервационный дизайн исследования, что означает возможность получения пациентом кортикостероидов по другим причинами, отличным от тяжелой внебольничной пневмонии. И хотя мы старались соблюсти условия клинического исследования настолько, насколько это было возможно, лечение кортикостероидами не шло по протоколу и, таким образом, не соблюдалась гомогенность пациентов в терминах «время до получения первой дозы кортикостероидов», «общая доза», «тип кортикостероид». Второе ограничение мы видим в том, что несмотря на исчерпывающе соответствие PS имеющимся условиям, критерии тяжести, адекватность терапии, центр, где проводилась терапия, могли иметь различия между группами. И, наконец, мы создали временное окно для включения или исключения пациентов в исследование. Подобное временное окно можно найти и в других клинических исследованиях, но в нашем случае такой подход мог привести к селекции пациентов с уже определенными характеристиками, исключая при этом других пациентов. Тем не менее, эти ограничения все-таки отражают сценарий исследования в реальных условиях. Наши результаты следует рассматривать с определенной осторожностью, помня о противоречивых результатах ранее проведенных исследований. Но мы надеемся, что наши результаты смогут помочь при проведении новых клинических исследований, в которые будет включаться только наиболее тяжёлые пациенты с чрезмерно выраженным воспалительным ответом.
Выводы
Польза в отношении летальности при лечении кортикостероидами внебольничной пневмонии, как об этом ранее сообщалось в мета-анализе, в реальных условиях проявляется только у наиболее тяжелых пациентов с чрезмерно выраженным воспалительным ответом. У пациентов с более легким течением внебольничной пневмонии, которое не требует проведения механической вентиляции и при которой не развивается септический шок, применение кортикостероидов не приводит к снижению летальности.
References
1. Prina E, Ranzani OT, Torres A. Community-acquired pneumonia. Lancet Lond Engl. 2015;386(9998):1097–108.
2. Dambrava PG, Torres A, Vallès X, Mensa J, Marcos MA, Peñarroja G, et al. Adherence to guidelines’ empirical antibiotic recommendations and community-acquired pneumonia outcome. Eur Respir J. 2008;32(4):892–901.
3. Fine MJ, Auble TE, Yealy DM, Hanusa BH, Weissfeld LA, Singer DE, et al. A prediction rule to identify low-risk patients with community-acquired pneumonia. N Engl J Med. 1997;336(4):243–50.
4. Metlay JP, Waterer GW, Long AC, Anzueto A, Brozek J, Crothers K, et al.
Diagnosis and treatment of adults with community-acquired pneumonia. An official clinical practice guideline of the American thoracic society and infectious diseases society of America. Am J Respir Crit Care Med. 2019;200(7):e45-67.
5. Ferrer M, Travierso C, Cilloniz C, Gabarrus A, Ranzani OT, Polverino E, et al. Severe community-acquired pneumonia: Characteristics and prognostic factors in ventilated and non-ventilated patients. PLoS ONE. 2018;13(1):e0191721.
6. Menéndez R, Cavalcanti M, Reyes S, Mensa J, Martinez R, Marcos MA, et al.
Markers of treatment failure in hospitalised community acquired pneumonia. Thorax. 2008;63(5):447–52.
7. Jones RN, Farrell DJ, Mendes RE, Sader HS. Comparative ceftaroline activity tested against pathogens associated with community-acquired pneumonia: results from an international surveillance study. J Antimicrob Chemother. 2011;66(Suppl 3):iii69-80.
8. Rhen T, Cidlowski JA. Antiinflammatory action of glucocorticoids–new mechanisms for old drugs. N Engl J Med. 2005;353(16):1711–23.
9. Torres A, Ferrer M, Niederman MS. Adjuvant therapies in critical care: steroids in community-acquired pneumonia. Intensive Care Med. 2018;44(4):478–81.
10. Prina E, Ceccato A, Torres A. New aspects in the management of pneumonia. Crit Care Lond Engl. 2016;20(1):267.
11. Ceccato A, Ferrer M, Barbeta E, Torres A. Adjunctive therapies for community-acquired pneumonia. Clin Chest Med. 2018;39(4):753–64.
12. Marti C, Grosgurin O, Harbarth S, Combescure C, Abbas M, Rutschmann O, et al. Adjunctive corticotherapy for community acquired pneumonia: a systematic review and meta-analysis. PLoS ONE [Internet]. 2015 Dec 7 [cited 2021 Mar 1];10(12). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC46 71611/
13. Siempos II, Vardakas KZ, Kopterides P, Falagas ME. Adjunctive therapies for community-acquired pneumonia: a systematic review. J Antimicrob Chemother. 2008;62(4):661–8.
14. Nie W, Zhang Y, Cheng J, Xiu Q. Corticosteroids in the treatment of community-acquired pneumonia in adults: a meta-analysis. PLoS ONE. 2012;7(10):e47926.
15. Siemieniuk RAC, Meade MO, Alonso-Coello P, Briel M, Evaniew N, Prasad M, et al. Corticosteroid therapy for patients hospitalized with communityacquired pneumonia: a systematic review and meta-analysis. Ann Intern Med. 2015;163(7):519–28.
16. Horita N, Otsuka T, Haranaga S, Namkoong H, Miki M, Miyashita N, et al.
Adjunctive systemic corticosteroids for hospitalized community-acquired pneumonia: systematic review and meta-analysis 2015 update. Sci Rep [Internet]. 2015;5. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC45 71641/
17. Wan Y-D, Sun T-W, Liu Z-Q, Zhang S-G, Wang L-X, Kan Q-C. Efficacy and safety of corticosteroids for community-acquired pneumonia: a systematic review and meta-analysis. Chest. 2016;149(1):209–19.
18. Briel M, Spoorenberg SMC, Snijders D, Torres A, Fernandez-Serrano S, Meduri GU, et al. Corticosteroids in patients hospitalized with community-acquired pneumonia: systematic review and individual patient data metaanalysis. Clin Infect Dis Off Publ Infect Dis Soc Am. 2018;66(3):346–54.
19. Torres A, Sibila O, Ferrer M, Polverino E, Menendez R, Mensa J, et al. Effect of corticosteroids on treatment failure among hospitalized patients with severe community-acquired pneumonia and high inflammatory response: a randomized clinical trial. JAMA. 2015;313(7):677–86.
20. Mandell LA, Wunderink RG, Anzueto A, Bartlett JG, Campbell GD, Dean NC, et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults. Clin Infect Dis Off Publ Infect Dis Soc Am. 2007;1(44 Suppl 2):S27-72
21. Vincent JL, Moreno R, Takala J, Willatts S, De Mendonça A, Bruining H, et al.
The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine. Intensive Care Med. 1996;22(7):707–10.
22. Austin PC. An introduction to propensity score methods for reducing the effects of confounding in observational studies. Multivar Behav Res. 2011;46(3):399–424.
23. Rosenbaum PR, Rubin DB. The central role of the propensity score in observational studies for causal effects. Biometrika. 1983;70(1):41–55.
24. Brookhart MA, Schneeweiss S, Rothman KJ, Glynn RJ, Avorn J, Stürmer T. Variable selection for propensity score models. Am J Epidemiol. 2006;163(12):1149–56.
25. Sterne JAC, White IR, Carlin JB, Spratt M, Royston P, Kenward MG, et al. Multiple imputation for missing data in epidemiological and clinical research: potential and pitfalls. BMJ. 2009;338:b2393.
26. Collet D. Modelling survival data in medical research. 2nd edn. London; 1994.
27. Blum CA, Nigro N, Briel M, Schuetz P, Ullmer E, Suter-Widmer I, et al. Adjunct prednisone therapy for patients with community-acquired pneumonia: a multicentre, double-blind, randomised, placebo-controlled trial. Lancet Lond Engl. 2015;385(9977):1511–8.
28. Cangemi R, Falcone M, Taliani G, Calvieri C, Tiseo G, Romiti GF, et al. Corticosteroid use and incident myocardial infarction in adults hospitalized for community-acquired pneumonia. Ann Am Thorac Soc. 2019;16(1):91–8.
29. Confalonieri M, Urbino R, Potena A, Piattella M, Parigi P, Puccio G, et al.
Hydrocortisone infusion for severe community-acquired pneumonia: a preliminary randomized study. Am J Respir Crit Care Med. 2005;171(3):242–8.
30. Stern A, Skalsky K, Avni T, Carrara E, Leibovici L, Paul M. Corticosteroids for pneumonia. Cochrane Database Syst Rev. 2017;12:CD007720.
31. Wu W-F, Fang Q, He G-J. Efficacy of corticosteroid treatment for severe community-acquired pneumonia: a meta-analysis. Am J Emerg Med. 2017;
32. Bi J, Yang J, Wang Y, Yao C, Mei J, Liu Y, et al. Efficacy and safety of adjunctive corticosteroids therapy for severe community-acquired pneumonia in adults: an updated systematic review and meta-analysis. PLoS ONE. 2016;11(11):e0165942.
33. Nafae RM, Ragab MI, Amany FM, Rashed SB. Adjuvant role of corticosteroids in the treatment of community-acquired pneumonia. Egypt J Chest Dis Tuberc. 2013;62(3):439–45.
34. Pastores SM, Annane D, Rochwerg B, Esicm and the CGTF of S and. Guidelines for the Diagnosis and Management of Critical Illness-Related Corticosteroid Insufficiency (CIRCI) in Critically Ill Patients (Part II): Society of Critical Care Medicine (SCCM) and European Society of Intensive Care Medicine (ESICM) 2017. Crit Care Med. 2018;46(1):146.
35. Urwyler SA, Blum CA, Coslovsky M, Mueller B, Schuetz P, Christ-Crain M.
Cytokines and Cortisol—predictors of treatment response to corticosteroids in community-acquired pneumonia? J Intern Med. 2019;286(1):75–87.
36. Moreno G, Rodríguez A, Reyes LF, Gomez J, Sole-Violan J, Díaz E, et al. Corticosteroid treatment in critically ill patients with severe influenza pneumonia: a propensity score matching study. Intensive Care Med. 2018;44(9):1470–82.
37. Dexamethasone in hospitalized patients with Covid-19. N Engl J Med. 2021;384(8):693–704.
38. Association between administration of systemic corticosteroids and mortality among critically ill patients with COVID-19: a meta-analysis|Critical Care Medicine|JAMA|JAMA Network [Internet]. [cited 2021 Mar 10]. https://jaman etwork.com/journals/jama/fullarticle/2770279
39. Huang J, Guo J, Li H, Huang W, Zhang T. Efficacy and safety of adjunctive corticosteroids therapy for patients with severe community-acquired pneumonia: a systematic review and meta-analysis. Medicine (Baltimore). 2019;98(13):e14636.
40. Villar J, Ferrando C, Martínez D, Ambrós A, Muñoz T, Soler JA, et al. Dexamethasone treatment for the acute respiratory distress syndrome: a multicentre, randomised controlled trial. Lancet Respir Med. 2020;8(3):267–76.
41. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. 2017;43(3):304–77.
Ceccato et al. Critical Care (2021) 25:432