Array
(
[NAME] => Понимание, оценка и лечение дисфункции иммунной и эндотелиальной системы и нарушений коагуляции при бактериальном сепсисе
[~NAME] => Понимание, оценка и лечение дисфункции иммунной и эндотелиальной системы и нарушений коагуляции при бактериальном сепсисе
[PREVIEW_PICTURE] => Array
(
[ID] => 6062
[TIMESTAMP_X] => 19.03.2025 16:25:54
[MODULE_ID] => iblock
[HEIGHT] => 624
[WIDTH] => 1000
[FILE_SIZE] => 465368
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/538/yl3e92592yqzf1137pj6x7mqqtdhrwxn
[FILE_NAME] => 2149611205.jpg
[ORIGINAL_NAME] => 2149611205.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 6e6e49b8fc61c40171d8dbd09e067cfd
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/538/yl3e92592yqzf1137pj6x7mqqtdhrwxn/2149611205.jpg
[UNSAFE_SRC] => /upload/iblock/538/yl3e92592yqzf1137pj6x7mqqtdhrwxn/2149611205.jpg
[SAFE_SRC] => /upload/iblock/538/yl3e92592yqzf1137pj6x7mqqtdhrwxn/2149611205.jpg
[ALT] => Понимание, оценка и лечение дисфункции иммунной и эндотелиальной системы и нарушений коагуляции при бактериальном сепсисе
[TITLE] => Понимание, оценка и лечение дисфункции иммунной и эндотелиальной системы и нарушений коагуляции при бактериальном сепсисе
)
[~PREVIEW_PICTURE] => 6062
[DETAIL_TEXT] =>
Intensive Care Med
https://doi.org/10.1007/s00134-024-07586-2Understanding, assessing and treating immune, endothelial and haemostasis dysfunctions in bacterial sepsis
Massimo Girardis, Sascha David, Ricard Ferrer, Julie Helms, Nicole P. Juffermans, Ignacio Martin‑Loeches, Pedro Povoa, Lene Russell, Manu Shankar‑Hari, Toshiaki Iba, Irene Coloretti, Nicholas Parchim and Nathan D. Nielsen
Аннотация
Взаимодействие между иммунной системой, коагуляцией и эндотелием имеет решающее значение в регулировании реакции хозяина на инфекцию. Однако при сепсисе и других критических состояний нерегулируемый иммунный ответ может привести к чрезмерным изменениям в этих механизмах, что приводит к коагулопатии, эндотелиальной и полиорганной дисфункции. Целью этого обзора является комплексный анализ патофизиологических механизмов сложных взаимодействий между иммунной, эндотелиальной дисфункцией и нарушениям коагуляции при сепсисе. В нем подчеркивается клиническое значение, методы оценки и потенциальные терапевтические вмешательства. Понимание этих механизмов необходимо для разработки эффективных методов лечения, которые могут модулировать иммунный ответ, уменьшать риск тромбозов, восстанавливать эндотелиальную функцию и в конечном итоге улучшать выживаемость пациентов.
Ключевые слова: Иммунная система, Коагуляция, Эндотелий, Сепсис
Введение
Сложное взаимодействие между иммунным ответом, коагуляцией и эндотелием является фундаментальной частью регулируемого, то есть физиологического, ответа хозяина на инфекцию. Без эффективной командной работы этих трех чрезвычайно сложных систем ни одна инфекция не может быть успешно устранена. Всякий раз, когда это взаимодействие становится несинхронизированным тем или иным образом, его можно описать как «нарушенный ответ хозяина», термин, широко используемый с тех пор, как определение сепсиса было изменено в 2016 году [1]. Стоит отметить, что нарушенный ответ хозяина является характеристикой, общей для множества критических состояний, таких как сепсис, острый респираторный дистресс-синдром и панкреатит. При сепсисе под дисрегуляцией иммунного ответа хозяина понимается патологическое нарушение и/или изменение гомеостаза иммунных механизмов сопротивления, толерантности к болезни и ее разрешения, происходящие одновременно. Устойчивость относится к эффекторным иммунным механизмам, которые снижают бремя патогена посредством обнаружения, нейтрализации, уничтожения микроорганизмов и воспаления врожденным иммунитетом [2].
В этом контексте иммунный тромбоз (или тромбовоспаление) относится к врожденным иммунным реакциям, ответственным за генерацию тромбина и образование микротромбов, что способствует распознаванию, сдерживанию и разрушению патогена. Однако во время сепсиса и других критических состояний нерегулируемый иммунный ответ вызывает интенсивную активацию лейкоцитов, тромбоцитов и эндотелия с чрезмерной активацией коагуляции, что в сочетании с дефектными антикоагулянтными и фибринолитическими системами может привести к диссеминированному внутрисосудистому свертыванию (ДВС), связанному с полиорганной дисфункцией и высокими показателями смертности [3, 4]. Таким образом, стратегии, направленные на контроль чрезмерной иммунной активации, генерации тромбина и эндотелиальной дисфункции, могут потенциально помочь пережить инфекцию [5].
Патофизиологические механизмы взаимодействия иммунных клеток, эндотелия и гемостаза при сепсисе
Иммунные клетки
При сепсисе моноциты и нейтрофилы играют решающую роль в активации воспаления, экспрессируя рецепторы, такие как толл-подобные рецепторы (TLR), рецепторы Fcγ, рецепторы, сопряженные с G-белком, и рецепторы, активируемые протеазой (PAR). Эти рецепторы реагируют на различные стимулы. При сепсисе моноциты выделяют провоспалительные цитокины и активируют врожденные иммунные реакции, тем самым запуская активацию нейтрофилов, которая инициирует образование нейтрофильных внеклеточных ловушек (NET). NET представляют собой деконденсированные волокна дезоксирибонуклеиновой кислоты (ДНК), несущие цитруллинированные гистоны и протеолитические ферменты, такие как миелопероксидаза и нейтрофильная эластаза [6]. Микровезикулы (MVs) представляют собой субмикронные везикулы плазматической мембраны, которые высвобождаются активированными клетками. MVs (особенно из эндотелиальных клеток и лейкоцитов) высвобождаются во время экспрессии тканевого фактора (TF), вызванной сепсисом, и стимулируют воспалительные сигнальные пути в кровеносных сосудах и сердце [7].
Воздействие фосфатидилсерина MVs вызывает "сборку" прокоагулянтных и антикоагулянтных комплексов факторов свертывания на поверхности клеток. Интересно, что эндотелиальные и лейкоцитарные MVs также проявляют фибринолитические функции [8]. Колокализация MVs на NET представляет собой поверхность, способную способствовать свертыванию крови, тем самым способствуя потенциальной прокоагулянтной активности NET посредством активации контактного пути (фактор XII) ДНК [9]. Кроме того, NET обладают высоким сродством к связыванию тромбоцитов. При сепсисе лейкоциты также связаны с различными типами гибели клеток, включая некроз, некроптоз и пироптоз [10]. Клеточные компоненты, высвобождаемые из мертвых клеток, а именно молекулярные паттерны, ассоциированные с повреждением (DAMP), включая ДНК, гистоны и высокомобильную группу 1 (HMGB-1), являются высоковоспалительными и прокоагулянтными и усиливают тромбовоспаление путем связывания с рецепторами молекулярных паттернов, ассоциированных с патогенами (PAMP) [11] (Fig.. 1).
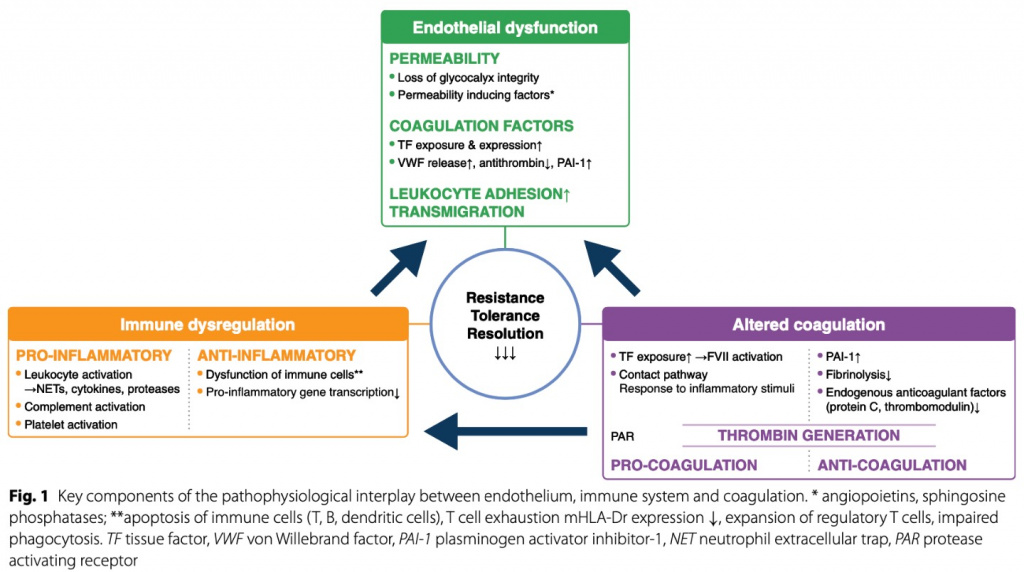
Эндотелий
Эндотелиальный ответ на воспаление является эволюционно обусловленным явлением, необходимым для эффективного контроля источника инфекции иммунной системой. Однако его системное и одновременное возникновение может быть вредным для хозяина. Сепсис вызывает воздействие на прокоагулянтную, проницаемую и адгезивную поверхности эндотелия [12].
Например, системное воспаление приводит к слущиванию/деградации эндотелиального гликокаликса (eGC) [13]. Гликокаликс представляет собой гелеобразный слой, который покрывает эндотелиальную поверхность и состоит из мембраносвязывающих протеогликанов, боковых цепей гликозаминогликанов и высокомолекулярных полисахаридов, которые связывают функциональные белки, такие как антитромбин [14]. Однако, поскольку гликокаликс является хрупким, он может быть легко разрушен и деградирован в результате гипервоспаления [14].
Удаление гликокаликса приводит к обнажению прокоагулянтной поверхности эндотелия, а также к повышенной экспрессии TF и фактора фон Виллебранда (VWF) на поверхностях эндотелия и моноцитов. TF запускает коагуляцию и избыточную генерацию тромбина. Затем тромбин преобразует фибриноген в мономеры фибрина, которые собираются в нерастворимую сеть фибрина, которая дополнительно усиливается прямой активацией контактного пути и ингибированием фибринолиза длинно-размерными бактериальными полифосфатами [15]. Одновременно системное воспаление запускает высвобождение предварительно сохраненного VWF из эндотелия. Острое увеличение VWF в кровотоке расходует его расщепляющую протеазу (дезинтегрин и металлопротеиназу с мотивом тромбоспондина типа 1 [ADAMTS13]), так что на эндотелиальных поверхностях присутствуют преимущественно сверхбольшие мультимеры VWF (ULVWM), агрегирующие тромбоциты и в конечном итоге нарушающие микрососудистую перфузию [13, 14, 16].
Наконец, повышенная эндотелиальная экспрессия и воздействие молекул поверхностной адгезии, таких как молекула межклеточной адгезии 1 (ICAM-1) и молекула сосудистой адгезии 1 (VICAM-1), запускают адгезию лейкоцитов и их трансмиграцию в здоровые ткани, способствуя органной недостаточности [6, 12, 17]. Недавний систематический обзор проанализировал связь между концентрацией компонентов гликокаликса в плазме и структурными оценками эндотелия [18]. Хотя в большинстве исследований сообщалось об увеличении продуктов гликокаликса в плазме, структурные оценки с использованием методов визуализации показали, что истончение эндотелиального гликокаликса не всегда соответствует повышенным концентрациям компонентов гликокаликса в плазме, и не было обнаружено никаких доказательств, подтверждающих идею о том, что проницаемость капилляров действительно увеличивается при увеличении уровней фрагментов гликокаликса в плазме (Fig. 1).
Гемостаз
Система гемостаза играет важную роль в первичном иммунном ответе. Активация коагуляции является быстрым механизмом ограничения и нейтрализации инфекционных агентов внутри сгустков, и этот процесс происходит как в тканях, так и в кровотоке. Патогены выработали факторы, которые специально нацелены на пути коагуляции [19]. Например, некоторые микроорганизмы обладают способностью растворять фибриновые сгустки посредством ферментативной активности, тогда как другие могут ингибировать агрегацию тромбоцитов [20]. Чрезмерная и нерегулируемая активация путей коагуляции, связанная с недостатками механизмов деградации фибрина, вызывает избыточную продукцию тромбина, что является ключевым фактором в развитии коагулопатии, вызванной сепсисом (SIC) [21]. Фибринолиз характеризуется активацией фибринсвязанного плазминогена в плазмин тканевым активатором плазминогена (t-PA) и, в меньшей степени, урокиназой (u-PA). Затем фибрин расщепляется плазмином, в результате чего высвобождаются специфические продукты распада фибрина, включая D-димер [22].
Генерация плазмина в основном контролируется ингибитором активатора плазминогена (PAI-1) и ингибитором активируемого тромбином фибринолиза (TAFI) в присутствии тромбомодулина [23]. Хотя патогенез остается практически неизвестным, в нескольких исследованиях было отмечено, что у пациентов с сепсисом, индуцирующим ДВС, наблюдается дефект фибринолиза, что обусловлено увеличением PAI-1 (секретируемого эндотелиальными клетками и активированными тромбоцитами), активацией TAFI [24] и деградацией плазминогена нейтрофильной эластазой из NETs [25]. Системы контррегуляции также утратили свою эффективность. Концентрации в плазме естественных антикоагулянтов (протеина C, протеина S и антитромбина) снижаются при сепсисе. Ингибитор пути тканевого фактора (TFPI) ингибирует фибринолиз, взаимодействуя с факторами свертывания VII, X и TF, ограничивая активацию каскада свертывания [26].
Молниеносная пурпура, обычно связанная с менингококковыми и пневмококковыми инфекциями, широко рассматривается как архетип нарушения гемостаза при сепсисе, характеризующийся внутрисосудистым свертыванием, которое быстро развивается при ДВС-синдроме, сопровождающемся эпидермальным некрозом и воспалительным васкулитом [27]. Помимо своего влияния на коагуляцию, тромбоциты играют важную роль во врожденной иммунной системе и выделяют несколько агентов, которые напрямую способствуют активации нейтрофилов и привлекают лейкоциты через экспрессию P-селектина [28], который связывает нейтрофилы и моноциты с активированными тромбоцитами [29]. Они также экспрессируют TLR-4 и активируют альтернативные и классические пути комплемента напрямую через рецепторы связывания комплемента [30].
Система комплемента является ключевым регулятором иммунитета, который связывает врожденные и адаптивные реакции и способствует опсонизации и лизису патогенов. Каскад комплемента может быть активирован тремя путями путем вторжения патогенов через повреждение тканей и связанное с этим высвобождение DAMPs [31]. При сепсисе система комплемента играет защитную роль против бактериальных инфекций, но также может напрямую способствовать гипервоспалению, приводящему к полиорганной недостаточности. Далее анафилатоксины, активированные комплементом 3 (C3a) и активированным комплементом 5 (C5a), способствуют активации тромбоцитов, агрегации и высвобождению провоспалительных медиаторов [32] (Fig 1).
Клинические аспекты эндотелиальных и гемостатических нарушений, вызванных иммунной дисфункцией
В 2001 году Международное общество по тромбозу и гемостазу (ISTH) опубликовало определение и диагностические критерии явного ДВС-синдрома [33]. Хотя критерии явного ДВС-синдрома получили широкое признание, они были разработаны для диагностики окончательного (часто позднего или запущенного) ДВС-синдрома. Были высказаны предположения, что опора на эти критерии может привести к запоздалой диагностике ДВС-синдрома [34], при которой варианты лечения пациента, вероятно, будут неэффективными. Следовательно, ISTH выпустило еще один набор упрощенных диагностических критериев, разработанных для выявления ранней фазы ДВС-синдрома при сепсисе, то есть коагулопатии, вызванной сепсисом (SIC) [35]. SIC включает оценку органной недостаточности (SOFA) > 2, количество тромбоцитов и протромбиновое время, что делает его легко подсчитываемым у постели больного (Fig.. 2). Распространенность и смертность от SIC (с использованием определения «Сепсис-3») были изучены во вторичном анализе двух РКИ [36], в которых распространенность SIC составила 22,1% и 24,2% соответственно.

90-дневная смертность пациентов с SIC в исследовании HYPRESS (сепсис без шока) была значительно выше (почти вдвое), чем у пациентов без SIC (26,8% против 13,9%, p = 0,027). Хотя это РКИ было нацелено на относительно менее тяжелых пациентов, а число не выживших было небольшим (15 из 56 пациентов в группе SIC и 28 из 201 пациента в группе без SIC), исследование пришло к выводу, что SIC связан с более высокой смертностью и должен интерпретироваться как ранний предупреждающий признак неблагоприятного прогноза сепсиса. Chen et al. наблюдали равную дискриминационную способность SIC и DIC для 28-дневной смертности среди 452 пациентов [37], а Li et al. сообщили о сопоставимой прогностической точности оценок смертности в течение 28 дней по шкалам SIC и SOFA в проспективном исследовании, в котором приняли участие 209 пациентов [38].
Несмотря на широко признанную и тщательно документированную связь между активацией коагуляции и развитием дисфункции органов, образование стабильных микрососудистых тромбов, которое может привести к ишемии тканей и недостаточности органов, по-видимому, встречается у пациентов с сепсисом нечасто [39]. При аутопсии, проведенной у 51 человек, умершим от сепсиса или септического шока, только у трех из них были обнаружены микрососудистые тромбы [40], и только у одного человека были обнаружены микротромбы как в почках, так и в легких. Эти результаты позволяют предположить, что микрососудистый тромбоз может не быть значимым фактором в патогенезе сепсиса. Частота острого повреждения почек (AKI ) значительно различается в разных исследованиях, и White et al. [41] сообщили, что приблизительно 16% пациентов с сепсисом соответствовали критериям AKI; у половины из них была AKI 1-й стадии, а у 3% — AKI 3-й стадии (рис. 3).

Однако частота тяжелого AKI значительно увеличивалась при наличии ДВС-синдрома. Helmset al. [42] сообщили, что около половины пациентов с ДВС-синдромом, связанным с сепсисом, и шоком нуждались в заместительной почечной терапии, и эта доля была более чем в два раза выше по сравнению с пациентами без ДВС-синдрома (47,3% против 21,3%, p < 0,001). Другие отчеты также предполагали тесную связь между ДВС-синдромом и AKI и их связь с более плохими исходами [43]. Отличительная архитектура почечных сосудов, характеризующаяся наличием капилляров клубочков между афферентными и эфферентными артериолами, делает почку особенно восприимчивой к образованию микротромбов. Однако гистопатологические исследования выявили нормальную гистологию только с легкими неспецифическими изменениями почек как при человеческом, так и при AKI при сепсисе в эксперименте [44].
Оценка эндотелия/гемостаза и иммунной системы у постели больного
Эффективная помощь пациентам с сепсисом зависит от понимания базовых биологических механизмов, при этом дисфункция иммунной, эндотелиальной и гемостатической системы выделяются как важнейшие участники. Иммунный ответ включает в себя множество типов клеток и медиаторов [45]. Несмотря на доступность различных методов у постели больного, в настоящее время не существует единого биомаркера, который мог бы эффективно отражать общее функционирование иммунной системы [46]. Измерения цитокинов и других медиаторов должны быть более всеобъемлющими, чтобы обеспечить полное представление об активности иммунной системы и эндотелиальной дисфункции, и большинство доступных тестов требуют лучшей стандартизации. В частности, несколько исследований выявили выраженную вариабельность в комбинациях цитокинов у пациентов с септическим шоком [47, 48].
Тесты, оценивающие клеточную активность, дают больше информации, но также могут быть ограниченными. Эти тесты включают проточную цитометрию, исследование лимфоцитарных субпопуляций, соотношения CD4 + /CD8 +, главного комплекса гистосовместимости II (MHC II) (человеческий лейкоцитарный антиген-DR [HLA-DR]) экспрессию на антигенпрезентирующих клетках (APC), контрольные точки Т-клеток (белок программируемой клеточной смерти 1 [PD-1], лиганд программируемой смерти 1 [PD-L1] и цитотоксический Т-лимфоцитарный антиген 4 [CTLA-4]) и функциональные тесты для оценки пролиферативной способности, такие как активация Т-клеток через анти-CD28 или стимуляция in vitro мононуклеарных клеток периферической крови (PBMC) липополисахаридом или Escherichia coli для измерения продукции цитокинов (например, интерлейкина [IL]-6 и/или фактора некроза опухоли [TNF]) [49].
Простым способом выявления пациентов с риском иммуносупрессии является мониторинг абсолютного количества лимфоцитов. Если присутствует постоянная и необъяснимая лимфопения, следует рассмотреть возможность иммунной дисфункции и провести дополнительные тесты [50]. Поддержание целостности эндотелия имеет решающее значение для микроциркуляторного потока и доставки кислорода тканям, что соответствует главной цели интенсивной терапии. Клиническая оценка структуры и функции микроциркуляции улучшила наше понимание воздействия сепсиса на эндотелиальный гликокаликс, что может служить прогностическим инструментом и потенциально направлять будущие вмешательства. Микроскопия в темном поле с боковым потоком позволяет визуализировать in vivo нарушение гликокаликса, предлагая возможность определять фенотипически уникальные формы критических состояний, а также отображать микроскопические эффекты терапии в режиме реального времени [51].
Про-адреномедуллин (про-АДМ) является молекулой-предшественником адреномедуллина, пептидного гормона, участвующего в различных физиологических процессах, включая эндотелиальную и сосудистую функцию [52]. При сепсисе повышенные уровни про-АДМ могут указывать на эндотелиальную дисфункцию и тяжесть воспалительной реакции.
Такие уровни также связаны с повышенным риском смертности, что указывает на потенциальную полезность про-АДМ в качестве прогностического биомаркера [53]. Несколько других биомаркеров, включая растворимые факторы и клеточные маркеры, были предложены для оценки эндотелиальной целостности [54]. Среди них ангиопоэтин-1 и -2 и ангиопоэтин/тирозинкиназа с осью иммуноглобулин-подобного петлевого эпидермального фактора роста 2 (Tie2), по-видимому, являются перспективными биомаркерами для раннего выявления эндотелиального нарушения и могут быть важной терапевтической целью для предотвращения органной недостаточности [55].
Оценка дисфункции гемостаза у постели больного более проста. Как обсуждалось ранее, шкала ISTH явного ДВС-синдрома, созданная в 2001 году, стала золотым стандартом для диагностики ДВС-синдрома, но столкнулась с ограничениями из-за сложности и требований к ресурсам [33]. Следовательно, была разработана шкала SIC, позволяющая проводить раннюю диагностику ДВС-синдрома, связанного с сепсисом, с использованием легкодоступных биомаркеров и шкалы SOFA. Недавние рекомендации рекомендуют двухэтапный подход, сначала оценивая шкалу SIC у всех пациентов с сепсисом, а затем, при необходимости, шкалу ISTH, что помогает принимать терапевтические решения и проводить клинические испытания [35, 56]. Антитромбин и VWF были предложены в качестве потенциальных циркулирующих маркеров активации эндотелия [57]. Однако из-за их ограниченной доступности их использование в настоящее время ограничено. Следовательно, несмотря на свои ограничения, оценка SIC является простым и удобным в использовании инструментом скрининга для пациентов с высоким риском, а также для выявления случаев, в которых могут быть полезны индивидуальные стратегии антикоагулянтной терапии (хотя нет убедительных доказательств в поддержку их рутинного использования) [57–59].
Важно помнить, что тромбоцитопения очень распространена при сепсисе и имеет много причин, включая гемодилюцию, побочные эффекты лекарств (включая несколько часто используемых антибиотиков) и подавленный тромбопоэз [60]. Хотя связь между протромбином/международным нормализованным отношением (МНО) и кровотечением, тромбозом и смертью была непоследовательной в различных исследованиях, было последовательно продемонстрировано, что тяжелая тромбоцитопения связана с плохими результатами [61]. Существует значительный интерес к использованию тестов по месту оказания помощи, таких как тромбоэластография (TEG) и тромбоэластометрия, для диагностики нарушений коагуляции у пациентов с сепсисом. Эти тесты могут обнаружить гиперкоагуляцию, гипокоагуляцию и нарушенный фибринолиз, хотя никакой связи с кровотечением или тромбозом не было установлено [62]. Однако интерпретация результатов TEG/тромбоэластометрии (ROTEM ) сложна, а качество доказательств, подтверждающих полезность этих тестов для выявления SIC , по-прежнему считается низким [63].
Влияние стандартных вмешательств при сепсисе на взаимодействие систем
Инфузионная терапия вместе с антибиотикотерапией, контролем источника и вазопрессорами являются краеугольным камнем лечения сепсиса, особенно у пациентов с шоком. Два ключевых аспекта инфузионной терапии могут существенно повлиять на коагуляцию и эндотелиальный ответ: объем и тип вводимой жидкости. Основываясь на научно обоснованных рекомендациях, рекомендуется, чтобы после введения первого объема , дальнейшее введение жидкостей было тщательно сбалансировано с учетом потенциального риска и вреда, вызванного ее перегрузкой [64]. В частности, эти риски включают длительную искусственную вентиляцию легких, усугубление острого повреждения почек и повышенные показатели смертности. У пациентов с сепсисом чрезмерное введение жидкости связано с циркулирующими уровнями синдекана-1, маркера потери эндотелиального гликокаликса, что приводит к капиллярной утечке, отеку тканей и нарушению микроциркуляции [65].
Кроме того, перегрузка жидкостью при сепсисе связана с повышенным уровнем ангиопоэтина-2, что связано с эндотелиальной дисфункцией и повышенной проницаемостью [66]. Чрезмерное введение жидкости может "разбавлять" факторы свертывания и тромбоциты, тем самым усугубляя коагулопатию, вызванную сепсисом. Несмотря на априорную привлекательность консервативных стратегий объемов жидкости, аналогичных тем, которые применяются при геморрагическом шоке, клинических доказательств, подтверждающих их превосходство над более либеральными подходами, по-прежнему не хватает [67]. Кристаллоиды (сбалансированные, а не нормальные солевые растворы) в настоящее время рекомендуются в качестве растворов первой линии для пациентов с сепсисом, поскольку на сегодняшний день отсутствуют явные клинические преимущества и некоторые сигналы о вреде при введении коллоидов по сравнению с кристаллоидами [64, 68].
В периоперационном периоде, но не у пациентов в критическом состоянии, использование гидроксиэтилкрахмалов по сравнению с кристаллоидами или альбумином было связано с повышенной кровопотерей из-за снижения коагуляционной компетентности, оцененной с помощью ТЭГ [69]. Однако провоспалительные и прокоагулянтные эффекты кристаллоидных растворов по сравнению с коллоидами наблюдались на животных моделях [70, 71]. Аналогичным образом, исследования на животных моделях и у пациентов с сепсисом продемонстрировали, что использование кристаллоидов связано с большим отторжением гликокаликса и потерей целостности, чем синтетические (например, крахмалы) или натуральные (например, альбумин) коллоиды [70, 72]. Использование альбумина, по-видимому, больше защищает эндотелий благодаря нескольким неонкотическим свойствам, таким как антиоксидантная активность и электрическая и химическая защита поверхностного слоя эндотелия со стабилизацией проницаемости, лейкоцитарным роллингом и адгезией [64]. Кроме того, альбумин может оказывать специфическое противовоспалительное и иммуномодулирующее действие при сепсисе. Эти потенциальные защитные эффекты альбумина не были подтверждены снижением смертности в крупных рандомизированных исследованиях; таким образом, использование альбумина в качестве инфузионной терапии предлагается только для пациентов с сепсисом, которым требуются большие объемы кристаллоидов [73].
В целом, влияние жидкостей на пути коагуляции и эндотелиальные клетки при сепсисе широко распространено, и необходимы дальнейшие исследования для определения оптимальных стратегий управления инфузионной терапией для улучшения результатов у пациентов с сепсисом. Эндотелий высвобождает различные вазоактивные факторы. Это могут быть вазодилатирующие факторы, такие как оксид азота (NO), простациклин и гиперполяризующие факторы, полученные из эндотелия, или вазоконстрикторные факторы, такие как тромбоксан и эндотелин-1 [74]. При сепсисе повышенная продукция NO связана с развитием вазоплегии, дисфункцией миокарда, снижением чувствительности к адренергическим стимулам, прямой клеточной токсичностью и биоэнергетической недостаточностью. Поэтому были разработаны потенциальные подходы к модуляции продукции NO при сепсисе [75]. В настоящее время в клинической практике несколько вазопрессоров со специфическими рецепторами на эндотелиальном уровне используются в мультимодальном подходе.
Норэпинефрин является вазопрессором первой линии, рекомендуемым для пациентов с сепсисом, и оказывает адренергическую активность с выраженным α1-агонизмом, умеренным β1-агонизмом и минимальным воздействием на β2-адренергические рецепторы. Использование вазопрессина в сочетании с норадреналином является обычной практикой для минимизации негативных последствий, связанных с высокими уровнями катехоламинов. Это связано с фармакодинамическими свойствами вазопрессина как эндогенного гормона, который действует на эндотелиальные рецепторы V1a, V1b и V2, и его потенциальными защитными эффектами на функцию почек и снижением возникновения сердечных аритмий. Ангиотензин II, по-видимому, является многообещающим и безопасным некатехоламиновым вазопрессором, что продемонстрировано как в экспериментальных моделях, так и в клинике [76]. Интересно, что в моделях на животных ангиотензин II, по-видимому, усиливает иммунный ответ при сепсисе [77], тогда как норадреналин и вазопрессин оказывают преимущественно противовоспалительное действие, которое способствует иммунопараличу [78].
Терапевтические цели и текущие данные для конкретных вмешательств, направленных на нерегулируемый ответ хозяина
Нерегулируемые пути сепсиса, рассмотренные ранее в этой статье, могут обеспечить потенциальные терапевтические цели, начиная от вмешательств, направленных на нерегулируемую функцию иммунных клеток, до более нисходящих эффектов, включая измененный гемостаз и потерю целостности сосудистого барьера. Следовательно, проведено несколько исследований вмешательств, направленные на иммунологические, эндотелиальные игемостатические нерегулируемые ответы (Table 1).
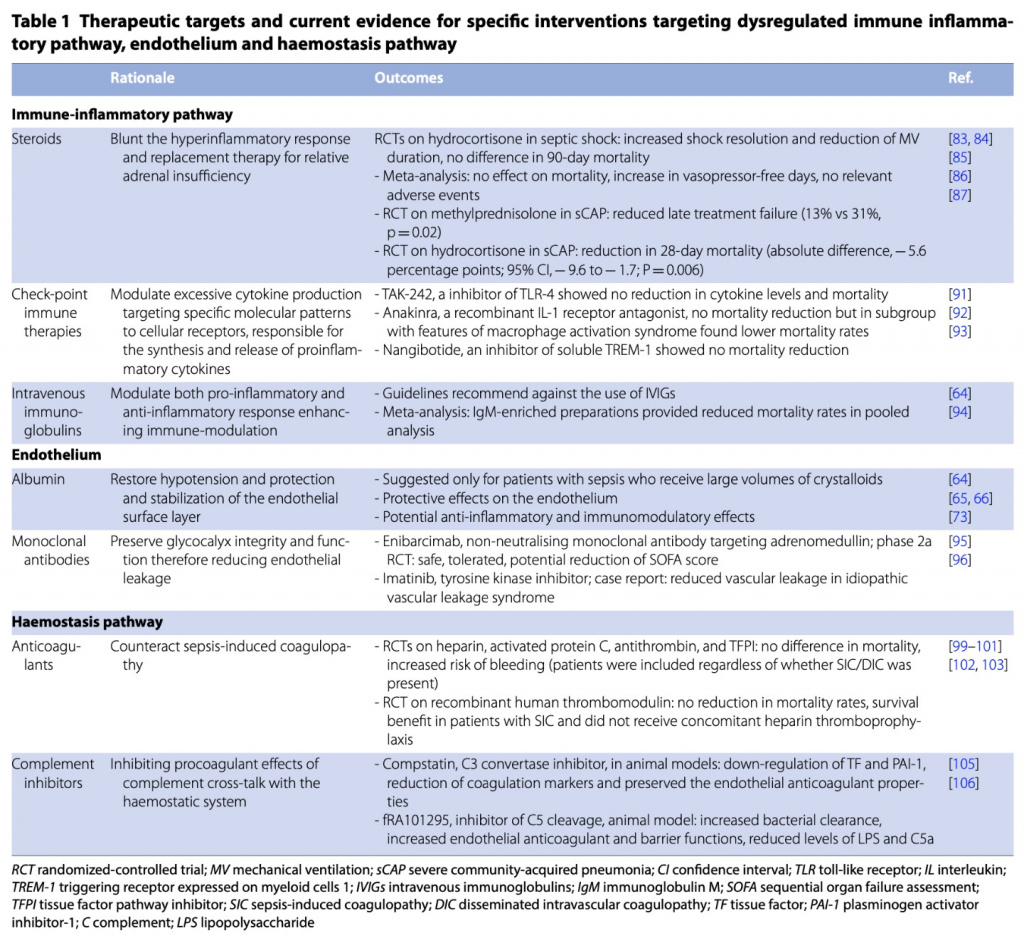
Иммуновоспалительный путь
Стероиды широко рассматривались для использования при сепсисе из-за их широкого воздействия на воспалительный ответ хозяина. Известно, что у пациентов с сепсисом стероиды снижают высвобождение провоспалительных факторов, таких как ИЛ-1 и ИЛ-6, протеолитические ферменты, реактивные формы кислорода и азота и другие цитокины. Считается, что эти эффекты частично объясняются их способностью стабилизировать клеточные мембраны, включая лизосомальные [79].
Более того, стероиды могут поддерживать целостность эндотелиальных клеток, по-видимому, снижают проницаемость сосудов и повышают чувствительность кровеносных сосудов к катехоламинам за счет активации адренергических рецепторов [80, 81]. Важно признать, что воздействие на иммунную систему часто зависит от дозы. В частности, было показано, что низкие дозы кортикостерона усиливают воспалительную реакцию макрофагов, активированных липополисахаридом, в то время как более высокие дозы, снижают эту реакцию [82]. Эффекты низких доз гидрокортизона у пациентов с септическим шоком были оценены в нескольких РКИ с различными результатами [83, 84].
Самый последний метаанализ, включающий 17 испытаний с более чем 7000 пациентов, показал, что гидрокортизон не оказал значительного влияния на 90-дневную смертность или большинство вторичных результатов, за исключением увеличения дней без вазопрессоров [85]. Неблагоприятные события, такие как суперинфекция, гипергликемия и гастродуоденальное кровотечение, не были значительно связаны с использованием гидрокортизона. Использование стероидов также исследовалось у пациентов с тяжелой внебольничной пневмонией (CAP) [86, 87]. Хотя многочисленные испытания продемонстрировали положительное влияние стероидной терапии на снижение прогрессирования до искусственной вентиляции легких при тяжелой CAP, влияние этой терапии на смертность остается неопределенным [88].
Кроме того, использование стероидов при дыхательной недостаточности, вызванной вирусом гриппа, связано с более высоким риском смерти [89]. Недавнее руководство, основанное на фактических данных, от Society of Critical Care Medicine рекомендовало использовать стероиды со средней степенью доказательности в течение 5–7 дней в суточной дозе < 400 мг внутривенного гидрокортизона или эквивалента у госпитализированных пациентов с тяжелой внебольничной пневмонией [90]. Было разработано и испытано несколько методов лечения, нацеленных на специфические иммунные медиаторы, у пациентов с сепсисом. Большинство из них были нацелены на избыточную продукцию цитокинов в результате связывания патоген-ассоциированных молекулярных паттернов с клеточными рецепторами, такими как TLR, которые инициируют быстрый синтез и высвобождение провоспалительных цитокинов. Однако исследование, направленное на ингибирование процесса сигнализации TLR-4 и, таким образом, продукции TNF-α, IL-1 и IL-6, не показало улучшения смертности или более низкой активности цитокинов, несмотря на предыдущие многообещающие результаты в мышиных моделях [91].
Хотя анакинра, рекомбинантный антагонист рецептора ИЛ-1, не показал никакого эффекта в нестратифицированной популяции пациентов с сепсисом, анализ подгрупп пациентов, леченных анакинрой, с признаками синдрома активации макрофагов показал снижение 28-дневной смертности [92]. Более новый агент, нангиботид, ингибитор растворимого TREM-1 (триггерный рецептор, экспрессируемый на миелоидных клетках 1), трансмембранного белка, высвобождаемого в результате эндотелиального повреждения и считающегося неотъемлемой частью повреждающего воспалительного ответа, наблюдаемого в случаях гипервоспаления при сепсисе, показал многообещающие результаты в клиническом исследовании фазы 2b [93], а исследование фазы 3 находится в стадии разработки.
Внутривенные иммуноглобулины (IVIG) ранее предлагались в качестве адъювантной терапии при сепсисе, однако доказательства не были убедительными, и в рекомендациях Surviving SepsisCampaign 2021 года было высказано мнение об отказе от их использования при сепсисе [64]. Однако было продемонстрировано, что обогащенный IgM IVIG играет решающую роль в иммунной модуляции B/T-клеток, и он и продемонстрировал потенциал для снижения смертности в объединенном анализе. Тем не менее, его эффект, как правило, менее последователен в исследованиях адекватного качества [94].
Эндотелий и пути гемостаза
Вмешательства, которые напрямую воздействуют на эндотелий и либо восстанавливают вызванное сепсисом повреждение, либо ослабляют эндотелиальную дисфункцию, в настоящее время находятся на поздней стадии испытаний. Например, альбумин изучался как возможное средство восстановления поврежденного эндотелиального гликокаликса, а энибарцимаб, не нейтрализующее моноклональное антитело, нацеленное на адреномедуллин, как полагают, потенциально снижает вызванную сепсисом вазодилатацию и эндотелиальную утечку [95]. Также потенциальный интерес представляют ингибиторы тирозинкиназы, такие как иматиниб, которые, как было обнаружено, уменьшают сосудистую утечку при идиопатическом синдроме сосудистой утечки [96].
Вмешательства также могут быть направлены на нерегулируемый гемостаз. Одним из самых ранних антикоагулянтных вмешательств, испытанных при сепсисе, был гепарин, который не показал положительного эффекта в рандомизированном исследовании [97]. Несмотря на потребление физиологических антикоагулянтов, таких как активированный протеин С, антитромбин и ингибиторы пути тканевого фактора, и многообещающие результаты реальных данных и первоначальных исследований [98], крупные рандомизированные исследования не смогли показать никакого преимущества в выживании от приема антикоагулянтов, но вместо этого увеличили случаи кровотечения [99–101]. Опасения, высказанные по поводу неудач испытаний, исследующих иммунофокусированные стратегии, напрямую применимы к испытаниям, исследующим гемостатические вмешательства. Большинство этих испытаний имели те же недостатки, поскольку они включали пациентов с сепсисом или септическим шоком независимо от наличия SIC/DIC, что означает, что многие пациенты получали антикоагулянтное лечение, хотя у них не было характерных признаков SIC или DIC.
Совсем недавно рекомбинантный человеческий тромбомодулин также не продемонстрировал никакого снижения показателей смертности, хотя тенденция к улучшению наблюдалась у пациентов с исходной коагулопатией и у тех, кто не получал сопутствующую тромбопрофилактику гепарином [102, 103]. Интересно, что в это исследование были включены только пациенты с признаками SIC в то время, но, в частности, не удалось определить надлежащее временное окно, поскольку у 20% пролеченных пациентов состояние улучшилось к моменту начала лечения, и у них больше не было SIC. Помимо отбора пациентов, другие факторы могли потенциально объяснить неудачу исследований антикоагулянтов, такие как время начала лечения, дозировка и продолжительность приема антикоагулянтов. Кроме того, использование 28-дневной смертности в качестве первичной конечной точки в рандомизированных контролируемых исследованиях может быть нецелесообразным, поскольку на него могут влиять многочисленные факторы, выходящие за рамки антикоагулянтной терапии.
Более подходящими конечными точками были бы разрешение ДВС-синдрома и улучшение дисфункции органов. Например, было проведено клиническое исследование фазы 3 для оценки эффективности рекомбинантного тромбомодулина при различных причинах ДВС-синдрома, причем разрешение ДВС было первичной конечной точкой [104]. Результаты исследования продемонстрировали превосходное разрешение ДВС-синдрома в группе тромбомодулина по сравнению с контрольной группой гепарина (66,1% против 49,9%; разница 16,2%, 95% доверительный интервал [ДИ] 3,3–29,1), и это привело к одобрению рекомбинантного тромбомодулина для лечения ДВС-синдрома в Японии.
Разработка методов лечения для управления гипервоспаления, вызванным системой комплемента, открывает большие перспективы для снижения риска полиорганной дисфункции, связанной с сепсисом. Обнадёживает то, что доклинические испытания продемонстрировали потенциальные преимущества ингибирующих стратегий у нечеловекообразных приматов и свиней, с уменьшением частоты недостаточности органов, коагулопатии и даже улучшением выживаемости [105, 106]. Интересно, что терапевтический плазмаферез при септическом шоке может иметь потенциал для модуляции различных аспектов, включая отмирание гликокаликса и коагулопатию, в одном вмешательстве [16]. В совокупности возможны несколько потенциальных стратегий, большинство из которых заслуживают дальнейшего исследования. Кроме того, предварительная стратификация и определение адекватного временного окна для надлежащего лечения являются обязательными должны быть мотивацией для новых клинических испытаний.
Выводы
Точные механизмы, лежащие в основе сепсиса, септического шока и полиорганной недостаточности, остаются частично понятыми. Одним из потенциальных факторов является распространение бактерий, которые могут напрямую повреждать органы и вырабатывать токсины, конкурирующие за одни и те же субстраты. Другим возможным фактором является активация врожденной иммунной системы, приводящая к нарушению регуляции как гуморального, так и клеточного иммунитета. Эти изменения могут влиять на коагуляцию и эндотелиальную функцию, приводя к сепсис-индуцированной дисфункции эндотелия и гемостаза. Нарушенное взаимодействие между этими тремя системами может объяснить, почему локализованный источник инфекции, такой как обструктивный пиелонефрит, может приводить к осложнениям, таким как острый респираторный дистресс-синдром, измененный уровень сознания, шок и AKI . Вызванная сепсисом иммунная, эндотелиальная и дисфункция гемостаза представляет собой сегмент более обширной и сложной дисрегуляционной системы, которая завершается органной недостаточностью после инфекции. Понимание этого единого механизма полиорганной недостаточности может позволить разработать новые тесты и терапевтические мишени для решения проблем нарушения коагуляции и эндотелиальной дисфункции.
References
1. Shankar-Hari M, Phillips GS, Levy ML, Seymour CW, Liu VX, Deutschman CS et al (2016) Developing a New Definition and Assessing New Clinical Criteria for Septic Shock: For the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 315:775–787. https:// doi. org/ 10. 1001/ jama. 2016. 0289
2. Shankar-Hari M, Calandra T, Soares MP, Bauer M, Wiersinga WJ, Prescott HC, et al. Reframing sepsis immunobiology for translation: towards informative subtyping and targeted immunomodulatory therapies. The Lancet Respiratory Medicine 2024;0. https:// doi. org/10. 1016/ S2213-2600(23) 00468-X.
3. Engelmann B, Massberg S (2013) Thrombosis as an intravascular effector of innate immunity. Nat Rev Immunol 13:34–45. https:// doi.org/ 10. 1038/ nri33 45
4. Iba T, Helms J, Levi M, Levy JH (2024) Thromboinflammation in acute injury: infections, heatstroke, and trauma. J Thromb Haemost 22:7–22. https:// doi. org/ 10. 1016/j. jtha. 2023. 07. 020
5. Helms J, Iba T, Connors JM, Gando S, Levi M, Meziani F et al (2023) How to manage coagulopathies in critically ill patients. Intensive Care Med 49:273–290. https:// doi. org/ 10. 1007/ s00134-023-06980-6
6. Brinkmann V, Reichard U, Goosmann C, Fauler B, Uhlemann Y, Weiss DS et al (2004) Neutrophil extracellular traps kill bacteria. Science 303:1532–1535. https:// doi. org/ 10. 1126/ scien ce. 10923 85
7. Meziani F, Delabranche X, Asfar P, Toti F (2010) Bench-to-bedside review: circulating microparticles—a new player in sepsis? Crit Care 14:236. https:// doi. org/ 10. 1186/ cc9231
8. Zhang Y, Meng H, Ma R, He Z, Wu X, Cao M et al (2016) Circulating microparticles, blood cells, and endothelium induce procoagulant activity in sepsis through phosphatidylserine exposure. Shock45:299–307. https:// doi. org/ 10. 1097/ SHK. 00000 00000 000509
9. Stiel L, Meziani F, Helms J (2018) Neutrophil Activation During Septic Shock. Shock 49:371–384. https:// doi. org/ 10. 1097/ SHK. 00000 00000000980
10. Robinson N, Ganesan R, Hegedűs C, Kovacs K, Kufer TA, Virag L (2019)
Programmed necrotic cell death of macrophages: Focus on pyroptosis, necroptosis, and parthanatos. Redox Biol 26:101239. https:// doi.org/ 10. 1016/j. redox. 2019. 101239
11. Duprez L, Takahashi N, Van Hauwermeiren F, Vandendriessche B,Goossens V, Vanden Berghe T et al (2011) RIP kinase-dependent necrosis drives lethal systemic inflammatory response syndrome. Immunity 35:908–918. https:// doi. org/ 10. 1016/j. immuni. 2011. 09. 020
12. Aird WC (2003) The role of the endothelium in severe sepsis and multiple organ dysfunction syndrome. Blood 101:3765–3777. https:// doi.org/ 10. 1182/ blood-2002-06-1887
13. Pape T, Hunkemoller AM, Kumpers P, Haller H, David S, Stahl K (2021)
Targeting the “sweet spot” in septic shock - A perspective on the endothelial glycocalyx regulating proteins Heparanase-1 and -2. Matrix Biol Plus 12:100095. https:// doi. org/ 10. 1016/j. mbplus. 2021. 100095
14. Iba T, Levy JH (2019) Derangement of the endothelial glycocalyx in sepsis. J Thromb Haemost 17:283–294. https:// doi. org/ 10. 1111/ jth. 14371
15. Delabranche X, Helms J, Meziani F (2017) Immunohaemostasis: a new view on haemostasis during sepsis. Ann Intensive Care 7:117. https://doi. org/ 10. 1186/ s13613-017-0339-5
16. Stahl K, Schmidt JJ, Seeliger B, Schmidt BMW, Welte T, Haller H et al (2020) Effect of therapeutic plasma exchange on endothelial activation and coagulation-related parameters in septic shock. Crit Care 24:71.https:// doi. org/ 10. 1186/ s13054-020-2799-5
17. Yipp BG, Kubes P (2013) NETosis: how vital is it? Blood 122:2784–2794.https:// doi. org/ 10. 1182/ blood-2013-04-457671
18. Hahn RG, Patel V, Dull RO (2021) Human glycocalyx shedding: Systematic
review and critical appraisal. Acta Anaesthesiol Scand 65:590–606. https:// doi. org/ 10. 1111/ aas. 13797
19. Minasyan H, Flachsbart F (2019) Blood coagulation: a powerful bactericidal
mechanism of human innate immunity. Int Rev Immunol 38:3–17. https:// doi. org/ 10. 1080/ 08830 185. 2018. 15330 09
20. Sun H, Ringdahl U, Homeister JW, Fay WP, Engleberg NC, Yang AY et al
(2004) Plasminogen is a critical host pathogenicity factor for group A streptococcal infection. Science 305:1283–1286. https:// doi. org/ 10.1126/ scien ce. 11012 45
21. van der Poll T, Herwald H (2014) The coagulation system and its function
in early immune defense. Thromb Haemost 112:640–648. https://doi. org/ 10. 1160/ TH14-01-0053
22. Angles-Cano E (1994) Overview on fibrinolysis: plasminogen activation
pathways on fibrin and cell surfaces. Chem Phys Lipids 67–68:353–362.https:// doi. org/ 10. 1016/ 0009-3084(94) 90157-0
23. Morser J, Gabazza EC, Myles T, Leung LLK (2010) What has been learnt from the thrombin-activatable fibrinolysis inhibitor-deficient mouse? J Thromb Haemost 8:868–876. https:// doi. org/ 10. 1111/j. 1538-7836. 2010.03787.x
24. Zeerleder S, Schroeder V, Hack CE, Kohler HP, Wuillemin WA (2006) TAFI
and PAI-1 levels in human sepsis. Thromb Res 118:205–212. https:// doi.
org/ 10. 1016/j. throm res. 2005. 06. 007
25. da Cruz DB, Helms J, Aquino LR, Stiel L, Cougourdan L, Broussard C et al
(2019) DNA-bound elastase of neutrophil extracellular traps degrades plasminogen, reduces plasmin formation, and decreases fibrinolysis: proof of concept in septic shock plasma. FASEB J 33:14270–14280. https:// doi. org/ 10. 1096/ fj. 20190 1363R RR
26. Mast AE, Ruf W (2022) Regulation of coagulation by tissue factor pathway
inhibitor: Implications for hemophilia therapy. J Thromb Haemost 20:1290–1300. https:// doi. org/ 10. 1111/ jth. 15697
27. Chalmers E, Cooper P, Forman K, Grimley C, Khair K, Minford A et al
(2011) Purpura fulminans: recognition, diagnosis and management. Arch Dis Child 96:1066–1071. https:// doi. org/ 10. 1136/ adc. 2010. 199919
28. Ed Rainger G, Chimen M, Harrison MJ, Yates CM, Harrison P, Watson SP,et al. The role of platelets in the recruitment of leukocytes during vascular disease. Platelets 2015;26:507–20. https:// doi. org/ 10. 3109/ 09537 104.2015. 10648 81.
29. Lorant DE, Topham MK, Whatley RE, McEver RP, McIntyre TM, Prescott
SM et al (1993) Inflammatory roles of P-selectin. J Clin Invest 92:559–570. https:// doi. org/ 10. 1172/ JCI11 6623
30. Peerschke EIB, Yin W, Ghebrehiwet B (2008) Platelet mediated complement
activation. Adv Exp Med Biol 632:81–91. https:// doi. org/ 10. 1007/978-0-387-78952-1_7
31. Merle NS, Church SE, Fremeaux-Bacchi V, Roumenina LT (2015) Complement System Part I - Molecular Mechanisms of Activation and Regulation.
Front Immunol 6:262. https:// doi. org/ 10. 3389/ fimmu. 2015. 00262
32. Esmon CT (2004) The impact of the inflammatory response on coagulation.
Thromb Res 114:321–327. https:// doi. org/ 10. 1016/j. throm res. 2004.06. 028
33. Taylor FB, Toh CH, Hoots WK, Wada H, Levi M, Scientific Subcommittee
on Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost 2001;86:1327–30.
34. Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K et al (2006) A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med 34:625–631. https:// doi. org/ 10. 1097/ 01. ccm.00002 02209. 42491. 38
35. Iba T, Levy JH, Yamakawa K, Thachil J, Warkentin TE, Levi M et al (2019)
Proposal of a two-step process for the diagnosis of sepsis-induced disseminated
intravascular coagulation. J Thromb Haemost 17:1265–1268.https:// doi. org/ 10. 1111/ jth. 14482
36. Schmoch T, Mohnle P, Weigand MA, Briegel J, Bauer M, Bloos F et al (2023) The prevalence of sepsis-induced coagulopathy in patients with sepsis - a secondary analysis of two German multicenter randomized controlled trials. Ann Intensive Care 13:3. https:// doi. org/ 10. 1186/s13613-022-01093-7
37. Chen Y, Chen W, Ba F, Zheng Y, Zhou Y, Shi W et al (2023) Prognostic
Accuracy of the Different Scoring Systems for Assessing Coagulopathy in Sepsis: A Retrospective Study. Clin Appl Thromb Hemost 29:10760296231207630. https:// doi. org/ 10. 1177/ 10760 29623 12076 30
38. Li J, Liu H, Wang N, Wang F, Shang N, Guo S et al (2024) Persistent high
sepsis-induced coagulopathy and sequential organ failure assessment scores can predict the 28-day mortality of patients with sepsis: A prospective study. BMC Infect Dis 24:282. https:// doi. org/ 10. 1186/s12879-024-09154-x
39. Lerolle N, Nochy D, Guerot E, Bruneval P, Fagon J-Y, Diehl J-L et al (2010)
Histopathology of septic shock induced acute kidney injury: apoptosis and leukocytic infiltration. Intensive Care Med 36:471–478. https:// doi.org/ 10. 1007/ s00134-009-1723-x
40. Tani VM, Assis-Mendonca GR, da Silva TB, Rogerio F, De Paula EV (2017)
Microvascular thrombosis in sepsis: An autopsy study. Thromb Res 156:23–25. https:// doi. org/ 10. 1016/j. throm res. 2017. 05. 031
41. White KC, Serpa-Neto A, Hurford R, Clement P, Laupland KB, See E, et al. Sepsis-associated acute kidney injury in the intensive care unit: incidence, patient characteristics, timing, trajectory, treatment, and associated outcomes. A multicenter, observational study. Intensive Care Med 2023;49:1079–89. https:// doi. org/ 10. 1007/ s00134-023-07138-0.
42. Helms J, Merdji H, Loewert S, Severac F, Monnier A, Kaurin J et al (2023)
Disseminated intravascular coagulation is strongly associated with severe acute kidney injury in patients with septic shock. Ann Intensive Care 13:119. https:// doi. org/ 10. 1186/ s13613-023-01216-8
43. Seymour CW, Kennedy JN, Wang S, Chang C-CH, Elliott CF, Xu Z, et al.
Derivation, Validation, and Potential Treatment Implications of Novel Clinical Phenotypes for Sepsis. JAMA 2019;321:2003–17. https:// doi. org/10. 1001/ jama. 2019. 5791.
44. Langenberg C, Bagshaw SM, May CN, Bellomo R (2008) The histopathology
of septic acute kidney injury: a systematic review. Crit Care 12:R38. https:// doi. org/ 10. 1186/ cc6823
45. Torres LK, Pickkers P, van der Poll T (2022) Sepsis-Induced Immunosuppression. Annu Rev Physiol 84:157–181. https:// doi. org/ 10. 1146/ annurev-physi ol-061121-040214
46. Cajander S, Kox M, Scicluna BP, Weigand MA, Mora RA, Flohe SB et al (2024) Profiling the dysregulated immune response in sepsis: overcoming challenges to achieve the goal of precision medicine. Lancet Respir Med 12:305–322. https:// doi. org/ 10. 1016/ S2213-2600(23) 00330-2
47. Bozza FA, Salluh JI, Japiassu AM, Soares M, Assis EF, Gomes RN et al (2007) Cytokine profiles as markers of disease severity in sepsis: a multiplex analysis. Crit Care 11:R49. https:// doi. org/ 10. 1186/ cc5783
48. Russell JA, Fjell C, Hsu JL, Lee T, Boyd J, Thair S et al (2013) Vasopressin
compared with norepinephrine augments the decline of plasma cytokine levels in septic shock. Am J Respir Crit Care Med 188:356–364.https:// doi. org/ 10. 1164/ rccm. 201302-0355OC
49. Venet F, Monneret G (2018) Advances in the understanding and treatment of sepsis-induced immunosuppression. Nat Rev Nephrol 14:121–137. https:// doi. org/ 10. 1038/ nrneph. 2017. 165
50. Grimaldi D, Pradier O, Hotchkiss RS, Vincent J-L (2017) Nivolumab plus
interferon-γ in the treatment of intractable mucormycosis. Lancet Infect Dis 17:18. https:// doi. org/ 10. 1016/ S1473-3099(16) 30541-2
51. Cusack R, Leone M, Rodriguez AH, Martin-Loeches I (2022) Endothelial
Damage and the Microcirculation in Critical Illness. Biomedicines 10:3150. https:// doi. org/ 10. 3390/ biome dicin es101 23150
52. Hinson JP, Kapas S, Smith DM (2000) Adrenomedullin, a multifunctional
regulatory peptide. Endocr Rev 21:138–167. https:// doi. org/ 10. 1210/edrv. 21.2. 0396
53. Valenzuela-Sanchez F, Valenzuela-Mendez B, Rodriguez-Gutierrez JF,
Estella-Garcia A, Gonzalez-Garcia MA. New role of biomarkers: midregional
pro-adrenomedullin, the biomarker of organ failure. Ann Transl Med 2016;4:329. https:// doi. org/ 10. 21037/ atm. 2016. 08. 65.
54. Fang Y, Li C, Shao R, Yu H, Zhang Q (2018) The role of biomarkers of
endothelial activation in predicting morbidity and mortality in patients with severe sepsis and septic shock in intensive care: A prospective observational study. Thromb Res 171:149–154. https:// doi. org/ 10.1016/j. throm res. 2018. 09. 059
55. Chi Y, Yu S, Yin J, Liu D, Zhuo M, Li X (2024) Role of Angiopoietin/Tie2
System in Sepsis: A Potential Therapeutic Target. Clin Appl Thromb Hemost 30:10760296241238010. https:// doi. org/ 10. 1177/ 10760 29624 12380 10
56. Iba T, Nisio MD, Levy JH, Kitamura N, Thachil J (2017) New criteria for sepsis-induced coagulopathy (SIC) following the revised sepsis definition: a retrospective analysis of a nationwide survey. BMJ Open 7:e017046. https:// doi. org/ 10. 1136/ bmjop en-2017-017046
57. Iba T, Levy JH, Thachil J, Susen S, Levi M, Scarlatescu E (2023) Communication from the Scientific Standardization Committees of the
International Society on Thrombosis and Haemostasis on vascular endothelium-related biomarkers in disseminated intravascular coagulation. J Thromb Haemost 21:691–699. https:// doi. org/ 10. 1016/j. jtha. 2022.11. 032
58. Vincent JL, Francois B, Zabolotskikh I, Daga MK, Lascarrou JB, Kirov MY
et al (2019) Effect of a Recombinant Human Soluble Thrombomodulin on Mortality in Patients with Sepsis-Associated Coagulopathy: The SCARLET Randomized Clinical Trial. JAMA - Journal of the American Medical Association 321:1993–2002. https:// doi. org/ 10. 1001/ jama. 2019.5358
59. Levi M, Vincent J-L, Tanaka K, Radford AH, Kayanoki T, Fineberg DA et al (2020) Effect of a Recombinant Human Soluble Thrombomodulin on Baseline Coagulation Biomarker Levels and Mortality Outcome in Patients With Sepsis-Associated Coagulopathy. Crit Care Med 48:1140–1147. https:// doi. org/ 10. 1097/ CCM. 00000 00000 004426
60. Greinacher A, Selleng S (2016) How I evaluate and treat thrombocytopenia
in the intensive care unit patient. Blood 128:3032–3042. https://doi. org/ 10. 1182/ blood-2016-09-693655
61. Russell L, Madsen MB, Dahl M, Kampmann P, Perner A (2018) Prediction of bleeding and thrombosis by standard biochemical coagulation variables in haematological intensive care patients. Acta Anaesthesiol Scand 62:196–206. https:// doi. org/ 10. 1111/ aas. 13036
62. Davies GR, Lawrence M, Pillai S, Mills GM, Aubrey R, Thomas D et al (2018) The effect of sepsis and septic shock on the viscoelastic properties of clot quality and mass using rotational thromboelastometry: A prospective observational study. J Crit Care 44:7–11. https:// doi. org/ 10.1016/j. jcrc. 2017. 09. 183
63. Muller MC, Meijers JC, Vroom MB, Juffermans NP (2014) Utility of thromboelastography and/or thromboelastometry in adults with sepsis: a
systematic review. Crit Care 18:R30. https:// doi. org/ 10. 1186/ cc137 21
64. Evans L, Rhodes A, Alhazzani W, Antonelli M, Coopersmith CM, French
C et al (2021) Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med 47:1181–1247. https:// doi. org/ 10. 1007/ s00134-021-06506-y
65. Hippensteel JA, Uchimido R, Tyler PD, Burke RC, Han X, Zhang F et al (2019) Intravenous fluid resuscitation is associated with septic endothelial glycocalyx degradation. Crit Care 23:259. https:// doi. org/ 10. 1186/s13054-019-2534-2
66. Fisher J, Douglas JJ, Linder A, Boyd JH, Walley KR, Russell JA (2016)
Elevated Plasma Angiopoietin-2 Levels Are Associated With Fluid Overload, Organ Dysfunction, and Mortality in Human Septic Shock. Crit Care Med 44:2018–2027. https:// doi. org/ 10. 1097/ CCM. 00000 00000 001853
67. Sivapalan P, Ellekjaer KL, Jessen MK, Meyhoff TS, Cronhjort M, Hjortrup
PB et al (2023) Lower vs Higher Fluid Volumes in Adult Patients With Sepsis: An Updated Systematic Review With Meta-Analysis and Trial Sequential Analysis. Chest 164:892–912. https:// doi. org/ 10. 1016/j. chest.2023. 04. 036
68. Lewis SR, Pritchard MW, Evans DJ, Butler AR, Alderson P, Smith AF, et al.
Colloids versus crystalloids for fluid resuscitation in critically ill people.Cochrane Database Syst Rev 2018;8:CD000567. https:// doi. org/ 10. 1002/14651 858. CD000 567. pub7.
69. Rasmussen KC, Secher NH, Pedersen T (2016) Effect of perioperative crystalloid or colloid fluid therapy on hemorrhage, coagulation competence, and outcome: A systematic review and stratified meta-analysis. Medicine (Baltimore) 95:e4498. https:// doi. org/ 10. 1097/ MD. 00000 00000 004498
70. Kozek-Langenecker SA (2009) Influence of fluid therapy on the haemostatic
system of intensive care patients. Best Pract Res Clin Anaesthesiol 23:225–236. https:// doi. org/ 10. 1016/j. bpa. 2008. 11. 002
71. Kellum JA, Song M, Almasri E (2006) Hyperchloremic acidosis increases
circulating inflammatory molecules in experimental sepsis. Chest 130:962–967. https:// doi. org/ 10. 1378/ chest. 130.4. 962
72. Fernandez-Sarmiento J, Salazar-Pelaez LM, Acevedo L, Nino-Serna LF, Florez S, Alarcon-Forero L et al (2023) Endothelial and Glycocalyx Biomarkers in Children With Sepsis After One Bolus of Unbalanced or Balanced Crystalloids. Pediatr Crit Care Med 24:213–221. https:// doi.org/ 10. 1097/ PCC. 00000 00000 003123
73. Saravi B, Goebel U, Hassenzahl LO, Jung C, David S, Feldheiser A et al (2023) Capillary leak and endothelial permeability in critically ill patients: a current overview. Intensive Care Med Exp 11:96. https:// doi.org/ 10. 1186/ s40635-023-00582-8
74. Sandoo A, van Zanten JJCSV, Metsios GS, Carroll D, Kitas GD. The endothelium and its role in regulating vascular tone. Open Cardiovasc Med J 2010;4:302–12. https:// doi. org/ 10. 2174/ 18741 92401 00401 0302.
75. Lambden S (2019) Bench to bedside review: therapeutic modulation of nitric oxide in sepsis-an update. Intensive Care Med Exp 7:64. https://doi. org/ 10. 1186/ s40635-019-0274-x
76. Coloretti I, Genovese A, Teixeira JP, Cherian A, Ferrer R, Landoni G et al (2024) Angiotensin ii therapy in refractory septic shock: which patient can benefit most? A narrative review. J Anesth Analg Crit Care 4:13. https:// doi. org/ 10. 1186/ s44158-024-00150-w
77. Leisman DE, Privratsky JR, Lehman JR, Abraham MN, Yaipan OY, Brewer MR et al (2022) Angiotensin II enhances bacterial clearance via myeloid signaling in a murine sepsis model. Proc Natl Acad Sci U S A 119:e2211370119. https:// doi. org/ 10. 1073/ pnas. 22113 70119
78. Stolk RF, van der Poll T, Angus DC, van der Hoeven JG, Pickkers P, Kox M (2016) Potentially Inadvertent Immunomodulation: Norepinephrine Use in Sepsis. Am J Respir Crit Care Med 194:550–558. https:// doi. org/10. 1164/ rccm. 201604-0862CP
79. Heming N, Sivanandamoorthy S, Meng P, Bounab R, Annane D (2018) Immune Effects of Corticosteroids in Sepsis. Front Immunol 9:1736. https:// doi. org/ 10. 3389/ fimmu. 2018. 01736
80. Barabutis N, Khangoora V, Marik PE, Catravas JD (2017) Hydrocortisone
and Ascorbic Acid Synergistically Prevent and Repair Lipopolysaccharide-
Induced Pulmonary Endothelial Barrier Dysfunction. Chest 152:954–962. https:// doi. org/ 10. 1016/j. chest. 2017. 07. 014
81. Mansart A, Bollaert PE, Seguin C, Levy B, Longrois D, Mallie JP (2003) Hemodynamic effects of early versus late glucocorticosteroid administration
in experimental septic shock. Shock 19:38–44. https:// doi. org/10. 1097/ 00024 382-20030 1000-00008
82. Lim H-Y, Muller N, Herold MJ, van den Brandt J, Reichardt HM (2007) Glucocorticoids exert opposing effects on macrophage function dependent on their concentration. Immunology 122:47–53. https:// doi. org/ 10. 1111/j. 1365-2567. 2007. 02611.x
83. Venkatesh B, Finfer S, Cohen J, Rajbhandari D, Arabi Y, Bellomo R et al (2018) Adjunctive Glucocorticoid Therapy in Patients with Septic Shock. N Engl J Med 378:797–808. https:// doi. org/ 10. 1056/ NEJMo a1705 835
84. Annane D, Renault A, Brun-Buisson C, Megarbane B, Quenot J-P, Siami S et al (2018) Hydrocortisone plus Fludrocortisone for Adults with Septic Shock. N Engl J Med 378:809–818. https:// doi. org/ 10. 1056/ NEJMoa1705 716
85. Pirracchio R, Annane D, Waschka AK, Lamontagne F, Arabi YM, Bollaert
P-E, et al. Patient-Level Meta-Analysis of Low-Dose Hydrocortisone in
Adults with Septic Shock. NEJM Evid 2023;2:EVIDoa2300034. https:// doi.
org/ 10. 1056/ EVIDo a2300 034.
86. Torres A, Sibila O, Ferrer M, Polverino E, Menendez R, Mensa J et al (2015) Effect of corticosteroids on treatment failure among hospitalized patients with severe community-acquired pneumonia and high inflammatory response: a randomized clinical trial. JAMA 313:677–686.https:// doi. org/ 10. 1001/ jama. 2015. 88
87. Dequin P-F, Meziani F, Quenot J-P, Kamel T, Ricard J-D, Badie J et al (2023) Hydrocortisone in Severe Community-Acquired Pneumonia. N Engl J Med 388:1931–1941. https:// doi. org/ 10. 1056/ NEJMo a2215 145
88. Saleem N, Kulkarni A, Snow TAC, Ambler G, Singer M, Arulkumaran N (2023) Effect of Corticosteroids on Mortality and Clinical Cure in Community-Acquired Pneumonia: A Systematic Review, Meta-analysis, and Meta-regression of Randomized Control Trials. Chest 163:484–497.https:// doi. org/ 10. 1016/j. chest. 2022. 08. 2229
89. Lansbury L, Rodrigo C, Leonardi-Bee J, Nguyen-Van-Tam J, Lim WS. Corticosteroids as adjunctive therapy in the treatment of influenza. Cochrane Database Syst Rev 2019;2:CD010406. https:// doi. org/ 10. 1002/14651 858. CD010 406. pub3.
90. Chaudhuri D, Nei AM, Rochwerg B, Balk RA, Asehnoune K, Cadena R et al (2024) 2024 Focused Update: Guidelines on Use of Corticosteroids in Sepsis, Acute Respiratory Distress Syndrome, and Community-Acquired Pneumonia. Crit Care Med 52:e219–e233. https:// doi. org/ 10.1097/ CCM. 00000 00000 006172
91. Rice TW, Wheeler AP, Bernard GR, Vincent J-L, Angus DC, Aikawa N et al
(2010) A randomized, double-blind, placebo-controlled trial of TAK-242 for the treatment of severe sepsis. Crit Care Med 38:1685–1694. https://doi. org/ 10. 1097/ CCM. 0b013 e3181 e7c5c9
92. Shakoory B, Carcillo JA, Chatham WW, Amdur RL, Zhao H, Dinarello CA
et al (2016) Interleukin-1 Receptor Blockade Is Associated With Reduced
Mortality in Sepsis Patients With Features of Macrophage Activation Syndrome: Reanalysis of a Prior Phase III Trial. Crit Care Med 44:275–281. https:// doi. org/ 10. 1097/ CCM. 00000 00000 001402
93. Francois B, Lambden S, Fivez T, Gibot S, Derive M, Grouin J-M et al (2023)
Prospective evaluation of the efficacy, safety, and optimal biomarker enrichment strategy for nangibotide, a TREM-1 inhibitor, in patients with septic shock (ASTONISH): a double-blind, randomised, controlled, phase 2b trial. Lancet Respir Med 11:894–904. https:// doi. org/ 10. 1016/S2213-2600(23) 00158-3
94. Cui J, Wei X, Lv H, Li Y, Li P, Chen Z et al (2019) The clinical efficacy of
intravenous IgM-enriched immunoglobulin (pentaglobin) in sepsis or septic shock: a meta-analysis with trial sequential analysis. Ann Intensive Care 9:27. https:// doi. org/ 10. 1186/ s13613-019-0501-3
95. Laterre P-F, Pickkers P, Marx G, Wittebole X, Meziani F, Dugernier T et al
(2021) Safety and tolerability of non-neutralizing adrenomedullin antibody adrecizumab (HAM8101) in septic shock patients: the AdrenOSS-2 phase 2a biomarker-guided trial. Intensive Care Med 47:1284–1294. https:// doi. org/ 10. 1007/ s00134-021-06537-5
96. Aman J, Peters MJL, Weenink C, van Nieuw Amerongen GP, Vonk NA (2013) Reversal of vascular leak with imatinib. Am J Respir Crit Care Med 188:1171–1173. https:// doi. org/ 10. 1164/ rccm. 201301-0136LE
97. Jaimes F, De La Rosa G, Morales C, Fortich F, Arango C, Aguirre D et al (2009) Unfractioned heparin for treatment of sepsis: A randomized clinical trial (The HETRASE Study). Crit Care Med 37:1185–1196. https://doi. org/ 10. 1097/ CCM. 0b013 e3181 9c06bc
98. Tagami T, Matsui H, Horiguchi H, Fushimi K, Yasunaga H (2014) Antithrombin and mortality in severe pneumonia patients with sepsisassociated
disseminated intravascular coagulation: an observational nationwide study. J Thromb Haemost 12:1470–1479. https:// doi. org/ 10.1111/ jth. 12643
99. Ranieri VM, Thompson BT, Barie PS, Dhainaut J-F, Douglas IS, Finfer S et al (2012) Drotrecogin alfa (activated) in adults with septic shock. N Engl J Med 366:2055–2064. https:// doi. org/ 10. 1056/ NEJMo a1202 290
100. Warren BL, Eid A, Singer P, Pillay SS, Carl P, Novak I, et al. Caring for the critically ill patient. High-dose antithrombin III in severe sepsis: a randomized controlled trial. JAMA 2001;286:1869–78. https:// doi. org/10. 1001/ jama. 286. 15. 1869.
101. Abraham E, Reinhart K, Opal S, Demeyer I, Doig C, Rodriguez AL et al (2003) Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA 290:238–247. https:// doi. org/ 10. 1001/ jama. 290.2. 238
102. Vincent J-L, Francois B, Zabolotskikh I, Daga MK, Lascarrou J-B, Kirov MY
et al (2019) Effect of a Recombinant Human Soluble Thrombomodulin on Mortality in Patients With Sepsis-Associated Coagulopathy: The SCARLET Randomized Clinical Trial. JAMA 321:1993–2002. https:// doi.org/ 10. 1001/ jama. 2019. 5358
103. Francois B, Fiancette M, Helms J, Mercier E, Lascarrou J-B, Kayanoki T et al (2021) Efficacy and safety of human soluble thrombomodulin (ART-123) for treatment of patients in France with sepsis-associated coagulopathy: post hoc analysis of SCARLET. Ann Intensive Care 11:53.https:// doi. org/ 10. 1186/ s13613-021-00842-4
104. Saito H, Maruyama I, Shimazaki S, Yamamoto Y, Aikawa N, Ohno R et al
(2007) Efficacy and safety of recombinant human soluble thrombomodulin (ART-123) in disseminated intravascular coagulation: results of a phase III, randomized, double-blind clinical trial. J Thromb Haemost 5:31–41. https:// doi. org/ 10. 1111/j. 1538-7836. 2006. 02267.x
105. Silasi-Mansat R, Zhu H, Popescu NI, Peer G, Sfyroera G, Magotti P et al (2010) Complement inhibition decreases the procoagulant response and confers organ protection in a baboon model of Escherichia coli sepsis. Blood 116:1002–1010. https:// doi. org/ 10. 1182/ blood-2010-02-269746
106. Keshari RS, Silasi R, Popescu NI, Patel MM, Chaaban H, Lupu C et al (2017) Inhibition of complement C5 protects against organ failure and reduces mortality in a baboon model of Escherichia coli sepsis. Proc Natl Acad Sci U S A 114:E6390–E6399. https:// doi. org/ 10. 1073/ pnas. 17068 18114
Источник фотоиллюстрации - www.freepik.com
[~DETAIL_TEXT] =>
Intensive Care Med
https://doi.org/10.1007/s00134-024-07586-2Understanding, assessing and treating immune, endothelial and haemostasis dysfunctions in bacterial sepsis
Massimo Girardis, Sascha David, Ricard Ferrer, Julie Helms, Nicole P. Juffermans, Ignacio Martin‑Loeches, Pedro Povoa, Lene Russell, Manu Shankar‑Hari, Toshiaki Iba, Irene Coloretti, Nicholas Parchim and Nathan D. Nielsen
Аннотация
Взаимодействие между иммунной системой, коагуляцией и эндотелием имеет решающее значение в регулировании реакции хозяина на инфекцию. Однако при сепсисе и других критических состояний нерегулируемый иммунный ответ может привести к чрезмерным изменениям в этих механизмах, что приводит к коагулопатии, эндотелиальной и полиорганной дисфункции. Целью этого обзора является комплексный анализ патофизиологических механизмов сложных взаимодействий между иммунной, эндотелиальной дисфункцией и нарушениям коагуляции при сепсисе. В нем подчеркивается клиническое значение, методы оценки и потенциальные терапевтические вмешательства. Понимание этих механизмов необходимо для разработки эффективных методов лечения, которые могут модулировать иммунный ответ, уменьшать риск тромбозов, восстанавливать эндотелиальную функцию и в конечном итоге улучшать выживаемость пациентов.
Ключевые слова: Иммунная система, Коагуляция, Эндотелий, Сепсис
Введение
Сложное взаимодействие между иммунным ответом, коагуляцией и эндотелием является фундаментальной частью регулируемого, то есть физиологического, ответа хозяина на инфекцию. Без эффективной командной работы этих трех чрезвычайно сложных систем ни одна инфекция не может быть успешно устранена. Всякий раз, когда это взаимодействие становится несинхронизированным тем или иным образом, его можно описать как «нарушенный ответ хозяина», термин, широко используемый с тех пор, как определение сепсиса было изменено в 2016 году [1]. Стоит отметить, что нарушенный ответ хозяина является характеристикой, общей для множества критических состояний, таких как сепсис, острый респираторный дистресс-синдром и панкреатит. При сепсисе под дисрегуляцией иммунного ответа хозяина понимается патологическое нарушение и/или изменение гомеостаза иммунных механизмов сопротивления, толерантности к болезни и ее разрешения, происходящие одновременно. Устойчивость относится к эффекторным иммунным механизмам, которые снижают бремя патогена посредством обнаружения, нейтрализации, уничтожения микроорганизмов и воспаления врожденным иммунитетом [2].
В этом контексте иммунный тромбоз (или тромбовоспаление) относится к врожденным иммунным реакциям, ответственным за генерацию тромбина и образование микротромбов, что способствует распознаванию, сдерживанию и разрушению патогена. Однако во время сепсиса и других критических состояний нерегулируемый иммунный ответ вызывает интенсивную активацию лейкоцитов, тромбоцитов и эндотелия с чрезмерной активацией коагуляции, что в сочетании с дефектными антикоагулянтными и фибринолитическими системами может привести к диссеминированному внутрисосудистому свертыванию (ДВС), связанному с полиорганной дисфункцией и высокими показателями смертности [3, 4]. Таким образом, стратегии, направленные на контроль чрезмерной иммунной активации, генерации тромбина и эндотелиальной дисфункции, могут потенциально помочь пережить инфекцию [5].
Патофизиологические механизмы взаимодействия иммунных клеток, эндотелия и гемостаза при сепсисе
Иммунные клетки
При сепсисе моноциты и нейтрофилы играют решающую роль в активации воспаления, экспрессируя рецепторы, такие как толл-подобные рецепторы (TLR), рецепторы Fcγ, рецепторы, сопряженные с G-белком, и рецепторы, активируемые протеазой (PAR). Эти рецепторы реагируют на различные стимулы. При сепсисе моноциты выделяют провоспалительные цитокины и активируют врожденные иммунные реакции, тем самым запуская активацию нейтрофилов, которая инициирует образование нейтрофильных внеклеточных ловушек (NET). NET представляют собой деконденсированные волокна дезоксирибонуклеиновой кислоты (ДНК), несущие цитруллинированные гистоны и протеолитические ферменты, такие как миелопероксидаза и нейтрофильная эластаза [6]. Микровезикулы (MVs) представляют собой субмикронные везикулы плазматической мембраны, которые высвобождаются активированными клетками. MVs (особенно из эндотелиальных клеток и лейкоцитов) высвобождаются во время экспрессии тканевого фактора (TF), вызванной сепсисом, и стимулируют воспалительные сигнальные пути в кровеносных сосудах и сердце [7].
Воздействие фосфатидилсерина MVs вызывает "сборку" прокоагулянтных и антикоагулянтных комплексов факторов свертывания на поверхности клеток. Интересно, что эндотелиальные и лейкоцитарные MVs также проявляют фибринолитические функции [8]. Колокализация MVs на NET представляет собой поверхность, способную способствовать свертыванию крови, тем самым способствуя потенциальной прокоагулянтной активности NET посредством активации контактного пути (фактор XII) ДНК [9]. Кроме того, NET обладают высоким сродством к связыванию тромбоцитов. При сепсисе лейкоциты также связаны с различными типами гибели клеток, включая некроз, некроптоз и пироптоз [10]. Клеточные компоненты, высвобождаемые из мертвых клеток, а именно молекулярные паттерны, ассоциированные с повреждением (DAMP), включая ДНК, гистоны и высокомобильную группу 1 (HMGB-1), являются высоковоспалительными и прокоагулянтными и усиливают тромбовоспаление путем связывания с рецепторами молекулярных паттернов, ассоциированных с патогенами (PAMP) [11] (Fig.. 1).

Эндотелий
Эндотелиальный ответ на воспаление является эволюционно обусловленным явлением, необходимым для эффективного контроля источника инфекции иммунной системой. Однако его системное и одновременное возникновение может быть вредным для хозяина. Сепсис вызывает воздействие на прокоагулянтную, проницаемую и адгезивную поверхности эндотелия [12].
Например, системное воспаление приводит к слущиванию/деградации эндотелиального гликокаликса (eGC) [13]. Гликокаликс представляет собой гелеобразный слой, который покрывает эндотелиальную поверхность и состоит из мембраносвязывающих протеогликанов, боковых цепей гликозаминогликанов и высокомолекулярных полисахаридов, которые связывают функциональные белки, такие как антитромбин [14]. Однако, поскольку гликокаликс является хрупким, он может быть легко разрушен и деградирован в результате гипервоспаления [14].
Удаление гликокаликса приводит к обнажению прокоагулянтной поверхности эндотелия, а также к повышенной экспрессии TF и фактора фон Виллебранда (VWF) на поверхностях эндотелия и моноцитов. TF запускает коагуляцию и избыточную генерацию тромбина. Затем тромбин преобразует фибриноген в мономеры фибрина, которые собираются в нерастворимую сеть фибрина, которая дополнительно усиливается прямой активацией контактного пути и ингибированием фибринолиза длинно-размерными бактериальными полифосфатами [15]. Одновременно системное воспаление запускает высвобождение предварительно сохраненного VWF из эндотелия. Острое увеличение VWF в кровотоке расходует его расщепляющую протеазу (дезинтегрин и металлопротеиназу с мотивом тромбоспондина типа 1 [ADAMTS13]), так что на эндотелиальных поверхностях присутствуют преимущественно сверхбольшие мультимеры VWF (ULVWM), агрегирующие тромбоциты и в конечном итоге нарушающие микрососудистую перфузию [13, 14, 16].
Наконец, повышенная эндотелиальная экспрессия и воздействие молекул поверхностной адгезии, таких как молекула межклеточной адгезии 1 (ICAM-1) и молекула сосудистой адгезии 1 (VICAM-1), запускают адгезию лейкоцитов и их трансмиграцию в здоровые ткани, способствуя органной недостаточности [6, 12, 17]. Недавний систематический обзор проанализировал связь между концентрацией компонентов гликокаликса в плазме и структурными оценками эндотелия [18]. Хотя в большинстве исследований сообщалось об увеличении продуктов гликокаликса в плазме, структурные оценки с использованием методов визуализации показали, что истончение эндотелиального гликокаликса не всегда соответствует повышенным концентрациям компонентов гликокаликса в плазме, и не было обнаружено никаких доказательств, подтверждающих идею о том, что проницаемость капилляров действительно увеличивается при увеличении уровней фрагментов гликокаликса в плазме (Fig. 1).
Гемостаз
Система гемостаза играет важную роль в первичном иммунном ответе. Активация коагуляции является быстрым механизмом ограничения и нейтрализации инфекционных агентов внутри сгустков, и этот процесс происходит как в тканях, так и в кровотоке. Патогены выработали факторы, которые специально нацелены на пути коагуляции [19]. Например, некоторые микроорганизмы обладают способностью растворять фибриновые сгустки посредством ферментативной активности, тогда как другие могут ингибировать агрегацию тромбоцитов [20]. Чрезмерная и нерегулируемая активация путей коагуляции, связанная с недостатками механизмов деградации фибрина, вызывает избыточную продукцию тромбина, что является ключевым фактором в развитии коагулопатии, вызванной сепсисом (SIC) [21]. Фибринолиз характеризуется активацией фибринсвязанного плазминогена в плазмин тканевым активатором плазминогена (t-PA) и, в меньшей степени, урокиназой (u-PA). Затем фибрин расщепляется плазмином, в результате чего высвобождаются специфические продукты распада фибрина, включая D-димер [22].
Генерация плазмина в основном контролируется ингибитором активатора плазминогена (PAI-1) и ингибитором активируемого тромбином фибринолиза (TAFI) в присутствии тромбомодулина [23]. Хотя патогенез остается практически неизвестным, в нескольких исследованиях было отмечено, что у пациентов с сепсисом, индуцирующим ДВС, наблюдается дефект фибринолиза, что обусловлено увеличением PAI-1 (секретируемого эндотелиальными клетками и активированными тромбоцитами), активацией TAFI [24] и деградацией плазминогена нейтрофильной эластазой из NETs [25]. Системы контррегуляции также утратили свою эффективность. Концентрации в плазме естественных антикоагулянтов (протеина C, протеина S и антитромбина) снижаются при сепсисе. Ингибитор пути тканевого фактора (TFPI) ингибирует фибринолиз, взаимодействуя с факторами свертывания VII, X и TF, ограничивая активацию каскада свертывания [26].
Молниеносная пурпура, обычно связанная с менингококковыми и пневмококковыми инфекциями, широко рассматривается как архетип нарушения гемостаза при сепсисе, характеризующийся внутрисосудистым свертыванием, которое быстро развивается при ДВС-синдроме, сопровождающемся эпидермальным некрозом и воспалительным васкулитом [27]. Помимо своего влияния на коагуляцию, тромбоциты играют важную роль во врожденной иммунной системе и выделяют несколько агентов, которые напрямую способствуют активации нейтрофилов и привлекают лейкоциты через экспрессию P-селектина [28], который связывает нейтрофилы и моноциты с активированными тромбоцитами [29]. Они также экспрессируют TLR-4 и активируют альтернативные и классические пути комплемента напрямую через рецепторы связывания комплемента [30].
Система комплемента является ключевым регулятором иммунитета, который связывает врожденные и адаптивные реакции и способствует опсонизации и лизису патогенов. Каскад комплемента может быть активирован тремя путями путем вторжения патогенов через повреждение тканей и связанное с этим высвобождение DAMPs [31]. При сепсисе система комплемента играет защитную роль против бактериальных инфекций, но также может напрямую способствовать гипервоспалению, приводящему к полиорганной недостаточности. Далее анафилатоксины, активированные комплементом 3 (C3a) и активированным комплементом 5 (C5a), способствуют активации тромбоцитов, агрегации и высвобождению провоспалительных медиаторов [32] (Fig 1).
Клинические аспекты эндотелиальных и гемостатических нарушений, вызванных иммунной дисфункцией
В 2001 году Международное общество по тромбозу и гемостазу (ISTH) опубликовало определение и диагностические критерии явного ДВС-синдрома [33]. Хотя критерии явного ДВС-синдрома получили широкое признание, они были разработаны для диагностики окончательного (часто позднего или запущенного) ДВС-синдрома. Были высказаны предположения, что опора на эти критерии может привести к запоздалой диагностике ДВС-синдрома [34], при которой варианты лечения пациента, вероятно, будут неэффективными. Следовательно, ISTH выпустило еще один набор упрощенных диагностических критериев, разработанных для выявления ранней фазы ДВС-синдрома при сепсисе, то есть коагулопатии, вызванной сепсисом (SIC) [35]. SIC включает оценку органной недостаточности (SOFA) > 2, количество тромбоцитов и протромбиновое время, что делает его легко подсчитываемым у постели больного (Fig.. 2). Распространенность и смертность от SIC (с использованием определения «Сепсис-3») были изучены во вторичном анализе двух РКИ [36], в которых распространенность SIC составила 22,1% и 24,2% соответственно.

90-дневная смертность пациентов с SIC в исследовании HYPRESS (сепсис без шока) была значительно выше (почти вдвое), чем у пациентов без SIC (26,8% против 13,9%, p = 0,027). Хотя это РКИ было нацелено на относительно менее тяжелых пациентов, а число не выживших было небольшим (15 из 56 пациентов в группе SIC и 28 из 201 пациента в группе без SIC), исследование пришло к выводу, что SIC связан с более высокой смертностью и должен интерпретироваться как ранний предупреждающий признак неблагоприятного прогноза сепсиса. Chen et al. наблюдали равную дискриминационную способность SIC и DIC для 28-дневной смертности среди 452 пациентов [37], а Li et al. сообщили о сопоставимой прогностической точности оценок смертности в течение 28 дней по шкалам SIC и SOFA в проспективном исследовании, в котором приняли участие 209 пациентов [38].
Несмотря на широко признанную и тщательно документированную связь между активацией коагуляции и развитием дисфункции органов, образование стабильных микрососудистых тромбов, которое может привести к ишемии тканей и недостаточности органов, по-видимому, встречается у пациентов с сепсисом нечасто [39]. При аутопсии, проведенной у 51 человек, умершим от сепсиса или септического шока, только у трех из них были обнаружены микрососудистые тромбы [40], и только у одного человека были обнаружены микротромбы как в почках, так и в легких. Эти результаты позволяют предположить, что микрососудистый тромбоз может не быть значимым фактором в патогенезе сепсиса. Частота острого повреждения почек (AKI ) значительно различается в разных исследованиях, и White et al. [41] сообщили, что приблизительно 16% пациентов с сепсисом соответствовали критериям AKI; у половины из них была AKI 1-й стадии, а у 3% — AKI 3-й стадии (рис. 3).

Однако частота тяжелого AKI значительно увеличивалась при наличии ДВС-синдрома. Helmset al. [42] сообщили, что около половины пациентов с ДВС-синдромом, связанным с сепсисом, и шоком нуждались в заместительной почечной терапии, и эта доля была более чем в два раза выше по сравнению с пациентами без ДВС-синдрома (47,3% против 21,3%, p < 0,001). Другие отчеты также предполагали тесную связь между ДВС-синдромом и AKI и их связь с более плохими исходами [43]. Отличительная архитектура почечных сосудов, характеризующаяся наличием капилляров клубочков между афферентными и эфферентными артериолами, делает почку особенно восприимчивой к образованию микротромбов. Однако гистопатологические исследования выявили нормальную гистологию только с легкими неспецифическими изменениями почек как при человеческом, так и при AKI при сепсисе в эксперименте [44].
Оценка эндотелия/гемостаза и иммунной системы у постели больного
Эффективная помощь пациентам с сепсисом зависит от понимания базовых биологических механизмов, при этом дисфункция иммунной, эндотелиальной и гемостатической системы выделяются как важнейшие участники. Иммунный ответ включает в себя множество типов клеток и медиаторов [45]. Несмотря на доступность различных методов у постели больного, в настоящее время не существует единого биомаркера, который мог бы эффективно отражать общее функционирование иммунной системы [46]. Измерения цитокинов и других медиаторов должны быть более всеобъемлющими, чтобы обеспечить полное представление об активности иммунной системы и эндотелиальной дисфункции, и большинство доступных тестов требуют лучшей стандартизации. В частности, несколько исследований выявили выраженную вариабельность в комбинациях цитокинов у пациентов с септическим шоком [47, 48].
Тесты, оценивающие клеточную активность, дают больше информации, но также могут быть ограниченными. Эти тесты включают проточную цитометрию, исследование лимфоцитарных субпопуляций, соотношения CD4 + /CD8 +, главного комплекса гистосовместимости II (MHC II) (человеческий лейкоцитарный антиген-DR [HLA-DR]) экспрессию на антигенпрезентирующих клетках (APC), контрольные точки Т-клеток (белок программируемой клеточной смерти 1 [PD-1], лиганд программируемой смерти 1 [PD-L1] и цитотоксический Т-лимфоцитарный антиген 4 [CTLA-4]) и функциональные тесты для оценки пролиферативной способности, такие как активация Т-клеток через анти-CD28 или стимуляция in vitro мононуклеарных клеток периферической крови (PBMC) липополисахаридом или Escherichia coli для измерения продукции цитокинов (например, интерлейкина [IL]-6 и/или фактора некроза опухоли [TNF]) [49].
Простым способом выявления пациентов с риском иммуносупрессии является мониторинг абсолютного количества лимфоцитов. Если присутствует постоянная и необъяснимая лимфопения, следует рассмотреть возможность иммунной дисфункции и провести дополнительные тесты [50]. Поддержание целостности эндотелия имеет решающее значение для микроциркуляторного потока и доставки кислорода тканям, что соответствует главной цели интенсивной терапии. Клиническая оценка структуры и функции микроциркуляции улучшила наше понимание воздействия сепсиса на эндотелиальный гликокаликс, что может служить прогностическим инструментом и потенциально направлять будущие вмешательства. Микроскопия в темном поле с боковым потоком позволяет визуализировать in vivo нарушение гликокаликса, предлагая возможность определять фенотипически уникальные формы критических состояний, а также отображать микроскопические эффекты терапии в режиме реального времени [51].
Про-адреномедуллин (про-АДМ) является молекулой-предшественником адреномедуллина, пептидного гормона, участвующего в различных физиологических процессах, включая эндотелиальную и сосудистую функцию [52]. При сепсисе повышенные уровни про-АДМ могут указывать на эндотелиальную дисфункцию и тяжесть воспалительной реакции.
Такие уровни также связаны с повышенным риском смертности, что указывает на потенциальную полезность про-АДМ в качестве прогностического биомаркера [53]. Несколько других биомаркеров, включая растворимые факторы и клеточные маркеры, были предложены для оценки эндотелиальной целостности [54]. Среди них ангиопоэтин-1 и -2 и ангиопоэтин/тирозинкиназа с осью иммуноглобулин-подобного петлевого эпидермального фактора роста 2 (Tie2), по-видимому, являются перспективными биомаркерами для раннего выявления эндотелиального нарушения и могут быть важной терапевтической целью для предотвращения органной недостаточности [55].
Оценка дисфункции гемостаза у постели больного более проста. Как обсуждалось ранее, шкала ISTH явного ДВС-синдрома, созданная в 2001 году, стала золотым стандартом для диагностики ДВС-синдрома, но столкнулась с ограничениями из-за сложности и требований к ресурсам [33]. Следовательно, была разработана шкала SIC, позволяющая проводить раннюю диагностику ДВС-синдрома, связанного с сепсисом, с использованием легкодоступных биомаркеров и шкалы SOFA. Недавние рекомендации рекомендуют двухэтапный подход, сначала оценивая шкалу SIC у всех пациентов с сепсисом, а затем, при необходимости, шкалу ISTH, что помогает принимать терапевтические решения и проводить клинические испытания [35, 56]. Антитромбин и VWF были предложены в качестве потенциальных циркулирующих маркеров активации эндотелия [57]. Однако из-за их ограниченной доступности их использование в настоящее время ограничено. Следовательно, несмотря на свои ограничения, оценка SIC является простым и удобным в использовании инструментом скрининга для пациентов с высоким риском, а также для выявления случаев, в которых могут быть полезны индивидуальные стратегии антикоагулянтной терапии (хотя нет убедительных доказательств в поддержку их рутинного использования) [57–59].
Важно помнить, что тромбоцитопения очень распространена при сепсисе и имеет много причин, включая гемодилюцию, побочные эффекты лекарств (включая несколько часто используемых антибиотиков) и подавленный тромбопоэз [60]. Хотя связь между протромбином/международным нормализованным отношением (МНО) и кровотечением, тромбозом и смертью была непоследовательной в различных исследованиях, было последовательно продемонстрировано, что тяжелая тромбоцитопения связана с плохими результатами [61]. Существует значительный интерес к использованию тестов по месту оказания помощи, таких как тромбоэластография (TEG) и тромбоэластометрия, для диагностики нарушений коагуляции у пациентов с сепсисом. Эти тесты могут обнаружить гиперкоагуляцию, гипокоагуляцию и нарушенный фибринолиз, хотя никакой связи с кровотечением или тромбозом не было установлено [62]. Однако интерпретация результатов TEG/тромбоэластометрии (ROTEM ) сложна, а качество доказательств, подтверждающих полезность этих тестов для выявления SIC , по-прежнему считается низким [63].
Влияние стандартных вмешательств при сепсисе на взаимодействие систем
Инфузионная терапия вместе с антибиотикотерапией, контролем источника и вазопрессорами являются краеугольным камнем лечения сепсиса, особенно у пациентов с шоком. Два ключевых аспекта инфузионной терапии могут существенно повлиять на коагуляцию и эндотелиальный ответ: объем и тип вводимой жидкости. Основываясь на научно обоснованных рекомендациях, рекомендуется, чтобы после введения первого объема , дальнейшее введение жидкостей было тщательно сбалансировано с учетом потенциального риска и вреда, вызванного ее перегрузкой [64]. В частности, эти риски включают длительную искусственную вентиляцию легких, усугубление острого повреждения почек и повышенные показатели смертности. У пациентов с сепсисом чрезмерное введение жидкости связано с циркулирующими уровнями синдекана-1, маркера потери эндотелиального гликокаликса, что приводит к капиллярной утечке, отеку тканей и нарушению микроциркуляции [65].
Кроме того, перегрузка жидкостью при сепсисе связана с повышенным уровнем ангиопоэтина-2, что связано с эндотелиальной дисфункцией и повышенной проницаемостью [66]. Чрезмерное введение жидкости может "разбавлять" факторы свертывания и тромбоциты, тем самым усугубляя коагулопатию, вызванную сепсисом. Несмотря на априорную привлекательность консервативных стратегий объемов жидкости, аналогичных тем, которые применяются при геморрагическом шоке, клинических доказательств, подтверждающих их превосходство над более либеральными подходами, по-прежнему не хватает [67]. Кристаллоиды (сбалансированные, а не нормальные солевые растворы) в настоящее время рекомендуются в качестве растворов первой линии для пациентов с сепсисом, поскольку на сегодняшний день отсутствуют явные клинические преимущества и некоторые сигналы о вреде при введении коллоидов по сравнению с кристаллоидами [64, 68].
В периоперационном периоде, но не у пациентов в критическом состоянии, использование гидроксиэтилкрахмалов по сравнению с кристаллоидами или альбумином было связано с повышенной кровопотерей из-за снижения коагуляционной компетентности, оцененной с помощью ТЭГ [69]. Однако провоспалительные и прокоагулянтные эффекты кристаллоидных растворов по сравнению с коллоидами наблюдались на животных моделях [70, 71]. Аналогичным образом, исследования на животных моделях и у пациентов с сепсисом продемонстрировали, что использование кристаллоидов связано с большим отторжением гликокаликса и потерей целостности, чем синтетические (например, крахмалы) или натуральные (например, альбумин) коллоиды [70, 72]. Использование альбумина, по-видимому, больше защищает эндотелий благодаря нескольким неонкотическим свойствам, таким как антиоксидантная активность и электрическая и химическая защита поверхностного слоя эндотелия со стабилизацией проницаемости, лейкоцитарным роллингом и адгезией [64]. Кроме того, альбумин может оказывать специфическое противовоспалительное и иммуномодулирующее действие при сепсисе. Эти потенциальные защитные эффекты альбумина не были подтверждены снижением смертности в крупных рандомизированных исследованиях; таким образом, использование альбумина в качестве инфузионной терапии предлагается только для пациентов с сепсисом, которым требуются большие объемы кристаллоидов [73].
В целом, влияние жидкостей на пути коагуляции и эндотелиальные клетки при сепсисе широко распространено, и необходимы дальнейшие исследования для определения оптимальных стратегий управления инфузионной терапией для улучшения результатов у пациентов с сепсисом. Эндотелий высвобождает различные вазоактивные факторы. Это могут быть вазодилатирующие факторы, такие как оксид азота (NO), простациклин и гиперполяризующие факторы, полученные из эндотелия, или вазоконстрикторные факторы, такие как тромбоксан и эндотелин-1 [74]. При сепсисе повышенная продукция NO связана с развитием вазоплегии, дисфункцией миокарда, снижением чувствительности к адренергическим стимулам, прямой клеточной токсичностью и биоэнергетической недостаточностью. Поэтому были разработаны потенциальные подходы к модуляции продукции NO при сепсисе [75]. В настоящее время в клинической практике несколько вазопрессоров со специфическими рецепторами на эндотелиальном уровне используются в мультимодальном подходе.
Норэпинефрин является вазопрессором первой линии, рекомендуемым для пациентов с сепсисом, и оказывает адренергическую активность с выраженным α1-агонизмом, умеренным β1-агонизмом и минимальным воздействием на β2-адренергические рецепторы. Использование вазопрессина в сочетании с норадреналином является обычной практикой для минимизации негативных последствий, связанных с высокими уровнями катехоламинов. Это связано с фармакодинамическими свойствами вазопрессина как эндогенного гормона, который действует на эндотелиальные рецепторы V1a, V1b и V2, и его потенциальными защитными эффектами на функцию почек и снижением возникновения сердечных аритмий. Ангиотензин II, по-видимому, является многообещающим и безопасным некатехоламиновым вазопрессором, что продемонстрировано как в экспериментальных моделях, так и в клинике [76]. Интересно, что в моделях на животных ангиотензин II, по-видимому, усиливает иммунный ответ при сепсисе [77], тогда как норадреналин и вазопрессин оказывают преимущественно противовоспалительное действие, которое способствует иммунопараличу [78].
Терапевтические цели и текущие данные для конкретных вмешательств, направленных на нерегулируемый ответ хозяина
Нерегулируемые пути сепсиса, рассмотренные ранее в этой статье, могут обеспечить потенциальные терапевтические цели, начиная от вмешательств, направленных на нерегулируемую функцию иммунных клеток, до более нисходящих эффектов, включая измененный гемостаз и потерю целостности сосудистого барьера. Следовательно, проведено несколько исследований вмешательств, направленные на иммунологические, эндотелиальные игемостатические нерегулируемые ответы (Table 1).

Иммуновоспалительный путь
Стероиды широко рассматривались для использования при сепсисе из-за их широкого воздействия на воспалительный ответ хозяина. Известно, что у пациентов с сепсисом стероиды снижают высвобождение провоспалительных факторов, таких как ИЛ-1 и ИЛ-6, протеолитические ферменты, реактивные формы кислорода и азота и другие цитокины. Считается, что эти эффекты частично объясняются их способностью стабилизировать клеточные мембраны, включая лизосомальные [79].
Более того, стероиды могут поддерживать целостность эндотелиальных клеток, по-видимому, снижают проницаемость сосудов и повышают чувствительность кровеносных сосудов к катехоламинам за счет активации адренергических рецепторов [80, 81]. Важно признать, что воздействие на иммунную систему часто зависит от дозы. В частности, было показано, что низкие дозы кортикостерона усиливают воспалительную реакцию макрофагов, активированных липополисахаридом, в то время как более высокие дозы, снижают эту реакцию [82]. Эффекты низких доз гидрокортизона у пациентов с септическим шоком были оценены в нескольких РКИ с различными результатами [83, 84].
Самый последний метаанализ, включающий 17 испытаний с более чем 7000 пациентов, показал, что гидрокортизон не оказал значительного влияния на 90-дневную смертность или большинство вторичных результатов, за исключением увеличения дней без вазопрессоров [85]. Неблагоприятные события, такие как суперинфекция, гипергликемия и гастродуоденальное кровотечение, не были значительно связаны с использованием гидрокортизона. Использование стероидов также исследовалось у пациентов с тяжелой внебольничной пневмонией (CAP) [86, 87]. Хотя многочисленные испытания продемонстрировали положительное влияние стероидной терапии на снижение прогрессирования до искусственной вентиляции легких при тяжелой CAP, влияние этой терапии на смертность остается неопределенным [88].
Кроме того, использование стероидов при дыхательной недостаточности, вызванной вирусом гриппа, связано с более высоким риском смерти [89]. Недавнее руководство, основанное на фактических данных, от Society of Critical Care Medicine рекомендовало использовать стероиды со средней степенью доказательности в течение 5–7 дней в суточной дозе < 400 мг внутривенного гидрокортизона или эквивалента у госпитализированных пациентов с тяжелой внебольничной пневмонией [90]. Было разработано и испытано несколько методов лечения, нацеленных на специфические иммунные медиаторы, у пациентов с сепсисом. Большинство из них были нацелены на избыточную продукцию цитокинов в результате связывания патоген-ассоциированных молекулярных паттернов с клеточными рецепторами, такими как TLR, которые инициируют быстрый синтез и высвобождение провоспалительных цитокинов. Однако исследование, направленное на ингибирование процесса сигнализации TLR-4 и, таким образом, продукции TNF-α, IL-1 и IL-6, не показало улучшения смертности или более низкой активности цитокинов, несмотря на предыдущие многообещающие результаты в мышиных моделях [91].
Хотя анакинра, рекомбинантный антагонист рецептора ИЛ-1, не показал никакого эффекта в нестратифицированной популяции пациентов с сепсисом, анализ подгрупп пациентов, леченных анакинрой, с признаками синдрома активации макрофагов показал снижение 28-дневной смертности [92]. Более новый агент, нангиботид, ингибитор растворимого TREM-1 (триггерный рецептор, экспрессируемый на миелоидных клетках 1), трансмембранного белка, высвобождаемого в результате эндотелиального повреждения и считающегося неотъемлемой частью повреждающего воспалительного ответа, наблюдаемого в случаях гипервоспаления при сепсисе, показал многообещающие результаты в клиническом исследовании фазы 2b [93], а исследование фазы 3 находится в стадии разработки.
Внутривенные иммуноглобулины (IVIG) ранее предлагались в качестве адъювантной терапии при сепсисе, однако доказательства не были убедительными, и в рекомендациях Surviving SepsisCampaign 2021 года было высказано мнение об отказе от их использования при сепсисе [64]. Однако было продемонстрировано, что обогащенный IgM IVIG играет решающую роль в иммунной модуляции B/T-клеток, и он и продемонстрировал потенциал для снижения смертности в объединенном анализе. Тем не менее, его эффект, как правило, менее последователен в исследованиях адекватного качества [94].
Эндотелий и пути гемостаза
Вмешательства, которые напрямую воздействуют на эндотелий и либо восстанавливают вызванное сепсисом повреждение, либо ослабляют эндотелиальную дисфункцию, в настоящее время находятся на поздней стадии испытаний. Например, альбумин изучался как возможное средство восстановления поврежденного эндотелиального гликокаликса, а энибарцимаб, не нейтрализующее моноклональное антитело, нацеленное на адреномедуллин, как полагают, потенциально снижает вызванную сепсисом вазодилатацию и эндотелиальную утечку [95]. Также потенциальный интерес представляют ингибиторы тирозинкиназы, такие как иматиниб, которые, как было обнаружено, уменьшают сосудистую утечку при идиопатическом синдроме сосудистой утечки [96].
Вмешательства также могут быть направлены на нерегулируемый гемостаз. Одним из самых ранних антикоагулянтных вмешательств, испытанных при сепсисе, был гепарин, который не показал положительного эффекта в рандомизированном исследовании [97]. Несмотря на потребление физиологических антикоагулянтов, таких как активированный протеин С, антитромбин и ингибиторы пути тканевого фактора, и многообещающие результаты реальных данных и первоначальных исследований [98], крупные рандомизированные исследования не смогли показать никакого преимущества в выживании от приема антикоагулянтов, но вместо этого увеличили случаи кровотечения [99–101]. Опасения, высказанные по поводу неудач испытаний, исследующих иммунофокусированные стратегии, напрямую применимы к испытаниям, исследующим гемостатические вмешательства. Большинство этих испытаний имели те же недостатки, поскольку они включали пациентов с сепсисом или септическим шоком независимо от наличия SIC/DIC, что означает, что многие пациенты получали антикоагулянтное лечение, хотя у них не было характерных признаков SIC или DIC.
Совсем недавно рекомбинантный человеческий тромбомодулин также не продемонстрировал никакого снижения показателей смертности, хотя тенденция к улучшению наблюдалась у пациентов с исходной коагулопатией и у тех, кто не получал сопутствующую тромбопрофилактику гепарином [102, 103]. Интересно, что в это исследование были включены только пациенты с признаками SIC в то время, но, в частности, не удалось определить надлежащее временное окно, поскольку у 20% пролеченных пациентов состояние улучшилось к моменту начала лечения, и у них больше не было SIC. Помимо отбора пациентов, другие факторы могли потенциально объяснить неудачу исследований антикоагулянтов, такие как время начала лечения, дозировка и продолжительность приема антикоагулянтов. Кроме того, использование 28-дневной смертности в качестве первичной конечной точки в рандомизированных контролируемых исследованиях может быть нецелесообразным, поскольку на него могут влиять многочисленные факторы, выходящие за рамки антикоагулянтной терапии.
Более подходящими конечными точками были бы разрешение ДВС-синдрома и улучшение дисфункции органов. Например, было проведено клиническое исследование фазы 3 для оценки эффективности рекомбинантного тромбомодулина при различных причинах ДВС-синдрома, причем разрешение ДВС было первичной конечной точкой [104]. Результаты исследования продемонстрировали превосходное разрешение ДВС-синдрома в группе тромбомодулина по сравнению с контрольной группой гепарина (66,1% против 49,9%; разница 16,2%, 95% доверительный интервал [ДИ] 3,3–29,1), и это привело к одобрению рекомбинантного тромбомодулина для лечения ДВС-синдрома в Японии.
Разработка методов лечения для управления гипервоспаления, вызванным системой комплемента, открывает большие перспективы для снижения риска полиорганной дисфункции, связанной с сепсисом. Обнадёживает то, что доклинические испытания продемонстрировали потенциальные преимущества ингибирующих стратегий у нечеловекообразных приматов и свиней, с уменьшением частоты недостаточности органов, коагулопатии и даже улучшением выживаемости [105, 106]. Интересно, что терапевтический плазмаферез при септическом шоке может иметь потенциал для модуляции различных аспектов, включая отмирание гликокаликса и коагулопатию, в одном вмешательстве [16]. В совокупности возможны несколько потенциальных стратегий, большинство из которых заслуживают дальнейшего исследования. Кроме того, предварительная стратификация и определение адекватного временного окна для надлежащего лечения являются обязательными должны быть мотивацией для новых клинических испытаний.
Выводы
Точные механизмы, лежащие в основе сепсиса, септического шока и полиорганной недостаточности, остаются частично понятыми. Одним из потенциальных факторов является распространение бактерий, которые могут напрямую повреждать органы и вырабатывать токсины, конкурирующие за одни и те же субстраты. Другим возможным фактором является активация врожденной иммунной системы, приводящая к нарушению регуляции как гуморального, так и клеточного иммунитета. Эти изменения могут влиять на коагуляцию и эндотелиальную функцию, приводя к сепсис-индуцированной дисфункции эндотелия и гемостаза. Нарушенное взаимодействие между этими тремя системами может объяснить, почему локализованный источник инфекции, такой как обструктивный пиелонефрит, может приводить к осложнениям, таким как острый респираторный дистресс-синдром, измененный уровень сознания, шок и AKI . Вызванная сепсисом иммунная, эндотелиальная и дисфункция гемостаза представляет собой сегмент более обширной и сложной дисрегуляционной системы, которая завершается органной недостаточностью после инфекции. Понимание этого единого механизма полиорганной недостаточности может позволить разработать новые тесты и терапевтические мишени для решения проблем нарушения коагуляции и эндотелиальной дисфункции.
References
1. Shankar-Hari M, Phillips GS, Levy ML, Seymour CW, Liu VX, Deutschman CS et al (2016) Developing a New Definition and Assessing New Clinical Criteria for Septic Shock: For the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 315:775–787. https:// doi. org/ 10. 1001/ jama. 2016. 0289
2. Shankar-Hari M, Calandra T, Soares MP, Bauer M, Wiersinga WJ, Prescott HC, et al. Reframing sepsis immunobiology for translation: towards informative subtyping and targeted immunomodulatory therapies. The Lancet Respiratory Medicine 2024;0. https:// doi. org/10. 1016/ S2213-2600(23) 00468-X.
3. Engelmann B, Massberg S (2013) Thrombosis as an intravascular effector of innate immunity. Nat Rev Immunol 13:34–45. https:// doi.org/ 10. 1038/ nri33 45
4. Iba T, Helms J, Levi M, Levy JH (2024) Thromboinflammation in acute injury: infections, heatstroke, and trauma. J Thromb Haemost 22:7–22. https:// doi. org/ 10. 1016/j. jtha. 2023. 07. 020
5. Helms J, Iba T, Connors JM, Gando S, Levi M, Meziani F et al (2023) How to manage coagulopathies in critically ill patients. Intensive Care Med 49:273–290. https:// doi. org/ 10. 1007/ s00134-023-06980-6
6. Brinkmann V, Reichard U, Goosmann C, Fauler B, Uhlemann Y, Weiss DS et al (2004) Neutrophil extracellular traps kill bacteria. Science 303:1532–1535. https:// doi. org/ 10. 1126/ scien ce. 10923 85
7. Meziani F, Delabranche X, Asfar P, Toti F (2010) Bench-to-bedside review: circulating microparticles—a new player in sepsis? Crit Care 14:236. https:// doi. org/ 10. 1186/ cc9231
8. Zhang Y, Meng H, Ma R, He Z, Wu X, Cao M et al (2016) Circulating microparticles, blood cells, and endothelium induce procoagulant activity in sepsis through phosphatidylserine exposure. Shock45:299–307. https:// doi. org/ 10. 1097/ SHK. 00000 00000 000509
9. Stiel L, Meziani F, Helms J (2018) Neutrophil Activation During Septic Shock. Shock 49:371–384. https:// doi. org/ 10. 1097/ SHK. 00000 00000000980
10. Robinson N, Ganesan R, Hegedűs C, Kovacs K, Kufer TA, Virag L (2019)
Programmed necrotic cell death of macrophages: Focus on pyroptosis, necroptosis, and parthanatos. Redox Biol 26:101239. https:// doi.org/ 10. 1016/j. redox. 2019. 101239
11. Duprez L, Takahashi N, Van Hauwermeiren F, Vandendriessche B,Goossens V, Vanden Berghe T et al (2011) RIP kinase-dependent necrosis drives lethal systemic inflammatory response syndrome. Immunity 35:908–918. https:// doi. org/ 10. 1016/j. immuni. 2011. 09. 020
12. Aird WC (2003) The role of the endothelium in severe sepsis and multiple organ dysfunction syndrome. Blood 101:3765–3777. https:// doi.org/ 10. 1182/ blood-2002-06-1887
13. Pape T, Hunkemoller AM, Kumpers P, Haller H, David S, Stahl K (2021)
Targeting the “sweet spot” in septic shock - A perspective on the endothelial glycocalyx regulating proteins Heparanase-1 and -2. Matrix Biol Plus 12:100095. https:// doi. org/ 10. 1016/j. mbplus. 2021. 100095
14. Iba T, Levy JH (2019) Derangement of the endothelial glycocalyx in sepsis. J Thromb Haemost 17:283–294. https:// doi. org/ 10. 1111/ jth. 14371
15. Delabranche X, Helms J, Meziani F (2017) Immunohaemostasis: a new view on haemostasis during sepsis. Ann Intensive Care 7:117. https://doi. org/ 10. 1186/ s13613-017-0339-5
16. Stahl K, Schmidt JJ, Seeliger B, Schmidt BMW, Welte T, Haller H et al (2020) Effect of therapeutic plasma exchange on endothelial activation and coagulation-related parameters in septic shock. Crit Care 24:71.https:// doi. org/ 10. 1186/ s13054-020-2799-5
17. Yipp BG, Kubes P (2013) NETosis: how vital is it? Blood 122:2784–2794.https:// doi. org/ 10. 1182/ blood-2013-04-457671
18. Hahn RG, Patel V, Dull RO (2021) Human glycocalyx shedding: Systematic
review and critical appraisal. Acta Anaesthesiol Scand 65:590–606. https:// doi. org/ 10. 1111/ aas. 13797
19. Minasyan H, Flachsbart F (2019) Blood coagulation: a powerful bactericidal
mechanism of human innate immunity. Int Rev Immunol 38:3–17. https:// doi. org/ 10. 1080/ 08830 185. 2018. 15330 09
20. Sun H, Ringdahl U, Homeister JW, Fay WP, Engleberg NC, Yang AY et al
(2004) Plasminogen is a critical host pathogenicity factor for group A streptococcal infection. Science 305:1283–1286. https:// doi. org/ 10.1126/ scien ce. 11012 45
21. van der Poll T, Herwald H (2014) The coagulation system and its function
in early immune defense. Thromb Haemost 112:640–648. https://doi. org/ 10. 1160/ TH14-01-0053
22. Angles-Cano E (1994) Overview on fibrinolysis: plasminogen activation
pathways on fibrin and cell surfaces. Chem Phys Lipids 67–68:353–362.https:// doi. org/ 10. 1016/ 0009-3084(94) 90157-0
23. Morser J, Gabazza EC, Myles T, Leung LLK (2010) What has been learnt from the thrombin-activatable fibrinolysis inhibitor-deficient mouse? J Thromb Haemost 8:868–876. https:// doi. org/ 10. 1111/j. 1538-7836. 2010.03787.x
24. Zeerleder S, Schroeder V, Hack CE, Kohler HP, Wuillemin WA (2006) TAFI
and PAI-1 levels in human sepsis. Thromb Res 118:205–212. https:// doi.
org/ 10. 1016/j. throm res. 2005. 06. 007
25. da Cruz DB, Helms J, Aquino LR, Stiel L, Cougourdan L, Broussard C et al
(2019) DNA-bound elastase of neutrophil extracellular traps degrades plasminogen, reduces plasmin formation, and decreases fibrinolysis: proof of concept in septic shock plasma. FASEB J 33:14270–14280. https:// doi. org/ 10. 1096/ fj. 20190 1363R RR
26. Mast AE, Ruf W (2022) Regulation of coagulation by tissue factor pathway
inhibitor: Implications for hemophilia therapy. J Thromb Haemost 20:1290–1300. https:// doi. org/ 10. 1111/ jth. 15697
27. Chalmers E, Cooper P, Forman K, Grimley C, Khair K, Minford A et al
(2011) Purpura fulminans: recognition, diagnosis and management. Arch Dis Child 96:1066–1071. https:// doi. org/ 10. 1136/ adc. 2010. 199919
28. Ed Rainger G, Chimen M, Harrison MJ, Yates CM, Harrison P, Watson SP,et al. The role of platelets in the recruitment of leukocytes during vascular disease. Platelets 2015;26:507–20. https:// doi. org/ 10. 3109/ 09537 104.2015. 10648 81.
29. Lorant DE, Topham MK, Whatley RE, McEver RP, McIntyre TM, Prescott
SM et al (1993) Inflammatory roles of P-selectin. J Clin Invest 92:559–570. https:// doi. org/ 10. 1172/ JCI11 6623
30. Peerschke EIB, Yin W, Ghebrehiwet B (2008) Platelet mediated complement
activation. Adv Exp Med Biol 632:81–91. https:// doi. org/ 10. 1007/978-0-387-78952-1_7
31. Merle NS, Church SE, Fremeaux-Bacchi V, Roumenina LT (2015) Complement System Part I - Molecular Mechanisms of Activation and Regulation.
Front Immunol 6:262. https:// doi. org/ 10. 3389/ fimmu. 2015. 00262
32. Esmon CT (2004) The impact of the inflammatory response on coagulation.
Thromb Res 114:321–327. https:// doi. org/ 10. 1016/j. throm res. 2004.06. 028
33. Taylor FB, Toh CH, Hoots WK, Wada H, Levi M, Scientific Subcommittee
on Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost 2001;86:1327–30.
34. Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K et al (2006) A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med 34:625–631. https:// doi. org/ 10. 1097/ 01. ccm.00002 02209. 42491. 38
35. Iba T, Levy JH, Yamakawa K, Thachil J, Warkentin TE, Levi M et al (2019)
Proposal of a two-step process for the diagnosis of sepsis-induced disseminated
intravascular coagulation. J Thromb Haemost 17:1265–1268.https:// doi. org/ 10. 1111/ jth. 14482
36. Schmoch T, Mohnle P, Weigand MA, Briegel J, Bauer M, Bloos F et al (2023) The prevalence of sepsis-induced coagulopathy in patients with sepsis - a secondary analysis of two German multicenter randomized controlled trials. Ann Intensive Care 13:3. https:// doi. org/ 10. 1186/s13613-022-01093-7
37. Chen Y, Chen W, Ba F, Zheng Y, Zhou Y, Shi W et al (2023) Prognostic
Accuracy of the Different Scoring Systems for Assessing Coagulopathy in Sepsis: A Retrospective Study. Clin Appl Thromb Hemost 29:10760296231207630. https:// doi. org/ 10. 1177/ 10760 29623 12076 30
38. Li J, Liu H, Wang N, Wang F, Shang N, Guo S et al (2024) Persistent high
sepsis-induced coagulopathy and sequential organ failure assessment scores can predict the 28-day mortality of patients with sepsis: A prospective study. BMC Infect Dis 24:282. https:// doi. org/ 10. 1186/s12879-024-09154-x
39. Lerolle N, Nochy D, Guerot E, Bruneval P, Fagon J-Y, Diehl J-L et al (2010)
Histopathology of septic shock induced acute kidney injury: apoptosis and leukocytic infiltration. Intensive Care Med 36:471–478. https:// doi.org/ 10. 1007/ s00134-009-1723-x
40. Tani VM, Assis-Mendonca GR, da Silva TB, Rogerio F, De Paula EV (2017)
Microvascular thrombosis in sepsis: An autopsy study. Thromb Res 156:23–25. https:// doi. org/ 10. 1016/j. throm res. 2017. 05. 031
41. White KC, Serpa-Neto A, Hurford R, Clement P, Laupland KB, See E, et al. Sepsis-associated acute kidney injury in the intensive care unit: incidence, patient characteristics, timing, trajectory, treatment, and associated outcomes. A multicenter, observational study. Intensive Care Med 2023;49:1079–89. https:// doi. org/ 10. 1007/ s00134-023-07138-0.
42. Helms J, Merdji H, Loewert S, Severac F, Monnier A, Kaurin J et al (2023)
Disseminated intravascular coagulation is strongly associated with severe acute kidney injury in patients with septic shock. Ann Intensive Care 13:119. https:// doi. org/ 10. 1186/ s13613-023-01216-8
43. Seymour CW, Kennedy JN, Wang S, Chang C-CH, Elliott CF, Xu Z, et al.
Derivation, Validation, and Potential Treatment Implications of Novel Clinical Phenotypes for Sepsis. JAMA 2019;321:2003–17. https:// doi. org/10. 1001/ jama. 2019. 5791.
44. Langenberg C, Bagshaw SM, May CN, Bellomo R (2008) The histopathology
of septic acute kidney injury: a systematic review. Crit Care 12:R38. https:// doi. org/ 10. 1186/ cc6823
45. Torres LK, Pickkers P, van der Poll T (2022) Sepsis-Induced Immunosuppression. Annu Rev Physiol 84:157–181. https:// doi. org/ 10. 1146/ annurev-physi ol-061121-040214
46. Cajander S, Kox M, Scicluna BP, Weigand MA, Mora RA, Flohe SB et al (2024) Profiling the dysregulated immune response in sepsis: overcoming challenges to achieve the goal of precision medicine. Lancet Respir Med 12:305–322. https:// doi. org/ 10. 1016/ S2213-2600(23) 00330-2
47. Bozza FA, Salluh JI, Japiassu AM, Soares M, Assis EF, Gomes RN et al (2007) Cytokine profiles as markers of disease severity in sepsis: a multiplex analysis. Crit Care 11:R49. https:// doi. org/ 10. 1186/ cc5783
48. Russell JA, Fjell C, Hsu JL, Lee T, Boyd J, Thair S et al (2013) Vasopressin
compared with norepinephrine augments the decline of plasma cytokine levels in septic shock. Am J Respir Crit Care Med 188:356–364.https:// doi. org/ 10. 1164/ rccm. 201302-0355OC
49. Venet F, Monneret G (2018) Advances in the understanding and treatment of sepsis-induced immunosuppression. Nat Rev Nephrol 14:121–137. https:// doi. org/ 10. 1038/ nrneph. 2017. 165
50. Grimaldi D, Pradier O, Hotchkiss RS, Vincent J-L (2017) Nivolumab plus
interferon-γ in the treatment of intractable mucormycosis. Lancet Infect Dis 17:18. https:// doi. org/ 10. 1016/ S1473-3099(16) 30541-2
51. Cusack R, Leone M, Rodriguez AH, Martin-Loeches I (2022) Endothelial
Damage and the Microcirculation in Critical Illness. Biomedicines 10:3150. https:// doi. org/ 10. 3390/ biome dicin es101 23150
52. Hinson JP, Kapas S, Smith DM (2000) Adrenomedullin, a multifunctional
regulatory peptide. Endocr Rev 21:138–167. https:// doi. org/ 10. 1210/edrv. 21.2. 0396
53. Valenzuela-Sanchez F, Valenzuela-Mendez B, Rodriguez-Gutierrez JF,
Estella-Garcia A, Gonzalez-Garcia MA. New role of biomarkers: midregional
pro-adrenomedullin, the biomarker of organ failure. Ann Transl Med 2016;4:329. https:// doi. org/ 10. 21037/ atm. 2016. 08. 65.
54. Fang Y, Li C, Shao R, Yu H, Zhang Q (2018) The role of biomarkers of
endothelial activation in predicting morbidity and mortality in patients with severe sepsis and septic shock in intensive care: A prospective observational study. Thromb Res 171:149–154. https:// doi. org/ 10.1016/j. throm res. 2018. 09. 059
55. Chi Y, Yu S, Yin J, Liu D, Zhuo M, Li X (2024) Role of Angiopoietin/Tie2
System in Sepsis: A Potential Therapeutic Target. Clin Appl Thromb Hemost 30:10760296241238010. https:// doi. org/ 10. 1177/ 10760 29624 12380 10
56. Iba T, Nisio MD, Levy JH, Kitamura N, Thachil J (2017) New criteria for sepsis-induced coagulopathy (SIC) following the revised sepsis definition: a retrospective analysis of a nationwide survey. BMJ Open 7:e017046. https:// doi. org/ 10. 1136/ bmjop en-2017-017046
57. Iba T, Levy JH, Thachil J, Susen S, Levi M, Scarlatescu E (2023) Communication from the Scientific Standardization Committees of the
International Society on Thrombosis and Haemostasis on vascular endothelium-related biomarkers in disseminated intravascular coagulation. J Thromb Haemost 21:691–699. https:// doi. org/ 10. 1016/j. jtha. 2022.11. 032
58. Vincent JL, Francois B, Zabolotskikh I, Daga MK, Lascarrou JB, Kirov MY
et al (2019) Effect of a Recombinant Human Soluble Thrombomodulin on Mortality in Patients with Sepsis-Associated Coagulopathy: The SCARLET Randomized Clinical Trial. JAMA - Journal of the American Medical Association 321:1993–2002. https:// doi. org/ 10. 1001/ jama. 2019.5358
59. Levi M, Vincent J-L, Tanaka K, Radford AH, Kayanoki T, Fineberg DA et al (2020) Effect of a Recombinant Human Soluble Thrombomodulin on Baseline Coagulation Biomarker Levels and Mortality Outcome in Patients With Sepsis-Associated Coagulopathy. Crit Care Med 48:1140–1147. https:// doi. org/ 10. 1097/ CCM. 00000 00000 004426
60. Greinacher A, Selleng S (2016) How I evaluate and treat thrombocytopenia
in the intensive care unit patient. Blood 128:3032–3042. https://doi. org/ 10. 1182/ blood-2016-09-693655
61. Russell L, Madsen MB, Dahl M, Kampmann P, Perner A (2018) Prediction of bleeding and thrombosis by standard biochemical coagulation variables in haematological intensive care patients. Acta Anaesthesiol Scand 62:196–206. https:// doi. org/ 10. 1111/ aas. 13036
62. Davies GR, Lawrence M, Pillai S, Mills GM, Aubrey R, Thomas D et al (2018) The effect of sepsis and septic shock on the viscoelastic properties of clot quality and mass using rotational thromboelastometry: A prospective observational study. J Crit Care 44:7–11. https:// doi. org/ 10.1016/j. jcrc. 2017. 09. 183
63. Muller MC, Meijers JC, Vroom MB, Juffermans NP (2014) Utility of thromboelastography and/or thromboelastometry in adults with sepsis: a
systematic review. Crit Care 18:R30. https:// doi. org/ 10. 1186/ cc137 21
64. Evans L, Rhodes A, Alhazzani W, Antonelli M, Coopersmith CM, French
C et al (2021) Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med 47:1181–1247. https:// doi. org/ 10. 1007/ s00134-021-06506-y
65. Hippensteel JA, Uchimido R, Tyler PD, Burke RC, Han X, Zhang F et al (2019) Intravenous fluid resuscitation is associated with septic endothelial glycocalyx degradation. Crit Care 23:259. https:// doi. org/ 10. 1186/s13054-019-2534-2
66. Fisher J, Douglas JJ, Linder A, Boyd JH, Walley KR, Russell JA (2016)
Elevated Plasma Angiopoietin-2 Levels Are Associated With Fluid Overload, Organ Dysfunction, and Mortality in Human Septic Shock. Crit Care Med 44:2018–2027. https:// doi. org/ 10. 1097/ CCM. 00000 00000 001853
67. Sivapalan P, Ellekjaer KL, Jessen MK, Meyhoff TS, Cronhjort M, Hjortrup
PB et al (2023) Lower vs Higher Fluid Volumes in Adult Patients With Sepsis: An Updated Systematic Review With Meta-Analysis and Trial Sequential Analysis. Chest 164:892–912. https:// doi. org/ 10. 1016/j. chest.2023. 04. 036
68. Lewis SR, Pritchard MW, Evans DJ, Butler AR, Alderson P, Smith AF, et al.
Colloids versus crystalloids for fluid resuscitation in critically ill people.Cochrane Database Syst Rev 2018;8:CD000567. https:// doi. org/ 10. 1002/14651 858. CD000 567. pub7.
69. Rasmussen KC, Secher NH, Pedersen T (2016) Effect of perioperative crystalloid or colloid fluid therapy on hemorrhage, coagulation competence, and outcome: A systematic review and stratified meta-analysis. Medicine (Baltimore) 95:e4498. https:// doi. org/ 10. 1097/ MD. 00000 00000 004498
70. Kozek-Langenecker SA (2009) Influence of fluid therapy on the haemostatic
system of intensive care patients. Best Pract Res Clin Anaesthesiol 23:225–236. https:// doi. org/ 10. 1016/j. bpa. 2008. 11. 002
71. Kellum JA, Song M, Almasri E (2006) Hyperchloremic acidosis increases
circulating inflammatory molecules in experimental sepsis. Chest 130:962–967. https:// doi. org/ 10. 1378/ chest. 130.4. 962
72. Fernandez-Sarmiento J, Salazar-Pelaez LM, Acevedo L, Nino-Serna LF, Florez S, Alarcon-Forero L et al (2023) Endothelial and Glycocalyx Biomarkers in Children With Sepsis After One Bolus of Unbalanced or Balanced Crystalloids. Pediatr Crit Care Med 24:213–221. https:// doi.org/ 10. 1097/ PCC. 00000 00000 003123
73. Saravi B, Goebel U, Hassenzahl LO, Jung C, David S, Feldheiser A et al (2023) Capillary leak and endothelial permeability in critically ill patients: a current overview. Intensive Care Med Exp 11:96. https:// doi.org/ 10. 1186/ s40635-023-00582-8
74. Sandoo A, van Zanten JJCSV, Metsios GS, Carroll D, Kitas GD. The endothelium and its role in regulating vascular tone. Open Cardiovasc Med J 2010;4:302–12. https:// doi. org/ 10. 2174/ 18741 92401 00401 0302.
75. Lambden S (2019) Bench to bedside review: therapeutic modulation of nitric oxide in sepsis-an update. Intensive Care Med Exp 7:64. https://doi. org/ 10. 1186/ s40635-019-0274-x
76. Coloretti I, Genovese A, Teixeira JP, Cherian A, Ferrer R, Landoni G et al (2024) Angiotensin ii therapy in refractory septic shock: which patient can benefit most? A narrative review. J Anesth Analg Crit Care 4:13. https:// doi. org/ 10. 1186/ s44158-024-00150-w
77. Leisman DE, Privratsky JR, Lehman JR, Abraham MN, Yaipan OY, Brewer MR et al (2022) Angiotensin II enhances bacterial clearance via myeloid signaling in a murine sepsis model. Proc Natl Acad Sci U S A 119:e2211370119. https:// doi. org/ 10. 1073/ pnas. 22113 70119
78. Stolk RF, van der Poll T, Angus DC, van der Hoeven JG, Pickkers P, Kox M (2016) Potentially Inadvertent Immunomodulation: Norepinephrine Use in Sepsis. Am J Respir Crit Care Med 194:550–558. https:// doi. org/10. 1164/ rccm. 201604-0862CP
79. Heming N, Sivanandamoorthy S, Meng P, Bounab R, Annane D (2018) Immune Effects of Corticosteroids in Sepsis. Front Immunol 9:1736. https:// doi. org/ 10. 3389/ fimmu. 2018. 01736
80. Barabutis N, Khangoora V, Marik PE, Catravas JD (2017) Hydrocortisone
and Ascorbic Acid Synergistically Prevent and Repair Lipopolysaccharide-
Induced Pulmonary Endothelial Barrier Dysfunction. Chest 152:954–962. https:// doi. org/ 10. 1016/j. chest. 2017. 07. 014
81. Mansart A, Bollaert PE, Seguin C, Levy B, Longrois D, Mallie JP (2003) Hemodynamic effects of early versus late glucocorticosteroid administration
in experimental septic shock. Shock 19:38–44. https:// doi. org/10. 1097/ 00024 382-20030 1000-00008
82. Lim H-Y, Muller N, Herold MJ, van den Brandt J, Reichardt HM (2007) Glucocorticoids exert opposing effects on macrophage function dependent on their concentration. Immunology 122:47–53. https:// doi. org/ 10. 1111/j. 1365-2567. 2007. 02611.x
83. Venkatesh B, Finfer S, Cohen J, Rajbhandari D, Arabi Y, Bellomo R et al (2018) Adjunctive Glucocorticoid Therapy in Patients with Septic Shock. N Engl J Med 378:797–808. https:// doi. org/ 10. 1056/ NEJMo a1705 835
84. Annane D, Renault A, Brun-Buisson C, Megarbane B, Quenot J-P, Siami S et al (2018) Hydrocortisone plus Fludrocortisone for Adults with Septic Shock. N Engl J Med 378:809–818. https:// doi. org/ 10. 1056/ NEJMoa1705 716
85. Pirracchio R, Annane D, Waschka AK, Lamontagne F, Arabi YM, Bollaert
P-E, et al. Patient-Level Meta-Analysis of Low-Dose Hydrocortisone in
Adults with Septic Shock. NEJM Evid 2023;2:EVIDoa2300034. https:// doi.
org/ 10. 1056/ EVIDo a2300 034.
86. Torres A, Sibila O, Ferrer M, Polverino E, Menendez R, Mensa J et al (2015) Effect of corticosteroids on treatment failure among hospitalized patients with severe community-acquired pneumonia and high inflammatory response: a randomized clinical trial. JAMA 313:677–686.https:// doi. org/ 10. 1001/ jama. 2015. 88
87. Dequin P-F, Meziani F, Quenot J-P, Kamel T, Ricard J-D, Badie J et al (2023) Hydrocortisone in Severe Community-Acquired Pneumonia. N Engl J Med 388:1931–1941. https:// doi. org/ 10. 1056/ NEJMo a2215 145
88. Saleem N, Kulkarni A, Snow TAC, Ambler G, Singer M, Arulkumaran N (2023) Effect of Corticosteroids on Mortality and Clinical Cure in Community-Acquired Pneumonia: A Systematic Review, Meta-analysis, and Meta-regression of Randomized Control Trials. Chest 163:484–497.https:// doi. org/ 10. 1016/j. chest. 2022. 08. 2229
89. Lansbury L, Rodrigo C, Leonardi-Bee J, Nguyen-Van-Tam J, Lim WS. Corticosteroids as adjunctive therapy in the treatment of influenza. Cochrane Database Syst Rev 2019;2:CD010406. https:// doi. org/ 10. 1002/14651 858. CD010 406. pub3.
90. Chaudhuri D, Nei AM, Rochwerg B, Balk RA, Asehnoune K, Cadena R et al (2024) 2024 Focused Update: Guidelines on Use of Corticosteroids in Sepsis, Acute Respiratory Distress Syndrome, and Community-Acquired Pneumonia. Crit Care Med 52:e219–e233. https:// doi. org/ 10.1097/ CCM. 00000 00000 006172
91. Rice TW, Wheeler AP, Bernard GR, Vincent J-L, Angus DC, Aikawa N et al
(2010) A randomized, double-blind, placebo-controlled trial of TAK-242 for the treatment of severe sepsis. Crit Care Med 38:1685–1694. https://doi. org/ 10. 1097/ CCM. 0b013 e3181 e7c5c9
92. Shakoory B, Carcillo JA, Chatham WW, Amdur RL, Zhao H, Dinarello CA
et al (2016) Interleukin-1 Receptor Blockade Is Associated With Reduced
Mortality in Sepsis Patients With Features of Macrophage Activation Syndrome: Reanalysis of a Prior Phase III Trial. Crit Care Med 44:275–281. https:// doi. org/ 10. 1097/ CCM. 00000 00000 001402
93. Francois B, Lambden S, Fivez T, Gibot S, Derive M, Grouin J-M et al (2023)
Prospective evaluation of the efficacy, safety, and optimal biomarker enrichment strategy for nangibotide, a TREM-1 inhibitor, in patients with septic shock (ASTONISH): a double-blind, randomised, controlled, phase 2b trial. Lancet Respir Med 11:894–904. https:// doi. org/ 10. 1016/S2213-2600(23) 00158-3
94. Cui J, Wei X, Lv H, Li Y, Li P, Chen Z et al (2019) The clinical efficacy of
intravenous IgM-enriched immunoglobulin (pentaglobin) in sepsis or septic shock: a meta-analysis with trial sequential analysis. Ann Intensive Care 9:27. https:// doi. org/ 10. 1186/ s13613-019-0501-3
95. Laterre P-F, Pickkers P, Marx G, Wittebole X, Meziani F, Dugernier T et al
(2021) Safety and tolerability of non-neutralizing adrenomedullin antibody adrecizumab (HAM8101) in septic shock patients: the AdrenOSS-2 phase 2a biomarker-guided trial. Intensive Care Med 47:1284–1294. https:// doi. org/ 10. 1007/ s00134-021-06537-5
96. Aman J, Peters MJL, Weenink C, van Nieuw Amerongen GP, Vonk NA (2013) Reversal of vascular leak with imatinib. Am J Respir Crit Care Med 188:1171–1173. https:// doi. org/ 10. 1164/ rccm. 201301-0136LE
97. Jaimes F, De La Rosa G, Morales C, Fortich F, Arango C, Aguirre D et al (2009) Unfractioned heparin for treatment of sepsis: A randomized clinical trial (The HETRASE Study). Crit Care Med 37:1185–1196. https://doi. org/ 10. 1097/ CCM. 0b013 e3181 9c06bc
98. Tagami T, Matsui H, Horiguchi H, Fushimi K, Yasunaga H (2014) Antithrombin and mortality in severe pneumonia patients with sepsisassociated
disseminated intravascular coagulation: an observational nationwide study. J Thromb Haemost 12:1470–1479. https:// doi. org/ 10.1111/ jth. 12643
99. Ranieri VM, Thompson BT, Barie PS, Dhainaut J-F, Douglas IS, Finfer S et al (2012) Drotrecogin alfa (activated) in adults with septic shock. N Engl J Med 366:2055–2064. https:// doi. org/ 10. 1056/ NEJMo a1202 290
100. Warren BL, Eid A, Singer P, Pillay SS, Carl P, Novak I, et al. Caring for the critically ill patient. High-dose antithrombin III in severe sepsis: a randomized controlled trial. JAMA 2001;286:1869–78. https:// doi. org/10. 1001/ jama. 286. 15. 1869.
101. Abraham E, Reinhart K, Opal S, Demeyer I, Doig C, Rodriguez AL et al (2003) Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA 290:238–247. https:// doi. org/ 10. 1001/ jama. 290.2. 238
102. Vincent J-L, Francois B, Zabolotskikh I, Daga MK, Lascarrou J-B, Kirov MY
et al (2019) Effect of a Recombinant Human Soluble Thrombomodulin on Mortality in Patients With Sepsis-Associated Coagulopathy: The SCARLET Randomized Clinical Trial. JAMA 321:1993–2002. https:// doi.org/ 10. 1001/ jama. 2019. 5358
103. Francois B, Fiancette M, Helms J, Mercier E, Lascarrou J-B, Kayanoki T et al (2021) Efficacy and safety of human soluble thrombomodulin (ART-123) for treatment of patients in France with sepsis-associated coagulopathy: post hoc analysis of SCARLET. Ann Intensive Care 11:53.https:// doi. org/ 10. 1186/ s13613-021-00842-4
104. Saito H, Maruyama I, Shimazaki S, Yamamoto Y, Aikawa N, Ohno R et al
(2007) Efficacy and safety of recombinant human soluble thrombomodulin (ART-123) in disseminated intravascular coagulation: results of a phase III, randomized, double-blind clinical trial. J Thromb Haemost 5:31–41. https:// doi. org/ 10. 1111/j. 1538-7836. 2006. 02267.x
105. Silasi-Mansat R, Zhu H, Popescu NI, Peer G, Sfyroera G, Magotti P et al (2010) Complement inhibition decreases the procoagulant response and confers organ protection in a baboon model of Escherichia coli sepsis. Blood 116:1002–1010. https:// doi. org/ 10. 1182/ blood-2010-02-269746
106. Keshari RS, Silasi R, Popescu NI, Patel MM, Chaaban H, Lupu C et al (2017) Inhibition of complement C5 protects against organ failure and reduces mortality in a baboon model of Escherichia coli sepsis. Proc Natl Acad Sci U S A 114:E6390–E6399. https:// doi. org/ 10. 1073/ pnas. 17068 18114
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 09.04.2025 00:01:00
[~DATE_ACTIVE_FROM] => 09.04.2025 00:01:00
[ACTIVE_FROM_X] => 2025-04-09 00:01:00
[~ACTIVE_FROM_X] => 2025-04-09 00:01:00
[ACTIVE_FROM] => 09.04.2025 00:01:00
[~ACTIVE_FROM] => 09.04.2025 00:01:00
[SHOW_COUNTER] => 303
[~SHOW_COUNTER] => 303
[ID] => 8513
[~ID] => 8513
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => html
[~PREVIEW_TEXT_TYPE] => html
[TIMESTAMP_X] => 19.03.2025 16:25:54
[~TIMESTAMP_X] => 19.03.2025 16:25:54
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/ponimanie-otsenka-i-lechenie-disfunktsii-immunnoy-i-endotelialnoy-sistemy-i-narusheniy-koagulyatsii-/
[~DETAIL_PAGE_URL] => /library/articles/ponimanie-otsenka-i-lechenie-disfunktsii-immunnoy-i-endotelialnoy-sistemy-i-narusheniy-koagulyatsii-/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => ponimanie-otsenka-i-lechenie-disfunktsii-immunnoy-i-endotelialnoy-sistemy-i-narusheniy-koagulyatsii-
[~CODE] => ponimanie-otsenka-i-lechenie-disfunktsii-immunnoy-i-endotelialnoy-sistemy-i-narusheniy-koagulyatsii-
[EXTERNAL_ID] => 8513
[~EXTERNAL_ID] => 8513
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 9 апреля 2025
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Понимание, оценка и лечение дисфункции иммунной и эндотелиальной системы и нарушений коагуляции при бактериальном сепсисе
[PREVIEW_PICTURE] => Array
(
[ID] => 6062
[TIMESTAMP_X] => 19.03.2025 16:25:54
[MODULE_ID] => iblock
[HEIGHT] => 624
[WIDTH] => 1000
[FILE_SIZE] => 465368
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/538/yl3e92592yqzf1137pj6x7mqqtdhrwxn
[FILE_NAME] => 2149611205.jpg
[ORIGINAL_NAME] => 2149611205.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 6e6e49b8fc61c40171d8dbd09e067cfd
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/538/yl3e92592yqzf1137pj6x7mqqtdhrwxn/2149611205.jpg
[UNSAFE_SRC] => /upload/iblock/538/yl3e92592yqzf1137pj6x7mqqtdhrwxn/2149611205.jpg
[SAFE_SRC] => /upload/iblock/538/yl3e92592yqzf1137pj6x7mqqtdhrwxn/2149611205.jpg
[ALT] => Понимание, оценка и лечение дисфункции иммунной и эндотелиальной системы и нарушений коагуляции при бактериальном сепсисе
[TITLE] => Понимание, оценка и лечение дисфункции иммунной и эндотелиальной системы и нарушений коагуляции при бактериальном сепсисе
)
[DETAIL_TEXT] =>
Intensive Care Med
https://doi.org/10.1007/s00134-024-07586-2Understanding, assessing and treating immune, endothelial and haemostasis dysfunctions in bacterial sepsis
Massimo Girardis, Sascha David, Ricard Ferrer, Julie Helms, Nicole P. Juffermans, Ignacio Martin‑Loeches, Pedro Povoa, Lene Russell, Manu Shankar‑Hari, Toshiaki Iba, Irene Coloretti, Nicholas Parchim and Nathan D. Nielsen
Аннотация
Взаимодействие между иммунной системой, коагуляцией и эндотелием имеет решающее значение в регулировании реакции хозяина на инфекцию. Однако при сепсисе и других критических состояний нерегулируемый иммунный ответ может привести к чрезмерным изменениям в этих механизмах, что приводит к коагулопатии, эндотелиальной и полиорганной дисфункции. Целью этого обзора является комплексный анализ патофизиологических механизмов сложных взаимодействий между иммунной, эндотелиальной дисфункцией и нарушениям коагуляции при сепсисе. В нем подчеркивается клиническое значение, методы оценки и потенциальные терапевтические вмешательства. Понимание этих механизмов необходимо для разработки эффективных методов лечения, которые могут модулировать иммунный ответ, уменьшать риск тромбозов, восстанавливать эндотелиальную функцию и в конечном итоге улучшать выживаемость пациентов.
Ключевые слова: Иммунная система, Коагуляция, Эндотелий, Сепсис
Введение
Сложное взаимодействие между иммунным ответом, коагуляцией и эндотелием является фундаментальной частью регулируемого, то есть физиологического, ответа хозяина на инфекцию. Без эффективной командной работы этих трех чрезвычайно сложных систем ни одна инфекция не может быть успешно устранена. Всякий раз, когда это взаимодействие становится несинхронизированным тем или иным образом, его можно описать как «нарушенный ответ хозяина», термин, широко используемый с тех пор, как определение сепсиса было изменено в 2016 году [1]. Стоит отметить, что нарушенный ответ хозяина является характеристикой, общей для множества критических состояний, таких как сепсис, острый респираторный дистресс-синдром и панкреатит. При сепсисе под дисрегуляцией иммунного ответа хозяина понимается патологическое нарушение и/или изменение гомеостаза иммунных механизмов сопротивления, толерантности к болезни и ее разрешения, происходящие одновременно. Устойчивость относится к эффекторным иммунным механизмам, которые снижают бремя патогена посредством обнаружения, нейтрализации, уничтожения микроорганизмов и воспаления врожденным иммунитетом [2].
В этом контексте иммунный тромбоз (или тромбовоспаление) относится к врожденным иммунным реакциям, ответственным за генерацию тромбина и образование микротромбов, что способствует распознаванию, сдерживанию и разрушению патогена. Однако во время сепсиса и других критических состояний нерегулируемый иммунный ответ вызывает интенсивную активацию лейкоцитов, тромбоцитов и эндотелия с чрезмерной активацией коагуляции, что в сочетании с дефектными антикоагулянтными и фибринолитическими системами может привести к диссеминированному внутрисосудистому свертыванию (ДВС), связанному с полиорганной дисфункцией и высокими показателями смертности [3, 4]. Таким образом, стратегии, направленные на контроль чрезмерной иммунной активации, генерации тромбина и эндотелиальной дисфункции, могут потенциально помочь пережить инфекцию [5].
Патофизиологические механизмы взаимодействия иммунных клеток, эндотелия и гемостаза при сепсисе
Иммунные клетки
При сепсисе моноциты и нейтрофилы играют решающую роль в активации воспаления, экспрессируя рецепторы, такие как толл-подобные рецепторы (TLR), рецепторы Fcγ, рецепторы, сопряженные с G-белком, и рецепторы, активируемые протеазой (PAR). Эти рецепторы реагируют на различные стимулы. При сепсисе моноциты выделяют провоспалительные цитокины и активируют врожденные иммунные реакции, тем самым запуская активацию нейтрофилов, которая инициирует образование нейтрофильных внеклеточных ловушек (NET). NET представляют собой деконденсированные волокна дезоксирибонуклеиновой кислоты (ДНК), несущие цитруллинированные гистоны и протеолитические ферменты, такие как миелопероксидаза и нейтрофильная эластаза [6]. Микровезикулы (MVs) представляют собой субмикронные везикулы плазматической мембраны, которые высвобождаются активированными клетками. MVs (особенно из эндотелиальных клеток и лейкоцитов) высвобождаются во время экспрессии тканевого фактора (TF), вызванной сепсисом, и стимулируют воспалительные сигнальные пути в кровеносных сосудах и сердце [7].
Воздействие фосфатидилсерина MVs вызывает "сборку" прокоагулянтных и антикоагулянтных комплексов факторов свертывания на поверхности клеток. Интересно, что эндотелиальные и лейкоцитарные MVs также проявляют фибринолитические функции [8]. Колокализация MVs на NET представляет собой поверхность, способную способствовать свертыванию крови, тем самым способствуя потенциальной прокоагулянтной активности NET посредством активации контактного пути (фактор XII) ДНК [9]. Кроме того, NET обладают высоким сродством к связыванию тромбоцитов. При сепсисе лейкоциты также связаны с различными типами гибели клеток, включая некроз, некроптоз и пироптоз [10]. Клеточные компоненты, высвобождаемые из мертвых клеток, а именно молекулярные паттерны, ассоциированные с повреждением (DAMP), включая ДНК, гистоны и высокомобильную группу 1 (HMGB-1), являются высоковоспалительными и прокоагулянтными и усиливают тромбовоспаление путем связывания с рецепторами молекулярных паттернов, ассоциированных с патогенами (PAMP) [11] (Fig.. 1).

Эндотелий
Эндотелиальный ответ на воспаление является эволюционно обусловленным явлением, необходимым для эффективного контроля источника инфекции иммунной системой. Однако его системное и одновременное возникновение может быть вредным для хозяина. Сепсис вызывает воздействие на прокоагулянтную, проницаемую и адгезивную поверхности эндотелия [12].
Например, системное воспаление приводит к слущиванию/деградации эндотелиального гликокаликса (eGC) [13]. Гликокаликс представляет собой гелеобразный слой, который покрывает эндотелиальную поверхность и состоит из мембраносвязывающих протеогликанов, боковых цепей гликозаминогликанов и высокомолекулярных полисахаридов, которые связывают функциональные белки, такие как антитромбин [14]. Однако, поскольку гликокаликс является хрупким, он может быть легко разрушен и деградирован в результате гипервоспаления [14].
Удаление гликокаликса приводит к обнажению прокоагулянтной поверхности эндотелия, а также к повышенной экспрессии TF и фактора фон Виллебранда (VWF) на поверхностях эндотелия и моноцитов. TF запускает коагуляцию и избыточную генерацию тромбина. Затем тромбин преобразует фибриноген в мономеры фибрина, которые собираются в нерастворимую сеть фибрина, которая дополнительно усиливается прямой активацией контактного пути и ингибированием фибринолиза длинно-размерными бактериальными полифосфатами [15]. Одновременно системное воспаление запускает высвобождение предварительно сохраненного VWF из эндотелия. Острое увеличение VWF в кровотоке расходует его расщепляющую протеазу (дезинтегрин и металлопротеиназу с мотивом тромбоспондина типа 1 [ADAMTS13]), так что на эндотелиальных поверхностях присутствуют преимущественно сверхбольшие мультимеры VWF (ULVWM), агрегирующие тромбоциты и в конечном итоге нарушающие микрососудистую перфузию [13, 14, 16].
Наконец, повышенная эндотелиальная экспрессия и воздействие молекул поверхностной адгезии, таких как молекула межклеточной адгезии 1 (ICAM-1) и молекула сосудистой адгезии 1 (VICAM-1), запускают адгезию лейкоцитов и их трансмиграцию в здоровые ткани, способствуя органной недостаточности [6, 12, 17]. Недавний систематический обзор проанализировал связь между концентрацией компонентов гликокаликса в плазме и структурными оценками эндотелия [18]. Хотя в большинстве исследований сообщалось об увеличении продуктов гликокаликса в плазме, структурные оценки с использованием методов визуализации показали, что истончение эндотелиального гликокаликса не всегда соответствует повышенным концентрациям компонентов гликокаликса в плазме, и не было обнаружено никаких доказательств, подтверждающих идею о том, что проницаемость капилляров действительно увеличивается при увеличении уровней фрагментов гликокаликса в плазме (Fig. 1).
Гемостаз
Система гемостаза играет важную роль в первичном иммунном ответе. Активация коагуляции является быстрым механизмом ограничения и нейтрализации инфекционных агентов внутри сгустков, и этот процесс происходит как в тканях, так и в кровотоке. Патогены выработали факторы, которые специально нацелены на пути коагуляции [19]. Например, некоторые микроорганизмы обладают способностью растворять фибриновые сгустки посредством ферментативной активности, тогда как другие могут ингибировать агрегацию тромбоцитов [20]. Чрезмерная и нерегулируемая активация путей коагуляции, связанная с недостатками механизмов деградации фибрина, вызывает избыточную продукцию тромбина, что является ключевым фактором в развитии коагулопатии, вызванной сепсисом (SIC) [21]. Фибринолиз характеризуется активацией фибринсвязанного плазминогена в плазмин тканевым активатором плазминогена (t-PA) и, в меньшей степени, урокиназой (u-PA). Затем фибрин расщепляется плазмином, в результате чего высвобождаются специфические продукты распада фибрина, включая D-димер [22].
Генерация плазмина в основном контролируется ингибитором активатора плазминогена (PAI-1) и ингибитором активируемого тромбином фибринолиза (TAFI) в присутствии тромбомодулина [23]. Хотя патогенез остается практически неизвестным, в нескольких исследованиях было отмечено, что у пациентов с сепсисом, индуцирующим ДВС, наблюдается дефект фибринолиза, что обусловлено увеличением PAI-1 (секретируемого эндотелиальными клетками и активированными тромбоцитами), активацией TAFI [24] и деградацией плазминогена нейтрофильной эластазой из NETs [25]. Системы контррегуляции также утратили свою эффективность. Концентрации в плазме естественных антикоагулянтов (протеина C, протеина S и антитромбина) снижаются при сепсисе. Ингибитор пути тканевого фактора (TFPI) ингибирует фибринолиз, взаимодействуя с факторами свертывания VII, X и TF, ограничивая активацию каскада свертывания [26].
Молниеносная пурпура, обычно связанная с менингококковыми и пневмококковыми инфекциями, широко рассматривается как архетип нарушения гемостаза при сепсисе, характеризующийся внутрисосудистым свертыванием, которое быстро развивается при ДВС-синдроме, сопровождающемся эпидермальным некрозом и воспалительным васкулитом [27]. Помимо своего влияния на коагуляцию, тромбоциты играют важную роль во врожденной иммунной системе и выделяют несколько агентов, которые напрямую способствуют активации нейтрофилов и привлекают лейкоциты через экспрессию P-селектина [28], который связывает нейтрофилы и моноциты с активированными тромбоцитами [29]. Они также экспрессируют TLR-4 и активируют альтернативные и классические пути комплемента напрямую через рецепторы связывания комплемента [30].
Система комплемента является ключевым регулятором иммунитета, который связывает врожденные и адаптивные реакции и способствует опсонизации и лизису патогенов. Каскад комплемента может быть активирован тремя путями путем вторжения патогенов через повреждение тканей и связанное с этим высвобождение DAMPs [31]. При сепсисе система комплемента играет защитную роль против бактериальных инфекций, но также может напрямую способствовать гипервоспалению, приводящему к полиорганной недостаточности. Далее анафилатоксины, активированные комплементом 3 (C3a) и активированным комплементом 5 (C5a), способствуют активации тромбоцитов, агрегации и высвобождению провоспалительных медиаторов [32] (Fig 1).
Клинические аспекты эндотелиальных и гемостатических нарушений, вызванных иммунной дисфункцией
В 2001 году Международное общество по тромбозу и гемостазу (ISTH) опубликовало определение и диагностические критерии явного ДВС-синдрома [33]. Хотя критерии явного ДВС-синдрома получили широкое признание, они были разработаны для диагностики окончательного (часто позднего или запущенного) ДВС-синдрома. Были высказаны предположения, что опора на эти критерии может привести к запоздалой диагностике ДВС-синдрома [34], при которой варианты лечения пациента, вероятно, будут неэффективными. Следовательно, ISTH выпустило еще один набор упрощенных диагностических критериев, разработанных для выявления ранней фазы ДВС-синдрома при сепсисе, то есть коагулопатии, вызванной сепсисом (SIC) [35]. SIC включает оценку органной недостаточности (SOFA) > 2, количество тромбоцитов и протромбиновое время, что делает его легко подсчитываемым у постели больного (Fig.. 2). Распространенность и смертность от SIC (с использованием определения «Сепсис-3») были изучены во вторичном анализе двух РКИ [36], в которых распространенность SIC составила 22,1% и 24,2% соответственно.

90-дневная смертность пациентов с SIC в исследовании HYPRESS (сепсис без шока) была значительно выше (почти вдвое), чем у пациентов без SIC (26,8% против 13,9%, p = 0,027). Хотя это РКИ было нацелено на относительно менее тяжелых пациентов, а число не выживших было небольшим (15 из 56 пациентов в группе SIC и 28 из 201 пациента в группе без SIC), исследование пришло к выводу, что SIC связан с более высокой смертностью и должен интерпретироваться как ранний предупреждающий признак неблагоприятного прогноза сепсиса. Chen et al. наблюдали равную дискриминационную способность SIC и DIC для 28-дневной смертности среди 452 пациентов [37], а Li et al. сообщили о сопоставимой прогностической точности оценок смертности в течение 28 дней по шкалам SIC и SOFA в проспективном исследовании, в котором приняли участие 209 пациентов [38].
Несмотря на широко признанную и тщательно документированную связь между активацией коагуляции и развитием дисфункции органов, образование стабильных микрососудистых тромбов, которое может привести к ишемии тканей и недостаточности органов, по-видимому, встречается у пациентов с сепсисом нечасто [39]. При аутопсии, проведенной у 51 человек, умершим от сепсиса или септического шока, только у трех из них были обнаружены микрососудистые тромбы [40], и только у одного человека были обнаружены микротромбы как в почках, так и в легких. Эти результаты позволяют предположить, что микрососудистый тромбоз может не быть значимым фактором в патогенезе сепсиса. Частота острого повреждения почек (AKI ) значительно различается в разных исследованиях, и White et al. [41] сообщили, что приблизительно 16% пациентов с сепсисом соответствовали критериям AKI; у половины из них была AKI 1-й стадии, а у 3% — AKI 3-й стадии (рис. 3).

Однако частота тяжелого AKI значительно увеличивалась при наличии ДВС-синдрома. Helmset al. [42] сообщили, что около половины пациентов с ДВС-синдромом, связанным с сепсисом, и шоком нуждались в заместительной почечной терапии, и эта доля была более чем в два раза выше по сравнению с пациентами без ДВС-синдрома (47,3% против 21,3%, p < 0,001). Другие отчеты также предполагали тесную связь между ДВС-синдромом и AKI и их связь с более плохими исходами [43]. Отличительная архитектура почечных сосудов, характеризующаяся наличием капилляров клубочков между афферентными и эфферентными артериолами, делает почку особенно восприимчивой к образованию микротромбов. Однако гистопатологические исследования выявили нормальную гистологию только с легкими неспецифическими изменениями почек как при человеческом, так и при AKI при сепсисе в эксперименте [44].
Оценка эндотелия/гемостаза и иммунной системы у постели больного
Эффективная помощь пациентам с сепсисом зависит от понимания базовых биологических механизмов, при этом дисфункция иммунной, эндотелиальной и гемостатической системы выделяются как важнейшие участники. Иммунный ответ включает в себя множество типов клеток и медиаторов [45]. Несмотря на доступность различных методов у постели больного, в настоящее время не существует единого биомаркера, который мог бы эффективно отражать общее функционирование иммунной системы [46]. Измерения цитокинов и других медиаторов должны быть более всеобъемлющими, чтобы обеспечить полное представление об активности иммунной системы и эндотелиальной дисфункции, и большинство доступных тестов требуют лучшей стандартизации. В частности, несколько исследований выявили выраженную вариабельность в комбинациях цитокинов у пациентов с септическим шоком [47, 48].
Тесты, оценивающие клеточную активность, дают больше информации, но также могут быть ограниченными. Эти тесты включают проточную цитометрию, исследование лимфоцитарных субпопуляций, соотношения CD4 + /CD8 +, главного комплекса гистосовместимости II (MHC II) (человеческий лейкоцитарный антиген-DR [HLA-DR]) экспрессию на антигенпрезентирующих клетках (APC), контрольные точки Т-клеток (белок программируемой клеточной смерти 1 [PD-1], лиганд программируемой смерти 1 [PD-L1] и цитотоксический Т-лимфоцитарный антиген 4 [CTLA-4]) и функциональные тесты для оценки пролиферативной способности, такие как активация Т-клеток через анти-CD28 или стимуляция in vitro мононуклеарных клеток периферической крови (PBMC) липополисахаридом или Escherichia coli для измерения продукции цитокинов (например, интерлейкина [IL]-6 и/или фактора некроза опухоли [TNF]) [49].
Простым способом выявления пациентов с риском иммуносупрессии является мониторинг абсолютного количества лимфоцитов. Если присутствует постоянная и необъяснимая лимфопения, следует рассмотреть возможность иммунной дисфункции и провести дополнительные тесты [50]. Поддержание целостности эндотелия имеет решающее значение для микроциркуляторного потока и доставки кислорода тканям, что соответствует главной цели интенсивной терапии. Клиническая оценка структуры и функции микроциркуляции улучшила наше понимание воздействия сепсиса на эндотелиальный гликокаликс, что может служить прогностическим инструментом и потенциально направлять будущие вмешательства. Микроскопия в темном поле с боковым потоком позволяет визуализировать in vivo нарушение гликокаликса, предлагая возможность определять фенотипически уникальные формы критических состояний, а также отображать микроскопические эффекты терапии в режиме реального времени [51].
Про-адреномедуллин (про-АДМ) является молекулой-предшественником адреномедуллина, пептидного гормона, участвующего в различных физиологических процессах, включая эндотелиальную и сосудистую функцию [52]. При сепсисе повышенные уровни про-АДМ могут указывать на эндотелиальную дисфункцию и тяжесть воспалительной реакции.
Такие уровни также связаны с повышенным риском смертности, что указывает на потенциальную полезность про-АДМ в качестве прогностического биомаркера [53]. Несколько других биомаркеров, включая растворимые факторы и клеточные маркеры, были предложены для оценки эндотелиальной целостности [54]. Среди них ангиопоэтин-1 и -2 и ангиопоэтин/тирозинкиназа с осью иммуноглобулин-подобного петлевого эпидермального фактора роста 2 (Tie2), по-видимому, являются перспективными биомаркерами для раннего выявления эндотелиального нарушения и могут быть важной терапевтической целью для предотвращения органной недостаточности [55].
Оценка дисфункции гемостаза у постели больного более проста. Как обсуждалось ранее, шкала ISTH явного ДВС-синдрома, созданная в 2001 году, стала золотым стандартом для диагностики ДВС-синдрома, но столкнулась с ограничениями из-за сложности и требований к ресурсам [33]. Следовательно, была разработана шкала SIC, позволяющая проводить раннюю диагностику ДВС-синдрома, связанного с сепсисом, с использованием легкодоступных биомаркеров и шкалы SOFA. Недавние рекомендации рекомендуют двухэтапный подход, сначала оценивая шкалу SIC у всех пациентов с сепсисом, а затем, при необходимости, шкалу ISTH, что помогает принимать терапевтические решения и проводить клинические испытания [35, 56]. Антитромбин и VWF были предложены в качестве потенциальных циркулирующих маркеров активации эндотелия [57]. Однако из-за их ограниченной доступности их использование в настоящее время ограничено. Следовательно, несмотря на свои ограничения, оценка SIC является простым и удобным в использовании инструментом скрининга для пациентов с высоким риском, а также для выявления случаев, в которых могут быть полезны индивидуальные стратегии антикоагулянтной терапии (хотя нет убедительных доказательств в поддержку их рутинного использования) [57–59].
Важно помнить, что тромбоцитопения очень распространена при сепсисе и имеет много причин, включая гемодилюцию, побочные эффекты лекарств (включая несколько часто используемых антибиотиков) и подавленный тромбопоэз [60]. Хотя связь между протромбином/международным нормализованным отношением (МНО) и кровотечением, тромбозом и смертью была непоследовательной в различных исследованиях, было последовательно продемонстрировано, что тяжелая тромбоцитопения связана с плохими результатами [61]. Существует значительный интерес к использованию тестов по месту оказания помощи, таких как тромбоэластография (TEG) и тромбоэластометрия, для диагностики нарушений коагуляции у пациентов с сепсисом. Эти тесты могут обнаружить гиперкоагуляцию, гипокоагуляцию и нарушенный фибринолиз, хотя никакой связи с кровотечением или тромбозом не было установлено [62]. Однако интерпретация результатов TEG/тромбоэластометрии (ROTEM ) сложна, а качество доказательств, подтверждающих полезность этих тестов для выявления SIC , по-прежнему считается низким [63].
Влияние стандартных вмешательств при сепсисе на взаимодействие систем
Инфузионная терапия вместе с антибиотикотерапией, контролем источника и вазопрессорами являются краеугольным камнем лечения сепсиса, особенно у пациентов с шоком. Два ключевых аспекта инфузионной терапии могут существенно повлиять на коагуляцию и эндотелиальный ответ: объем и тип вводимой жидкости. Основываясь на научно обоснованных рекомендациях, рекомендуется, чтобы после введения первого объема , дальнейшее введение жидкостей было тщательно сбалансировано с учетом потенциального риска и вреда, вызванного ее перегрузкой [64]. В частности, эти риски включают длительную искусственную вентиляцию легких, усугубление острого повреждения почек и повышенные показатели смертности. У пациентов с сепсисом чрезмерное введение жидкости связано с циркулирующими уровнями синдекана-1, маркера потери эндотелиального гликокаликса, что приводит к капиллярной утечке, отеку тканей и нарушению микроциркуляции [65].
Кроме того, перегрузка жидкостью при сепсисе связана с повышенным уровнем ангиопоэтина-2, что связано с эндотелиальной дисфункцией и повышенной проницаемостью [66]. Чрезмерное введение жидкости может "разбавлять" факторы свертывания и тромбоциты, тем самым усугубляя коагулопатию, вызванную сепсисом. Несмотря на априорную привлекательность консервативных стратегий объемов жидкости, аналогичных тем, которые применяются при геморрагическом шоке, клинических доказательств, подтверждающих их превосходство над более либеральными подходами, по-прежнему не хватает [67]. Кристаллоиды (сбалансированные, а не нормальные солевые растворы) в настоящее время рекомендуются в качестве растворов первой линии для пациентов с сепсисом, поскольку на сегодняшний день отсутствуют явные клинические преимущества и некоторые сигналы о вреде при введении коллоидов по сравнению с кристаллоидами [64, 68].
В периоперационном периоде, но не у пациентов в критическом состоянии, использование гидроксиэтилкрахмалов по сравнению с кристаллоидами или альбумином было связано с повышенной кровопотерей из-за снижения коагуляционной компетентности, оцененной с помощью ТЭГ [69]. Однако провоспалительные и прокоагулянтные эффекты кристаллоидных растворов по сравнению с коллоидами наблюдались на животных моделях [70, 71]. Аналогичным образом, исследования на животных моделях и у пациентов с сепсисом продемонстрировали, что использование кристаллоидов связано с большим отторжением гликокаликса и потерей целостности, чем синтетические (например, крахмалы) или натуральные (например, альбумин) коллоиды [70, 72]. Использование альбумина, по-видимому, больше защищает эндотелий благодаря нескольким неонкотическим свойствам, таким как антиоксидантная активность и электрическая и химическая защита поверхностного слоя эндотелия со стабилизацией проницаемости, лейкоцитарным роллингом и адгезией [64]. Кроме того, альбумин может оказывать специфическое противовоспалительное и иммуномодулирующее действие при сепсисе. Эти потенциальные защитные эффекты альбумина не были подтверждены снижением смертности в крупных рандомизированных исследованиях; таким образом, использование альбумина в качестве инфузионной терапии предлагается только для пациентов с сепсисом, которым требуются большие объемы кристаллоидов [73].
В целом, влияние жидкостей на пути коагуляции и эндотелиальные клетки при сепсисе широко распространено, и необходимы дальнейшие исследования для определения оптимальных стратегий управления инфузионной терапией для улучшения результатов у пациентов с сепсисом. Эндотелий высвобождает различные вазоактивные факторы. Это могут быть вазодилатирующие факторы, такие как оксид азота (NO), простациклин и гиперполяризующие факторы, полученные из эндотелия, или вазоконстрикторные факторы, такие как тромбоксан и эндотелин-1 [74]. При сепсисе повышенная продукция NO связана с развитием вазоплегии, дисфункцией миокарда, снижением чувствительности к адренергическим стимулам, прямой клеточной токсичностью и биоэнергетической недостаточностью. Поэтому были разработаны потенциальные подходы к модуляции продукции NO при сепсисе [75]. В настоящее время в клинической практике несколько вазопрессоров со специфическими рецепторами на эндотелиальном уровне используются в мультимодальном подходе.
Норэпинефрин является вазопрессором первой линии, рекомендуемым для пациентов с сепсисом, и оказывает адренергическую активность с выраженным α1-агонизмом, умеренным β1-агонизмом и минимальным воздействием на β2-адренергические рецепторы. Использование вазопрессина в сочетании с норадреналином является обычной практикой для минимизации негативных последствий, связанных с высокими уровнями катехоламинов. Это связано с фармакодинамическими свойствами вазопрессина как эндогенного гормона, который действует на эндотелиальные рецепторы V1a, V1b и V2, и его потенциальными защитными эффектами на функцию почек и снижением возникновения сердечных аритмий. Ангиотензин II, по-видимому, является многообещающим и безопасным некатехоламиновым вазопрессором, что продемонстрировано как в экспериментальных моделях, так и в клинике [76]. Интересно, что в моделях на животных ангиотензин II, по-видимому, усиливает иммунный ответ при сепсисе [77], тогда как норадреналин и вазопрессин оказывают преимущественно противовоспалительное действие, которое способствует иммунопараличу [78].
Терапевтические цели и текущие данные для конкретных вмешательств, направленных на нерегулируемый ответ хозяина
Нерегулируемые пути сепсиса, рассмотренные ранее в этой статье, могут обеспечить потенциальные терапевтические цели, начиная от вмешательств, направленных на нерегулируемую функцию иммунных клеток, до более нисходящих эффектов, включая измененный гемостаз и потерю целостности сосудистого барьера. Следовательно, проведено несколько исследований вмешательств, направленные на иммунологические, эндотелиальные игемостатические нерегулируемые ответы (Table 1).

Иммуновоспалительный путь
Стероиды широко рассматривались для использования при сепсисе из-за их широкого воздействия на воспалительный ответ хозяина. Известно, что у пациентов с сепсисом стероиды снижают высвобождение провоспалительных факторов, таких как ИЛ-1 и ИЛ-6, протеолитические ферменты, реактивные формы кислорода и азота и другие цитокины. Считается, что эти эффекты частично объясняются их способностью стабилизировать клеточные мембраны, включая лизосомальные [79].
Более того, стероиды могут поддерживать целостность эндотелиальных клеток, по-видимому, снижают проницаемость сосудов и повышают чувствительность кровеносных сосудов к катехоламинам за счет активации адренергических рецепторов [80, 81]. Важно признать, что воздействие на иммунную систему часто зависит от дозы. В частности, было показано, что низкие дозы кортикостерона усиливают воспалительную реакцию макрофагов, активированных липополисахаридом, в то время как более высокие дозы, снижают эту реакцию [82]. Эффекты низких доз гидрокортизона у пациентов с септическим шоком были оценены в нескольких РКИ с различными результатами [83, 84].
Самый последний метаанализ, включающий 17 испытаний с более чем 7000 пациентов, показал, что гидрокортизон не оказал значительного влияния на 90-дневную смертность или большинство вторичных результатов, за исключением увеличения дней без вазопрессоров [85]. Неблагоприятные события, такие как суперинфекция, гипергликемия и гастродуоденальное кровотечение, не были значительно связаны с использованием гидрокортизона. Использование стероидов также исследовалось у пациентов с тяжелой внебольничной пневмонией (CAP) [86, 87]. Хотя многочисленные испытания продемонстрировали положительное влияние стероидной терапии на снижение прогрессирования до искусственной вентиляции легких при тяжелой CAP, влияние этой терапии на смертность остается неопределенным [88].
Кроме того, использование стероидов при дыхательной недостаточности, вызванной вирусом гриппа, связано с более высоким риском смерти [89]. Недавнее руководство, основанное на фактических данных, от Society of Critical Care Medicine рекомендовало использовать стероиды со средней степенью доказательности в течение 5–7 дней в суточной дозе < 400 мг внутривенного гидрокортизона или эквивалента у госпитализированных пациентов с тяжелой внебольничной пневмонией [90]. Было разработано и испытано несколько методов лечения, нацеленных на специфические иммунные медиаторы, у пациентов с сепсисом. Большинство из них были нацелены на избыточную продукцию цитокинов в результате связывания патоген-ассоциированных молекулярных паттернов с клеточными рецепторами, такими как TLR, которые инициируют быстрый синтез и высвобождение провоспалительных цитокинов. Однако исследование, направленное на ингибирование процесса сигнализации TLR-4 и, таким образом, продукции TNF-α, IL-1 и IL-6, не показало улучшения смертности или более низкой активности цитокинов, несмотря на предыдущие многообещающие результаты в мышиных моделях [91].
Хотя анакинра, рекомбинантный антагонист рецептора ИЛ-1, не показал никакого эффекта в нестратифицированной популяции пациентов с сепсисом, анализ подгрупп пациентов, леченных анакинрой, с признаками синдрома активации макрофагов показал снижение 28-дневной смертности [92]. Более новый агент, нангиботид, ингибитор растворимого TREM-1 (триггерный рецептор, экспрессируемый на миелоидных клетках 1), трансмембранного белка, высвобождаемого в результате эндотелиального повреждения и считающегося неотъемлемой частью повреждающего воспалительного ответа, наблюдаемого в случаях гипервоспаления при сепсисе, показал многообещающие результаты в клиническом исследовании фазы 2b [93], а исследование фазы 3 находится в стадии разработки.
Внутривенные иммуноглобулины (IVIG) ранее предлагались в качестве адъювантной терапии при сепсисе, однако доказательства не были убедительными, и в рекомендациях Surviving SepsisCampaign 2021 года было высказано мнение об отказе от их использования при сепсисе [64]. Однако было продемонстрировано, что обогащенный IgM IVIG играет решающую роль в иммунной модуляции B/T-клеток, и он и продемонстрировал потенциал для снижения смертности в объединенном анализе. Тем не менее, его эффект, как правило, менее последователен в исследованиях адекватного качества [94].
Эндотелий и пути гемостаза
Вмешательства, которые напрямую воздействуют на эндотелий и либо восстанавливают вызванное сепсисом повреждение, либо ослабляют эндотелиальную дисфункцию, в настоящее время находятся на поздней стадии испытаний. Например, альбумин изучался как возможное средство восстановления поврежденного эндотелиального гликокаликса, а энибарцимаб, не нейтрализующее моноклональное антитело, нацеленное на адреномедуллин, как полагают, потенциально снижает вызванную сепсисом вазодилатацию и эндотелиальную утечку [95]. Также потенциальный интерес представляют ингибиторы тирозинкиназы, такие как иматиниб, которые, как было обнаружено, уменьшают сосудистую утечку при идиопатическом синдроме сосудистой утечки [96].
Вмешательства также могут быть направлены на нерегулируемый гемостаз. Одним из самых ранних антикоагулянтных вмешательств, испытанных при сепсисе, был гепарин, который не показал положительного эффекта в рандомизированном исследовании [97]. Несмотря на потребление физиологических антикоагулянтов, таких как активированный протеин С, антитромбин и ингибиторы пути тканевого фактора, и многообещающие результаты реальных данных и первоначальных исследований [98], крупные рандомизированные исследования не смогли показать никакого преимущества в выживании от приема антикоагулянтов, но вместо этого увеличили случаи кровотечения [99–101]. Опасения, высказанные по поводу неудач испытаний, исследующих иммунофокусированные стратегии, напрямую применимы к испытаниям, исследующим гемостатические вмешательства. Большинство этих испытаний имели те же недостатки, поскольку они включали пациентов с сепсисом или септическим шоком независимо от наличия SIC/DIC, что означает, что многие пациенты получали антикоагулянтное лечение, хотя у них не было характерных признаков SIC или DIC.
Совсем недавно рекомбинантный человеческий тромбомодулин также не продемонстрировал никакого снижения показателей смертности, хотя тенденция к улучшению наблюдалась у пациентов с исходной коагулопатией и у тех, кто не получал сопутствующую тромбопрофилактику гепарином [102, 103]. Интересно, что в это исследование были включены только пациенты с признаками SIC в то время, но, в частности, не удалось определить надлежащее временное окно, поскольку у 20% пролеченных пациентов состояние улучшилось к моменту начала лечения, и у них больше не было SIC. Помимо отбора пациентов, другие факторы могли потенциально объяснить неудачу исследований антикоагулянтов, такие как время начала лечения, дозировка и продолжительность приема антикоагулянтов. Кроме того, использование 28-дневной смертности в качестве первичной конечной точки в рандомизированных контролируемых исследованиях может быть нецелесообразным, поскольку на него могут влиять многочисленные факторы, выходящие за рамки антикоагулянтной терапии.
Более подходящими конечными точками были бы разрешение ДВС-синдрома и улучшение дисфункции органов. Например, было проведено клиническое исследование фазы 3 для оценки эффективности рекомбинантного тромбомодулина при различных причинах ДВС-синдрома, причем разрешение ДВС было первичной конечной точкой [104]. Результаты исследования продемонстрировали превосходное разрешение ДВС-синдрома в группе тромбомодулина по сравнению с контрольной группой гепарина (66,1% против 49,9%; разница 16,2%, 95% доверительный интервал [ДИ] 3,3–29,1), и это привело к одобрению рекомбинантного тромбомодулина для лечения ДВС-синдрома в Японии.
Разработка методов лечения для управления гипервоспаления, вызванным системой комплемента, открывает большие перспективы для снижения риска полиорганной дисфункции, связанной с сепсисом. Обнадёживает то, что доклинические испытания продемонстрировали потенциальные преимущества ингибирующих стратегий у нечеловекообразных приматов и свиней, с уменьшением частоты недостаточности органов, коагулопатии и даже улучшением выживаемости [105, 106]. Интересно, что терапевтический плазмаферез при септическом шоке может иметь потенциал для модуляции различных аспектов, включая отмирание гликокаликса и коагулопатию, в одном вмешательстве [16]. В совокупности возможны несколько потенциальных стратегий, большинство из которых заслуживают дальнейшего исследования. Кроме того, предварительная стратификация и определение адекватного временного окна для надлежащего лечения являются обязательными должны быть мотивацией для новых клинических испытаний.
Выводы
Точные механизмы, лежащие в основе сепсиса, септического шока и полиорганной недостаточности, остаются частично понятыми. Одним из потенциальных факторов является распространение бактерий, которые могут напрямую повреждать органы и вырабатывать токсины, конкурирующие за одни и те же субстраты. Другим возможным фактором является активация врожденной иммунной системы, приводящая к нарушению регуляции как гуморального, так и клеточного иммунитета. Эти изменения могут влиять на коагуляцию и эндотелиальную функцию, приводя к сепсис-индуцированной дисфункции эндотелия и гемостаза. Нарушенное взаимодействие между этими тремя системами может объяснить, почему локализованный источник инфекции, такой как обструктивный пиелонефрит, может приводить к осложнениям, таким как острый респираторный дистресс-синдром, измененный уровень сознания, шок и AKI . Вызванная сепсисом иммунная, эндотелиальная и дисфункция гемостаза представляет собой сегмент более обширной и сложной дисрегуляционной системы, которая завершается органной недостаточностью после инфекции. Понимание этого единого механизма полиорганной недостаточности может позволить разработать новые тесты и терапевтические мишени для решения проблем нарушения коагуляции и эндотелиальной дисфункции.
References
1. Shankar-Hari M, Phillips GS, Levy ML, Seymour CW, Liu VX, Deutschman CS et al (2016) Developing a New Definition and Assessing New Clinical Criteria for Septic Shock: For the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 315:775–787. https:// doi. org/ 10. 1001/ jama. 2016. 0289
2. Shankar-Hari M, Calandra T, Soares MP, Bauer M, Wiersinga WJ, Prescott HC, et al. Reframing sepsis immunobiology for translation: towards informative subtyping and targeted immunomodulatory therapies. The Lancet Respiratory Medicine 2024;0. https:// doi. org/10. 1016/ S2213-2600(23) 00468-X.
3. Engelmann B, Massberg S (2013) Thrombosis as an intravascular effector of innate immunity. Nat Rev Immunol 13:34–45. https:// doi.org/ 10. 1038/ nri33 45
4. Iba T, Helms J, Levi M, Levy JH (2024) Thromboinflammation in acute injury: infections, heatstroke, and trauma. J Thromb Haemost 22:7–22. https:// doi. org/ 10. 1016/j. jtha. 2023. 07. 020
5. Helms J, Iba T, Connors JM, Gando S, Levi M, Meziani F et al (2023) How to manage coagulopathies in critically ill patients. Intensive Care Med 49:273–290. https:// doi. org/ 10. 1007/ s00134-023-06980-6
6. Brinkmann V, Reichard U, Goosmann C, Fauler B, Uhlemann Y, Weiss DS et al (2004) Neutrophil extracellular traps kill bacteria. Science 303:1532–1535. https:// doi. org/ 10. 1126/ scien ce. 10923 85
7. Meziani F, Delabranche X, Asfar P, Toti F (2010) Bench-to-bedside review: circulating microparticles—a new player in sepsis? Crit Care 14:236. https:// doi. org/ 10. 1186/ cc9231
8. Zhang Y, Meng H, Ma R, He Z, Wu X, Cao M et al (2016) Circulating microparticles, blood cells, and endothelium induce procoagulant activity in sepsis through phosphatidylserine exposure. Shock45:299–307. https:// doi. org/ 10. 1097/ SHK. 00000 00000 000509
9. Stiel L, Meziani F, Helms J (2018) Neutrophil Activation During Septic Shock. Shock 49:371–384. https:// doi. org/ 10. 1097/ SHK. 00000 00000000980
10. Robinson N, Ganesan R, Hegedűs C, Kovacs K, Kufer TA, Virag L (2019)
Programmed necrotic cell death of macrophages: Focus on pyroptosis, necroptosis, and parthanatos. Redox Biol 26:101239. https:// doi.org/ 10. 1016/j. redox. 2019. 101239
11. Duprez L, Takahashi N, Van Hauwermeiren F, Vandendriessche B,Goossens V, Vanden Berghe T et al (2011) RIP kinase-dependent necrosis drives lethal systemic inflammatory response syndrome. Immunity 35:908–918. https:// doi. org/ 10. 1016/j. immuni. 2011. 09. 020
12. Aird WC (2003) The role of the endothelium in severe sepsis and multiple organ dysfunction syndrome. Blood 101:3765–3777. https:// doi.org/ 10. 1182/ blood-2002-06-1887
13. Pape T, Hunkemoller AM, Kumpers P, Haller H, David S, Stahl K (2021)
Targeting the “sweet spot” in septic shock - A perspective on the endothelial glycocalyx regulating proteins Heparanase-1 and -2. Matrix Biol Plus 12:100095. https:// doi. org/ 10. 1016/j. mbplus. 2021. 100095
14. Iba T, Levy JH (2019) Derangement of the endothelial glycocalyx in sepsis. J Thromb Haemost 17:283–294. https:// doi. org/ 10. 1111/ jth. 14371
15. Delabranche X, Helms J, Meziani F (2017) Immunohaemostasis: a new view on haemostasis during sepsis. Ann Intensive Care 7:117. https://doi. org/ 10. 1186/ s13613-017-0339-5
16. Stahl K, Schmidt JJ, Seeliger B, Schmidt BMW, Welte T, Haller H et al (2020) Effect of therapeutic plasma exchange on endothelial activation and coagulation-related parameters in septic shock. Crit Care 24:71.https:// doi. org/ 10. 1186/ s13054-020-2799-5
17. Yipp BG, Kubes P (2013) NETosis: how vital is it? Blood 122:2784–2794.https:// doi. org/ 10. 1182/ blood-2013-04-457671
18. Hahn RG, Patel V, Dull RO (2021) Human glycocalyx shedding: Systematic
review and critical appraisal. Acta Anaesthesiol Scand 65:590–606. https:// doi. org/ 10. 1111/ aas. 13797
19. Minasyan H, Flachsbart F (2019) Blood coagulation: a powerful bactericidal
mechanism of human innate immunity. Int Rev Immunol 38:3–17. https:// doi. org/ 10. 1080/ 08830 185. 2018. 15330 09
20. Sun H, Ringdahl U, Homeister JW, Fay WP, Engleberg NC, Yang AY et al
(2004) Plasminogen is a critical host pathogenicity factor for group A streptococcal infection. Science 305:1283–1286. https:// doi. org/ 10.1126/ scien ce. 11012 45
21. van der Poll T, Herwald H (2014) The coagulation system and its function
in early immune defense. Thromb Haemost 112:640–648. https://doi. org/ 10. 1160/ TH14-01-0053
22. Angles-Cano E (1994) Overview on fibrinolysis: plasminogen activation
pathways on fibrin and cell surfaces. Chem Phys Lipids 67–68:353–362.https:// doi. org/ 10. 1016/ 0009-3084(94) 90157-0
23. Morser J, Gabazza EC, Myles T, Leung LLK (2010) What has been learnt from the thrombin-activatable fibrinolysis inhibitor-deficient mouse? J Thromb Haemost 8:868–876. https:// doi. org/ 10. 1111/j. 1538-7836. 2010.03787.x
24. Zeerleder S, Schroeder V, Hack CE, Kohler HP, Wuillemin WA (2006) TAFI
and PAI-1 levels in human sepsis. Thromb Res 118:205–212. https:// doi.
org/ 10. 1016/j. throm res. 2005. 06. 007
25. da Cruz DB, Helms J, Aquino LR, Stiel L, Cougourdan L, Broussard C et al
(2019) DNA-bound elastase of neutrophil extracellular traps degrades plasminogen, reduces plasmin formation, and decreases fibrinolysis: proof of concept in septic shock plasma. FASEB J 33:14270–14280. https:// doi. org/ 10. 1096/ fj. 20190 1363R RR
26. Mast AE, Ruf W (2022) Regulation of coagulation by tissue factor pathway
inhibitor: Implications for hemophilia therapy. J Thromb Haemost 20:1290–1300. https:// doi. org/ 10. 1111/ jth. 15697
27. Chalmers E, Cooper P, Forman K, Grimley C, Khair K, Minford A et al
(2011) Purpura fulminans: recognition, diagnosis and management. Arch Dis Child 96:1066–1071. https:// doi. org/ 10. 1136/ adc. 2010. 199919
28. Ed Rainger G, Chimen M, Harrison MJ, Yates CM, Harrison P, Watson SP,et al. The role of platelets in the recruitment of leukocytes during vascular disease. Platelets 2015;26:507–20. https:// doi. org/ 10. 3109/ 09537 104.2015. 10648 81.
29. Lorant DE, Topham MK, Whatley RE, McEver RP, McIntyre TM, Prescott
SM et al (1993) Inflammatory roles of P-selectin. J Clin Invest 92:559–570. https:// doi. org/ 10. 1172/ JCI11 6623
30. Peerschke EIB, Yin W, Ghebrehiwet B (2008) Platelet mediated complement
activation. Adv Exp Med Biol 632:81–91. https:// doi. org/ 10. 1007/978-0-387-78952-1_7
31. Merle NS, Church SE, Fremeaux-Bacchi V, Roumenina LT (2015) Complement System Part I - Molecular Mechanisms of Activation and Regulation.
Front Immunol 6:262. https:// doi. org/ 10. 3389/ fimmu. 2015. 00262
32. Esmon CT (2004) The impact of the inflammatory response on coagulation.
Thromb Res 114:321–327. https:// doi. org/ 10. 1016/j. throm res. 2004.06. 028
33. Taylor FB, Toh CH, Hoots WK, Wada H, Levi M, Scientific Subcommittee
on Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost 2001;86:1327–30.
34. Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K et al (2006) A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med 34:625–631. https:// doi. org/ 10. 1097/ 01. ccm.00002 02209. 42491. 38
35. Iba T, Levy JH, Yamakawa K, Thachil J, Warkentin TE, Levi M et al (2019)
Proposal of a two-step process for the diagnosis of sepsis-induced disseminated
intravascular coagulation. J Thromb Haemost 17:1265–1268.https:// doi. org/ 10. 1111/ jth. 14482
36. Schmoch T, Mohnle P, Weigand MA, Briegel J, Bauer M, Bloos F et al (2023) The prevalence of sepsis-induced coagulopathy in patients with sepsis - a secondary analysis of two German multicenter randomized controlled trials. Ann Intensive Care 13:3. https:// doi. org/ 10. 1186/s13613-022-01093-7
37. Chen Y, Chen W, Ba F, Zheng Y, Zhou Y, Shi W et al (2023) Prognostic
Accuracy of the Different Scoring Systems for Assessing Coagulopathy in Sepsis: A Retrospective Study. Clin Appl Thromb Hemost 29:10760296231207630. https:// doi. org/ 10. 1177/ 10760 29623 12076 30
38. Li J, Liu H, Wang N, Wang F, Shang N, Guo S et al (2024) Persistent high
sepsis-induced coagulopathy and sequential organ failure assessment scores can predict the 28-day mortality of patients with sepsis: A prospective study. BMC Infect Dis 24:282. https:// doi. org/ 10. 1186/s12879-024-09154-x
39. Lerolle N, Nochy D, Guerot E, Bruneval P, Fagon J-Y, Diehl J-L et al (2010)
Histopathology of septic shock induced acute kidney injury: apoptosis and leukocytic infiltration. Intensive Care Med 36:471–478. https:// doi.org/ 10. 1007/ s00134-009-1723-x
40. Tani VM, Assis-Mendonca GR, da Silva TB, Rogerio F, De Paula EV (2017)
Microvascular thrombosis in sepsis: An autopsy study. Thromb Res 156:23–25. https:// doi. org/ 10. 1016/j. throm res. 2017. 05. 031
41. White KC, Serpa-Neto A, Hurford R, Clement P, Laupland KB, See E, et al. Sepsis-associated acute kidney injury in the intensive care unit: incidence, patient characteristics, timing, trajectory, treatment, and associated outcomes. A multicenter, observational study. Intensive Care Med 2023;49:1079–89. https:// doi. org/ 10. 1007/ s00134-023-07138-0.
42. Helms J, Merdji H, Loewert S, Severac F, Monnier A, Kaurin J et al (2023)
Disseminated intravascular coagulation is strongly associated with severe acute kidney injury in patients with septic shock. Ann Intensive Care 13:119. https:// doi. org/ 10. 1186/ s13613-023-01216-8
43. Seymour CW, Kennedy JN, Wang S, Chang C-CH, Elliott CF, Xu Z, et al.
Derivation, Validation, and Potential Treatment Implications of Novel Clinical Phenotypes for Sepsis. JAMA 2019;321:2003–17. https:// doi. org/10. 1001/ jama. 2019. 5791.
44. Langenberg C, Bagshaw SM, May CN, Bellomo R (2008) The histopathology
of septic acute kidney injury: a systematic review. Crit Care 12:R38. https:// doi. org/ 10. 1186/ cc6823
45. Torres LK, Pickkers P, van der Poll T (2022) Sepsis-Induced Immunosuppression. Annu Rev Physiol 84:157–181. https:// doi. org/ 10. 1146/ annurev-physi ol-061121-040214
46. Cajander S, Kox M, Scicluna BP, Weigand MA, Mora RA, Flohe SB et al (2024) Profiling the dysregulated immune response in sepsis: overcoming challenges to achieve the goal of precision medicine. Lancet Respir Med 12:305–322. https:// doi. org/ 10. 1016/ S2213-2600(23) 00330-2
47. Bozza FA, Salluh JI, Japiassu AM, Soares M, Assis EF, Gomes RN et al (2007) Cytokine profiles as markers of disease severity in sepsis: a multiplex analysis. Crit Care 11:R49. https:// doi. org/ 10. 1186/ cc5783
48. Russell JA, Fjell C, Hsu JL, Lee T, Boyd J, Thair S et al (2013) Vasopressin
compared with norepinephrine augments the decline of plasma cytokine levels in septic shock. Am J Respir Crit Care Med 188:356–364.https:// doi. org/ 10. 1164/ rccm. 201302-0355OC
49. Venet F, Monneret G (2018) Advances in the understanding and treatment of sepsis-induced immunosuppression. Nat Rev Nephrol 14:121–137. https:// doi. org/ 10. 1038/ nrneph. 2017. 165
50. Grimaldi D, Pradier O, Hotchkiss RS, Vincent J-L (2017) Nivolumab plus
interferon-γ in the treatment of intractable mucormycosis. Lancet Infect Dis 17:18. https:// doi. org/ 10. 1016/ S1473-3099(16) 30541-2
51. Cusack R, Leone M, Rodriguez AH, Martin-Loeches I (2022) Endothelial
Damage and the Microcirculation in Critical Illness. Biomedicines 10:3150. https:// doi. org/ 10. 3390/ biome dicin es101 23150
52. Hinson JP, Kapas S, Smith DM (2000) Adrenomedullin, a multifunctional
regulatory peptide. Endocr Rev 21:138–167. https:// doi. org/ 10. 1210/edrv. 21.2. 0396
53. Valenzuela-Sanchez F, Valenzuela-Mendez B, Rodriguez-Gutierrez JF,
Estella-Garcia A, Gonzalez-Garcia MA. New role of biomarkers: midregional
pro-adrenomedullin, the biomarker of organ failure. Ann Transl Med 2016;4:329. https:// doi. org/ 10. 21037/ atm. 2016. 08. 65.
54. Fang Y, Li C, Shao R, Yu H, Zhang Q (2018) The role of biomarkers of
endothelial activation in predicting morbidity and mortality in patients with severe sepsis and septic shock in intensive care: A prospective observational study. Thromb Res 171:149–154. https:// doi. org/ 10.1016/j. throm res. 2018. 09. 059
55. Chi Y, Yu S, Yin J, Liu D, Zhuo M, Li X (2024) Role of Angiopoietin/Tie2
System in Sepsis: A Potential Therapeutic Target. Clin Appl Thromb Hemost 30:10760296241238010. https:// doi. org/ 10. 1177/ 10760 29624 12380 10
56. Iba T, Nisio MD, Levy JH, Kitamura N, Thachil J (2017) New criteria for sepsis-induced coagulopathy (SIC) following the revised sepsis definition: a retrospective analysis of a nationwide survey. BMJ Open 7:e017046. https:// doi. org/ 10. 1136/ bmjop en-2017-017046
57. Iba T, Levy JH, Thachil J, Susen S, Levi M, Scarlatescu E (2023) Communication from the Scientific Standardization Committees of the
International Society on Thrombosis and Haemostasis on vascular endothelium-related biomarkers in disseminated intravascular coagulation. J Thromb Haemost 21:691–699. https:// doi. org/ 10. 1016/j. jtha. 2022.11. 032
58. Vincent JL, Francois B, Zabolotskikh I, Daga MK, Lascarrou JB, Kirov MY
et al (2019) Effect of a Recombinant Human Soluble Thrombomodulin on Mortality in Patients with Sepsis-Associated Coagulopathy: The SCARLET Randomized Clinical Trial. JAMA - Journal of the American Medical Association 321:1993–2002. https:// doi. org/ 10. 1001/ jama. 2019.5358
59. Levi M, Vincent J-L, Tanaka K, Radford AH, Kayanoki T, Fineberg DA et al (2020) Effect of a Recombinant Human Soluble Thrombomodulin on Baseline Coagulation Biomarker Levels and Mortality Outcome in Patients With Sepsis-Associated Coagulopathy. Crit Care Med 48:1140–1147. https:// doi. org/ 10. 1097/ CCM. 00000 00000 004426
60. Greinacher A, Selleng S (2016) How I evaluate and treat thrombocytopenia
in the intensive care unit patient. Blood 128:3032–3042. https://doi. org/ 10. 1182/ blood-2016-09-693655
61. Russell L, Madsen MB, Dahl M, Kampmann P, Perner A (2018) Prediction of bleeding and thrombosis by standard biochemical coagulation variables in haematological intensive care patients. Acta Anaesthesiol Scand 62:196–206. https:// doi. org/ 10. 1111/ aas. 13036
62. Davies GR, Lawrence M, Pillai S, Mills GM, Aubrey R, Thomas D et al (2018) The effect of sepsis and septic shock on the viscoelastic properties of clot quality and mass using rotational thromboelastometry: A prospective observational study. J Crit Care 44:7–11. https:// doi. org/ 10.1016/j. jcrc. 2017. 09. 183
63. Muller MC, Meijers JC, Vroom MB, Juffermans NP (2014) Utility of thromboelastography and/or thromboelastometry in adults with sepsis: a
systematic review. Crit Care 18:R30. https:// doi. org/ 10. 1186/ cc137 21
64. Evans L, Rhodes A, Alhazzani W, Antonelli M, Coopersmith CM, French
C et al (2021) Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med 47:1181–1247. https:// doi. org/ 10. 1007/ s00134-021-06506-y
65. Hippensteel JA, Uchimido R, Tyler PD, Burke RC, Han X, Zhang F et al (2019) Intravenous fluid resuscitation is associated with septic endothelial glycocalyx degradation. Crit Care 23:259. https:// doi. org/ 10. 1186/s13054-019-2534-2
66. Fisher J, Douglas JJ, Linder A, Boyd JH, Walley KR, Russell JA (2016)
Elevated Plasma Angiopoietin-2 Levels Are Associated With Fluid Overload, Organ Dysfunction, and Mortality in Human Septic Shock. Crit Care Med 44:2018–2027. https:// doi. org/ 10. 1097/ CCM. 00000 00000 001853
67. Sivapalan P, Ellekjaer KL, Jessen MK, Meyhoff TS, Cronhjort M, Hjortrup
PB et al (2023) Lower vs Higher Fluid Volumes in Adult Patients With Sepsis: An Updated Systematic Review With Meta-Analysis and Trial Sequential Analysis. Chest 164:892–912. https:// doi. org/ 10. 1016/j. chest.2023. 04. 036
68. Lewis SR, Pritchard MW, Evans DJ, Butler AR, Alderson P, Smith AF, et al.
Colloids versus crystalloids for fluid resuscitation in critically ill people.Cochrane Database Syst Rev 2018;8:CD000567. https:// doi. org/ 10. 1002/14651 858. CD000 567. pub7.
69. Rasmussen KC, Secher NH, Pedersen T (2016) Effect of perioperative crystalloid or colloid fluid therapy on hemorrhage, coagulation competence, and outcome: A systematic review and stratified meta-analysis. Medicine (Baltimore) 95:e4498. https:// doi. org/ 10. 1097/ MD. 00000 00000 004498
70. Kozek-Langenecker SA (2009) Influence of fluid therapy on the haemostatic
system of intensive care patients. Best Pract Res Clin Anaesthesiol 23:225–236. https:// doi. org/ 10. 1016/j. bpa. 2008. 11. 002
71. Kellum JA, Song M, Almasri E (2006) Hyperchloremic acidosis increases
circulating inflammatory molecules in experimental sepsis. Chest 130:962–967. https:// doi. org/ 10. 1378/ chest. 130.4. 962
72. Fernandez-Sarmiento J, Salazar-Pelaez LM, Acevedo L, Nino-Serna LF, Florez S, Alarcon-Forero L et al (2023) Endothelial and Glycocalyx Biomarkers in Children With Sepsis After One Bolus of Unbalanced or Balanced Crystalloids. Pediatr Crit Care Med 24:213–221. https:// doi.org/ 10. 1097/ PCC. 00000 00000 003123
73. Saravi B, Goebel U, Hassenzahl LO, Jung C, David S, Feldheiser A et al (2023) Capillary leak and endothelial permeability in critically ill patients: a current overview. Intensive Care Med Exp 11:96. https:// doi.org/ 10. 1186/ s40635-023-00582-8
74. Sandoo A, van Zanten JJCSV, Metsios GS, Carroll D, Kitas GD. The endothelium and its role in regulating vascular tone. Open Cardiovasc Med J 2010;4:302–12. https:// doi. org/ 10. 2174/ 18741 92401 00401 0302.
75. Lambden S (2019) Bench to bedside review: therapeutic modulation of nitric oxide in sepsis-an update. Intensive Care Med Exp 7:64. https://doi. org/ 10. 1186/ s40635-019-0274-x
76. Coloretti I, Genovese A, Teixeira JP, Cherian A, Ferrer R, Landoni G et al (2024) Angiotensin ii therapy in refractory septic shock: which patient can benefit most? A narrative review. J Anesth Analg Crit Care 4:13. https:// doi. org/ 10. 1186/ s44158-024-00150-w
77. Leisman DE, Privratsky JR, Lehman JR, Abraham MN, Yaipan OY, Brewer MR et al (2022) Angiotensin II enhances bacterial clearance via myeloid signaling in a murine sepsis model. Proc Natl Acad Sci U S A 119:e2211370119. https:// doi. org/ 10. 1073/ pnas. 22113 70119
78. Stolk RF, van der Poll T, Angus DC, van der Hoeven JG, Pickkers P, Kox M (2016) Potentially Inadvertent Immunomodulation: Norepinephrine Use in Sepsis. Am J Respir Crit Care Med 194:550–558. https:// doi. org/10. 1164/ rccm. 201604-0862CP
79. Heming N, Sivanandamoorthy S, Meng P, Bounab R, Annane D (2018) Immune Effects of Corticosteroids in Sepsis. Front Immunol 9:1736. https:// doi. org/ 10. 3389/ fimmu. 2018. 01736
80. Barabutis N, Khangoora V, Marik PE, Catravas JD (2017) Hydrocortisone
and Ascorbic Acid Synergistically Prevent and Repair Lipopolysaccharide-
Induced Pulmonary Endothelial Barrier Dysfunction. Chest 152:954–962. https:// doi. org/ 10. 1016/j. chest. 2017. 07. 014
81. Mansart A, Bollaert PE, Seguin C, Levy B, Longrois D, Mallie JP (2003) Hemodynamic effects of early versus late glucocorticosteroid administration
in experimental septic shock. Shock 19:38–44. https:// doi. org/10. 1097/ 00024 382-20030 1000-00008
82. Lim H-Y, Muller N, Herold MJ, van den Brandt J, Reichardt HM (2007) Glucocorticoids exert opposing effects on macrophage function dependent on their concentration. Immunology 122:47–53. https:// doi. org/ 10. 1111/j. 1365-2567. 2007. 02611.x
83. Venkatesh B, Finfer S, Cohen J, Rajbhandari D, Arabi Y, Bellomo R et al (2018) Adjunctive Glucocorticoid Therapy in Patients with Septic Shock. N Engl J Med 378:797–808. https:// doi. org/ 10. 1056/ NEJMo a1705 835
84. Annane D, Renault A, Brun-Buisson C, Megarbane B, Quenot J-P, Siami S et al (2018) Hydrocortisone plus Fludrocortisone for Adults with Septic Shock. N Engl J Med 378:809–818. https:// doi. org/ 10. 1056/ NEJMoa1705 716
85. Pirracchio R, Annane D, Waschka AK, Lamontagne F, Arabi YM, Bollaert
P-E, et al. Patient-Level Meta-Analysis of Low-Dose Hydrocortisone in
Adults with Septic Shock. NEJM Evid 2023;2:EVIDoa2300034. https:// doi.
org/ 10. 1056/ EVIDo a2300 034.
86. Torres A, Sibila O, Ferrer M, Polverino E, Menendez R, Mensa J et al (2015) Effect of corticosteroids on treatment failure among hospitalized patients with severe community-acquired pneumonia and high inflammatory response: a randomized clinical trial. JAMA 313:677–686.https:// doi. org/ 10. 1001/ jama. 2015. 88
87. Dequin P-F, Meziani F, Quenot J-P, Kamel T, Ricard J-D, Badie J et al (2023) Hydrocortisone in Severe Community-Acquired Pneumonia. N Engl J Med 388:1931–1941. https:// doi. org/ 10. 1056/ NEJMo a2215 145
88. Saleem N, Kulkarni A, Snow TAC, Ambler G, Singer M, Arulkumaran N (2023) Effect of Corticosteroids on Mortality and Clinical Cure in Community-Acquired Pneumonia: A Systematic Review, Meta-analysis, and Meta-regression of Randomized Control Trials. Chest 163:484–497.https:// doi. org/ 10. 1016/j. chest. 2022. 08. 2229
89. Lansbury L, Rodrigo C, Leonardi-Bee J, Nguyen-Van-Tam J, Lim WS. Corticosteroids as adjunctive therapy in the treatment of influenza. Cochrane Database Syst Rev 2019;2:CD010406. https:// doi. org/ 10. 1002/14651 858. CD010 406. pub3.
90. Chaudhuri D, Nei AM, Rochwerg B, Balk RA, Asehnoune K, Cadena R et al (2024) 2024 Focused Update: Guidelines on Use of Corticosteroids in Sepsis, Acute Respiratory Distress Syndrome, and Community-Acquired Pneumonia. Crit Care Med 52:e219–e233. https:// doi. org/ 10.1097/ CCM. 00000 00000 006172
91. Rice TW, Wheeler AP, Bernard GR, Vincent J-L, Angus DC, Aikawa N et al
(2010) A randomized, double-blind, placebo-controlled trial of TAK-242 for the treatment of severe sepsis. Crit Care Med 38:1685–1694. https://doi. org/ 10. 1097/ CCM. 0b013 e3181 e7c5c9
92. Shakoory B, Carcillo JA, Chatham WW, Amdur RL, Zhao H, Dinarello CA
et al (2016) Interleukin-1 Receptor Blockade Is Associated With Reduced
Mortality in Sepsis Patients With Features of Macrophage Activation Syndrome: Reanalysis of a Prior Phase III Trial. Crit Care Med 44:275–281. https:// doi. org/ 10. 1097/ CCM. 00000 00000 001402
93. Francois B, Lambden S, Fivez T, Gibot S, Derive M, Grouin J-M et al (2023)
Prospective evaluation of the efficacy, safety, and optimal biomarker enrichment strategy for nangibotide, a TREM-1 inhibitor, in patients with septic shock (ASTONISH): a double-blind, randomised, controlled, phase 2b trial. Lancet Respir Med 11:894–904. https:// doi. org/ 10. 1016/S2213-2600(23) 00158-3
94. Cui J, Wei X, Lv H, Li Y, Li P, Chen Z et al (2019) The clinical efficacy of
intravenous IgM-enriched immunoglobulin (pentaglobin) in sepsis or septic shock: a meta-analysis with trial sequential analysis. Ann Intensive Care 9:27. https:// doi. org/ 10. 1186/ s13613-019-0501-3
95. Laterre P-F, Pickkers P, Marx G, Wittebole X, Meziani F, Dugernier T et al
(2021) Safety and tolerability of non-neutralizing adrenomedullin antibody adrecizumab (HAM8101) in septic shock patients: the AdrenOSS-2 phase 2a biomarker-guided trial. Intensive Care Med 47:1284–1294. https:// doi. org/ 10. 1007/ s00134-021-06537-5
96. Aman J, Peters MJL, Weenink C, van Nieuw Amerongen GP, Vonk NA (2013) Reversal of vascular leak with imatinib. Am J Respir Crit Care Med 188:1171–1173. https:// doi. org/ 10. 1164/ rccm. 201301-0136LE
97. Jaimes F, De La Rosa G, Morales C, Fortich F, Arango C, Aguirre D et al (2009) Unfractioned heparin for treatment of sepsis: A randomized clinical trial (The HETRASE Study). Crit Care Med 37:1185–1196. https://doi. org/ 10. 1097/ CCM. 0b013 e3181 9c06bc
98. Tagami T, Matsui H, Horiguchi H, Fushimi K, Yasunaga H (2014) Antithrombin and mortality in severe pneumonia patients with sepsisassociated
disseminated intravascular coagulation: an observational nationwide study. J Thromb Haemost 12:1470–1479. https:// doi. org/ 10.1111/ jth. 12643
99. Ranieri VM, Thompson BT, Barie PS, Dhainaut J-F, Douglas IS, Finfer S et al (2012) Drotrecogin alfa (activated) in adults with septic shock. N Engl J Med 366:2055–2064. https:// doi. org/ 10. 1056/ NEJMo a1202 290
100. Warren BL, Eid A, Singer P, Pillay SS, Carl P, Novak I, et al. Caring for the critically ill patient. High-dose antithrombin III in severe sepsis: a randomized controlled trial. JAMA 2001;286:1869–78. https:// doi. org/10. 1001/ jama. 286. 15. 1869.
101. Abraham E, Reinhart K, Opal S, Demeyer I, Doig C, Rodriguez AL et al (2003) Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA 290:238–247. https:// doi. org/ 10. 1001/ jama. 290.2. 238
102. Vincent J-L, Francois B, Zabolotskikh I, Daga MK, Lascarrou J-B, Kirov MY
et al (2019) Effect of a Recombinant Human Soluble Thrombomodulin on Mortality in Patients With Sepsis-Associated Coagulopathy: The SCARLET Randomized Clinical Trial. JAMA 321:1993–2002. https:// doi.org/ 10. 1001/ jama. 2019. 5358
103. Francois B, Fiancette M, Helms J, Mercier E, Lascarrou J-B, Kayanoki T et al (2021) Efficacy and safety of human soluble thrombomodulin (ART-123) for treatment of patients in France with sepsis-associated coagulopathy: post hoc analysis of SCARLET. Ann Intensive Care 11:53.https:// doi. org/ 10. 1186/ s13613-021-00842-4
104. Saito H, Maruyama I, Shimazaki S, Yamamoto Y, Aikawa N, Ohno R et al
(2007) Efficacy and safety of recombinant human soluble thrombomodulin (ART-123) in disseminated intravascular coagulation: results of a phase III, randomized, double-blind clinical trial. J Thromb Haemost 5:31–41. https:// doi. org/ 10. 1111/j. 1538-7836. 2006. 02267.x
105. Silasi-Mansat R, Zhu H, Popescu NI, Peer G, Sfyroera G, Magotti P et al (2010) Complement inhibition decreases the procoagulant response and confers organ protection in a baboon model of Escherichia coli sepsis. Blood 116:1002–1010. https:// doi. org/ 10. 1182/ blood-2010-02-269746
106. Keshari RS, Silasi R, Popescu NI, Patel MM, Chaaban H, Lupu C et al (2017) Inhibition of complement C5 protects against organ failure and reduces mortality in a baboon model of Escherichia coli sepsis. Proc Natl Acad Sci U S A 114:E6390–E6399. https:// doi. org/ 10. 1073/ pnas. 17068 18114
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 09.04.2025 00:01:00
[ACTIVE_FROM] => 09.04.2025 00:01:00
[SHOW_COUNTER] => 303
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830890
[VALUE] => Сепсис, коагулопатия, ОРИТ
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Сепсис, коагулопатия, ОРИТ
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830891
[VALUE] => Понимание, оценка и лечение дисфункции иммунной и эндотелиальной системы и нарушений коагуляции при бактериальном сепсисе
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Понимание, оценка и лечение дисфункции иммунной и эндотелиальной системы и нарушений коагуляции при бактериальном сепсисе
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830892
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 830898
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 830893
[1] => 830894
[2] => 830895
[3] => 830896
[4] => 830897
)
[VALUE] => Array
(
[0] => sepsis
[1] => Koagulyatsiya
[2] => intensivnayaterapiya
[3] => kriticheskiesostoyaniya
[4] => statia
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
[1] => Koagulyatsiya
[2] => intensivnayaterapiya
[3] => kriticheskiesostoyaniya
[4] => statia
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830892
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 830898
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 830893
[1] => 830894
[2] => 830895
[3] => 830896
[4] => 830897
)
[VALUE] => Array
(
[0] => sepsis
[1] => Koagulyatsiya
[2] => intensivnayaterapiya
[3] => kriticheskiesostoyaniya
[4] => statia
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
[1] => Koagulyatsiya
[2] => intensivnayaterapiya
[3] => kriticheskiesostoyaniya
[4] => statia
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Сепсис
[1] => Коагуляция
[2] => Интенсивная терапия
[3] => Критические состояния
[4] => Статья
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 13.08.2025 01:26:24
[~TIMESTAMP_X] => 13.08.2025 01:26:24
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[FULLTEXT_INDEX] => N
[~FULLTEXT_INDEX] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Понимание, оценка и лечение дисфункции иммунной и эндотелиальной системы и нарушений коагуляции при бактериальном сепсисе
[BROWSER_TITLE] => Понимание, оценка и лечение дисфункции иммунной и эндотелиальной системы и нарушений коагуляции при бактериальном сепсисе
[KEYWORDS] => Сепсис, коагулопатия, ОРИТ
[DESCRIPTION] =>
)
)



