Array
(
[NAME] => Плазмообмен в отделении интенсивной терапии: описательный обзор
[~NAME] => Плазмообмен в отделении интенсивной терапии: описательный обзор
[PREVIEW_PICTURE] => Array
(
[ID] => 5851
[TIMESTAMP_X] => 11.11.2024 15:24:29
[MODULE_ID] => iblock
[HEIGHT] => 5000
[WIDTH] => 5000
[FILE_SIZE] => 11937981
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/44b/53gfu95g2prjqndjku9pqnus4u33srg0
[FILE_NAME] => 3d-render-medical-background-with-blood-cells.jpg
[ORIGINAL_NAME] => 3d-render-medical-background-with-blood-cells.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 3a69415207e958b17ac6cbb6ac6ba6b6
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/44b/53gfu95g2prjqndjku9pqnus4u33srg0/3d-render-medical-background-with-blood-cells.jpg
[UNSAFE_SRC] => /upload/iblock/44b/53gfu95g2prjqndjku9pqnus4u33srg0/3d-render-medical-background-with-blood-cells.jpg
[SAFE_SRC] => /upload/iblock/44b/53gfu95g2prjqndjku9pqnus4u33srg0/3d-render-medical-background-with-blood-cells.jpg
[ALT] => Плазмообмен в отделении интенсивной терапии: описательный обзор
[TITLE] => Плазмообмен в отделении интенсивной терапии: описательный обзор
)
[~PREVIEW_PICTURE] => 5851
[DETAIL_TEXT] => Philippe R. Bauer , Marlies Ostermann, Lene Russell, Chiara Robba, Sascha David, Bruno L. Ferreyro, Joan Cid, PedroCastro, Nicole P. Juffermans, Luca Montini, Tasneem Pirani, Andry Van De Louw, Nathan Nielsen, Julia Wendon, Anne C.Brignier, Miet Schetz, Jan T. Kielstein, Jeffrey L. Winters,Elie Azoulay on behalf of the Nine-I Investigators Plasmaexchange in the intensive care unit: a narrative review Плазмообмен в отделении интенсивной терапии: описательный обзор Intensive Care Med (2022) 48:1382–1396 doi.org/10.1007/s00134-022-06793-z
Абстракт
В этом описательном обзоре мы обсуждаем актуальные вопросы терапевтического плазмообмена (ТПО) у пациентов в критическом состоянии. Для многих состояний оптимальные показания, тип устройства, частота, продолжительность, тип заместительной жидкости и критерии прекращения ТПО не определены. TПО является потенциально спасительной, но также инвазивной процедурой с риском побочных эффектов и осложнений и требует тщательного наблюдения со стороны опытных бригад. В отделении интенсивной терапии (ОИТ) показания для ТПО можно разделить на (1) абсолютные, хорошо зарекомендовавшие себя и основанные на доказательствах, для которых ТПО признан терапией первой линии, (2) относительная, для которой ТПО признан терапией второй линии (самостоятельно или в сочетании ) и (3) спасительная терапия, при которой ТПО используется с ограниченной или теоретической доказательной базой. Появляются новые показания и сохраняющиеся пробелы в знаниях, особенно в отношении использования ТПО во время критических состояний, поддерживают создание реестра ТПО, предназначенного для интенсивной терапии.
Ключевые слова: плазмообмен, плазмаферез, отделения интенсивной терапии, современный обзор, бригада ухода за больными.
Введение
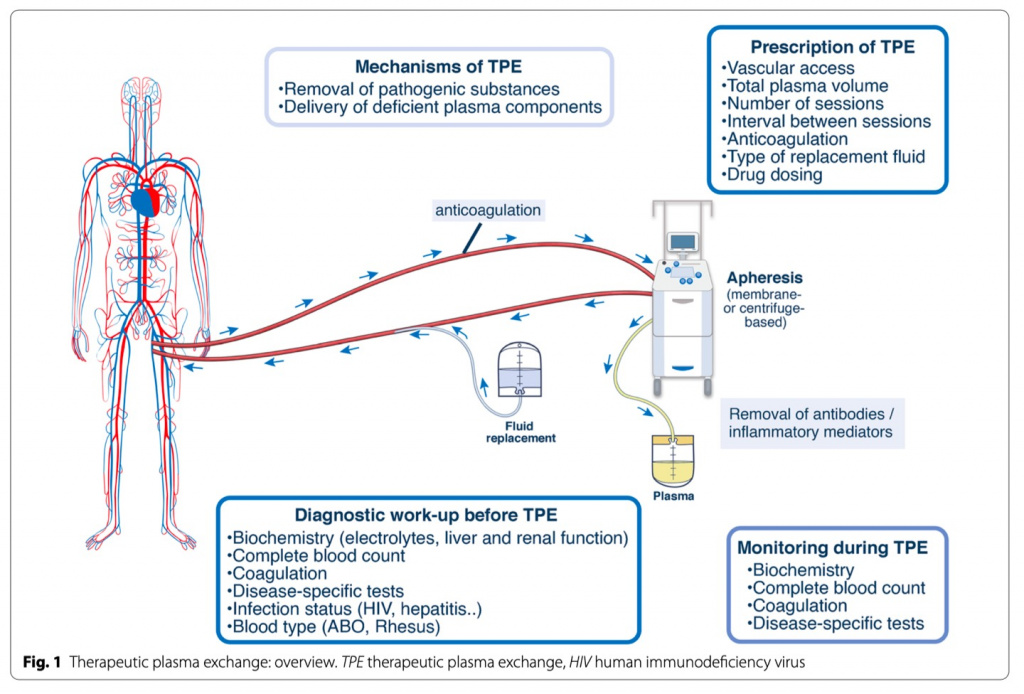
Терапевтический аферез включает удаление плазмы (плазмаферез) или клеток крови (цитаферез, то есть эритроцитов, лейкоцитов или тромбоцитов) из крови пациента. Если плазму забирают не для донорства, а в лечебных целях и заменяют донорской плазмой, коллоидом или кристаллоидами или их смесью, то является терапевтическим плазмообменом (ТПО) (Fig. 1). TPО служит для удаления патогенных веществ (например, аутоантител или токсических агентов) и/или для введения дефицитных веществ, присутствующих в плазме здоровых доноров (например, дезинтегрин), хотя могут быть задействованы другие потенциальные иммуномодулирующие эффекты [1].
Показания к ТПО со временем уточнялись. Многие пациенты, нуждающиеся в ТПО, находятся в критическом состоянии и нуждаются в госпитализации в отделение интенсивной терапии (ОИТ). TПО является инвазивной процедурой, показанием для проведения которой служат экстренные ситуации, что требует участия опытного персонала, специального оборудования, тщательного мониторинга и междисциплинарного подхода.
Цель данной статьи — представить описательный обзор основных показаний к ТПО у пациентов в критическом состоянии, а также их основные характеристики. Междисциплинарная группа реаниматологов, иммунологов, нефрологов, патологоанатомов и гематологов рассмотрела и обобщила данные об обосновании и показаниях к ТПО в ОИТ, поделилась своим опытом и определила актуальные вопросы, которые должны быть известны реаниматологам, поскольку а также пробелы в знаниях, которые должны быть нивелированы будущими исследованиями.
Показания к неотложному ТПО у пациентов в критическом состоянии
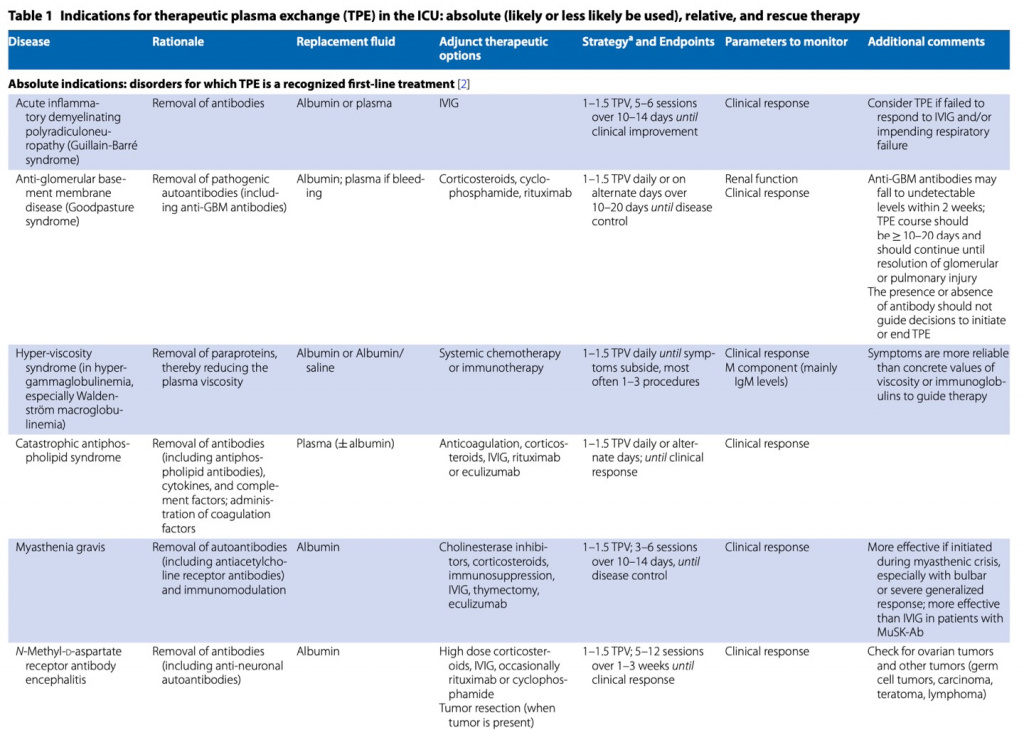
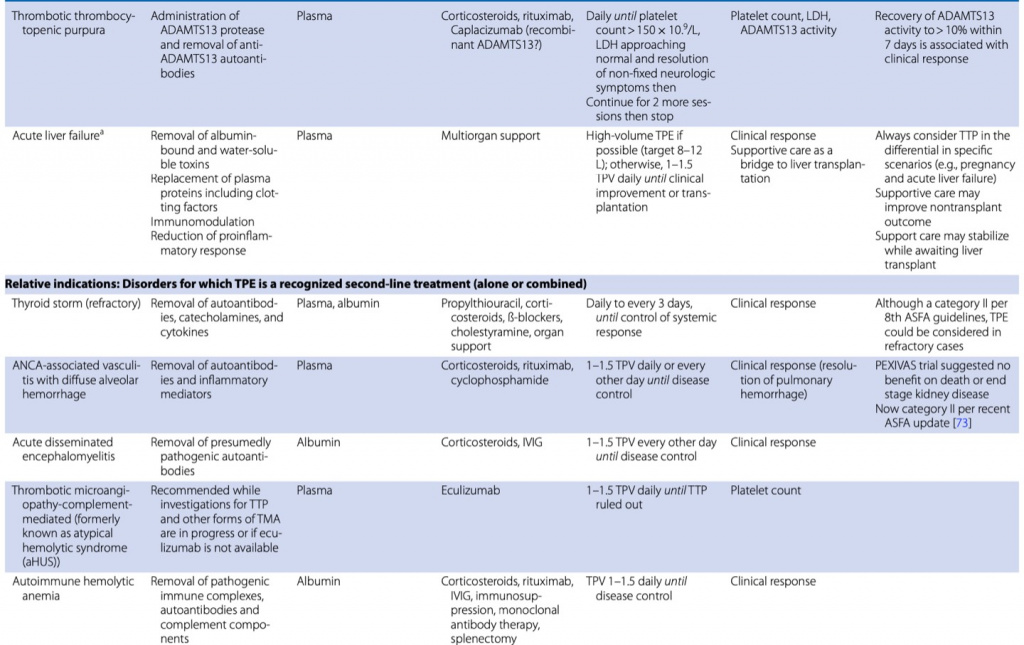
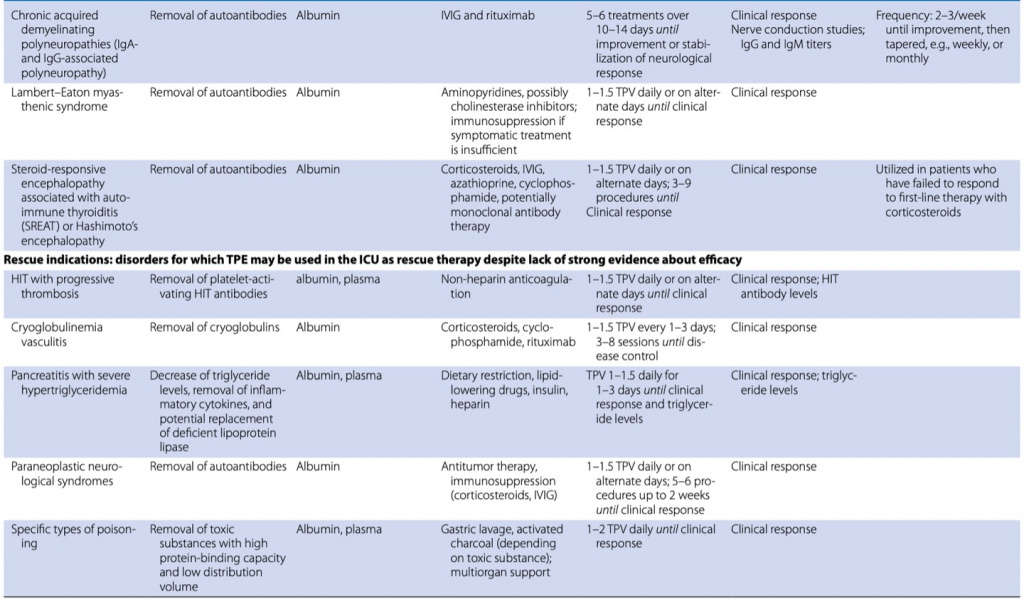
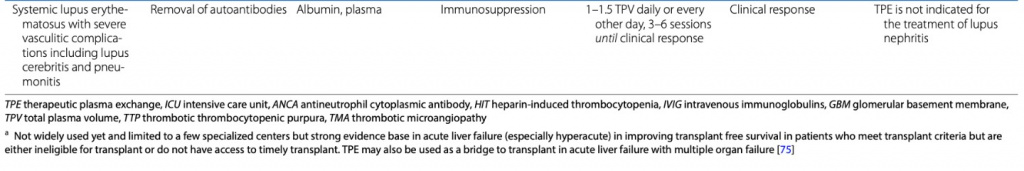
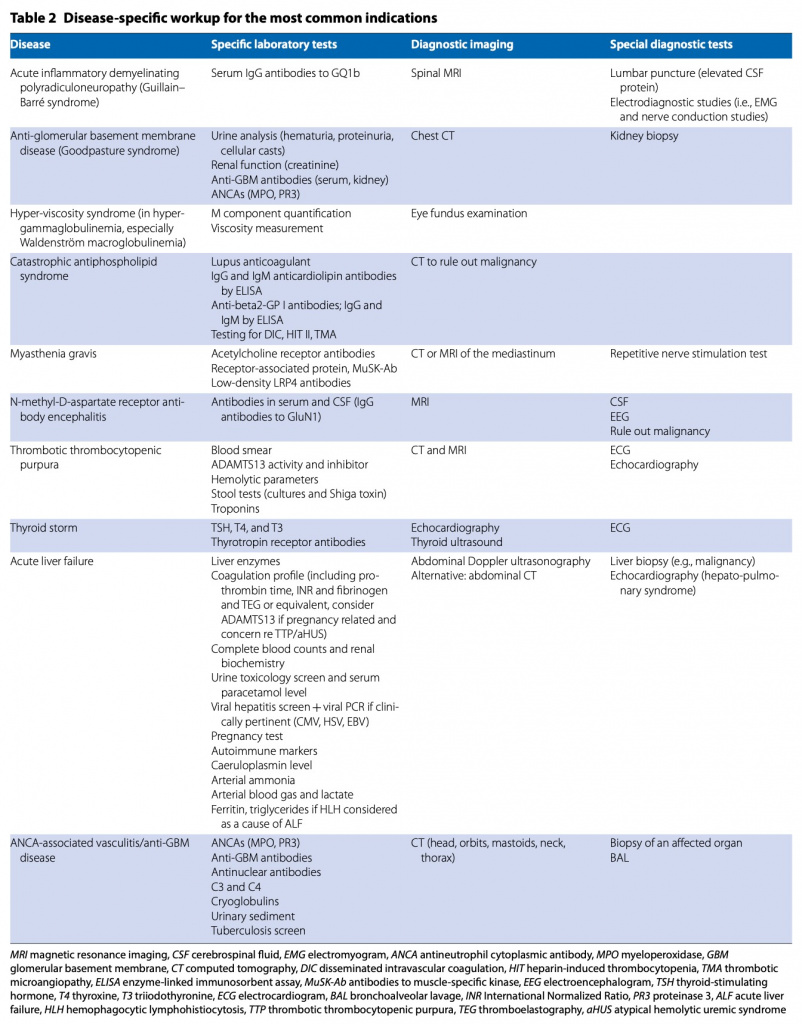
Американское общество афереза (ASFA) обновило свои рекомендации по терапевтическому аферезу в 2019 г. [2], а Японское общество — в 2021 г. [3]. Они определили четыре категории использования: терапия первой линии (категория I), терапия второй линии (категория II), роль не установлена (категория III) и неэффективная или вредная (категория IV). В ОИТ показания к ТПО можно разделить на (1) абсолютные, хорошо установленные и основанные на доказательствах, при которых ТПО признается терапией первой линии, (2) относительные, при которых ТПО признается методом лечения второй линии отдельно или в сочетании с другими вмешательствами и (3) спасительная терапия, при которой ТПО используется с ограниченными доказательствами преимуществ, но правдоподобным теоретическим обоснованием (Table 1) [4–7].
 Механизмы, кинетика и цели ТПО
Механизмы, кинетика и цели ТПО
Механизмы ТПО
ТПО имеет два механизма действия (Fig. 1): 1. Удаление из плазмы патологического вещества (например, IgG при миастении, IgM при макроглобулинемии Вальденстрема или изоагглютининов IgG и IgM перед трансплантацией органов, несовместимых по системе АВО [8]). Для эффективного выведения с помощью ТПО в идеале необходимо идентифицировать вещество, которое должно иметь малый молекулярный вес и низкий объем распределения. Следует отметить, что степень удаления вещества не обязательно коррелирует с облегчением клинических симптомов, как при миастении [9]. 2. Доставка больших количеств дефицитных компонентов плазмы (например, ADAMTS13 при тромботической тромбоцитопенической пурпуре (ТТП). Жидкость, используемая для замещения плазмы, должна быть плазмой здорового донора или быть получена из нее. [1].
Кинетические модели
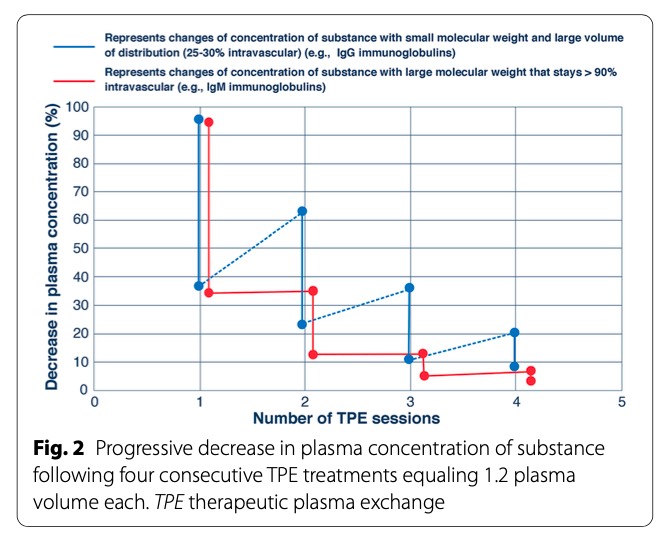
Разработаны кинетические модели для прогнозирования удаления вещества [10]. Период полувыведения и объем распределения удаляемого вещества необходимо учитывать при планировании интенсивности и частоты сеансов ТПО. Объем замещаемой плазмы определяют путем расчета общего объема крови и общего объема плазмы (ОПП) пациента [11]. Для вещества, которое не синтезируется быстро, не перераспределяется и ограничивается внутрисосудистым пространством при первом сеансе удаляется 65–70% целевой субстанции. При обмене дополнительных объемов плазмы абсолютное количество удаляемого вещества постепенно уменьшается из-за экспоненциального характера удаления (Fig. 2). Второй сеанс удаляет дополнительные 23%, а третий сеанс — только дополнительные 9% целевой субстанции. На чистое снижение будут влиять перераспределение из внесосудистого в внутрисосудистое пространство, скорость продукции и объемы распределения. Например, один стандартный сеанс ТПО, заменяющий в 1,2 раза общий объем плазмы (ООП), удалит 10 г IgG и 0,3 г IgM из-за количества IgG, присутствующего во внутрисосудистом пространстве, и его способности перераспределяться из внесосудистого пространства, чего не наблюдается с IgM [12]. Это также зависит от исходного уровня IgG (Fig. 2). У пациентов с дефицитом IgG ТПО может заменить отсутствующий IgG [13].
Рекомендации ASFA 2019 г. предлагают обменивать 1,0–1,5-кратный индивидуально рассчитанный ООП [2]. Тем не менее, несколько клинических исследований показали частые неудачи в достижении этой цели [14]. В исследовании, проведенном в Германии, сообщается, что обмен только в 0,4–1,0 раза превышает предполагаемое значение ООП [15]. В недавнем исследовании, проведенном в Индии, общий обменный объем при ТПО по различным показаниям составил всего 2,1 л при общем уровне ответа 84% [16].
Оптимальный объем обмена неизвестен и может зависеть от заболевания. Плазмаферез малого объема удалит меньше веществ из плазмы, но может быть более доступным и оставаться эффективным. Например, в Бангладеш, где большинство пациентов с синдромом Гийена-Барре (СГБ) не могут позволить себе стандартное лечение внутривенным иммуноглобулином или стандартный курс ТПО, небольшое клиническое исследование с участием 20 взрослых пациентов с данным заболеванием продемонстрировало осуществимость и безопасностьплазмаферез малого объема как потенциальную альтернативу лечения низкой стоимости [17].
Негативное воздействие высоких доз ТПО не описано, но следует помнить, что ТПО также удаляет лекарства, направленные на лечение основного заболевания, такие как ритуксимаб или каплацизумаб, а также такие важные препараты как антибиотики или антикоагулянты.
Кроме того, если целью является удаление более крупных веществ, эффективность ТПО будет снижаться по мере увеличения общего обменного объема, так как удаленному большему количеству патологического вещества могут потребоваться часы или дни для диффузии из внесосудистого во внутрисосудистое пространство [12]. В этом случае может оказаться более эффективным повторение сеансов плазмефереза, чем продолжение высокообъемной ТПО свыше 1–1,5 объемов плазмы. Знание характеристик и кинетики веществ, подлежащих удалению, необходимо для назначения ТПО. Наиболее рациональным подходом для достижения наиболее эффективного удаления вещества является рассмотрение природы удаляемого токсина (токсинов) и наилучшее сочетание объема обмена, кратности процедур и времени [18].
Терапевтические цели ТПО
Терапевтические цели ТПО зависят от патофизиологии заболевания. Например, при макроглобулинемии Вальденстрема целью является снижение уровня IgM для снижения вязкости плазмы и устранения симптомов гипоперфузии. При тромботической тромбоцитопенической пурпуре цель состоит в том, чтобы поднять количество тромбоцитов выше 150 000/мкл и остановить гемолиз путем удаления ингибирующих антител против ADAMTS13, удаления ультракрупных мультимеров факторов фон Виллебранда и замены фермента ADAMTS13 [19]. При миастении целью является достижение быстрой клинической стабилизации путем удаления антител к ацетилхолиновым рецепторам, особенно в случае миастенического криза. При синдроме Гийена-Барре цель состоит в том, чтобы улучшить мышечную силу и уменьшить потребность в искусственной вентиляции легких и ускорить выздоровление. В Table 1 приведены основные параметры для мониторинга и конечные точки для различных показаний к ТПО в ОИТ (Table 1).
Определение показаний и мониторинг ТПО
ТПО используется в различных медицинских условиях. Обследование пациентов направлено на выявление основного заболевания и определения его характеристик (Table 1). Во время ТПО необходим тщательный мониторинг для предотвращения нежелательных явлений и обеспечения эффективности и безопасности.Критерии прекращения ТПО должны быть определены заранее. Многие рутинные биомаркеры (например, СРБ, креатинин, билирубин и т. д.) будут снижаться после сеанса ТПО, возможно, в течение многих часов, и поэтому их следует интерпретировать с осторожностью. Изменения в количестве вещества, удаляемого с помощью ТПО, не обязательно свидетельствуют об улучшении патологического процесса, и следует искать дополнительные доказательства клинического ответа, например, исчезновение симптомов (Table 1S). Точно так же снижение уровня СРБ после ТПО не обязательно означает, что воспаление и/или инфекция находятся под контролем.
Технические аспекты
При ТПО плазму можно отделить от корпускулярных компонентов крови центрифугированием и мембранной фильтрацией [20]. Центрифугирование основано на различиях в плотности различных компонентов крови. Зрелые эритроциты имеют наибольшую относительную плотность, за ними следуют молодые эритроциты (неоциты), гранулоциты, мононуклеары, тромбоциты и, наконец, плазма. Фильтрация использует разницу в размерах частиц для отделения плазмы от клеток.
В настоящее время лицензированные устройства для ТПО могут работать с непрерывным или прерывистым потоком [21]. Доступны как центробежные, так и мембранные устройства. В отделениях афереза, базирующихся в отделениях трансфузиологии или гематологии, ТПО обычно выполняется с помощью центрифужных систем (цТПО), которые часто используют цитрат в качестве антикоагулянта. В большинстве нефрологических отделений и ОИТ предпочтительными являются мембранные устройства (мTПО), в том числе аппараты многофункциональной заместительной почечной терапии (ЗПТ). Как при цTПО, так и при мTПО богатая клетками кровь, которая остается после удаления плазмы, смешивается с замещающей жидкостью (например, альбумином, плазмой или кристаллоидами) и возвращается к пациенту для предотвращения гиповолемии. Для снижения затрат и сокращения использования донорской плазмы до 30% замещающей жидкости могут составлять подходящие кристаллоиды. В системах здравоохранения с низким уровнем ресурсов плазма, кристаллоиды, или неплазменный коллоид, может использоваться для замены более 30% замещенного объема.
Эффективность удаления плазмы (PRE) — это показатель, используемый для сравнения устройств ТПО. Он описывает долю (%) плазмы, которая проходит через устройство и удаляется за одну процедуру. Оценка PREможет варьировать в зависимости от используемых математических формул [22–26]. С устройствами цТПО PREбыстрее и выше, чем с устройствами мТПО [12, 26]. Скорость удаления сопоставима с цТПО и мТПО для IgG, но не для фибриногена [12].
Сосудистый доступ
Выбор сосудистого доступа для ТПО зависит в первую очередь от используемого метода: для цТПО обычно требуется более низкая скорость кровотока (Qb) (50–120 мл/мин), чем для мТПО (150–200 мл/мин) [27]. Более низкий Qb позволяет использовать более узкие катетеры, такие как периферийные устройства (например, игла 18G) или стандартные трехпросветные центральные венозные катетеры (например,7 Fr). В случае периферической вены возможен одноигольный доступ при использовании цТПО [28], но это может увеличить время лечения.
Периферически установленные центральные катетеры не подходят, потому что узкий калибр катетера "схлопнется" при отрицательном давлении, оказываемом во время ТПО [29]. Устройства мТПО часто требуют более высокого Qb и, следовательно, более широких катетеров, таких как временные гемодиализные катетеры или двухпросветные катетеры большого диаметра (например, 13,5 French) [30]. Оптимальные характеристики катетера для ТПО включают жесткие стенки, большой диаметр и короткую длину для снижения сопротивления и уменьшения сигналов тревоги прибора. Машины, используемые для цТПО, могут концентрировать эритроциты до гематокрита 80% или выше, что позволяет обрабатывать больше плазмы на единицу объема по сравнению с устройствами мТПО [11]. Для устройств мТПО требуется более высокий Qb, поскольку они обычно извлекают только около 30–35% обработанной плазмы, чтобы предотвратить повреждение эритроцитов из-за высокого гематокрита. Таким образом, с устройствами мТПО необходимо обрабатывать в три или четыре раза больше объема плазмы, чтобы удалить тот же объем плазмы, что с устройствами цТПО.
Антикоагуляция
Антикоагулянтная терапия при ТПО направлена на достижение тонкого баланса между предотвращением отказа контура с потерей дорогостоящих компонентов крови и предотвращением кровотечения. Системный гепарин и регионарный цитрат являются наиболее распространенными антикоагулянтами, тогда как эпопростенол также можно использовать, когда цитрат недоступен, а гепарин противопоказан. В прошлом цитрат обычно использовался для цТПО, а гепарин — для мТПО, но теперь цитрат также используется для мТПО [12, 31, 32]. По данным Всемирного регистра афереза, в котором две трети процедур афереза были терапевтическими, 73% процедур обеспечивались цитратной антикоагуляцией [33].
Как гепариновая, так и цитратная антикоагулянтная терапия имеют свои преимущества и недостатки (Table 2S). Риск кровотечения при ТПО при применении цитрата ниже, чем при применении гепарина. Однако при использовании цитрата с устройством мТПО побочные эффекты возникают чаще, главным образом потому, что требуется больше цитрата в результате более высокого Qb, плюс удаление меньшего количества плазмы приводит к попаданию большего количества цитрата в системный кровоток пациента [11]. Симптоматическая гипокальциемия также чаще встречается при приеме цитрата и может быть предотвращена профилактическим введением кальция [34]. Имеющиеся в продаже устройства для мТПО со встроенным введением цитрата с поправкой на Qb и добавление кальция в соответствии со скоростью выведения снижают риск. При использовании гепарина для антикоагуляции при оценке необходимой дозы следует учитывать экстракорпоральные потери препарата и его кофактора антитромбина [35]. Более того, потеря антитромбина может затруднить антикоагулянтную терапию гепарином, а также интерпретацию хромогенных анти-Ха тестов.
Заместительная терапия
В качестве заместительной жидкости можно использовать альбумин или плазму, по отдельности или в комбинации, с добавлением или без добавления кристаллоидов, таких как физиологический раствор. Альбумин используют чаще всего, так как он связан с более низкой частотой аллергических или иммунных реакций (например, острого повреждения легких, связанного с переливанием крови) по сравнению с плазмой и не связан с риском трансфузионно-трансмиссивного заболевания [12, 36, 37]. В Table 3S суммированы плюсы и минусы каждого подхода. При использовании альбумина в качестве заместительного раствора после сеанса ТПО может наблюдаться метаболический ацидоз [38]. Замена альбумина может также влиять на концентрацию фибриногена и других факторов коагуляции, приводя к глубоким нарушениям параметров тромбоэластографии [39]. Плазма показана для замены компонентов плазмы (например, ADAMTS13 при тромботической тромбоцитопенической пурпуре). Несмотря на отсутствие веских доказательств, многие центры также используют плазму для предотвращения истощения факторов свертывания крови (например, при наличии геморрагического диатеза или планировании инвазивной процедуры). Установленные рекомендации по мониторингу/управлению гемостазом во время ТПО отсутствуют, но необходимо учитывать экстракорпоральные потери как про-, так и антикоагулянтных факторов [40].
Недавнее исследование, проведенное подкомитетом ASFA, выявило широкое практическое разнообразие типов заместительной жидкости, но чаще всего выбор определяется потенциальным риском кровотечения [41]. Из-за большого объема, количества контактов с донорами и часто длительной терапии риск аллергических реакций выше при использовании плазмы, чем при использовании альбумина, и в некоторых центрах при использовании плазмы назначают антигистаминные препараты и/или глюкокортикоиды [42]. При использовании плазмы в качестве заместительного раствора может возникнуть метаболический алкалоз из-за метаболизма цитрата, используемого в качестве антикоагулянта, и цитрата, присутствующего в плазме. На каждую метаболизированную молекулу цитрата приходится потребление ионов водорода и производство трех молекул бикарбоната натрия, что повышает уровень pH в сыворотке [43].
Кристаллоиды могут быть добавлены для уменьшения затрат и у пациентов с синдромом повышенной вязкости.Однако замена плазмы кристаллоидами сопряжена с риском гипотензии, если доля замещения кристаллоидами превышает 30% [44]. В этих условиях могут происходить значительные сдвиги жидкости, поскольку вода следует градиенту своей концентрации из внутрисосудистого пространства во внесосудистое пространство. Когда кристаллоиды используются в качестве частчной замены, их следует вводить в начале заместительной терапии, а не в конце, чтобы избежать значительного смещения жидкости и гипотензии. Гидроксиэтилкрахмал (ГЭК) больше не рекомендуется пациентам в критическом состоянии из-за его вредного воздействия как на функцию почек, так и на свертываемость крови. Тем не менее, он все еще иногда используется в качестве заместительной терапии (например, 3% ГЭК с 5% человеческим альбумином), особенно в системах здравоохранения с ограниченными ресурсами [45, 46]. Его также можно использовать у пациентов, которые отказываются от препаратов крови.
Клинический ответ
Ожидаемые преимущества и потенциально вредные эффекты ТПО зависят от сроков проведения процедуры по отношению к началу заболевания, объема заменяемой жидкости, типа замещающего раствора, а также частоты и интервалов удаления плазмы. Индивидуальные критерии «клинического ответа» очень специфичны для заболевания и варьируют от изменений отдельных или нескольких гематологических параметров, концентраций антител или биохимических параметров до улучшения клинических признаков и симптомов. Воздействие TПО может быть быстрым или медленным и может длиться от нескольких недель до месяцев, в зависимости от основного заболевания. Однако о долгосрочных эффектах, включая психологическое благополучие и риске хронической органной дисфункции после острого заболевания, сообщают редко.
Осложнения
ТПО – относительно безопасная процедура, обычно хорошо переносимая. Осложнения включают события, связанные с катетером и процедурой. Частота нежелательных явлений со временем снизилась [47, 48] и в настоящее время колеблется от 5 до 36% в зависимости от используемого сосудистого доступа, типа заместительной жидкости и антикоагулянтной терапии (Table 4S). Инфекции, связанные с катетером, пневмоторакс и местное кровотечение были зарегистрированы у 0,4–1,6% пациентов [49, 50]. У пациентов в критическом состоянии нарушения свертываемости крови встречались редко (<10%), но наиболее частым осложнением было нарушение функции катетера (32%) [30]. Частота осложнений была одинаковой при использовании мТПО и цТПО [30]. Потенциально опасные для жизни осложнения, среди которых преобладали анафилактоидные реакции и тяжелая гипотензия, были зарегистрированы в 1–2% сеансов ТПО у пациентов в критическом состоянии [30, 51]. Их следует свести к минимуму путем разумного выбора сосудистого доступа в тесном сотрудничестве со специалистом по аферезу. Цитратная антикоагулянтная терапия и замещение плазмы являются факторами риска гипокальциемии и парестезии [52]. Замена плазмой связана с более высоким риском анафилактоидных реакций. С другой стороны, замена альбумином не корректирует истощение и балансировку факторов свертывания крови и иммуноглобулинов, что приводит к потенциальному риску кровотечения и инфекции соответственно.
Удаление лекарственных препаратов при ТПО
Данные об удалении лекарств с помощью ТПО немногочисленны и основаны только на сообщениях о случаях или сериях случаев [53, 54]. По большинству препаратов либо нет информации, либо она не имеет важного клинического значения. Для сильно связанных с белком препаратов с низким объемом распределения и для химерных антител характерно очень эффективное удаление. Факторы, связанные с клинически значимым выведением лекарственного средства, включают характеристики лекарственного средства (объем распределения, сродство к связыванию с белками, скорость эндогенного клиренса, период полураспределения, дозозависимая фармакодинамика), характеристики ТПО (объем удаляемой плазмы, интервал между сеансами, время между первым и последним сеансом) и время введения препарата [54–57]. Важные меж- и внутри-индивидуальные различия в фармакокинетике, а также многокомпонентные кинетические паттерны, наблюдаемые во время ТПО, могут сильно затруднить прогнозирование.
Недавно был рассмотрен вопрос об удалении антибиотиков во время ТПО [53, 56]. Следует ли вводить антибиотик до или после ТПО, зависит также от его фармакодинамических характеристик. Аминогликозиды лучше всего вводить перед процедурой, так как они обладают высоким пиковым бактерицидным эффектом и сниженной токсичностью, связанной с низким минимальным уровнем за счет экстракорпорального удаления. Уровни бета-лактама в плазме, с другой стороны, должны поддерживаться выше минимальной ингибирующей концентрации, что часто требует дополнительной дозы после процедуры. Моноклональные антитела, такие как ритуксимаб, имеют небольшой объем распределения и длительный период полувыведения и поэтому значительно удаляются с помощью ТПО [58]. При ТПО общий клиренс препарата со временем снижается по мере снижения уровня в плазме [59]. Хотя уровни моноклональных антител коррелируют с клиническими эффектами, они могут не коррелировать с фармакодинамическими маркерами (например, количеством CD20 + B-клеток для ритуксимаба) [54]. Сообщалось о значительном удалении эноксапарина, такролимуса и микофеноловой кислоты во время ТПО [60, 61].
Большинство исследований включало введение лекарств после ТПО и планирование следующего сеанса ТПО через 24–36 часов. В целом, терапевтический лекарственный мониторинг должен применяться, когда это возможно, у пациентов в критическом состоянии, подвергающихся серийным сеансам ТПО, особенно если препарат имеет узкий терапевтический индекс. Время отбора проб должно учитывать перераспределение после процедуры с восстановлением концентрации в плазме.
Вопросы без ответов и программа исследований. Потенциальные новые механизмы и новые показания для ТПО в ОИТ
Считается, что для наиболее неотложных показаний к ТПО при интенсивной терапии, перечисленных в Table 1, эффективность ТПО связана с удалением патогенных веществ и/или предоставлением дефицитных защитных молекул. Эта классическая концепция очистки крови может применяться к системным воспалительным синдромам, возникающим при самых разных критических состояниях, но время и баланс противовоспалительных/провоспалительных средств могут иметь решающее значение для определения пользы и потенциального вреда. Таким образом, воспалительные процессы с коагулопатией потребления в диапазоне от тромбоцитопении до диссеминированного внутрисосудистого свертывания крови могут реагировать на ТПО. Кроме того, TПО удаляет молекулярные паттерны, связанные с повреждением (DAMP), которые высвобождаются поврежденными клетками и могут запускать и закреплять полиорганную дисфункцию. У пациентов с сепсисом и полиорганной дисфункцией ТПО может привести к купированию шока и улучшить сосудистую проницаемость и нарушения коагуляции, а иметь тенденцию к улучшению выживаемости [62–64].
Учитывая способность ТПО модулировать системное воспаление и коагулопатию, вызвали интерес потенциальные преимущества у пациентов с тяжелой формой COVID-19 [65, 66]. Кроме того, TПО может корректировать повышенный мультимер фактора фон Виллебранда и сниженную активность ADAMTS13 у пациентов с COVID-19 [67]. В одном небольшом рандомизированном контролируемом исследовании было показано более быстрое выздоровление, но не влияние на смертность [68]. Многие исследования, в том числе рандомизированные контролируемые испытания, продолжаются для проверки различных гипотез. Помимо сепсиса, клинические сценарии, характеризующиеся системным воспалительным ответом, который может улучшиться при ТПО, включают гемофагоцитарный лимфогистиоцитоз, синдром активации макрофагов, синдром высвобождения цитокинов, ассоциированный с химерным антигенным рецептором Т-клеток, тяжелый панкреатит и тяжелые ожоги. До сих пор текущие доказательства остаются ограниченными сериями случаев и неконтролируемыми обсервационными исследованиями. Наконец, недавно ТПО применяли в рефрактерных случаях индуцированного вакцинами тромбоза и тромбоцитопении, которые можно было бы добавить в список неотложной терапии, хотя данные все еще ограничены [69].
Начало ТПО
Необходимо определить подходящее время начала ТПО. Уровни биомаркеров, титры антител или клинические симптомы, подтверждающие начало ТПО, различаются в зависимости от показаний. Необходимо определить конкретные пороговые значения, различных тестов, связанные с неудовлетворительными результатами. Следует отметить, что воспалительные синдромы, встречающиеся в ОИТ, также могут служить маркерами для мониторинга эффективности ТПО, такими как маркеры активации эндотелия и первичного гемостаза. Хотя травма и сепсис являются разными состояниями, в обоих случаях повышение биомаркеров потери гликокаликса, таких как синдекан-1 и гепарансульфат, связано с неблагоприятными исходами [70], и их уровни могут быть снижены с помощью ТПО [71]. Кроме того, дисбаланс между ADAMTS13 и фактором фон Виллебранда обнаруживается как при сепсисе, так и при травмах. Были предложены определенные пороговые значения, но остается неизвестным, полезны ли они для определения показаний и мониторинга TПО.
Сравнение TПО с другими вмешательствами
Для большинства состояний эффективность ТПО по сравнению с другими методами неизвестна. При СГБ и миастении эффективность ТПО сравнивали с эффективностью внутривенного введения иммуноглобулина или их комбинации [72]. Для состояний, связанных с патогенными антителами, данные ограниченного уровня свидетельствуют о том, что TПО и более селективные методы иммуноадсорбции могут иметь одинаковую эффективность, но необходимы дополнительные исследования. Кроме того, в некоторых случаях новые данные могут поставить под сомнение преимущества TПО. Испытания, такие как исследование PEXIVAS, привели к тому, что AFSA изменило показания для ТПО для тяжелого ANCA -ассоциированного васкулита с категории I на категорию II [73, 74].
Технические аспекты TПО
Мало доказательств в поддержку стандартных схем ТПО у пациентов в ОИТ. В частности, все существующие схемы лечения были разработаны на основе длительного опыта работы с стационарными или амбулаторными пациентами. У пациентов в ОИТ, вероятно, изменились объемы распределения из-за недостаточности органов, капиллярной утечки и/или гипоальбуминемии. В идеале схемы ТПО должны быть адаптированы к потребностям каждого пациента. Необходима дополнительная информация об оптимальных интервалах и объемах ТПО для пациентов в критическом состоянии, а также об оптимальных заместительных растворах и длительности лечения.
Выводы
ТПО — признанная терапия в современной интенсивной терапии. Он включает центробежные и мембранные методики и требует замены жидкости плазмой или раствором альбумина. Мы обобщили ключевые моменты для специалистов, не занимающихся ТПО (Table 3). Хотя ТПО считается терапией первой или второй линии при многих расстройствах, остаются значительные пробелы в знаниях, особенно в отношении точных триггеров и пороговых значений для начала, оптимальных маркеров для мониторинга и триггеров для прекращения процедуры. Более того, интерпретация рутинных лабораторных анализов крови и дозировка лекарственных средств во время ТПО затруднены. Необходимы дополнительные наблюдательные и интервенционные исследования, чтобы заполнить существующие пробелы в знаниях, выявить пациентов, которым ТПО может принести пользу, и избежать ТПО у тех, кому она не принесет пользы или может причинить вред.

Ссылка на документ с дополнительными данными исследования (Supplementary)
References
1. Reeves HM, Winters JL (2014) The mechanisms of action of plasma exchange. Br J Haematol 164:342–351.https://doi.org/10.1111/bjh.12629
2. Padmanabhan A, Connelly-Smith L, Aqui N, Balogun RA, Klingel R, Meyer E, Pham HP, Schneiderman J, Witt V, WuY, Zantek ND, Dunbar NM, Schwartz GEJ (2019) Guidelines on the use of therapeutic apheresis in clinical practice—evidence-based approach from the Writing Commit- tee of the American Society for Apheresis: the eighth special issue. JClin Apher 34:171–354. https://doi.org/10.1002/jca.21705
3. Abe T, Matsuo H, Abe R, Abe S, Asada H, Ashida A, Baba A, Eguchi K, Eguchi Y, Endo Y, Fujimori Y, Furuichi K, Furukawa Y, Furuya M, Furuya T, Hanafusa N, Hara W, Harada-Shiba M, Hasegawa M, Hattori N, Hattori M, Hidaka S,Hidaka T, Hirayama C, Ikeda S, Imamura H, Inoue K, Ishizuka K, Ishizuka K, Ito T, Iwamoto H, Izaki S, Kagitani M, Kaneko S, Kaneko N, Kanekura T, Kitagawa K, Kusaoi M, Lin Y, Maeda T, Makino H, Makino S, Matsuda K, MatsuganeT, Minematsu Y, Mineshima M, Miura K, Miyamoto K, Moriguchi T, Murata M, Naganuma M, Nakae H, Narukawa S,Nohara A, Nomura K, Ochi H, Ohkubo A, Ohtake T, Okada K, Okado T, Okuyama Y, Omokawa S, Oji S, Sakai N,Sakamoto Y, Sasaki S, Sato M, Seishima M, Shiga H, Shimohata H, Sugawara N, Sugimoto K, Suzuki Y, Suzuki M,Tajima T, Takikawa Y, Tanaka S, Taniguchi K, Tsuchida S, Tsukamoto T, Tsushima K, Ueda Y, Wada T, Yamada H,Yamada H, Yamaka T, Yamamoto K, Yokoyama Y, Yoshida N, Yoshioka T, Yamaji K (2021) The Japanese Society forApheresis clinical practice guideline for therapeutic apheresis. Ther Apher Dial 25:728–876. https://doi.org/10.1111/1744-9987.13749
4. Pham HP, Schwartz J (2019) Therapeutic plasma exchange in Guillain- Barre Syndrome and chronic inflammatorydemyelinating polyradiculo- neuropathy. Presse Med 48:338–346. https://doi.org/10.1016/j.lpm.2019. 03.016
5. Chevret S, Hughes RA, Annane D (2017) Plasma exchange for Guillain- Barré syndrome. Cochrane Database Syst Rev2:CD001798. https://doi. org/10.1002/14651858.CD001798.pub3
6. Gilhus NE (2016) Myasthenia gravis. N Engl J Med 375:2570–2581. https:// doi.org/10.1056/NEJMra1602678
7. Barth D, Nabavi Nouri M, Ng E, Nwe P, Bril V (2011) Comparison of IVIg and PLEX in patients with myasthenia gravis.Neurology 76:2017–2023. https://doi.org/10.1212/WNL.0b013e31821e5505
8. Naciri Bennani H, Noble J, Chevallier E, Terrec F, Motte L, Giroux-Lathuile C, Bugnazet M, Imerzoukene F, Janbon B,Malvezzi P, Rostaing L, Jouve T (2021) Isoagglutinin removal by plasma centrifugation or filtration (single or double): aprospective study in a single center. J Clin Apher 36:149–160. https://doi.org/10.1002/jca.21857
9. Yeh JH, Chen WH, Chiu HC (2003) Predicting the course of myasthenic weakness following double filtrationplasmapheresis. Acta Neurol Scand 108(3):174–178. https://doi.org/10.1034/j.1600-0404.2003.00107.x
10. Reverberi R, Reverberi L (2007) Removal kinetics of therapeutic apheresis. Blood Transfus 5:164–174.https://doi.org/10.2450/2007.0032-07
11. Ward DM (2011) Conventional apheresis therapies: a review. J Clin Apher 26:230–238. https://doi.org/10.1002/jca.20302
12. Hafer C, Golla P, Gericke M, Eden G, Beutel G, Schmidt JJ, Schmidt BM, De Reys S, Kielstein JT (2016) Membraneversus centrifuge-based therapeutic plasma exchange: a randomized prospective crossover study. Int Urol Nephrol 48:133–138. https://doi.org/10.1007/s11255-015-1137-3
13. Stahl K, Bikker R, Seeliger B, Schmidt JJ, Schenk H, Schmidt BMW, Welte T, Haller H, Hoeper MM, Brand K, David S (2021) Effect of therapeutic plasma exchange on immunoglobulin deficiency in early and severe septic shock. J IntensiveCare Med 36:1491–1497. https://doi.org/10. 1177/0885066620965169
14. Hafer C, Kielstein JT (2017) Pro: High dose of therapeutic plasma exchange-mind the gap! Nephrol Dial Transplant32:1457–1460. https:// doi.org/10.1093/ndt/gfx084
15. Schmidt JJ, Asper F, Einecke G, Eden G, Hafer C, Kielstein JT (2018) Therapeutic plasma exchange in a tertiary carecenter: 185 patients undergo- ing 912 treatments—a one-year retrospective analysis. BMC Nephrol 19:12.https://doi.org/10.1186/s12882-017-0803-3
16. Sharma RR, Saluja K, Jain A, Dhawan HK, Thakral B, Marwaha N (2011) Scope and application of therapeuticapheresis: experience from a ter- tiary care hospital in North India. Transfus Apher Sci 45:239–245. https://doi.org/10.1016/j.transci.2011.09.002
17. Islam MB, Islam Z, Rahman S, Endtz HP, Vos MC, van der Jagt M, van Doorn PA, Jacobs BC, Mohammad QD (2017) Small volume plasma exchange for Guillain-Barré syndrome in resource poor settings: a safety and feasibility study. Pilot Feasibility Stud 3:40. https://doi.org/10.1186/ s40814-017-0185-0
18. ERBP Guideline Development Group on Vascular Access, Gatta G (2020) Linee guida di pratica clinica sulla cura peri- epost-operatoria delle fistole e delle protesi arterovenose per emodialisi negli adulti. Sintesi delle raccomandazioni delle"European Renal Best Practice (ERBP)". G Ital Nefrol 37(Suppl 75):S75
19. Azoulay E, Bauer PR, Mariotte E, Russell L, Knoebl P, Martin-Loeches I, Pène F, Puxty K, Povoa P, Barratt-Due A,Garnacho-Montero J, Wendon J, Munshi L, Benoit D, von Bergwelt-Baildon M, Maggiorini M, Coppo P, Cataland S, Veyradier A, Van de Louw A, Investigators N-i (2019) Expert statement on the ICU management of patients with thrombotic thrombocytopenic purpura. Intensive Care Med 45:1518–1539. https://doi.org/10.1007/ s00134-019-05736-5
20. Reimann PM, Mason PD (1990) Plasmapheresis: technique and complications. Intensive Care Med 16:3–10.https://doi.org/10.1007/BF01706318
21. Cid J, Molina JM, Mustieles MJ, Periáñez M, Lozano M (2015) Comparison of plasma exchange procedures using threeapheresis systems. Transfu- sion 55:1001–1007. https://doi.org/10.1111/trf.12948
22. Winters JL, Burgstaler EA, Gottschall JL, Balogun RA, Houghton JR, Lee WJ, Snyder EL (2013) A multicenterevaluation of a new therapeutic plasma exchange procedure. Transfusion 53:3269–3278. https://doi.org/10.1111/trf.12189
23. Burgstaler EA, Pineda AA (2001) Therapeutic plasma exchange: a paired comparison of Fresenius AS104 vs. COBESpectra J Clin Apher 16:61–66. https://doi.org/10.1002/jca.1014
24. Tormey CA, Peddinghaus ME, Erickson M, King KE, Cushing MM, Bill J, Goodrich T, Snyder EL (2010) Improvedplasma removal efficiency for therapeutic plasma exchange using a new apheresis platform. Transfu- sion 50:471–477.https://doi.org/10.1111/j.1537-2995.2009.02412.x
25.
Lambert C, Gericke M, Smith R, Hermans C (2011) Plasma extraction rate and collection efficiency during therapeuticplasma exchange with Spec- tra Optia in comparison with Haemonetics MCS . J Clin Apher 26:17–22.https://doi.org/10.1002/jca.20271
26. Kes P, Janssens ME, Bašić-Jukić N, Kljak M (2016) A randomized crossover study comparing membrane and centrifugal therapeutic plasma exchange procedures. Transfusion 56:3065–3072. https://doi.org/10. 1111/trf.13850
27. Ipe TS, Marques MB (2018) Vascular access for therapeutic plasma exchange. Transfusion 58(Suppl 1):580–589.https://doi.org/10.1111/trf. 14479
28. Doggett BM, Session-Augustine N, Roig J, Strunk M, Valiyaparambil S, Sarode R, De Simone N (2019) Single-needle:an effective alternative to dual-needle peripheral access in therapeutic plasma exchange. J Clin Apher 34:21–25.https://doi.org/10.1002/jca.21665
29. Mustieles MJ, Acosta M, Cid J, Jiménez M, Mateo D, Andreu B, Alba C, Perea D, Lozano M (2020) Peripheral venousaccess devices for apheresis: 16-gauge is not always needed. Transfusion 60:607–612. https://doi.org/ 10.1111/trf.15698
30. Lemaire A, Parquet N, Galicier L, Boutboul D, Bertinchamp R, Malphettes M, Dumas G, Mariotte E, Peraldi MN,Souppart V, Schlemmer B, Azoulay E, Canet E (2017) Plasma exchange in the intensive care unit: Technical aspects andcomplications. J Clin Apher 32:405–412. https://doi.org/10. 1002/jca.21529
31. Brunetta Gavranić B, Bašić-Jukić N, Premužić V, Kes P (2017) Membrane therapeutic plasma exchange with andwithout heparin anticoagulation. J Clin Apher 32:479–485. https://doi.org/10.1002/jca.21544
32. Kissling S, Legallais C, Pruijm M, Teta D, Vogt B, Burnier M, Rondeau E, Ridel C (2017) A new prescription model forregional citrate anticoagulation in therapeutic plasma exchanges. BMC Nephrol 18:81. https://doi.org/10. 1186/s12882-017-0494-9
33. Stegmayr B, Ptak J, Wikström B, Berlin G, Axelsson CG, Griskevicius A, Centoni P, Liumbruno G, Molfettini P, Audzijoniene J, Mokvist K, Sojka BN, Norda R, Knutson F, Ramlow W, Blaha M, Witt V, Evergren M, Tomaz J (2008)World apheresis registry 2003–2007 data. Transfus Apher Sci 39:247–254. https://doi.org/10.1016/j.transci.2008.09.003
34. Toss F, Edgren G, Berlin G, Stegmayr B, Witt V (2018) Does prophylactic calcium in apheresis cause more harm thangood?—Centre heterogene- ity within the World Apheresis Association Register prevents firm conclu- sions. Vox Sang113:632–638. https://doi.org/10.1111/vox.12698
35. Kaplan A, Raut P, Totoe G, Morgan S, Zantek ND (2016) Management of systemic unfractionated heparin anticoagulation during therapeutic plasma exchange. J Clin Apher 31:507–515. https://doi.org/10.1002/jca. 21441
36. Tutarel O, Golla P, Beutel G, Bauersachs J, David S, Schmidt BM, Lichting- hagen R, Kielstein JT (2012) Therapeuticplasma exchange decreases levels of routinely used cardiac and inflammatory biomarkers. PLoS ONE 7:e38573.https://doi.org/10.1371/journal.pone.0038573
37. Schmidt JJ, Jahn J, Golla P, Hafer C, Kielstein JT, Kielstein H (2015) Effect of therapeutic plasma exchange on plasmalevels and total removal of adipokines and inflammatory markers. BMC Obes 2:37. https://doi.org/10. 1186/s40608-015-0067-z
38. Cid J, Carbassé G, Gamir M, Jiménez M, Arellano-Rodrigo E, Lozano M (2015) Acid-base balance disturbances in plasma exchange depend on the replacement fluid used. Transfusion 55:2653–2658. https://doi.org/10. 1111/trf.13215
39. Flaum MA, Cuneo RA, Appelbaum FR, Deisseroth AB, Engel WK, Gralnick HR (1979) The hemostatic imbalance ofplasma-exchange transfusion. Blood 54:694–702
40. Zantek ND, Boral LI, Li Y, Yamada C, Svensson AM, Crane JE, Smith RE, Pagano MB, Rollins-Raval MA, Schmidt AE,Wong ECC, Wu Y (2018) Hemostasis management and therapeutic plasma exchange: results of a practice survey. J Clin Apher 33:604–610. https://doi.org/10.1002/jca. 21653
41. Reutter JC, Sanders KF, Brecher ME, Jones HG, Bandarenko N (2001) Inci- dence of allergic reactions with freshfrozen plasma or cryo-supernatant plasma in the treatment of thrombotic thrombocytopenic purpura. J Clin Apher 16:134–138. https://doi.org/10.1002/jca.1025
42. Dzik WH, Kirkley SA (1988) Citrate toxicity during massive blood transfu- sion. Transfus Med Rev 2:76–94. https://doi.org/10.1016/s0887-7963(88) 70035-8
43. Irani MS, Toushan M, Zhang L, Simpson PM, Karafin MS (2019) Risk of hypotensive reactions is increased when usingpartial saline replacement for therapeutic plasma exchange. J Clin Apher 34:524–527. https://doi. org/10.1002/jca.21703
44. Radhakrishnan M, Batra A, Periyavan S, Philip M, Anand V (2018) Hydroxy- ethyl starch and kidney function: aretrospective study in patients under- going therapeutic plasma exchange. J Clin Apher 33:278–282. https://doi.org/10.1002/jca.21598
45. Agreda-Vásquez GP, Espinosa-Poblano I, Sánchez-Guerrero SA, Crespo- Solís E, Cabrera-Vásquez S, López-Salmorán J, Barajas J, Peñaloza-Ramírez P, Tirado-Cárdenas N, Velázquez A (2008) Starch and albumin mixture as replacementfluid in therapeutic plasma exchange is safe and effective. J Clin Apher 23:163–167. https://doi.org/10.1002/jca.20175
46. Blasi A, Cid J, Beltran J, Taurà P, Balust J, Lozano M (2016) Coagulation profile after plasma exchange using albuminas a replacement solution measured by thromboelastometry. Vox Sang 110:159–165. https://doi. org/10.1111/vox.12347
47. Korach JM, Petitpas D, Poiron L, Vincent N, Berger PH, Chillet P, French Registry Study Group (2001) 14 years oftherapeutic plasma exchange in France. Transfus Apher Sci 25:73–77. https://doi.org/10.1016/s1473- 0502(01)00090-8
48. Som S, Deford CC, Kaiser ML, Terrell DR, Kremer Hovinga JA, Lämmle B, George JN, Vesely SK (2012) Decreasingfrequency of plasma exchange complications in patients treated for thrombotic thrombocytopenic purpura-hemolyticuremic syndrome, 1996 to 2011. Transfusion 52:2525–2532. https://doi.org/10.1111/j.1537-2995.2012.03646.x
49. Basic-Jukic N, Kes P, Glavas-Boras S, Brunetta B, Bubic-Filipi L, Puretic Z (2005) Complications of therapeutic plasmaexchange: experience with 4857 treatments. Ther Apher Dial 9:391–395. https://doi.org/10.1111/j. 1744-9987.2005.00319.x
50. Couriel D, Weinstein R (1994) Complications of therapeutic plasma exchange: a recent assessment. J Clin Apher 9:1–5.https://doi.org/10. 1002/jca.2920090102
51. Szczeklik W, Wawrzycka K, Włudarczyk A, Sega A, Nowak I, Seczyńska B, Fajfer I, Zając K, Królikowski W, Kózka M(2013) Complications in patients treated with plasmapheresis in the intensive care unit. Anaesthesiol Intensive Ther 45:7–13. https://doi.org/10.5603/AIT.2013.0002
52. Shemin D, Briggs D, Greenan M (2007) Complications of therapeutic plasma exchange: a prospective study of 1,727procedures. J Clin Apher 22:270–276. https://doi.org/10.1002/jca.20143
53. Cheng CW, Hendrickson JE, Tormey CA, Sidhu D (2017) Therapeutic plasma exchange and its impact on drug levels: anACLPS critical review. Am J Clin Pathol 148:190–198. https://doi.org/10.1093/ajcp/aqx056
54. McDonald V, Manns K, Mackie IJ, Machin SJ, Scully MA (2010) Rituxi- mab pharmacokinetics during themanagement of acute idiopathic thrombotic thrombocytopenic purpura. J Thromb Haemost 8:1201–1208.https://doi.org/10.1111/j.1538-7836.2010.03818.x
55. Ibrahim RB, Liu C, Cronin SM, Murphy BC, Cha R, Swerdlow P, Edwards DJ (2007) Drug removal by plasmapheresis:an evidence-based review. Phar- macotherapy 27:1529–1549. https://doi.org/10.1592/phco.27.11.1529
56. Krzych ŁJ, Czok M, Putowski Z (2020) Is antimicrobial treatment effective during therapeutic plasma exchange? Investigating the role of possible interactions. Pharmaceutics 12:395. https://doi.org/10.3390/pharmaceut ics12050395
57. Ibrahim RB, Balogun RA (2012) Medications in patients treated with therapeutic plasma exchange: prescription dosage,timing, and drug overdose. Semin Dial 25:176–189. https://doi.org/10.1111/j.1525-139X. 2011.01030.x
58. Puisset F, White-Koning M, Kamar N, Huart A, Haberer F, Blasco H, Le Guellec C, Lafont T, Grand A, Rostaing L,Chatelut E, Pourrat J (2013) Popu- lation pharmacokinetics of rituximab with or without plasmapheresis in kidney patientswith antibody-mediated disease. Br J Clin Pharmacol 76:734–740. https://doi.org/10.1111/bcp.12098
59. Petitcollin A, Bensalem A, Verdier MC, Tron C, Lemaitre F, Paintaud G, Bellissant E, Ternant D (2020) Modelling ofthe time-varying pharma- cokinetics of therapeutic monoclonal antibodies: a literature review. Clin Pharmacokinet 59:37–49. https://doi.org/10.1007/s40262-019-00816-7
60. Peters BJ, Hofer M, Daniels CE, Winters JL (2018) Effect of plasma exchange on antifactor Xa activity of enoxaparinand serum leveti- racetam levels. Am J Health Syst Pharm 75:1883–1888. https://doi.org/10. 2146/ajhp170885
61. Kawauchi S, Wada K, Oita A (2019) Changes in blood concentration of mycophenolic acid and FK506 in a heart-transplant patient treated with plasmapheresis. Int J Clin Pharmacol Ther 57:32–36. https://doi.org/10. 5414/CP20327
62. Knaup H, Stahl K, Schmidt BMW, Idowu TO, Busch M, Wiesner O, Welte T, Haller H, Kielstein JT, Hoeper MM, David S (2018) Early therapeutic plasma exchange in septic shock: a prospective open-label nonrand- omized pilot studyfocusing on safety, hemodynamics, vascular barrier function, and biologic markers. Crit Care 22:285. https://doi.org/10.1186/ s13054-018-2220-9
63. Stahl K, Schmidt JJ, Seeliger B, Schmidt BMW, Welte T, Haller H, Hoeper MM, Budde U, Bode C, David S (2020) Effectof therapeutic plasma exchange on endothelial activation and coagulation-related parameters in septic shock. Crit Care 24:71. https://doi.org/10.1186/ s13054-020-2799-5
64. David S, Bode C, Putensen C, Welte T, Stahl K, EXCHANGE Study Group (2021) Adjuvant therapeutic plasmaexchange in septic shock. Intensive Care Med 47:352–354. https://doi.org/10.1007/s00134-020-06339-1
65. Memish ZA, Faqihi F, Alharthy A, Alqahtani SA, Karakitsos D (2021) Plasma exchange in the treatment of complexCOVID-19-related critical illness: controversies and perspectives. Int J Antimicrob Agents 57:106273.https://doi.org/10.1016/j.ijantimicag.2020.106273
66. Fernandez J, Gratacos-Ginès J, Olivas P, Costa M, Nieto S, Mateo D, Sánchez MB, Aguilar F, Bassegoda O, Ruiz P,Caballol B, Pocurull A, Llach J, Mustieles MJ, Cid J, Reverter E, Toapanta ND, Hernández-Tejero M, Martínez JA, Claria J,Fernández C, Mensa J, Arroyo V, Castro P, Lozano M, Covid Clinic Critical Care (CCCC) Group (2020) Plasmaexchange: an effec- tive rescue therapy in critically ill patients with coronavirus disease 2019 infection. Crit Care Med48:e1350–e1355. https://doi.org/10.1097/CCM. 0000000000004613
67. Doevelaar AAN, Bachmann M, Hölzer B, Seibert FS, Rohn BJ, Bauer F, Witzke O, Dittmer U, Bachmann M, Yilmaz S,Dittmer R, Schneppenheim S, Babel N, Budde U, Westhoff TH (2021) von Willebrand factor multimer formation contributes to immunothrombosis in coronavirus disease 2019. Crit Care Med 49:e512–e520.https://doi.org/10.1097/CCM.00000 00000004918
68. Faqihi F, Alharthy A, Abdulaziz S, Balhamar A, Alomari A, AlAseri Z, Tamim H, Alqahtani SA, Kutsogiannis DJ,Brindley PG, Karakitsos D, Memish ZA (2021) Therapeutic plasma exchange in patients with life-threatening COVID-19:a randomised controlled clinical trial. Int J Antimicrob Agents 57:106334.https://doi.org/10.1016/j.ijantimicag.2021.106334
69. Pavord S, Scully M, Hunt BJ, Lester W, Bagot C, Craven B, Rampotas A, Ambler G, Makris M (2021) Clinical featuresof vaccine-induced immune thrombocytopenia and thrombosis. N Engl J Med 385:1680–1689.https://doi.org/10.1056/NEJMoa2109908
70. Dogné S, Flamion B (2020) Endothelial glycocalyx impairment in disease: focus on hyaluronan shedding. Am J Pathol190:768–780. https://doi.org/ 10.1016/j.ajpath.2019.11.016
71. Stahl K, Hillebrand UC, Kiyan Y, Seeliger B, Schmidt JJ, Schenk H, Pape T, Schmidt BMW, Welte T, Hoeper MM,Sauer A, Wygrecka M, Bode C, Wede- meyer H, Haller H, David S (2021) Effects of therapeutic plasma exchange on theendothelial glycocalyx in septic shock. Intensive Care Med Exp 9:57. https://doi.org/10.1186/s40635-021-00417-4
72. Hughes RA, Swan AV, van Doorn PA (2014) Intravenous immunoglobulin for Guillain-Barré syndrome. CochraneDatabase Syst Rev 2014:CD002063. https://doi.org/10.1002/14651858.CD002063.pub6
73. Walsh M, Merkel PA, Peh CA, Szpirt WM, Puéchal X, Fujimoto S, Hawley CM, Khalidi N, Floßmann O, Wald R, GirardLP, Levin A, Gregorini G, Harper L, Clark WF, Pagnoux C, Specks U, Smyth L, Tesar V, Ito-Ihara T, de Zoysa JR,Szczeklik W, Flores-Suárez LF, Carette S, Guillevin L, Pusey CD, Casian AL, Brezina B, Mazzetti A, McAlear CA,Broadhurst E, Reidlinger D, Mehta S, Ives N, Jayne DRW, Investigators PEXIVAS (2020) Plasma exchange andglucocorticoids in severe ANCA-associated vasculitis. N Engl J Med 382:622–631.https://doi.org/10.1056/NEJMoa1803537
74. Balogun RA, Sanchez AP, Klingel R, Witt V, Aqui N, Meyer E, Padmanabhan A, Pham HP, Schneiderman J, Schwartz J,Wu Y, Zantek ND, Connelly-Smith L, Dunbar NM (2020) Update to the ASFA guidelines on the use of therapeuticapheresis in ANCA-associated vasculitis. J Clin Apher 35:493–499. https://doi.org/10.1002/jca.21820
75. Larsen FS, Schmidt LE, Bernsmeier C, Rasmussen A, Isoniemi H, Patel VC, Triantafyllou E, Bernal W, Auzinger G,Shawcross D, Eefsen M, Bjerring PN, Clemmesen JO, Hockerstedt K, Frederiksen HJ, Hansen BA, Antoniades CG, Wendon J (2020) High-volume plasma exchange in patients with acute liver failure: an open randomised controlled trial.J Hepatol 64:69–78. https://doi.org/10.1016/j.jhep.2015.08.018
Источник фотоиллюстрации - www.freepik.com
[~DETAIL_TEXT] =>
Philippe R. Bauer , Marlies Ostermann, Lene Russell, Chiara Robba, Sascha David, Bruno L. Ferreyro, Joan Cid, PedroCastro, Nicole P. Juffermans, Luca Montini, Tasneem Pirani, Andry Van De Louw, Nathan Nielsen, Julia Wendon, Anne C.Brignier, Miet Schetz, Jan T. Kielstein, Jeffrey L. Winters,Elie Azoulay on behalf of the Nine-I Investigators Plasmaexchange in the intensive care unit: a narrative review Плазмообмен в отделении интенсивной терапии: описательный обзор Intensive Care Med (2022) 48:1382–1396 doi.org/10.1007/s00134-022-06793-z
Абстракт
В этом описательном обзоре мы обсуждаем актуальные вопросы терапевтического плазмообмена (ТПО) у пациентов в критическом состоянии. Для многих состояний оптимальные показания, тип устройства, частота, продолжительность, тип заместительной жидкости и критерии прекращения ТПО не определены. TПО является потенциально спасительной, но также инвазивной процедурой с риском побочных эффектов и осложнений и требует тщательного наблюдения со стороны опытных бригад. В отделении интенсивной терапии (ОИТ) показания для ТПО можно разделить на (1) абсолютные, хорошо зарекомендовавшие себя и основанные на доказательствах, для которых ТПО признан терапией первой линии, (2) относительная, для которой ТПО признан терапией второй линии (самостоятельно или в сочетании ) и (3) спасительная терапия, при которой ТПО используется с ограниченной или теоретической доказательной базой. Появляются новые показания и сохраняющиеся пробелы в знаниях, особенно в отношении использования ТПО во время критических состояний, поддерживают создание реестра ТПО, предназначенного для интенсивной терапии.
Ключевые слова: плазмообмен, плазмаферез, отделения интенсивной терапии, современный обзор, бригада ухода за больными.
Введение
Терапевтический аферез включает удаление плазмы (плазмаферез) или клеток крови (цитаферез, то есть эритроцитов, лейкоцитов или тромбоцитов) из крови пациента. Если плазму забирают не для донорства, а в лечебных целях и заменяют донорской плазмой, коллоидом или кристаллоидами или их смесью, то является терапевтическим плазмообменом (ТПО) (Fig. 1). TPО служит для удаления патогенных веществ (например, аутоантител или токсических агентов) и/или для введения дефицитных веществ, присутствующих в плазме здоровых доноров (например, дезинтегрин), хотя могут быть задействованы другие потенциальные иммуномодулирующие эффекты [1].
Показания к ТПО со временем уточнялись. Многие пациенты, нуждающиеся в ТПО, находятся в критическом состоянии и нуждаются в госпитализации в отделение интенсивной терапии (ОИТ). TПО является инвазивной процедурой, показанием для проведения которой служат экстренные ситуации, что требует участия опытного персонала, специального оборудования, тщательного мониторинга и междисциплинарного подхода.
Цель данной статьи — представить описательный обзор основных показаний к ТПО у пациентов в критическом состоянии, а также их основные характеристики. Междисциплинарная группа реаниматологов, иммунологов, нефрологов, патологоанатомов и гематологов рассмотрела и обобщила данные об обосновании и показаниях к ТПО в ОИТ, поделилась своим опытом и определила актуальные вопросы, которые должны быть известны реаниматологам, поскольку а также пробелы в знаниях, которые должны быть нивелированы будущими исследованиями.
Показания к неотложному ТПО у пациентов в критическом состоянии
Американское общество афереза (ASFA) обновило свои рекомендации по терапевтическому аферезу в 2019 г. [2], а Японское общество — в 2021 г. [3]. Они определили четыре категории использования: терапия первой линии (категория I), терапия второй линии (категория II), роль не установлена (категория III) и неэффективная или вредная (категория IV). В ОИТ показания к ТПО можно разделить на (1) абсолютные, хорошо установленные и основанные на доказательствах, при которых ТПО признается терапией первой линии, (2) относительные, при которых ТПО признается методом лечения второй линии отдельно или в сочетании с другими вмешательствами и (3) спасительная терапия, при которой ТПО используется с ограниченными доказательствами преимуществ, но правдоподобным теоретическим обоснованием (Table 1) [4–7].



 Механизмы, кинетика и цели ТПО
Механизмы, кинетика и цели ТПО
Механизмы ТПО
ТПО имеет два механизма действия (Fig. 1): 1. Удаление из плазмы патологического вещества (например, IgG при миастении, IgM при макроглобулинемии Вальденстрема или изоагглютининов IgG и IgM перед трансплантацией органов, несовместимых по системе АВО [8]). Для эффективного выведения с помощью ТПО в идеале необходимо идентифицировать вещество, которое должно иметь малый молекулярный вес и низкий объем распределения. Следует отметить, что степень удаления вещества не обязательно коррелирует с облегчением клинических симптомов, как при миастении [9]. 2. Доставка больших количеств дефицитных компонентов плазмы (например, ADAMTS13 при тромботической тромбоцитопенической пурпуре (ТТП). Жидкость, используемая для замещения плазмы, должна быть плазмой здорового донора или быть получена из нее. [1].

Кинетические модели
Разработаны кинетические модели для прогнозирования удаления вещества [10]. Период полувыведения и объем распределения удаляемого вещества необходимо учитывать при планировании интенсивности и частоты сеансов ТПО. Объем замещаемой плазмы определяют путем расчета общего объема крови и общего объема плазмы (ОПП) пациента [11]. Для вещества, которое не синтезируется быстро, не перераспределяется и ограничивается внутрисосудистым пространством при первом сеансе удаляется 65–70% целевой субстанции. При обмене дополнительных объемов плазмы абсолютное количество удаляемого вещества постепенно уменьшается из-за экспоненциального характера удаления (Fig. 2). Второй сеанс удаляет дополнительные 23%, а третий сеанс — только дополнительные 9% целевой субстанции. На чистое снижение будут влиять перераспределение из внесосудистого в внутрисосудистое пространство, скорость продукции и объемы распределения. Например, один стандартный сеанс ТПО, заменяющий в 1,2 раза общий объем плазмы (ООП), удалит 10 г IgG и 0,3 г IgM из-за количества IgG, присутствующего во внутрисосудистом пространстве, и его способности перераспределяться из внесосудистого пространства, чего не наблюдается с IgM [12]. Это также зависит от исходного уровня IgG (Fig. 2). У пациентов с дефицитом IgG ТПО может заменить отсутствующий IgG [13].

Рекомендации ASFA 2019 г. предлагают обменивать 1,0–1,5-кратный индивидуально рассчитанный ООП [2]. Тем не менее, несколько клинических исследований показали частые неудачи в достижении этой цели [14]. В исследовании, проведенном в Германии, сообщается, что обмен только в 0,4–1,0 раза превышает предполагаемое значение ООП [15]. В недавнем исследовании, проведенном в Индии, общий обменный объем при ТПО по различным показаниям составил всего 2,1 л при общем уровне ответа 84% [16].
Оптимальный объем обмена неизвестен и может зависеть от заболевания. Плазмаферез малого объема удалит меньше веществ из плазмы, но может быть более доступным и оставаться эффективным. Например, в Бангладеш, где большинство пациентов с синдромом Гийена-Барре (СГБ) не могут позволить себе стандартное лечение внутривенным иммуноглобулином или стандартный курс ТПО, небольшое клиническое исследование с участием 20 взрослых пациентов с данным заболеванием продемонстрировало осуществимость и безопасностьплазмаферез малого объема как потенциальную альтернативу лечения низкой стоимости [17].
Негативное воздействие высоких доз ТПО не описано, но следует помнить, что ТПО также удаляет лекарства, направленные на лечение основного заболевания, такие как ритуксимаб или каплацизумаб, а также такие важные препараты как антибиотики или антикоагулянты.
Кроме того, если целью является удаление более крупных веществ, эффективность ТПО будет снижаться по мере увеличения общего обменного объема, так как удаленному большему количеству патологического вещества могут потребоваться часы или дни для диффузии из внесосудистого во внутрисосудистое пространство [12]. В этом случае может оказаться более эффективным повторение сеансов плазмефереза, чем продолжение высокообъемной ТПО свыше 1–1,5 объемов плазмы. Знание характеристик и кинетики веществ, подлежащих удалению, необходимо для назначения ТПО. Наиболее рациональным подходом для достижения наиболее эффективного удаления вещества является рассмотрение природы удаляемого токсина (токсинов) и наилучшее сочетание объема обмена, кратности процедур и времени [18].
Терапевтические цели ТПО
Терапевтические цели ТПО зависят от патофизиологии заболевания. Например, при макроглобулинемии Вальденстрема целью является снижение уровня IgM для снижения вязкости плазмы и устранения симптомов гипоперфузии. При тромботической тромбоцитопенической пурпуре цель состоит в том, чтобы поднять количество тромбоцитов выше 150 000/мкл и остановить гемолиз путем удаления ингибирующих антител против ADAMTS13, удаления ультракрупных мультимеров факторов фон Виллебранда и замены фермента ADAMTS13 [19]. При миастении целью является достижение быстрой клинической стабилизации путем удаления антител к ацетилхолиновым рецепторам, особенно в случае миастенического криза. При синдроме Гийена-Барре цель состоит в том, чтобы улучшить мышечную силу и уменьшить потребность в искусственной вентиляции легких и ускорить выздоровление. В Table 1 приведены основные параметры для мониторинга и конечные точки для различных показаний к ТПО в ОИТ (Table 1).
Определение показаний и мониторинг ТПО
ТПО используется в различных медицинских условиях. Обследование пациентов направлено на выявление основного заболевания и определения его характеристик (Table 1). Во время ТПО необходим тщательный мониторинг для предотвращения нежелательных явлений и обеспечения эффективности и безопасности.Критерии прекращения ТПО должны быть определены заранее. Многие рутинные биомаркеры (например, СРБ, креатинин, билирубин и т. д.) будут снижаться после сеанса ТПО, возможно, в течение многих часов, и поэтому их следует интерпретировать с осторожностью. Изменения в количестве вещества, удаляемого с помощью ТПО, не обязательно свидетельствуют об улучшении патологического процесса, и следует искать дополнительные доказательства клинического ответа, например, исчезновение симптомов (Table 1S). Точно так же снижение уровня СРБ после ТПО не обязательно означает, что воспаление и/или инфекция находятся под контролем.
Технические аспекты
При ТПО плазму можно отделить от корпускулярных компонентов крови центрифугированием и мембранной фильтрацией [20]. Центрифугирование основано на различиях в плотности различных компонентов крови. Зрелые эритроциты имеют наибольшую относительную плотность, за ними следуют молодые эритроциты (неоциты), гранулоциты, мононуклеары, тромбоциты и, наконец, плазма. Фильтрация использует разницу в размерах частиц для отделения плазмы от клеток.
В настоящее время лицензированные устройства для ТПО могут работать с непрерывным или прерывистым потоком [21]. Доступны как центробежные, так и мембранные устройства. В отделениях афереза, базирующихся в отделениях трансфузиологии или гематологии, ТПО обычно выполняется с помощью центрифужных систем (цТПО), которые часто используют цитрат в качестве антикоагулянта. В большинстве нефрологических отделений и ОИТ предпочтительными являются мембранные устройства (мTПО), в том числе аппараты многофункциональной заместительной почечной терапии (ЗПТ). Как при цTПО, так и при мTПО богатая клетками кровь, которая остается после удаления плазмы, смешивается с замещающей жидкостью (например, альбумином, плазмой или кристаллоидами) и возвращается к пациенту для предотвращения гиповолемии. Для снижения затрат и сокращения использования донорской плазмы до 30% замещающей жидкости могут составлять подходящие кристаллоиды. В системах здравоохранения с низким уровнем ресурсов плазма, кристаллоиды, или неплазменный коллоид, может использоваться для замены более 30% замещенного объема.
Эффективность удаления плазмы (PRE) — это показатель, используемый для сравнения устройств ТПО. Он описывает долю (%) плазмы, которая проходит через устройство и удаляется за одну процедуру. Оценка PREможет варьировать в зависимости от используемых математических формул [22–26]. С устройствами цТПО PREбыстрее и выше, чем с устройствами мТПО [12, 26]. Скорость удаления сопоставима с цТПО и мТПО для IgG, но не для фибриногена [12].
Сосудистый доступ
Выбор сосудистого доступа для ТПО зависит в первую очередь от используемого метода: для цТПО обычно требуется более низкая скорость кровотока (Qb) (50–120 мл/мин), чем для мТПО (150–200 мл/мин) [27]. Более низкий Qb позволяет использовать более узкие катетеры, такие как периферийные устройства (например, игла 18G) или стандартные трехпросветные центральные венозные катетеры (например,7 Fr). В случае периферической вены возможен одноигольный доступ при использовании цТПО [28], но это может увеличить время лечения.
Периферически установленные центральные катетеры не подходят, потому что узкий калибр катетера "схлопнется" при отрицательном давлении, оказываемом во время ТПО [29]. Устройства мТПО часто требуют более высокого Qb и, следовательно, более широких катетеров, таких как временные гемодиализные катетеры или двухпросветные катетеры большого диаметра (например, 13,5 French) [30]. Оптимальные характеристики катетера для ТПО включают жесткие стенки, большой диаметр и короткую длину для снижения сопротивления и уменьшения сигналов тревоги прибора. Машины, используемые для цТПО, могут концентрировать эритроциты до гематокрита 80% или выше, что позволяет обрабатывать больше плазмы на единицу объема по сравнению с устройствами мТПО [11]. Для устройств мТПО требуется более высокий Qb, поскольку они обычно извлекают только около 30–35% обработанной плазмы, чтобы предотвратить повреждение эритроцитов из-за высокого гематокрита. Таким образом, с устройствами мТПО необходимо обрабатывать в три или четыре раза больше объема плазмы, чтобы удалить тот же объем плазмы, что с устройствами цТПО.
Антикоагуляция
Антикоагулянтная терапия при ТПО направлена на достижение тонкого баланса между предотвращением отказа контура с потерей дорогостоящих компонентов крови и предотвращением кровотечения. Системный гепарин и регионарный цитрат являются наиболее распространенными антикоагулянтами, тогда как эпопростенол также можно использовать, когда цитрат недоступен, а гепарин противопоказан. В прошлом цитрат обычно использовался для цТПО, а гепарин — для мТПО, но теперь цитрат также используется для мТПО [12, 31, 32]. По данным Всемирного регистра афереза, в котором две трети процедур афереза были терапевтическими, 73% процедур обеспечивались цитратной антикоагуляцией [33].

Как гепариновая, так и цитратная антикоагулянтная терапия имеют свои преимущества и недостатки (Table 2S). Риск кровотечения при ТПО при применении цитрата ниже, чем при применении гепарина. Однако при использовании цитрата с устройством мТПО побочные эффекты возникают чаще, главным образом потому, что требуется больше цитрата в результате более высокого Qb, плюс удаление меньшего количества плазмы приводит к попаданию большего количества цитрата в системный кровоток пациента [11]. Симптоматическая гипокальциемия также чаще встречается при приеме цитрата и может быть предотвращена профилактическим введением кальция [34]. Имеющиеся в продаже устройства для мТПО со встроенным введением цитрата с поправкой на Qb и добавление кальция в соответствии со скоростью выведения снижают риск. При использовании гепарина для антикоагуляции при оценке необходимой дозы следует учитывать экстракорпоральные потери препарата и его кофактора антитромбина [35]. Более того, потеря антитромбина может затруднить антикоагулянтную терапию гепарином, а также интерпретацию хромогенных анти-Ха тестов.
Заместительная терапия
В качестве заместительной жидкости можно использовать альбумин или плазму, по отдельности или в комбинации, с добавлением или без добавления кристаллоидов, таких как физиологический раствор. Альбумин используют чаще всего, так как он связан с более низкой частотой аллергических или иммунных реакций (например, острого повреждения легких, связанного с переливанием крови) по сравнению с плазмой и не связан с риском трансфузионно-трансмиссивного заболевания [12, 36, 37]. В Table 3S суммированы плюсы и минусы каждого подхода. При использовании альбумина в качестве заместительного раствора после сеанса ТПО может наблюдаться метаболический ацидоз [38]. Замена альбумина может также влиять на концентрацию фибриногена и других факторов коагуляции, приводя к глубоким нарушениям параметров тромбоэластографии [39]. Плазма показана для замены компонентов плазмы (например, ADAMTS13 при тромботической тромбоцитопенической пурпуре). Несмотря на отсутствие веских доказательств, многие центры также используют плазму для предотвращения истощения факторов свертывания крови (например, при наличии геморрагического диатеза или планировании инвазивной процедуры). Установленные рекомендации по мониторингу/управлению гемостазом во время ТПО отсутствуют, но необходимо учитывать экстракорпоральные потери как про-, так и антикоагулянтных факторов [40].
Недавнее исследование, проведенное подкомитетом ASFA, выявило широкое практическое разнообразие типов заместительной жидкости, но чаще всего выбор определяется потенциальным риском кровотечения [41]. Из-за большого объема, количества контактов с донорами и часто длительной терапии риск аллергических реакций выше при использовании плазмы, чем при использовании альбумина, и в некоторых центрах при использовании плазмы назначают антигистаминные препараты и/или глюкокортикоиды [42]. При использовании плазмы в качестве заместительного раствора может возникнуть метаболический алкалоз из-за метаболизма цитрата, используемого в качестве антикоагулянта, и цитрата, присутствующего в плазме. На каждую метаболизированную молекулу цитрата приходится потребление ионов водорода и производство трех молекул бикарбоната натрия, что повышает уровень pH в сыворотке [43].
Кристаллоиды могут быть добавлены для уменьшения затрат и у пациентов с синдромом повышенной вязкости.Однако замена плазмы кристаллоидами сопряжена с риском гипотензии, если доля замещения кристаллоидами превышает 30% [44]. В этих условиях могут происходить значительные сдвиги жидкости, поскольку вода следует градиенту своей концентрации из внутрисосудистого пространства во внесосудистое пространство. Когда кристаллоиды используются в качестве частчной замены, их следует вводить в начале заместительной терапии, а не в конце, чтобы избежать значительного смещения жидкости и гипотензии. Гидроксиэтилкрахмал (ГЭК) больше не рекомендуется пациентам в критическом состоянии из-за его вредного воздействия как на функцию почек, так и на свертываемость крови. Тем не менее, он все еще иногда используется в качестве заместительной терапии (например, 3% ГЭК с 5% человеческим альбумином), особенно в системах здравоохранения с ограниченными ресурсами [45, 46]. Его также можно использовать у пациентов, которые отказываются от препаратов крови.
Клинический ответ
Ожидаемые преимущества и потенциально вредные эффекты ТПО зависят от сроков проведения процедуры по отношению к началу заболевания, объема заменяемой жидкости, типа замещающего раствора, а также частоты и интервалов удаления плазмы. Индивидуальные критерии «клинического ответа» очень специфичны для заболевания и варьируют от изменений отдельных или нескольких гематологических параметров, концентраций антител или биохимических параметров до улучшения клинических признаков и симптомов. Воздействие TПО может быть быстрым или медленным и может длиться от нескольких недель до месяцев, в зависимости от основного заболевания. Однако о долгосрочных эффектах, включая психологическое благополучие и риске хронической органной дисфункции после острого заболевания, сообщают редко.
Осложнения
ТПО – относительно безопасная процедура, обычно хорошо переносимая. Осложнения включают события, связанные с катетером и процедурой. Частота нежелательных явлений со временем снизилась [47, 48] и в настоящее время колеблется от 5 до 36% в зависимости от используемого сосудистого доступа, типа заместительной жидкости и антикоагулянтной терапии (Table 4S). Инфекции, связанные с катетером, пневмоторакс и местное кровотечение были зарегистрированы у 0,4–1,6% пациентов [49, 50]. У пациентов в критическом состоянии нарушения свертываемости крови встречались редко (<10%), но наиболее частым осложнением было нарушение функции катетера (32%) [30]. Частота осложнений была одинаковой при использовании мТПО и цТПО [30]. Потенциально опасные для жизни осложнения, среди которых преобладали анафилактоидные реакции и тяжелая гипотензия, были зарегистрированы в 1–2% сеансов ТПО у пациентов в критическом состоянии [30, 51]. Их следует свести к минимуму путем разумного выбора сосудистого доступа в тесном сотрудничестве со специалистом по аферезу. Цитратная антикоагулянтная терапия и замещение плазмы являются факторами риска гипокальциемии и парестезии [52]. Замена плазмой связана с более высоким риском анафилактоидных реакций. С другой стороны, замена альбумином не корректирует истощение и балансировку факторов свертывания крови и иммуноглобулинов, что приводит к потенциальному риску кровотечения и инфекции соответственно.
Удаление лекарственных препаратов при ТПО
Данные об удалении лекарств с помощью ТПО немногочисленны и основаны только на сообщениях о случаях или сериях случаев [53, 54]. По большинству препаратов либо нет информации, либо она не имеет важного клинического значения. Для сильно связанных с белком препаратов с низким объемом распределения и для химерных антител характерно очень эффективное удаление. Факторы, связанные с клинически значимым выведением лекарственного средства, включают характеристики лекарственного средства (объем распределения, сродство к связыванию с белками, скорость эндогенного клиренса, период полураспределения, дозозависимая фармакодинамика), характеристики ТПО (объем удаляемой плазмы, интервал между сеансами, время между первым и последним сеансом) и время введения препарата [54–57]. Важные меж- и внутри-индивидуальные различия в фармакокинетике, а также многокомпонентные кинетические паттерны, наблюдаемые во время ТПО, могут сильно затруднить прогнозирование.
Недавно был рассмотрен вопрос об удалении антибиотиков во время ТПО [53, 56]. Следует ли вводить антибиотик до или после ТПО, зависит также от его фармакодинамических характеристик. Аминогликозиды лучше всего вводить перед процедурой, так как они обладают высоким пиковым бактерицидным эффектом и сниженной токсичностью, связанной с низким минимальным уровнем за счет экстракорпорального удаления. Уровни бета-лактама в плазме, с другой стороны, должны поддерживаться выше минимальной ингибирующей концентрации, что часто требует дополнительной дозы после процедуры. Моноклональные антитела, такие как ритуксимаб, имеют небольшой объем распределения и длительный период полувыведения и поэтому значительно удаляются с помощью ТПО [58]. При ТПО общий клиренс препарата со временем снижается по мере снижения уровня в плазме [59]. Хотя уровни моноклональных антител коррелируют с клиническими эффектами, они могут не коррелировать с фармакодинамическими маркерами (например, количеством CD20 + B-клеток для ритуксимаба) [54]. Сообщалось о значительном удалении эноксапарина, такролимуса и микофеноловой кислоты во время ТПО [60, 61].
Большинство исследований включало введение лекарств после ТПО и планирование следующего сеанса ТПО через 24–36 часов. В целом, терапевтический лекарственный мониторинг должен применяться, когда это возможно, у пациентов в критическом состоянии, подвергающихся серийным сеансам ТПО, особенно если препарат имеет узкий терапевтический индекс. Время отбора проб должно учитывать перераспределение после процедуры с восстановлением концентрации в плазме.
Вопросы без ответов и программа исследований. Потенциальные новые механизмы и новые показания для ТПО в ОИТ
Считается, что для наиболее неотложных показаний к ТПО при интенсивной терапии, перечисленных в Table 1, эффективность ТПО связана с удалением патогенных веществ и/или предоставлением дефицитных защитных молекул. Эта классическая концепция очистки крови может применяться к системным воспалительным синдромам, возникающим при самых разных критических состояниях, но время и баланс противовоспалительных/провоспалительных средств могут иметь решающее значение для определения пользы и потенциального вреда. Таким образом, воспалительные процессы с коагулопатией потребления в диапазоне от тромбоцитопении до диссеминированного внутрисосудистого свертывания крови могут реагировать на ТПО. Кроме того, TПО удаляет молекулярные паттерны, связанные с повреждением (DAMP), которые высвобождаются поврежденными клетками и могут запускать и закреплять полиорганную дисфункцию. У пациентов с сепсисом и полиорганной дисфункцией ТПО может привести к купированию шока и улучшить сосудистую проницаемость и нарушения коагуляции, а иметь тенденцию к улучшению выживаемости [62–64].
Учитывая способность ТПО модулировать системное воспаление и коагулопатию, вызвали интерес потенциальные преимущества у пациентов с тяжелой формой COVID-19 [65, 66]. Кроме того, TПО может корректировать повышенный мультимер фактора фон Виллебранда и сниженную активность ADAMTS13 у пациентов с COVID-19 [67]. В одном небольшом рандомизированном контролируемом исследовании было показано более быстрое выздоровление, но не влияние на смертность [68]. Многие исследования, в том числе рандомизированные контролируемые испытания, продолжаются для проверки различных гипотез. Помимо сепсиса, клинические сценарии, характеризующиеся системным воспалительным ответом, который может улучшиться при ТПО, включают гемофагоцитарный лимфогистиоцитоз, синдром активации макрофагов, синдром высвобождения цитокинов, ассоциированный с химерным антигенным рецептором Т-клеток, тяжелый панкреатит и тяжелые ожоги. До сих пор текущие доказательства остаются ограниченными сериями случаев и неконтролируемыми обсервационными исследованиями. Наконец, недавно ТПО применяли в рефрактерных случаях индуцированного вакцинами тромбоза и тромбоцитопении, которые можно было бы добавить в список неотложной терапии, хотя данные все еще ограничены [69].
Начало ТПО
Необходимо определить подходящее время начала ТПО. Уровни биомаркеров, титры антител или клинические симптомы, подтверждающие начало ТПО, различаются в зависимости от показаний. Необходимо определить конкретные пороговые значения, различных тестов, связанные с неудовлетворительными результатами. Следует отметить, что воспалительные синдромы, встречающиеся в ОИТ, также могут служить маркерами для мониторинга эффективности ТПО, такими как маркеры активации эндотелия и первичного гемостаза. Хотя травма и сепсис являются разными состояниями, в обоих случаях повышение биомаркеров потери гликокаликса, таких как синдекан-1 и гепарансульфат, связано с неблагоприятными исходами [70], и их уровни могут быть снижены с помощью ТПО [71]. Кроме того, дисбаланс между ADAMTS13 и фактором фон Виллебранда обнаруживается как при сепсисе, так и при травмах. Были предложены определенные пороговые значения, но остается неизвестным, полезны ли они для определения показаний и мониторинга TПО.
Сравнение TПО с другими вмешательствами
Для большинства состояний эффективность ТПО по сравнению с другими методами неизвестна. При СГБ и миастении эффективность ТПО сравнивали с эффективностью внутривенного введения иммуноглобулина или их комбинации [72]. Для состояний, связанных с патогенными антителами, данные ограниченного уровня свидетельствуют о том, что TПО и более селективные методы иммуноадсорбции могут иметь одинаковую эффективность, но необходимы дополнительные исследования. Кроме того, в некоторых случаях новые данные могут поставить под сомнение преимущества TПО. Испытания, такие как исследование PEXIVAS, привели к тому, что AFSA изменило показания для ТПО для тяжелого ANCA -ассоциированного васкулита с категории I на категорию II [73, 74].
Технические аспекты TПО
Мало доказательств в поддержку стандартных схем ТПО у пациентов в ОИТ. В частности, все существующие схемы лечения были разработаны на основе длительного опыта работы с стационарными или амбулаторными пациентами. У пациентов в ОИТ, вероятно, изменились объемы распределения из-за недостаточности органов, капиллярной утечки и/или гипоальбуминемии. В идеале схемы ТПО должны быть адаптированы к потребностям каждого пациента. Необходима дополнительная информация об оптимальных интервалах и объемах ТПО для пациентов в критическом состоянии, а также об оптимальных заместительных растворах и длительности лечения.
Выводы
ТПО — признанная терапия в современной интенсивной терапии. Он включает центробежные и мембранные методики и требует замены жидкости плазмой или раствором альбумина. Мы обобщили ключевые моменты для специалистов, не занимающихся ТПО (Table 3). Хотя ТПО считается терапией первой или второй линии при многих расстройствах, остаются значительные пробелы в знаниях, особенно в отношении точных триггеров и пороговых значений для начала, оптимальных маркеров для мониторинга и триггеров для прекращения процедуры. Более того, интерпретация рутинных лабораторных анализов крови и дозировка лекарственных средств во время ТПО затруднены. Необходимы дополнительные наблюдательные и интервенционные исследования, чтобы заполнить существующие пробелы в знаниях, выявить пациентов, которым ТПО может принести пользу, и избежать ТПО у тех, кому она не принесет пользы или может причинить вред.

Ссылка на документ с дополнительными данными исследования (Supplementary)
References
1. Reeves HM, Winters JL (2014) The mechanisms of action of plasma exchange. Br J Haematol 164:342–351.https://doi.org/10.1111/bjh.12629
2. Padmanabhan A, Connelly-Smith L, Aqui N, Balogun RA, Klingel R, Meyer E, Pham HP, Schneiderman J, Witt V, WuY, Zantek ND, Dunbar NM, Schwartz GEJ (2019) Guidelines on the use of therapeutic apheresis in clinical practice—evidence-based approach from the Writing Commit- tee of the American Society for Apheresis: the eighth special issue. JClin Apher 34:171–354. https://doi.org/10.1002/jca.21705
3. Abe T, Matsuo H, Abe R, Abe S, Asada H, Ashida A, Baba A, Eguchi K, Eguchi Y, Endo Y, Fujimori Y, Furuichi K, Furukawa Y, Furuya M, Furuya T, Hanafusa N, Hara W, Harada-Shiba M, Hasegawa M, Hattori N, Hattori M, Hidaka S,Hidaka T, Hirayama C, Ikeda S, Imamura H, Inoue K, Ishizuka K, Ishizuka K, Ito T, Iwamoto H, Izaki S, Kagitani M, Kaneko S, Kaneko N, Kanekura T, Kitagawa K, Kusaoi M, Lin Y, Maeda T, Makino H, Makino S, Matsuda K, MatsuganeT, Minematsu Y, Mineshima M, Miura K, Miyamoto K, Moriguchi T, Murata M, Naganuma M, Nakae H, Narukawa S,Nohara A, Nomura K, Ochi H, Ohkubo A, Ohtake T, Okada K, Okado T, Okuyama Y, Omokawa S, Oji S, Sakai N,Sakamoto Y, Sasaki S, Sato M, Seishima M, Shiga H, Shimohata H, Sugawara N, Sugimoto K, Suzuki Y, Suzuki M,Tajima T, Takikawa Y, Tanaka S, Taniguchi K, Tsuchida S, Tsukamoto T, Tsushima K, Ueda Y, Wada T, Yamada H,Yamada H, Yamaka T, Yamamoto K, Yokoyama Y, Yoshida N, Yoshioka T, Yamaji K (2021) The Japanese Society forApheresis clinical practice guideline for therapeutic apheresis. Ther Apher Dial 25:728–876. https://doi.org/10.1111/1744-9987.13749
4. Pham HP, Schwartz J (2019) Therapeutic plasma exchange in Guillain- Barre Syndrome and chronic inflammatorydemyelinating polyradiculo- neuropathy. Presse Med 48:338–346. https://doi.org/10.1016/j.lpm.2019. 03.016
5. Chevret S, Hughes RA, Annane D (2017) Plasma exchange for Guillain- Barré syndrome. Cochrane Database Syst Rev2:CD001798. https://doi. org/10.1002/14651858.CD001798.pub3
6. Gilhus NE (2016) Myasthenia gravis. N Engl J Med 375:2570–2581. https:// doi.org/10.1056/NEJMra1602678
7. Barth D, Nabavi Nouri M, Ng E, Nwe P, Bril V (2011) Comparison of IVIg and PLEX in patients with myasthenia gravis.Neurology 76:2017–2023. https://doi.org/10.1212/WNL.0b013e31821e5505
8. Naciri Bennani H, Noble J, Chevallier E, Terrec F, Motte L, Giroux-Lathuile C, Bugnazet M, Imerzoukene F, Janbon B,Malvezzi P, Rostaing L, Jouve T (2021) Isoagglutinin removal by plasma centrifugation or filtration (single or double): aprospective study in a single center. J Clin Apher 36:149–160. https://doi.org/10.1002/jca.21857
9. Yeh JH, Chen WH, Chiu HC (2003) Predicting the course of myasthenic weakness following double filtrationplasmapheresis. Acta Neurol Scand 108(3):174–178. https://doi.org/10.1034/j.1600-0404.2003.00107.x
10. Reverberi R, Reverberi L (2007) Removal kinetics of therapeutic apheresis. Blood Transfus 5:164–174.https://doi.org/10.2450/2007.0032-07
11. Ward DM (2011) Conventional apheresis therapies: a review. J Clin Apher 26:230–238. https://doi.org/10.1002/jca.20302
12. Hafer C, Golla P, Gericke M, Eden G, Beutel G, Schmidt JJ, Schmidt BM, De Reys S, Kielstein JT (2016) Membraneversus centrifuge-based therapeutic plasma exchange: a randomized prospective crossover study. Int Urol Nephrol 48:133–138. https://doi.org/10.1007/s11255-015-1137-3
13. Stahl K, Bikker R, Seeliger B, Schmidt JJ, Schenk H, Schmidt BMW, Welte T, Haller H, Hoeper MM, Brand K, David S (2021) Effect of therapeutic plasma exchange on immunoglobulin deficiency in early and severe septic shock. J IntensiveCare Med 36:1491–1497. https://doi.org/10. 1177/0885066620965169
14. Hafer C, Kielstein JT (2017) Pro: High dose of therapeutic plasma exchange-mind the gap! Nephrol Dial Transplant32:1457–1460. https:// doi.org/10.1093/ndt/gfx084
15. Schmidt JJ, Asper F, Einecke G, Eden G, Hafer C, Kielstein JT (2018) Therapeutic plasma exchange in a tertiary carecenter: 185 patients undergo- ing 912 treatments—a one-year retrospective analysis. BMC Nephrol 19:12.https://doi.org/10.1186/s12882-017-0803-3
16. Sharma RR, Saluja K, Jain A, Dhawan HK, Thakral B, Marwaha N (2011) Scope and application of therapeuticapheresis: experience from a ter- tiary care hospital in North India. Transfus Apher Sci 45:239–245. https://doi.org/10.1016/j.transci.2011.09.002
17. Islam MB, Islam Z, Rahman S, Endtz HP, Vos MC, van der Jagt M, van Doorn PA, Jacobs BC, Mohammad QD (2017) Small volume plasma exchange for Guillain-Barré syndrome in resource poor settings: a safety and feasibility study. Pilot Feasibility Stud 3:40. https://doi.org/10.1186/ s40814-017-0185-0
18. ERBP Guideline Development Group on Vascular Access, Gatta G (2020) Linee guida di pratica clinica sulla cura peri- epost-operatoria delle fistole e delle protesi arterovenose per emodialisi negli adulti. Sintesi delle raccomandazioni delle"European Renal Best Practice (ERBP)". G Ital Nefrol 37(Suppl 75):S75
19. Azoulay E, Bauer PR, Mariotte E, Russell L, Knoebl P, Martin-Loeches I, Pène F, Puxty K, Povoa P, Barratt-Due A,Garnacho-Montero J, Wendon J, Munshi L, Benoit D, von Bergwelt-Baildon M, Maggiorini M, Coppo P, Cataland S, Veyradier A, Van de Louw A, Investigators N-i (2019) Expert statement on the ICU management of patients with thrombotic thrombocytopenic purpura. Intensive Care Med 45:1518–1539. https://doi.org/10.1007/ s00134-019-05736-5
20. Reimann PM, Mason PD (1990) Plasmapheresis: technique and complications. Intensive Care Med 16:3–10.https://doi.org/10.1007/BF01706318
21. Cid J, Molina JM, Mustieles MJ, Periáñez M, Lozano M (2015) Comparison of plasma exchange procedures using threeapheresis systems. Transfu- sion 55:1001–1007. https://doi.org/10.1111/trf.12948
22. Winters JL, Burgstaler EA, Gottschall JL, Balogun RA, Houghton JR, Lee WJ, Snyder EL (2013) A multicenterevaluation of a new therapeutic plasma exchange procedure. Transfusion 53:3269–3278. https://doi.org/10.1111/trf.12189
23. Burgstaler EA, Pineda AA (2001) Therapeutic plasma exchange: a paired comparison of Fresenius AS104 vs. COBESpectra J Clin Apher 16:61–66. https://doi.org/10.1002/jca.1014
24. Tormey CA, Peddinghaus ME, Erickson M, King KE, Cushing MM, Bill J, Goodrich T, Snyder EL (2010) Improvedplasma removal efficiency for therapeutic plasma exchange using a new apheresis platform. Transfu- sion 50:471–477.https://doi.org/10.1111/j.1537-2995.2009.02412.x
25.
Lambert C, Gericke M, Smith R, Hermans C (2011) Plasma extraction rate and collection efficiency during therapeuticplasma exchange with Spec- tra Optia in comparison with Haemonetics MCS . J Clin Apher 26:17–22.https://doi.org/10.1002/jca.20271
26. Kes P, Janssens ME, Bašić-Jukić N, Kljak M (2016) A randomized crossover study comparing membrane and centrifugal therapeutic plasma exchange procedures. Transfusion 56:3065–3072. https://doi.org/10. 1111/trf.13850
27. Ipe TS, Marques MB (2018) Vascular access for therapeutic plasma exchange. Transfusion 58(Suppl 1):580–589.https://doi.org/10.1111/trf. 14479
28. Doggett BM, Session-Augustine N, Roig J, Strunk M, Valiyaparambil S, Sarode R, De Simone N (2019) Single-needle:an effective alternative to dual-needle peripheral access in therapeutic plasma exchange. J Clin Apher 34:21–25.https://doi.org/10.1002/jca.21665
29. Mustieles MJ, Acosta M, Cid J, Jiménez M, Mateo D, Andreu B, Alba C, Perea D, Lozano M (2020) Peripheral venousaccess devices for apheresis: 16-gauge is not always needed. Transfusion 60:607–612. https://doi.org/ 10.1111/trf.15698
30. Lemaire A, Parquet N, Galicier L, Boutboul D, Bertinchamp R, Malphettes M, Dumas G, Mariotte E, Peraldi MN,Souppart V, Schlemmer B, Azoulay E, Canet E (2017) Plasma exchange in the intensive care unit: Technical aspects andcomplications. J Clin Apher 32:405–412. https://doi.org/10. 1002/jca.21529
31. Brunetta Gavranić B, Bašić-Jukić N, Premužić V, Kes P (2017) Membrane therapeutic plasma exchange with andwithout heparin anticoagulation. J Clin Apher 32:479–485. https://doi.org/10.1002/jca.21544
32. Kissling S, Legallais C, Pruijm M, Teta D, Vogt B, Burnier M, Rondeau E, Ridel C (2017) A new prescription model forregional citrate anticoagulation in therapeutic plasma exchanges. BMC Nephrol 18:81. https://doi.org/10. 1186/s12882-017-0494-9
33. Stegmayr B, Ptak J, Wikström B, Berlin G, Axelsson CG, Griskevicius A, Centoni P, Liumbruno G, Molfettini P, Audzijoniene J, Mokvist K, Sojka BN, Norda R, Knutson F, Ramlow W, Blaha M, Witt V, Evergren M, Tomaz J (2008)World apheresis registry 2003–2007 data. Transfus Apher Sci 39:247–254. https://doi.org/10.1016/j.transci.2008.09.003
34. Toss F, Edgren G, Berlin G, Stegmayr B, Witt V (2018) Does prophylactic calcium in apheresis cause more harm thangood?—Centre heterogene- ity within the World Apheresis Association Register prevents firm conclu- sions. Vox Sang113:632–638. https://doi.org/10.1111/vox.12698
35. Kaplan A, Raut P, Totoe G, Morgan S, Zantek ND (2016) Management of systemic unfractionated heparin anticoagulation during therapeutic plasma exchange. J Clin Apher 31:507–515. https://doi.org/10.1002/jca. 21441
36. Tutarel O, Golla P, Beutel G, Bauersachs J, David S, Schmidt BM, Lichting- hagen R, Kielstein JT (2012) Therapeuticplasma exchange decreases levels of routinely used cardiac and inflammatory biomarkers. PLoS ONE 7:e38573.https://doi.org/10.1371/journal.pone.0038573
37. Schmidt JJ, Jahn J, Golla P, Hafer C, Kielstein JT, Kielstein H (2015) Effect of therapeutic plasma exchange on plasmalevels and total removal of adipokines and inflammatory markers. BMC Obes 2:37. https://doi.org/10. 1186/s40608-015-0067-z
38. Cid J, Carbassé G, Gamir M, Jiménez M, Arellano-Rodrigo E, Lozano M (2015) Acid-base balance disturbances in plasma exchange depend on the replacement fluid used. Transfusion 55:2653–2658. https://doi.org/10. 1111/trf.13215
39. Flaum MA, Cuneo RA, Appelbaum FR, Deisseroth AB, Engel WK, Gralnick HR (1979) The hemostatic imbalance ofplasma-exchange transfusion. Blood 54:694–702
40. Zantek ND, Boral LI, Li Y, Yamada C, Svensson AM, Crane JE, Smith RE, Pagano MB, Rollins-Raval MA, Schmidt AE,Wong ECC, Wu Y (2018) Hemostasis management and therapeutic plasma exchange: results of a practice survey. J Clin Apher 33:604–610. https://doi.org/10.1002/jca. 21653
41. Reutter JC, Sanders KF, Brecher ME, Jones HG, Bandarenko N (2001) Inci- dence of allergic reactions with freshfrozen plasma or cryo-supernatant plasma in the treatment of thrombotic thrombocytopenic purpura. J Clin Apher 16:134–138. https://doi.org/10.1002/jca.1025
42. Dzik WH, Kirkley SA (1988) Citrate toxicity during massive blood transfu- sion. Transfus Med Rev 2:76–94. https://doi.org/10.1016/s0887-7963(88) 70035-8
43. Irani MS, Toushan M, Zhang L, Simpson PM, Karafin MS (2019) Risk of hypotensive reactions is increased when usingpartial saline replacement for therapeutic plasma exchange. J Clin Apher 34:524–527. https://doi. org/10.1002/jca.21703
44. Radhakrishnan M, Batra A, Periyavan S, Philip M, Anand V (2018) Hydroxy- ethyl starch and kidney function: aretrospective study in patients under- going therapeutic plasma exchange. J Clin Apher 33:278–282. https://doi.org/10.1002/jca.21598
45. Agreda-Vásquez GP, Espinosa-Poblano I, Sánchez-Guerrero SA, Crespo- Solís E, Cabrera-Vásquez S, López-Salmorán J, Barajas J, Peñaloza-Ramírez P, Tirado-Cárdenas N, Velázquez A (2008) Starch and albumin mixture as replacementfluid in therapeutic plasma exchange is safe and effective. J Clin Apher 23:163–167. https://doi.org/10.1002/jca.20175
46. Blasi A, Cid J, Beltran J, Taurà P, Balust J, Lozano M (2016) Coagulation profile after plasma exchange using albuminas a replacement solution measured by thromboelastometry. Vox Sang 110:159–165. https://doi. org/10.1111/vox.12347
47. Korach JM, Petitpas D, Poiron L, Vincent N, Berger PH, Chillet P, French Registry Study Group (2001) 14 years oftherapeutic plasma exchange in France. Transfus Apher Sci 25:73–77. https://doi.org/10.1016/s1473- 0502(01)00090-8
48. Som S, Deford CC, Kaiser ML, Terrell DR, Kremer Hovinga JA, Lämmle B, George JN, Vesely SK (2012) Decreasingfrequency of plasma exchange complications in patients treated for thrombotic thrombocytopenic purpura-hemolyticuremic syndrome, 1996 to 2011. Transfusion 52:2525–2532. https://doi.org/10.1111/j.1537-2995.2012.03646.x
49. Basic-Jukic N, Kes P, Glavas-Boras S, Brunetta B, Bubic-Filipi L, Puretic Z (2005) Complications of therapeutic plasmaexchange: experience with 4857 treatments. Ther Apher Dial 9:391–395. https://doi.org/10.1111/j. 1744-9987.2005.00319.x
50. Couriel D, Weinstein R (1994) Complications of therapeutic plasma exchange: a recent assessment. J Clin Apher 9:1–5.https://doi.org/10. 1002/jca.2920090102
51. Szczeklik W, Wawrzycka K, Włudarczyk A, Sega A, Nowak I, Seczyńska B, Fajfer I, Zając K, Królikowski W, Kózka M(2013) Complications in patients treated with plasmapheresis in the intensive care unit. Anaesthesiol Intensive Ther 45:7–13. https://doi.org/10.5603/AIT.2013.0002
52. Shemin D, Briggs D, Greenan M (2007) Complications of therapeutic plasma exchange: a prospective study of 1,727procedures. J Clin Apher 22:270–276. https://doi.org/10.1002/jca.20143
53. Cheng CW, Hendrickson JE, Tormey CA, Sidhu D (2017) Therapeutic plasma exchange and its impact on drug levels: anACLPS critical review. Am J Clin Pathol 148:190–198. https://doi.org/10.1093/ajcp/aqx056
54. McDonald V, Manns K, Mackie IJ, Machin SJ, Scully MA (2010) Rituxi- mab pharmacokinetics during themanagement of acute idiopathic thrombotic thrombocytopenic purpura. J Thromb Haemost 8:1201–1208.https://doi.org/10.1111/j.1538-7836.2010.03818.x
55. Ibrahim RB, Liu C, Cronin SM, Murphy BC, Cha R, Swerdlow P, Edwards DJ (2007) Drug removal by plasmapheresis:an evidence-based review. Phar- macotherapy 27:1529–1549. https://doi.org/10.1592/phco.27.11.1529
56. Krzych ŁJ, Czok M, Putowski Z (2020) Is antimicrobial treatment effective during therapeutic plasma exchange? Investigating the role of possible interactions. Pharmaceutics 12:395. https://doi.org/10.3390/pharmaceut ics12050395
57. Ibrahim RB, Balogun RA (2012) Medications in patients treated with therapeutic plasma exchange: prescription dosage,timing, and drug overdose. Semin Dial 25:176–189. https://doi.org/10.1111/j.1525-139X. 2011.01030.x
58. Puisset F, White-Koning M, Kamar N, Huart A, Haberer F, Blasco H, Le Guellec C, Lafont T, Grand A, Rostaing L,Chatelut E, Pourrat J (2013) Popu- lation pharmacokinetics of rituximab with or without plasmapheresis in kidney patientswith antibody-mediated disease. Br J Clin Pharmacol 76:734–740. https://doi.org/10.1111/bcp.12098
59. Petitcollin A, Bensalem A, Verdier MC, Tron C, Lemaitre F, Paintaud G, Bellissant E, Ternant D (2020) Modelling ofthe time-varying pharma- cokinetics of therapeutic monoclonal antibodies: a literature review. Clin Pharmacokinet 59:37–49. https://doi.org/10.1007/s40262-019-00816-7
60. Peters BJ, Hofer M, Daniels CE, Winters JL (2018) Effect of plasma exchange on antifactor Xa activity of enoxaparinand serum leveti- racetam levels. Am J Health Syst Pharm 75:1883–1888. https://doi.org/10. 2146/ajhp170885
61. Kawauchi S, Wada K, Oita A (2019) Changes in blood concentration of mycophenolic acid and FK506 in a heart-transplant patient treated with plasmapheresis. Int J Clin Pharmacol Ther 57:32–36. https://doi.org/10. 5414/CP20327
62. Knaup H, Stahl K, Schmidt BMW, Idowu TO, Busch M, Wiesner O, Welte T, Haller H, Kielstein JT, Hoeper MM, David S (2018) Early therapeutic plasma exchange in septic shock: a prospective open-label nonrand- omized pilot studyfocusing on safety, hemodynamics, vascular barrier function, and biologic markers. Crit Care 22:285. https://doi.org/10.1186/ s13054-018-2220-9
63. Stahl K, Schmidt JJ, Seeliger B, Schmidt BMW, Welte T, Haller H, Hoeper MM, Budde U, Bode C, David S (2020) Effectof therapeutic plasma exchange on endothelial activation and coagulation-related parameters in septic shock. Crit Care 24:71. https://doi.org/10.1186/ s13054-020-2799-5
64. David S, Bode C, Putensen C, Welte T, Stahl K, EXCHANGE Study Group (2021) Adjuvant therapeutic plasmaexchange in septic shock. Intensive Care Med 47:352–354. https://doi.org/10.1007/s00134-020-06339-1
65. Memish ZA, Faqihi F, Alharthy A, Alqahtani SA, Karakitsos D (2021) Plasma exchange in the treatment of complexCOVID-19-related critical illness: controversies and perspectives. Int J Antimicrob Agents 57:106273.https://doi.org/10.1016/j.ijantimicag.2020.106273
66. Fernandez J, Gratacos-Ginès J, Olivas P, Costa M, Nieto S, Mateo D, Sánchez MB, Aguilar F, Bassegoda O, Ruiz P,Caballol B, Pocurull A, Llach J, Mustieles MJ, Cid J, Reverter E, Toapanta ND, Hernández-Tejero M, Martínez JA, Claria J,Fernández C, Mensa J, Arroyo V, Castro P, Lozano M, Covid Clinic Critical Care (CCCC) Group (2020) Plasmaexchange: an effec- tive rescue therapy in critically ill patients with coronavirus disease 2019 infection. Crit Care Med48:e1350–e1355. https://doi.org/10.1097/CCM. 0000000000004613
67. Doevelaar AAN, Bachmann M, Hölzer B, Seibert FS, Rohn BJ, Bauer F, Witzke O, Dittmer U, Bachmann M, Yilmaz S,Dittmer R, Schneppenheim S, Babel N, Budde U, Westhoff TH (2021) von Willebrand factor multimer formation contributes to immunothrombosis in coronavirus disease 2019. Crit Care Med 49:e512–e520.https://doi.org/10.1097/CCM.00000 00000004918
68. Faqihi F, Alharthy A, Abdulaziz S, Balhamar A, Alomari A, AlAseri Z, Tamim H, Alqahtani SA, Kutsogiannis DJ,Brindley PG, Karakitsos D, Memish ZA (2021) Therapeutic plasma exchange in patients with life-threatening COVID-19:a randomised controlled clinical trial. Int J Antimicrob Agents 57:106334.https://doi.org/10.1016/j.ijantimicag.2021.106334
69. Pavord S, Scully M, Hunt BJ, Lester W, Bagot C, Craven B, Rampotas A, Ambler G, Makris M (2021) Clinical featuresof vaccine-induced immune thrombocytopenia and thrombosis. N Engl J Med 385:1680–1689.https://doi.org/10.1056/NEJMoa2109908
70. Dogné S, Flamion B (2020) Endothelial glycocalyx impairment in disease: focus on hyaluronan shedding. Am J Pathol190:768–780. https://doi.org/ 10.1016/j.ajpath.2019.11.016
71. Stahl K, Hillebrand UC, Kiyan Y, Seeliger B, Schmidt JJ, Schenk H, Pape T, Schmidt BMW, Welte T, Hoeper MM,Sauer A, Wygrecka M, Bode C, Wede- meyer H, Haller H, David S (2021) Effects of therapeutic plasma exchange on theendothelial glycocalyx in septic shock. Intensive Care Med Exp 9:57. https://doi.org/10.1186/s40635-021-00417-4
72. Hughes RA, Swan AV, van Doorn PA (2014) Intravenous immunoglobulin for Guillain-Barré syndrome. CochraneDatabase Syst Rev 2014:CD002063. https://doi.org/10.1002/14651858.CD002063.pub6
73. Walsh M, Merkel PA, Peh CA, Szpirt WM, Puéchal X, Fujimoto S, Hawley CM, Khalidi N, Floßmann O, Wald R, GirardLP, Levin A, Gregorini G, Harper L, Clark WF, Pagnoux C, Specks U, Smyth L, Tesar V, Ito-Ihara T, de Zoysa JR,Szczeklik W, Flores-Suárez LF, Carette S, Guillevin L, Pusey CD, Casian AL, Brezina B, Mazzetti A, McAlear CA,Broadhurst E, Reidlinger D, Mehta S, Ives N, Jayne DRW, Investigators PEXIVAS (2020) Plasma exchange andglucocorticoids in severe ANCA-associated vasculitis. N Engl J Med 382:622–631.https://doi.org/10.1056/NEJMoa1803537
74. Balogun RA, Sanchez AP, Klingel R, Witt V, Aqui N, Meyer E, Padmanabhan A, Pham HP, Schneiderman J, Schwartz J,Wu Y, Zantek ND, Connelly-Smith L, Dunbar NM (2020) Update to the ASFA guidelines on the use of therapeuticapheresis in ANCA-associated vasculitis. J Clin Apher 35:493–499. https://doi.org/10.1002/jca.21820
75. Larsen FS, Schmidt LE, Bernsmeier C, Rasmussen A, Isoniemi H, Patel VC, Triantafyllou E, Bernal W, Auzinger G,Shawcross D, Eefsen M, Bjerring PN, Clemmesen JO, Hockerstedt K, Frederiksen HJ, Hansen BA, Antoniades CG, Wendon J (2020) High-volume plasma exchange in patients with acute liver failure: an open randomised controlled trial.J Hepatol 64:69–78. https://doi.org/10.1016/j.jhep.2015.08.018
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 06.02.2023
[~DATE_ACTIVE_FROM] => 06.02.2023
[ACTIVE_FROM_X] => 2023-02-06 00:00:00
[~ACTIVE_FROM_X] => 2023-02-06 00:00:00
[ACTIVE_FROM] => 06.02.2023
[~ACTIVE_FROM] => 06.02.2023
[SHOW_COUNTER] => 5050
[~SHOW_COUNTER] => 5050
[ID] => 8332
[~ID] => 8332
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => html
[~PREVIEW_TEXT_TYPE] => html
[TIMESTAMP_X] => 11.11.2024 15:24:29
[~TIMESTAMP_X] => 11.11.2024 15:24:29
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/plazmoobmen-v-otdelenii-intensivnoy-terapii-opisatelnyy-obzor/
[~DETAIL_PAGE_URL] => /library/articles/plazmoobmen-v-otdelenii-intensivnoy-terapii-opisatelnyy-obzor/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => plazmoobmen-v-otdelenii-intensivnoy-terapii-opisatelnyy-obzor
[~CODE] => plazmoobmen-v-otdelenii-intensivnoy-terapii-opisatelnyy-obzor
[EXTERNAL_ID] => 8332
[~EXTERNAL_ID] => 8332
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 6 февраля 2023
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Плазмообмен в отделении интенсивной терапии: описательный обзор
[PREVIEW_PICTURE] => Array
(
[ID] => 5851
[TIMESTAMP_X] => 11.11.2024 15:24:29
[MODULE_ID] => iblock
[HEIGHT] => 5000
[WIDTH] => 5000
[FILE_SIZE] => 11937981
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/44b/53gfu95g2prjqndjku9pqnus4u33srg0
[FILE_NAME] => 3d-render-medical-background-with-blood-cells.jpg
[ORIGINAL_NAME] => 3d-render-medical-background-with-blood-cells.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 3a69415207e958b17ac6cbb6ac6ba6b6
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/44b/53gfu95g2prjqndjku9pqnus4u33srg0/3d-render-medical-background-with-blood-cells.jpg
[UNSAFE_SRC] => /upload/iblock/44b/53gfu95g2prjqndjku9pqnus4u33srg0/3d-render-medical-background-with-blood-cells.jpg
[SAFE_SRC] => /upload/iblock/44b/53gfu95g2prjqndjku9pqnus4u33srg0/3d-render-medical-background-with-blood-cells.jpg
[ALT] => Плазмообмен в отделении интенсивной терапии: описательный обзор
[TITLE] => Плазмообмен в отделении интенсивной терапии: описательный обзор
)
[DETAIL_TEXT] =>
Philippe R. Bauer , Marlies Ostermann, Lene Russell, Chiara Robba, Sascha David, Bruno L. Ferreyro, Joan Cid, PedroCastro, Nicole P. Juffermans, Luca Montini, Tasneem Pirani, Andry Van De Louw, Nathan Nielsen, Julia Wendon, Anne C.Brignier, Miet Schetz, Jan T. Kielstein, Jeffrey L. Winters,Elie Azoulay on behalf of the Nine-I Investigators Plasmaexchange in the intensive care unit: a narrative review Плазмообмен в отделении интенсивной терапии: описательный обзор Intensive Care Med (2022) 48:1382–1396 doi.org/10.1007/s00134-022-06793-z
Абстракт
В этом описательном обзоре мы обсуждаем актуальные вопросы терапевтического плазмообмена (ТПО) у пациентов в критическом состоянии. Для многих состояний оптимальные показания, тип устройства, частота, продолжительность, тип заместительной жидкости и критерии прекращения ТПО не определены. TПО является потенциально спасительной, но также инвазивной процедурой с риском побочных эффектов и осложнений и требует тщательного наблюдения со стороны опытных бригад. В отделении интенсивной терапии (ОИТ) показания для ТПО можно разделить на (1) абсолютные, хорошо зарекомендовавшие себя и основанные на доказательствах, для которых ТПО признан терапией первой линии, (2) относительная, для которой ТПО признан терапией второй линии (самостоятельно или в сочетании ) и (3) спасительная терапия, при которой ТПО используется с ограниченной или теоретической доказательной базой. Появляются новые показания и сохраняющиеся пробелы в знаниях, особенно в отношении использования ТПО во время критических состояний, поддерживают создание реестра ТПО, предназначенного для интенсивной терапии.
Ключевые слова: плазмообмен, плазмаферез, отделения интенсивной терапии, современный обзор, бригада ухода за больными.
Введение
Терапевтический аферез включает удаление плазмы (плазмаферез) или клеток крови (цитаферез, то есть эритроцитов, лейкоцитов или тромбоцитов) из крови пациента. Если плазму забирают не для донорства, а в лечебных целях и заменяют донорской плазмой, коллоидом или кристаллоидами или их смесью, то является терапевтическим плазмообменом (ТПО) (Fig. 1). TPО служит для удаления патогенных веществ (например, аутоантител или токсических агентов) и/или для введения дефицитных веществ, присутствующих в плазме здоровых доноров (например, дезинтегрин), хотя могут быть задействованы другие потенциальные иммуномодулирующие эффекты [1].
Показания к ТПО со временем уточнялись. Многие пациенты, нуждающиеся в ТПО, находятся в критическом состоянии и нуждаются в госпитализации в отделение интенсивной терапии (ОИТ). TПО является инвазивной процедурой, показанием для проведения которой служат экстренные ситуации, что требует участия опытного персонала, специального оборудования, тщательного мониторинга и междисциплинарного подхода.
Цель данной статьи — представить описательный обзор основных показаний к ТПО у пациентов в критическом состоянии, а также их основные характеристики. Междисциплинарная группа реаниматологов, иммунологов, нефрологов, патологоанатомов и гематологов рассмотрела и обобщила данные об обосновании и показаниях к ТПО в ОИТ, поделилась своим опытом и определила актуальные вопросы, которые должны быть известны реаниматологам, поскольку а также пробелы в знаниях, которые должны быть нивелированы будущими исследованиями.
Показания к неотложному ТПО у пациентов в критическом состоянии
Американское общество афереза (ASFA) обновило свои рекомендации по терапевтическому аферезу в 2019 г. [2], а Японское общество — в 2021 г. [3]. Они определили четыре категории использования: терапия первой линии (категория I), терапия второй линии (категория II), роль не установлена (категория III) и неэффективная или вредная (категория IV). В ОИТ показания к ТПО можно разделить на (1) абсолютные, хорошо установленные и основанные на доказательствах, при которых ТПО признается терапией первой линии, (2) относительные, при которых ТПО признается методом лечения второй линии отдельно или в сочетании с другими вмешательствами и (3) спасительная терапия, при которой ТПО используется с ограниченными доказательствами преимуществ, но правдоподобным теоретическим обоснованием (Table 1) [4–7].



 Механизмы, кинетика и цели ТПО
Механизмы, кинетика и цели ТПО
Механизмы ТПО
ТПО имеет два механизма действия (Fig. 1): 1. Удаление из плазмы патологического вещества (например, IgG при миастении, IgM при макроглобулинемии Вальденстрема или изоагглютининов IgG и IgM перед трансплантацией органов, несовместимых по системе АВО [8]). Для эффективного выведения с помощью ТПО в идеале необходимо идентифицировать вещество, которое должно иметь малый молекулярный вес и низкий объем распределения. Следует отметить, что степень удаления вещества не обязательно коррелирует с облегчением клинических симптомов, как при миастении [9]. 2. Доставка больших количеств дефицитных компонентов плазмы (например, ADAMTS13 при тромботической тромбоцитопенической пурпуре (ТТП). Жидкость, используемая для замещения плазмы, должна быть плазмой здорового донора или быть получена из нее. [1].

Кинетические модели
Разработаны кинетические модели для прогнозирования удаления вещества [10]. Период полувыведения и объем распределения удаляемого вещества необходимо учитывать при планировании интенсивности и частоты сеансов ТПО. Объем замещаемой плазмы определяют путем расчета общего объема крови и общего объема плазмы (ОПП) пациента [11]. Для вещества, которое не синтезируется быстро, не перераспределяется и ограничивается внутрисосудистым пространством при первом сеансе удаляется 65–70% целевой субстанции. При обмене дополнительных объемов плазмы абсолютное количество удаляемого вещества постепенно уменьшается из-за экспоненциального характера удаления (Fig. 2). Второй сеанс удаляет дополнительные 23%, а третий сеанс — только дополнительные 9% целевой субстанции. На чистое снижение будут влиять перераспределение из внесосудистого в внутрисосудистое пространство, скорость продукции и объемы распределения. Например, один стандартный сеанс ТПО, заменяющий в 1,2 раза общий объем плазмы (ООП), удалит 10 г IgG и 0,3 г IgM из-за количества IgG, присутствующего во внутрисосудистом пространстве, и его способности перераспределяться из внесосудистого пространства, чего не наблюдается с IgM [12]. Это также зависит от исходного уровня IgG (Fig. 2). У пациентов с дефицитом IgG ТПО может заменить отсутствующий IgG [13].

Рекомендации ASFA 2019 г. предлагают обменивать 1,0–1,5-кратный индивидуально рассчитанный ООП [2]. Тем не менее, несколько клинических исследований показали частые неудачи в достижении этой цели [14]. В исследовании, проведенном в Германии, сообщается, что обмен только в 0,4–1,0 раза превышает предполагаемое значение ООП [15]. В недавнем исследовании, проведенном в Индии, общий обменный объем при ТПО по различным показаниям составил всего 2,1 л при общем уровне ответа 84% [16].
Оптимальный объем обмена неизвестен и может зависеть от заболевания. Плазмаферез малого объема удалит меньше веществ из плазмы, но может быть более доступным и оставаться эффективным. Например, в Бангладеш, где большинство пациентов с синдромом Гийена-Барре (СГБ) не могут позволить себе стандартное лечение внутривенным иммуноглобулином или стандартный курс ТПО, небольшое клиническое исследование с участием 20 взрослых пациентов с данным заболеванием продемонстрировало осуществимость и безопасностьплазмаферез малого объема как потенциальную альтернативу лечения низкой стоимости [17].
Негативное воздействие высоких доз ТПО не описано, но следует помнить, что ТПО также удаляет лекарства, направленные на лечение основного заболевания, такие как ритуксимаб или каплацизумаб, а также такие важные препараты как антибиотики или антикоагулянты.
Кроме того, если целью является удаление более крупных веществ, эффективность ТПО будет снижаться по мере увеличения общего обменного объема, так как удаленному большему количеству патологического вещества могут потребоваться часы или дни для диффузии из внесосудистого во внутрисосудистое пространство [12]. В этом случае может оказаться более эффективным повторение сеансов плазмефереза, чем продолжение высокообъемной ТПО свыше 1–1,5 объемов плазмы. Знание характеристик и кинетики веществ, подлежащих удалению, необходимо для назначения ТПО. Наиболее рациональным подходом для достижения наиболее эффективного удаления вещества является рассмотрение природы удаляемого токсина (токсинов) и наилучшее сочетание объема обмена, кратности процедур и времени [18].
Терапевтические цели ТПО
Терапевтические цели ТПО зависят от патофизиологии заболевания. Например, при макроглобулинемии Вальденстрема целью является снижение уровня IgM для снижения вязкости плазмы и устранения симптомов гипоперфузии. При тромботической тромбоцитопенической пурпуре цель состоит в том, чтобы поднять количество тромбоцитов выше 150 000/мкл и остановить гемолиз путем удаления ингибирующих антител против ADAMTS13, удаления ультракрупных мультимеров факторов фон Виллебранда и замены фермента ADAMTS13 [19]. При миастении целью является достижение быстрой клинической стабилизации путем удаления антител к ацетилхолиновым рецепторам, особенно в случае миастенического криза. При синдроме Гийена-Барре цель состоит в том, чтобы улучшить мышечную силу и уменьшить потребность в искусственной вентиляции легких и ускорить выздоровление. В Table 1 приведены основные параметры для мониторинга и конечные точки для различных показаний к ТПО в ОИТ (Table 1).
Определение показаний и мониторинг ТПО
ТПО используется в различных медицинских условиях. Обследование пациентов направлено на выявление основного заболевания и определения его характеристик (Table 1). Во время ТПО необходим тщательный мониторинг для предотвращения нежелательных явлений и обеспечения эффективности и безопасности.Критерии прекращения ТПО должны быть определены заранее. Многие рутинные биомаркеры (например, СРБ, креатинин, билирубин и т. д.) будут снижаться после сеанса ТПО, возможно, в течение многих часов, и поэтому их следует интерпретировать с осторожностью. Изменения в количестве вещества, удаляемого с помощью ТПО, не обязательно свидетельствуют об улучшении патологического процесса, и следует искать дополнительные доказательства клинического ответа, например, исчезновение симптомов (Table 1S). Точно так же снижение уровня СРБ после ТПО не обязательно означает, что воспаление и/или инфекция находятся под контролем.
Технические аспекты
При ТПО плазму можно отделить от корпускулярных компонентов крови центрифугированием и мембранной фильтрацией [20]. Центрифугирование основано на различиях в плотности различных компонентов крови. Зрелые эритроциты имеют наибольшую относительную плотность, за ними следуют молодые эритроциты (неоциты), гранулоциты, мононуклеары, тромбоциты и, наконец, плазма. Фильтрация использует разницу в размерах частиц для отделения плазмы от клеток.
В настоящее время лицензированные устройства для ТПО могут работать с непрерывным или прерывистым потоком [21]. Доступны как центробежные, так и мембранные устройства. В отделениях афереза, базирующихся в отделениях трансфузиологии или гематологии, ТПО обычно выполняется с помощью центрифужных систем (цТПО), которые часто используют цитрат в качестве антикоагулянта. В большинстве нефрологических отделений и ОИТ предпочтительными являются мембранные устройства (мTПО), в том числе аппараты многофункциональной заместительной почечной терапии (ЗПТ). Как при цTПО, так и при мTПО богатая клетками кровь, которая остается после удаления плазмы, смешивается с замещающей жидкостью (например, альбумином, плазмой или кристаллоидами) и возвращается к пациенту для предотвращения гиповолемии. Для снижения затрат и сокращения использования донорской плазмы до 30% замещающей жидкости могут составлять подходящие кристаллоиды. В системах здравоохранения с низким уровнем ресурсов плазма, кристаллоиды, или неплазменный коллоид, может использоваться для замены более 30% замещенного объема.
Эффективность удаления плазмы (PRE) — это показатель, используемый для сравнения устройств ТПО. Он описывает долю (%) плазмы, которая проходит через устройство и удаляется за одну процедуру. Оценка PREможет варьировать в зависимости от используемых математических формул [22–26]. С устройствами цТПО PREбыстрее и выше, чем с устройствами мТПО [12, 26]. Скорость удаления сопоставима с цТПО и мТПО для IgG, но не для фибриногена [12].
Сосудистый доступ
Выбор сосудистого доступа для ТПО зависит в первую очередь от используемого метода: для цТПО обычно требуется более низкая скорость кровотока (Qb) (50–120 мл/мин), чем для мТПО (150–200 мл/мин) [27]. Более низкий Qb позволяет использовать более узкие катетеры, такие как периферийные устройства (например, игла 18G) или стандартные трехпросветные центральные венозные катетеры (например,7 Fr). В случае периферической вены возможен одноигольный доступ при использовании цТПО [28], но это может увеличить время лечения.
Периферически установленные центральные катетеры не подходят, потому что узкий калибр катетера "схлопнется" при отрицательном давлении, оказываемом во время ТПО [29]. Устройства мТПО часто требуют более высокого Qb и, следовательно, более широких катетеров, таких как временные гемодиализные катетеры или двухпросветные катетеры большого диаметра (например, 13,5 French) [30]. Оптимальные характеристики катетера для ТПО включают жесткие стенки, большой диаметр и короткую длину для снижения сопротивления и уменьшения сигналов тревоги прибора. Машины, используемые для цТПО, могут концентрировать эритроциты до гематокрита 80% или выше, что позволяет обрабатывать больше плазмы на единицу объема по сравнению с устройствами мТПО [11]. Для устройств мТПО требуется более высокий Qb, поскольку они обычно извлекают только около 30–35% обработанной плазмы, чтобы предотвратить повреждение эритроцитов из-за высокого гематокрита. Таким образом, с устройствами мТПО необходимо обрабатывать в три или четыре раза больше объема плазмы, чтобы удалить тот же объем плазмы, что с устройствами цТПО.
Антикоагуляция
Антикоагулянтная терапия при ТПО направлена на достижение тонкого баланса между предотвращением отказа контура с потерей дорогостоящих компонентов крови и предотвращением кровотечения. Системный гепарин и регионарный цитрат являются наиболее распространенными антикоагулянтами, тогда как эпопростенол также можно использовать, когда цитрат недоступен, а гепарин противопоказан. В прошлом цитрат обычно использовался для цТПО, а гепарин — для мТПО, но теперь цитрат также используется для мТПО [12, 31, 32]. По данным Всемирного регистра афереза, в котором две трети процедур афереза были терапевтическими, 73% процедур обеспечивались цитратной антикоагуляцией [33].

Как гепариновая, так и цитратная антикоагулянтная терапия имеют свои преимущества и недостатки (Table 2S). Риск кровотечения при ТПО при применении цитрата ниже, чем при применении гепарина. Однако при использовании цитрата с устройством мТПО побочные эффекты возникают чаще, главным образом потому, что требуется больше цитрата в результате более высокого Qb, плюс удаление меньшего количества плазмы приводит к попаданию большего количества цитрата в системный кровоток пациента [11]. Симптоматическая гипокальциемия также чаще встречается при приеме цитрата и может быть предотвращена профилактическим введением кальция [34]. Имеющиеся в продаже устройства для мТПО со встроенным введением цитрата с поправкой на Qb и добавление кальция в соответствии со скоростью выведения снижают риск. При использовании гепарина для антикоагуляции при оценке необходимой дозы следует учитывать экстракорпоральные потери препарата и его кофактора антитромбина [35]. Более того, потеря антитромбина может затруднить антикоагулянтную терапию гепарином, а также интерпретацию хромогенных анти-Ха тестов.
Заместительная терапия
В качестве заместительной жидкости можно использовать альбумин или плазму, по отдельности или в комбинации, с добавлением или без добавления кристаллоидов, таких как физиологический раствор. Альбумин используют чаще всего, так как он связан с более низкой частотой аллергических или иммунных реакций (например, острого повреждения легких, связанного с переливанием крови) по сравнению с плазмой и не связан с риском трансфузионно-трансмиссивного заболевания [12, 36, 37]. В Table 3S суммированы плюсы и минусы каждого подхода. При использовании альбумина в качестве заместительного раствора после сеанса ТПО может наблюдаться метаболический ацидоз [38]. Замена альбумина может также влиять на концентрацию фибриногена и других факторов коагуляции, приводя к глубоким нарушениям параметров тромбоэластографии [39]. Плазма показана для замены компонентов плазмы (например, ADAMTS13 при тромботической тромбоцитопенической пурпуре). Несмотря на отсутствие веских доказательств, многие центры также используют плазму для предотвращения истощения факторов свертывания крови (например, при наличии геморрагического диатеза или планировании инвазивной процедуры). Установленные рекомендации по мониторингу/управлению гемостазом во время ТПО отсутствуют, но необходимо учитывать экстракорпоральные потери как про-, так и антикоагулянтных факторов [40].
Недавнее исследование, проведенное подкомитетом ASFA, выявило широкое практическое разнообразие типов заместительной жидкости, но чаще всего выбор определяется потенциальным риском кровотечения [41]. Из-за большого объема, количества контактов с донорами и часто длительной терапии риск аллергических реакций выше при использовании плазмы, чем при использовании альбумина, и в некоторых центрах при использовании плазмы назначают антигистаминные препараты и/или глюкокортикоиды [42]. При использовании плазмы в качестве заместительного раствора может возникнуть метаболический алкалоз из-за метаболизма цитрата, используемого в качестве антикоагулянта, и цитрата, присутствующего в плазме. На каждую метаболизированную молекулу цитрата приходится потребление ионов водорода и производство трех молекул бикарбоната натрия, что повышает уровень pH в сыворотке [43].
Кристаллоиды могут быть добавлены для уменьшения затрат и у пациентов с синдромом повышенной вязкости.Однако замена плазмы кристаллоидами сопряжена с риском гипотензии, если доля замещения кристаллоидами превышает 30% [44]. В этих условиях могут происходить значительные сдвиги жидкости, поскольку вода следует градиенту своей концентрации из внутрисосудистого пространства во внесосудистое пространство. Когда кристаллоиды используются в качестве частчной замены, их следует вводить в начале заместительной терапии, а не в конце, чтобы избежать значительного смещения жидкости и гипотензии. Гидроксиэтилкрахмал (ГЭК) больше не рекомендуется пациентам в критическом состоянии из-за его вредного воздействия как на функцию почек, так и на свертываемость крови. Тем не менее, он все еще иногда используется в качестве заместительной терапии (например, 3% ГЭК с 5% человеческим альбумином), особенно в системах здравоохранения с ограниченными ресурсами [45, 46]. Его также можно использовать у пациентов, которые отказываются от препаратов крови.
Клинический ответ
Ожидаемые преимущества и потенциально вредные эффекты ТПО зависят от сроков проведения процедуры по отношению к началу заболевания, объема заменяемой жидкости, типа замещающего раствора, а также частоты и интервалов удаления плазмы. Индивидуальные критерии «клинического ответа» очень специфичны для заболевания и варьируют от изменений отдельных или нескольких гематологических параметров, концентраций антител или биохимических параметров до улучшения клинических признаков и симптомов. Воздействие TПО может быть быстрым или медленным и может длиться от нескольких недель до месяцев, в зависимости от основного заболевания. Однако о долгосрочных эффектах, включая психологическое благополучие и риске хронической органной дисфункции после острого заболевания, сообщают редко.
Осложнения
ТПО – относительно безопасная процедура, обычно хорошо переносимая. Осложнения включают события, связанные с катетером и процедурой. Частота нежелательных явлений со временем снизилась [47, 48] и в настоящее время колеблется от 5 до 36% в зависимости от используемого сосудистого доступа, типа заместительной жидкости и антикоагулянтной терапии (Table 4S). Инфекции, связанные с катетером, пневмоторакс и местное кровотечение были зарегистрированы у 0,4–1,6% пациентов [49, 50]. У пациентов в критическом состоянии нарушения свертываемости крови встречались редко (<10%), но наиболее частым осложнением было нарушение функции катетера (32%) [30]. Частота осложнений была одинаковой при использовании мТПО и цТПО [30]. Потенциально опасные для жизни осложнения, среди которых преобладали анафилактоидные реакции и тяжелая гипотензия, были зарегистрированы в 1–2% сеансов ТПО у пациентов в критическом состоянии [30, 51]. Их следует свести к минимуму путем разумного выбора сосудистого доступа в тесном сотрудничестве со специалистом по аферезу. Цитратная антикоагулянтная терапия и замещение плазмы являются факторами риска гипокальциемии и парестезии [52]. Замена плазмой связана с более высоким риском анафилактоидных реакций. С другой стороны, замена альбумином не корректирует истощение и балансировку факторов свертывания крови и иммуноглобулинов, что приводит к потенциальному риску кровотечения и инфекции соответственно.
Удаление лекарственных препаратов при ТПО
Данные об удалении лекарств с помощью ТПО немногочисленны и основаны только на сообщениях о случаях или сериях случаев [53, 54]. По большинству препаратов либо нет информации, либо она не имеет важного клинического значения. Для сильно связанных с белком препаратов с низким объемом распределения и для химерных антител характерно очень эффективное удаление. Факторы, связанные с клинически значимым выведением лекарственного средства, включают характеристики лекарственного средства (объем распределения, сродство к связыванию с белками, скорость эндогенного клиренса, период полураспределения, дозозависимая фармакодинамика), характеристики ТПО (объем удаляемой плазмы, интервал между сеансами, время между первым и последним сеансом) и время введения препарата [54–57]. Важные меж- и внутри-индивидуальные различия в фармакокинетике, а также многокомпонентные кинетические паттерны, наблюдаемые во время ТПО, могут сильно затруднить прогнозирование.
Недавно был рассмотрен вопрос об удалении антибиотиков во время ТПО [53, 56]. Следует ли вводить антибиотик до или после ТПО, зависит также от его фармакодинамических характеристик. Аминогликозиды лучше всего вводить перед процедурой, так как они обладают высоким пиковым бактерицидным эффектом и сниженной токсичностью, связанной с низким минимальным уровнем за счет экстракорпорального удаления. Уровни бета-лактама в плазме, с другой стороны, должны поддерживаться выше минимальной ингибирующей концентрации, что часто требует дополнительной дозы после процедуры. Моноклональные антитела, такие как ритуксимаб, имеют небольшой объем распределения и длительный период полувыведения и поэтому значительно удаляются с помощью ТПО [58]. При ТПО общий клиренс препарата со временем снижается по мере снижения уровня в плазме [59]. Хотя уровни моноклональных антител коррелируют с клиническими эффектами, они могут не коррелировать с фармакодинамическими маркерами (например, количеством CD20 + B-клеток для ритуксимаба) [54]. Сообщалось о значительном удалении эноксапарина, такролимуса и микофеноловой кислоты во время ТПО [60, 61].
Большинство исследований включало введение лекарств после ТПО и планирование следующего сеанса ТПО через 24–36 часов. В целом, терапевтический лекарственный мониторинг должен применяться, когда это возможно, у пациентов в критическом состоянии, подвергающихся серийным сеансам ТПО, особенно если препарат имеет узкий терапевтический индекс. Время отбора проб должно учитывать перераспределение после процедуры с восстановлением концентрации в плазме.
Вопросы без ответов и программа исследований. Потенциальные новые механизмы и новые показания для ТПО в ОИТ
Считается, что для наиболее неотложных показаний к ТПО при интенсивной терапии, перечисленных в Table 1, эффективность ТПО связана с удалением патогенных веществ и/или предоставлением дефицитных защитных молекул. Эта классическая концепция очистки крови может применяться к системным воспалительным синдромам, возникающим при самых разных критических состояниях, но время и баланс противовоспалительных/провоспалительных средств могут иметь решающее значение для определения пользы и потенциального вреда. Таким образом, воспалительные процессы с коагулопатией потребления в диапазоне от тромбоцитопении до диссеминированного внутрисосудистого свертывания крови могут реагировать на ТПО. Кроме того, TПО удаляет молекулярные паттерны, связанные с повреждением (DAMP), которые высвобождаются поврежденными клетками и могут запускать и закреплять полиорганную дисфункцию. У пациентов с сепсисом и полиорганной дисфункцией ТПО может привести к купированию шока и улучшить сосудистую проницаемость и нарушения коагуляции, а иметь тенденцию к улучшению выживаемости [62–64].
Учитывая способность ТПО модулировать системное воспаление и коагулопатию, вызвали интерес потенциальные преимущества у пациентов с тяжелой формой COVID-19 [65, 66]. Кроме того, TПО может корректировать повышенный мультимер фактора фон Виллебранда и сниженную активность ADAMTS13 у пациентов с COVID-19 [67]. В одном небольшом рандомизированном контролируемом исследовании было показано более быстрое выздоровление, но не влияние на смертность [68]. Многие исследования, в том числе рандомизированные контролируемые испытания, продолжаются для проверки различных гипотез. Помимо сепсиса, клинические сценарии, характеризующиеся системным воспалительным ответом, который может улучшиться при ТПО, включают гемофагоцитарный лимфогистиоцитоз, синдром активации макрофагов, синдром высвобождения цитокинов, ассоциированный с химерным антигенным рецептором Т-клеток, тяжелый панкреатит и тяжелые ожоги. До сих пор текущие доказательства остаются ограниченными сериями случаев и неконтролируемыми обсервационными исследованиями. Наконец, недавно ТПО применяли в рефрактерных случаях индуцированного вакцинами тромбоза и тромбоцитопении, которые можно было бы добавить в список неотложной терапии, хотя данные все еще ограничены [69].
Начало ТПО
Необходимо определить подходящее время начала ТПО. Уровни биомаркеров, титры антител или клинические симптомы, подтверждающие начало ТПО, различаются в зависимости от показаний. Необходимо определить конкретные пороговые значения, различных тестов, связанные с неудовлетворительными результатами. Следует отметить, что воспалительные синдромы, встречающиеся в ОИТ, также могут служить маркерами для мониторинга эффективности ТПО, такими как маркеры активации эндотелия и первичного гемостаза. Хотя травма и сепсис являются разными состояниями, в обоих случаях повышение биомаркеров потери гликокаликса, таких как синдекан-1 и гепарансульфат, связано с неблагоприятными исходами [70], и их уровни могут быть снижены с помощью ТПО [71]. Кроме того, дисбаланс между ADAMTS13 и фактором фон Виллебранда обнаруживается как при сепсисе, так и при травмах. Были предложены определенные пороговые значения, но остается неизвестным, полезны ли они для определения показаний и мониторинга TПО.
Сравнение TПО с другими вмешательствами
Для большинства состояний эффективность ТПО по сравнению с другими методами неизвестна. При СГБ и миастении эффективность ТПО сравнивали с эффективностью внутривенного введения иммуноглобулина или их комбинации [72]. Для состояний, связанных с патогенными антителами, данные ограниченного уровня свидетельствуют о том, что TПО и более селективные методы иммуноадсорбции могут иметь одинаковую эффективность, но необходимы дополнительные исследования. Кроме того, в некоторых случаях новые данные могут поставить под сомнение преимущества TПО. Испытания, такие как исследование PEXIVAS, привели к тому, что AFSA изменило показания для ТПО для тяжелого ANCA -ассоциированного васкулита с категории I на категорию II [73, 74].
Технические аспекты TПО
Мало доказательств в поддержку стандартных схем ТПО у пациентов в ОИТ. В частности, все существующие схемы лечения были разработаны на основе длительного опыта работы с стационарными или амбулаторными пациентами. У пациентов в ОИТ, вероятно, изменились объемы распределения из-за недостаточности органов, капиллярной утечки и/или гипоальбуминемии. В идеале схемы ТПО должны быть адаптированы к потребностям каждого пациента. Необходима дополнительная информация об оптимальных интервалах и объемах ТПО для пациентов в критическом состоянии, а также об оптимальных заместительных растворах и длительности лечения.
Выводы
ТПО — признанная терапия в современной интенсивной терапии. Он включает центробежные и мембранные методики и требует замены жидкости плазмой или раствором альбумина. Мы обобщили ключевые моменты для специалистов, не занимающихся ТПО (Table 3). Хотя ТПО считается терапией первой или второй линии при многих расстройствах, остаются значительные пробелы в знаниях, особенно в отношении точных триггеров и пороговых значений для начала, оптимальных маркеров для мониторинга и триггеров для прекращения процедуры. Более того, интерпретация рутинных лабораторных анализов крови и дозировка лекарственных средств во время ТПО затруднены. Необходимы дополнительные наблюдательные и интервенционные исследования, чтобы заполнить существующие пробелы в знаниях, выявить пациентов, которым ТПО может принести пользу, и избежать ТПО у тех, кому она не принесет пользы или может причинить вред.

Ссылка на документ с дополнительными данными исследования (Supplementary)
References
1. Reeves HM, Winters JL (2014) The mechanisms of action of plasma exchange. Br J Haematol 164:342–351.https://doi.org/10.1111/bjh.12629
2. Padmanabhan A, Connelly-Smith L, Aqui N, Balogun RA, Klingel R, Meyer E, Pham HP, Schneiderman J, Witt V, WuY, Zantek ND, Dunbar NM, Schwartz GEJ (2019) Guidelines on the use of therapeutic apheresis in clinical practice—evidence-based approach from the Writing Commit- tee of the American Society for Apheresis: the eighth special issue. JClin Apher 34:171–354. https://doi.org/10.1002/jca.21705
3. Abe T, Matsuo H, Abe R, Abe S, Asada H, Ashida A, Baba A, Eguchi K, Eguchi Y, Endo Y, Fujimori Y, Furuichi K, Furukawa Y, Furuya M, Furuya T, Hanafusa N, Hara W, Harada-Shiba M, Hasegawa M, Hattori N, Hattori M, Hidaka S,Hidaka T, Hirayama C, Ikeda S, Imamura H, Inoue K, Ishizuka K, Ishizuka K, Ito T, Iwamoto H, Izaki S, Kagitani M, Kaneko S, Kaneko N, Kanekura T, Kitagawa K, Kusaoi M, Lin Y, Maeda T, Makino H, Makino S, Matsuda K, MatsuganeT, Minematsu Y, Mineshima M, Miura K, Miyamoto K, Moriguchi T, Murata M, Naganuma M, Nakae H, Narukawa S,Nohara A, Nomura K, Ochi H, Ohkubo A, Ohtake T, Okada K, Okado T, Okuyama Y, Omokawa S, Oji S, Sakai N,Sakamoto Y, Sasaki S, Sato M, Seishima M, Shiga H, Shimohata H, Sugawara N, Sugimoto K, Suzuki Y, Suzuki M,Tajima T, Takikawa Y, Tanaka S, Taniguchi K, Tsuchida S, Tsukamoto T, Tsushima K, Ueda Y, Wada T, Yamada H,Yamada H, Yamaka T, Yamamoto K, Yokoyama Y, Yoshida N, Yoshioka T, Yamaji K (2021) The Japanese Society forApheresis clinical practice guideline for therapeutic apheresis. Ther Apher Dial 25:728–876. https://doi.org/10.1111/1744-9987.13749
4. Pham HP, Schwartz J (2019) Therapeutic plasma exchange in Guillain- Barre Syndrome and chronic inflammatorydemyelinating polyradiculo- neuropathy. Presse Med 48:338–346. https://doi.org/10.1016/j.lpm.2019. 03.016
5. Chevret S, Hughes RA, Annane D (2017) Plasma exchange for Guillain- Barré syndrome. Cochrane Database Syst Rev2:CD001798. https://doi. org/10.1002/14651858.CD001798.pub3
6. Gilhus NE (2016) Myasthenia gravis. N Engl J Med 375:2570–2581. https:// doi.org/10.1056/NEJMra1602678
7. Barth D, Nabavi Nouri M, Ng E, Nwe P, Bril V (2011) Comparison of IVIg and PLEX in patients with myasthenia gravis.Neurology 76:2017–2023. https://doi.org/10.1212/WNL.0b013e31821e5505
8. Naciri Bennani H, Noble J, Chevallier E, Terrec F, Motte L, Giroux-Lathuile C, Bugnazet M, Imerzoukene F, Janbon B,Malvezzi P, Rostaing L, Jouve T (2021) Isoagglutinin removal by plasma centrifugation or filtration (single or double): aprospective study in a single center. J Clin Apher 36:149–160. https://doi.org/10.1002/jca.21857
9. Yeh JH, Chen WH, Chiu HC (2003) Predicting the course of myasthenic weakness following double filtrationplasmapheresis. Acta Neurol Scand 108(3):174–178. https://doi.org/10.1034/j.1600-0404.2003.00107.x
10. Reverberi R, Reverberi L (2007) Removal kinetics of therapeutic apheresis. Blood Transfus 5:164–174.https://doi.org/10.2450/2007.0032-07
11. Ward DM (2011) Conventional apheresis therapies: a review. J Clin Apher 26:230–238. https://doi.org/10.1002/jca.20302
12. Hafer C, Golla P, Gericke M, Eden G, Beutel G, Schmidt JJ, Schmidt BM, De Reys S, Kielstein JT (2016) Membraneversus centrifuge-based therapeutic plasma exchange: a randomized prospective crossover study. Int Urol Nephrol 48:133–138. https://doi.org/10.1007/s11255-015-1137-3
13. Stahl K, Bikker R, Seeliger B, Schmidt JJ, Schenk H, Schmidt BMW, Welte T, Haller H, Hoeper MM, Brand K, David S (2021) Effect of therapeutic plasma exchange on immunoglobulin deficiency in early and severe septic shock. J IntensiveCare Med 36:1491–1497. https://doi.org/10. 1177/0885066620965169
14. Hafer C, Kielstein JT (2017) Pro: High dose of therapeutic plasma exchange-mind the gap! Nephrol Dial Transplant32:1457–1460. https:// doi.org/10.1093/ndt/gfx084
15. Schmidt JJ, Asper F, Einecke G, Eden G, Hafer C, Kielstein JT (2018) Therapeutic plasma exchange in a tertiary carecenter: 185 patients undergo- ing 912 treatments—a one-year retrospective analysis. BMC Nephrol 19:12.https://doi.org/10.1186/s12882-017-0803-3
16. Sharma RR, Saluja K, Jain A, Dhawan HK, Thakral B, Marwaha N (2011) Scope and application of therapeuticapheresis: experience from a ter- tiary care hospital in North India. Transfus Apher Sci 45:239–245. https://doi.org/10.1016/j.transci.2011.09.002
17. Islam MB, Islam Z, Rahman S, Endtz HP, Vos MC, van der Jagt M, van Doorn PA, Jacobs BC, Mohammad QD (2017) Small volume plasma exchange for Guillain-Barré syndrome in resource poor settings: a safety and feasibility study. Pilot Feasibility Stud 3:40. https://doi.org/10.1186/ s40814-017-0185-0
18. ERBP Guideline Development Group on Vascular Access, Gatta G (2020) Linee guida di pratica clinica sulla cura peri- epost-operatoria delle fistole e delle protesi arterovenose per emodialisi negli adulti. Sintesi delle raccomandazioni delle"European Renal Best Practice (ERBP)". G Ital Nefrol 37(Suppl 75):S75
19. Azoulay E, Bauer PR, Mariotte E, Russell L, Knoebl P, Martin-Loeches I, Pène F, Puxty K, Povoa P, Barratt-Due A,Garnacho-Montero J, Wendon J, Munshi L, Benoit D, von Bergwelt-Baildon M, Maggiorini M, Coppo P, Cataland S, Veyradier A, Van de Louw A, Investigators N-i (2019) Expert statement on the ICU management of patients with thrombotic thrombocytopenic purpura. Intensive Care Med 45:1518–1539. https://doi.org/10.1007/ s00134-019-05736-5
20. Reimann PM, Mason PD (1990) Plasmapheresis: technique and complications. Intensive Care Med 16:3–10.https://doi.org/10.1007/BF01706318
21. Cid J, Molina JM, Mustieles MJ, Periáñez M, Lozano M (2015) Comparison of plasma exchange procedures using threeapheresis systems. Transfu- sion 55:1001–1007. https://doi.org/10.1111/trf.12948
22. Winters JL, Burgstaler EA, Gottschall JL, Balogun RA, Houghton JR, Lee WJ, Snyder EL (2013) A multicenterevaluation of a new therapeutic plasma exchange procedure. Transfusion 53:3269–3278. https://doi.org/10.1111/trf.12189
23. Burgstaler EA, Pineda AA (2001) Therapeutic plasma exchange: a paired comparison of Fresenius AS104 vs. COBESpectra J Clin Apher 16:61–66. https://doi.org/10.1002/jca.1014
24. Tormey CA, Peddinghaus ME, Erickson M, King KE, Cushing MM, Bill J, Goodrich T, Snyder EL (2010) Improvedplasma removal efficiency for therapeutic plasma exchange using a new apheresis platform. Transfu- sion 50:471–477.https://doi.org/10.1111/j.1537-2995.2009.02412.x
25.
Lambert C, Gericke M, Smith R, Hermans C (2011) Plasma extraction rate and collection efficiency during therapeuticplasma exchange with Spec- tra Optia in comparison with Haemonetics MCS . J Clin Apher 26:17–22.https://doi.org/10.1002/jca.20271
26. Kes P, Janssens ME, Bašić-Jukić N, Kljak M (2016) A randomized crossover study comparing membrane and centrifugal therapeutic plasma exchange procedures. Transfusion 56:3065–3072. https://doi.org/10. 1111/trf.13850
27. Ipe TS, Marques MB (2018) Vascular access for therapeutic plasma exchange. Transfusion 58(Suppl 1):580–589.https://doi.org/10.1111/trf. 14479
28. Doggett BM, Session-Augustine N, Roig J, Strunk M, Valiyaparambil S, Sarode R, De Simone N (2019) Single-needle:an effective alternative to dual-needle peripheral access in therapeutic plasma exchange. J Clin Apher 34:21–25.https://doi.org/10.1002/jca.21665
29. Mustieles MJ, Acosta M, Cid J, Jiménez M, Mateo D, Andreu B, Alba C, Perea D, Lozano M (2020) Peripheral venousaccess devices for apheresis: 16-gauge is not always needed. Transfusion 60:607–612. https://doi.org/ 10.1111/trf.15698
30. Lemaire A, Parquet N, Galicier L, Boutboul D, Bertinchamp R, Malphettes M, Dumas G, Mariotte E, Peraldi MN,Souppart V, Schlemmer B, Azoulay E, Canet E (2017) Plasma exchange in the intensive care unit: Technical aspects andcomplications. J Clin Apher 32:405–412. https://doi.org/10. 1002/jca.21529
31. Brunetta Gavranić B, Bašić-Jukić N, Premužić V, Kes P (2017) Membrane therapeutic plasma exchange with andwithout heparin anticoagulation. J Clin Apher 32:479–485. https://doi.org/10.1002/jca.21544
32. Kissling S, Legallais C, Pruijm M, Teta D, Vogt B, Burnier M, Rondeau E, Ridel C (2017) A new prescription model forregional citrate anticoagulation in therapeutic plasma exchanges. BMC Nephrol 18:81. https://doi.org/10. 1186/s12882-017-0494-9
33. Stegmayr B, Ptak J, Wikström B, Berlin G, Axelsson CG, Griskevicius A, Centoni P, Liumbruno G, Molfettini P, Audzijoniene J, Mokvist K, Sojka BN, Norda R, Knutson F, Ramlow W, Blaha M, Witt V, Evergren M, Tomaz J (2008)World apheresis registry 2003–2007 data. Transfus Apher Sci 39:247–254. https://doi.org/10.1016/j.transci.2008.09.003
34. Toss F, Edgren G, Berlin G, Stegmayr B, Witt V (2018) Does prophylactic calcium in apheresis cause more harm thangood?—Centre heterogene- ity within the World Apheresis Association Register prevents firm conclu- sions. Vox Sang113:632–638. https://doi.org/10.1111/vox.12698
35. Kaplan A, Raut P, Totoe G, Morgan S, Zantek ND (2016) Management of systemic unfractionated heparin anticoagulation during therapeutic plasma exchange. J Clin Apher 31:507–515. https://doi.org/10.1002/jca. 21441
36. Tutarel O, Golla P, Beutel G, Bauersachs J, David S, Schmidt BM, Lichting- hagen R, Kielstein JT (2012) Therapeuticplasma exchange decreases levels of routinely used cardiac and inflammatory biomarkers. PLoS ONE 7:e38573.https://doi.org/10.1371/journal.pone.0038573
37. Schmidt JJ, Jahn J, Golla P, Hafer C, Kielstein JT, Kielstein H (2015) Effect of therapeutic plasma exchange on plasmalevels and total removal of adipokines and inflammatory markers. BMC Obes 2:37. https://doi.org/10. 1186/s40608-015-0067-z
38. Cid J, Carbassé G, Gamir M, Jiménez M, Arellano-Rodrigo E, Lozano M (2015) Acid-base balance disturbances in plasma exchange depend on the replacement fluid used. Transfusion 55:2653–2658. https://doi.org/10. 1111/trf.13215
39. Flaum MA, Cuneo RA, Appelbaum FR, Deisseroth AB, Engel WK, Gralnick HR (1979) The hemostatic imbalance ofplasma-exchange transfusion. Blood 54:694–702
40. Zantek ND, Boral LI, Li Y, Yamada C, Svensson AM, Crane JE, Smith RE, Pagano MB, Rollins-Raval MA, Schmidt AE,Wong ECC, Wu Y (2018) Hemostasis management and therapeutic plasma exchange: results of a practice survey. J Clin Apher 33:604–610. https://doi.org/10.1002/jca. 21653
41. Reutter JC, Sanders KF, Brecher ME, Jones HG, Bandarenko N (2001) Inci- dence of allergic reactions with freshfrozen plasma or cryo-supernatant plasma in the treatment of thrombotic thrombocytopenic purpura. J Clin Apher 16:134–138. https://doi.org/10.1002/jca.1025
42. Dzik WH, Kirkley SA (1988) Citrate toxicity during massive blood transfu- sion. Transfus Med Rev 2:76–94. https://doi.org/10.1016/s0887-7963(88) 70035-8
43. Irani MS, Toushan M, Zhang L, Simpson PM, Karafin MS (2019) Risk of hypotensive reactions is increased when usingpartial saline replacement for therapeutic plasma exchange. J Clin Apher 34:524–527. https://doi. org/10.1002/jca.21703
44. Radhakrishnan M, Batra A, Periyavan S, Philip M, Anand V (2018) Hydroxy- ethyl starch and kidney function: aretrospective study in patients under- going therapeutic plasma exchange. J Clin Apher 33:278–282. https://doi.org/10.1002/jca.21598
45. Agreda-Vásquez GP, Espinosa-Poblano I, Sánchez-Guerrero SA, Crespo- Solís E, Cabrera-Vásquez S, López-Salmorán J, Barajas J, Peñaloza-Ramírez P, Tirado-Cárdenas N, Velázquez A (2008) Starch and albumin mixture as replacementfluid in therapeutic plasma exchange is safe and effective. J Clin Apher 23:163–167. https://doi.org/10.1002/jca.20175
46. Blasi A, Cid J, Beltran J, Taurà P, Balust J, Lozano M (2016) Coagulation profile after plasma exchange using albuminas a replacement solution measured by thromboelastometry. Vox Sang 110:159–165. https://doi. org/10.1111/vox.12347
47. Korach JM, Petitpas D, Poiron L, Vincent N, Berger PH, Chillet P, French Registry Study Group (2001) 14 years oftherapeutic plasma exchange in France. Transfus Apher Sci 25:73–77. https://doi.org/10.1016/s1473- 0502(01)00090-8
48. Som S, Deford CC, Kaiser ML, Terrell DR, Kremer Hovinga JA, Lämmle B, George JN, Vesely SK (2012) Decreasingfrequency of plasma exchange complications in patients treated for thrombotic thrombocytopenic purpura-hemolyticuremic syndrome, 1996 to 2011. Transfusion 52:2525–2532. https://doi.org/10.1111/j.1537-2995.2012.03646.x
49. Basic-Jukic N, Kes P, Glavas-Boras S, Brunetta B, Bubic-Filipi L, Puretic Z (2005) Complications of therapeutic plasmaexchange: experience with 4857 treatments. Ther Apher Dial 9:391–395. https://doi.org/10.1111/j. 1744-9987.2005.00319.x
50. Couriel D, Weinstein R (1994) Complications of therapeutic plasma exchange: a recent assessment. J Clin Apher 9:1–5.https://doi.org/10. 1002/jca.2920090102
51. Szczeklik W, Wawrzycka K, Włudarczyk A, Sega A, Nowak I, Seczyńska B, Fajfer I, Zając K, Królikowski W, Kózka M(2013) Complications in patients treated with plasmapheresis in the intensive care unit. Anaesthesiol Intensive Ther 45:7–13. https://doi.org/10.5603/AIT.2013.0002
52. Shemin D, Briggs D, Greenan M (2007) Complications of therapeutic plasma exchange: a prospective study of 1,727procedures. J Clin Apher 22:270–276. https://doi.org/10.1002/jca.20143
53. Cheng CW, Hendrickson JE, Tormey CA, Sidhu D (2017) Therapeutic plasma exchange and its impact on drug levels: anACLPS critical review. Am J Clin Pathol 148:190–198. https://doi.org/10.1093/ajcp/aqx056
54. McDonald V, Manns K, Mackie IJ, Machin SJ, Scully MA (2010) Rituxi- mab pharmacokinetics during themanagement of acute idiopathic thrombotic thrombocytopenic purpura. J Thromb Haemost 8:1201–1208.https://doi.org/10.1111/j.1538-7836.2010.03818.x
55. Ibrahim RB, Liu C, Cronin SM, Murphy BC, Cha R, Swerdlow P, Edwards DJ (2007) Drug removal by plasmapheresis:an evidence-based review. Phar- macotherapy 27:1529–1549. https://doi.org/10.1592/phco.27.11.1529
56. Krzych ŁJ, Czok M, Putowski Z (2020) Is antimicrobial treatment effective during therapeutic plasma exchange? Investigating the role of possible interactions. Pharmaceutics 12:395. https://doi.org/10.3390/pharmaceut ics12050395
57. Ibrahim RB, Balogun RA (2012) Medications in patients treated with therapeutic plasma exchange: prescription dosage,timing, and drug overdose. Semin Dial 25:176–189. https://doi.org/10.1111/j.1525-139X. 2011.01030.x
58. Puisset F, White-Koning M, Kamar N, Huart A, Haberer F, Blasco H, Le Guellec C, Lafont T, Grand A, Rostaing L,Chatelut E, Pourrat J (2013) Popu- lation pharmacokinetics of rituximab with or without plasmapheresis in kidney patientswith antibody-mediated disease. Br J Clin Pharmacol 76:734–740. https://doi.org/10.1111/bcp.12098
59. Petitcollin A, Bensalem A, Verdier MC, Tron C, Lemaitre F, Paintaud G, Bellissant E, Ternant D (2020) Modelling ofthe time-varying pharma- cokinetics of therapeutic monoclonal antibodies: a literature review. Clin Pharmacokinet 59:37–49. https://doi.org/10.1007/s40262-019-00816-7
60. Peters BJ, Hofer M, Daniels CE, Winters JL (2018) Effect of plasma exchange on antifactor Xa activity of enoxaparinand serum leveti- racetam levels. Am J Health Syst Pharm 75:1883–1888. https://doi.org/10. 2146/ajhp170885
61. Kawauchi S, Wada K, Oita A (2019) Changes in blood concentration of mycophenolic acid and FK506 in a heart-transplant patient treated with plasmapheresis. Int J Clin Pharmacol Ther 57:32–36. https://doi.org/10. 5414/CP20327
62. Knaup H, Stahl K, Schmidt BMW, Idowu TO, Busch M, Wiesner O, Welte T, Haller H, Kielstein JT, Hoeper MM, David S (2018) Early therapeutic plasma exchange in septic shock: a prospective open-label nonrand- omized pilot studyfocusing on safety, hemodynamics, vascular barrier function, and biologic markers. Crit Care 22:285. https://doi.org/10.1186/ s13054-018-2220-9
63. Stahl K, Schmidt JJ, Seeliger B, Schmidt BMW, Welte T, Haller H, Hoeper MM, Budde U, Bode C, David S (2020) Effectof therapeutic plasma exchange on endothelial activation and coagulation-related parameters in septic shock. Crit Care 24:71. https://doi.org/10.1186/ s13054-020-2799-5
64. David S, Bode C, Putensen C, Welte T, Stahl K, EXCHANGE Study Group (2021) Adjuvant therapeutic plasmaexchange in septic shock. Intensive Care Med 47:352–354. https://doi.org/10.1007/s00134-020-06339-1
65. Memish ZA, Faqihi F, Alharthy A, Alqahtani SA, Karakitsos D (2021) Plasma exchange in the treatment of complexCOVID-19-related critical illness: controversies and perspectives. Int J Antimicrob Agents 57:106273.https://doi.org/10.1016/j.ijantimicag.2020.106273
66. Fernandez J, Gratacos-Ginès J, Olivas P, Costa M, Nieto S, Mateo D, Sánchez MB, Aguilar F, Bassegoda O, Ruiz P,Caballol B, Pocurull A, Llach J, Mustieles MJ, Cid J, Reverter E, Toapanta ND, Hernández-Tejero M, Martínez JA, Claria J,Fernández C, Mensa J, Arroyo V, Castro P, Lozano M, Covid Clinic Critical Care (CCCC) Group (2020) Plasmaexchange: an effec- tive rescue therapy in critically ill patients with coronavirus disease 2019 infection. Crit Care Med48:e1350–e1355. https://doi.org/10.1097/CCM. 0000000000004613
67. Doevelaar AAN, Bachmann M, Hölzer B, Seibert FS, Rohn BJ, Bauer F, Witzke O, Dittmer U, Bachmann M, Yilmaz S,Dittmer R, Schneppenheim S, Babel N, Budde U, Westhoff TH (2021) von Willebrand factor multimer formation contributes to immunothrombosis in coronavirus disease 2019. Crit Care Med 49:e512–e520.https://doi.org/10.1097/CCM.00000 00000004918
68. Faqihi F, Alharthy A, Abdulaziz S, Balhamar A, Alomari A, AlAseri Z, Tamim H, Alqahtani SA, Kutsogiannis DJ,Brindley PG, Karakitsos D, Memish ZA (2021) Therapeutic plasma exchange in patients with life-threatening COVID-19:a randomised controlled clinical trial. Int J Antimicrob Agents 57:106334.https://doi.org/10.1016/j.ijantimicag.2021.106334
69. Pavord S, Scully M, Hunt BJ, Lester W, Bagot C, Craven B, Rampotas A, Ambler G, Makris M (2021) Clinical featuresof vaccine-induced immune thrombocytopenia and thrombosis. N Engl J Med 385:1680–1689.https://doi.org/10.1056/NEJMoa2109908
70. Dogné S, Flamion B (2020) Endothelial glycocalyx impairment in disease: focus on hyaluronan shedding. Am J Pathol190:768–780. https://doi.org/ 10.1016/j.ajpath.2019.11.016
71. Stahl K, Hillebrand UC, Kiyan Y, Seeliger B, Schmidt JJ, Schenk H, Pape T, Schmidt BMW, Welte T, Hoeper MM,Sauer A, Wygrecka M, Bode C, Wede- meyer H, Haller H, David S (2021) Effects of therapeutic plasma exchange on theendothelial glycocalyx in septic shock. Intensive Care Med Exp 9:57. https://doi.org/10.1186/s40635-021-00417-4
72. Hughes RA, Swan AV, van Doorn PA (2014) Intravenous immunoglobulin for Guillain-Barré syndrome. CochraneDatabase Syst Rev 2014:CD002063. https://doi.org/10.1002/14651858.CD002063.pub6
73. Walsh M, Merkel PA, Peh CA, Szpirt WM, Puéchal X, Fujimoto S, Hawley CM, Khalidi N, Floßmann O, Wald R, GirardLP, Levin A, Gregorini G, Harper L, Clark WF, Pagnoux C, Specks U, Smyth L, Tesar V, Ito-Ihara T, de Zoysa JR,Szczeklik W, Flores-Suárez LF, Carette S, Guillevin L, Pusey CD, Casian AL, Brezina B, Mazzetti A, McAlear CA,Broadhurst E, Reidlinger D, Mehta S, Ives N, Jayne DRW, Investigators PEXIVAS (2020) Plasma exchange andglucocorticoids in severe ANCA-associated vasculitis. N Engl J Med 382:622–631.https://doi.org/10.1056/NEJMoa1803537
74. Balogun RA, Sanchez AP, Klingel R, Witt V, Aqui N, Meyer E, Padmanabhan A, Pham HP, Schneiderman J, Schwartz J,Wu Y, Zantek ND, Connelly-Smith L, Dunbar NM (2020) Update to the ASFA guidelines on the use of therapeuticapheresis in ANCA-associated vasculitis. J Clin Apher 35:493–499. https://doi.org/10.1002/jca.21820
75. Larsen FS, Schmidt LE, Bernsmeier C, Rasmussen A, Isoniemi H, Patel VC, Triantafyllou E, Bernal W, Auzinger G,Shawcross D, Eefsen M, Bjerring PN, Clemmesen JO, Hockerstedt K, Frederiksen HJ, Hansen BA, Antoniades CG, Wendon J (2020) High-volume plasma exchange in patients with acute liver failure: an open randomised controlled trial.J Hepatol 64:69–78. https://doi.org/10.1016/j.jhep.2015.08.018
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 06.02.2023
[ACTIVE_FROM] => 06.02.2023
[SHOW_COUNTER] => 5050
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 828364
[VALUE] => плазмообмен, интенсивная терапия
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => плазмообмен, интенсивная терапия
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 828365
[VALUE] => Плазмообмен в отделении интенсивной терапии: описательный обзор
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Плазмообмен в отделении интенсивной терапии: описательный обзор
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830457
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828370
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828367
[1] => 828368
[2] => 828369
[3] => 828691
[4] => 828692
)
[VALUE] => Array
(
[0] => sepsis
[1] => Infekcionnyj kontrol'
[2] => statia
[3] => plazmoobmen
[4] => intensivnayaterapiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
[1] => Infekcionnyj kontrol'
[2] => statia
[3] => plazmoobmen
[4] => intensivnayaterapiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830457
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828370
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [
8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828367
[1] => 828368
[2] => 828369
[3] => 828691
[4] => 828692
)
[VALUE] => Array
(
[0] => sepsis
[1] => Infekcionnyj kontrol'
[2] => statia
[3] => plazmoobmen
[4] => intensivnayaterapiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
[1] => Infekcionnyj kontrol'
[2] => statia
[3] => plazmoobmen
[4] => intensivnayaterapiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Сепсис
[1] => Инфекционный контроль
[2] => Статья
[3] => Плазмообмен
[4] => Интенсивная терапия
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 03.07.2025 10:45:52
[~TIMESTAMP_X] => 03.07.2025 10:45:52
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[FULLTEXT_INDEX] => N
[~FULLTEXT_INDEX] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Плазмообмен в отделении интенсивной терапии: описательный обзор
[BROWSER_TITLE] => Плазмообмен в отделении интенсивной терапии: описательный обзор
[KEYWORDS] => плазмообмен, интенсивная терапия
[DESCRIPTION] =>
)
)



 Механизмы, кинетика и цели ТПО
Механизмы, кинетика и цели ТПО 


