Array
(
[NAME] => Питание в отделении интенсивной терапии: от острой фазы до последующего периода
[~NAME] => Питание в отделении интенсивной терапии: от острой фазы до последующего периода
[PREVIEW_PICTURE] => Array
(
[ID] => 5753
[TIMESTAMP_X] => 11.11.2024 13:57:04
[MODULE_ID] => iblock
[HEIGHT] => 667
[WIDTH] => 1000
[FILE_SIZE] => 100038
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/33b/sowmajmfqbrx3yxyfdjrusfyl5hyhy3z
[FILE_NAME] => view-healthy-food-incased-pill-shaped-container.jpg
[ORIGINAL_NAME] => view-healthy-food-incased-pill-shaped-container.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => b31227fed4c0453998611c53609d9957
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/33b/sowmajmfqbrx3yxyfdjrusfyl5hyhy3z/view-healthy-food-incased-pill-shaped-container.jpg
[UNSAFE_SRC] => /upload/iblock/33b/sowmajmfqbrx3yxyfdjrusfyl5hyhy3z/view-healthy-food-incased-pill-shaped-container.jpg
[SAFE_SRC] => /upload/iblock/33b/sowmajmfqbrx3yxyfdjrusfyl5hyhy3z/view-healthy-food-incased-pill-shaped-container.jpg
[ALT] => Питание в отделении интенсивной терапии: от острой фазы до последующего периода
[TITLE] => Питание в отделении интенсивной терапии: от острой фазы до последующего периода
)
[~PREVIEW_PICTURE] => 5753
[DETAIL_TEXT] => Angelique M. E. de Man, Jan Gunst and Annika Reintam
Blaser Nutrition in the intensive care unit: from the acute phase to beyond
Intensive Care Med.2024. doi.org/10.1007/s00134-024-07458-9
Абстракт
Последние рандомизированные контролируемые исследования (РКИ) показали отсутствие пользы, но дозозависимый вред от ранней полной нутритивной поддержки у критически больных пациентов.
Отсутствие пользы может быть объяснено анаболической резистентностью, подавлением процессов восстановления клеток и усугублением гипергликемии и потребности в инсулине. Кроме того, ранние высокие дозы аминокислот не принесли пользы, а вместо этого были связаны с вредом у пациентов с органными дисфункциями. Однако большинство исследований было сосредоточено на вмешательствах, начатых в первые дни после поступления в отделение интенсивной терапии (ОРИТ). Хотя окно вмешательства в некоторых РКИ распространялось и на постострую фазу критического заболевания, ни в одном крупном РКИ не изучалось питание, начатое после первой недели. Следовательно, отсутствуют четкие, основанные на фактических данных рекомендации о том, когда и как начинать и продолжать питание. Длительное недоедание будет иметь свою цену, поскольку не существует проверенного метаболического монитора, указывающего на готовность к лечебному питанию и адекватную реакцию на питание, которая, вероятно, варьирует у разных пациентов. Кроме того, статус микроэлементов не может быть надежно оценен, поскольку воспаление может вызвать перераспределение, поэтому концентрации микроэлементов в плазме не обязательно отражают общие запасы в организме. Более того, высокие дозы отдельных микроэлементов не оказались полезными. Соответственно, имеющиеся данные дают четкие рекомендации относительно того, каких стратегий питания следует избегать, но идеальный режим питания для отдельных пациентов остается неясным. В этом описательном обзоре мы суммируем результаты недавних исследований, обсуждаем возможные механизмы, объясняющие результаты, отмечаем ошибки в интерпретации РКИ и их влияние на клиническую практику, а также сформулировать предложения для будущих исследований.
Ключевые слова: питание, макронутриенты, глюкоза, аминокислоты, микроэлементы, критическое заболевание, интенсивная терапия.
Введение
При остром критическом заболевании стимулируется катаболизм, что приводит к атрофии мышц, слабости и невозможности отлучения от респиратора [1]. Низкое потребление белка, энергии и микроэлементов этими пациентами может усугубить катаболизм и это связано с инфекциями, задержкой выздоровления и повышенной смертностью [2–4]. Однако традиционное предположение о том, что питательные вещества могут противодействовать катаболизму и тем самым улучшать клинические результаты у пациентов в критическом состоянии подвергается сомнению совокупными данными крупных рандомизированных контролируемых исследований (РКИ), выявляющими вред полноценного питания в острой фазе [5–8]. Несмотря на то, что был предложен персонализированный подход [9, 10], инструменты мониторинга, которые бы точно определяли фактическую потребность в энергии, белке и микроэлементах для отдельного пациента, в настоящее время недоступны [4]. В этом описательном обзоре мы даем сжатую интерпретацию данных недавних РКИ, обсуждаем влияние доказательств на клиническую практику и формулируем некоторые предложения для будущих исследований.
Лечебное питание в ОРИТ: данные РКИ
Наблюдательные исследования связали кумулятивный дефицит белка и энергии с ухудшением исхода критического заболевания [2, 3, 11]. Однако результаты этих исследования также можно объяснить пищевой непереносимостью как маркером тяжести заболевания [2, 3, 12]. За последнее десятилетие было проведено несколько крупных РКИ, посвященных срокам, способу и дозировке лечебного питания у пациентов в критическом состоянии. Первым РКИ, которое поставило под сомнение предположение о том, что раннее полноценное питание будет полезным, было РКИ EPaNIC, опубликованное в 2011 году [5]. У 4640 взрослых пациентов в критическом состоянии начало парентерального питания в дополнение к недостаточному энтеральному питанию продлило зависимость от интенсивной терапии по сравнению с отсрочкой дополнительного парентерального питания до 1 недели после поступления в ОРИТ. Пациенты, получавшие раннее дополнительное парентеральное питание, имели более длительную продолжительность поддержки жизненно важных органов, больше инфекций, более высокую частоту слабости, приобретенной в ОРИТ, и нарушение восстановления после перевода из ОРИТ [5, 13]. Дополнительное парентеральное питание также не улучшило функциональный статус при выписке из больницы по оценке расстояния 6-минутной ходьбы и повседневная деятельности [5].
Эти результаты были впоследствии подтверждены у детей в критическом состоянии (РКИ PEPaNIC, N = 1440), у которых дополнительное парентеральное питание также отрицательно влияло на 2- и 4-летние исходы развития нервной системы [8, 14]. В обоих РКИ смертность не изменилась, тогда как вред от раннего парентерального питания присутствовал во всех исследуемых подгруппах, включая пациентов с высоким показателем нутритивного риска (шкала NRS ≥5), пациентов с индексом массы тела <25 или ≥40, пациентов с сепсисом, пациентам с противопоказаниями к энтеральному питанию и новорожденных в критическом состоянии [5, 8].Теоретически вред в этих РКИ можно объяснить более высокой дозой кормления (ранним перекармливанием) или вредом, специфичным для парентерального способа питания. Вторичный анализ этих РКИ показал наличие дозозависимого вреда, а не вреда от внутривенного способа питания [15, 16], что было подтверждено последующими РКИ.
Действительно, два крупных РКИ — CALORIES (N = 2400) [17] и РКИ NUTRIREA-2 (N = 2410) [6] — не обнаружили различий между энтеральным и парентеральным путем питания с одинаковой энергетической дозой в обеих группах. В РКИ Nutrirea-2, включавшем пациентов с шоком, находящихся на ИВЛ, раннее введение высоких доз энтерального питания было даже более вредным по сравнению с ранним введением высоких доз парентерального питания, поскольку вызывало потенциально летальные желудочно-кишечные осложнения [6]. В обоих РКИ пациенты были рандомизированы вскоре после поступления в ОРИТ, окно вмешательства составляло 5–7 дней. Также в трех РКИ, в которых пациенты в критическом состоянии рандомизированно получали более низкую или более высокую дозу энтерального питания, начатую в острой фазе и продолжавшуюся в течение 6 (РКИ EDEN, N = 1000), 14 (РКИ PermiT, N = 894) или 28 дней ( TARGET RCT, N = 3957), более высокие дозы энтерального питания, начатые в острой фазе, не принесли пользы, а вторичные результаты предполагали потенциальный вред [18–20].
Кроме того, в РКИ EDEN и TARGET долгосрочный функциональный результат не улучшился при использовании более высоких доз питания [21–23]. Отсутствие пользы в последних РКИ было постоянным во всех исследуемых подгруппах, включая пациентов с высоким прогнозируемым риском смерти [20], пациентов с индексом массы тела (ИМТ) <18 [20] и пациентов с сепсисом [19, 20]. В подробном апостериорном анализе РКИ PermiT ни один из изученных маркеров исходного нутритивного риска не смог выявить пациентов, которым было бы полезно раннее усиленное энтеральное питание, включая модифицированную шкалу нутритивного риска при критических состояниях (NUTRIC), ИМТ, трансферрин, фосфат, азот мочевины мочи и азотистый баланс [24]. Низкий исходный уровень преальбумина, предположительно, указывает на высокий нутритивный риск, даже связанный со значительным вредом для смертности при получении более высоких доз энтерального питания [24].
Аналогичным образом, недавнее РКИ NUTRIREA-3, в котором 3044 пациента с шоком, находящихся на искусственной вентиляции легких, рандомизировали на раннее питание с высокими дозами (25 ккал/кг/день и 1,0–1,3 г белка на кг в день) по сравнению с питанием с низкими дозами в первую неделю (6 ккал/кг/день и 0,2–0,4 г белка/кг/день), выявили вред от раннего высокодозного питания с длительной зависимостью от ОРИТ и увеличением осложнений в этой группе [7]. Важно отметить, что в РКИ NUTRIREA-3 целевые показатели питания определялись методом рандомизации; для достижения этой цели лечебное питание может проводиться как энтерально, так и парентерально [7]. Недавний метаанализ подтвердил вред раннего полноценного питания у пациентов в критическом состоянии по сравнению с допустимым недоеданием. Хотя этот метаанализ не включал РКИ EPaNIC, это, вероятно, не влияет на выводы, поскольку пациентам EPaNIC в равной степени вредило раннее полное кормление [25].
Недавний метаанализ, проведенный в рамках обновленных американских рекомендаций по лечебному питанию, не показал преимуществ дополнительного парентерального питания по сравнению с только энтеральным питанием. Тем не менее, различный дизайн включенных РКИ, с разными сроками дополнительного парентерального питания, разными сопутствующими вмешательствами и контрольными группами может усложнить интерпретацию результатов [26]. В целом, недавние РКИ показали дозозависимый вред от раннего лечебного питания у пациентов в критическом состоянии, независимо от способа и предполагаемого риска, связанного с питанием. В Table 1 суммированы РКИ, в которых сравнивалось большее и меньшее количество энергии по тому же или другому пути, при этом питание было начато вскоре после поступления в ОРИТ. В этих исследованиях мы сообщаем о потреблении энергии на третий день, поскольку более высокая цель по энергии была достигнута в соответствующей группе с высокими дозами в этот ранний момент времени. Этот момент времени также приблизительно соответствует предполагаемому концу раннего периода острой фазы, как это предложено Европейскими рекомендациями по питанию [27].
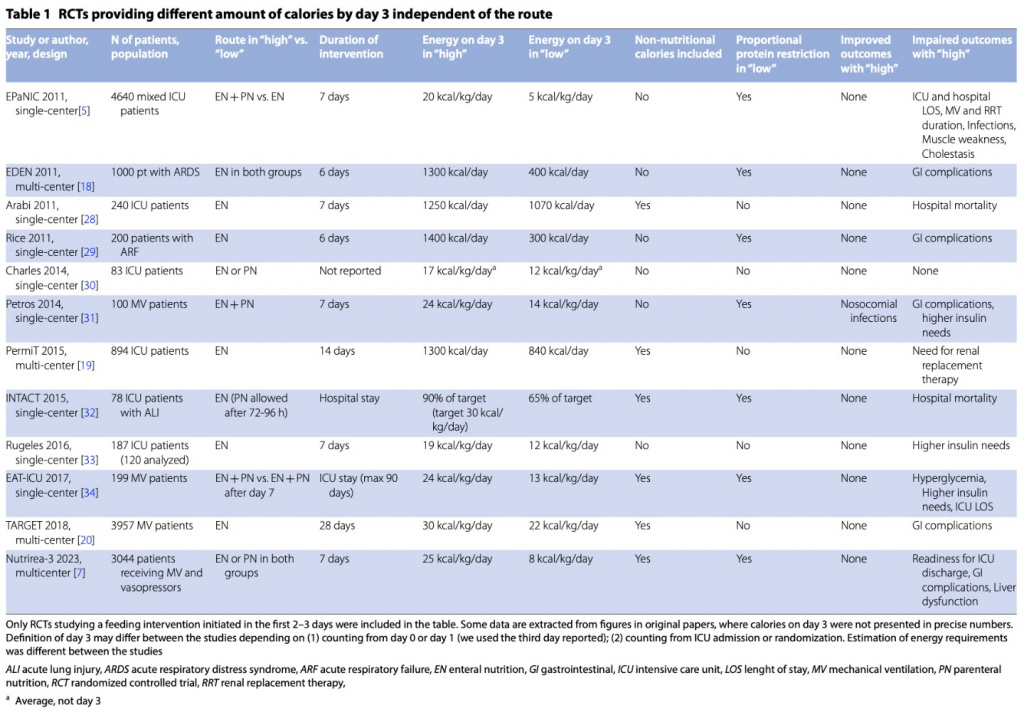
Тем не менее, продолжительность острой фазы является спорной и, вероятно, варьирует у разных пациентов.Американские рекомендации предлагают продолжительность острой фазы 7–10 дней без каких-либо различий между ранним и поздним периодами [26]. Вышеупомянутые РКИ подвергались критике за введение относительно низких доз белков и за расчет энергетической цели по фиксированной формуле [35, 36]. Однако недавние исследования не подтверждают эту критику. Действительно, помимо увеличения потребления энергии, повышенное потребление белка, начатое на ранних стадиях критического заболевания, не принесло пользы. Крупнейшее РКИ по белковым добавкам, РКИ EFFORT Protein, в котором рандомизировано 1329 пациентов в критическом состоянии для получения высокой (≥2,2 г/кг/день) или обычной (≤1,2 г/кг/день) дозы белка, начатое в течение 96 часов после поступления в ОРИТ и продолжения лечения до 28 дней не показали пользы от высоких доз белка [37].
Напротив, раннее введение высоких доз белка связано с длительным пребыванием в ОРИТ и повышенной смертностью у наиболее тяжело больных пациентов и пациентов с острым повреждением почек [37]. Кроме того, в нефро-протективном РКИ (N = 474) не было выявлено пользы от внутривенного введения аминокислот, начатого в 1 или 2 день и продолжавшегося до выписки из ОРИТ [38], а вторичный анализ РКИ EPaNIC и PEPaNIC показал вред от раннего парентерального питания, особенно с более высокими дозам белка [15, 16].Недавний метаанализ влияния более высоких и более низких доз белка у пациентов в критическом состоянии не подтвердил никакой пользы от более высоких доз белка. Метаанализ показал потенциальную гетерогенность лечения, однако значительный вред смертности ограничивается пациентами с острым повреждением почек, что требует дальнейшего изучения [39].
Второй причиной, по которой недавние РКИ не смогли показать никакой пользы от раннего усиленного лечебного питания, является отсутствие непрямой калориметрии. Действительно, точная количественная оценка расхода энергии требует непрямой калориметрии, поскольку прогностические уравнения не позволяют точно оценить расход энергии у всех пациентов [40]. Однако нет убедительных доказательств того, что раннее кормление, основанное на непрямой калориметрии, будет превосходить питание, основанное на рассчитанном целевом потреблении энергии. Хотя метаанализ показал потенциальное снижение 28-дневной смертности у взрослых в критическом состоянии, это не повлияло на 90-дневную смертность и исходы были сходными [41]. Такая временная разница в смертности может быть объяснена смешением данных в неслепых РКИ. Более того, воспринимаемая разница в смертности через 28 дней была пограничной, поскольку статистическая значимость была бы потеряна, если бы у одного пациента был другой исход 28-дневной смертности (fragility index 1). Кроме того, метаанализ включал РКИ с разным дизайном и сопутствующими вмешательствами, что еще больше усложняет интерпретацию этих результатов.
Крупнейшее РКИ, сравнивающее расчетное и измеренное целевое потребление энергии, TICACOS-International РКИ (N = 580), не выявило преимуществ кормления на основе непрямой калориметрии, начатого рано после поступления в ОРИТ [42]. Более того, исследование было прекращено преждевременно из-за медленного набора участников, что может поставить под сомнение целесообразность рутинного использования непрямой калориметрии. Очевидно, эти результаты не обязательно могут быть экстраполированы на пациентов с длительным критическим состоянием.
Влияние фактических данных на клиническую практику и рекомендации
Опубликованные исследования способа, времени и дозы питания, возможно, значительно изменили практику в Европе, как предполагают Veraar et al. [43]. Указанный момент времени для начала энтерального и/или парентерального питания был перенесен на более поздний срок вскоре после публикации исследования EPaNIC (Fig. 1). Тем не менее, в течение нескольких лет после этого постепенно возникла тенденция возврата к более раннему началу, с несколько большими различиями между респондентами. РКИ CALORIES, показавшее отсутствие различий между изокалорическим энтеральным и парентеральным питанием, возможно, способствовало этому очевидному изменению. Очевидно, что тренд учитывает только время, а не дозу, которая могла снизиться за период времени, представленный на Fig. 1.
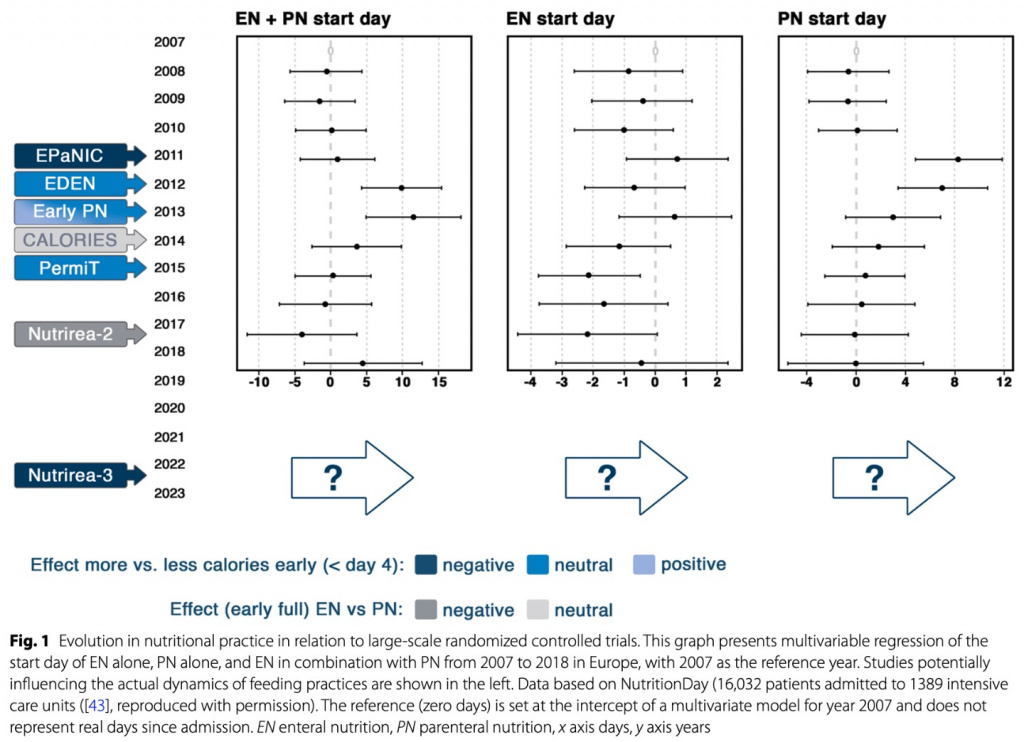
В противном случае можно было бы ожидать, что, по крайней мере, доза питания в острой фазе снизится в последующие годы, поскольку недавно РКИ Nutrirea-3 показало значительный вред от раннего введения высоких доз питания, независимо от пути введения [7]. Исследований, посвященных дозировке и способу питания, начатому после первых дней пребывания в ОРИТ, мало. В одном РКИ (N = 305) начало дополнительного парентерального питания у пациентов, не переносящих 60% или более измеренных энергетических потребностей энтеральным путем к 4-му дню после поступления в ОРИТ, не показало вреда по сравнению с отказом от дополнительного парентерального питания до 9-го дня [44]. В этом РКИ дополнительное парентеральное питание привело к значительно меньшему количеству инфекций в период с 9 по 28 день, хотя этому потенциальному позднему защитному эффекту противодействовало большее количество инфекций между 4 и 9 днями [45].
В ответ на РКИ, проведенные за последнее десятилетие, международные рекомендации по питанию изменились. Европейские рекомендации сместились в сторону рекомендаций менее агрессивного питания в острой фазе (Table 2) [40]. В то время как рекомендации 2006/2009 гг. рекомендовали начинать энтеральное питание в течение 24 часов и достигать целевого показателя калорийности (25 ккал/кг/день) в течение 2–3 дней [46, 47], рекомендации 2019 г. и частично обновленные рекомендации 2023 г. рекомендуют начинать с низкой калорийности дозирования энтерального питания в течение 48 часов после поступления в ОРИТ, если нет противопоказаний, и достижения целевого уровня энергии в течение 3–7 дней [40]. Если энтерального питания недостаточно, парентеральное питание рекомендуется начинать между 4 и 7 днями, а не в течение первых 2 дней [40, 47]. Что касается доз белка, рекомендация класса B – вводить белок в дозе 1,3–1,5 г/кг/день была преобразована в рекомендацию степени 0, в которой говорилось, что 1,3 г/кг/день можно вводить постепенно [40, 47].
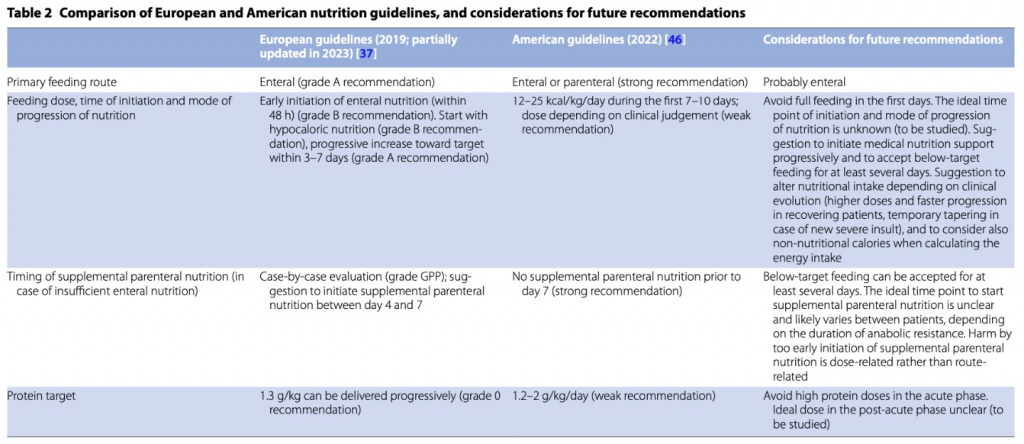
Кроме того, американские рекомендации по питанию со временем изменились, но в разной степени. В то время как рекомендации 2009 г. рекомендовали раннее начало энтерального питания и отказ от лечебного питания, если энтеральное питание невозможно [26], рекомендации 2022 г. рекомендуют либо энтеральное, либо парентеральное питание в качестве основного способа питания в первые 7–10 дней [48]. Несмотря на более низкую рекомендуемую цель по питанию, чем в рекомендациях 2009 г. (12–25 ккал/кг/день в первые 7–10 дней вместо 25–30 ккал/кг/день), более широкий диапазон по-прежнему включает полную цель сразу после госпитализации в ОРИТ [26, 48]. Однако эта рекомендация была сделана до того, как стали доступны результаты РКИ Nutrirea-3, которые показали вред от такой высокой энергетической дозы, начатой сразу после поступления в ОРИТ, по сравнению с дозой, вдвое меньшей, чем самая низкая доза, в американских рекомендациях.
Если энтерального питания недостаточно, последние рекомендации по-прежнему не рекомендуют дополнительное парентеральное питание до 7-го дня [48]. Что касается целевого уровня белка, американские рекомендации содержат слабую рекомендацию по назначению 1,2–2 г белка/кг/день. Однако это предложение было сделано до того, как было опубликовано РКИ EFFORT по белкам [37], и можно было ожидать, что обновленная версия рекомендаций больше не будет предлагать такие высокие дозы. Различия между европейскими и американскими рекомендациями отражают постоянную неопределенность в отношении оптимальной стратегии питания пациентов в критическом состоянии. Действительно, поскольку недавние крупномасштабные РКИ были в основном отрицательными, стало ясно, каких стратегий кормления следует избегать, но не то, что следует делать.
Мы предлагаем лучше отразить в рекомендациях различный уровень доказательности. В связи с этим мы предлагаем, чтобы руководства содержали четкие рекомендации, чего следует избегать, а предложения о том, что делать, могли бы быть более неточными. Стало ясно, что в острой фазе следует избегать высоких доз всех макронутриентов. Однако продолжительность острой фазы остается неясной. Это иллюстрируется различиями между европейскими и американскими рекомендациями, которые допускают питаие ниже целевого уровня в течение 3–7 дней или максимум 7–10 дней соответственно [40, 48]. Различия между международными рекомендациями могут отражать разную оценку потенциального вреда длительного периода относительного голодания и потенциального вреда слишком раннего начала полноценной нутритивной поддержки.
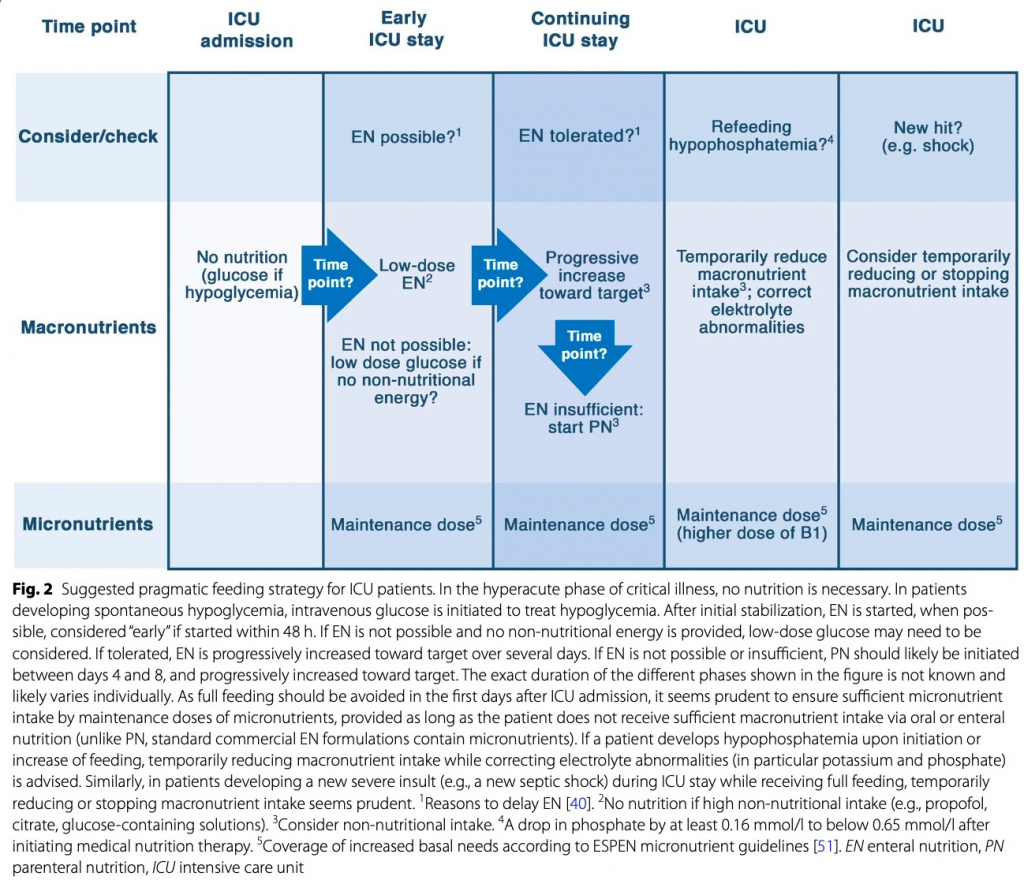
Кроме того, некоторые рекомендации в руководствах могут сбивать с толку. Принимая во внимание, что Американские рекомендации допускают раннее кормление в дозах до 25 ккал/кг/день (которые, возможно, потребуется обновить после Nutrirea-3) и предлагают либо энтеральное, либо парентеральное питание в качестве основного метода питания. И существует сильная рекомендация против дополнительного парентерального питания в течение первых 7 дней. На сегодняшний день остаются неясными оптимальная доза и режим питания в острой фазе и после нее, а также идеальный момент для начала лечебного питания. Ни в одном РКИ не оценивалось, является ли кормление низкими дозами в острой фазе более эффективным по сравнению с прогрессивным лечебным питанием, кормлением промежуточными дозами или даже отсутствием питания. Кроме того, ни в одном крупном РКИ не изучалось, действительно ли раннее энтеральное питание превосходит отсроченное [49]. Однако при начале лечебного питания мы полагаем, что энтеральное питание является основным методом питания, если нет противопоказаний. Хотя РКИ не выявили преимущества энтерального способа питания по сравнению с парентеральным, окно вмешательства было коротким. При длительном применении парентеральное питание само по себе может вызвать проблемы, как это наблюдается у пациентов с короткой кишкой [50]. Кроме того, затраты на энтеральное питание ниже. Потенциальная прагматичная стратегия питания представлена на Fig. 2.
Назначение микроэлементов при критических состояниях
Без внешнего пополнения запасы большинства микроэлементов у здоровых людей истощаются в течение недель или месяцев [51]. У пациентов в критическом состоянии запасы микроэлементов могут уменьшаться гораздо быстрее. Кроме того, при поступлении в ОРИТ пациенты могут иметь дефицит питания, повышенное использование микроэлементов и повышенные потери жидкости организмом, а также находится на постоянной заместительной почечной терапии [52, 53]. Более того, недавний сдвиг в рекомендациях в сторону более ограничительного питания в острой фазе может способствовать развитию дефицита микроэлементов.Микронутриенты имеют решающее значение для жизненно важных функций, таких как производство АТФ, антиоксидантная и иммунная защита, транскрипция генов и в качестве кофакторов для многочисленных ферментов [54]. Симптомы дефицита микроэлементов неспецифичны и напоминают симптомы критического состояния [55]. Они могут проявиться только при начале лечебного питания, что проявляется рефидинг синдромом.
Действительно, рефидинг увеличивает потребность и внутриклеточное поглощение некоторых микроэлементов (особенно тиамина, а также других витаминов группы B и микроэлементов) и электролитов (преимущественно фосфата и калия). В случае низких общих запасов в организме это может привести к опасным для жизни аритмиям, угнетению сердечной деятельности, лактоацидозу и тяжелой мышечной слабости. Не существует утвержденных стандартных критериев диагностики рефидинг-синдрома. В качестве возможного суррогата использовалось снижение уровня фосфатов как минимум на 0,16 ммоль/л до уровня ниже 0,65 ммоль/л [56, 57].Риск рефидинг-синдрома увеличивается при переходе от длительного голодания или длительного малодозного питания к полноценному питанию. В Refeeding RCT (N = 339) временное ограничение потребления макронутриентов у пациентов, у которых развивалась гипофосфатемия при возобновлении питания, ассоциировалось со снижением смертности по сравнению с продолжающимся и увеличивающимся потреблением пищи, в то время как электролиты корректировались с одинаковой эффективностью в обеих группах [57]. Эти данные подтверждают осторожность в наращивании лечебного питания у пациентов с риском рефидинг-синдрома. В исследованиях не было подтверждено, можно ли снизить риск повторного кормления с помощью прогрессивного лечебного питания и/или введения достаточного количества микроэлементов и электролитов в острой фазе для предотвращения дефицита микроэлементов и электролитов.
Тем не менее, назначение поддерживающих доз микроэлементов представляется разумным. Однако идеальные дозы остаются неясными. Концентрации микроэлементов в плазме не могут определять терапию, поскольку на них также влияет перераспределение вследствие воспаления. Следовательно, концентрации микроэлементов в плазме не обязательно отражают запасы в организме, и не существует точных формул коррекции воспаления [58].
Когда пациент получает 1500 ккал через коммерческую формулу энтерального питания, она содержит достаточно микроэлементов, чтобы покрыть Dietary Reference Intake (DRI) (рекомендованную диетическую норму) для здоровых людей [51]. Однако у пациентов в критическом состоянии могут быть более высокие требования к удовлетворению основных потребностей. Рекомендации по предполагаемому оптимальному потреблению могут быть обнаружены в рекомендациях ESPEN по микроэлементам, опубликованных в 2022 году [51]. Предлагаемые поддерживающие дозы для пациентов в критическом состоянии, как правило, основаны на доказательствах низкого уровня. Помимо поддерживающих доз, также были предложены гораздо более высокие фармакологические дозы для отдельных микроэлементов, включая витамин С, витамин D и селен. Подобную практику, вероятно, следует отделить от лечебного питания и рассматриваться как фармакологические вмешательства, направленные на терапевтический эффект лекарственного средства. Однако назначение высоких доз каких-либо микроэлементов не оказалось полезным и не рекомендуется [51, 59].
Механизмы, объясняющие отсутствие пользы от раннего высокодозного питания
Отсутствие пользы от раннего высокодозного питания можно объяснить несколькими механизмами, включая анаболическую резистентность (неспособность использовать питательные вещества для анаболизма), подавление процессов восстановления клеток, включая аутофагию и кетогенез, а также обострение стрессовой гипергликемии и потребности в инсулине (Fig. 3) [4]. Похоже, что при остром критическом состоянии макронутриенты нельзя использовать так, как у здоровых людей [4]. Несмотря на то, что лечебное питание пропагандируется для ограничения эндогенного катаболизма, недавние данные подтверждают обратное. Действительно, увеличение потребления пищи не предотвратило потерю мышечной массы в РКИ EPaNIC [13, 60]. Более того, несколько РКИ показали усиление уреагенеза за счет увеличения потребления белка или аминокислот, что указывает на бесполезный катаболизм дополнительных аминокислот [16, 34, 37,38, 61–63].
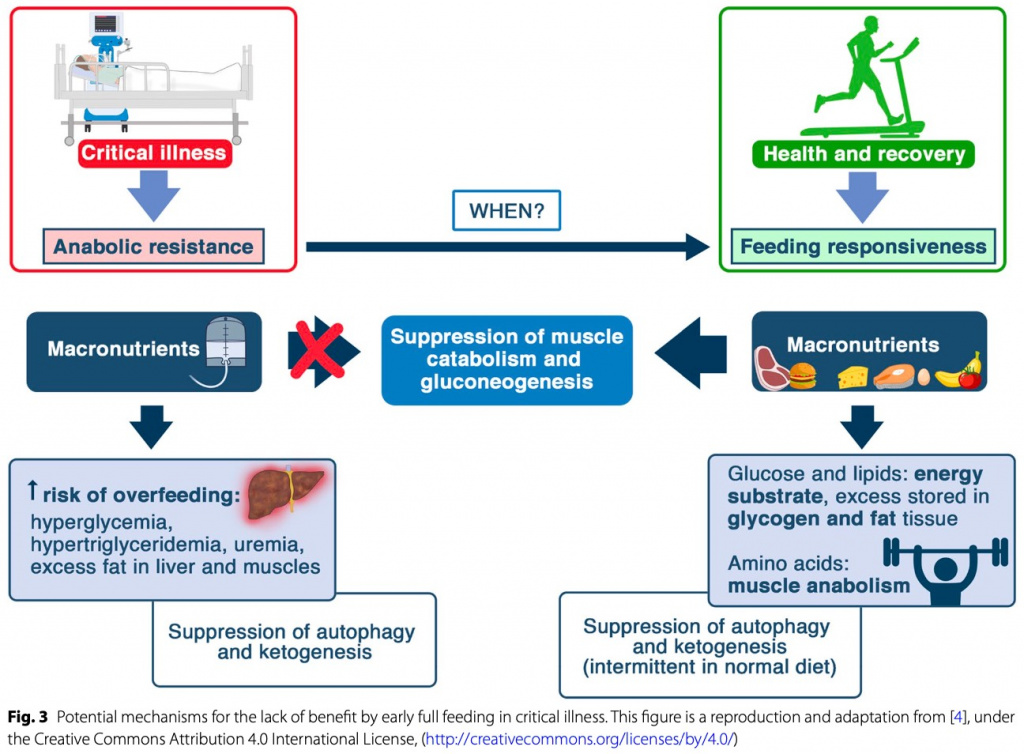
Лечебное питание также мощно подавляет аутофагию и кетогенез, что может быть вредным [4]. Действительно, аутофагия является важным процессом восстановления клеток, который способен устранять макромолекулярные повреждения, включая поврежденные клеточные органеллы, белковые агрегаты и внутриклеточные микроорганизмы [64, 65]. Все больше данных указывает на то, что активированная аутофагия является важнейшим путем восстановления после органной недостаточности, вызванной критическим состоянием [64]. В физиологических условиях аутофагия сильно подавляется питанием и инсулином, а экспериментальные исследования подтверждают подавление аутофагии усиленным питанием при критических состояниях [13, 64, 66]. В подгруппе пациентов, включенных в РКИ EPaNIC, подавление мышечной аутофагии ранним парентеральным питанием ассоциировалось с усилением слабости, что подтверждает функциональную значимость этих результатов [13].
Также подавление кетогенеза считается потенциальным медиатором вреда при раннем питании высокими дозами.Помимо того, что кетоны являются эффективным источником энергии, они могут стимулировать аутофагию и регенерацию мышц, а также оказывать противовоспалительное действие [67]. Экспериментальные исследования показали, что введение экзогенных кетонов защищает мышей с сепсисом от мышечной слабости [68, 69]. Во вторичном анализе РКИ EPaNIC и PEPaNIC отказ от раннего парентерального питания активировал кетогенез, особенно у детей в критическом состоянии, у которых влияние на кетогенез статистически опосредовано частью конечной пользы вмешательства [70, 71]. Следовательно, анорексия и непереносимость энтерального питания могут быть адаптивными при остром критическом состоянии за счет активации процессов восстановления клеток, вызванных относительным голоданием.
Раннее лечебное питание также увеличивает степень стрессовой гипергликемии, что связано с плохим исходом, хотя идеальный целевой уровень глюкозы в крови остается дискуссионным [72]. В отличие от первоначальных Leuven РКИ , которые показали улучшение результата за счет жесткого контроля уровня глюкозы у пациентов, получавших раннее парентеральное питание (N = 3448) [73–75], недавнее TGC-fast РКИ (N = 9230) у пациентов, не получавших раннее парентеральное питание, не показало улучшения в снижении смертности [76] .Поразительным различием между Leuven РКИ и TGC-fast РКИ является гораздо меньшая тяжесть гипергликемии TGC-fast РКИ, что объясняется значительно более низким энергетическим обеспечением из-за отсутствия раннего парентерального питания [76].
Следовательно, повышенная смертность в Leuven РКИ, по-видимому, объясняется более тяжелой гипергликемией, вызванной ранним парентеральным питанием, которое привело к перееданию в первую неделю [76, 77]. Механистические исследования связывают вред тяжелой ятрогенной гипергликемии с перегрузкой глюкозой в жизненно важных органах, а не с отсутствием эффекта инсулина [78]. Действительно, инсулин сам по себе может иметь нежелательные побочные эффекты на восстановление органов, поскольку он является мощным супрессором аутофагии и кетогенеза [79, 80]. Это может объяснить, почему более низкие уровни глюкозы независимо связаны с улучшением результатов в РКИ, тогда как увеличение доз инсулина независимо связано с вредом [81].
Следовательно, отказ от раннего полноценного питания может быть полезным, поскольку позволяет избежать ятрогенной тяжелой гипергликемии и снизить потребность в инсулине. В настоящее время ни один проверенный метаболический монитор не может определить момент времени, когда анаболическая резистентность переключается на реакцию на питание. Потенциальные признаки переедания, включая гипергликемию и повышенную потребность в инсулине, гиперуремию, повышение соотношения мочевины и креатинина и гипертриглицеридемию, неспецифичны [82]. Более того, недостаточное питание также может привести к гиперуремии и увеличению соотношения мочевины и креатинина [83]. Косвенная калориметрия не определяет количество эндогенной энергии, не подавляемой питанием [4]. Измерение расхода энергии в состоянии покоя (REE) с помощью непрямой калориметрии после острой фазы может быть полезным для определения дозы питания; однако необходима проверка, а также определенный опыт для интерпретации результатов, выходящих за пределы одного значения REE [84].
Следует иметь в виду, что перекармливание приводит к увеличению REE (не отражающему фактическую потребность) из-за усиления диетоиндуцированного термогенеза, что может ошибочно побудить врачей к увеличению дозы питания, тогда как недостаточное питание не приводит к снижению REE. Вероятно, продолжительность анаболической резистентности и нежелательных эффектов нутритивной поддержки различаются у разных пациентов, поскольку нежелательная реакция на кормление, вероятно, сопровождает острую реакцию на стресс и связанные с ней воспалительные и эндокринные изменения [4]. Ввиду отсутствия метаболического монитора и принимая во внимание вышеизложенное, может быть разумным снова временно ограничить прием макронутриентов у пациентов, столкнувшихся с новым тяжелым состоянием в ОРИТ, включая септический шок de novo, возникающий после пребывания в ОРИТ.
Перспективы на будущее
Хотя недавние данные показали преимущества, связанные с относительным голоданием при острых критических заболеваниях, длительное голодание, вероятно, будет иметь свою цену. В крупных РКИ по вопросам питания основное внимание уделялось началу лечебного питания в первые дни, а окно вмешательства часто ограничивалось первой неделей пребывания в ОРИТ. В РКИ с более длительным окном вмешательства любая польза от более высокой дозы питания в постострой фазе могла быть нейтрализована вредом в острой фазе.Будущие РКИ должны быть сосредоточены на вмешательствах, начатых после острой фазы, и вмешательствах, продолжающихся в период восстановления [4]. В связи с этим РКИ с участием госпитализированных пациентов в некритическом состоянии (N = 2088) выявило снижение смертности при индивидуальной нутритивной поддержке в соответствии с протоколом по сравнению со стандартным питанием, что позволяет предположить, что оптимизированное питание может улучшить тяжелые клинические конечные точки, если оно предоставляется в правильной дозе для правильного пациента [85].
Тем не менее, оптимизация питания в этом РКИ была достигнута главным образом за счет оптимизации перорального приема пищи, что вряд ли возможно у большинства пациентов ОРИТ. Более того, протокол также обеспечивал достаточное потребление микроэлементов в группе вмешательства. Таким образом, остается неясным, объясняется ли снижение смертности оптимизацией потребления макронутриентов, предотвращением дефицита микроэлементов или тем и другим. Поскольку последствия избыточного и недостаточного питания неочевидны, будущие РКИ должны включать результаты, выходящие за рамки выписки из ОРИТ. Кроме того, может существовать взаимосвязь между оптимизацией потребления питательных веществ в постострой фазе и физическими упражнениями, которая требует дальнейшего изучения [86, 87]. Будущие исследования должны выяснить, может ли непрямая калориметрия быть полезной для определения дозировки энергии после острой фазы критического заболевания, а также оценить дыхательный коэффициент как переменную, позволяющую дифференцировать переедание и недоедание, как предлагают некоторые эксперты [84].
Кроме того, состав макронутриентов практически не изучен, но, вероятно, он важен, исходя из физиологии и косвенных данных. Метаболический монитор, позволяющий отслеживать использование питательных веществ во время их приема, будет необходим для разработки и проверки вмешательств, основанных на метаболических реакциях на кормление [4]. Результаты мониторинга желудочно-кишечной дисфункции также должны быть подтверждены в будущих исследованиях, поскольку они могут быть полезны при изучении этого аспекта комплексного ответа на энтеральное питание (ЭН). Поскольку механистические исследования показывают пользу от активации реакции на голодание при критических заболеваниях [4], будущие исследования должны выяснить, можно ли использовать эти преимущества, связанные с голоданием, в новых стратегиях питания.
В связи с этим в качестве альтернативных стратегий были предложены стратегии прерывистого голодания/питания, кетогенные диеты и добавки кетонов [67]. Чередование периодов кормления с интервалами голодания может периодически активировать реакцию на голодание с усилением аутофагии и кетогенеза, избегая при этом длительного голодания [67]. Прерывистое голодание также улучшило чувствительность к инсулину у людей и животных, не находящихся в критическом состоянии [88]. Более того, было высказано предположение, что прерывистое введение аминокислот является более анаболическим, чем непрерывное введение аминокислот, поскольку позволяет избежать так называемого эффекта наполнения мышц [89–91]. Однако данные крупномасштабных РКИ, подтверждающие эффективность и безопасность периодического голодания/питания, добавок кетонов и кетогенных диет, отсутствуют. РКИ, в которых изучалась прерывистая и непрерывная лечебная диетотерапия, не показали устойчивых преимуществ [92, 93].
Однако, помимо недостаточной мощности для обнаружения или исключения пользы, интервал голодания в этих РКИ был относительно коротким (в целом всего 4–6 часов), что могло быть слишком коротким для активации полного ответа натощак [94]. Хотя кетогенные диеты успешно применяются при рефрактерном эпилептическом статусе, данные РКИ, подтверждающие их широкое применение у пациентов в критическом состоянии, отсутствуют [67, 95]. Более того, достижение кетоза может оказаться затруднительным, поскольку значительное количество лекарств содержит углеводные соединения [96]. Что касается микроэлементов, будущие исследования могут быть направлены на выяснение индивидуальных основных потребностей. Большинство рекомендаций относительно покрытия основных потребностей являются Good Clinical Practice Points [51]. Улучшение оценки реальных потерь и статуса микроэлементов может помочь оптимизировать поддерживающую дозирование.
Выводы
Данные крупномасштабных РКИ показали вред введения высоких доз макронутриентов любым путем во время острой фазы критического заболевания, что можно объяснить анаболической резистентностью, подавлением аутофагии и кетогенеза, а также перекармливанием с более тяжелой гипергликемией и потребностью в инсулине.Момент времени, когда анаболическая резистентность переключается на реакцию на питание, остается неясным.Таким образом, персонализированное лечебное питание, хотя и желательно, в настоящее время неосуществима.Необходимы проверенные инструменты, которые контролируют фактические потребности в энергии, белке и микроэлементах и потенциально позволяют свести к минимуму как пере-, так и недоедание. Поскольку отсрочка полноценного питания может увеличить риск дефицита микроэлементов и последующего синдрома возобновления питания, представляется разумным покрывать базальные потребности в микроэлементах у всех пациентов в критическом состоянии.
References
1. Vanhorebeek I, Latronico N, Van den Berghe G (2020) ICU-acquired weakness. Intensive Care Med 46(4):637–653. https:// doi. org/ 10. 1007/s00134- 020- 05944-4
2. Villet S, Chiolero RL, Bollmann MD, Revelly JP, Cayeux RNM, Delarue J, Berger MM (2005) Negative impact of hypocaloric feeding and energy balance on clinical outcome in ICU patients. Clin Nutr 24(4):502–509. https:// doi. org/ 10. 1016/j. clnu. 2005. 03. 006
3. Lew CCH, Wong GJY, Cheung KP, Chua AP, Chong MFF, Miller M (2017) Association between malnutrition and 28-day mortality and intensive care length-of-stay in the critically ill: a prospective cohort study. Nutrients.https:// doi. org/ 10. 3390/ nu100 10010
4. Gunst J, Casaer MP, Preiser JC, Reignier J, Van den Berghe G (2023) Toward nutrition improving outcome of critically ill patients: how to interpret recent feeding RCTs? Crit Care 27(1):43. https:// doi. org/ 10. 1186/s13054- 023- 04317-9
5. Casaer MP, Mesotten D, Hermans G, Wouters PJ, Schetz M, Meyfroidt G,Van Cromphaut S, Ingels C, Meersseman P, Muller J, Vlasselaers D, DebaveyeY, Desmet L, Dubois J, Van Assche A, Vanderheyden S, Wilmer A, Van den Berghe G (2011) Early versus late parenteral nutrition in critically ill adults. N Engl J Med 365(6):506–517. https:// doi. org/ 10. 1056/ NEJMoa1102 662
6. Reignier J, Boisrame-Helms J, Brisard L, Lascarrou JB, AitHssain A, Anguel N, Argaud L, Asehnoune K, Asfar P, Bellec F, Botoc V, Bretagnol A, Bui HN, Canet E, Da Silva D, Darmon M, Das V, Devaquet J, Djibre M, Ganster F, Garrouste-Orgeas M, Gaudry S, Gontier O, Guerin C, Guidet B, Guitton C, Herbrecht JE, Lacherade JC, Letocart P, Martino F, Maxime V, Mercier E, Mira JP, Nseir S, Piton G, Quenot JP, Richecoeur J, Rigaud JP, Robert R, Rolin N, Schwebel C, Sirodot M, Tinturier F, Thevenin D, Giraudeau B, Le Gouge A, Investigators N-T, Clinical Research in Intensive C, Sepsis g (2018) Enteral versus parenteral early nutrition in ventilated adults withshock: a randomised, controlled, multicentre, open-label, parallel-group study (NUTRIREA-2). Lancet 391(10116):133–143. https:// doi. org/ 10. 1016/S0140- 6736(17) 32146-3
7. Reignier J, Plantefeve G, Mira JP, Argaud L, Asfar P, Aissaoui N, Badie J, Botoc NV, Brisard L, Bui HN, Chatellier D, Chauvelot L, Combes A, Cracco C, Darmon M, Das V, Debarre M, Delbove A, Devaquet J, Dumont LM, Gontier O, Groyer S, Guerin L, Guidet B, Hourmant Y, Jaber S, Lambiotte F, Leroy C, Letocart P, Madeux B, Maizel J, Martinet O, Martino F, Maxime
V, Mercier E, Nay MA, Nseir S, Oziel J, Picard W, Piton G, Quenot JP, Reizine F, Renault A, Richecoeur J, Rigaud JP, Schneider F, Silva D, Sirodot M, Souweine B, Tamion F, Terzi N, Thevenin D, Thiery G, Thieulot-Rolin N, Timsit JF, Tinturier F, Tirot P, Vanderlinden T, Vinatier I, Vinsonneau C, Voicu S, Lascarrou JB, Le Gouge A, Investigators N-T, Clinical Research in Intensive C, Sepsis G (2023) Low versus standard calorie and protein feeding in ventilated adults with shock: a randomised, controlled, multicentre, open-label, parallel-group trial (NUTRIREA-3). Lancet Respir Med 11(7):602–612. https:// doi. org/ 10. 1016/ S2213- 2600(23) 00092-9
8. Fivez T, Kerklaan D, Mesotten D, Verbruggen S, Wouters PJ, Vanhorebeek I, Debaveye Y, Vlasselaers D, Desmet L, Casaer MP, Garcia Guerra G, Hanot J, Joffe A, Tibboel D, Joosten K, Van den Berghe G (2016) Early versus late parenteral nutrition in critically ill children. N Engl J Med 374(12):1111–1122. https:// doi. org/ 10. 1056/ NEJMo a1514 762
9. Wischmeyer PE, Bear DE, Berger MM, De Waele E, Gunst J, McClave SA, Prado CM, Puthucheary Z, Ridley EJ, Van den Berghe G, van Zanten ARH (2023) Personalized nutrition therapy in critical care: 10 expert recommendations. Crit Care 27(1):261. https:// doi. org/ 10. 1186/s13054- 023- 04539-x
10. Reintam Blaser A, Rooyackers O, Bear DE (2023) How to avoid harm with feeding critically ill patients: a synthesis of viewpoints of a basic scientist, dietitian and intensivist. Crit Care 27(1):258. https:// doi. org/ 10. 1186/s13054- 023- 04543-1
11. Alberda C, Gramlich L, Jones N, Jeejeebhoy K, Day AG, Dhaliwal R, Heyland DK (2009) The relationship between nutritional intake and clinical outcomes in critically ill patients: results of an international multicenter observational study. Intensive Care Med 35(10):1728–1737. https:// doi.org/ 10. 1007/ s00134- 009- 1567-4
12. Lv C, Jiang X, Long Y, Liu Z, Lin J, Wu C, Ye X, Ye R, Liu Y, Liu M, Liu Y, Chen W, Gao L, Tong Z, Ke L, Jiang Z, Li W (2022) Association between caloric adequacy and short-term clinical outcomes in critically ill patients using a weight-based equation: secondary analysis of a cluster-randomized controlled trial. Front Nutr 9:902986. https:// doi. org/ 10. 3389/ fnut. 2022.902986
13. Hermans G, Casaer MP, Clerckx B, Guiza F, Vanhullebusch T, Derde S, Meersseman P, Derese I, Mesotten D, Wouters PJ, Van Cromphaut S, Debaveye Y, Gosselink R, Gunst J, Wilmer A, Van den Berghe G, Vanhorebeek I (2013) Effect of tolerating macronutrient deficit on the development of intensive-care unit acquired weakness: a subanalysis of the EPaNIC trial. Lancet Respir Med 1(8):621–629. https:// doi. org/ 10. 1016/S2213- 2600(13) 70183-8
14. Jacobs A, Dulfer K, Eveleens RD, Hordijk J, Van Cleemput H, Verlinden I, Wouters PJ, Mebis L, Guerra GG, Joosten K, Verbruggen SC, Guiza F, Vanhorebeek I, Van den Berghe G (2020) Long-term developmental effect of withholding parenteral nutrition in paediatric intensive care units: a 4-year follow-up of the PEPaNICrandomised controlled trial. Lancet Child Adolesc Health 4(7):503–514. https:// doi. org/ 10. 1016/ S2352- 4642(20)30104-8
15. Casaer MP, Wilmer A, Hermans G, Wouters PJ, Mesotten D, Van den Berghe G (2013) Role of disease and macronutrient dose in the randomized controlled EPaNIC trial: a post hoc analysis. Am J Respir Crit Care Med 187(3):247–255. https:// doi. org/ 10. 1164/ rccm. 201206- 0999OC
16. Vanhorebeek I, Verbruggen S, Casaer MP, Gunst J, Wouters PJ, Hanot J, Guerra GG, Vlasselaers D, Joosten K, Van den Berghe G (2017) Effect of early supplemental parenteral nutrition in the paediatric ICU: a preplanned observational study of post-randomisation treatments in the PEPaNIC trial. Lancet Respir Med 5(6):475–483. https:// doi. org/ 10.1016/ S2213- 2600(17) 30186-8
17. Harvey SE, Parrott F, Harrison DA, Bear DE, Segaran E, Beale R, Bellingan G, Leonard R, Mythen MG, Rowan KM, Investigators CT (2014) Trial of the route of early nutritional support in critically ill adults. N Engl J Med 371(18):1673–1684. https:// doi. org/ 10. 1056/ NEJMo a1409 860
18. National Heart L, Blood Institute Acute Respiratory Distress Syndrome Clinical Trials N, Rice TW, Wheeler AP, Thompson BT, Steingrub J, Hite RD, Moss M, Morris A, Dong N, Rock P (2012) Initial trophic vs full enteral feeding in patients with acute lung injury: the EDEN randomized trial. JAMA 307(8):795–803. https:// doi. org/ 10. 1001/ jama. 2012. 137
19. Arabi YM, Aldawood AS, Haddad SH, Al-Dorzi HM, Tamim HM, Jones G, Mehta S, McIntyre L, Solaiman O, Sakkijha MH, Sadat M, Afesh L, Permi TTG (2015) Permissive Underfeeding or Standard Enteral Feeding in Critically Ill Adults. N Engl J Med 372(25):2398–2408. https:// doi. org/ 10. 1056/NEJMo a1502 826
20. Target Investigators ftACTG, Chapman M, Peake SL, Bellomo R, Davies A, Deane A, Horowitz M, Hurford S, Lange K, Little L, Mackle D, O’Connor S, Presneill J, Ridley E, Williams P, Young P (2018) Energy-dense versus routine enteral nutrition in the critically ill. N Engl J Med 379(19):1823–1834. https:// doi. org/ 10. 1056/ NEJMo a1811 687
21. Needham DM, Dinglas VD, Morris PE, Jackson JC, Hough CL, Mendez-Tellez PA, Wozniak AW, Colantuoni E, Ely EW, Rice TW, Hopkins RO, Network NNA (2013) Physical and cognitive performance of patients with acute lung injury 1 year after initial trophic versus full enteral feeding. EDEN trial follow-up. Am J Respir Crit Care Med 188(5):567–576. https://
doi. org/ 10. 1164/ rccm. 201304- 0651OC
22. Needham DM, Dinglas VD, Bienvenu OJ, Colantuoni E, Wozniak AW, Rice TW, Hopkins RO, Network NNA (2013) One year outcomes in patients with acute lung injury randomised to initial trophic or full enteral feeding: prospective follow-up of EDEN randomised trial. BMJ 346:f1532. https://doi. org/ 10. 1136/ bmj. f1532
23. Deane AM, Little L, Bellomo R, Chapman MJ, Davies AR, Ferrie S, Horowitz M, Hurford S, Lange K, Litton E, Mackle D, O’Connor S, Parker J, Peake SL, Presneill JJ, Ridley EJ, Singh V, van Haren F, Williams P, Young P, Iwashyna TJ (2020) Outcomes six months after delivering 100% or 70% of enteral calorie requirements during critical illness (TARGET). A randomized controlled trial. Am J Respir Crit Care Med 201(7):814–822. https:// doi. org/ 10. 1164/rccm. 201909- 1810OC
24. Arabi YM, Aldawood AS, Al-Dorzi HM, Tamim HM, Haddad SH, Jones G, McIntyre L, Solaiman O, Sakkijha MH, Sadat M, Mundekkadan S, Kumar A, Bagshaw SM, Mehta S, Permi T (2017) Permissive underfeeding or standard enteral feeding in high- and low-nutritional-risk critically ill adults. Post hoc analysis of the PermiT Trial. Am J Respir Crit Care Med 195(5):652–662. https:// doi. org/ 10. 1164/ rccm. 201605- 1012OC
25. Yue HY, Peng W, Zeng J, Zhang Y, Wang Y, Jiang H (2024) Efficacy of permissive underfeeding for critically ill patients: an updated systematic review and trial sequential meta-analysis. J Intensive Care 12(1):4. https://doi. org/ 10. 1186/ s40560- 024- 00717-3
26. McClave SA, Martindale RG, Vanek VW, McCarthy M, Roberts P, Taylor B, Ochoa JB, Napolitano L, Cresci G, Directors ASPENBo, American College of Critical Care M, Society of Critical Care M (2009) Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (ASPEN). JPEN J Parenter Enteral Nutr 33(3):277–316. https:// doi. org/ 10. 1177/ 01486 07109 335234
27. Singer P, Blaser AR, Berger MM, Alhazzani W, Calder PC, Casaer MP, Hiesmayr M, Mayer K, Montejo JC, Pichard C, Preiser JC, van Zanten ARH, Oczkowski S, Szczeklik W, Bischoff SC (2019) ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 38(1):48–79. https:// doi. org/10. 1016/j. clnu. 2018. 08. 037
28. Arabi YM, Tamim HM, Dhar GS, Al-Dawood A, Al-Sultan M, Sakkijha MH, Kahoul SH, Brits R (2011) Permissive underfeeding and intensive insulin therapy in critically ill patients: a randomized controlled trial. Am J Clin Nutr 93(3):569–577. https:// doi. org/ 10. 3945/ ajcn. 110. 005074
29. Rice TW, Mogan S, Hays MA, Bernard GR, Jensen GL, Wheeler AP (2011) Randomized trial of initial trophic versus full-energy enteral nutrition in mechanically ventilated patients with acute respiratory failure. Crit Care Med 39(5):967–974. https:// doi. org/ 10. 1097/ CCM. 0b013 e3182 0a905a
30. Charles EJ, Petroze RT, Metzger R, Hranjec T, Rosenberger LH, Riccio LM, McLeod MD, Guidry CA, Stukenborg GJ, Swenson BR, Willcutts KF,O’Donnell KB, Sawyer RG (2014) Hypocaloric compared with eucaloric nutritional support and its effect on infection rates in a surgical intensive care unit: a randomized controlled trial. Am J Clin Nutr 100(5):1337–1343.https:// doi. org/ 10. 3945/ ajcn. 114. 088609
31. Petros S, Horbach M, Seidel F, Weidhase L (2016) Hypocaloric vs normocaloric nutrition in critically ill patients: a prospective randomized pilot trial. JPEN J Parenter Enteral Nutr 40(2):242–249. https:// doi. org/ 10. 1177/01486 07114 528980
32. Braunschweig CA, Sheean PM, Peterson SJ, Gomez Perez S, Freels S, Lateef O, Gurka D, Fantuzzi G (2015) Intensive nutrition in acute lung injury: a clinical trial (INTACT). JPEN J Parenter Enteral Nutr 39(1):13–20. https:// doi.org/ 10. 1177/ 01486 07114 528541
33. Rugeles S, Villarraga-Angulo LG, Ariza-Gutierrez A, Chaverra-Kornerup S, Lasalvia P, Rosselli D (2016) High-protein hypocaloric vs normocaloric enteral nutrition in critically ill patients: a randomized clinical trial. J Crit Care 35:110–114. https:// doi. org/ 10. 1016/j. jcrc. 2016. 05. 004
34. Allingstrup MJ, Kondrup J, Wiis J, Claudius C, Pedersen UG, Hein-Rasmussen R, Bjerregaard MR, Steensen M, Jensen TH, Lange T, Madsen MB, Moller MH, Perner A (2017) Early goal-directed nutrition versus standard of care in adult intensive care patients: the single-centre, randomised, outcome assessor-blinded EAT-ICU trial. Intensive Care Med 43(11):1637–1647. https:// doi. org/ 10. 1007/ s00134- 017- 4880-3
35. Hoffer LJ, Bistrian BR (2016) Nutrition in critical illness: a current conundrum. F1000Res 5:2531. https:// doi. org/ 10. 12688/ f1000 research. 9278.1
36. Hartl WH, Elke G (2023) Nutrition during the acute phase of critical illness:discussions on NUTRIREA-3. Lancet Respir Med 11(7):e61. https:// doi. org/10. 1016/ S2213- 2600(23) 00212-6
37. Heyland DK, Patel J, Compher C, Rice TW, Bear DE, Lee ZY, Gonzalez VC,O’Reilly K, Regala R, Wedemire C, Ibarra-Estrada M, Stoppe C, Ortiz-Reyes L, Jiang X, Day AG, team EPT (2023) The effect of higher protein dosing in critically ill patients with high nutritional risk (EFFORT Protein): an international, multicentre, pragmatic, registry-based randomised trial. Lancet 401(10376):568–576. https:// doi. org/ 10. 1016/ S0140- 6736(22) 02469-2
38. Doig GS, Simpson F, Bellomo R, Heighes PT, Sweetman EA, Chesher D, Pollock C, Davies A, Botha J, Harrigan P, Reade MC (2015) Intravenous amino acid therapy for kidney function in critically ill patients: a randomized controlled trial. Intensive Care Med 41(7):1197–1208. https:// doi.org/ 10. 1007/ s00134- 015- 3827-9
39. Lee ZY, Dresen E, Lew CCH, Bels J, Hill A, Hasan MS, Ke L, van Zanten A, van de Poll MCG, Heyland DK, Stoppe C (2024) The effects of higher versus lower protein delivery in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials with trial sequential analysis. Crit Care 28(1):15. https:// doi. org/ 10. 1186/s13054- 023- 04783-1
40. Singer P, Blaser AR, Berger MM, Calder PC, Casaer M, Hiesmayr M, Mayer K, Montejo-Gonzalez JC, Pichard C, Preiser JC, Szczeklik W, van Zanten ARH, Bischoff SC (2023) ESPEN practical and partially revised guideline: Clinical nutrition in the intensive care unit. Clin Nutr 42(9):1671–1689. https:// doi.org/ 10. 1016/j. clnu. 2023. 07. 011
41. Pertzov B, Bar-Yoseph H, Menndel Y, Bendavid I, Kagan I, Glass YD, Singer P (2022) The effect of indirect calorimetry guided isocaloric nutrition on mortality in critically ill patients-a systematic review and meta-analysis. Eur J Clin Nutr 76(1):5–15. https:// doi. org/ 10. 1038/ s41430- 021- 00919-0
42. Singer P, De Waele E, Sanchez C, Ruiz Santana S, Montejo JC, Laterre PF, Soroksky A, Moscovici E, Kagan I (2021) TICACOS international: A multicenter, randomized, prospective controlled study comparing tight calorie control versus Liberal calorie administration study. Clin Nutr 40(2):380–387. https:// doi. org/ 10. 1016/j. clnu. 2020. 05. 024
43. Veraar C, Geilen J, Fischer A, Sulz I, Tarantino S, Mouhieddine M, Mora B, Schuh C, Singer P, Hiesmayr MJ (2021) Timing of parenteral nutrition in ICU patients: a transatlantic controversy. Clin Nutr ESPEN. 46:532–538.https:// doi. org/ 10. 1016/j. clnesp. 2021. 08. 007
44. Heidegger CP, Berger MM, Graf S, Zingg W, Darmon P, Costanza MC, Thibault R, Pichard C (2013) Optimisation of energy provision with supplemental parenteral nutrition in critically ill patients: a randomised controlled clinical trial. Lancet 381(9864):385–393. https:// doi. org/ 10.1016/ S0140- 6736(12) 61351-8
45. Heidegger CP, Berger MM, Thibault R, Zingg W, Pichard C (2013) Supplemental parenteral nutrition in critically ill patients–authors’ reply. Lancet 381(9879):1716–1717. https:// doi. org/ 10. 1016/ S0140- 6736(13) 61072-7
46. Kreymann KG, Berger MM, Deutz NE, Hiesmayr M, Jolliet P, Kazandjiev G, Nitenberg G, van den Berghe G, Wernerman J, Dgem EC, Hartl W, Heymann C, Spies C, Espen (2006) ESPEN guidelines on enteral nutrition: intensive care. Clin Nutr 25(2):210–223. https:// doi. org/ 10. 1016/j.clnu. 2006. 01. 021
47. Singer P, Berger MM, Van den Berghe G, Biolo G, Calder P, Forbes A, Griffiths R, Kreyman G, Leverve X, Pichard C, Espen (2009) ESPEN Guidelines on parenteral nutrition: intensive care. Clin Nutr 28(4):387–400.https:// doi. org/ 10. 1016/j. clnu. 2009. 04. 024
48. Compher C, Bingham AL, McCall M, Patel J, Rice TW, Braunschweig C, McKeever L (2022) Guidelines for the provision of nutrition support therapy in the adult critically ill patient: the American Society for Parenteral and Enteral Nutrition. JPEN J Parenter Enteral Nutr 46(1):12–41. https://doi. org/ 10. 1002/ jpen. 2267
49. Fuentes Padilla P, Martinez G, Vernooij RW, Urrutia G, Roque IFM, Bonfill Cosp X (2019) Early enteral nutrition (within 48 hours) versus delayed enteral nutrition (after 48 hours) with or without supplemental parenteral nutrition in critically ill adults. Cochrane Database Syst Rev. https:// doi.org/ 10. 1002/ 14651 858. CD012 340. pub2
50. Fuglsang KA, Brandt CF, Jeppesen PB (2022) Survival in patients initiating home parenteral support due to nonmalignant short bowel syndrome compared with background population. Clin Nutr ESPEN 50:170–177.https:// doi. org/ 10. 1016/j. clnesp. 2022. 05. 023
51. Berger MM, Shenkin A, Schweinlin A, Amrein K, Augsburger M, Biesalski HK, Bischoff SC, Casaer MP, Gundogan K, Lepp HL, de Man AME, Muscogiuri G, Pietka M, Pironi L, Rezzi S, Cuerda C (2022) ESPEN micronutrient guideline. Clin Nutr 41(6):1357–1424. https:// doi. org/ 10. 1016/j. clnu. 2022.02. 015
52. Koekkoek WA, van Zanten AR (2016) Antioxidant vitamins and trace elements in critical illness. Nutr Clin Pract 31(4):457–474. https:// doi. org/ 10.1177/ 08845 33616 653832
53. Berger MM, Broman M, Forni L, Ostermann M, De Waele E, Wischmeyer PE (2021) Nutrients and micronutrients at risk during renal replacement therapy: a scoping review. Curr Opin Crit Care 27(4):367–377. https:// doi. org/ 10. 1097/ MCC. 00000 00000 000851
54. Koekkoek KWA, Berger MM (2023) An update on essential micronutrients in critical illness. Curr Opin Crit Care 29(4):315–329. https:// doi. org/ 10.1097/ MCC. 00000 00000 001062
55. Casaer MP, Bellomo R (2019) Micronutrient deficiency in critical illness: an invisible foe? Intensive Care Med 45(8):1136–1139. https:// doi. org/ 10.1007/ s00134- 019- 05678-y
56. Doig GS, Simpson F, Heighes PT, Bellomo R, Chesher D, Caterson ID, Reade MC, Harrigan PW, Refeeding Syndrome Trial Investigators G (2015) Restricted versus continued standard caloric intake during the management of refeeding syndrome in critically ill adults: a randomised, parallel-group, multicentre, single-blind controlled trial. Lancet Respir Med 3(12):943–952. https:// doi. org/ 10. 1016/ S2213- 2600(15) 00418-X
57. Olthof LE, Koekkoek W, van Setten C, Kars JCN, van Blokland D, van Zanten ARH (2018) Impact of caloric intake in critically ill patients with, and without, refeeding syndrome: a retrospective study. Clin Nutr 37(5):1609–1617. https:// doi. org/ 10. 1016/j. clnu. 2017. 08. 001
58. Berger MM, Talwar D, Shenkin A (2022) Pitfalls in the interpretation of blood tests used to assess and monitor micronutrient nutrition status. Nutr Clin Pract. https:// doi. org/ 10. 1002/ ncp. 10924
59. Reintam Blaser A, Alhazzani W, Belley-Cote E, Moller MH, Adhikari NKJ, Burry L, Coopersmith CM, Al Duhailib Z, Fujii T, Granholm A, Gunst J, Hammond N, Ke L, Lamontagne F, Loudet C, Morgan M, Ostermann M, Reinikainen M, Rosenfeld R, Spies C, Oczkowski S (2023) Intravenous vitamin C therapy in adult patients with sepsis: a rapid practice guideline. Acta Anaesthesiol Scand. https:// doi. org/ 10. 1111/ aas. 14311
60. Casaer MP, Langouche L, Coudyzer W, Vanbeckevoort D, De Dobbelaer B, Guiza FG, Wouters PJ, Mesotten D, Van den Berghe G (2013) Impact of early parenteral nutrition on muscle and adipose tissue compartments during critical illness. Crit Care Med 41(10):2298–2309. https:// doi. org/ 10.1097/ CCM. 0b013 e3182 8cef02
61. Gunst J, Vanhorebeek I, Casaer MP, Hermans G, Wouters PJ, Dubois J, Claes K, Schetz M, Van den Berghe G (2013) Impact of early parenteral nutrition on metabolism and kidney injury. J Am Soc Nephrol 24(6):995–1005.https:// doi. org/ 10. 1681/ ASN. 20120 70732
62. Heyland DK, Wibbenmeyer L, Pollack JA, Friedman B, Turgeon AF, Eshraghi N, Jeschke MG, Belisle S, Grau D, Mandell S, Velamuri SR, Hundeshagen G, Moiemen N, Shokrollahi K, Foster K, Huss F, Collins D, Savetamal A, Gurney JM, Depetris N, Stoppe C, Ortiz-Reyes L, Garrel D, Day AG, Team R-ET (2022) A randomized trial of enteral glutamine for treatment of burn injuries. N Engl J Med 387(11):1001–1010. https:// doi. org/ 10. 1056/ NEJMo a2203 364
63. Heyland D, Muscedere J, Wischmeyer PE, Cook D, Jones G, Albert M, Elke G, Berger MM, Day AG, Canadian Critical Care Trials G (2013) A randomized trial of glutamine and antioxidants in critically ill patients. N Engl J Med 368(16):1489–1497. https:// doi. org/ 10. 1056/ NEJMo a1212 722
64. Vanhorebeek I, Casaer M, Gunst J (2023) Nutrition and autophagy deficiency in critical illness. Curr Opin Crit Care 29(4):306–314. https:// doi. org/10. 1097/ MCC. 00000 00000 001056
65. Mizushima N, Levine B (2020) Autophagy in human diseases. N Engl J Med 383(16):1564–1576. https:// doi. org/ 10. 1056/ NEJMr a2022 774
66. Derde S, Vanhorebeek I, Guiza F, Derese I, Gunst J, Fahrenkrog B, Martinet W, Vervenne H, Ververs EJ, Larsson L, Van den Berghe G (2012) Early parenteral nutrition evokes a phenotype of autophagy deficiency in liverand skeletal muscle of critically ill rabbits. Endocrinology 153(5):2267–2276. https:// doi. org/ 10. 1210/ en. 2011- 2068
67. Gunst J, Casaer MP, Langouche L, Van den Berghe G (2021) Role of ketones, ketogenic diets and intermittent fasting in ICU. Curr Opin Crit Care 27(4):385–389. https:// doi. org/ 10. 1097/ MCC. 00000 00000 000841
68. Weckx R, Goossens C, Derde S, Pauwels L, Vander Perre S, Van den Berghe G, Langouche L (2022) Efficacy and safety of ketone ester infusion to prevent muscle weakness in a mouse model of sepsis-induced critical illness. Sci Rep 12(1):10591. https:// doi. org/ 10. 1038/ s41598- 022- 14961-w
69. Goossens C, Weckx R, Derde S, Dufour T, Vander Perre S, Pauwels L, Thiessen SE, Van Veldhoven PP, Van den Berghe G, Langouche L (2019)Adipose tissue protects against sepsis-induced muscle weakness in mice:from lipolysis to ketones. Crit Care 23(1):236. https:// doi. org/ 10. 1186/s13054- 019- 2506-6
70. De Bruyn A, Langouche L, Vander Perre S, Gunst J, Van den Berghe G (2021) Impact of withholding early parenteral nutrition in adult critically ill patients on ketogenesis in relation to outcome. Crit Care 25(1):102. https:// doi. org/ 10. 1186/ s13054- 021- 03519-3
71. De Bruyn A, Gunst J, Goossens C, Vander Perre S, Guerra GG, Verbruggen S, Joosten K, Langouche L, Van den Berghe G (2020) Effect of withholding early parenteral nutrition in PICU on ketogenesis as potential mediator of its outcome benefit. Crit Care 24(1):536. https:// doi. org/ 10. 1186/s13054- 020- 03256-z
72. Gunst J, Verbruggen SC (2023) Insulin resistance in critical illness: consequences for nutrition therapy and glucose management. Curr Opin Crit Care 29(4):286–292. https:// doi. org/ 10. 1097/ MCC. 00000 00000 001055
73. van den Berghe G, Wouters P, Weekers F, Verwaest C, Bruyninckx F, Schetz M, Vlasselaers D, Ferdinande P, Lauwers P, Bouillon R (2001) Intensive insulin therapy in critically ill patients. N Engl J Med 345(19):1359–1367. https:// doi. org/ 10. 1056/ NEJMo a0113 00
74. Van den Berghe G, Wilmer A, Hermans G, Meersseman W, Wouters PJ, Milants I, Van Wijngaerden E, Bobbaers H, Bouillon R (2006) Intensive insulin therapy in the medical ICU. N Engl J Med 354(5):449–461. https://doi. org/ 10. 1056/ NEJMo a0525 21
75. Vlasselaers D, Milants I, Desmet L, Wouters PJ, Vanhorebeek I, van den Heuvel I, Mesotten D, Casaer MP, Meyfroidt G, Ingels C, Muller J, Van Cromphaut S, Schetz M, Van den Berghe G (2009) Intensive insulin therapy for patients in paediatric intensive care: a prospective, randomised controlled study. Lancet 373(9663):547–556. https:// doi. org/ 10. 1016/S0140- 6736(09) 60044-1
76. Gunst J, Debaveye Y, Guiza F, Dubois J, De Bruyn A, Dauwe D, De Troy E, Casaer MP, De Vlieger G, Haghedooren R, Jacobs B, Meyfroidt G, Ingels C, Muller J, Vlasselaers D, Desmet L, Mebis L, Wouters PJ, Stessel B, Geebelen L, Vandenbrande J, Brands M, Gruyters I, Geerts E, De Pauw I, Vermassen J, Peperstraete H, Hoste E, De Waele JJ, Herck I, Depuydt P, Wilmer A, Hermans G, Benoit DD, Van den Berghe G, Collaborators TG-F (2023) Tight blood-glucose control without early parenteral nutrition in the ICU. N Engl J Med 389(13):1180–1190. https:// doi. org/ 10. 1056/ NEJMo a2304 855
77. Umpierrez GE (2023) Glucose control in the ICU. N Engl J Med 389(13):1234–1237. https:// doi. org/ 10. 1056/ NEJMe 23094 42
78. Gunst J, Van den Berghe G (2016) Blood glucose control in the ICU: don’t throw out the baby with the bathwater! Intensive Care Med 42(9):1478–1481. https:// doi. org/ 10. 1007/ s00134- 016- 4350-3
79. Gunst J (2017) Recovery from critical illness-induced organ failure: the role of autophagy. Crit Care 21(1):209. https:// doi. org/ 10. 1186/s13054- 017- 1786-y
80. Gunst J, De Bruyn A, Casaer MP, Vander Perre S, Langouche L, Van den Berghe G (2021) Impact of tight glucose control on circulating 3-hydroxybutyrate in critically ill patients. Crit Care 25(1):373. https:// doi.org/ 10. 1186/ s13054- 021- 03772-6
81. Van den Berghe G, Wouters PJ, Bouillon R, Weekers F, Verwaest C, Schetz M, Vlasselaers D, Ferdinande P, Lauwers P (2003) Outcome benefit of intensive insulin therapy in the critically ill: Insulin dose versus glycemic control. Crit Care Med 31(2):359–366. https:// doi. org/ 10. 1097/ 01. CCM.00000 45568. 12881. 10
82. Berger MM, Reintam-Blaser A, Calder PC, Casaer M, Hiesmayr MJ, Mayer K, Montejo JC, Pichard C, Preiser JC, van Zanten ARH, Bischoff SC, Singer P (2019) Monitoring nutrition in the ICU. Clin Nutr 38(2):584–593. https://doi. org/ 10. 1016/j. clnu. 2018. 07. 009
83. Gunst J, Kashani KB, Hermans G (2019) The urea-creatinine ratio as a novel biomarker of critical illness-associated catabolism. Intensive Care Med 45(12):1813–1815. https:// doi. org/ 10. 1007/ s00134- 019- 05810-y
84. Achamrah N, Delsoglio M, De Waele E, Berger MM, Pichard C (2021) Indirect calorimetry: The 6 main issues. Clin Nutr 40:4–14
85. Schuetz P, Fehr R, Baechli V, Geiser M, Deiss M, Gomes F, Kutz A, Tribolet P, Bregenzer T, Braun N, Hoess C, Pavlicek V, Schmid S, Bilz S, Sigrist S, Brandle M, Benz C, Henzen C, Mattmann S, Thomann R, Brand C, Rutishauser J, Aujesky D, Rodondi N, Donze J, Stanga Z, Mueller B (2019) Individualised nutritional support in medical inpatients at nutritional risk: a randomised clinical trial. Lancet 393(10188):2312–2321. https:// doi. org/ 10. 1016/S0140- 6736(18) 32776-4
86. Kagan I, Cohen J, Bendavid I, Kramer S, Mesilati-Stahy R, Glass Y, Theilla M, Singer P (2022) Effect of combined protein-enriched enteral nutrition and early cycle ergometry in mechanically ventilated critically ill patients—a pilot study. Nutrients. https:// doi. org/ 10. 3390/ nu140 81589
87. Kim HK, Suzuki T, Saito K, Yoshida H, Kobayashi H, Kato H, Katayama M (2012) Effects of exercise and amino acid supplementation on body composition and physical function in community-dwelling elderly Japanese sarcopenic women: a randomized controlled trial. J Am Geriatr Soc 60(1):16–23. https:// doi. org/ 10. 1111/j. 1532- 5415. 2011. 03776.x
88. de Cabo R, Mattson MP (2019) Effects of intermittent fasting on health, aging, and disease. N Engl J Med 381(26):2541–2551. https:// doi. org/ 10.1056/ NEJMr a1905 136
89. Bohe J, Low JF, Wolfe RR, Rennie MJ (2001) Latency and duration of stimulation of human muscle protein synthesis during continuous infusion of amino acids. J Physiol 532(Pt 2):575–579. https:// doi. org/ 10. 1111/j. 1469-7793. 2001. 0575f.x
90. Atherton PJ, Etheridge T, Watt PW, Wilkinson D, Selby A, Rankin D, Smith K, Rennie MJ (2010) Muscle full effect after oral protein: time-dependent concordance and discordance between human muscle protein synthesis and mTORC1 signaling. Am J Clin Nutr 92(5):1080–1088. https:// doi. org/10. 3945/ ajcn. 2010. 29819
91. Flower L, Haines RW, McNelly A, Bear DE, Koelfat K, Damink SO, Hart N, Montgomery H, Prowle JR, Puthucheary Z (2022) Effect of intermittent or continuous feeding and amino acid concentration on urea-to-creatinine ratio in critical illness. JPEN J Parenter Enteral Nutr 46(4):789–797. https://doi. org/ 10. 1002/ jpen. 2258
92. Van Dyck L, Casaer MP (2019) Intermittent or continuous feeding: any difference during the first week? Curr Opin Crit Care 25(4):356–362. https://doi. org/ 10. 1097/ MCC. 00000 00000 000617
93. McNelly AS, Bear DE, Connolly BA, Arbane G, Allum L, Tarbhai A, CooperJA, Hopkins PA, Wise MP, Brealey D, Rooney K, Cupitt J, Carr B, Koelfat K, Damink SO, Atherton PJ, Hart N, Montgomery HE, Puthucheary ZA (2020) Effect of intermittent or continuous feed on muscle wasting in critical illness: a phase 2 clinical trial. Chest 158(1):183–194. https:// doi. org/ 10.1016/j. chest. 2020. 03. 045
94. Van Dyck L, Vanhorebeek I, Wilmer A, Schrijvers A, Derese I, Mebis L, Wouters PJ, Van den Berghe G, Gunst J, Casaer MP (2020) Towards a fasting-mimicking diet for critically ill patients: the pilot randomized crossover ICU-FM-1 study. Crit Care 24(1):249. https:// doi. org/ 10. 1186/s13054- 020- 02987-3
95. White H, Venkatesh B (2011) Clinical review: ketones and brain injury. Crit Care 15(2):219. https:// doi. org/ 10. 1186/ cc100 20
96. Katz JB, Owusu K, Nussbaum I, Beekman R, DeFilippo NA, Gilmore EJ, Hirsch LJ, Cervenka MC, Maciel CB (2021) Pearls and pitfalls of introducing ketogenic diet in adult status epilepticus: a practical guide for the intensivist. J Clin Med. https:// doi. org/ 10. 3390/ jcm10 040881
Источник фотоиллюстрации - www.freepik.com
[~DETAIL_TEXT] => Angelique M. E. de Man, Jan Gunst and Annika Reintam
Blaser Nutrition in the intensive care unit: from the acute phase to beyond
Intensive Care Med.2024. doi.org/10.1007/s00134-024-07458-9
Абстракт
Последние рандомизированные контролируемые исследования (РКИ) показали отсутствие пользы, но дозозависимый вред от ранней полной нутритивной поддержки у критически больных пациентов.
Отсутствие пользы может быть объяснено анаболической резистентностью, подавлением процессов восстановления клеток и усугублением гипергликемии и потребности в инсулине. Кроме того, ранние высокие дозы аминокислот не принесли пользы, а вместо этого были связаны с вредом у пациентов с органными дисфункциями. Однако большинство исследований было сосредоточено на вмешательствах, начатых в первые дни после поступления в отделение интенсивной терапии (ОРИТ). Хотя окно вмешательства в некоторых РКИ распространялось и на постострую фазу критического заболевания, ни в одном крупном РКИ не изучалось питание, начатое после первой недели. Следовательно, отсутствуют четкие, основанные на фактических данных рекомендации о том, когда и как начинать и продолжать питание. Длительное недоедание будет иметь свою цену, поскольку не существует проверенного метаболического монитора, указывающего на готовность к лечебному питанию и адекватную реакцию на питание, которая, вероятно, варьирует у разных пациентов. Кроме того, статус микроэлементов не может быть надежно оценен, поскольку воспаление может вызвать перераспределение, поэтому концентрации микроэлементов в плазме не обязательно отражают общие запасы в организме. Более того, высокие дозы отдельных микроэлементов не оказались полезными. Соответственно, имеющиеся данные дают четкие рекомендации относительно того, каких стратегий питания следует избегать, но идеальный режим питания для отдельных пациентов остается неясным. В этом описательном обзоре мы суммируем результаты недавних исследований, обсуждаем возможные механизмы, объясняющие результаты, отмечаем ошибки в интерпретации РКИ и их влияние на клиническую практику, а также сформулировать предложения для будущих исследований.
Ключевые слова: питание, макронутриенты, глюкоза, аминокислоты, микроэлементы, критическое заболевание, интенсивная терапия.
Введение
При остром критическом заболевании стимулируется катаболизм, что приводит к атрофии мышц, слабости и невозможности отлучения от респиратора [1]. Низкое потребление белка, энергии и микроэлементов этими пациентами может усугубить катаболизм и это связано с инфекциями, задержкой выздоровления и повышенной смертностью [2–4]. Однако традиционное предположение о том, что питательные вещества могут противодействовать катаболизму и тем самым улучшать клинические результаты у пациентов в критическом состоянии подвергается сомнению совокупными данными крупных рандомизированных контролируемых исследований (РКИ), выявляющими вред полноценного питания в острой фазе [5–8]. Несмотря на то, что был предложен персонализированный подход [9, 10], инструменты мониторинга, которые бы точно определяли фактическую потребность в энергии, белке и микроэлементах для отдельного пациента, в настоящее время недоступны [4]. В этом описательном обзоре мы даем сжатую интерпретацию данных недавних РКИ, обсуждаем влияние доказательств на клиническую практику и формулируем некоторые предложения для будущих исследований.
Лечебное питание в ОРИТ: данные РКИ
Наблюдательные исследования связали кумулятивный дефицит белка и энергии с ухудшением исхода критического заболевания [2, 3, 11]. Однако результаты этих исследования также можно объяснить пищевой непереносимостью как маркером тяжести заболевания [2, 3, 12]. За последнее десятилетие было проведено несколько крупных РКИ, посвященных срокам, способу и дозировке лечебного питания у пациентов в критическом состоянии. Первым РКИ, которое поставило под сомнение предположение о том, что раннее полноценное питание будет полезным, было РКИ EPaNIC, опубликованное в 2011 году [5]. У 4640 взрослых пациентов в критическом состоянии начало парентерального питания в дополнение к недостаточному энтеральному питанию продлило зависимость от интенсивной терапии по сравнению с отсрочкой дополнительного парентерального питания до 1 недели после поступления в ОРИТ. Пациенты, получавшие раннее дополнительное парентеральное питание, имели более длительную продолжительность поддержки жизненно важных органов, больше инфекций, более высокую частоту слабости, приобретенной в ОРИТ, и нарушение восстановления после перевода из ОРИТ [5, 13]. Дополнительное парентеральное питание также не улучшило функциональный статус при выписке из больницы по оценке расстояния 6-минутной ходьбы и повседневная деятельности [5].
Эти результаты были впоследствии подтверждены у детей в критическом состоянии (РКИ PEPaNIC, N = 1440), у которых дополнительное парентеральное питание также отрицательно влияло на 2- и 4-летние исходы развития нервной системы [8, 14]. В обоих РКИ смертность не изменилась, тогда как вред от раннего парентерального питания присутствовал во всех исследуемых подгруппах, включая пациентов с высоким показателем нутритивного риска (шкала NRS ≥5), пациентов с индексом массы тела <25 или ≥40, пациентов с сепсисом, пациентам с противопоказаниями к энтеральному питанию и новорожденных в критическом состоянии [5, 8].Теоретически вред в этих РКИ можно объяснить более высокой дозой кормления (ранним перекармливанием) или вредом, специфичным для парентерального способа питания. Вторичный анализ этих РКИ показал наличие дозозависимого вреда, а не вреда от внутривенного способа питания [15, 16], что было подтверждено последующими РКИ.
Действительно, два крупных РКИ — CALORIES (N = 2400) [17] и РКИ NUTRIREA-2 (N = 2410) [6] — не обнаружили различий между энтеральным и парентеральным путем питания с одинаковой энергетической дозой в обеих группах. В РКИ Nutrirea-2, включавшем пациентов с шоком, находящихся на ИВЛ, раннее введение высоких доз энтерального питания было даже более вредным по сравнению с ранним введением высоких доз парентерального питания, поскольку вызывало потенциально летальные желудочно-кишечные осложнения [6]. В обоих РКИ пациенты были рандомизированы вскоре после поступления в ОРИТ, окно вмешательства составляло 5–7 дней. Также в трех РКИ, в которых пациенты в критическом состоянии рандомизированно получали более низкую или более высокую дозу энтерального питания, начатую в острой фазе и продолжавшуюся в течение 6 (РКИ EDEN, N = 1000), 14 (РКИ PermiT, N = 894) или 28 дней ( TARGET RCT, N = 3957), более высокие дозы энтерального питания, начатые в острой фазе, не принесли пользы, а вторичные результаты предполагали потенциальный вред [18–20].
Кроме того, в РКИ EDEN и TARGET долгосрочный функциональный результат не улучшился при использовании более высоких доз питания [21–23]. Отсутствие пользы в последних РКИ было постоянным во всех исследуемых подгруппах, включая пациентов с высоким прогнозируемым риском смерти [20], пациентов с индексом массы тела (ИМТ) <18 [20] и пациентов с сепсисом [19, 20]. В подробном апостериорном анализе РКИ PermiT ни один из изученных маркеров исходного нутритивного риска не смог выявить пациентов, которым было бы полезно раннее усиленное энтеральное питание, включая модифицированную шкалу нутритивного риска при критических состояниях (NUTRIC), ИМТ, трансферрин, фосфат, азот мочевины мочи и азотистый баланс [24]. Низкий исходный уровень преальбумина, предположительно, указывает на высокий нутритивный риск, даже связанный со значительным вредом для смертности при получении более высоких доз энтерального питания [24].
Аналогичным образом, недавнее РКИ NUTRIREA-3, в котором 3044 пациента с шоком, находящихся на искусственной вентиляции легких, рандомизировали на раннее питание с высокими дозами (25 ккал/кг/день и 1,0–1,3 г белка на кг в день) по сравнению с питанием с низкими дозами в первую неделю (6 ккал/кг/день и 0,2–0,4 г белка/кг/день), выявили вред от раннего высокодозного питания с длительной зависимостью от ОРИТ и увеличением осложнений в этой группе [7]. Важно отметить, что в РКИ NUTRIREA-3 целевые показатели питания определялись методом рандомизации; для достижения этой цели лечебное питание может проводиться как энтерально, так и парентерально [7]. Недавний метаанализ подтвердил вред раннего полноценного питания у пациентов в критическом состоянии по сравнению с допустимым недоеданием. Хотя этот метаанализ не включал РКИ EPaNIC, это, вероятно, не влияет на выводы, поскольку пациентам EPaNIC в равной степени вредило раннее полное кормление [25].
Недавний метаанализ, проведенный в рамках обновленных американских рекомендаций по лечебному питанию, не показал преимуществ дополнительного парентерального питания по сравнению с только энтеральным питанием. Тем не менее, различный дизайн включенных РКИ, с разными сроками дополнительного парентерального питания, разными сопутствующими вмешательствами и контрольными группами может усложнить интерпретацию результатов [26]. В целом, недавние РКИ показали дозозависимый вред от раннего лечебного питания у пациентов в критическом состоянии, независимо от способа и предполагаемого риска, связанного с питанием. В Table 1 суммированы РКИ, в которых сравнивалось большее и меньшее количество энергии по тому же или другому пути, при этом питание было начато вскоре после поступления в ОРИТ. В этих исследованиях мы сообщаем о потреблении энергии на третий день, поскольку более высокая цель по энергии была достигнута в соответствующей группе с высокими дозами в этот ранний момент времени. Этот момент времени также приблизительно соответствует предполагаемому концу раннего периода острой фазы, как это предложено Европейскими рекомендациями по питанию [27].

Тем не менее, продолжительность острой фазы является спорной и, вероятно, варьирует у разных пациентов.Американские рекомендации предлагают продолжительность острой фазы 7–10 дней без каких-либо различий между ранним и поздним периодами [26]. Вышеупомянутые РКИ подвергались критике за введение относительно низких доз белков и за расчет энергетической цели по фиксированной формуле [35, 36]. Однако недавние исследования не подтверждают эту критику. Действительно, помимо увеличения потребления энергии, повышенное потребление белка, начатое на ранних стадиях критического заболевания, не принесло пользы. Крупнейшее РКИ по белковым добавкам, РКИ EFFORT Protein, в котором рандомизировано 1329 пациентов в критическом состоянии для получения высокой (≥2,2 г/кг/день) или обычной (≤1,2 г/кг/день) дозы белка, начатое в течение 96 часов после поступления в ОРИТ и продолжения лечения до 28 дней не показали пользы от высоких доз белка [37].
Напротив, раннее введение высоких доз белка связано с длительным пребыванием в ОРИТ и повышенной смертностью у наиболее тяжело больных пациентов и пациентов с острым повреждением почек [37]. Кроме того, в нефро-протективном РКИ (N = 474) не было выявлено пользы от внутривенного введения аминокислот, начатого в 1 или 2 день и продолжавшегося до выписки из ОРИТ [38], а вторичный анализ РКИ EPaNIC и PEPaNIC показал вред от раннего парентерального питания, особенно с более высокими дозам белка [15, 16].Недавний метаанализ влияния более высоких и более низких доз белка у пациентов в критическом состоянии не подтвердил никакой пользы от более высоких доз белка. Метаанализ показал потенциальную гетерогенность лечения, однако значительный вред смертности ограничивается пациентами с острым повреждением почек, что требует дальнейшего изучения [39].
Второй причиной, по которой недавние РКИ не смогли показать никакой пользы от раннего усиленного лечебного питания, является отсутствие непрямой калориметрии. Действительно, точная количественная оценка расхода энергии требует непрямой калориметрии, поскольку прогностические уравнения не позволяют точно оценить расход энергии у всех пациентов [40]. Однако нет убедительных доказательств того, что раннее кормление, основанное на непрямой калориметрии, будет превосходить питание, основанное на рассчитанном целевом потреблении энергии. Хотя метаанализ показал потенциальное снижение 28-дневной смертности у взрослых в критическом состоянии, это не повлияло на 90-дневную смертность и исходы были сходными [41]. Такая временная разница в смертности может быть объяснена смешением данных в неслепых РКИ. Более того, воспринимаемая разница в смертности через 28 дней была пограничной, поскольку статистическая значимость была бы потеряна, если бы у одного пациента был другой исход 28-дневной смертности (fragility index 1). Кроме того, метаанализ включал РКИ с разным дизайном и сопутствующими вмешательствами, что еще больше усложняет интерпретацию этих результатов.
Крупнейшее РКИ, сравнивающее расчетное и измеренное целевое потребление энергии, TICACOS-International РКИ (N = 580), не выявило преимуществ кормления на основе непрямой калориметрии, начатого рано после поступления в ОРИТ [42]. Более того, исследование было прекращено преждевременно из-за медленного набора участников, что может поставить под сомнение целесообразность рутинного использования непрямой калориметрии. Очевидно, эти результаты не обязательно могут быть экстраполированы на пациентов с длительным критическим состоянием.
Влияние фактических данных на клиническую практику и рекомендации
Опубликованные исследования способа, времени и дозы питания, возможно, значительно изменили практику в Европе, как предполагают Veraar et al. [43]. Указанный момент времени для начала энтерального и/или парентерального питания был перенесен на более поздний срок вскоре после публикации исследования EPaNIC (Fig. 1). Тем не менее, в течение нескольких лет после этого постепенно возникла тенденция возврата к более раннему началу, с несколько большими различиями между респондентами. РКИ CALORIES, показавшее отсутствие различий между изокалорическим энтеральным и парентеральным питанием, возможно, способствовало этому очевидному изменению. Очевидно, что тренд учитывает только время, а не дозу, которая могла снизиться за период времени, представленный на Fig. 1.

В противном случае можно было бы ожидать, что, по крайней мере, доза питания в острой фазе снизится в последующие годы, поскольку недавно РКИ Nutrirea-3 показало значительный вред от раннего введения высоких доз питания, независимо от пути введения [7]. Исследований, посвященных дозировке и способу питания, начатому после первых дней пребывания в ОРИТ, мало. В одном РКИ (N = 305) начало дополнительного парентерального питания у пациентов, не переносящих 60% или более измеренных энергетических потребностей энтеральным путем к 4-му дню после поступления в ОРИТ, не показало вреда по сравнению с отказом от дополнительного парентерального питания до 9-го дня [44]. В этом РКИ дополнительное парентеральное питание привело к значительно меньшему количеству инфекций в период с 9 по 28 день, хотя этому потенциальному позднему защитному эффекту противодействовало большее количество инфекций между 4 и 9 днями [45].
В ответ на РКИ, проведенные за последнее десятилетие, международные рекомендации по питанию изменились. Европейские рекомендации сместились в сторону рекомендаций менее агрессивного питания в острой фазе (Table 2) [40]. В то время как рекомендации 2006/2009 гг. рекомендовали начинать энтеральное питание в течение 24 часов и достигать целевого показателя калорийности (25 ккал/кг/день) в течение 2–3 дней [46, 47], рекомендации 2019 г. и частично обновленные рекомендации 2023 г. рекомендуют начинать с низкой калорийности дозирования энтерального питания в течение 48 часов после поступления в ОРИТ, если нет противопоказаний, и достижения целевого уровня энергии в течение 3–7 дней [40]. Если энтерального питания недостаточно, парентеральное питание рекомендуется начинать между 4 и 7 днями, а не в течение первых 2 дней [40, 47]. Что касается доз белка, рекомендация класса B – вводить белок в дозе 1,3–1,5 г/кг/день была преобразована в рекомендацию степени 0, в которой говорилось, что 1,3 г/кг/день можно вводить постепенно [40, 47].

Кроме того, американские рекомендации по питанию со временем изменились, но в разной степени. В то время как рекомендации 2009 г. рекомендовали раннее начало энтерального питания и отказ от лечебного питания, если энтеральное питание невозможно [26], рекомендации 2022 г. рекомендуют либо энтеральное, либо парентеральное питание в качестве основного способа питания в первые 7–10 дней [48]. Несмотря на более низкую рекомендуемую цель по питанию, чем в рекомендациях 2009 г. (12–25 ккал/кг/день в первые 7–10 дней вместо 25–30 ккал/кг/день), более широкий диапазон по-прежнему включает полную цель сразу после госпитализации в ОРИТ [26, 48]. Однако эта рекомендация была сделана до того, как стали доступны результаты РКИ Nutrirea-3, которые показали вред от такой высокой энергетической дозы, начатой сразу после поступления в ОРИТ, по сравнению с дозой, вдвое меньшей, чем самая низкая доза, в американских рекомендациях.
Если энтерального питания недостаточно, последние рекомендации по-прежнему не рекомендуют дополнительное парентеральное питание до 7-го дня [48]. Что касается целевого уровня белка, американские рекомендации содержат слабую рекомендацию по назначению 1,2–2 г белка/кг/день. Однако это предложение было сделано до того, как было опубликовано РКИ EFFORT по белкам [37], и можно было ожидать, что обновленная версия рекомендаций больше не будет предлагать такие высокие дозы. Различия между европейскими и американскими рекомендациями отражают постоянную неопределенность в отношении оптимальной стратегии питания пациентов в критическом состоянии. Действительно, поскольку недавние крупномасштабные РКИ были в основном отрицательными, стало ясно, каких стратегий кормления следует избегать, но не то, что следует делать.
Мы предлагаем лучше отразить в рекомендациях различный уровень доказательности. В связи с этим мы предлагаем, чтобы руководства содержали четкие рекомендации, чего следует избегать, а предложения о том, что делать, могли бы быть более неточными. Стало ясно, что в острой фазе следует избегать высоких доз всех макронутриентов. Однако продолжительность острой фазы остается неясной. Это иллюстрируется различиями между европейскими и американскими рекомендациями, которые допускают питаие ниже целевого уровня в течение 3–7 дней или максимум 7–10 дней соответственно [40, 48]. Различия между международными рекомендациями могут отражать разную оценку потенциального вреда длительного периода относительного голодания и потенциального вреда слишком раннего начала полноценной нутритивной поддержки.
Кроме того, некоторые рекомендации в руководствах могут сбивать с толку. Принимая во внимание, что Американские рекомендации допускают раннее кормление в дозах до 25 ккал/кг/день (которые, возможно, потребуется обновить после Nutrirea-3) и предлагают либо энтеральное, либо парентеральное питание в качестве основного метода питания. И существует сильная рекомендация против дополнительного парентерального питания в течение первых 7 дней. На сегодняшний день остаются неясными оптимальная доза и режим питания в острой фазе и после нее, а также идеальный момент для начала лечебного питания. Ни в одном РКИ не оценивалось, является ли кормление низкими дозами в острой фазе более эффективным по сравнению с прогрессивным лечебным питанием, кормлением промежуточными дозами или даже отсутствием питания. Кроме того, ни в одном крупном РКИ не изучалось, действительно ли раннее энтеральное питание превосходит отсроченное [49]. Однако при начале лечебного питания мы полагаем, что энтеральное питание является основным методом питания, если нет противопоказаний. Хотя РКИ не выявили преимущества энтерального способа питания по сравнению с парентеральным, окно вмешательства было коротким. При длительном применении парентеральное питание само по себе может вызвать проблемы, как это наблюдается у пациентов с короткой кишкой [50]. Кроме того, затраты на энтеральное питание ниже. Потенциальная прагматичная стратегия питания представлена на Fig. 2.

Назначение микроэлементов при критических состояниях
Без внешнего пополнения запасы большинства микроэлементов у здоровых людей истощаются в течение недель или месяцев [51]. У пациентов в критическом состоянии запасы микроэлементов могут уменьшаться гораздо быстрее. Кроме того, при поступлении в ОРИТ пациенты могут иметь дефицит питания, повышенное использование микроэлементов и повышенные потери жидкости организмом, а также находится на постоянной заместительной почечной терапии [52, 53]. Более того, недавний сдвиг в рекомендациях в сторону более ограничительного питания в острой фазе может способствовать развитию дефицита микроэлементов.Микронутриенты имеют решающее значение для жизненно важных функций, таких как производство АТФ, антиоксидантная и иммунная защита, транскрипция генов и в качестве кофакторов для многочисленных ферментов [54]. Симптомы дефицита микроэлементов неспецифичны и напоминают симптомы критического состояния [55]. Они могут проявиться только при начале лечебного питания, что проявляется рефидинг синдромом.
Действительно, рефидинг увеличивает потребность и внутриклеточное поглощение некоторых микроэлементов (особенно тиамина, а также других витаминов группы B и микроэлементов) и электролитов (преимущественно фосфата и калия). В случае низких общих запасов в организме это может привести к опасным для жизни аритмиям, угнетению сердечной деятельности, лактоацидозу и тяжелой мышечной слабости. Не существует утвержденных стандартных критериев диагностики рефидинг-синдрома. В качестве возможного суррогата использовалось снижение уровня фосфатов как минимум на 0,16 ммоль/л до уровня ниже 0,65 ммоль/л [56, 57].Риск рефидинг-синдрома увеличивается при переходе от длительного голодания или длительного малодозного питания к полноценному питанию. В Refeeding RCT (N = 339) временное ограничение потребления макронутриентов у пациентов, у которых развивалась гипофосфатемия при возобновлении питания, ассоциировалось со снижением смертности по сравнению с продолжающимся и увеличивающимся потреблением пищи, в то время как электролиты корректировались с одинаковой эффективностью в обеих группах [57]. Эти данные подтверждают осторожность в наращивании лечебного питания у пациентов с риском рефидинг-синдрома. В исследованиях не было подтверждено, можно ли снизить риск повторного кормления с помощью прогрессивного лечебного питания и/или введения достаточного количества микроэлементов и электролитов в острой фазе для предотвращения дефицита микроэлементов и электролитов.
Тем не менее, назначение поддерживающих доз микроэлементов представляется разумным. Однако идеальные дозы остаются неясными. Концентрации микроэлементов в плазме не могут определять терапию, поскольку на них также влияет перераспределение вследствие воспаления. Следовательно, концентрации микроэлементов в плазме не обязательно отражают запасы в организме, и не существует точных формул коррекции воспаления [58].
Когда пациент получает 1500 ккал через коммерческую формулу энтерального питания, она содержит достаточно микроэлементов, чтобы покрыть Dietary Reference Intake (DRI) (рекомендованную диетическую норму) для здоровых людей [51]. Однако у пациентов в критическом состоянии могут быть более высокие требования к удовлетворению основных потребностей. Рекомендации по предполагаемому оптимальному потреблению могут быть обнаружены в рекомендациях ESPEN по микроэлементам, опубликованных в 2022 году [51]. Предлагаемые поддерживающие дозы для пациентов в критическом состоянии, как правило, основаны на доказательствах низкого уровня. Помимо поддерживающих доз, также были предложены гораздо более высокие фармакологические дозы для отдельных микроэлементов, включая витамин С, витамин D и селен. Подобную практику, вероятно, следует отделить от лечебного питания и рассматриваться как фармакологические вмешательства, направленные на терапевтический эффект лекарственного средства. Однако назначение высоких доз каких-либо микроэлементов не оказалось полезным и не рекомендуется [51, 59].
Механизмы, объясняющие отсутствие пользы от раннего высокодозного питания
Отсутствие пользы от раннего высокодозного питания можно объяснить несколькими механизмами, включая анаболическую резистентность (неспособность использовать питательные вещества для анаболизма), подавление процессов восстановления клеток, включая аутофагию и кетогенез, а также обострение стрессовой гипергликемии и потребности в инсулине (Fig. 3) [4]. Похоже, что при остром критическом состоянии макронутриенты нельзя использовать так, как у здоровых людей [4]. Несмотря на то, что лечебное питание пропагандируется для ограничения эндогенного катаболизма, недавние данные подтверждают обратное. Действительно, увеличение потребления пищи не предотвратило потерю мышечной массы в РКИ EPaNIC [13, 60]. Более того, несколько РКИ показали усиление уреагенеза за счет увеличения потребления белка или аминокислот, что указывает на бесполезный катаболизм дополнительных аминокислот [16, 34, 37,38, 61–63].

Лечебное питание также мощно подавляет аутофагию и кетогенез, что может быть вредным [4]. Действительно, аутофагия является важным процессом восстановления клеток, который способен устранять макромолекулярные повреждения, включая поврежденные клеточные органеллы, белковые агрегаты и внутриклеточные микроорганизмы [64, 65]. Все больше данных указывает на то, что активированная аутофагия является важнейшим путем восстановления после органной недостаточности, вызванной критическим состоянием [64]. В физиологических условиях аутофагия сильно подавляется питанием и инсулином, а экспериментальные исследования подтверждают подавление аутофагии усиленным питанием при критических состояниях [13, 64, 66]. В подгруппе пациентов, включенных в РКИ EPaNIC, подавление мышечной аутофагии ранним парентеральным питанием ассоциировалось с усилением слабости, что подтверждает функциональную значимость этих результатов [13].
Также подавление кетогенеза считается потенциальным медиатором вреда при раннем питании высокими дозами.Помимо того, что кетоны являются эффективным источником энергии, они могут стимулировать аутофагию и регенерацию мышц, а также оказывать противовоспалительное действие [67]. Экспериментальные исследования показали, что введение экзогенных кетонов защищает мышей с сепсисом от мышечной слабости [68, 69]. Во вторичном анализе РКИ EPaNIC и PEPaNIC отказ от раннего парентерального питания активировал кетогенез, особенно у детей в критическом состоянии, у которых влияние на кетогенез статистически опосредовано частью конечной пользы вмешательства [70, 71]. Следовательно, анорексия и непереносимость энтерального питания могут быть адаптивными при остром критическом состоянии за счет активации процессов восстановления клеток, вызванных относительным голоданием.
Раннее лечебное питание также увеличивает степень стрессовой гипергликемии, что связано с плохим исходом, хотя идеальный целевой уровень глюкозы в крови остается дискуссионным [72]. В отличие от первоначальных Leuven РКИ , которые показали улучшение результата за счет жесткого контроля уровня глюкозы у пациентов, получавших раннее парентеральное питание (N = 3448) [73–75], недавнее TGC-fast РКИ (N = 9230) у пациентов, не получавших раннее парентеральное питание, не показало улучшения в снижении смертности [76] .Поразительным различием между Leuven РКИ и TGC-fast РКИ является гораздо меньшая тяжесть гипергликемии TGC-fast РКИ, что объясняется значительно более низким энергетическим обеспечением из-за отсутствия раннего парентерального питания [76].
Следовательно, повышенная смертность в Leuven РКИ, по-видимому, объясняется более тяжелой гипергликемией, вызванной ранним парентеральным питанием, которое привело к перееданию в первую неделю [76, 77]. Механистические исследования связывают вред тяжелой ятрогенной гипергликемии с перегрузкой глюкозой в жизненно важных органах, а не с отсутствием эффекта инсулина [78]. Действительно, инсулин сам по себе может иметь нежелательные побочные эффекты на восстановление органов, поскольку он является мощным супрессором аутофагии и кетогенеза [79, 80]. Это может объяснить, почему более низкие уровни глюкозы независимо связаны с улучшением результатов в РКИ, тогда как увеличение доз инсулина независимо связано с вредом [81].
Следовательно, отказ от раннего полноценного питания может быть полезным, поскольку позволяет избежать ятрогенной тяжелой гипергликемии и снизить потребность в инсулине. В настоящее время ни один проверенный метаболический монитор не может определить момент времени, когда анаболическая резистентность переключается на реакцию на питание. Потенциальные признаки переедания, включая гипергликемию и повышенную потребность в инсулине, гиперуремию, повышение соотношения мочевины и креатинина и гипертриглицеридемию, неспецифичны [82]. Более того, недостаточное питание также может привести к гиперуремии и увеличению соотношения мочевины и креатинина [83]. Косвенная калориметрия не определяет количество эндогенной энергии, не подавляемой питанием [4]. Измерение расхода энергии в состоянии покоя (REE) с помощью непрямой калориметрии после острой фазы может быть полезным для определения дозы питания; однако необходима проверка, а также определенный опыт для интерпретации результатов, выходящих за пределы одного значения REE [84].
Следует иметь в виду, что перекармливание приводит к увеличению REE (не отражающему фактическую потребность) из-за усиления диетоиндуцированного термогенеза, что может ошибочно побудить врачей к увеличению дозы питания, тогда как недостаточное питание не приводит к снижению REE. Вероятно, продолжительность анаболической резистентности и нежелательных эффектов нутритивной поддержки различаются у разных пациентов, поскольку нежелательная реакция на кормление, вероятно, сопровождает острую реакцию на стресс и связанные с ней воспалительные и эндокринные изменения [4]. Ввиду отсутствия метаболического монитора и принимая во внимание вышеизложенное, может быть разумным снова временно ограничить прием макронутриентов у пациентов, столкнувшихся с новым тяжелым состоянием в ОРИТ, включая септический шок de novo, возникающий после пребывания в ОРИТ.
Перспективы на будущее
Хотя недавние данные показали преимущества, связанные с относительным голоданием при острых критических заболеваниях, длительное голодание, вероятно, будет иметь свою цену. В крупных РКИ по вопросам питания основное внимание уделялось началу лечебного питания в первые дни, а окно вмешательства часто ограничивалось первой неделей пребывания в ОРИТ. В РКИ с более длительным окном вмешательства любая польза от более высокой дозы питания в постострой фазе могла быть нейтрализована вредом в острой фазе.Будущие РКИ должны быть сосредоточены на вмешательствах, начатых после острой фазы, и вмешательствах, продолжающихся в период восстановления [4]. В связи с этим РКИ с участием госпитализированных пациентов в некритическом состоянии (N = 2088) выявило снижение смертности при индивидуальной нутритивной поддержке в соответствии с протоколом по сравнению со стандартным питанием, что позволяет предположить, что оптимизированное питание может улучшить тяжелые клинические конечные точки, если оно предоставляется в правильной дозе для правильного пациента [85].
Тем не менее, оптимизация питания в этом РКИ была достигнута главным образом за счет оптимизации перорального приема пищи, что вряд ли возможно у большинства пациентов ОРИТ. Более того, протокол также обеспечивал достаточное потребление микроэлементов в группе вмешательства. Таким образом, остается неясным, объясняется ли снижение смертности оптимизацией потребления макронутриентов, предотвращением дефицита микроэлементов или тем и другим. Поскольку последствия избыточного и недостаточного питания неочевидны, будущие РКИ должны включать результаты, выходящие за рамки выписки из ОРИТ. Кроме того, может существовать взаимосвязь между оптимизацией потребления питательных веществ в постострой фазе и физическими упражнениями, которая требует дальнейшего изучения [86, 87]. Будущие исследования должны выяснить, может ли непрямая калориметрия быть полезной для определения дозировки энергии после острой фазы критического заболевания, а также оценить дыхательный коэффициент как переменную, позволяющую дифференцировать переедание и недоедание, как предлагают некоторые эксперты [84].
Кроме того, состав макронутриентов практически не изучен, но, вероятно, он важен, исходя из физиологии и косвенных данных. Метаболический монитор, позволяющий отслеживать использование питательных веществ во время их приема, будет необходим для разработки и проверки вмешательств, основанных на метаболических реакциях на кормление [4]. Результаты мониторинга желудочно-кишечной дисфункции также должны быть подтверждены в будущих исследованиях, поскольку они могут быть полезны при изучении этого аспекта комплексного ответа на энтеральное питание (ЭН). Поскольку механистические исследования показывают пользу от активации реакции на голодание при критических заболеваниях [4], будущие исследования должны выяснить, можно ли использовать эти преимущества, связанные с голоданием, в новых стратегиях питания.
В связи с этим в качестве альтернативных стратегий были предложены стратегии прерывистого голодания/питания, кетогенные диеты и добавки кетонов [67]. Чередование периодов кормления с интервалами голодания может периодически активировать реакцию на голодание с усилением аутофагии и кетогенеза, избегая при этом длительного голодания [67]. Прерывистое голодание также улучшило чувствительность к инсулину у людей и животных, не находящихся в критическом состоянии [88]. Более того, было высказано предположение, что прерывистое введение аминокислот является более анаболическим, чем непрерывное введение аминокислот, поскольку позволяет избежать так называемого эффекта наполнения мышц [89–91]. Однако данные крупномасштабных РКИ, подтверждающие эффективность и безопасность периодического голодания/питания, добавок кетонов и кетогенных диет, отсутствуют. РКИ, в которых изучалась прерывистая и непрерывная лечебная диетотерапия, не показали устойчивых преимуществ [92, 93].
Однако, помимо недостаточной мощности для обнаружения или исключения пользы, интервал голодания в этих РКИ был относительно коротким (в целом всего 4–6 часов), что могло быть слишком коротким для активации полного ответа натощак [94]. Хотя кетогенные диеты успешно применяются при рефрактерном эпилептическом статусе, данные РКИ, подтверждающие их широкое применение у пациентов в критическом состоянии, отсутствуют [67, 95]. Более того, достижение кетоза может оказаться затруднительным, поскольку значительное количество лекарств содержит углеводные соединения [96]. Что касается микроэлементов, будущие исследования могут быть направлены на выяснение индивидуальных основных потребностей. Большинство рекомендаций относительно покрытия основных потребностей являются Good Clinical Practice Points [51]. Улучшение оценки реальных потерь и статуса микроэлементов может помочь оптимизировать поддерживающую дозирование.
Выводы
Данные крупномасштабных РКИ показали вред введения высоких доз макронутриентов любым путем во время острой фазы критического заболевания, что можно объяснить анаболической резистентностью, подавлением аутофагии и кетогенеза, а также перекармливанием с более тяжелой гипергликемией и потребностью в инсулине.Момент времени, когда анаболическая резистентность переключается на реакцию на питание, остается неясным.Таким образом, персонализированное лечебное питание, хотя и желательно, в настоящее время неосуществима.Необходимы проверенные инструменты, которые контролируют фактические потребности в энергии, белке и микроэлементах и потенциально позволяют свести к минимуму как пере-, так и недоедание. Поскольку отсрочка полноценного питания может увеличить риск дефицита микроэлементов и последующего синдрома возобновления питания, представляется разумным покрывать базальные потребности в микроэлементах у всех пациентов в критическом состоянии.
References
1. Vanhorebeek I, Latronico N, Van den Berghe G (2020) ICU-acquired weakness. Intensive Care Med 46(4):637–653. https:// doi. org/ 10. 1007/s00134- 020- 05944-4
2. Villet S, Chiolero RL, Bollmann MD, Revelly JP, Cayeux RNM, Delarue J, Berger MM (2005) Negative impact of hypocaloric feeding and energy balance on clinical outcome in ICU patients. Clin Nutr 24(4):502–509. https:// doi. org/ 10. 1016/j. clnu. 2005. 03. 006
3. Lew CCH, Wong GJY, Cheung KP, Chua AP, Chong MFF, Miller M (2017) Association between malnutrition and 28-day mortality and intensive care length-of-stay in the critically ill: a prospective cohort study. Nutrients.https:// doi. org/ 10. 3390/ nu100 10010
4. Gunst J, Casaer MP, Preiser JC, Reignier J, Van den Berghe G (2023) Toward nutrition improving outcome of critically ill patients: how to interpret recent feeding RCTs? Crit Care 27(1):43. https:// doi. org/ 10. 1186/s13054- 023- 04317-9
5. Casaer MP, Mesotten D, Hermans G, Wouters PJ, Schetz M, Meyfroidt G,Van Cromphaut S, Ingels C, Meersseman P, Muller J, Vlasselaers D, DebaveyeY, Desmet L, Dubois J, Van Assche A, Vanderheyden S, Wilmer A, Van den Berghe G (2011) Early versus late parenteral nutrition in critically ill adults. N Engl J Med 365(6):506–517. https:// doi. org/ 10. 1056/ NEJMoa1102 662
6. Reignier J, Boisrame-Helms J, Brisard L, Lascarrou JB, AitHssain A, Anguel N, Argaud L, Asehnoune K, Asfar P, Bellec F, Botoc V, Bretagnol A, Bui HN, Canet E, Da Silva D, Darmon M, Das V, Devaquet J, Djibre M, Ganster F, Garrouste-Orgeas M, Gaudry S, Gontier O, Guerin C, Guidet B, Guitton C, Herbrecht JE, Lacherade JC, Letocart P, Martino F, Maxime V, Mercier E, Mira JP, Nseir S, Piton G, Quenot JP, Richecoeur J, Rigaud JP, Robert R, Rolin N, Schwebel C, Sirodot M, Tinturier F, Thevenin D, Giraudeau B, Le Gouge A, Investigators N-T, Clinical Research in Intensive C, Sepsis g (2018) Enteral versus parenteral early nutrition in ventilated adults withshock: a randomised, controlled, multicentre, open-label, parallel-group study (NUTRIREA-2). Lancet 391(10116):133–143. https:// doi. org/ 10. 1016/S0140- 6736(17) 32146-3
7. Reignier J, Plantefeve G, Mira JP, Argaud L, Asfar P, Aissaoui N, Badie J, Botoc NV, Brisard L, Bui HN, Chatellier D, Chauvelot L, Combes A, Cracco C, Darmon M, Das V, Debarre M, Delbove A, Devaquet J, Dumont LM, Gontier O, Groyer S, Guerin L, Guidet B, Hourmant Y, Jaber S, Lambiotte F, Leroy C, Letocart P, Madeux B, Maizel J, Martinet O, Martino F, Maxime
V, Mercier E, Nay MA, Nseir S, Oziel J, Picard W, Piton G, Quenot JP, Reizine F, Renault A, Richecoeur J, Rigaud JP, Schneider F, Silva D, Sirodot M, Souweine B, Tamion F, Terzi N, Thevenin D, Thiery G, Thieulot-Rolin N, Timsit JF, Tinturier F, Tirot P, Vanderlinden T, Vinatier I, Vinsonneau C, Voicu S, Lascarrou JB, Le Gouge A, Investigators N-T, Clinical Research in Intensive C, Sepsis G (2023) Low versus standard calorie and protein feeding in ventilated adults with shock: a randomised, controlled, multicentre, open-label, parallel-group trial (NUTRIREA-3). Lancet Respir Med 11(7):602–612. https:// doi. org/ 10. 1016/ S2213- 2600(23) 00092-9
8. Fivez T, Kerklaan D, Mesotten D, Verbruggen S, Wouters PJ, Vanhorebeek I, Debaveye Y, Vlasselaers D, Desmet L, Casaer MP, Garcia Guerra G, Hanot J, Joffe A, Tibboel D, Joosten K, Van den Berghe G (2016) Early versus late parenteral nutrition in critically ill children. N Engl J Med 374(12):1111–1122. https:// doi. org/ 10. 1056/ NEJMo a1514 762
9. Wischmeyer PE, Bear DE, Berger MM, De Waele E, Gunst J, McClave SA, Prado CM, Puthucheary Z, Ridley EJ, Van den Berghe G, van Zanten ARH (2023) Personalized nutrition therapy in critical care: 10 expert recommendations. Crit Care 27(1):261. https:// doi. org/ 10. 1186/s13054- 023- 04539-x
10. Reintam Blaser A, Rooyackers O, Bear DE (2023) How to avoid harm with feeding critically ill patients: a synthesis of viewpoints of a basic scientist, dietitian and intensivist. Crit Care 27(1):258. https:// doi. org/ 10. 1186/s13054- 023- 04543-1
11. Alberda C, Gramlich L, Jones N, Jeejeebhoy K, Day AG, Dhaliwal R, Heyland DK (2009) The relationship between nutritional intake and clinical outcomes in critically ill patients: results of an international multicenter observational study. Intensive Care Med 35(10):1728–1737. https:// doi.org/ 10. 1007/ s00134- 009- 1567-4
12. Lv C, Jiang X, Long Y, Liu Z, Lin J, Wu C, Ye X, Ye R, Liu Y, Liu M, Liu Y, Chen W, Gao L, Tong Z, Ke L, Jiang Z, Li W (2022) Association between caloric adequacy and short-term clinical outcomes in critically ill patients using a weight-based equation: secondary analysis of a cluster-randomized controlled trial. Front Nutr 9:902986. https:// doi. org/ 10. 3389/ fnut. 2022.902986
13. Hermans G, Casaer MP, Clerckx B, Guiza F, Vanhullebusch T, Derde S, Meersseman P, Derese I, Mesotten D, Wouters PJ, Van Cromphaut S, Debaveye Y, Gosselink R, Gunst J, Wilmer A, Van den Berghe G, Vanhorebeek I (2013) Effect of tolerating macronutrient deficit on the development of intensive-care unit acquired weakness: a subanalysis of the EPaNIC trial. Lancet Respir Med 1(8):621–629. https:// doi. org/ 10. 1016/S2213- 2600(13) 70183-8
14. Jacobs A, Dulfer K, Eveleens RD, Hordijk J, Van Cleemput H, Verlinden I, Wouters PJ, Mebis L, Guerra GG, Joosten K, Verbruggen SC, Guiza F, Vanhorebeek I, Van den Berghe G (2020) Long-term developmental effect of withholding parenteral nutrition in paediatric intensive care units: a 4-year follow-up of the PEPaNICrandomised controlled trial. Lancet Child Adolesc Health 4(7):503–514. https:// doi. org/ 10. 1016/ S2352- 4642(20)30104-8
15. Casaer MP, Wilmer A, Hermans G, Wouters PJ, Mesotten D, Van den Berghe G (2013) Role of disease and macronutrient dose in the randomized controlled EPaNIC trial: a post hoc analysis. Am J Respir Crit Care Med 187(3):247–255. https:// doi. org/ 10. 1164/ rccm. 201206- 0999OC
16. Vanhorebeek I, Verbruggen S, Casaer MP, Gunst J, Wouters PJ, Hanot J, Guerra GG, Vlasselaers D, Joosten K, Van den Berghe G (2017) Effect of early supplemental parenteral nutrition in the paediatric ICU: a preplanned observational study of post-randomisation treatments in the PEPaNIC trial. Lancet Respir Med 5(6):475–483. https:// doi. org/ 10.1016/ S2213- 2600(17) 30186-8
17. Harvey SE, Parrott F, Harrison DA, Bear DE, Segaran E, Beale R, Bellingan G, Leonard R, Mythen MG, Rowan KM, Investigators CT (2014) Trial of the route of early nutritional support in critically ill adults. N Engl J Med 371(18):1673–1684. https:// doi. org/ 10. 1056/ NEJMo a1409 860
18. National Heart L, Blood Institute Acute Respiratory Distress Syndrome Clinical Trials N, Rice TW, Wheeler AP, Thompson BT, Steingrub J, Hite RD, Moss M, Morris A, Dong N, Rock P (2012) Initial trophic vs full enteral feeding in patients with acute lung injury: the EDEN randomized trial. JAMA 307(8):795–803. https:// doi. org/ 10. 1001/ jama. 2012. 137
19. Arabi YM, Aldawood AS, Haddad SH, Al-Dorzi HM, Tamim HM, Jones G, Mehta S, McIntyre L, Solaiman O, Sakkijha MH, Sadat M, Afesh L, Permi TTG (2015) Permissive Underfeeding or Standard Enteral Feeding in Critically Ill Adults. N Engl J Med 372(25):2398–2408. https:// doi. org/ 10. 1056/NEJMo a1502 826
20. Target Investigators ftACTG, Chapman M, Peake SL, Bellomo R, Davies A, Deane A, Horowitz M, Hurford S, Lange K, Little L, Mackle D, O’Connor S, Presneill J, Ridley E, Williams P, Young P (2018) Energy-dense versus routine enteral nutrition in the critically ill. N Engl J Med 379(19):1823–1834. https:// doi. org/ 10. 1056/ NEJMo a1811 687
21. Needham DM, Dinglas VD, Morris PE, Jackson JC, Hough CL, Mendez-Tellez PA, Wozniak AW, Colantuoni E, Ely EW, Rice TW, Hopkins RO, Network NNA (2013) Physical and cognitive performance of patients with acute lung injury 1 year after initial trophic versus full enteral feeding. EDEN trial follow-up. Am J Respir Crit Care Med 188(5):567–576. https://
doi. org/ 10. 1164/ rccm. 201304- 0651OC
22. Needham DM, Dinglas VD, Bienvenu OJ, Colantuoni E, Wozniak AW, Rice TW, Hopkins RO, Network NNA (2013) One year outcomes in patients with acute lung injury randomised to initial trophic or full enteral feeding: prospective follow-up of EDEN randomised trial. BMJ 346:f1532. https://doi. org/ 10. 1136/ bmj. f1532
23. Deane AM, Little L, Bellomo R, Chapman MJ, Davies AR, Ferrie S, Horowitz M, Hurford S, Lange K, Litton E, Mackle D, O’Connor S, Parker J, Peake SL, Presneill JJ, Ridley EJ, Singh V, van Haren F, Williams P, Young P, Iwashyna TJ (2020) Outcomes six months after delivering 100% or 70% of enteral calorie requirements during critical illness (TARGET). A randomized controlled trial. Am J Respir Crit Care Med 201(7):814–822. https:// doi. org/ 10. 1164/rccm. 201909- 1810OC
24. Arabi YM, Aldawood AS, Al-Dorzi HM, Tamim HM, Haddad SH, Jones G, McIntyre L, Solaiman O, Sakkijha MH, Sadat M, Mundekkadan S, Kumar A, Bagshaw SM, Mehta S, Permi T (2017) Permissive underfeeding or standard enteral feeding in high- and low-nutritional-risk critically ill adults. Post hoc analysis of the PermiT Trial. Am J Respir Crit Care Med 195(5):652–662. https:// doi. org/ 10. 1164/ rccm. 201605- 1012OC
25. Yue HY, Peng W, Zeng J, Zhang Y, Wang Y, Jiang H (2024) Efficacy of permissive underfeeding for critically ill patients: an updated systematic review and trial sequential meta-analysis. J Intensive Care 12(1):4. https://doi. org/ 10. 1186/ s40560- 024- 00717-3
26. McClave SA, Martindale RG, Vanek VW, McCarthy M, Roberts P, Taylor B, Ochoa JB, Napolitano L, Cresci G, Directors ASPENBo, American College of Critical Care M, Society of Critical Care M (2009) Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (ASPEN). JPEN J Parenter Enteral Nutr 33(3):277–316. https:// doi. org/ 10. 1177/ 01486 07109 335234
27. Singer P, Blaser AR, Berger MM, Alhazzani W, Calder PC, Casaer MP, Hiesmayr M, Mayer K, Montejo JC, Pichard C, Preiser JC, van Zanten ARH, Oczkowski S, Szczeklik W, Bischoff SC (2019) ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 38(1):48–79. https:// doi. org/10. 1016/j. clnu. 2018. 08. 037
28. Arabi YM, Tamim HM, Dhar GS, Al-Dawood A, Al-Sultan M, Sakkijha MH, Kahoul SH, Brits R (2011) Permissive underfeeding and intensive insulin therapy in critically ill patients: a randomized controlled trial. Am J Clin Nutr 93(3):569–577. https:// doi. org/ 10. 3945/ ajcn. 110. 005074
29. Rice TW, Mogan S, Hays MA, Bernard GR, Jensen GL, Wheeler AP (2011) Randomized trial of initial trophic versus full-energy enteral nutrition in mechanically ventilated patients with acute respiratory failure. Crit Care Med 39(5):967–974. https:// doi. org/ 10. 1097/ CCM. 0b013 e3182 0a905a
30. Charles EJ, Petroze RT, Metzger R, Hranjec T, Rosenberger LH, Riccio LM, McLeod MD, Guidry CA, Stukenborg GJ, Swenson BR, Willcutts KF,O’Donnell KB, Sawyer RG (2014) Hypocaloric compared with eucaloric nutritional support and its effect on infection rates in a surgical intensive care unit: a randomized controlled trial. Am J Clin Nutr 100(5):1337–1343.https:// doi. org/ 10. 3945/ ajcn. 114. 088609
31. Petros S, Horbach M, Seidel F, Weidhase L (2016) Hypocaloric vs normocaloric nutrition in critically ill patients: a prospective randomized pilot trial. JPEN J Parenter Enteral Nutr 40(2):242–249. https:// doi. org/ 10. 1177/01486 07114 528980
32. Braunschweig CA, Sheean PM, Peterson SJ, Gomez Perez S, Freels S, Lateef O, Gurka D, Fantuzzi G (2015) Intensive nutrition in acute lung injury: a clinical trial (INTACT). JPEN J Parenter Enteral Nutr 39(1):13–20. https:// doi.org/ 10. 1177/ 01486 07114 528541
33. Rugeles S, Villarraga-Angulo LG, Ariza-Gutierrez A, Chaverra-Kornerup S, Lasalvia P, Rosselli D (2016) High-protein hypocaloric vs normocaloric enteral nutrition in critically ill patients: a randomized clinical trial. J Crit Care 35:110–114. https:// doi. org/ 10. 1016/j. jcrc. 2016. 05. 004
34. Allingstrup MJ, Kondrup J, Wiis J, Claudius C, Pedersen UG, Hein-Rasmussen R, Bjerregaard MR, Steensen M, Jensen TH, Lange T, Madsen MB, Moller MH, Perner A (2017) Early goal-directed nutrition versus standard of care in adult intensive care patients: the single-centre, randomised, outcome assessor-blinded EAT-ICU trial. Intensive Care Med 43(11):1637–1647. https:// doi. org/ 10. 1007/ s00134- 017- 4880-3
35. Hoffer LJ, Bistrian BR (2016) Nutrition in critical illness: a current conundrum. F1000Res 5:2531. https:// doi. org/ 10. 12688/ f1000 research. 9278.1
36. Hartl WH, Elke G (2023) Nutrition during the acute phase of critical illness:discussions on NUTRIREA-3. Lancet Respir Med 11(7):e61. https:// doi. org/10. 1016/ S2213- 2600(23) 00212-6
37. Heyland DK, Patel J, Compher C, Rice TW, Bear DE, Lee ZY, Gonzalez VC,O’Reilly K, Regala R, Wedemire C, Ibarra-Estrada M, Stoppe C, Ortiz-Reyes L, Jiang X, Day AG, team EPT (2023) The effect of higher protein dosing in critically ill patients with high nutritional risk (EFFORT Protein): an international, multicentre, pragmatic, registry-based randomised trial. Lancet 401(10376):568–576. https:// doi. org/ 10. 1016/ S0140- 6736(22) 02469-2
38. Doig GS, Simpson F, Bellomo R, Heighes PT, Sweetman EA, Chesher D, Pollock C, Davies A, Botha J, Harrigan P, Reade MC (2015) Intravenous amino acid therapy for kidney function in critically ill patients: a randomized controlled trial. Intensive Care Med 41(7):1197–1208. https:// doi.org/ 10. 1007/ s00134- 015- 3827-9
39. Lee ZY, Dresen E, Lew CCH, Bels J, Hill A, Hasan MS, Ke L, van Zanten A, van de Poll MCG, Heyland DK, Stoppe C (2024) The effects of higher versus lower protein delivery in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials with trial sequential analysis. Crit Care 28(1):15. https:// doi. org/ 10. 1186/s13054- 023- 04783-1
40. Singer P, Blaser AR, Berger MM, Calder PC, Casaer M, Hiesmayr M, Mayer K, Montejo-Gonzalez JC, Pichard C, Preiser JC, Szczeklik W, van Zanten ARH, Bischoff SC (2023) ESPEN practical and partially revised guideline: Clinical nutrition in the intensive care unit. Clin Nutr 42(9):1671–1689. https:// doi.org/ 10. 1016/j. clnu. 2023. 07. 011
41. Pertzov B, Bar-Yoseph H, Menndel Y, Bendavid I, Kagan I, Glass YD, Singer P (2022) The effect of indirect calorimetry guided isocaloric nutrition on mortality in critically ill patients-a systematic review and meta-analysis. Eur J Clin Nutr 76(1):5–15. https:// doi. org/ 10. 1038/ s41430- 021- 00919-0
42. Singer P, De Waele E, Sanchez C, Ruiz Santana S, Montejo JC, Laterre PF, Soroksky A, Moscovici E, Kagan I (2021) TICACOS international: A multicenter, randomized, prospective controlled study comparing tight calorie control versus Liberal calorie administration study. Clin Nutr 40(2):380–387. https:// doi. org/ 10. 1016/j. clnu. 2020. 05. 024
43. Veraar C, Geilen J, Fischer A, Sulz I, Tarantino S, Mouhieddine M, Mora B, Schuh C, Singer P, Hiesmayr MJ (2021) Timing of parenteral nutrition in ICU patients: a transatlantic controversy. Clin Nutr ESPEN. 46:532–538.https:// doi. org/ 10. 1016/j. clnesp. 2021. 08. 007
44. Heidegger CP, Berger MM, Graf S, Zingg W, Darmon P, Costanza MC, Thibault R, Pichard C (2013) Optimisation of energy provision with supplemental parenteral nutrition in critically ill patients: a randomised controlled clinical trial. Lancet 381(9864):385–393. https:// doi. org/ 10.1016/ S0140- 6736(12) 61351-8
45. Heidegger CP, Berger MM, Thibault R, Zingg W, Pichard C (2013) Supplemental parenteral nutrition in critically ill patients–authors’ reply. Lancet 381(9879):1716–1717. https:// doi. org/ 10. 1016/ S0140- 6736(13) 61072-7
46. Kreymann KG, Berger MM, Deutz NE, Hiesmayr M, Jolliet P, Kazandjiev G, Nitenberg G, van den Berghe G, Wernerman J, Dgem EC, Hartl W, Heymann C, Spies C, Espen (2006) ESPEN guidelines on enteral nutrition: intensive care. Clin Nutr 25(2):210–223. https:// doi. org/ 10. 1016/j.clnu. 2006. 01. 021
47. Singer P, Berger MM, Van den Berghe G, Biolo G, Calder P, Forbes A, Griffiths R, Kreyman G, Leverve X, Pichard C, Espen (2009) ESPEN Guidelines on parenteral nutrition: intensive care. Clin Nutr 28(4):387–400.https:// doi. org/ 10. 1016/j. clnu. 2009. 04. 024
48. Compher C, Bingham AL, McCall M, Patel J, Rice TW, Braunschweig C, McKeever L (2022) Guidelines for the provision of nutrition support therapy in the adult critically ill patient: the American Society for Parenteral and Enteral Nutrition. JPEN J Parenter Enteral Nutr 46(1):12–41. https://doi. org/ 10. 1002/ jpen. 2267
49. Fuentes Padilla P, Martinez G, Vernooij RW, Urrutia G, Roque IFM, Bonfill Cosp X (2019) Early enteral nutrition (within 48 hours) versus delayed enteral nutrition (after 48 hours) with or without supplemental parenteral nutrition in critically ill adults. Cochrane Database Syst Rev. https:// doi.org/ 10. 1002/ 14651 858. CD012 340. pub2
50. Fuglsang KA, Brandt CF, Jeppesen PB (2022) Survival in patients initiating home parenteral support due to nonmalignant short bowel syndrome compared with background population. Clin Nutr ESPEN 50:170–177.https:// doi. org/ 10. 1016/j. clnesp. 2022. 05. 023
51. Berger MM, Shenkin A, Schweinlin A, Amrein K, Augsburger M, Biesalski HK, Bischoff SC, Casaer MP, Gundogan K, Lepp HL, de Man AME, Muscogiuri G, Pietka M, Pironi L, Rezzi S, Cuerda C (2022) ESPEN micronutrient guideline. Clin Nutr 41(6):1357–1424. https:// doi. org/ 10. 1016/j. clnu. 2022.02. 015
52. Koekkoek WA, van Zanten AR (2016) Antioxidant vitamins and trace elements in critical illness. Nutr Clin Pract 31(4):457–474. https:// doi. org/ 10.1177/ 08845 33616 653832
53. Berger MM, Broman M, Forni L, Ostermann M, De Waele E, Wischmeyer PE (2021) Nutrients and micronutrients at risk during renal replacement therapy: a scoping review. Curr Opin Crit Care 27(4):367–377. https:// doi. org/ 10. 1097/ MCC. 00000 00000 000851
54. Koekkoek KWA, Berger MM (2023) An update on essential micronutrients in critical illness. Curr Opin Crit Care 29(4):315–329. https:// doi. org/ 10.1097/ MCC. 00000 00000 001062
55. Casaer MP, Bellomo R (2019) Micronutrient deficiency in critical illness: an invisible foe? Intensive Care Med 45(8):1136–1139. https:// doi. org/ 10.1007/ s00134- 019- 05678-y
56. Doig GS, Simpson F, Heighes PT, Bellomo R, Chesher D, Caterson ID, Reade MC, Harrigan PW, Refeeding Syndrome Trial Investigators G (2015) Restricted versus continued standard caloric intake during the management of refeeding syndrome in critically ill adults: a randomised, parallel-group, multicentre, single-blind controlled trial. Lancet Respir Med 3(12):943–952. https:// doi. org/ 10. 1016/ S2213- 2600(15) 00418-X
57. Olthof LE, Koekkoek W, van Setten C, Kars JCN, van Blokland D, van Zanten ARH (2018) Impact of caloric intake in critically ill patients with, and without, refeeding syndrome: a retrospective study. Clin Nutr 37(5):1609–1617. https:// doi. org/ 10. 1016/j. clnu. 2017. 08. 001
58. Berger MM, Talwar D, Shenkin A (2022) Pitfalls in the interpretation of blood tests used to assess and monitor micronutrient nutrition status. Nutr Clin Pract. https:// doi. org/ 10. 1002/ ncp. 10924
59. Reintam Blaser A, Alhazzani W, Belley-Cote E, Moller MH, Adhikari NKJ, Burry L, Coopersmith CM, Al Duhailib Z, Fujii T, Granholm A, Gunst J, Hammond N, Ke L, Lamontagne F, Loudet C, Morgan M, Ostermann M, Reinikainen M, Rosenfeld R, Spies C, Oczkowski S (2023) Intravenous vitamin C therapy in adult patients with sepsis: a rapid practice guideline. Acta Anaesthesiol Scand. https:// doi. org/ 10. 1111/ aas. 14311
60. Casaer MP, Langouche L, Coudyzer W, Vanbeckevoort D, De Dobbelaer B, Guiza FG, Wouters PJ, Mesotten D, Van den Berghe G (2013) Impact of early parenteral nutrition on muscle and adipose tissue compartments during critical illness. Crit Care Med 41(10):2298–2309. https:// doi. org/ 10.1097/ CCM. 0b013 e3182 8cef02
61. Gunst J, Vanhorebeek I, Casaer MP, Hermans G, Wouters PJ, Dubois J, Claes K, Schetz M, Van den Berghe G (2013) Impact of early parenteral nutrition on metabolism and kidney injury. J Am Soc Nephrol 24(6):995–1005.https:// doi. org/ 10. 1681/ ASN. 20120 70732
62. Heyland DK, Wibbenmeyer L, Pollack JA, Friedman B, Turgeon AF, Eshraghi N, Jeschke MG, Belisle S, Grau D, Mandell S, Velamuri SR, Hundeshagen G, Moiemen N, Shokrollahi K, Foster K, Huss F, Collins D, Savetamal A, Gurney JM, Depetris N, Stoppe C, Ortiz-Reyes L, Garrel D, Day AG, Team R-ET (2022) A randomized trial of enteral glutamine for treatment of burn injuries. N Engl J Med 387(11):1001–1010. https:// doi. org/ 10. 1056/ NEJMo a2203 364
63. Heyland D, Muscedere J, Wischmeyer PE, Cook D, Jones G, Albert M, Elke G, Berger MM, Day AG, Canadian Critical Care Trials G (2013) A randomized trial of glutamine and antioxidants in critically ill patients. N Engl J Med 368(16):1489–1497. https:// doi. org/ 10. 1056/ NEJMo a1212 722
64. Vanhorebeek I, Casaer M, Gunst J (2023) Nutrition and autophagy deficiency in critical illness. Curr Opin Crit Care 29(4):306–314. https:// doi. org/10. 1097/ MCC. 00000 00000 001056
65. Mizushima N, Levine B (2020) Autophagy in human diseases. N Engl J Med 383(16):1564–1576. https:// doi. org/ 10. 1056/ NEJMr a2022 774
66. Derde S, Vanhorebeek I, Guiza F, Derese I, Gunst J, Fahrenkrog B, Martinet W, Vervenne H, Ververs EJ, Larsson L, Van den Berghe G (2012) Early parenteral nutrition evokes a phenotype of autophagy deficiency in liverand skeletal muscle of critically ill rabbits. Endocrinology 153(5):2267–2276. https:// doi. org/ 10. 1210/ en. 2011- 2068
67. Gunst J, Casaer MP, Langouche L, Van den Berghe G (2021) Role of ketones, ketogenic diets and intermittent fasting in ICU. Curr Opin Crit Care 27(4):385–389. https:// doi. org/ 10. 1097/ MCC. 00000 00000 000841
68. Weckx R, Goossens C, Derde S, Pauwels L, Vander Perre S, Van den Berghe G, Langouche L (2022) Efficacy and safety of ketone ester infusion to prevent muscle weakness in a mouse model of sepsis-induced critical illness. Sci Rep 12(1):10591. https:// doi. org/ 10. 1038/ s41598- 022- 14961-w
69. Goossens C, Weckx R, Derde S, Dufour T, Vander Perre S, Pauwels L, Thiessen SE, Van Veldhoven PP, Van den Berghe G, Langouche L (2019)Adipose tissue protects against sepsis-induced muscle weakness in mice:from lipolysis to ketones. Crit Care 23(1):236. https:// doi. org/ 10. 1186/s13054- 019- 2506-6
70. De Bruyn A, Langouche L, Vander Perre S, Gunst J, Van den Berghe G (2021) Impact of withholding early parenteral nutrition in adult critically ill patients on ketogenesis in relation to outcome. Crit Care 25(1):102. https:// doi. org/ 10. 1186/ s13054- 021- 03519-3
71. De Bruyn A, Gunst J, Goossens C, Vander Perre S, Guerra GG, Verbruggen S, Joosten K, Langouche L, Van den Berghe G (2020) Effect of withholding early parenteral nutrition in PICU on ketogenesis as potential mediator of its outcome benefit. Crit Care 24(1):536. https:// doi. org/ 10. 1186/s13054- 020- 03256-z
72. Gunst J, Verbruggen SC (2023) Insulin resistance in critical illness: consequences for nutrition therapy and glucose management. Curr Opin Crit Care 29(4):286–292. https:// doi. org/ 10. 1097/ MCC. 00000 00000 001055
73. van den Berghe G, Wouters P, Weekers F, Verwaest C, Bruyninckx F, Schetz M, Vlasselaers D, Ferdinande P, Lauwers P, Bouillon R (2001) Intensive insulin therapy in critically ill patients. N Engl J Med 345(19):1359–1367. https:// doi. org/ 10. 1056/ NEJMo a0113 00
74. Van den Berghe G, Wilmer A, Hermans G, Meersseman W, Wouters PJ, Milants I, Van Wijngaerden E, Bobbaers H, Bouillon R (2006) Intensive insulin therapy in the medical ICU. N Engl J Med 354(5):449–461. https://doi. org/ 10. 1056/ NEJMo a0525 21
75. Vlasselaers D, Milants I, Desmet L, Wouters PJ, Vanhorebeek I, van den Heuvel I, Mesotten D, Casaer MP, Meyfroidt G, Ingels C, Muller J, Van Cromphaut S, Schetz M, Van den Berghe G (2009) Intensive insulin therapy for patients in paediatric intensive care: a prospective, randomised controlled study. Lancet 373(9663):547–556. https:// doi. org/ 10. 1016/S0140- 6736(09) 60044-1
76. Gunst J, Debaveye Y, Guiza F, Dubois J, De Bruyn A, Dauwe D, De Troy E, Casaer MP, De Vlieger G, Haghedooren R, Jacobs B, Meyfroidt G, Ingels C, Muller J, Vlasselaers D, Desmet L, Mebis L, Wouters PJ, Stessel B, Geebelen L, Vandenbrande J, Brands M, Gruyters I, Geerts E, De Pauw I, Vermassen J, Peperstraete H, Hoste E, De Waele JJ, Herck I, Depuydt P, Wilmer A, Hermans G, Benoit DD, Van den Berghe G, Collaborators TG-F (2023) Tight blood-glucose control without early parenteral nutrition in the ICU. N Engl J Med 389(13):1180–1190. https:// doi. org/ 10. 1056/ NEJMo a2304 855
77. Umpierrez GE (2023) Glucose control in the ICU. N Engl J Med 389(13):1234–1237. https:// doi. org/ 10. 1056/ NEJMe 23094 42
78. Gunst J, Van den Berghe G (2016) Blood glucose control in the ICU: don’t throw out the baby with the bathwater! Intensive Care Med 42(9):1478–1481. https:// doi. org/ 10. 1007/ s00134- 016- 4350-3
79. Gunst J (2017) Recovery from critical illness-induced organ failure: the role of autophagy. Crit Care 21(1):209. https:// doi. org/ 10. 1186/s13054- 017- 1786-y
80. Gunst J, De Bruyn A, Casaer MP, Vander Perre S, Langouche L, Van den Berghe G (2021) Impact of tight glucose control on circulating 3-hydroxybutyrate in critically ill patients. Crit Care 25(1):373. https:// doi.org/ 10. 1186/ s13054- 021- 03772-6
81. Van den Berghe G, Wouters PJ, Bouillon R, Weekers F, Verwaest C, Schetz M, Vlasselaers D, Ferdinande P, Lauwers P (2003) Outcome benefit of intensive insulin therapy in the critically ill: Insulin dose versus glycemic control. Crit Care Med 31(2):359–366. https:// doi. org/ 10. 1097/ 01. CCM.00000 45568. 12881. 10
82. Berger MM, Reintam-Blaser A, Calder PC, Casaer M, Hiesmayr MJ, Mayer K, Montejo JC, Pichard C, Preiser JC, van Zanten ARH, Bischoff SC, Singer P (2019) Monitoring nutrition in the ICU. Clin Nutr 38(2):584–593. https://doi. org/ 10. 1016/j. clnu. 2018. 07. 009
83. Gunst J, Kashani KB, Hermans G (2019) The urea-creatinine ratio as a novel biomarker of critical illness-associated catabolism. Intensive Care Med 45(12):1813–1815. https:// doi. org/ 10. 1007/ s00134- 019- 05810-y
84. Achamrah N, Delsoglio M, De Waele E, Berger MM, Pichard C (2021) Indirect calorimetry: The 6 main issues. Clin Nutr 40:4–14
85. Schuetz P, Fehr R, Baechli V, Geiser M, Deiss M, Gomes F, Kutz A, Tribolet P, Bregenzer T, Braun N, Hoess C, Pavlicek V, Schmid S, Bilz S, Sigrist S, Brandle M, Benz C, Henzen C, Mattmann S, Thomann R, Brand C, Rutishauser J, Aujesky D, Rodondi N, Donze J, Stanga Z, Mueller B (2019) Individualised nutritional support in medical inpatients at nutritional risk: a randomised clinical trial. Lancet 393(10188):2312–2321. https:// doi. org/ 10. 1016/S0140- 6736(18) 32776-4
86. Kagan I, Cohen J, Bendavid I, Kramer S, Mesilati-Stahy R, Glass Y, Theilla M, Singer P (2022) Effect of combined protein-enriched enteral nutrition and early cycle ergometry in mechanically ventilated critically ill patients—a pilot study. Nutrients. https:// doi. org/ 10. 3390/ nu140 81589
87. Kim HK, Suzuki T, Saito K, Yoshida H, Kobayashi H, Kato H, Katayama M (2012) Effects of exercise and amino acid supplementation on body composition and physical function in community-dwelling elderly Japanese sarcopenic women: a randomized controlled trial. J Am Geriatr Soc 60(1):16–23. https:// doi. org/ 10. 1111/j. 1532- 5415. 2011. 03776.x
88. de Cabo R, Mattson MP (2019) Effects of intermittent fasting on health, aging, and disease. N Engl J Med 381(26):2541–2551. https:// doi. org/ 10.1056/ NEJMr a1905 136
89. Bohe J, Low JF, Wolfe RR, Rennie MJ (2001) Latency and duration of stimulation of human muscle protein synthesis during continuous infusion of amino acids. J Physiol 532(Pt 2):575–579. https:// doi. org/ 10. 1111/j. 1469-7793. 2001. 0575f.x
90. Atherton PJ, Etheridge T, Watt PW, Wilkinson D, Selby A, Rankin D, Smith K, Rennie MJ (2010) Muscle full effect after oral protein: time-dependent concordance and discordance between human muscle protein synthesis and mTORC1 signaling. Am J Clin Nutr 92(5):1080–1088. https:// doi. org/10. 3945/ ajcn. 2010. 29819
91. Flower L, Haines RW, McNelly A, Bear DE, Koelfat K, Damink SO, Hart N, Montgomery H, Prowle JR, Puthucheary Z (2022) Effect of intermittent or continuous feeding and amino acid concentration on urea-to-creatinine ratio in critical illness. JPEN J Parenter Enteral Nutr 46(4):789–797. https://doi. org/ 10. 1002/ jpen. 2258
92. Van Dyck L, Casaer MP (2019) Intermittent or continuous feeding: any difference during the first week? Curr Opin Crit Care 25(4):356–362. https://doi. org/ 10. 1097/ MCC. 00000 00000 000617
93. McNelly AS, Bear DE, Connolly BA, Arbane G, Allum L, Tarbhai A, CooperJA, Hopkins PA, Wise MP, Brealey D, Rooney K, Cupitt J, Carr B, Koelfat K, Damink SO, Atherton PJ, Hart N, Montgomery HE, Puthucheary ZA (2020) Effect of intermittent or continuous feed on muscle wasting in critical illness: a phase 2 clinical trial. Chest 158(1):183–194. https:// doi. org/ 10.1016/j. chest. 2020. 03. 045
94. Van Dyck L, Vanhorebeek I, Wilmer A, Schrijvers A, Derese I, Mebis L, Wouters PJ, Van den Berghe G, Gunst J, Casaer MP (2020) Towards a fasting-mimicking diet for critically ill patients: the pilot randomized crossover ICU-FM-1 study. Crit Care 24(1):249. https:// doi. org/ 10. 1186/s13054- 020- 02987-3
95. White H, Venkatesh B (2011) Clinical review: ketones and brain injury. Crit Care 15(2):219. https:// doi. org/ 10. 1186/ cc100 20
96. Katz JB, Owusu K, Nussbaum I, Beekman R, DeFilippo NA, Gilmore EJ, Hirsch LJ, Cervenka MC, Maciel CB (2021) Pearls and pitfalls of introducing ketogenic diet in adult status epilepticus: a practical guide for the intensivist. J Clin Med. https:// doi. org/ 10. 3390/ jcm10 040881
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 09.10.2024 00:01:00
[~DATE_ACTIVE_FROM] => 09.10.2024 00:01:00
[ACTIVE_FROM_X] => 2024-10-09 00:01:00
[~ACTIVE_FROM_X] => 2024-10-09 00:01:00
[ACTIVE_FROM] => 09.10.2024 00:01:00
[~ACTIVE_FROM] => 09.10.2024 00:01:00
[SHOW_COUNTER] => 1148
[~SHOW_COUNTER] => 1148
[ID] => 8472
[~ID] => 8472
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => html
[~PREVIEW_TEXT_TYPE] => html
[TIMESTAMP_X] => 11.11.2024 13:57:04
[~TIMESTAMP_X] => 11.11.2024 13:57:04
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/pitanie-v-otdelenii-intensivnoy-terapii-ot-ostroy-fazy-do-posleduyushchego-perioda/
[~DETAIL_PAGE_URL] => /library/articles/pitanie-v-otdelenii-intensivnoy-terapii-ot-ostroy-fazy-do-posleduyushchego-perioda/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => pitanie-v-otdelenii-intensivnoy-terapii-ot-ostroy-fazy-do-posleduyushchego-perioda
[~CODE] => pitanie-v-otdelenii-intensivnoy-terapii-ot-ostroy-fazy-do-posleduyushchego-perioda
[EXTERNAL_ID] => 8472
[~EXTERNAL_ID] => 8472
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 9 октября 2024
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Питание в отделении интенсивной терапии: от острой фазы до последующего периода
[PREVIEW_PICTURE] => Array
(
[ID] => 5753
[TIMESTAMP_X] => 11.11.2024 13:57:04
[MODULE_ID] => iblock
[HEIGHT] => 667
[WIDTH] => 1000
[FILE_SIZE] => 100038
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/33b/sowmajmfqbrx3yxyfdjrusfyl5hyhy3z
[FILE_NAME] => view-healthy-food-incased-pill-shaped-container.jpg
[ORIGINAL_NAME] => view-healthy-food-incased-pill-shaped-container.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => b31227fed4c0453998611c53609d9957
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/33b/sowmajmfqbrx3yxyfdjrusfyl5hyhy3z/view-healthy-food-incased-pill-shaped-container.jpg
[UNSAFE_SRC] => /upload/iblock/33b/sowmajmfqbrx3yxyfdjrusfyl5hyhy3z/view-healthy-food-incased-pill-shaped-container.jpg
[SAFE_SRC] => /upload/iblock/33b/sowmajmfqbrx3yxyfdjrusfyl5hyhy3z/view-healthy-food-incased-pill-shaped-container.jpg
[ALT] => Питание в отделении интенсивной терапии: от острой фазы до последующего периода
[TITLE] => Питание в отделении интенсивной терапии: от острой фазы до последующего периода
)
[DETAIL_TEXT] => Angelique M. E. de Man, Jan Gunst and Annika Reintam
Blaser Nutrition in the intensive care unit: from the acute phase to beyond
Intensive Care Med.2024. doi.org/10.1007/s00134-024-07458-9
Абстракт
Последние рандомизированные контролируемые исследования (РКИ) показали отсутствие пользы, но дозозависимый вред от ранней полной нутритивной поддержки у критически больных пациентов.
Отсутствие пользы может быть объяснено анаболической резистентностью, подавлением процессов восстановления клеток и усугублением гипергликемии и потребности в инсулине. Кроме того, ранние высокие дозы аминокислот не принесли пользы, а вместо этого были связаны с вредом у пациентов с органными дисфункциями. Однако большинство исследований было сосредоточено на вмешательствах, начатых в первые дни после поступления в отделение интенсивной терапии (ОРИТ). Хотя окно вмешательства в некоторых РКИ распространялось и на постострую фазу критического заболевания, ни в одном крупном РКИ не изучалось питание, начатое после первой недели. Следовательно, отсутствуют четкие, основанные на фактических данных рекомендации о том, когда и как начинать и продолжать питание. Длительное недоедание будет иметь свою цену, поскольку не существует проверенного метаболического монитора, указывающего на готовность к лечебному питанию и адекватную реакцию на питание, которая, вероятно, варьирует у разных пациентов. Кроме того, статус микроэлементов не может быть надежно оценен, поскольку воспаление может вызвать перераспределение, поэтому концентрации микроэлементов в плазме не обязательно отражают общие запасы в организме. Более того, высокие дозы отдельных микроэлементов не оказались полезными. Соответственно, имеющиеся данные дают четкие рекомендации относительно того, каких стратегий питания следует избегать, но идеальный режим питания для отдельных пациентов остается неясным. В этом описательном обзоре мы суммируем результаты недавних исследований, обсуждаем возможные механизмы, объясняющие результаты, отмечаем ошибки в интерпретации РКИ и их влияние на клиническую практику, а также сформулировать предложения для будущих исследований.
Ключевые слова: питание, макронутриенты, глюкоза, аминокислоты, микроэлементы, критическое заболевание, интенсивная терапия.
Введение
При остром критическом заболевании стимулируется катаболизм, что приводит к атрофии мышц, слабости и невозможности отлучения от респиратора [1]. Низкое потребление белка, энергии и микроэлементов этими пациентами может усугубить катаболизм и это связано с инфекциями, задержкой выздоровления и повышенной смертностью [2–4]. Однако традиционное предположение о том, что питательные вещества могут противодействовать катаболизму и тем самым улучшать клинические результаты у пациентов в критическом состоянии подвергается сомнению совокупными данными крупных рандомизированных контролируемых исследований (РКИ), выявляющими вред полноценного питания в острой фазе [5–8]. Несмотря на то, что был предложен персонализированный подход [9, 10], инструменты мониторинга, которые бы точно определяли фактическую потребность в энергии, белке и микроэлементах для отдельного пациента, в настоящее время недоступны [4]. В этом описательном обзоре мы даем сжатую интерпретацию данных недавних РКИ, обсуждаем влияние доказательств на клиническую практику и формулируем некоторые предложения для будущих исследований.
Лечебное питание в ОРИТ: данные РКИ
Наблюдательные исследования связали кумулятивный дефицит белка и энергии с ухудшением исхода критического заболевания [2, 3, 11]. Однако результаты этих исследования также можно объяснить пищевой непереносимостью как маркером тяжести заболевания [2, 3, 12]. За последнее десятилетие было проведено несколько крупных РКИ, посвященных срокам, способу и дозировке лечебного питания у пациентов в критическом состоянии. Первым РКИ, которое поставило под сомнение предположение о том, что раннее полноценное питание будет полезным, было РКИ EPaNIC, опубликованное в 2011 году [5]. У 4640 взрослых пациентов в критическом состоянии начало парентерального питания в дополнение к недостаточному энтеральному питанию продлило зависимость от интенсивной терапии по сравнению с отсрочкой дополнительного парентерального питания до 1 недели после поступления в ОРИТ. Пациенты, получавшие раннее дополнительное парентеральное питание, имели более длительную продолжительность поддержки жизненно важных органов, больше инфекций, более высокую частоту слабости, приобретенной в ОРИТ, и нарушение восстановления после перевода из ОРИТ [5, 13]. Дополнительное парентеральное питание также не улучшило функциональный статус при выписке из больницы по оценке расстояния 6-минутной ходьбы и повседневная деятельности [5].
Эти результаты были впоследствии подтверждены у детей в критическом состоянии (РКИ PEPaNIC, N = 1440), у которых дополнительное парентеральное питание также отрицательно влияло на 2- и 4-летние исходы развития нервной системы [8, 14]. В обоих РКИ смертность не изменилась, тогда как вред от раннего парентерального питания присутствовал во всех исследуемых подгруппах, включая пациентов с высоким показателем нутритивного риска (шкала NRS ≥5), пациентов с индексом массы тела <25 или ≥40, пациентов с сепсисом, пациентам с противопоказаниями к энтеральному питанию и новорожденных в критическом состоянии [5, 8].Теоретически вред в этих РКИ можно объяснить более высокой дозой кормления (ранним перекармливанием) или вредом, специфичным для парентерального способа питания. Вторичный анализ этих РКИ показал наличие дозозависимого вреда, а не вреда от внутривенного способа питания [15, 16], что было подтверждено последующими РКИ.
Действительно, два крупных РКИ — CALORIES (N = 2400) [17] и РКИ NUTRIREA-2 (N = 2410) [6] — не обнаружили различий между энтеральным и парентеральным путем питания с одинаковой энергетической дозой в обеих группах. В РКИ Nutrirea-2, включавшем пациентов с шоком, находящихся на ИВЛ, раннее введение высоких доз энтерального питания было даже более вредным по сравнению с ранним введением высоких доз парентерального питания, поскольку вызывало потенциально летальные желудочно-кишечные осложнения [6]. В обоих РКИ пациенты были рандомизированы вскоре после поступления в ОРИТ, окно вмешательства составляло 5–7 дней. Также в трех РКИ, в которых пациенты в критическом состоянии рандомизированно получали более низкую или более высокую дозу энтерального питания, начатую в острой фазе и продолжавшуюся в течение 6 (РКИ EDEN, N = 1000), 14 (РКИ PermiT, N = 894) или 28 дней ( TARGET RCT, N = 3957), более высокие дозы энтерального питания, начатые в острой фазе, не принесли пользы, а вторичные результаты предполагали потенциальный вред [18–20].
Кроме того, в РКИ EDEN и TARGET долгосрочный функциональный результат не улучшился при использовании более высоких доз питания [21–23]. Отсутствие пользы в последних РКИ было постоянным во всех исследуемых подгруппах, включая пациентов с высоким прогнозируемым риском смерти [20], пациентов с индексом массы тела (ИМТ) <18 [20] и пациентов с сепсисом [19, 20]. В подробном апостериорном анализе РКИ PermiT ни один из изученных маркеров исходного нутритивного риска не смог выявить пациентов, которым было бы полезно раннее усиленное энтеральное питание, включая модифицированную шкалу нутритивного риска при критических состояниях (NUTRIC), ИМТ, трансферрин, фосфат, азот мочевины мочи и азотистый баланс [24]. Низкий исходный уровень преальбумина, предположительно, указывает на высокий нутритивный риск, даже связанный со значительным вредом для смертности при получении более высоких доз энтерального питания [24].
Аналогичным образом, недавнее РКИ NUTRIREA-3, в котором 3044 пациента с шоком, находящихся на искусственной вентиляции легких, рандомизировали на раннее питание с высокими дозами (25 ккал/кг/день и 1,0–1,3 г белка на кг в день) по сравнению с питанием с низкими дозами в первую неделю (6 ккал/кг/день и 0,2–0,4 г белка/кг/день), выявили вред от раннего высокодозного питания с длительной зависимостью от ОРИТ и увеличением осложнений в этой группе [7]. Важно отметить, что в РКИ NUTRIREA-3 целевые показатели питания определялись методом рандомизации; для достижения этой цели лечебное питание может проводиться как энтерально, так и парентерально [7]. Недавний метаанализ подтвердил вред раннего полноценного питания у пациентов в критическом состоянии по сравнению с допустимым недоеданием. Хотя этот метаанализ не включал РКИ EPaNIC, это, вероятно, не влияет на выводы, поскольку пациентам EPaNIC в равной степени вредило раннее полное кормление [25].
Недавний метаанализ, проведенный в рамках обновленных американских рекомендаций по лечебному питанию, не показал преимуществ дополнительного парентерального питания по сравнению с только энтеральным питанием. Тем не менее, различный дизайн включенных РКИ, с разными сроками дополнительного парентерального питания, разными сопутствующими вмешательствами и контрольными группами может усложнить интерпретацию результатов [26]. В целом, недавние РКИ показали дозозависимый вред от раннего лечебного питания у пациентов в критическом состоянии, независимо от способа и предполагаемого риска, связанного с питанием. В Table 1 суммированы РКИ, в которых сравнивалось большее и меньшее количество энергии по тому же или другому пути, при этом питание было начато вскоре после поступления в ОРИТ. В этих исследованиях мы сообщаем о потреблении энергии на третий день, поскольку более высокая цель по энергии была достигнута в соответствующей группе с высокими дозами в этот ранний момент времени. Этот момент времени также приблизительно соответствует предполагаемому концу раннего периода острой фазы, как это предложено Европейскими рекомендациями по питанию [27].

Тем не менее, продолжительность острой фазы является спорной и, вероятно, варьирует у разных пациентов.Американские рекомендации предлагают продолжительность острой фазы 7–10 дней без каких-либо различий между ранним и поздним периодами [26]. Вышеупомянутые РКИ подвергались критике за введение относительно низких доз белков и за расчет энергетической цели по фиксированной формуле [35, 36]. Однако недавние исследования не подтверждают эту критику. Действительно, помимо увеличения потребления энергии, повышенное потребление белка, начатое на ранних стадиях критического заболевания, не принесло пользы. Крупнейшее РКИ по белковым добавкам, РКИ EFFORT Protein, в котором рандомизировано 1329 пациентов в критическом состоянии для получения высокой (≥2,2 г/кг/день) или обычной (≤1,2 г/кг/день) дозы белка, начатое в течение 96 часов после поступления в ОРИТ и продолжения лечения до 28 дней не показали пользы от высоких доз белка [37].
Напротив, раннее введение высоких доз белка связано с длительным пребыванием в ОРИТ и повышенной смертностью у наиболее тяжело больных пациентов и пациентов с острым повреждением почек [37]. Кроме того, в нефро-протективном РКИ (N = 474) не было выявлено пользы от внутривенного введения аминокислот, начатого в 1 или 2 день и продолжавшегося до выписки из ОРИТ [38], а вторичный анализ РКИ EPaNIC и PEPaNIC показал вред от раннего парентерального питания, особенно с более высокими дозам белка [15, 16].Недавний метаанализ влияния более высоких и более низких доз белка у пациентов в критическом состоянии не подтвердил никакой пользы от более высоких доз белка. Метаанализ показал потенциальную гетерогенность лечения, однако значительный вред смертности ограничивается пациентами с острым повреждением почек, что требует дальнейшего изучения [39].
Второй причиной, по которой недавние РКИ не смогли показать никакой пользы от раннего усиленного лечебного питания, является отсутствие непрямой калориметрии. Действительно, точная количественная оценка расхода энергии требует непрямой калориметрии, поскольку прогностические уравнения не позволяют точно оценить расход энергии у всех пациентов [40]. Однако нет убедительных доказательств того, что раннее кормление, основанное на непрямой калориметрии, будет превосходить питание, основанное на рассчитанном целевом потреблении энергии. Хотя метаанализ показал потенциальное снижение 28-дневной смертности у взрослых в критическом состоянии, это не повлияло на 90-дневную смертность и исходы были сходными [41]. Такая временная разница в смертности может быть объяснена смешением данных в неслепых РКИ. Более того, воспринимаемая разница в смертности через 28 дней была пограничной, поскольку статистическая значимость была бы потеряна, если бы у одного пациента был другой исход 28-дневной смертности (fragility index 1). Кроме того, метаанализ включал РКИ с разным дизайном и сопутствующими вмешательствами, что еще больше усложняет интерпретацию этих результатов.
Крупнейшее РКИ, сравнивающее расчетное и измеренное целевое потребление энергии, TICACOS-International РКИ (N = 580), не выявило преимуществ кормления на основе непрямой калориметрии, начатого рано после поступления в ОРИТ [42]. Более того, исследование было прекращено преждевременно из-за медленного набора участников, что может поставить под сомнение целесообразность рутинного использования непрямой калориметрии. Очевидно, эти результаты не обязательно могут быть экстраполированы на пациентов с длительным критическим состоянием.
Влияние фактических данных на клиническую практику и рекомендации
Опубликованные исследования способа, времени и дозы питания, возможно, значительно изменили практику в Европе, как предполагают Veraar et al. [43]. Указанный момент времени для начала энтерального и/или парентерального питания был перенесен на более поздний срок вскоре после публикации исследования EPaNIC (Fig. 1). Тем не менее, в течение нескольких лет после этого постепенно возникла тенденция возврата к более раннему началу, с несколько большими различиями между респондентами. РКИ CALORIES, показавшее отсутствие различий между изокалорическим энтеральным и парентеральным питанием, возможно, способствовало этому очевидному изменению. Очевидно, что тренд учитывает только время, а не дозу, которая могла снизиться за период времени, представленный на Fig. 1.

В противном случае можно было бы ожидать, что, по крайней мере, доза питания в острой фазе снизится в последующие годы, поскольку недавно РКИ Nutrirea-3 показало значительный вред от раннего введения высоких доз питания, независимо от пути введения [7]. Исследований, посвященных дозировке и способу питания, начатому после первых дней пребывания в ОРИТ, мало. В одном РКИ (N = 305) начало дополнительного парентерального питания у пациентов, не переносящих 60% или более измеренных энергетических потребностей энтеральным путем к 4-му дню после поступления в ОРИТ, не показало вреда по сравнению с отказом от дополнительного парентерального питания до 9-го дня [44]. В этом РКИ дополнительное парентеральное питание привело к значительно меньшему количеству инфекций в период с 9 по 28 день, хотя этому потенциальному позднему защитному эффекту противодействовало большее количество инфекций между 4 и 9 днями [45].
В ответ на РКИ, проведенные за последнее десятилетие, международные рекомендации по питанию изменились. Европейские рекомендации сместились в сторону рекомендаций менее агрессивного питания в острой фазе (Table 2) [40]. В то время как рекомендации 2006/2009 гг. рекомендовали начинать энтеральное питание в течение 24 часов и достигать целевого показателя калорийности (25 ккал/кг/день) в течение 2–3 дней [46, 47], рекомендации 2019 г. и частично обновленные рекомендации 2023 г. рекомендуют начинать с низкой калорийности дозирования энтерального питания в течение 48 часов после поступления в ОРИТ, если нет противопоказаний, и достижения целевого уровня энергии в течение 3–7 дней [40]. Если энтерального питания недостаточно, парентеральное питание рекомендуется начинать между 4 и 7 днями, а не в течение первых 2 дней [40, 47]. Что касается доз белка, рекомендация класса B – вводить белок в дозе 1,3–1,5 г/кг/день была преобразована в рекомендацию степени 0, в которой говорилось, что 1,3 г/кг/день можно вводить постепенно [40, 47].

Кроме того, американские рекомендации по питанию со временем изменились, но в разной степени. В то время как рекомендации 2009 г. рекомендовали раннее начало энтерального питания и отказ от лечебного питания, если энтеральное питание невозможно [26], рекомендации 2022 г. рекомендуют либо энтеральное, либо парентеральное питание в качестве основного способа питания в первые 7–10 дней [48]. Несмотря на более низкую рекомендуемую цель по питанию, чем в рекомендациях 2009 г. (12–25 ккал/кг/день в первые 7–10 дней вместо 25–30 ккал/кг/день), более широкий диапазон по-прежнему включает полную цель сразу после госпитализации в ОРИТ [26, 48]. Однако эта рекомендация была сделана до того, как стали доступны результаты РКИ Nutrirea-3, которые показали вред от такой высокой энергетической дозы, начатой сразу после поступления в ОРИТ, по сравнению с дозой, вдвое меньшей, чем самая низкая доза, в американских рекомендациях.
Если энтерального питания недостаточно, последние рекомендации по-прежнему не рекомендуют дополнительное парентеральное питание до 7-го дня [48]. Что касается целевого уровня белка, американские рекомендации содержат слабую рекомендацию по назначению 1,2–2 г белка/кг/день. Однако это предложение было сделано до того, как было опубликовано РКИ EFFORT по белкам [37], и можно было ожидать, что обновленная версия рекомендаций больше не будет предлагать такие высокие дозы. Различия между европейскими и американскими рекомендациями отражают постоянную неопределенность в отношении оптимальной стратегии питания пациентов в критическом состоянии. Действительно, поскольку недавние крупномасштабные РКИ были в основном отрицательными, стало ясно, каких стратегий кормления следует избегать, но не то, что следует делать.
Мы предлагаем лучше отразить в рекомендациях различный уровень доказательности. В связи с этим мы предлагаем, чтобы руководства содержали четкие рекомендации, чего следует избегать, а предложения о том, что делать, могли бы быть более неточными. Стало ясно, что в острой фазе следует избегать высоких доз всех макронутриентов. Однако продолжительность острой фазы остается неясной. Это иллюстрируется различиями между европейскими и американскими рекомендациями, которые допускают питаие ниже целевого уровня в течение 3–7 дней или максимум 7–10 дней соответственно [40, 48]. Различия между международными рекомендациями могут отражать разную оценку потенциального вреда длительного периода относительного голодания и потенциального вреда слишком раннего начала полноценной нутритивной поддержки.
Кроме того, некоторые рекомендации в руководствах могут сбивать с толку. Принимая во внимание, что Американские рекомендации допускают раннее кормление в дозах до 25 ккал/кг/день (которые, возможно, потребуется обновить после Nutrirea-3) и предлагают либо энтеральное, либо парентеральное питание в качестве основного метода питания. И существует сильная рекомендация против дополнительного парентерального питания в течение первых 7 дней. На сегодняшний день остаются неясными оптимальная доза и режим питания в острой фазе и после нее, а также идеальный момент для начала лечебного питания. Ни в одном РКИ не оценивалось, является ли кормление низкими дозами в острой фазе более эффективным по сравнению с прогрессивным лечебным питанием, кормлением промежуточными дозами или даже отсутствием питания. Кроме того, ни в одном крупном РКИ не изучалось, действительно ли раннее энтеральное питание превосходит отсроченное [49]. Однако при начале лечебного питания мы полагаем, что энтеральное питание является основным методом питания, если нет противопоказаний. Хотя РКИ не выявили преимущества энтерального способа питания по сравнению с парентеральным, окно вмешательства было коротким. При длительном применении парентеральное питание само по себе может вызвать проблемы, как это наблюдается у пациентов с короткой кишкой [50]. Кроме того, затраты на энтеральное питание ниже. Потенциальная прагматичная стратегия питания представлена на Fig. 2.

Назначение микроэлементов при критических состояниях
Без внешнего пополнения запасы большинства микроэлементов у здоровых людей истощаются в течение недель или месяцев [51]. У пациентов в критическом состоянии запасы микроэлементов могут уменьшаться гораздо быстрее. Кроме того, при поступлении в ОРИТ пациенты могут иметь дефицит питания, повышенное использование микроэлементов и повышенные потери жидкости организмом, а также находится на постоянной заместительной почечной терапии [52, 53]. Более того, недавний сдвиг в рекомендациях в сторону более ограничительного питания в острой фазе может способствовать развитию дефицита микроэлементов.Микронутриенты имеют решающее значение для жизненно важных функций, таких как производство АТФ, антиоксидантная и иммунная защита, транскрипция генов и в качестве кофакторов для многочисленных ферментов [54]. Симптомы дефицита микроэлементов неспецифичны и напоминают симптомы критического состояния [55]. Они могут проявиться только при начале лечебного питания, что проявляется рефидинг синдромом.
Действительно, рефидинг увеличивает потребность и внутриклеточное поглощение некоторых микроэлементов (особенно тиамина, а также других витаминов группы B и микроэлементов) и электролитов (преимущественно фосфата и калия). В случае низких общих запасов в организме это может привести к опасным для жизни аритмиям, угнетению сердечной деятельности, лактоацидозу и тяжелой мышечной слабости. Не существует утвержденных стандартных критериев диагностики рефидинг-синдрома. В качестве возможного суррогата использовалось снижение уровня фосфатов как минимум на 0,16 ммоль/л до уровня ниже 0,65 ммоль/л [56, 57].Риск рефидинг-синдрома увеличивается при переходе от длительного голодания или длительного малодозного питания к полноценному питанию. В Refeeding RCT (N = 339) временное ограничение потребления макронутриентов у пациентов, у которых развивалась гипофосфатемия при возобновлении питания, ассоциировалось со снижением смертности по сравнению с продолжающимся и увеличивающимся потреблением пищи, в то время как электролиты корректировались с одинаковой эффективностью в обеих группах [57]. Эти данные подтверждают осторожность в наращивании лечебного питания у пациентов с риском рефидинг-синдрома. В исследованиях не было подтверждено, можно ли снизить риск повторного кормления с помощью прогрессивного лечебного питания и/или введения достаточного количества микроэлементов и электролитов в острой фазе для предотвращения дефицита микроэлементов и электролитов.
Тем не менее, назначение поддерживающих доз микроэлементов представляется разумным. Однако идеальные дозы остаются неясными. Концентрации микроэлементов в плазме не могут определять терапию, поскольку на них также влияет перераспределение вследствие воспаления. Следовательно, концентрации микроэлементов в плазме не обязательно отражают запасы в организме, и не существует точных формул коррекции воспаления [58].
Когда пациент получает 1500 ккал через коммерческую формулу энтерального питания, она содержит достаточно микроэлементов, чтобы покрыть Dietary Reference Intake (DRI) (рекомендованную диетическую норму) для здоровых людей [51]. Однако у пациентов в критическом состоянии могут быть более высокие требования к удовлетворению основных потребностей. Рекомендации по предполагаемому оптимальному потреблению могут быть обнаружены в рекомендациях ESPEN по микроэлементам, опубликованных в 2022 году [51]. Предлагаемые поддерживающие дозы для пациентов в критическом состоянии, как правило, основаны на доказательствах низкого уровня. Помимо поддерживающих доз, также были предложены гораздо более высокие фармакологические дозы для отдельных микроэлементов, включая витамин С, витамин D и селен. Подобную практику, вероятно, следует отделить от лечебного питания и рассматриваться как фармакологические вмешательства, направленные на терапевтический эффект лекарственного средства. Однако назначение высоких доз каких-либо микроэлементов не оказалось полезным и не рекомендуется [51, 59].
Механизмы, объясняющие отсутствие пользы от раннего высокодозного питания
Отсутствие пользы от раннего высокодозного питания можно объяснить несколькими механизмами, включая анаболическую резистентность (неспособность использовать питательные вещества для анаболизма), подавление процессов восстановления клеток, включая аутофагию и кетогенез, а также обострение стрессовой гипергликемии и потребности в инсулине (Fig. 3) [4]. Похоже, что при остром критическом состоянии макронутриенты нельзя использовать так, как у здоровых людей [4]. Несмотря на то, что лечебное питание пропагандируется для ограничения эндогенного катаболизма, недавние данные подтверждают обратное. Действительно, увеличение потребления пищи не предотвратило потерю мышечной массы в РКИ EPaNIC [13, 60]. Более того, несколько РКИ показали усиление уреагенеза за счет увеличения потребления белка или аминокислот, что указывает на бесполезный катаболизм дополнительных аминокислот [16, 34, 37,38, 61–63].

Лечебное питание также мощно подавляет аутофагию и кетогенез, что может быть вредным [4]. Действительно, аутофагия является важным процессом восстановления клеток, который способен устранять макромолекулярные повреждения, включая поврежденные клеточные органеллы, белковые агрегаты и внутриклеточные микроорганизмы [64, 65]. Все больше данных указывает на то, что активированная аутофагия является важнейшим путем восстановления после органной недостаточности, вызванной критическим состоянием [64]. В физиологических условиях аутофагия сильно подавляется питанием и инсулином, а экспериментальные исследования подтверждают подавление аутофагии усиленным питанием при критических состояниях [13, 64, 66]. В подгруппе пациентов, включенных в РКИ EPaNIC, подавление мышечной аутофагии ранним парентеральным питанием ассоциировалось с усилением слабости, что подтверждает функциональную значимость этих результатов [13].
Также подавление кетогенеза считается потенциальным медиатором вреда при раннем питании высокими дозами.Помимо того, что кетоны являются эффективным источником энергии, они могут стимулировать аутофагию и регенерацию мышц, а также оказывать противовоспалительное действие [67]. Экспериментальные исследования показали, что введение экзогенных кетонов защищает мышей с сепсисом от мышечной слабости [68, 69]. Во вторичном анализе РКИ EPaNIC и PEPaNIC отказ от раннего парентерального питания активировал кетогенез, особенно у детей в критическом состоянии, у которых влияние на кетогенез статистически опосредовано частью конечной пользы вмешательства [70, 71]. Следовательно, анорексия и непереносимость энтерального питания могут быть адаптивными при остром критическом состоянии за счет активации процессов восстановления клеток, вызванных относительным голоданием.
Раннее лечебное питание также увеличивает степень стрессовой гипергликемии, что связано с плохим исходом, хотя идеальный целевой уровень глюкозы в крови остается дискуссионным [72]. В отличие от первоначальных Leuven РКИ , которые показали улучшение результата за счет жесткого контроля уровня глюкозы у пациентов, получавших раннее парентеральное питание (N = 3448) [73–75], недавнее TGC-fast РКИ (N = 9230) у пациентов, не получавших раннее парентеральное питание, не показало улучшения в снижении смертности [76] .Поразительным различием между Leuven РКИ и TGC-fast РКИ является гораздо меньшая тяжесть гипергликемии TGC-fast РКИ, что объясняется значительно более низким энергетическим обеспечением из-за отсутствия раннего парентерального питания [76].
Следовательно, повышенная смертность в Leuven РКИ, по-видимому, объясняется более тяжелой гипергликемией, вызванной ранним парентеральным питанием, которое привело к перееданию в первую неделю [76, 77]. Механистические исследования связывают вред тяжелой ятрогенной гипергликемии с перегрузкой глюкозой в жизненно важных органах, а не с отсутствием эффекта инсулина [78]. Действительно, инсулин сам по себе может иметь нежелательные побочные эффекты на восстановление органов, поскольку он является мощным супрессором аутофагии и кетогенеза [79, 80]. Это может объяснить, почему более низкие уровни глюкозы независимо связаны с улучшением результатов в РКИ, тогда как увеличение доз инсулина независимо связано с вредом [81].
Следовательно, отказ от раннего полноценного питания может быть полезным, поскольку позволяет избежать ятрогенной тяжелой гипергликемии и снизить потребность в инсулине. В настоящее время ни один проверенный метаболический монитор не может определить момент времени, когда анаболическая резистентность переключается на реакцию на питание. Потенциальные признаки переедания, включая гипергликемию и повышенную потребность в инсулине, гиперуремию, повышение соотношения мочевины и креатинина и гипертриглицеридемию, неспецифичны [82]. Более того, недостаточное питание также может привести к гиперуремии и увеличению соотношения мочевины и креатинина [83]. Косвенная калориметрия не определяет количество эндогенной энергии, не подавляемой питанием [4]. Измерение расхода энергии в состоянии покоя (REE) с помощью непрямой калориметрии после острой фазы может быть полезным для определения дозы питания; однако необходима проверка, а также определенный опыт для интерпретации результатов, выходящих за пределы одного значения REE [84].
Следует иметь в виду, что перекармливание приводит к увеличению REE (не отражающему фактическую потребность) из-за усиления диетоиндуцированного термогенеза, что может ошибочно побудить врачей к увеличению дозы питания, тогда как недостаточное питание не приводит к снижению REE. Вероятно, продолжительность анаболической резистентности и нежелательных эффектов нутритивной поддержки различаются у разных пациентов, поскольку нежелательная реакция на кормление, вероятно, сопровождает острую реакцию на стресс и связанные с ней воспалительные и эндокринные изменения [4]. Ввиду отсутствия метаболического монитора и принимая во внимание вышеизложенное, может быть разумным снова временно ограничить прием макронутриентов у пациентов, столкнувшихся с новым тяжелым состоянием в ОРИТ, включая септический шок de novo, возникающий после пребывания в ОРИТ.
Перспективы на будущее
Хотя недавние данные показали преимущества, связанные с относительным голоданием при острых критических заболеваниях, длительное голодание, вероятно, будет иметь свою цену. В крупных РКИ по вопросам питания основное внимание уделялось началу лечебного питания в первые дни, а окно вмешательства часто ограничивалось первой неделей пребывания в ОРИТ. В РКИ с более длительным окном вмешательства любая польза от более высокой дозы питания в постострой фазе могла быть нейтрализована вредом в острой фазе.Будущие РКИ должны быть сосредоточены на вмешательствах, начатых после острой фазы, и вмешательствах, продолжающихся в период восстановления [4]. В связи с этим РКИ с участием госпитализированных пациентов в некритическом состоянии (N = 2088) выявило снижение смертности при индивидуальной нутритивной поддержке в соответствии с протоколом по сравнению со стандартным питанием, что позволяет предположить, что оптимизированное питание может улучшить тяжелые клинические конечные точки, если оно предоставляется в правильной дозе для правильного пациента [85].
Тем не менее, оптимизация питания в этом РКИ была достигнута главным образом за счет оптимизации перорального приема пищи, что вряд ли возможно у большинства пациентов ОРИТ. Более того, протокол также обеспечивал достаточное потребление микроэлементов в группе вмешательства. Таким образом, остается неясным, объясняется ли снижение смертности оптимизацией потребления макронутриентов, предотвращением дефицита микроэлементов или тем и другим. Поскольку последствия избыточного и недостаточного питания неочевидны, будущие РКИ должны включать результаты, выходящие за рамки выписки из ОРИТ. Кроме того, может существовать взаимосвязь между оптимизацией потребления питательных веществ в постострой фазе и физическими упражнениями, которая требует дальнейшего изучения [86, 87]. Будущие исследования должны выяснить, может ли непрямая калориметрия быть полезной для определения дозировки энергии после острой фазы критического заболевания, а также оценить дыхательный коэффициент как переменную, позволяющую дифференцировать переедание и недоедание, как предлагают некоторые эксперты [84].
Кроме того, состав макронутриентов практически не изучен, но, вероятно, он важен, исходя из физиологии и косвенных данных. Метаболический монитор, позволяющий отслеживать использование питательных веществ во время их приема, будет необходим для разработки и проверки вмешательств, основанных на метаболических реакциях на кормление [4]. Результаты мониторинга желудочно-кишечной дисфункции также должны быть подтверждены в будущих исследованиях, поскольку они могут быть полезны при изучении этого аспекта комплексного ответа на энтеральное питание (ЭН). Поскольку механистические исследования показывают пользу от активации реакции на голодание при критических заболеваниях [4], будущие исследования должны выяснить, можно ли использовать эти преимущества, связанные с голоданием, в новых стратегиях питания.
В связи с этим в качестве альтернативных стратегий были предложены стратегии прерывистого голодания/питания, кетогенные диеты и добавки кетонов [67]. Чередование периодов кормления с интервалами голодания может периодически активировать реакцию на голодание с усилением аутофагии и кетогенеза, избегая при этом длительного голодания [67]. Прерывистое голодание также улучшило чувствительность к инсулину у людей и животных, не находящихся в критическом состоянии [88]. Более того, было высказано предположение, что прерывистое введение аминокислот является более анаболическим, чем непрерывное введение аминокислот, поскольку позволяет избежать так называемого эффекта наполнения мышц [89–91]. Однако данные крупномасштабных РКИ, подтверждающие эффективность и безопасность периодического голодания/питания, добавок кетонов и кетогенных диет, отсутствуют. РКИ, в которых изучалась прерывистая и непрерывная лечебная диетотерапия, не показали устойчивых преимуществ [92, 93].
Однако, помимо недостаточной мощности для обнаружения или исключения пользы, интервал голодания в этих РКИ был относительно коротким (в целом всего 4–6 часов), что могло быть слишком коротким для активации полного ответа натощак [94]. Хотя кетогенные диеты успешно применяются при рефрактерном эпилептическом статусе, данные РКИ, подтверждающие их широкое применение у пациентов в критическом состоянии, отсутствуют [67, 95]. Более того, достижение кетоза может оказаться затруднительным, поскольку значительное количество лекарств содержит углеводные соединения [96]. Что касается микроэлементов, будущие исследования могут быть направлены на выяснение индивидуальных основных потребностей. Большинство рекомендаций относительно покрытия основных потребностей являются Good Clinical Practice Points [51]. Улучшение оценки реальных потерь и статуса микроэлементов может помочь оптимизировать поддерживающую дозирование.
Выводы
Данные крупномасштабных РКИ показали вред введения высоких доз макронутриентов любым путем во время острой фазы критического заболевания, что можно объяснить анаболической резистентностью, подавлением аутофагии и кетогенеза, а также перекармливанием с более тяжелой гипергликемией и потребностью в инсулине.Момент времени, когда анаболическая резистентность переключается на реакцию на питание, остается неясным.Таким образом, персонализированное лечебное питание, хотя и желательно, в настоящее время неосуществима.Необходимы проверенные инструменты, которые контролируют фактические потребности в энергии, белке и микроэлементах и потенциально позволяют свести к минимуму как пере-, так и недоедание. Поскольку отсрочка полноценного питания может увеличить риск дефицита микроэлементов и последующего синдрома возобновления питания, представляется разумным покрывать базальные потребности в микроэлементах у всех пациентов в критическом состоянии.
References
1. Vanhorebeek I, Latronico N, Van den Berghe G (2020) ICU-acquired weakness. Intensive Care Med 46(4):637–653. https:// doi. org/ 10. 1007/s00134- 020- 05944-4
2. Villet S, Chiolero RL, Bollmann MD, Revelly JP, Cayeux RNM, Delarue J, Berger MM (2005) Negative impact of hypocaloric feeding and energy balance on clinical outcome in ICU patients. Clin Nutr 24(4):502–509. https:// doi. org/ 10. 1016/j. clnu. 2005. 03. 006
3. Lew CCH, Wong GJY, Cheung KP, Chua AP, Chong MFF, Miller M (2017) Association between malnutrition and 28-day mortality and intensive care length-of-stay in the critically ill: a prospective cohort study. Nutrients.https:// doi. org/ 10. 3390/ nu100 10010
4. Gunst J, Casaer MP, Preiser JC, Reignier J, Van den Berghe G (2023) Toward nutrition improving outcome of critically ill patients: how to interpret recent feeding RCTs? Crit Care 27(1):43. https:// doi. org/ 10. 1186/s13054- 023- 04317-9
5. Casaer MP, Mesotten D, Hermans G, Wouters PJ, Schetz M, Meyfroidt G,Van Cromphaut S, Ingels C, Meersseman P, Muller J, Vlasselaers D, DebaveyeY, Desmet L, Dubois J, Van Assche A, Vanderheyden S, Wilmer A, Van den Berghe G (2011) Early versus late parenteral nutrition in critically ill adults. N Engl J Med 365(6):506–517. https:// doi. org/ 10. 1056/ NEJMoa1102 662
6. Reignier J, Boisrame-Helms J, Brisard L, Lascarrou JB, AitHssain A, Anguel N, Argaud L, Asehnoune K, Asfar P, Bellec F, Botoc V, Bretagnol A, Bui HN, Canet E, Da Silva D, Darmon M, Das V, Devaquet J, Djibre M, Ganster F, Garrouste-Orgeas M, Gaudry S, Gontier O, Guerin C, Guidet B, Guitton C, Herbrecht JE, Lacherade JC, Letocart P, Martino F, Maxime V, Mercier E, Mira JP, Nseir S, Piton G, Quenot JP, Richecoeur J, Rigaud JP, Robert R, Rolin N, Schwebel C, Sirodot M, Tinturier F, Thevenin D, Giraudeau B, Le Gouge A, Investigators N-T, Clinical Research in Intensive C, Sepsis g (2018) Enteral versus parenteral early nutrition in ventilated adults withshock: a randomised, controlled, multicentre, open-label, parallel-group study (NUTRIREA-2). Lancet 391(10116):133–143. https:// doi. org/ 10. 1016/S0140- 6736(17) 32146-3
7. Reignier J, Plantefeve G, Mira JP, Argaud L, Asfar P, Aissaoui N, Badie J, Botoc NV, Brisard L, Bui HN, Chatellier D, Chauvelot L, Combes A, Cracco C, Darmon M, Das V, Debarre M, Delbove A, Devaquet J, Dumont LM, Gontier O, Groyer S, Guerin L, Guidet B, Hourmant Y, Jaber S, Lambiotte F, Leroy C, Letocart P, Madeux B, Maizel J, Martinet O, Martino F, Maxime
V, Mercier E, Nay MA, Nseir S, Oziel J, Picard W, Piton G, Quenot JP, Reizine F, Renault A, Richecoeur J, Rigaud JP, Schneider F, Silva D, Sirodot M, Souweine B, Tamion F, Terzi N, Thevenin D, Thiery G, Thieulot-Rolin N, Timsit JF, Tinturier F, Tirot P, Vanderlinden T, Vinatier I, Vinsonneau C, Voicu S, Lascarrou JB, Le Gouge A, Investigators N-T, Clinical Research in Intensive C, Sepsis G (2023) Low versus standard calorie and protein feeding in ventilated adults with shock: a randomised, controlled, multicentre, open-label, parallel-group trial (NUTRIREA-3). Lancet Respir Med 11(7):602–612. https:// doi. org/ 10. 1016/ S2213- 2600(23) 00092-9
8. Fivez T, Kerklaan D, Mesotten D, Verbruggen S, Wouters PJ, Vanhorebeek I, Debaveye Y, Vlasselaers D, Desmet L, Casaer MP, Garcia Guerra G, Hanot J, Joffe A, Tibboel D, Joosten K, Van den Berghe G (2016) Early versus late parenteral nutrition in critically ill children. N Engl J Med 374(12):1111–1122. https:// doi. org/ 10. 1056/ NEJMo a1514 762
9. Wischmeyer PE, Bear DE, Berger MM, De Waele E, Gunst J, McClave SA, Prado CM, Puthucheary Z, Ridley EJ, Van den Berghe G, van Zanten ARH (2023) Personalized nutrition therapy in critical care: 10 expert recommendations. Crit Care 27(1):261. https:// doi. org/ 10. 1186/s13054- 023- 04539-x
10. Reintam Blaser A, Rooyackers O, Bear DE (2023) How to avoid harm with feeding critically ill patients: a synthesis of viewpoints of a basic scientist, dietitian and intensivist. Crit Care 27(1):258. https:// doi. org/ 10. 1186/s13054- 023- 04543-1
11. Alberda C, Gramlich L, Jones N, Jeejeebhoy K, Day AG, Dhaliwal R, Heyland DK (2009) The relationship between nutritional intake and clinical outcomes in critically ill patients: results of an international multicenter observational study. Intensive Care Med 35(10):1728–1737. https:// doi.org/ 10. 1007/ s00134- 009- 1567-4
12. Lv C, Jiang X, Long Y, Liu Z, Lin J, Wu C, Ye X, Ye R, Liu Y, Liu M, Liu Y, Chen W, Gao L, Tong Z, Ke L, Jiang Z, Li W (2022) Association between caloric adequacy and short-term clinical outcomes in critically ill patients using a weight-based equation: secondary analysis of a cluster-randomized controlled trial. Front Nutr 9:902986. https:// doi. org/ 10. 3389/ fnut. 2022.902986
13. Hermans G, Casaer MP, Clerckx B, Guiza F, Vanhullebusch T, Derde S, Meersseman P, Derese I, Mesotten D, Wouters PJ, Van Cromphaut S, Debaveye Y, Gosselink R, Gunst J, Wilmer A, Van den Berghe G, Vanhorebeek I (2013) Effect of tolerating macronutrient deficit on the development of intensive-care unit acquired weakness: a subanalysis of the EPaNIC trial. Lancet Respir Med 1(8):621–629. https:// doi. org/ 10. 1016/S2213- 2600(13) 70183-8
14. Jacobs A, Dulfer K, Eveleens RD, Hordijk J, Van Cleemput H, Verlinden I, Wouters PJ, Mebis L, Guerra GG, Joosten K, Verbruggen SC, Guiza F, Vanhorebeek I, Van den Berghe G (2020) Long-term developmental effect of withholding parenteral nutrition in paediatric intensive care units: a 4-year follow-up of the PEPaNICrandomised controlled trial. Lancet Child Adolesc Health 4(7):503–514. https:// doi. org/ 10. 1016/ S2352- 4642(20)30104-8
15. Casaer MP, Wilmer A, Hermans G, Wouters PJ, Mesotten D, Van den Berghe G (2013) Role of disease and macronutrient dose in the randomized controlled EPaNIC trial: a post hoc analysis. Am J Respir Crit Care Med 187(3):247–255. https:// doi. org/ 10. 1164/ rccm. 201206- 0999OC
16. Vanhorebeek I, Verbruggen S, Casaer MP, Gunst J, Wouters PJ, Hanot J, Guerra GG, Vlasselaers D, Joosten K, Van den Berghe G (2017) Effect of early supplemental parenteral nutrition in the paediatric ICU: a preplanned observational study of post-randomisation treatments in the PEPaNIC trial. Lancet Respir Med 5(6):475–483. https:// doi. org/ 10.1016/ S2213- 2600(17) 30186-8
17. Harvey SE, Parrott F, Harrison DA, Bear DE, Segaran E, Beale R, Bellingan G, Leonard R, Mythen MG, Rowan KM, Investigators CT (2014) Trial of the route of early nutritional support in critically ill adults. N Engl J Med 371(18):1673–1684. https:// doi. org/ 10. 1056/ NEJMo a1409 860
18. National Heart L, Blood Institute Acute Respiratory Distress Syndrome Clinical Trials N, Rice TW, Wheeler AP, Thompson BT, Steingrub J, Hite RD, Moss M, Morris A, Dong N, Rock P (2012) Initial trophic vs full enteral feeding in patients with acute lung injury: the EDEN randomized trial. JAMA 307(8):795–803. https:// doi. org/ 10. 1001/ jama. 2012. 137
19. Arabi YM, Aldawood AS, Haddad SH, Al-Dorzi HM, Tamim HM, Jones G, Mehta S, McIntyre L, Solaiman O, Sakkijha MH, Sadat M, Afesh L, Permi TTG (2015) Permissive Underfeeding or Standard Enteral Feeding in Critically Ill Adults. N Engl J Med 372(25):2398–2408. https:// doi. org/ 10. 1056/NEJMo a1502 826
20. Target Investigators ftACTG, Chapman M, Peake SL, Bellomo R, Davies A, Deane A, Horowitz M, Hurford S, Lange K, Little L, Mackle D, O’Connor S, Presneill J, Ridley E, Williams P, Young P (2018) Energy-dense versus routine enteral nutrition in the critically ill. N Engl J Med 379(19):1823–1834. https:// doi. org/ 10. 1056/ NEJMo a1811 687
21. Needham DM, Dinglas VD, Morris PE, Jackson JC, Hough CL, Mendez-Tellez PA, Wozniak AW, Colantuoni E, Ely EW, Rice TW, Hopkins RO, Network NNA (2013) Physical and cognitive performance of patients with acute lung injury 1 year after initial trophic versus full enteral feeding. EDEN trial follow-up. Am J Respir Crit Care Med 188(5):567–576. https://
doi. org/ 10. 1164/ rccm. 201304- 0651OC
22. Needham DM, Dinglas VD, Bienvenu OJ, Colantuoni E, Wozniak AW, Rice TW, Hopkins RO, Network NNA (2013) One year outcomes in patients with acute lung injury randomised to initial trophic or full enteral feeding: prospective follow-up of EDEN randomised trial. BMJ 346:f1532. https://doi. org/ 10. 1136/ bmj. f1532
23. Deane AM, Little L, Bellomo R, Chapman MJ, Davies AR, Ferrie S, Horowitz M, Hurford S, Lange K, Litton E, Mackle D, O’Connor S, Parker J, Peake SL, Presneill JJ, Ridley EJ, Singh V, van Haren F, Williams P, Young P, Iwashyna TJ (2020) Outcomes six months after delivering 100% or 70% of enteral calorie requirements during critical illness (TARGET). A randomized controlled trial. Am J Respir Crit Care Med 201(7):814–822. https:// doi. org/ 10. 1164/rccm. 201909- 1810OC
24. Arabi YM, Aldawood AS, Al-Dorzi HM, Tamim HM, Haddad SH, Jones G, McIntyre L, Solaiman O, Sakkijha MH, Sadat M, Mundekkadan S, Kumar A, Bagshaw SM, Mehta S, Permi T (2017) Permissive underfeeding or standard enteral feeding in high- and low-nutritional-risk critically ill adults. Post hoc analysis of the PermiT Trial. Am J Respir Crit Care Med 195(5):652–662. https:// doi. org/ 10. 1164/ rccm. 201605- 1012OC
25. Yue HY, Peng W, Zeng J, Zhang Y, Wang Y, Jiang H (2024) Efficacy of permissive underfeeding for critically ill patients: an updated systematic review and trial sequential meta-analysis. J Intensive Care 12(1):4. https://doi. org/ 10. 1186/ s40560- 024- 00717-3
26. McClave SA, Martindale RG, Vanek VW, McCarthy M, Roberts P, Taylor B, Ochoa JB, Napolitano L, Cresci G, Directors ASPENBo, American College of Critical Care M, Society of Critical Care M (2009) Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (ASPEN). JPEN J Parenter Enteral Nutr 33(3):277–316. https:// doi. org/ 10. 1177/ 01486 07109 335234
27. Singer P, Blaser AR, Berger MM, Alhazzani W, Calder PC, Casaer MP, Hiesmayr M, Mayer K, Montejo JC, Pichard C, Preiser JC, van Zanten ARH, Oczkowski S, Szczeklik W, Bischoff SC (2019) ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 38(1):48–79. https:// doi. org/10. 1016/j. clnu. 2018. 08. 037
28. Arabi YM, Tamim HM, Dhar GS, Al-Dawood A, Al-Sultan M, Sakkijha MH, Kahoul SH, Brits R (2011) Permissive underfeeding and intensive insulin therapy in critically ill patients: a randomized controlled trial. Am J Clin Nutr 93(3):569–577. https:// doi. org/ 10. 3945/ ajcn. 110. 005074
29. Rice TW, Mogan S, Hays MA, Bernard GR, Jensen GL, Wheeler AP (2011) Randomized trial of initial trophic versus full-energy enteral nutrition in mechanically ventilated patients with acute respiratory failure. Crit Care Med 39(5):967–974. https:// doi. org/ 10. 1097/ CCM. 0b013 e3182 0a905a
30. Charles EJ, Petroze RT, Metzger R, Hranjec T, Rosenberger LH, Riccio LM, McLeod MD, Guidry CA, Stukenborg GJ, Swenson BR, Willcutts KF,O’Donnell KB, Sawyer RG (2014) Hypocaloric compared with eucaloric nutritional support and its effect on infection rates in a surgical intensive care unit: a randomized controlled trial. Am J Clin Nutr 100(5):1337–1343.https:// doi. org/ 10. 3945/ ajcn. 114. 088609
31. Petros S, Horbach M, Seidel F, Weidhase L (2016) Hypocaloric vs normocaloric nutrition in critically ill patients: a prospective randomized pilot trial. JPEN J Parenter Enteral Nutr 40(2):242–249. https:// doi. org/ 10. 1177/01486 07114 528980
32. Braunschweig CA, Sheean PM, Peterson SJ, Gomez Perez S, Freels S, Lateef O, Gurka D, Fantuzzi G (2015) Intensive nutrition in acute lung injury: a clinical trial (INTACT). JPEN J Parenter Enteral Nutr 39(1):13–20. https:// doi.org/ 10. 1177/ 01486 07114 528541
33. Rugeles S, Villarraga-Angulo LG, Ariza-Gutierrez A, Chaverra-Kornerup S, Lasalvia P, Rosselli D (2016) High-protein hypocaloric vs normocaloric enteral nutrition in critically ill patients: a randomized clinical trial. J Crit Care 35:110–114. https:// doi. org/ 10. 1016/j. jcrc. 2016. 05. 004
34. Allingstrup MJ, Kondrup J, Wiis J, Claudius C, Pedersen UG, Hein-Rasmussen R, Bjerregaard MR, Steensen M, Jensen TH, Lange T, Madsen MB, Moller MH, Perner A (2017) Early goal-directed nutrition versus standard of care in adult intensive care patients: the single-centre, randomised, outcome assessor-blinded EAT-ICU trial. Intensive Care Med 43(11):1637–1647. https:// doi. org/ 10. 1007/ s00134- 017- 4880-3
35. Hoffer LJ, Bistrian BR (2016) Nutrition in critical illness: a current conundrum. F1000Res 5:2531. https:// doi. org/ 10. 12688/ f1000 research. 9278.1
36. Hartl WH, Elke G (2023) Nutrition during the acute phase of critical illness:discussions on NUTRIREA-3. Lancet Respir Med 11(7):e61. https:// doi. org/10. 1016/ S2213- 2600(23) 00212-6
37. Heyland DK, Patel J, Compher C, Rice TW, Bear DE, Lee ZY, Gonzalez VC,O’Reilly K, Regala R, Wedemire C, Ibarra-Estrada M, Stoppe C, Ortiz-Reyes L, Jiang X, Day AG, team EPT (2023) The effect of higher protein dosing in critically ill patients with high nutritional risk (EFFORT Protein): an international, multicentre, pragmatic, registry-based randomised trial. Lancet 401(10376):568–576. https:// doi. org/ 10. 1016/ S0140- 6736(22) 02469-2
38. Doig GS, Simpson F, Bellomo R, Heighes PT, Sweetman EA, Chesher D, Pollock C, Davies A, Botha J, Harrigan P, Reade MC (2015) Intravenous amino acid therapy for kidney function in critically ill patients: a randomized controlled trial. Intensive Care Med 41(7):1197–1208. https:// doi.org/ 10. 1007/ s00134- 015- 3827-9
39. Lee ZY, Dresen E, Lew CCH, Bels J, Hill A, Hasan MS, Ke L, van Zanten A, van de Poll MCG, Heyland DK, Stoppe C (2024) The effects of higher versus lower protein delivery in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials with trial sequential analysis. Crit Care 28(1):15. https:// doi. org/ 10. 1186/s13054- 023- 04783-1
40. Singer P, Blaser AR, Berger MM, Calder PC, Casaer M, Hiesmayr M, Mayer K, Montejo-Gonzalez JC, Pichard C, Preiser JC, Szczeklik W, van Zanten ARH, Bischoff SC (2023) ESPEN practical and partially revised guideline: Clinical nutrition in the intensive care unit. Clin Nutr 42(9):1671–1689. https:// doi.org/ 10. 1016/j. clnu. 2023. 07. 011
41. Pertzov B, Bar-Yoseph H, Menndel Y, Bendavid I, Kagan I, Glass YD, Singer P (2022) The effect of indirect calorimetry guided isocaloric nutrition on mortality in critically ill patients-a systematic review and meta-analysis. Eur J Clin Nutr 76(1):5–15. https:// doi. org/ 10. 1038/ s41430- 021- 00919-0
42. Singer P, De Waele E, Sanchez C, Ruiz Santana S, Montejo JC, Laterre PF, Soroksky A, Moscovici E, Kagan I (2021) TICACOS international: A multicenter, randomized, prospective controlled study comparing tight calorie control versus Liberal calorie administration study. Clin Nutr 40(2):380–387. https:// doi. org/ 10. 1016/j. clnu. 2020. 05. 024
43. Veraar C, Geilen J, Fischer A, Sulz I, Tarantino S, Mouhieddine M, Mora B, Schuh C, Singer P, Hiesmayr MJ (2021) Timing of parenteral nutrition in ICU patients: a transatlantic controversy. Clin Nutr ESPEN. 46:532–538.https:// doi. org/ 10. 1016/j. clnesp. 2021. 08. 007
44. Heidegger CP, Berger MM, Graf S, Zingg W, Darmon P, Costanza MC, Thibault R, Pichard C (2013) Optimisation of energy provision with supplemental parenteral nutrition in critically ill patients: a randomised controlled clinical trial. Lancet 381(9864):385–393. https:// doi. org/ 10.1016/ S0140- 6736(12) 61351-8
45. Heidegger CP, Berger MM, Thibault R, Zingg W, Pichard C (2013) Supplemental parenteral nutrition in critically ill patients–authors’ reply. Lancet 381(9879):1716–1717. https:// doi. org/ 10. 1016/ S0140- 6736(13) 61072-7
46. Kreymann KG, Berger MM, Deutz NE, Hiesmayr M, Jolliet P, Kazandjiev G, Nitenberg G, van den Berghe G, Wernerman J, Dgem EC, Hartl W, Heymann C, Spies C, Espen (2006) ESPEN guidelines on enteral nutrition: intensive care. Clin Nutr 25(2):210–223. https:// doi. org/ 10. 1016/j.clnu. 2006. 01. 021
47. Singer P, Berger MM, Van den Berghe G, Biolo G, Calder P, Forbes A, Griffiths R, Kreyman G, Leverve X, Pichard C, Espen (2009) ESPEN Guidelines on parenteral nutrition: intensive care. Clin Nutr 28(4):387–400.https:// doi. org/ 10. 1016/j. clnu. 2009. 04. 024
48. Compher C, Bingham AL, McCall M, Patel J, Rice TW, Braunschweig C, McKeever L (2022) Guidelines for the provision of nutrition support therapy in the adult critically ill patient: the American Society for Parenteral and Enteral Nutrition. JPEN J Parenter Enteral Nutr 46(1):12–41. https://doi. org/ 10. 1002/ jpen. 2267
49. Fuentes Padilla P, Martinez G, Vernooij RW, Urrutia G, Roque IFM, Bonfill Cosp X (2019) Early enteral nutrition (within 48 hours) versus delayed enteral nutrition (after 48 hours) with or without supplemental parenteral nutrition in critically ill adults. Cochrane Database Syst Rev. https:// doi.org/ 10. 1002/ 14651 858. CD012 340. pub2
50. Fuglsang KA, Brandt CF, Jeppesen PB (2022) Survival in patients initiating home parenteral support due to nonmalignant short bowel syndrome compared with background population. Clin Nutr ESPEN 50:170–177.https:// doi. org/ 10. 1016/j. clnesp. 2022. 05. 023
51. Berger MM, Shenkin A, Schweinlin A, Amrein K, Augsburger M, Biesalski HK, Bischoff SC, Casaer MP, Gundogan K, Lepp HL, de Man AME, Muscogiuri G, Pietka M, Pironi L, Rezzi S, Cuerda C (2022) ESPEN micronutrient guideline. Clin Nutr 41(6):1357–1424. https:// doi. org/ 10. 1016/j. clnu. 2022.02. 015
52. Koekkoek WA, van Zanten AR (2016) Antioxidant vitamins and trace elements in critical illness. Nutr Clin Pract 31(4):457–474. https:// doi. org/ 10.1177/ 08845 33616 653832
53. Berger MM, Broman M, Forni L, Ostermann M, De Waele E, Wischmeyer PE (2021) Nutrients and micronutrients at risk during renal replacement therapy: a scoping review. Curr Opin Crit Care 27(4):367–377. https:// doi. org/ 10. 1097/ MCC. 00000 00000 000851
54. Koekkoek KWA, Berger MM (2023) An update on essential micronutrients in critical illness. Curr Opin Crit Care 29(4):315–329. https:// doi. org/ 10.1097/ MCC. 00000 00000 001062
55. Casaer MP, Bellomo R (2019) Micronutrient deficiency in critical illness: an invisible foe? Intensive Care Med 45(8):1136–1139. https:// doi. org/ 10.1007/ s00134- 019- 05678-y
56. Doig GS, Simpson F, Heighes PT, Bellomo R, Chesher D, Caterson ID, Reade MC, Harrigan PW, Refeeding Syndrome Trial Investigators G (2015) Restricted versus continued standard caloric intake during the management of refeeding syndrome in critically ill adults: a randomised, parallel-group, multicentre, single-blind controlled trial. Lancet Respir Med 3(12):943–952. https:// doi. org/ 10. 1016/ S2213- 2600(15) 00418-X
57. Olthof LE, Koekkoek W, van Setten C, Kars JCN, van Blokland D, van Zanten ARH (2018) Impact of caloric intake in critically ill patients with, and without, refeeding syndrome: a retrospective study. Clin Nutr 37(5):1609–1617. https:// doi. org/ 10. 1016/j. clnu. 2017. 08. 001
58. Berger MM, Talwar D, Shenkin A (2022) Pitfalls in the interpretation of blood tests used to assess and monitor micronutrient nutrition status. Nutr Clin Pract. https:// doi. org/ 10. 1002/ ncp. 10924
59. Reintam Blaser A, Alhazzani W, Belley-Cote E, Moller MH, Adhikari NKJ, Burry L, Coopersmith CM, Al Duhailib Z, Fujii T, Granholm A, Gunst J, Hammond N, Ke L, Lamontagne F, Loudet C, Morgan M, Ostermann M, Reinikainen M, Rosenfeld R, Spies C, Oczkowski S (2023) Intravenous vitamin C therapy in adult patients with sepsis: a rapid practice guideline. Acta Anaesthesiol Scand. https:// doi. org/ 10. 1111/ aas. 14311
60. Casaer MP, Langouche L, Coudyzer W, Vanbeckevoort D, De Dobbelaer B, Guiza FG, Wouters PJ, Mesotten D, Van den Berghe G (2013) Impact of early parenteral nutrition on muscle and adipose tissue compartments during critical illness. Crit Care Med 41(10):2298–2309. https:// doi. org/ 10.1097/ CCM. 0b013 e3182 8cef02
61. Gunst J, Vanhorebeek I, Casaer MP, Hermans G, Wouters PJ, Dubois J, Claes K, Schetz M, Van den Berghe G (2013) Impact of early parenteral nutrition on metabolism and kidney injury. J Am Soc Nephrol 24(6):995–1005.https:// doi. org/ 10. 1681/ ASN. 20120 70732
62. Heyland DK, Wibbenmeyer L, Pollack JA, Friedman B, Turgeon AF, Eshraghi N, Jeschke MG, Belisle S, Grau D, Mandell S, Velamuri SR, Hundeshagen G, Moiemen N, Shokrollahi K, Foster K, Huss F, Collins D, Savetamal A, Gurney JM, Depetris N, Stoppe C, Ortiz-Reyes L, Garrel D, Day AG, Team R-ET (2022) A randomized trial of enteral glutamine for treatment of burn injuries. N Engl J Med 387(11):1001–1010. https:// doi. org/ 10. 1056/ NEJMo a2203 364
63. Heyland D, Muscedere J, Wischmeyer PE, Cook D, Jones G, Albert M, Elke G, Berger MM, Day AG, Canadian Critical Care Trials G (2013) A randomized trial of glutamine and antioxidants in critically ill patients. N Engl J Med 368(16):1489–1497. https:// doi. org/ 10. 1056/ NEJMo a1212 722
64. Vanhorebeek I, Casaer M, Gunst J (2023) Nutrition and autophagy deficiency in critical illness. Curr Opin Crit Care 29(4):306–314. https:// doi. org/10. 1097/ MCC. 00000 00000 001056
65. Mizushima N, Levine B (2020) Autophagy in human diseases. N Engl J Med 383(16):1564–1576. https:// doi. org/ 10. 1056/ NEJMr a2022 774
66. Derde S, Vanhorebeek I, Guiza F, Derese I, Gunst J, Fahrenkrog B, Martinet W, Vervenne H, Ververs EJ, Larsson L, Van den Berghe G (2012) Early parenteral nutrition evokes a phenotype of autophagy deficiency in liverand skeletal muscle of critically ill rabbits. Endocrinology 153(5):2267–2276. https:// doi. org/ 10. 1210/ en. 2011- 2068
67. Gunst J, Casaer MP, Langouche L, Van den Berghe G (2021) Role of ketones, ketogenic diets and intermittent fasting in ICU. Curr Opin Crit Care 27(4):385–389. https:// doi. org/ 10. 1097/ MCC. 00000 00000 000841
68. Weckx R, Goossens C, Derde S, Pauwels L, Vander Perre S, Van den Berghe G, Langouche L (2022) Efficacy and safety of ketone ester infusion to prevent muscle weakness in a mouse model of sepsis-induced critical illness. Sci Rep 12(1):10591. https:// doi. org/ 10. 1038/ s41598- 022- 14961-w
69. Goossens C, Weckx R, Derde S, Dufour T, Vander Perre S, Pauwels L, Thiessen SE, Van Veldhoven PP, Van den Berghe G, Langouche L (2019)Adipose tissue protects against sepsis-induced muscle weakness in mice:from lipolysis to ketones. Crit Care 23(1):236. https:// doi. org/ 10. 1186/s13054- 019- 2506-6
70. De Bruyn A, Langouche L, Vander Perre S, Gunst J, Van den Berghe G (2021) Impact of withholding early parenteral nutrition in adult critically ill patients on ketogenesis in relation to outcome. Crit Care 25(1):102. https:// doi. org/ 10. 1186/ s13054- 021- 03519-3
71. De Bruyn A, Gunst J, Goossens C, Vander Perre S, Guerra GG, Verbruggen S, Joosten K, Langouche L, Van den Berghe G (2020) Effect of withholding early parenteral nutrition in PICU on ketogenesis as potential mediator of its outcome benefit. Crit Care 24(1):536. https:// doi. org/ 10. 1186/s13054- 020- 03256-z
72. Gunst J, Verbruggen SC (2023) Insulin resistance in critical illness: consequences for nutrition therapy and glucose management. Curr Opin Crit Care 29(4):286–292. https:// doi. org/ 10. 1097/ MCC. 00000 00000 001055
73. van den Berghe G, Wouters P, Weekers F, Verwaest C, Bruyninckx F, Schetz M, Vlasselaers D, Ferdinande P, Lauwers P, Bouillon R (2001) Intensive insulin therapy in critically ill patients. N Engl J Med 345(19):1359–1367. https:// doi. org/ 10. 1056/ NEJMo a0113 00
74. Van den Berghe G, Wilmer A, Hermans G, Meersseman W, Wouters PJ, Milants I, Van Wijngaerden E, Bobbaers H, Bouillon R (2006) Intensive insulin therapy in the medical ICU. N Engl J Med 354(5):449–461. https://doi. org/ 10. 1056/ NEJMo a0525 21
75. Vlasselaers D, Milants I, Desmet L, Wouters PJ, Vanhorebeek I, van den Heuvel I, Mesotten D, Casaer MP, Meyfroidt G, Ingels C, Muller J, Van Cromphaut S, Schetz M, Van den Berghe G (2009) Intensive insulin therapy for patients in paediatric intensive care: a prospective, randomised controlled study. Lancet 373(9663):547–556. https:// doi. org/ 10. 1016/S0140- 6736(09) 60044-1
76. Gunst J, Debaveye Y, Guiza F, Dubois J, De Bruyn A, Dauwe D, De Troy E, Casaer MP, De Vlieger G, Haghedooren R, Jacobs B, Meyfroidt G, Ingels C, Muller J, Vlasselaers D, Desmet L, Mebis L, Wouters PJ, Stessel B, Geebelen L, Vandenbrande J, Brands M, Gruyters I, Geerts E, De Pauw I, Vermassen J, Peperstraete H, Hoste E, De Waele JJ, Herck I, Depuydt P, Wilmer A, Hermans G, Benoit DD, Van den Berghe G, Collaborators TG-F (2023) Tight blood-glucose control without early parenteral nutrition in the ICU. N Engl J Med 389(13):1180–1190. https:// doi. org/ 10. 1056/ NEJMo a2304 855
77. Umpierrez GE (2023) Glucose control in the ICU. N Engl J Med 389(13):1234–1237. https:// doi. org/ 10. 1056/ NEJMe 23094 42
78. Gunst J, Van den Berghe G (2016) Blood glucose control in the ICU: don’t throw out the baby with the bathwater! Intensive Care Med 42(9):1478–1481. https:// doi. org/ 10. 1007/ s00134- 016- 4350-3
79. Gunst J (2017) Recovery from critical illness-induced organ failure: the role of autophagy. Crit Care 21(1):209. https:// doi. org/ 10. 1186/s13054- 017- 1786-y
80. Gunst J, De Bruyn A, Casaer MP, Vander Perre S, Langouche L, Van den Berghe G (2021) Impact of tight glucose control on circulating 3-hydroxybutyrate in critically ill patients. Crit Care 25(1):373. https:// doi.org/ 10. 1186/ s13054- 021- 03772-6
81. Van den Berghe G, Wouters PJ, Bouillon R, Weekers F, Verwaest C, Schetz M, Vlasselaers D, Ferdinande P, Lauwers P (2003) Outcome benefit of intensive insulin therapy in the critically ill: Insulin dose versus glycemic control. Crit Care Med 31(2):359–366. https:// doi. org/ 10. 1097/ 01. CCM.00000 45568. 12881. 10
82. Berger MM, Reintam-Blaser A, Calder PC, Casaer M, Hiesmayr MJ, Mayer K, Montejo JC, Pichard C, Preiser JC, van Zanten ARH, Bischoff SC, Singer P (2019) Monitoring nutrition in the ICU. Clin Nutr 38(2):584–593. https://doi. org/ 10. 1016/j. clnu. 2018. 07. 009
83. Gunst J, Kashani KB, Hermans G (2019) The urea-creatinine ratio as a novel biomarker of critical illness-associated catabolism. Intensive Care Med 45(12):1813–1815. https:// doi. org/ 10. 1007/ s00134- 019- 05810-y
84. Achamrah N, Delsoglio M, De Waele E, Berger MM, Pichard C (2021) Indirect calorimetry: The 6 main issues. Clin Nutr 40:4–14
85. Schuetz P, Fehr R, Baechli V, Geiser M, Deiss M, Gomes F, Kutz A, Tribolet P, Bregenzer T, Braun N, Hoess C, Pavlicek V, Schmid S, Bilz S, Sigrist S, Brandle M, Benz C, Henzen C, Mattmann S, Thomann R, Brand C, Rutishauser J, Aujesky D, Rodondi N, Donze J, Stanga Z, Mueller B (2019) Individualised nutritional support in medical inpatients at nutritional risk: a randomised clinical trial. Lancet 393(10188):2312–2321. https:// doi. org/ 10. 1016/S0140- 6736(18) 32776-4
86. Kagan I, Cohen J, Bendavid I, Kramer S, Mesilati-Stahy R, Glass Y, Theilla M, Singer P (2022) Effect of combined protein-enriched enteral nutrition and early cycle ergometry in mechanically ventilated critically ill patients—a pilot study. Nutrients. https:// doi. org/ 10. 3390/ nu140 81589
87. Kim HK, Suzuki T, Saito K, Yoshida H, Kobayashi H, Kato H, Katayama M (2012) Effects of exercise and amino acid supplementation on body composition and physical function in community-dwelling elderly Japanese sarcopenic women: a randomized controlled trial. J Am Geriatr Soc 60(1):16–23. https:// doi. org/ 10. 1111/j. 1532- 5415. 2011. 03776.x
88. de Cabo R, Mattson MP (2019) Effects of intermittent fasting on health, aging, and disease. N Engl J Med 381(26):2541–2551. https:// doi. org/ 10.1056/ NEJMr a1905 136
89. Bohe J, Low JF, Wolfe RR, Rennie MJ (2001) Latency and duration of stimulation of human muscle protein synthesis during continuous infusion of amino acids. J Physiol 532(Pt 2):575–579. https:// doi. org/ 10. 1111/j. 1469-7793. 2001. 0575f.x
90. Atherton PJ, Etheridge T, Watt PW, Wilkinson D, Selby A, Rankin D, Smith K, Rennie MJ (2010) Muscle full effect after oral protein: time-dependent concordance and discordance between human muscle protein synthesis and mTORC1 signaling. Am J Clin Nutr 92(5):1080–1088. https:// doi. org/10. 3945/ ajcn. 2010. 29819
91. Flower L, Haines RW, McNelly A, Bear DE, Koelfat K, Damink SO, Hart N, Montgomery H, Prowle JR, Puthucheary Z (2022) Effect of intermittent or continuous feeding and amino acid concentration on urea-to-creatinine ratio in critical illness. JPEN J Parenter Enteral Nutr 46(4):789–797. https://doi. org/ 10. 1002/ jpen. 2258
92. Van Dyck L, Casaer MP (2019) Intermittent or continuous feeding: any difference during the first week? Curr Opin Crit Care 25(4):356–362. https://doi. org/ 10. 1097/ MCC. 00000 00000 000617
93. McNelly AS, Bear DE, Connolly BA, Arbane G, Allum L, Tarbhai A, CooperJA, Hopkins PA, Wise MP, Brealey D, Rooney K, Cupitt J, Carr B, Koelfat K, Damink SO, Atherton PJ, Hart N, Montgomery HE, Puthucheary ZA (2020) Effect of intermittent or continuous feed on muscle wasting in critical illness: a phase 2 clinical trial. Chest 158(1):183–194. https:// doi. org/ 10.1016/j. chest. 2020. 03. 045
94. Van Dyck L, Vanhorebeek I, Wilmer A, Schrijvers A, Derese I, Mebis L, Wouters PJ, Van den Berghe G, Gunst J, Casaer MP (2020) Towards a fasting-mimicking diet for critically ill patients: the pilot randomized crossover ICU-FM-1 study. Crit Care 24(1):249. https:// doi. org/ 10. 1186/s13054- 020- 02987-3
95. White H, Venkatesh B (2011) Clinical review: ketones and brain injury. Crit Care 15(2):219. https:// doi. org/ 10. 1186/ cc100 20
96. Katz JB, Owusu K, Nussbaum I, Beekman R, DeFilippo NA, Gilmore EJ, Hirsch LJ, Cervenka MC, Maciel CB (2021) Pearls and pitfalls of introducing ketogenic diet in adult status epilepticus: a practical guide for the intensivist. J Clin Med. https:// doi. org/ 10. 3390/ jcm10 040881
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 09.10.2024 00:01:00
[ACTIVE_FROM] => 09.10.2024 00:01:00
[SHOW_COUNTER] => 1148
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830218
[VALUE] => Питание в ОРИТ, клинические рекомендации
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Питание в ОРИТ, клинические рекомендации
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830219
[VALUE] => Питание в отделении интенсивной терапии: от острой фазы до последующего периода
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Питание в отделении интенсивной терапии: от острой фазы до последующего периода
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830382
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 830226
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 830221
[1] => 830222
[2] => 830223
[3] => 830224
[4] => 830225
)
[VALUE] => Array
(
[0] => Nutricionnaya terapiya
[1] => intensivnayaterapiya
[2] => klinicheskierekomendatsii
[3] => kriticheskiesostoyaniya
[4] => statia
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => Nutricionnaya terapiya
[1] => intensivnayaterapiya
[2] => klinicheskierekomendatsii
[3] => kriticheskiesostoyaniya
[4] => statia
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830382
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 830226
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 830221
[1] => 830222
[2] => 830223
[3] => 830224
[4] => 830225
)
[VALUE] => Array
(
[0] => Nutricionnaya terapiya
[1] => intensivnayaterapiya
[2] => klinicheskierekomendatsii
[3] => kriticheskiesostoyaniya
[4] => statia
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => Nutricionnaya terapiya
[1] => intensivnayaterapiya
[2] => klinicheskierekomendatsii
[3] => kriticheskiesostoyaniya
[4] => statia
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Нутриционная терапия
[1] => Интенсивная терапия
[2] => Клинические рекомендации
[3] => Критические состояния
[4] => Статья
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 13.08.2025 01:26:24
[~TIMESTAMP_X] => 13.08.2025 01:26:24
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[FULLTEXT_INDEX] => N
[~FULLTEXT_INDEX] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Питание в отделении интенсивной терапии: от острой фазы до последующего периода
[BROWSER_TITLE] => Питание в отделении интенсивной терапии: от острой фазы до последующего периода
[KEYWORDS] => Питание в ОРИТ, клинические рекомендации
[DESCRIPTION] =>
)
)




