Пилотное двойное ослепленное плацебо-контролируемое рандомизированное клиническое исследование
Shah et al. Critical Care Explorations
DOI: 10.1097/CCE.0000000000000550
Пилотное двойное ослепленное плацебо-контролируемое рандомизированное клиническое исследование для изучения эффектов ранних энтеральных нутриентов при сепсисе.
Перевод оригинальной статьи «A Pilot Double-Blind Placebo-Controlled Randomized Clinical Trial to Investigate the Effects of Early Enteral Nutrients in Sepsis»
Авторы: Faraaz Ali Shah, Georgios D. Kitsios, Sachin Yende, Daniel G. Dunlap, Denise Scholl, Byron Chuan, Nameer Al-Yousif, Yingze Zhang, Seyed Mehdi Nouraie, Alison Morris, David T. Huang, Christopher P. O’Donnell, Bryan J. McVerry
Division of Pulmonary, Allergy and Critical Care Medicine, University of Pittsburgh, Pittsburgh,PA.
VA Pittsburgh Healthcare System, Department of Medicine, Pittsburgh, PA.
Acute Lung Injury Center of Excellence, University of Pittsburgh, Pittsburgh, PA.
Center for Medicine and the Microbiome, University of Pittsburgh, Pittsburgh, PA.
VA Pittsburgh Healthcare System, Department of Critical Care Medicine, Pittsburgh, PA.
Department of Critical Care Medicine, University of Pittsburgh, Pittsburgh, PA.
Department of Internal Medicine, UPMC Mercy, Pittsburgh, PA.
KEY WORDS: dextrose; enteral nutrition; incretins; inflammation; sepsis
Ключевые слова: декстроза, энтеральное питание, инкретины, воспаление, сепсис.
Введение
Текущие клинические руководства рекомендуют проводить раннее энтеральное питание у пациентов, находящихся в критическом состоянии, но механизмы, с помощью которых энтеральное питание может улучшить клинические исходы у таких пациентов, остаются неясными [1, 2]. Предполагаемые положительные эффекты энтерального питания включают в себя сохранение целостности слизистой кишечного тракта, профилактику бактериальной транслокации, снижение катаболизма, вызванного критическим заболеванием [3, 4], но вот эффекты энтерального питания на метаболизм и воспаление у пациентов с сепсисом до настоящего времени не определены.
Потенциальный механизм улучшения исходов при энтеральном питании может быть связан с инкретинами [5, 6]. Инкретины кишечного происхождения, такие как глюкозозависимый инсулинотропный пептид (англ. glucose dependent insulinotropic peptide [GIP]) и глюкагоноподобный пептид-1 (англ. glucagon-like peptide-1 [GLP-1]), высвобождаются в ответ на энтеральные нутриенты и увеличивают продукцию инсулина, тем самым предупреждая гипергликемию и, теоретически, снижают риск развития гипогликемии по сравнению с экзогенным инсулином [7, 8]. Инкретинам также свойственны плейотропные противовоспалительные эффекты, при этом в преклинических исследованиях показано, что аналоги инкретинов снижают системное воспаление и органное повреждение, улучшая исходы [6, 9—11]. Уже проведены тесты экзогенных аналогов инкретинов в исследованиях, посвященных гликемическому контролю, но до клинической практики дело еще не дошло [12, 13]. Стимуляция оси инкретинов энтеральными нутриентами может оказывать подобные терапевтические эффекты.
В ранее проведенных преклинических исследованиях мы показали, что низкоуровневая энтеральная инфузия декстрозы у мышей, подвергшихся воздействию эндотоксина, улучшает утилизацию глюкозы, увеличивает продукцию инсулина, снижает резистентность к инсулину и снижает системное воспаление за счет эндогенного увеличения инкретина GIP [14]. Подобным же образом энтеральное введение декстрозы поддерживает эугликемию, что улучшает выживаемость мышиных моделей пневмонии, вызванной Klebsiella [15]. Мы провели исследование ранней энтеральной декстрозы при сепсисе (англ. the Study of Early Enteral Dextrose in Sepsis [SEEDS]) для внедрения в практику наших преклинических результатов и проверки эффектов от ранней низкоуровневой энтеральной инфузии декстрозы пациентам с сепсисом, находящимся в критическом состоянии. Мы выдвинули гипотезу о том, что энтерально вводимая декстроза может увеличить выработку инкретинов, поддержать эугликемию и снизить системное воспаление по сравнению с плацебо контролем.
Материалы и методы
Дизайн исследования и контроль
SEEDS - пилотное одноцентровое рандомизированное плацебо контролируемое клиническое исследование, тестирующее раннюю энтеральную инфузию декстрозы пациентам с сепсисом, находящимся в критическом состоянии (ClinicalTrials.gov registration number NCT03454087). Детали исследования и причины для его проведения были опубликованы ранее [16]. Протокол исследования был одобрен институциональной комиссией университета города Питсбург (PRO17010532, STUDY19080314), а поддержка исследованию была оказана Национальным институтом здоровья (the National Institutes of Health [K23GM122069]). Исследование SEEDS координировалось the Multidisciplinary Acute Care Research Organization университета города Питсбург на соответствие Хельсинской декларации. Независимая комиссия по безопасности и мониторингу данных собиралась до начала исследования и последующие 6 месяцев для отслеживания осложнений и предоставления рекомендаций по продолжению, изменению или прекращению исследования. Исследователи оставались «ослепленными» до завершения анализа полученных данных (октябрь 2020 года). Авторы несут ответственность за точность и полноту предоставленных данных, а также за соблюдение протокола исследования. Все данные предоставлены в соответствии с Сonsolidated Standards of Reporting Trials guidelines [17].
Условия и участники
В исследование SEEDS включались взрослые пациенты 18 лет и старше, у которых имелся диагноз сепсиса в ОИТ академического медицинского центра в городе Питсбург (Пенсильвания). Участники включались в исследование в первые 48 часов при условии соответствия критериям сепсиса, которые определялись как подтвержденная инфекция или подозрение на инфекцию с увеличением от исходных значений по шкале последовательной оценки органного повреждения (SOFA) на два и более баллов в соответствии с СЕПСИС-3 [18]. Для скрининга использовалась модифицированная шкала SOFA, в которой были исключены показатели билирубина и неврологические критерии (шкала ком Глазго), поскольку эти тесты не всегда проводятся в нашем учреждении у больных с сепсисом. Мы включали в исследование пациентов с уже установленными энтеральными зондами (назогастральным или орогастральным), или тогда, когда установки энтеральных зондов невозможно было избежать, или при наличии гастростомы. Мы исключали из исследования пациентов, которым уже проводилось энтеральное питание, лечение диабетического кетоацидоза или гипергликемического гиперосмолярного синдрома на момент скрининга, или при явной непереносимости энтеральной инфузии по мнению клинической команды. Информированное согласие в письменном виде получалось либо напрямую от участника исследования, либо от его официального представителя.
Рандомизация и ослепление
Участники исследования SEEDS были случайным образом распределены по группам вмешательства и плацебо в соотношении 1:1. Мы стратифицировали участников на наличие или отсутствие сахарного диабета, используя для этого отдельные рандомизированные таблицы, которые генерировались the UPMC Investigational Drug Service. Мы рассматривали возможность включения в исследование SEEDS исключительно пациентов без диабета для того, чтобы с большей точностью проверить наши доклинические данные, поскольку пациенты с диабетом могут показывать как незначительное увеличение инкретинов в ответ на энтеральные питательные вещества, так и снижение секреции инсулина в ответ на GIP [19-21], но, в конце концов, выбрали как приоритет набор репрезентативной выборки из популяции пациентов с сепсисом, находящихся в критическом состоянии и проходящих лечение в нашем учреждении. Участники и клиницисты, работающие непосредственно у постели пациентов, оставались «ослепленными» в отношении распределения по группам на протяжении всего исследования.
Вмешательства
У всех участников не более, чем за два часа до начала инфузии декстрозы (инфузия исследования) проводилось исследование крови. После этого участники получали инфузию исследования либо в виде 50% раствора декстрозы (вмешательство), либо в виде воды (плацебо) в дозе 10 мл/час в течение 24 часов. Инфузия проводилась в уже установленный энтеральный зонд с помощью стандартной инфузионной помпы. Углеводы при инфузии декстрозы к 24 часу обеспечивали около 400 ккал, что подобно большинству рецептур смесей для энтерального питания на трофическом уровне (~10–20 ккал/час). Уровень глюкозы в капиллярной крови определялся каждые 6 часов, при необходимости клиническая команда определяла уровень глюкозы чаще. Коррекция дозы инсулина также была в зоне ответственности клинической команды. Инфузия исследования прекращалась на время в случае клинической необходимости. Мониторинг остаточного объема в желудке не входил в протокол данного исследования, так что каждое решение о продолжении или о прекращении введения инфузии исследования решался клинической командой. При необходимости проведения энтерального питания клиническая команда на время прекращала введение инфузии исследования. Каждое введение лекарственных препаратов во время инфузии исследования, которые могли оказать влияние на метаболизм глюкозы (к примеру, пропофол или внутривенная декстроза), или на системное воспаление (к примеру, глюкортикоиды), заносилось в протокол [22, 23]. Стоит заметить, что внутривенно введенная декстроза напрямую не стимулирует продукцию инкретинов, но степень продукции инкретинов может зависеть от уровня глюкозы в крови [8, 24]. Второй анализ крови проводился после 24 часов инфузии исследования. После того, как период инфузии исследования заканчивался, дальнейшая нутриционная поддержка определялась клинической командой. В контексте клинических исходов обзор электронных медицинских записей продолжался в течение 30 дней после начала введения инфузии исследования.
Критерии оценки/исходов
Первичным исходом стал уровень циркулирующего интерлейкина-6 (IL-6), измеренный на 24 час после начала инфузии исследования. Вторичные исходы включали в себя: 1) гликемический контроль во время периода инфузии исследования с определением гипогликемии (определяемой как уровень глюкозы крови менее 70 мг/дл) и гипергликемии (определяемой как уровень глюкозы крови свыше 180 мг/дл); 2) уровень циркулирующих гормонов (инсулин, С-пептид, GIP и GLP-1); 3) маркеры иммунного ответа (ответа хозяина), как то антагонист рецептора интерлейкина-1 [IL1ra], рецептор фактора некроза опухоли-1 [Tnfr1], супрессор онкогенности-2 [ST2], прокальцитонин и пентраксин-3); 4) частота рвоты во время периода инфузии исследования; 5) клинические исходы в виде длительности госпитализации (стационар и ОИТ), 30-дневная госпитальная летальность. Точка отсечения для гипергликемии была выбрана на основании клинического руководства the Surviving Sepsis Campaing [25] и на основании протокола введения инсулина, применяемого в нашем учреждении, принимая во внимание то, что пороговые значения уровня глюкозы для определения гипергликемии очень сильно разнятся от исследования к исследованию [26–29]. Измерения иммунного ответа были выбраны на основании предыдущих исследований, в которых поддерживалась связь иммунного ответа с гипергликемией [28, 30–33].
Взятие проб крови
В каждую временную точку медицинские сестры осуществляли забор 10 мл цельной крови в следующие пробирки: «сыворотка», «EDTA» и «P800» (BD Biosciences, Catalog Number 366420, San Jose, CA), последняя из которых содержала проприетарный коктейль ингибиторов протеаз, что увеличивало точность измерения инкретинов [34]. Образцы обрабатывались в течение 60 минут после взятия. Образцы центрифугировались в течение 10 минут 800 × g либо при комнатной температуре (EDTA), либо при температуре 4° (P800). До окончательного анализа все образцы хранились при температуре –80°C. Для измерения IL-6, Tnfr1, ST2, пентраксина-3 и прокальцитонина использовалась панель Luminex (Fisher-Scientific, Waltham, MA). Для определения инсулина, С-пептида, GIP, GLP-1 и IL-1ra использовалась панель U-plex (Meso Scale Discovery, Rockland, MD). Анализ биомаркеров проводился с помощью Bio-Plex 100 Analyzer (Bio-Rad, Hercules, CA).
Статистический анализ
Сначала с помощью статистического анализа мы оценили уровни IL-6, измеренные через 24 часа после начала введения инфузии исследования, и сравнили показатели между группой вмешательства и группой плацебо с помощью теста Wilcoxon. Основываясь на публикациях, в которых изучались уровни циркулирующих цитокинов у пациентов в критическом состоянии на механической вентиляции [35], мы определили, что семи пациентов в каждой группе обеспечат 90% мощность для определения 15% разницы между группами в отношении уровня IL-6 с альфа-ошибкой 0.05. Мы планировали включить по 30 пациентов в каждую группу для снижения риска несбалансированности ковариант между группами [36]. Далее мы сравнили продолженные переменные, измеренные во время периода инфузии к 24 часу, с помощью теста Wilcoxon, а дихотомные переменные — с помощью теста Fisher. Мы оценили изменения эндокринных гормонов и изменения иммунного ответа от исходных значений с помощью ковариционного анализа (ANCOVA) с послеинфузионными значениями в качестве исходов. Мы выбрали подход ANCOVA для понимания изменений в непрерывных переменных на основе литературы, предполагающей его превосходство над сравнениями абсолютных различий, применяемых в рандомизированных контролируемых исследованиях [(37, 38]. Доверительные интервалы для оценок ANCOVA были получены из начального анализа с использованием 500 итераций. Результаты вторичных анализов с участием биомаркеров были скорректированы для множественных сравнений по методу Simes [39. В апостериорном анализе изучались различия между группами по биомаркерам, стратифицированным по диабетическому статусу. Количество дней без вентиляции рассчитывалось через 30 дней от начала инфузии исследования, при этом значение «0» присваивалось участникам, которые умерли до 30 дней, в соответствии с предыдущими исследованиями [40]. Выживаемость визуализировали с помощью кривых Kaplan-Meier и анализировали с помощью логарифмического рангового теста.
РЕЗУЛЬТАТЫ
Пациенты
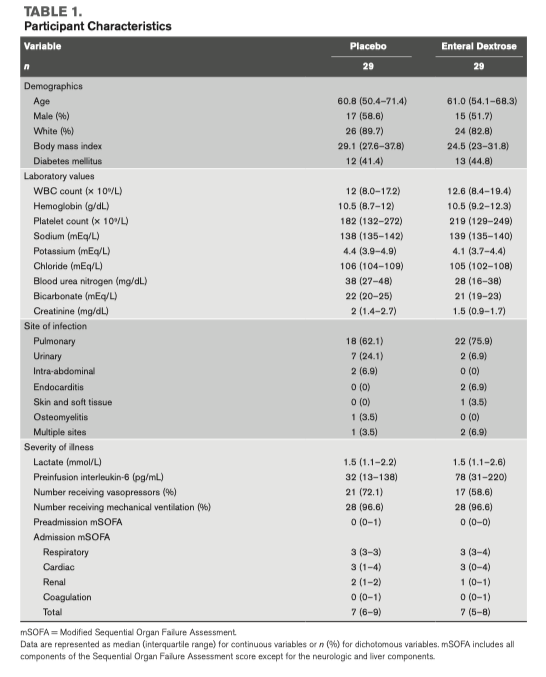
С июня 2018 по февраль 2020 скринингу подверглись 1054 пациента, из которых 186 пациентов отвечали критериям включения (eFig. 1, Online Supplement, http://links.lww. com/CCX/A814). Из них, при целевом значении в 60, в исследование было включено 58 пациентов. У одного пациента резко развилась клиническая декомпенсация с быстрым нарастанием дозировки вазопрессоров еще до начала введения инфузии исследования и этот пациент не был включен в анализ биомаркеров, но этот пациент был включен в анализ клинических исходов. Исследование SEEDS было завершено в марте 2020 года в связи со свертыванием исследовательских программ по причине пандемии COVID-19. Среди 58 рандомизированных участников исследования, медиана возраста составила 60,9 лет (50.4–70.7), 32 из них (55%) были мужчинами, а 50 пациентов были белыми (86%). У двадцати пяти участников (43%) в анамнезе был сахарный диабет, медиана средней оценки по модифицированной шкале SOFA составила 7 (6—9) баллов. Наиболее частой инфекцией стала пневмония (74%). Исходные характеристики групп между собой не различались (Таблица 1).
Период инфузии исследования
Медиана длительности инфузии исследования составила 24 часа (20.9–24) в группе плацебо и 23.9 часа (23–24) в группе энтеральной декстрозы (p = 0.59). В терминах конкомитантных медикаментов, что могли бы оказать влияние на воспаление и на метаболизм глюкозы, мы нашли практически одинаковое использование пропофола, глюкокортикоидов и экзогенной декстрозы (которая применялась только для разведения лекарственных препаратов) между группами (Supplementary Table 1, http://links.lww.com/CCX/A814). В каждой группе у двух пациентов инфузия останавливалась по причине рвоты (p> 0.99). У одного пациента в группе энтеральной декстрозы инфузия исследования была заменена на энтеральное питание через зонд, когда началось введение инсулина при эугликемическом кетоацидозе. Ни у кого из пациентов на развилась мезентериальная ишемия.
Измерения системного воспалительного ответа
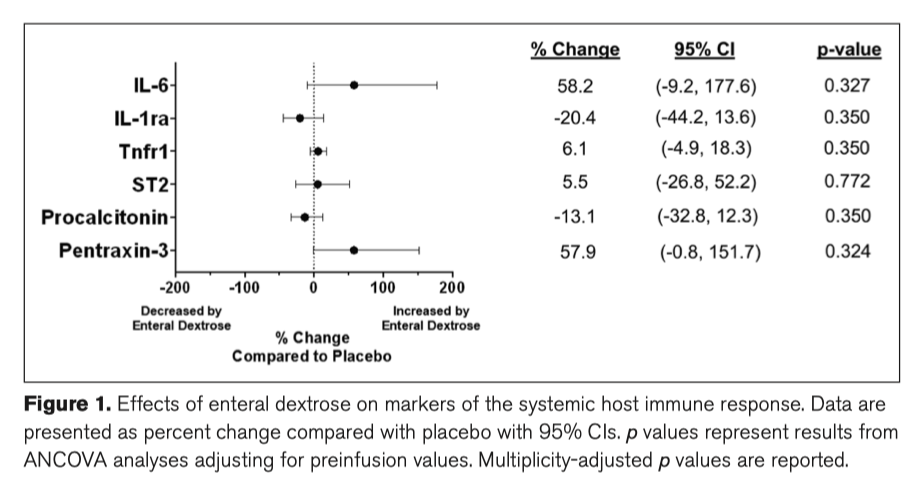
Первичный исход в виде уровня циркулирующего IL-6 после 24 часов после начала введения инфузии исследования не различался между группой плацебо (медиана, 24 pg/mL [interquartile range, 9–59 pg/mL]) и группой энтеральной декстрозы (32 pg/mL [19–78]) groups (p = 0.240). При последующем анализе уровни IL-1ra, Tnfr1, ST2, и прокальцитонина также не имели существенных различий (Supplementary Table 2, http://links.lww.com/CCX/A814). Уровень пентраксина-3, измеренного в конце инфузии, увеличивался в группе энтеральной декстрозы (4,825 pg/mL [2,065–9,895 pg/mL]) по сравнению с группой плацебо (995 [216–2,391]; p = 0.045). Однако, после корректировки значение перед инфузией или после стратификации на диабет, энтеральная декстроза существенно не изменяла значения биомаркеров иммунного ответа на 24 час по сравнению с плацебо (Fig. 1; Supplementary Table 2, http://links. lww.com/CCX/A814, and Supplementary Table 3, http://links.lww.com/CCX/A814).
Гликемический контроль во время периода инфузии и эндокринные исходы
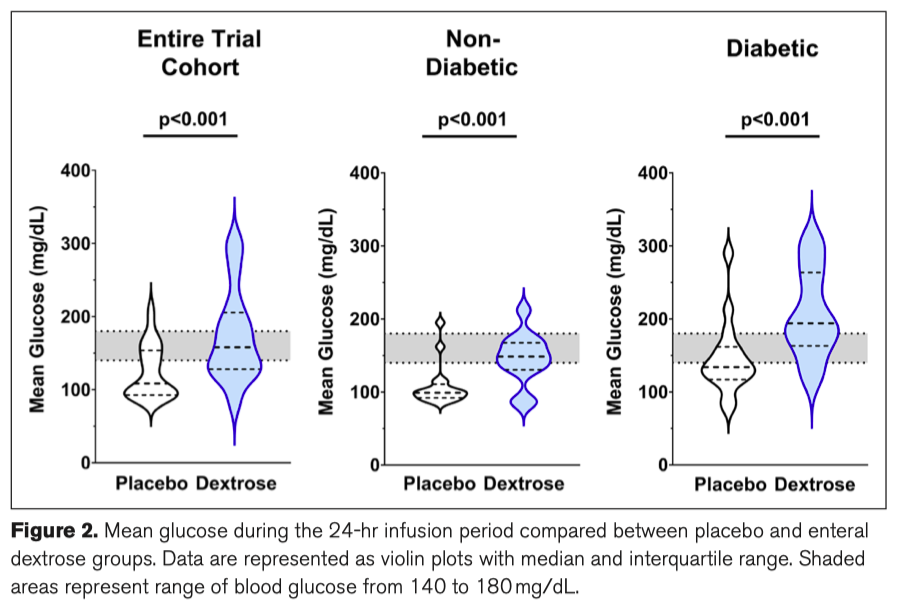
Уровень глюкозы в капиллярной крови существенно не различался между группой плацебо и группой энтеральной глюкозы в начале инфузии исследования (Supplementary Table 4, http://links.lww.com/CCX/ A814). Средний показатель глюкозы во время периода инфузии значительно увеличивался в группе энтеральной декстрозы (158 mg/dL [128–206 mg/dL]) по сравнению с группой плацебо (109 mg/dL [93–154 mg/dL]; p < 0.001), а результаты были последовательны как у участников с диабетом, так и участников без диабета (Рис. 2). Уровень глюкозы капиллярной крови в конце периода инфузии (153 mg/dL [119–223 mg/dL] против 116 mg/dL [91–140 mg/dL]; p = 0.004), также как и максимальный уровень глюкозы (201 mg/dL [152–239 mg/dL] vs 126 mg/dL [107–191 mg/dL]; p = 0.001, аналогичным образом увеличился в группе энтеральной декстрозы. Однако общее количество введенного инсулина после коррекции между группами не различалось (p = 0.132). Тренд к большей частоте развития гипергликемии (определяемой как уровень глюкозы свыше 180 mg/dL в период инфузии) наблюдался в группе энтеральной декстрозы (55.2% vs 32.1%; p = 0.068) с последовательными результатами по другим пороговым значениям, что достигло статистической значимости в ретроспективном анализе. У двух пациентов в группе плацебо (7.1%) развилась гипогликемия по сравнению с одним пациентом в группе энтеральной декстрозы (3.5%; p = 0.487).
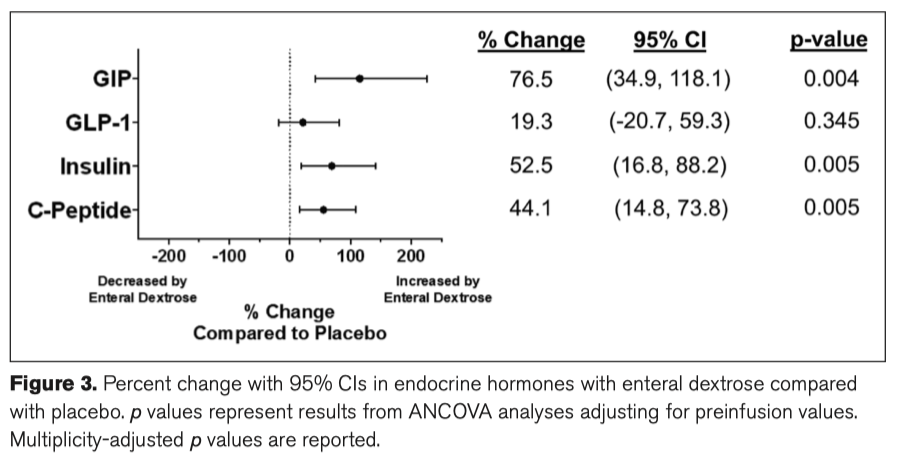
К 24 часу у участников в группе энтеральной декстрозы был выше уровень циркулирующего GIP (1,396 pg/mL [764–1,973] vs 581 [267–838]; p =0.004) и выше уровень инсулина 158 [86–215]; p =0.036) по сравнению с группой плацебо. Уровни GLP-1 и С-пептида к 24 часу существенно между группами не различались (Supplementary Table 5, http://links.lww.com/CCX/A814). После корректировки на прединфузионные значения энтеральная вводимая декстроза значительно повышала уровень GIP, инсулина и С-пептида по сравнению с группой плацебо (Рис. 3). Post hoc анализ предполагает наличие последовательных эффектов от энтерального введения декстрозы на увеличение уровня GIP независимо от диабета (есть или нет), а также на потенциальное «притупление» увеличения инсулина и С-пептида у пациентов с диабетом (Supplementary Table 5, http://links.lww.com/ CCX/A814, and Supplementary Table 6, http://links. lww.com/CCX/A814).
Клинические исходы
Все рандомизированные участники (n = 58) были включены в анализ «намерение-к-лечению» (intention-to-treat) клинических исходов независимо от получения ими инфузии исследования. Свободные от вентилятора дни, длительность госпитализации в ОИТ и в госпитале, существенно между группами не отличались (Supplementary Table 7, http://links.lww.com/CCX/A814). На 30 день после начала инфузии исследования по семь участников в каждой группе умерли (плацебо 24.1%; энтеральная декстроза 24.1%) без существенной разницы в выживаемости (p = 0.98; eFig. 2, http://links.lww. com/CCX/A814).
ОБСУЖДЕНИЕ
Изучение потенциальной роли инкретинов и терапии, основанной на инкретинах, у пациентов, находящихся в критическом состоянии, становится первоочередной целью в исследованиях по питанию и метаболизму [5]. Предшествующие рандомизированные контролируемые исследования тестировали терапию, основанную на инкретинах, у пациентов в критическом состоянии, предполагая снижение гипергликемии. Однако, во всех этих исследованиях использовалась внутривенная продолженная инфузия инкретинов в супрафизиологической дозе, что невозможно в рутинной клинической практике [12, 13, 41]. В нашем пилотном рандомизированном клиническом исследовании мы изучили вопрос, а действительно ли доставка энтеральных нутриентов может способствовать выработке эндогенных инкретинов у пациентов с сепсисом с аналогичной терапевтической пользой. Мы показали, что ранняя инфузия энтеральной декстрозы увеличивает уровень циркулирующего инкретина GIP, а также инсулина и С-пептида, но не снижает уровень циркулирующего IL-6 и уровень гипергликемии по сравнению с плацебо контролем.
Результаты исследования SEEDS и результаты преклинических исследований нашей лаборатории, послуживших основанием для проведения исследования SEEDS [14, 15], находятся в противоречии, а именно в том, что инфузия энтеральной декстрозы септическим мышам увеличивало уровни GIP и эндогенного инсулина, что приводило к эугликемии, тогда как в исследовании SEED мы чаще видели тренд к гипергликемии. Несмотря на увеличение уровня GIP, энтеральная декстроза не снижала уровень циркулирующего IL-6 в отличие от результатов преклинических исследований. Следует отметить, что вариабельность уровня IL-6 в исследовании SEEDS была выше ранее опубликованных оценок, на основании которых мы рассчитывали размер выборки, что ведет к необходимости в проведении более большого исследования. Клинические исходы не различались между группами, но исследование не было достаточно мощным и больше было нацелено на изучение физиологического ответа на энтеральные нутриенты. Трудности в переносе результатов преклинических исследований сепсиса в клинические исследования достаточно хорошо известны [42, 43]. В преклинических исследованиях животные подвергаются идентичным воздействиям с идентичным сбором биологических образцов, что способствует точности и воспроизводимости результатов. И наоборот, в клинических исследованиях воздействие варьируется, а время развития сепсиса никогда нельзя установить точно. Вариабельность в возрасте пациентов, их демографии и коморбидности, а также вариабельности иммунного ответа может оказывать существенное влияние на различия ответов на терапевтические вмешательства [44]. Наиболее важными для исследования SEEDS являются различия в ответах на энтеральное введение декстрозы у пациентов с диабетом, когда пациенты с диабетом показывали более медленный ответ эндогенного инсулина, несмотря на увеличение уровня GIP. Резистентность к инкретинам, в частности к GIP, хорошо задокументирована у пациентов с диабетом и ожирением [19, 20], и к GLP-1 (уровень которого не увеличивался при энтеральном введении декстрозы), может потребоваться для положительных эффектов у пациентов с сепсисом. Полное энтеральное питание, включающее в себя жиры, аминокислоты и комплекс углеводов, может способствовать GLP-1, но в исследовании SEEDS таких тестов не проводилось. Пилотное одноцентровое исследование 49 пациентов с септическим шоком показало безопасность трофического питания, по сравнению с его отсутствием, со снижением длительности пребывания пациента в ОИТ [45]. Потенциальная роль GLP-1 на терапевтические эффекты энтерального питания остается не совсем ясной. При этом несколько пилотных исследования проверили эффекты от инфузии экзогенного GLP-1 (или аналогов) в смешанной популяции пациентов в критическом состоянии и показали снижение частоты развития гипергликемии [6, 12, 13, 46—48], но несмотря на это, до сих пор не завершено ни одного крупного многоцентрового исследования терапии инкретинами, хотя о необходимости такого исследования уже говорилось [5].
Важно, что наше пилотное исследование имеет несколько сильных сторон, включая сюда использование плацебо контроля, «ослепления», хорошего соблюдения протокола, успешную рандомизацию с отсутствием дисбаланса между группами даже несмотря на небольшое количество участников. К тому же, исследований, посвященных изучению влияния нутриционной поддержки на ответ биомаркеров, очень мало [51].
Выводы
В этом пилотном исследовании мы показали возможность сочетания энтерального вмешательства со сбором образцов, что может помочь в понимании изменений молекулярных путей в ответ на питание у постели больного. Мы полагаем, что дальнейшие исследования у пациентов с септическим шоком должны включать в себя и биомаркеры для более полного понимания механистических изменений в ответ на нутриционную поддержку, и для понимания того, почему пациенты показывают различный ответ на питание, и для понимания лучших стратегий питания в контексте индивидуализированной терапии.
Список литературы:
1. McClave SA, Taylor BE, Martindale RG, et al; Society of Critical Care Medicine; American Society for Parenteral and Enteral Nutrition: Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr 2016; 40:159–211
2. Rhodes A, Evans LE, Alhazzani W, et al: Surviving sepsis campaign: International guidelines for management of sepsis and septic shock: 2016. Crit Care Med 2017; 45:486–552
3. Casaer MP, Mesotten D, Hermans G, et al: Early versus late parenteral nutrition in critically ill adults. N Engl J Med 2011; 365:506–517
4. Doig GS, Simpson F, Sweetman EA, et al; Early PN Investigators of the ANZICS Clinical Trials Group: Early parenteral nutrition in critically ill patients with short-term relative contraindications to early enteral nutrition: A randomized controlled trial. JAMA 2013; 309:2130–2138
5. Arabi YM, Casaer MP, Chapman M, et al: The intensive care medicine research agenda in nutrition and metabolism. Intensive Care Med 2017; 43:1239–1256
6. Shah FA, Mahmud H, Gallego-Martin T, et al: Therapeutic effects of endogenous incretin hormones and exogenous incretin-based medications in sepsis. J Clin Endocrinol Metab 2019; 104:5274–5284
7. Baggio LL, Drucker DJ: Biology of incretins: GLP-1 and GIP. Gastroenterology 2007; 132:2131–2157
8. Campbell JE, Drucker DJ: Pharmacology, physiology, and mechanisms of incretin hormone action. Cell Metab 2013; 17:819–837
9. Lee W, Ku SK, Park EJ, et al: Exendin-4 inhibits HMGB1induced inflammatory responses in HUVECs and in murine polymicrobial sepsis. Inflammation 2014; 37:1876–1888
10. Lee W, Park EJ, Kwak S, et al: Trimeric PEG-conjugated exendin-4 for the treatment of sepsis. Biomacromolecules 2016; 17:1160–1169
11. Neves FS, Marques PT, Barros-Aragão F, et al: Brain-defective insulin signaling is associated to late cognitive impairment in post-septic mice. Mol Neurobiol 2018; 55:435–444
12. Deane AM, Chapman MJ, Fraser RJ, et al: Effects of exogenous glucagon-like peptide-1 on gastric emptying and glucose absorption in the critically ill: Relationship to glycemia. Crit Care Med 2010; 38:1261–1269
13. Miller A, Deane AM, Plummer MP, et al: Exogenous glucagonlike peptide-1 attenuates glucose absorption and reduces blood glucose concentration after small intestinal glucose delivery in critical illness. Crit Care Resusc 2017; 19:37–42
14. Shah FA, Singamsetty S, Guo L, et al: Stimulation of the endogenous incretin glucose-dependent insulinotropicpeptide by enteral dextrose improves glucose homeostasis and inflammation in murine endotoxemia. Transl Res 2018; 193:1–12
15. Chuan B, Guo L, Cooper B, et al: Physiologic effects of exogenous dextrose in murine Klebsiella pneumoniae sepsis vary by route of provision. Nutrients 2020; 12:E2901
16. Shah FA, Kitsios GD, Zhang Y, et al: Rationale for and design of the study of early enteral dextrose in sepsis: A pilot placebo-controlled randomized clinical trial. JPEN J Parenter Enteral Nutr 2020; 44:541–547
17. Schulz KF, Altman DG, Moher D; CONSORT Group: CONSORT 2010 statement: Updated guidelines for reporting parallel group randomised trials. BMJ 2010; 340:c332
18. Singer M, Deutschman CS, Seymour CW, et al: The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA 2016; 315:801–810
19. Meier JJ, Gallwitz B, Kask B, et al: Stimulation of insulin secretion by intravenous bolus injection and continuous infusion of gastric inhibitory polypeptide in patients with type 2 diabetes and healthy control subjects. Diabetes 2004; 53(Suppl 3):S220–S224
20. Nauck MA, Heimesaat MM, Orskov C, et al: Preserved incretin activity of glucagon-like peptide 1 [7-36 amide] but not of synthetic human gastric inhibitory polypeptide in patients with type-2 diabetes mellitus. J Clin Invest 1993; 91:301–307
21. Holst JJ, Knop FK, Vilsbøll T, et al: Loss of incretin effect is a specific, important, and early characteristic of type 2 diabetes. Diabetes Care 2011; 34(Suppl 2):S251–S257
22. Meduri GU, Tolley EA, Chrousos GP, et al: Prolonged methylprednisolone treatment suppresses systemic inflammation in patients with unresolving acute respiratory distress syndrome: Evidence for inadequate endogenous glucocorticoid secretion and inflammation-induced immune cell resistance to glucocorticoids. Am J Respir Crit Care Med 2002; 165:983–991
23. Maeda K, Iwasaki M, Itou Y, et al: Effect of propofol continuous-rate infusion on intravenous glucose tolerance test in dogs. Vet Sci 2018; 5:E43
24. Herrmann C, Göke R, Richter G, et al: Glucagon-like peptide-1 and glucose-dependent insulin-releasing polypeptide plasma levels in response to nutrients. Digestion 1995; 56:117–126
25. Rhodes A, Evans LE, Alhazzani W, et al: Surviving sepsis campaign: International guidelines for management of sepsis and septic shock: 2016. Intensive Care Med 2017; 43:304–377
26. Green JP, Berger T, Garg N, et al: Hyperlactatemia affects the association of hyperglycemia with mortality in nondiabetic adults with sepsis. Acad Emerg Med 2012; 19:1268–1275
27. van Vught LA, Wiewel MA, Klein Klouwenberg PM, et al; Molecular Diagnosis and Risk Stratification of Sepsis Consortium: Admission hyperglycemia in critically ill sepsis patients: Association with outcome and host response. Crit Care Med 2016; 44:1338–1346
28. Nakamura M, Oda S, Sadahiro T, et al: Correlation between high blood IL-6 level, hyperglycemia, and glucose control in septic patients. Crit Care 2012; 16:R58
29. Falciglia M, Freyberg RW, Almenoff PL, et al: Hyperglycemiarelated mortality in critically ill patients varies with admission diagnosis. Crit Care Med 2009; 37:3001–3009
30. Farooq N, Chuan B, Mahmud H, et al: Association of the systemic host immune response with acute hyperglycemia in mechanically ventilated septic patients. PLoS One 2021; 16:e0248853
31. Hotamisligil GS: The role of TNFalpha and TNF receptors in obesity and insulin resistance. J Intern Med 1999; 245:621–625
32. Maedler K, Sergeev P, Ris F, et al: Glucose-induced beta cell production of IL-1beta contributes to glucotoxicity in human pancreatic islets. J Clin Invest 2002; 110:851–860
33. Yu WK, Li WQ, Li N, et al: Influence of acute hyperglycemia in human sepsis on inflammatory cytokine and counterregulatory hormone concentrations. World J Gastroenterol 2003; 9:1824–1827
34. Yi J, Warunek D, Craft D: Degradation and stabilization of peptide hormones in human blood specimens. PLoS One 2015; 10:e0134427
35. Meduri GU, Headley S, Kohler G, et al: Persistent elevation of inflammatory cytokines predicts a poor outcome in ARDS. Plasma IL-1 beta and IL-6 levels are consistent and efficient predictors of outcome over time. Chest 1995; 107:1062–1073
36. Whitehead AL, Julious SA, Cooper CL, et al: Estimating the sample size for a pilot randomised trial to minimise the overall trial sample size for the external pilot and main trial for a continuous outcome variable. Stat Methods Med Res 2016; 25:1057–1073
37. Ritz C: Statistical analysis of continuous outcomes from parallel-arm randomized controlled trials in nutrition-a tutorial. Eur J Clin Nutr 2021; 75:160–171
38. Van Breukelen GJ: ANCOVA versus change from baseline: More power in randomized studies, more bias in nonrandomized studies [corrected]. J Clin Epidemiol 2006; 59:920–925
39. Simes RJ: An improved Bonferroni procedure for multiple tests of significance. Biometrika 1986; 73:751–754
40. Kitsios GD, Yang L, Manatakis DV, et al: Host-response subphenotypes offer prognostic enrichment in patients with or at risk for acute respiratory distress syndrome. Crit Care Med 2019; 47:1724–1734
41. Deane AM, Chapman MJ, Fraser RJ, et al: The effect of exogenous glucagon-like peptide-1 on the glycaemic response to small intestinal nutrient in the critically ill: A randomised double-blind placebo-controlled cross over study. Crit Care 2009; 13:R67
42. Osuchowski MF, Remick DG, Lederer JA, et al: Abandon the mouse research ship? Not just yet! Shock 2014; 41:463–475
43. Guillon A, Preau S, Aboab J, et al; Translational Research Committee of the French Intensive Care Society (Société de Réanimation de Langue Française): Preclinical septic shock research: Why we need an animal ICU. Ann Intensive Care 2019; 9:66
44. Seymour CW, Kennedy JN, Wang S, et al: Derivation, validation, and potential treatment implications of novel clinical phenotypes for sepsis. JAMA 2019; 321:2003–2017
45. Patel JJ, Kozeniecki M, Peppard WJ, et al: Phase 3 pilot randomized controlled trial comparing early trophic enteral nutrition with “no enteral nutrition” in mechanically ventilated patients with septic shock. JPEN J Parenter Enteral Nutr 2020; 44:866–873
46. Galiatsatos P, Gibson BR, Rabiee A, et al: The glucoregulatory benefits of glucagon-like peptide-1 (7-36) amide infusion during intensive insulin therapy in critically ill surgical patients: A pilot study. Crit Care Med 2014; 42:638–645
47. Plummer MP, Hermanides J, Deane AM: Incretin physiology and pharmacology in the intensive care unit. Crit Care Clin 2019; 35:341–355
48. Deane AM, Summers MJ, Zaknic AV, et al: Exogenous glucagon-like peptide-1 attenuates the glycaemic response to postpyloric nutrient infusion in critically ill patients with type-2 diabetes. Crit Care 2011; 15:R35
49. Arabi Y, Jawdat D, Bouchama A, et al: Permissive underfeeding, cytokine profiles and outcomes in critically ill patients. PLoS One 2019; 14:e0209669
50. Bastarache JA, Ware LB, Girard TD, et al: Markers of inflammation and coagulation may be modulated by enteral feeding strategy. JPEN J Parenter Enteral Nutr 2012; 36:732–740
51. Englert JA, Rogers AJ: Metabolism, metabolomics, and nutritional support of patients with sepsis. Clin Chest Med 2016; 37:321–331
Shah et al. Critical Care Explorations