Array
(
[NAME] => Патофизиология, диагностика и лечение сепсис-ассоциированного диссеминированного внутрисосудистого свертывания крови
[~NAME] => Патофизиология, диагностика и лечение сепсис-ассоциированного диссеминированного внутрисосудистого свертывания крови
[PREVIEW_PICTURE] => Array
(
[ID] => 5761
[TIMESTAMP_X] => 11.11.2024 13:53:29
[MODULE_ID] => iblock
[HEIGHT] => 4000
[WIDTH] => 6000
[FILE_SIZE] => 8575740
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/edc/zulasr7sxzezl257yf7ves06do1f0juq
[FILE_NAME] => representation-microorganisms-concept.jpg
[ORIGINAL_NAME] => representation-microorganisms-concept.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => bb22f227f2afc09963eac61fadd2c8f1
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/edc/zulasr7sxzezl257yf7ves06do1f0juq/representation-microorganisms-concept.jpg
[UNSAFE_SRC] => /upload/iblock/edc/zulasr7sxzezl257yf7ves06do1f0juq/representation-microorganisms-concept.jpg
[SAFE_SRC] => /upload/iblock/edc/zulasr7sxzezl257yf7ves06do1f0juq/representation-microorganisms-concept.jpg
[ALT] => Патофизиология, диагностика и лечение сепсис-ассоциированного диссеминированного внутрисосудистого свертывания крови
[TITLE] => Патофизиология, диагностика и лечение сепсис-ассоциированного диссеминированного внутрисосудистого свертывания крови
)
[~PREVIEW_PICTURE] => 5761
[DETAIL_TEXT] => Journal of Intensive Care (2023) 11:24 doi.org/10.1186/s40560-023-00672-5
The pathophysiology, diagnosis, and management of sepsis‑associated disseminated intravascular coagulation
Toshiaki Iba, Julie Helms, Jean Marie Connors and Jerrold H. Levy
Аннотация
Международное общество по тромбозу и гемостазу (ISTH) опубликовало диагностические критерии явного диссеминированного внутрисосудистого свертывания (ДВС) в 2001 году. С тех пор ДВС-синдром понимается как конечная стадия коагулопатии потребления, а не терапевтическая цель. Однако ДВС-синдром — это не просто декомпенсированное нарушение коагуляции, но также включает ранние стадии с системной активацией коагуляции. Таким образом, ISTH недавно опубликовало критерии коагулопатии, вызванной сепсисом (SIC), которые позволяют диагностировать компенсированную фазу коагулопатии с помощью легкодоступных биомаркеров.
ДВС-синдром - это лабораторный диагноз, обусловленный различными критическими состояниями, при этом сепсис является наиболее распространенным заболеванием, сопровождающимся развитием ДВС-синдрома.
Патофизиология ДВС-синдрома, связанного с сепсисом, многофакторна, и в дополнение к активации коагуляции с подавленным фибринолизом, множественные воспалительные реакции инициируются активированными лейкоцитами, тромбоцитами и сосудистыми эндотелиальными клетками как часть тромбовоспаления. Хотя ISTH установил явные диагностические критерии ДВС для диагностики его поздней стадии, для потенциальных терапевтических соображений требовались дополнительные критерии, которые могут обнаружить более раннюю стадию ДВС. Соответственно, ISTH ввел критерии SIC в 2019 году, которые просты в использовании и требуют только количества тромбоцитов, протромбинового времени, международного нормализованного отношения и оценки по шкале SOFA. Шкала SIC может использоваться для оценки тяжести заболевания и определения сроков потенциальных терапевтических вмешательств. Одним из основных недостатков лечения ДВС-синдрома, связанного с сепсисом, является отсутствие конкретных терапевтических подходов, выходящих за рамки лечения основной инфекции. Клинические испытания на сегодняшний день не увенчались успехом, поскольку включали пациентов, не страдающих коагулопатией. Тем не менее, в дополнение к контролю инфекции, антикоагулянтная терапия будет выбором при ДВС-синдроме, связанном с сепсисом. Поэтому эффективность гепарина, антитромбина и рекомбинантного тромбомодулина должна быть доказана в будущих клинических исследованиях.
Необходимо разработать новую терапевтическую стратегию против ДВС-синдрома, связанного с сепсисом, чтобы улучшить результаты. Следовательно, мы рекомендуем скрининг и мониторинг ДВС-синдрома с использованием системы оценок SIC.
Ключевые слова: Сепсис, Диссеминированное внутрисосудистое свертывание, Коагулопатия, Эндотелиальная клетка, Антитромбин, Тромбомодулин
Введение
Гемостаз - фундаментальный механизм защиты хозяина от различных патофизиологических нарушений, клинически проявляется в виде макро- и микротромбоза при острых травмах и у пациентов в критическом состоянии. Хотя гемостатический ответ полезен в некоторых условиях, избыточное тромбовоспаление
также вызывает нарушение кровообращения в тканях и вызывает последующую дисфункцию органов [1]. Системная гиперкоагуляция с коагулопатией потребления или без нее часто возникает после серьезного повреждения тканей, и на основании лабораторных диагностических критериев ациентам клинически ставится диагноз ДВС [2]. Патофизиология, фенотипическое проявление и методы лечения ДВС-синдрома значительно различаются в зависимости от основного его вызывающего заболевания [3, 4].
Однако сепсис является наиболее частой и опасной для жизни причиной ДВС-синдрома и обычно проявляется как тромботический тип ДВС-синдрома [5, 6]. Этот тип ДВС-синдрома часто осложняется дисфункцией органов, при этом геморрагические события происходят реже [7]. Состояние коагуляции динамически изменяется в зависимости от прогрессирования основного заболевания. ДВС-синдром, связанный с сепсисом, является динамическим состоянием, которое начинается с нарушения коагуляции, может перейти в коагулопатию, индуцированную сепсисом (SIC), и, наконец, в декомпенсированное нарушение коагуляции (явный ДВС-синдром) (Fig. 1).
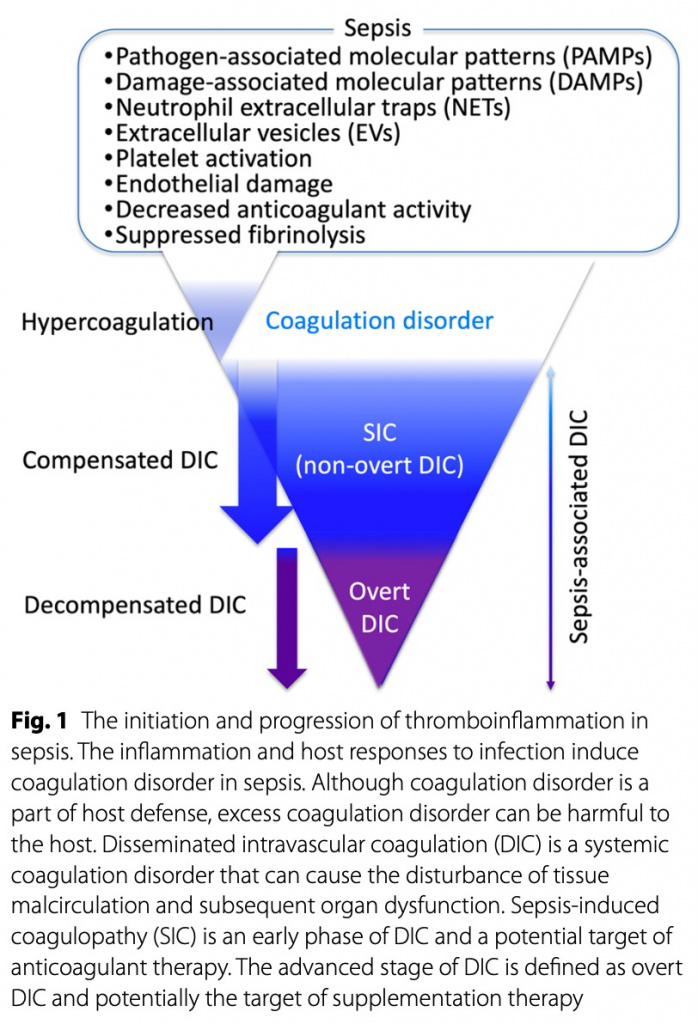
Использование антикоагулянтов предполагается при компенсированном ДВС-синдроме, а декомпенсированная стадия может потребовать дополнительных методов тарапии [8, 9]. Последние достижения в лечении ДВС-синдрома, связанного с сепсисом, включают разработку ранних диагностических критериев на основе легкодоступной клинической информации и назначение потенциально эффективных антикоагулянтов [4, 10]. В этом обзоре основное внимание будет уделено достижениям в диагностике и лечении ДВС-синдрома, связанного с сепсисом, а также будущим перспективам.
Патофизиология ДВС-синдрома, связанного с сепсисом
Моноциты/макрофаги являются первой линией реагирования и фагоцитируют патогены, обнаруживая бактерии путем распознавания специфических молекулярных паттернов и вызывая провоспалительные и прокоагулянтные реакции для их захвата и локализации [11]. В качестве паттерн-распознающих рецепторов моноциты/макрофаги экспрессируют Toll-подобные рецепторы (TLR), Fcγ-рецепторы и G-белок-связанные рецепторы, которые распознают патоген-ассоциированные молекулярные паттерны (PAMPs), впоследствии интегрируя врожденную иммунную систему, а также систему коагуляции [12]. TLR не только реагируют на PAMP, но и передают сигналы молекулярных паттернов, ассоциированных с повреждением (DAMP), тем самым инициируя порочный цикл воспаления и коагуляции [13].
После последующей многоэтапной передачи сигнала моноциты/макрофаги продуцируют провоспалительные цитокины и хемокины, которые активируют нейтрофилы и повышают экспрессию тканевого фактора (TF) и фосфатидилсерина (PS) на клеточной мембране [14]. TF и PS инициируют внешние и внутренние каскады коагуляции и способствуют протромботическим реакциям.
Активированные нейтрофилы уничтожают патогены с помощью протеаз, реактивных форм кислорода, высвобождая внеклеточные ловушки нейтрофилов (NETs) и способствуя дальнейшему распространению воспаления с помощью механизмов гибели клеток [15]. Пироптоз, некроптоз, NETosis и некроз являются репрезентативными механизмами клеточной смерти, которые усиливают воспаление и коагуляцию путем высвобождения DAMPs и других цитотоксических веществ [16].
Тромбоциты также участвуют в защите хозяина, способствуя образованию тромба посредством экспрессии молекул адгезии, высвобождая компоненты гранул, такие как тромбоцитарный фактор 4 (PF4), фактор фон Виллебранда (VWF) [17] и прокоагулянтные микровезикулы [18]. Эти реакции приводят к образованию внутрисосудистых микротромбов (иммунотромбозу) для защиты хозяина от инфекции (Fig. 2). Среди факторов коагуляции тромбин является критическим медиатором, который регулирует воспаление и коагуляцию [19]. Моноциты, нейтрофилы, тромбоциты и эндотелиальные клетки также экспрессируют протеазно-активируемый рецептор-1 (PAR-1), а тромбин усиливает провоспалительные и прокоагулянтные реакции, связываясь с PAR-1 [19, 20].
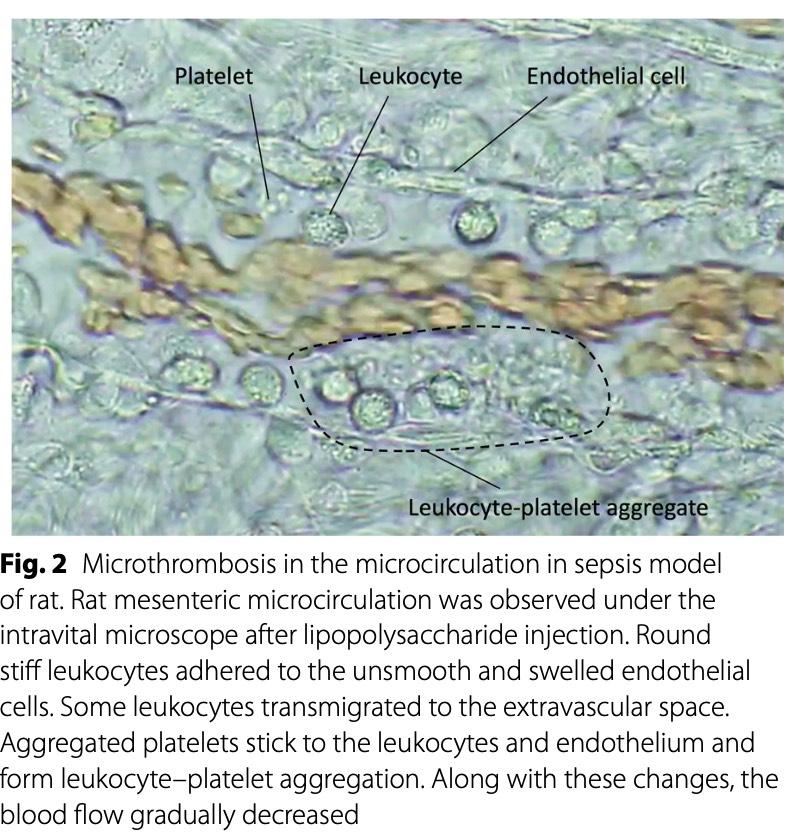
После острой воспалительной реакции, вызванной сепсисом, эндотелиальные клетки сосудов теряют свои антитромботические свойства под воздействием факторов, включающих снижение выработки оксида азота/простагландина I2 и разрушение гликокаликса.
Тромбомодулин подвергается протеолитическому расщеплению и высвобождается с поверхности эндотелия. Кроме того, повышается выработка ингибитора активатора плазминогена 1 (PAI-1), и подавление фибринолиза становится очевидным. Это подавление фибринолиза является критической особенностью нарушения коагуляции при сепсисе (фибринолитическое отключение). Поврежденные эндотелиальные клетки высвобождают тромбогенные молекулы, включая VWF и молекулы адгезии, и стимулируют адгезию и агрегацию тромбоцитов [21]. Кроме того, физиологические антикоагулянтные факторы, такие как антитромбин и протеин С, подвергаются экстравазации за счет повышенной проницаемости сосудов [22]. Эти события способствуют распространенному образованию микротромбов при сепсисе (рис. 3).
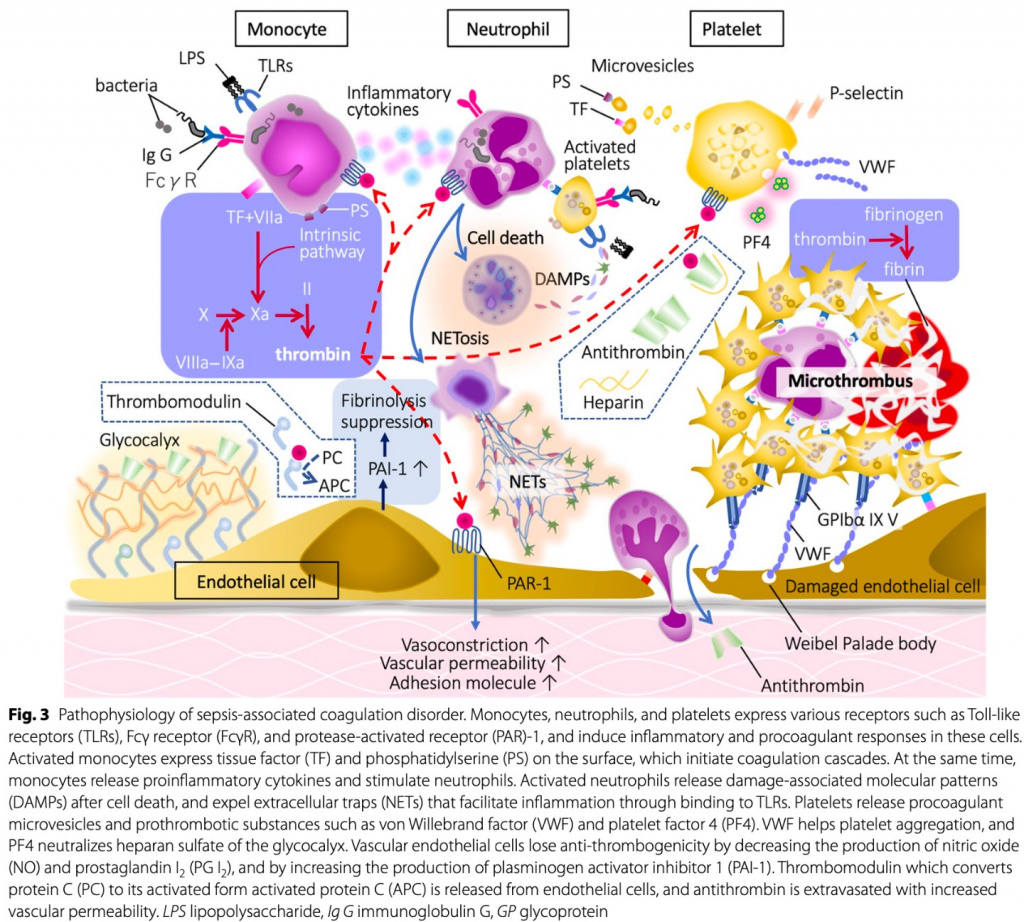
It has not been well-known, but the ISTH has also defined non-overt DIC diagnostic criteria determined by sensitive and specific molecular markers that include antithrombin, protein C, or thrombin–antithrombin (TAT) complexes [23].
Диагностика ДВС-синдрома, связанного с сепсисом
ДВС-синдром определяется как системная активация коагуляции, а не как коагулопатия потребления [23], но многие врачи считают ДВС-синдром декомпенсированным нарушением коагуляции, возможно, из-за определения явных критериев ДВС Международным обществом по тромбозу и гемостазу (ISTH) в 2001 году, которое определяется как тромбоцитопения, значительное удлинение протромбинового времени (ПТВ), умеренное или значительное повышение уровня маркеров, связанных с фибрином, и/или снижение уровня фибриногена. До сих пор не было общеизвестным, но ISTH также определил критерии диагностики скрытого ДВС, определяемые чувствительными и специфическими молекулярными маркерами, включающими антитромбин, протеин С или комплексы тромбин-антитромбин (ТАТ) [23]. Однако у многих пациентов развился явный ДВС-синдром независимо от неявного ДВС-синдрома. Кроме того, поскольку молекулярные маркеры не использовались клинически, они не подходили для диагностики неявного ДВС-синдрома. Несмотря на наличие этих классических определений и критериев, для определения потенциальной терапевтической цели потребовалось установление новых диагностических критериев ДВС-синдрома. Japanese Society for Acute Medicine (JAAM) опубликовало свои критерии компенсированного ДВС-синдрома, используя легкодоступные лабораторные тесты и клинические данные в 2006 году [24]. Однако после обновления определения сепсиса до Sepsis-3 [25, 26] критерии ДВС JAAM устарели, поскольку критерии ДВС JAAM включали оценку синдрома системного воспалительного ответа (SIRS). Затем в 2017 году были введены критерии SIC для диагностики раннего начала ДВС-синдрома при сепсисе [27].
Критерии SIC определяются наличием сепсиса (инфекция с органной недостаточностью [увеличение (SOFA)]) и нарушением коагуляции (снижение количества тромбоцитов и увеличение PT-INR) [27] (Table 1). Измерение количества тромбоцитов и PT-INR являются рутинными клиническими тестами, а оценка SOFA представляет собой легко рассчитываемую клиническую оценку, используемую для оценки тяжести сепсиса [28].
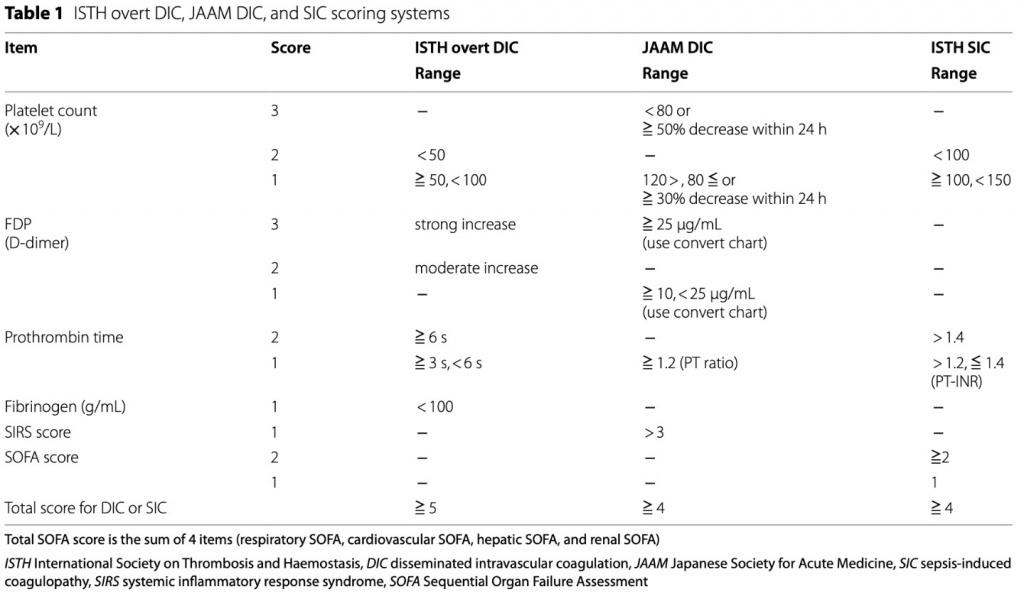
Скрининг на ДВС у пациентов с сепсисом имеет важное значение на основании результатов большого японского исследования, в котором сообщалось об эффективности антикоагулянтной терапии у пациентов с коагулопатией и высоким риском смерти [29].
После дополнительных клинических отчетов [30, 31] диагностические критерии SIC были одобрены Комитетом по научной стандартизации ISTH DIC (SSC) [32, 33]. Клинически значимость критериев SIC заключается в их простоте и способности облегчать выбор времени антикоагулянтной терапии [34].
Критерии JAAM DIC широко используются для диагностики ДВС-синдрома, связанного с сепсисом, в Японии. Чтобы отметить превосходство оценки SIC над оценкой JAAM DIC, мы должны показать лучший эффект лечения, основанный на диагностике SIC, чем на диагностике JAAM DIC. Однако такое исследование еще не проводилось. Но критерии SIC проще, чем критерии JAAM DIC, менее затратны и, следовательно, более подходят для мониторинга. Критерии SIC были специально разработаны для сепсис-ассоциированного ДВС. Аналогичным образом, установление специфики заболевания может позволить нам разработать простые и лучшие критерии; мы считаем, что этот подход должен быть распространен на другие области ДВС-синдрома, т. е. гематологический ДВС-синдром и ДВС-синдром, вызванный раком.
Распространенность и смертность от ДВС-синдрома, связанного с сепсисом
При сепсисе распространенность ДВС-синдрома варьирует в зависимости от целевых когорт и диагностических критериев, но смертность всегда выше у пациентов с ДВС-синдромом по сравнению с пациентами без него. Gando et al. [35] исследовали распространенность и смертность от явного ДВС-синдрома и ДВС-синдрома с JAAM DIC у пациентов с сепсисом (сепсис-1) и сообщили, что они составили 18,1% против 46,8% и 38,1% против 38,4% соответственно. Другое ретроспективное когортное исследование изучало распространенность и смертность от явного ДВС-синдрома, ДВС-синдрома с JAAM DIC и SIC у 1892 пациентов с сепсисом (сепсис-1) и сообщили, что они составили 29,3% и 38,4%, 61,4% и 33,9% и 60,8% и 32,5% соответственно [36]. Данные когорты пациентов с сепсисом-3 из 296 человек показали, что распространенность явного ДВС-синдрома, ДВС-синдрома с измененной шкалой JAAM DIC (оценка SIRS была заменена на активность антитромбина) и SICсоставила 22,6%, 43,2% и 56,1%, а 28-дневная смертность составила 55,2%, 47,7% и 44,0% соответственно [37].
Эти данные свидетельствуют о том, что распространенность ДВС-синдрома различается в зависимости от определений, но смертность от ДВС-синдрома, связанного с сепсисом, превысила 30% независимо от диагностических критериев. Основной целью диагностики ДВС-синдрома является не прогнозирование результатов, а определение сроков начала лечения, поскольку у пациентов с ДВС-синдромом наблюдается более высокая смертность по сравнению с пациентами без ДВС-синдрома [38]. Следует отметить, что недавние исследования подтверждают идею о том, что антикоагулянтная терапия более эффективна для пациентов с коагулопатией/ДВС-синдромом и высокой тяжестью заболевания [38, 39]. Кроме того, оценки JAAM DIC и SICотражают тяжесть заболевания, и была описана связь между оценками и смертностью [24, 27]. Lu et al. [40] оценили эффективность оценки SIC у 9432 пациентов с сепсисом и сообщили, что 28-дневная смертность составила 34% у пациентов с SIC по сравнению с 25% у пациентов без SIC . Они также сообщили, что наличие SIC было независимым фактором риска 28-дневной смертности со скорректированным отношением шансов 1,52 (95% [ДИ]: от 1,39 до 1,67).
Эффективность системы оценки SIC
Полезность диагностических критериев была изучена путем оценки их эффективности для выявления пациентов с высоким риском смерти. Wang et al. [37] сравнили эффективность различных диагностических критериев ДВС, включая SIC, модифицированный JAAM DIC, упрощенный Japanese Society on Thrombosis and Hemostasis ДВС и явные критерии ДВС в прогнозировании 28-дневной смертности и сообщили, что площадь под кривыми (AUC) не различалась среди диагностических критериев (AUC: от 0,730 до 0,763); тем не менее, важно, что SIC является самым простым критерием среди них, а отношение шансов к смерти было самым высоким и составило 5,218 (95% ДИ: от 2,878 до 9,459, P < 0,001).
В качестве скринингового теста, такого как оценка SIC, ожидаемая эффективность заключается в способности отрицать смерть при отрицательном результате SIC.
В этом смысле отрицательная прогностическая ценность для 28-дневной смертности также была самой высокой при SIC и составила 86,9%. Аналогичные результаты были подтверждены в нескольких исследованиях, и сообщалось, что оценка SIC связана с тяжестью заболеваний [40–49]. Основной целью диагностики ДВС было не выявление пациентов с сепсисом с высоким риском смерти, а выявление пациентов, которым может быть полезна антикоагулянтная терапия. Zou et al. [47] ретроспективно оценили 6646 пациентов с сепсисом и сообщили о связи между введением гепарина и более низкой смертностью только у пациентов с SIC (коэффициент риска [HR]: 0,74, 95% ДИ: 0,65–0,85).
Напротив, эта связь не наблюдалась у пациентов без SIC (HR: 0,95, 95% ДИ: 0,64–1,40). Peng et al. [48] также изучили влияние гепарина на пациентов с сепсисом в своем ретроспективном исследовании и пришли к выводу, что пациенты с SIC могут быть хорошими кандидатами на терапию гепарином. В их исследовании у большинства пациентов с явной ДВС была диагностирована сепсисиндуцированная коагулопатия (SIC), а у большинства пациентов с явной ДВС ранее был поставлен диагноз SIC [30]. Таким образом, SIC предшествует явному ДВС, и пациенты переходят от SIC к явному ДВС по мере прогрессирования заболевания.
Одним из ограничений критериев SIC является риск неправильной диагностики заболеваний, имитирующих ДВС-синдром, который может быть немалым, поскольку включены только два биомаркера коагуляции. Например, нелегко дифференцировать тромботические микроангиопатические (ТМА) расстройства, такие как тромботическая тромбоцитопеническая пурпура (ТТP) [49] и атипичный гемолитико-уремический синдром (aHUS ) [50], а также гепарин-индуцированную тромбоцитопению (HIT) от SIC [51]. Для поддержки точной диагностики ISTH DIC SSC предоставляет блок-схему, которая помогает в систематической дифференциальной диагностике [52]. Хотя удлинение PT-INR является незначительным, ТМА- расстройства обычно сопровождаются значительной тромбоцитопенией и достигают достаточных баллов. Уменьшение количества тромбоцитов более выражено, а изменения в ПВ более незначительны при ТТP, aHUS и HIT , а баланс количества тромбоцитов и PTможет быть полезен для дифференциации.
Кроме того, активность антитромбина, биомаркера повреждения эндотелия, значительно снижена при SIC и ДВС [53, 54], но обычно сохраняется при TMA и может быть полезна для дифференциальной диагностики [55, 56]. Известно, что уровень антитромбина снижается на ранней стадии ДВС. Jackson Chornenki et al. [57] сообщили, что количество тромбоцитов и PT-INR в сочетании с активностью антитромбина могут идентифицировать раннюю стадию ДВС у пациентов с сепсисом. Хотя заболеваемость невысока, дифференциальная диагностика этих заболеваний, имитирующих ДВС, имеет решающее значение, поскольку смертность значительно высока при неправильном лечении.
Как нам следует лечить ДВС-синдром, связанный с сепсисом?
Лечение основного заболевания имеет важное значение при ДВС-синдроме, но для ДВС-синдрома, связанного с сепсисом, дополнительное лечение продолжающейся плохой перфузии тканей имеет решающее значение в клиническом ведении. Однако мало доказательств, подтверждающих эффективность антикоагулянтной терапии в дополнение к антибиотикам и контролю источника. Несмотря на исследования нескольких антикоагулянтов в масштабных рандомизированных контролируемых исследованиях (РКИ), ни один из современных антикоагулянтов еще не продемонстрировал эффективности [61,63]. Возможные причины включают изменчивость клинической картины сепсиса [61], но, как ранее было описано, антикоагулянтную терапию следует рассматривать только для пациентов с нарушением коагуляции, оптимальной целью является ДВС-синдром, связанный с сепсисом, с высокой тяжестью заболевания [38, 39] (Fig. 4).
Гепарин
Гепарин обычно используется у пациентов с сепсисом по нескольким причинам. Однако ни одно крупное рандомизированное контролируемое исследование не изучало гепарин отдельно при ДВС-синдроме, связанном с сепсисом. Недавний метаанализ показал, что нефракционированный гепарин может снизить смертность от сепсиса, особенно у пациентов с высокой степенью тяжести [62]. Однако исследуемая популяция не ограничивалась пациентами с коагулопатией/ДВС-синдромом. Другой систематический обзор гепарина при ДВС-синдроме [63] был ограничен включением исследований, в которых три из восьми исследований использовали гепарин в качестве контроля. Хотя гепарин настоятельно рекомендуется для лечения COVID-19 [64], его эффективность при ДВС-синдроме, связанном с сепсисом, до сих пор неясна. РКИ, проведенное в Японии, сравнило эффективность и безопасность рекомбинантного тромбомодулина с гепарином при ДВС-синдроме, связанном с гематологическими злокачественными новообразованиями или инфекциями. В анализе подгрупп были подвергнуты анализу 80 пациентов с ДВС-синдромом, связанным с сепсисом. Результаты показали, что частота разрешения ДВС-синдрома в группе рекомбинантного тромбомодулина и группе гепарина составила 67,5% и 55,6%, а частота 28-дневной смертности составила 21,4% и 31,6% соответственно [65].
Рекомбинантный тромбомодулин
Рекомбинантный тромбомодулин был разработан и одобрен для клинического использования в Японии в 2008 году для лечения ДВС-синдрома [66]. Как было описано ранее, Aikawa et al. [65] провели анализ подгрупп 80 пациентов с ДВС-синдромом, связанным с сепсисом, из исследования фазы 3 [67] и сообщили о лучшей эффективности рекомбинантного тромбомодулина. Последующее исследование SCARLET, о котором сообщалось в 2019 году, включало пациентов с сепсисом с коагулопатией и дисфункцией органов (сердечно-сосудистая и/или дыхательная недостаточность, количество тромбоцитов от 30 до 150 × 109/л или > 30%-ное снижение в течение 24 ч и PT-INR > 1,4 [оценка SIC > 4]) [68]. Несмотря на то, что разница не была статистически значимой в intention-to-treat популяции, наблюдалась тенденция к улучшению 28-дневной выживаемости в подгруппе, которая соответствовала исходным критериям (разница: 5,40%, 95% ДИ: от -1,68% до 12,48%).
В этом исследовании была отмечена значительная разница в различных межданародных когортах, и post hocанализ выявил абсолютное снижение риска на 8,3% во французской популяции по сравнению с 1,1% в остальном мире; считалось, что больший эффект во французской когорте был обусловлен более высокой частотой устойчивой коагулопатии и более низкой частотой использования гепарина [69]. Примечательно, что все РКИ показали тенденции к лучшим результатам в группе лечения, а метаанализ РКИ показал значительное улучшение показателей смертности [70]. Следовательно, рекомбинантный тромбомодулин рекомендуется для ДВС-синдрома, связанного с сепсисом, в руководствах по сепсису в Японии [71].
Антитромбин
Крупнейшее РКИ, в котором изучалось действие антитромбина, было проведено при тяжелом сепсисе, но не у пациентов с ДВС-синдромом, связанным с сепсисом [58]. Однако Kienast et al. [72] провели постфактум-анализ у 563 пациентов (группа антитромбина: n = 286 и группа плацебо: n = 277), у которых был ДВС-синдром и которые не получали сопутствующий гепарин, и сообщили об абсолютном снижении 28-дневной смертности на 14,6% в группе антитромбина (P = 0,02), тогда как у пациентов без ДВС-синдрома такого эффекта не наблюдалось. Антитромбин используется для лечения ДВС-синдрома в Японии, и это включено в рекомендации по сепсису [71]. Японские рекомендации основаны на данных Tagami et al. [73], которые провели анализ с сопоставлением показателей предрасположенности, используя общенациональную базу данных, состоящую из 9075 пациентов с пневмонией с ДВС-синдромом, связанным с сепсисом (антитромбин: n = 2663 и контроль: n = 6412), и создали сопоставленную когорту из 2194 пар. Результат показал разницу в смертности между группами (антитромбин: 40,6% против контроля: 44,2%, P = 0,02). Кроме того, множественный логистический регрессионный анализ показал связь между использованием антитромбина и 28-дневной смертностью ([OR] 0,85, 95% CI: 0,75–0,97). В дополнение к продукту, полученному из плазмы, в Японии в 2015 году был одобрен рекомбинантный антитромбин (антитромбин-γ), и в небольших исследованиях сообщалось о более высоких показателях с точки зрения улучшения показателей ДВС и SOFA [74, 75]. В соответствии с этими отчетами, японские руководства по сепсису рекомендуют использовать антитромбин и рекомбинантный тромбомодулин для ДВС, связанного с сепсисом [71]. Недавно сообщалось о потенциально полезном эффекте комбинированной терапии антитромбина с рекомбинантным тромбомодулином, особенно в тяжелых случаях [76]. Эффект этой комбинированной терапии следует изучить в будущем исследовании.
Перспективы на будущее
Смертность, связанная с сепсисом, а также с ДВС-синдромом, связанным с сепсисом, остается высокой и превышает 30%. Накопленные данные свидетельствуют о том, что антикоагулянтная терапия эффективна для пациентов в критическом состоянии с нарушениями коагуляции. Сепсис — это системная реакция, которая вызывает острую полиорганную дисфункцию и поддается лечению антибиотиками и контролем источника на ранней стадии. Однако состояние ухудшается, когда течение заболевания осложняется нарушением коагуляции. Поэтому важно регулярно проводить скрининг и мониторинг изменений коагуляции у пациентов с сепсисом с помощью легкодоступных методов. Этот обзор фокусируется на ДВС-синдроме, связанном с сепсисом, а не охватывает все типы ДВС.
Система оценки SIC специально разработана для диагностики ДВС-синдрома, связанного с сепсисом, на ранней стадии, проста и удобна для расчета, что делает ее полезной для целей скрининга и мониторинга ДВС-синдрома у больных сепсисом. Такой скрининг и мониторинг проводились в Японии с использованием критериев JAAM ДВС. Однако, поскольку расчет оценки SIRS больше не использовался при диагностике сепсиса, необходимо обновление. SIC был введен в Японии Japanese Sepsis Guideline Working Group в 2019 году в качестве альтернативного диагностического критерия [77], и он будет включен в следующую версию руководства по сепсису. Что касается лечения SIC, то гепарины, антитромбин и рекомбинантный тромбомодулин являются текущим выбором сепсис- ассоциированного ДВС-синдрома.
Since activation in coagulation is a part of host defense mechanisms, the selection of targets and the choice of agents are also important. Since anticoagulation has increasingly attracted attention [4, 8, 10], it is necessary to set up international collaborative studies that adopt proper endpoints.
Пока ни один из них не имеет надежных доказательств эффективности. Существуют некоторые препятствия для разработки клинических испытаний, которые доказывают эффективность этих антикоагулянтов. Во-первых, конечная точка была установлена как разница в смертности; однако существует множество факторов, которые влияют на исход для пациента, и более сложная конечная точка, которая отражает эффект лечения антикоагулянтами, является оправданной. Во-вторых, определение оптимальной дозы, продолжительности и прекращения лечения не является простым.
Поскольку активация свертывания крови является частью защитных механизмов хозяина, выбор мишеней и выбор агентов также важен. Поскольку антикоагуляция привлекает все больше внимания [4, 8, 10], необходимо организовать международные совместные исследования, в которых будут приняты соответствующие конечные точки.
Заключение
ДВС-синдром является распространенным осложнением при сепсисе. Хотя смертность от ДВС-синдрома, связанного с сепсисом, высока, раннее выявление и своевременное вмешательство важны для улучшения результатов. ДВС-синдром является лабораторным диагнозом, и ISTH DIC SSC ввел критерии SIC, которые просты, легко поддаются расчету и подходят для повторной оценки для выявления пациентов с сепсисом с риском прогрессирования до явного ДВС-синдрома и смерти. Несмотря на достижения в исследованиях патофизиологии, терапевтические средства для улучшения результатов сепсиса, выходящие за рамки антимикробного лечения, никогда не рекомендовались в большинстве стран. Хотя рекомбинантный тромбомодулин и антитромбин одобрены японскими руководствами по сепсису, необходимы дальнейшие перспективные международные совместные исследования.
References
1. Lelubre C, Vincent JL. Mechanisms and treatment of organ failure in sepsis. Nat Rev Nephrol. 2018;14(7):417–27.
2. Squizzato A, Gallo A, Levi M, Iba T, Levy JH, Erez O, Ten Cate H, Solh Z, Gando S, Vicente V, Di Nisio M. Underlying disorders of disseminated intravascular coagulation: communication from the ISTH SSC Subcommittees on Disseminated Intravascular Coagulation and Perioperative and Critical Care Thrombosis and Hemostasis. J Thromb Haemost.2020;18(9):2400–7.
3. Levi M, Sivapalaratnam S. Disseminated intravascular coagulation: an update on pathogenesis and diagnosis. Expert Rev Hematol. 2018;11(8):663–72.
4. Iba T, Levi M, Thachil J, Levy JH. Disseminated intravascular coagulation:the past, present, and future considerations. Semin Thromb Hemost.2022;48(8):978–87.
5. Yamakawa K, Ohbe H, Taniguchi K, Matsui H, Fushimi K, Yasunaga H. Time trends of the outcomes and treatment options for disseminated intravascular coagulation: a nationwide observational study in Japan. JMA J.2020;3(4):313–20.
6. Adelborg K, Larsen JB, Hvas AM. Disseminated intravascular coagulation: epidemiology, biomarkers, and management. Br J Haematol.2021;192(5):803–18.
7. Chang JC. Disseminated intravascular coagulation: new identity as endotheliopathy-associated vascular microthrombotic disease based on in vivo hemostasis and endothelial molecular pathogenesis. Thromb J. 2020;18:25.
8. Helms J, Iba T, Connors JM, Gando S, Levi M, Meziani F, Levy JH. How to manage coagulopathies in critically ill patients? Int Care Med.2023;49(3):273–90.
9. Scully M, Levi M. How we manage haemostasis during sepsis. Br J Haematol. 2019;185(2):209–18.
10. Iba T, Connors JM, Nagaoka I, Levy JH. Recent advances in the research and management of sepsis-associated DIC. Int J Hematol.2021;113(1):24–33.
11. Futosi K, Fodor S, Mocsai A. Neutrophil cell surface receptors and their intracellular signal transduction pathways. Int Immunopharmacol. 2013;17(3):638–50.
12. Iba T, Levi M, Levy JH. Intracellular communication and immunothrombosis in sepsis. J Thromb Haemost. 2022;20(11):2475–84.
13. Salomao R, Martins PS, Brunialti MK, Fernandes Mda L, Martos LS, Mendes ME, Gomes NE, Rigato O. TLR signaling pathway in patients with sepsis. Shock. 2008;30(Suppl 1):73–7.
14. Gould TJ, Lysov Z, Swystun LL, Dwivedi DJ, Zarychanski R, Fox-Robichaud AE, Liaw PC, Canadian Critical Care Translational Biology Group. Extracellular histones increase tissue factor activity and enhance thrombin generation by human blood monocytes. Shock. 2016;46(6):655–62.
15. Kolaczkowska E, Kubes P. Neutrophil recruitment and function in health and inflammation. Nat Rev Immunol. 2013;13(3):159–75.
16. Perez-Figueroa E, Alvarez-Carrasco P, Ortega E, Maldonado-Bernal C. Neutrophils: many ways to die. Front Immunol. 2021;12: 631821.
17. Assinger A, Schrottmaier WC, Salzmann M, Rayes J. Platelets in sepsis: an update on experimental models and clinical data. Front Immunol.2019;10:1687.
18. Reid VL, Webster NR. Role of microparticles in sepsis. Br J Anaesth. 2012;109(4):503–13.
19. Ma L, Dorling A. The roles of thrombin and protease-activated receptors in inflammation. Semin Immunopathol. 2012;34(1):63–72.
20. Jose RJ, Williams AE, Mercer PF, Sulikowski MG, Brown JS, Chambers RC. Regulation of neutrophilic inflammation by proteinase-activated receptor 1 during bacterial pulmonary infection. J Immunol. 2015;194(12):6024–34.
21. Joffre J, Hellman J, Ince C, Ait-Oufella H. Endothelial responses in sepsis. Am J Respir Crit Care Med. 2020;202(3):361–70.
22. Ito T, Kakuuchi M, Maruyama I. Endotheliopathy in septic conditions: mechanistic insight into intravascular coagulation. Crit Care.2021;25(1):95.
23. Taylor FB Jr, Toh CH, Hoots WK, Wada H, Levi M, Scientific Subcommittee on Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost. 2001;86(5):1327–30.
24. Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K, Mayumi T,Murata A, Ikeda T, Ishikura H, Ueyama M, Ogura H, Kushimoto S, Saitoh D, Endo S, Shimazaki S, Japanese Association for Acute Medicine multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med. 2006;34(3):625–31.
25. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, Bellomo R, Bernard GR, Chiche JD, Coopersmith CM, Hotchkiss RS, Levy MM, Marshall JC, Martin GS, Opal SM, Rubenfeld GD, van der Poll T, Vincent JL, Angus DC. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801–10.
26. Members of the American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference Committee: American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference. Definition for sepsis and organ failure and guidelines for the use innovative therapies in sepsis. Crit Care Med. 1992;20:864–74.
27. Iba T, Nisio MD, Levy JH, Kitamura N, Thachil J. New criteria for sepsisinduced coagulopathy (SIC) following the revised sepsis definition: a retrospective analysis of a nationwide survey. BMJ Open. 2017;7(9): e017046.
28. Zhang Y, Khalid S, Jiang L. Diagnostic and predictive performance of biomarkers in patients with sepsis in an intensive care unit. J Int Med Res.2019;47(1):44–58.
29. Hayakawa M, Ono K. A summary of the Japan septic disseminated intravascular coagulation study. Acute Med Surg. 2018;5(2):123–8.
30. Iba T, Arakawa M, Di Nisio M, Gando S, Anan H, Sato K, Ueki Y, Levy JH, Thachil J. Newly proposed sepsis-induced coagulopathy precedes international society on thrombosis and haemostasis overt-disseminated intravascular coagulation and predicts high mortality. J Intensive Care Med. 2020;35(7):643–9.
31. Iba T, Arakawa M, Levy JH, Yamakawa K, Koami H, Hifumi T, Sato K. Sepsisinduced coagulopathy and Japanese Association for Acute Medicine DIC in coagulopathic patients with decreased antithrombin and treated by antithrombin. Clin Appl Thromb Hemost. 2018;24(7):1020–6.
32. Iba T, Levy JH, Yamakawa K, Thachil J, Warkentin TE, Levi M, Scientific and Standardization Committee on DIC of the International Society on Thrombosis and Haemostasis. Proposal of a two-step process for the diagnosis of sepsis-induced disseminated intravascular coagulation. J Thromb Haemost. 2019;17(8):1265–8.
33. Iba T, Levy JH, Warkentin TE, Thachil J, van der Poll T, Levi M, Scientific and Standardization Committee on DIC, and the Scientific and Standardization Committee on Perioperative and Critical Care of the International Society on Thrombosis and Haemostasis. Diagnosis and management of sepsis-induced coagulopathy and disseminated intravascular coagulation. J Thromb Haemost. 2019;17(11):1989–94.
34. Iba T, Levi M, Thachil J, Helms J, Scarlatescu E, Levy JH. Communication from the SSC of the ISTH on sepsis-induced coagulopathy (SIC) in the management of sepsis. J Thromb Haemost. 2022. https:// doi. org/ 10.1016/j. jtha. 2022. 10. 022.
35. Gando S, Saitoh D, Ogura H, Fujishima S, Mayumi T, Araki T, Ikeda H, Kotani J, Kushimoto S, Miki Y, Shiraishi S, Suzuki K, Suzuki Y, Takeyama N, Takuma K, Tsuruta R, Yamaguchi Y, Yamashita N, Aikawa N, Japanese Association for Acute Medicine Sepsis Registry (JAAMSR) Study Group. A multicenter, prospective validation study of the Japanese Association for Acute Medicine disseminated intravascular coagulation scoring system in patients with severe sepsis. Crit Care. 2013;17:R111.
36. Yamakawa K, Yoshimura J, Ito T, Hayakawa M, Hamasaki T, Fujimi S. External validation of the two newly proposed criteria for assessing coagulopathy in sepsis. Thromb Haemost. 2019;119(2):203–12.
37. Wang B, Zhang B, Shen Y, Li J, Yuan X, Tang N. Validation of two revised,simplified criteria for assessing sepsis-associated disseminated intravascular coagulation in ICU patients with sepsis-3: a retrospective study. Lab Med. 2022. https:// doi. org/ 10. 1093/ labmed/ lmac1 12.
38. Umemura Y, Yamakawa K. Optimal patient selection for anticoagulant therapy in sepsis: an evidence-based proposal from Japan. J Thromb Haemost. 2018;16(3):462–4.
39. Yamakawa K, Gando S, Ogura H, Umemura Y, Kabata D, Shintani A,Shiraishi A, Saitoh D, Fujishima S, Mayumi T, Kushimoto S, Abe T, Shiino Y, Nakada TA, Tarui T, Hifumi T, Otomo Y, Okamoto K, Kotani J, Sakamoto Y, Sasaki J, Shiraishi SI, Takuma K, Tsuruta R, Hagiwara A, Masuno T, Takeyama N, Yamashita N, Ikeda H, Ueyama M, Fujimi S, Japanese Association for
Acute Medicine (JAAM) Focused Outcomes Research in Emergency Care in Acute Respiratory Distress Syndrome, Sepsis Trauma (FORECAST) Study Group. Identifying sepsis populations benefitting from anticoagulant therapy: a prospective cohort study incorporating a restricted cubic spline regression model. Thromb Haemost. 2019;119(11):1740–51.
40. Lu Z, Zhang J, Hong J, Wu J, Liu Y, Xiao W, Hua T, Yang M. Development of a nomogram to predict 28-day mortality of patients with sepsis-induced coagulopathy: an analysis of the MIMIC-III database. Front Med. 2021;8:661710.
41. Fang Y, Lin S, Dou Q, Gui J, Li W, Tan H, Wang Y, Zeng J, Khan A, Wei DQ. Network pharmacology- and molecular simulation-based exploration of therapeutic targets and mechanisms of heparin for the treatment of sepsis/COVID-19. J Biomol Struct Dyn. 2023;20:1–13.
42. Tanaka C, Tagami T, Kudo S, Takehara A, Fukuda R, Nakayama F, Kaneko J, Ishiki Y, Sato S, Kuno M, Unemoto K. Validation of sepsis-induced coagulopathy score in critically ill patients with septic shock: post hoc analysis of a nationwide multicenter observational study in Japan. Int J Hematol. 2021;114(2):164–71.
43. Xiang L, Ren H, Wang Y, Zhang J, Qian J, Li B, An K, Fu L. Clinical value of pediatric sepsis-induced coagulopathy score in diagnosis of sepsisinduced coagulopathy and prognosis in children. J Thromb Haemost. 2021;19(12):2930–7.
44. Hosseini SF, Behnam-Roudsari S, Alavinia G, Emami A, Toghyani A, Moradi S, Zadeh MM, Mohseni S, Shafiee MA. Diagnostic and prognostic value of sepsis-induced coagulopathy and International Society on Thrombosis and Hemostasis scoring systems in COVID-19-associated disseminated intravascular coagulopathy. J Res Med Sci. 2021;26:102.
45. Kapoor M, Panda PK, Saini LK, Bahurupi Y. Disseminated intravascular coagulation score and sepsis-induced coagulopathy score in prediction of COVID-19 severity: a retrospective analysis. Indian J Crit Care Med. 2021;25(12):1357–63.
46. Shinada K, Miike T, Matsuoka A, Miyazaki M, Goto T, Sasaki A, Yamazaki H,Mori K, Nakayama K, Sakurai R, Asahi M, Yoshitake K, Narumi S, Koba M, Koami H, Sakamoto Y. Coagulation influencing liberation from respiratory support in patients with coronavirus disease 2019: a retrospective, observational study. J Nippon Med Sch. 2022. https:// doi. org/ 10. 1272/
jnms. JNMS. 2022_ 89- 506.
47. Zou ZY, Huang JJ, Luan YY, Yang ZJ, Zhou ZP, Zhang JJ, Yao YM, Wu M.Early prophylactic anticoagulation with heparin alleviates mortality in critically ill patients with sepsis: a retrospective analysis from the MIMIC-IV database. Burns Trauma. 2022;10:tkac029.
48. Peng JC, Nie F, Li YJ, Xu QY, Xing SP, Li W, Gao Y. Favorable outcomes of anticoagulation with unfractioned heparin in sepsis-induced coagulopathy: a retrospective analysis of MIMIC-III database. Front Med. 2022;8:773339.
49. Habe K, Wada H, Ito-Habe N, Hatada T, Matsumoto T, Ohishi K, Maruyama K, Imai H, Mizutani H, Nobori T. Plasma ADAMTS13, von Willebrand factor (VWF) and VWF propeptide profiles in patients with DIC and related diseases. Thromb Res. 2012;129(5):598–602.
50. Laurence J, Haller H, Mannucci PM, Nangaku M, Praga M, Rodriguez de Cordoba S. Atypical hemolytic uremic syndrome (aHUS): essential aspects of an accurate diagnosis. Clin Adv Hematol Oncol. 2016;14(Suppl 11):2–15.
51. Greinacher A, Selleng K, Warkentin TE. Autoimmune heparin-induced thrombocytopenia. J Thromb Haemost. 2017;15(11):2099–114.
52. Iba T, Levy JH, Wada H, Thachil J, Warkentin TE, Levi M, Subcommittee on Disseminated Intravascular Coagulation. Differential diagnoses for sepsisinduced disseminated intravascular coagulation: communication from the SSC of the ISTH. J Thromb Haemost. 2019;17(2):415–9.
53. Iba T, Levy JH, Thachil J, Susen S, Levi M, Scarlatescu E. Communication from the SSC of the ISTH on vascular endothelium-related biomarkers in DIC. J Thromb Haemost. 2022 in press.
54. Matsubara T, Yamakawa K, Umemura Y, Gando S, Ogura H, Shiraishi A, Kushimoto S, Abe T, Tarui T, Hagiwara A, Otomo Y, Fujimi S, Japanese Association for Acute Medicine (JAAM) Focused Outcomes Research in Emergency Care in Acute Respiratory Distress Syndrome, Sepsis and Trauma (FORECAST) Group. Significance of plasma fibrinogen level and antithrombin activity in sepsis: a multicenter cohort study using a cubic spline model. Thromb Res. 2019;181:17–23.
55. Sakai K, Wada H, Nakatsuka Y, Kubo M, Hayakawa M, Matsumoto M. Characteristics behaviors of coagulation and fibrinolysis markers in acquired thrombotic thrombocytopenic purpura. J Intensive Care Med. 2021;36(4):436–42.
56. Sakurai S, Kato H, Yoshida Y, Sugawara Y, Fujisawa M, Yasumoto A, Matsumoto M, Fujimura Y, Yatomi Y, Nangaku M. Profiles of coagulation and fibrinolysis activation-associated molecular markers of atypical hemolytic uremic syndrome in the acute phase. J Atheroscler Thromb. 2020;27(4):353–62.
57. Jackson Chornenki NL, Dwivedi DJ, Kwong AC, Zamir N, Fox-Robichaud AE, Liaw PC, Canadian Critical Care Translational Biology Group. Identification of hemostatic markers that define the pre-DIC state: a multi-center observational study. J Thromb Haemost. 2020;18(10):2524–31.
58. Warren BL, Eid A, Singer P, Pillay SS, Carl P, Novak I, Chalupa P, Atherstone A, Penzes I, Kubler A, Knaub S, Keinecke HO, Heinrichs H, Schindel F, Juers M, Bone RC, Opal SM, KyberSept Trial Study Group. Caring for the critically ill patient High-dose antithrombin III in severe sepsis: a randomized controlled trial (Erratum in: JAMA 2002;287(2):192.). JAMA.2001;286(15):1869–78. https:// doi. org/ 10. 1001/ jama. 286. 15. 1869.
59. Ranieri VM, Thompson BT, Barie PS, Dhainaut JF, Douglas IS, Finfer S, Gardlund B, Marshall JC, Rhodes A, Artigas A, Payen D, Tenhunen J, Al-Khalidi HR, Thompson V, Janes J, Macias WL, Vangerow B, Williams MD, PROWESS-SHOCK Study Group. Drotrecogin alfa (activated) in adults with septic shock. N Engl J Med. 2012;366(22):2055–64.
60. Abraham E, Reinhart K, Opal S, Demeyer I, Doig C, Rodriguez AL, Beale R, Svoboda P, Laterre PF, Simon S, Light B, Spapen H, Stone J, Seibert A, Peckelsen C, De Deyne C, Postier R, Pettila V, Sprung CL, Artigas A, Percell SR, Shu V, Zwingelstein C, Tobias J, Poole L, Stolzenbach JC, Creasey AA, OPTIMIST Trial Study Group. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA. 2003;290(2):238–47.
61. Seymour CW, Kennedy JN, Wang S, Chang CH, Elliott CF, Xu Z, et al. Derivation, validation, and potential treatment implications of novel clinical phenotypes for sepsis. JAMA. 2019;321:2003–17.
62. Fu S, Yu S, Wang L, Ma X, Li X. Unfractionated heparin improves the clinical efficacy in adult sepsis patients: a systematic review and metaanalysis. BMC Anesthesiol. 2022;22(1):28.
63. Omidkhoda N, Abedi F, Ghavami V, Rahimi H, Samadi S, Arasteh O, Mohammadpour AH. The effect of heparin and its preparations on disseminated intravascular coagulation mortality and hospitalization: a systematic review. Int J Clin Pract. 2022;2022:2226761.
64. Schulman S, Sholzberg M, Spyropoulos AC, Zarychanski R, Resnick HE, Bradbury CA, Broxmeyer L, Connors JM, Falanga A, Iba T, Kaatz S, Levy JH, Middeldorp S, Minichiello T, Ramacciotti E, Samama CM, Thachil J, International Society on Thrombosis and Haemostasis. ISTH guidelines for antithrombotic treatment in COVID-19. J Thromb Haemost.2022;20(10):2214–25.
65. Aikawa N, Shimazaki S, Yamamoto Y, Saito H, Maruyama I, Ohno R, Hirayama A, Aoki Y, Aoki N. Thrombomodulin alfa in the treatment of infectious patients complicated by disseminated intravascular coagulation: subanalysis from the phase 3 trial. Shock. 2011;35(4):349–54.
66. Murata A, Okamoto K, Mayumi T, Muramatsu K, Matsuda S. Recent change in treatment of disseminated intravascular coagulation in Japan: an epidemiological study based on a National Administrative Database.Clin Appl Thromb Hemost. 2016;22(1):21–7.
67. Saito H, Maruyama I, Shimazaki S, Yamamoto Y, Aikawa N, Ohno R, Hirayama A, Matsuda T, Asakura H, Nakashima M, Aoki N. Efficacy and safety of recombinant human soluble thrombomodulin (ART-123) in disseminated intravascular coagulation: results of a phase III, randomized, double-blind clinical trial. J Thromb Haemost. 2007;5(1):31–41.
68. Vincent JL, Francois B, Zabolotskikh I, Daga MK, Lascarrou JB, Kirov MY, Pettila V, Wittebole X, Meziani F, Mercier E, Lobo SM, Barie PS, Crowther M, Esmon CT, Fareed J, Gando S, Gorelick KJ, Levi M, Mira JP, Opal SM, Parrillo J, Russell JA, Saito H, Tsuruta K, Sakai T, Fineberg D, SCARLET Trial Group. Effect of a recombinant human soluble thrombomodulin on mortality in patients with sepsis-associated coagulopathy: the SCARLET Randomized Clinical Trial. JAMA. 2019;321(20):1993–2002.
69. Francois B, Fiancette M, Helms J, Mercier E, Lascarrou JB, Kayanoki T, Tanaka K, Fineberg D, Vincent JL, Wittebole X. Efficacy and safety of human soluble thrombomodulin (ART-123) for treatment of patients in Fra ce with sepsis-associated coagulopathy: post hoc analysis of SCARLET. Ann Intensive Care. 2021;11(1):53.
70. Yamakawa K, Levy JH, Iba T. Recombinant human soluble thrombomodulin in patients with sepsis-associated coagulopathy (SCARLET): an updated meta-analysis. Crit Care. 2019;23(1):302.
71. Egi M, Ogura H, Yatabe T, Atagi K, Inoue S, Iba T, Kakihana Y, Kawasaki T, Kushimoto S, Kuroda Y, Kotani J, Shime N, Taniguchi T, Tsuruta R, Doi K, Doi M, Nakada TA, Nakane M, Fujishima S, Hosokawa N, Masuda Y, Matsushima A, Matsuda N, Yamakawa K, Hara Y, Sakuraya M, Ohshimo S, Aoki Y, Inada M, Umemura Y, Kawai Y, Kondo Y, Saito H, Taito S, Takeda C, Terayama T, Tohira H, Hashimoto H, Hayashida K, Hifumi T, Hirose T, Fukuda T, Fujii T, Miura S, Yasuda H, Abe T, Andoh K, Iida Y, Ishihara T, Ide K, Ito K, Ito Y, Inata Y, Utsunomiya A, Unoki T, Endo K, Ouchi A, Ozaki M, Ono S, Katsura M, Kawaguchi A, Kawamura Y, Kudo D, Kubo K, Kurahashi K, Sakuramoto H, Shimoyama A, Suzuki T, Sekine S, Sekino M, Takahashi N, Takahashi S, Takahashi H, Tagami T, Tajima G, Tatsumi H, Tani M, Tsuchiya A, Tsutsumi Y, Naito T, Nagae M, Nagasawa I, Nakamura K, Nishimura T, Nunomiya S, Norisue Y, Hashimoto S, Hasegawa D, Hatakeyama J, Hara N, Higashibeppu N, Furushima N, Furusono H, Matsuishi Y, Matsuyama T, Minematsu Y, Miyashita R, Miyatake Y, Moriyasu M, Yamada T, Yamada H, Yamamoto R, Yoshida T, Yoshida Y, Yoshimura J, Yotsumoto R, Yonekura H, Wada T, Watanabe E, Aoki M, Asai H, Abe T, Igarashi Y, Iguchi N, Ishikawa M, Ishimaru G, Isokawa S, Itakura R, Imahase H, Imura H, Irinoda T, Uehara K, Ushio N, Umegaki T, Egawa Y, Enomoto Y, Ota K, Ohchi Y, Ohno T, Ohbe H, Oka K, Okada N, Okada Y, Okano H, Okamoto J, Okuda H, Ogura T, Onodera Y, Oyama Y, Kainuma M, Kako E, Kashiura M, Kato H, Kanaya A,
Kaneko T, Kanehata K, Kano KI, Kawano H, Kikutani K, Kikuchi H, Kido T, Kimura S, Koami H, Kobashi D, Saiki I, Sakai M, Sakamoto A, Sato T, Shiga Y, Shimoto M, Shimoyama S, Shoko T, Sugawara Y, Sugita A, Suzuki S,Suzuki Y, Suhara T, Sonota K, Takauji S, Takashima K, Takahashi S, Takahashi Y, Takeshita J, Tanaka Y, Tampo A, Tsunoyama T, Tetsuhara K, Tokunaga K, Tomioka Y, Tomita K, Tominaga N, Toyosaki M, Toyoda Y, Naito H, Nagata I,
Nagato T, Nakamura Y, Nakamori Y, Nahara I, Naraba H, Narita C, Nishioka N, Nishimura T, Nishiyama K, Nomura T, Haga T, Hagiwara Y, Hashimoto K, Hatachi T, Hamasaki T, Hayashi T, Hayashi M, Hayamizu A, Haraguchi G, Hirano Y, Fujii R, Fujita M, Fujimura N, Funakoshi H, Horiguchi M, Maki J, Masunaga N, Matsumura Y, Mayumi T, Minami K, Miyazaki Y, Miyamoto
K, Murata T, Yanai M, Yano T, Yamada K, Yamada N, Yamamoto T, Yoshihiro S, Tanaka H, Nishida O. The Japanese Clinical Practice Guidelines for Management of Sepsis and Septic Shock 2020 (J-SSCG 2020). Acute Med Surg. 2021;8(1): e659.
72. Kienast J, Juers M, Wiedermann CJ, Hoffmann JN, Ostermann H, Strauss R, Keinecke HO, Warren BL, Opal SM, KyberSept investigators. Treatment effects of high-dose antithrombin without concomitant heparin in patients with severe sepsis with or without disseminated intravascular coagulation. J Thromb Haemost. 2006;4(1):90–7.
73. Tagami T. Antithrombin concentrate use in sepsis-associated disseminated intravascular coagulation: re-evaluation of a “pendulum effect” drug using a nationwide database. J Thromb Haemost. 2018;16(3):458–61.
74. Kuroda H, Masuda Y. Comparison of protective effects of recombinant antithrombin gamma and plasma-derived antithrombin on sepsisinduced disseminated intravascular coagulation and multiple organ failure. Clin Appl Thromb Hemost. 2020. https:// doi. org/ 10. 1177/ 10760
29620 981630.
75. Endo S, Shimazaki R, Antithrombin Gamma Study Group. An open-label,randomized, phase 3 study of the efficacy and safety of antithrombin gamma in patients with sepsis-induced disseminated intravascular coagulation syndrome. J Intensive Care. 2018;6:75.
76. Murao A, Kato T, Yamane T, Honda G, Eguchi Y. Benefit profile of thrombomodulin
alfa combined with antithrombin concentrate in patients with sepsis-induced disseminated intravascular coagulation. Clin Appl Thromb Hemost. 2022;28:10760296221077096.
77. Iba T, Umemura Y, Watanabe E, Wada T, Hayashida K, Kushimoto S, Japanese Surviving Sepsis Campaign Guideline Working Group for disseminated intravascular coagulation. Diagnosis of sepsis-induced disseminated intravascular coagulation and coagulopathy. Acute Med Surg.2019;6(3):223–32.
Источник фотоиллюстрации - www.freepik.com
[~DETAIL_TEXT] => Journal of Intensive Care (2023) 11:24 doi.org/10.1186/s40560-023-00672-5
The pathophysiology, diagnosis, and management of sepsis‑associated disseminated intravascular coagulation
Toshiaki Iba, Julie Helms, Jean Marie Connors and Jerrold H. Levy
Аннотация
Международное общество по тромбозу и гемостазу (ISTH) опубликовало диагностические критерии явного диссеминированного внутрисосудистого свертывания (ДВС) в 2001 году. С тех пор ДВС-синдром понимается как конечная стадия коагулопатии потребления, а не терапевтическая цель. Однако ДВС-синдром — это не просто декомпенсированное нарушение коагуляции, но также включает ранние стадии с системной активацией коагуляции. Таким образом, ISTH недавно опубликовало критерии коагулопатии, вызванной сепсисом (SIC), которые позволяют диагностировать компенсированную фазу коагулопатии с помощью легкодоступных биомаркеров.
ДВС-синдром - это лабораторный диагноз, обусловленный различными критическими состояниями, при этом сепсис является наиболее распространенным заболеванием, сопровождающимся развитием ДВС-синдрома.
Патофизиология ДВС-синдрома, связанного с сепсисом, многофакторна, и в дополнение к активации коагуляции с подавленным фибринолизом, множественные воспалительные реакции инициируются активированными лейкоцитами, тромбоцитами и сосудистыми эндотелиальными клетками как часть тромбовоспаления. Хотя ISTH установил явные диагностические критерии ДВС для диагностики его поздней стадии, для потенциальных терапевтических соображений требовались дополнительные критерии, которые могут обнаружить более раннюю стадию ДВС. Соответственно, ISTH ввел критерии SIC в 2019 году, которые просты в использовании и требуют только количества тромбоцитов, протромбинового времени, международного нормализованного отношения и оценки по шкале SOFA. Шкала SIC может использоваться для оценки тяжести заболевания и определения сроков потенциальных терапевтических вмешательств. Одним из основных недостатков лечения ДВС-синдрома, связанного с сепсисом, является отсутствие конкретных терапевтических подходов, выходящих за рамки лечения основной инфекции. Клинические испытания на сегодняшний день не увенчались успехом, поскольку включали пациентов, не страдающих коагулопатией. Тем не менее, в дополнение к контролю инфекции, антикоагулянтная терапия будет выбором при ДВС-синдроме, связанном с сепсисом. Поэтому эффективность гепарина, антитромбина и рекомбинантного тромбомодулина должна быть доказана в будущих клинических исследованиях.
Необходимо разработать новую терапевтическую стратегию против ДВС-синдрома, связанного с сепсисом, чтобы улучшить результаты. Следовательно, мы рекомендуем скрининг и мониторинг ДВС-синдрома с использованием системы оценок SIC.
Ключевые слова: Сепсис, Диссеминированное внутрисосудистое свертывание, Коагулопатия, Эндотелиальная клетка, Антитромбин, Тромбомодулин
Введение
Гемостаз - фундаментальный механизм защиты хозяина от различных патофизиологических нарушений, клинически проявляется в виде макро- и микротромбоза при острых травмах и у пациентов в критическом состоянии. Хотя гемостатический ответ полезен в некоторых условиях, избыточное тромбовоспаление
также вызывает нарушение кровообращения в тканях и вызывает последующую дисфункцию органов [1]. Системная гиперкоагуляция с коагулопатией потребления или без нее часто возникает после серьезного повреждения тканей, и на основании лабораторных диагностических критериев ациентам клинически ставится диагноз ДВС [2]. Патофизиология, фенотипическое проявление и методы лечения ДВС-синдрома значительно различаются в зависимости от основного его вызывающего заболевания [3, 4].
Однако сепсис является наиболее частой и опасной для жизни причиной ДВС-синдрома и обычно проявляется как тромботический тип ДВС-синдрома [5, 6]. Этот тип ДВС-синдрома часто осложняется дисфункцией органов, при этом геморрагические события происходят реже [7]. Состояние коагуляции динамически изменяется в зависимости от прогрессирования основного заболевания. ДВС-синдром, связанный с сепсисом, является динамическим состоянием, которое начинается с нарушения коагуляции, может перейти в коагулопатию, индуцированную сепсисом (SIC), и, наконец, в декомпенсированное нарушение коагуляции (явный ДВС-синдром) (Fig. 1).

Использование антикоагулянтов предполагается при компенсированном ДВС-синдроме, а декомпенсированная стадия может потребовать дополнительных методов тарапии [8, 9]. Последние достижения в лечении ДВС-синдрома, связанного с сепсисом, включают разработку ранних диагностических критериев на основе легкодоступной клинической информации и назначение потенциально эффективных антикоагулянтов [4, 10]. В этом обзоре основное внимание будет уделено достижениям в диагностике и лечении ДВС-синдрома, связанного с сепсисом, а также будущим перспективам.
Патофизиология ДВС-синдрома, связанного с сепсисом
Моноциты/макрофаги являются первой линией реагирования и фагоцитируют патогены, обнаруживая бактерии путем распознавания специфических молекулярных паттернов и вызывая провоспалительные и прокоагулянтные реакции для их захвата и локализации [11]. В качестве паттерн-распознающих рецепторов моноциты/макрофаги экспрессируют Toll-подобные рецепторы (TLR), Fcγ-рецепторы и G-белок-связанные рецепторы, которые распознают патоген-ассоциированные молекулярные паттерны (PAMPs), впоследствии интегрируя врожденную иммунную систему, а также систему коагуляции [12]. TLR не только реагируют на PAMP, но и передают сигналы молекулярных паттернов, ассоциированных с повреждением (DAMP), тем самым инициируя порочный цикл воспаления и коагуляции [13].
После последующей многоэтапной передачи сигнала моноциты/макрофаги продуцируют провоспалительные цитокины и хемокины, которые активируют нейтрофилы и повышают экспрессию тканевого фактора (TF) и фосфатидилсерина (PS) на клеточной мембране [14]. TF и PS инициируют внешние и внутренние каскады коагуляции и способствуют протромботическим реакциям.
Активированные нейтрофилы уничтожают патогены с помощью протеаз, реактивных форм кислорода, высвобождая внеклеточные ловушки нейтрофилов (NETs) и способствуя дальнейшему распространению воспаления с помощью механизмов гибели клеток [15]. Пироптоз, некроптоз, NETosis и некроз являются репрезентативными механизмами клеточной смерти, которые усиливают воспаление и коагуляцию путем высвобождения DAMPs и других цитотоксических веществ [16].
Тромбоциты также участвуют в защите хозяина, способствуя образованию тромба посредством экспрессии молекул адгезии, высвобождая компоненты гранул, такие как тромбоцитарный фактор 4 (PF4), фактор фон Виллебранда (VWF) [17] и прокоагулянтные микровезикулы [18]. Эти реакции приводят к образованию внутрисосудистых микротромбов (иммунотромбозу) для защиты хозяина от инфекции (Fig. 2). Среди факторов коагуляции тромбин является критическим медиатором, который регулирует воспаление и коагуляцию [19]. Моноциты, нейтрофилы, тромбоциты и эндотелиальные клетки также экспрессируют протеазно-активируемый рецептор-1 (PAR-1), а тромбин усиливает провоспалительные и прокоагулянтные реакции, связываясь с PAR-1 [19, 20].

После острой воспалительной реакции, вызванной сепсисом, эндотелиальные клетки сосудов теряют свои антитромботические свойства под воздействием факторов, включающих снижение выработки оксида азота/простагландина I2 и разрушение гликокаликса.
Тромбомодулин подвергается протеолитическому расщеплению и высвобождается с поверхности эндотелия. Кроме того, повышается выработка ингибитора активатора плазминогена 1 (PAI-1), и подавление фибринолиза становится очевидным. Это подавление фибринолиза является критической особенностью нарушения коагуляции при сепсисе (фибринолитическое отключение). Поврежденные эндотелиальные клетки высвобождают тромбогенные молекулы, включая VWF и молекулы адгезии, и стимулируют адгезию и агрегацию тромбоцитов [21]. Кроме того, физиологические антикоагулянтные факторы, такие как антитромбин и протеин С, подвергаются экстравазации за счет повышенной проницаемости сосудов [22]. Эти события способствуют распространенному образованию микротромбов при сепсисе (рис. 3).

It has not been well-known, but the ISTH has also defined non-overt DIC diagnostic criteria determined by sensitive and specific molecular markers that include antithrombin, protein C, or thrombin–antithrombin (TAT) complexes [23].
Диагностика ДВС-синдрома, связанного с сепсисом
ДВС-синдром определяется как системная активация коагуляции, а не как коагулопатия потребления [23], но многие врачи считают ДВС-синдром декомпенсированным нарушением коагуляции, возможно, из-за определения явных критериев ДВС Международным обществом по тромбозу и гемостазу (ISTH) в 2001 году, которое определяется как тромбоцитопения, значительное удлинение протромбинового времени (ПТВ), умеренное или значительное повышение уровня маркеров, связанных с фибрином, и/или снижение уровня фибриногена. До сих пор не было общеизвестным, но ISTH также определил критерии диагностики скрытого ДВС, определяемые чувствительными и специфическими молекулярными маркерами, включающими антитромбин, протеин С или комплексы тромбин-антитромбин (ТАТ) [23]. Однако у многих пациентов развился явный ДВС-синдром независимо от неявного ДВС-синдрома. Кроме того, поскольку молекулярные маркеры не использовались клинически, они не подходили для диагностики неявного ДВС-синдрома. Несмотря на наличие этих классических определений и критериев, для определения потенциальной терапевтической цели потребовалось установление новых диагностических критериев ДВС-синдрома. Japanese Society for Acute Medicine (JAAM) опубликовало свои критерии компенсированного ДВС-синдрома, используя легкодоступные лабораторные тесты и клинические данные в 2006 году [24]. Однако после обновления определения сепсиса до Sepsis-3 [25, 26] критерии ДВС JAAM устарели, поскольку критерии ДВС JAAM включали оценку синдрома системного воспалительного ответа (SIRS). Затем в 2017 году были введены критерии SIC для диагностики раннего начала ДВС-синдрома при сепсисе [27].
Критерии SIC определяются наличием сепсиса (инфекция с органной недостаточностью [увеличение (SOFA)]) и нарушением коагуляции (снижение количества тромбоцитов и увеличение PT-INR) [27] (Table 1). Измерение количества тромбоцитов и PT-INR являются рутинными клиническими тестами, а оценка SOFA представляет собой легко рассчитываемую клиническую оценку, используемую для оценки тяжести сепсиса [28].

Скрининг на ДВС у пациентов с сепсисом имеет важное значение на основании результатов большого японского исследования, в котором сообщалось об эффективности антикоагулянтной терапии у пациентов с коагулопатией и высоким риском смерти [29].
После дополнительных клинических отчетов [30, 31] диагностические критерии SIC были одобрены Комитетом по научной стандартизации ISTH DIC (SSC) [32, 33]. Клинически значимость критериев SIC заключается в их простоте и способности облегчать выбор времени антикоагулянтной терапии [34].
Критерии JAAM DIC широко используются для диагностики ДВС-синдрома, связанного с сепсисом, в Японии. Чтобы отметить превосходство оценки SIC над оценкой JAAM DIC, мы должны показать лучший эффект лечения, основанный на диагностике SIC, чем на диагностике JAAM DIC. Однако такое исследование еще не проводилось. Но критерии SIC проще, чем критерии JAAM DIC, менее затратны и, следовательно, более подходят для мониторинга. Критерии SIC были специально разработаны для сепсис-ассоциированного ДВС. Аналогичным образом, установление специфики заболевания может позволить нам разработать простые и лучшие критерии; мы считаем, что этот подход должен быть распространен на другие области ДВС-синдрома, т. е. гематологический ДВС-синдром и ДВС-синдром, вызванный раком.
Распространенность и смертность от ДВС-синдрома, связанного с сепсисом
При сепсисе распространенность ДВС-синдрома варьирует в зависимости от целевых когорт и диагностических критериев, но смертность всегда выше у пациентов с ДВС-синдромом по сравнению с пациентами без него. Gando et al. [35] исследовали распространенность и смертность от явного ДВС-синдрома и ДВС-синдрома с JAAM DIC у пациентов с сепсисом (сепсис-1) и сообщили, что они составили 18,1% против 46,8% и 38,1% против 38,4% соответственно. Другое ретроспективное когортное исследование изучало распространенность и смертность от явного ДВС-синдрома, ДВС-синдрома с JAAM DIC и SIC у 1892 пациентов с сепсисом (сепсис-1) и сообщили, что они составили 29,3% и 38,4%, 61,4% и 33,9% и 60,8% и 32,5% соответственно [36]. Данные когорты пациентов с сепсисом-3 из 296 человек показали, что распространенность явного ДВС-синдрома, ДВС-синдрома с измененной шкалой JAAM DIC (оценка SIRS была заменена на активность антитромбина) и SICсоставила 22,6%, 43,2% и 56,1%, а 28-дневная смертность составила 55,2%, 47,7% и 44,0% соответственно [37].
Эти данные свидетельствуют о том, что распространенность ДВС-синдрома различается в зависимости от определений, но смертность от ДВС-синдрома, связанного с сепсисом, превысила 30% независимо от диагностических критериев. Основной целью диагностики ДВС-синдрома является не прогнозирование результатов, а определение сроков начала лечения, поскольку у пациентов с ДВС-синдромом наблюдается более высокая смертность по сравнению с пациентами без ДВС-синдрома [38]. Следует отметить, что недавние исследования подтверждают идею о том, что антикоагулянтная терапия более эффективна для пациентов с коагулопатией/ДВС-синдромом и высокой тяжестью заболевания [38, 39]. Кроме того, оценки JAAM DIC и SICотражают тяжесть заболевания, и была описана связь между оценками и смертностью [24, 27]. Lu et al. [40] оценили эффективность оценки SIC у 9432 пациентов с сепсисом и сообщили, что 28-дневная смертность составила 34% у пациентов с SIC по сравнению с 25% у пациентов без SIC . Они также сообщили, что наличие SIC было независимым фактором риска 28-дневной смертности со скорректированным отношением шансов 1,52 (95% [ДИ]: от 1,39 до 1,67).
Эффективность системы оценки SIC
Полезность диагностических критериев была изучена путем оценки их эффективности для выявления пациентов с высоким риском смерти. Wang et al. [37] сравнили эффективность различных диагностических критериев ДВС, включая SIC, модифицированный JAAM DIC, упрощенный Japanese Society on Thrombosis and Hemostasis ДВС и явные критерии ДВС в прогнозировании 28-дневной смертности и сообщили, что площадь под кривыми (AUC) не различалась среди диагностических критериев (AUC: от 0,730 до 0,763); тем не менее, важно, что SIC является самым простым критерием среди них, а отношение шансов к смерти было самым высоким и составило 5,218 (95% ДИ: от 2,878 до 9,459, P < 0,001).
В качестве скринингового теста, такого как оценка SIC, ожидаемая эффективность заключается в способности отрицать смерть при отрицательном результате SIC.
В этом смысле отрицательная прогностическая ценность для 28-дневной смертности также была самой высокой при SIC и составила 86,9%. Аналогичные результаты были подтверждены в нескольких исследованиях, и сообщалось, что оценка SIC связана с тяжестью заболеваний [40–49]. Основной целью диагностики ДВС было не выявление пациентов с сепсисом с высоким риском смерти, а выявление пациентов, которым может быть полезна антикоагулянтная терапия. Zou et al. [47] ретроспективно оценили 6646 пациентов с сепсисом и сообщили о связи между введением гепарина и более низкой смертностью только у пациентов с SIC (коэффициент риска [HR]: 0,74, 95% ДИ: 0,65–0,85).
Напротив, эта связь не наблюдалась у пациентов без SIC (HR: 0,95, 95% ДИ: 0,64–1,40). Peng et al. [48] также изучили влияние гепарина на пациентов с сепсисом в своем ретроспективном исследовании и пришли к выводу, что пациенты с SIC могут быть хорошими кандидатами на терапию гепарином. В их исследовании у большинства пациентов с явной ДВС была диагностирована сепсисиндуцированная коагулопатия (SIC), а у большинства пациентов с явной ДВС ранее был поставлен диагноз SIC [30]. Таким образом, SIC предшествует явному ДВС, и пациенты переходят от SIC к явному ДВС по мере прогрессирования заболевания.
Одним из ограничений критериев SIC является риск неправильной диагностики заболеваний, имитирующих ДВС-синдром, который может быть немалым, поскольку включены только два биомаркера коагуляции. Например, нелегко дифференцировать тромботические микроангиопатические (ТМА) расстройства, такие как тромботическая тромбоцитопеническая пурпура (ТТP) [49] и атипичный гемолитико-уремический синдром (aHUS ) [50], а также гепарин-индуцированную тромбоцитопению (HIT) от SIC [51]. Для поддержки точной диагностики ISTH DIC SSC предоставляет блок-схему, которая помогает в систематической дифференциальной диагностике [52]. Хотя удлинение PT-INR является незначительным, ТМА- расстройства обычно сопровождаются значительной тромбоцитопенией и достигают достаточных баллов. Уменьшение количества тромбоцитов более выражено, а изменения в ПВ более незначительны при ТТP, aHUS и HIT , а баланс количества тромбоцитов и PTможет быть полезен для дифференциации.
Кроме того, активность антитромбина, биомаркера повреждения эндотелия, значительно снижена при SIC и ДВС [53, 54], но обычно сохраняется при TMA и может быть полезна для дифференциальной диагностики [55, 56]. Известно, что уровень антитромбина снижается на ранней стадии ДВС. Jackson Chornenki et al. [57] сообщили, что количество тромбоцитов и PT-INR в сочетании с активностью антитромбина могут идентифицировать раннюю стадию ДВС у пациентов с сепсисом. Хотя заболеваемость невысока, дифференциальная диагностика этих заболеваний, имитирующих ДВС, имеет решающее значение, поскольку смертность значительно высока при неправильном лечении.
Как нам следует лечить ДВС-синдром, связанный с сепсисом?
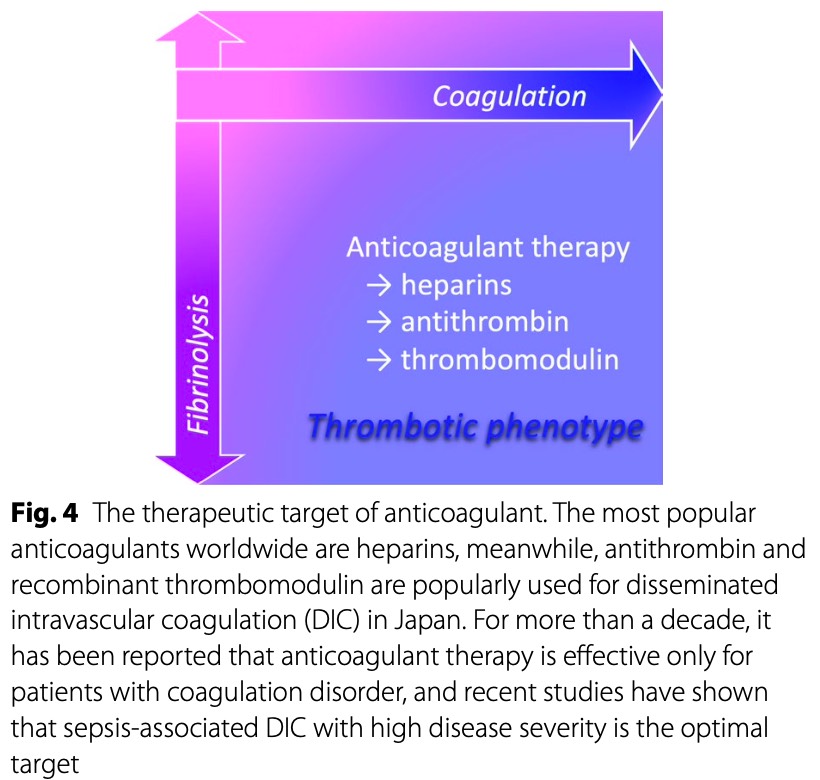
Лечение основного заболевания имеет важное значение при ДВС-синдроме, но для ДВС-синдрома, связанного с сепсисом, дополнительное лечение продолжающейся плохой перфузии тканей имеет решающее значение в клиническом ведении. Однако мало доказательств, подтверждающих эффективность антикоагулянтной терапии в дополнение к антибиотикам и контролю источника. Несмотря на исследования нескольких антикоагулянтов в масштабных рандомизированных контролируемых исследованиях (РКИ), ни один из современных антикоагулянтов еще не продемонстрировал эффективности [61,63]. Возможные причины включают изменчивость клинической картины сепсиса [61], но, как ранее было описано, антикоагулянтную терапию следует рассматривать только для пациентов с нарушением коагуляции, оптимальной целью является ДВС-синдром, связанный с сепсисом, с высокой тяжестью заболевания [38, 39] (Fig. 4).

Гепарин
Гепарин обычно используется у пациентов с сепсисом по нескольким причинам. Однако ни одно крупное рандомизированное контролируемое исследование не изучало гепарин отдельно при ДВС-синдроме, связанном с сепсисом. Недавний метаанализ показал, что нефракционированный гепарин может снизить смертность от сепсиса, особенно у пациентов с высокой степенью тяжести [62]. Однако исследуемая популяция не ограничивалась пациентами с коагулопатией/ДВС-синдромом. Другой систематический обзор гепарина при ДВС-синдроме [63] был ограничен включением исследований, в которых три из восьми исследований использовали гепарин в качестве контроля. Хотя гепарин настоятельно рекомендуется для лечения COVID-19 [64], его эффективность при ДВС-синдроме, связанном с сепсисом, до сих пор неясна. РКИ, проведенное в Японии, сравнило эффективность и безопасность рекомбинантного тромбомодулина с гепарином при ДВС-синдроме, связанном с гематологическими злокачественными новообразованиями или инфекциями. В анализе подгрупп были подвергнуты анализу 80 пациентов с ДВС-синдромом, связанным с сепсисом. Результаты показали, что частота разрешения ДВС-синдрома в группе рекомбинантного тромбомодулина и группе гепарина составила 67,5% и 55,6%, а частота 28-дневной смертности составила 21,4% и 31,6% соответственно [65].
Рекомбинантный тромбомодулин
Рекомбинантный тромбомодулин был разработан и одобрен для клинического использования в Японии в 2008 году для лечения ДВС-синдрома [66]. Как было описано ранее, Aikawa et al. [65] провели анализ подгрупп 80 пациентов с ДВС-синдромом, связанным с сепсисом, из исследования фазы 3 [67] и сообщили о лучшей эффективности рекомбинантного тромбомодулина. Последующее исследование SCARLET, о котором сообщалось в 2019 году, включало пациентов с сепсисом с коагулопатией и дисфункцией органов (сердечно-сосудистая и/или дыхательная недостаточность, количество тромбоцитов от 30 до 150 × 109/л или > 30%-ное снижение в течение 24 ч и PT-INR > 1,4 [оценка SIC > 4]) [68]. Несмотря на то, что разница не была статистически значимой в intention-to-treat популяции, наблюдалась тенденция к улучшению 28-дневной выживаемости в подгруппе, которая соответствовала исходным критериям (разница: 5,40%, 95% ДИ: от -1,68% до 12,48%).
В этом исследовании была отмечена значительная разница в различных межданародных когортах, и post hocанализ выявил абсолютное снижение риска на 8,3% во французской популяции по сравнению с 1,1% в остальном мире; считалось, что больший эффект во французской когорте был обусловлен более высокой частотой устойчивой коагулопатии и более низкой частотой использования гепарина [69]. Примечательно, что все РКИ показали тенденции к лучшим результатам в группе лечения, а метаанализ РКИ показал значительное улучшение показателей смертности [70]. Следовательно, рекомбинантный тромбомодулин рекомендуется для ДВС-синдрома, связанного с сепсисом, в руководствах по сепсису в Японии [71].
Антитромбин
Крупнейшее РКИ, в котором изучалось действие антитромбина, было проведено при тяжелом сепсисе, но не у пациентов с ДВС-синдромом, связанным с сепсисом [58]. Однако Kienast et al. [72] провели постфактум-анализ у 563 пациентов (группа антитромбина: n = 286 и группа плацебо: n = 277), у которых был ДВС-синдром и которые не получали сопутствующий гепарин, и сообщили об абсолютном снижении 28-дневной смертности на 14,6% в группе антитромбина (P = 0,02), тогда как у пациентов без ДВС-синдрома такого эффекта не наблюдалось. Антитромбин используется для лечения ДВС-синдрома в Японии, и это включено в рекомендации по сепсису [71]. Японские рекомендации основаны на данных Tagami et al. [73], которые провели анализ с сопоставлением показателей предрасположенности, используя общенациональную базу данных, состоящую из 9075 пациентов с пневмонией с ДВС-синдромом, связанным с сепсисом (антитромбин: n = 2663 и контроль: n = 6412), и создали сопоставленную когорту из 2194 пар. Результат показал разницу в смертности между группами (антитромбин: 40,6% против контроля: 44,2%, P = 0,02). Кроме того, множественный логистический регрессионный анализ показал связь между использованием антитромбина и 28-дневной смертностью ([OR] 0,85, 95% CI: 0,75–0,97). В дополнение к продукту, полученному из плазмы, в Японии в 2015 году был одобрен рекомбинантный антитромбин (антитромбин-γ), и в небольших исследованиях сообщалось о более высоких показателях с точки зрения улучшения показателей ДВС и SOFA [74, 75]. В соответствии с этими отчетами, японские руководства по сепсису рекомендуют использовать антитромбин и рекомбинантный тромбомодулин для ДВС, связанного с сепсисом [71]. Недавно сообщалось о потенциально полезном эффекте комбинированной терапии антитромбина с рекомбинантным тромбомодулином, особенно в тяжелых случаях [76]. Эффект этой комбинированной терапии следует изучить в будущем исследовании.
Перспективы на будущее
Смертность, связанная с сепсисом, а также с ДВС-синдромом, связанным с сепсисом, остается высокой и превышает 30%. Накопленные данные свидетельствуют о том, что антикоагулянтная терапия эффективна для пациентов в критическом состоянии с нарушениями коагуляции. Сепсис — это системная реакция, которая вызывает острую полиорганную дисфункцию и поддается лечению антибиотиками и контролем источника на ранней стадии. Однако состояние ухудшается, когда течение заболевания осложняется нарушением коагуляции. Поэтому важно регулярно проводить скрининг и мониторинг изменений коагуляции у пациентов с сепсисом с помощью легкодоступных методов. Этот обзор фокусируется на ДВС-синдроме, связанном с сепсисом, а не охватывает все типы ДВС.
Система оценки SIC специально разработана для диагностики ДВС-синдрома, связанного с сепсисом, на ранней стадии, проста и удобна для расчета, что делает ее полезной для целей скрининга и мониторинга ДВС-синдрома у больных сепсисом. Такой скрининг и мониторинг проводились в Японии с использованием критериев JAAM ДВС. Однако, поскольку расчет оценки SIRS больше не использовался при диагностике сепсиса, необходимо обновление. SIC был введен в Японии Japanese Sepsis Guideline Working Group в 2019 году в качестве альтернативного диагностического критерия [77], и он будет включен в следующую версию руководства по сепсису. Что касается лечения SIC, то гепарины, антитромбин и рекомбинантный тромбомодулин являются текущим выбором сепсис- ассоциированного ДВС-синдрома.
Since activation in coagulation is a part of host defense mechanisms, the selection of targets and the choice of agents are also important. Since anticoagulation has increasingly attracted attention [4, 8, 10], it is necessary to set up international collaborative studies that adopt proper endpoints.
Пока ни один из них не имеет надежных доказательств эффективности. Существуют некоторые препятствия для разработки клинических испытаний, которые доказывают эффективность этих антикоагулянтов. Во-первых, конечная точка была установлена как разница в смертности; однако существует множество факторов, которые влияют на исход для пациента, и более сложная конечная точка, которая отражает эффект лечения антикоагулянтами, является оправданной. Во-вторых, определение оптимальной дозы, продолжительности и прекращения лечения не является простым.
Поскольку активация свертывания крови является частью защитных механизмов хозяина, выбор мишеней и выбор агентов также важен. Поскольку антикоагуляция привлекает все больше внимания [4, 8, 10], необходимо организовать международные совместные исследования, в которых будут приняты соответствующие конечные точки.
Заключение
ДВС-синдром является распространенным осложнением при сепсисе. Хотя смертность от ДВС-синдрома, связанного с сепсисом, высока, раннее выявление и своевременное вмешательство важны для улучшения результатов. ДВС-синдром является лабораторным диагнозом, и ISTH DIC SSC ввел критерии SIC, которые просты, легко поддаются расчету и подходят для повторной оценки для выявления пациентов с сепсисом с риском прогрессирования до явного ДВС-синдрома и смерти. Несмотря на достижения в исследованиях патофизиологии, терапевтические средства для улучшения результатов сепсиса, выходящие за рамки антимикробного лечения, никогда не рекомендовались в большинстве стран. Хотя рекомбинантный тромбомодулин и антитромбин одобрены японскими руководствами по сепсису, необходимы дальнейшие перспективные международные совместные исследования.
References
1. Lelubre C, Vincent JL. Mechanisms and treatment of organ failure in sepsis. Nat Rev Nephrol. 2018;14(7):417–27.
2. Squizzato A, Gallo A, Levi M, Iba T, Levy JH, Erez O, Ten Cate H, Solh Z, Gando S, Vicente V, Di Nisio M. Underlying disorders of disseminated intravascular coagulation: communication from the ISTH SSC Subcommittees on Disseminated Intravascular Coagulation and Perioperative and Critical Care Thrombosis and Hemostasis. J Thromb Haemost.2020;18(9):2400–7.
3. Levi M, Sivapalaratnam S. Disseminated intravascular coagulation: an update on pathogenesis and diagnosis. Expert Rev Hematol. 2018;11(8):663–72.
4. Iba T, Levi M, Thachil J, Levy JH. Disseminated intravascular coagulation:the past, present, and future considerations. Semin Thromb Hemost.2022;48(8):978–87.
5. Yamakawa K, Ohbe H, Taniguchi K, Matsui H, Fushimi K, Yasunaga H. Time trends of the outcomes and treatment options for disseminated intravascular coagulation: a nationwide observational study in Japan. JMA J.2020;3(4):313–20.
6. Adelborg K, Larsen JB, Hvas AM. Disseminated intravascular coagulation: epidemiology, biomarkers, and management. Br J Haematol.2021;192(5):803–18.
7. Chang JC. Disseminated intravascular coagulation: new identity as endotheliopathy-associated vascular microthrombotic disease based on in vivo hemostasis and endothelial molecular pathogenesis. Thromb J. 2020;18:25.
8. Helms J, Iba T, Connors JM, Gando S, Levi M, Meziani F, Levy JH. How to manage coagulopathies in critically ill patients? Int Care Med.2023;49(3):273–90.
9. Scully M, Levi M. How we manage haemostasis during sepsis. Br J Haematol. 2019;185(2):209–18.
10. Iba T, Connors JM, Nagaoka I, Levy JH. Recent advances in the research and management of sepsis-associated DIC. Int J Hematol.2021;113(1):24–33.
11. Futosi K, Fodor S, Mocsai A. Neutrophil cell surface receptors and their intracellular signal transduction pathways. Int Immunopharmacol. 2013;17(3):638–50.
12. Iba T, Levi M, Levy JH. Intracellular communication and immunothrombosis in sepsis. J Thromb Haemost. 2022;20(11):2475–84.
13. Salomao R, Martins PS, Brunialti MK, Fernandes Mda L, Martos LS, Mendes ME, Gomes NE, Rigato O. TLR signaling pathway in patients with sepsis. Shock. 2008;30(Suppl 1):73–7.
14. Gould TJ, Lysov Z, Swystun LL, Dwivedi DJ, Zarychanski R, Fox-Robichaud AE, Liaw PC, Canadian Critical Care Translational Biology Group. Extracellular histones increase tissue factor activity and enhance thrombin generation by human blood monocytes. Shock. 2016;46(6):655–62.
15. Kolaczkowska E, Kubes P. Neutrophil recruitment and function in health and inflammation. Nat Rev Immunol. 2013;13(3):159–75.
16. Perez-Figueroa E, Alvarez-Carrasco P, Ortega E, Maldonado-Bernal C. Neutrophils: many ways to die. Front Immunol. 2021;12: 631821.
17. Assinger A, Schrottmaier WC, Salzmann M, Rayes J. Platelets in sepsis: an update on experimental models and clinical data. Front Immunol.2019;10:1687.
18. Reid VL, Webster NR. Role of microparticles in sepsis. Br J Anaesth. 2012;109(4):503–13.
19. Ma L, Dorling A. The roles of thrombin and protease-activated receptors in inflammation. Semin Immunopathol. 2012;34(1):63–72.
20. Jose RJ, Williams AE, Mercer PF, Sulikowski MG, Brown JS, Chambers RC. Regulation of neutrophilic inflammation by proteinase-activated receptor 1 during bacterial pulmonary infection. J Immunol. 2015;194(12):6024–34.
21. Joffre J, Hellman J, Ince C, Ait-Oufella H. Endothelial responses in sepsis. Am J Respir Crit Care Med. 2020;202(3):361–70.
22. Ito T, Kakuuchi M, Maruyama I. Endotheliopathy in septic conditions: mechanistic insight into intravascular coagulation. Crit Care.2021;25(1):95.
23. Taylor FB Jr, Toh CH, Hoots WK, Wada H, Levi M, Scientific Subcommittee on Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost. 2001;86(5):1327–30.
24. Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K, Mayumi T,Murata A, Ikeda T, Ishikura H, Ueyama M, Ogura H, Kushimoto S, Saitoh D, Endo S, Shimazaki S, Japanese Association for Acute Medicine multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med. 2006;34(3):625–31.
25. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, Bellomo R, Bernard GR, Chiche JD, Coopersmith CM, Hotchkiss RS, Levy MM, Marshall JC, Martin GS, Opal SM, Rubenfeld GD, van der Poll T, Vincent JL, Angus DC. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801–10.
26. Members of the American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference Committee: American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference. Definition for sepsis and organ failure and guidelines for the use innovative therapies in sepsis. Crit Care Med. 1992;20:864–74.
27. Iba T, Nisio MD, Levy JH, Kitamura N, Thachil J. New criteria for sepsisinduced coagulopathy (SIC) following the revised sepsis definition: a retrospective analysis of a nationwide survey. BMJ Open. 2017;7(9): e017046.
28. Zhang Y, Khalid S, Jiang L. Diagnostic and predictive performance of biomarkers in patients with sepsis in an intensive care unit. J Int Med Res.2019;47(1):44–58.
29. Hayakawa M, Ono K. A summary of the Japan septic disseminated intravascular coagulation study. Acute Med Surg. 2018;5(2):123–8.
30. Iba T, Arakawa M, Di Nisio M, Gando S, Anan H, Sato K, Ueki Y, Levy JH, Thachil J. Newly proposed sepsis-induced coagulopathy precedes international society on thrombosis and haemostasis overt-disseminated intravascular coagulation and predicts high mortality. J Intensive Care Med. 2020;35(7):643–9.
31. Iba T, Arakawa M, Levy JH, Yamakawa K, Koami H, Hifumi T, Sato K. Sepsisinduced coagulopathy and Japanese Association for Acute Medicine DIC in coagulopathic patients with decreased antithrombin and treated by antithrombin. Clin Appl Thromb Hemost. 2018;24(7):1020–6.
32. Iba T, Levy JH, Yamakawa K, Thachil J, Warkentin TE, Levi M, Scientific and Standardization Committee on DIC of the International Society on Thrombosis and Haemostasis. Proposal of a two-step process for the diagnosis of sepsis-induced disseminated intravascular coagulation. J Thromb Haemost. 2019;17(8):1265–8.
33. Iba T, Levy JH, Warkentin TE, Thachil J, van der Poll T, Levi M, Scientific and Standardization Committee on DIC, and the Scientific and Standardization Committee on Perioperative and Critical Care of the International Society on Thrombosis and Haemostasis. Diagnosis and management of sepsis-induced coagulopathy and disseminated intravascular coagulation. J Thromb Haemost. 2019;17(11):1989–94.
34. Iba T, Levi M, Thachil J, Helms J, Scarlatescu E, Levy JH. Communication from the SSC of the ISTH on sepsis-induced coagulopathy (SIC) in the management of sepsis. J Thromb Haemost. 2022. https:// doi. org/ 10.1016/j. jtha. 2022. 10. 022.
35. Gando S, Saitoh D, Ogura H, Fujishima S, Mayumi T, Araki T, Ikeda H, Kotani J, Kushimoto S, Miki Y, Shiraishi S, Suzuki K, Suzuki Y, Takeyama N, Takuma K, Tsuruta R, Yamaguchi Y, Yamashita N, Aikawa N, Japanese Association for Acute Medicine Sepsis Registry (JAAMSR) Study Group. A multicenter, prospective validation study of the Japanese Association for Acute Medicine disseminated intravascular coagulation scoring system in patients with severe sepsis. Crit Care. 2013;17:R111.
36. Yamakawa K, Yoshimura J, Ito T, Hayakawa M, Hamasaki T, Fujimi S. External validation of the two newly proposed criteria for assessing coagulopathy in sepsis. Thromb Haemost. 2019;119(2):203–12.
37. Wang B, Zhang B, Shen Y, Li J, Yuan X, Tang N. Validation of two revised,simplified criteria for assessing sepsis-associated disseminated intravascular coagulation in ICU patients with sepsis-3: a retrospective study. Lab Med. 2022. https:// doi. org/ 10. 1093/ labmed/ lmac1 12.
38. Umemura Y, Yamakawa K. Optimal patient selection for anticoagulant therapy in sepsis: an evidence-based proposal from Japan. J Thromb Haemost. 2018;16(3):462–4.
39. Yamakawa K, Gando S, Ogura H, Umemura Y, Kabata D, Shintani A,Shiraishi A, Saitoh D, Fujishima S, Mayumi T, Kushimoto S, Abe T, Shiino Y, Nakada TA, Tarui T, Hifumi T, Otomo Y, Okamoto K, Kotani J, Sakamoto Y, Sasaki J, Shiraishi SI, Takuma K, Tsuruta R, Hagiwara A, Masuno T, Takeyama N, Yamashita N, Ikeda H, Ueyama M, Fujimi S, Japanese Association for
Acute Medicine (JAAM) Focused Outcomes Research in Emergency Care in Acute Respiratory Distress Syndrome, Sepsis Trauma (FORECAST) Study Group. Identifying sepsis populations benefitting from anticoagulant therapy: a prospective cohort study incorporating a restricted cubic spline regression model. Thromb Haemost. 2019;119(11):1740–51.
40. Lu Z, Zhang J, Hong J, Wu J, Liu Y, Xiao W, Hua T, Yang M. Development of a nomogram to predict 28-day mortality of patients with sepsis-induced coagulopathy: an analysis of the MIMIC-III database. Front Med. 2021;8:661710.
41. Fang Y, Lin S, Dou Q, Gui J, Li W, Tan H, Wang Y, Zeng J, Khan A, Wei DQ. Network pharmacology- and molecular simulation-based exploration of therapeutic targets and mechanisms of heparin for the treatment of sepsis/COVID-19. J Biomol Struct Dyn. 2023;20:1–13.
42. Tanaka C, Tagami T, Kudo S, Takehara A, Fukuda R, Nakayama F, Kaneko J, Ishiki Y, Sato S, Kuno M, Unemoto K. Validation of sepsis-induced coagulopathy score in critically ill patients with septic shock: post hoc analysis of a nationwide multicenter observational study in Japan. Int J Hematol. 2021;114(2):164–71.
43. Xiang L, Ren H, Wang Y, Zhang J, Qian J, Li B, An K, Fu L. Clinical value of pediatric sepsis-induced coagulopathy score in diagnosis of sepsisinduced coagulopathy and prognosis in children. J Thromb Haemost. 2021;19(12):2930–7.
44. Hosseini SF, Behnam-Roudsari S, Alavinia G, Emami A, Toghyani A, Moradi S, Zadeh MM, Mohseni S, Shafiee MA. Diagnostic and prognostic value of sepsis-induced coagulopathy and International Society on Thrombosis and Hemostasis scoring systems in COVID-19-associated disseminated intravascular coagulopathy. J Res Med Sci. 2021;26:102.
45. Kapoor M, Panda PK, Saini LK, Bahurupi Y. Disseminated intravascular coagulation score and sepsis-induced coagulopathy score in prediction of COVID-19 severity: a retrospective analysis. Indian J Crit Care Med. 2021;25(12):1357–63.
46. Shinada K, Miike T, Matsuoka A, Miyazaki M, Goto T, Sasaki A, Yamazaki H,Mori K, Nakayama K, Sakurai R, Asahi M, Yoshitake K, Narumi S, Koba M, Koami H, Sakamoto Y. Coagulation influencing liberation from respiratory support in patients with coronavirus disease 2019: a retrospective, observational study. J Nippon Med Sch. 2022. https:// doi. org/ 10. 1272/
jnms. JNMS. 2022_ 89- 506.
47. Zou ZY, Huang JJ, Luan YY, Yang ZJ, Zhou ZP, Zhang JJ, Yao YM, Wu M.Early prophylactic anticoagulation with heparin alleviates mortality in critically ill patients with sepsis: a retrospective analysis from the MIMIC-IV database. Burns Trauma. 2022;10:tkac029.
48. Peng JC, Nie F, Li YJ, Xu QY, Xing SP, Li W, Gao Y. Favorable outcomes of anticoagulation with unfractioned heparin in sepsis-induced coagulopathy: a retrospective analysis of MIMIC-III database. Front Med. 2022;8:773339.
49. Habe K, Wada H, Ito-Habe N, Hatada T, Matsumoto T, Ohishi K, Maruyama K, Imai H, Mizutani H, Nobori T. Plasma ADAMTS13, von Willebrand factor (VWF) and VWF propeptide profiles in patients with DIC and related diseases. Thromb Res. 2012;129(5):598–602.
50. Laurence J, Haller H, Mannucci PM, Nangaku M, Praga M, Rodriguez de Cordoba S. Atypical hemolytic uremic syndrome (aHUS): essential aspects of an accurate diagnosis. Clin Adv Hematol Oncol. 2016;14(Suppl 11):2–15.
51. Greinacher A, Selleng K, Warkentin TE. Autoimmune heparin-induced thrombocytopenia. J Thromb Haemost. 2017;15(11):2099–114.
52. Iba T, Levy JH, Wada H, Thachil J, Warkentin TE, Levi M, Subcommittee on Disseminated Intravascular Coagulation. Differential diagnoses for sepsisinduced disseminated intravascular coagulation: communication from the SSC of the ISTH. J Thromb Haemost. 2019;17(2):415–9.
53. Iba T, Levy JH, Thachil J, Susen S, Levi M, Scarlatescu E. Communication from the SSC of the ISTH on vascular endothelium-related biomarkers in DIC. J Thromb Haemost. 2022 in press.
54. Matsubara T, Yamakawa K, Umemura Y, Gando S, Ogura H, Shiraishi A, Kushimoto S, Abe T, Tarui T, Hagiwara A, Otomo Y, Fujimi S, Japanese Association for Acute Medicine (JAAM) Focused Outcomes Research in Emergency Care in Acute Respiratory Distress Syndrome, Sepsis and Trauma (FORECAST) Group. Significance of plasma fibrinogen level and antithrombin activity in sepsis: a multicenter cohort study using a cubic spline model. Thromb Res. 2019;181:17–23.
55. Sakai K, Wada H, Nakatsuka Y, Kubo M, Hayakawa M, Matsumoto M. Characteristics behaviors of coagulation and fibrinolysis markers in acquired thrombotic thrombocytopenic purpura. J Intensive Care Med. 2021;36(4):436–42.
56. Sakurai S, Kato H, Yoshida Y, Sugawara Y, Fujisawa M, Yasumoto A, Matsumoto M, Fujimura Y, Yatomi Y, Nangaku M. Profiles of coagulation and fibrinolysis activation-associated molecular markers of atypical hemolytic uremic syndrome in the acute phase. J Atheroscler Thromb. 2020;27(4):353–62.
57. Jackson Chornenki NL, Dwivedi DJ, Kwong AC, Zamir N, Fox-Robichaud AE, Liaw PC, Canadian Critical Care Translational Biology Group. Identification of hemostatic markers that define the pre-DIC state: a multi-center observational study. J Thromb Haemost. 2020;18(10):2524–31.
58. Warren BL, Eid A, Singer P, Pillay SS, Carl P, Novak I, Chalupa P, Atherstone A, Penzes I, Kubler A, Knaub S, Keinecke HO, Heinrichs H, Schindel F, Juers M, Bone RC, Opal SM, KyberSept Trial Study Group. Caring for the critically ill patient High-dose antithrombin III in severe sepsis: a randomized controlled trial (Erratum in: JAMA 2002;287(2):192.). JAMA.2001;286(15):1869–78. https:// doi. org/ 10. 1001/ jama. 286. 15. 1869.
59. Ranieri VM, Thompson BT, Barie PS, Dhainaut JF, Douglas IS, Finfer S, Gardlund B, Marshall JC, Rhodes A, Artigas A, Payen D, Tenhunen J, Al-Khalidi HR, Thompson V, Janes J, Macias WL, Vangerow B, Williams MD, PROWESS-SHOCK Study Group. Drotrecogin alfa (activated) in adults with septic shock. N Engl J Med. 2012;366(22):2055–64.
60. Abraham E, Reinhart K, Opal S, Demeyer I, Doig C, Rodriguez AL, Beale R, Svoboda P, Laterre PF, Simon S, Light B, Spapen H, Stone J, Seibert A, Peckelsen C, De Deyne C, Postier R, Pettila V, Sprung CL, Artigas A, Percell SR, Shu V, Zwingelstein C, Tobias J, Poole L, Stolzenbach JC, Creasey AA, OPTIMIST Trial Study Group. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA. 2003;290(2):238–47.
61. Seymour CW, Kennedy JN, Wang S, Chang CH, Elliott CF, Xu Z, et al. Derivation, validation, and potential treatment implications of novel clinical phenotypes for sepsis. JAMA. 2019;321:2003–17.
62. Fu S, Yu S, Wang L, Ma X, Li X. Unfractionated heparin improves the clinical efficacy in adult sepsis patients: a systematic review and metaanalysis. BMC Anesthesiol. 2022;22(1):28.
63. Omidkhoda N, Abedi F, Ghavami V, Rahimi H, Samadi S, Arasteh O, Mohammadpour AH. The effect of heparin and its preparations on disseminated intravascular coagulation mortality and hospitalization: a systematic review. Int J Clin Pract. 2022;2022:2226761.
64. Schulman S, Sholzberg M, Spyropoulos AC, Zarychanski R, Resnick HE, Bradbury CA, Broxmeyer L, Connors JM, Falanga A, Iba T, Kaatz S, Levy JH, Middeldorp S, Minichiello T, Ramacciotti E, Samama CM, Thachil J, International Society on Thrombosis and Haemostasis. ISTH guidelines for antithrombotic treatment in COVID-19. J Thromb Haemost.2022;20(10):2214–25.
65. Aikawa N, Shimazaki S, Yamamoto Y, Saito H, Maruyama I, Ohno R, Hirayama A, Aoki Y, Aoki N. Thrombomodulin alfa in the treatment of infectious patients complicated by disseminated intravascular coagulation: subanalysis from the phase 3 trial. Shock. 2011;35(4):349–54.
66. Murata A, Okamoto K, Mayumi T, Muramatsu K, Matsuda S. Recent change in treatment of disseminated intravascular coagulation in Japan: an epidemiological study based on a National Administrative Database.Clin Appl Thromb Hemost. 2016;22(1):21–7.
67. Saito H, Maruyama I, Shimazaki S, Yamamoto Y, Aikawa N, Ohno R, Hirayama A, Matsuda T, Asakura H, Nakashima M, Aoki N. Efficacy and safety of recombinant human soluble thrombomodulin (ART-123) in disseminated intravascular coagulation: results of a phase III, randomized, double-blind clinical trial. J Thromb Haemost. 2007;5(1):31–41.
68. Vincent JL, Francois B, Zabolotskikh I, Daga MK, Lascarrou JB, Kirov MY, Pettila V, Wittebole X, Meziani F, Mercier E, Lobo SM, Barie PS, Crowther M, Esmon CT, Fareed J, Gando S, Gorelick KJ, Levi M, Mira JP, Opal SM, Parrillo J, Russell JA, Saito H, Tsuruta K, Sakai T, Fineberg D, SCARLET Trial Group. Effect of a recombinant human soluble thrombomodulin on mortality in patients with sepsis-associated coagulopathy: the SCARLET Randomized Clinical Trial. JAMA. 2019;321(20):1993–2002.
69. Francois B, Fiancette M, Helms J, Mercier E, Lascarrou JB, Kayanoki T, Tanaka K, Fineberg D, Vincent JL, Wittebole X. Efficacy and safety of human soluble thrombomodulin (ART-123) for treatment of patients in Fra ce with sepsis-associated coagulopathy: post hoc analysis of SCARLET. Ann Intensive Care. 2021;11(1):53.
70. Yamakawa K, Levy JH, Iba T. Recombinant human soluble thrombomodulin in patients with sepsis-associated coagulopathy (SCARLET): an updated meta-analysis. Crit Care. 2019;23(1):302.
71. Egi M, Ogura H, Yatabe T, Atagi K, Inoue S, Iba T, Kakihana Y, Kawasaki T, Kushimoto S, Kuroda Y, Kotani J, Shime N, Taniguchi T, Tsuruta R, Doi K, Doi M, Nakada TA, Nakane M, Fujishima S, Hosokawa N, Masuda Y, Matsushima A, Matsuda N, Yamakawa K, Hara Y, Sakuraya M, Ohshimo S, Aoki Y, Inada M, Umemura Y, Kawai Y, Kondo Y, Saito H, Taito S, Takeda C, Terayama T, Tohira H, Hashimoto H, Hayashida K, Hifumi T, Hirose T, Fukuda T, Fujii T, Miura S, Yasuda H, Abe T, Andoh K, Iida Y, Ishihara T, Ide K, Ito K, Ito Y, Inata Y, Utsunomiya A, Unoki T, Endo K, Ouchi A, Ozaki M, Ono S, Katsura M, Kawaguchi A, Kawamura Y, Kudo D, Kubo K, Kurahashi K, Sakuramoto H, Shimoyama A, Suzuki T, Sekine S, Sekino M, Takahashi N, Takahashi S, Takahashi H, Tagami T, Tajima G, Tatsumi H, Tani M, Tsuchiya A, Tsutsumi Y, Naito T, Nagae M, Nagasawa I, Nakamura K, Nishimura T, Nunomiya S, Norisue Y, Hashimoto S, Hasegawa D, Hatakeyama J, Hara N, Higashibeppu N, Furushima N, Furusono H, Matsuishi Y, Matsuyama T, Minematsu Y, Miyashita R, Miyatake Y, Moriyasu M, Yamada T, Yamada H, Yamamoto R, Yoshida T, Yoshida Y, Yoshimura J, Yotsumoto R, Yonekura H, Wada T, Watanabe E, Aoki M, Asai H, Abe T, Igarashi Y, Iguchi N, Ishikawa M, Ishimaru G, Isokawa S, Itakura R, Imahase H, Imura H, Irinoda T, Uehara K, Ushio N, Umegaki T, Egawa Y, Enomoto Y, Ota K, Ohchi Y, Ohno T, Ohbe H, Oka K, Okada N, Okada Y, Okano H, Okamoto J, Okuda H, Ogura T, Onodera Y, Oyama Y, Kainuma M, Kako E, Kashiura M, Kato H, Kanaya A,
Kaneko T, Kanehata K, Kano KI, Kawano H, Kikutani K, Kikuchi H, Kido T, Kimura S, Koami H, Kobashi D, Saiki I, Sakai M, Sakamoto A, Sato T, Shiga Y, Shimoto M, Shimoyama S, Shoko T, Sugawara Y, Sugita A, Suzuki S,Suzuki Y, Suhara T, Sonota K, Takauji S, Takashima K, Takahashi S, Takahashi Y, Takeshita J, Tanaka Y, Tampo A, Tsunoyama T, Tetsuhara K, Tokunaga K, Tomioka Y, Tomita K, Tominaga N, Toyosaki M, Toyoda Y, Naito H, Nagata I,
Nagato T, Nakamura Y, Nakamori Y, Nahara I, Naraba H, Narita C, Nishioka N, Nishimura T, Nishiyama K, Nomura T, Haga T, Hagiwara Y, Hashimoto K, Hatachi T, Hamasaki T, Hayashi T, Hayashi M, Hayamizu A, Haraguchi G, Hirano Y, Fujii R, Fujita M, Fujimura N, Funakoshi H, Horiguchi M, Maki J, Masunaga N, Matsumura Y, Mayumi T, Minami K, Miyazaki Y, Miyamoto
K, Murata T, Yanai M, Yano T, Yamada K, Yamada N, Yamamoto T, Yoshihiro S, Tanaka H, Nishida O. The Japanese Clinical Practice Guidelines for Management of Sepsis and Septic Shock 2020 (J-SSCG 2020). Acute Med Surg. 2021;8(1): e659.
72. Kienast J, Juers M, Wiedermann CJ, Hoffmann JN, Ostermann H, Strauss R, Keinecke HO, Warren BL, Opal SM, KyberSept investigators. Treatment effects of high-dose antithrombin without concomitant heparin in patients with severe sepsis with or without disseminated intravascular coagulation. J Thromb Haemost. 2006;4(1):90–7.
73. Tagami T. Antithrombin concentrate use in sepsis-associated disseminated intravascular coagulation: re-evaluation of a “pendulum effect” drug using a nationwide database. J Thromb Haemost. 2018;16(3):458–61.
74. Kuroda H, Masuda Y. Comparison of protective effects of recombinant antithrombin gamma and plasma-derived antithrombin on sepsisinduced disseminated intravascular coagulation and multiple organ failure. Clin Appl Thromb Hemost. 2020. https:// doi. org/ 10. 1177/ 10760
29620 981630.
75. Endo S, Shimazaki R, Antithrombin Gamma Study Group. An open-label,randomized, phase 3 study of the efficacy and safety of antithrombin gamma in patients with sepsis-induced disseminated intravascular coagulation syndrome. J Intensive Care. 2018;6:75.
76. Murao A, Kato T, Yamane T, Honda G, Eguchi Y. Benefit profile of thrombomodulin
alfa combined with antithrombin concentrate in patients with sepsis-induced disseminated intravascular coagulation. Clin Appl Thromb Hemost. 2022;28:10760296221077096.
77. Iba T, Umemura Y, Watanabe E, Wada T, Hayashida K, Kushimoto S, Japanese Surviving Sepsis Campaign Guideline Working Group for disseminated intravascular coagulation. Diagnosis of sepsis-induced disseminated intravascular coagulation and coagulopathy. Acute Med Surg.2019;6(3):223–32.
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 23.10.2024 00:01:00
[~DATE_ACTIVE_FROM] => 23.10.2024 00:01:00
[ACTIVE_FROM_X] => 2024-10-23 00:01:00
[~ACTIVE_FROM_X] => 2024-10-23 00:01:00
[ACTIVE_FROM] => 23.10.2024 00:01:00
[~ACTIVE_FROM] => 23.10.2024 00:01:00
[SHOW_COUNTER] => 567
[~SHOW_COUNTER] => 567
[ID] => 8474
[~ID] => 8474
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => html
[~PREVIEW_TEXT_TYPE] => html
[TIMESTAMP_X] => 11.11.2024 13:53:29
[~TIMESTAMP_X] => 11.11.2024 13:53:29
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/patofiziologiya-diagnostika-i-lechenie-sepsis-assotsiirovannogo-disseminirovannogo-vnutrisosudistogo/
[~DETAIL_PAGE_URL] => /library/articles/patofiziologiya-diagnostika-i-lechenie-sepsis-assotsiirovannogo-disseminirovannogo-vnutrisosudistogo/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => patofiziologiya-diagnostika-i-lechenie-sepsis-assotsiirovannogo-disseminirovannogo-vnutrisosudistogo
[~CODE] => patofiziologiya-diagnostika-i-lechenie-sepsis-assotsiirovannogo-disseminirovannogo-vnutrisosudistogo
[EXTERNAL_ID] => 8474
[~EXTERNAL_ID] => 8474
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 23 октября 2024
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Патофизиология, диагностика и лечение сепсис-ассоциированного диссеминированного внутрисосудистого свертывания крови
[PREVIEW_PICTURE] => Array
(
[ID] => 5761
[TIMESTAMP_X] => 11.11.2024 13:53:29
[MODULE_ID] => iblock
[HEIGHT] => 4000
[WIDTH] => 6000
[FILE_SIZE] => 8575740
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/edc/zulasr7sxzezl257yf7ves06do1f0juq
[FILE_NAME] => representation-microorganisms-concept.jpg
[ORIGINAL_NAME] => representation-microorganisms-concept.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => bb22f227f2afc09963eac61fadd2c8f1
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/edc/zulasr7sxzezl257yf7ves06do1f0juq/representation-microorganisms-concept.jpg
[UNSAFE_SRC] => /upload/iblock/edc/zulasr7sxzezl257yf7ves06do1f0juq/representation-microorganisms-concept.jpg
[SAFE_SRC] => /upload/iblock/edc/zulasr7sxzezl257yf7ves06do1f0juq/representation-microorganisms-concept.jpg
[ALT] => Патофизиология, диагностика и лечение сепсис-ассоциированного диссеминированного внутрисосудистого свертывания крови
[TITLE] => Патофизиология, диагностика и лечение сепсис-ассоциированного диссеминированного внутрисосудистого свертывания крови
)
[DETAIL_TEXT] => Journal of Intensive Care (2023) 11:24 doi.org/10.1186/s40560-023-00672-5
The pathophysiology, diagnosis, and management of sepsis‑associated disseminated intravascular coagulation
Toshiaki Iba, Julie Helms, Jean Marie Connors and Jerrold H. Levy
Аннотация
Международное общество по тромбозу и гемостазу (ISTH) опубликовало диагностические критерии явного диссеминированного внутрисосудистого свертывания (ДВС) в 2001 году. С тех пор ДВС-синдром понимается как конечная стадия коагулопатии потребления, а не терапевтическая цель. Однако ДВС-синдром — это не просто декомпенсированное нарушение коагуляции, но также включает ранние стадии с системной активацией коагуляции. Таким образом, ISTH недавно опубликовало критерии коагулопатии, вызванной сепсисом (SIC), которые позволяют диагностировать компенсированную фазу коагулопатии с помощью легкодоступных биомаркеров.
ДВС-синдром - это лабораторный диагноз, обусловленный различными критическими состояниями, при этом сепсис является наиболее распространенным заболеванием, сопровождающимся развитием ДВС-синдрома.
Патофизиология ДВС-синдрома, связанного с сепсисом, многофакторна, и в дополнение к активации коагуляции с подавленным фибринолизом, множественные воспалительные реакции инициируются активированными лейкоцитами, тромбоцитами и сосудистыми эндотелиальными клетками как часть тромбовоспаления. Хотя ISTH установил явные диагностические критерии ДВС для диагностики его поздней стадии, для потенциальных терапевтических соображений требовались дополнительные критерии, которые могут обнаружить более раннюю стадию ДВС. Соответственно, ISTH ввел критерии SIC в 2019 году, которые просты в использовании и требуют только количества тромбоцитов, протромбинового времени, международного нормализованного отношения и оценки по шкале SOFA. Шкала SIC может использоваться для оценки тяжести заболевания и определения сроков потенциальных терапевтических вмешательств. Одним из основных недостатков лечения ДВС-синдрома, связанного с сепсисом, является отсутствие конкретных терапевтических подходов, выходящих за рамки лечения основной инфекции. Клинические испытания на сегодняшний день не увенчались успехом, поскольку включали пациентов, не страдающих коагулопатией. Тем не менее, в дополнение к контролю инфекции, антикоагулянтная терапия будет выбором при ДВС-синдроме, связанном с сепсисом. Поэтому эффективность гепарина, антитромбина и рекомбинантного тромбомодулина должна быть доказана в будущих клинических исследованиях.
Необходимо разработать новую терапевтическую стратегию против ДВС-синдрома, связанного с сепсисом, чтобы улучшить результаты. Следовательно, мы рекомендуем скрининг и мониторинг ДВС-синдрома с использованием системы оценок SIC.
Ключевые слова: Сепсис, Диссеминированное внутрисосудистое свертывание, Коагулопатия, Эндотелиальная клетка, Антитромбин, Тромбомодулин
Введение
Гемостаз - фундаментальный механизм защиты хозяина от различных патофизиологических нарушений, клинически проявляется в виде макро- и микротромбоза при острых травмах и у пациентов в критическом состоянии. Хотя гемостатический ответ полезен в некоторых условиях, избыточное тромбовоспаление
также вызывает нарушение кровообращения в тканях и вызывает последующую дисфункцию органов [1]. Системная гиперкоагуляция с коагулопатией потребления или без нее часто возникает после серьезного повреждения тканей, и на основании лабораторных диагностических критериев ациентам клинически ставится диагноз ДВС [2]. Патофизиология, фенотипическое проявление и методы лечения ДВС-синдрома значительно различаются в зависимости от основного его вызывающего заболевания [3, 4].
Однако сепсис является наиболее частой и опасной для жизни причиной ДВС-синдрома и обычно проявляется как тромботический тип ДВС-синдрома [5, 6]. Этот тип ДВС-синдрома часто осложняется дисфункцией органов, при этом геморрагические события происходят реже [7]. Состояние коагуляции динамически изменяется в зависимости от прогрессирования основного заболевания. ДВС-синдром, связанный с сепсисом, является динамическим состоянием, которое начинается с нарушения коагуляции, может перейти в коагулопатию, индуцированную сепсисом (SIC), и, наконец, в декомпенсированное нарушение коагуляции (явный ДВС-синдром) (Fig. 1).

Использование антикоагулянтов предполагается при компенсированном ДВС-синдроме, а декомпенсированная стадия может потребовать дополнительных методов тарапии [8, 9]. Последние достижения в лечении ДВС-синдрома, связанного с сепсисом, включают разработку ранних диагностических критериев на основе легкодоступной клинической информации и назначение потенциально эффективных антикоагулянтов [4, 10]. В этом обзоре основное внимание будет уделено достижениям в диагностике и лечении ДВС-синдрома, связанного с сепсисом, а также будущим перспективам.
Патофизиология ДВС-синдрома, связанного с сепсисом
Моноциты/макрофаги являются первой линией реагирования и фагоцитируют патогены, обнаруживая бактерии путем распознавания специфических молекулярных паттернов и вызывая провоспалительные и прокоагулянтные реакции для их захвата и локализации [11]. В качестве паттерн-распознающих рецепторов моноциты/макрофаги экспрессируют Toll-подобные рецепторы (TLR), Fcγ-рецепторы и G-белок-связанные рецепторы, которые распознают патоген-ассоциированные молекулярные паттерны (PAMPs), впоследствии интегрируя врожденную иммунную систему, а также систему коагуляции [12]. TLR не только реагируют на PAMP, но и передают сигналы молекулярных паттернов, ассоциированных с повреждением (DAMP), тем самым инициируя порочный цикл воспаления и коагуляции [13].
После последующей многоэтапной передачи сигнала моноциты/макрофаги продуцируют провоспалительные цитокины и хемокины, которые активируют нейтрофилы и повышают экспрессию тканевого фактора (TF) и фосфатидилсерина (PS) на клеточной мембране [14]. TF и PS инициируют внешние и внутренние каскады коагуляции и способствуют протромботическим реакциям.
Активированные нейтрофилы уничтожают патогены с помощью протеаз, реактивных форм кислорода, высвобождая внеклеточные ловушки нейтрофилов (NETs) и способствуя дальнейшему распространению воспаления с помощью механизмов гибели клеток [15]. Пироптоз, некроптоз, NETosis и некроз являются репрезентативными механизмами клеточной смерти, которые усиливают воспаление и коагуляцию путем высвобождения DAMPs и других цитотоксических веществ [16].
Тромбоциты также участвуют в защите хозяина, способствуя образованию тромба посредством экспрессии молекул адгезии, высвобождая компоненты гранул, такие как тромбоцитарный фактор 4 (PF4), фактор фон Виллебранда (VWF) [17] и прокоагулянтные микровезикулы [18]. Эти реакции приводят к образованию внутрисосудистых микротромбов (иммунотромбозу) для защиты хозяина от инфекции (Fig. 2). Среди факторов коагуляции тромбин является критическим медиатором, который регулирует воспаление и коагуляцию [19]. Моноциты, нейтрофилы, тромбоциты и эндотелиальные клетки также экспрессируют протеазно-активируемый рецептор-1 (PAR-1), а тромбин усиливает провоспалительные и прокоагулянтные реакции, связываясь с PAR-1 [19, 20].

После острой воспалительной реакции, вызванной сепсисом, эндотелиальные клетки сосудов теряют свои антитромботические свойства под воздействием факторов, включающих снижение выработки оксида азота/простагландина I2 и разрушение гликокаликса.
Тромбомодулин подвергается протеолитическому расщеплению и высвобождается с поверхности эндотелия. Кроме того, повышается выработка ингибитора активатора плазминогена 1 (PAI-1), и подавление фибринолиза становится очевидным. Это подавление фибринолиза является критической особенностью нарушения коагуляции при сепсисе (фибринолитическое отключение). Поврежденные эндотелиальные клетки высвобождают тромбогенные молекулы, включая VWF и молекулы адгезии, и стимулируют адгезию и агрегацию тромбоцитов [21]. Кроме того, физиологические антикоагулянтные факторы, такие как антитромбин и протеин С, подвергаются экстравазации за счет повышенной проницаемости сосудов [22]. Эти события способствуют распространенному образованию микротромбов при сепсисе (рис. 3).

It has not been well-known, but the ISTH has also defined non-overt DIC diagnostic criteria determined by sensitive and specific molecular markers that include antithrombin, protein C, or thrombin–antithrombin (TAT) complexes [23].
Диагностика ДВС-синдрома, связанного с сепсисом
ДВС-синдром определяется как системная активация коагуляции, а не как коагулопатия потребления [23], но многие врачи считают ДВС-синдром декомпенсированным нарушением коагуляции, возможно, из-за определения явных критериев ДВС Международным обществом по тромбозу и гемостазу (ISTH) в 2001 году, которое определяется как тромбоцитопения, значительное удлинение протромбинового времени (ПТВ), умеренное или значительное повышение уровня маркеров, связанных с фибрином, и/или снижение уровня фибриногена. До сих пор не было общеизвестным, но ISTH также определил критерии диагностики скрытого ДВС, определяемые чувствительными и специфическими молекулярными маркерами, включающими антитромбин, протеин С или комплексы тромбин-антитромбин (ТАТ) [23]. Однако у многих пациентов развился явный ДВС-синдром независимо от неявного ДВС-синдрома. Кроме того, поскольку молекулярные маркеры не использовались клинически, они не подходили для диагностики неявного ДВС-синдрома. Несмотря на наличие этих классических определений и критериев, для определения потенциальной терапевтической цели потребовалось установление новых диагностических критериев ДВС-синдрома. Japanese Society for Acute Medicine (JAAM) опубликовало свои критерии компенсированного ДВС-синдрома, используя легкодоступные лабораторные тесты и клинические данные в 2006 году [24]. Однако после обновления определения сепсиса до Sepsis-3 [25, 26] критерии ДВС JAAM устарели, поскольку критерии ДВС JAAM включали оценку синдрома системного воспалительного ответа (SIRS). Затем в 2017 году были введены критерии SIC для диагностики раннего начала ДВС-синдрома при сепсисе [27].
Критерии SIC определяются наличием сепсиса (инфекция с органной недостаточностью [увеличение (SOFA)]) и нарушением коагуляции (снижение количества тромбоцитов и увеличение PT-INR) [27] (Table 1). Измерение количества тромбоцитов и PT-INR являются рутинными клиническими тестами, а оценка SOFA представляет собой легко рассчитываемую клиническую оценку, используемую для оценки тяжести сепсиса [28].

Скрининг на ДВС у пациентов с сепсисом имеет важное значение на основании результатов большого японского исследования, в котором сообщалось об эффективности антикоагулянтной терапии у пациентов с коагулопатией и высоким риском смерти [29].
После дополнительных клинических отчетов [30, 31] диагностические критерии SIC были одобрены Комитетом по научной стандартизации ISTH DIC (SSC) [32, 33]. Клинически значимость критериев SIC заключается в их простоте и способности облегчать выбор времени антикоагулянтной терапии [34].
Критерии JAAM DIC широко используются для диагностики ДВС-синдрома, связанного с сепсисом, в Японии. Чтобы отметить превосходство оценки SIC над оценкой JAAM DIC, мы должны показать лучший эффект лечения, основанный на диагностике SIC, чем на диагностике JAAM DIC. Однако такое исследование еще не проводилось. Но критерии SIC проще, чем критерии JAAM DIC, менее затратны и, следовательно, более подходят для мониторинга. Критерии SIC были специально разработаны для сепсис-ассоциированного ДВС. Аналогичным образом, установление специфики заболевания может позволить нам разработать простые и лучшие критерии; мы считаем, что этот подход должен быть распространен на другие области ДВС-синдрома, т. е. гематологический ДВС-синдром и ДВС-синдром, вызванный раком.
Распространенность и смертность от ДВС-синдрома, связанного с сепсисом
При сепсисе распространенность ДВС-синдрома варьирует в зависимости от целевых когорт и диагностических критериев, но смертность всегда выше у пациентов с ДВС-синдромом по сравнению с пациентами без него. Gando et al. [35] исследовали распространенность и смертность от явного ДВС-синдрома и ДВС-синдрома с JAAM DIC у пациентов с сепсисом (сепсис-1) и сообщили, что они составили 18,1% против 46,8% и 38,1% против 38,4% соответственно. Другое ретроспективное когортное исследование изучало распространенность и смертность от явного ДВС-синдрома, ДВС-синдрома с JAAM DIC и SIC у 1892 пациентов с сепсисом (сепсис-1) и сообщили, что они составили 29,3% и 38,4%, 61,4% и 33,9% и 60,8% и 32,5% соответственно [36]. Данные когорты пациентов с сепсисом-3 из 296 человек показали, что распространенность явного ДВС-синдрома, ДВС-синдрома с измененной шкалой JAAM DIC (оценка SIRS была заменена на активность антитромбина) и SICсоставила 22,6%, 43,2% и 56,1%, а 28-дневная смертность составила 55,2%, 47,7% и 44,0% соответственно [37].
Эти данные свидетельствуют о том, что распространенность ДВС-синдрома различается в зависимости от определений, но смертность от ДВС-синдрома, связанного с сепсисом, превысила 30% независимо от диагностических критериев. Основной целью диагностики ДВС-синдрома является не прогнозирование результатов, а определение сроков начала лечения, поскольку у пациентов с ДВС-синдромом наблюдается более высокая смертность по сравнению с пациентами без ДВС-синдрома [38]. Следует отметить, что недавние исследования подтверждают идею о том, что антикоагулянтная терапия более эффективна для пациентов с коагулопатией/ДВС-синдромом и высокой тяжестью заболевания [38, 39]. Кроме того, оценки JAAM DIC и SICотражают тяжесть заболевания, и была описана связь между оценками и смертностью [24, 27]. Lu et al. [40] оценили эффективность оценки SIC у 9432 пациентов с сепсисом и сообщили, что 28-дневная смертность составила 34% у пациентов с SIC по сравнению с 25% у пациентов без SIC . Они также сообщили, что наличие SIC было независимым фактором риска 28-дневной смертности со скорректированным отношением шансов 1,52 (95% [ДИ]: от 1,39 до 1,67).
Эффективность системы оценки SIC
Полезность диагностических критериев была изучена путем оценки их эффективности для выявления пациентов с высоким риском смерти. Wang et al. [37] сравнили эффективность различных диагностических критериев ДВС, включая SIC, модифицированный JAAM DIC, упрощенный Japanese Society on Thrombosis and Hemostasis ДВС и явные критерии ДВС в прогнозировании 28-дневной смертности и сообщили, что площадь под кривыми (AUC) не различалась среди диагностических критериев (AUC: от 0,730 до 0,763); тем не менее, важно, что SIC является самым простым критерием среди них, а отношение шансов к смерти было самым высоким и составило 5,218 (95% ДИ: от 2,878 до 9,459, P < 0,001).
В качестве скринингового теста, такого как оценка SIC, ожидаемая эффективность заключается в способности отрицать смерть при отрицательном результате SIC.
В этом смысле отрицательная прогностическая ценность для 28-дневной смертности также была самой высокой при SIC и составила 86,9%. Аналогичные результаты были подтверждены в нескольких исследованиях, и сообщалось, что оценка SIC связана с тяжестью заболеваний [40–49]. Основной целью диагностики ДВС было не выявление пациентов с сепсисом с высоким риском смерти, а выявление пациентов, которым может быть полезна антикоагулянтная терапия. Zou et al. [47] ретроспективно оценили 6646 пациентов с сепсисом и сообщили о связи между введением гепарина и более низкой смертностью только у пациентов с SIC (коэффициент риска [HR]: 0,74, 95% ДИ: 0,65–0,85).
Напротив, эта связь не наблюдалась у пациентов без SIC (HR: 0,95, 95% ДИ: 0,64–1,40). Peng et al. [48] также изучили влияние гепарина на пациентов с сепсисом в своем ретроспективном исследовании и пришли к выводу, что пациенты с SIC могут быть хорошими кандидатами на терапию гепарином. В их исследовании у большинства пациентов с явной ДВС была диагностирована сепсисиндуцированная коагулопатия (SIC), а у большинства пациентов с явной ДВС ранее был поставлен диагноз SIC [30]. Таким образом, SIC предшествует явному ДВС, и пациенты переходят от SIC к явному ДВС по мере прогрессирования заболевания.
Одним из ограничений критериев SIC является риск неправильной диагностики заболеваний, имитирующих ДВС-синдром, который может быть немалым, поскольку включены только два биомаркера коагуляции. Например, нелегко дифференцировать тромботические микроангиопатические (ТМА) расстройства, такие как тромботическая тромбоцитопеническая пурпура (ТТP) [49] и атипичный гемолитико-уремический синдром (aHUS ) [50], а также гепарин-индуцированную тромбоцитопению (HIT) от SIC [51]. Для поддержки точной диагностики ISTH DIC SSC предоставляет блок-схему, которая помогает в систематической дифференциальной диагностике [52]. Хотя удлинение PT-INR является незначительным, ТМА- расстройства обычно сопровождаются значительной тромбоцитопенией и достигают достаточных баллов. Уменьшение количества тромбоцитов более выражено, а изменения в ПВ более незначительны при ТТP, aHUS и HIT , а баланс количества тромбоцитов и PTможет быть полезен для дифференциации.
Кроме того, активность антитромбина, биомаркера повреждения эндотелия, значительно снижена при SIC и ДВС [53, 54], но обычно сохраняется при TMA и может быть полезна для дифференциальной диагностики [55, 56]. Известно, что уровень антитромбина снижается на ранней стадии ДВС. Jackson Chornenki et al. [57] сообщили, что количество тромбоцитов и PT-INR в сочетании с активностью антитромбина могут идентифицировать раннюю стадию ДВС у пациентов с сепсисом. Хотя заболеваемость невысока, дифференциальная диагностика этих заболеваний, имитирующих ДВС, имеет решающее значение, поскольку смертность значительно высока при неправильном лечении.
Как нам следует лечить ДВС-синдром, связанный с сепсисом?
Лечение основного заболевания имеет важное значение при ДВС-синдроме, но для ДВС-синдрома, связанного с сепсисом, дополнительное лечение продолжающейся плохой перфузии тканей имеет решающее значение в клиническом ведении. Однако мало доказательств, подтверждающих эффективность антикоагулянтной терапии в дополнение к антибиотикам и контролю источника. Несмотря на исследования нескольких антикоагулянтов в масштабных рандомизированных контролируемых исследованиях (РКИ), ни один из современных антикоагулянтов еще не продемонстрировал эффективности [61,63]. Возможные причины включают изменчивость клинической картины сепсиса [61], но, как ранее было описано, антикоагулянтную терапию следует рассматривать только для пациентов с нарушением коагуляции, оптимальной целью является ДВС-синдром, связанный с сепсисом, с высокой тяжестью заболевания [38, 39] (Fig. 4).

Гепарин
Гепарин обычно используется у пациентов с сепсисом по нескольким причинам. Однако ни одно крупное рандомизированное контролируемое исследование не изучало гепарин отдельно при ДВС-синдроме, связанном с сепсисом. Недавний метаанализ показал, что нефракционированный гепарин может снизить смертность от сепсиса, особенно у пациентов с высокой степенью тяжести [62]. Однако исследуемая популяция не ограничивалась пациентами с коагулопатией/ДВС-синдромом. Другой систематический обзор гепарина при ДВС-синдроме [63] был ограничен включением исследований, в которых три из восьми исследований использовали гепарин в качестве контроля. Хотя гепарин настоятельно рекомендуется для лечения COVID-19 [64], его эффективность при ДВС-синдроме, связанном с сепсисом, до сих пор неясна. РКИ, проведенное в Японии, сравнило эффективность и безопасность рекомбинантного тромбомодулина с гепарином при ДВС-синдроме, связанном с гематологическими злокачественными новообразованиями или инфекциями. В анализе подгрупп были подвергнуты анализу 80 пациентов с ДВС-синдромом, связанным с сепсисом. Результаты показали, что частота разрешения ДВС-синдрома в группе рекомбинантного тромбомодулина и группе гепарина составила 67,5% и 55,6%, а частота 28-дневной смертности составила 21,4% и 31,6% соответственно [65].
Рекомбинантный тромбомодулин
Рекомбинантный тромбомодулин был разработан и одобрен для клинического использования в Японии в 2008 году для лечения ДВС-синдрома [66]. Как было описано ранее, Aikawa et al. [65] провели анализ подгрупп 80 пациентов с ДВС-синдромом, связанным с сепсисом, из исследования фазы 3 [67] и сообщили о лучшей эффективности рекомбинантного тромбомодулина. Последующее исследование SCARLET, о котором сообщалось в 2019 году, включало пациентов с сепсисом с коагулопатией и дисфункцией органов (сердечно-сосудистая и/или дыхательная недостаточность, количество тромбоцитов от 30 до 150 × 109/л или > 30%-ное снижение в течение 24 ч и PT-INR > 1,4 [оценка SIC > 4]) [68]. Несмотря на то, что разница не была статистически значимой в intention-to-treat популяции, наблюдалась тенденция к улучшению 28-дневной выживаемости в подгруппе, которая соответствовала исходным критериям (разница: 5,40%, 95% ДИ: от -1,68% до 12,48%).
В этом исследовании была отмечена значительная разница в различных межданародных когортах, и post hocанализ выявил абсолютное снижение риска на 8,3% во французской популяции по сравнению с 1,1% в остальном мире; считалось, что больший эффект во французской когорте был обусловлен более высокой частотой устойчивой коагулопатии и более низкой частотой использования гепарина [69]. Примечательно, что все РКИ показали тенденции к лучшим результатам в группе лечения, а метаанализ РКИ показал значительное улучшение показателей смертности [70]. Следовательно, рекомбинантный тромбомодулин рекомендуется для ДВС-синдрома, связанного с сепсисом, в руководствах по сепсису в Японии [71].
Антитромбин
Крупнейшее РКИ, в котором изучалось действие антитромбина, было проведено при тяжелом сепсисе, но не у пациентов с ДВС-синдромом, связанным с сепсисом [58]. Однако Kienast et al. [72] провели постфактум-анализ у 563 пациентов (группа антитромбина: n = 286 и группа плацебо: n = 277), у которых был ДВС-синдром и которые не получали сопутствующий гепарин, и сообщили об абсолютном снижении 28-дневной смертности на 14,6% в группе антитромбина (P = 0,02), тогда как у пациентов без ДВС-синдрома такого эффекта не наблюдалось. Антитромбин используется для лечения ДВС-синдрома в Японии, и это включено в рекомендации по сепсису [71]. Японские рекомендации основаны на данных Tagami et al. [73], которые провели анализ с сопоставлением показателей предрасположенности, используя общенациональную базу данных, состоящую из 9075 пациентов с пневмонией с ДВС-синдромом, связанным с сепсисом (антитромбин: n = 2663 и контроль: n = 6412), и создали сопоставленную когорту из 2194 пар. Результат показал разницу в смертности между группами (антитромбин: 40,6% против контроля: 44,2%, P = 0,02). Кроме того, множественный логистический регрессионный анализ показал связь между использованием антитромбина и 28-дневной смертностью ([OR] 0,85, 95% CI: 0,75–0,97). В дополнение к продукту, полученному из плазмы, в Японии в 2015 году был одобрен рекомбинантный антитромбин (антитромбин-γ), и в небольших исследованиях сообщалось о более высоких показателях с точки зрения улучшения показателей ДВС и SOFA [74, 75]. В соответствии с этими отчетами, японские руководства по сепсису рекомендуют использовать антитромбин и рекомбинантный тромбомодулин для ДВС, связанного с сепсисом [71]. Недавно сообщалось о потенциально полезном эффекте комбинированной терапии антитромбина с рекомбинантным тромбомодулином, особенно в тяжелых случаях [76]. Эффект этой комбинированной терапии следует изучить в будущем исследовании.
Перспективы на будущее
Смертность, связанная с сепсисом, а также с ДВС-синдромом, связанным с сепсисом, остается высокой и превышает 30%. Накопленные данные свидетельствуют о том, что антикоагулянтная терапия эффективна для пациентов в критическом состоянии с нарушениями коагуляции. Сепсис — это системная реакция, которая вызывает острую полиорганную дисфункцию и поддается лечению антибиотиками и контролем источника на ранней стадии. Однако состояние ухудшается, когда течение заболевания осложняется нарушением коагуляции. Поэтому важно регулярно проводить скрининг и мониторинг изменений коагуляции у пациентов с сепсисом с помощью легкодоступных методов. Этот обзор фокусируется на ДВС-синдроме, связанном с сепсисом, а не охватывает все типы ДВС.
Система оценки SIC специально разработана для диагностики ДВС-синдрома, связанного с сепсисом, на ранней стадии, проста и удобна для расчета, что делает ее полезной для целей скрининга и мониторинга ДВС-синдрома у больных сепсисом. Такой скрининг и мониторинг проводились в Японии с использованием критериев JAAM ДВС. Однако, поскольку расчет оценки SIRS больше не использовался при диагностике сепсиса, необходимо обновление. SIC был введен в Японии Japanese Sepsis Guideline Working Group в 2019 году в качестве альтернативного диагностического критерия [77], и он будет включен в следующую версию руководства по сепсису. Что касается лечения SIC, то гепарины, антитромбин и рекомбинантный тромбомодулин являются текущим выбором сепсис- ассоциированного ДВС-синдрома.
Since activation in coagulation is a part of host defense mechanisms, the selection of targets and the choice of agents are also important. Since anticoagulation has increasingly attracted attention [4, 8, 10], it is necessary to set up international collaborative studies that adopt proper endpoints.
Пока ни один из них не имеет надежных доказательств эффективности. Существуют некоторые препятствия для разработки клинических испытаний, которые доказывают эффективность этих антикоагулянтов. Во-первых, конечная точка была установлена как разница в смертности; однако существует множество факторов, которые влияют на исход для пациента, и более сложная конечная точка, которая отражает эффект лечения антикоагулянтами, является оправданной. Во-вторых, определение оптимальной дозы, продолжительности и прекращения лечения не является простым.
Поскольку активация свертывания крови является частью защитных механизмов хозяина, выбор мишеней и выбор агентов также важен. Поскольку антикоагуляция привлекает все больше внимания [4, 8, 10], необходимо организовать международные совместные исследования, в которых будут приняты соответствующие конечные точки.
Заключение
ДВС-синдром является распространенным осложнением при сепсисе. Хотя смертность от ДВС-синдрома, связанного с сепсисом, высока, раннее выявление и своевременное вмешательство важны для улучшения результатов. ДВС-синдром является лабораторным диагнозом, и ISTH DIC SSC ввел критерии SIC, которые просты, легко поддаются расчету и подходят для повторной оценки для выявления пациентов с сепсисом с риском прогрессирования до явного ДВС-синдрома и смерти. Несмотря на достижения в исследованиях патофизиологии, терапевтические средства для улучшения результатов сепсиса, выходящие за рамки антимикробного лечения, никогда не рекомендовались в большинстве стран. Хотя рекомбинантный тромбомодулин и антитромбин одобрены японскими руководствами по сепсису, необходимы дальнейшие перспективные международные совместные исследования.
References
1. Lelubre C, Vincent JL. Mechanisms and treatment of organ failure in sepsis. Nat Rev Nephrol. 2018;14(7):417–27.
2. Squizzato A, Gallo A, Levi M, Iba T, Levy JH, Erez O, Ten Cate H, Solh Z, Gando S, Vicente V, Di Nisio M. Underlying disorders of disseminated intravascular coagulation: communication from the ISTH SSC Subcommittees on Disseminated Intravascular Coagulation and Perioperative and Critical Care Thrombosis and Hemostasis. J Thromb Haemost.2020;18(9):2400–7.
3. Levi M, Sivapalaratnam S. Disseminated intravascular coagulation: an update on pathogenesis and diagnosis. Expert Rev Hematol. 2018;11(8):663–72.
4. Iba T, Levi M, Thachil J, Levy JH. Disseminated intravascular coagulation:the past, present, and future considerations. Semin Thromb Hemost.2022;48(8):978–87.
5. Yamakawa K, Ohbe H, Taniguchi K, Matsui H, Fushimi K, Yasunaga H. Time trends of the outcomes and treatment options for disseminated intravascular coagulation: a nationwide observational study in Japan. JMA J.2020;3(4):313–20.
6. Adelborg K, Larsen JB, Hvas AM. Disseminated intravascular coagulation: epidemiology, biomarkers, and management. Br J Haematol.2021;192(5):803–18.
7. Chang JC. Disseminated intravascular coagulation: new identity as endotheliopathy-associated vascular microthrombotic disease based on in vivo hemostasis and endothelial molecular pathogenesis. Thromb J. 2020;18:25.
8. Helms J, Iba T, Connors JM, Gando S, Levi M, Meziani F, Levy JH. How to manage coagulopathies in critically ill patients? Int Care Med.2023;49(3):273–90.
9. Scully M, Levi M. How we manage haemostasis during sepsis. Br J Haematol. 2019;185(2):209–18.
10. Iba T, Connors JM, Nagaoka I, Levy JH. Recent advances in the research and management of sepsis-associated DIC. Int J Hematol.2021;113(1):24–33.
11. Futosi K, Fodor S, Mocsai A. Neutrophil cell surface receptors and their intracellular signal transduction pathways. Int Immunopharmacol. 2013;17(3):638–50.
12. Iba T, Levi M, Levy JH. Intracellular communication and immunothrombosis in sepsis. J Thromb Haemost. 2022;20(11):2475–84.
13. Salomao R, Martins PS, Brunialti MK, Fernandes Mda L, Martos LS, Mendes ME, Gomes NE, Rigato O. TLR signaling pathway in patients with sepsis. Shock. 2008;30(Suppl 1):73–7.
14. Gould TJ, Lysov Z, Swystun LL, Dwivedi DJ, Zarychanski R, Fox-Robichaud AE, Liaw PC, Canadian Critical Care Translational Biology Group. Extracellular histones increase tissue factor activity and enhance thrombin generation by human blood monocytes. Shock. 2016;46(6):655–62.
15. Kolaczkowska E, Kubes P. Neutrophil recruitment and function in health and inflammation. Nat Rev Immunol. 2013;13(3):159–75.
16. Perez-Figueroa E, Alvarez-Carrasco P, Ortega E, Maldonado-Bernal C. Neutrophils: many ways to die. Front Immunol. 2021;12: 631821.
17. Assinger A, Schrottmaier WC, Salzmann M, Rayes J. Platelets in sepsis: an update on experimental models and clinical data. Front Immunol.2019;10:1687.
18. Reid VL, Webster NR. Role of microparticles in sepsis. Br J Anaesth. 2012;109(4):503–13.
19. Ma L, Dorling A. The roles of thrombin and protease-activated receptors in inflammation. Semin Immunopathol. 2012;34(1):63–72.
20. Jose RJ, Williams AE, Mercer PF, Sulikowski MG, Brown JS, Chambers RC. Regulation of neutrophilic inflammation by proteinase-activated receptor 1 during bacterial pulmonary infection. J Immunol. 2015;194(12):6024–34.
21. Joffre J, Hellman J, Ince C, Ait-Oufella H. Endothelial responses in sepsis. Am J Respir Crit Care Med. 2020;202(3):361–70.
22. Ito T, Kakuuchi M, Maruyama I. Endotheliopathy in septic conditions: mechanistic insight into intravascular coagulation. Crit Care.2021;25(1):95.
23. Taylor FB Jr, Toh CH, Hoots WK, Wada H, Levi M, Scientific Subcommittee on Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost. 2001;86(5):1327–30.
24. Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K, Mayumi T,Murata A, Ikeda T, Ishikura H, Ueyama M, Ogura H, Kushimoto S, Saitoh D, Endo S, Shimazaki S, Japanese Association for Acute Medicine multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med. 2006;34(3):625–31.
25. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, Bellomo R, Bernard GR, Chiche JD, Coopersmith CM, Hotchkiss RS, Levy MM, Marshall JC, Martin GS, Opal SM, Rubenfeld GD, van der Poll T, Vincent JL, Angus DC. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801–10.
26. Members of the American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference Committee: American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference. Definition for sepsis and organ failure and guidelines for the use innovative therapies in sepsis. Crit Care Med. 1992;20:864–74.
27. Iba T, Nisio MD, Levy JH, Kitamura N, Thachil J. New criteria for sepsisinduced coagulopathy (SIC) following the revised sepsis definition: a retrospective analysis of a nationwide survey. BMJ Open. 2017;7(9): e017046.
28. Zhang Y, Khalid S, Jiang L. Diagnostic and predictive performance of biomarkers in patients with sepsis in an intensive care unit. J Int Med Res.2019;47(1):44–58.
29. Hayakawa M, Ono K. A summary of the Japan septic disseminated intravascular coagulation study. Acute Med Surg. 2018;5(2):123–8.
30. Iba T, Arakawa M, Di Nisio M, Gando S, Anan H, Sato K, Ueki Y, Levy JH, Thachil J. Newly proposed sepsis-induced coagulopathy precedes international society on thrombosis and haemostasis overt-disseminated intravascular coagulation and predicts high mortality. J Intensive Care Med. 2020;35(7):643–9.
31. Iba T, Arakawa M, Levy JH, Yamakawa K, Koami H, Hifumi T, Sato K. Sepsisinduced coagulopathy and Japanese Association for Acute Medicine DIC in coagulopathic patients with decreased antithrombin and treated by antithrombin. Clin Appl Thromb Hemost. 2018;24(7):1020–6.
32. Iba T, Levy JH, Yamakawa K, Thachil J, Warkentin TE, Levi M, Scientific and Standardization Committee on DIC of the International Society on Thrombosis and Haemostasis. Proposal of a two-step process for the diagnosis of sepsis-induced disseminated intravascular coagulation. J Thromb Haemost. 2019;17(8):1265–8.
33. Iba T, Levy JH, Warkentin TE, Thachil J, van der Poll T, Levi M, Scientific and Standardization Committee on DIC, and the Scientific and Standardization Committee on Perioperative and Critical Care of the International Society on Thrombosis and Haemostasis. Diagnosis and management of sepsis-induced coagulopathy and disseminated intravascular coagulation. J Thromb Haemost. 2019;17(11):1989–94.
34. Iba T, Levi M, Thachil J, Helms J, Scarlatescu E, Levy JH. Communication from the SSC of the ISTH on sepsis-induced coagulopathy (SIC) in the management of sepsis. J Thromb Haemost. 2022. https:// doi. org/ 10.1016/j. jtha. 2022. 10. 022.
35. Gando S, Saitoh D, Ogura H, Fujishima S, Mayumi T, Araki T, Ikeda H, Kotani J, Kushimoto S, Miki Y, Shiraishi S, Suzuki K, Suzuki Y, Takeyama N, Takuma K, Tsuruta R, Yamaguchi Y, Yamashita N, Aikawa N, Japanese Association for Acute Medicine Sepsis Registry (JAAMSR) Study Group. A multicenter, prospective validation study of the Japanese Association for Acute Medicine disseminated intravascular coagulation scoring system in patients with severe sepsis. Crit Care. 2013;17:R111.
36. Yamakawa K, Yoshimura J, Ito T, Hayakawa M, Hamasaki T, Fujimi S. External validation of the two newly proposed criteria for assessing coagulopathy in sepsis. Thromb Haemost. 2019;119(2):203–12.
37. Wang B, Zhang B, Shen Y, Li J, Yuan X, Tang N. Validation of two revised,simplified criteria for assessing sepsis-associated disseminated intravascular coagulation in ICU patients with sepsis-3: a retrospective study. Lab Med. 2022. https:// doi. org/ 10. 1093/ labmed/ lmac1 12.
38. Umemura Y, Yamakawa K. Optimal patient selection for anticoagulant therapy in sepsis: an evidence-based proposal from Japan. J Thromb Haemost. 2018;16(3):462–4.
39. Yamakawa K, Gando S, Ogura H, Umemura Y, Kabata D, Shintani A,Shiraishi A, Saitoh D, Fujishima S, Mayumi T, Kushimoto S, Abe T, Shiino Y, Nakada TA, Tarui T, Hifumi T, Otomo Y, Okamoto K, Kotani J, Sakamoto Y, Sasaki J, Shiraishi SI, Takuma K, Tsuruta R, Hagiwara A, Masuno T, Takeyama N, Yamashita N, Ikeda H, Ueyama M, Fujimi S, Japanese Association for
Acute Medicine (JAAM) Focused Outcomes Research in Emergency Care in Acute Respiratory Distress Syndrome, Sepsis Trauma (FORECAST) Study Group. Identifying sepsis populations benefitting from anticoagulant therapy: a prospective cohort study incorporating a restricted cubic spline regression model. Thromb Haemost. 2019;119(11):1740–51.
40. Lu Z, Zhang J, Hong J, Wu J, Liu Y, Xiao W, Hua T, Yang M. Development of a nomogram to predict 28-day mortality of patients with sepsis-induced coagulopathy: an analysis of the MIMIC-III database. Front Med. 2021;8:661710.
41. Fang Y, Lin S, Dou Q, Gui J, Li W, Tan H, Wang Y, Zeng J, Khan A, Wei DQ. Network pharmacology- and molecular simulation-based exploration of therapeutic targets and mechanisms of heparin for the treatment of sepsis/COVID-19. J Biomol Struct Dyn. 2023;20:1–13.
42. Tanaka C, Tagami T, Kudo S, Takehara A, Fukuda R, Nakayama F, Kaneko J, Ishiki Y, Sato S, Kuno M, Unemoto K. Validation of sepsis-induced coagulopathy score in critically ill patients with septic shock: post hoc analysis of a nationwide multicenter observational study in Japan. Int J Hematol. 2021;114(2):164–71.
43. Xiang L, Ren H, Wang Y, Zhang J, Qian J, Li B, An K, Fu L. Clinical value of pediatric sepsis-induced coagulopathy score in diagnosis of sepsisinduced coagulopathy and prognosis in children. J Thromb Haemost. 2021;19(12):2930–7.
44. Hosseini SF, Behnam-Roudsari S, Alavinia G, Emami A, Toghyani A, Moradi S, Zadeh MM, Mohseni S, Shafiee MA. Diagnostic and prognostic value of sepsis-induced coagulopathy and International Society on Thrombosis and Hemostasis scoring systems in COVID-19-associated disseminated intravascular coagulopathy. J Res Med Sci. 2021;26:102.
45. Kapoor M, Panda PK, Saini LK, Bahurupi Y. Disseminated intravascular coagulation score and sepsis-induced coagulopathy score in prediction of COVID-19 severity: a retrospective analysis. Indian J Crit Care Med. 2021;25(12):1357–63.
46. Shinada K, Miike T, Matsuoka A, Miyazaki M, Goto T, Sasaki A, Yamazaki H,Mori K, Nakayama K, Sakurai R, Asahi M, Yoshitake K, Narumi S, Koba M, Koami H, Sakamoto Y. Coagulation influencing liberation from respiratory support in patients with coronavirus disease 2019: a retrospective, observational study. J Nippon Med Sch. 2022. https:// doi. org/ 10. 1272/
jnms. JNMS. 2022_ 89- 506.
47. Zou ZY, Huang JJ, Luan YY, Yang ZJ, Zhou ZP, Zhang JJ, Yao YM, Wu M.Early prophylactic anticoagulation with heparin alleviates mortality in critically ill patients with sepsis: a retrospective analysis from the MIMIC-IV database. Burns Trauma. 2022;10:tkac029.
48. Peng JC, Nie F, Li YJ, Xu QY, Xing SP, Li W, Gao Y. Favorable outcomes of anticoagulation with unfractioned heparin in sepsis-induced coagulopathy: a retrospective analysis of MIMIC-III database. Front Med. 2022;8:773339.
49. Habe K, Wada H, Ito-Habe N, Hatada T, Matsumoto T, Ohishi K, Maruyama K, Imai H, Mizutani H, Nobori T. Plasma ADAMTS13, von Willebrand factor (VWF) and VWF propeptide profiles in patients with DIC and related diseases. Thromb Res. 2012;129(5):598–602.
50. Laurence J, Haller H, Mannucci PM, Nangaku M, Praga M, Rodriguez de Cordoba S. Atypical hemolytic uremic syndrome (aHUS): essential aspects of an accurate diagnosis. Clin Adv Hematol Oncol. 2016;14(Suppl 11):2–15.
51. Greinacher A, Selleng K, Warkentin TE. Autoimmune heparin-induced thrombocytopenia. J Thromb Haemost. 2017;15(11):2099–114.
52. Iba T, Levy JH, Wada H, Thachil J, Warkentin TE, Levi M, Subcommittee on Disseminated Intravascular Coagulation. Differential diagnoses for sepsisinduced disseminated intravascular coagulation: communication from the SSC of the ISTH. J Thromb Haemost. 2019;17(2):415–9.
53. Iba T, Levy JH, Thachil J, Susen S, Levi M, Scarlatescu E. Communication from the SSC of the ISTH on vascular endothelium-related biomarkers in DIC. J Thromb Haemost. 2022 in press.
54. Matsubara T, Yamakawa K, Umemura Y, Gando S, Ogura H, Shiraishi A, Kushimoto S, Abe T, Tarui T, Hagiwara A, Otomo Y, Fujimi S, Japanese Association for Acute Medicine (JAAM) Focused Outcomes Research in Emergency Care in Acute Respiratory Distress Syndrome, Sepsis and Trauma (FORECAST) Group. Significance of plasma fibrinogen level and antithrombin activity in sepsis: a multicenter cohort study using a cubic spline model. Thromb Res. 2019;181:17–23.
55. Sakai K, Wada H, Nakatsuka Y, Kubo M, Hayakawa M, Matsumoto M. Characteristics behaviors of coagulation and fibrinolysis markers in acquired thrombotic thrombocytopenic purpura. J Intensive Care Med. 2021;36(4):436–42.
56. Sakurai S, Kato H, Yoshida Y, Sugawara Y, Fujisawa M, Yasumoto A, Matsumoto M, Fujimura Y, Yatomi Y, Nangaku M. Profiles of coagulation and fibrinolysis activation-associated molecular markers of atypical hemolytic uremic syndrome in the acute phase. J Atheroscler Thromb. 2020;27(4):353–62.
57. Jackson Chornenki NL, Dwivedi DJ, Kwong AC, Zamir N, Fox-Robichaud AE, Liaw PC, Canadian Critical Care Translational Biology Group. Identification of hemostatic markers that define the pre-DIC state: a multi-center observational study. J Thromb Haemost. 2020;18(10):2524–31.
58. Warren BL, Eid A, Singer P, Pillay SS, Carl P, Novak I, Chalupa P, Atherstone A, Penzes I, Kubler A, Knaub S, Keinecke HO, Heinrichs H, Schindel F, Juers M, Bone RC, Opal SM, KyberSept Trial Study Group. Caring for the critically ill patient High-dose antithrombin III in severe sepsis: a randomized controlled trial (Erratum in: JAMA 2002;287(2):192.). JAMA.2001;286(15):1869–78. https:// doi. org/ 10. 1001/ jama. 286. 15. 1869.
59. Ranieri VM, Thompson BT, Barie PS, Dhainaut JF, Douglas IS, Finfer S, Gardlund B, Marshall JC, Rhodes A, Artigas A, Payen D, Tenhunen J, Al-Khalidi HR, Thompson V, Janes J, Macias WL, Vangerow B, Williams MD, PROWESS-SHOCK Study Group. Drotrecogin alfa (activated) in adults with septic shock. N Engl J Med. 2012;366(22):2055–64.
60. Abraham E, Reinhart K, Opal S, Demeyer I, Doig C, Rodriguez AL, Beale R, Svoboda P, Laterre PF, Simon S, Light B, Spapen H, Stone J, Seibert A, Peckelsen C, De Deyne C, Postier R, Pettila V, Sprung CL, Artigas A, Percell SR, Shu V, Zwingelstein C, Tobias J, Poole L, Stolzenbach JC, Creasey AA, OPTIMIST Trial Study Group. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA. 2003;290(2):238–47.
61. Seymour CW, Kennedy JN, Wang S, Chang CH, Elliott CF, Xu Z, et al. Derivation, validation, and potential treatment implications of novel clinical phenotypes for sepsis. JAMA. 2019;321:2003–17.
62. Fu S, Yu S, Wang L, Ma X, Li X. Unfractionated heparin improves the clinical efficacy in adult sepsis patients: a systematic review and metaanalysis. BMC Anesthesiol. 2022;22(1):28.
63. Omidkhoda N, Abedi F, Ghavami V, Rahimi H, Samadi S, Arasteh O, Mohammadpour AH. The effect of heparin and its preparations on disseminated intravascular coagulation mortality and hospitalization: a systematic review. Int J Clin Pract. 2022;2022:2226761.
64. Schulman S, Sholzberg M, Spyropoulos AC, Zarychanski R, Resnick HE, Bradbury CA, Broxmeyer L, Connors JM, Falanga A, Iba T, Kaatz S, Levy JH, Middeldorp S, Minichiello T, Ramacciotti E, Samama CM, Thachil J, International Society on Thrombosis and Haemostasis. ISTH guidelines for antithrombotic treatment in COVID-19. J Thromb Haemost.2022;20(10):2214–25.
65. Aikawa N, Shimazaki S, Yamamoto Y, Saito H, Maruyama I, Ohno R, Hirayama A, Aoki Y, Aoki N. Thrombomodulin alfa in the treatment of infectious patients complicated by disseminated intravascular coagulation: subanalysis from the phase 3 trial. Shock. 2011;35(4):349–54.
66. Murata A, Okamoto K, Mayumi T, Muramatsu K, Matsuda S. Recent change in treatment of disseminated intravascular coagulation in Japan: an epidemiological study based on a National Administrative Database.Clin Appl Thromb Hemost. 2016;22(1):21–7.
67. Saito H, Maruyama I, Shimazaki S, Yamamoto Y, Aikawa N, Ohno R, Hirayama A, Matsuda T, Asakura H, Nakashima M, Aoki N. Efficacy and safety of recombinant human soluble thrombomodulin (ART-123) in disseminated intravascular coagulation: results of a phase III, randomized, double-blind clinical trial. J Thromb Haemost. 2007;5(1):31–41.
68. Vincent JL, Francois B, Zabolotskikh I, Daga MK, Lascarrou JB, Kirov MY, Pettila V, Wittebole X, Meziani F, Mercier E, Lobo SM, Barie PS, Crowther M, Esmon CT, Fareed J, Gando S, Gorelick KJ, Levi M, Mira JP, Opal SM, Parrillo J, Russell JA, Saito H, Tsuruta K, Sakai T, Fineberg D, SCARLET Trial Group. Effect of a recombinant human soluble thrombomodulin on mortality in patients with sepsis-associated coagulopathy: the SCARLET Randomized Clinical Trial. JAMA. 2019;321(20):1993–2002.
69. Francois B, Fiancette M, Helms J, Mercier E, Lascarrou JB, Kayanoki T, Tanaka K, Fineberg D, Vincent JL, Wittebole X. Efficacy and safety of human soluble thrombomodulin (ART-123) for treatment of patients in Fra ce with sepsis-associated coagulopathy: post hoc analysis of SCARLET. Ann Intensive Care. 2021;11(1):53.
70. Yamakawa K, Levy JH, Iba T. Recombinant human soluble thrombomodulin in patients with sepsis-associated coagulopathy (SCARLET): an updated meta-analysis. Crit Care. 2019;23(1):302.
71. Egi M, Ogura H, Yatabe T, Atagi K, Inoue S, Iba T, Kakihana Y, Kawasaki T, Kushimoto S, Kuroda Y, Kotani J, Shime N, Taniguchi T, Tsuruta R, Doi K, Doi M, Nakada TA, Nakane M, Fujishima S, Hosokawa N, Masuda Y, Matsushima A, Matsuda N, Yamakawa K, Hara Y, Sakuraya M, Ohshimo S, Aoki Y, Inada M, Umemura Y, Kawai Y, Kondo Y, Saito H, Taito S, Takeda C, Terayama T, Tohira H, Hashimoto H, Hayashida K, Hifumi T, Hirose T, Fukuda T, Fujii T, Miura S, Yasuda H, Abe T, Andoh K, Iida Y, Ishihara T, Ide K, Ito K, Ito Y, Inata Y, Utsunomiya A, Unoki T, Endo K, Ouchi A, Ozaki M, Ono S, Katsura M, Kawaguchi A, Kawamura Y, Kudo D, Kubo K, Kurahashi K, Sakuramoto H, Shimoyama A, Suzuki T, Sekine S, Sekino M, Takahashi N, Takahashi S, Takahashi H, Tagami T, Tajima G, Tatsumi H, Tani M, Tsuchiya A, Tsutsumi Y, Naito T, Nagae M, Nagasawa I, Nakamura K, Nishimura T, Nunomiya S, Norisue Y, Hashimoto S, Hasegawa D, Hatakeyama J, Hara N, Higashibeppu N, Furushima N, Furusono H, Matsuishi Y, Matsuyama T, Minematsu Y, Miyashita R, Miyatake Y, Moriyasu M, Yamada T, Yamada H, Yamamoto R, Yoshida T, Yoshida Y, Yoshimura J, Yotsumoto R, Yonekura H, Wada T, Watanabe E, Aoki M, Asai H, Abe T, Igarashi Y, Iguchi N, Ishikawa M, Ishimaru G, Isokawa S, Itakura R, Imahase H, Imura H, Irinoda T, Uehara K, Ushio N, Umegaki T, Egawa Y, Enomoto Y, Ota K, Ohchi Y, Ohno T, Ohbe H, Oka K, Okada N, Okada Y, Okano H, Okamoto J, Okuda H, Ogura T, Onodera Y, Oyama Y, Kainuma M, Kako E, Kashiura M, Kato H, Kanaya A,
Kaneko T, Kanehata K, Kano KI, Kawano H, Kikutani K, Kikuchi H, Kido T, Kimura S, Koami H, Kobashi D, Saiki I, Sakai M, Sakamoto A, Sato T, Shiga Y, Shimoto M, Shimoyama S, Shoko T, Sugawara Y, Sugita A, Suzuki S,Suzuki Y, Suhara T, Sonota K, Takauji S, Takashima K, Takahashi S, Takahashi Y, Takeshita J, Tanaka Y, Tampo A, Tsunoyama T, Tetsuhara K, Tokunaga K, Tomioka Y, Tomita K, Tominaga N, Toyosaki M, Toyoda Y, Naito H, Nagata I,
Nagato T, Nakamura Y, Nakamori Y, Nahara I, Naraba H, Narita C, Nishioka N, Nishimura T, Nishiyama K, Nomura T, Haga T, Hagiwara Y, Hashimoto K, Hatachi T, Hamasaki T, Hayashi T, Hayashi M, Hayamizu A, Haraguchi G, Hirano Y, Fujii R, Fujita M, Fujimura N, Funakoshi H, Horiguchi M, Maki J, Masunaga N, Matsumura Y, Mayumi T, Minami K, Miyazaki Y, Miyamoto
K, Murata T, Yanai M, Yano T, Yamada K, Yamada N, Yamamoto T, Yoshihiro S, Tanaka H, Nishida O. The Japanese Clinical Practice Guidelines for Management of Sepsis and Septic Shock 2020 (J-SSCG 2020). Acute Med Surg. 2021;8(1): e659.
72. Kienast J, Juers M, Wiedermann CJ, Hoffmann JN, Ostermann H, Strauss R, Keinecke HO, Warren BL, Opal SM, KyberSept investigators. Treatment effects of high-dose antithrombin without concomitant heparin in patients with severe sepsis with or without disseminated intravascular coagulation. J Thromb Haemost. 2006;4(1):90–7.
73. Tagami T. Antithrombin concentrate use in sepsis-associated disseminated intravascular coagulation: re-evaluation of a “pendulum effect” drug using a nationwide database. J Thromb Haemost. 2018;16(3):458–61.
74. Kuroda H, Masuda Y. Comparison of protective effects of recombinant antithrombin gamma and plasma-derived antithrombin on sepsisinduced disseminated intravascular coagulation and multiple organ failure. Clin Appl Thromb Hemost. 2020. https:// doi. org/ 10. 1177/ 10760
29620 981630.
75. Endo S, Shimazaki R, Antithrombin Gamma Study Group. An open-label,randomized, phase 3 study of the efficacy and safety of antithrombin gamma in patients with sepsis-induced disseminated intravascular coagulation syndrome. J Intensive Care. 2018;6:75.
76. Murao A, Kato T, Yamane T, Honda G, Eguchi Y. Benefit profile of thrombomodulin
alfa combined with antithrombin concentrate in patients with sepsis-induced disseminated intravascular coagulation. Clin Appl Thromb Hemost. 2022;28:10760296221077096.
77. Iba T, Umemura Y, Watanabe E, Wada T, Hayashida K, Kushimoto S, Japanese Surviving Sepsis Campaign Guideline Working Group for disseminated intravascular coagulation. Diagnosis of sepsis-induced disseminated intravascular coagulation and coagulopathy. Acute Med Surg.2019;6(3):223–32.
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 23.10.2024 00:01:00
[ACTIVE_FROM] => 23.10.2024 00:01:00
[SHOW_COUNTER] => 567
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830237
[VALUE] => Сепсис, ОРИТ, диссеминированное внутрисосудистое свертывание крови, клинические рекомендации
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Сепсис, ОРИТ, диссеминированное внутрисосудистое свертывание крови, клинические рекомендации
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830238
[VALUE] => Патофизиология, диагностика и лечение сепсис-ассоциированного диссеминированного внутрисосудистого свертывания крови
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Патофизиология, диагностика и лечение сепсис-ассоциированного диссеминированного внутрисосудистого свертывания крови
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830380
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 830246
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 830240
[1] => 830241
[2] => 830242
[3] => 830243
[4] => 830244
[5] => 830245
)
[VALUE] => Array
(
[0] => sepsis
[1] => Koagulyatsiya
[2] => Krovotecheniya i koagulopatii
[3] => kriticheskiesostoyaniya
[4] => intensivnayaterapiya
[5] => statia
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
[5] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
[1] => Koagulyatsiya
[2] => Krovotecheniya i koagulopatii
[3] => kriticheskiesostoyaniya
[4] => intensivnayaterapiya
[5] => statia
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
[5] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830380
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 830246
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-08-13 01:26:24
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 830240
[1] => 830241
[2] => 830242
[3] => 830243
[4] => 830244
[5] => 830245
)
[VALUE] => Array
(
[0] => sepsis
[1] => Koagulyatsiya
[2] => Krovotecheniya i koagulopatii
[3] => kriticheskiesostoyaniya
[4] => intensivnayaterapiya
[5] => statia
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
[5] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
[1] => Koagulyatsiya
[2] => Krovotecheniya i koagulopatii
[3] => kriticheskiesostoyaniya
[4] => intensivnayaterapiya
[5] => statia
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
[5] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Сепсис
[1] => Коагуляция
[2] => Кровотечения и коагулопатии
[3] => Критические состояния
[4] => Интенсивная терапия
[5] => Статья
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 13.08.2025 01:26:24
[~TIMESTAMP_X] => 13.08.2025 01:26:24
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[FULLTEXT_INDEX] => N
[~FULLTEXT_INDEX] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Патофизиология, диагностика и лечение сепсис-ассоциированного диссеминированного внутрисосудистого свертывания крови
[BROWSER_TITLE] => Патофизиология, диагностика и лечение сепсис-ассоциированного диссеминированного внутрисосудистого свертывания крови
[KEYWORDS] => Сепсис, ОРИТ, диссеминированное внутрисосудистое свертывание крови, клинические рекомендации
[DESCRIPTION] =>
)
)




