Острая жизне-угрожающая интоксикация при применении Т-клеточной терапии химерным рецептором антигена
Intensive Care Med
Что нового в интенсивной терапии?
Острая жизне-угрожающая интоксикация при применении Т-клеточной терапии химерным рецептором антигена
Перевод оригинальной статьи «Acute life-threatening toxicity from CAR T-cell therapy»
Авторы Elie Azoulay, Michael Darmon and Sandrine Valade
Médecine Intensive Et Réanimation, APHP, Hôpital Saint-Louis, Paris Diderot Sorbonne University, Paris, France
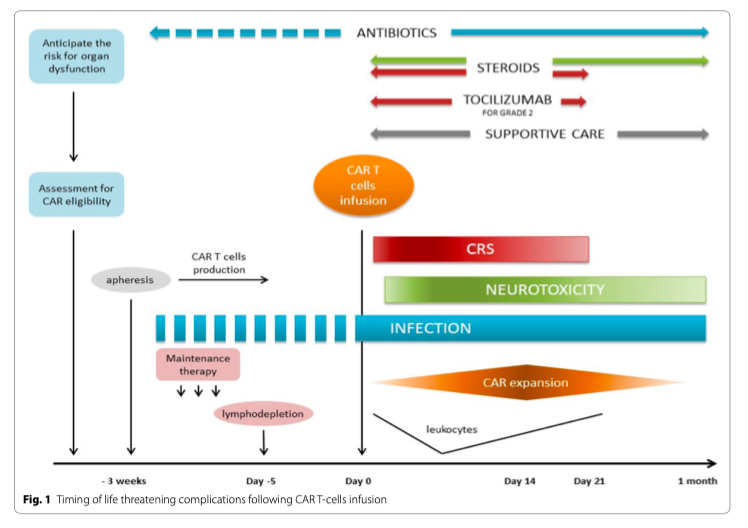
Химерный рецептор антигена (англ. chimeric antigen receptor или CAR) при Т-клеточной терапии является эффективным видом клеточной терапии и представляет собой новый класс терапевтических агентов для лечения пациентов, страдающих В-клеточной лейкемией и лимфомой [1]. При таком виде терапии используются Т-лимфоциты пациента, полученные путем цитафереза, после чего ex vivo с ними проводятся манипуляции с целью экспрессии специфических антигенов и уже после этого клетки возвращаются пациенту. Несмотря на то, что клинические результаты превосходят ожидания, все таки нередко CAR Т-клетки могут вызвать выраженный токсический синдром [2], главным образом по типу цитокин-рилизинг синдрома (англ. cytokine-release syndrome или CRS) и нейротоксичность (Рис. 1). Синдром лизиса опухоли, который развивается у более, чем 5% пациентов и о котором сообщалось в первых клинических исследованиях, в данной статье не обсуждается. Очевидно, что у такой группы пациентов с ослабленным иммунитетом и с измененным ответом В-клеток и Т-клеток, зачастую имеющих нейтропению, всегда следует подозревать развитие сепсиса и проводить его эмпирическую терапию. В представленной работе мы перечислили десять основных советов по ведению тяжелобольных реципиентов CAR Т-клеток.
Уроки онкологии
Все больше и больше врачей интенсивной терапии вовлекается в процесс терапии/управления токсичностью ингибиторов контрольных точек, которые позволяют усиливать специфические иммунные ответы Т-клеток против опухолевых клеток. Неконтролируемые мультиорганные и связанные с иммунными реакциями нежелательные эффекты при применении ингибиторов контрольных точек встречаются редко [3], однако жизне-угрожающие интоксикации встречаются у 1% пациентов, которым проводится подобная терапия [4], и этим пациентам требуется: 1) проведение интенсивной терапии; 2) внимательная клиническая оценка тяжести состояния и исключения инфекции; 3) эмпирическая антибиотикотерапия; 4) тесное сотрудничество интенсивистов с онкологами и гематологами; 5) противовоспалительная терапия, в которой больше полагаются на стероиды.
CAR T‑клеточная терапия: чудо адоптивной иммунотерапии
На сегодня известно два типа анти-CD19 Т-клеточной терапии (tisagenlecleucel and axicabtagene-ciloleucel) злокачественных новообразований В клеток. Уже есть сообщения о впечатляющих кратко- и долгосрочных результатах [5 - 7]. Реципиентами CAR T‑клеточной терапии являются пациенты, рефрактерные к нескольким линиям химиотерапии и те пациенты, которые не ответили на трансплантацию стволовых клеток. Но даже несмотря на это, все эти пациенты показывают выживаемость без прогрессирования болезни в течение 1 года [5 - 7], а у более 50% из них выживаемость более длительная, особенно при применении CAR второго поколения [8].
Избегать развития сепсиса
Неудивительно, что реципиенты CAR T-клеток находятся в зоне высокого риска развития сепсиса. В исследовании, что включило в себя 133 пациента, Hill et al. [9] сообщили о развитии инфекционных эпизодов в течение 28 дней после инфузии у 23% пациентов (1.19/100 дней). В другом исследовании сообщалось о 42% пациентах, у которых в течение 30 дней после инфузии развились инфекционные осложнения [10]. Наибольшее количество диагнозов инфекционных осложнений устанавливалось в течение 10 дней после инфузии CAR T-клеток (медиана 6 дней). Тяжелый CRS был независимо связан с инфекцией [9], при этом у более, чем 50% пациентов с CRS выли выявлены и подтверждены инфекции кровотока [10]. Таким образом, таким пациентам с ослабленным иммунитетом и, как правило, с нейтропенией, необходимо рутинно проводить эмпирическую антибактериальную терапию антибиотиками широкого спектра действия.
Цитокин-рилизинг синдром: тяжелая интоксикация
В развитии CRS и его тяжести центральную роль играют клетки эндотелия и миелоидные клетки. Как только CAR T-клетки начинают взаимодействовать с раковыми В-клетками, они активируются с выпуском цитокинов (чаще IFN-γ и TNF-α), что и приводит к лизису клеток. Более того, моноциты и макрофаги также активируются, что приводит к продукции большого количества провоспалительных цитокинов (IL-6, IL-1, IL-10), следствием чего является
дальнейшее прогрессирование CRS [2, 11, 12]. CRS связан с экспансией CAR-T in vivo и с их противораковой активностью [11, 12]. CRS проявляется у одного из четырех пациентов и каждому из них требуется проведение высокопоточной оксигенотреапии и введение вазопрессоров [2, 11], при этом наибольшая частота развития CRS наблюдается у пациентов с B-ALL (29.3%) по сравнению с В-лимфомой [13]. К факторам риска развития тяжелого CRS относят тяжелое течение заболевания, высокую инфузионную дозу, лимфодеплецию флударабина, сопутствующую инфекцию и схемы дробного дозирования [13]. У пациентов течение от 1 до 14 дней после начала CAR инфузии развивается гриппоподобный синдром (англ. a flu-like syndrome), проявляющийся лихорадкой, миалгией, слабостью, тошнотой, диареей. CRS может прогрессировать до вазодиляторного шока с капиллярной утечкой, гипоксемией и с развитием полиорганной недостаточности. Наиболее тяжелые случаи CRS могут сопровождаться развитием у пациента гемофагоцитарного лимфогистиоцитоза с подъемом уровня INF-γ, IL-2 Rc, IL-6 и IL-10).
Нейротоксичность
Острая нейротоксичность возникает в течение 8 недель после инфузии CAR и продолжается около 2 недель [2, 11, 12]. Такое осложненное течение получило свое название - Неврологический синдром, связанный с иммуно-эффекторными клетками (англ. Immune effector Cell Associated Neurologic Syndrome или ICANS). ICANS является вторым по частоте встречаемости осложнением CAR T-клеточной терапии после CRS, но может развиваться вместе с CRS. Обычно ICANS развивается на 4 - 6 день после инфузии у 20% пациентов. Симптомами являются головная боль, потеря памяти, головокружение, нарушения ментального статуса (сонливость, дезориентация, нарушения внимания, ажитация, кома), нарушения двигательных движений (тремор, миоклония), нарушения речи (дизартрия, афазия) и судороги [5–7]. Оценку неврологического статуса можно провести с использованием шкалы «CARTOX» или шкалы «the ICE score» [11]. ЭЭГ может помочь выявлять/документировать субклинические припадки, а МРТ показывает обратимый общий характер гиперинтенсивности T2/FLAIR у 30% пациентов с нарушениями неврологического статуса [2, 14, 15].
Паттерны развития нейротоксичности различаются, но иногда они друг друга перекрывают. Один из них случается одновременно с клиническими проявлениями СRS и может быть связан с дисфункцией гематоэнцефалического барьера, вызванной влиянием цитокинов (TNF-α, IL-6 and IL-1), нарушениями баланса ангиотензин 1/ангиотензин 2, стрессом перицитов (клеток Руже) с последующей секрецией цитокинов, активирующих эндотелий [15]. Второй ассоциирован с экспансией и активацией CAR T-клеток, что ведет и их активной инфильтрации паренхимы. При нейротоксичности, сопровождающейся повышенными уровнями провоспалительных цитокинов в спинномозговой жидкости, Taraseviciute et al.[16] на животных моделях описали пан-Т-клеточный энцефалит с инфильтрацией как CAR, так и не-CAR Т-лимфоцитов в спинномозговую жидкость и в головной мозг.
Лечение CRS
Разрешение CRS обычно происходит к третьему дню после начала инфузии CAR. В зависимости от тяжести течения при лечении CRS может потребоваться проведение целенаправленной антицитокиновой терапии (тоцилизумаб или кортикостероиды). Пациентам с одной лишь лихорадкой может быть достаточно назначения парацетамола, тщательного мониторинга состояния, недопущения развития инфекционных осложнений. На этом этапе применение антицитокиновой терапии не имеет оснований.
У пациентов со сниженной оксигенацией, не требующей высокопоточной оксигенотерапии и/или с потребностью в увеличении объема инфузионной терапии (Grade 2) решение основывается на дифференциальном диагнозе с сепсисом, зная, что эти два синдрома могут протекать одновременно [9, 10]. Мы считаем, что именно данная ситуация подходит для назначения тоцилизумаба. В случае, когда у пациентов сохраняется лихорадка, но без ухудшения дисфункции органов, тоцилизумаб можно вводить повторно.
Пациентам с тяжелым течением CRS, клиника которого подобна септическому шоку (≥ Grade3, с вазопрессорами, высокопоточной оксигенотерапией или с интубацией трахеи/ИВЛ), тоцилизумаб может больше не назначаться, а следует начать введение кортикостероидов. У пациентов с рефрактерной полиорганной дисфункцией такие стратегии спасения, как введение Anakinra (антагонист рецептора интерлейкина 1 человека), плазмаферез, гемофильтрация, предлагались, но не оценивались.
Лечение нейротоксичности
На самых ранних стадиях у пациентов с легкими клиническими признаками нейротоксичности следует проводить полное диагностическое обследование с целью исключения инфекции и эпилепсии, обязательно проводить профилактику аспирации и судорог (с помощью леветирацетама). У пациентов с ассоциированным CRS следует избегать применения тоцилизумаба. У более тяжелых пациентов с пониженным уровнем сознания к терапии следует добавить дексаметазон (10 мг каждые 6 ч). У самых тяжелых пациентов с эпилептическим статусом, двигательной слабостью и/или диффузным отеком головного мозга или тогда, когда на МРТ головного мозга выявлен очаговый или диффузный отек, следует начинать введение 1000 мг солюмедрола.
Необходимо избежать наложения одной интоксикации на другую
Задержка в назначении соответствующей антибактериальной терапии, задержка с переводом в отделение интенсивной терапии, неоптимальное лечение органной дисфункции может иметь пагубные последствия. Кроме того, у некоторых пациентов следует избегать приема тоцилизумаба. У пациентов с неврологическими симптомами и CRS в состоянии средней тяжести применение тоцилизумаба было связано с неврологическим ухудшением, что согласуется с экспериментальными данными, показывающими, что накопление IL6 во внутриклеточном пространстве может быть пагубным для пациента [17, 18]. Альтернативой может быть силтуксимаб, который сам блокирует IL6. Однако раннее применение кортикостероидов не препятствует распространению CARТ-клеток и формированию ответа опухоли, что определяет кортикостероиды как препараты выбора для этих пациентов.
Новые CAR T-клетки
CAR Т-клетки третьего поколения будут способны продуцировать более низкие уровни цитокинов, экспрессировать более высокие уровни молекул антипоптоза и размножаться медленнее, чем существующие CAR, что приведет к минимальным клиническим проявлениям CRS и нейротоксичности, но при сохранении сильной цитолитической активности [19]. Точно так же нейтрализация GM-CSF (granulocyte-macrophage colony-stimulating factor) лензилумабом не подавляет функцию клеток CART19 in vitro или in vivo, но пролиферация CAR остается устойчивой, а противоопухолевая активность сохраняется [20].
Роль специалистов интенсивной терапии в лечении острой интоксикации, вызванной проведением CAR T-клеточной терапии
Мы считаем, что роль интенсивистов имеет решающее значение на различных стадиях процесса лечения с применением CAR T-клеток. После того, как пациенты оцениваются на соответствие критериям CAR, специалисты ОИТ могут помочь предвидеть риск развития органной дисфункции или сепсиса у каждого пациента в зависимости от его исходного состояния, сопутствующих заболеваний. После инфузии CAR, когда у пациентов развивается подострая лихорадка и умеренное поражение органов, мы настоятельно поддерживаем раннюю госпитализацию в ОИТ. Однако необходимы дальнейшие исследования алгоритмов, что позволят определить те пороговые значения, когда необходимо проведение консультации реаниматолога и последующего перевода в отделение интенсивной терапии.
References
1. Makita S, Yoshimura K, Tobinai K (2017) Clinical development of anti-CD19 chimeric antigen receptor T-cell therapy for B-cell non-Hodgkin lymphoma. Cancer Sci 108:1109–1118. https://doi.org/10.1111/cas.13239;
2. Neelapu SS, Tummala S, Kebriaei P et al (2018) Chimeric antigen receptor T-cell therapy—assessment and management of toxicities. Nat Rev Clin Oncol 15:47–62. https://doi.org/10.1038/nrclinonc.2017.148
3. Weber JS, Yang JC, Atkins MB, Disis ML (2015) Toxicities of immunotherapy for the practitioner. J Clin Oncol Off J Am Soc Clin Oncol 33:20922099. https://doi.org/10.1200/JCO.2014.60.0379
4. Assoun S, Lemiale V, Azoulay E (2019) Molecular targeted therapy-related life-threatening toxicity in patients with malignancies. A systematic review of published cases. Intensive Care Med 45:988–997. https://doi. org/10.1007/s00134-019-05650-w
5. Neelapu SS, Locke FL, Bartlett NL et al (2017) Axicabtagene ciloleucel CAR T-cell therapy in refractory large B-cell lymphoma. N Engl J Med 377:2531–2544. https://doi.org/10.1056/NEJMoa1707447
6. Maude SL, Laetsch TW, Buechner J et al (2018) Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N Engl J Med 378:439–448. https://doi.org/10.1056/NEJMoa1709866
7. Schuster SJ, Svoboda J, Chong EA et al (2017) Chimeric antigen receptor T cells in refractory B-cell lymphomas. N Engl J Med 377:2545–2554. https ://doi.org/10.1056/NEJMoa1708566
8. Zhou H, Luo Y, Zhu S et al (2018) The efficacy and safety of anti-CD19/ CD20 chimeric antigen receptor—T cells immunotherapy in relapsed or refractory B-cell malignancies:a meta-analysis. BMC Cancer 18:929. https ://doi.org/10.1186/s12885-018-4817-4
9. Hill JA, Li D, Hay KA et al (2018) Infectious complications of CD19-targeted chimeric antigen receptor-modified T-cell immunotherapy. Blood 131:121–130. https://doi.org/10.1182/blood-2017-07-793760
10. Park JH, Romero FA, Taur Y et al (2018) Cytokine release syndrome grade as a predictive marker for infections in patients with relapsed or refractory B-cell acute lymphoblastic leukemia treated with chimeric antigen receptor T cells. Clin Infect Dis Off Publ Infect Dis Soc Am 67:533–540. https://doi.org/10.1093/cid/ciy152
11. Lee DW, Santomasso BD, Locke FL et al (2019) ASTCT consensus grading for cytokine release syndrome and neurologic toxicity associated with immune effector cells. Biol Blood Marrow Trans J Am Soc Blood Marrow Trans 25:625–638. https://doi.org/10.1016/j.bbmt.2018.12.758
12. Frey N, Porter D (2019) Cytokine release syndrome with chimeric antigen receptor T cell therapy. Biol Blood Marrow Trans J Am Soc Blood Marrow Trans 25:e123–e127. https://doi.org/10.1016/j.bbmt.2018.12.756
13. Jin Z, Xiang R, Qing K et al (2018) The severe cytokine release syndrome in phase I trials of CD19-CAR-T cell therapy: a systematic review. Ann Hematol 97:1327–1335. https://doi.org/10.1007/s00277-018-3368-8
14. Santomasso BD, Park JH, Salloum D et al (2018) Clinical and biological correlates of neurotoxicity associated with CAR T-cell therapy in patients with B-cell acute lymphoblastic leukemia. Cancer Discov 8:958–971. https ://doi.org/10.1158/2159-8290.CD-17-1319
15. Gust J, Taraseviciute A, Turtle CJ (2018) Neurotoxicity associated with CD19-targeted CAR-T cell therapies. CNS Drugs 32:1091–1101. https:// doi.org/10.1007/s40263-018-0582-9
16. Taraseviciute A, Tkachev V, Ponce R et al (2018) Chimeric antigen receptor T cell-mediated neurotoxicity in nonhuman primates. Cancer Discov 8:750–763. https://doi.org/10.1158/2159-8290.CD-17-1368
17. Norelli M, Camisa B, Barbiera G et al (2018) Monocyte-derived IL-1 and IL-6 are differentially required for cytokine-release syndrome and neurotoxicity due to CAR T cells. Nat Med 24:739–748. https://doi.org/10.1038/ s41591-018-0036-4
18. Giavridis T, van der Stegen SJC, Eyquem J et al (2018) CAR T cell-induced cytokine release syndrome is mediated by macrophages and abated by IL-1 blockade. Nat Med 24:731–738. https://doi.org/10.1038/s4159 1-018-0041-7
19. Ying Z, Huang XF, Xiang X et al (2019) A safe and potent anti-CD19 CAR T cell therapy. Nat Med 25:947–953. https://doi.org/10.1038/s4159 1-019-0421-7
20. Sterner RM, Sakemura R, Cox MJ et al (2019) GM-CSF inhibition reduces cytokine release syndrome and neuroinflammation but enhances CAR-T cell function in xenografts. Blood 133:697–709. https://doi.org/10.1182/ blood-2018-10-881722
Intensive Care Med
https://doi.org/10.1007/s00134-020-06193-1
Что нового в интенсивной терапии?
Острая жизне-угрожающая интоксикация при применении Т-клеточной терапии химерным рецептором антигена
Перевод оригинальной статьи «Acute life-threatening toxicity from CAR T-cell therapy»
Авторы Elie Azoulay, Michael Darmon and Sandrine Valade
Médecine Intensive Et Réanimation, APHP, Hôpital Saint-Louis, Paris Diderot Sorbonne University, Paris, France
Химерный рецептор антигена (англ. chimeric antigen receptor или CAR) при Т-клеточной терапии является эффективным видом клеточной терапии и представляет собой новый класс терапевтических агентов для лечения пациентов, страдающих В-клеточной лейкемией и лимфомой [1]. При таком виде терапии используются Т-лимфоциты пациента, полученные путем цитафереза, после чего ex vivo с ними проводятся манипуляции с целью экспрессии специфических антигенов и уже после этого клетки возвращаются пациенту. Несмотря на то, что клинические результаты превосходят ожидания, все таки нередко CAR Т-клетки могут вызвать выраженный токсический синдром [2], главным образом по типу цитокин-рилизинг синдрома (англ. cytokine-release syndrome или CRS) и нейротоксичность (Рис. 1). Синдром лизиса опухоли, который развивается у более, чем 5% пациентов и о котором сообщалось в первых клинических исследованиях, в данной статье не обсуждается. Очевидно, что у такой группы пациентов с ослабленным иммунитетом и с измененным ответом В-клеток и Т-клеток, зачастую имеющих нейтропению, всегда следует подозревать развитие сепсиса и проводить его эмпирическую терапию. В представленной работе мы перечислили десять основных советов по ведению тяжелобольных реципиентов CAR Т-клеток.
Уроки онкологии
Все больше и больше врачей интенсивной терапии вовлекается в процесс терапии/управления токсичностью ингибиторов контрольных точек, которые позволяют усиливать специфические иммунные ответы Т-клеток против опухолевых клеток. Неконтролируемые мультиорганные и связанные с иммунными реакциями нежелательные эффекты при применении ингибиторов контрольных точек встречаются редко [3], однако жизне-угрожающие интоксикации встречаются у 1% пациентов, которым проводится подобная терапия [4], и этим пациентам требуется: 1) проведение интенсивной терапии; 2) внимательная клиническая оценка тяжести состояния и исключения инфекции; 3) эмпирическая антибиотикотерапия; 4) тесное сотрудничество интенсивистов с онкологами и гематологами; 5) противовоспалительная терапия, в которой больше полагаются на стероиды.
CAR T‑клеточная терапия: чудо адоптивной иммунотерапии
На сегодня известно два типа анти-CD19 Т-клеточной терапии (tisagenlecleucel and axicabtagene-ciloleucel) злокачественных новообразований В клеток. Уже есть сообщения о впечатляющих кратко- и долгосрочных результатах [5 - 7]. Реципиентами CAR T‑клеточной терапии являются пациенты, рефрактерные к нескольким линиям химиотерапии и те пациенты, которые не ответили на трансплантацию стволовых клеток. Но даже несмотря на это, все эти пациенты показывают выживаемость без прогрессирования болезни в течение 1 года [5 - 7], а у более 50% из них выживаемость более длительная, особенно при применении CAR второго поколения [8].
Избегать развития сепсиса
Неудивительно, что реципиенты CAR T-клеток находятся в зоне высокого риска развития сепсиса. В исследовании, что включило в себя 133 пациента, Hill et al. [9] сообщили о развитии инфекционных эпизодов в течение 28 дней после инфузии у 23% пациентов (1.19/100 дней). В другом исследовании сообщалось о 42% пациентах, у которых в течение 30 дней после инфузии развились инфекционные осложнения [10]. Наибольшее количество диагнозов инфекционных осложнений устанавливалось в течение 10 дней после инфузии CAR T-клеток (медиана 6 дней). Тяжелый CRS был независимо связан с инфекцией [9], при этом у более, чем 50% пациентов с CRS выли выявлены и подтверждены инфекции кровотока [10]. Таким образом, таким пациентам с ослабленным иммунитетом и, как правило, с нейтропенией, необходимо рутинно проводить эмпирическую антибактериальную терапию антибиотиками широкого спектра действия.
Цитокин-рилизинг синдром: тяжелая интоксикация
В развитии CRS и его тяжести центральную роль играют клетки эндотелия и миелоидные клетки. Как только CAR T-клетки начинают взаимодействовать с раковыми В-клетками, они активируются с выпуском цитокинов (чаще IFN-γ и TNF-α), что и приводит к лизису клеток. Более того, моноциты и макрофаги также активируются, что приводит к продукции большого количества провоспалительных цитокинов (IL-6, IL-1, IL-10), следствием чего является
дальнейшее прогрессирование CRS [2, 11, 12]. CRS связан с экспансией CAR-T in vivo и с их противораковой активностью [11, 12]. CRS проявляется у одного из четырех пациентов и каждому из них требуется проведение высокопоточной оксигенотреапии и введение вазопрессоров [2, 11], при этом наибольшая частота развития CRS наблюдается у пациентов с B-ALL (29.3%) по сравнению с В-лимфомой [13]. К факторам риска развития тяжелого CRS относят тяжелое течение заболевания, высокую инфузионную дозу, лимфодеплецию флударабина, сопутствующую инфекцию и схемы дробного дозирования [13]. У пациентов течение от 1 до 14 дней после начала CAR инфузии развивается гриппоподобный синдром (англ. a flu-like syndrome), проявляющийся лихорадкой, миалгией, слабостью, тошнотой, диареей. CRS может прогрессировать до вазодиляторного шока с капиллярной утечкой, гипоксемией и с развитием полиорганной недостаточности. Наиболее тяжелые случаи CRS могут сопровождаться развитием у пациента гемофагоцитарного лимфогистиоцитоза с подъемом уровня INF-γ, IL-2 Rc, IL-6 и IL-10).
Нейротоксичность
Острая нейротоксичность возникает в течение 8 недель после инфузии CAR и продолжается около 2 недель [2, 11, 12]. Такое осложненное течение получило свое название - Неврологический синдром, связанный с иммуно-эффекторными клетками (англ. Immune effector Cell Associated Neurologic Syndrome или ICANS). ICANS является вторым по частоте встречаемости осложнением CAR T-клеточной терапии после CRS, но может развиваться вместе с CRS. Обычно ICANS развивается на 4 - 6 день после инфузии у 20% пациентов. Симптомами являются головная боль, потеря памяти, головокружение, нарушения ментального статуса (сонливость, дезориентация, нарушения внимания, ажитация, кома), нарушения двигательных движений (тремор, миоклония), нарушения речи (дизартрия, афазия) и судороги [5–7]. Оценку неврологического статуса можно провести с использованием шкалы «CARTOX» или шкалы «the ICE score» [11]. ЭЭГ может помочь выявлять/документировать субклинические припадки, а МРТ показывает обратимый общий характер гиперинтенсивности T2/FLAIR у 30% пациентов с нарушениями неврологического статуса [2, 14, 15].
Паттерны развития нейротоксичности различаются, но иногда они друг друга перекрывают. Один из них случается одновременно с клиническими проявлениями СRS и может быть связан с дисфункцией гематоэнцефалического барьера, вызванной влиянием цитокинов (TNF-α, IL-6 and IL-1), нарушениями баланса ангиотензин 1/ангиотензин 2, стрессом перицитов (клеток Руже) с последующей секрецией цитокинов, активирующих эндотелий [15]. Второй ассоциирован с экспансией и активацией CAR T-клеток, что ведет и их активной инфильтрации паренхимы. При нейротоксичности, сопровождающейся повышенными уровнями провоспалительных цитокинов в спинномозговой жидкости, Taraseviciute et al.[16] на животных моделях описали пан-Т-клеточный энцефалит с инфильтрацией как CAR, так и не-CAR Т-лимфоцитов в спинномозговую жидкость и в головной мозг.
Лечение CRS
Разрешение CRS обычно происходит к третьему дню после начала инфузии CAR. В зависимости от тяжести течения при лечении CRS может потребоваться проведение целенаправленной антицитокиновой терапии (тоцилизумаб или кортикостероиды). Пациентам с одной лишь лихорадкой может быть достаточно назначения парацетамола, тщательного мониторинга состояния, недопущения развития инфекционных осложнений. На этом этапе применение антицитокиновой терапии не имеет оснований.
У пациентов со сниженной оксигенацией, не требующей высокопоточной оксигенотерапии и/или с потребностью в увеличении объема инфузионной терапии (Grade 2) решение основывается на дифференциальном диагнозе с сепсисом, зная, что эти два синдрома могут протекать одновременно [9, 10]. Мы считаем, что именно данная ситуация подходит для назначения тоцилизумаба. В случае, когда у пациентов сохраняется лихорадка, но без ухудшения дисфункции органов, тоцилизумаб можно вводить повторно.
Пациентам с тяжелым течением CRS, клиника которого подобна септическому шоку (≥ Grade3, с вазопрессорами, высокопоточной оксигенотерапией или с интубацией трахеи/ИВЛ), тоцилизумаб может больше не назначаться, а следует начать введение кортикостероидов. У пациентов с рефрактерной полиорганной дисфункцией такие стратегии спасения, как введение Anakinra (антагонист рецептора интерлейкина 1 человека), плазмаферез, гемофильтрация, предлагались, но не оценивались.
Лечение нейротоксичности
На самых ранних стадиях у пациентов с легкими клиническими признаками нейротоксичности следует проводить полное диагностическое обследование с целью исключения инфекции и эпилепсии, обязательно проводить профилактику аспирации и судорог (с помощью леветирацетама). У пациентов с ассоциированным CRS следует избегать применения тоцилизумаба. У более тяжелых пациентов с пониженным уровнем сознания к терапии следует добавить дексаметазон (10 мг каждые 6 ч). У самых тяжелых пациентов с эпилептическим статусом, двигательной слабостью и/или диффузным отеком головного мозга или тогда, когда на МРТ головного мозга выявлен очаговый или диффузный отек, следует начинать введение 1000 мг солюмедрола.
Необходимо избежать наложения одной интоксикации на другую
Задержка в назначении соответствующей антибактериальной терапии, задержка с переводом в отделение интенсивной терапии, неоптимальное лечение органной дисфункции может иметь пагубные последствия. Кроме того, у некоторых пациентов следует избегать приема тоцилизумаба. У пациентов с неврологическими симптомами и CRS в состоянии средней тяжести применение тоцилизумаба было связано с неврологическим ухудшением, что согласуется с экспериментальными данными, показывающими, что накопление IL6 во внутриклеточном пространстве может быть пагубным для пациента [17, 18]. Альтернативой может быть силтуксимаб, который сам блокирует IL6. Однако раннее применение кортикостероидов не препятствует распространению CARТ-клеток и формированию ответа опухоли, что определяет кортикостероиды как препараты выбора для этих пациентов.
Новые CAR T-клетки
CAR Т-клетки третьего поколения будут способны продуцировать более низкие уровни цитокинов, экспрессировать более высокие уровни молекул антипоптоза и размножаться медленнее, чем существующие CAR, что приведет к минимальным клиническим проявлениям CRS и нейротоксичности, но при сохранении сильной цитолитической активности [19]. Точно так же нейтрализация GM-CSF (granulocyte-macrophage colony-stimulating factor) лензилумабом не подавляет функцию клеток CART19 in vitro или in vivo, но пролиферация CAR остается устойчивой, а противоопухолевая активность сохраняется [20].
Роль специалистов интенсивной терапии в лечении острой интоксикации, вызванной проведением CAR T-клеточной терапии
Мы считаем, что роль интенсивистов имеет решающее значение на различных стадиях процесса лечения с применением CAR T-клеток. После того, как пациенты оцениваются на соответствие критериям CAR, специалисты ОИТ могут помочь предвидеть риск развития органной дисфункции или сепсиса у каждого пациента в зависимости от его исходного состояния, сопутствующих заболеваний. После инфузии CAR, когда у пациентов развивается подострая лихорадка и умеренное поражение органов, мы настоятельно поддерживаем раннюю госпитализацию в ОИТ. Однако необходимы дальнейшие исследования алгоритмов, что позволят определить те пороговые значения, когда необходимо проведение консультации реаниматолога и последующего перевода в отделение интенсивной терапии.
References
1. Makita S, Yoshimura K, Tobinai K (2017) Clinical development of anti-CD19 chimeric antigen receptor T-cell therapy for B-cell non-Hodgkin lymphoma. Cancer Sci 108:1109–1118. https://doi.org/10.1111/cas.13239;
2. Neelapu SS, Tummala S, Kebriaei P et al (2018) Chimeric antigen receptor T-cell therapy—assessment and management of toxicities. Nat Rev Clin Oncol 15:47–62. https://doi.org/10.1038/nrclinonc.2017.148
3. Weber JS, Yang JC, Atkins MB, Disis ML (2015) Toxicities of immunotherapy for the practitioner. J Clin Oncol Off J Am Soc Clin Oncol 33:20922099. https://doi.org/10.1200/JCO.2014.60.0379
4. Assoun S, Lemiale V, Azoulay E (2019) Molecular targeted therapy-related life-threatening toxicity in patients with malignancies. A systematic review of published cases. Intensive Care Med 45:988–997. https://doi. org/10.1007/s00134-019-05650-w
5. Neelapu SS, Locke FL, Bartlett NL et al (2017) Axicabtagene ciloleucel CAR T-cell therapy in refractory large B-cell lymphoma. N Engl J Med 377:2531–2544. https://doi.org/10.1056/NEJMoa1707447
6. Maude SL, Laetsch TW, Buechner J et al (2018) Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N Engl J Med 378:439–448. https://doi.org/10.1056/NEJMoa1709866
7. Schuster SJ, Svoboda J, Chong EA et al (2017) Chimeric antigen receptor T cells in refractory B-cell lymphomas. N Engl J Med 377:2545–2554. https ://doi.org/10.1056/NEJMoa1708566
8. Zhou H, Luo Y, Zhu S et al (2018) The efficacy and safety of anti-CD19/ CD20 chimeric antigen receptor—T cells immunotherapy in relapsed or refractory B-cell malignancies:a meta-analysis. BMC Cancer 18:929. https ://doi.org/10.1186/s12885-018-4817-4
9. Hill JA, Li D, Hay KA et al (2018) Infectious complications of CD19-targeted chimeric antigen receptor-modified T-cell immunotherapy. Blood 131:121–130. https://doi.org/10.1182/blood-2017-07-793760
10. Park JH, Romero FA, Taur Y et al (2018) Cytokine release syndrome grade as a predictive marker for infections in patients with relapsed or refractory B-cell acute lymphoblastic leukemia treated with chimeric antigen receptor T cells. Clin Infect Dis Off Publ Infect Dis Soc Am 67:533–540. https://doi.org/10.1093/cid/ciy152
11. Lee DW, Santomasso BD, Locke FL et al (2019) ASTCT consensus grading for cytokine release syndrome and neurologic toxicity associated with immune effector cells. Biol Blood Marrow Trans J Am Soc Blood Marrow Trans 25:625–638. https://doi.org/10.1016/j.bbmt.2018.12.758
12. Frey N, Porter D (2019) Cytokine release syndrome with chimeric antigen receptor T cell therapy. Biol Blood Marrow Trans J Am Soc Blood Marrow Trans 25:e123–e127. https://doi.org/10.1016/j.bbmt.2018.12.756
13. Jin Z, Xiang R, Qing K et al (2018) The severe cytokine release syndrome in phase I trials of CD19-CAR-T cell therapy: a systematic review. Ann Hematol 97:1327–1335. https://doi.org/10.1007/s00277-018-3368-8
14. Santomasso BD, Park JH, Salloum D et al (2018) Clinical and biological correlates of neurotoxicity associated with CAR T-cell therapy in patients with B-cell acute lymphoblastic leukemia. Cancer Discov 8:958–971. https ://doi.org/10.1158/2159-8290.CD-17-1319
15. Gust J, Taraseviciute A, Turtle CJ (2018) Neurotoxicity associated with CD19-targeted CAR-T cell therapies. CNS Drugs 32:1091–1101. https:// doi.org/10.1007/s40263-018-0582-9
16. Taraseviciute A, Tkachev V, Ponce R et al (2018) Chimeric antigen receptor T cell-mediated neurotoxicity in nonhuman primates. Cancer Discov 8:750–763. https://doi.org/10.1158/2159-8290.CD-17-1368
17. Norelli M, Camisa B, Barbiera G et al (2018) Monocyte-derived IL-1 and IL-6 are differentially required for cytokine-release syndrome and neurotoxicity due to CAR T cells. Nat Med 24:739–748. https://doi.org/10.1038/ s41591-018-0036-4
18. Giavridis T, van der Stegen SJC, Eyquem J et al (2018) CAR T cell-induced cytokine release syndrome is mediated by macrophages and abated by IL-1 blockade. Nat Med 24:731–738. https://doi.org/10.1038/s4159 1-018-0041-7
19. Ying Z, Huang XF, Xiang X et al (2019) A safe and potent anti-CD19 CAR T cell therapy. Nat Med 25:947–953. https://doi.org/10.1038/s4159 1-019-0421-7
20. Sterner RM, Sakemura R, Cox MJ et al (2019) GM-CSF inhibition reduces cytokine release syndrome and neuroinflammation but enhances CAR-T cell function in xenografts. Blood 133:697–709. https://doi.org/10.1182/ blood-2018-10-881722