Оптимальная цель интенсивной терапии септического шока
Annals of Translational Medicine
Оптимальная цель интенсивной терапии септического шока
Перевод оригинальной статьи «Optimal target in septic shock resuscitation»
Авторы: Eduardo Kattan, Ricardo Castro, Magdalena Vera, Glenn Hernández
Departamento de Medicina Intensiva, Facultad de Medicina, Pontificia Universidad Católica de Chile, Santiago, Chile
Keywords: Septic shock; resuscitation; fluid therapy; microcirculation; capillary refill time (CRT); lactate
Ключевые слова: септический шок, интенсивная терапия, инфузионная терапия, микроциркуляция, время ре-заполнения капилляра, лактат
Введение
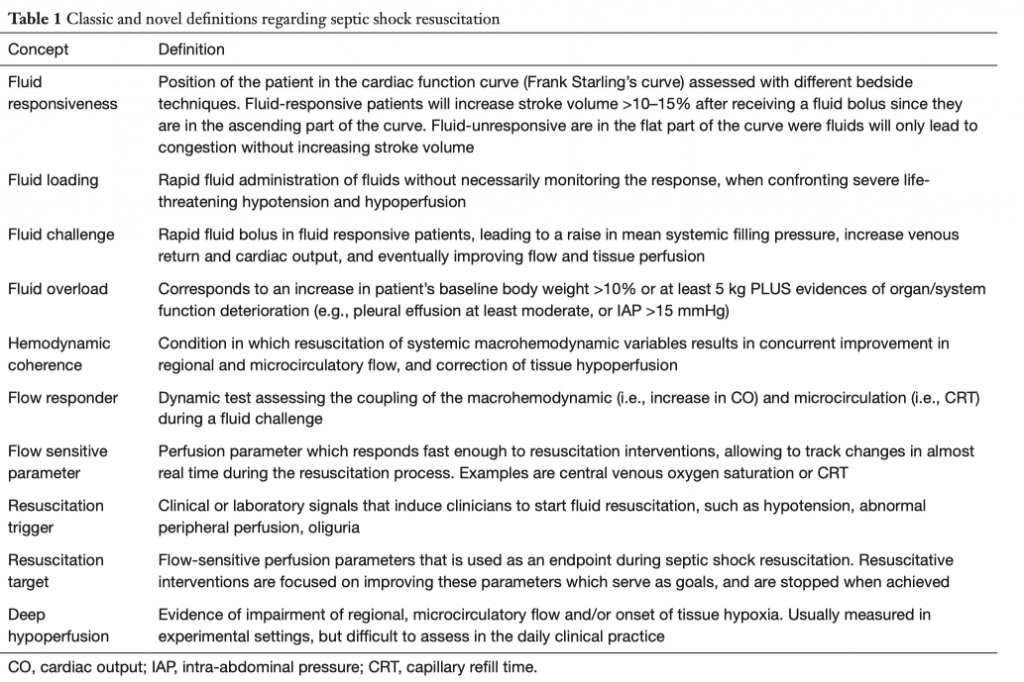
Септический шок определяется, как связанная с инфекцией дисфункция циркуляции, требующая введения вазопрессоров для поддержания среднего артериального давления (САД) на уровне 65 ммHg или выше, при этом уровень сывороточного лактата достигает значений 2 ммоль/л и выше при отсутствии явных признаков гиповолемии. Септический шок ассоциируется с органной дисфункцией и очень высоким риском летального исхода [1]. Важнейшими вопросами лечения септического шока являются его раннее распознавание, эффективный и своевременный контроль источника инфекции и восстановление гемодинамики [2]. Восстановление гемодинамики означает применение терапевтических стратегий, направленных на быстрое восстановление перфузии тканей, основную роль здесь играют инфузионная терапия и введение вазоактивных агентов [3]. Вместе с тем, обязательным условием успешной терапии септического шока является предотвращение чрезмерного вмешательства, которое парадоксальным образом может привести к увеличению заболеваемости и летальности [4 - 6]. Выполнение данного условия требует «тонкой настройки» всего процесса интенсивной терапии для того, чтобы своевременно остановить ее тогда, когда достигнуты физиологические цели и, в первую очередь, тогда, когда восстановлена перфузия тканей [7]. И здесь уместно будет подчеркнуть, что показатели состояния макроциркуляции должны подвергаться коррекции в зависимости от состояния перфузии и никакие абсолютные величины не могут рассматриваться, как нормальные, и не могут служить целями интенсивной терапии. Цель данного обзора - показать перспективы мониторинга перфузии при септическом шоке и показать комплексное видение и рекомендации, основанные на результатах исследования ANDROMEDA-SHOCK [8]. Определения терминов даны в таблице 1.
Стадии септического шока, согласованность (когерентность) гемодинамики и оценка перфузии
Ранняя стадия
Патогенетические механизмы, вовлеченные в процесс острой циркуляторной дисфункции, многообразны и изменяются с течением времени. Начальная стадия характеризуется потерей сосудистого тонуса и это есть фундаментальный патофизиологический механизм [9]. Потеря сосудистого тонуса ведет к гипотензии за счет вазодилятации артериальных сосудов, но и снижение тонуса венозных сосудов также имеет важное значение. Последствиями являются: снижение стрессового объема, системного давления наполнения, движущего давления (англ. the driving pressure), что все вместе ведет к снижению венозного возврата и, значит, к резкому падению преднагрузки (относительная гиповолемия) и сердечного выброса (СВ). Результат - снижение системного кровотока и среднего артериального давления (САД), что рассматривается как давление перфузии [10, 11]. Стимуляция адренэргического и нейрогуморального ответа приводит к вазоконстрикции венозного резервуара, расположенного в спланхнологической области, что может улучшить венозный возврат и увеличить САД. Также, СВ увеличивается за счет инотропного эффекта эпинефрина и норэпинефрина [12]. К сожалению, эти эффекты имеют свои отрицательные стороны в виде чрезмерной стимуляции миокарда и длительной вазоконстрикции в спланхнологической области [13]. Интересно то, что на этой ранней стадии сохраняется функционирование микроциркуляции даже несмотря на снижение кровотока [13]. Ранняя интенсивная терапия в виде введения жидкости и/или вазопрессоров восстанавливает СВ и САД, что может привести к улучшению потока в микроциркуляции и, следовательно, к улучшению перфузии. Такое взаимодействие между макроциркуляцией и микроциркуляцией называется согласованностью (когерентностью) гемодинамики, что есть физиологическое состояние [14, 15]. Динамическим аналогом данного состояния является чувствительность к потоку, что подразумевает увеличение системного кровотока у пациентов с сохраненной когерентностью гемодинамики после введения, например, болюса жидкости с последующим улучшением регионального и микроциркуляторного потока крови и снижением уровня маркеров, связанных с гипоперфузией.
Оценка перфузии на этой ранней стадии достаточно проста. Периферическая перфузия отражает высокий адренергический тонус и низкий кровоток, что приводит к увеличению времени ре-заполнения капилляра (англ. capillary refill time или CRT) и «мраморности» кожных покровов [16]. Если начальная интенсивная терапия успешна, то адренергический тонус снижается, а СВ растет, что подтверждается состоянием кожных покровов (снижением «мраморности»). Фактически, по нормализации времени ре-заполнения капилляров после нагрузки жидкостью мы можем судить об нормализации тканевой перфузии [17]. Снижение сатурации центральной венозной крови (ScvO2) свидетельствует об увеличении экстракции кислорода [18, 19], а высокая венозно-артериальная разница по углекислому газу (ΔPCO2) сигнализирует о снижении кровотока [20, 21]. Увеличение системного кровотока приводит к быстрому улучшению этих двух показателей. Приведенные три показателя - время ре-заполнения капилляра, ScvO2 и ΔPCO2, относятся к переменным, зависимым от потока и СВ, и показали свою пригодность для оценки в течение нескольких минут эффективности проводимой нагрузки жидкостью в реальном времени [22].
И наоборот, лактат, уровень которого увеличивается свыше нормальных значений в случае анаэробной его продукции тканями в условиях гипоперфузии или скелетными мышцами в условиях адренэргической стимуляции, может показывать снижение своего уровня в связи с улучшением микроциркуляции и со снижением адренэргической стимуляции [23 - 25]. В тоже время, остаточный лактат может перераспределяться или метаболизироваться с очень низкой скоростью, что ограничивает его применение не только для оценки эффективности нагрузки жидкостью, но и для других, направленных на получение быстрого эффекта, вмешательств. По этой причине большинство экспертов рекомендуют измерять уровень лактата не чаще, чем раз в два часа [26].
С точки зрения клинических перспектив и иерархии мнений наиболее подходящим параметром для оценки эффективности терапии на ранней стадии септического шока является время ре-заполнения капилляра. Среди множества причин, лежащих в основе такого мнения, находятся следующие: простота использования, универсальность (возможность применения в любых условиях), не требует денежных затрат и не является инвазивным методом измерения. Стандартизация техники измерения, как это было сделано в исследовании ANDROMEDA-SHOCK, может привести к увеличению так называемой меж-экспертной надежности (англ.inter-rater reliability), когда возможно будет сравнивать результаты, полученные разными клиницистами в разных стационарах.
Также время ре-заполнения капилляра может помочь при сортировке пациентов в отделениях неотложной помощи. Lara et al. [17] провели проспективное наблюдательное исследование в отделении неотложной помощи в большом учебном госпитале, в которое они включили девяносто пять пациентов с циркуляторной дисфункцией и гиперлактатемией, причиной которых стал септический шок. Время ре-заполнения капилляра оценивалось до и после начальной инфузионной терапии, объем которой в 30 мл/кг соответствовал рекомендациям клинического руководства he Surviving Sepsis Campaign. Пациенты, у которых время ре-заполнения капилляра не восстанавливалось до нормальных значений после ранней интенсивной инфузионной терапии, имели более высокий риск неблагоприятного исхода [RR 4.4 (2.7–7.4), P<0.001] и летальности [RR 6.7 (2.9–16)] по сравнению с пациентами, у которых время ре-заполнения капилляров к окончанию ранней интенсивной терапии восстанавливалось. Такие результаты исследования показывают, что время ре-заполнения капилляров, измеренное после начальной нагрузки жидкостью, может служить ориентиром при сортировке пациентов в отделении неотложной помощи и тогда, когда это время остается ниже нормальных значений, необходимо принимать решение о переводе такого пациента в отделение интенсивной терапии (ОИТ).
Стадия прогрессирования (поздняя)
Развернутая стадия септического шока характеризуется нарастанием эндотелиальной дисфункции и нарушениям коагуляции, что приводит к расстройствам микроциркуляции, целостности перфузии и оксигенации тканей и клеток [9]. Увеличение проницаемости капилляров вызывает утечку. Чрезмерное введение жидкости приводит к венозному застою, формированию интерстициальных отеков и увеличению диффузионного расстояния для кислорода [4]. Все это, наряду с другими нарушениями, ведет к потере когерентности гемодинамики [14] и генерирует новое состояние, при котором микроциркуляция и макроциркуляция разобщаются до такой степени, что увеличение системного кровотока не приводит к улучшению микроциркуляторной перфузии. И даже более того, продолжающееся введение жидкости в таких условиях только увеличивает дисфункцию микроциркуляции, что ограничивает возможности ре-перфузии.
Какова же роль оценки перфузии на этой стадии септического шока? Персистирующая гиперлактатемия рассматривается в контексте дисфункции микроциркуляции в сочетании с гипоксией тканей и ацидозом. У большинства пациентов развивается печеночная дисфункция, тяжелое воспаление и гиперадренэргия, что вносит существенный вклад в гиперлактатемию [24]. Но при этом показатель ScvO2 может быть нормальным или даже превышать нормальные значения, что отражает нарушения в экстракции кислорода в тканях, причиной которого является выраженная дисфункция микроциркуляции [27]. Показатель ΔPCO2 при развернутой клинической картине септического шока очень часто далек от нормальных его значений, что отражает гипоксию и переход на анаэробный метаболизм [28]. Интересный факт привели Ospina-Tascón et al. [28] - на этой стадии септического шока именно увеличение ΔPCO2 помогает отслеживать нарушения микроциркуляции. Таким образом, периферическая перфузия практически полностью нарушена и не отвечает на увеличение системного кровотока. Большинство экспертов полагают, что на этой стадии ситуацию с нарушенной перфузией лучше отражает состоянии микроциркуляции кожных покровов, чем параметры, чувствительные к потоку крови.
Комплексная интерпретация традиционных переменных, связанных с перфузией
Один из базовых принципов терапии септического шока гласит, что ранняя целенаправленная терапия может предотвратить тканевую гипоксию [29]. К сожалению, это не так, ведь гипоксия есть феномен, что лежит на уровне клеток/митохондрий, а это делает невозможным его оценку с помощью клинической картины и/или лабораторных тестов. Все обычные переменные - ScvO2, ΔPCO2, лактат и периферическая перфузия могут рассматриваться лишь как суррогатные маркеры феномена гипоксии и об этом мы поговорим ниже.
Низкий уровень ScvO2 представляет собой нарушение равновесия между общим и региональным (территория верхней полой вены) транспортом и потреблением кислорода [18]. В то же время увеличение экстракции O2 при увеличении потребности в нем или при снижении его доставки является ранним физиологическим ответом, направленным на предотвращение гипоксии тканей. Низкий уровень ScvO2 не свидетельствует о гипоксии тканей как таковой в отличие от нормального или даже сверх нормального уровня ScvO2 у пациентов с явным, клинически ухудшающимся состоянием гемодинамики, и именно это свидетельствует о тяжелой дисфункции микроциркуляторного русла [27].
Мониторинг ΔPCO2 на ранней стадии интенсивной терапии септического шока может помочь в оценке адекватности СВ потребностям тканевой перфузии [20].
На ранней стадии увеличение системного кровотока за счет оптимизации СВ может устранить стагнацию CO2 [25]. Но при увеличении тканевой гипоксии все больше лактата продуцируется по анаэробному пути, что увеличивает ΔPCO2, но все это происходит уже на более поздней стадии [20].
Лактат является комплексным параметром состояния метаболизма [24]. Традиционное представление о том, что лактат отражает гипоксию тканей, сменяется пониманием того, что персиститрующая гиперлактатемия имеет несколько источников. Здесь и связанная со стрессом, движимая адренэргической стимуляцией, продукция лактата в скелетных мышцах, а также снижение клиренса лактата в печени [23]. Все это имеет очень важное значение потому, что строгое следование рекомендациям текущих клинических руководств по нормализации уровня лактата может привести к избыточной интенсивной терапии (англ. overresuscitation), что, в свою очередь, может привести к увеличению заболеваемости и летальности у неизвестного количества пациентов. В двух наблюдательных исследованиях было высказано предположение о том, что мультимодальный мониторинг перфузии может помочь в интерпретации причин гиперлактатемии [7, 25]. Нормальные показатели ScvO2, ΔPCO2 и периферической перфузии, полученные одновременно, могут выявить гиперлактатемию, не связанную с гипоперфузией, что позволяет проводить более консервативное лечение [20]. Другие авторы в целях выяснения превалирующей причины гиперлактатемии предлагают использовать венозно-артериальный градиент рСО2, артериально-венозную разницу по кислороду, но здесь требуются дополнительные исследования для подтверждения этого [30].
Комплексность причин, вызывающих тяжелую циркуляторную дисфункцию, делает невозможным использование только лишь одного параметра, как уникального, для мониторинга состояния тканевой перфузии или как «гида-путеводителя» при проведении интенсивной терапии септического шока. Все перечисленные выше параметры имеют свои ограничения и трудности при их интерпретации, что делает обязательным именно мультимодальный подход к мониторингу перфузии.
Потенциальная роль времени ре-заполнения капилляров для определения состояния согласованности (когерентности) гемодинамики
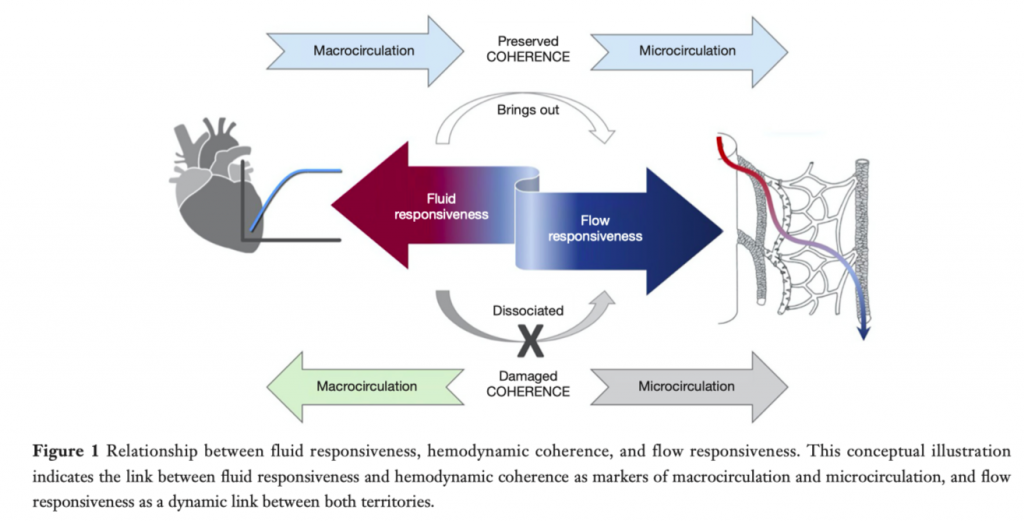
Раннее выявление пациентов, у которые гемодинамическая когерентность уже утеряна, является очень важным постольку, поскольку в этом состоянии целеполагание интенсивной терапии на оптимизацию/увеличение СВ практически бесполезно и даже вредно и может привести к ее чрезмерности и развитию осложнений. Более того, ранняя идентификация такого фенотипа пациентов может быть полезна для будущих исследований терапии спасения или иммуномодулирующей терапии, ориентированных на такую конкретную когорту. Основным риском интенсивной инфузионной терапии в ОИТ остается перегрузка жидкостью, результатом которой является увеличение летальности и заболеваемости, основными причинами чего служат органная дисфункция, продолжительная искусственная вентиляция легких и внутрибрюшная гипертензия [4, 6]. Введение жидкости пациентам с септическим шоком, у которых утеряна гемодинамическая когерентность, может ухудшить оксигенацию тканей даже тогда, когда эти пациенты остаются чувствительными к нагрузке жидкостью (респондеры) в отношении сохраненной сердечной функции. Это очень важное соображение. Оценка гемодинамической когерентности и чувствительности к потоку есть шаг вперед по сравнению с концепцией чувствительности к нагрузке жидкостью. Последняя рассматривает кривую сердечной функции, а первая - целостную взаимосвязь между различными компонентами сердечно-сосудистой системы (Рис. 1).
Вся проблема в том, что ни один статический параметр не может предсказать состояние гемодинамической когерентности, следствием чего является злоупотребление инфузионной терапией, что, вероятно, способствуют прогрессированию состояния пациента до рефрактерного шока и смерти. Это фундаментальное противоречие в интенсивной терапии септического шока подчеркивает разницу между концепциями чувствительности к жидкости и гемодинамической когерентности (Таблица 1). Например, пациенты с капиллярной утечкой сохраняют чувствительность к нагрузке жидкостью просто потому, что введенная жидкость быстро выходит в интерстиций, а тяжелая эндотелиальная/микроциркуляторная дисфункция препятствует ре-перфузии. Более того, клиницисты в отчаянии продолжают вводить все больше жидкости в попытках восстановить перфузию, но это только усугубляет нарушения микроциркуляции и еще больше ухудшает перфузию.
Только динамический параметр способен дать оценку состоянию согласованности (когерентности) между макроциркуляцией и региональным/микроциркуляторным потоком и, тем самым, предупредить перегрузку жидкостью. Как гипотеза, таким параметром может послужить время ре-заполнения капилляров, позволяющая быстро оценить эффект от нагрузки жидкостью и, таким образом, быть новейшим тестом на «гемодинамическую когерентность» или тестом «ответа потока» на нагрузку жидкостью [31] (Рис. 2). Время ре-заполнения капилляров является мостом между макро- и микроциркуляцией, прямо представляющим состояние системного кровотока в условиях потери ауторегуляции и нарушений микроциркуляции, как это уже предложено несколькими авторами [30]. Нормализация времени ре-заполнения капилляров представляет улучшение региональной и микроциркуляторной перфузии кожных покровов, что вторично по отношению к улучшению системного кровотока и/или реактивного снижения адренэргического тонуса, но все это вместе указывает на состояние гемодинамической когерентности. И наоборот, отсутствие ответа со стороны времени ре-заполнения капилляров после быстрой нагрузки жидкостью является ненормальным состоянием и служит сигналом потери когерентности. Однако нет данных, подтверждающих полезность мониторинга времени ре-заполнения капилляров в таких ситуациях, как сильная капиллярная утечка, когда ответ на предварительную нагрузку жидкостью и состояние системного кровотока резко меняются иногда за короткие периоды времени.
Есть несколько данных, свидетельствующих в пользу гипотезы, что время ре-заполнения капилляров является маркером состояния гемодинамической когерентности: (I) в наших предыдущих исследованиях пациенты с нормальным против пациентов с ненормальным временем ре-заполнения капилляров после интенсивной инфузионной терапии показывали значительную разницу в 28-ми дневной летальности (ED observational: 8.8% vs. 55.6% [17]; ICU observational 15% vs. 50% [22]; ANDROMEDA-SHOCK: 23% vs. 49% (at 8 h) [8]. (II) в пилотном исследовании пациенты с улучшением времени ре-заполнения капилляров после интенсивной инфузионной терапии показывали улучшение кровотока в гепато-спланхнологической области [32], в большей степени за счет снижения адренэргического тонуса. (III) время ре-заполнения капилляров представляет наиболее быструю кинетику восстановления у выживших пациентов с септическим шоком, что может объяснено только лишь сохранением гемодинамической когерентности [7]. (IV) нормализация времени ре-заполнения капилляров в исследовании ANDROMEDA-SHOCK ассоциировалась с меньшей степенью органной дисфункции [8]. (V) ранняя интенсивная инфузионная терапия улучшала поток в микроциркуляции в классическом ED исследовании [33].
Касательно результатов исследования ANDROMEDA-SHOCK. Несмотря на то, что эти результаты очень обнадеживают, следует помнить о некоторых ограничениях и, в частности, о потенциальной вариативности оценки времени ре-заполнения капилляров между наблюдателями. Конечно, в этом исследовании использовался стандартизированный подход, но в других странах такую практику невозможно отнести к обычным. Кроме того, некоторые результаты были близки к значимым, что диктует необходимость подтверждения их в дальнейших крупных исследованиях.
Существует множество возможных объяснений того, почему время ре-заполнения капилляра может не реагировать на увеличение ударного объема, вызванное быстрым введением жидкости: (I) более поздняя стадия септического шока с разобщением между макро- и микроциркуляцией [14]. (II) объема введенной жидкости было недостаточно для увеличения ударного объема. (III) наличие чрезмерного адренергического тонуса с регионарной/ микроциркуляторной гипоперфузией. (IV) более выраженная активация коагуляции и/или дисфункция эндотелия, что нарушает микроциркуляцию и вместе с этим перфузию [34].
Если эта гипотеза подтвердится в будущем, то ответ времени ре-заполнения капилляров на нагрузку жидкостью может использоваться в качестве теста на гемодинамическую когерентность или на чувствительность к потоку, что, в свою очередь, поможет в данных условиях избежать бесполезного и опасного введения жидкости у пациентов с разобщением микро- и макроциркуляции и, в конечном итоге, снизить связанную с этим, по сути ятрогенной, избыточную летальность. Все это приведет к тому, что интенсивная инфузионная терапия станет применяться у пациентов с сохраненной гемодинамической когерентность тогда, когда другие параметры перфузии, ScvO2 и ΔPCO2, еще далеки от нормальных. Более того, определение статуса гемодинамической когерентности с помощью такого простого теста на догоспитальном этапе и в условиях недостаточности ресурсов может помочь при сортировке пациентов. Пациенты, у которых нет ответной реакции времени ре-заполнения капилляров на нагрузку жидкостью должны в срочном порядке быть переведены в ОИТ, где есть возможности расширенного мониторинга и лечения, лучшего контроля за источником и более широкого выбора методов лечения, включая сюда и терапию спасения [17].
Связь между параметрами перфузии и региональным/микроциркуляторным кровотоком и параметрами гипоксии: концепция глубокой гипоперфузии
В экспериментальных условиях региональный кровоток и его распределение можно оценить напрямую, что позволило изучить влияние жидкостей и вазоактивных агентов на кровоток в почках, мезентериальных сосудах и в печени. У пациентов для оценки различных аспектов кровотока и перфузии применялись желудочная тонометрия, внутрижелудочный лазер-допплер, катетеризация печеночной вены и показатели пульсации некоторых гепато-спланхнологических артерий [35]. Сублингвальная оценка микроциркуляции не вошла в рутинную клиническую практику и остается ограниченной областью исследований [13, 36] по причинам неразрешенных разногласий между экспертами относительно лучшего способа анализа изображений, что препятствует развитию данного метода.
Концепция глубокой гипоперфузии полагается на такие доказательства нарушения регионального или микроциркуляторного кровотока, как суррогатные маркеры гипоксии - лактат/пируват, градиент венозно-артериальной разницы pCO2/артерио-венозная разница по кислороду (Таблица 1). Но ни в экспериментальных, ни в клинических исследованиях связь между клинически оцениваемыми параметрами и маркерами глубокой гипоперфузии практически не рассматривалась.
Brunauer et al. [32] обнаружили значительную корреляцию между изменениями времени ре-заполнения капилляров и шкалы пятнистости с индексом пульсации различных гепато-спланхнологических артерий при интенсивной терапии септического шока. Эта корреляция является физиологически согласованной, поскольку на обеих территориях действует один и тот же адренергический ответ на циркуляторный стресс, который, как было показано в их исследовании, может быть обращён вспять путем увеличения системного кровотока.
В более раннем исследовании ассоциация между параметрами перфузии с 6-ти часовым клиренсом лактата изучалась в когорте пациентов с гипердинамическим септическим шоком [37]. Пациенты, у которых клиренс лактата за шесть часов был менее 10%, показывали более худший гепато-спланхнологический поток и более серьезные нарушения скорости исчезновения индоцианового зеленого в плазме [9.7% (8–19%) vs. 19.6% (9–32%)/min, P<0.05], что скорее всего связано гипоперфузией печени.
Взаимосвязь между кровотоком в печени и клиренсом лактата была глубоко изучена в экспериментальной модели эндотоксического шока [38]. Инвазивный мониторинг здесь включал в себя общий кровоток в печени с помощью ультразвукового датчика потока и катетеризацию воротной/печеночной вены. После вводили болюс эндотоксина с последующей непрерывной инфузией. Экзогенный клиренс лактата рассчитывали путем в/в введения лактата натрия и повторного отбора проб. У животных моделей эндотоксического шока клиренс лактата резко снизился до менее чем 10% от контроля [46 (30–180) против 1212 (743–2,116) мл / мин, P <0,01]. Однако данный результат не был связан с гипоперфузией печени, поскольку общий кровоток в печени, клиренс экзогенного сорбита (определяемый потоком), ферменты печени и митохондриальное дыхание ex vivo были сопоставимы между группой эндотоксического шока и контрольной группой. Авторы предположили, что объяснить такие результаты могут метаболическая блокада и/или нарушения микроциркуляции печени, но, к сожалению, эти механизмы не были изучены в исследовании. Но все же эти данные предполагают, что нарушение клиренса лактата при раннем септическом шоке может быть объяснено как гипоперфузией гепато-спланхнологической области, так и дисфункцией печени при сохраненном кровотоке в ней.
Недавнее клиническое рандомизированное контролируемое исследование сравнивало две цели интенсивной терапии септического шока - время ре-заполнения капилляров против лактата. Среди пациентов, которые достигли целевых показателей в обеих группах, значения параметров, связанных с перфузией [например, индекс микроциркуляторного кровотока 3 (2,5–3) против 2,9 (2,75–3), P = 0,9; лактат/пируват 7,9 (3,77–13,6) против 6,3 (2,46–13,9), P = 0,68; сатурация мышц кислородом 75% (68–85%) против 79% (68–85%), P = 0,67], были сопоставимы. Интересно, что у пациентов в группе времени ре-заполнения капилляров были признаки глубокой гипоперфузии, определяемой комбинированным результатом нарушения регионарного/микроциркуляторного кровотока и суррогатных маркеров гипоксии (7% против 43%, P = 0,07) (неопубликованные данные). Другое исследование, в котором при гипердинамическом септическом шоке сравнивали добутамин с плацебо по макрогемодинамике, параметрам регионарной, периферической и микроциркуляторной перфузии, показало, что у пациентов, у которых нормализовалось время ре-заполнения капилляров, также нормализовалась сатурация скелетных мышц и скорость исчезновения индоцианового зеленого [35].
Все полученные результаты подтверждают, что нормальное время ре-заполнения капилляров связано с сохранением гепато-спланхнологического и мышечного кровотока (7,32,35). Лактат намного сложнее, как показано в цитируемых исследованиях по клиренсу лактата.
Но на сегодня все эти доказательства скудны и случайны, поэтому необходимы дополнительные исследования, чтобы лучше определить взаимосвязь между переменными системной перфузии и маркерами глубокой гипоперфузии.
Концепция нагрузки жидкостью
Поскольку абсолютная или относительная гиповолемия почти всегда присутствует при раннем септическом шоке, интенсивная терапия начинается с введения жидкости еще до поступления пациента в ОИТ, например, в отделении неотложной помощи или в общей палате [39]. Нагрузка жидкостью есть ничто иное, чем быстрое введение жидкости без обязательного мониторинга реакции в режиме реального времени при столкновении с серьезной и опасной для жизни гипотонией и гипоперфузией. Это представляет собой «R = спасение (rescue)» (от акронима ROSE) и обычно включает внутривенное введение кристаллоидов в объеме 20–30 мл/кг в соответствии с текущими рекомендациями [40]. Быстрое введение достаточно большого объема жидкости преследует цель увеличения перфузии тканей за счет увеличения среднего системного давления наполнения и увеличения венозного возврата и СВ у чувствительных к жидкости пациентов.
Если дисфункция кровообращения не устраняется таким ранним лечением, пациенты переводятся в отделение интенсивной терапии, где начинается расширенная жидкостная реанимация с основной целью увеличения системного кровотока. Это упоминается как «O = оптимизация» в ROSE [41]. Первым шагом является оценка чувствительности к жидкости [4, 41]. В исследовании ANDROMEDA-SHOCK [8, 42, 43] мы обнаружили, что только 70% пациентов при поступлении в ОИТ реагировали на инфузию, и, таким образом, мы смогли избежать ненужного введения жидкости у остальных 30%. Пациентов, которые не реагировали на жидкость, можно было лечить с помощью альтернативных этапов протокола, таких как вазопрессоры и/или инотропы с аналогичными показателями достижения цели, несмотря на получение этими пациентами значительно меньшего количества жидкости.
Стандартной практикой является болюсное введение жидкости чувствительным к этому вмешательству пациентам, у которых все еще сохраняется гипоперфузия [41, 44], что в конечном итоге улучшает перфузию тканей, но только в зависимости от состояния гемодинамической согласованности [14]. (Таблица 1).
Существует также фундаментальное различие между триггерами начала интенсивной инфузионной терапии и ее целями [39, 45]. Как показало исследование FENICE, клиницисты используют самые разные триггеры для начала инфузионной терапии [44]. Наиболее часто упоминались гипотония, олигоурия и отлучение от вазопрессоров, показания, которые весьма спорны и могут привести к перегрузке жидкостью. Переменные, связанные с перфузией, упомянули только 8% респондентов.
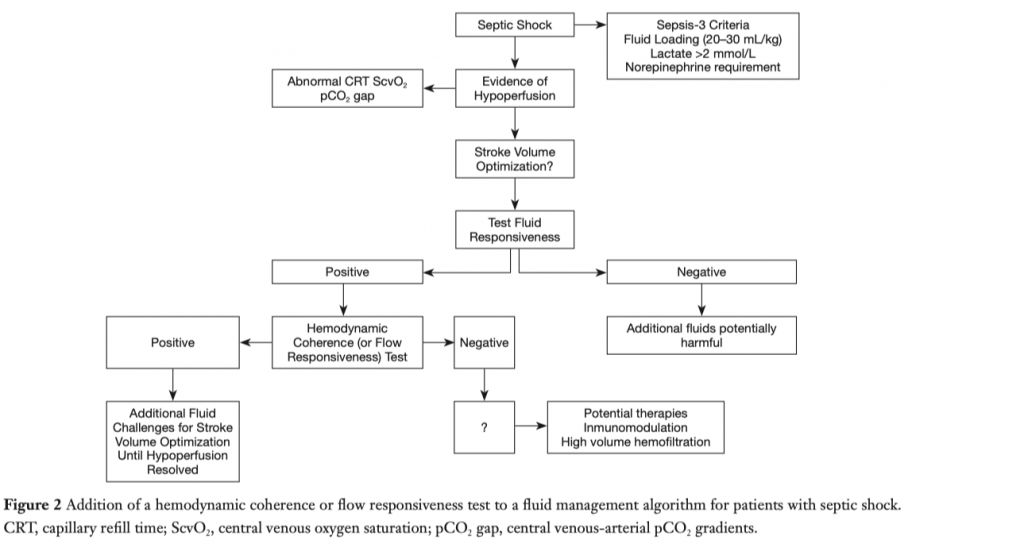
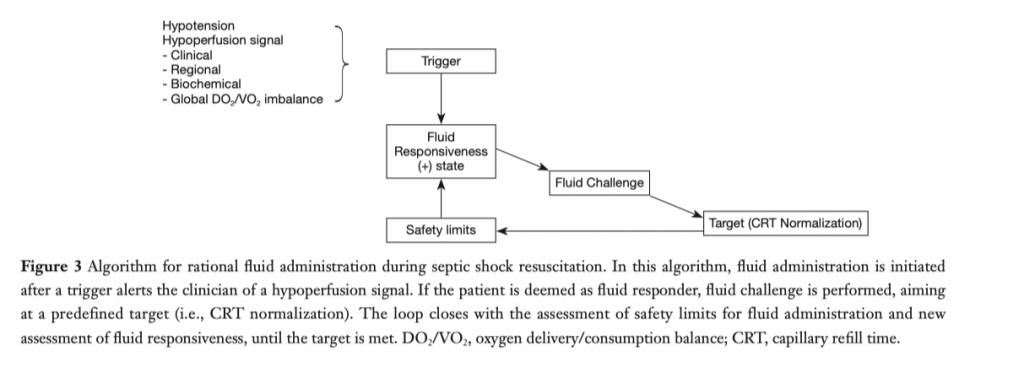
Цели - те параметры, против которых направлено введение болюса жидкости. Правильными целями для интенсивной терапии септического шока являются связанные с перфузией переменные, коррекция которых коррелирует с улучшением тканевого или микроциркуляторного кровотока и которые, в идеале, показывают реакцию на увеличение СВ или перфузионного давления в реальном времени. Кроме того, они должны быть простыми и общедоступными. Результаты исследования ANDROMEDA-SHOCK подтверждают использование времени ре-заполнения капилляров в качестве цели при проведении интенсивной инфузионной терапии [8, 46]. Физиологический и концептуальный взгляд на наилучшее проведение болюсной нагрузки жидкостью показан на рисунке 3. Триггеры принятия решения должны быть рациональными. Например, у пациента с септическим шоком и с низким диастолическим артериальным давлением (<40 ммHg в сочетании с тахикардией) явно наблюдается резкое снижение сосудистого тонуса, а согласно базовой физиологии, сосудистый тонус не восстанавливается кристаллоидами, так что здесь явные показания для начала терапии вазопрессорами [12]. И наоборот, пациент с гипотензией и с низким пульсовым давлением может быть хорошим кандидатом для введения жидкости с целью восстановления преднагрузки, но только при отсутствии клинических или эхокардиографических признаков сердечной дисфункции. Олигоурия является очень иррациональным триггером по нескольким причинам, подробно обсуждаемым в другом месте [39]. Введение жидкости не обязательно приводит к восстановлению нормального темпа диуреза. Диурез относится к тем переменным, для изменения которых требуется время, к тому же на темп диуреза влияют другие факторы, помимо гемодинамического статуса. Следовательно, целеполагание только лишь на олигоурию может привести к перегрузке жидкостью и нанести вред пациенту.
Если пациент относится к так называемым «респондерам», то проводится болюсная нагрузка жидкостью (как правило, это введение внутривенно 500 мл кристаллоидов в течение 30 минут), после чего снова производится оценка времени ре-заполнения капилляров (целевой показатель) (Рис. 3) [10]. Если цель достигнута, то дальше производиться периодический контроль. Если нет, то необходимо рассмотреть введение нового болюса, но только при соблюдении двух условий: первое - не достигнут предел безопасности (к примеру, повышение центрального венозного давления свыше 5 мм Hg), второе - пациент все еще сохраняет чувствительность к нагрузке жидкостью (требуется предварительная оценка этого).
Влияние уровня САД и/или дозы вазопрессоров на тканевую перфузию
У пациентов с отсутствием реакции на жидкость («не-респондеры») следует опробовать альтернативные способы восстановлению перфузии тканей. Начальное САД на уровне 60 – 65 мм Hg представляется приемлемым практически для всех пациентов, поскольку этот уровень, вероятно, превышает теоретический порог ауторегуляции. В тоже время, части пациентов может потребоваться более высокое САД в случае наличия у них хронической гипертензии, однако по этому поводу нет единого мнения. Исследования, ориентированные на микроциркуляцию, с использованием метода бокового темного потока (англ. the side-dark stream technique) показывают, что у пациентов с нарушениями сублингвальной микроциркуляцией на исходном уровне, при увеличении САД с 65 до 85 мм Hg кровоток может улучшиться. Поэтому, учитывая противоречивые результаты исследования SEPSISPAM, нельзя сделать однозначных выводов [49].
В исследовании ANDROMEDA-SHOCK был выбран прагматический подход в виде теста на вазопрессоры [8, 43]. САД достаточно быстро поднимали до уровня 80 - 85 мм Hg у пациентов, имеющих в анамнезе артериальную гипертензию, и у которых невозможно было достигнуть целевых значений только лишь инфузионной терапией. По прошествии одного или двух часов (зависело от группы) проводилась переоценка целей и, в случае если цели опять не были достигнуты, уровень САД снижали до 60 - 65 мм Hg. Напротив, у пациентов, у которых цели интенсивной терапии были достигнуты, уровень САД поддерживали до конца 8-ми часового периода вмешательства. Вазопрессорный тест потребовался меньшему количеству пациентов в группе периферической перфузии (28,8%) по сравнению с группой лактата (40,1%) (P = 0,02), хотя успех не отличался (44% против 38% соответственно; P = 0,86). Таким образом, вазопрессорный тест есть ни что иное, как способ отбора пациентов, у которых повышение перфузионного давления преобладает над пре-капиллярной вазоконстрикцией, вызванной вазопрессорами, а его выполнении не причиняет вреда.
Инотропы как последний шаг
Инотропы (англ. inodilators), особенно добутамин, использовались в прошлом и все еще рекомендуются к применению в некоторых клинических руководствах для увеличения системного кровотока и, тем самым, улучшения перфузии тканей [2]. Прямая локальная вазодилятация, независимая от СВ, была предложена в некоторых предыдущих клинических и экспериментальных исследованиях, но эффекты от нее не были не столько уж явными [50]. В нескольких современных протоколах добавление добутамина было последним шагом в последовательности всех тех терапевтических вмешательств, направленных на достижение целей интенсивной терапии [44,51,52]. Тем не менее, большинство исследований было выполнено в «докардиографическую» эпоху, когда оставалось неясным, будет ли такое вмешательство полезным для пациентов без клинически значимой дисфункции миокарда. В ранее упомянутом перекрестном двойном слепом рандомизированном контролируемом испытании добутамина в сравнении с плацебо в качестве краткосрочного вмешательства не было показано никаких преимуществ, которые оценивались с помощью комплексной мультимодальной оценки перфузии, включающей в себя тонометрию кишечника, сублингвальную микроциркуляцию, скорость исчезновения индоцианового зеленого из плазмы, сатурацию кислородом скелетной мускулатуры [35]. В исследовании ANDROMEDA-SHOCK 15% пациентов получали инотропы без каких-либо существенных различий между группами [8]. Таким образом, роль инотропов остается под вопросом.
Как интегрировать все эти концепции в алгоритм интенсивной терапии, нацеленной на время ре-заполнения капилляров
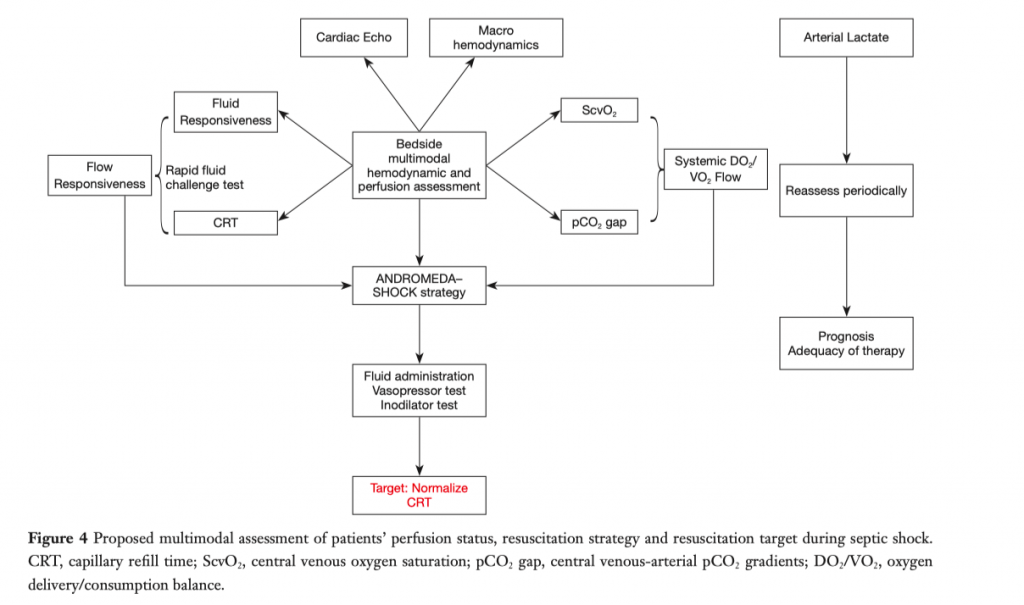
Концептуальный алгоритм ведения интенсивной терапии септического шока представлен на рисунке 4. Ключевую роль в этом процессе играет мультимодальный мониторинг перфузии. Базовый гемодинамический мониторинг с помощью центрального венозного катетера и артериальной линии позволяет определять ScvO2 и ΔPCO2. Интегрированный анализ этих двух параметров может определить состояние потока и привести к оптимизации отношения DO2/VO2. Концепция чувствительности потока как сигнала сохраненной гемодинамической когерентности может быть проверена путем быстрого введения жидкости (например, 4 мл/кг за 5 минут) у чувствительных к жидкости пациентов и с последующей оценкой ответа на основании времени ре-заполнения капилляров. Последовательные шаги, предложенные в исследовании ANDROMEDA-SHOCK, могут использоваться для достижения целевого показателя времени ре-заполнения капилляров у пациентов, чувствительных к потоку, в то время как параллельно оптимизируются другие аспекты взаимосвязи DO2/VO2. Для прогностических целей можно периодически контролировать уровень лактата, впрочем, как и для оценки общей адекватности процесса интенсивной терапии и корректировки других аспектов, таких как контроль источника инфекции.
Заключение
Прогресс в нашем понимании патофизиологических механизмов и стадий септического шока может привести к появлению более рациональных алгоритмов его интенсивной терапии. Новые концепции, такие как гемодинамическая когерентность и чувствительность к потоку, могут быть использованы у постели больного и помочь в выборе лучших стратегий лечения в любой момент времени. Мультимодальный мониторинг перфузии и комплексный анализ с макрогемодинамическими параметрами обязательны для оптимизации процесса интенсивной терапии.
Время ре-заполнения капилляров появляется как иерархическая цель реанимации, которую можно преследовать после успешного выполнения протокола ANDROMEDA-SHOCK. Нормальное время ре-заполнения капилляров, вероятно, связано с разрешением глубокой гипоперфузии.
Список литературы
1. Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016;315:801-10.
2. Rhodes A, Evans L, Alhazzani W, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Crit Care Med 2017;45:486-552.
3. Hernandez G, Bruhn A, Castro R, et al. The holistic view on perfusion monitoring in septic shock. Curr Opin Crit Care 2012;18:280-6.
4. Bagshaw SM, Brophy PD, Cruz D, et al. Fluid balance as a biomarker: impact of fluid overload on outcome in critically ill patients with acute kidney injury. Crit Care 2008;12:169.
5. Boyd JH, Forbes J, Nakada TA, et al. Fluid resuscitation in septic shock: A positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med 2011;39:259-65.
6. Payen D, de Pont AC, Sakr Y, et al. A positive fluid balance is associated with a worse outcome in patients with acute renal failure. Crit Care 2008;12:R74.
7. Hernandez G, Luengo C, Bruhn A, et al. When to stop septic shock resuscitation: clues from a dynamic perfusion monitoring. Ann Intensive Care 2014;4:30.
8. Hernández G, Ospina-Tascon G, Petri Damiani L, et al. Effect of a Resuscitation Strategy Targeting Peripheral Perfusion Status vs Serum Lactate Levels on 28-Day Mortality Among Patients With Septic Shock. The ANDROMEDA-SHOCK Randomized Clinical Trial. JAMA 2019;321:654-64.
9. Hernández G, Teboul JL. Is the macrocirculation really dissociated from the microcirculation in septic shock? Intensive Care Med 2016;42:1621-4.
10. Monnet X, Teboul JL. My patient has received fluid. How to assess its efficacy and side effects? Ann Intensive Care 2018;8:54.
11. Berlin DA, Bakker J. Understanding venous return. Intensive Care Med 2014;40:1564-6.
12. Hernández G, Teboul JL, Bakker J. Norepinephrine in septic shock. Intensive Care Med 2019;45:687-9.
13. Dubin A, Henriquez E, Hernández G. Monitoring peripheral perfusion and microcirculation. Curr Opin Crit Care 2018;24:173-80.
14. Ince C. Hemodynamic coherence and the rationale for monitoring the microcirculation. Crit Care 2015;19:S8.
15. Morelli A, Passariello M. Hemodynamic coherence in sepsis. Best Pract Res Clin Anaesthesiol 2016;30:453-63.
16. Lima A, Jansen TC, Van Bommel J, et al. The prognostic value of the subjective assessment of peripheral perfusion in critically ill patients. Crit Care Med 2009;37:934-8.
17. Lara B, Enberg L, Ortega M, et al. Capillary refill time during fluid resuscitation in patients with sepsis-related hyperlactatemia at the emergency department is related to mortality. PLoS One 2017;12:e0188548.
18. Bauer P, Reinhart K, Bauer M. Significance of venous oximetry in the critically ill. Med Intensiva 2008;32:134-42.
19. Boulain T, Garot D, Vignon P, et al. Prevalence of low central venous oxygen saturation in the first hours of intensive care unit admission and associated mortality in septic shock patients: a prospective multicentre study. Crit Care 2014;18:609.
20. Gavelli F, Teboul JL, Monnet X. How can CO2-derived indices guide resuscitation in critically ill patients? J Thorac Dis 2019;11:S1528-37.
21. Scheeren TWL, Wicke JN, Teboul JL. Understanding the carbon dioxide gaps. Curr Opin Crit Care 2018;24:181-9.
22. Hernandez G, Pedreros C, Veas E, et al. Evolution of peripheral vs metabolic perfusion parameters during septic shock resuscitation. A clinical-physiologic study. J Crit Care 2012;27:283-8.
23. Bakker J, de Backer D, Hernandez G. Lactate-guided resuscitation saves lives: we are not sure. Intensive Care Med 2016;42:472-4.
24. Hernandez G, Bellomo R, Bakker J. The ten pitfalls of lactate clearance in sepsis. Intensive Care Med 2019;45:82-5.
25. Alegría L, Vera M, Dreyse J, et al. A hypoperfusion context may aid to interpret hyperlactatemia in sepsis-3 septic shock patients: a proof-of-concept study. Ann Intensive Care 2017;7:29.
26. Vincent JL, e Silva AQ, Couto L, et al. The value of blood lactate kinetics in critically ill patients: A systematic review. Crit Care 2016;20:257.
27. Textoris J, Fouché L, Wiramus S, et al. High central venous oxygen saturation in the latter stages of septic shock is associated with increased mortality. Crit Care 2011;15:R176.
28. Ospina-Tascón GA, Umaña M, Bermúdez WF, et al. Can venous-to-arterial carbon dioxide differences reflect microcirculatory alterations in patients with septic shock? Intensive Care Med 2016;42:211-21.
29. MacIntyre NR. Tissue hypoxia: Implications for the respiratory clinician. Respir Care 2014;59:1590-6.
30. Ospina-Tascón GA, Hernández G, Cecconi M. Understanding the venous-arterial CO2 to arterialvenous O2 content difference ratio. Intensive Care Med 2016;42:1801-4.
31. Hernández G, Castro R, Bakker J. Capillary refill time: the missing link between macrocirculation and microcirculation in septic shock? J Thorac Dis 2020;12:1127-9.
32. Brunauer A, Koköfer A, Bataar O, et al. Changes in peripheral perfusion relate to visceral organ perfusion in early septic shock: A pilot study. J Crit Care 2016;35:105-9.
33. Trzeciak S, McCoy JV, Dellinger RP, et al. Early increases in microcirculatory perfusion during protocol-directed resuscitation are associated with reduced multi-organ failure at 24 h in patients with sepsis. Intensive Care Med 2008;34:2210-7.
34. Ince C, Mayeux PR, Nguyen T, et al. The endothelium in sepsis. Shock 2016;45:259-70.
35. Hernandez G, Bruhn A, Luengo C, et al. Effects of dobutamine on systemic, regional and microcirculatory perfusion parameters in septic shock: A randomized, placebo-controlled, double-blind, crossover study. Intensive Care Med 2013;39:1435-43.
36. Vellinga NAR, Boerma EC, Koopmans M, et al. International Study on Microcirculatory Shock Occurrence in Acutely Ill Patients. Crit Care Med 2015;43:48-56.
37. Hernandez G, Regueira T, Bruhn A, et al. Relationship of systemic, hepatosplanchnic, and microcirculatory perfusion parameters with 6-hour lactate clearance in hyperdynamic septic shock patients: an acute, clinical-physiological, pilot study. Ann Intensive Care 2012;2:44.
38. Tapia P, Soto D, Bruhn A, et al. Impairment of exogenous lactate clearance in experimental hyperdynamic septic shock is not related to total liver hypoperfusion. Crit Care 2015;19:188.
39. Cecconi M, Hernandez G, Dunser M, et al. Fluid administration for acute circulatory dysfunction using basic monitoring: narrative review and expert panel recommendations from an ESICM task force. Intensive Care Med 2019;45:21-32.
40. Malbrain MLNG, Van Regenmortel N, Saugel B, et al. Principles of fluid management and stewardship in septic shock: it is time to consider the four D’s and the four phases of fluid therapy. Ann Intensive Care 2018;8:66.
41. Monnet X, Teboul JL. Assessment of fluid responsiveness: Recent advances. Curr Opin Crit Care 2018;24:190-5.
42. Kattan E, Ospina-Tascón GA, Teboul JL, et al. Systematic assessment of fluid responsiveness during early septic shock resuscitation: secondary analysis of the ANDROMEDASHOCK trial. Crit Care 2020;24:23.
43. Hernández G, Cavalcanti AB, Ospina-Tascón G, et al. Early goal-directed therapy using a physiological holistic view: the ANDROMEDA-SHOCK—a randomized controlled trial. Ann Intensive Care 2018;8:52.
44. Cecconi M, Hofer C, Teboul JL, et al. Fluid challenges in intensive care: the FENICE study: A global inception cohort study. Intensive Care Med 2015;41:1529-37.
45. Cecconi M, Parsons AK, Rhodes A. What is a fluid challenge? Curr Opin Crit Care 2011;17:290-5.
46. Zampieri FG, Damiani LP, Bakker J, et al. Effect of a Resuscitation Strategy Targeting Peripheral Perfusion Status vs Serum Lactate Levels on 28-Day Mortality Among Patients with Septic Shock: A Bayesian Reanalysis of the ANDROMEDA-SHOCK Trial. Am J Respir Crit Care Med 2020. doi: 10.1164/rccm.201905-0968OC.
47. De Backer D, Vincent JL. Should we measure the central venous pressure to guide fluid management? Ten answers to 10 questions. Crit Care 2018;22:43.
48. Dubin A, Pozo MO, Casabella CA, et al. Increasing arterial blood pressure with norepinephrine does not improve microcirculatory blood flow: A prospective study. Crit Care 2009;13:R92.
49. Asfar P, Meziani F, Hamel JF, et al. High versus Low Blood-Pressure Target in Patients with Septic Shock. N Engl J Med 2014;370:1583-93.
50. De Backer D, Creteur J, Dubois MJ, et al. The effects of dobutamine on microcirculatory alterations in patients with septic shock are independent of its systemic effects. Crit Care Med 2006;34:403-8.
51. Rivers E, Nguyen B, Havstad S, et al. Early-goal directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001;345:1368-77.
52. Jansen TC, Van Bommel J, Schoonderbeek FJ, et al. Early lactate-guided therapy in intensive care unit patients: A multicenter, open-label, randomized controlled trial. Am J Respir Crit Care Med 2010;182:752-61.
Annals of Translational Medicine