Новая версия Методических рекомендаций «Диагностика и антимикробная терапия инфекций, вызванных полирезистентными штаммами микроорганизмов» (обновление 2022 г.)
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Российской некоммерческой общественной организации «Ассоциация анестезиологов- реаниматологов», Межрегиональной общественной организации «Альянс клинических химиотерапевтов и микробиологов», Межрегиональной ассоциации по клинической микро- биологии и антимикробной химиотерапии (МАКМАХ), общественной организации «Российский Сепсис Форум»
«Диагностика и антимикробная терапия инфекций, вызванных полирезистентными штаммами микроорганизмов» (обновление 2022 г.)
В.Б. БЕЛОБОРОДОВ (МОСКВА), О.В.ГОЛОЩАПОВ (САНКТ-ПЕТЕРБУРГ), В.Г ГУСАРОВ (МОСКВА), А.В. ДЕХНИЧ (СМОЛЕНСК), М.Н. ЗАМЯТИН (МОСКВА), Н.А. ЗУБАРЕВА (ПЕРМЬ), С.К. ЗЫРЯНОВ (МОСКВА), Д.А. КАМЫШОВА (МОСКВА), Н.Н. КЛИМКО (САНКТ-ПЕТЕРБУРГ), Р.С. КОЗЛОВ (СМОЛЕНСК), В.В. КУЛАБУХОВ (МОСКВА), М.А.ПЕТРУШИН (ТВЕРЬ), Ю.С. ПОЛУШИН (САНКТ-ПЕТЕРБУРГ), Д.А. ПОПОВ (МОСКВА), В.А. РУДНОВ (ЕКАТЕРИНБУРГ), С.В. СИДОРЕНКО (САНКТ- ПЕТЕРБУРГ), Д.В. СОКОЛОВ, И.В. ШЛЫК (САНКТ-ПЕТЕРБУРГ), М.В. ЭЙДЕЛЬ- ШТЕЙН (СМОЛЕНСК), С.В. ЯКОВЛЕВ (МОСКВА)
Резюме.
В большинстве регионов мира, в том числе и в России, продолжают распространяться штаммы микроорганизмов, характеризующиеся устойчивостью к используемым в медицинских организациях антимикробным препаратам. Понятно, что это закономерно влияет как на эффективность антимикробной терапии, так и на тактику и стратегию ее применения не только у взрослых, но и у детей. Пандемия коронавирусной инфекции, кроме того, высветила нарастающие проблемы с лечением инвазивных микозов, подбором дозирования антибактериальных средств при использовании методов сорбционной и диализной терапии. Эти обстоятельства обусловили необходимость внести коррективы в Методические рекомендации «Диагностика и антимикробная терапия инфекций, вызванных полирезистентными штаммами микрорганизмов», которые были подготовлены группой ведущих российских экспертов в 2020 г. [1]. Представляемый вариант рекомендаций был утвержден 25.03.2022 г. на совместном заседании рабочей группы с представителями общественных организаций: Российской некоммерческой общественной организации «Ассоциация анестезиологов-реаниматологов», Межрегиональной общественной организации «Альянс клинических химиотерапевтов и микробиологов», Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ), общественной организации
«Российский Сепсис Форум». Данные рекомендации отражают междисциплинарное консенсусное мнение о подходах к диагностике и антимикробной терапии инфекций, вызванных полирезистентными микрорганизмами. В их основу положены данные из публикаций, полученные в ходе рандомизированных исследований, а также положения, изложенные в международных клинических рекомендациях, имеющие высокую степень доказательности.
Изложенные в Рекомендациях положения целесообразно использовать при определении тактики эмпирической и этиотропной терапии наиболее тяжелых инфекций.
Ключевые слова: инфекция, микробы, детекция микроорганизмов, антибактериальная терапия, антибиотикорезистентность, эмпирическая антибактериальная терапия
Белобородов Владимир Борисович – д.м.н., вице-президент МОО «Альянс клинических химиотерапевтов и микробиологов», заведующий кафедрой инфекционных болезней ФГБОУ ДПО Российская медицинская академия непрерывного профессионального образования Минздрава России, Москва
Голощапов Олег Валерьевич – к.м.н., ассистент кафедры анестезиологии и реаниматологии, заведующий ОРИТ НИИ ДГОТ им. Р.М.
Горбачевой ПСПбГМУ им. И.П. Павлова, Санкт-Петербург
Гусаров Виталий Геннадьевич – д.м.н., доцент, заведующий кафедрой анестезиологии и реаниматологии, главный врач стационара ФГБУ «НМХЦ им.Н.И. Пирогова» Минздрава России, Москва
Дехнич Андрей Владимирович – к. м. н., заместитель директора по научной работе НИИ антимикробной химиотерапии ФГБОУ ВО Смоленский государственный медицинский университет Минздрава России, Смоленск
Замятин Михаил Николаевич – д.м.н., профессор, заведующий кафедрой организации медицинской помощи в чрезвычайных ситуациях ИУВ, директор федерального центра медицины катастроф ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России, Москва
Зубарева Надежда Анатольевна – д.м.н., профессор кафедры
общей хирургии № 1 Пермского
государственного медицинского университета им. академика Е.А. Вагнера Минздрава
России, Пермь
Зырянов Сергей Кенсаринович – д.м.н., профессор, заместитель главного врача по терапии ГКБ №24, заведующий кафедрой общей и клинической фармакологии ФГАОУ ВО «Российский университет дружбы народов», Москва
Камышова Дарья Андреевна – заведующий отделением клинической фармакологии ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России, Москва
Климко Николай Николаевич – д.м.н., профессор, заведующий кафедрой клинической микологии, аллергологии и иммунологии Северо-Западного государственного медицинского университета им. И.И. Мечникова, Санкт-Петербург
Козлов Роман Сергеевич – член-корреспондент РАН, д.м.н., профессор, директор НИИ антимикробной химиотерапии ФГБОУ ВО Смоленский государственный медицинский университет Минздрава России, президент Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ), главный внештатный специалист по клинической микробиологии и антимикробной резистентности МЗ РФ, Смоленск
Кулабухов Владимир Витальевич – к.м.н., президент общественной организации «Российский Сепсис-форум», член координационного совета Ассоциации анестезиологов-реаниматологов, ведущий научный сотрудник НИИ СП им. Н.В. Склифосовского, Москва
Петрушин Максим Александрович - заведующий
службой анестезиологии-реанимации областной клинической больницы, главный внештатный
анестезиолог-реаниматолог Тверской области, Тверь
Полушин Юрий Сергеевич – академик РАН, д.м.н., профессор, президент Ассоциации анестезиологов-реаниматологов, руководитель Научно-клинического центра анестезиологии и реаниматоло гии, заведующий кафедрой анестезиологии и реаниматологии ПСПбГМУ им. И.П. Павлова Мин здрава России, Санкт-Петербург
Попов Дмитрий Александрович – д.м.н., заведующий лабораторией клинической микробиологии и антимикробной терапии, профессор кафедры анестезиологии и реаниматологии с курсом клинической лабораторной диагностики ИПКВК И ПО ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России, Москва
Руднов Владимир Александрович – д.м.н., заведующий кафедрой анестезиологии, реаниматологии и токсикологии Уральского государственного медицинского университета, зам. главного врача МАУ ГКБ № 40 по анестезиологии и реанимации, вице-президент МАКМАХ, председатель совета экспертов Российской общественной организации «Сепсис Форум», член координационного совета ассоциации анестезиологов-реаниматологов, Екатеринбург
Сидоренко Сергей Владимирович – д.м.н., профессор, вице-президент МОО «Альянс клинических химиотерапевтов и микробиологов», заведующий отделом медицинской микробиологии и молекулярной эпидемиологии Детского научно-клинического центра инфекционных болезней ФМБА; профессор кафедры медицинской микробиологии Северо-Западного государственного медицинско- го университета, Санкт-Петербург
Соколов Дмитрий Васильевич – научный сотрудник Научно-клинического центра анестезиологии и реаниматологии ПСПбГМУ им. И.П. Павлова Минздрава России, Санкт-Петербург
Шлык Ирина Владимировна – д.м.н., заместитель президента Ассоциации анестезиологов- реаниматологов, профессор кафедры анестезиологии и реаниматологии, заместитель главного врача по анестезиологии и реаниматологии клиники ПСПбГМУ им. И.П. Павлова, Санкт-Петербург
Эйдельштейн Михаил Владимирович – старший научный сотрудник, руководитель лабораторного подразделения НИИ антимикробной химиотерапии ФГБОУ ВО Смоленский государствен ный медицинский университет Минздрава России, Смоленск
Яковлев Сергей Владимирович – д.м.н. президент МОО «Альянс клинических химиотерапевтов и микробиологов», профессор кафедры госпитальной терапии № 2 лечебного факультета ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет), Москва
1. Современные проблемы и распространение антибиотикорезистентности в Российской Федерации
В XXI веке проблема антибиотикорезистентности приобрела особую значимость во всем мире. Резистентность к антибиотикам имеет огромное социально-экономическое значение и в развитых странах мира рассматривается как угроза национальной безопасности [7]. Согласно оценкам международных экспертов, антимикробная резистентность является причиной более 700 тысяч смертельных случаев ежегодно (в том числе в Европе – 22 тысячи случаев). Предполагается, что к 2050 году эта цифра может увеличиться до 10 млн. человек.
В России эта проблема также имеет место. При экстраполяции данных многоцентрового исследования распространенности нозокомиальных инфекций в стационарах «ЭР- ГИНИ» на общее количество госпитализированных пациентов, количество нозокомиальных инфекций в РФ, согласно экспертной оценке, составляет около 2,3 млн. случаев в год [13].
Характеристика наиболее проблемных возбудителей нозокомиальных инфекций, а также методов идентификации приведена ниже. С текущей ситуацией (а также с динамикой), по структуре возбудителей бактериальных инфекций и их устойчивости к антимикробным препаратам, можно ознакомиться на открытом онлайн ресурсе «Карта антибиотикорезистентности» – https://amrmap.ru.
Enterobacterales.
Представители порядка Enterobacterales в совокупности являются наиболее частыми возбудителями нозокомиальных инфекций в России на протяжении последних лет. В 2015-2016 гг. доля изолятов Enterobacterales среди всех бактериальных возбудителей нозокомиальных инфекций составляла 48,2%, в 2020 г. она достигла 53,2%. Энтеробактерии характеризуются высоким уровнем устойчивости к антимикробным препаратам. На сегодняшний день наибольшее клиническое значение имеет высокая распространенность резистентности нозокомиальных штаммов энтеробактерий к цефалоспоринам и карбапенемам. По данным ранее проведенных исследований, устойчивость к цефалоспоринам среди госпитальных штаммов энтеробактерий в России достигла уровня >80%, главным образом вследствие эпидемического распространения штаммов, продуцирующих бета-лактамазы расширенного спектра действия (БЛРС), преимущественно CTX-M-15. Результаты предыдущих исследований показали отчетливую тенденцию к повышению уровня резистентности к карбапенемам среди нозокомиальных энтеробактерий, в том числе опосредованную продукцией карбапенемаз. Наиболее частыми видами энтеробактерий, вызывающими нозоко- миальные инфекции в 2018-2019 гг., являлись K. pneumoniae (26,7%) и E. coli (14,6%). Большинство нозокомиальных изолятов энтеробактерий в 2018-2019 гг. являлись резистентными (в подавляющем большинстве за счет продукции БЛРС) к оксиимино-бета- лактамам: к цефотаксиму – 74,1% (K. pneumoniae – 88,4%, E. coli – 64,4%), цефтазидиму – 63,0% (K. pneumoniae – 84,0%, E. coli – 45,7%), цефепиму – 60,9% (K. pneumoniae – 83,7%, E. coli – 41,0%) и азтреонаму – 65,6% (K. pneumoniae – 83,9%, E. coli – 55,4%) [https://amrmap.ru/?id=vmgwR36vt04vt10]. В 2020 г. устойчивость K. pneumoniae и E. coli к цефтазидиму составила 85,3% и 45,1% соответственно. Резистентность нозокомиальных изолятов энтеробактерий в 2018-2019 гг. к карбапенемам – имипенему, меропенему и эрта- пенему составила соответственно 18,8% (K. pneumoniae – 31,1%, E. coli – 4,3%), 20,3% (K. pneumoniae – 35,1%, E. coli – 4,4%) и 36,6% (K. pneumoniae – 63,8%, E. coli – 6,5%) [https://amrmap.ru/?id=vmgwR36vt04vt10]. В 2020 г. частота устойчивости к карбапенемам повысилась: к меропенему и эртапенему были резистентны 50,4% и 68,7% штаммов K. pneumoniae и 4,7% и 5,8% штаммов E. coli, соответственно. В 2018-2019 гг. у 31,8% изоля- тов энтеробактерий была выявлена продукция карбапенемаз (K. pneumoniae – 55,6%, E. Coli – 0,04%). Из них большинство (62,9%) относились к молекулярному классу D группы OXA- 48; 27,3% относились к классу B группы NDM-1; 4,4% – к классу А группы KPC; 3,8% од- новременно продуцировали NDM и OXA-48 карбапенемазы, 1,1% - одновременно KPC и OXA-48 карбапенемазы [11, https://amrmap.ru/?id=6ILer58j205j210]. Большинство карбапенемазопродуцирующих изолятов K. pneumoniae относились к международным клонам высокого риска: CG395, CG11, CG147 и CG307. Наиболее высокую активность в отношении нозокомиальных энтеробактерий показали цефтазидим/авибактам (доля резистентных к нему изолятов, в основном за счет продукции карбапенемаз группы NDM, в 2018-2019 гг. составила 10,4%) и азтреонам/авибактам (МПК50 и МПК90 составили 0,06 и 0,25 мг/л, соответственно) [https://amrmap.ru/?id=SPzyV13kf44kf06]. Среди не-β-лактамных антибиотиков наиболее высокую активность in vitro проявлял колистин, резистентными к которому в 2018-2019 гг. были 14,3% изолятов [https://amrmap.ru/?id=frRma55ri45ri06]. Отмечена относительно высокая активность тигециклина в отношении E. coli (6,7% резистентных изолятов) при достаточно умеренной его активности в отношении K. pneumoniae (МПК50 и МПК90 1 и 4 мг/л, соответственно) [https://amrmap.ru/?id=0LvZ4117M487M06].
Проблемой также является не только антибиотикорезистентность нозокомиальных штаммов энтеробактерий, но и рост устойчивости штаммов, вызывающих внебольничные инфекции. Так, в 2018-2019 гг. к цефотаксиму, цефтазидиму и цефепиму были устойчивы 32,2%, 22,6% и 19,7% изолятов E.coli, выделенных у взрослых пациентов с внебольничны- ми инфекциями, в основном за счет продукции БЛРС; частота устойчивости к амоксицил- лину/клавуланату составляла 41,4%, к ципрофлоксацину – 37,2%, к тигециклину – 7,0%, к цефтолозану/тазобактаму – 3,8%, к эртапенему – 1,0% [https://amrmap.ru/?id=DWtlP37nc22nc08]. В 2020 г. была ситуация с антибиотикорезистентностью внебольничных изолятов значимо не изменилась.
Pseudomonas aeruginosa – один из наиболее распространенных возбудителей нозокомиальных инфекций. Доля изолятов этого микроорганизма среди всех бактериальных возбудителей нозокомиальных инфекций в 2018-2019 гг. составляла 16,5% (в 2020 г. – 21,9%), он является вторым-третьим по частоте встречаемости видом после Klebsiella pneumoniae и, в ряде стационаров, Acinetobacter spp.
Частота устойчивости к антибиотикам в 2018-2019 гг. составляла (в порядке убывания in vitro активности): к колистину – 5,6%, цефтазидиму/авибактаму – 40,1%, азтреонаму
– 40,4%, цефтолозану/тазобактаму – 42,9%, амикацину – 46,7%, меропенему – 52,5%, цефе- пиму – 52,8%, цефтазидиму – 55,0%, имипенему – 57,9%, пиперациллину/тазобактаму – 61,1%, ципрофлоксацину – 63,2% [https://amrmap.ru/?id=VsCh7022q112q09]. У 42,4% изолятов выявлены гены приобретенных карбапенемаз, из них: металло-бета-лактамазы (МБЛ) групп VIM и IMP – 83,2% и 0,8%, соответственно; сериновые карбапенемазы группы GES-5 – 15,2%; одновременно МБЛ и сериновые карбапенемазы продуцировали 0,8% изо- лятов [https://amrmap.ru/?id=P4C8S48UD11UD09]. Продуценты МБЛ проявляли высокую устойчивость ко всем антибиотикам, кроме азтреонама и полимиксинов; продуценты GES-5
– к большинству препаратов, кроме цефтазидима/авибактама и полимиксинов. Карбапене- мазопродуцирующие штаммы относились в основном к международным клонам высокого риска: CC235 и CC654 [11, www.AMRmap.ru]
Acinetobacter spp. (в основном Acinetobacter baumannii) в настоящее время является одним из наиболее частых возбудителей нозокомиальных инфекций. Доля изолятов Acinetobacter spp. среди всех бактериальных возбудителей нозокомиальных инфекций, вы- деленных в рамках исследования в 2018-2019 гг., составила 15,1%. A. baumannii в 2018-2019 гг. являлся четвертым по частоте встречаемости видом (14,3%) после K. pneumoniae (26,7%), P. aeruginosa (16,5%) и E. coli (14,6%). В 2020 г. A. baumannii составил 16,7% от всех возбудителей нозокомиальных инфекций, оставаясь на 4 месте. A. baumannii и родственные виды обладают значительно более низкой природной чувствительностью к боль- шинству бета-лактамных антибиотиков, включая пенициллины и цефалоспорины, что ограничивает выбор препаратов, потенциально применимых для терапии инфекций, вызванных Acinetobacter spp.
Устойчивость к карбапенемам (имипенему и меропенему) в 2018-2019 гг. составила соответственно 88,4% и 85,5% [https://amrmap.ru/?id=RqPL409wO13wO09]. У 90,5% изолятов A. baumannii выявлено наличие генов приобретенных карбапенемаз, в основном относящихся к молекулярному классу D (98,6%): OXA-24/40 – 60,5%, OXA-23 – 35,6%, OXA- 24/40+OXA-23 – 2,4%. Металло-карбапенемазы группы NDM составляли 1,3%, сериновые карбапенемазы группы GES-5 – 0,1% [https://amrmap.ru/?id=EFAiB4993139309]. Большинство продуцентов карбапенемаз относились к международным клонам высокого риска: CC92/208OXF/CC2PAS, CC944OXF/CC78PAS и CC109/231OXF/CC1PAS. Подавляющее большинство изолятов A. baumannii в 2018-2019 гг. были устойчивыми к ципрофлоксацину (98,1%), амикацину (91,8%) и гентамицину (82,7%). Частота резистентности к тобрамицину и триметоприму/сульфаметоксазолу была различной у штаммов разных генотипов, в целом составляя 64,5% для тобрамицина и 52,8% для котримоксазола. Наиболее высокой актив- ностью in vitro обладали полимиксины (1,1% резистентных изолятов) [https://amrmap.ru/?id=nG5jp4856145609]. Штаммы других видов Acinetobacter spp. были более чувствительны к различным антибиотикам [11, www.AMRmap.ru].
Staphylococcus aureus. По результатам проведённого в 2018-2019 гг. многоцентрового исследования доля Staphylococcus aureus в структуре бактериальных возбудителей нозокомиальных инфекций составляла 7,7%, данный возбудитель и занимает 5-е место после
K. pneumoniae, P. aeruginosa, A. baumannii и Escherichia coli [https://amrmap.ru/?id=YGQdd00O916O909]. Таким образом, роль S. aureus в этиологии нозокомиальных инфекций снизилась в сравнении с более ранним периодом.
Основной проблемой антибиотикорезистентности S. aureus является устойчивость к β-лактамным антибиотикам. Так, в проведённых ранее многоцентровых российских исследованиях, доля метициллинорезистентных штаммов S. aureus (MRSA) составляла от 24,9% до 66,9%. В 2018-2019 гг. метициллинорезистентными были 30,3% изолятов. Наибольшей активностью обладали гликопептиды и липопептиды (ванкомицин, телаванцин, даптомицин), оксазолидиноны (линезолид, тедизолид), анти-MRSA цефемы (цефтаролин) и глицил- циклины (тигециклин), к которым были чувствительны все исследованные штаммы (8,2% изолятов были чувствительны при увеличенной экспозиции к цефтаролину). Также высокую активность демонстрировали триметоприм-сульфаметоксазол, фузидиевая кислота и рифампицин (0,4%, 0,9% и 2,9% устойчивых штаммов соответственно). Остальные антибиотики проявляли умеренную и низкую активность [11, www.AMRmap.ru].
Перечень полирезистентных возбудителей, рассматриваемых в рамках данных рекомендаций,1 может быть изменен в последующих редакциях рекомендаций при изменении эпидемиологической ситуации.
2. Методы выявление наиболее значимых фенотипов/детерминант антибиотикорези- стентности
Данные рекомендации предназначены для использования в повседневной практике клинических микробиологических лабораторий и не содержат описания методов выявления механизмов резистентности для экспертных и научных лабораторий. Рекомендации также не содержат описания процедур выявления бессимптомного носительства полирезистентных микроорганизмов [9].
2.1. Выявление устойчивости к карбапенемам представителей порядка Enterobacterales
Фенотипическое определение чувствительности.
Определение чувствительности к карбапенемам и другим анантимикробным препаратам, включая препараты, потенциально активные против устойчивых к карбапенемам штаммов, диско-диффузионным методом рекомендуется проводить в соответствии с актуальной версией Клинических рекомендаций «Определение чувствительности к антимикробным препаратам» (размещены на Интернет-портале главного внештатного специалиста Минздрава России по клинической микробиологии и антимикробной резистентности; текущая версия) [6]. При использовании коммерческих систем следует руководствоваться инструкциями изготовителей. Современные критерии интерпритации результатов оценки чувствительности к биапенему отсутствуют, в качестве суррогатного маркера можно использовать результат определения чувствительность к имипинему.
Механизмы устойчивости Enterobacterales к карбапенемам можно разделить на две большие группы: связанные и не связанные с продукцией карбапенемаз. Карбапенемазы – это β-лактамазы, гидролизующие пенициллины, большинство цефалоспоринов и, в различной степени, карбапенемы и монобактамы (последние не гидролизуются металло-β- лактамазами). Подавляющее число карбапенемаз энтеробактерий принадлежат к трем группам ферментов – KPC, OXA-48 и NDM, первые две из которых являются сериновыми бета- лактамазами, последняя – метало-бета-лактамазами. Дифференциация различных карбапенемаз между собой является значимой не только с точки зрения эпидемиологии, но и даёт клинически важную информацию ввиду различий в чувствительности к антибиотикам, в особенности к новым ингибиторозащищенным бета-лактамам. Карбапенемазы являются предметом особого беспокойства, так как они могут быть причиной устойчивости практически ко всем β-лактамам и быстро распространяются. Продуценты некоторых карбапенемаз (например, OXA-48-подобных), могут быть чувствительны к цефалоспоринам 3-4 поколения. Однако в настоящее время большинство карбапенемазопродуцирующих изолятов являются также и ко-продуцентами ферментов, гидролизующих цефалоспорины, таких как БЛРС CTX-M-типа, и поэтому характеризуются устойчивостью и к цефалоспоринам. Кроме того, крабапенемазопродуцирующие штаммы часто обладают механизмами устойчивости к широкому спектру антимикробных препаратов, а инфекции, вызываемые карбапенемазо- продуцирующими энтеробактериями, характеризуются высоким уровнем летальности [8, 25, 50].
Согласно рекомендациям EUCAST выявление механизма резистентности бактерий имеет значение для организации инфекционного контроля и общественного здравоохранения и не влияет на интерпретацию результатов оценки чувствительности бактерий к карбапенемам.
Если продуцент карбапенемаз проявляет фенотипическую чувствительность к карбапенемам, то в отчете лаборатории его необходимо оценивать как чувствительный, что соответствует рекомендации лечения карбапенемами.
Однако столь категоричная позиция разделяется не всеми экспертами. Данные об эффективности лечения инфекций, вызванных устойчивыми к карбапенемам патогенами, продуцирующими и не продуцирующими карбапенемазы ограничены и неоднородны [35, 28]. Недостаточно изучена эффективность отдельных антибиотиков в отношении инфекций, вызванных продуцентами различных карбапенемаз. Перечисленные факты свидетельствуют в пользу целесообразности детекции карбапенемазной активности и типирования карбапенемаз. Исследования включают следующие этапы: а) выявление изолятов, подозрительных на продукцию карбапенемаз; б) выявление продукции карбапенемаз; в) определение типа карбапенемаз.
Значения минимальной подавляющей концентрации (МПК) энтеробактерий, продуцирующих карбапенемазы, могут быть ниже установленных клинических пограничных значений для резистентных штаммов [26, 33, 60]. Для выявления изолятов, подозрительных на продукцию карбапенемаз, EUCAST рекомендует использовать значения «эпидемиологи- ческой пограничной точки отсечения» (ECOFF) для меропенема: диаметре зоны подавления роста <28 мм при использовании диско-дифузионного метода или МПК меропенема >0,125 мг/л.
Выявление продукции карбапенемаз у энтеробактерий.
В данных рекомендациях представлены только методы выявления карбапенемаз, доступные в настоящее время и наиболее приемлемые для использования в клинической практике [8].
Метод инактивации карбапенемов (Carbapenem Inactivation Method – CIM).
CIM представляет собой простой, малозатратный и эффективный тест для выявления продукции карбапенемаз у грамотрицательных бактерий [61]. Принцип метода – выявление ферментативного гидролиза при инкубации карбапенема с суспензией исследуемой бактериальной культуры. В качестве источника карбапенема используется диск с меропенемом (10 мкг) для определения чувствительности диско-диффузионным методом. Оценка результатов проводится на основании наличия или отсутствия зоны подавления роста чувствительного контрольного штамма Escherichia coli ATCC 25922 вокруг диска с меропенемом, предварительно инкубированного (8 часов при 35°С) с исследуемой бактериальной культурой. На практике выявить первые признаки роста контрольного штамма и зонообра- зования можно уже через 4–5 часов.
Оригинальный CIM тест не позволяет дифференцировать сериновые и металло- бета-лактамазы, а также проводить точное типирование карбапенемаз и выявлять ко- продукцию нескольких ферментов. Для дифференцировки карбапенемаз предложена модификация метода инактивации карбапенемов с ЭДТА (eCIM) [53].
Типирование карбапенемаз
Задачу типирования карбапенемаз решают иммунохроматографические и молекулярно-биологические методы. Общим недостатком этих методов является невозможность выявления карбапенемаз, не входящих в состав используемых систем. В этой связи постановка CIM теста приобретает важное значение. Положительный результат CIM теста при отрицательных результатах иммунохроматографических и/или молекулярных тестов позволяет заподозрить продукцию редких или новых карбапенемаз.
Иммунохроматографические тесты.
Иммунохроматографические тесты отличаются высокой чувствительностью, скоростью получения результата (около 15 минут) и возможностью определения типа фермента [38, 62]. Данные тест-системы по своей специфичности практически не уступают молекулярным методам, при этом они не требуют аппаратного обеспечения и выигрывают по времени получения результата у всех доступных в настоящее время методов. Существуют тесты как для детекции одного вида ферментов (в частности, KPC, OXA-23), так и для наи- более актуального в настоящее время комплекса (KPC, OXA-48, VIM, IMP, NDM).
Молекулярно-биологические методы выявления генов карбапенемаз.
Кроме выявления генов карбапенемаз непосредственно в клиническом материале, молекулярные методы могут использоваться для верификации результатов, полученных фенотипическими и аналитическими методами. Большинство доступных в настоящее время на практике молекулярных методов определения устойчивости к карбапенемам базируется на технологии real time ПЦР.
Наличие генов карбапенемаз не во всех случаях коррелирует с фенотипической резистентностью к карбапенемам, поэтому использование молекулярно генетических методов не заменяет фенотипические методы определения чувствительности.
Сравнительная характеристика методов определения продукции карбапенемаз представлена в таблице 1.
Таблица 1. Сравнительная характеристика наиболее распространенных методов оп- ределения продукции карбапенемаз и их типирования
|
Метод |
Исследуемый материал |
Преимущества |
Ограничения |
|
Метод инактива- ции карбапене мов (CIM тест) |
Чистая культура микроорганизма |
Простота выполнения. Отсутствие необходимости в специальном оборудовании. Низкая стоимость. Позволяет предположить на- личие редких или новых кар- бапенемаз |
Необходимость выделения чистой культуры микроорга- низма. Длительность выполнения (18-24 ч). «Классический» CIM тест не позволяет дифференцировать тип карбапенемаз (модифи- цированный eCIM позволяет дифференцировать серино- |
|
|
|
|
вые и металлоферменты). |
|
Иммунохромато- графические тес- ты |
Чистая культура микроорганизма |
Простота выполнения. Отсутствие необходимости в специальном оборудовании. Быстрое получение результа- та. Позволяют определять тип карбапенемаз. |
Отсутствие возможности вы- явления новых вариантов карбапенемаз. |
|
Молекулярно- генетические ме- тоды |
Нативный клиниче- ский материал Чистая культура микроорганизма |
Быстрое получение результа- та. Возможность проведения исследования с использова- нием нативного клиническо- го материала. Позволяют определять тип карбапенемаз. |
Необходимость наличия спе- циального оборудования и обученного персонала. Сравнительно высокая стои- мость либо оборудования ирасходных материалов. Отсутствие возможности вы- явления новых вариантов карбапенемаз. |
2.2. Выявление устойчивости к карбапенемам у Pseudomonas aeruginosa
Фенотипическое определение чувствительности.
Определение чувствительности P. aeruginosa к карбапенемам и другим антимикробным препаратам, включая препараты, потенциально активные против устойчивых к карбапенемам штаммов, фенотипическими методами рекомендуется проводить в соответствии с актуальной версией Клинических рекомендаций «Определение чувствительности к анти- микробным препаратам» [6].
Карбапенемы, к которым следует определять чувствительность P. aeruginosa: меропенем (обязательно), имипенем (обязательно), дорипенем (опционно, если чувствительность к дорипенему не определяется, чувствительность к нему оценивается по результатам определения чувствительности к меропенему).
Выявление продукции карбапенемаз у P. aeruginosa.
Выявление продукции карбапенемаз у P. aeruginosa имеет в основном эпидемиологическое значение. Исключение - методы быстрой детекции карбапенемаз в клиническом материале (молекулярно-биологические методы), которые могут использоваться для принятия клинического решения до получения результатов определения чувствительности фенотипическими методами.
2.3. Выявление устойчивости к карбапенемам у Acinetobacter spp.
Фенотипическое определение чувствительности Acinetobacter spp.
Определение чувствительности Acinetobacter spp. к карбапенемам и другим антимикробным препаратам, включая препараты, потенциально активные против устойчивых к карбапенемам штаммов, фенотипическими методами рекомендуется проводить в соответст вии с актуальной версией Клинических рекомендаций «Определение чувствительности к антимикробным препаратам» [6].
Карбапенемы, к которым следует определять чувствительность Acinetobacter spp.: меропенем (обязательно), имипенем (обязательно), чувствительность к дорипенему оценивается по результатам определения чувствительности к меропенему.
Выявление продукции карбапенемаз у Acinetobacter spp.
2.4. Выявление β-лактамаз расширенного спектра (БЛРС) у энтеробактерий
БЛРС (соответствующая англоязычная аббревиатура – ESBL) – ферменты, гидролизующие большинтво пенициллинов и цефалоспоринов, в том числе цефалоспорины 3-4 поколения, в также монобактамы (азтреонам), но не цефамицины (цефокситин, цефотетан) или карбапенемы. Большинство БЛРС относятся к β-лактамазам класса А и подавляются ингибиторами β-лактамаз (клавулановой кислотой, сульбактамом, тазобактамом, авибактамом) [19].
Наиболее частыми продуцентами БЛРС являются Escherichia coli и Klebsiella pneumoniae, однако продукция БЛРС встречается и у всех других клинически значимых видов энтеробактерий. Распространенность БЛРС-продуцирующих изолятов зависит от ряда факторов, таких как биологический вид, географическое расположение, тип стационара/отделения, группа пациентов и тип инфекции, в результате чего в разных исследованиях были зарегистрированы достаточно широкие вариации [29].
Подавляющее большинство БЛРС являются приобретенными ферментами, кодируемыми расположенными на плазмидах генами. Для приобретенных БЛРС характерен различный уровень экспрессии, они существенно отличаются по таким биохимическим характеристикам, как, например, активность в отношении различных β-лактамов. Вариации в уровне экспрессии и свойствах конкретного фермента, а также наличие других механизмов резистентности (других β-лактамаз, выведения молекул антибиотика из клетки, нарушения проницаемости) приводит к большому разнообразию фенотипов резистентности среди БЛРС-продуцирующих изолятов [34].
Рекомендуемые методы выявления БЛРС у энтеробактерий.
Для выявления БЛРС используются различные фенотипичестие методы выявления синергизма между оксиимино-β-лактамами (цефотаксим, цефтазидим, цефепим, азтреонам) и ингибитором β-лактамаз класса А – клавулановой кислотой. К числу таких методов относится метод комбинированных дисков, двойных дисков и методы определения МПК в присутствии и без ингибитора. Чувствительность и специфичность этих методов на практике зависит от вида микроорганизма, наличия дополнительных ферментов, гидролизующих оксиимино-β-лактамы, и от технических факторов. Вследствие значительного генетического разнообразия БЛРС их универсальная детекция с использованием молекулярно- генетических методов является затруднительной. Однако существующие тест-системы позволяют выявлять наиболее часто встречающиеся БЛРС группы CTX-M.
2.5. Выявление метициллинорезистентных Staphylococcus aureus (MRSA)
Staphylococcus aureus (MRSA) - изоляты S. aureus, имеющие дополнительный пенициллин-связывающий белок (PBP2a или недавно открытый альтернативным PBP2, кодируемый геном mecC), к которым β-лактамы (за исключением цефтаролина) имеют низкую степень сродства. Для выявления резистентности к метициллину/оксациллину могут использоваться как фенотипические – определение МПК, диско-диффузионный метод или латексная агглютинация для выявления белка PBP2a, так и молекулярно-генетические методы (ПЦР).
Выявление метициллинорезистентности фенотипическими методами
Диско-диффузионный метод. Если диаметр зоны подавления роста вокруг диска с цефокситином (30 мкг в диске) <22 мм, изолят оценивается как метициллинорезистентный.
Метод микроразведений в бульоне (ISO 20776-1). Если МПК цефокситина > 4 мг/л, изолят оценивается как метициллинорезистентный.
Выявление метициллинорезистентности молекулярно-биологическими методами
Для выявления гена mecA могут использоваться как коммерческие наборы реагентов и оборудование, так и тесты, разработанные в лаборатории. Вместе с тем, следует помнить, что ген mecC в настоящее время может не обнаруживаться некоторыми коммерчески доступными молекулярно-генетическими методами.
Важной характеристикой молекулярно-биологических методов детекции метициллинорезистентности является существенное ускорение получения результата за счет возможности выполнения исследования непосредственно клинического материала.
2.6. Выявление устойчивости Enterococcus faecium и Enterococcus faecalis к ванкомици- ну
Enterococcus faecium или Enterococcus faecalis считаются устойчивыми к ванкомицину (VRE) при МПК ванкомицина > 4 мг/л. Применение гликопептидов (ванкомицина, те- лаванцина, тейкопланина) при инфекциях, вызванных такими штаммами малоэффективно.
Фенотипические методы выявления устойчивости E. faecium и E. faecalis к глико- пептидам (ванкомицину). Определение чувствительности энтерококков к гликопептидам фенотипическими методами (диско-дифузионный метод, метод микроразведения в бульоне, метод градиентных тестов) рекомендуется проводить в соответствии с актуальной версией Клинических рекомендаций «Определение чувствительности к антимикробным препаратам» [6]. В качестве индикаторного значения используется чувствительность к ванкомици- ну.
Молекулярно-биологические методы выявления устойчивости к гликопептидам (ванкомицину). Определение генов устойчивости к ванкомицину vanA и vanB с помощью ПЦР может выполняться с использованием коммерческих тест-систем и тест-систем собственной разработки [31].
3. Принципы рационального использования антимикробных препаратов (АМП)
Главные принципы рациональной антимикробной терапии (АМТ) были сформулированы еще в период поиска и внедрения в клинику первых антибиотиков в середине прошлого века:
- выбор антибиотика в соответствии с чувствительностью к нему возбудителя заболевания;
- разовая и суточная дозы антибиотика, путь введения должны обеспечивать лечебную концентрацию в очаге воспаления;
- антибиотик должен назначаться в такой дозе и вводиться таким путем, чтобы исключить или максимально ограничить его повреждающее действие на макроорганизм.
3.1. Констатация развития инфекции
Антибактериальная терапия не должна проводиться без клинико-лабораторных признаков бактериальной инфекции [27]. Это правило является ключевым. Наличие дренажей, центрального венозного катетера, эндотрахеальной трубки, трахеостомической канюли, мочевого катетера, цистостомы, гастростомы, электродов ЭКС, а также случаи выделения патогенных или условно патогенных микроорганизмов из вышеуказанных инвазивных устройств без признаков инфекционного процесса не являются показанием для проведения АМТ.
Поэтому перед тем, как назначить АМП, врач должен оценить вероятность инфекционной этиологии симптомов, объединить их в синдром, установить диагноз инфекции и зафиксировать его в медицинской карте пациента.
3.2. Идентификация возбудителя инфекции, с определением его чувствительности к антимикробным препаратам
В соответствии с этим правилом, до первого введения АМП следует произвести забор биоматериала для бактериоскопического, бактериологического и, в ряде случаев, молекулярно-биологического исследований [27]. Обязательным является исследование биоматериала из локуса инфекции, при тяжелом течении инфекции дополняется исследованием крови из периферической вены. В случае, если очевидных или потенциальных очагов инфекции несколько, забор биоматериала осуществляется из всех предполагаемых локусов. Взятие крови для микробиологического исследования осуществляется трехкратно из разных периферических вен с интервалом 20-30 минут. Для забора крови нельзя использовать периферические и центральные венозные катетеры (кроме случаев дифференциальной диагностики катетер-ассоциированной инфекции, в таких случаях кровь берется последовательно сначала из периферической вены, далее из катетера с минимальной временной задержкой) [5]. Если у пациента имеет место тяжелая инфекция2, а для получения биоматериала из инфекционного очага требуется длительное время (бронхоскопия, оперативное вмешательство, инвазивная манипуляция и т.д.), АМП назначаются сразу после забора крови на посев, а биоматериал из инфекционного локуса получают, как только это будет возможно.
3.3. Выбор оптимального антимикробного препарата
Практически всегда назначение АБТ представляет собой процесс выбора определенных препаратов на основе анамнеза, эпидемиологических данных, клинической картины заболевания, предполагаемого инфекционного локуса, характера предшествующих меди- цинских манипуляций, учета данных локальной резистентности флоры, предшествующего применения антибиотиков - такой подход называется эмпирическим (основанным на опыте) выбором антимикробных препаратов или эмпирической АБТ. Коррекция АБТ после получения микробиологических данных или начало АБТ на основе наличия микробиологических данных называется целенаправленной АБТ, то есть назначением АБП активной против вероятного возбудителя с учетом выявленных механизмов резистентности.
При эмпирическом выборе назначение АМП проводят с учетом наиболее вероятных возбудителей данной инфекции и их предполагаемой чувствительности с учетом данных локального микробиологического мониторинга в медицинской организации. Методология такого подхода к проведению антимикробной терапии и его реализации на практике детально изложена в Российских клинических рекомендациях «Программа СКАТ (стратегия контроля антимикробной терапии) при оказании стационарной медицинской помощи» [10]. При назначении стартовой эмпирической АМТ обязательной является стратификация пациентов в соответствии с риском наличия резистентности возбудителей к различным группам антибиотиков.
При эмпирической антимикробной терапии всегда сохраняется вероятность ее избыточности или неэффективности, поэтому период ее проведения должен быть максимально коротким, а при правильной организации работы и использовании современных методов лабораторных исследований не превышать 48-72 часов. После получения результатов исследований необходимо оценить возможность и целесообразность коррекции терапии (продолжить без изменения, провести деэскалацию, дополнить и пр.), но в любом случае с этого момента терапия должна стать этиотропной. Такую терапию можно будет считать оптимальной [2, 4].
При проведении целенаправленной терапии учитывают следующие аспекты.
- Активность спектра действия АМП в отношении установленного возбудителя или возбудителей. Используемый АМП должен обладать активностью в отношении возбудителя при максимально возможном узком спектре действия. Если установлено несколько возбудителей, то следует назначать либо монотерапию препаратом, спектру активности которого они соответствуют, либо адекватную комбинацию препаратов.
- Способность проникать и создавать терапевтические концентрации в очаге инфекции при назначении в дозах, соответствующих официальной инструкции к препарату. Применение АМП в дозах ниже терапевтических недопустимо.
- При повышении минимальной подавляющей концентрации (МПК) у проблемных микроорганизмов для получения клинического эффекта антибиотика необходимо увеличить его концентрацию в крови и очаге (для концентрационно-зависимых антимикробных препаратов) или увеличить кратность и/или продолжительность его введения (для антибиотиков с время-зависимой фармакокинетикой). В этом случае назначение антибиотиков в дозах, превышающих рекомендуемые в официальной инструкции, может осуществляться по решению врачебной комиссии, которое фиксируется в медицинской документации пациента.
- В ряде случае у пациентов с жизнеугрожающими тяжелыми инфекциями (септический шок, вентилятор-ассоциированная пневмония) показано назначение комбинации АМП, обладающих синергидным эффектом [17, 27].
- При
проведении эмпирической и целенаправленной терапии необходимо учитывать вероятность возможных
нежелательных реакций, связанных
с особенностями пациента
(возраст, масса тела, аллергологический и фармакологический анамнез,
функция почек и печени, беременность, кормление грудью, прием других ЛС т.д.).
3.4. Путь введения препарата
Основными путями введения АМП являются внутривенный, внутримышечный, пероральный, ингаляционный. Альтернативные пути введения (интраартериальный, эндолимфатический, внутрибрюшной) не изучены с точки зрения безопасности, не имеют доказанных преимуществ и не разрешены к применению. Выбор пути введения определяется тяжестью состояния пациента, а также параметрами фармакокинетики и фармакодинамики препарата. У больных в удовлетворительном и среднетяжелом состоянии предпочтителен пероральный прием препарата. При тяжелом течении заболевания пациенты должны получать АМП внутривенно.
3.5. Оценка эффективности антимикробной терапии
Клинический эффект от проводимой антибактериальной терапии у пациентов с сепсисом необходимо оценивать ежедневно. На основании динамики клинических и лабораторных показателей ССВР, маркеров бактериального воспаления, выраженности органных нарушений, оцененных по SOFA, решается вопрос о продолжении, усилении и окончании проводимой терапии.
Отсутствие эффекта не должно автоматически вести к смене АМТ. В первую очередь следует исключить наличие недренированных или несанированных очагов инфекции (абсцесс, несостоятельность анастомоза, раневая инфекция и т.д.), провести поиск новых очагов, оценить вероятность неинфекционного генеза сохраняющихся симптомов, рассмотреть вопрос о наличии небактериальной инфекции (системный микоз, вирусная инфекция). Коррекцию эмпирического режима антибактериальной терапии следует проводить через 48–72 ч. после начала лечения при отсутствии клинического улучшения и/или выделения резистентного к проводимой терапии возбудителя. Исключение составляют случаи стремительного ухудшения состояния пациента или получение результатов микробиологического исследования, требующих коррекции антибактериальной терапии. У тяжелых пациентов, находящихся в ОРИТ, наряду с оценкой динамики состояния по балльным шкалам (SOFA, MODS) в качестве информативных показателей адекватности антибактериальной терапии могут быть использованы динамика количественного значения прокальцитонина и С- реактивного белка (с учетом низкой специфичности последнего).
3.6. Длительность антимикробной терапии
В большинстве случаев длительность эффективной АМТ составляет 5-7 суток, этого времени обычно достаточно для уменьшения микробной нагрузки ниже критического уровня. Исключение составляют инфекции, требующие более длительной терапии (такие, как инфекционный эндокардит, туберкулез, гнойный менингит, инфекции костей и суставов, инфекции, вызванные неферментирующими полирезистентными грамотрицательными микроорганизмами, бактериемия, вызванная S. aureus, кандидемия и инвазивный кандидоз), а также инфекции у пациентов с иммунологическим дефицитом, включая нейтропению.
Условиями отмены АМТ являются клинические признаки эффективности терапии, адекватная хирургическая санация очага инфекции (если необходимо), уменьшение проявлений ССВР, снижение уровня ПКТ до 80% от исходного уровня к 4-м суткам или нормализация его значения [27]. При решении вопроса об отмене АМТ следует ориентироваться, прежде всего, на отсутствие клинических проявлений инфекционного процесса, остальные признаки являются косвенными. Необоснованно длительное применение антибиотиков приводит к появлению и распространению резистентных микроорганизмов, развитию у больных новых нозокомиальных "суперинфекций", аллергических и/или токсических реакций. В конечном итоге это ухудшает состояние пациента и снижает эффективность лечения.
4. Алгоритм назначения эмпирической антимикробной терапии с учетом стратифика- ции пациентов по риску антибиотикорезистентности
Наибольшее число назначений антибиотиков происходит эмпирически без или до определения чувствительности микроорганизма, вызвавшего инфекцию. Адекватная эмпирическая антимикробная терапия (ЭАМТ) предполагает эффективное действие в отношении всех этиологически значимых возбудителей инфекции данной локализации в достаточной дозе с учетом риска инфицирования полирезистентными возбудителями.
В современных условиях выбор ЭАМТ должен быть основан на знании ряда факторов, определяющих особенности этиологической структуры возбудителей инфекции. К ним относятся:
- условия возникновения инфекции: внебольничная или инфекция, связанная с оказанием медицинской помощи (ИСМП);
- локализация инфекции (определение ключевых возбудителей инфекции, выбор АМП с учетом фармакокинетических особенностей);
- факторы риска наличия полирезистентных микроорганизмов, основным из которых является неблагопрятная локальная эпидемиология антибиотикорезистентности.
Глобальный рост резистентности возбудителей к антибиотикам приводит к высокой вероятности возникновения внебольничных инфекций, вызванных резистентной флорой, что делает определяющим выявление факторов риска наличия полирезистентных микроорганизмов у пациента. Наиболее важными возбудителями инфекции, с точки зрения их распространенности и потенциала формирования антибиотикорезистентности, являются энтеробактерии, продуцирующие карбапенемазы, энтеробактерии, продуцирующие БЛРС, неферментирующие грамотрицательные бактерии (НФГОБ) – P. aeruginosa, Acinetobacter spp., Stenotrophomonas maltophilia и Burkholderia cepacia complex, обладающие множественной устойчивостью к антибиотикам, а также метициллинорезистентные штаммы Staphylococcus aureus (MRSA) и ванкомицинорезистентные штаммы Enterococcus spp.
4.1. Факторы риска инфекции , вызванных полирезистентными штаммами микроорганизмов
4.1.1. Факторы риска инфекции, вызванных энтеробактериями продуцентами БЛРС
[10, 14, 36]:
- госпитализация в течение предшествующих 3 месяцев или текущая госпитализация;
- прием антибиотиков (цефалоспорины III-IV поколения, фторхинолоны) по любому поводу в течение предшествующих 3 месяцев;
- пребывание в учреждениях длительного ухода (дом престарелых, дом ребенка, хоспис);
- гемодиализ;
- коморбидность: сахарный диабет, цирроз печени, хроническая болезнь почек (ХБП);
4.1.2. Факторы риска инфекций, вызванных MRSA [10, 20, 39, 42]:
- высокая распространенность MRSA в отделении, где находится пациент;
- прием антибиотиков широкого спектра (фторхинолоны, в меньшей степени цефалоспорины III–IV поколения) по любому поводу в течение предшествующих 3 месяцев;
- наличие внутрисосудистого катетера;
- назальное носительство MRSA;
- в/в наркомания;
- наличие трофических язв или пролежней.
4.1.3.Факторы риска инфекций, вызванных полирезистентной P. Aeruginosa [10, 15, 21, 32, 43, 45]:
- длительное нахождение в ОРИТ;
- предшествующая терапия цефалоспоринами, фторхинолонами и карбапенемами
- ИВЛ > 4 суток;
- стернотомия;
- наличие бронхоэктазов, муковисцидоза;
- наличие уретрального катетера.
4.1.4. Факторы риска инфекций, вызванных карбапенеморезистентными энтеробактериями [10, 44]:
- предшествующая терапия карбапенемами;
- высокая распространенность карбапенеморезистентных энтеробактерий в отделении, где находится пациент;
- колонизация кишечника пациента карбапенеморезистентными энтеробактериями.
4.2. Стратификация пациентов по риску наличия резистентных возбудителей и инвазивного кандидоза
Всех пациентов с инфекцией целесообразно стратифицировать с учетом факторов риска наличия антибиотикорезистентных микроорганизмов в соответствии с подходами, описанными в клинических рекомендациях по СКАТ [10, 24]. В рекомендациях СКАТ приведен перечень антибактериальных препаратов для эмпирического назначения в зависимости от стратификации пациентов по риску наличия антибиотикорезистентных микроорганизмов и инвазивного кандидоза.
Данные рекомендации носят общий характер и
могут служить основой для разработки алгоритмов АМТ в медицинских организациях.
Учитывая этот факт, факторы риска могут
варьировать по своей значимости и срокам реализации в зависимости от
конкретного лечебного учреждения,
особенностей пациента и его анамнеза, а уровень устойчивости нозокомиальных
возбудителей к антибиотикам может сильно отличаться в разных лечебных учреждениях, целесообразно создание
локальных программ СКАТ и протоколов эмпирической АМТ, основанных на данных об
антибиотикорезистентности в конкретном стационаре. Формирование таких протоколов поможет повысить эффективность
проводимой эмпирической АМТ, снизить количество осложнений, добиться уменьшения
доли антибиотикорезистентных микроорганизмов, сократить использование
антибиотиков и расходы медицинской организации.
5. Схемы антибактериальной терапии инфекций, вызванных полирезистентными микроорганизмами
Целенаправленная АМТ должна начинаться с момента микробиологической идентификации возбудителя инфекции, и должна быть основана на знании чувствительности микроорганизма к АМП и механизмов антибиотикорезистентности с учетом локализации инфекционного очага. При выборе схемы АМТ необходимо опираться на показания, способ применения и дозы, указанные в официальной инструкции к препарату. Возможные схемы АМТ инфекций, вызванных полирезистентными микроорганизмами, с указанием режимов дозирования АМП указаны в приложении 1.
6. Рекомендации по дозированию антимикробных препаратов у пациентов в критиче- ском состоянии
Основные режимы дозирования АМП указаны в инструкции по медицинскому применению препарата. В инструкции рекомендованные дозы антибиотика рассчитываются на основании фармакокинетики и фармакодинамики для чувствительных к антибиотику микроорганизмов. Со временем происходит закономерный процесс снижения чувствительности микроорганизмов к АМП (что отражается в увеличении МПК) и появления устойчивых штаммов. Однако в инструкции рекомендованный режим дозирования не претерпевает коррекции. Экспериментальные и клинические исследования показали, что период времени, когда свободная концентрация АБ остается выше МПК (fT), является основным параметром оптимального киллинга бактерий, обеспечивающего клинический эффект. Концентрация АБ ниже МПК позволяет многим микробам возобновить рост в короткий период после окончания постантибиотического эффекта.
Кроме повышения МПК микроорганизмов отсутствие ожидаемого клинического эффекта может быть связано со снижением концентрации антибиотика в плазме больного, обусловленного увеличением объема распределения антибиотика и повышенным клиренсом, который наблюдается у 50-60% пациентов в первые сутки пребывания в ОРИТ. Критично увеличение СrCl ≥130 мл/мин [58]. Поэтому при повышении МПК возбудителя к антимикробному препарату для поддержания эффекта на прежнем уровне для антибиотиков с концентрационно-зависимым антимикробным действием (в частности, амногликозидов, фторхинолонов) необходимо увеличить их концентрацию в крови, а для антибиотиков с времязависимым действием (бета-лактамные антибиотики) – кратность и/или продолжительность введения каждой дозы.
Это объясняет сложившуюся практику назначения некоторых АМП в дозах, превышающих рекомендуемые в медицинской инструкции, а также соответствующее изменение режима дозирования у пациентов в критическом состоянии при развитии тяжелых форм инфекции.
Для лечения тяжелых MRSA-инфекций возможно (и целесообразно) увеличение суточной дозы ванкомицина до 25–30 мг/кг впервые сутки, затем 15–20 мг/кг с интервалом 8-12 часов (при выделении штаммов MRSA со сниженной чувствительностью к ванкомицину МПК > 1мг/л, ванкомицин является субоптимальной опцией для терапии). Следует помнить, что максимально разрешенная по инструкции суточная доза даптомицина составляет 6 мг/кг, хотя в отдельных публикациях имеются данные о применении препарата при ангио- генных инфекциях в более высоких дозах: 10-12 мг/кг/сут. [4]. Также в научной литературе можно встретить рекомендации о применении тигециклина в более высокой (по сравнению с разрешенной в инструкции) суточной дозе – 200 мг при лечении инфекций, вызванных карбапенеморезистентными энтеробактериями и ацинетобактером.
Более адекватный эффект аминогликозидов прогнозируется при применении гентамицина в дозе 7 мг/кг в сутки и амикацина – 20 мг/кг в сутки. Аминогликозиды характеризуются концентрационно-зависимым киллингом, поэтому целесообразно суточную дозу аминогликозида вводить внутривенно однократно в виде в виде 30-минутной инфузии. Антимикробное действие бета-лактамных антибиотиков является концентрационнонезависимым и определяется временем сохранения терапевтических концентраций антибиотика (выше МПК) в течение интервала дозирования. Поэтому при необходимости увеличения суточной дозы бета-лактама большее значение может иметь увеличение кратности введения препарата, чем величины разовой дозы. Оптимизация фармакодинамических показателей достигается также при продленной инфузии бета-лактамных антибиотиков. Клинические данные по продленным инфузиям бета-лактамов ограничены, однако фармакодинамические и клинические исследования документируют преимущество такого введения антибиотиков при лечении инфекций, вызванных полирезистентными микроорганизмами. При лечении тяжелых инфекций целесообразно бета-лактамные антибиотики вводить внутривенно в течение 2–3-часовой инфузии. Продленные инфузии разрешены в инструкции по медицинскому применению дорипенема и оригинального меропенема, однако имеются клинические данные, свидетельствующие об эффективности такого введения и других оригинальных карбапенемов, цефтазидима, цефепима, пиперациллина/тазобактама и других препаратов. При проведении продленных ифузий следует принимать во внимание стабильность антибиотика в инфузионном растворе.
7. Антибактериальная терапия инфекций в особых случаях
7.1. Рекомендации по назначению, дозированию антимикробных и противогрибковых препаратов у детей до 18 лет
Правила выбора антимикробных препаратов у пациентов детского возраста в целом строятся на тех же позициях, что и у взрослых пациентов. В то же время при проведении антимикробной терапии у детей необходимо учитывать ряд принципиальных особенностей.
1. Многие антимикробные препараты имеют возрастные ограничения по применению. Это может быть связано с высоким риском нежелательных реакций, специфичных для определенного возраста, и/или отсутствием клинических исследований у детей. В частности, тетрациклины и тигециклин противопоказаны к применению у детей до 8 лет в связи с нежелательным влиянием на костную ткань и зубную эмаль. Фторхинолоны в целом противопоказаны для применения до 18 лет из-за риска нежелательного влияния на хрящевую ткань (установлено для неполовозрелых особей некоторых видов животных). Однако в ряде стран отдельные фторхинолоны разрешены для использования у детей по определенным показаниям (в России разрешено применение ципрофлоксацина у пациентов детского возраста с муковисцидозом, а также для лечения и профилактики сибирской язвы). По мнению экспертов, фторхинолоны могут быть использованы при жизнеугрожающих инфекциях у детей в случае отсутствия более безопасной альтернативы. В этих же ситуациях может рассматриваться возможность применения других антибактериальных препаратов, противопоказанных или не рекомендованных для применения у детей.
2. У многих антимикробных препаратов имеются существенные возрастные особенности фармакокинетики, обусловленные анатомо-физиологической незрелостью детского организма в первые месяцы жизни, в особенности у недоношенных новорожденных. Это может приводить к увеличению риска развития обычных или появлению специфических нежелательных реакций, что требует использования у детей в определенном возрасте особой дозировки и/или особого режима применения антимикробных препаратов. В частности, применение цефтриаксона и сульфаниламидов у новорожденных сопряжено с риском гипербилирубинемии и развития ядерной желтухи.
При использовании хлорамфеникола в первые месяцы жизни возрастает риск характерных нежелательных реакций (в частности, гемотоксичности) в связи с повышением концентрации в крови из-за замедления метаболизма препарата в печени, что требует мониторинга его концентрации в крови.
3. Доза антимикробных препаратов у детей рассчитывается на вес пациента. При назначении парентеральных антимикробных препаратов у детей предпочтение отдается внутривенному введению, так как внутримышечное введение болезненно и сопряжено у детей с повышенным риском инъекционных осложнений. Для перорального приема антимикробных препаратов у детей должны использоваться специальные пероральные формы антимикробных препаратов – суспензии, диспергируемые таблетки, которые могут быть легко проглочены ребенком. Доза антимикробного препарата у детей, также как у взрослых пациентов, обычно определяется тяжестью инфекционного заболевания, в отдельных случаях – видом и свойствами возбудителя.
Режимы дозирования антимикробных препаратов у детей для лечения инфекций, вызванных полирезистентными возбудителями, приведены в приложении 2.
Решение о назначении и дозировании антимикробных и противогрибковых препаратов у детей, при отсутствии указаний в инструкции о применении препарата в педиатрии, а также не относящихся к перечню ЖНВЛП, необходимо оформлять консилиумом.
7.2. Применение антимикробных препаратов у пациентов с почечной и печеночной недостаточностью, а также при проведении экстракорпоральной мембранной оксигенации
При нарушении функции печени – основного метаболизирующего органа – инактивация некоторых антибиотиков (макролиды, линкозамиды, тетрациклины и др.) может существенно замедляться, что сопровождается увеличением концентрации АМП в сыворотке крови и повышением риска их токсического воздействия. Кроме того, в условиях печеночной недостаточности риску нежелательного влияния таких АМП подвергается и сама печень, что приводит к дальнейшему нарушению функций гепатоцитов и создает угрозу развития печеночной комы. Поэтому при клинических и лабораторных признаках печеночной недостаточности (повышение уровня билирубина, активности трансаминаз) для АМП, метаболизирующихся в печени, следует предусмотреть коррекцию дозы.
При почечной недостаточности период полувыведения многих АМП может удлиняться в несколько раз. Поэтому перед назначением АМП, которые активно выводятся с мочой (аминогликозиды, β-лактамы и др.), необходимо определить клиренс креатинина и при его снижении уменьшить суточные дозы антибиотиков, а также, в ряде случаев, увеличить интервалы между отдельными введениями. Это особенно актуально при тяжелой почечной недостаточности с дегидратацией, когда даже первая доза должна быть снижена. В ряде случаев, если имеются выраженные отеки, может потребоваться обычная (или даже несколько завышенная) первоначальная доза, которая позволит преодолеть избыточное распределение АМП в жидкостях организма и достичь нужной концентрации в крови и тканях.
Дозирование антимикробных препаратов у пациентов, находящихся на заместительной почечной терапии, зависит от [14]:
- вида экстракорпоральной процедуры (гемодиализ, гемофильтрация, гемосорбция и т.д.);
- модальности ЗПТ (интермиттирующий, продленный или продолжительный диализ); скорость выведения препарата в различных модальностях выглядит следующим образом: ПВВГДФ > ПВВГД > ПВВГФ > PIRRT ≥ ИГД;
- дозы эффлюента (сумма потоков диализирующего, замещающего раствора и чистой ультрафильтрации);
- площади и свойств фильтра для проведения экстракорпоральной гемокоррекции (коэффициент просеивания или точка отсечки);
- распределения препарата в крови и тканях и степени связывания его с белками;
- уровня сывороточного альбумина пациента;
- остаточной функции почек.
Коррекция дозы антимикробных препаратов у пациентов с почечной и печеночной недостаточностью приведены в приложении 3.
У пациентов, которым проводят экстракорпоральную мембранную оксигенацию (ЭКМО), значительные изменения фармакокинетики лекарственного средства могут происходить из-за взаимодействия с контуром ЭКМО путем секвестрации лекарств, изменения клиренса их элиминации [35, 40].
В таблице 2 представлены режимы дозирования при ЭКМО некоторых антибиотиков, составленные на основании экспертных данных, строгие общепринятые рекомендации на данный счет в настоящее время отсутствуют.
Таблица 2. Режимы дозирования антимикробных средств при проведении экстракорпоральной мембранной оксигенации
|
Препарат |
Режим дозирования |
|
Меропенем |
1 г в/в нагрузочная доза (30-60 мин.), затем 1 г в/в каждые 8 ч в виде продленной инфузии |
|
Имипенем/циластатин |
1 г (в пересчете на имипенем) каждые 6 ч в/в в виде продленной инфузии |
|
Пиперациллин/тазобактам |
4,5 г в/в нагрузочная доза (30-60 мин), затем 4,5 г в/в каждые 6 ч в виде продленной инфузии |
|
Цефепим |
1 г в/в каждые 8 ч в виде продленной инфузии |
|
Цефтазидим |
2 г в/в нагрузочная доза (30-60 мин), затем 2 г в/в каждые 8 ч в виде продленной инфузии |
|
Ванкомицин |
25-30 мг/кг в/в нагрузочная доза затем 12,5–20 мг/кг в/в каждые 12 ч |
|
Амикацин |
30 мг/кг в/в каждые 24 ч |
|
Гентамицин |
7–10 мг/кг в/в каждые 24 ч |
7.3. Применение антимикробных препаратов у беременных и при кормлении грудью
Рациональное и эффективное применение антибиотиков во время беременности предполагает выполнение следующих условий:
- необходимо использовать ЛС только с установленной безопасностью применения при беременности, с известными путями метаболизма;
- при назначении АМП следует учитывать срок беременности: ранний или поздний. Поскольку срок окончательного завершения эмбриогенеза установить невозможно, то необходимо особенно тщательно подходить к назначению АМП до 5 мес. беременности;
- в процессе лечения АМП необходим тщательный контроль за состоянием матери и плода;
- выбор АМП, пути введения, определение дозы должно соответствовать инструкции по применению лекарственного средства.
8. Профилактика, диагностика и лечение инвазивных микозов
8.1. Диагностика и лечение инвазивного кандидоза
Candida spp. – важные нозокомиальные патогены, они составляют 8,4 % возбудителей внутрибольничных инфекций в крупных стационарах Российской Федерации.
Инвазивный кандидоз (ИК) характеризуется тяжестью клинических проявлений и высокой летальностью, которая, по данным проведенного в РФ крупного исследования (КРИТ), составила 57%. Большинство случаев ИК возникает у больных в отделениях реанимации и интенсивной терапии (ОРИТ), а также у онкологических и гематологических пациентов.
В российских ОРИТ у взрослых больных основными возбудителями ИК являются
C. albicans (42-48%), C. glabrata (14-24%), C. parapsilosis (2-17%), С. tropicalis (5-15%) и C. krusei (5-16%); реже (1-3%) выявляют C. lusitaniae, C. guilliermondii, C. kefyr и пр. В последние годы в стационарах РФ отмечены вспышки внутрибольничного кандидоза, обусловленного полирезистентным патогеном C. auris. Вид Candida spp. коррелирует с чувствительностью к противогрибковым ЛИ in vitro. Например, C. albicans обычно чувствителен к флуконазолу, а не-albicans Candida часто устойчивы. В российских ОРИТ чувствительность к флуконазолу снижена у 21% возбудителей ИК. C. auris устойчив к флуконазолу, может быть резистентен к вориконазолу и амфотерицину В. Устойчивость к эхинокандинам (анидулафунгину, каспофунгину и микафунгину) встречается очень редко.
Факторы риска развития ИК у взрослых пациентов в ОРИТ: использование ЦВК, применение антибактериальных лекарственных средств (ЛС), тяжелое состояние больного (медиана APACHE II – 13, SOFA – 6), хирургическое лечение или перфорация желудочно- кишечного тракта, инфицированный панкреонекроз, ИВЛ, полное парентеральное питание, гемодиализ, применение стероидов и иммуносупрессоров. Инвазивный кандидоз чаще развивается у мужчин старшего возраста.
Кандидемия (циркуляция Candida spp. в кровеносном русле) и острый диссеминированный кандидоз (ОДК – кандидемия в сочетании с очагом/очагами диссеминации или множественные очаги диссеминации) составляют до 90% всех случаев ИК.
Клинические признаки кандидемии неспецифичны и не отличаются от симптомов бактериального сепсиса: рефрактерное к применению антибактериальных ЛС повышение температуры тела > 38 °C выявляют у 82% больных, синдром множественной органной дисфункции – у 48%, ДВС – у 13%. При ОДК возможно поражение практически всех органов и тканей, но наиболее часто в патологический процесс вовлекаются кожа и подкожная клетчатка, головной мозг, почки, сердце, легкие и органы зрения.
Диагностика ИК основана на выделении Candida spp. из крови и других стерильных в норме локусов (СМЖ, биоптат и пр.). Стандартный метод диагностики ИК – посев крови - обладает недостаточной диагностической чувствительностью. Увеличение объема крови (≥40 мл в сутки для взрослого пациента) при посеве повышает эффективность диагностики ИК. Среднее время выявления Candida spp. при посеве крови составляет 3 суток и может достигать 8 суток для C. glabrata. При выделении возбудителя ИК должен быть определен его вид и чувствительность in vitro стандартным методом. Быстрые методы диагностики ИК (T2Candida и тест на (1,3)-β-D-глюкан) незарегистрированы для применения в нашей стране.
Риск развития ИК у больных в ОРИТ без факторов риска (нейтропении на фоне применения цитостатиков, трансплантации кроветворных стволовых клеток, трансплантации печени и пр.) невысок, поэтому рутинная первичная антифунгальная профилактика не рекомендуется. У больных в ОРИТ показанием для первичной антифунгальной профилактики могут развиться повторная перфорация желудочно-кишечного тракта или инфицированный панкреонекроз. В этих ситуациях целесообразно назначение системных противогрибковых препаратов (флуконазол 12 мг/кг в сутки в первый день, затем по 6 мг/кг в сутки или каспофунгин 70 мг в 1-е сутки, затем 50 мг/сут). Назначение для профилактики инвазивного микоза неадсорбируемых полиеновых антибиотиков (нистатина, натамицина и др.) неэффективно и нецелесообразно, равно как и применение флуконазола в дозе менее 6 мг/кг в сутки.
Раннее эмпирическое назначение эхинокандинов повышает выживаемость больных ИК. Показанием для эмпирической терапии ИК у больных в ОРИТ является лихорадка неясной этиологии продолжительностью более 4–6 суток, резистентная к адекватной терапии антибактериальными препаратами широкого спектра действия в сочетании с наличием двух и более факторов риска (применению антибактериальных ЛС, ЦВК, хирургическое вмешательство на органах брюшной полости, полное парентеральное питание, применение глюкокортикостероидов или иммуносупрессантов). При наличии факторов риска ИК и клинических признаков септического шока эмпирическую терапию следует начинать немедленно. Препараты выбора для эмпирической терапии ИК – анидулафунгин, каспофунгин и микафунгин. При назначении эмпирической терапии ИК следует заменить ЦВК (не по проводнику), а также посеять кровь (≥40 мл в сутки для взрослого пациента), материал из возможных локусов ИК и дистальный фрагмент ЦВК.
При выделении Candida spp. из стерильных в норме локусов (кровь, спинномозговая жидкость и пр.) в течение 24 часов следует назначить противогрибковое лекарственное средство и заменить ЦВК (не по проводнику). Анидулафунгин, каспофунгин и микафунгин препараты выбора для целенаправленной терапии всех вариантов ИК, кроме менингита и эндофтальмита. Триазольные ЛС (вориконазол, флуконазол) можно назначать только в случае выделении чувствительного к препарату возбудителя ИК при стабильном состоянии пациента, а также для лечения кандидозного менингита и эндофтальмита. Кроме того, вориконазол и флуконазол используют для деэскалационной терапии после стабилизации больного на фоне применения эхинокандина. Липосомальный амфотерицин В и липидный комплекс амфотерицина В применяют при неэффективности, непереносимости или недоступности эхинокандинов. Амфотерицин В, позаконазол и итраконазол не рекомендованы для лечения ИК (приложение 4) [3, 46].
8.2. Диагностика и лечение инвазивного аспергиллеза
Инвазивный аспергиллез (ИА), обусловленная Aspergillus spp. инфекция, становится все более распространенным в ОРИТ. В зависимости от профиля отделения и фонового заболевания у пациента, частота его может составлять 0,5–20%. Кроме того, ИА – хорошо известное осложнение интенсивной цитостатической и иммуносупрессивной терапии, а также трансплантации органов и тканей.
Aspergillus spp. – повсеместно распространенные многоклеточные нитчатые грибы, которые образуют септированные гифы диаметром 2,5-4,5 мкм, дихотомически (Y-образно) ветвящиеся под острым углом. Основные возбудители ИА в ОРИТ: A. fumigatus (50–70%), A. flavus (10–20%) и A. niger (10–20%); другие (A. terreus, A. nidulans и пр.) встречаются реже. Возбудители ИА чувствительны к вориконазолу, изавуконазолу, позаконазолу, анидулафунгину, каспофунгину и микафунгину, резистентны к флуконазолу. A. fumigatus и A. niger чувствительны к амфотерицину В, а A. flavus, A. terreus и A. nidulans могут быть резистентны.
Факторы риска развития ИА у больных в ОРИТ:
- применение системных глюкокортикостероидов, иммуносупрессоров до и во время ОРИТ;
- тяжелые респираторные вирусные инфекции (грипп, COVID-19);
- ХОБЛ;
- онкологические заболевания вне ремиссии;
- острый респираторный дистресс-синдром;
- хроническая печеночная недостаточность;
- нейтропения ≤0,5х109/л и/или лимфоцитопения ≤1,0х109/л;
- использование экстракорпоральной мембранной оксигенации.
Внутрибольничные вспышки ИА могут быть связаны с высокой концентрацией конидий Aspergillus spp. в воздухе при проведении ремонта, а также поражении этими грибами гипсокартона, системы вентиляции, аппаратов ИВЛ и пр.
Инфицирование пациентов обычно происходит при ингаляции конидий Aspergillus spp. с вдыхаемым воздухом, другие пути инфицирования (пищевой, травматическая имплантация возбудителя, при ожогах и пр.) имеют меньшее значение. От человека к человеку ИА не передается.
Первичное поражение легких определяют у 90–100% больных ИА в ОРИТ, придаточных пазух носа — 5–10%. Aspergillus spp. ангиотропны, способны проникать в сосуды и вызывать тромбозы. У 5–20% больных ИА в ОРИТ выявляют очаги диссеминации с поражением различных органов, например, головного мозга (4–12%), кожи и подкожной клетчатки, печени, почек и пр.
Клинические признаки ИА у больных в ОРИТ неспецифичны. У
большинства пациентов отмечают рефрактерную к антибиотикам лихорадку (65–100%),
кашель (65–90%) и нарастание
дыхательной недостаточности (65–90%), реже — «плевральные» боли в груди (10–45% или кровохарканье (10–30%).
Поэтому ИА часто диагностируют поздно, нередко
посмертно. По данным аутопсии, 53-60% случаев ИА у пациентов в ОРИТ не
выявляют при жизни, при этом частота
недиагностированных случаев ИА значительно выше у негематологических пациентов.
Ранние клинические признаки аспергиллезного риносинусита (повышение температуры тела, односторонние боли в области пораженной придаточной пазухи, появление темного отделяемого из носа) неспецифичны, их часто принимают за проявления бактериальной инфекции. Быстрое прогрессирование процесса приводит к появлению боли в области орбиты глаза и нарушению зрения, а также разрушению твердого и мягкого неба с появлением черных струпьев.
Основными вариантами церебрального аспергиллеза являются абсцесс и кровоизлияние в вещество головного мозга, менингит развивается редко. Клинические проявления (головная боль, головокружение, тошнота и рвота, очаговые неврологические симптомы и нарушение сознания) неспецифичны. Летальность при ИА у больных в ОРИТ составляет 50–70%.
Диагностика. У больных с факторами риска, ИА следует исключить при лихорадке, рефрактерной к адекватной антибактериальной терапии ≥3 дней, или нового эпизода лихорадки после нормализации температуры тела ≥2 дней, нарастании дыхательной недостаточности, а также появлении кровохаркания, боли в груди или шума трения плевры. При ИА при КТ или рентгенографии легких выявляют двусторонние (80-90%) или односторонние очаги консолидации (70-85%) или деструкции (10-50%), а также гидроторакс (20-25%). При наличии указанных клинических и радиологических признаков ИА показана бронхоскопия с получением бронхоскопического лаважа (БАЛ) из пораженного сегмента. Если пациенту обеспечивают респираторную поддержку через интубационную трубку, возможно повторное получение трахеального аспирата (ТА) или небронхоскопического лаважа (НБЛ).
Микробиологическое исследование БАЛ, НБЛ или ТА должно включать тест на галактоманнан, микроскопию с окраской калькофлюором белым, и посев на среду Сабуро. У больных без нейтропении тест на галактоманнан в сыворотке крови отличается высокой специфичностью, но низкой чувствительностью.
Диагноз ИА устанавливают при наличии клинических и радиологических признаков, положительных результатов теста на галактоманнан (сыворотка крови – индекс оптической плотности (ИОП) > 0,5, БАЛ – ИОП > 1,0, НБЛ или ТА – ИОП > 1,0 при повторном определении), микроскопии и посева БАЛ, НБЛ или ТА, а также при гистологическом исследовании и/или посеве материала из очагов поражения. Даже при диссеминированном ИА возбудителя очень редко выделяют при посеве крови.
У больных в ОРИТ достаточно часто (20-30%) выявляют сочетание ИА и другими инвазивными микозами (пневмоцистная пневмония, ИК, мукормикоз и пр.).
Лечение (прил. 4). ИА состоит из антифунгальной терапии, устранения или снижения выраженности факторов риска и хирургического удаления пораженных тканей. Ранняя антифунгальная терапия — обязательное условие успешного лечения ИА. Препараты выбора – вориконазол (в/в 6 мг/кг 2 р/сут. в 1-е сутки, затем 4 мг/кг 2 р/сут.) и изавуконазол (в/в 200 мг 3 р/сут. в 1-2-е сутки, затем 200 мг/сут.). При их использовании следует учитывать межлекарственные взаимодействия. При выраженной дисфункции почек противопоказано в/в введение вориконазола, определение его концентрации в плазме крови повышает эффективность и снижает токсичность. После стабилизации состояния пациента возможно применение этих ЛС перорально. Альтернативные ЛС (липосомальный АмВ в/в 3 мг/кг/сут., липидный комплекс АмВ в/в 5 мг/кг/сут. и каспофунгин в/в 70 мг в 1-й день, за- тем 50 мг/сут.) назначают при невозможности применения вориконазола или изавуконазола. Оценку эффективности стартовой терапии следует провести в течение первой недели лечения. При отсутствии убедительных клинических и КТ признаков эффективности следует перейти на альтернативные препараты. Комбинации антимикотиков в начале лечения обычно не используют, их применение возможно при неэффективности стартовой терапии и сочетанных микозах. Продолжительность противогрибковой терапии – 4-6 недель.
Устранение или снижение выраженности факторов риска достигается успешным лечением основного заболевания, а также отменой или снижением дозы стероидов или им- муносупрессоров.
Хирургическое лечение. Основное показание для лобэктомии или резекции пораженного участка легкого — высокий риск легочного кровотечения (выраженное кровохаркание, расположение очагов поражения вблизи крупных сосудов). При аспергиллезе ЦНС удаление или дренирование очага поражения повышает вероятность выживания больного. Кроме того, получение материала из очага поражения может способствовать установлению диагноза [59].
8.3. Диагностика и лечение мукормикоза
Во время пандемии COVID-19 значительно увеличилась частота мукормикоза, который до этого диагностировали преимущественно у онкогематологических больных. При COVID-19 мукормикоз возникает реже (0,5-1,5% у пациентов в ОРИТ), чем ИА и ИК. Возбудители мукормикоза (Rhizopus spp., Lichthemia spp., Mucor spp. и пр.) чувствительны in vitro только к амфотерицину В, изавуконазолу и позаконазолу, устойчивы к остальным доступным противогрибковым ЛС. Летальность при COVID-ассоциированном мукоромикозе составляет около 50%. Основные фоновые заболевания при развитии у пациентов с COVID- 19 и мукормикозом – сахарный диабет, гематологические и онкологические болезни. Факторы риска развития мукормикоза при COVID-19 – применение высоких доз глюкокортикостероидов, использование биологических иммуносупрессоров, длительная лимфопения, декомпенсированный сахарный диабет. Для «ковидного» мукормикоза характерно поражение околоносовых пазух с очень быстрым развитием диссеминации, с частым поражением ЦНС, органов зрения и легких.
Мукормикоз следует исключить у больных COVID-19 с указанными факторами риска при появлении симптомов синусита, болей в области околоносовых пазух и орбиты, нарушении зрения и пр. При диагностике мукормикоза важна компьютерная томография не только пораженного органа (околоносовых пазух), но и КТ легких и брюшной полости. Диагноз подтверждают выявлением мукормицетов при микроскопии, посеве и гистологическом исследовании материала из очага поражения. Исследование биоптата более информативно, чем аспирата. При микроскопии полученного материала следует использовать калькофлюор белый. Гифы мукормицетов несептированные, диаметр 6-25 мкм, число ветвлений более 45. При выделении возбудителя мукормицета в культуре показано определение рода. При гистологическом исследовании следует использовать окраски по Грокотту, гематоксилин-эозин и PAS. Определение диаметра гиф позволяет дифференцировать возбудителей мукормикоза (6-25 мкм) и аспергиллеза (3-5 мкм).
Для стартового лечения мукормикоза используют липосомальный АмВ (в/в 5-10 мг/кг/сут.) или липидный комплекс амфотерицина В (5 мг/кг/сут.). Амфотерицин В деоксихолат (1,0-1,5 мг/кг/сут.) менее эффективен и более токсичен; его применение возможно только при отсутствии липидных форм препарата. Изавуконазол или позаконазол назначают при невозможности (почечная недостаточность и пр.) или неэффективности применения указанных форм амфотерицина В, а также после стабилизации состояния пациента. Важные условия успешного лечения – хирургическое удаление пораженных тканей, стабилизации фоновых заболеваний и уменьшение степени иммуносупрессии (отмена или снижение дозы глюкокортикостероидов и пр.) [22].
9. Критерии качества оказания помощи с использованием лекарственных средств для лечения инфекций, вызванных полирезистенными микроорганизмами
Таблица 3. Критерии качества оказания помощи с использованием лекарственных средств для лечения инфекций, вызванных полирезистенными микроорганизмами
|
п/п |
Критерии качества |
Оценка выпол- нения |
|
1. |
Наличие обоснования в медицинской документации для проведения антимикробной терапии (Инфекция, вызванная условнопатогенными микроорганизмами, вынесенная в основной, сопутствующий диагноз или осложнение с соответствующим ко- дом МКБ) |
Да/Нет |
|
2 |
Наличие результатов микробиологического исследования биологического материала из очага инфекции c выделением, как минимум, одного из полирезистентных возбудителей и опреде лением чувствительности возбудителя к АМП |
Да/Нет |
|
3 |
Определена продукция карбапенемаз при выявлении карбапе- неморезистентных штаммов Enterobacterales |
Да/Нет |
|
4 |
Проведена коррекция антибактериальной терапии (при необходимости) с учетом результатов бактериологического исследования |
Да/Нет |
|
5 |
При выявлении полирезистентных бактерий и грибов режимы анттимикробной терапии назначены в соответствии с данными методическими рекомендациями |
Да/Нет |
|
6 |
Проведена коррекция дозы антибактериальных препаратов с учетом тяжести состояния больного (при необходимости) |
Да/Нет |
|
7 |
Проведена ежедневная оценка эффективности антибактериальной терапии с учетом выраженности воспалительной реакции, органной дисфункции по шкалам |
Да/Нет |
Приложение 1. Схемы антимикробной терапии инфекций, вызванных полирезистентными возбудителям (* - под тяжелыми формами инфекции понимаются пневмония тяжелого течения, сепсис, септический шок)
|
Инфекции, вызванные грам (+) микроорганизмами |
||||
|
Инфекции, вызванные MRSA и MR-CNS |
||||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) и примечания |
|
1 |
Ванкомицин |
1,0 г х 2 р/сут. в/в в течение 1 ч. |
Да |
УП. При МПК ванкомицина ≤ 1 мг/л – у пациентов без сепсиса при инфекциях кроме пневмонии - стандартный режим дозирования; у пациентов с сепсисом или пневмонией - увеличение дозы по решению врачебной комиссии (ВК) - нагрузочная доза 25–30 мг/кг, затем 15– 20 мг/кг с интервалом 8-12 часов [42]. При МПК ванкомицина ≥ 1 мг/л приме- нение ванкомицина не рекомендовано. Прим. Оптимальным способом выбора режима дозирования ванкомицина явля- ется его коррекция на основании тера- певтического лекарственного монито- ринга. Не рекомендован при инфекциях, вы- званных МSSA и MR-CNS. |
|
2 |
Тейкопланин |
400 мг каждые 12 часов для первых 3х доз, затем 400 мг в/в 1 р/сут. |
Нет |
Прим. Профиль безопасности более бла- гоприятный, чем у ванкомицина. Воз- можно не только в/в, но и в/м введение. |
|
3 |
Линезолид |
600 мг х 2 р/сут. в/в |
Да |
Прим. Применение при бактериемии, инфекционном эндокардите не опти- мально. |
|
4 |
Цефтаролина фосамил |
600 мг х 2 р/сут. в/в в течение 1 ч. |
Да |
Прим. В случае тяжелого течения ин- фекции* рекомендовано повышение ре- жима дозирования до 600 мг х 3 р/сут. по решению ВК. |
|
5 |
Даптомицин |
6 мг/кг х 1 р/сут. в/в струйно в течение двух минут или в/в инфузия в течение 30 мин. |
Да |
Прим. При бактериемии и бактериаль- ном эндокардите по решению ВК увели- чение дозы до 8-12 мг/кг/сут. [18,30]. При бактериальных эндокардитах, ассо- циированных с имплантацией внутри- сердечных устройств, возможна комби- нация с цефтаролином по решению ВК. |
|
6 |
Телаванцин |
10 мг /кг х 1 р/сут. в/в в течение 1 ч. |
Да |
Прим. Не рекомендуется при клиренсе креатинина < 50 мл/мин. |
|
7 |
Тедизолид |
200 мг х 1 р/сут. в/в в течение 1 ч. |
Да |
- |
|
8 |
Тигециклин |
Первая нагрузочная доза 100 мг в/в в течение 1 ч., затем по 50 мг х 2 р/сут. в/в в течение 1 ч. |
Да |
Прим. Возможно применение в виде монотерапии при смешанных инфекци- ях, вызванных MRSA и грамотрицатель- ными микроорганизмами, чувствитель- ными к тигециклину (за исключением пневмонии, бактериемии и ИМП). |
|
Инфекции, вызванные ванкомицинорезистентными энтерококками (VRE) |
||||
|
9 |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) и примечания |
|
10 |
Линезолид |
600 мг х 2 р/сут. в/в. |
Да |
Прим. Применение при бактериемии, инфекционном эндокардите не опти- мально. |
|
11 |
Тедизолид |
200 мг х 1 р/сут. в/в инфузия в течение 1 ч. |
Да |
- |
|
12 |
Тигециклин |
Первая нагрузочная доза 100 мг в/в в течение 1 ч., затем по 50 мг х 2 р/сут. в/в в течение 1 ч. |
Да |
Прим. Возможно применение в виде монотерапии при смешанных инфекци- ях, вызванных VRE и грамотрицатель- ными микроорганизмами, чувствитель- ными к тигециклину. |
|
13 |
Даптомицин |
10-12 мг/кг х 1 р/сут. в/в струйно в течение двух минут или в/в инфузия в течение 30 мин. |
Да |
Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. При эндокардите желательно в комбина- ции с цефтаролином или ампициллином. |
|
Инфекции, вызванные пенициллинорезистентными пневмококками (ПРП) |
||||
|
1 |
Цефтаролина фосамил |
600 мг х 2 р/сут. в/в в течение 1 ч. |
Да |
Прим. Предпочтительная терапевтиче- ская опция. |
|
2 |
Линезолид |
600 мг х 2 р/сут. в/в. |
Да |
- |
|
3 |
Моксифлокса- цин |
400 мг х 1 р/сут в/в или внутрь |
Да |
- |
|
4 |
Ванкомицин |
1,0 г х 2 р/сут. в/в в течение 1 ч. |
Да |
- |
|
5 |
Тейкопланин |
400 мг х 2 р/сут. в/в первые сутки (при тяжелых инфекциях – первые 3 дозы), затем 400 мг х 1 р/сут в/в или в/м |
Нет |
Прим. Профиль безопасности более бла- гоприятный, чем у ванкомицина. Воз- можно не только в/в, но и в/м введение. |
|
|
|
|
|
|
|
Инфекции, вызванные грам (-) микроорганизмами |
||||
|
Инфекции, вызванные полирезистентными штаммами Enterobacterales |
||||
|
|
Klebsiella pneumoniae, продуцирующие β-лактамазы расширенного спектра дей- ствия (БЛРС) |
|||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) и примечания |
|
Базовые препараты |
||||
|
1 |
Эртапенем |
1 г х 1 р/сут в/в |
Да |
Прим. Более высокий риск устойчиво- сти по сравнению с другими карбапене- мами. При тяжелых инфекциях* пред- почтительно использование других кар- бапенемов. Потенциальное преимущество более вы- сокого режима дозирования - 1 г х 2 р/сут в/в, при этом превышение макси- мальной суточной дозы должно быть оформлено решением ВК. Обосновано применение в монотерапии. |
|
2 |
Меропенем |
1 г х 3 р/сут. |
Да |
Прим. При тяжелых инфекциях* воз- можно - 2 г в/в инфузия в течение 3 ча- сов х 3 р/сут. (в первые сутки непосред- |
|
|
|
|
|
ственно перед первой инфузией введе- ние нагрузочной дозы 2 г в/в болюсно). Обосновано применение в монотерапии. |
|
3 |
Дорипенем |
1 г х 3 р/сут. в/в |
Нет |
Прим. При тяжелых инфекциях* пред- почтительно введение в виде продлен- ной инфузии (в течение 4 часов, в пер- вые сутки непосредственно перед первой инфузией введение нагрузочной дозы 1 г в/в болюсно). Прим. Превышение максимальной су- точной дозы в первые сутки должно быть оформлено решением ВК. Обосновано применение в монотерапии. |
|
4 |
Имипенем/ Циластатин |
0,5-1 г х 4 р/сут. в/в |
Да |
Прим. При тяжелых инфекциях* пред- почтительный режим дозирования 1 г х 4 р/сут в/в. Обосновано применение в монотерапии. |
|
5 |
Биапенем |
0,6 г х 2-3 р/сут. в/в |
Нет |
Прим. Обосновано применение в моно- терапии. Учитывая возможное превышение дози- ровки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
5 |
Тигециклин |
Первая нагрузочная доза 100 мг в/в в течение 1 ч., затем по 50 мг х 2 р/сут. в/в в течение 1 ч. |
Да |
Прим. Препарат для альтернативного выбора при невозможности использова- ния β-лактамных антибиотиков. Не рекомендуется использовать при пневмонии, бактериемии, инфекциях мочевых путей. Обосновано применение в монотерапии. |
|
6 |
Цефепим /сульбактам |
1-2 г х 3 р/сут. в/в или в/м |
Нет |
Прим. Большинство штаммов K. pneumoniae устойчиво. При лечении тяжелых инфекций* использовать толь- ко при известной чувствительности к пиперациллину/тазобактаму или цефто- лозану/тазобактаму |
|
Антибиотики для комбинации с базовыми препаратами1 |
||||
|
1 |
Амикацин |
15-20 мг/кг х 1 р/сут. в/в |
Да |
Прим. Возможно применение совместно с одним из «базовых» препаратов при доказанной или предполагаемой бакте- риемии, сепсисе, септическом шоке. Возможно применение в монотерапии при инфекциях мочевых путей (при из- вестной чувствительности к препарату) [54]. Учитывая возможное превышение дози- ровки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
2 |
Гентамицин |
5-7 мг/кг х 1 р/сут. в/в |
Да |
Прим. Возможно применение совместно с одним из «базовых» препаратов при доказанной или предполагаемой бакте- риемии, сепсисе, септическом шоке. Возможно в монотерапии при инфекци- ях мочевых путей (при известной чувст- вительности к препарату). Учитывая возможное превышение дозировки, ре- |
|
|
|
|
|
комендованной в инструкции к препара- ту, назначение производится по реше- нию ВК. |
|
3 |
Фосфомицин |
4 г в/в инфузия в течение 1 часа х 4 р/сут. |
Да |
Прим. В случае тяжелого течения ин- фекции* возможно применение высоких доз по решению ВК: 6 г в/в инфузия в течение 1 часа х 4 р/сут. под контролем уровня Na+ крови (с осторожностью у пациентов с сердечной недостаточно- стью, ОПП и ХБП) [37]. Использовать в комбинации с одним из базовых препаратов при сепсисе, септи- ческом шоке. |
|
Escherichia coli, продуцирующие β-лактамазы расширенного спектра действия (БЛРС) |
||||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) и примечания |
|
Базовые препараты |
||||
|
1 |
Эртапенем |
1 г х 1 р/сут. в/в |
Да |
Прим. Более высокий риск устойчиво- сти по сравнению с другими карбапене- мами. При жизнеугрожающих инфекци- ях предпочтительно использование дру- гих карбапенемов. В случае использования при тяжелых инфекциях возможно использование ре- жима дозирования 1 г х 2 р/сут в/в, при этом превышение максимальной суточ- ной дозы должно быть оформлено реше- нием ВК. Обосновано применение в монотерапии. |
|
2 |
Цефепим /сульбактам |
1-2 г х 2-3 р/сут. в/в или в/м |
Нет |
Прим. При тяжелых инфекциях* ис- пользовать только в случае известной чувствительности возбудителя к пипера- циллину/тазобактаму или при невоз- можности назначения карбапенемов Обосновано применение в монотерапии. |
|
3 |
Пиперацил- лин/тазобактам |
4,5 г х 3-4 р/сут. в/в |
Нет |
- |
|
4 |
Меропенем |
1 г х 3 р/сут. |
Да |
Прим. При тяжелых инфекциях* пред- почтительный режим дозирования - 2 г в/в инфузия в течение 3 часов х 3 р/сут. (в первые сутки непосредственно перед первой инфузией введение нагрузочной дозы 2 г в/в болюсно). Обосновано применение в монотерапии. |
|
5 |
Дорипенем |
0,5 г х 3 р/сут. в/в |
Нет |
Прим. При тяжелых инфекциях* 1 г 3 р/сут. предпочтительно введение в виде продленной инфузии (в течение 4 часов, в первые сутки непосредственно перед первой инфузией введение нагрузочной дозы 1 г в/в болюсно). Прим. Превышение максимальной су- точной дозы в первые сутки должно быть оформлено решением ВК. Обосновано применение в монотерапии. |
|
6 |
Имипенем/ Циластатин |
0,5 г х 4 р/сут. в/в |
Да |
Прим. При тяжелых инфекциях* пред- почтительный режим дозирования 1 г х 4 р/сут. в/в. |
|
|
|
|
|
Обосновано применение в монотерапии. |
|
7 |
Биапенем |
0,6 г х 2-3 р/сут. в/в |
Нет |
Прим. Учитывая возможное превыше- ние дозировки, рекомендованной в инст- рукции к препарату, назначение произ- водится по решению ВК. |
|
8 |
Тигециклин |
Первая нагрузочная доза 100 мг в/в в течение 1 ч., затем по 50 мг х 2 р/сут. в/в в течение 1 ч. |
Да |
Прим. Препарат альтернативного выбо- ра при невозможности назначения β- лакактамных антибиотиков при интра- абдоминальных инфекциях и инфекциях кожи и мягких тканей (без сепси- са/септического шока). Не рекомендуется использовать при пневмонии, бактериемии, инфекциях мочевых путей. |
|
Антибиотики для комбинации с базовыми препаратами1 |
||||
|
1 |
Амикацин |
15-20 мг/кг х 1 р/сут. в/в |
Да |
Прим. Возможно применение совместно с одним из «базовых» препаратов при тяжелых формах инфекции* Возможно применение в монотерапии при инфекциях мочевых путей (при из- вестной чувствительности к препарату). Учитывая возможное превышение дози- ровки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
2 |
Гентамицин |
5-7 мг/кг х 1 р/сут. в/в |
Да |
Прим. Возможно применение совместно с одним из «базовых» препаратов при тяжелых формах инфекции* Возможно применение в монотерапии при инфекциях мочевых путей (при из- вестной чувствительности к препарату). При превышении дозы, рекомендован- ной инструкцией к препарату, решение принимается ВК. |
|
3 |
Фосфомицин |
4 г в/в инфузия в течение 1 часа х 4 р/сут. |
Да |
Прим. В случае тяжелого течения ин- фекции (сепсис, септический шок) воз- можно применение высоких доз по ре- шению ВК: 6 г в/в инфузия в течение 1 часа х 4 р/сут. под контролем уровня Na+ крови (с осторожностью у- пациентов с сердечной недостаточностью, ОПП и ХБП) [37]. Использовать в комбинации с одним из базовых препаратов при сепсисе, септи- ческом шоке. |
|
Карбапенеморезистентные штаммы2 Enterobacterales (Klebsiella spp., Escherichia coli, Enterobacter spp. и др.) |
||||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) и примечания |
|
Базовые препараты |
||||
|
1 |
Цефтази- дим/авибактам |
2,5 г х 3 р/сут. в/в в виде инфузии объ- емом 100 мл с по- стоянной скоро- стью в течение 120 |
Да |
УП. При инфекциях, вызванных Enterobacterales, продуцирующими кар- бапенемазы типов КРС и/или ОХА-48. В случае сочетанной продукции КРС и/или ОХА-48 + MBL показана комбиниро- |
|
|
|
мин. |
|
ванная терапия цефтази- дим/авибактам+азтреонам [47]. |
|
2 |
Тигециклин |
Первая нагрузочная доза 100 мг в/в в течение 1 ч., затем по 50 мг х 2 р/сут. в/в в течение 1 ч. |
Да |
УП. В комбинированном режиме Прим. В случае тяжелого течения ин- фекции* возможно применение высоких доз по решению ВК: первая нагрузочная доза 200 мг, затем 100 мг х 2 р/сут. [18, 23]. Не рекомендовано применение в моно- терапии при пневмонии, бактериемии, инфекциях мочевых путей [47]. |
|
3 |
Меропенем |
2 г в/в инфузия в течение 3 часов х 3 р/сут. (в первые су- тки непосредствен- но перед первой инфузией введение нагрузочной дозы 2 г в/в болюсно). |
Да |
УП. Возможно применение при устой- чивости к эртапенему и имипенему и сохраненной чувствительности к меро- пенему [12, 18, 66]. Прим. Превышение максимальной су- точной дозы в первые сутки должно быть оформлено решением ВК. |
|
4 |
Дорипенем |
1 г в течение 4 ча- сов х 3 р/сут. в/в (в первые сутки непо- средственно перед первой инфузией введение нагрузоч- ной дозы 1 г в/в бо- люсно). |
Нет |
УП. Возможно применение при устой- чивости к эртапенему и имипенему и сохраненной чувствительности к дори- пенему и/или меропенему [12, 18, 47, 66]. Прим. Превышение максим альной су- точной дозы в первые сутки должно быть оформлено решением ВК. |
|
Антибиотики для комбинации с базовыми препаратами1 |
||||
|
1 |
Азтреонам |
По 2,0 г х 3 р/сут. в/в (длительность инфузии – 2 ч) |
Нет |
УП. Комбинация с цефтазиди- мом/авибактамом при инфекциях, вы- званных Enterobacterales, продуцирущи- ми MBL с обязательным условием вве- дения одновременно с цефтазиди- мом/авибактамом через разные порты катетера или через различный венозный доступ. |
|
2 |
Полимиксин В |
2,5 мг/кг/сут. в/в, доза делится на два введения |
Да |
УП. Избегать одновременного назначе- ния с аминогликозидами, колистимета- том натрия и другими нефротоксичными препаратами ввиду увеличения риска нефротоксичности. Прим. Более предпочтительная фарма- кокинетика по сравнению с колистином. |
|
3 |
Колистиметат натрия |
9 млн ЕД /сутки в/в, делится на 2-3 вве- дения |
Нет |
УП. Избегать одновременного назначе- ния с аминогликозидами, полимиксином и другими нефротоксичными препара- тами ввиду увеличения риска нефроток- сичности. Предпочтительнее полимиксина В толь- ко при инфекциях мочевыводящих пу- тей, в остальных случаях препарат вы- бора из группы полимиксинов - поли- миксин В. Прим. При жизнеугрожающих инфек- циях нагрузочная доза составляет 9 млн ЕД, затем суточная доза 9 млн ЕД/сут. в/в в 2 – 3 введения. |
|
4 |
Амикацин |
15-20 мг/кг х 1 р/сут. в/в в течение 30 мин. |
Да |
Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК [55]. Избегать одновременного назначения с полимиксином В и колистиметатом на- трия ввиду увеличения риска нефроток- сичности. Возможно применение в монотерапии при инфекциях мочевых путей (при из- вестной чувствительности к препарату). |
|
5 |
Гентамицин |
5-7 мг/кг х 1 р/сут. в/в |
Да |
Прим. Избегать одновременного назна- чения с полимиксином В и колистимета- том натрия ввиду увеличения риска неф- ротоксичности. Возможно применение в монотерапии при инфекциях мочевых путей (при из- вестной чувствительности к препарату). |
|
6 |
Фосфомицин |
4 г в/в инфузия в течение 1 часа х 4 р/сут. |
Да |
Прим. В случае тяжелого течения ин- фекции* возможно применение высоких доз по решению ВК: 6 г в/в инфузия в течение 1 часа х 4 р/сут. под контролем уровня Na+ крови (с осторожностью у пациентов с сердечной недостаточно- стью, ОПП и ХБП) [37]. |
|
|
|
|
|
|
|
Карбапенеморезистентные (CPR) штаммы2 P. aeruginosa [18] Примеры схем терапии вынесены в примечание к таблице 3 |
||||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) и примечания |
|
Базовые препараты |
||||
|
1 |
Цефтолозан/ Тазобактам |
1,5 г в/в х 3 р/сут. в/в в течение 120 мин (при лечении нозокомиальной пневмонии - 3 г х 3 р/сут. каждые 8 ча- сов в/в в течение 120 мин). |
Да |
УП. При инфекции, вызванной CPR P. aeruginosa при отсутствии продукции карбапенемаз, подтвержденной культу- ральными или ПЦР методами (вероятны другие механизмы антибиотикорези- стентности). При подтвержденной чувствительности in vitro возможно проведение монотера- пии. |
|
2 |
Цефтазидим/ авибактам |
2,5 г в/в в виде ин- фузии объемом 100 мл с постоянной скоростью в тече- ние 120 мин. каж- дые 8 часов. |
Да |
УП. При подтвержденной чувствитель- ности in vitro возможно проведение мо- нотерапии. |
|
3 |
Азтреонам |
2 г х 4 р/сут. в/в |
Нет |
УП. При инфекциях, вызванных P. aeruginosa, продуцирующей карбапене- мазы группы MBL. |
|
4 |
Полимиксин В |
2,5 мг/кг/сут. в/в, доза делится на два введения. |
Да |
УП. Избегать одновременного назначе- ния с аминогликозидами и колистимета- том натрия ввиду увеличения риска неф- ротоксичности. Прим. Более предпочтительная фарма- кокинетика по сравнению с колистином. |
|
5 |
Колистиметат натрия |
9 млн ЕД /сутки в/в, делится на 2-3 вве- дения |
|
УП. Избегать одновременного назначе- ния с аминогликозидами и полимикси- ном ввиду увеличения риска нефроток- сичности. Предпочтительнее полимиксина В толь- ко при ИМВП, в остальных случаях пре- парат выбора из группы полимиксинов - полимиксин В. Прим. При тяжелых формах инфекции нагрузочная доза 9 млн ЕД, затем суточ- ная. |
|
Антибиотики для комбинации с базовыми препаратами1 |
||||
|
1 |
Фосфомицин |
4 г х 4 р/сут. в/в инфузия в течение 1 часа |
Да |
Прим. В случае тяжелого течения ин- фекции (сепсис, септический шок) воз- можно применение высоких доз по ре- шению ВК: 6 г в/в инфузия в течение 1 часа х 4 р/сут. под контролем уровня Na+ крови (с осторожностью у пациентов с сердечной недостаточностью, ОПП и ХБП) |
|
2 |
Амикацин |
15-20 мг/кг х 1 р/сут. в/в в течение 30 мин. |
Да |
УП. Может быть использован в качест- ве монотерапии при неосложненных ин- фекциях мочевыводящих путей и нали- чии чувствительности [55]. Учитывая возможное превышение до- зировки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
3 |
Меропенем |
2 г в/в в течение 3 часов х 3 р/сут. (в первые сутки непо- средственно перед первой инфузией введение нагрузоч- ной дозы 2 г в/в бо- люсно. |
Да |
УП. При устойчивости к эртапенему и имипенему и сохраненной чувствитель- ности к меропенему [12, 18, 66]. Прим. Превышение максимальной су- точной дозы в первые сутки должно быть оформлено решением ВК. |
|
4 |
Дорипенем |
1 г в течение 4 ча- сов х 3 раза в сут. в/в (в первые сутки непосредственно перед первой инфу- зией введение на- грузочной дозы 1 г в/в болюсно). |
Нет |
УП. При устойчивости к эртапенему и имипенему и сохраненной чувствитель- ности к дорипинему [12, 18, 66]. Прим. Превышение максимальной су- точной дозы в первые сутки должно быть оформлено решением ВК. |
|
5 |
Имипенем/ Циластатин |
1 г 4 р/сут. в/в. |
Да |
При инфекциях, вызванных P. aeruginosa с чувствительностью к имипенему/циластатину при увеличен- ной экспозиции (I) [38]. |
|
Карбапенеморезистентные штаммы штаммы2 Acinetobacter spp. Примеры схем терапии вынесены в примечание к таблице 4 |
||||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Примечание |
|
Базовые препараты |
||||
|
1 |
Полимиксин В |
2,5 мг/кг в сут. в/в, доза делится на два |
Да |
УП. Избегать одновременного назначе- ния с аминогликозидами и колистимета- |
|
|
|
введения |
|
том натрия ввиду увеличения риска неф- ротоксичности. Возможно комбинированное примене- ние с сульбактам-содержащими препа- ратами. Прим. Более предпочтительная фарма- кокинетика по сравнению с колистином. |
|
2 |
Колистиметат натрия |
9 млн ЕД /сутки в/в, делится на 2-3 вве- дения |
Нет |
УП. Избегать одновременного назначе- ния с аминогликозидами и полимикси- ном ввиду увеличения риска нефроток- сичности. Предпочтительнее полимиксина В толь- ко при инфекциях мочевыводящих пу- тей, в остальных случаях препарат вы- бора из группы полимиксинов - поли- миксин В. Возможно комбинированное примене- ние с сульбактам-содержащими препа- ратами. Прим. При тяжелых формах инфекции нагрузочная доза 9 млн. ЕД, затем су- точная. |
|
3 |
Ампициллин/ сульбактам |
По 2 г (по сульбак- таму) х 4 р/сут. в/в |
Да |
УП. Только в составе комбинированной терапии. |
|
4 |
Цефепим/ сульбактам |
По 2 г (по сульбак- таму) х 3-4 р/сут. в/в |
Да |
УП. Только в составе комбинированной терапии. Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
5 |
Цефоперазон/ сульбактам |
По 2 г (по сульбак- таму) х 3 р/сут. в/в |
Да |
УП. Только в составе комбинированной терапии. Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
Антибиотики для комбинации с базовыми препаратами1 |
||||
|
1 |
Тигециклин |
Первая нагрузочная доза 200 мг, затем 100 мг х 2 р/сут. |
Да |
Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
2 |
Ко-тримоксазол |
10-15 мг/кг/сут. (по триметоприму) в 2- 3 введения |
Да |
Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
3 |
Меропенем |
2 г в/в в течение 3 часов х 3 р/сут. (в первые сутки непо- средственно перед первой инфузией введение нагрузоч- ной дозы 2 г в/в бо- люсно). |
Да |
УП. При устойчивости к эртапенему и имипенему и сохраненной чувствитель- ности к меропенему в составе комбини- рованной терапии с двумя другими АМП [12, 18, 47, 66]. Прим. Превышение максимальной су- точной дозы в первые сутки должно быть оформлено решением ВК. |
|
4 |
Дорипенем |
1 г в течение 4 ча- сов х 3 р/сут. в/в (в первые сутки непо- средственно перед |
Нет |
УП. При устойчивости к эртапенему и имипенему и сохраненной чувствитель- ности к дорипинему в составе комбини- рованной терапии с двумя другими АМП |
|
|
|
первой инфузией введение нагрузоч- ной дозы 1 г в/в бо- люсно). |
|
[12, 18, 47, 66]. |
|
5 |
Амикацин |
20-30 мг/кг х 1 р/сут. в/в в течение 30 мин. [55] |
Да |
Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
Stenotrophomonas maltophilia [ https://www.idsociety.org/practice-guideline/amr-guidance-2.0/] |
||||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) и примечание |
|
1 |
Ко-тримоксазол |
10-15 мг/кг/сут. (по триметоприму) в 2- 3 введения, в/в. |
Да |
УП. При нетяжелых инфекциях возмож- на монотерапия, при тяжелых инфекци- ях* – в комбинации с тигециклином или левофлоксацином. Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
2 |
Тигециклин |
Первая нагрузочная доза 200 мг, затем 100 мг х 2 р/сут. |
Да |
УП. При нетяжелых инфекциях возмож- на монотерапия, при тяжелых инфекциях – в комбинации с ко-тримоксазолом или левофлоксацином. Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
3 |
Левофлоксацин |
500 мг х 2 р/сут. в/в |
Да |
УП. При нетяжелых инфекциях возмож- на монотерапия, при тяжелых инфекциях – в комбинации с ко-тримоксазолом или тигециклином. |
|
4 |
Цефтази- дим/авибактам |
По 2,5 г в/в в виде инфузии объемом 100 мл с постоян- ной скоростью в течение 120 мин. каждые 8 часов. |
|
УП. Только одновременно с Азтреона- мом (2 г х 3 р/сут.) через разные порты катетера или через различный венозный доступ. Прим. При неэффективности других режимов терапии. |
Примечания:
1. В комбинации с базовыми препаратами используются 1-2 препарат из данного перечня.
2. Карбапенемрезистентные штаммы – штаммы, резистентные хотя бы к одному из перечисленных карбапенемов (эртапенему, имипенему, меропенему)
3. Примеры комбинаций антимикробных препаратов при терапии инфекций, вызванных карбапенеморезистентной (CPR) P. aeruginosa:
- цефтазидим/авибактам + азтреонам или амикацин или фосфомицин;
- цефтолозан/тазобактам + амикацин или полимиксин В или колистиметат натрия или фосфомицин;
- азтреонам + полимиксин В или колистиметат натрия или амикацин;
- полимиксин В или колистиметат натрия + меропенем или дорипенем ± фосфомицин.
4. Примеры комбинаций АМП при терапии инфекций, вызванных штаммами CPR
Acinetobacter spp.:
- полимиксин В или колистиметат натрия + ампициллин/сульбактам или цефепим/сульбактам или цефоперазон/сульбактам + тигециклин
- полимиксин В или колистиметат натрия ± тигециклин ± ко-тримоксазол;
- полимиксин В или колистиметат натрия + ко-тримоксазол или тигециклин ± меропенем или дорипенем;
- тигециклин + амикацин ± меропенем или дорипенем.
Приложение 2. Дозы антимикробных препаратов, применяемых для лечения инфекций, вызванных полирезистентными возбудителями у детей
|
№ |
МНН |
Возрастная категория |
Рекомендуемые дозы АМП |
|
1 |
Ванкомицин |
0-18 лет |
40-60 мг/кг/сут. в 3-4 в/в введения |
|
2 |
Линезолид |
0-12 лет |
10 мг/кг в/в 3 р/сут. |
|
12-18 лет |
10 мг/кг в/в 2 р/сут. |
||
|
3 |
Цефтаролин |
2 мес.-2 года |
10 мг/кг в/в 3 р/сут. |
|
2-18 лет |
12 мг/кг в/в 3 р/сут. |
||
|
4 |
Цефтазидим /авибактам |
3 мес.- 6 мес. |
40 мг/кг (по цефтазидиму) 3 р/сут., в/в инфузия в течение 2 часов |
|
6 мес.-18лет |
50 мг/кг (по цефтазидиму) 3 р/сут., в/в инфузия в течение 2 часов (разовая доза по цефтазидиму - не более 2 г) |
||
|
5 |
Азтреонам |
9 мес-18 лет |
30 мг/кг 3-4 р/сут. |
|
6 |
Полимиксин В |
0-1 год |
4 мг/кг/сут. в 2 введения |
|
2-18 лет |
1,5-2,5 мг/кг/сут. в/в в 2 введения |
||
|
7 |
Меропенем |
3 мес.-12 лет |
10-20 мг/кг 3 р/сут. (максимальная су- точная доза – 120 мг/кг) |
|
8 |
Имипенем |
3 мес. - 18 лет |
15 мг/кг 4 р/сут. |
|
9 |
Фосфомицин |
С 0 мес. |
200-400 мг/кг в сутки (разделенные на 3 введения) |
|
10 |
Тигециклин |
8-11 лет |
1,2 мг/кг в/в 2 р/сут. |
|
12-18 лет |
50 мг в/в 2 р/сут. |
||
|
11 |
Цефоперазон /сульбактам |
С 0 мес. |
40-80 мг/кг/сут в 2-4 введения; при тяже- лых, инфекциях - по 160 мг/кг/сут. Мак- симальная суточная доза сульбакткма не должна превышать - 80 мг/кг/сут. |
|
12 |
Цефепим/сульбактам |
2 мес. – 18 лет |
50 мг/кг (по цефепиму) в/в 2 раза в сут. |
|
13 |
Тримето- прим/сульфаметоксазол |
С 3-х до 12 лет |
6 мг/кг/сут. по тримептоприму в два в/в введения |
|
12-18 лет |
960 мг в/в 2-3 р/сут. |
||
|
14 |
Пиперациллин /тазобактам |
С 2 лет |
100/12,5 мг/кг в/в 3 р/сут. |
|
15 |
Амикацин |
С 0 мес. |
10- 15 мг/кг в/в 1 раз в сут. Новорожденным и недоношенным детям 10 мг/кг в сут., затем 7,5 мг/кг в сут. |
Приложение 3. Дозирование антимикробных препаратов у пациентов с почечной и печеночной недостаточностью
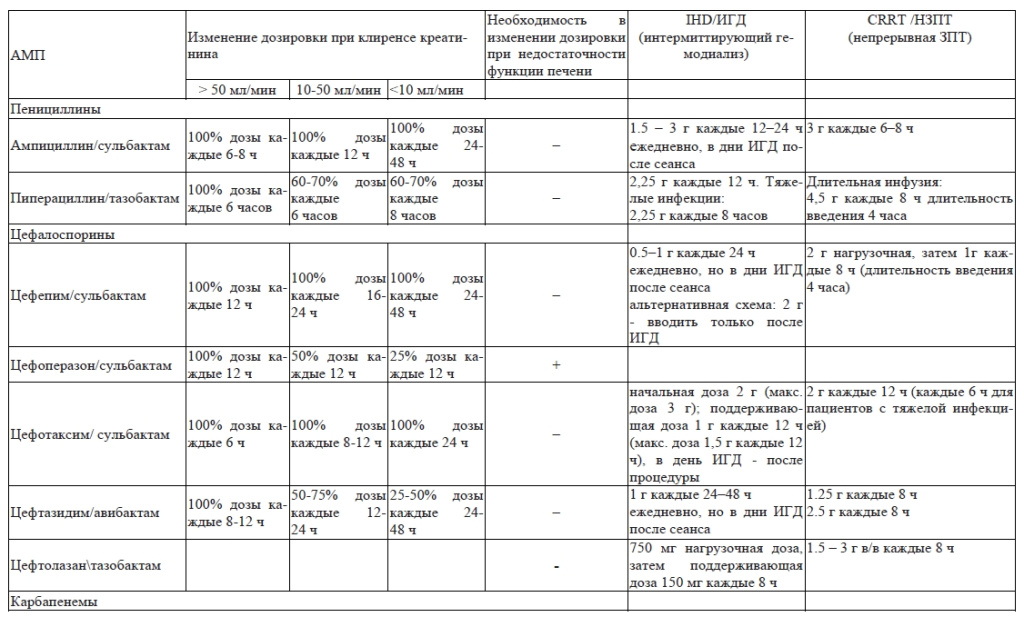
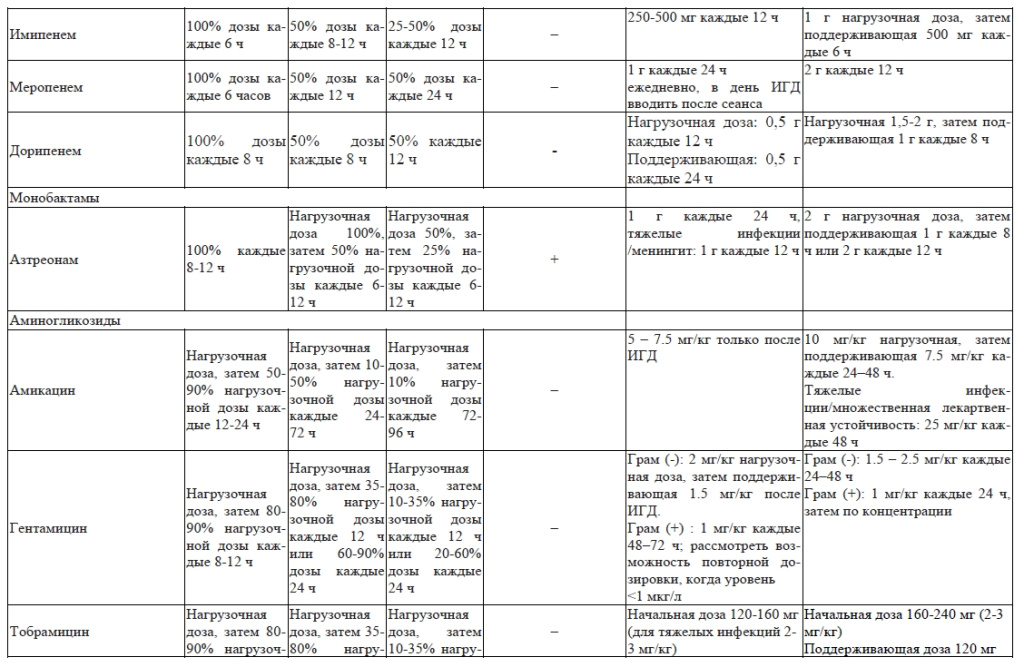
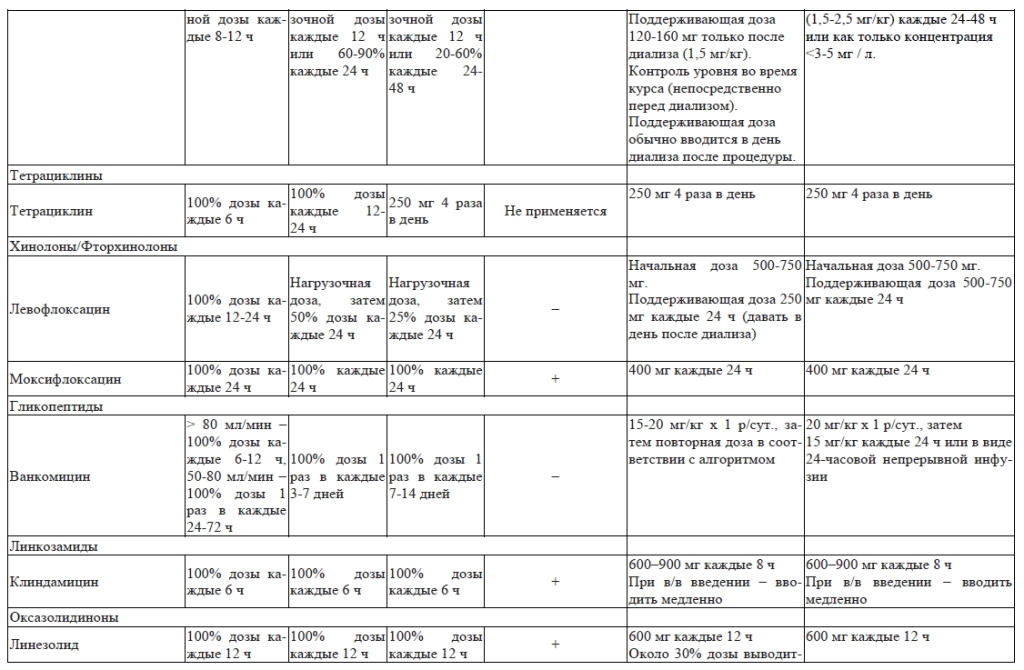
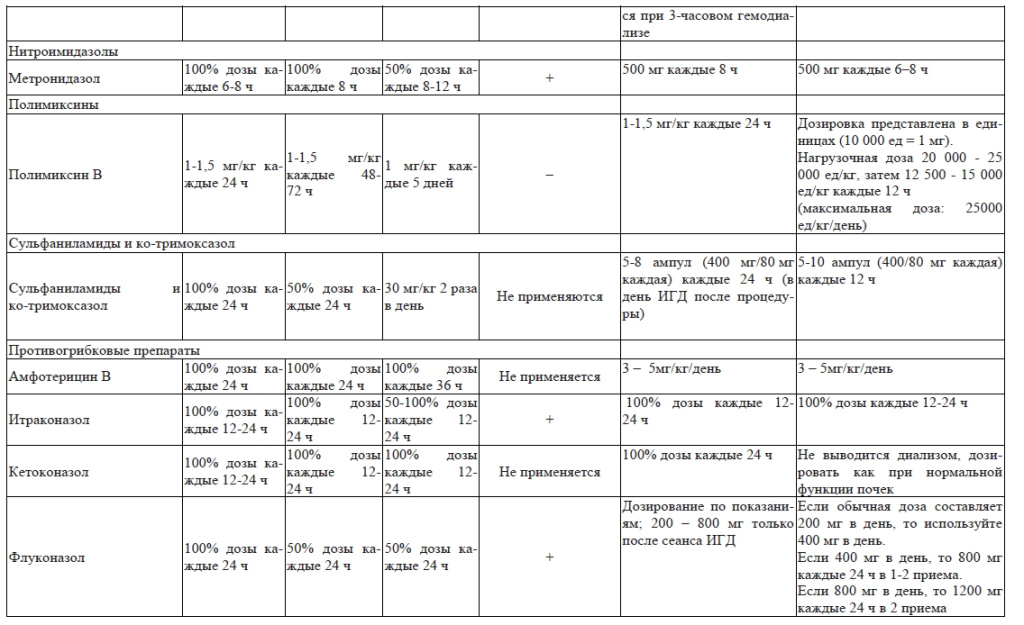
Приложение 4. Схемы лекарственной терапии инвазивного кандидоза (ИК) и кандидемии, аспергиллеза (ИА) и мукормикоза у взрослых и детей
|
№ |
МНН |
Рекомендуемые дозы АМП |
ЖНВЛП |
Примечание |
|
1 |
Анидулафун- гин |
взрослые: в/в в 1-е сутки 200 мг, затем по 100 мг 1 р/сут. дети старше 1 месяца: в/в в 1-е сутки 3 мг/кг (не бо- лее 200 мг), затем 1,5 мг/кг 1 р/сут. (не более 100 мг) |
Нет |
Препарат выбора для эмпири- ческой и целенаправленной те- рапии ИК. |
|
2 |
Каспофунгин |
взрослые: в/в в 1-е сутки 70 мг, затем по 50 мг 1 р/сут. дети: в/в в 1-е сутки 70 мг/м2, затем 50 мг/м2 1 р/сут. |
Да |
Препарат выбора для эмпири- ческой и целенаправленной те- рапии ИК. ИА - при невозможности назна- чения вориконазола. |
|
3 |
Микафунгин |
взрослые: в/в 100 мг 1 р/сут. дети с массой тела < 40 кг: в/в 2 мг/кг 1 р/сут. дети с массой тела > 40 кг в/в 100 мг 1 р/сут. |
Да |
Препарат выбора для эмпири- ческой и целенаправленной те- рапии ИК. |
|
4 |
Вориконазол |
взрослые: в/в в 1-е сутки 6 мг/кг 2 раза, затем по 4 мг/кг 2 р/сут. дети с 2 до 12 лет: в/в в 1-е сутки 9 мг/кг 2 р/сут., затем 8 мг/кг 2 р/сут. |
Да |
Препарат выбора для лечения аспергиллеза. ИК, вызванный чувствитель- ными к вориконазолу Candida spp., менингит и эндофтальмит, де-эскалационная терапия. |
|
5 |
Изавуконазол |
взрослые: в/в в 1-2-е сутки 200 мг 3 раза, затем 200 мг/сут. |
Нет |
Препарат выбора для терапии аспергиллеза. Лечение мукормикоза при не- возможности или неэффектив- ности применения липидных форм амфотерицина В, а также после стабилизации состояния пациента. |
|
6 |
Флуконазол |
взрослые: в/в или перорально в 1-е сутки 12 мг/кг, затем 6 мг/кг в сутки дети: в/в или перорально в 1-е сутки 12 мг/кг, затем 6 мг/кг в сутки |
Да |
Клинически стабильный паци- ент, возбудитель – C. albicans или другие чувствительные к флуконазолу Candida spp., ме- нингит и эндофтальмит, деэс- калационная терапия. |
|
7 |
Липосомаль- ный амфоте- рицин В |
взрослые: в/в 3-10 мг/кг/сут. дети старше 1 месяца: в/в 3-10 мг/кг/сут. |
Да |
Препарат выбора для лечения мукормикоза. Лечение ИК, ИА - при неэффективности, ток- сичности или недоступности эхинокандинов, вориконазола и изавуконазола. |
|
8 |
Липидный комплекс ам- фотерицина В |
взрослые: в/в 5 мг/кг/сут. дети: в/в 5 мг/кг/сут. |
Да |
Препарат выбора для лечения мукормикоза. Лечение ИК, ИА при неэффективности, токсич- ности или недоступности эхи- нокандинов, вориконазола и изавуконазола. |
Ссылки
1. - Энтеробактерии (представители порядка Enterobacterales), продуцирующие β-лактамазы расширенного спектра действия (БЛРС, альтернативная аббревиатура – ESBL);
- Энтеробактерии (представители порядка Enterobacterales), продуцирующие карбапенемазы;
- Pseudomonas aeruginosa, устойчивые к карбапенемам;
- Acinetobacter spp., устойчивые к карбапенемам;
- Stenotrophomonas maltophilia;
- Staphylococcus aureus, устойчивые к β-лактамамным антибиоткам, за исключением анти-MRSA-цефемов (метициллинорезистентные штаммы S. aureus – MRSA);
- Enterococcus spp., устойчивые к ванкомицину (VRE);
- Streptococcus pneumoniae, устойчивые к пенициллину
- Candida spp., устойчивые к флуконазолу;
- Aspergillus spp.;
- Возбудители мукормикозов.
2. Здесь и далее под тяжелой инфекцией понимается тяжелое течение превмонии, сепсис, септический шок.
Литература
1. Белобородов В.Б., Гусаров В.Г., Дехнич А.В., Замятин М.Н., Зубарева Н.А., Зырянов С.К., Камышова Д.А., Климко Н.Н., Козлов Р.С., Кулабухов В.В., Полушин Ю.С., Руднов В.А., Сидоренко С.В., Шлык И.В., Эдельштейн М.В., Яковлев С.В. Диагностика и антимикробная терапия инфекций, вызванных полирезистентными микроорганизмами. Методические рекомендации. / / Вестник анестезиологии и реаниматологии. - 2020. - Т. 17, № 1. - С. 52-83. DOI: 10.21292/2078-5658-2020-17-1-52-83.
2. Гусаров В.Г., Лашенкова Н.Н., Петрова Н.В. и др. Протоколы эмпирической антимикробной терапии как инструмент улучшения качества неотложной медицинской помощи пациентам с инфекцией в многопрофильном хирургическом стационаре // Медицинский алфавит. – 2016. – Т. 33, № 4. – Неотложная медицина. – С. 28–24.
3. Диагностика и лечение микозов в отделениях реанимации и интенсивной терапии: Российские рекомендации / Отв. ред. Н.Н. Климко. – 2-е изд. доп. и перераб. – М.: Фармтек, 2015. – 96 с.
4. Карпов О.Э., Гусаров В.Г., Замятин М.Н., Орлова О.А., Петрова Л.В., Камышова Д.А., Дементиенко М.В., Габоян Я.С., Пивкина А.И., Гриценко Е.А. Управление антибиотикорезистентностью в стационаре: современные реалии и перспективы // Клиническая микробиология и антимикробная химиотерапия. – 2020. – Т. 22. - № 4. – С. 277-286. DOI: 10.36488/cmac.2020.4.277-286.
5. Найговзина Н.В., Попова А.Ю., Бирюкова Е.Е. и др. Оптимизация системы мер борьбы и профилактики инфекций, связанных с оказанием медицинской помощи в Российской Федерации // ОРГЗДРАВ: Новости. Мнения. Обучение. Вестник ВШОУЗ. – 2018. – №. 1 (11). – C. 17-26. https://epidemiology- journal.ru/ru/archive/article/36040
6. Определение чувствительности к антимикробным препаратам. Клинические рекомендации //Интернет- портал главного внештатного специалиста Минздрава России по клинической микробиологии и анти- микробной резистентности. - https://www.antibiotic.ru/files/321/clrec-dsma2021.pdf
7. План мероприятий на 2019 – 2024 годы по реализации Стратегии предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 года. Утвержден распоряжением Правительства Российской Федерации от 30 марта 2019 г. № 604-р. https://www.garant.ru/products/ipo/prime/doc/71677266/
8. Попов Д. А. Сравнительная характеристика современных методов определения продукции карбапенемаз / Попов Д. А. // Клиническая микробиология и антимикробная химиотерапия. – 2019. – Т. 21. – №. 2 – С.125-133.
9. Практическое руководство по мониторингу антибиотикорезистентности с использованием платформы AMRcloud» https://monitoring.amrcloud.net/docs
10. Программа СКАТ (Стратегия Контроля Антимикробной Терапии) при оказании стационарной медицинской помощи: Российские клинические рекомендации /Под ред. С.В. Яковлева, Н.И. Брико, С.В. Сидоренко и др. – М.: Издательство «Перо», 2018. – 156 с.
11. Романов А.В., Дехнич А.В., Сухорукова М.В. и др. Антибиотикорезистентность нозокомиальных штаммов в стационарах России: результаты многоцентрового эпидемиологического исследования МАРАФОН в 2015-2016 г. // Клиническая микробиология и антимикробная химиотерапия. – 2019. – Т. 21. – С. 147- 159.
12. Штейнберг Л.Л., Упницкий А.А., Белоусов Ю.Б. Особенности применения карбапенемов в лечении нозокомиальной пневмонии // Лечебное дело. – 2014. – № 1. – C. 27-32.
13. Яковлев С.В., Суворова М.П., Белобородов В.Б., с соавт. Распространённость и клиническое значение нозокомиальных инфекций в лечебных учреждениях России: исследование ЭРГИНИ // Антибиотики и химиотерапия. – 2016. – Т. 61. – С. 5-6.
14. Aaftab G.P., Patil A.B., Medegar S. Multivariate analysis of risk factors for ESBL and AmpC producing Escherichia coli and Klebsiella pneumoniae at a Tertiary Care Hospital in Karnataka: A case control study // Indian Journal of Microbiology Research. – 2018. – Vol. 5, № 1. – P. 1-6. doi:10.18231/2394-5478.2018.0001
15. Aloush V., Navon-Venezia, S., Seigman-Igra Y. et al. Multidrug-resistant Pseudomonas aeruginosa: risk fac- tors and clinical impact // Antimicrobial agents and chemotherapy. – 2006. – Vol. 50, №1. – P. 43-48. doi:10.1128/AAC.50.1.43-48.2006
16. Ashley C., Dunleavy A. The renal drug handbook: the ultimate prescribing guide for renal practitioners. 5th edition. CRC Press Taylor & Francis Group, 2019 Paperback: 1108 pp. – ISBN-10: 9781138624511
17. Bassetti M., Righi E. New antibiotics and antimicrobial combination therapy for the treatment of gram- negative bacterial infections // Current opinion in critical care. – 2015. – Vol. 21, №. 5. – P. 402-411. doi: 10.1097/MCC.0000000000000235
18. Bassetti M., Righi E., Carnelutti A. Bloodstream infections in the intensive care unit // Virulence. – 2016. – Vol. 7, № 3. – P. 267-279. doi: 10.1080/21505594.2015.1134072
19. Bush K., Jacoby G.A., Medeiros A.A. A functional classification scheme for beta-lactamases and its correlation with molecular structure // Antimicrobial agents and chemotherapy. – 1995. – Vol. 39, №. 6. – P. 1211- 1233. doi: 10.1128/AAC.39.6.1211
20. Callejo-Torre F., Bouza J.M.E., Astigarraga P.O. et al. Risk factors for methicillin-resistant Staphylococcus aureus colonisation or infection in intensive care units and their reliability for predicting MRSA on ICU ad- mission // Europe. – 2016. – Vol. 5. – P. 1-9. PMID: 27668900
21. Cao B., Wang H., Sun H., et al. Risk factors and clinical outcomes of nosocomial multi-drug resistant Pseudomonas aeruginosa infections // Journal of Hospital Infection. – 2004. – Vol. 57, № 2. – P. 112-118. doi:10.1016/j.jhin.2004.03.021
22. Cornely O., Alastruey-Izquierdo A., Arenz D. et al. Global guideline for the diagnosis and management of mucormycosis: An initiative of the European Confederation of Medical Mycology in cooperation with the Mycoses Study Group Education and Research Consortium // The Lancet Infect Dis. – 2019. – Vol. 12. – e405-e421 doi: 10.1016/S1473-3099(19)30312-3
23. 23.De Pascale G., Montini L., Pennisi M.A. et al. High dose tigecycline in critically ill patients with severe in- fections due to multidrug-resistant bacteria // Critical Care. – 2014. – Vol. 18, № 3. – R90. doi:10.1186/cc13858
24. 24.Dellit T.H. Owens R.C., McGowan J.E. et al. Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America guidelines for developing an institutional program to enhance antimicrobial stewardship // Clinical Infectious Diseases. – 2007. – Vol. 44, № 2. – P. 159-177. doi: 10.1086/510393
25. 25.Doumith M., Ellington M.J., Livermore D.M. et al. Molecular mechanisms disrupting porin expression in ertapenem-resistant Klebsiella and Enterobacter spp. clinical isolates from the UK // Journal of Antimicrobial Chemotherapy. – 2009. – Vol. 63, № 4. – P. 659-667. doi: 10.1093/jac/dkp029
26. 26.Doyle D., Peirano G., Lascols C. et al. Laboratory detection of Enterobacteriaceae that produce carbapenemases // Journal of clinical microbiology. – 2012. – Vol. 50, №. 12. – P. 3877-3880. doi: 10.1128/JCM.02117-12
27. Evans L., Rhodes A., Alhazzani W. et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2021 // Intensive Care Med. – 2021. – Vol. 47, №11. – P. 1181-1247. doi.org/10.1007/s00134-021-06506-y
28. Duin D., Arias C. A., Komarow L., Chen L. et al. Molecular and clinical epidemiology of carbapenemresistant Enterobacterales in the USA (CRACKLE-2): a prospective cohort study // The Lancet Infectious Diseases.- 2020.- Vol. 20.- № 6.- P. 731-741. doi: 10.1016/S1473-3099(19)30755-8
29. European Centres for Disease Prevention and Control (ECDC). Antimicrobial resistance surveillance in Europe 2011. Annual report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). https://www.ecdc.europa.eu/en/publications-data/antimicrobial-resistance-surveillance-europe-2011
30. Falcone M., Russo A., Venditti M. et al. Considerations for higher doses of daptomycin in critically ill patients with methicillin-resistant Staphylococcus aureus bacteremia // Clinical infectious diseases. – 2013. – Vol. 57,
№ 11. – P. 1568-1576. doi:10.1093/cid/cit582
31. Gazin M., Lammens, C., Goossens, H. et al. Evaluation of GeneOhm VanR and Xpert vanA/vanB molecular assays for the rapid detection of vancomycin-resistant enterococci // European journal of clinical microbiology & infectious diseases. – 2012. – Vol. 31, № 3. – P. 273-276. doi: 10.1007/s10096-011-1306-y
32. Ghibu L., Miftode E., Teodor A. et al. Risk factors for Pseudomonas aeruginosa infections, resistant to carbapenem // Revista medico-chirurgicala a Societatii de Medici si Naturalisti din Iasi. – 2010. – Vol. 114, № 4. – P. 1012-1016. PMID: 21500452
33. Giske C.G., Gezelius L., Samuelsen O. et al. A sensitive and specific phenotypic assay for detection of metallo‐β‐lactamases and KPC in Klebsiella pneumoniae with the use of meropenem disks supplemented with aminophenylboronic acid, dipicolinic acid and cloxacillin // Clinical microbiology and infection. – 2011. – Vol. 17, № 4. – P. 552-556. doi: 10.1111/j.1469-0691.2010.03294.x.
34. Gniadkowski M. Evolution of extended‐spectrum β‐lactamases by mutation // Clinical microbiology and in- fection. – 2008. – Vol. 14. – P. 11-32. doi.org/10.1111/j.1469-0691.2007.01854.x
35. Gomez F., Veita J., Laudanski K. Antibiotics and ECMO in the Adult Population - Persistent Challenges and Practical Guides//Antibiotics.-2022.- №11, 338. https:// doi.org/10.3390/antibiotics11030338
36. Goyal D., Dean N., Neill S., et al. Risk Factors for community-acquired extended-spectrum beta-lactamase- producing enterobacteriaceae infections – a retrospective study of symptomatic urinary tract infections // Open forum infectious diseases. – US: Oxford University Press, 2019. – Vol. 6. – № 2. doi.org/10.1093/ofid/ofy357
37. Grabein B., Graninger W., Baño J. et al. Intravenous fosfomycin-back to the future. Systematic review and meta-analysis of the clinical literature // Clinical Microbiology and Infection. – 2017. – Vol. 23. – №. 6. – P. 363-372. doi: 10.1016/j.cmi.2016.12.005
38. Greissl C., Saleh A., Hamprecht A. Rapid detection of OXA-48-like, KPC, NDM, and VIM carbapenemases in Enterobacterales by a new multiplex immunochromatographic test / Greissl C., Saleh A., Hamprecht A. // European Journal of Clinical Microbiology & Infectious Diseases. – 2019. – Vol. 38. – №. 2. – P. 331-335. doi: 10.1007/s10096-018-3432-2
39. Haley C.C., Mittal D., LaViolette A., et al. Methicillin-resistant Staphylococcus aureus infection or colonization present at hospital admission: multivariable risk factor screening to increase efficiency of surveillance culturing // Journal of clinical microbiology. – 2007. – Vol. 45, № 9. – P. 3031-3038. doi: 10.1128/JCM.00315-07
40. Hahn J., Choi J.H., Chang M.J. Pharmacokinetic changes of antibiotic, antiviral, antituberculosis and antifungal agents during extracorporeal membrane oxygenation in critically ill adult patients. J Clin Pharm Ther. 2017; 42: 661– 671. https://doi.org/10.1111/jcpt.12636
41. Hovan M. R., Narayanan N., Cedarbaum V., Bhowmick T., Kirn T. J. Comparing Mortality in Patients with Carbapenemase-Producing Carbapenem Resistant Enterobacterales and non-Carbapenemase-Producing Carbapenem Resistant Enterobacterales Bacteremia // Diagnostic Microbiology and Infectious Disease.- 2021.- P. 115505. doi: 10.1016/j.diagmicrobio.2021.115505
42. Kao K.C., Chen C.B., Hu H.C. et al. Risk factors of methicillin-resistant Staphylococcus aureus infection and correlation with nasal colonization based on molecular genotyping in medical intensive care units: a prospective observational study // Medicine. – 2015. – Vol. 94, № 28. – e1100. doi: 10.1097/MD.0000000000001100.
43. Merchant S., Proudfoot E.M., Quadri H.N. et al. Risk factors for Pseudomonas aeruginosa infections in AsiaPacific and consequences of inappropriate initial antimicrobial therapy: A systematic literature review and meta-analysis // Journal of global antimicrobial resistance. – 2018. – Vol. 14. – P. 33-44. doi: 10.1016/j.jgar.2018.02.005
44. Nicolas-Chanoine M.H., Vigan M., Laouenan C. et al. Risk factors for carbapenem-resistant Enterobacteriaceae infections: a French case-control-control study // European Journal of Clinical Microbiology & Infectious Diseases. – 2019. – Vol. 38, № 2. – P. 383-393. doi: 10.1007/s10096-018-3438-9.
45. Ohmagari N., Hanna H., Graviss L. et al. Risk factors for infections with multidrug‐resistant Pseudomonas aeruginosa in patients with cancer // Cancer. – 2005. – Vol. 104, №. 1. – P. 205-212. doi: 10.1002/cncr.21115
46. Pappas P.G., Kauffman C.A., Andes D.R. et al. Clinical practice guideline for the management of candidiasis: 2016 update by the Infectious Diseases Society of America // Clinical Infectious Diseases. – 2016. –Vol. 62. – e1–50. doi: 10.1093/cid/civ933
47. Paul M., Carrara E., Retamar P. et al. European Society of Clinical Microbiology and Infectious Diseases (ESCMID) guidelines for the treatment of infections caused by multidrug-resistant Gram-negative bacilli (endorsed by European society of intensive care medicine)// Clinical Microbiology and Infection, https://doi.org/10.1016/j.cmi.2021.11.025
48. Platteel T.N., Stuart J.C., Voets G.M. et al. Evaluation of a commercial microarray as a confirmation test for the presence of extended‐spectrum β‐lactamases in isolates from the routine clinical setting // Clinical Microbiology and Infection. – 2011. – Vol. 17, № 9. – P. 1435-1438. doi: 10.1111/j.1469-0691.2011.03567.x.
49. Predic M., Delano J.P., Tremblay E. et al. Risk factors for carbapenem-resistant Enterobacteriaceae infection // American Journal of Infection Control. – 2017. – Vol. 45, № 6. – P. S14. doi: doi.org/10.1016/j.ajic.2017.04.271
50. Queenan A.M., Bush K. Carbapenemases: the versatile β-lactamases // Clinical microbiology reviews. – 2007.
– Vol. 20, №. 3. – P. 440-458. doi: 10.1128/CMR.00001-07
51. Red Book. 29 Edition; American Academy of Pediatrics. – 2012. 1058 pp. ISBN-10: 158110703X
52. Rybak M.J, Pharm D., Le J. et al. Therapeutic monitoring of Vancomycin for serious methicillin-resistant Staphylococcus aureus infections: A revised consensus guideline and review by the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, the Pediatric Infectious Diseases Society, and the Society of Infectious Diseases Pharmacists // American Journal of Health-System Pharmacy. – 2020. – Vol. 77, Is. 11. – P. 835–864. https://doi.org/10.1093/ajhp/zxaa036
53. Sfeir M.M., Hayden J.A., Fauntleroy K.A. et al. EDTA-Modified Carbapenem Inactivation Method: a Phenotypic Method for Detecting Metallo-β-Lactamase-Producing Enterobacteriaceae // Journal of clinical microbiology. – 2019. – Vol. 57, № 5. doi:10.1128/JCM.01757-18.
54. Søraas A., Sundsfjord A., Sandven I. et al. Risk factors for community-acquired urinary tract infections caused by ESBL-producing Enterobacteriaceae-a case-control study in a low prevalence country // PloS one. – 2013.
– Vol. 8, № 7. – e 69581. doi:10.1371/journal.pone.0069581.
55. Taccone F.S., Laterre P.F., Spapen H. et al. Revisiting the loading dose of amikacin for patients with severe sepsis and septic shock // Critical care. – 2010. – Vol. 14. – №. 2. – P. R53. doi.org/10.1093/cid/ciq146
56. The Sanford Guide to Antimicrobial Therapy 2014. 44 Edition. 243 pp. ISBN-10: 1930808801
57. Tuon F.F., Kruger M., Terreri M. et al. Klebsiella ESBL bacteremia-mortality and risk factors // Brazilian Journal of Infectious Diseases. – 2011. – Vol. 15, № 6. – P. 594-598. doi: 10.1590/s1413- 86702011000600016
58. Udy A.A., Baptista J.P., Lim N.L. et al. Augmented renal clearance in the ICU: results of a multicenter observational study of renal function in critically ill patients with normal plasma creatinine concentrations // Critical care medicine. – 2014. – Vol. 42, № 3. – P. 520-527. doi: 10.1097/CCM.0000000000000029
59. Ullmann A.J., Aguado J.M., Arikan-Akdagli S. et al. Diagnosis and management of Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline // Clin Microbiol Infect. – 2018. – Vol. 24 (Suppl 1). – e1-e38. doi: 10.1016/j.cmi.2018.01.002.
60. Vading M., Samuelsen Ø., Haldorsen B. et al. Comparison of disk diffusion, Etest and VITEK2 for detection of carbapenemase producing Klebsiella pneumoniae with the EUCAST and CLSI breakpoint systems // Clinical Microbiology and Infection. – 2011. – Vol. 17, № 5. – P. 668-674. doi: 10.1111/j.1469-0691.2010.03299.x
61. Van der Zwaluw K., de Haan A., Pluister G.N. et al. The carbapenem inactivation method (CIM), a simple and low-cost alternative for the Carba NP test to assess phenotypic carbapenemase activity in gram-negative rods
// PloS one. – 2015. – Vol. 10, № 3. – P. e0123690. doi: 10.1371/journal.pone.0123690
62. Van Dijk K., Voets G.M., Scharringa J. et al. A disc diffusion assay for detection of class A, B and OXA-48 carbapenemases in Enterobacteriaceae using phenyl boronic acid, dipicolinic acid and temocillin // Clinical Microbiology and Infection. – 2014. – Vol. 20, № 4. – P. 345-349. https://www.clinicalmicrobiologyandinfection.com/article/S1198-743X(14)60285-8/pdf
63. Wener K.M., Schechner V., Gold H.S. et al. Treatment with fluoroquinolones or with β-lactam-β-lactamase inhibitor combinations is a risk factor for isolation of extended-spectrum-β-lactamase-producing Klebsiella species in hospitalized patients // Antimicrobial agents and chemotherapy. – 2010. – Vol. 54, № 5. doi:10.1128/AAC.01131-09.
64. WHO: Antimicrobial resistance: global report on surveillance, 2014.
65. Willemsen I., Overdevest I., al Naiemi N. et al. New diagnostic microarray (Check-KPC ESBL) for detection and identification of extended-spectrum beta-lactamases in highly resistant Enterobacteriaceae // Journal of clinical microbiology. – 2011. – Vol. 49. – №. 8. – P. 2985-2987. doi: 10.1128/JCM.02087-10.
66. Yu Z., Pang X., Wu X. et al. Clinical outcomes of prolonged infusion (extended infusion or continuous infusion) versus intermittent bolus of meropenem in severe infection: A meta-analysis // PloS one. – 2018. – Vol. 13, № 7. – e0201667. doi: 10.1371/journal.pone.0201667
67. Zaha D.C., Kiss R., Hegedűs C. et al. Recent advances in investigation, prevention, and management of healthcare-associated infections (hais): resistant multidrug strain colonization and its risk factors in an Intensive Care Unit of a University Hospital // BioMed Research International. – 2019. doi: 10.1155/2019/2510875.
68. Zamyatin M., Gusarov V., Petrova N. et al. Results of
antimicrobial stewardship programme implementation in multidisciplinary hospital // ICU Management & Practice.
2018 – Vol. 18. – №2. – P. 125-127. https://healthmanagement.org/c/icu/issuearticle/results-of-antimicrobial-stewardship-programme- implementation-in-multidisciplinary-hospitai
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ