Не-катехоламиновые вазопрессоры в лечении взрослых пациентов с септическим шоком
Zhong et al. Journal of Intensive Care (2020) 8:83
Не-катехоламиновые вазопрессоры в лечении взрослых пациентов с септическим шоком - доказательства из мета-анализов и последовательных анализов рандомизированных клинических исследований
Перевод оригинальной статьи «Non-catecholamine vasopressors in the treatment of adult patients with septic shock—evidence from meta-analysis and of randomized clinical trials»
Авторы: Lei Zhong, Xiao-Wei Ji, Hai-Li Wang, Guang-Ming Zhao, Qing Zhou, Bo Xie
Department of Intensive Care Units, Huzhou Central Hospita, Affiliated Central Hospital, HuZhou University, 198 Hongqi Rd, Huzhou 313000, Zhejiang, PR China.
Department of Obstetrics and Gynecology, Huzhou Central Hospital, Affiliated Central Hospital, Huzhou University, Huzhou 313000, Zhejiang, PR China. Department of Intensive Care Unit, Affiliated Hospital of Yangzhou University, Yangzhou 225000, Jiangsu Province, PR China.
Keywords: Norepinephrine, Vasopressin, Pituitrin, Terlipressin, Selepressin, Angiotensin II, Septic shock
Ключевые слова: норэпинефрин, вазопрессин, питуитрин, терлипрессин, селепрессин, ангиотензин II, септический шок
Введение
Септический шок, как разновидность сепсиса, есть состояние, которое характеризуется персистирующей гипотензией, требующей введения вазопрессоров для поддержания среднего артериального давления (САД) на уровне ≥ 65 мм Hg, и высоким, > 2 ммоль/л, уровнем сывороточного лактата и все это несмотря на интенсивную инфузионную терапию [1]. Недавние эпидемиологические данные из Европы и Северной Америки показывают, что частота инцидентов септического шока у взрослых пациентов в отделениях интенсивной терапии (ОИТ) составляет при поступлении около 10,4%, а во время нахождения в ОИТ частота инцидентов септического шока составляет около 8,3%, при этом летальность остается около 38% [2]. Для улучшения выживаемости пациентов с септическим шоком имеет значение своевременное и соответствующее лечение, составляющими которого являются адекватный введённый объем жидкости, применение антибиотиков и применение вазопрессоров.
На сегодня норэпинефрин (НЭ), катехоламиновый вазопрессор, остается препаратом первой линии для лечения септического шока, и который рекомендован к применению клиническим руководством Surviving Sepsis Campaign (SSC) 2016 года для достижения целевого значения САД ≥ 65 мм Hg [3]. Вместе с тем, достижение целевого значения САД может потребовать введения больших доз НЭ, что увеличивает риск ишемии миокарда, мезентериальных сосудов, пальцевой ишемии наряду с развитием аритмий, что все вместе повышает летальность [4, 5]. Как это не прискорбно признавать, но около 7% пациентов, находящихся в критическом состоянии, имеют тенденцию к отсутствию ответа на увеличение дозы НЭ (рефрактерный шок) даже несмотря на своевременное распознавание, диагностику и лечение септического шока и в этом случае краткосрочная летальность увеличивается до 50% [6]. Введение не-катехоламиновых вазопрессоров (вазопрессин/питуитрин, терлипрессин, селепрессин/ангиотензин II) либо как альтернатива НЭ, либо в дополнение к НЭ, может принести пользу для пациентов с септическим шоком, особенно для случаев с резистентным к катехоламинам септическим шоком.
Вазопрессин (ВП) является не-специфическим агонистом V1, V2 и V3 рецепторов и принадлежит к полипептидным гормонам [7]. Обоснованием применения ВП может послужить и как его относительная/абсолютная недостаточность при септическом шоке, так и эффект вазоконстрикции, в основном за счет V1 рецептора в гладких мышцах сосудов, что приводит к восстановлению сосудистого тонуса, достижению целевого значения САД, к снижению потребности в катехоламинах [8, 9]. Терлипрессин (ТП) является синтетическим аналогом ВП, селективным к V1, что также приводит к снижению потребности в НЭ, а отсутствие активации V2 помогает избежать побочных эффектов [10]. Селепрессин, новейший агонист V1, может быть полезен пациентам с септическим шоком из-за полного отсутствия V2 активности [11]. Ангиотензин II (AT-II) как полипетидный гормон ренин-ангиотензин-альдостероновой системы, представляет собой мощный вазопрессор, индуцирующий вазоконстрикцию за счет активации рецепторов AT-II тип 1 [12].
За последние десять лет, начиная с момента первой публикации рандомизированного клинического исследования (РКИ), посвященного вопросу применения не-катехоламиновых вазопрессоров при лечении септического шока, уже получено несколько благоприятных результатов на этом поле исследований [13-15]. И наоборот, все эти многообещающие результаты не подтвердились в других исследованиях [16-28]. Понимая такие конфликтующие результаты, мы, тем не менее, провели данное исследование с целью изучения существования связи между не-катехоламиновыми вазопрессорами в сочетании с НЭ и улучшением выживаемости среди взрослых пациентов с септическим шоком.
Методы
Наш мета-анализ основан на предпочтительных элементах для проведения систематических обзоров и мета-анализов, указанных в руководствах (PRISMA) (дополнительный файл 1) [29]. С целью определения клинического вопроса мы использовали структуру PICO (дополнительный файл 2).
Стратегия поиска и критерии выбора
Два автора (ZL и JXW), независимо друг от друга, проводили поиск в базах данных PubMed, Embase, Cochrane Library, окончание которого датировалось 30 апреля 2020 года, без ограничений по языку, отбирались все РКИ, в которых сравнивалось применение не-катехоламиновых вазопрессоров с НЭ и изучалась летальность у взрослых пациентов с септическим шоком. Все термины, что применялись в стратегии поиска, приведены в дополнительном файле 2. Критерии исключения: возраст менее 16 лет, сообщения о случаях, письма, комментарии, сдвоенные публикации, обзоры, исследования «случай/контроль», когортные исследования и исследования на животных. Приемлемость исследований определялась двумя авторами (ZL и JXW) независимо друг от друга.
Извлечение данных и оценка результатов
Оба автора, независимо и в двух экземплярах, извлекали данные, которые затем проверялись другими авторами. Извлеченные данные приведены в таблице 1. Во время всего процесса поиска литературы были обнаружены различия во времени летальности (6/24 часа/3/7/14/28/30/90/180 дней/госпитальная летальность/ летальность в ОИТ). Летальность на 30 сутки считалась 28-ми дневной летальностью. В итоге мы провели анализ четырех временных точек летальности (28/90 дней, летальность в ОИТ/госпитале), что клинически имеет очень важное значение.
Первичным результатом исследования была 28-ми дневная летальность. Вторичными результатами послужили: 90 дневная летальность, летальность в ОИТ и в госпитале, длительность нахождения пациента в ОИТ, длительность госпитализации, длительность продолженной почечно-заместительной терапии (ППЗТ) и длительность механической вентиляции (МВ), частота успешного разрешения шока к шестому часу терапии и осложнения (гипонатриемия, пальцевая ишемия, острое почечное повреждение), а также параметры гемодинамики и метаболизма (48 часов), частота сердечных сокращений (ЧСС), сывороточный креатинин, сердечный индекс, среднее артериальное давление, среднее давление в легочной артерии, центральное венозное давление, индекс транспорта кислорода, лактат, индекс работы левого желудочка, индекс оксигенации, давление заклинивания легочной артерии, индекс сопротивления легочных сосудов, давление в правом предсердии, gastric-mucosal arterial carbon dioxide partial pressure difference, PH, индекс работы правого желудочка, индекс ударного объема, индекс системного сосудистого сопротивления, сатурация смешанной венозной крови, темп диуреза, индекс потребления кислорода.
Оценка качества исследования
Качество подходящих работ оценивалось двумя авторами (ZL и WHL) в соответствии с the Cochrane Handbook for systemic reviews of interventions [35].
Оценка риска предвзятости
В этом исследовании использовался анализ чувствительности для оценки устойчивости совокупного эффекта. Кроме того, систематическая ошибка публикации была оценена с помощью воронкообразного графика, Begg’s Test, Egger’s Test [35].
Статистический анализ
Объединенные эффекты для дихотомических и непрерывных результатов были выражены как относительный риск (RR) с 95% доверительным интервалом (CI) и стандартная разница средних (SMD) с 95% CI, соответственно. Поскольку данные нескольких исследований были представлены в виде медианы и диапазона/межквартильного размаха, мы рассчитали среднее значение и стандартное отклонение по формуле, предоставленной Wan и его коллегами [36]. Неоднородность включенных испытаний определялась тестом X 2, значениями P и статистикой I2. Учитывая консервативность моделей случайных эффектов, мы использовали эту модель для всего объединенного анализа [37]. Мы также провели пробный последовательный анализ (TSA) с использованием модели случайных эффектов, чтобы контролировать риски случайных ошибок из-за разреженных данных и повторяющегося тестирования совокупных данных. Данные были получены с использованием Review Manager Version 5.3.5 (http://tech.cochrane.org/revman/download), TSA 0.9.5.10 beta (http://www.ctu.dk/tsa/downloads.aspx), and Stata 12.0 software (StataCorp, College Station, TX, USA). Все статистические тесты были проанализированы с использованием двустороннего уровня α 0,05.
Исследование Gordon [38], являющееся частью включенного исследования VASST [17], в основном изучает сердечно-легочные эффекты ВП по сравнению с НЭ при септическом шоке. Поэтому мы включили это исследование для анализа гемодинамических параметров. Более того, некоторые данные, представляющие интерес в Dunser [30], получены из ранее опубликованного мета-анализа индивидуальных данных пациентов [39].
Кроме того, был произведен анализ подгрупп в соответствии с риском систематической ошибки (низкий риск против высокого риска), не-катехоламиновые вазопрессоры (ВП против аналогов ВП против AT-II) и типами шока (резистентный к катехоламинам рефрактерный шок против септического шока). Одновременно с этим был проведен кумулятивный мета-анализ подходящих исследований, сравнивающих НЭ с не-катехоламиновыми вазопрессорами в снижении 28-дневной летальности у взрослых пациентов с септическим шоком на основе года публикации.
Результаты
Не было РКИ, соответствующих нашему PICO, поэтому все подходящие статьи были исследованы на дополнительный эффект не-катехоламинов. Таким образом, мы сравнили эффект между не-катехоламиновыми вазопрессорами + катехоламины и группой НЭ (катехоламины).
Поиск результатов и характеристики исследования
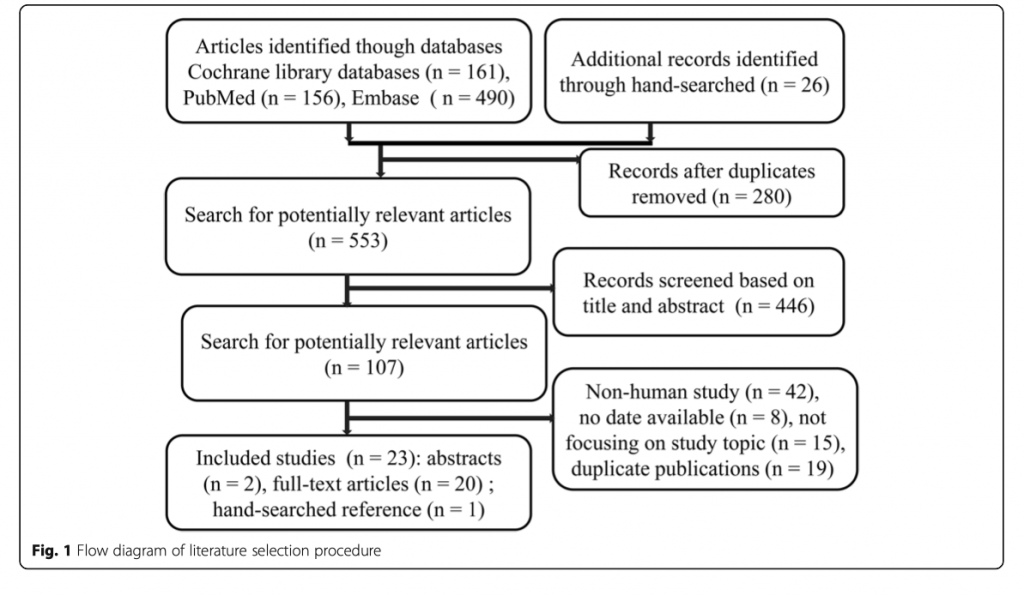
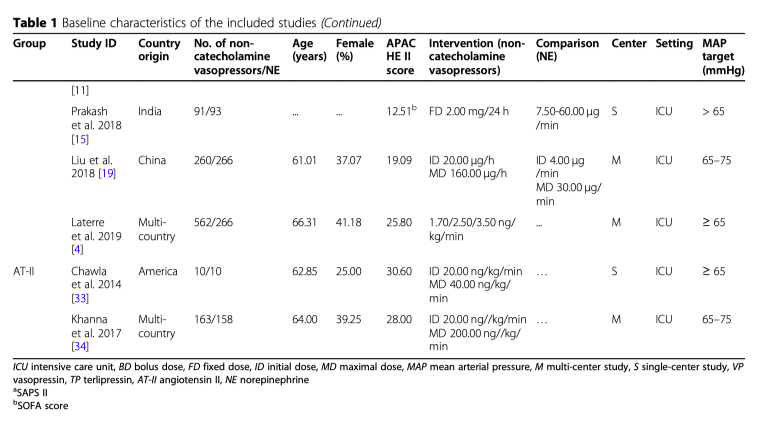
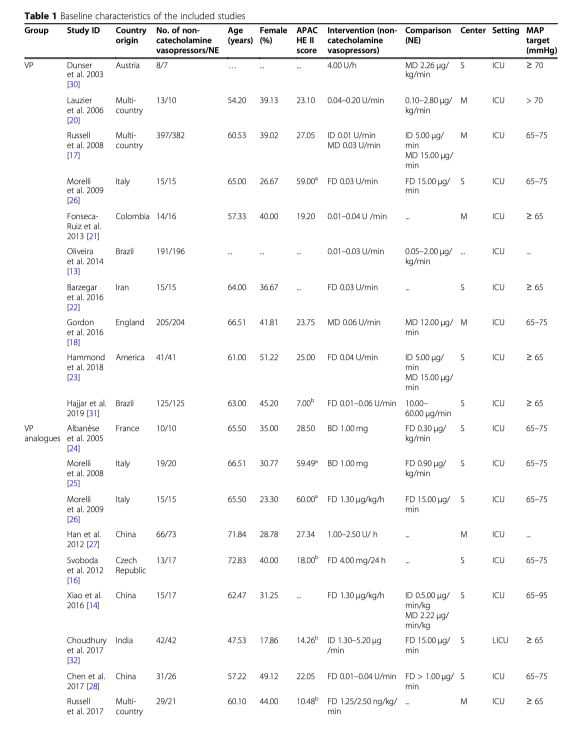
Чарт, отображающий селекцию исследований показан на рисунке 1. До 30 апреля 2020 года мы извлекли 807 записей и 23 исследования, в которых сообщалось о 4380 пациентах в шоке, которые вошли в окончательный анализ (21 полноразмерный текст и 2 реферата). Все работы были сделаны: в австрии [30] (n = 1), Франции [24] (n = 1), Иране [22] (n = 1), Республике Чехия [16] (n = 1), в Англии [18] (n = 1), Колумбии [21] (n = 1), Бразилии [13, 31] (n = 2), Индии [15, 32] (n = 2), Италии [25, 26] (n = 2), tв США [23, 33] (n = 2), Китае [14, 19, 27, 28] (n = 4) в других странах [4, 11, 17, 20, 34] (n = 5). Все эти исследования из ОИТ были опубликованы в период между 2003 и 2019 гг., средний возраст составил от 47.53 до 72.83 лет. Процент женщин варьировался от 17.86 до 51.22%, средняя оценка по шкале APACHE II наводилась между 19.09 и 30.60. Источником инфекции в 43.1% случаях были нижние дыхательные пути, в 29,4% - брюшная полость, в 7.8% - мочевой тракт, а кожа и мягкие ткани были источником инфекции в 3.21%, кровь 2.2%, другие источники в 18,4%. Базовые характеристики включенных исследований показаны в таблице 1.
Оценка качества исследований
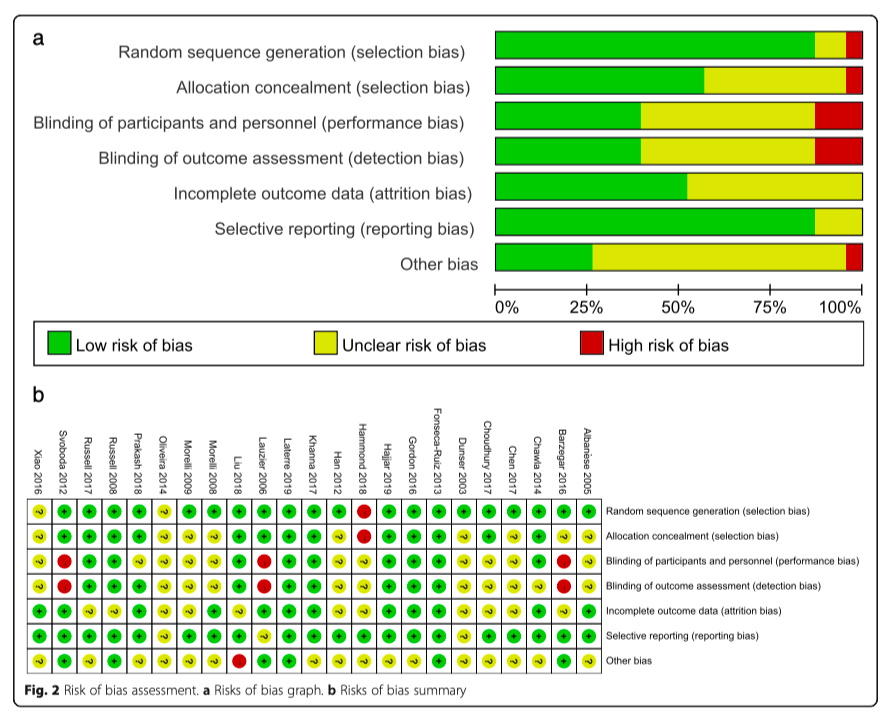
Риск предвзятости во включенных работах изображен на рисунке 2. В трех исследованиях [16, 20, 22] существовал высокий риск ошибки как производительности, так и обнаружения из-за отсутствия ослепления. В исследовании Liu [19] был высокий риск других потенциальных источников систематической ошибки из-за преждевременного прекращения графика. Исследование Hammond [23] было предметом систематической ошибки отбора, поскольку на вывод могли повлиять эффекты сезонности - метод распределения в этом исследовании был основан на заранее установленном периоде времени, а не на принципе рандомизации.
Анализ чувствительности и оценка систематических ошибок
Анализ чувствительности показал, что ни одно исследование не оказало существенного влияния на объединенный RR, что свидетельствует о стабильности и надежности результатов (28-дневная летальность).
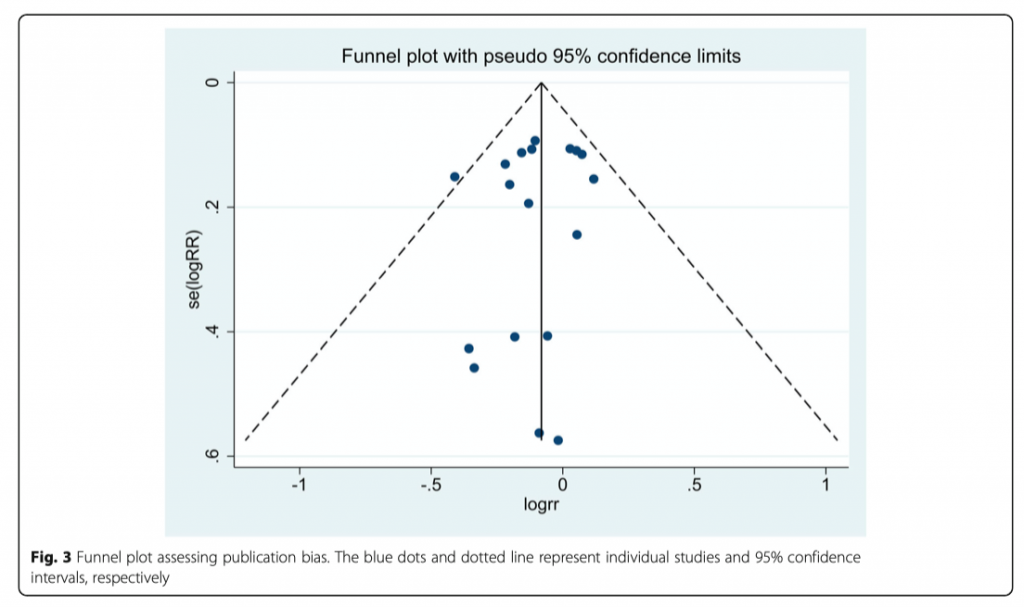
Как отмечено на рисунке 3, при визуальном осмотре воронкообразного графика не наблюдалось значительной систематической ошибки публикации первичного результата (28-дневная летальность) среди включенных исследований, что было подтверждено статистическими тестами (Begg test, P = 1.00; Egger test, P = 0.47; дополнительный файл 3).
Синтез первичных результатов
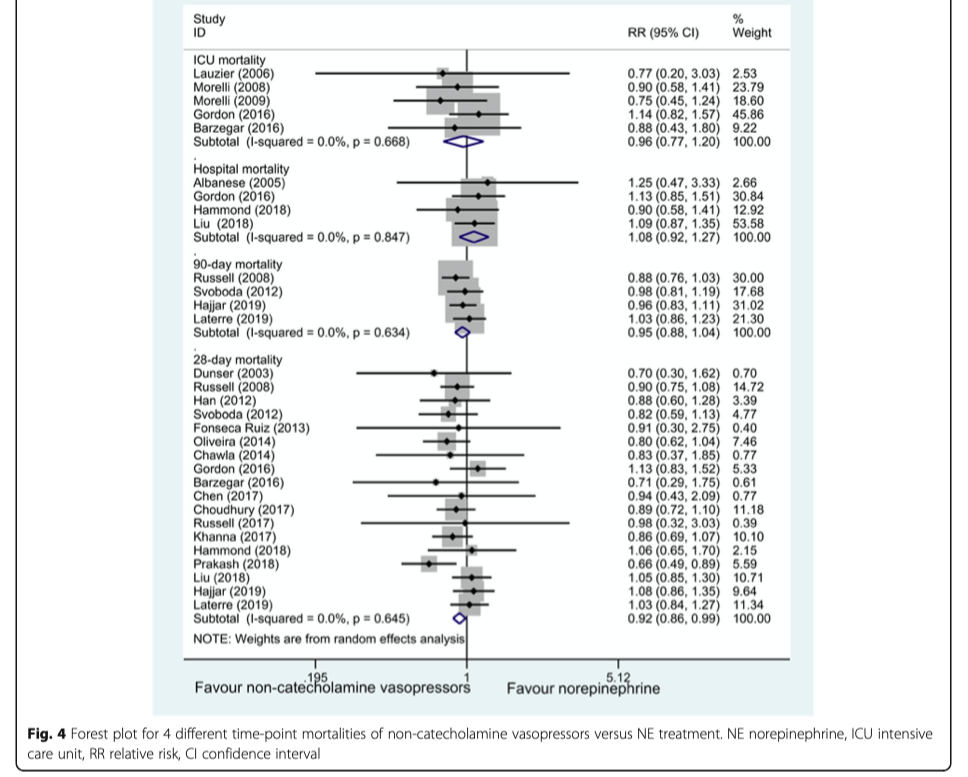
Летальность по четырем временным точкам (28/90 дней, ОИТ, госпиталь) были доступны в 23 исследованиях 4380 пациентов. По сравнению с группой НЭ, лечение не-катехоламиновыми вазопрессорами плюс НЭ ассоциировалось с незначительным снижением 28-ми дневной летальности (n = 4217; RR, 0.92; 95% CI 0.86–0.99; P = 0.02), с незначительной гетерогенностью исследований, при этом не было значительного эффекта на 90 дневную летальность, летальность в ОИТ и в госпитале (P > 0.05, Рис. 4).
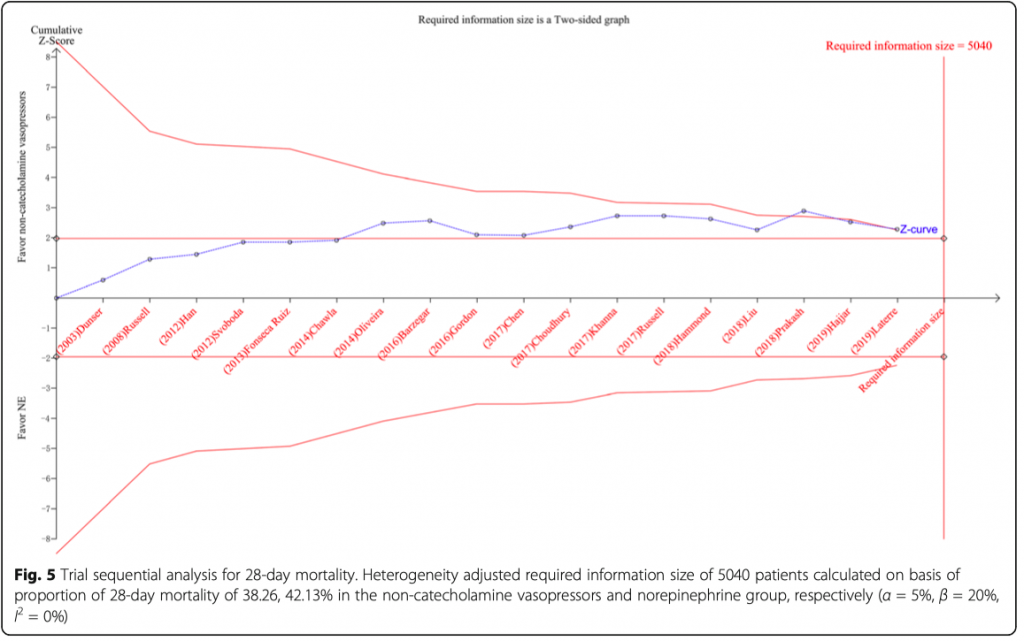
Результат TSA 28-дневной летальности показал, что было накоплено 4217 (83,67%) из необходимого объема информации (RIS) 5040 пациентов. Хотя кумулятивная Z-кривая (синяя линия) явно превзошла обычную линию границы и немного скорректировала линию границы в пользу группы вмешательства, все таки она не достигла оптимального размера информации, что указывает на потенциальную возможность отрицательного результата (Рис. 5).
Результаты анализа нескольких конечных точек представлены в таблице 2.
Синтез вторичных результатов
Время госпитализации, нахождения в ОИТ, ППЗТ и МВ
У всех пациентов значительно меньшее снижение длительности МВ (SMD = − 0.19; 95% CI = − 0.31 to − 0.07; P < 0.01) отмечалось в группе не-катехоламиновых вазопрессоров, но такой эффект не касался длительности нахождения пациента в ОИТ и в госпитале, длительности ППЗТ, с различными уровнями гетерогенности среди исследования (дополнительный файл 3).
Успешное разрешение шока к шестому часу и частота инцидентов с осложнениями
Объединенный анализ показал, что группа не-катехоламиновых вазопрессоров выявила значительную разницу в успешном разрешении шока к 6 часу (n = 330; RR, 1.14; 95% CI = 1.05 to 1.23; P < 0.01), ППЗТ (n = 869; RR, 0.71;95% CI = 0.56 to 0.89; P < 0.01), гипонатриемия (n = 1584; RR, 1.51; 95% CI = 1.04 to 2.20; P = 0.03), пальцевой ишемии (n = 3329; RR, 2.43; 95% CI = 1.18 to 5.00; P = 0.02) (дополнительный файл 3).
Параметры гемодинамики и метаболизма (48 часов)
По сравнению с группой НЭ, не-катехоламиновые вазопрессоры показали значительное снижение ЧСС (SMD = − 0.43; 95%CI = − 0.66 to − 0.19; P < 0.001) и уровня сывороточного креатинина (SMD = − 0.15; 95%CI = − 0.29 to − 0.01; P = 0.04), но не показала существенных различий по другим параметрам гемодинамики и метаболизма (дополнительный файл 3).
Результаты анализа подгрупп
RR был 0.91 (n = 3549, 95% CI = 0.84 to 0.98; P = 0.02) для исследований с низким риском предвзятости и 0.97 (n = 668, 95% CI = 0.83 to 1.15; P = 0.75) для исследований с высоким риском предвзятости. В анализе подгрупп, стратифицированных по типу не-катехоламиновых вазопрессоров, не было показано значительной разницы в 28-ми дневной летальности по сравнению с группой НЭ (P > 0.05). В анализе подгрупп согласно виду шока, незначительное улучшение в виде 28-ми дневной летальности было показано у пациентов с рефрактерным шоком (n = 396, RR, 0.84; 95% CI = 0.70 to 1.00; P = 0.048) (дополнительный файл 3).
Кумулятивный мета-анализ
Кумулятивный метаанализ предполагает, что положительный результат впервые появился в 2014 году Oliveira [13] (совокупный RR 0,86; 95% ДИ = 0,76–0,97) и эта тенденция кажется относительно стабильной с течением времени (дополнительный файл 3).
Обсуждение
Наше исследование 23 РКИ с общим количеством пациентов 4360 сравнило безопасность и эффективность не-катехоламиновых вазопрессоров с НЭ в контексте улучшения выживаемости среди пациентов с септическим шоком, по результатам которого мы пришли к заключению, что лечение потенциальными вазопрессорами может ассоциироваться с улучшением 28-ми дневной летальности, что впоследствии было подтверждено кумулятивным анализом и TSA. В тоже время, к благоприятному результату TSA следует относиться с осторожностью из-за недостаточной RIS, к тому же, благоприятный результат не бытл подтвержден большинством анализов подгрупп. Примечательно, что анализ подгрупп, стратифицированных по типам шока, частично соответствовал основному результату, и, в частности, для резистентных к катехоламинам пациентов с рефрактерным шоком RR составил 0,998. Именно такие пациенты несут в себе наиболее сложную клиническую проблему, которая связана в большей своей части с неконтролируемой патологической вазодилятацией (избыточной продукцией оксида азота) и резким снижением ответной реакции сосудов на вазоактивные гормоны (кортизол, ВП, AT-II) [6]. И здесь необходимо отметить, что будущие исследования должны будут сосредоточиться на оценке чувствительности клеток сосудистого эндотелия к вазопрессорам с целью более индивидуализированной терапии.
По сравнению с группой НЭ, у пациентов, получавшие не-катехоламиновые вазопрессоры, значительно снижалась длительность механической вентиляции, несущественно снижались длительность нахождения в ОИТ и в стационаре, длительность ППЗТ. Помимо этого, по сравнению с пациентами, которые получали НЭ, пациенты, которым лечение проводилось не-катехоламиновыми вазопрессорами, показали более высокую частоту разрешения шока к шестому часу, снижение риска проведения ППЗТ на 29%, но при этом у этих пациентов на 51% увеличивался риск развития гипонатриемии и в 2.43 раза увеличивался риск развития ишемии пальцев. При сравнении с НЭ, не-катехоламиновые вазопрессоры снижали ЧСС и уровень сывороточного креатинина, но не было существенной разницы в сердечном индексе (СИ). В нашем исследовании мы подтвердили защитный эффект не-катехоламиновых вазопрессоров на почки, что объясняется снижением концентрации креатинина и снижением риска проведения ППЗТ по сравнению с монотерапией НЭ.
НЭ стал препаратом первой линии при лечении пациентов с септическим шоком с момента первой публикации клинического руководства SSC в 2004 году, но это не значит, что НЭ есть идеальный выбор. НЭ, как андреэргический агент, вызывает окислительный стресс и имеет неблагоприятные биологические эффекты на воспалительный ответ и на клеточный метаболизм энергии [40]. И в этом отношении, концепция «декатехоламинимизации» (англ.decatecholaminization), определяемая как частичная или полная альтернатива катехоламинам, и именно эта концепция привела к появлению не-катехоламиновых вазопрессоров (ВП, ТП, селепрессин, AT-II), точкой приложения которых являются не-адренэргические рецепторы [41-43].
Подавляющее большинство исследований, включая обзор Cochrane [44], несколько испытаний [23, 28], обзоры и мета-анализы [5, 39, 45] показали, что имеется совсем незначительная разница в летальности между пациентами с шоком, которые получали не-адренергические агенты и теми, кто получал катехоламины. Один, совсем недавний мета-анализ, проведенный Zhou and colleagues [45], включивший в себя семь исследований, признал, что не было выявлено значительных доказательств, позволяющих сделать вывод о том, что ВП не уступает НЭ в улучшении 28-ми дневной выживаемости и в улучшении гемодинамики, что в было подтверждено в более позднем мета-анализе 2019 года, включившем в себя четыре исследования [39]. В противоречие с этими неблагоприятными результатами вошли несколько мета-анализов [46-28], показавших, что применение не-адренэргических вазопрессоров связано со снижением летальности. Например, совсем недавний мета-анализ 2019 года, в который вошло двадцать исследований, показал, что при сравнении с катехоламинами применение агонистов ВП рецепторов снижает летальность у пациентов с септическим шоком даже несмотря на увеличение риска развития пальцевой ишемии [47].
Но и это еще не все, в обзоре Cochrane было высказано мнение, что нет достаточных доказательств того, что какие-либо из исследованных вазопрессоров (НЭ /ТП/ВП/адреналин/допамин) превосходят другие в отношении летальности [44]. Как упоминалось в нескольких обзорах [41, 49], борьба между адренергическими и не-адренергическими вазопрессорами уже больше кажется междоусобной. Таким образом, может быть более разумной мультимодальная стратегия с двумя или более вазопрессорами. Более того, современные рекомендации SSC также подтверждают, что НЭ является вазопрессором первой линии, а вот у пациентов с пониженной чувствительностью к вазопрессорам в качестве альтернативного варианта желательно добавление либо ВП, либо адреналина [3]. В клинической практике у пациентов с септическим шоком обычным явлением стали сочетанные инфузии НЭ и ВП [50]. В связи с этим мы считаем, что концепция «декатехоламинизация» до появления мощного альтернативного вазопрессора преждевременна.
Насколько нам известно, наше исследование может быть первым кумулятивным мета-анализом в целях оценки эффективности и безопасности не-катехоламиновых вазопрессоров (вазопрессин, питуитрин, терлипрессин, селепрессин и ангиотензин II) по сравнению с НЭ при ведении взрослых пациентов с септическим шоком. До этого летальность в разные моменты времени (28/30/ ОИТ/стационар) для анализа в большинстве предыдущих мета-анализов считалась равной. Наше исследование наооборот, основывалось на точке зрения, что 4 различных временных точек летальности (28/90/ОИТ/стационар) в некоторой степени отражает достоверное влияние не-катехоламиновых агентов на летальность у пациентов с септическим шоком. Наш результат, в соответствии с некоторыми из существующих мета-анализов, предполагает, что применение не-адренергических агентов могло привести к снижению 28-ми дневной летальности у пациентов с септическим шоком, что дополнительно подтверждается результатом кумулятивного мета-анализа и TSA.
Следует упомянуть различные потенциальные ограничения. Во-первых, уровни ВП в плазме в большинстве включенных исследований не оценивались и, таким образом, трудно определить, оказывает ли абсолютный или относительный дефицит этого эндогенного гормона свое влияние на фармакологический эффект экзогенно вводимого гормона у пациентов с септическим шоком. В качестве обоснования добавления к терапии экзогенных гормонов в будущих исследованиях необходимо оценивать плазменные концентрации ВП. Во-вторых, несмотря на введение с открытой меткой максимальных доз исследуемых препаратов и НЭ, пациентам, у которых все еще не удавалось достичь целевого САД, необходимо было проводить терапию спасения путем введения другого открытого вазопрессора (дофамин, адреналин, фенилэфрин), вызывая смешанный эффект. Более того, испытания, сравнивающие одновременное использование не-катехоламиновых агентов и НЭ с одним только НЭ, также учитывались в нашем анализе. В-третьих, на результаты могут влиять различное время введения, дозировки и методы инфузии не-катехоламиновых вазопрессоров в разных исследованиях. Наконец, несмотря на низкий уровень статистической неоднородности нашего исследования, мы не можем игнорировать клиническую и методологическую неоднородность, которая связана с различиями пациентов, вмешательств, конечных точек, дизайна исследования и его качества. Следовательно, для того, чтобы проверить наши результаты в этой области, могут потребоваться дальнейшие крупные проспективные РКИ, особенно для исследований с долгосрочным наблюдением (таких как 90/180 дневная летальность).
Выводы
В заключение, объединенные данные из 23 исследований показывают, что одновременное лечение не-катехоламиновыми вазопрессорами и НЭ может незначительно улучшить 28-дневную летальность, что связано с сокращением продолжительности механической вентиляции, улучшением функции почек, снижением ЧСС и увеличением вероятности успешного достижения целевого сначения САД через 6 часов после начала терапии вазопрессорами, но за счет увеличения рисков развития гипонатриемии и ишемии пальцев.
Список литературы
1. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, Bellomo R, Bernard GR, Chiche JD, Coopersmith CM, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3). Jama. 2016;315(8):801–10.
2. Vincent JL, Jones G, David S, Olariu E, Cadwell KK. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis. Critical care. 2019;23(1):196.
3. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, Kumar A, Sevransky JE, Sprung CL, Nunnally ME, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive care medicine. 2017;43(3):304–77.
4. Laterre PF, Berry SM, Blemings A, Carlsen JE, Francois B, Graves T, Jacobsen K, Lewis RJ, Opal SM, Perner A, et al. Effect of selepressin vs placebo on ventilator- and vasopressor-free days in patients with septic shock: the SEPS IS-ACT randomized clinical trial. Jama. 2019;322(15):1476.
5. Zhu Y, Huang H, Xi X, Du B. Terlipressin for septic shock patients: a metaanalysis of randomized controlled study. J Intensive Care. 2019;7:16.
6. Jentzer JC, Vallabhajosyula S, Khanna AK, Chawla LS, Busse LW, Kashani KB. Management of refractory vasodilatory shock. Chest. 2018;154(2):416–26.
7. Saad AF, Maybauer MO. The role of vasopressin and the vasopressin type V1a receptor agonist selepressin in septic shock. Journal of critical care. 2017;40:41–5.
8. Sims CA, Yuxia G, Singh K, Werlin EC, Reilly PM, Baur JA. Supplemental arginine vasopressin during the resuscitation of severe hemorrhagic shock preserves renal mitochondrial function. PLoS One. 2017;12(10):e0186339.
9. Allen B, Kram B, Kram S, Schultheis J, Wolf S, Gilstrap D, Shapiro M. Predictors of vasopressin responsiveness in critically ill adults. The Annals of pharmacotherapy. 2017;1060028017729480.
10. Kim SE, Jung DM, Park JW, Ju Y, Lee B, Kim HS, Suk KT, Jang MK, Park SH, Kang JG, et al. Baseline renal function predicts hyponatremia in liver cirrhosis patients treated with terlipressin for variceal bleeding. Gastroenterol Res Pract. 2017;2017:7610374.
11. Russell JA, Vincent JL, Kjolbye AL, Olsson H, Blemings A, Spapen H, Carl P, Laterre PF, Grundemar L. Selepressin, a novel selective vasopressin V1A agonist, is an effective substitute for norepinephrine in a phase IIa randomized, placebo-controlled trial in septic shock patients. Critical care. 2017;21(1):213.
12. Jadhav AP, Sadaka FG. Angiotensin II in septic shock. Am J Emerg Med. 2019;37(6):1169–74.
13. Oliveira SDF, Rocha C, Oliveira F. Early vasopressin application in shock study. Critical care. 2014;18(1):158.
14. Xiao X, Zhang J, Wang Y, Zhou J, Zhu Y, Jiang D, Liu L, Li T. Effects of terlipressin on patients with sepsis via improving tissue blood flow. J Surg Res. 2016;200(1):274–82.
15. Prakash V. Timely introduction of a combination of low dose terlipressin and noradrenaline as vasopressors is superior to high dose noradrenaline alone in patients of cirrhosis with septic shock (NCT02468063). Hepatology international. 2018;12(2):S648–9.
16. Svoboda P, Scheer P, Kantorova I, Doubek J, Dudra J, Radvan M, Radvanova J. Terlipressin in the treatment of late phase catecholamine-resistant septic shock. Hepatogastroenterology. 2012;59(116):1043–7.
17. Russell JA, Walley KR, Singer J, Gordon AC, Hebert PC, Cooper DJ, Holmes CL, Mehta S, Granton JT, Storms MM, et al. Vasopressin versus norepinephrine infusion in patients with septic shock. The New England journal of medicine. 2008;358(9):877–87.
18. Gordon AC, Mason AJ, Thirunavukkarasu N, Perkins GD, Cecconi M, Cepkova M, Pogson DG, Aya HD, Anjum A, Frazier GJ, et al. Effect of early vasopressin vs norepinephrine on kidney failure in patients with septic shock: the VANI SH randomized clinical trial. Jama. 2016;316(5):509–18.
19. Liu ZM, Chen J, Kou Q, Lin Q, Huang X, Tang Z, Kang Y, Li K, Zhou L, Song Q, et al. Terlipressin versus norepinephrine as infusion in patients with septic shock: a multicentre, randomised, double-blinded trial. Intensive care medicine. 2018;44(11):1816–25.
20. Lauzier F, Levy B, Lamarre P, Lesur O. Vasopressin or norepinephrine in early hyperdynamic septic shock: a randomized clinical trial. Intensive care medicine. 2006;32(11):1782–9.
21. Fonseca-Ruiz NJ CA, Carmona DPO, Aguirre MC, Hernández MPG, García CO, Castro DPC, Saldarriaga FJM: Uso de vasopresina en pacientes con choque séptico refractario a catecolaminas: estudio piloto. Acta Colombiana de Cuidado Intensivo 2013, 13(2):114-123.(2):11.
22. Barzegar E, Ahmadi A, Mousavi S, Nouri M, Mojtahedzadeh M. The therapeutic role of vasopressin on improving lactate clearance during and after vasogenic shock: microcirculation, is it the black box? Acta Med Iran. 2016;54(1):15–23.
23. Hammond DA, Ficek OA, Painter JT, McCain K, Cullen J, Brotherton AL, Kakkera K, Chopra D, Meena N. Prospective open-label trial of early concomitant vasopressin and norepinephrine therapy versus initial norepinephrine monotherapy in septic shock. Pharmacotherapy. 2018;38(5):531–8.
24. Albanese J, Leone M, Delmas A, Martin C. Terlipressin or norepinephrine in hyperdynamic septic shock: a prospective, randomized study. Critical care medicine. 2005;33(9):1897–902.
25. Morelli A, Ertmer C, Lange M, Dunser M, Rehberg S, Van Aken H, Pietropaoli P, Westphal M. Effects of short-term simultaneous infusion of dobutamine and terlipressin in patients with septic shock: the DOBUPRESS study. British journal of anaesthesia. 2008;100(4):494–503.
26. Morelli A, Ertmer C, Rehberg S, Lange M, Orecchioni A, Cecchini V, Bachetoni A, D'Alessandro M, Van Aken H, Pietropaoli P, et al. Continuous terlipressin versus vasopressin infusion in septic shock (TERLIVAP): a randomized, controlled pilot study. Critical care. 2009;13(4):R130.
27. Han XD, Sun H, Huang XY, Zhang SY, Wang YD, Ren K, Li F. A clinical study of pituitrin versus norepinephrine in the treatment of patients with septic shock. Zhongguo Wei Zhong Bing Ji Jiu Yi Xue. 2012;24(1):33–7.
28. Chen Z, Zhou P, Lu Y, Yang C. Comparison of effect of norepinephrine and terlipressin on patients with ARDS combined with septic shock: a prospective single-blind randomized controlled trial. Zhonghua wei zhong bing ji jiu yi xue. 2017;29(2):111–6.
29. Moher D, Liberati A, Tetzlaff J, Altman DG, Group P. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. Bmj. 2009;339:b2535.
30. Dunser MW, Mayr AJ, Ulmer H, Knotzer H, Sumann G, Pajk W, Friesenecker B, Hasibeder WR. Arginine vasopressin in advanced vasodilatory shock: a prospective, randomized, controlled study. Circulation. 2003;107(18):2313–9.
31. Hajjar LA, Zambolim C, Belletti A, de Almeida JP, Gordon AC, Oliveira G, Park CHL, Fukushima JT, Rizk SI, Szeles TF, et al. Vasopressin versus norepinephrine for the management of septic shock in cancer patients: the VANCS II randomized clinical trial. Critical care medicine. 2019.
32. Choudhury A, Kedarisetty CK, Vashishtha C, Saini D, Kumar S, Maiwall R, Sharma MK, Bhadoria AS, Kumar G, Joshi YK, et al. A randomized trial comparing terlipressin and noradrenaline in patients with cirrhosis and septic shock. Liver Int. 2017;37(4):552–61.
33. Chawla LS, Busse L, Brasha-Mitchell E, Davison D, Honiq J, Alotaibi Z, Seneff MG. Intravenous angiotensin II for the treatment of high-output shock (ATHOS trial): a pilot study. Critical care. 2014;18:5.
34. Khanna A, Ostermann M, Bellomo R. Angiotensin II for the treatment of vasodilatory shock. New Engl J Med. 2017;377(26):2604.
35. Higgins JPTGS. Cochrane Collaboration.: Cochrane handbook for systematic reviews of interventions. Chichester, England Hoboken: WileyBlackwell; 2008.
36. Wan X, Wang W, Liu J, Tong T. Estimating the sample mean and standard deviation from the sample size, median, range and/or interquartile range. BMC Med Res Methodol. 2014;14:135.
37. Borenstein M, Hedges LV, Higgins JP, Rothstein HR. A basic introduction to fixed-effect and random-effects models for meta-analysis. Research synthesis methods. 2010;1(2):97–111.
38. Gordon AC, Wang N, Walley KR, Ashby D, Russell JA. The cardiopulmonary effects of vasopressin compared with norepinephrine in septic shock. Chest. 2012;142(3):593–605.
39. Nagendran M, Russell JA, Walley KR, Brett SJ, Perkins GD, Hajjar L, Mason AJ, Ashby D, Gordon AC. Vasopressin in septic shock: an individual patient data meta-analysis of randomised controlled trials. Intensive care medicine. 2019;45(6):844–55.
40. Coquerel D, Sainsily X, Dumont L, Sarret P, Marsault E, Auger-Messier M, Lesur O. The apelinergic system as an alternative to catecholamines in lowoutput septic shock. Critical care. 2018;22(1):10.
41. Levy B, Fritz C, Tahon E, Jacquot A, Auchet T, Kimmoun A. Vasoplegia treatments: the past, the present, and the future. Critical care. 2018;22(1):52.
42. Singer M, Matthay MA. Clinical review: thinking outside the box--an iconoclastic view of current practice. Critical care. 2011;15(4):225.
43. Asfar P, Russell JA, Tuckermann J, Radermacher P. Selepressin in septic shock: a step toward decatecholaminization? Critical care medicine. 2016;44(1):234–6.
44. Gamper G, Havel C, Arrich J, Losert H, Pace NL, Mullner M, Herkner H. Vasopressors for hypotensive shock. Cochrane Database Syst Rev. 2016;2:CD003709.
45. Zhou FH, Song Q. Clinical trials comparing norepinephrine with vasopressin in patients with septic shock: a meta-analysis. Mil Med Res. 2014;1:6.
46. Serpa Neto A, Nassar AP, Cardoso SO, Manetta JA, Pereira VG, Esposito DC, Damasceno MC, Russell JA. Vasopressin and terlipressin in adult vasodilatory shock: a systematic review and meta-analysis of nine randomized controlled trials. Critical care. 2012;16(4):R154.
47. Jiang L, Sheng Y, Feng X, Wu J. The effects and safety of vasopressin receptor agonists in patients with septic shock: a meta-analysis and trial sequential analysis. Critical care. 2019;23(1):91.
48. Huang L, Zhang S, Chang W, Xia F, Liu S, Yang Y, Qiu H. Terlipressin for the treatment of septic shock in adults: a systematic review and meta-analysis. BMC Anesthesiol. 2020;20(1):58.
49. Chen C, Pang L, Wang Y, Wen T, Yu W, Yue X, Rong Y, Liao W. Combination era, using combined vasopressors showed benefits in treating septic shock patients: a network meta-analysis of randomized controlled trials. Ann Transl Med. 2019;7(20):535.
50. Wu Z, Zhang S, Xu J, Xie J, Huang L, Huang Y, Yang Y, Qiu H. Norepinephrine vs vasopressin: which vasopressor should be discontinued first in septic shock? A meta-analysis. Shock (Augusta, Ga). 2020;53(1):50–7.
Zhong et al. Journal of Intensive Care (2020) 8:83