Маркеры раннего сепсиса у пациентов, поступающих в интенсивную терапию со среднетяжёлым и тяжелым течением диабетического кетоацидоза
Blanchard et al. Ann. Intensive Care (2020) 10:58
Перевод оригинальной статьи: «Early sepsis markers in patients admitted to intensive care unit with moderate-to-severe diabetic ketoacidosis»
Авторы: Florian Blanchard, Judith Charbit, Guillaume Van der Meersch, Benjamin Popoff, Adrien Picod, Regis Cohen, Frank Chemouni, Stephane Gaudry, Helene Bihan, Yves Cohen
Medical-Surgical Intensive Care Unit, Avicenne University Hospital, AP-HP, Paris 13 University, Sorbonne Paris Cité, 125 rue Stalingrad, 93000 Bobigny, France.
Department of Endocrinology, Diabetology, Metabolic Disease, Avicenne University Hospital, AP-HP, Paris 13 University, Sorbonne Paris Cité, CRNH-IdF, 125 rue Stalingrad, Bobigny, France.
Department of Anesthesiology and Critical Care, Rouen University Hospital, Rouen, France.
Department of Endocrinology, Delafontaine Hospital, 2 rue du Dr Delafontaine, Saint-Denis, France.
Gustave Roussy, Médecine Intensive Réanimation, 94805 Villejuif, France. 6 Sorbonne University, INSERM, Remodeling and Repair of Renal Tissue, UMR S1155, Tenon Hospital, Paris, France.
Keywords: Diabetic ketoacidosis, Sepsis, Bacterial infection, Procalcitonin, Inflammation, Biomarkers
Ключевые слова: диабетический кетоацидоз, сепсис, бактериальная инфекция, прокальцитонин, воспаление, биомаркеры
Введение
Диабетический кетоацидоз (ДКА) встречается в 4 – 9% от общего числа поступивших в стационар пациентов с диабетом [1, 2]. Несмотря на практически 50% падение летальности, начиная с 1980 года, что связано со стандартизацией протокола оказания медицинской помощи [3], недавние исследования показывают, что на сегодня уровень летальности составляет 2 - 5% и во многом определяется возрастом пациента [4, 5]. Клинические руководства по лечению ДКА в основном сосредоточены на инсулинотерапии и коррекции водно-электролитных нарушений
Наиболее частыми причинами летальности являются прекращение инсулиновой терапии и инфекционные осложнения [2, 5, 8]. Бактериальные инфекции - в первую очередь инфекции мочевыводящих путей, а затем пневмония - объясняют до 50% случаев ДКА [6, 8, 9]. Сообщается, что в контексте ДКА бактериальные инфекции увеличивают как летальность [10], так и продолжительность пребывания пациента в стационаре [9]. Отсюда раннее выявление бактериальных инфекций и адекватное назначение антибиотиков является ключевым элементом для улучшения результатов лечения пациентов. Однако, и сам по себе ДКА может имитировать инфекции [10], а дифференциация септического и не-септического воспалительного ответа может быть затруднена. Клиническое подозрение на инфекцию вряд ли может служить оправданием при назначении антибактериальной терапии и, таким образом, множество пациентов подвергается чрезмерному лечению антибиотиками, что приводит к неадекватным затратам на лечение, развитию побочных эффектов и резистентности к антибиотикам. Развитие резистентности вызывает все большее беспокойство, так как можно спрогнозировать, что в будущем у поступивших пациентов с ДКА у 20 - 40% из них разовьется новый эпизод инфекции [3, 5, 11].
Насколько нам известно, ни одно исследование еще не оценивало полезность маркеров сепсиса при ДКА. Считается, что конститутивные признаки синдрома системного воспалительного ответа имеют низкую специфичность [12]. Тахикардия и тахипноэ могут быть легко интегрированы в патофизиологию ДКА. При оценке септического состояния обычно учитываются гипотермия, лихорадка и аномалии в количестве лейкоцитов. Тем не менее, ни один из этих признаков никогда не был признан релевантным для различия инфицированных и не-инфицированных пациентов при ДКА. При диагностике бактериальных инфекций одним из основных маркеров является прокальцитонин (PCT). PCT практически ежедневно применяется в целях определения показаний для начала антибактериальной терапии у пациентов с инфекциями дыхательных путей и сепсисом [13–15].
Однако, некоторые предварительные данные свидетельствуют о том, что у пациентов с диабетом, особенно во время гипергликемического кризиса, порог PCT для принятия решения о назначении антибиотиков может быть выше по сравнению с пациентами, не страдающими диабетом [16, 17]. Поэтому мы провели ретроспективное исследование, в котором стремились изучить диагностические возможности различных маркеров сепсиса (в том числе PCT) в целях прогнозирования развития бактериальной инфекции в первые 2 дня после поступления пациента с ДКА в отделение интенсивной терапии (ОИТ).
Материалы и методы
Моно-центровое ретроспективное когортное исследование, в которое были включены пациенты с диабетическим кетоацидозом, определяемого как pH ≤ 7,25, гликемия > 300 мг/дл и наличие кетонов, поступившие в отделение интенсивной терапии. Доказанная бактериальная инфекция определялась, как положительный бактериологический посев. Клинические данные - наличие лихорадки: температура> 38 ° C и наличие гипотермии: температура <36 ° C плюс биологические маркеры (общий анализ крови, количество нейтрофилов, отношение количества нейтрофилов к лимфоцитам и прокальцитонин) сравнивались при поступлении в зависимости от наличия или отсутствия доказанной бактериальной инфекции.
Результаты
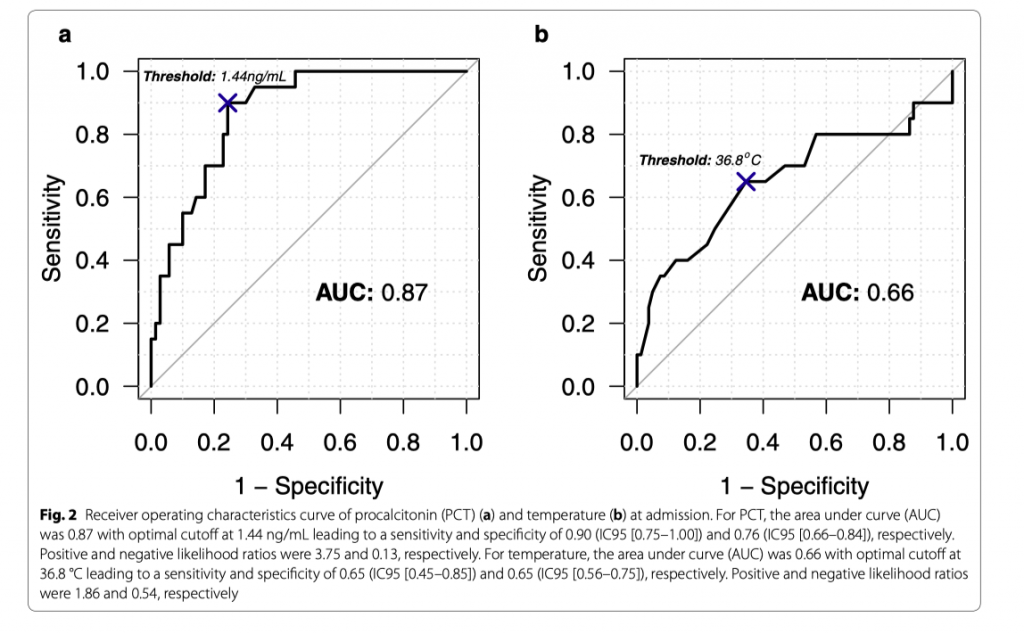
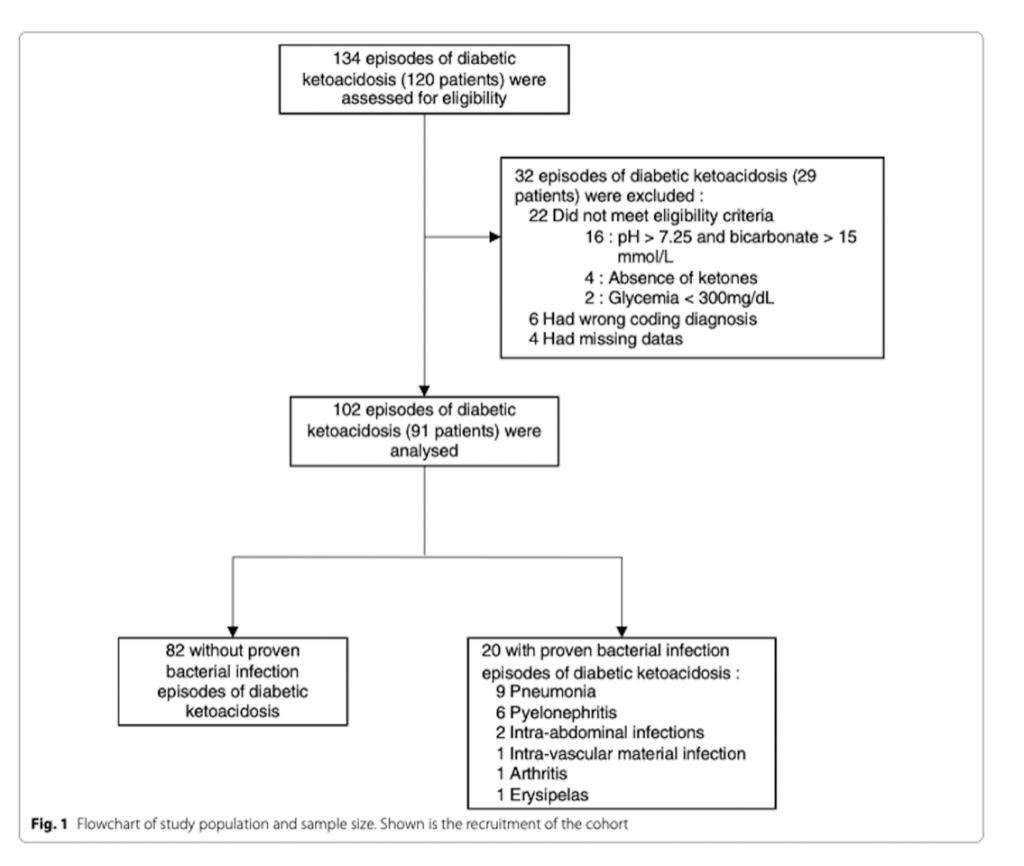
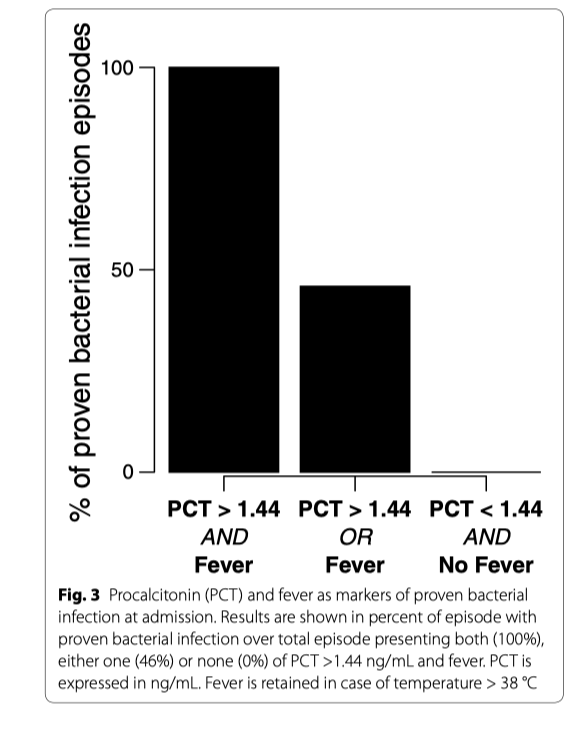
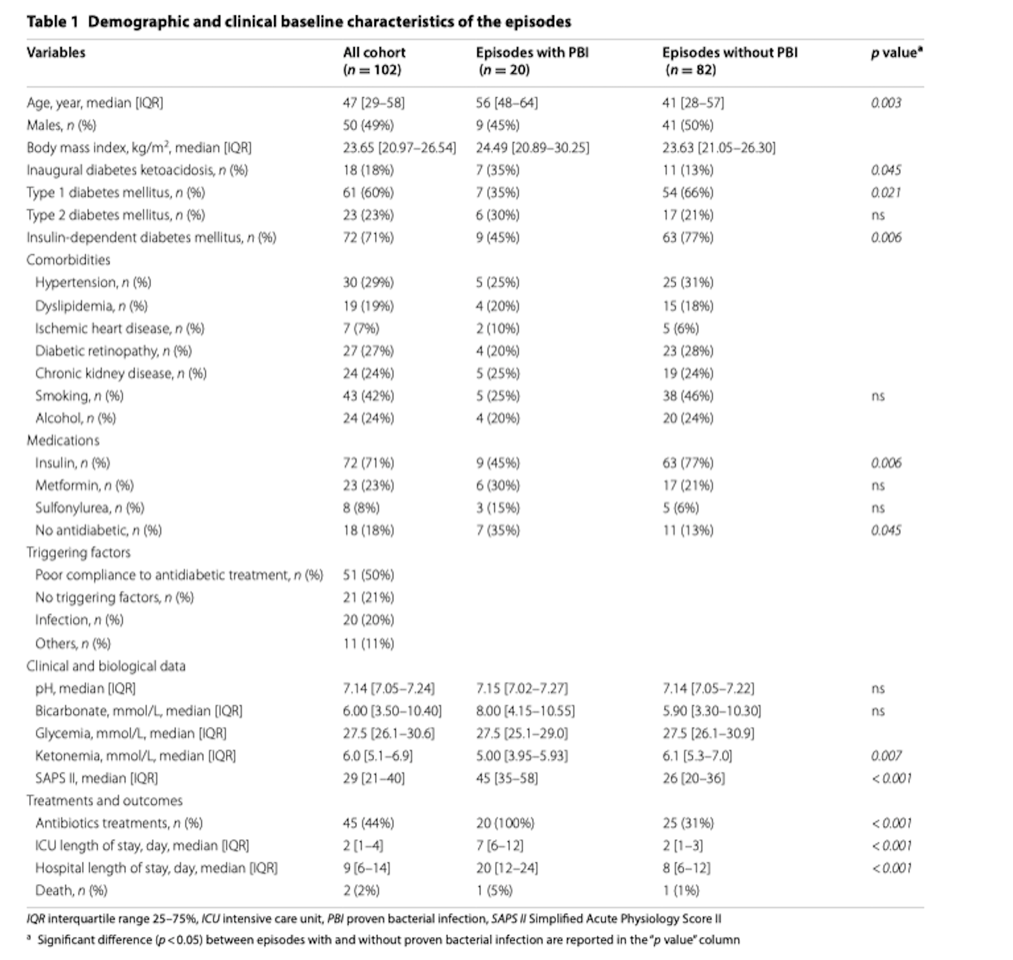
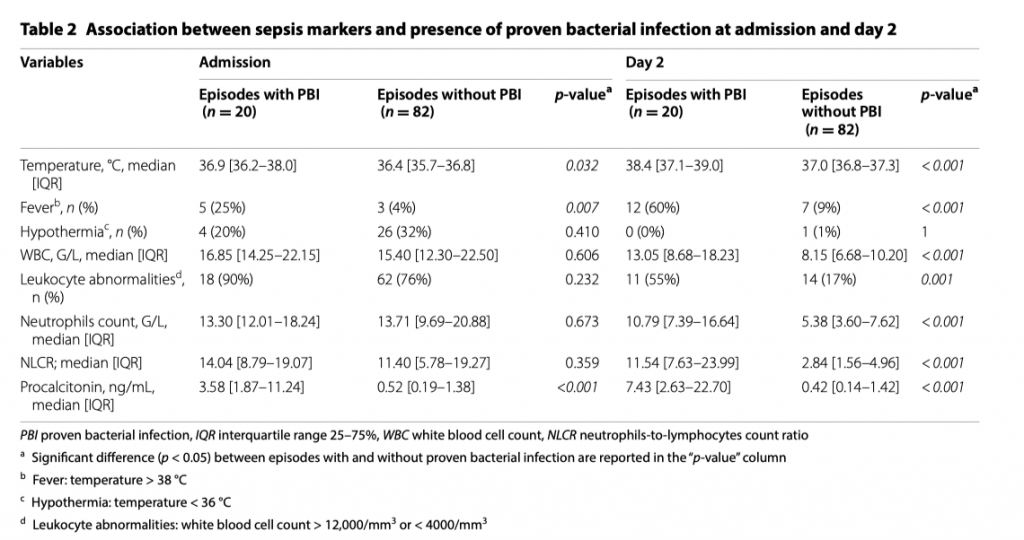
В период с 2011 по 2018 год в число 134 случаев диабетического кетоацидоза были включены 102 (91 пациент). У двадцати из 102 была подтверждена бактериальная инфекция. При поступлении: прокальцитонин (медиана: 3,58 нг/мл против 0,52 нг/мл, р <0,001) и наличие лихорадки (25% против 44%, р = 0,007) отличались между эпизодами с и без доказанной бактериальной инфекции как в однофакторной, так и в однофакторной форме многомерного анализа. Такие показатели, как общий анализ крови, количество нейтрофилов, соотношение нейтрофилов к лимфоцитам и наличие гипотермии не различались в обеих группах. Диагностический анализ эффективности прокальцитонина выявил область под кривой 0,87 с оптимальным отсечением 1,44 нг / мл, что привело к чувствительности 0,90 и специфичности 0,76. Сочетание прокальцитонина с лихорадкой позволило отличить доказанные эпизоды бактериальной инфекции от эпизодов без доказанной бактериальной инфекции. Действительно, все пациенты с уровнем прокальцитонина более 1,44 нг/мл и лихорадкой имели подтвержденные эпизоды бактериальной инфекции. Присутствие одного из этих двух маркеров было связано с 46% подтвержденных эпизодов бактериальной инфекции. Ни у одного пациента с нормотермией при уровне прокальцитонина менее 1,44 нг/мл не было доказанной бактериальной инфекции.
Дискуссия
Наше исследование стало первым, в котором оценивалась прогностические возможности различных маркеров сепсиса для установления бактериальной инфекции у пациентов с ДКА, поступивших в ОИТ. Лихорадка и высокий уровень прокальцитонина с точкой отсечения 1.44 нг/мл на первый день поступления (D0) могут помочь в выявлении пациентов с подтвержденной бактериальной инфекцией в контексте ДКА. Температура была единственным клиническим маркером. Лихорадка на D0 и D2 было выше в эпизодах с подтвержденной бактериальной инфекцией (ПБИ), как и сообщалось в ранее проведенных исследованиях [10]. Тем не менее в эпизодах без подтвержденной бактериальной инфекции на D0 температура тела колебалась от 32,9°C до 38,7°C. Такой большой разброс может быть объяснен нарушением функции терморегуляции у пациентов с диабетом [22]. Гипотермия (температура <36 ° C) была одинаково представлена в обеих группах. В 1978 году Gale et al. [23] сообщали о 20 пациентах с гипотермией при ДКА, где наблюдался высокий уровень летальности (60%). Гипотермия также связывают с инфекцией [24]. Но в нашем исследовании мы не обнаружили у пациентов с гипотермией ни увеличения летальности, ни связи гипотермии с сепсисом.
Другие классические маркеры сепсиса также оказались неэффективными в нашем исследовании для дифференциации эпизодов ПБИ от эпизодов без ПБИ. Мы обнаружили высокий уровень лейкоцитов на D0 (в основном состоящий из полинуклеарных нейтрофилов) в эпизодах без ПБИ. Этот результат приводит к пересмотру полезности высокого уровня лейкоцитов для прогнозирования бактериальной инфекции при поступлении пациента в ОИТ с ДКА. Недавно предложенный новый инструмент для диагностика бактериальной инфекции - соотношение нейтрофилов к лимфоцитам [27], в нашем исследовании различий между группами при поступлении пациента в ОИТ не показал.
PCT, предшественник кальцитонина, генерируется как часть системного ответа на бактериальные инфекции [28]. Наше исследование подчеркнуло важность PCT для прогнозирования инфекции, с хорошим прогностическим значением при уровне свыше 1,44 нг/мл на D0. У пациентов с лихорадкой, поступивших в отделение неотложной помощи, Hausfater et al. [29] настаивали на том, что пороговое значение для PCT, равное 0,2 нг/мл, для диагностики бактериальных инфекций имело низкие чувствительность и специфичность (0,77 и 0,59 соответственно). Wacker et al. [30] в своем мета-анализе, основной фокус которого был направлен на точность и клиническое значение PCT для диагностики сепсиса у критически больных пациентов, сообщили о чувствительности в 0,77 и 0,79 соответственно. Sager et al. [31] недавно суммировали использование PCT для диагностики сепсиса. Для пациентов, находящихся в критическом состоянии, бактериальная инфекция считалась «вероятной» тогда, когда уровень РСТ составлял 0,5–1,0 нг/мл, и «очень вероятной» при уровне РСТ свыше 1,0 нг/мл. В нашем исследовании уровень PCT при поступлении был точен для того, чтобы отличить эпизоды ПБИ от эпизодов без ПБИ с чувствительностью 0,90 и специфичностью 0,76. Тем не менее, порог, по-видимому, еще выше, чем в нашем исследовании (оптимальное ограничение на D0: 1,44 нг/мл). Предыдущие исследования уже сообщали об огромной неоднородности точки отсечения. Например, Wacker et al. [30] в своем мета-анализе сообщили о медианном отсечении 1,1 нг/мл (IQR 0,5–2,0 нг / мл). В тоже время, не может быть исключено участие гипергликемического кризиса в увеличении уровня PCT. К примеру, Aksu et al. [32] сообщили о снижении уровня РСТ после нормализации гликемии у пациентов с острым гипергликемическим кризисом. В нашем исследовании мы обнаружили повышенный уровень PCT у пациентов без какой-либо доказанной бактериальной инфекции с последующим снижением уровня PCT после нормализации гликемии. Высокие уровни PCT были недавно зарегистрированы в различных отчетах или сериях случаев, посвященных диабетическому кетоацидозу без инфекции [33, 34]. В серии случаев из 5 пациентов, госпитализированных по поводу диабетического кетоацидоза, сообщалось об уровнях РСТ в диапазоне от 6,87 до 30,47 нг/мл. Интересно, что такого наблюдения в случае гиперосмолярного гипергликемического синдрома не было обнаружено. Это привело автора к заключению, что увеличение PCT при остром гликемическом кризисе может быть обнаружено только во время диабетического кетоацидоза [34].
При раннем лечении ДКА традиционные клинические (гипотермия) и биологические (лейкоцитоз, соотношение нейтрофилов к лифмоцитам) признаки бактериальной инфекции оказались неэффективными, что вероятно, происходит из-за корреляции между гипергликемическим кризисом и воспалительным ответом. У пациентов без диабета индуцированная гипергликемия приводила к увеличению не только уровня интерлейкина-6 (IL-6), но и других провоспалительных маркеров [35]. Добавление низких доз инсулина позволяет избежать этих изменений даже при постоянной гипергликемии [35]. Но вот по сравнению со здоровым контролем, индуцированная гипергликемия у пациентов с диабетом приводит к более выраженной секреции провоспалительных цитокинов, таких как фактор некроза опухоли-α (TNF-α) и IL-6 [36]. Известно, что помимо любой бактериальной инфекции TNF-α индуцирует высвобождение большого количества PCT как у животных [37], так и у людей [38]. Эти данные могут объяснить увеличение как PCT, так и количества лейкоцитов в эпизодах без ПБИ на D0. Сочетание РСТ и лихорадки может быть более существенным и в действительности только при эпизодах ПБИ имелись оба этих признака, в то время при отсутствии обоих этих признаков ПБИ не определялась (рис. 3). На D2, после введения инсулина и коррекции гликемии, почти нормализация уровня PCT и количества лейкоцитов в эпизодах без ПБИ может быть объяснена коррекцией воспалительного состояния, что позволяет различать два различных паттерна - эпизоды с и без ПБИ. В первой группе наблюдаются эпизоды лихорадки в сочетании с высоким уровнем PCT, лейкоцитозом, которые все еще сохраняются на D2. Во второй группе наблюдается снижение, если не нормализация, всех вышеупомянутых маркеров после коррекции гликемии. Таким образом, на D0 статус инфекции может быть основан на уровне PCT и наличии лихорадки независимо от лейкоцитоза или гипотермии. На D2, после нормализации гликемии, обычные маркеры восстанавливают свой различающий потенциал, что может нам позволить провести переоценку проводимой антибактериальной терапии в случае, когда проведение антибактериальной терапии началось на D0.
Это исследование имеет некоторые ограничения. Во-первых, это был моно-центровой ретроспективный анализ, который ограничивает возможность обобщения результатов. Тем не менее, измерения PCT и лейкоцитов для каждого пациента, поступившего с ДКА в наш центр, оценивались систематически. Во-вторых, размер выборки невелик - значительное число исключенных пациентов (32 из 134) по разным причинам (как показано на рис.1) могли вызвать смещение. В-третьих, мы изучили только эпизоды доказанной бактериальной инфекции, определяемой положительным бактериальным посевом. Такое определение бактериальной инфекции может вызывать смещение, поскольку положительные посевы могут быть не реализованы или быть ложноотрицательными. Действительно, 31% пациентам с не-ПБИ эпизодами назначались антибиотики. Все это может указывать как на чрезмерное лечение, так и на не доказанную, но все же присутствующую бактериальную инфекцию. Таким образом, некоторые эпизоды, классифицированные как без-ПБИ, могут не быть действительно свободными от бактериальной инфекции. В-четвертых, С-реактивный белок был недоступен почти всем пациентам нашей когорты. Уже сообщалось, что С-реактивный белок ассоциирован с инфекцией у пациентов с тяжелой формой ДКА [10]. В нашем учреждении С-реактивный белок не измеряется из-за его противоречивого результата для пациентов интенсивной терапии [40]. Даже если бы С-реактивный белок был информативным, мы не смогли бы включить его в наше исследование.
Наконец, не измерялась центральная температура. В нашем учреждении, когда центральная температура недоступна, измеряется температура в подмышечной впадине. Известно, что средняя разница между температурой в подмышечной впадине и температурой в легочной артерии составляет 0,5°C (от 0,4 до 1,2°C) [41]. Мы решили добавить поправочный коэффициент 0,5°C к измеренной в подмышечной впадине температуре [20]. Несмотря на все эти ограничения, наше исследование было «реальным» наблюдением за популяцией и соответствовало предыдущим исследованиям относительно триггерных факторов [2], выживаемости [4] и увеличения продолжительности пребывания у инфицированных пациентов [9]. Для подтверждения интереса и диагностических порогов этих маркеров необходимы будущие проспективные исследования. Таким образом, проспективное клиническое рандомизированное контрольное исследование, включающее правило принятия решения, основанное на прокальцитонине и лихорадке, для руководства назначением антибиотиков во время ДКА, может быть проведено для подтверждения клинической добавленной ценности такого отношения.
Выводы
Наше исследование показало, что при поступлении в ОИТ пациента с ДКА в процессе диагностики инфекции не следует принимать во внимание лейкоцитоз, количество нейтрофилов и гипотермию. Только лихорадка и PCT (с более высоким порогом, чем обычно: 1,44 нг/мл) могут помочь отличить пациентов с и без ПБИ. Комбинируя эти два маркера, можно снизить частоту неадекватного назначения антибиотиков.
References
1. Data & Statistics | Diabetes | CDC [Internet]. Centers for Disease Control and Prevention. National Diabetes Statistics Report, 2017. Atlanta, GA: Centers for Disease Control and Prevention, U.S. Dept of Health and Human Services; 2017. https://www.cdc.gov/diabetes/data/index.html. Accessed 12 Mar 2018.
2. Umpierrez GE, Kitabchi AE. Diabetic ketoacidosis: risk factors and management strategies. Treat Endocrinol. 2003;2:95–108.
3. Barranco RJ, Gomez-Peralta F, Abreu C, Delgado-Rodriguez M, MorenoCarazo A, Romero F, et al. Incidence, recurrence and cost of hyperglycaemic crises requiring emergency treatment in Andalusia, Spain. Diabet Med. 2017;34:966–72.
4. Henriksen OM, Røder ME, Prahl JB, Svendsen OL. Diabetic ketoacidosis in Denmark incidence and mortality estimated from public health registries. Diabetes Res Clin Pract. 2007;76:51–6.
5. Alourfi Z, Homsi H. Precipitating factors, outcomes, and recurrence of diabetic ketoacidosis at a university hospital in Damascus. Avicenna J Med. 2015;5:11–5.
6. Kitabchi AE, Umpierrez GE, Miles JM, Fisher JN. Hyperglycemic crises in adult patients with diabetes. Diabetes Care. 2009;32:1335–43.
7. Savage MW, Dhatariya KK, Kilvert A, Rayman G, Rees JAE, Courtney CH, et al. Joint British Diabetes Societies guideline for the management of diabetic ketoacidosis. Diabet Med. 2011;28:508–15.
8. Mahesh M, Shivaswamy RP, Chandra BS, Syed S. The study of different clinical pattern of diabetic ketoacidosis and common precipitating events and independent mortality factors. J Clin Diagn Res. 2017;11:OC42–6.
9. Freire AX, Umpierrez GE, Afessa B, Latif KA, Bridges L, Kitabchi AE. Predictors of intensive care unit and hospital length of stay in diabetic ketoacidosis. J Crit Care. 2002;17:207–11.
10. Gogos CA, Giali S, Paliogianni F, Dimitracopoulos G, Bassaris HP, Vagenakis AG. Interleukin-6 and C-reactive protein as early markers of sepsis in patients with diabetic ketoacidosis or hyperosmosis. Diabetologia. 2001;44:1011–4.
11. Kuppermann N, Ghetti S, Schunk JE, Stoner MJ, Rewers A, McManemy JK, et al. Clinical trial of fluid infusion rates for pediatric diabetic ketoacidosis. N Engl J Med. 2018;378:2275–87.
12. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016;315:801–10.
13. Schuetz P, Amin DN, Greenwald JL. Role of procalcitonin in managing adult patients with respiratory tract infections. Chest. 2012;141:1063–73.
14. Schuetz P, Christ-Crain M, Thomann R, Falconnier C, Wolbers M, Widmer I, et al. Effect of procalcitonin-based guidelines vs standard guidelines on antibiotic use in lower respiratory tract infections: the ProHOSP randomized controlled trial. JAMA. 2009;302:1059–66.
15. Bouadma L, Luyt C-E, Tubach F, Cracco C, Alvarez A, Schwebel C, et al. Use of procalcitonin to reduce patients’ exposure to antibiotics in intensive care units (PRORATA trial): a multicentre randomised controlled trial. The Lancet. 2010;375:463–74.
16. Abbasi A, Corpeleijn E, Postmus D, Gansevoort RT, de Jong PE, Gans ROB, et al. Plasma procalcitonin is associated with obesity, insulin resistance, and the metabolic syndrome. J Clin Endocrinol Metab. 2010;95:E26–31.
17. Abbasi A, Corpeleijn E, Postmus D, Gansevoort RT, de Jong PE, Gans ROB, et al. Plasma procalcitonin and risk of type 2 diabetes in the general population. Diabetologia. 2011;54:2463–5.
18. Glaser N, Barnett P, McCaslin I, Nelson D, Trainor J, Louie J, et al. Risk factors for cerebral edema in children with diabetic ketoacidosis. The Pediatric Emergency Medicine Collaborative Research Committee of the American Academy of Pediatrics. N Engl J Med. 2001;344:264–9.
19. Christ-Crain M, Müller B. Procalcitonin in bacterial infections-hype, hope, more or less? Swiss Med Wkly. 2005;135:451–60.
20. Myny D, De Waele J, Defloor T, Blot S, Colardyn F. Temporal scanner thermometry: a new method of core temperature estimation in ICU patients. Scott Med J. 2005;50:15–8.
21. Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest. 1992;101:1644–55.
22. Kenny GP, Sigal RJ, McGinn R. Body temperature regulation in diabetes.
Temperature (Austin). 2016;3:119–45.
23. Gale EA, Tattersall RB. Hypothermia: a complication of diabetic ketoacidosis. Br Med J. 1978;2:1387–9.
24. Guerin J-M, Meyer P, Segrestaa J-M. Hypothermia in diabetic ketoacidosis.
Diabetes Care. 1987;10:801–2.
25. Tullis JL. The leukocytosis of diabetic acidosis. Am J Med Sci. 1948;215:424–6.
26. Burris AS. Leukemoid reaction associated with severe diabetic ketoacidosis. South Med J. 1986;79:647–8.
27. Naess A, Nilssen SS, Mo R, Eide GE, Sjursen H. Role of neutrophil to lymphocyte and monocyte to lymphocyte ratios in the diagnosis of bacterial infection in patients with fever. Infection. 2017;45:299–307.
28. Becker KL, Nylén ES, White JC, Müller B, Snider RH. Clinical review 167:
procalcitonin and the calcitonin gene family of peptides in inflammation, infection, and sepsis: a journey from calcitonin back to its precursors. J Clin Endocrinol Metab. 2004;89:1512–25.
29. Hausfater P, Juillien G, Madonna-Py B, Haroche J, Bernard M, Riou B.
Serum procalcitonin measurement as diagnostic and prognostic marker in febrile adult patients presenting to the emergency department. Crit Care. 2007;11:R60.
30. Wacker C, Prkno A, Brunkhorst FM, Schlattmann P. Procalcitonin as a diagnostic marker for sepsis: a systematic review and meta-analysis. Lancet Infect Dis. 2013;13:426–35.
31. Sager R, Kutz A, Mueller B, Schuetz P. Procalcitonin-guided diagnosis and antibiotic stewardship revisited. BMC Med. 2017;15:15.
32. Aksu NM, Aksoy DY, Akkaş M, Yilmaz H, Akman C, Yildiz BO, et al. 25-OHvitamin D and procalcitonin levels after correction of acute hyperglycemia. Med Sci Monit. 2013;19:264–8.
33. Cipriano A, Rebelos E, Park N, Santini M. Moderate increase of serum levels of procalcitonin in diabetic ketoacidosis. Neth J Med. 2018;76:454.
34. Anno T, Shigemoto R, Kawasaki F, Irie S, Miyashita N, Kaku K, et al. Marked elevation of plasma procalcitonin levels in patients with diabetic ketoacidosis: a possible useful diagnostic biomarker. Diabetes Metab. 2019. https ://doi.org/10.1016/j.diabet.2019.05.006.
35. Perkins JM, Joy NG, Tate DB, Davis SN. Acute effects of hyperinsulinemia and hyperglycemia on vascular inflammatory biomarkers and endothelial function in overweight and obese humans. Am J Physiol Endocrinol Metab. 2015;309:E168–76.
36. Esposito K, Nappo F, Marfella R, Giugliano G, Giugliano F, Ciotola M, et al. Inflammatory cytokine concentrations are acutely increased by hyperglycemia in humans: role of oxidative stress. Circulation. 2002;106:2067–72.
37. Whang KT, Vath SD, Becker KL, Snider RH, Nylen ES, Muller B, et al.
Procalcitonin and proinflammatory cytokine interactions in sepsis. Shock. 2000;14:73–8.
38. Nijsten MW, Olinga P, The TH, de Vries EG, Koops HS, Groothuis GM, et al. Procalcitonin behaves as a fast responding acute phase protein in vivo and in vitro. Crit Care Med. 2000;28:458–61.
39. Dalton RR, Hoffman WH, Passmore GG, Martin SLA. Plasma C-reactive protein levels in severe diabetic ketoacidosis. Ann Clin Lab Sci. 2003;33:435–42.
40. Lelubre C, Anselin S, Zouaoui Boudjeltia K, Biston P, Piagnerelli M. Interpretation of C-Reactive Protein Concentrations in Critically Ill Patients. Biomed Res Int [Internet]; 2013. https://www.ncbi.nlm.nih.gov/pmc/artic les/PMC3826426/. Accessed 16 Feb 2020.
41. Rubia-Rubia J, Arias A, Sierra A, Aguirre-Jaime A. Measurement of body temperature in adult patients: comparative study of accuracy, reliability and validity of different devices. Int J Nurs Stud. 2011;48:872–80.