Лихорадка и гипотермия представляют две популяции пациентов с сепсисом и ассоциируются с наружной температурой
Thomas‑Rüddel et al. Crit Care (2021) 25:368
Исследование
Лихорадка и гипотермия представляют две популяции пациентов с сепсисом и ассоциируются с наружной температурой (температурой за окном)
Перевод оригинальной статьи «Fever and hypothermia represent two populations of sepsis patients and are associated with outside temperature»
Авторы: Daniel O. Thomas‑Rüddel, Peter Hoffmann, Daniel Schwarzkopf, Christian Scheer, Friedhelm Bach, Marcus Komann, Herwig Gerlach, Manfred Weiss, Matthias Lindner, Hendrik Rüddel, Philipp Simon, Sven‑Olaf Kuhn, Reinhard Wetzker, Michael Bauer, Konrad Reinhart, Frank Bloos, MEDUSA study group
Center for Sepsis Control and Care, Jena University Hospital, Jena, Germany. Department of Anesthesiology and Intensive Care Medicine, Jena University Hospital, Am Klinikum 1, 07747 Jena, Germany.
Potsdam Institute for Climate Impact Research, Potsdam, Germany.
Department of Anesthesiology and Intensive Care Medicine, Greifswald University Hospital, Greifswald, Germany.
Department of Anesthesiology and Intensive Care Medicine, Evangelisches Klinikum Bethel, Bielefeld, Germany.
Department of Anesthesiology and Intensive Care Medicine, Vivantes Klinikum Neuköln, Berlin, Germany.
Department of Anesthesiology and Intensive Care Medicine, Ulm University Hospital, Ulm, Germany.
Department of Anesthesiology and Intensive Care Medicine, University Hospital Schleswig‑Holstein, Kiel, Germany.
Department of Anesthesiology and Intensive Care Medicine, Leipzig University Hospital, Leipzig, Germany.
Department of Anesthesiology and Operative Intensive Care Medicine (CCM, CVK), Charité University Medical Center Berlin, Berlin, Germany.
Введение
Великий канадский врач сэр William Osler в 1896 году написал: «Человечество имеет трех великих врагов: лихорадку, голод и войну, но самым великим врагом из них является лихорадка» [1]. Лихорадка вызывается за счет высвобождения пирогенов, таких как белки острой фазы, и часто является первым симптомом инфекции [2]. Но длительные наблюдения сепсиса показывают, что терморегуляторный ответ от пациента к пациенту варьируется [3—5]. Определения Сепсис-1, основанные на синдроме системного воспалительного ответа (ССВО или SIRS), включают в себя как лихорадку, так и гипотермию [6]. Дебаты по влиянию терморегуляторного ответа на прогноз при сепсисе, начавшись в 60-х годах прошлого столетия, продолжаются по настоящую пору, а данные остаются противоречивыми. Гипотермия или лихорадка у животных моделей с тяжелой инфекцией или воспалением ассоциируется либо с защитным, либо с пагубным эффектами [7—10]. В мета-анализе клинических данных, пациенты с сепсисом и гипотермией показывали более высокую летальность по сравнению с пациентами с сепсисом и лихорадкой [11]. Однако, включенные в этот мета-анализ исследования были небольшими и имели высокую гетерогенность.
За последнее десятилетие свое признание получила иммунологическая теория устойчивости против толерантности, как двух отдельных и хорошо регулируемых моделей ответа на инфекцию [12, 13]. Недавние исследования на животных моделях определили дальнейшие перспективы в понимании патофизиологии и метаболизма, когда гипотермия нацелена на толерантность и сохранение энергии, а лихорадка нацелена на очищение от патогена с большим расходом энергии. В экспериментах на животных показано, что физиологическое здоровье, питание, температура окружающей среды и степень иммунной защиты являются важнейшими факторами, содействующими либо лихорадке, либо гипотермии [10, 14, 15].
Для изучения того, существуют ли подобные процессы у человека, мы оценили терморегуляторный ответ у пациентов с сепсисом и его ассоциации с предрасполагающими факторами, включая сюда температуру окружающей среды (за окном), тяжесть заболевания и клинические исходы путем вторичного анализа большой базы данных [16].
Методы
Дизайн исследования
Это был вторичный анализ проспективно собранной базы данных пациентов в исследовании MEDUSA - кластерного, рандомизированного исследования качества, нацеленного на улучшение ранней диагностики сепсиса и его лечения в участвующих в исследовании госпиталях [16]. Оригинальное исследование было зарегистрировано на ClinicalTrials.gov (NCT01187134) и одобрено локальными этическими комитетами (см.дополнительный файл 1).
Популяция исследования
В исследование были включены пациенты отделений интенсивной терапии (ОИТ) с подозрением на инфекцию или с подтвержденной инфекцией, у которых было не менее одной, связанной с инфекцией, органной дисфункции и которым проводилось лечение в период с июля 2011 года по май 2015 года. Пациенты исключались из исследования в случаях, когда у них имелись ограничения к релевантной терапии, которым не проводилось лечение в ОИТ госпиталей, участвующих в исследовании, или в случаях, когда инфекционный контроль начинался в другом госпитале. Характеристики госпиталей, участвующих в исследовании, были показаны ранее [16. 17]. Поскольку анализ был вторичным, размер выборки не определялся.
Сбор данных
Сбор данных и определения были предварительно описаны [16, 17]. Кратко, начало сепсиса или септического шока определялось на момент выявления органной дисфункции, связанной с инфекцией. Измерения температуры тела были частью рутинного ухода. Центральная температура измерялась ректально, в барабанной перепонке или в кровотоке. В случае измерения температуры в ротовой полости, в подмышечной или паховой областях, персоналу были даны инструкции добавлять 0.5°C к измеренной температуре. В первые 24 часа после начала сепсиса у каждого пациента записывалась наибольшее патологическое значение температуры тела. Наибольшие значения лабораторных параметров, а не их изменение с течением времени, в первые 24 часа после начала сепсиса записывались как исходные значения.
Для анализа погодных условий окружающей среды (наружной температуры) использовались данные сети метеорологических станций Немецкой метеорологической службы (the German Meteorological Service [DWD]). Ежедневные данные от 273 метеостанций, которые работают с 1961 года по настоящее время, были отобраны и интерполированы на регулярную сетку 12 × 12 км с использованием обратного взвешивания расстояний (inverse distance weighting [IDW]) с поправкой на высоту для значений температуры [18], в результате чего была получена однородная база данных, которая ежегодно расширяется и используется также для различных приложений диагностики и мониторинга изменения климата на национальном уровне [19]. Средняя температура наружного воздуха за два дня до начала сепсиса и в день начала сепсиса были сопоставлены со случаями на основании почтовых индексов госпиталей, принимавших участие в исследовании, для всей дальнейшей аналитики использовалось среднее значение за три дня.
Анализ данных
Пациенты были распределены в четыре группы - гипотермия ( ≤ 35.5 °C), нормотермия (35.6–37.5 °C «основано на опубликованных данных» [20]), гипертермия (37.6–38.9 °C) и лихорадка ( ≥ 39 °C). Различия между группами, согласно демографическим и клиническим характеристикам, представлены с помощью описательной статистики, а оценка проводилась соответствующими одномерными тестами в зависимости от структуры и распределения данных. Для изучения взаимосвязи между температурой тела и лактатом, прокальцитонином и летальностью, между температурой тела и температурой окружающей среды использовались графические изображения. Для более детального описания ассоциаций внутри групп с гипотермией и нормотермией использовался интервал, равный 1°C. Так как гипертермия охватывала интервал 1.5°C, подобное разделение внутри этой группы не проводилось. Для лучшей визуализации эффекта от экстремально высокой температуры, мы использовали дополнительную пороговую точку в 40.5°C. Нелинейные отношения были изучены с помощью регрессионного анализа с дробными полиномами с построением регрессионных прогнозов [21]. Были исключены одно резко выделяющееся значение температуры тела с температурой <25°C и четыре резко выделяющихся значения внешней температуры < -15°C.
Для дальнейшего выявления предикторов, ассоциированных с четырьмя температурными группами, была выполнена мультиноминальная логистическая регрессия, в которую включили характеристики пациентов (возраст, половая принадлежность, ИМТ), характеристики инфекции (происхождение и очаг инфекции, результаты микробиологических посевов), маркеры воспаления (прокальцитонин, количество лейкоцитов, лейкопения) и среднюю температуру окружающей среды. Из финальной модели были исключены предикторы, не связанные с температурой. Для достижения нормального распределения в регрессионном анализе прокальцитонин логарифмически преобразовывали с основанием 10. Для оценки того, действительно ли температура тела и летальность независимо связаны, был проведен расчет модели логистической регрессии, прогнозирующей 28-дневную летальность, в которую включались характеристики пациентов (возраст, половая принадлежность, ИМТ), характеристики инфекции (происхождение и очаг инфекции, результаты микробиологических посевов крови), маркеры воспаления (прокальцитонин, количество лейкоцитов, лейкопения), тяжесть заболевания (шкала SOFA, лактат, септический шок), время до начала введения антибиотиков и средняя температура окружающей среды, как возможно вмешивающиеся факторы. Регрессионный анализ проводился с помощью обобщенных иерархических линейных моделей со случайным перехватом для корректировки кластеризации случаев в госпиталях. Анализы чувствительности не проводились.
Результаты
Характеристики пациентов
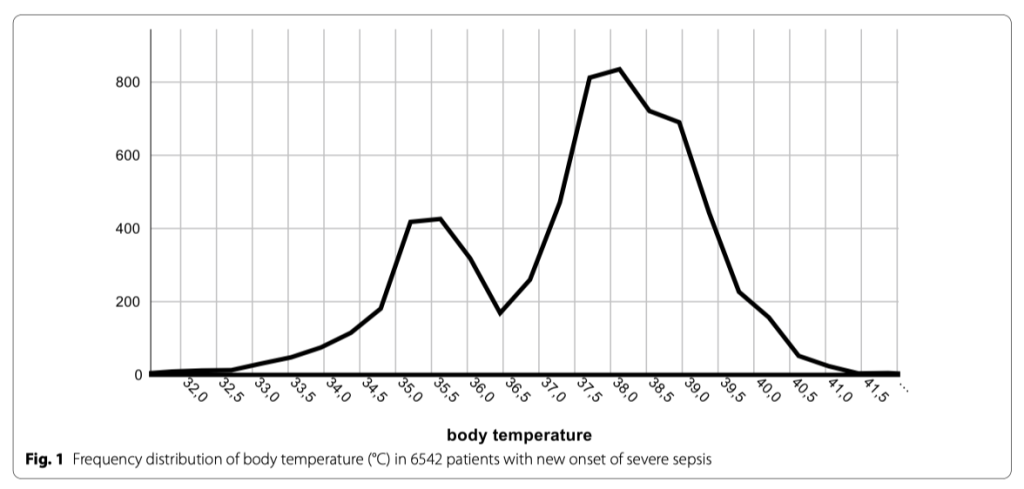
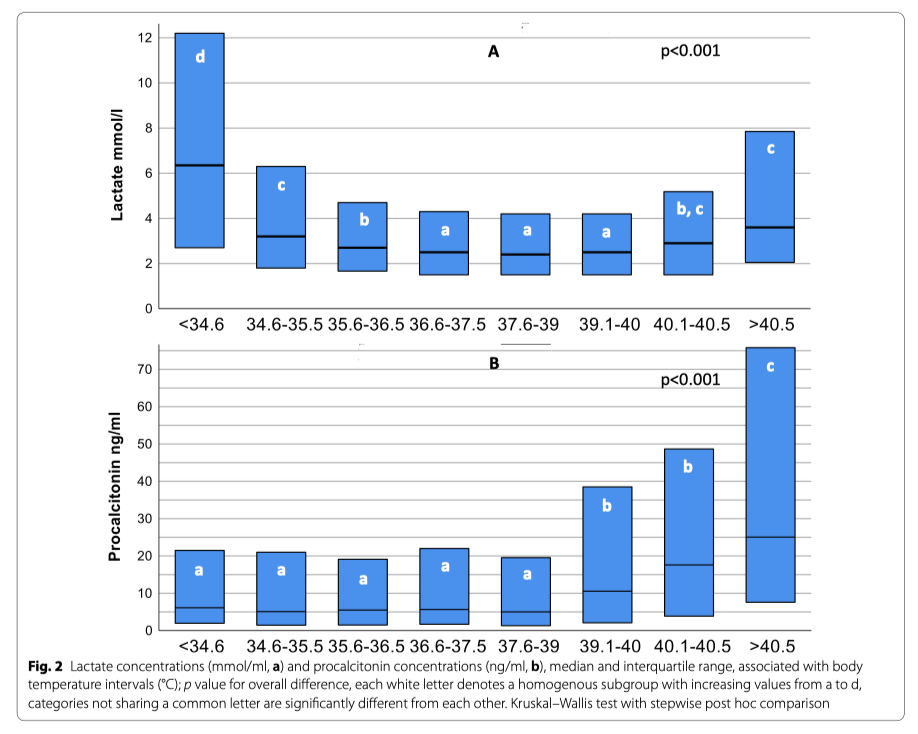
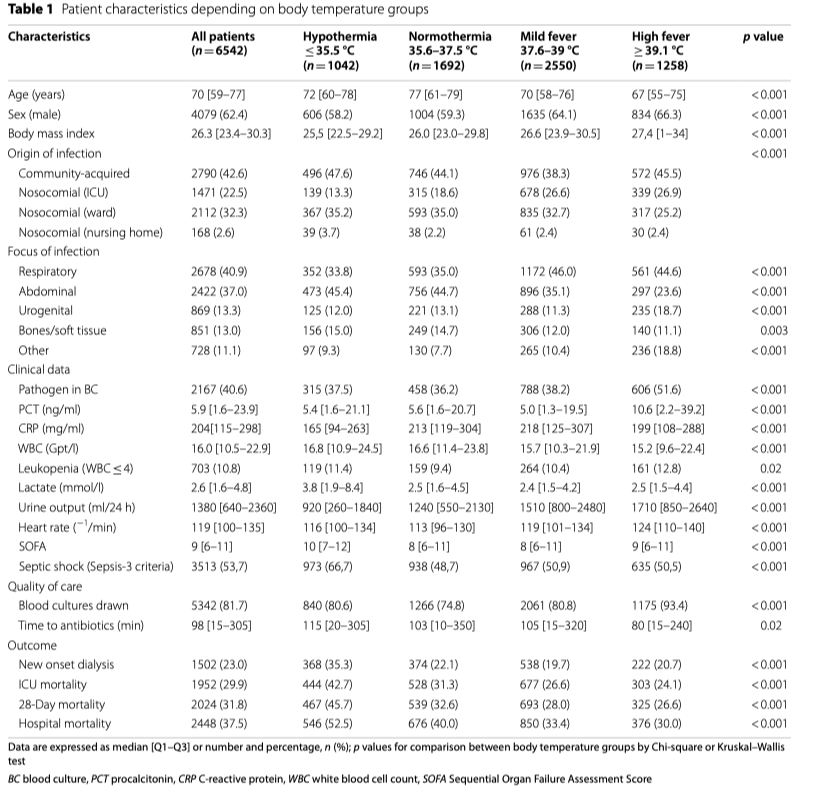
Во время периода исследования документально зарегистрировано 6561 пациентов с сепсисом и септическим шоком из 40 госпиталей. Температура тела не была записана у 19 пациентов, так что общее количество случаев, готовых к анализу, оказалось 6542. Температура тела показала бимодальное распределение паттернов с пиком частоты около 35.5°C и примерно в два раза большим пиком между 38 и 38.5°C (Fig. 1). Клиническая информация в виде начальных значений и исходов, зависящих от температуры тела в группах, показана в Таблице 1. Наивысшие значения лактата наблюдались на обоих спектрах экстремальной температуры тела (Fig. 2A, Additional file 2: aFigure 1) в то время, как уровни прокальцитонина ассоциировались с наибольшей (Fig. 2B) и с наименьшей температурой тела (Additional file 2: aFigure 2).
Средняя температура окружающей среды
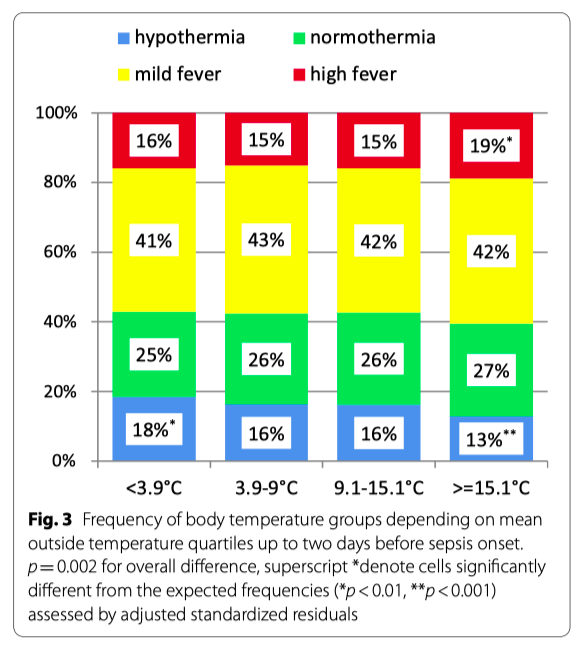
Средняя температура окружающей среды до и во время клинического проявления сепсиса существенно ассоциировалась с температурой тела (p <0.001, see Additional file 2: aFigure 3&4). В случае низкой температуры окружающей среды (за окном) больше было случаев с гипотермией. Если же температура за окном была высокой, частота гипотермий снижалась за счет увеличения частоты лихорадки (Fig. 3). Средняя температура окружающей среды не ассоциировалась с летальностью (see Additional file 2: aTable2).
Предикторы гипотермии, нормотермии и лихорадки
Модель мультиноминальной регрессии выявила предикторы, независимо ассоциированные с температурными группами (Table 2). Вне-больничный сепсис, абдоминальный источник инфекции, более низкие показатели ИМТ, более старший возраст и низкая температура окружающей среды были независимо связаны с гипотермией. Положительные микробиологические посевы крови, сепсис и высокие уровни прокальцитонина были ассоциированы с тяжелой лихорадкой.
Летальность
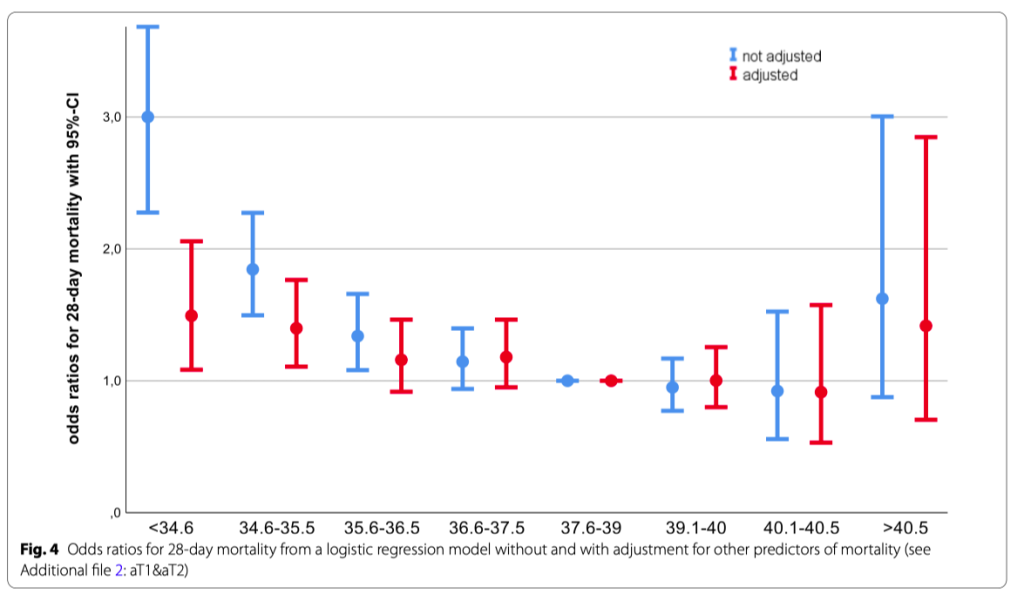
28-дневная летальность была выше (45.7%) в гипотермической группе пациентов и ниже (27.7%) в группе пациентов с высокой температурой (p <0.001) (Table 1, see Additional file 2: aFigure 5). Если посмотреть на меньшие интервалы температуры тела, можно увидеть снижение летальности при более высокой температуре тела — при лихорадке> 40,5°C может иметь место тенденция к увеличению летальности, но без какой-либо статистической значимости ( (Fig. 4, see Additional file 2: aTable 2, aFigures 6&7). После корректировки исходных переменных и тяжести заболевания, повышенный риск смерти, связанный с гипотермией, был менее выражен, при том не было значимого изменения риска смертности для пациентов с лихорадкой. (Fig. 4, see Additional file 2: aTables 1&2). Повторение анализа с четырьмя категориями температуры тела показало аналогичные результаты. (Additional file 2: aTables 3&4).
Обсуждение
Используя большую базу данных, мы наблюдали бимодальное распределение температуры тела у пациентов с сепсисом. Мы подтвердили увеличение летальности, ассоциированное с гипотермией, но после корректировки на тяжесть заболевания такая ассоциация стала менее выраженной. Вне-больничный сепсис, возраст, низкий ИМТ и абдоминальный очаг инфекции ассоциируются с гипотермией в то время, как бактеремия и высокий уровень прокальцитонина ассоциируются с лихорадкой. Температура окружающей среды оказывает свое влияние на температурную реакцию тела у пациентов с сепсисом.
Определение нормотермии, по-видимому, в основном зависит от возраста и места измерения [20]. Мы выбрали интервал 35,6–37,5°C в большей степени ориентируясь на пожилых пациентов в используемой базе данных, клиническую оценку и преимущества использования интервалов 0,5 ° C для анализа и удобочитаемости. Второй пик частоты температуры тела около 35,5°C, наблюдаемый в наших данных, находится около нижней границы нормы, но эти значения будут редкими для здорового населения. Средняя температура тела в такой популяции будет немного выше 36,5°C [20], что соответствует наблюдаемой частоте самой низкой температуры тела в нашем наборе данных. Очевидная интерпретация состоит в том, что пациенты с тяжелым сепсисом демонстрируют либо гипотермию, либо, что намного чаще, лихорадку. Наличи части пациентов с сепсисом и гипотермией общеизвестно и было частью критериев ССВО [6], но, насколько нам известно, бимодальный образец гипер- или гипотермического ответа, когда нормотермические пациенты являются редкостью, не был еще описан так четко.
Лихорадка является физиологической реакцией на инфекцию, направленной на угнетение роста бактерий, останавливающая рост большинства грибов и ускоряющая уничтожение бактерий иммунными клетками [2, 22, 23]. Патогены в культуре крови и высокие уровни прокальцитонина в нашем исследовании/базе данных ассоциировались с лихорадкой, что может представлять сильное иммунное сопротивление, несущее пользу. Ранее проведенные исследования показали конфликтующие результаты в отношении связи уровня и типа циркулирующих интерлейкинов и TNF-α с типом терморегуляторного ответа у пациентов с сепсисом [24—27]. Но кинетика прокальцитонина может лучше подходить для измерения активации воспаления, чем TNF-α и интерлейкины, чьи пиковые значения в большинстве клинических сценариев приходятся до первого взятия проб крови [28]. Механизмы, регулирующие гипотермию, в которые вовлечены те же цитокины, что и при гипертермии, до конца не выяснены [10, 24–27]. В экспериментах на животных терморегуляторная реакция на сепсис зависит от температуры окружающей среды [9, 10]. Такой феномен окрестили пойкилотермией, означающей диссоциацию верхнего и нижнего порога регуляции температуры, когда температура тела зависит от внешних причин [9]. Но недавние данные указывают на хорошо регулируемый механизм, при котором активированный иммунитет находится в энергетическом компромиссе с гомеотермией [10]. Находясь в условиях холода или ограничения калорий, мыши показывают гипометаболический ответ, поддерживающий толерантность в то время, как теплая температура окружающей среды и хорошее питание показывают нормотермический ответ, который поддерживает сопротивляемость, но такой ответ ассоциирован с большей летальностью [10]. Наши данные показали, что низкий ИМТ и более старший возраст, что являются суррогатными маркерами сниженного метаболизма, были ассоциированы с гипотермией, и эти данные находятся в соответствии с результатами ранее проведенного небольшого когортного исследования [25]. Другие факторы, ассоциированные с гипотермией - (абдоминальный очаг) или сепсис, связанный с ОИТ, с большим трудом поддаются интерпретации потому, что абдоминальная хирургия может поддерживать гипотермию, а лечение в ОИТ ассоциируется с множеством манипуляций - активное согревание, введение энергетических субстратов и вмешательства, направленные на восстановление сердечно-сосудистого гомеостаза уже в ранней фазе заболевания.
Насколько нам известно, мы первые, кто показал влияние температуры окружающей среды на терморегуляторный ответ при сепсисе у человека, в то время как ответ в виде гипотермии в ответ на холодную погоду в зависимости от метаболических резервов описан достаточно давно [29], а теоретическая дискуссия об адаптивном гипометаболическом состоянии при критических состояниях началась совсем недавно [30]. Средняя температура наружного воздуха в районе расположения госпиталя для конкретного пациента является лишь приблизительным показателем ситуации, которая зависит от местной погоды на момент начала болезни, от условий проживания, отопления и одежды. В случае сепсиса, связанного с госпитализацией (hospital-acquired sepsis), следует ограничить влияние холода, а вот вне-больничный сепсис действительно показал наличие связи с гипотермией. Когда же приходит теплая погода следует иметь в виду, что в Германии частные дома, общие палаты в госпиталях и, в некоторых случаях, и отделения интенсивной терапии не используют регулярно кондиционирование воздуха, что приводит к прямой связи между теплой погодой и температурой внутри помещения. Возможность показать эффект с помощью такого несовершенного и косвенного показателя может указывать на то, что в реальности этот эффект может быть довольно серьезным, поскольку этот эффект явно виден даже при большом статистическом шуме.
В отличие от мышей, гипотермия при сепсисе у человека ассоциируются с большей летальностью, о чем говорят и наши данные и данные литературы [11]. Но при сравнении с экспериментальными животными моделями, когда манипуляции производятся только с потреблением калорий или с температурой окружающей среды, пациенты (люди) более гетерогенны. Возраст, к примеру, ассоциируется с гипотермией и с худшими исходами. После корректировки на факторы, ассоциирующиеся с типом терморегуляторного ответа и тяжестью заболевания, связь между гипотермией и летальностью становилась менее выраженной. Таким образом горячо обсуждаемый вопрос - действительно ли и у каких пациентов лихорадка или гипотермия является адаптивным или дезадаптивным ответом и какой из них приводит к пагубным последствиям [9, 31, 32] остается открытым. Но этот вопрос имеет первостепенное значение поскольку существует тенденция к коррекции температуры тела пациента до так называемых нормальных значений с помощью физических или фармакологических вмешательств в рамках стандартной (рутинной) терапии/ухода или при проведении клинических исследований [33—37]. Касательно лечения лихорадки имеются данные хорошего качества, что пациентам не приносит пользу температурный контроль [35, 37] даже несмотря на то, что он широко используется [38], а пациенты с лихорадкой свыше 40°C почти не представлены в этих исследованиях. В то время как индуцированная гипотермия, вероятно, несет в себе вред [36], не имеется клинических данных в доказательство того, что пациентам с гипотермией принесет пользу активное согревание, направленное на достижение нормотермии или даже на умеренную гипертермию. И только одно небольшое пилотное исследование пытается решить этот вопрос (NCT02706275).
Некоторые различия в качестве ухода/лечения находятся в зависимости от температуры тела, что согласуется с ранее полученными результатами [39, 40]. Нет ничего удивительного в том, что при наличии лихорадки клиницисты срочно начинают назначать антимикробные препараты и брать пробы крови на микробиологические посевы, так как они уверены в большей вероятности выявления патогена по сравнению с пациентами с субфебрильной температурой тела [41, 42].
Наш анализ имеет несколько сильны и слабых сторон. Как мы понимаем, наше исследование было первым, в котором использовалось множество случаев разной степени лихорадки и гипотермии в связи с температурой окружающей среды. Характер исследования - вторичный анализ данных, полученных в многоцентровом исследовании по улучшению качества, объясняет то, что доступность информации была несколько ограниченной. К сожалению, мы не имели доступа к информации, касающейся доставки кислорода и его потребления, к детальному анамнезу пациентов в отношении сопутствующей патологии, к назначению антипиретиков и седативных препаратов, цитокиновым панелям, а также мы не имели детальной информации о реальном состоянии окружающей пациента среды и о серии измерений температуры. Более того, мы не смогли использовать температурные траектории для большего разделения пациентов в сформированных нами группах [43]. Да и само измерение температуры не было стандартизировано. Несмотря на то, что за последние десять лет менеджмент температуры не претерпел каких-либо системных изменений, наш набор данных не может быть репрезентативным, что связано с изменениями в менеджменте сепсиса. При анализе наружной температуры, которая явно связана с местоположением госпиталя, особую озабоченность вызывают ошибки из-за различий в уровне госпиталей. Мы учли кластеризацию, включив случайные перехваты в наш регрессионный анализ, но не смогли оценить влияние конкретных госпитальных факторов.
Выводы
Лихорадка и гипотермия есть два, различающихся между собой, ответа человека на сепсис, при этом нормотермия встречается очень редко. Регуляторные причины лихорадки и гипотермии, как, впрочем, и их потенциальное влияние на исход на сегодня изучены недостаточно и необходимы более детализированные обсервационные исследования для лучшего их понимания прежде, чем терапевтические вмешательства, направленные на температуру тела или метаболическую адаптацию в целом, могут быть проверены на правильной целевой популяции.

Список литературы:
1. Osler W. The study of the fevers of the south. J Am Med Assoc. 1896;XXVI(21):999–1004.
2. Walter EJ, Hanna‑Jumma S, Carraretto M, Forni L. The pathophysiological basis and consequences of fever. Crit Care. 2016;20(1):200.
3. Clemmer TP, Fisher CJ Jr, Bone RC, Slotman GJ, Metz CA, Thomas FO. Hypothermia in the sepsis syndrome and clinical outcome. The Methylprednisolone Severe Sepsis Study Group. Critical Care Med. 1992;20(10):1395–401.
4. DuPont HL, Spink WW. Infections due to gram‑negative organisms: an analysis of 860 patients with bacteremia at the University of Minnesota Medical Center, 1958–1966. Medicine (Baltimore). 1969;48(4):307–32.
5. Mchenry MC, Martin WJ, Wellman WE. Bacteremia due to gram‑negative Bacilli ‑ review of 113 cases encountered in 5‑year period 1955 through 1959. Ann Intern Med. 1962;56(2):207.
6. Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, Schein RM, Sibbald WJ. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee American College of Chest Physicians/Society of Critical Care Medicine. Chest. 1992;101(6):1644–55.
7. Webb WR, Deguzman VC, Grogan JB, Artz CP. Hypothermia: its effects upon hematologic clearance in experimentally induced staphylococcal bacteremia. Surgery. 1962;52:643–7.
8. Atwood RP, Kass EH. Relationship of Body Temperature to the Lethal Action of Bacterial Endotoxin. J Clin Invest. 1964;43:151–69.
9. Romanovsky AA, Szekely M. Fever and hypothermia: two adaptive thermoregulatory responses to systemic inflammation. Med Hypotheses. 1998;50(3):219–26.
10. Ganeshan K, Nikkanen J, Man K, Leong YA, Sogawa Y, Maschek JA, Van Ry T, Chagwedera DN, Cox JE, Chawla A. Energetic trade‑offs and hypometabolic states promote disease tolerance. Cell. 2019;177(2):399‑413 e312.
11. Rumbus Z, Matics R, Hegyi P, Zsiboras C, Szabo I, Illes A, Petervari E, Balasko M, Marta K, Miko A, et al. Fever Is associated with reduced, hypothermia with increased mortality in septic patients: a meta‑analysis of clinical trials. PLoS ONE. 2017;12(1):e0170152.
12. McCarville JL, Ayres JS. Disease tolerance: concept and mechanisms. Curr Opin Immunol. 2018;50:88–93.
13. Schneider DS, Ayres JS. Two ways to survive infection: what resistance and tolerance can teach us about treating infectious diseases. Nat Rev Immunol. 2008;8(11):889–95.
14. Steiner AA, Romanovsky AA. Energy trade‑offs in host defense: immunology meets physiology. Trends Endocrinol Metab. 2019;30(12):875–8.
15. Wang A, Medzhitov R. Counting calories: the cost of inflammation. Cell.2019;177(2):223–4.
16. Bloos F, Ruddel H, Thomas‑Ruddel D, Schwarzkopf D, Pausch C, Harbarth S, Schreiber T, Grundling M, Marshall J, Simon P, et al. Effect of a multifaceted educational intervention for anti‑infectious measures on sepsis mortality: a cluster randomized trial. Intensive Care Med. 2017;43(11):1602–12.
17. Bloos F, Thomas‑Ruddel D, Ruddel H, Engel C, Schwarzkopf D, Marshall JC, Harbarth S, Simon P, Riessen R, Keh D, et al. Impact of compliance with infection management guidelines on outcome in patients with severe sepsis: a prospective observational multi‑center study. Crit Care. 2014;18(2):R42.
18. Dokumentation des Interpolationsverfahrens [https://swift.dkrz.de/v1/ dkrz_a88e3fa5289d4987b4d3b1530c9feb13/ReKliEs‑De/Supplement/ Info/Interpolationsverfahren_PIK.pdf]
19. Hoffmann P, Menz C, Spekat A. Bias adjustment for threshold‑based climate indicators. Adv Sci Res. 2018;15:107–16.
20. Geneva II, Cuzzo B, Fazili T, Javaid W. Normal body temperature: a systematic review. Open Forum Infect Dis. 2019;6(4):ofz032.
21. Sauerbrei W, Royston P, Binder H. Selection of important variables and determination of functional form for continuous predictors in multivariable model building. Stat Med. 2007;26(30):5512–28.
22. Evans SS, Repasky EA, Fisher DT. Fever and the thermal regulation of immunity: the immune system feels the heat. Nat Rev Immunol. 2015;15(6):335–49.
23. Bergman A, Casadevall A. Mammalian endothermy optimally restricts fungi and metabolic costs. mBio. 2010;1(5).
24. Marik PE, Zaloga GP. Hypothermia and cytokines in septic shock.
Norasept II Study Investigators. North American study of the safety and efficacy of murine monoclonal antibody to tumor necrosis factor for the treatment of septic shock. Intens Care Med. 2000;26(6):716–21.
25. Wiewel MA, Harmon MB, van Vught LA, Scicluna BP, Hoogendijk AJ, Horn J, Zwinderman AH, Cremer OL, Bonten MJ, Schultz MJ, et al. Risk factors, host response and outcome of hypothermic sepsis. Crit Care. 2016;20(1):328.
26. Bhavani SV, Wolfe KS, Hrusch CL, Greenberg JA, Krishack PA, Lin J, Lecompte‑Osorio P, Carey KA, Kress JP, Coopersmith CM, et al. Temperature trajectory subphenotypes correlate with immune responses in patients with sepsis. Crit Care Med. 2020;48(11):1645–53.
27. Leon LR. Hypothermia in systemic inflammation: role of cytokines. Front Biosci. 2004;9:1877–88.
28. Meisner M. Procalcitonin: Erfahrungen mit einer neuen Meßgröße für bakterielle Infektionen und systemische Inflammation. LaboratoriumsMedizin J Lab Med. 1999;23:63.
29. Bittel J. The different types of general cold adaptation in man. Int J Sports Med. 1992;13(Suppl 1):S172‑176.
30. Stanzani G, Tidswell R, Singer M. Do critical care patients hibernate? Theoretical support for less is more. Intensive Care Med. 2020;46(3):495–7.
31. Steiner AA, Fonseca MT, Soriano FG. Should we assume that hypothermia is a dysfunction in sepsis? Crit Care (London, England). 2017;21(1):8.
32. Cunha BA. With sepsis: If fever is good, then hypothermia is bad! Critical Care Med. 2012;40(10):2926.
33. Doyle JF, Schortgen F: Should we treat pyrexia? And how do we do it? Critical care. 2016;20.
34. Drewry AM, Ablordeppey EA, Murray ET, Stoll CRT, Izadi SR, Dalton CM, Hardi AC, Fowler SA, Fuller BM, Colditz GA. Antipyretic therapy in critically ill septic patients: a systematic review and meta‑analysis. Crit Care Med. 2017;45(5):806–13.
35. Dallimore J, Ebmeier S, Thayabaran D, Bellomo R, Bernard G, Schortgen F, Saxena M, Beasley R, Weatherall M, Young P. Effect of active temperature management on mortality in intensive care unit patients. Crit Care Resusc. 2018;20(2):150–63.
36. Itenov TS, Johansen ME, Bestle M, Thormar K, Hein L, Gyldensted L, Lindhardt A, Christensen H, Estrup S, Pedersen HP, et al. Induced hypothermia in patients with septic shock and respiratory failure (CASS): a randomised, controlled, open‑label trial. Lancet Respir Med. 2018;6(3):183–92.
37. Young PJ, Bellomo R, Bernard GR, Niven DJ, Schortgen F, Saxena M, Beasley R, Weatherall M. Fever control in critically ill adults. An individual patient data meta‑analysis of randomised controlled trials. Intens Care Med. 2019;
38. Beverly A, Walter E, Carraretto M. Management of hyperthermia and hypothermia in sepsis: a recent survey of current practice across UK intensive care units. J Intensive Care Soc. 2016;17(1):88–9.
39. Sunden‑Cullberg J, Rylance R, Svefors J, Norrby‑Teglund A, Bjork J, Inghammar M. Fever in the emergency department predicts survival of patients with severe sepsis and septic shock admitted to the ICU. Crit Care Med. 2017;45(4):591–9.
40. Kushimoto S, Abe T, Ogura H, Shiraishi A, Saitoh D, Fujishima S, Mayumi T, Hifumi T, Shiino Y, Nakada T‑A et al. Impact of body temperature abnormalities on the implementation of sepsis bundles and outcomes in patients with severe sepsis: a retrospective sub‑analysis of the focused outcome research on emergency care for acute respiratory distress syndrome, sepsis and trauma study. Crit Care Med; 2019.
41. Linsenmeyer K, Gupta K, Strymish JM, Dhanani M, Brecher SM, Breu AC.
Culture if spikes? Indications and yield of blood cultures in hospitalized medical patients. J Hosp Med. 2016;11(5):336–40.
42. Taniguchi T, Tsuha S, Shiiki S, Narita M. High positivity of blood cultures obtained within two hours after shaking chills. Int J Infect Dis. 2018;76:23–8.
43. Bhavani SV, Carey KA, Gilbert ER, Afshar M, Verhoef PA, Churpek MM. Identifying novel sepsis subphenotypes using temperature trajectories. Am J Respirat Crit Care Med. 2019;
44. ESICM LIVES 2017: 30th ESICM annual congress. September 23–27, 2017.Intensive Care Med Exp. 2017;5(Suppl 2):44.
Thomas‑Rüddel et al. Crit Care (2021) 25:368