Array
(
[NAME] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[~NAME] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[PREVIEW_PICTURE] => Array
(
[ID] => 4575
[TIMESTAMP_X] => 11.11.2024 15:27:43
[MODULE_ID] => iblock
[HEIGHT] => 481
[WIDTH] => 720
[FILE_SIZE] => 51382
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/dde/mvp8dux6juddpj58xbxh12zdjyjd2i89
[FILE_NAME] => michael-schiffer-13UugSL9q7A-unsplash.jpg
[ORIGINAL_NAME] => michael-schiffer-13UugSL9q7A-unsplash.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 491e6a28486edffa2214768e4395df81
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/dde/mvp8dux6juddpj58xbxh12zdjyjd2i89/michael-schiffer-13UugSL9q7A-unsplash.jpg
[UNSAFE_SRC] => /upload/iblock/dde/mvp8dux6juddpj58xbxh12zdjyjd2i89/michael-schiffer-13UugSL9q7A-unsplash.jpg
[SAFE_SRC] => /upload/iblock/dde/mvp8dux6juddpj58xbxh12zdjyjd2i89/michael-schiffer-13UugSL9q7A-unsplash.jpg
[ALT] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[TITLE] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
)
[~PREVIEW_PICTURE] => 4575
[DETAIL_TEXT] =>
Front. Cell. Infect. Microbiol. 12:962470. doi: 10.3389/fcimb.2022.962470.
He Y, Xu J, Shang X, Fang X, Gao C, Sun D, Yao L, Zhou T, Pan S, Zou X, Shu H, Yang X and Shang Y (2022) Clinical characteristics and risk factors associated with ICU-acquired infections in sepsis: A retrospectivecohort study.
Абстракт
Инфекция, приобретенная в отделении интенсивной терапии (ОИТ), является частой причиной неблагоприятного исхода сепсиса в ОИТ. Тем не менее, сепсис-ассоциированные инфекции, приобретенные в ОИТ, не были полностью охарактеризованы. Исследование направлено на оценку факторов риска и разработку модели, предсказывающей риск инфекций, приобретенных в ОИТ, у пациентов с сепсисом.
Информацию получали из базы данных Medical Information Mart for Intensive Care (MIMIC) IV. Пациенты были случайным образом разделены основную группу и группу сравнения в соотношении 7:3. Модель многомерной логистической регрессии использовалась для выявления независимых факторов риска, которые могли бы предсказать инфекцию, приобретенную в ОИТ.
Из 16 808 включенных пациентов с сепсисом у 2 871 (17,1%) развилась инфекция, приобретенная в ОИТ. У этих пациентов смертность в ОИТ составила 17,7%, внутрибольничная — 31,8%, а также обнаружили, что смертность продолжала расти с 28 до 100 дней после поступления в ОИТ. Уровень оценки по шкале синдрома системного воспалительного ответа (SIRS), SOFA, Оксфордской шкале тяжести острого заболевания (OASIS), шкалам SAPS II и LODS, индексу коморбидности Чарлсона (CCI) и шкале APS III были связаны с инфекцией, полученной в ОИТ, цереброваскулярной недостаточностью, грамотрицательными бактериями, хирургическим ОИТ, трахеостомой, центральным венозным катетером, мочевым катетером, ИВЛ, гемотрансфузией.
Оценка по шкале LODS и антикоагулянтная терапия были независимыми предикторами развития инфекции, приобретенной в ОИТ, у пациентов с сепсисом. Номограмма, основанная на этих независимых предикторах, показала хорошую калибровку и различия как в основной, (AUROC = 0,737; 95% ДИ, 0,725–0,749), так и в группе сравнения (AUROC = 0,751; 95% ДИ, 0,734–0,769) популяциях, и была выше по сравнению с моделями SIRS, SOFA, OASIS, SAPS II, LODS, CCI и APS III.
Инфекции, приобретенные в ОИТ, повышают вероятность смерти у больных с сепсисом. Индивидуальная прогностическая модель на основе номограммы может точно предсказать инфекцию, приобретенную в ОИТ, и оптимизировать лечение или индивидуальную терапию.
Сепсис характеризуется острой органной дисфункцией в ответ на различные тяжелые инфекции и является одним из самых серьезных заболеваний во всем мире, что приводит к высокой смертности пациентов в ОИТ (Rudd et al., 2020; Cavaillon et al., 2020). Среди смертей от сепсиса примерно 15% приходится на острые случаи, возникающие вскоре после начала сепсиса, а 85% — на позднюю фазу, обычно из-за инфекций, приобретенных в ОИТ (Nedeva et al., 2020). В настоящее время доминирующим взглядом на основные причины этих смертей является то, что у пациентов с сепсисом наблюдается иммуносупрессия (Stortz et al., 2018). Пациенты с ослабленным иммунитетом очень восприимчивы к опасным условно-патогенным микроорганизмам, вызывающими инфекции в ОИТ (Sundar and Sires, 2013; Koch et al., 2017). Инфекции, приобретенные в ОИТ, в значительной степени связаны с повышенной внутрибольничной смертностью, увеличением длительности госпитализации и неблагоприятным прогнозом (Otto et al., 2011; van Vught et al., 2017). Поэтому необходимо выявить факторы риска развития внутрибольничных инфекций у больных с сепсисом.
У пациентов с сепсисом на риск развития инфекции в ОИТ влияет множество взаимосвязанных факторов. Например, некоторые исследования, проведенные 10 лет назад с небольшими выборками или охватывающие короткий период времени (Chen et al., 2022), показали, что пожилой возраст, тяжесть заболевания, катетеризация глубоких вен и инвазивная вентиляция были связаны с повышенным риском развития инфекций в ОИТ при сепсисе (Wolkewitz et al., 2014; van Vught et al., 2016; Chen et al., 2019). Несмотря на связь более низкой экспрессии человеческого лейкоцитарного антигена и повышенного уровня интерлейкина-10 (ИЛ-10) с инфекцией, приобретенной в ОИТ (van Vught et al., 2017; Stortz et al., 2018), выявление пациентов с сепсисом с более высоким риском инфекции, приобретенной в ОИТ, остается клинически сложной. В настоящее время многие решения, связанные с ведением сепсис-ассоциированной инфекции в ОИТ основаны на оценке вероятности развития инфекции у пациента в будущем (van Vught et al., 2016). Тем не менее, сепсис-ассоциированные инфекции, приобретенные в ОИТ, еще предстоит полностью охарактеризовать.
Here, we analyzed the data from the large public database Medical Information Mart for Intensive Care (MIMIC) IV and attempted to identify the differences in clinical characteristics between septic patients who did and did not experience ICU- acquired infection, identify the risk factors associated with septic ICU-acquired infection occurrence andits outcomes, and develop a novel risk prediction model that predicts ICU- acquired infections for patients with sepsis.
Мы проанализировали данные из большой общедоступной базы данных Medical Information Mart forIntensive Care (MIMIC) IV и попытались выявить различия в клинических характеристиках у пациентов с сепсисом, перенесшими и не перенесшими инфекцию в ОИТ, определить факторы риска, связанные свозникновение инфекции в ОИТ и ее исходы, а также разработать новую модель прогнозирования риска, которая предсказывает развитие инфекции в ОИТ для пациентов с сепсисом.
Методы
База данных
Все клинические данные, проанализированные в этом исследовании, были извлечены из международной онлайн-базы данных интенсивной терапии MIMIC-IV (версия 1.0) (Johnson et al., 2018), которая включает данные о пациентах, собранные в ОИТ медицинского центра Beth Israel Deaconess в период с 2008 по 2019 год. Эта база включает данные 382 278 пациентов и 523 740 госпитализаций в ОИТ. Один из авторов этого исследования (YH) сдал экзамен по институциональному обучению (номер сертификата: 31935546). Код, используемый для извлечения данных, доступен на GitHub (https://github.com/MIT-LCP/mimic-iv).
Исследуемая популяция и определения
Использовали определение сепсиса на основании концепции Сепсис-3, что означает наличие у пациентов подозрения на инфекцию и оценку по шкале SOFA ≥2 (Singer et al., 2016). Пациенты моложе 18 лет, с оценкой по шкале SOFA <2 при поступлении в ОИТ и с пребыванием в ОИТ менее 48 часов, были исключены (van Vught etal., 2016). Первичная инфекция, приобретенная в ОИТ, определялась как любая новая возможная инфекция с новой положительной культурой патогенных микроорганизмов и новым режимом антибиотикотерапии через 48 часов после поступления в ОИТ в соответствии с критериями Центра по контролю и профилактике заболеваний (Singer et al., 2016; Johnson). и др., 2018).
Сбор данных
Только пациенты с сепсисом при первом поступлении в ОИТ, которые соответствовали критериям включения, были включены в анализ, чтобы избежать двойного учета повторных поступлений. Исходные параметры пациента были извлечены из базы данных: возраст, пол, вес, продолжительность госпитализации в ОИТ и стационаре и смерть. Базовые рейтинговые шкалы ОИТ такие как SOFA, SIRS, OASIS, LODS, SAPS II, APS III и CCI были рассчитаны при поступлении. Сопутствующие заболевания при первом поступлении включали шок, сердечно-сосудистые и цереброваскулярные заболевания, хирургическое вмешательство, рак, заболевание почек и печеночную недостаточность. Вмешательства включали медикаментозное лечение (вазопрессоры, глюкокортикоиды, гепарин), переливание крови, ИВЛ, заместительную почечную терапию, установку центрального венозного и мочевого катетера. Собраны лабораторные данные при поступлении в ОИТ. Результаты микробиологического исследования, зарегистрированные в базе данных, использовались как доказательство инфекции, приобретенной в ОИТ. Были зарегистрированы время возникновения инфекции, приобретенной в ОИТ, все патогенные микроорганизмы и очаги инфекции от момента госпитализации до перевода из ОИТ.
Статистический анализ
Переменные с >20% отсутствующих значений были исключены, а оставшиеся отсутствующие данные были оценены с использованием множественных импутаций. Для описательных данных параметрические количественные переменные выражаются как среднее значение и стандартное отклонение, непараметрические количественные переменные — как медиана и межквартильный размах (IQR), а категориальные переменные — как число и процент. Различия между пациентами с инфекцией, приобретенной в ОИТ, и без нее были проанализированы с использованием t-критерия или критерия хи-квадрат для параметрических переменных, U-критерия Манна-Уитни или критерия Крускала-Уоллиса для непрерывных непараметрических переменных и точного критерия Фишера для категориальных переменных. Кривая выживаемости Каплана-Мейера и анализ ориентиров с использованием логарифмического рангового теста применялись для оценки показателей выживаемости. Все пациенты были случайным образом распределены в когорты для изучения или проверки в соотношении 7:3 (Yang et al., 2021; Liu et al., 2021). В исследуемой когорте потенциальные прогностические факторы были исключены с помощью однофакторной регрессии, которая может быть связана с инфекцией, полученной в ОРИТ, включая все переменные со значением p <0,05. Затем факторы были дополнительно проанализированы с использованием модели бинарной многомерной логистической регрессии для выявления факторов риска (Zhang et al., 2018).
Впоследствии факторы с прогностической значимостью в многомерном логистическом регрессионном анализе использовались для построения модели прогнозирования, а для визуализации модели использовалась номограмма. Значения отношения шансов (OR) были рассчитаны с соответствующими 95% доверительными интервалами (ДИ). Эффективность распознавания номограммы измерялась с использованием индекса согласованности Харрелла (C-индекс), ROC-анализа и площади под кривой AUROC и калибровочных графиков, в то время как калибровочный график использовался для графической оценки калибровка номограммы как в исследуемой, так и в когорте сравнения.
Программное обеспечение Stata/IC 16.0 (Stata Corp., College Station, TX, USA) использовалось для проведения статистического анализа. Двустороннее значение p<0,05 считалось статистически значимым. Для анализа ориентиров использовались пакеты «TSHRC» и «survminer». Пакеты «rms» и «regplot» использовались для проведения модели логистического регрессионного анализа и для построения номограммы. Калибровочные кривые, кривые ROC и кривые DCA были созданы с использованием пакетов «graphics», «pROC» и «rmda» на языке программирования R (версия 4.1.3; R Foundation for Statistical Computing, Вена, Австрия).
Полученные результаты
Демографические и клинические характеристики пациентов
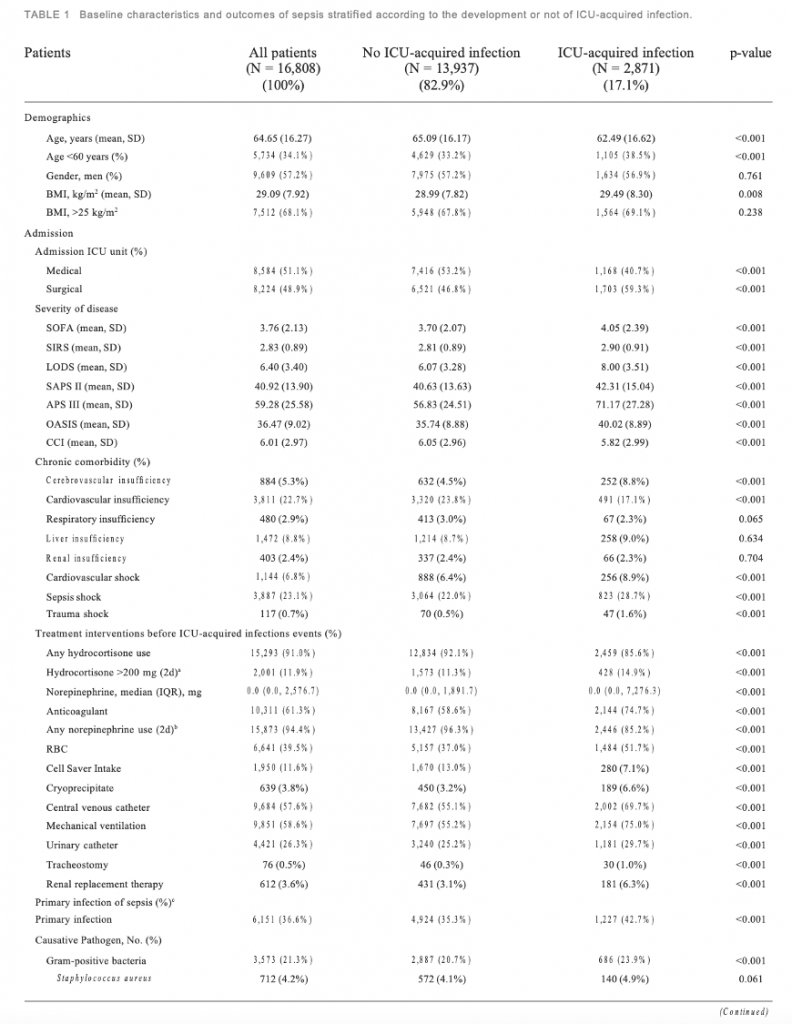
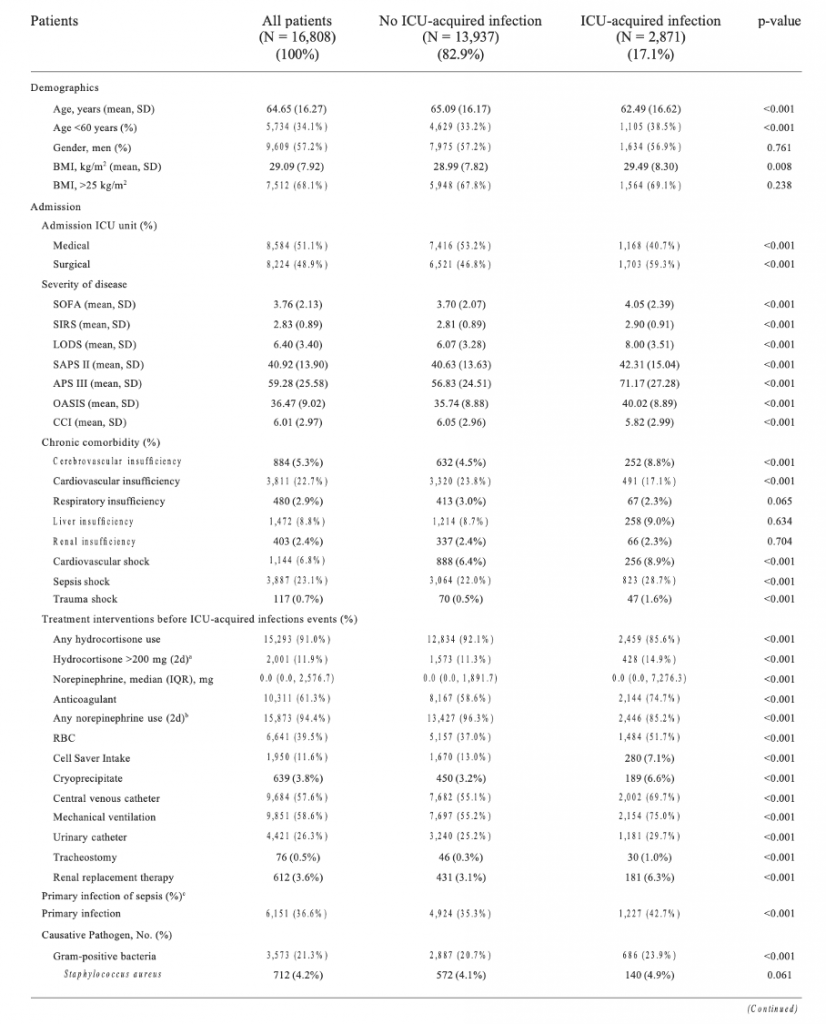
Мы обследовали 16 808 пациентов, которые соответствовали критериям включения (Figure 1). Исходные характеристики пациентов при поступлении представлены в Table 1. Средний возраст включенных пациентов составил 64,65 ± 16,27 года, 9609 пациентов (57,2%) были мужчинами. Среди пациентов с сепсисом у 2871 (17,1%) человека развились инфекции, приобретенные в ОИТ. Средний возраст составил 62,49 ± 16,62 года у пациентов с инфекциями, приобретенными в ОИТ, и 65,09 ± 16,17 года у пациентов без инфекций, приобретенных в ОИТ (p < 0,001). 1703 (59,3%) пациента с инфекциями, приобретенными в ОИТ, находились в ОИТ хирургического профиля. Количество пациентов без инфекций, приобретенных в ОИТ, составляет 6 521 (46,8%).
Кроме того, у больных с инфекциями, приобретенными в ОИТ была выше распространенность сердечно-сосудистого шока [256 (8,9%) против 888 (6,4%), p < 0,001], септического шока [823 (28,7%) против 3064 (22,0%), p < 0,001], травматического шока [47 (1,6%) против 117 (0,7%), p < 0,001] и цереброваскулярной недостаточности [252 (8,8%) против 632 (4,5%), p < 0,001]. .
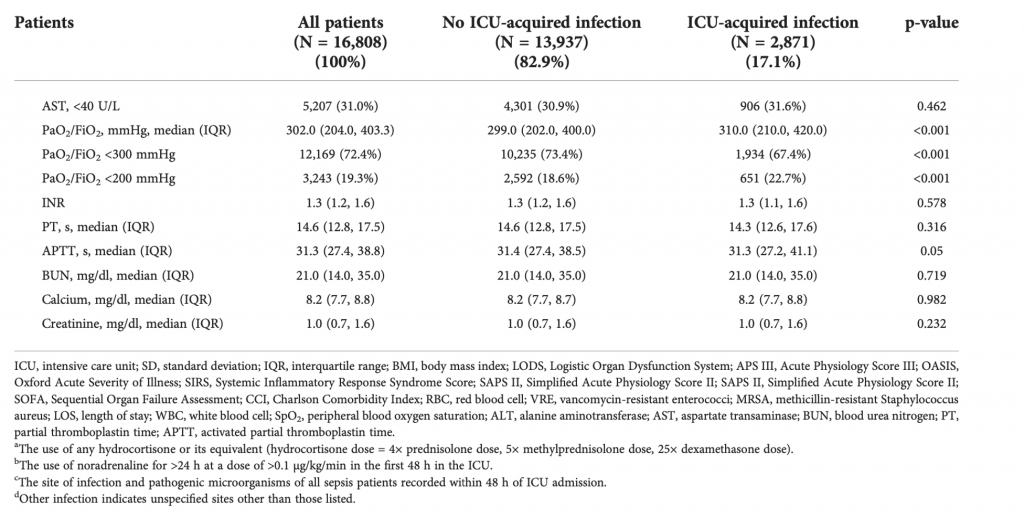
Первичная этиология сепсиса представлена грамположительными (21,3%) и грамотрицательными бактериями (14,0%). По сравнению с пациентами без инфекций, приобретенных в ОИТ, у пациентов с инфекциями, приобретенными в ОИТ, выше частота инфекций, вызванных грамположительными бактериями [686 (23,9%) против 2887 (20,7%), p <0,001], особенно MRSA [103 (3,6%) против 395 (2,8%), p = 0,03] и грамотрицательными бактериями [521 (18,1%) против 1839 (13,2%), p <0,001], такими как видами Pseudomonas[35 (1,2%) против 67 (0,5%), p < 0,001], Acinetobacter baumannii [5 (0,2%) против 6 (0,0%), p = 0,012] и Notrophomonas maltophilia [8 ( 0,3%) против 15 (0,1%), р = 0,024]. Пациенты с легочной инфекцией [659 (23,0%) против 2193 (15,7%), p < 0,001] при поступлении были более склонны к развитию инфекций, приобретенных в ОИТ. Не было никаких существенных различий в лейкоцитах, лимфоцитах, нейтрофилах и показателях гемокоагуляции при поступлении в ОИТ между двумя группами (Table 1).
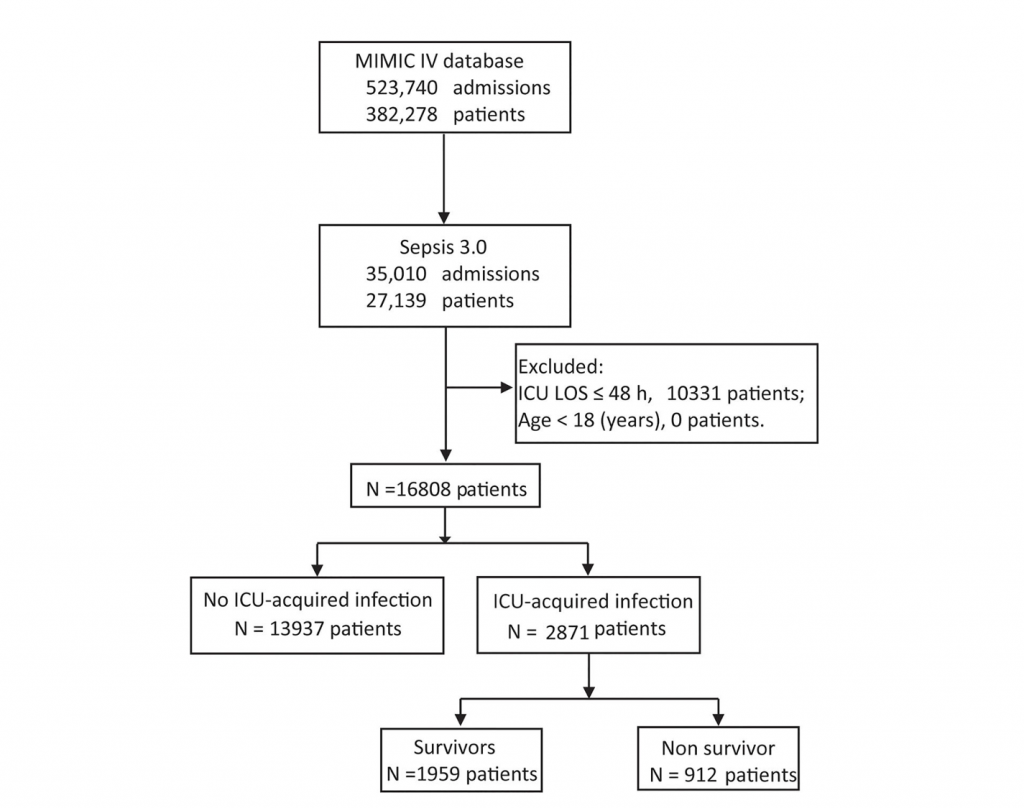
Характеристика инфекций, приобретенных в ОИТ
Очаги ОИТ-ассоциированных инфекций и возбудители представлены в Table 2. Среднее время от поступления в ОИТ до первой инфекции, полученной в ОИТ, составило 4,1 дня (межквартильный размах IQR2,9–6,5). Частыми локализациями инфекций, полученных в ОИТ, были дыхательные (n = 1442, 50,2%), мочевыводящие пути (n = 717, 25%) и катетер-ассоциированные инфекции кровотока (n = 385, 13,4%).Этиологическая структура инфекций была представлен грамотрицательными (1152, 40,2%), грамположительными бактериями (1154, 40,1%) и грибами (n = 544, 18,9%).
Исходы у пациентов с сепсисом с инфекциями, приобретенными в ОИТ
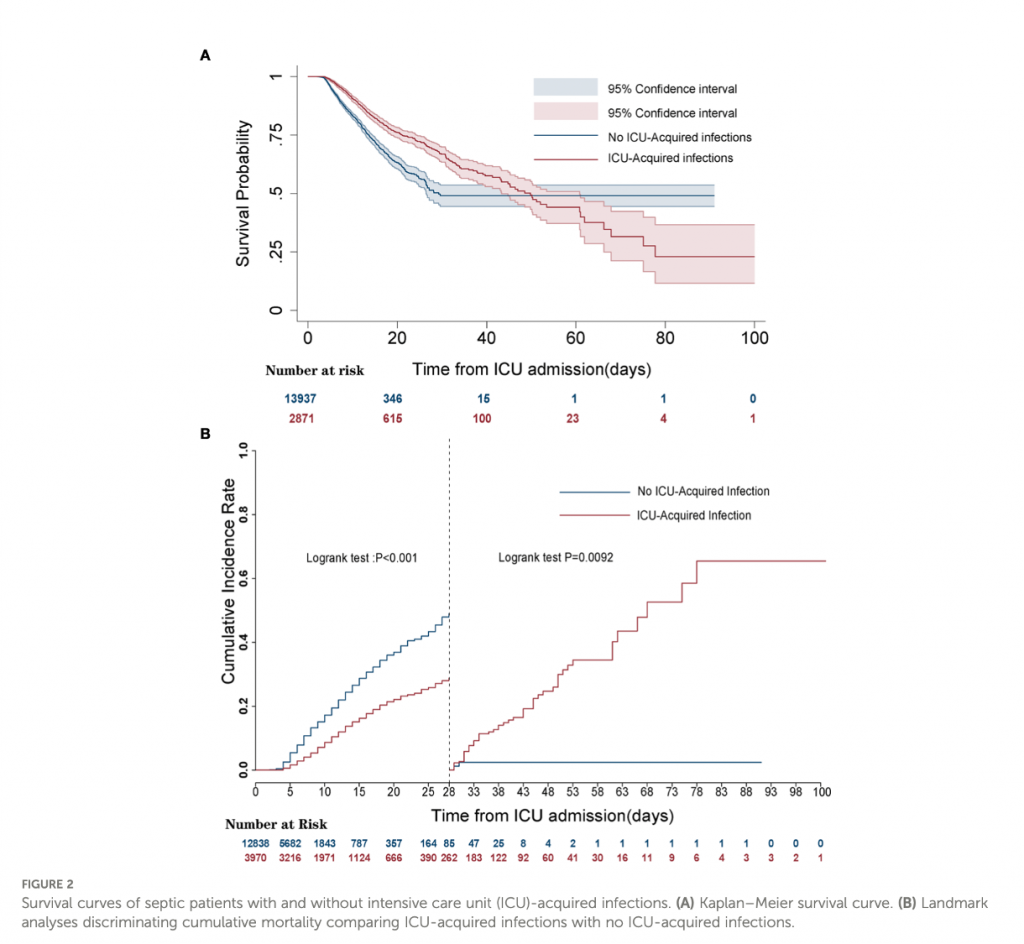
Пациенты с инфекциями, приобретенными в ОИТ, имели более длительные сроки госпитализации [17,6, IQR 11,2–26,2 против 8,9, IQR 6,0–14,5; p < 0,001) и пребывания в ОИТ (12,1, IQR 7,6–18,5 против 4,1, IQR 2,8–6,9; p < 0,001), чем таковых. Более того, у пациентов с приобретенной инфекцией смертность в ОИТ была выше [507 (17,7%) против 1036 (7,4%); p < 0,001] и выше госпитальная летальность [912 (31,8%) против 2600 (18,7%); p< 0,001], чем без таковой .
Кривая выживаемости Каплана-Мейера и ориентировочный анализ продемонстрировали значительно более высокую 28-дневную смертность у пациентов без инфекций, приобретенных в ОИТ, по сравнению с пациентами с приобретенной инфекцией, но смертность была неизменно выше от 28 до 100 дней после поступления в ОИТ при инфекциях, приобретенных в ОИТ (log-rank p <0,001).
Прогностические факторы, ассоциированные с ОИТ-ассоциированной инфекцией при сепсисе и построение номограммы
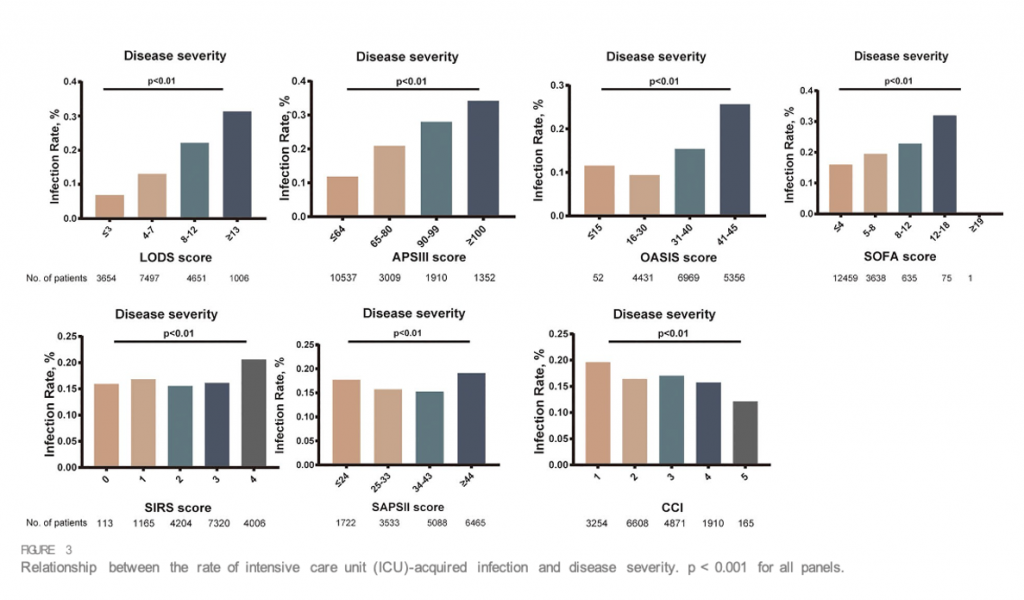
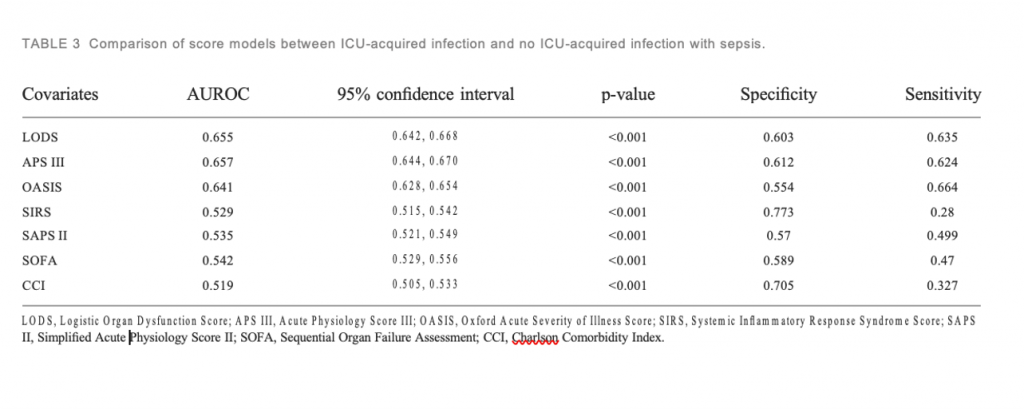
При однофакторном анализе по сравнению с пациентами без инфекции в ОИТ пациенты, у которых развилась инфекция в ОИТ, имеют более высокие баллы по шкале SOFA (4,05 ± 2,39 против 3,70 ± 2,07, p < 0,001), SIRS (2,90 ± 0,91 против 2,81 ± 0,89, p < 0,001), LODS (8,00 ± 3,51 против 6,07 ± 3,28, p < 0,001), оценка SAPS II (42,31 ± 15,04 против 40,63 ± 13,63, p < 0,001), оценка APS III (71,17 ± 27,28 против 0,001). 56,83 ± 24,51, р < 0,001) и OASIS (40,02 ± 8,89 против 35,74 ± 8,88, р < 0,001). На Figure 3 показано, что на тяжесть заболевания, основанную на показателях SIRS, SOFA, OASIS, LODS, APS III, CCI и SAPS II, большое влияние оказала частота инфекций, приобретенных в ОИТ. Мы построили модели, в которых система оценки предсказывает инфекции, приобретенные в ОИТ. Площадь под ROC-кривой прогностической эффективности системы оценки пациентов с инфекцией, приобретенной в ОИТ.

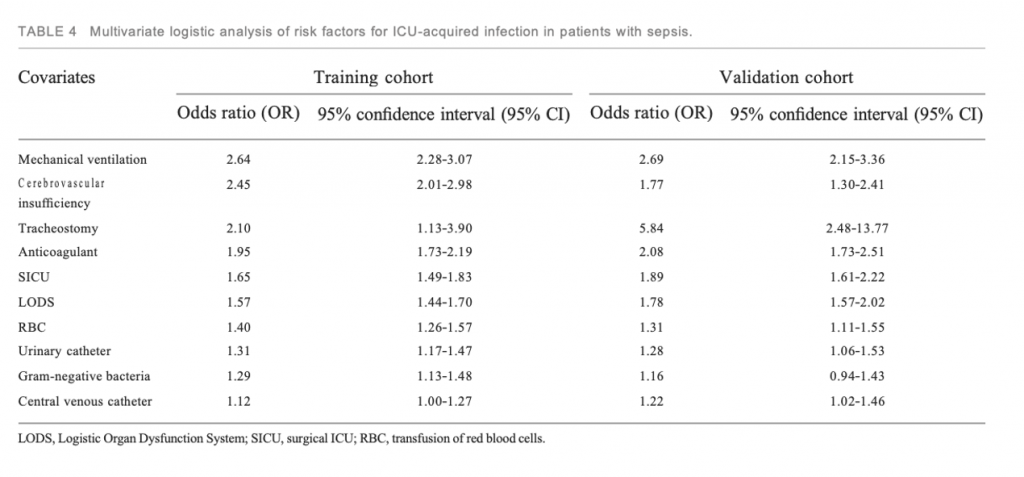
Многофакторный логистический анализ в исследуемой когорте показал, что ИВЛ (ОШ 2,64; 95% ДИ, 2,28–3,07), цереброваскулярная недостаточность (ОШ 2,45; 95% ДИ, 2,01–2,98), трахеостомия (ОШ 2,11; 95% ДИ, 1,14–3,90). ), антикоагулянты (ОШ 1,95; 95% ДИ, 1,73–2,19), LODS (ОШ 1,57; 95% ДИ, 1,44–1,70), нахождение в ОИТ хирургического профиля (ОШ 1,65; 95% ДИ, 1,49–1,83), грамотрицательные бактерии (ОШ 1,29; 95% ДИ, 1,13–1,48), гемотрансфузии (ОШ 1,40; 95% ДИ, 1,26–1,57), наличие центрального венозного (ОШ 1,12; 95% ДИ, 1,00–1,27) и мочевого катетера (ОШ 1,31; 95% ДИ, 1,17–1,47) были независимыми предикторами развития инфекции в ОИТ, у пациентов с сепсисом.
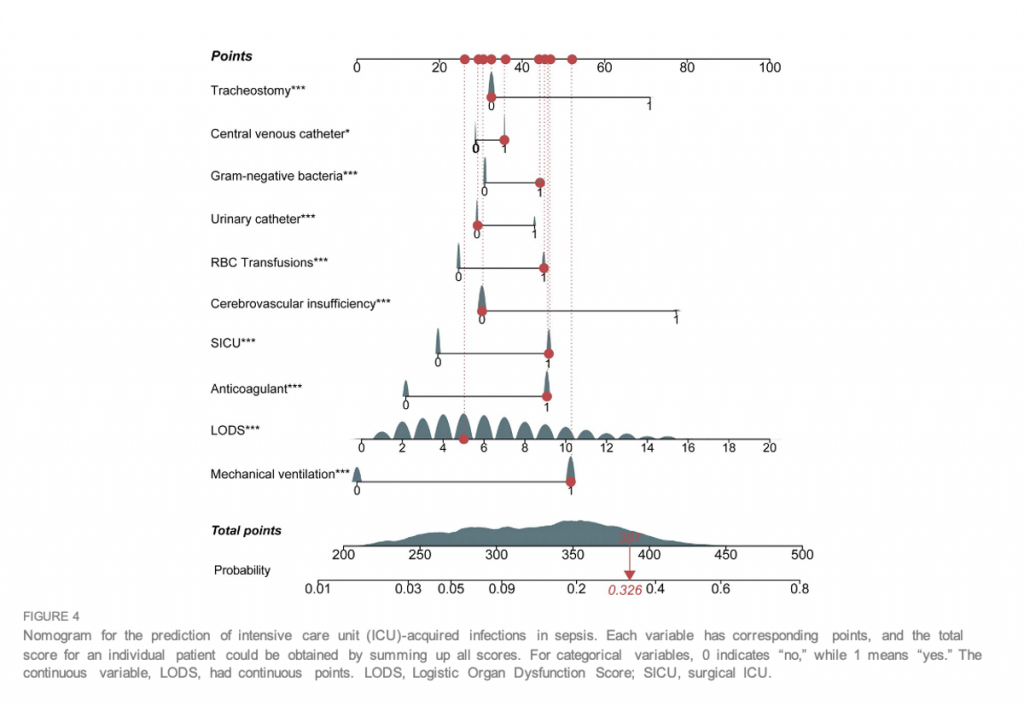
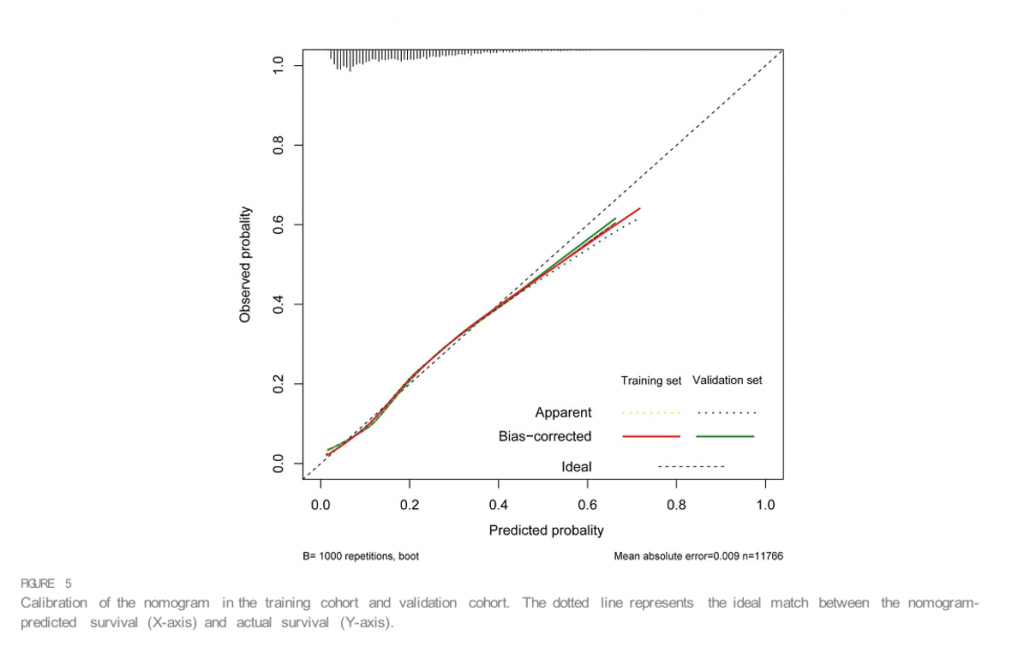
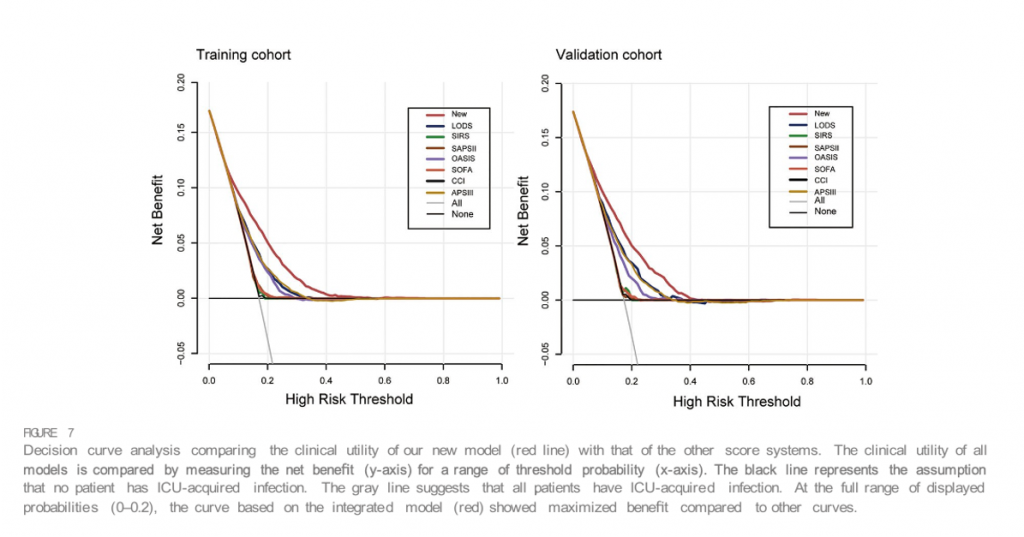
Номограмма этих предикторов представлена на Figure 4. С-индекс номограммы составил 0,737 (95% ДИ, 0,725–0,749) в исследуемой и 0,752 (95% ДИ, 0,735–0,769) в контрольной когорте. Калибровочные кривые и фактические наблюдения вероятности показаны на Figure 5. Новые модели имели AUC 0,737 (95% ДИ, 0,725–0,749), чувствительность 72,5% и специфичность 65,7% (Figure 6). Новые модели обладают большей точностью, чем классические системы оценки тяжести, в прогнозировании инфекции, приобретенной в ОИТ, у пациентов с сепсисом (Figure 6). Анализ кривой решений, сравнивающий клиническую полезность нашей новой модели и всех моделей системы оценки представлены наFigure 7.
Обсуждение
Насколько нам известно, это первое исследование с использованием большой общедоступной базы данных MIMIC IV для изучения инфекций, приобретенных в ОИТ, при сепсисе. В нашем исследовании строго следовали определению подозрения на инфекцию с органной дисфункцией согласно критериям Sepsis-3. Кроме того, база данных охватывает период в 10 лет, что намного превышает период предыдущих исследований, обеспечивая практическую значимость в контексте эпидемии и демонстрируя осуществимость в реальном мире. Мы подчеркиваем, что микробиологическая нагрузка и смертность от инфекции, приобретенной в ОИТ, постепенно увеличиваются с течением времени у выживших после сепсиса, несмотря на более высокую смертность в течение первых 28 дней в группе инфекции, не приобретенной в ОИТ.
Тяжелая инфекция вызывает цитокиновый шторм, способствуя широко распространенным реакциям хозяина, включая недостаточность микроциркуляции, дисфункцию органов, шок и смерть (Kaukonen et al., 2014). Ранняя летальность от сепсиса значительно снизилась благодаря активной реализации рекомендаций SurvivingSepsis Campaign (Coopersmith et al., 2018).
Следовательно, отдаленные исходы после сепсиса привлекают все большее внимание. Два недавних крупных исследования показали, что инфекция, приобретенная в ОИТ, может значительно увеличить смертность, связанную с сепсисом, с показателями 44,2% и 49,2% к 60-му дню (van Vught et al., 2016; van Vught et al., 2017). В то время как Goldenberg et al. (2014) сообщили, что инфекция, полученная в ОИТ, является причиной лишь 14% смертей при сепсисе, наряду с другими потенциальными факторами смертности от сепсиса, включая митохондриальную дисфункцию и капиллярную утечку. Уровень заболеваемости инфекциями, приобретенными в ОИТ, у больных сепсисом в этом исследовании составил 17,1%. Аналогичные результаты были получены в двух предыдущих крупных обсервационных исследованиях, которые составили 14,4% и 13,5% соответственно, хотя мы зафиксировали несколько более высокую кумулятивную частоту инфекций, приобретенных в ОИТ (van Vughtet al., 2016; van Vught et al., 2017). Тем не менее, в двух ретроспективных исследованиях была обнаружена более высокая частота инфекций, что составило 31,0% и 38,9% (Zhao et al., 2016; Chen et al., 2019). Это могло быть связано с относительно ограниченным размером выборки и использованием критериев сепсиса 2.0 для определения когорты пациентов для включение в исследования.
Для пациентов ОИТ шкалы SIRS, SOFA, OASIS, LODS, APS III, SAPS II и CCI являются фундаментальными индивидуальными оценками риска для характеристики тяжести заболевания и степени дисфункции органов (Minne et al., 2008; Chen et al., 2019 ; Li et al., 2020; Zhu et al., 2022). Пациенты с ослабленным иммунитетом очень восприимчивы к опасным условно-патогенным микроорганизмам и могут быстро погибнуть от инфекции (Sundar and Sires, 2013). Кроме того, SAPS II, SIRS и степень органной недостаточности были определены как плохие инструменты раннего предупреждения об инфекции (Vincent et al., 2009; Herrod et al., 2018).Учитывая это , мы попытались построить регрессионные модели с этими системами оценки и сравнить их с нашей недавно разработанной прогностической моделью. Номограмма включала LODS, обеспечивающую наилучшую дискриминационную способность и чистое преимущество по сравнению с любыми текущими распространенными моделями клинических систем оценки по всем пороговым значениям.
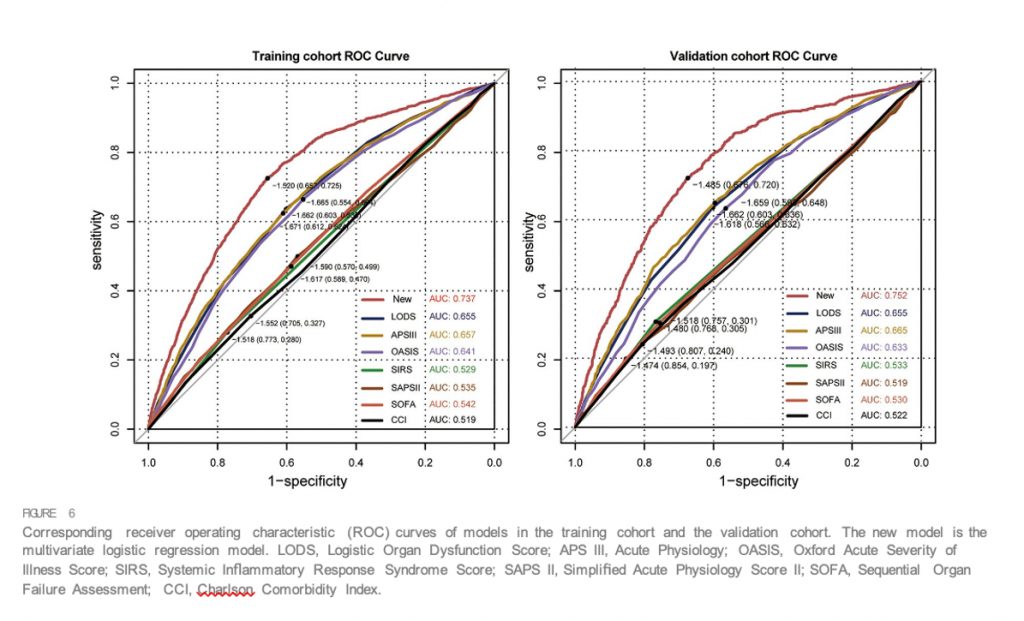
Шкала SOFA была задумана как инструмент для описания возникновения дисфункции различных органов и прогнозирования исхода, но несколько исследований показали, что прогностические значения LODS или SAPSII были немного лучше, чем шкалы SOFA для прогнозирования летальных исходов от сепсиса (Li et al., 2020; Zhuet al., 2022). В соответствии с этим оценка по шкале SOFA для прогнозирования развития инфекции а ОИТ, которая увеличивает смертность пациентов с сепсисом, в настоящем исследовании демонстрирует худший результат.
Синдром иммуносупрессии, вызванный повреждением головного мозга, инициированным ишемией обнаружен на животных моделях и был опосредован интенсивной активацией гипоталамо-гипофизарной оси и симпатической нервной системы (Dirnagl et al., 2007). Повышенный уровень катехоламинов и последующее подавление иммунной функции связаны с возникновением инфекций после острого повреждения головного мозга (Haeusler et al., 2008; Klehmet et al., 2009).
Почти у 40% пациентов, перенесших трепанацию черепа, по крайней мере один раз развивается инфекция, такая как пневмония, не связанная с ИВЛ (15%), вентилятор-ассоциированная пневмония (ВАП; 23%), инфекция мочевыводящих путей (ИМП; 9%) и инфекция области хирургического вмешательства (ИОХВ; 9%) (Kourbeti etal., 2015). Более того, инвазивные процедуры, в том числе центральный венозный катетер, мочевой катетер, искусственная вентиляция легких и трахеостомия являются потенциальными факторами риска в течение первых 48 часов пребывания в ОИТ, создавая идеальную возможность для бактериальной адгезии и образования биопленки (Sottile et al., 1986; Elsayed et al., 2022). Инфицированию способствует быстрая колонизация.Следовательно, дополнительные исследования должны быть сосредоточены на материалах катетеров с антимикробным покрытием, чтобы предотвратить возникновение инфекции и ее прогрессирование.
Переливание эритроцитов стало потенциальным фактором риска развития внутрибольничных инфекций при различных клинических ситуациях, включая сепсис (Dupuis et al., 2017; Dupuis et al., 2017; Nederpelt et al., 2020). Кроме того, это связано с повышенным риском венозного тромбоза при аллогенной трансфузии и инфекций, связанных с трансфузией (Jaffray et al., 2020; Miyamoto et al., 2021). Кроме того, хранящиеся эритроциты и тромбоциты могут высвобождать внутриклеточные цитокины и другие компоненты, которые индуцируют иммуносупрессивный фенотип в лимфоцитах (Aslam et al., 2008; Torrance et al., 2015).
Примечательно, что сепсис, вызванный грамотрицательными бактериями, повышает риск инфицирования в ОИТ. Среди 27 766 случаев инфекций кровотока, связанных с центральным венозным катетером, зарегистрированных в Национальной сети безопасности здравоохранения (NHSN) в период с 2009 по 2010 год, большая часть выделенных в ОИТ лекарственно-устойчивых бактерий была грамотрицательными (Sader et al., 2014). Резистентность к антимикробным препаратам приводит к низкой эффективности лечения и сложным схемам терапии. Растет осведомленность о том, что повышенная восприимчивость к инфекциям, приобретенным в ОИТ, может быть патоген-специфической из-за различных моделей разрушения иммунного барьера, что может привести к условно-патогенным бактериальным и грибковым инфекциям (Koch et al., 2017).
Хотя использование большого набора информации из общедоступной базы данных обеспечивает существенную поддержку наших выводов, наше исследование имеет несколько ограничений. Во-первых, на наши результаты могли повлиять искажающие факторы из-за того, что пациенты с сепсисом поступали в ОИТ с различной степенью тяжести заболевания, но крупнейшее когортное исследование, включающее данные о пациентах, собранные за почти 10 лет, должно быть клинически репрезентативным. Во-вторых, все переменные, включенные в нашу прогностическую модель, связаны в основном с демографическими характеристиками пациентов, основным заболеванием, патогенами и поддерживающим лечением, и отсутствовали некоторые значимые лабораторные показатели, что приводило к низкой прогностической эффективности нашей модели.
Тем не менее, вся клиническая информация доступна во многих учреждениях, и для оценки реальных клинических ситуаций использовалась многофакторная модель логистического риска. Действительно, не было никаких существенных различий в уровнях лимфоцитов, нейтрофилов, частичного тромбопластинового времени или активированного частичного тромбопластинового времени в нашей когорте. Нарушения микроциркуляции возникают рано, через 12 ч после сепсиса, и связаны с взаимодействием нейтрофилов и эндотелия, образованием микротромбов и повышением проницаемости сосудов (Wu et al., 2015).
This may explain that the indicators of coagulation function did not differ between those with ICU-acquired infection and those without. Additionally, the occurrence of acquired infection is mainly related to immune cell function; the value of some biomarkers of immune cell function in predicting susceptibility to ICU-acquired infections warrants exploration (van Vught et al., 2016). Third, up to dozens of risk factors were included in our model, which may be related to theheterogeneity of the group with sepsis. To overcome this limitation, we strictly followed the latest diagnostic criteria for sepsisand comprehensively accounted for pathogens, antibiotics, and other relevant factors, which may have improved theprediction of secondary infection occurrence.
Этим можно объяснить, что показатели свертывающей функции не различались между пациентами с инфекцией в ОИТ и без нее. Кроме того, развитие инфекции в основном связано с функцией иммунных клеток;значение некоторых биомаркеров в прогнозировании восприимчивости к инфекциям, приобретенным в ОРИТ, требует изучения (van Vught et al., 2016). В-третьих, в нашу модель было включено до десятков факторов риска, что может быть связано с неоднородностью группы с сепсисом. Чтобы преодолеть это ограничение, мы строго следовали последним диагностическим критериям сепсиса и всесторонне учитывали патогены, антибиотики и другие соответствующие факторы, что могло улучшить прогнозирование возникновения вторичной инфекции.
Вывод
Выжившие после сепсиса подвержены повышенному риску развития инфекций в ОРИТ, которые приводят к увеличению долгосрочной смертности. У пациентов с цереброваскулярной недостаточностью или грамотрицательными бактериями, находящимся в ОИТ хирургического профиля, имеющими центральный венозный или мочевой катетер, которым проводится искусственная вентиляция легких, гемотрансфузия назначают антикоагулянты в течение 48 часов после поступления в ОИТ гораздо приобретают инфекции в ОИТ. Полученные данные могут помочь врачам оптимизировать лечение инфекций, связанных с сепсисом, в ОИТ и улучшить исходы сепсиса.
References
Aslam, R., Speck, E. R., Kim, M., Freedman, J., and Semple, J. W. (2008). Transfusion-relatedimmunomodulation by platelets is dependent on their expression of MHC class I molecules and is independent of whitecells. Transfusion 48 (9), 1778–1786. doi: 10.1111/j.1537-2995.2008.01791.x
Cavaillon, J. M., Singer, M., and Skirecki, T. (2020). Sepsis therapies: learning from 30 years of failure of translational research to propose new leads. EMBO Mol. Med. 12 (4), e10128. doi: 10.15252/emmm.201810128
Chen, Y., Hu, Y., Zhang, J., Shen, Y., Huang, J., Yin, J., et al. (2019). Clinical characteristics, risk factors, immunestatus and prognosis of secondary infection of sepsis: a retrospective observational study. BMC Anesthesiol. 19 (1), 185.doi: 10.1186/s12871-019-0849-9
Chen, X., Ling, X., Liu, G., and Xiao, J. (2022). Antimicrobial coating: Tracheal tube application. Int. J.Nanomedicine 17, 1483–1494. doi: 10.2147/IJN.S353071
Chen, Q., Zhang, L., Ge, S., He, W., and Zeng, M. (2019). Prognosis predictive value of the Oxford acute severityof illness score for sepsis: a retrospective cohort study. PeerJ 7, e7083. doi: 10.7717/peerj.7083
Coopersmith, C. M., De Backer, D., Deutschman, C. S., Ferrer, R., Lat, I., Machado, F. R., et al. (2018). Surviving sepsis campaign: research priorities for sepsis and septic shock. Intensive Care Med. 44 (9), 1400–1426. doi: 10.1007/s00134-018-5175-z
Dirnagl, U., Klehmet, J., Braun, J. S., Harms, H., Meisel, C., Ziemssen, T., et al. (2007). Stroke-induced immunodepression: experimental evidence and clinical relevance. Stroke 38 (2 Suppl), 770–773. doi:10.1161/01.STR.0000251441.89665.bc
Dupuis, C., Garrouste-Orgeas, M., Bailly, S., Adrie, C., Goldgran-Toledano, D., Azoulay, E., et al. (2017). Effect of transfusion on mortality and other adverse events among critically ill septic patients: An observational study using amarginal structural cox model. Crit. Care Med. 45 (12), 1972–1980. doi: 10.1097/ CCM.0000000000002688
Dupuis, C., Sonneville, R., Adrie, C., Gros, A., Darmon, M., Bouadma, L., et al. (2017). Impact of transfusion on patients with sepsis admitted in intensive care unit: a systematic review and meta-analysis. Ann. Intensive Care 7 (1),5. doi: 10.1186/s13613-016-0226-5
Elsayed, A., Moussa, Z., Alrdahe, S. S., Alharbi, M. M., Ghoniem, A. A., El- khateeb, A. Y., et al. (2022).Optimization of heavy metals biosorption via artificial neural network: A case study of cobalt (II) sorption by pseudomonas alcaliphila NEWG-2. Front. Microbiol. 13. doi: 10.3389/fmicb.2022.893603
Goldenberg, N. M., Leligdowicz, A., Slutsky, A. S., Friedrich, J. O., and Lee, W. L. (2014). Is nosocomial infectionreally the major cause of death in sepsis? Crit. Care (London England) 18 (5), 540. doi: 10.1186/s13054-014-0540-y
Haeusler, K. G., Schmidt, W. U., Fohring, F., Meisel, C., Helms, T., Jungehulsing,
G. J., et al. (2008). Cellular immunodepression preceding infectious complications after acute ischemic stroke inhumans. Cerebrovasc. Dis. 25 (1-2), 50–58. doi: 10.1159/000111499
Herrod, P., Cox, M., Keevil, H., Smith, K., and Lund, J. N. (2018). NICE guidance on sepsis is of limited value inpostoperative colorectal patients: the scores that cry ‘wolf!’. Ann. R Coll. Surg. Engl. 100 (4), 275–278. doi:10.1308/rcsann.2017.0227
Jaffray, J., Witmer, C., O’Brien, S. H., Diaz, R., Ji, L., Krava, E., et al. (2020). Peripherally inserted centralcatheters lead to a high risk of venous thromboembolism in children. Blood 135 (3), 220–226. doi: 10.1182/blood.2019002260
Johnson, A. E. W., Aboab, J., Raffa, J. D., Pollard, T. J., Deliberato, R. O., Celi, L. A., et al. (2018). A comparative analysis of sepsis identification methods in an electronic database. Crit. Care Med. 46 (4), 494–499. doi: 10.1097/CCM.0000000000002965
Kaukonen, K. M., Bailey, M., Suzuki, S., Pilcher, D., and Bellomo, R. (2014). Mortality related to severe sepsis and septic shock among critically ill patients in Australia and new Zealand, 2000-2012. JAMA 311 (13), 1308–1316. doi:10.1001/ jama.2014.2637
Klehmet, J., Harms, H., Richter, M., Prass, K., Volk, H. D., Dirnagl, U., et al. (2009). Stroke-inducedimmunodepression and post-stroke infections: lessons from the preventive antibacterial therapy in stroke trial. Neuroscience 158 (3), 1184–1193. doi: 10.1016/j.neuroscience.2008.07.044
Koch, R. M., Kox, M., de Jonge, M. I., van der Hoeven, J. G., Ferwerda, G., and Pickkers, P. (2017). Patterns in bacterial- and viral-induced immunosuppression and secondary infections in the ICU. Shock 47 (1), 5–12. doi: 10.1097/SHK.0000000000000731
Kourbeti, I. S., Vakis, A. F., Ziakas, P., Karabetsos, D., Potolidis, E., Christou, S., et al. (2015). Infections in patients undergoing craniotomy: risk factors associated with post-craniotomy meningitis. J. Neurosurg. 122 (5), 1113–1119. doi: 10.3171/ 2014.8.JNS132557
Liu, C., Hu, C., Huang, J., Xiang, K., Li, Z., Qu, J., et al. (2021). A prognostic nomogram of colon cancer withliver metastasis: A study of the US SEER database and a Chinese cohort. Front. Oncol. 11. doi: 10.3389/fonc.2021.591009
Li, Y., Yan, C., Gan, Z., Xi, X., Tan, Z., Li, J., et al. (2020). Prognostic values of SOFA score, qSOFA score, andLODS score for patients with sepsis. Ann. Palliat. Med. 9 (3), 1037–1044. doi: 10.21037/apm-20-984
Minne, L., Abu-Hanna, A., and de Jonge, E. (2008). Evaluation of SOFA-based models for predicting mortality in the ICU: A systematic review. Crit. Care (London England) 12 (6), R161. doi: 10.1186/cc7160
Miyamoto, S., Umeda, K., Kurata, M., Nishimura, A., Yanagimachi, M., Ishimura, M., et al. (2021).Hematopoietic cell transplantation for severe combined immunodeficiency patients: a Japanese retrospective study. J. Clin. Immunol. 53 (3), 1–13. doi: 10.1007/s10875-021-01112-5
Nederpelt, C. J., El Hechi, M., Parks, J., Fawley, J., Mendoza, A. E., Saillant, N., et al. (2020). The dose-dependent relationship between blood transfusions and infections after trauma: A population-based study. J. Trauma Acute CareSurg. 89 (1), 51–57. doi: 10.1097/TA.0000000000002637
Nedeva, C., Menassa, J., Duan, M., Liu, C., Doerflinger, M., Kueh, A. J., et al. (2020). TREML4 receptor regulates inflammation and innate immune cell death during polymicrobial sepsis. Nat. Immunol. 21 (12), 1585–1596. doi: 10.1038/ s41590-020-0789-z
Otto, G. P., Sossdorf, M., Claus, R. A., Rodel, J., Menge, K., Reinhart, K., et al. (2011). The late phase of sepsis is characterized by an increased microbiological burden and death rate. Crit. Care (London England) 15 (4), R183. doi:10.1186/cc10332
Rudd, K. E., Johnson, S. C., Agesa, K. M., Shackelford, K. A., Tsoi, D., Kievlan, D. R., et al. (2020). et al: Global, regional, and national sepsis incidence and mortality, 1990–2017: analysis for the global burden of disease study. Lancet 395 (10219), 200–211. doi: 10.1016/s0140-6736(19)32989-7
Sader, H. S., Farrell, D. J., Flamm, R. K., and Jones, R. N. (2014). Antimicrobial susceptibility of gram-negative organisms isolated from patients hospitalized in intensive care units in united states and European hospitals (2009-2011). Diagn. Microbiol. Infect. Dis. 78 (4), 443–448. doi: 10.1016/j.diagmicrobio.2013.11.025
Singer, M., Deutschman, C. S., Seymour, C. W., Shankar-Hari, M., Annane, D., Bauer, M., et al. (2016). The thirdinternational consensus definitions for sepsis and septic shock (Sepsis-3). Jama 315 (8), 801–810. doi:10.1001/jama.2016.0287
Sottile, F. D., Marrie, T. J., Prough, D. S., Hobgood, C. D., Gower, D. J., Webb, L. X., et al. (1986). Nosocomial pulmonary infection: possible etiologic significance of bacterial adhesion to endotracheal tubes. Crit. Care Med. 14 (4), 265–270. doi: 10.1097/00003246-198604000-00001
Stortz, J. A., Murphy, T. J., Raymond, S. L., Mira, J. C., Ungaro, R., Dirain, M. L., et al. (2018). Evidence for persistent immune suppression in patients who develop chronic critical illness after sepsis. Shock 49 (3), 249–258. doi:10.1097/ SHK.0000000000000981
Sundar, K. M., and Sires, M. (2013). Sepsis induced immunosuppression: Implications for secondary infections and complications. Indian J. Crit. Care Medicine: Peer Reviewed Off. Publ. Indian Soc. Crit. Care Med. 17 (3), 162–169.doi: 10.4103/0972-5229.117054
Torrance, H. D., Brohi, K., Pearse, R. M., Mein, C. A., Wozniak, E., Prowle, J. R., et al. (2015). Associationbetween gene expression biomarkers of immunosuppression and blood transfusion in severely injured polytraumapatients. Ann. Surg. 261 (4), 751–759. doi: 10.1097/SLA.0000000000000653
van Vught, L. A., Klein Klouwenberg, P. M., Spitoni, C., Scicluna, B. P., Wiewel,
M. A., Horn, J., et al. (2016). Incidence, risk factors, and attributable mortality of secondary infections in the intensive care unit after admission for sepsis. JAMA 315 (14), 1469–1479. doi: 10.1001/jama.2016.2691
van Vught, L. A., Wiewel, M. A., Hoogendijk, A. J., Frencken, J. F., Scicluna, B. P., Klein Klouwenberg, P. M. C., et al. (2017). The host response in patients with sepsis developing intensive care unit-acquired secondary infections. Am.J. Respir. Crit. Care Med. 196 (4), 458–470. doi: 10.1164/rccm.201606-1225OC
Vincent, J. L., Rello, J., Marshall, J., Silva, E., Anzueto, A., Martin, C. D., et al. (2009). International study of theprevalence and outcomes of infection in intensive care units. JAMA 302 (21), 2323–2329. doi: 10.1001/jama.2009.1754
Wolkewitz, M., Cooper, B. S., Palomar-Martinez, M., Alvarez-Lerma, F., Olaechea-Astigarraga, P., Barnett, A. G., et al. (2014). Multilevel competing risk models to evaluate the risk of nosocomial infection. Crit. Care (London England) 18 (2), R64. doi: 10.1186/cc13821
Wu, Y., Ren, J., Zhou, B., Ding, C., Chen, J., Wang, G., et al. (2015). Laser speckle contrast imaging for measurement of hepatic microcirculation during the sepsis: a novel tool for early detection of microcirculationdysfunction. Microvasc. Res. 97, 137–146. doi: 10.1016/j.mvr.2014.10.006
Yang, Y. C., Wang, J. J., Huang, Y., Cai, W. X., and Tao, Q. (2021). Development and validation of a prognosticnomogram for postoperative recurrence-free survival of ameloblastoma. Cancer Manag Res. 13, 4403–4416. doi: 10.2147/ CMAR.S307517
Zhang, Z., Cortese, G., Combescure, C., Marshall, R., Lee, M., Lim, H. J., et al. (2018). Overview of model validation for survival regression model with competing risks using melanoma study data. Ann. Transl. Med. 6 (16), 325. doi:10.21037/atm.2018.07.38
Zhao, G. J., Li, D., Zhao, Q., Song, J. X., Chen, X. R., Hong, G. L., et al. (2016). Incidence, risk factors and impact on outcomes of secondary infection in patients with septic shock: an 8-year retrospective study. Sci. Rep. 6, 38361. doi: 10.1038/ srep38361
Zhu, Y., Zhang, R., Ye, X., Liu, H., and Wei, J. (2022). SAPS III is superior to SOFA for predicting 28-day mortality in sepsis patients based on sepsis 3.0 criteria. Int. J. Infect. Dis. 114, 135–141. doi: 10.1016/j.ijid.2021.11.015
Источник фотоиллюстрации - www.freepik.com
[~DETAIL_TEXT] =>
Front. Cell. Infect. Microbiol. 12:962470. doi: 10.3389/fcimb.2022.962470.
He Y, Xu J, Shang X, Fang X, Gao C, Sun D, Yao L, Zhou T, Pan S, Zou X, Shu H, Yang X and Shang Y (2022) Clinical characteristics and risk factors associated with ICU-acquired infections in sepsis: A retrospectivecohort study.
Абстракт
Инфекция, приобретенная в отделении интенсивной терапии (ОИТ), является частой причиной неблагоприятного исхода сепсиса в ОИТ. Тем не менее, сепсис-ассоциированные инфекции, приобретенные в ОИТ, не были полностью охарактеризованы. Исследование направлено на оценку факторов риска и разработку модели, предсказывающей риск инфекций, приобретенных в ОИТ, у пациентов с сепсисом.
Информацию получали из базы данных Medical Information Mart for Intensive Care (MIMIC) IV. Пациенты были случайным образом разделены основную группу и группу сравнения в соотношении 7:3. Модель многомерной логистической регрессии использовалась для выявления независимых факторов риска, которые могли бы предсказать инфекцию, приобретенную в ОИТ.
Из 16 808 включенных пациентов с сепсисом у 2 871 (17,1%) развилась инфекция, приобретенная в ОИТ. У этих пациентов смертность в ОИТ составила 17,7%, внутрибольничная — 31,8%, а также обнаружили, что смертность продолжала расти с 28 до 100 дней после поступления в ОИТ. Уровень оценки по шкале синдрома системного воспалительного ответа (SIRS), SOFA, Оксфордской шкале тяжести острого заболевания (OASIS), шкалам SAPS II и LODS, индексу коморбидности Чарлсона (CCI) и шкале APS III были связаны с инфекцией, полученной в ОИТ, цереброваскулярной недостаточностью, грамотрицательными бактериями, хирургическим ОИТ, трахеостомой, центральным венозным катетером, мочевым катетером, ИВЛ, гемотрансфузией.
Оценка по шкале LODS и антикоагулянтная терапия были независимыми предикторами развития инфекции, приобретенной в ОИТ, у пациентов с сепсисом. Номограмма, основанная на этих независимых предикторах, показала хорошую калибровку и различия как в основной, (AUROC = 0,737; 95% ДИ, 0,725–0,749), так и в группе сравнения (AUROC = 0,751; 95% ДИ, 0,734–0,769) популяциях, и была выше по сравнению с моделями SIRS, SOFA, OASIS, SAPS II, LODS, CCI и APS III.
Инфекции, приобретенные в ОИТ, повышают вероятность смерти у больных с сепсисом. Индивидуальная прогностическая модель на основе номограммы может точно предсказать инфекцию, приобретенную в ОИТ, и оптимизировать лечение или индивидуальную терапию.
Сепсис характеризуется острой органной дисфункцией в ответ на различные тяжелые инфекции и является одним из самых серьезных заболеваний во всем мире, что приводит к высокой смертности пациентов в ОИТ (Rudd et al., 2020; Cavaillon et al., 2020). Среди смертей от сепсиса примерно 15% приходится на острые случаи, возникающие вскоре после начала сепсиса, а 85% — на позднюю фазу, обычно из-за инфекций, приобретенных в ОИТ (Nedeva et al., 2020). В настоящее время доминирующим взглядом на основные причины этих смертей является то, что у пациентов с сепсисом наблюдается иммуносупрессия (Stortz et al., 2018). Пациенты с ослабленным иммунитетом очень восприимчивы к опасным условно-патогенным микроорганизмам, вызывающими инфекции в ОИТ (Sundar and Sires, 2013; Koch et al., 2017). Инфекции, приобретенные в ОИТ, в значительной степени связаны с повышенной внутрибольничной смертностью, увеличением длительности госпитализации и неблагоприятным прогнозом (Otto et al., 2011; van Vught et al., 2017). Поэтому необходимо выявить факторы риска развития внутрибольничных инфекций у больных с сепсисом.
У пациентов с сепсисом на риск развития инфекции в ОИТ влияет множество взаимосвязанных факторов. Например, некоторые исследования, проведенные 10 лет назад с небольшими выборками или охватывающие короткий период времени (Chen et al., 2022), показали, что пожилой возраст, тяжесть заболевания, катетеризация глубоких вен и инвазивная вентиляция были связаны с повышенным риском развития инфекций в ОИТ при сепсисе (Wolkewitz et al., 2014; van Vught et al., 2016; Chen et al., 2019). Несмотря на связь более низкой экспрессии человеческого лейкоцитарного антигена и повышенного уровня интерлейкина-10 (ИЛ-10) с инфекцией, приобретенной в ОИТ (van Vught et al., 2017; Stortz et al., 2018), выявление пациентов с сепсисом с более высоким риском инфекции, приобретенной в ОИТ, остается клинически сложной. В настоящее время многие решения, связанные с ведением сепсис-ассоциированной инфекции в ОИТ основаны на оценке вероятности развития инфекции у пациента в будущем (van Vught et al., 2016). Тем не менее, сепсис-ассоциированные инфекции, приобретенные в ОИТ, еще предстоит полностью охарактеризовать.
Here, we analyzed the data from the large public database Medical Information Mart for Intensive Care (MIMIC) IV and attempted to identify the differences in clinical characteristics between septic patients who did and did not experience ICU- acquired infection, identify the risk factors associated with septic ICU-acquired infection occurrence andits outcomes, and develop a novel risk prediction model that predicts ICU- acquired infections for patients with sepsis.
Мы проанализировали данные из большой общедоступной базы данных Medical Information Mart forIntensive Care (MIMIC) IV и попытались выявить различия в клинических характеристиках у пациентов с сепсисом, перенесшими и не перенесшими инфекцию в ОИТ, определить факторы риска, связанные свозникновение инфекции в ОИТ и ее исходы, а также разработать новую модель прогнозирования риска, которая предсказывает развитие инфекции в ОИТ для пациентов с сепсисом.
Методы
База данных
Все клинические данные, проанализированные в этом исследовании, были извлечены из международной онлайн-базы данных интенсивной терапии MIMIC-IV (версия 1.0) (Johnson et al., 2018), которая включает данные о пациентах, собранные в ОИТ медицинского центра Beth Israel Deaconess в период с 2008 по 2019 год. Эта база включает данные 382 278 пациентов и 523 740 госпитализаций в ОИТ. Один из авторов этого исследования (YH) сдал экзамен по институциональному обучению (номер сертификата: 31935546). Код, используемый для извлечения данных, доступен на GitHub (https://github.com/MIT-LCP/mimic-iv).
Исследуемая популяция и определения
Использовали определение сепсиса на основании концепции Сепсис-3, что означает наличие у пациентов подозрения на инфекцию и оценку по шкале SOFA ≥2 (Singer et al., 2016). Пациенты моложе 18 лет, с оценкой по шкале SOFA <2 при поступлении в ОИТ и с пребыванием в ОИТ менее 48 часов, были исключены (van Vught etal., 2016). Первичная инфекция, приобретенная в ОИТ, определялась как любая новая возможная инфекция с новой положительной культурой патогенных микроорганизмов и новым режимом антибиотикотерапии через 48 часов после поступления в ОИТ в соответствии с критериями Центра по контролю и профилактике заболеваний (Singer et al., 2016; Johnson). и др., 2018).
Сбор данных
Только пациенты с сепсисом при первом поступлении в ОИТ, которые соответствовали критериям включения, были включены в анализ, чтобы избежать двойного учета повторных поступлений. Исходные параметры пациента были извлечены из базы данных: возраст, пол, вес, продолжительность госпитализации в ОИТ и стационаре и смерть. Базовые рейтинговые шкалы ОИТ такие как SOFA, SIRS, OASIS, LODS, SAPS II, APS III и CCI были рассчитаны при поступлении. Сопутствующие заболевания при первом поступлении включали шок, сердечно-сосудистые и цереброваскулярные заболевания, хирургическое вмешательство, рак, заболевание почек и печеночную недостаточность. Вмешательства включали медикаментозное лечение (вазопрессоры, глюкокортикоиды, гепарин), переливание крови, ИВЛ, заместительную почечную терапию, установку центрального венозного и мочевого катетера. Собраны лабораторные данные при поступлении в ОИТ. Результаты микробиологического исследования, зарегистрированные в базе данных, использовались как доказательство инфекции, приобретенной в ОИТ. Были зарегистрированы время возникновения инфекции, приобретенной в ОИТ, все патогенные микроорганизмы и очаги инфекции от момента госпитализации до перевода из ОИТ.
Статистический анализ
Переменные с >20% отсутствующих значений были исключены, а оставшиеся отсутствующие данные были оценены с использованием множественных импутаций. Для описательных данных параметрические количественные переменные выражаются как среднее значение и стандартное отклонение, непараметрические количественные переменные — как медиана и межквартильный размах (IQR), а категориальные переменные — как число и процент. Различия между пациентами с инфекцией, приобретенной в ОИТ, и без нее были проанализированы с использованием t-критерия или критерия хи-квадрат для параметрических переменных, U-критерия Манна-Уитни или критерия Крускала-Уоллиса для непрерывных непараметрических переменных и точного критерия Фишера для категориальных переменных. Кривая выживаемости Каплана-Мейера и анализ ориентиров с использованием логарифмического рангового теста применялись для оценки показателей выживаемости. Все пациенты были случайным образом распределены в когорты для изучения или проверки в соотношении 7:3 (Yang et al., 2021; Liu et al., 2021). В исследуемой когорте потенциальные прогностические факторы были исключены с помощью однофакторной регрессии, которая может быть связана с инфекцией, полученной в ОРИТ, включая все переменные со значением p <0,05. Затем факторы были дополнительно проанализированы с использованием модели бинарной многомерной логистической регрессии для выявления факторов риска (Zhang et al., 2018).
Впоследствии факторы с прогностической значимостью в многомерном логистическом регрессионном анализе использовались для построения модели прогнозирования, а для визуализации модели использовалась номограмма. Значения отношения шансов (OR) были рассчитаны с соответствующими 95% доверительными интервалами (ДИ). Эффективность распознавания номограммы измерялась с использованием индекса согласованности Харрелла (C-индекс), ROC-анализа и площади под кривой AUROC и калибровочных графиков, в то время как калибровочный график использовался для графической оценки калибровка номограммы как в исследуемой, так и в когорте сравнения.
Программное обеспечение Stata/IC 16.0 (Stata Corp., College Station, TX, USA) использовалось для проведения статистического анализа. Двустороннее значение p<0,05 считалось статистически значимым. Для анализа ориентиров использовались пакеты «TSHRC» и «survminer». Пакеты «rms» и «regplot» использовались для проведения модели логистического регрессионного анализа и для построения номограммы. Калибровочные кривые, кривые ROC и кривые DCA были созданы с использованием пакетов «graphics», «pROC» и «rmda» на языке программирования R (версия 4.1.3; R Foundation for Statistical Computing, Вена, Австрия).
Полученные результаты
Демографические и клинические характеристики пациентов
Мы обследовали 16 808 пациентов, которые соответствовали критериям включения (Figure 1). Исходные характеристики пациентов при поступлении представлены в Table 1. Средний возраст включенных пациентов составил 64,65 ± 16,27 года, 9609 пациентов (57,2%) были мужчинами. Среди пациентов с сепсисом у 2871 (17,1%) человека развились инфекции, приобретенные в ОИТ. Средний возраст составил 62,49 ± 16,62 года у пациентов с инфекциями, приобретенными в ОИТ, и 65,09 ± 16,17 года у пациентов без инфекций, приобретенных в ОИТ (p < 0,001). 1703 (59,3%) пациента с инфекциями, приобретенными в ОИТ, находились в ОИТ хирургического профиля. Количество пациентов без инфекций, приобретенных в ОИТ, составляет 6 521 (46,8%).
Кроме того, у больных с инфекциями, приобретенными в ОИТ была выше распространенность сердечно-сосудистого шока [256 (8,9%) против 888 (6,4%), p < 0,001], септического шока [823 (28,7%) против 3064 (22,0%), p < 0,001], травматического шока [47 (1,6%) против 117 (0,7%), p < 0,001] и цереброваскулярной недостаточности [252 (8,8%) против 632 (4,5%), p < 0,001]. .
Первичная этиология сепсиса представлена грамположительными (21,3%) и грамотрицательными бактериями (14,0%). По сравнению с пациентами без инфекций, приобретенных в ОИТ, у пациентов с инфекциями, приобретенными в ОИТ, выше частота инфекций, вызванных грамположительными бактериями [686 (23,9%) против 2887 (20,7%), p <0,001], особенно MRSA [103 (3,6%) против 395 (2,8%), p = 0,03] и грамотрицательными бактериями [521 (18,1%) против 1839 (13,2%), p <0,001], такими как видами Pseudomonas[35 (1,2%) против 67 (0,5%), p < 0,001], Acinetobacter baumannii [5 (0,2%) против 6 (0,0%), p = 0,012] и Notrophomonas maltophilia [8 ( 0,3%) против 15 (0,1%), р = 0,024]. Пациенты с легочной инфекцией [659 (23,0%) против 2193 (15,7%), p < 0,001] при поступлении были более склонны к развитию инфекций, приобретенных в ОИТ. Не было никаких существенных различий в лейкоцитах, лимфоцитах, нейтрофилах и показателях гемокоагуляции при поступлении в ОИТ между двумя группами (Table 1).

Характеристика инфекций, приобретенных в ОИТ
Очаги ОИТ-ассоциированных инфекций и возбудители представлены в Table 2. Среднее время от поступления в ОИТ до первой инфекции, полученной в ОИТ, составило 4,1 дня (межквартильный размах IQR2,9–6,5). Частыми локализациями инфекций, полученных в ОИТ, были дыхательные (n = 1442, 50,2%), мочевыводящие пути (n = 717, 25%) и катетер-ассоциированные инфекции кровотока (n = 385, 13,4%).Этиологическая структура инфекций была представлен грамотрицательными (1152, 40,2%), грамположительными бактериями (1154, 40,1%) и грибами (n = 544, 18,9%).
Исходы у пациентов с сепсисом с инфекциями, приобретенными в ОИТ
Пациенты с инфекциями, приобретенными в ОИТ, имели более длительные сроки госпитализации [17,6, IQR 11,2–26,2 против 8,9, IQR 6,0–14,5; p < 0,001) и пребывания в ОИТ (12,1, IQR 7,6–18,5 против 4,1, IQR 2,8–6,9; p < 0,001), чем таковых. Более того, у пациентов с приобретенной инфекцией смертность в ОИТ была выше [507 (17,7%) против 1036 (7,4%); p < 0,001] и выше госпитальная летальность [912 (31,8%) против 2600 (18,7%); p< 0,001], чем без таковой .



Кривая выживаемости Каплана-Мейера и ориентировочный анализ продемонстрировали значительно более высокую 28-дневную смертность у пациентов без инфекций, приобретенных в ОИТ, по сравнению с пациентами с приобретенной инфекцией, но смертность была неизменно выше от 28 до 100 дней после поступления в ОИТ при инфекциях, приобретенных в ОИТ (log-rank p <0,001).
Прогностические факторы, ассоциированные с ОИТ-ассоциированной инфекцией при сепсисе и построение номограммы
При однофакторном анализе по сравнению с пациентами без инфекции в ОИТ пациенты, у которых развилась инфекция в ОИТ, имеют более высокие баллы по шкале SOFA (4,05 ± 2,39 против 3,70 ± 2,07, p < 0,001), SIRS (2,90 ± 0,91 против 2,81 ± 0,89, p < 0,001), LODS (8,00 ± 3,51 против 6,07 ± 3,28, p < 0,001), оценка SAPS II (42,31 ± 15,04 против 40,63 ± 13,63, p < 0,001), оценка APS III (71,17 ± 27,28 против 0,001). 56,83 ± 24,51, р < 0,001) и OASIS (40,02 ± 8,89 против 35,74 ± 8,88, р < 0,001). На Figure 3 показано, что на тяжесть заболевания, основанную на показателях SIRS, SOFA, OASIS, LODS, APS III, CCI и SAPS II, большое влияние оказала частота инфекций, приобретенных в ОИТ. Мы построили модели, в которых система оценки предсказывает инфекции, приобретенные в ОИТ. Площадь под ROC-кривой прогностической эффективности системы оценки пациентов с инфекцией, приобретенной в ОИТ.

Многофакторный логистический анализ в исследуемой когорте показал, что ИВЛ (ОШ 2,64; 95% ДИ, 2,28–3,07), цереброваскулярная недостаточность (ОШ 2,45; 95% ДИ, 2,01–2,98), трахеостомия (ОШ 2,11; 95% ДИ, 1,14–3,90). ), антикоагулянты (ОШ 1,95; 95% ДИ, 1,73–2,19), LODS (ОШ 1,57; 95% ДИ, 1,44–1,70), нахождение в ОИТ хирургического профиля (ОШ 1,65; 95% ДИ, 1,49–1,83), грамотрицательные бактерии (ОШ 1,29; 95% ДИ, 1,13–1,48), гемотрансфузии (ОШ 1,40; 95% ДИ, 1,26–1,57), наличие центрального венозного (ОШ 1,12; 95% ДИ, 1,00–1,27) и мочевого катетера (ОШ 1,31; 95% ДИ, 1,17–1,47) были независимыми предикторами развития инфекции в ОИТ, у пациентов с сепсисом.

Номограмма этих предикторов представлена на Figure 4. С-индекс номограммы составил 0,737 (95% ДИ, 0,725–0,749) в исследуемой и 0,752 (95% ДИ, 0,735–0,769) в контрольной когорте. Калибровочные кривые и фактические наблюдения вероятности показаны на Figure 5. Новые модели имели AUC 0,737 (95% ДИ, 0,725–0,749), чувствительность 72,5% и специфичность 65,7% (Figure 6). Новые модели обладают большей точностью, чем классические системы оценки тяжести, в прогнозировании инфекции, приобретенной в ОИТ, у пациентов с сепсисом (Figure 6). Анализ кривой решений, сравнивающий клиническую полезность нашей новой модели и всех моделей системы оценки представлены наFigure 7.

Обсуждение
Насколько нам известно, это первое исследование с использованием большой общедоступной базы данных MIMIC IV для изучения инфекций, приобретенных в ОИТ, при сепсисе. В нашем исследовании строго следовали определению подозрения на инфекцию с органной дисфункцией согласно критериям Sepsis-3. Кроме того, база данных охватывает период в 10 лет, что намного превышает период предыдущих исследований, обеспечивая практическую значимость в контексте эпидемии и демонстрируя осуществимость в реальном мире. Мы подчеркиваем, что микробиологическая нагрузка и смертность от инфекции, приобретенной в ОИТ, постепенно увеличиваются с течением времени у выживших после сепсиса, несмотря на более высокую смертность в течение первых 28 дней в группе инфекции, не приобретенной в ОИТ.

Тяжелая инфекция вызывает цитокиновый шторм, способствуя широко распространенным реакциям хозяина, включая недостаточность микроциркуляции, дисфункцию органов, шок и смерть (Kaukonen et al., 2014). Ранняя летальность от сепсиса значительно снизилась благодаря активной реализации рекомендаций SurvivingSepsis Campaign (Coopersmith et al., 2018).

Следовательно, отдаленные исходы после сепсиса привлекают все большее внимание. Два недавних крупных исследования показали, что инфекция, приобретенная в ОИТ, может значительно увеличить смертность, связанную с сепсисом, с показателями 44,2% и 49,2% к 60-му дню (van Vught et al., 2016; van Vught et al., 2017). В то время как Goldenberg et al. (2014) сообщили, что инфекция, полученная в ОИТ, является причиной лишь 14% смертей при сепсисе, наряду с другими потенциальными факторами смертности от сепсиса, включая митохондриальную дисфункцию и капиллярную утечку. Уровень заболеваемости инфекциями, приобретенными в ОИТ, у больных сепсисом в этом исследовании составил 17,1%. Аналогичные результаты были получены в двух предыдущих крупных обсервационных исследованиях, которые составили 14,4% и 13,5% соответственно, хотя мы зафиксировали несколько более высокую кумулятивную частоту инфекций, приобретенных в ОИТ (van Vughtet al., 2016; van Vught et al., 2017). Тем не менее, в двух ретроспективных исследованиях была обнаружена более высокая частота инфекций, что составило 31,0% и 38,9% (Zhao et al., 2016; Chen et al., 2019). Это могло быть связано с относительно ограниченным размером выборки и использованием критериев сепсиса 2.0 для определения когорты пациентов для включение в исследования.

Для пациентов ОИТ шкалы SIRS, SOFA, OASIS, LODS, APS III, SAPS II и CCI являются фундаментальными индивидуальными оценками риска для характеристики тяжести заболевания и степени дисфункции органов (Minne et al., 2008; Chen et al., 2019 ; Li et al., 2020; Zhu et al., 2022). Пациенты с ослабленным иммунитетом очень восприимчивы к опасным условно-патогенным микроорганизмам и могут быстро погибнуть от инфекции (Sundar and Sires, 2013). Кроме того, SAPS II, SIRS и степень органной недостаточности были определены как плохие инструменты раннего предупреждения об инфекции (Vincent et al., 2009; Herrod et al., 2018).Учитывая это , мы попытались построить регрессионные модели с этими системами оценки и сравнить их с нашей недавно разработанной прогностической моделью. Номограмма включала LODS, обеспечивающую наилучшую дискриминационную способность и чистое преимущество по сравнению с любыми текущими распространенными моделями клинических систем оценки по всем пороговым значениям.



Шкала SOFA была задумана как инструмент для описания возникновения дисфункции различных органов и прогнозирования исхода, но несколько исследований показали, что прогностические значения LODS или SAPSII были немного лучше, чем шкалы SOFA для прогнозирования летальных исходов от сепсиса (Li et al., 2020; Zhuet al., 2022). В соответствии с этим оценка по шкале SOFA для прогнозирования развития инфекции а ОИТ, которая увеличивает смертность пациентов с сепсисом, в настоящем исследовании демонстрирует худший результат.
Синдром иммуносупрессии, вызванный повреждением головного мозга, инициированным ишемией обнаружен на животных моделях и был опосредован интенсивной активацией гипоталамо-гипофизарной оси и симпатической нервной системы (Dirnagl et al., 2007). Повышенный уровень катехоламинов и последующее подавление иммунной функции связаны с возникновением инфекций после острого повреждения головного мозга (Haeusler et al., 2008; Klehmet et al., 2009).
Почти у 40% пациентов, перенесших трепанацию черепа, по крайней мере один раз развивается инфекция, такая как пневмония, не связанная с ИВЛ (15%), вентилятор-ассоциированная пневмония (ВАП; 23%), инфекция мочевыводящих путей (ИМП; 9%) и инфекция области хирургического вмешательства (ИОХВ; 9%) (Kourbeti etal., 2015). Более того, инвазивные процедуры, в том числе центральный венозный катетер, мочевой катетер, искусственная вентиляция легких и трахеостомия являются потенциальными факторами риска в течение первых 48 часов пребывания в ОИТ, создавая идеальную возможность для бактериальной адгезии и образования биопленки (Sottile et al., 1986; Elsayed et al., 2022). Инфицированию способствует быстрая колонизация.Следовательно, дополнительные исследования должны быть сосредоточены на материалах катетеров с антимикробным покрытием, чтобы предотвратить возникновение инфекции и ее прогрессирование.
Переливание эритроцитов стало потенциальным фактором риска развития внутрибольничных инфекций при различных клинических ситуациях, включая сепсис (Dupuis et al., 2017; Dupuis et al., 2017; Nederpelt et al., 2020). Кроме того, это связано с повышенным риском венозного тромбоза при аллогенной трансфузии и инфекций, связанных с трансфузией (Jaffray et al., 2020; Miyamoto et al., 2021). Кроме того, хранящиеся эритроциты и тромбоциты могут высвобождать внутриклеточные цитокины и другие компоненты, которые индуцируют иммуносупрессивный фенотип в лимфоцитах (Aslam et al., 2008; Torrance et al., 2015).
Примечательно, что сепсис, вызванный грамотрицательными бактериями, повышает риск инфицирования в ОИТ. Среди 27 766 случаев инфекций кровотока, связанных с центральным венозным катетером, зарегистрированных в Национальной сети безопасности здравоохранения (NHSN) в период с 2009 по 2010 год, большая часть выделенных в ОИТ лекарственно-устойчивых бактерий была грамотрицательными (Sader et al., 2014). Резистентность к антимикробным препаратам приводит к низкой эффективности лечения и сложным схемам терапии. Растет осведомленность о том, что повышенная восприимчивость к инфекциям, приобретенным в ОИТ, может быть патоген-специфической из-за различных моделей разрушения иммунного барьера, что может привести к условно-патогенным бактериальным и грибковым инфекциям (Koch et al., 2017).
Хотя использование большого набора информации из общедоступной базы данных обеспечивает существенную поддержку наших выводов, наше исследование имеет несколько ограничений. Во-первых, на наши результаты могли повлиять искажающие факторы из-за того, что пациенты с сепсисом поступали в ОИТ с различной степенью тяжести заболевания, но крупнейшее когортное исследование, включающее данные о пациентах, собранные за почти 10 лет, должно быть клинически репрезентативным. Во-вторых, все переменные, включенные в нашу прогностическую модель, связаны в основном с демографическими характеристиками пациентов, основным заболеванием, патогенами и поддерживающим лечением, и отсутствовали некоторые значимые лабораторные показатели, что приводило к низкой прогностической эффективности нашей модели.
Тем не менее, вся клиническая информация доступна во многих учреждениях, и для оценки реальных клинических ситуаций использовалась многофакторная модель логистического риска. Действительно, не было никаких существенных различий в уровнях лимфоцитов, нейтрофилов, частичного тромбопластинового времени или активированного частичного тромбопластинового времени в нашей когорте. Нарушения микроциркуляции возникают рано, через 12 ч после сепсиса, и связаны с взаимодействием нейтрофилов и эндотелия, образованием микротромбов и повышением проницаемости сосудов (Wu et al., 2015).
This may explain that the indicators of coagulation function did not differ between those with ICU-acquired infection and those without. Additionally, the occurrence of acquired infection is mainly related to immune cell function; the value of some biomarkers of immune cell function in predicting susceptibility to ICU-acquired infections warrants exploration (van Vught et al., 2016). Third, up to dozens of risk factors were included in our model, which may be related to theheterogeneity of the group with sepsis. To overcome this limitation, we strictly followed the latest diagnostic criteria for sepsisand comprehensively accounted for pathogens, antibiotics, and other relevant factors, which may have improved theprediction of secondary infection occurrence.
Этим можно объяснить, что показатели свертывающей функции не различались между пациентами с инфекцией в ОИТ и без нее. Кроме того, развитие инфекции в основном связано с функцией иммунных клеток;значение некоторых биомаркеров в прогнозировании восприимчивости к инфекциям, приобретенным в ОРИТ, требует изучения (van Vught et al., 2016). В-третьих, в нашу модель было включено до десятков факторов риска, что может быть связано с неоднородностью группы с сепсисом. Чтобы преодолеть это ограничение, мы строго следовали последним диагностическим критериям сепсиса и всесторонне учитывали патогены, антибиотики и другие соответствующие факторы, что могло улучшить прогнозирование возникновения вторичной инфекции.
Вывод
Выжившие после сепсиса подвержены повышенному риску развития инфекций в ОРИТ, которые приводят к увеличению долгосрочной смертности. У пациентов с цереброваскулярной недостаточностью или грамотрицательными бактериями, находящимся в ОИТ хирургического профиля, имеющими центральный венозный или мочевой катетер, которым проводится искусственная вентиляция легких, гемотрансфузия назначают антикоагулянты в течение 48 часов после поступления в ОИТ гораздо приобретают инфекции в ОИТ. Полученные данные могут помочь врачам оптимизировать лечение инфекций, связанных с сепсисом, в ОИТ и улучшить исходы сепсиса.
References
Aslam, R., Speck, E. R., Kim, M., Freedman, J., and Semple, J. W. (2008). Transfusion-relatedimmunomodulation by platelets is dependent on their expression of MHC class I molecules and is independent of whitecells. Transfusion 48 (9), 1778–1786. doi: 10.1111/j.1537-2995.2008.01791.x
Cavaillon, J. M., Singer, M., and Skirecki, T. (2020). Sepsis therapies: learning from 30 years of failure of translational research to propose new leads. EMBO Mol. Med. 12 (4), e10128. doi: 10.15252/emmm.201810128
Chen, Y., Hu, Y., Zhang, J., Shen, Y., Huang, J., Yin, J., et al. (2019). Clinical characteristics, risk factors, immunestatus and prognosis of secondary infection of sepsis: a retrospective observational study. BMC Anesthesiol. 19 (1), 185.doi: 10.1186/s12871-019-0849-9
Chen, X., Ling, X., Liu, G., and Xiao, J. (2022). Antimicrobial coating: Tracheal tube application. Int. J.Nanomedicine 17, 1483–1494. doi: 10.2147/IJN.S353071
Chen, Q., Zhang, L., Ge, S., He, W., and Zeng, M. (2019). Prognosis predictive value of the Oxford acute severityof illness score for sepsis: a retrospective cohort study. PeerJ 7, e7083. doi: 10.7717/peerj.7083
Coopersmith, C. M., De Backer, D., Deutschman, C. S., Ferrer, R., Lat, I., Machado, F. R., et al. (2018). Surviving sepsis campaign: research priorities for sepsis and septic shock. Intensive Care Med. 44 (9), 1400–1426. doi: 10.1007/s00134-018-5175-z
Dirnagl, U., Klehmet, J., Braun, J. S., Harms, H., Meisel, C., Ziemssen, T., et al. (2007). Stroke-induced immunodepression: experimental evidence and clinical relevance. Stroke 38 (2 Suppl), 770–773. doi:10.1161/01.STR.0000251441.89665.bc
Dupuis, C., Garrouste-Orgeas, M., Bailly, S., Adrie, C., Goldgran-Toledano, D., Azoulay, E., et al. (2017). Effect of transfusion on mortality and other adverse events among critically ill septic patients: An observational study using amarginal structural cox model. Crit. Care Med. 45 (12), 1972–1980. doi: 10.1097/ CCM.0000000000002688
Dupuis, C., Sonneville, R., Adrie, C., Gros, A., Darmon, M., Bouadma, L., et al. (2017). Impact of transfusion on patients with sepsis admitted in intensive care unit: a systematic review and meta-analysis. Ann. Intensive Care 7 (1),5. doi: 10.1186/s13613-016-0226-5
Elsayed, A., Moussa, Z., Alrdahe, S. S., Alharbi, M. M., Ghoniem, A. A., El- khateeb, A. Y., et al. (2022).Optimization of heavy metals biosorption via artificial neural network: A case study of cobalt (II) sorption by pseudomonas alcaliphila NEWG-2. Front. Microbiol. 13. doi: 10.3389/fmicb.2022.893603
Goldenberg, N. M., Leligdowicz, A., Slutsky, A. S., Friedrich, J. O., and Lee, W. L. (2014). Is nosocomial infectionreally the major cause of death in sepsis? Crit. Care (London England) 18 (5), 540. doi: 10.1186/s13054-014-0540-y
Haeusler, K. G., Schmidt, W. U., Fohring, F., Meisel, C., Helms, T., Jungehulsing,
G. J., et al. (2008). Cellular immunodepression preceding infectious complications after acute ischemic stroke inhumans. Cerebrovasc. Dis. 25 (1-2), 50–58. doi: 10.1159/000111499
Herrod, P., Cox, M., Keevil, H., Smith, K., and Lund, J. N. (2018). NICE guidance on sepsis is of limited value inpostoperative colorectal patients: the scores that cry ‘wolf!’. Ann. R Coll. Surg. Engl. 100 (4), 275–278. doi:10.1308/rcsann.2017.0227
Jaffray, J., Witmer, C., O’Brien, S. H., Diaz, R., Ji, L., Krava, E., et al. (2020). Peripherally inserted centralcatheters lead to a high risk of venous thromboembolism in children. Blood 135 (3), 220–226. doi: 10.1182/blood.2019002260
Johnson, A. E. W., Aboab, J., Raffa, J. D., Pollard, T. J., Deliberato, R. O., Celi, L. A., et al. (2018). A comparative analysis of sepsis identification methods in an electronic database. Crit. Care Med. 46 (4), 494–499. doi: 10.1097/CCM.0000000000002965
Kaukonen, K. M., Bailey, M., Suzuki, S., Pilcher, D., and Bellomo, R. (2014). Mortality related to severe sepsis and septic shock among critically ill patients in Australia and new Zealand, 2000-2012. JAMA 311 (13), 1308–1316. doi:10.1001/ jama.2014.2637
Klehmet, J., Harms, H., Richter, M., Prass, K., Volk, H. D., Dirnagl, U., et al. (2009). Stroke-inducedimmunodepression and post-stroke infections: lessons from the preventive antibacterial therapy in stroke trial. Neuroscience 158 (3), 1184–1193. doi: 10.1016/j.neuroscience.2008.07.044
Koch, R. M., Kox, M., de Jonge, M. I., van der Hoeven, J. G., Ferwerda, G., and Pickkers, P. (2017). Patterns in bacterial- and viral-induced immunosuppression and secondary infections in the ICU. Shock 47 (1), 5–12. doi: 10.1097/SHK.0000000000000731
Kourbeti, I. S., Vakis, A. F., Ziakas, P., Karabetsos, D., Potolidis, E., Christou, S., et al. (2015). Infections in patients undergoing craniotomy: risk factors associated with post-craniotomy meningitis. J. Neurosurg. 122 (5), 1113–1119. doi: 10.3171/ 2014.8.JNS132557
Liu, C., Hu, C., Huang, J., Xiang, K., Li, Z., Qu, J., et al. (2021). A prognostic nomogram of colon cancer withliver metastasis: A study of the US SEER database and a Chinese cohort. Front. Oncol. 11. doi: 10.3389/fonc.2021.591009
Li, Y., Yan, C., Gan, Z., Xi, X., Tan, Z., Li, J., et al. (2020). Prognostic values of SOFA score, qSOFA score, andLODS score for patients with sepsis. Ann. Palliat. Med. 9 (3), 1037–1044. doi: 10.21037/apm-20-984
Minne, L., Abu-Hanna, A., and de Jonge, E. (2008). Evaluation of SOFA-based models for predicting mortality in the ICU: A systematic review. Crit. Care (London England) 12 (6), R161. doi: 10.1186/cc7160
Miyamoto, S., Umeda, K., Kurata, M., Nishimura, A., Yanagimachi, M., Ishimura, M., et al. (2021).Hematopoietic cell transplantation for severe combined immunodeficiency patients: a Japanese retrospective study. J. Clin. Immunol. 53 (3), 1–13. doi: 10.1007/s10875-021-01112-5
Nederpelt, C. J., El Hechi, M., Parks, J., Fawley, J., Mendoza, A. E., Saillant, N., et al. (2020). The dose-dependent relationship between blood transfusions and infections after trauma: A population-based study. J. Trauma Acute CareSurg. 89 (1), 51–57. doi: 10.1097/TA.0000000000002637
Nedeva, C., Menassa, J., Duan, M., Liu, C., Doerflinger, M., Kueh, A. J., et al. (2020). TREML4 receptor regulates inflammation and innate immune cell death during polymicrobial sepsis. Nat. Immunol. 21 (12), 1585–1596. doi: 10.1038/ s41590-020-0789-z
Otto, G. P., Sossdorf, M., Claus, R. A., Rodel, J., Menge, K., Reinhart, K., et al. (2011). The late phase of sepsis is characterized by an increased microbiological burden and death rate. Crit. Care (London England) 15 (4), R183. doi:10.1186/cc10332
Rudd, K. E., Johnson, S. C., Agesa, K. M., Shackelford, K. A., Tsoi, D., Kievlan, D. R., et al. (2020). et al: Global, regional, and national sepsis incidence and mortality, 1990–2017: analysis for the global burden of disease study. Lancet 395 (10219), 200–211. doi: 10.1016/s0140-6736(19)32989-7
Sader, H. S., Farrell, D. J., Flamm, R. K., and Jones, R. N. (2014). Antimicrobial susceptibility of gram-negative organisms isolated from patients hospitalized in intensive care units in united states and European hospitals (2009-2011). Diagn. Microbiol. Infect. Dis. 78 (4), 443–448. doi: 10.1016/j.diagmicrobio.2013.11.025
Singer, M., Deutschman, C. S., Seymour, C. W., Shankar-Hari, M., Annane, D., Bauer, M., et al. (2016). The thirdinternational consensus definitions for sepsis and septic shock (Sepsis-3). Jama 315 (8), 801–810. doi:10.1001/jama.2016.0287
Sottile, F. D., Marrie, T. J., Prough, D. S., Hobgood, C. D., Gower, D. J., Webb, L. X., et al. (1986). Nosocomial pulmonary infection: possible etiologic significance of bacterial adhesion to endotracheal tubes. Crit. Care Med. 14 (4), 265–270. doi: 10.1097/00003246-198604000-00001
Stortz, J. A., Murphy, T. J., Raymond, S. L., Mira, J. C., Ungaro, R., Dirain, M. L., et al. (2018). Evidence for persistent immune suppression in patients who develop chronic critical illness after sepsis. Shock 49 (3), 249–258. doi:10.1097/ SHK.0000000000000981
Sundar, K. M., and Sires, M. (2013). Sepsis induced immunosuppression: Implications for secondary infections and complications. Indian J. Crit. Care Medicine: Peer Reviewed Off. Publ. Indian Soc. Crit. Care Med. 17 (3), 162–169.doi: 10.4103/0972-5229.117054
Torrance, H. D., Brohi, K., Pearse, R. M., Mein, C. A., Wozniak, E., Prowle, J. R., et al. (2015). Associationbetween gene expression biomarkers of immunosuppression and blood transfusion in severely injured polytraumapatients. Ann. Surg. 261 (4), 751–759. doi: 10.1097/SLA.0000000000000653
van Vught, L. A., Klein Klouwenberg, P. M., Spitoni, C., Scicluna, B. P., Wiewel,
M. A., Horn, J., et al. (2016). Incidence, risk factors, and attributable mortality of secondary infections in the intensive care unit after admission for sepsis. JAMA 315 (14), 1469–1479. doi: 10.1001/jama.2016.2691
van Vught, L. A., Wiewel, M. A., Hoogendijk, A. J., Frencken, J. F., Scicluna, B. P., Klein Klouwenberg, P. M. C., et al. (2017). The host response in patients with sepsis developing intensive care unit-acquired secondary infections. Am.J. Respir. Crit. Care Med. 196 (4), 458–470. doi: 10.1164/rccm.201606-1225OC
Vincent, J. L., Rello, J., Marshall, J., Silva, E., Anzueto, A., Martin, C. D., et al. (2009). International study of theprevalence and outcomes of infection in intensive care units. JAMA 302 (21), 2323–2329. doi: 10.1001/jama.2009.1754
Wolkewitz, M., Cooper, B. S., Palomar-Martinez, M., Alvarez-Lerma, F., Olaechea-Astigarraga, P., Barnett, A. G., et al. (2014). Multilevel competing risk models to evaluate the risk of nosocomial infection. Crit. Care (London England) 18 (2), R64. doi: 10.1186/cc13821
Wu, Y., Ren, J., Zhou, B., Ding, C., Chen, J., Wang, G., et al. (2015). Laser speckle contrast imaging for measurement of hepatic microcirculation during the sepsis: a novel tool for early detection of microcirculationdysfunction. Microvasc. Res. 97, 137–146. doi: 10.1016/j.mvr.2014.10.006
Yang, Y. C., Wang, J. J., Huang, Y., Cai, W. X., and Tao, Q. (2021). Development and validation of a prognosticnomogram for postoperative recurrence-free survival of ameloblastoma. Cancer Manag Res. 13, 4403–4416. doi: 10.2147/ CMAR.S307517
Zhang, Z., Cortese, G., Combescure, C., Marshall, R., Lee, M., Lim, H. J., et al. (2018). Overview of model validation for survival regression model with competing risks using melanoma study data. Ann. Transl. Med. 6 (16), 325. doi:10.21037/atm.2018.07.38
Zhao, G. J., Li, D., Zhao, Q., Song, J. X., Chen, X. R., Hong, G. L., et al. (2016). Incidence, risk factors and impact on outcomes of secondary infection in patients with septic shock: an 8-year retrospective study. Sci. Rep. 6, 38361. doi: 10.1038/ srep38361
Zhu, Y., Zhang, R., Ye, X., Liu, H., and Wei, J. (2022). SAPS III is superior to SOFA for predicting 28-day mortality in sepsis patients based on sepsis 3.0 criteria. Int. J. Infect. Dis. 114, 135–141. doi: 10.1016/j.ijid.2021.11.015
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] => Array
(
[ID] => 4576
[TIMESTAMP_X] => 11.11.2024 15:27:43
[MODULE_ID] => iblock
[HEIGHT] => 614
[WIDTH] => 920
[FILE_SIZE] => 77972
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/d97/pq0ysny0ubeuwad0c5ysgxeojnw3am8w
[FILE_NAME] => michael-schiffer-13UugSL9q7A-unsplash.jpg
[ORIGINAL_NAME] => michael-schiffer-13UugSL9q7A-unsplash.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 43e83d4c8bbfbca4e6dfe9917e3b65c0
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/d97/pq0ysny0ubeuwad0c5ysgxeojnw3am8w/michael-schiffer-13UugSL9q7A-unsplash.jpg
[UNSAFE_SRC] => /upload/iblock/d97/pq0ysny0ubeuwad0c5ysgxeojnw3am8w/michael-schiffer-13UugSL9q7A-unsplash.jpg
[SAFE_SRC] => /upload/iblock/d97/pq0ysny0ubeuwad0c5ysgxeojnw3am8w/michael-schiffer-13UugSL9q7A-unsplash.jpg
[ALT] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[TITLE] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
)
[~DETAIL_PICTURE] => 4576
[DATE_ACTIVE_FROM] => 10.11.2022
[~DATE_ACTIVE_FROM] => 10.11.2022
[ACTIVE_FROM_X] => 2022-11-10 00:00:00
[~ACTIVE_FROM_X] => 2022-11-10 00:00:00
[ACTIVE_FROM] => 10.11.2022
[~ACTIVE_FROM] => 10.11.2022
[SHOW_COUNTER] => 1327
[~SHOW_COUNTER] => 1327
[ID] => 8318
[~ID] => 8318
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 11.11.2024 15:27:43
[~TIMESTAMP_X] => 11.11.2024 15:27:43
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/klinicheskie-kharakteristiki-i-faktory-riska-svyazannye-s-infektsiyami-priobretennymi-v-otdelenii-in/
[~DETAIL_PAGE_URL] => /library/articles/klinicheskie-kharakteristiki-i-faktory-riska-svyazannye-s-infektsiyami-priobretennymi-v-otdelenii-in/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => klinicheskie-kharakteristiki-i-faktory-riska-svyazannye-s-infektsiyami-priobretennymi-v-otdelenii-in
[~CODE] => klinicheskie-kharakteristiki-i-faktory-riska-svyazannye-s-infektsiyami-priobretennymi-v-otdelenii-in
[EXTERNAL_ID] => 8318
[~EXTERNAL_ID] => 8318
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 10 ноября 2022
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[PREVIEW_PICTURE] => Array
(
[ID] => 4575
[TIMESTAMP_X] => 11.11.2024 15:27:43
[MODULE_ID] => iblock
[HEIGHT] => 481
[WIDTH] => 720
[FILE_SIZE] => 51382
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/dde/mvp8dux6juddpj58xbxh12zdjyjd2i89
[FILE_NAME] => michael-schiffer-13UugSL9q7A-unsplash.jpg
[ORIGINAL_NAME] => michael-schiffer-13UugSL9q7A-unsplash.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 491e6a28486edffa2214768e4395df81
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/dde/mvp8dux6juddpj58xbxh12zdjyjd2i89/michael-schiffer-13UugSL9q7A-unsplash.jpg
[UNSAFE_SRC] => /upload/iblock/dde/mvp8dux6juddpj58xbxh12zdjyjd2i89/michael-schiffer-13UugSL9q7A-unsplash.jpg
[SAFE_SRC] => /upload/iblock/dde/mvp8dux6juddpj58xbxh12zdjyjd2i89/michael-schiffer-13UugSL9q7A-unsplash.jpg
[ALT] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[TITLE] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
)
[DETAIL_TEXT] =>
Front. Cell. Infect. Microbiol. 12:962470. doi: 10.3389/fcimb.2022.962470.
He Y, Xu J, Shang X, Fang X, Gao C, Sun D, Yao L, Zhou T, Pan S, Zou X, Shu H, Yang X and Shang Y (2022) Clinical characteristics and risk factors associated with ICU-acquired infections in sepsis: A retrospectivecohort study.
Абстракт
Инфекция, приобретенная в отделении интенсивной терапии (ОИТ), является частой причиной неблагоприятного исхода сепсиса в ОИТ. Тем не менее, сепсис-ассоциированные инфекции, приобретенные в ОИТ, не были полностью охарактеризованы. Исследование направлено на оценку факторов риска и разработку модели, предсказывающей риск инфекций, приобретенных в ОИТ, у пациентов с сепсисом.
Информацию получали из базы данных Medical Information Mart for Intensive Care (MIMIC) IV. Пациенты были случайным образом разделены основную группу и группу сравнения в соотношении 7:3. Модель многомерной логистической регрессии использовалась для выявления независимых факторов риска, которые могли бы предсказать инфекцию, приобретенную в ОИТ.
Из 16 808 включенных пациентов с сепсисом у 2 871 (17,1%) развилась инфекция, приобретенная в ОИТ. У этих пациентов смертность в ОИТ составила 17,7%, внутрибольничная — 31,8%, а также обнаружили, что смертность продолжала расти с 28 до 100 дней после поступления в ОИТ. Уровень оценки по шкале синдрома системного воспалительного ответа (SIRS), SOFA, Оксфордской шкале тяжести острого заболевания (OASIS), шкалам SAPS II и LODS, индексу коморбидности Чарлсона (CCI) и шкале APS III были связаны с инфекцией, полученной в ОИТ, цереброваскулярной недостаточностью, грамотрицательными бактериями, хирургическим ОИТ, трахеостомой, центральным венозным катетером, мочевым катетером, ИВЛ, гемотрансфузией.
Оценка по шкале LODS и антикоагулянтная терапия были независимыми предикторами развития инфекции, приобретенной в ОИТ, у пациентов с сепсисом. Номограмма, основанная на этих независимых предикторах, показала хорошую калибровку и различия как в основной, (AUROC = 0,737; 95% ДИ, 0,725–0,749), так и в группе сравнения (AUROC = 0,751; 95% ДИ, 0,734–0,769) популяциях, и была выше по сравнению с моделями SIRS, SOFA, OASIS, SAPS II, LODS, CCI и APS III.
Инфекции, приобретенные в ОИТ, повышают вероятность смерти у больных с сепсисом. Индивидуальная прогностическая модель на основе номограммы может точно предсказать инфекцию, приобретенную в ОИТ, и оптимизировать лечение или индивидуальную терапию.
Сепсис характеризуется острой органной дисфункцией в ответ на различные тяжелые инфекции и является одним из самых серьезных заболеваний во всем мире, что приводит к высокой смертности пациентов в ОИТ (Rudd et al., 2020; Cavaillon et al., 2020). Среди смертей от сепсиса примерно 15% приходится на острые случаи, возникающие вскоре после начала сепсиса, а 85% — на позднюю фазу, обычно из-за инфекций, приобретенных в ОИТ (Nedeva et al., 2020). В настоящее время доминирующим взглядом на основные причины этих смертей является то, что у пациентов с сепсисом наблюдается иммуносупрессия (Stortz et al., 2018). Пациенты с ослабленным иммунитетом очень восприимчивы к опасным условно-патогенным микроорганизмам, вызывающими инфекции в ОИТ (Sundar and Sires, 2013; Koch et al., 2017). Инфекции, приобретенные в ОИТ, в значительной степени связаны с повышенной внутрибольничной смертностью, увеличением длительности госпитализации и неблагоприятным прогнозом (Otto et al., 2011; van Vught et al., 2017). Поэтому необходимо выявить факторы риска развития внутрибольничных инфекций у больных с сепсисом.
У пациентов с сепсисом на риск развития инфекции в ОИТ влияет множество взаимосвязанных факторов. Например, некоторые исследования, проведенные 10 лет назад с небольшими выборками или охватывающие короткий период времени (Chen et al., 2022), показали, что пожилой возраст, тяжесть заболевания, катетеризация глубоких вен и инвазивная вентиляция были связаны с повышенным риском развития инфекций в ОИТ при сепсисе (Wolkewitz et al., 2014; van Vught et al., 2016; Chen et al., 2019). Несмотря на связь более низкой экспрессии человеческого лейкоцитарного антигена и повышенного уровня интерлейкина-10 (ИЛ-10) с инфекцией, приобретенной в ОИТ (van Vught et al., 2017; Stortz et al., 2018), выявление пациентов с сепсисом с более высоким риском инфекции, приобретенной в ОИТ, остается клинически сложной. В настоящее время многие решения, связанные с ведением сепсис-ассоциированной инфекции в ОИТ основаны на оценке вероятности развития инфекции у пациента в будущем (van Vught et al., 2016). Тем не менее, сепсис-ассоциированные инфекции, приобретенные в ОИТ, еще предстоит полностью охарактеризовать.
Here, we analyzed the data from the large public database Medical Information Mart for Intensive Care (MIMIC) IV and attempted to identify the differences in clinical characteristics between septic patients who did and did not experience ICU- acquired infection, identify the risk factors associated with septic ICU-acquired infection occurrence andits outcomes, and develop a novel risk prediction model that predicts ICU- acquired infections for patients with sepsis.
Мы проанализировали данные из большой общедоступной базы данных Medical Information Mart forIntensive Care (MIMIC) IV и попытались выявить различия в клинических характеристиках у пациентов с сепсисом, перенесшими и не перенесшими инфекцию в ОИТ, определить факторы риска, связанные свозникновение инфекции в ОИТ и ее исходы, а также разработать новую модель прогнозирования риска, которая предсказывает развитие инфекции в ОИТ для пациентов с сепсисом.
Методы
База данных
Все клинические данные, проанализированные в этом исследовании, были извлечены из международной онлайн-базы данных интенсивной терапии MIMIC-IV (версия 1.0) (Johnson et al., 2018), которая включает данные о пациентах, собранные в ОИТ медицинского центра Beth Israel Deaconess в период с 2008 по 2019 год. Эта база включает данные 382 278 пациентов и 523 740 госпитализаций в ОИТ. Один из авторов этого исследования (YH) сдал экзамен по институциональному обучению (номер сертификата: 31935546). Код, используемый для извлечения данных, доступен на GitHub (https://github.com/MIT-LCP/mimic-iv).
Исследуемая популяция и определения
Использовали определение сепсиса на основании концепции Сепсис-3, что означает наличие у пациентов подозрения на инфекцию и оценку по шкале SOFA ≥2 (Singer et al., 2016). Пациенты моложе 18 лет, с оценкой по шкале SOFA <2 при поступлении в ОИТ и с пребыванием в ОИТ менее 48 часов, были исключены (van Vught etal., 2016). Первичная инфекция, приобретенная в ОИТ, определялась как любая новая возможная инфекция с новой положительной культурой патогенных микроорганизмов и новым режимом антибиотикотерапии через 48 часов после поступления в ОИТ в соответствии с критериями Центра по контролю и профилактике заболеваний (Singer et al., 2016; Johnson). и др., 2018).
Сбор данных
Только пациенты с сепсисом при первом поступлении в ОИТ, которые соответствовали критериям включения, были включены в анализ, чтобы избежать двойного учета повторных поступлений. Исходные параметры пациента были извлечены из базы данных: возраст, пол, вес, продолжительность госпитализации в ОИТ и стационаре и смерть. Базовые рейтинговые шкалы ОИТ такие как SOFA, SIRS, OASIS, LODS, SAPS II, APS III и CCI были рассчитаны при поступлении. Сопутствующие заболевания при первом поступлении включали шок, сердечно-сосудистые и цереброваскулярные заболевания, хирургическое вмешательство, рак, заболевание почек и печеночную недостаточность. Вмешательства включали медикаментозное лечение (вазопрессоры, глюкокортикоиды, гепарин), переливание крови, ИВЛ, заместительную почечную терапию, установку центрального венозного и мочевого катетера. Собраны лабораторные данные при поступлении в ОИТ. Результаты микробиологического исследования, зарегистрированные в базе данных, использовались как доказательство инфекции, приобретенной в ОИТ. Были зарегистрированы время возникновения инфекции, приобретенной в ОИТ, все патогенные микроорганизмы и очаги инфекции от момента госпитализации до перевода из ОИТ.
Статистический анализ
Переменные с >20% отсутствующих значений были исключены, а оставшиеся отсутствующие данные были оценены с использованием множественных импутаций. Для описательных данных параметрические количественные переменные выражаются как среднее значение и стандартное отклонение, непараметрические количественные переменные — как медиана и межквартильный размах (IQR), а категориальные переменные — как число и процент. Различия между пациентами с инфекцией, приобретенной в ОИТ, и без нее были проанализированы с использованием t-критерия или критерия хи-квадрат для параметрических переменных, U-критерия Манна-Уитни или критерия Крускала-Уоллиса для непрерывных непараметрических переменных и точного критерия Фишера для категориальных переменных. Кривая выживаемости Каплана-Мейера и анализ ориентиров с использованием логарифмического рангового теста применялись для оценки показателей выживаемости. Все пациенты были случайным образом распределены в когорты для изучения или проверки в соотношении 7:3 (Yang et al., 2021; Liu et al., 2021). В исследуемой когорте потенциальные прогностические факторы были исключены с помощью однофакторной регрессии, которая может быть связана с инфекцией, полученной в ОРИТ, включая все переменные со значением p <0,05. Затем факторы были дополнительно проанализированы с использованием модели бинарной многомерной логистической регрессии для выявления факторов риска (Zhang et al., 2018).
Впоследствии факторы с прогностической значимостью в многомерном логистическом регрессионном анализе использовались для построения модели прогнозирования, а для визуализации модели использовалась номограмма. Значения отношения шансов (OR) были рассчитаны с соответствующими 95% доверительными интервалами (ДИ). Эффективность распознавания номограммы измерялась с использованием индекса согласованности Харрелла (C-индекс), ROC-анализа и площади под кривой AUROC и калибровочных графиков, в то время как калибровочный график использовался для графической оценки калибровка номограммы как в исследуемой, так и в когорте сравнения.
Программное обеспечение Stata/IC 16.0 (Stata Corp., College Station, TX, USA) использовалось для проведения статистического анализа. Двустороннее значение p<0,05 считалось статистически значимым. Для анализа ориентиров использовались пакеты «TSHRC» и «survminer». Пакеты «rms» и «regplot» использовались для проведения модели логистического регрессионного анализа и для построения номограммы. Калибровочные кривые, кривые ROC и кривые DCA были созданы с использованием пакетов «graphics», «pROC» и «rmda» на языке программирования R (версия 4.1.3; R Foundation for Statistical Computing, Вена, Австрия).
Полученные результаты
Демографические и клинические характеристики пациентов
Мы обследовали 16 808 пациентов, которые соответствовали критериям включения (Figure 1). Исходные характеристики пациентов при поступлении представлены в Table 1. Средний возраст включенных пациентов составил 64,65 ± 16,27 года, 9609 пациентов (57,2%) были мужчинами. Среди пациентов с сепсисом у 2871 (17,1%) человека развились инфекции, приобретенные в ОИТ. Средний возраст составил 62,49 ± 16,62 года у пациентов с инфекциями, приобретенными в ОИТ, и 65,09 ± 16,17 года у пациентов без инфекций, приобретенных в ОИТ (p < 0,001). 1703 (59,3%) пациента с инфекциями, приобретенными в ОИТ, находились в ОИТ хирургического профиля. Количество пациентов без инфекций, приобретенных в ОИТ, составляет 6 521 (46,8%).
Кроме того, у больных с инфекциями, приобретенными в ОИТ была выше распространенность сердечно-сосудистого шока [256 (8,9%) против 888 (6,4%), p < 0,001], септического шока [823 (28,7%) против 3064 (22,0%), p < 0,001], травматического шока [47 (1,6%) против 117 (0,7%), p < 0,001] и цереброваскулярной недостаточности [252 (8,8%) против 632 (4,5%), p < 0,001]. .
Первичная этиология сепсиса представлена грамположительными (21,3%) и грамотрицательными бактериями (14,0%). По сравнению с пациентами без инфекций, приобретенных в ОИТ, у пациентов с инфекциями, приобретенными в ОИТ, выше частота инфекций, вызванных грамположительными бактериями [686 (23,9%) против 2887 (20,7%), p <0,001], особенно MRSA [103 (3,6%) против 395 (2,8%), p = 0,03] и грамотрицательными бактериями [521 (18,1%) против 1839 (13,2%), p <0,001], такими как видами Pseudomonas[35 (1,2%) против 67 (0,5%), p < 0,001], Acinetobacter baumannii [5 (0,2%) против 6 (0,0%), p = 0,012] и Notrophomonas maltophilia [8 ( 0,3%) против 15 (0,1%), р = 0,024]. Пациенты с легочной инфекцией [659 (23,0%) против 2193 (15,7%), p < 0,001] при поступлении были более склонны к развитию инфекций, приобретенных в ОИТ. Не было никаких существенных различий в лейкоцитах, лимфоцитах, нейтрофилах и показателях гемокоагуляции при поступлении в ОИТ между двумя группами (Table 1).

Характеристика инфекций, приобретенных в ОИТ
Очаги ОИТ-ассоциированных инфекций и возбудители представлены в Table 2. Среднее время от поступления в ОИТ до первой инфекции, полученной в ОИТ, составило 4,1 дня (межквартильный размах IQR2,9–6,5). Частыми локализациями инфекций, полученных в ОИТ, были дыхательные (n = 1442, 50,2%), мочевыводящие пути (n = 717, 25%) и катетер-ассоциированные инфекции кровотока (n = 385, 13,4%).Этиологическая структура инфекций была представлен грамотрицательными (1152, 40,2%), грамположительными бактериями (1154, 40,1%) и грибами (n = 544, 18,9%).
Исходы у пациентов с сепсисом с инфекциями, приобретенными в ОИТ
Пациенты с инфекциями, приобретенными в ОИТ, имели более длительные сроки госпитализации [17,6, IQR 11,2–26,2 против 8,9, IQR 6,0–14,5; p < 0,001) и пребывания в ОИТ (12,1, IQR 7,6–18,5 против 4,1, IQR 2,8–6,9; p < 0,001), чем таковых. Более того, у пациентов с приобретенной инфекцией смертность в ОИТ была выше [507 (17,7%) против 1036 (7,4%); p < 0,001] и выше госпитальная летальность [912 (31,8%) против 2600 (18,7%); p< 0,001], чем без таковой .



Кривая выживаемости Каплана-Мейера и ориентировочный анализ продемонстрировали значительно более высокую 28-дневную смертность у пациентов без инфекций, приобретенных в ОИТ, по сравнению с пациентами с приобретенной инфекцией, но смертность была неизменно выше от 28 до 100 дней после поступления в ОИТ при инфекциях, приобретенных в ОИТ (log-rank p <0,001).
Прогностические факторы, ассоциированные с ОИТ-ассоциированной инфекцией при сепсисе и построение номограммы
При однофакторном анализе по сравнению с пациентами без инфекции в ОИТ пациенты, у которых развилась инфекция в ОИТ, имеют более высокие баллы по шкале SOFA (4,05 ± 2,39 против 3,70 ± 2,07, p < 0,001), SIRS (2,90 ± 0,91 против 2,81 ± 0,89, p < 0,001), LODS (8,00 ± 3,51 против 6,07 ± 3,28, p < 0,001), оценка SAPS II (42,31 ± 15,04 против 40,63 ± 13,63, p < 0,001), оценка APS III (71,17 ± 27,28 против 0,001). 56,83 ± 24,51, р < 0,001) и OASIS (40,02 ± 8,89 против 35,74 ± 8,88, р < 0,001). На Figure 3 показано, что на тяжесть заболевания, основанную на показателях SIRS, SOFA, OASIS, LODS, APS III, CCI и SAPS II, большое влияние оказала частота инфекций, приобретенных в ОИТ. Мы построили модели, в которых система оценки предсказывает инфекции, приобретенные в ОИТ. Площадь под ROC-кривой прогностической эффективности системы оценки пациентов с инфекцией, приобретенной в ОИТ.

Многофакторный логистический анализ в исследуемой когорте показал, что ИВЛ (ОШ 2,64; 95% ДИ, 2,28–3,07), цереброваскулярная недостаточность (ОШ 2,45; 95% ДИ, 2,01–2,98), трахеостомия (ОШ 2,11; 95% ДИ, 1,14–3,90). ), антикоагулянты (ОШ 1,95; 95% ДИ, 1,73–2,19), LODS (ОШ 1,57; 95% ДИ, 1,44–1,70), нахождение в ОИТ хирургического профиля (ОШ 1,65; 95% ДИ, 1,49–1,83), грамотрицательные бактерии (ОШ 1,29; 95% ДИ, 1,13–1,48), гемотрансфузии (ОШ 1,40; 95% ДИ, 1,26–1,57), наличие центрального венозного (ОШ 1,12; 95% ДИ, 1,00–1,27) и мочевого катетера (ОШ 1,31; 95% ДИ, 1,17–1,47) были независимыми предикторами развития инфекции в ОИТ, у пациентов с сепсисом.

Номограмма этих предикторов представлена на Figure 4. С-индекс номограммы составил 0,737 (95% ДИ, 0,725–0,749) в исследуемой и 0,752 (95% ДИ, 0,735–0,769) в контрольной когорте. Калибровочные кривые и фактические наблюдения вероятности показаны на Figure 5. Новые модели имели AUC 0,737 (95% ДИ, 0,725–0,749), чувствительность 72,5% и специфичность 65,7% (Figure 6). Новые модели обладают большей точностью, чем классические системы оценки тяжести, в прогнозировании инфекции, приобретенной в ОИТ, у пациентов с сепсисом (Figure 6). Анализ кривой решений, сравнивающий клиническую полезность нашей новой модели и всех моделей системы оценки представлены наFigure 7.

Обсуждение
Насколько нам известно, это первое исследование с использованием большой общедоступной базы данных MIMIC IV для изучения инфекций, приобретенных в ОИТ, при сепсисе. В нашем исследовании строго следовали определению подозрения на инфекцию с органной дисфункцией согласно критериям Sepsis-3. Кроме того, база данных охватывает период в 10 лет, что намного превышает период предыдущих исследований, обеспечивая практическую значимость в контексте эпидемии и демонстрируя осуществимость в реальном мире. Мы подчеркиваем, что микробиологическая нагрузка и смертность от инфекции, приобретенной в ОИТ, постепенно увеличиваются с течением времени у выживших после сепсиса, несмотря на более высокую смертность в течение первых 28 дней в группе инфекции, не приобретенной в ОИТ.

Тяжелая инфекция вызывает цитокиновый шторм, способствуя широко распространенным реакциям хозяина, включая недостаточность микроциркуляции, дисфункцию органов, шок и смерть (Kaukonen et al., 2014). Ранняя летальность от сепсиса значительно снизилась благодаря активной реализации рекомендаций SurvivingSepsis Campaign (Coopersmith et al., 2018).

Следовательно, отдаленные исходы после сепсиса привлекают все большее внимание. Два недавних крупных исследования показали, что инфекция, приобретенная в ОИТ, может значительно увеличить смертность, связанную с сепсисом, с показателями 44,2% и 49,2% к 60-му дню (van Vught et al., 2016; van Vught et al., 2017). В то время как Goldenberg et al. (2014) сообщили, что инфекция, полученная в ОИТ, является причиной лишь 14% смертей при сепсисе, наряду с другими потенциальными факторами смертности от сепсиса, включая митохондриальную дисфункцию и капиллярную утечку. Уровень заболеваемости инфекциями, приобретенными в ОИТ, у больных сепсисом в этом исследовании составил 17,1%. Аналогичные результаты были получены в двух предыдущих крупных обсервационных исследованиях, которые составили 14,4% и 13,5% соответственно, хотя мы зафиксировали несколько более высокую кумулятивную частоту инфекций, приобретенных в ОИТ (van Vughtet al., 2016; van Vught et al., 2017). Тем не менее, в двух ретроспективных исследованиях была обнаружена более высокая частота инфекций, что составило 31,0% и 38,9% (Zhao et al., 2016; Chen et al., 2019). Это могло быть связано с относительно ограниченным размером выборки и использованием критериев сепсиса 2.0 для определения когорты пациентов для включение в исследования.

Для пациентов ОИТ шкалы SIRS, SOFA, OASIS, LODS, APS III, SAPS II и CCI являются фундаментальными индивидуальными оценками риска для характеристики тяжести заболевания и степени дисфункции органов (Minne et al., 2008; Chen et al., 2019 ; Li et al., 2020; Zhu et al., 2022). Пациенты с ослабленным иммунитетом очень восприимчивы к опасным условно-патогенным микроорганизмам и могут быстро погибнуть от инфекции (Sundar and Sires, 2013). Кроме того, SAPS II, SIRS и степень органной недостаточности были определены как плохие инструменты раннего предупреждения об инфекции (Vincent et al., 2009; Herrod et al., 2018).Учитывая это , мы попытались построить регрессионные модели с этими системами оценки и сравнить их с нашей недавно разработанной прогностической моделью. Номограмма включала LODS, обеспечивающую наилучшую дискриминационную способность и чистое преимущество по сравнению с любыми текущими распространенными моделями клинических систем оценки по всем пороговым значениям.



Шкала SOFA была задумана как инструмент для описания возникновения дисфункции различных органов и прогнозирования исхода, но несколько исследований показали, что прогностические значения LODS или SAPSII были немного лучше, чем шкалы SOFA для прогнозирования летальных исходов от сепсиса (Li et al., 2020; Zhuet al., 2022). В соответствии с этим оценка по шкале SOFA для прогнозирования развития инфекции а ОИТ, которая увеличивает смертность пациентов с сепсисом, в настоящем исследовании демонстрирует худший результат.
Синдром иммуносупрессии, вызванный повреждением головного мозга, инициированным ишемией обнаружен на животных моделях и был опосредован интенсивной активацией гипоталамо-гипофизарной оси и симпатической нервной системы (Dirnagl et al., 2007). Повышенный уровень катехоламинов и последующее подавление иммунной функции связаны с возникновением инфекций после острого повреждения головного мозга (Haeusler et al., 2008; Klehmet et al., 2009).
Почти у 40% пациентов, перенесших трепанацию черепа, по крайней мере один раз развивается инфекция, такая как пневмония, не связанная с ИВЛ (15%), вентилятор-ассоциированная пневмония (ВАП; 23%), инфекция мочевыводящих путей (ИМП; 9%) и инфекция области хирургического вмешательства (ИОХВ; 9%) (Kourbeti etal., 2015). Более того, инвазивные процедуры, в том числе центральный венозный катетер, мочевой катетер, искусственная вентиляция легких и трахеостомия являются потенциальными факторами риска в течение первых 48 часов пребывания в ОИТ, создавая идеальную возможность для бактериальной адгезии и образования биопленки (Sottile et al., 1986; Elsayed et al., 2022). Инфицированию способствует быстрая колонизация.Следовательно, дополнительные исследования должны быть сосредоточены на материалах катетеров с антимикробным покрытием, чтобы предотвратить возникновение инфекции и ее прогрессирование.
Переливание эритроцитов стало потенциальным фактором риска развития внутрибольничных инфекций при различных клинических ситуациях, включая сепсис (Dupuis et al., 2017; Dupuis et al., 2017; Nederpelt et al., 2020). Кроме того, это связано с повышенным риском венозного тромбоза при аллогенной трансфузии и инфекций, связанных с трансфузией (Jaffray et al., 2020; Miyamoto et al., 2021). Кроме того, хранящиеся эритроциты и тромбоциты могут высвобождать внутриклеточные цитокины и другие компоненты, которые индуцируют иммуносупрессивный фенотип в лимфоцитах (Aslam et al., 2008; Torrance et al., 2015).
Примечательно, что сепсис, вызванный грамотрицательными бактериями, повышает риск инфицирования в ОИТ. Среди 27 766 случаев инфекций кровотока, связанных с центральным венозным катетером, зарегистрированных в Национальной сети безопасности здравоохранения (NHSN) в период с 2009 по 2010 год, большая часть выделенных в ОИТ лекарственно-устойчивых бактерий была грамотрицательными (Sader et al., 2014). Резистентность к антимикробным препаратам приводит к низкой эффективности лечения и сложным схемам терапии. Растет осведомленность о том, что повышенная восприимчивость к инфекциям, приобретенным в ОИТ, может быть патоген-специфической из-за различных моделей разрушения иммунного барьера, что может привести к условно-патогенным бактериальным и грибковым инфекциям (Koch et al., 2017).
Хотя использование большого набора информации из общедоступной базы данных обеспечивает существенную поддержку наших выводов, наше исследование имеет несколько ограничений. Во-первых, на наши результаты могли повлиять искажающие факторы из-за того, что пациенты с сепсисом поступали в ОИТ с различной степенью тяжести заболевания, но крупнейшее когортное исследование, включающее данные о пациентах, собранные за почти 10 лет, должно быть клинически репрезентативным. Во-вторых, все переменные, включенные в нашу прогностическую модель, связаны в основном с демографическими характеристиками пациентов, основным заболеванием, патогенами и поддерживающим лечением, и отсутствовали некоторые значимые лабораторные показатели, что приводило к низкой прогностической эффективности нашей модели.
Тем не менее, вся клиническая информация доступна во многих учреждениях, и для оценки реальных клинических ситуаций использовалась многофакторная модель логистического риска. Действительно, не было никаких существенных различий в уровнях лимфоцитов, нейтрофилов, частичного тромбопластинового времени или активированного частичного тромбопластинового времени в нашей когорте. Нарушения микроциркуляции возникают рано, через 12 ч после сепсиса, и связаны с взаимодействием нейтрофилов и эндотелия, образованием микротромбов и повышением проницаемости сосудов (Wu et al., 2015).
This may explain that the indicators of coagulation function did not differ between those with ICU-acquired infection and those without. Additionally, the occurrence of acquired infection is mainly related to immune cell function; the value of some biomarkers of immune cell function in predicting susceptibility to ICU-acquired infections warrants exploration (van Vught et al., 2016). Third, up to dozens of risk factors were included in our model, which may be related to theheterogeneity of the group with sepsis. To overcome this limitation, we strictly followed the latest diagnostic criteria for sepsisand comprehensively accounted for pathogens, antibiotics, and other relevant factors, which may have improved theprediction of secondary infection occurrence.
Этим можно объяснить, что показатели свертывающей функции не различались между пациентами с инфекцией в ОИТ и без нее. Кроме того, развитие инфекции в основном связано с функцией иммунных клеток;значение некоторых биомаркеров в прогнозировании восприимчивости к инфекциям, приобретенным в ОРИТ, требует изучения (van Vught et al., 2016). В-третьих, в нашу модель было включено до десятков факторов риска, что может быть связано с неоднородностью группы с сепсисом. Чтобы преодолеть это ограничение, мы строго следовали последним диагностическим критериям сепсиса и всесторонне учитывали патогены, антибиотики и другие соответствующие факторы, что могло улучшить прогнозирование возникновения вторичной инфекции.
Вывод
Выжившие после сепсиса подвержены повышенному риску развития инфекций в ОРИТ, которые приводят к увеличению долгосрочной смертности. У пациентов с цереброваскулярной недостаточностью или грамотрицательными бактериями, находящимся в ОИТ хирургического профиля, имеющими центральный венозный или мочевой катетер, которым проводится искусственная вентиляция легких, гемотрансфузия назначают антикоагулянты в течение 48 часов после поступления в ОИТ гораздо приобретают инфекции в ОИТ. Полученные данные могут помочь врачам оптимизировать лечение инфекций, связанных с сепсисом, в ОИТ и улучшить исходы сепсиса.
References
Aslam, R., Speck, E. R., Kim, M., Freedman, J., and Semple, J. W. (2008). Transfusion-relatedimmunomodulation by platelets is dependent on their expression of MHC class I molecules and is independent of whitecells. Transfusion 48 (9), 1778–1786. doi: 10.1111/j.1537-2995.2008.01791.x
Cavaillon, J. M., Singer, M., and Skirecki, T. (2020). Sepsis therapies: learning from 30 years of failure of translational research to propose new leads. EMBO Mol. Med. 12 (4), e10128. doi: 10.15252/emmm.201810128
Chen, Y., Hu, Y., Zhang, J., Shen, Y., Huang, J., Yin, J., et al. (2019). Clinical characteristics, risk factors, immunestatus and prognosis of secondary infection of sepsis: a retrospective observational study. BMC Anesthesiol. 19 (1), 185.doi: 10.1186/s12871-019-0849-9
Chen, X., Ling, X., Liu, G., and Xiao, J. (2022). Antimicrobial coating: Tracheal tube application. Int. J.Nanomedicine 17, 1483–1494. doi: 10.2147/IJN.S353071
Chen, Q., Zhang, L., Ge, S., He, W., and Zeng, M. (2019). Prognosis predictive value of the Oxford acute severityof illness score for sepsis: a retrospective cohort study. PeerJ 7, e7083. doi: 10.7717/peerj.7083
Coopersmith, C. M., De Backer, D., Deutschman, C. S., Ferrer, R., Lat, I., Machado, F. R., et al. (2018). Surviving sepsis campaign: research priorities for sepsis and septic shock. Intensive Care Med. 44 (9), 1400–1426. doi: 10.1007/s00134-018-5175-z
Dirnagl, U., Klehmet, J., Braun, J. S., Harms, H., Meisel, C., Ziemssen, T., et al. (2007). Stroke-induced immunodepression: experimental evidence and clinical relevance. Stroke 38 (2 Suppl), 770–773. doi:10.1161/01.STR.0000251441.89665.bc
Dupuis, C., Garrouste-Orgeas, M., Bailly, S., Adrie, C., Goldgran-Toledano, D., Azoulay, E., et al. (2017). Effect of transfusion on mortality and other adverse events among critically ill septic patients: An observational study using amarginal structural cox model. Crit. Care Med. 45 (12), 1972–1980. doi: 10.1097/ CCM.0000000000002688
Dupuis, C., Sonneville, R., Adrie, C., Gros, A., Darmon, M., Bouadma, L., et al. (2017). Impact of transfusion on patients with sepsis admitted in intensive care unit: a systematic review and meta-analysis. Ann. Intensive Care 7 (1),5. doi: 10.1186/s13613-016-0226-5
Elsayed, A., Moussa, Z., Alrdahe, S. S., Alharbi, M. M., Ghoniem, A. A., El- khateeb, A. Y., et al. (2022).Optimization of heavy metals biosorption via artificial neural network: A case study of cobalt (II) sorption by pseudomonas alcaliphila NEWG-2. Front. Microbiol. 13. doi: 10.3389/fmicb.2022.893603
Goldenberg, N. M., Leligdowicz, A., Slutsky, A. S., Friedrich, J. O., and Lee, W. L. (2014). Is nosocomial infectionreally the major cause of death in sepsis? Crit. Care (London England) 18 (5), 540. doi: 10.1186/s13054-014-0540-y
Haeusler, K. G., Schmidt, W. U., Fohring, F., Meisel, C., Helms, T., Jungehulsing,
G. J., et al. (2008). Cellular immunodepression preceding infectious complications after acute ischemic stroke inhumans. Cerebrovasc. Dis. 25 (1-2), 50–58. doi: 10.1159/000111499
Herrod, P., Cox, M., Keevil, H., Smith, K., and Lund, J. N. (2018). NICE guidance on sepsis is of limited value inpostoperative colorectal patients: the scores that cry ‘wolf!’. Ann. R Coll. Surg. Engl. 100 (4), 275–278. doi:10.1308/rcsann.2017.0227
Jaffray, J., Witmer, C., O’Brien, S. H., Diaz, R., Ji, L., Krava, E., et al. (2020). Peripherally inserted centralcatheters lead to a high risk of venous thromboembolism in children. Blood 135 (3), 220–226. doi: 10.1182/blood.2019002260
Johnson, A. E. W., Aboab, J., Raffa, J. D., Pollard, T. J., Deliberato, R. O., Celi, L. A., et al. (2018). A comparative analysis of sepsis identification methods in an electronic database. Crit. Care Med. 46 (4), 494–499. doi: 10.1097/CCM.0000000000002965
Kaukonen, K. M., Bailey, M., Suzuki, S., Pilcher, D., and Bellomo, R. (2014). Mortality related to severe sepsis and septic shock among critically ill patients in Australia and new Zealand, 2000-2012. JAMA 311 (13), 1308–1316. doi:10.1001/ jama.2014.2637
Klehmet, J., Harms, H., Richter, M., Prass, K., Volk, H. D., Dirnagl, U., et al. (2009). Stroke-inducedimmunodepression and post-stroke infections: lessons from the preventive antibacterial therapy in stroke trial. Neuroscience 158 (3), 1184–1193. doi: 10.1016/j.neuroscience.2008.07.044
Koch, R. M., Kox, M., de Jonge, M. I., van der Hoeven, J. G., Ferwerda, G., and Pickkers, P. (2017). Patterns in bacterial- and viral-induced immunosuppression and secondary infections in the ICU. Shock 47 (1), 5–12. doi: 10.1097/SHK.0000000000000731
Kourbeti, I. S., Vakis, A. F., Ziakas, P., Karabetsos, D., Potolidis, E., Christou, S., et al. (2015). Infections in patients undergoing craniotomy: risk factors associated with post-craniotomy meningitis. J. Neurosurg. 122 (5), 1113–1119. doi: 10.3171/ 2014.8.JNS132557
Liu, C., Hu, C., Huang, J., Xiang, K., Li, Z., Qu, J., et al. (2021). A prognostic nomogram of colon cancer withliver metastasis: A study of the US SEER database and a Chinese cohort. Front. Oncol. 11. doi: 10.3389/fonc.2021.591009
Li, Y., Yan, C., Gan, Z., Xi, X., Tan, Z., Li, J., et al. (2020). Prognostic values of SOFA score, qSOFA score, andLODS score for patients with sepsis. Ann. Palliat. Med. 9 (3), 1037–1044. doi: 10.21037/apm-20-984
Minne, L., Abu-Hanna, A., and de Jonge, E. (2008). Evaluation of SOFA-based models for predicting mortality in the ICU: A systematic review. Crit. Care (London England) 12 (6), R161. doi: 10.1186/cc7160
Miyamoto, S., Umeda, K., Kurata, M., Nishimura, A., Yanagimachi, M., Ishimura, M., et al. (2021).Hematopoietic cell transplantation for severe combined immunodeficiency patients: a Japanese retrospective study. J. Clin. Immunol. 53 (3), 1–13. doi: 10.1007/s10875-021-01112-5
Nederpelt, C. J., El Hechi, M., Parks, J., Fawley, J., Mendoza, A. E., Saillant, N., et al. (2020). The dose-dependent relationship between blood transfusions and infections after trauma: A population-based study. J. Trauma Acute CareSurg. 89 (1), 51–57. doi: 10.1097/TA.0000000000002637
Nedeva, C., Menassa, J., Duan, M., Liu, C., Doerflinger, M., Kueh, A. J., et al. (2020). TREML4 receptor regulates inflammation and innate immune cell death during polymicrobial sepsis. Nat. Immunol. 21 (12), 1585–1596. doi: 10.1038/ s41590-020-0789-z
Otto, G. P., Sossdorf, M., Claus, R. A., Rodel, J., Menge, K., Reinhart, K., et al. (2011). The late phase of sepsis is characterized by an increased microbiological burden and death rate. Crit. Care (London England) 15 (4), R183. doi:10.1186/cc10332
Rudd, K. E., Johnson, S. C., Agesa, K. M., Shackelford, K. A., Tsoi, D., Kievlan, D. R., et al. (2020). et al: Global, regional, and national sepsis incidence and mortality, 1990–2017: analysis for the global burden of disease study. Lancet 395 (10219), 200–211. doi: 10.1016/s0140-6736(19)32989-7
Sader, H. S., Farrell, D. J., Flamm, R. K., and Jones, R. N. (2014). Antimicrobial susceptibility of gram-negative organisms isolated from patients hospitalized in intensive care units in united states and European hospitals (2009-2011). Diagn. Microbiol. Infect. Dis. 78 (4), 443–448. doi: 10.1016/j.diagmicrobio.2013.11.025
Singer, M., Deutschman, C. S., Seymour, C. W., Shankar-Hari, M., Annane, D., Bauer, M., et al. (2016). The thirdinternational consensus definitions for sepsis and septic shock (Sepsis-3). Jama 315 (8), 801–810. doi:10.1001/jama.2016.0287
Sottile, F. D., Marrie, T. J., Prough, D. S., Hobgood, C. D., Gower, D. J., Webb, L. X., et al. (1986). Nosocomial pulmonary infection: possible etiologic significance of bacterial adhesion to endotracheal tubes. Crit. Care Med. 14 (4), 265–270. doi: 10.1097/00003246-198604000-00001
Stortz, J. A., Murphy, T. J., Raymond, S. L., Mira, J. C., Ungaro, R., Dirain, M. L., et al. (2018). Evidence for persistent immune suppression in patients who develop chronic critical illness after sepsis. Shock 49 (3), 249–258. doi:10.1097/ SHK.0000000000000981
Sundar, K. M., and Sires, M. (2013). Sepsis induced immunosuppression: Implications for secondary infections and complications. Indian J. Crit. Care Medicine: Peer Reviewed Off. Publ. Indian Soc. Crit. Care Med. 17 (3), 162–169.doi: 10.4103/0972-5229.117054
Torrance, H. D., Brohi, K., Pearse, R. M., Mein, C. A., Wozniak, E., Prowle, J. R., et al. (2015). Associationbetween gene expression biomarkers of immunosuppression and blood transfusion in severely injured polytraumapatients. Ann. Surg. 261 (4), 751–759. doi: 10.1097/SLA.0000000000000653
van Vught, L. A., Klein Klouwenberg, P. M., Spitoni, C., Scicluna, B. P., Wiewel,
M. A., Horn, J., et al. (2016). Incidence, risk factors, and attributable mortality of secondary infections in the intensive care unit after admission for sepsis. JAMA 315 (14), 1469–1479. doi: 10.1001/jama.2016.2691
van Vught, L. A., Wiewel, M. A., Hoogendijk, A. J., Frencken, J. F., Scicluna, B. P., Klein Klouwenberg, P. M. C., et al. (2017). The host response in patients with sepsis developing intensive care unit-acquired secondary infections. Am.J. Respir. Crit. Care Med. 196 (4), 458–470. doi: 10.1164/rccm.201606-1225OC
Vincent, J. L., Rello, J., Marshall, J., Silva, E., Anzueto, A., Martin, C. D., et al. (2009). International study of theprevalence and outcomes of infection in intensive care units. JAMA 302 (21), 2323–2329. doi: 10.1001/jama.2009.1754
Wolkewitz, M., Cooper, B. S., Palomar-Martinez, M., Alvarez-Lerma, F., Olaechea-Astigarraga, P., Barnett, A. G., et al. (2014). Multilevel competing risk models to evaluate the risk of nosocomial infection. Crit. Care (London England) 18 (2), R64. doi: 10.1186/cc13821
Wu, Y., Ren, J., Zhou, B., Ding, C., Chen, J., Wang, G., et al. (2015). Laser speckle contrast imaging for measurement of hepatic microcirculation during the sepsis: a novel tool for early detection of microcirculationdysfunction. Microvasc. Res. 97, 137–146. doi: 10.1016/j.mvr.2014.10.006
Yang, Y. C., Wang, J. J., Huang, Y., Cai, W. X., and Tao, Q. (2021). Development and validation of a prognosticnomogram for postoperative recurrence-free survival of ameloblastoma. Cancer Manag Res. 13, 4403–4416. doi: 10.2147/ CMAR.S307517
Zhang, Z., Cortese, G., Combescure, C., Marshall, R., Lee, M., Lim, H. J., et al. (2018). Overview of model validation for survival regression model with competing risks using melanoma study data. Ann. Transl. Med. 6 (16), 325. doi:10.21037/atm.2018.07.38
Zhao, G. J., Li, D., Zhao, Q., Song, J. X., Chen, X. R., Hong, G. L., et al. (2016). Incidence, risk factors and impact on outcomes of secondary infection in patients with septic shock: an 8-year retrospective study. Sci. Rep. 6, 38361. doi: 10.1038/ srep38361
Zhu, Y., Zhang, R., Ye, X., Liu, H., and Wei, J. (2022). SAPS III is superior to SOFA for predicting 28-day mortality in sepsis patients based on sepsis 3.0 criteria. Int. J. Infect. Dis. 114, 135–141. doi: 10.1016/j.ijid.2021.11.015
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] => Array
(
[ID] => 4576
[TIMESTAMP_X] => 11.11.2024 15:27:43
[MODULE_ID] => iblock
[HEIGHT] => 614
[WIDTH] => 920
[FILE_SIZE] => 77972
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/d97/pq0ysny0ubeuwad0c5ysgxeojnw3am8w
[FILE_NAME] => michael-schiffer-13UugSL9q7A-unsplash.jpg
[ORIGINAL_NAME] => michael-schiffer-13UugSL9q7A-unsplash.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 43e83d4c8bbfbca4e6dfe9917e3b65c0
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/d97/pq0ysny0ubeuwad0c5ysgxeojnw3am8w/michael-schiffer-13UugSL9q7A-unsplash.jpg
[UNSAFE_SRC] => /upload/iblock/d97/pq0ysny0ubeuwad0c5ysgxeojnw3am8w/michael-schiffer-13UugSL9q7A-unsplash.jpg
[SAFE_SRC] => /upload/iblock/d97/pq0ysny0ubeuwad0c5ysgxeojnw3am8w/michael-schiffer-13UugSL9q7A-unsplash.jpg
[ALT] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[TITLE] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
)
[DATE_ACTIVE_FROM] => 10.11.2022
[ACTIVE_FROM] => 10.11.2022
[SHOW_COUNTER] => 1327
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 828124
[VALUE] => сепсис, ретроспективное когортное исследование, факторы риска,
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => сепсис, ретроспективное когортное исследование, факторы риска,
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 828126
[VALUE] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 828125
[VALUE] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830460
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828132
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828128
[1] => 828129
[2] => 828130
[3] => 828131
)
[VALUE] => Array
(
[0] => sepsis
[1] => Infekcionnyj kontrol'
[2] => Vnutribol'nichnye infekcii
[3] => Antibakterial'naya terapiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
[1] => Infekcionnyj kontrol'
[2] => Vnutribol'nichnye infekcii
[3] => Antibakterial'naya terapiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] => 830460
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828132
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 828128
[1] => 828129
[2] => 828130
[3] => 828131
)
[VALUE] => Array
(
[0] => sepsis
[1] => Infekcionnyj kontrol'
[2] => Vnutribol'nichnye infekcii
[3] => Antibakterial'naya terapiya
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
[1] => Infekcionnyj kontrol'
[2] => Vnutribol'nichnye infekcii
[3] => Antibakterial'naya terapiya
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Сепсис
[1] => Инфекционный контроль
[2] => Внутрибольничные инфекции
[3] => Антибактериальная терапия
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 03.07.2025 10:45:52
[~TIMESTAMP_X] => 03.07.2025 10:45:52
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[FULLTEXT_INDEX] => N
[~FULLTEXT_INDEX] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[BROWSER_TITLE] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
[KEYWORDS] => сепсис, ретроспективное когортное исследование, факторы риска,
[DESCRIPTION] => Клинические характеристики и факторы риска, связанные с инфекциями, приобретенными в отделении интенсивной терапии, при сепсисе: ретроспективное когортное исследование
)
)












