2 системы бальной оценки ДВС
Helms et al. Ann. Intensive Care (2020) 10:92
Исследование
Характеристики существующих на сегодня систем бальной оценки диссеминированного внутрисосудистого свертывания у пациентов с септическим шоком
Перевод оригинальной статьи «Performances of disseminated intravascular coagulation scoring systems in septic shock patients»
Keywords: Coagulopathy, Disseminated intravascular coagulation, DIC, Sepsis, Septic shock
Ключевые слова: коагулопатия, диссеминированное внутрисосудистое свертывание, ДВС, сепсис, септический шок
Введение
Существующие на сегодня системы бальной оценки диссеминированного внутрисосудистого свертывания (ДВС), (англ. disseminated intravascular coagulation или DIC) не настолько просты для того, чтобы их применять непосредственно у постели пациента, что приводит к нечастому их применению практикующими врачами. Однако совсем недавно Iba et al.[1] опубликовали свои рекомендации по диагностике сепсис-индуцированного ДВС. У пациентов с сепсисом они рекомендуют применение двух-шагового процесса, первый шаг которого опирается на простые диагностические критерии сепсис-индуцированной коагулопатии (протромбиновое время (ПТ), ПТ/международное нормализированное отношение (МНО) и количество тромбоцитов) и на данные шкалы последовательной оценки органного повреждения SOFA (англ. Sequential Organ Failure Assessment), являющейся суммой измерений четырех показателей - состояния респираторной системы (respiratory SOFA), состояния сердечно-сосудистой системы (cardiovascular SOFA), печени (hepatic SOFA) и почек (renal SOFA), шкала оценки сепсис-индуцированной коагулопатии (англ.sepsis-induced coagulopathy score или SIC). Второй шаг - если показатель SIC положительный, то уже следует оценка ДВС по шкале международного сообщества по тромбозам и гемостазу (англ. the International Society on Thrombosis and Haemostasis или ISTH).
Тем не менее, шкалы, которую можно отнести к «золотому стандарту», в контексте оценки четкой и ясной оценки/диагностики ДВС на сегодня нет и как в таком случае поставить диагноз ДВС у пациента с септическим шоком, остается не совсем ясным. Более того, такая ситуация сейчас частью исследователей называется «Диссеминированный международный беспорядок» [2]. Врачи, конечно, могут применять различные системы/шкалы оценки, но все эти шкалы страдают от своего несовершенства. Во-первых, все имеющиеся шкалы не могут помочь в диагностике ДВС на ранних этапах его развития, когда клиническая картина отсутсвует, что называется «пре-ДВС» или «не-явная» стадия (англ.«non-overt» stages), когда система коагуляции активирована, но компенсирована. Пациенты в этой стадии ДВС не менее тяжелые, чем те, что поступили в ОИТ с развернутой клинической картиной ДВС, да и уровень летальности у них практически одинаков [3]. Во-вторых, все эти шкалы не способны помочь различать пациентов с протромботической активацией коагуляции от пациентов, система коагуляции которых находится в геморрагической или фибринолитический стадиях. Само лечение пациентов зависит от стадии ДВС (тромботическая, геморрагическая, фибринолитическая), что обуславливает важность правильной стратификации пациентов на ранних стадиях. В-третьих, диагностические характеристики баллов неодинаковы и зависят от основного заболевания. Например, ДВС-синдром при различных клинических состояниях (тромботический ДВС-синдром, вызванный сепсисом или кровотечение, вызванное ДВС синдромом, индуцированным гематологическими злокачественными новообразованиями). Поэтому для диагностики ДВС могут потребоваться различные показатели и/или диагностические маркеры в зависимости от патофизиологического состояния[4]. И наконец, постоянно повторяющиеся тесты в целях скрининга у пациентов состояния коагуляции очень дорогое удовольствие [5].
При проведении сравнения основных систем бальной оценки предполагается, что критерии JAAM-DIC Японской ассоциации острой медицины (the Japanese Association for Acute Medicine) более чувствительны, чем критерии ISTH, что позволяет осуществить более раннюю диагностику ДВС по сравнению с оценкой по шкале ISTH [5]. Следовательно, оценка JAAM-DIC является предпочтительной для раннего назначения ДВС-специфического антикоагулянтного лечения [6]. Интересно отметить, что при сепсисе в шкале JAAM-DIC в качестве критерия не используется снижение уровня фибриногена, но учитывается кинетика снижения уровня тромбоцитов. В 2016 году, после принятия новых определений сепсиса, шкала JAAM-DIC была пересмотрена и критерий синдрома системного воспалительного ответа (SIRS) был заменен на критерий «уровень антитромбина» [7]. Несмотря на эти очевидные преимущества, оценка JAAM была исключена из последних рекомендаций по диагностике ДВС [1].
В своей работе мы сравнили диагностические свойства и характеристики различных основных систем оценки (пересмотренная версия шкалы оценки JAAM-DIC 2016; шкала оценки ISTH явного ДВС 2001; ассоциация между SIC и JAAM-DIC 2016; ассоциация между SIC и ISTH явного ДВС 2001) с точки зрения прогнозирования летальности в многоцентровой проспективной когорте пациентов, поступивших в ОИТ для лечения септического шока.
Пациенты и методы
Пациенты
Пятьсот восемьдесят два взрослых пациента (от 18 до 85 лет), с септическим шоком [8] и получавших норэпинефрин и/или адреналин, были проспективно зарегистрированы после поступления в ОИТ из четырех больниц в период с 2015 по 2019 гг. Пациенты с сердечной недостаточностью (класс NYHA IV), циррозом печени (классификация ChildPugh C) или с наличием злокачественного новообразования были исключены. Этический комитет Больницы Страсбургского университета одобрил это многоцентровое исследование (NCT02391792), и оно было зарегистрировано на сайте Clinicaltrial.gov. При поступлении от пациента, когда это возможно, или его родственников было получено информированное согласие. Пациенты проходили лечение в соответствии с текущими рекомендациями без специального терапевтического вмешательства.
Получение данных и оценка пациентов
Образцы крови для общих коагуляционных тестов (количество тромбоцитов, протромбиновое время (PT), фибриноген, антитромбин и D-димеры) были собраны в течение 12 часов после поступления пациентов в ОИТ (день 1), а также на день 2.
Все пациенты после включения в исследование находились под наблюдением в течение 28 дней, летальность от всех причин оценивалась в течение 7 и 28 дней. Также была проводилась ежедневная последовательная оценка степени недостаточности органов (SOFA).
ДВС и шкалы оценки состояния коагуляции
(см. дополнительный файл 1: Таблица S1)
Баллы JAAM-DIC 2016 [7], баллы ISTH явный ДВС [9], связь баллов SIC и JAAM-DIC 2016 и связь баллов SIC и ISTH явный ДВС были рассчитаны в дни 1 и 2. Баллы считались положительными, как подтверждено в оригинальных публикациях, если оценка по ISTH-явный ДВС составляла 5 баллов или более, оценка по JAAM-DIC составляла 4 балла или более, а оценка SIC составляла 4 балла или более. Задержка положительных результатов для пациентов с ДВС-синдромом - это время между поступлением в ОИТ с септическим шоком и постановкой диагноза ДВС-синдрома в соответствии с различными шкалами оценки.
Исходные характеристики пациентов
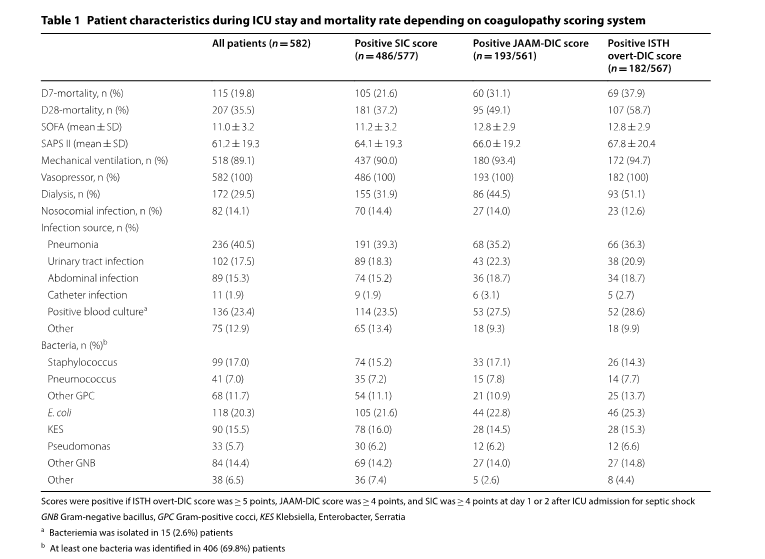
Пятьсот восемьдесят два пациента были последовательно включены в исследование. Средний возраст составлял 69 лет [60; 77] лет, а соотношение мужчин и женщин составляло 377/205. Средний балл по SAPS II составлял 59 [48; 74], а уровень летальности составил 19,9% на 7-й день и 35,5% на 28-й день. Характеристики пациентов во время пребывания в ОИТ, тип инфекции и бактерий приведены в таблице 1.
Статистический анализ
Непрерывные переменные представлены как медианы с первым и третьим квартилями распределений. Категориальные переменные представлены в виде чисел и процентов. Соответствие между различными баллами (положительными/отрицательными) было оценено с использованием Cohen’s Kappa коэффициентов, а 95% доверительные интервалы были рассчитаны с помощью начальной загрузки. Оценка позитивности сравнивалась с использованием McNemar’s Chi-squared теста. Чтобы учесть множественные сравнения, скорректированные значения р были представлены с использованием метода Bonferroni. Оценочные показатели для прогнозирования летальности оценивались путем вычисления чувствительности, специфичности, положительных и отрицательных прогностических значений. Сравнения специфичности были выполнены с помощью теста McNemar’s Chi-squared, а положительные прогностические значения сравнивались с использованием относительных прогностических значений [10]. Поскольку пропущенных данных было очень мало (от 0 до 3% в зависимости от переменной), для их обработки не было реализовано никакого конкретного метода. Значение р <0,05 считалось статистически значимым. Все анализы были выполнены с использованием программного обеспечения R версии 3.6.0. R Core Team (2019). R: язык и среда для статистических вычислений. R Фонд статистических вычислений, Вена, Австрия (https://www.R-project.org/.)
Полученные результаты
Соответствие между показателями ISTH overt-DIC и JAAM-DIC для диагностики ДВС
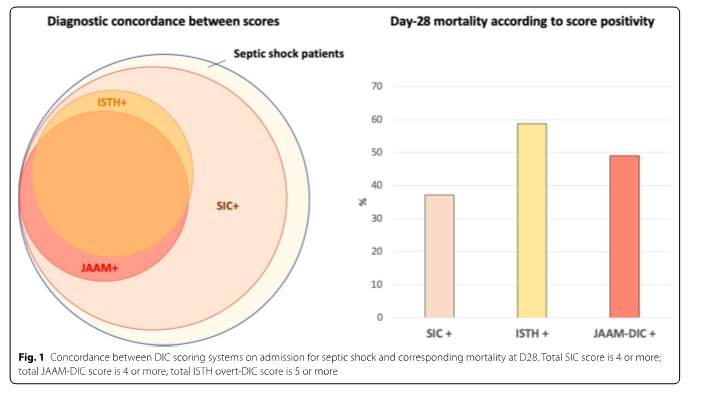
При бальной оценке ДВС-синдрома по шкалам ISTH-overt-DIC, JAAM-DIC и SIC была отмечена значительная разница. Среди всех 582 пациентов у 182/567 (32,1%) в 1-й и/или 2-й день по шкале ISTH overt-DIC был диагностирован ДВС-синдром (положительный балл в 1-й и / или 2-й день), по шкале JAAM-DIC диагноз ДВС-синдрома был поставлен 193/561 ( 34,4%) пациентам, и у 486/577 пациентов (84,2%) по шкале SIC была диагностирована «коагулопатия» (см. Рис. 1).
Умеренное соответствие наблюдалось между шкалами ISTH overt-DIC и JAAM-DIC (κ = 0,67 [0,60, 0,73], p <0,001). Соответствие было сильным при оценке по шкалам JAAM-DIC и SIC + JAAM-DIC (κ = 0,98 [0,96, 0,99], p <0,001) и практически идеальное соответствие наблюдалось между шкалами ISTH overt-DIC и SIC + ISTH overt-DIC (κ = 1).
При биологической диагностике ДВС по шкале ISTH у большинства пациентов (145/182 пациента, 79,7%) наблюдались только легкие, и тем коварные, клинические симптомы потребления или даже отсутствие симптомов/клинического проявления ДВС, в то время как тромбоэмболические и геморрагические проявления стали очевидными или даже жизне-угрожающими у 47,8% (87/182 пациентов) в дни, следующие за биологическим диагнозом ДВС-синдрома.
Шкала SIC определяет раньше, но специфичность диагноза неудовлетворительная
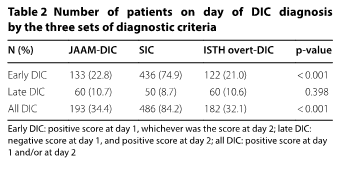
Чтобы проверить, предшествовала ли положительная оценка по шкале SIC показателям JAAM-DIC и ISTH overt--DIC, мы сравнили частоту положительных оценок по времени и классифицировали пациентов между «ранними значениями ДВС» (положительная оценка на 1-й день, в зависимости от того, какая оценка была на 2-й день). и «поздний ДВС» (отрицательный балл в 1-й день и положительный балл в 2-й день). В группу «все ДВС» были включены пациенты с положительным баллом на 1-й день и/или на 2-й день.
Для ранней диагностики («ранний ДВС») частота положительных тестов не отличалась между показателями JAAM-DIC и ISTH overt-DIC (22,8% против 21,0%, p = 0,60). Эти результаты были одинаковыми и для поздней диагностики («поздний ДВС») и для глобальной диагностики («весь ДВС») (нет различий между показателями JAAM-DIC и ISTH overt-DIC, 10,7% против 10,6%, р = 1 и 34,4% против 32,1 %, р = 0,30 соответственно).
Для раннего, позднего и общего диагноза показатель, определенный по шкале SIC был положительным немного раньше, чем два других показателя (p <0,001), но при этом имел худшую специфичность диагноза: к 1-му дню у 74,9% пациентов с септическим шоком была диагностирована «коагулопатия», и у 84,2% ко 2-му дню (таблица 2).
Оценка по шкале SIC в целях раннего прогнозирования летальности не является специфичной
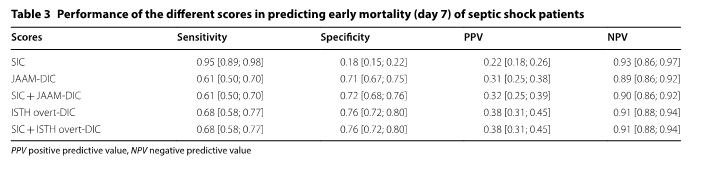
Мы оценили эффективность различных показателей в целях прогнозирования ранней (7-й день) летальности пациентов с септическим шоком. Уровень летальности пациентов с показателем SIC, равны 4-м или более баллам, был ниже, чем у одного из пациентов с показателем ISTH overt-DIC в 5 или более баллов или с показателем JAAM-DIC в 4 или более баллов (Рис. 1).
Как результат, специфичность только одной шкалы SIC для прогнозирования летальности была очень низкой (0,18 [0,15; 0,22]) по сравнению с оценками по шкале JAAM-DIC (0,71 [0,67; 0,75]), p <0,001 или по шкале ISTH overt-DIC (0,76 [0,72; 0,80]), p <0,001 (Таблица 3). Сравнения положительных прогностических значений (ППЗ) оценки по шкале SIC в сравнении со шкалой JAAM-DIC, с оценкой по шкале ISTH overt-DIC и оценки по шкале JAAM-DIC по сравнению с оценкой ISTHovert-DIC были <0,001 (Таблица 3, Дополнительный файл 2: Таблица S2). Кроме того, не было никакого повышения чувствительности и специфичности при сочетании оценки по шкале SIC с оценкой по шкале JAAM-DIC или с оценкой по шкале ISTH overt-DIC, по сравнению с одной лишь оценкой по шкалам JAAM-DIC или ISTH overt-DIC.
Обсуждение
Настоящее исследование было проведено в целях внесения ясности в ту неразбериху, что сопровождает диагностику ДВС-синдрома у пациентов с септическим шоком. Даже при наличии большого количества доступных на сегодня шкал оценки, все они показали наличие рисков неадекватной оценки при различных заболеваниях и в особенности у пациентов, находящихся в критическом состоянии, для которых единственной одобренной шкалой является шкала JAAM 2006 [11]. Более того, своевременное выявление пациентов с ДВС-синдромом, вызванным септическим шоком, которым может быть полезна антикоагулянтная терапия, стало серьезной проблемой в ОИТ [12, 13]. Действительно, в условиях, когда не имеется какого либо специфичного лечения ДВС-синдрома, что был доказало свою эффективность, ранняя диагностика ДВС-синдрома позволила бы проводить адекватную стратификацию пациентов с септическим шоком в соответствии с их стадией активации коагуляции - между теми, кто мог бы извлечь выгоду из специфического лечения коагулопатии и тех, кто, вероятно, не выиграет от этого, с последующей их надлежащей регистрацией в будущих клинических исследованиях. Затем, как мы ранее оценивали при поступлении в ОИТ, пациенты со стадией «до-ДВС» имеют такой же уровень летальности, как и пациенты с установленным диагнозом ДВС [3]. Клинические признаки, по сравнению с первыми признаками активации коагуляции, могут появляться слишком поздно, и как показано в настоящей когорте, надежду на улучшение состояния пациентов с помощью специального лечения сохраняет только ранняя диагностика ДВС-синдрома.
Gando et al. [11] написал, что «системы подсчета баллов успешны тогда, когда врачи могут использовать их у постели больного, но для этого данные должны быть легко доступны» [11]. В недавно опубликованных рекомендациях Iba et al. [1] для целей прогнозирования летальности рассмотрели и выделили показатели шкалы SIC. Оценка по шкале SIC связывает «легкодоступные» биологические значения (тромбоциты и МНО) с оценкой по шкале SOFA. Оценка по шкале SOFA представляет собой сложную клинико-биологическую оценку, включающую в себя четыре компонента (респираторный компонент SOFA, сердечно-сосудистый компонент SOFA, печеночный компонент SOFA, почечный компонент SOFA). Шкалу SOFA можно рассматривать, как простой инструмент при использовании у постели больного, только при условии, что оценка по SOFA используется в качестве двоичной оценки (< 2 или ≥ 2 баллов). На самом деле, поскольку все пациенты с септическим шоком, по определению, при поступлении в ОИТ получают оценку по шкале SOFA более чем в два балла, то у этих пациентов само окончательное количество баллов не имеет большого значения. SIC позволит выявлять пациентов с «коагулопатией», которые имеют высокий риск развития ДВС. Оценка по шкале SIC не должна использоваться отдельно, а только в сочетании с оценкой по шкале ISTH overt-DIC, при условии, что оценка пошкале SIC была положительной. Мы показали, что оценка по шкале SIC грубо выявляла всех пациентов (84,2%), поступивших в ОИТ с септическим шоком, как имеющих «коагулопатию». Можно действительно считать, что все пациенты с септическим шоком подвержены риску развития ДВС-синдрома. В соответствии с этим предложением первое валидационное исследование, таким образом, не показало преимущества оценки по шкале SIC по сравнению со шкалой ISTH overt-DIC при диагностике ДВС-синдрома, вызванного сепсисом [14]. Такое впечатление бесполезности подчеркивается безупречной корреляцией оценок только лишь по шкале ISTH overt-DIC и их комбинации с оценкой по шкале SIC, так как у всех пациентов с оценкой по шкале ISTH overt-DIC, равной 5 или более баллам, показатель по шкале SIC был равен 4 или более, а почти идеальная корреляция баллов была показана шкалой JAAM-DIC отдельно и шкалой SIC, но уже в сочетании с баллами JAAM-DIC.
Шкала JAAM 2006, как и предполагалось, оказалась более чувствительной, чем шкала IISTH overt-DIC при диагностике ДВС-синдрома, например, у пациентов с травмой [15], что позволило установить диагноз ДВС на более ранней стадии, чем при применении шкалы IISTH-DIC [5]. С патофизиологической точки зрения для диагностики ДВС у пациентов с сепсисом более подходит шкала JAAM-DIC, чем ISTH overt-DIC, поскольку шкала, объединяет в себе кинетику снижения тромбоцитов, более высокие значения D-димера и исключает из оценки уровень фибриногена, который при острых воспалительных процессах останется на ложно нормальном уровне или даже на более высоких уровнях практически на всех стадиях. Тем не менее, мы показали сильную корреляцию между показателями, полученными с помощью шкал ISTH overt-DIC и JAAM-DIC {McHugh 2012 # 2201}, предполагая, что любую из этих шкал можно использовать для диагностики ДВС-синдрома, вызванного септическим шоком. При рассмотрении причин задержки постановки диагноза, оценка по шкале JAAM-DIC определяла больше пациентов как «положительных по ДВС», чем при оценке по шкале ISTH overt-DIC в любой момент времени, предполагая, что разница между показателем JAAM-DIC и ISTH overt-DIC, возможно, более связана имеющимся пороговым значением, используемого для определения ДВС, как было предположено Dempfle et al. [16].
Пациенты, которым поставлен диагноз ДВС с помощью современных систем бальной оценки ДВС, показывают неблагоприятный клинический исход независимо от основного заболевания [17]. В первом ретроспективном анализе общенационального исследования по рекомбинантному человеческому растворимому тромбомодулину Iba et al. [18] показали, что оценка по шкале SIC, равная 4 баллам или более, имела более высокую прогностическую ценность в контексте 28-дневной летальности, чем оценка по шкале JAAM-DIC. В этой когорте, что составили пациенты с SIC-баллом выше 4, летальность за 28 дней достигла 38,4%, а у пациентов с баллом выше 6 — более 45%. Наши данные показывают почти такой же уровень летальности при положительном балле SIC > 4 балла (37,2% на 28-й день), но более высокие ППЗ для прогнозирования летальности при оценке по шкалам ISTH overt-DIC и JAAM-DIC.
Iba et al. [17] также показали, что у пациентов с сепсисом и диссеминированным внутрисосудистым свертыванием дельта-баллов SOFA, дельта-баллов шкалы ISTH overt-DIC и дельта-баллов шкалы JAAM-DIC коррелировали с 28-дневной летальностью, при этом дельта-баллов SOFA прогнозировала с большей точностью, чем дельта-баллов ISTH overt-DIC (80,5 против 66,7%, р <0,001). Поэтому у пациентов с сепсисом и ДВС-синдромом дельта-баллов SOFA наиболее сильно ассоциируется с 28-дневной летальностью [17]. Тем не менее, включение баллов по SOFA ≥ 2 в балл SIC выглядит бесполезным, так как в нашей группе у всех пациентов с септическим шоком оценка по шкале SOFA при поступлении в ОИТ была ≥ 2 (11,0 ± 3,2 балла), считая здесь и пациентов, которые были включены в исследование до изменения определений сепсиса и септического шока.
Наше исследование имеет несколько сильных сторон и некоторые ограничения. К сильным сторонам мы отнесли большую и многоцентровую когорту пациентов с септическим шоком с хорошими клиническими характеристиками. Сбор данных был проспективным, что позволило снизить процент пропущенных данных. И наконец, мы сравнили основные баллы и их пересмотренную форму с учетом последних рекомендаций по диагностике ДВС-синдрома.
Основное ограничение исследования - у нас не было компаратора золотого стандарта, который мог бы помочь оценить достоверность других показателей. Также мы не проводили сравнение наших данных с недавно выявленными новыми диагностическими маркерами, такими как эндотелиальные микровезикулы, флуоресценция нейтрофилов или степень образования нейтрофилами экстрацеллюлярных ловушек (англ. Neutrophil extracellular traps) [3, 19–21].
В общем и целом, наши данные показывают, что оценка по шкале SIC, вероятно, не относится к простой и легко доступной оценке, которая могла бы произвести революцию в диагностике ДВС. Шкалы оценки JAAM-DIC и ISTH overt-DIC, по-видимому, пригодны для пациентов с септическим шоком, но будущие исследования должны быть сосредоточены на валидации этих инструментов ранней диагностики сепсис-индуцированного ДВС-синдрома [13]. Между тем, несмотря на то, что оценки по шкалам JAAM-DIC и ISTH overt-DIC и могут показаться неудобными из-за необходимости «взвешивания предметов», простые электронные устройства могут помочь врачам при ежедневном расчете баллов у постели больного. Поэтому следует рассмотреть возможность выполнения этих оценок регулярно у пациентов с риском развития ДВС и в первую очередь, у пациентов с септическим шоком.
References
1. Iba T, Levy JH, Yamakawa K, Thachil J, Warkentin TE, Levi M, et al. Proposal of a two‑step process for the diagnosis of sepsis‑induced disseminated intravascular coagulation. JTH. 2019;17(8):1265–8.
2. Iba T, Levy JH, Raj A, Warkentin TE. Advance in the management of sepsisinduced coagulopathy and disseminated intravascular coagulation. J Clin Med. 2019;8:5.
3. Delabranche X, Quenot JP, Lavigne T, Mercier E, Francois B, Severac F, et al. Early detection of disseminated intravascular coagulation during septic shock: a multicenter prospective study. Crit Care Med. 2016;44(10):e930–9.
4. Iba T, Umemura Y, Watanabe E, Wada T, Hayashida K, Kushimoto S, et al. Diagnosis of sepsis‑induced disseminated intravascular coagulation and coagulopathy. Acute Med Surg. 2019;6(3):223–32.
5. Iba T, Levy JH, Warkentin TE, Thachil J, van der Poll T, Levi M, et al. Diagnosis and management of sepsis‑induced coagulopathy and disseminated intravascular coagulation. JTH. 2019;17(11):1989–94.
6. Nishida O, Ogura H, Egi M, Fujishima S, Hayashi Y, Iba T, et al. The japanese clinical practice guidelines for management of sepsis and septic shock 2016 (J‑SSCG 2016). Acute Med Surg. 2018;5(1):3–89.
7. Iba T, Di Nisio M, Thachil J, Wada H, Asakura H, Sato K, et al. Revision of the Japanese association for acute medicine (JAAM) disseminated intravascular coagulation (DIC) diagnostic criteria using antithrombin activity. Crit Care. 2016;20:287.
8. Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al.
American‑college of chest physicians society of critical care medicine
consensus conference—definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit Care Med. 1992;20(6):864–74.
9. Taylor FB, Toh CH, Hoots WK, Wada H, Levi M, Scientific Subcommittee on Disseminated Intravascular Coagulation of the International Society on T, et al. Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thrombosis and haemostasis. 2001;86(5):1327–30.
10. Moskowitz CS, Pepe MS. Comparing the predictive values of diagnostic tests: sample size and analysis for paired study designs. Clin Trials. 2006;3(3):272–9.
11. Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K, et al. A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med. 2006;34(3):625–31.
12. Iba T, Arakawa M, Di Nisio M, Gando S, Anan H, Sato K, et al. Newly proposed sepsis‑induced coagulopathy precedes international society on thrombosis and haemostasis overt‑disseminated intravascular coagulation and predicts high mortality. J Intensive Care Med. 2018;12:885066618773679.
13. Meziani F, Vincent JL, Gando S. Should all patients with sepsis receive anticoagulation? Intens Care Med. 2017;43:452.
14. Ding R, Wang Z, Lin Y, Liu B, Zhang Z, Ma X. Comparison of a new criteria for sepsis‑induced coagulopathy and International Society on Thrombosis and Haemostasis disseminated intravascular coagulation score in critically ill patients with sepsis 3.0: a retrospective study. Blood Coagul Fibrinolysis. 2018;29(6):551–8.
15. Sawamura A, Hayakawa M, Gando S, Kubota N, Sugano M, Wada T, et al. Disseminated intravascular coagulation with a fibrinolytic phenotype at an early phase of trauma predicts mortality. Thromb Res. 2009;124(5):608–13.
16. Dempfle CE. Comparing DIC scores: not an easy task indeed. Thromb Res. 2009;124(6):651–2.
17. Iba T, Arakawa M, Mochizuki K, Nishida O, Wada H, Levy JH. Usefulness of measuring changes in SOFA score for the prediction of 28‑day mortality in patients with sepsis‑associated disseminated intravascular coagulation. Clin Appl Thromb Hemost. 2019;25:1076029618824044.
18. Iba T, Nisio MD, Levy JH, Kitamura N, Thachil J. New criteria for sepsisinduced coagulopathy (SIC) following the revised sepsis definition: a retrospective analysis of a nationwide survey. BMJ Open. 2017;7(9):e017046.
19. Delabranche X, Boisrame‑Helms J, Asfar P, Berger A, Mootien Y, Lavigne T, et al. Microparticles are new biomarkers of septic shock‑induced disseminated intravascular coagulopathy. Intensive Care Med. 2013;39(10):1695–703.
20. Stiel L, Delabranche X, Galoisy AC, Severac F, Toti F, Mauvieux L, et al. Neutrophil fluorescence: a new indicator of cell activation during septic shock‑induced disseminated intravascular coagulation. Crit Care Med. 2016;44(11):e1132–6.
21. Abrams ST, Morton B, Alhamdi Y, Alsabani M, Lane S, Welters ID, et al. A novel assay for neutrophil extracellular trap formation independently predicts disseminated intravascular coagulation and mortality in critically Ill patients. Am J Respir Crit Care Med. 2019;200(7):869–80.
Helms et al. Ann. Intensive Care (2020) 10:92