Array
(
[NAME] => Инфекции, связанные с оказанием медицинской помощи, у взрослых пациентов отделений интенсивной терапии: изменения в эпидемиологии, диагностике, профилактике и вкладе новых технологий
[~NAME] => Инфекции, связанные с оказанием медицинской помощи, у взрослых пациентов отделений интенсивной терапии: изменения в эпидемиологии, диагностике, профилактике и вкладе новых технологий
[PREVIEW_PICTURE] => Array
(
[ID] => 5306
[TIMESTAMP_X] => 11.11.2024 15:28:25
[MODULE_ID] => iblock
[HEIGHT] => 624
[WIDTH] => 1000
[FILE_SIZE] => 95848
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/6ad/0362nqvdnm3v3ffz8lpuq5iw84743g9j
[FILE_NAME] => medical-banner-with-doctor-wearing-glove.jpg
[ORIGINAL_NAME] => medical-banner-with-doctor-wearing-glove.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 9517a014498797feece38deb6e4c6cd2
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/6ad/0362nqvdnm3v3ffz8lpuq5iw84743g9j/medical-banner-with-doctor-wearing-glove.jpg
[UNSAFE_SRC] => /upload/iblock/6ad/0362nqvdnm3v3ffz8lpuq5iw84743g9j/medical-banner-with-doctor-wearing-glove.jpg
[SAFE_SRC] => /upload/iblock/6ad/0362nqvdnm3v3ffz8lpuq5iw84743g9j/medical-banner-with-doctor-wearing-glove.jpg
[ALT] => Инфекции, связанные с оказанием медицинской помощи, у взрослых пациентов отделений интенсивной терапии: изменения в эпидемиологии, диагностике, профилактике и вкладе новых технологий
[TITLE] => Инфекции, связанные с оказанием медицинской помощи, у взрослых пациентов отделений интенсивной терапии: изменения в эпидемиологии, диагностике, профилактике и вкладе новых технологий
)
[~PREVIEW_PICTURE] => 5306
[DETAIL_TEXT] => Stijn
Blot , Etienne Ruppґe, Stephan Harbarth , Karim
Asehnoune , Garyphalia Poulakou , Charles-Edouard Luyt , Jordi Rello , Michael
Klompas , Pieter Depuydt , Christian Eckmann , Ignacio Martin-Loeches, Pedro
Povoa , Lila Bouadma , Jean-Francois Timsit , Jean-Ralph Zahar
Healthcare-associated
infections in adult intensive care unit patients:Changes in epidemiology,
diagnosis, prevention and contributions of new technologies
INTENS CRIT CARE NUR
70 (2022) 103227 https://doi.org/10.1016/j.iccn.2022.103227
Инфекции, связанные с оказанием
медицинской помощи, у взрослых пациентов отделений интенсивной терапии:
изменения в эпидемиологии, диагностике, профилактике и вкладе новых технологий
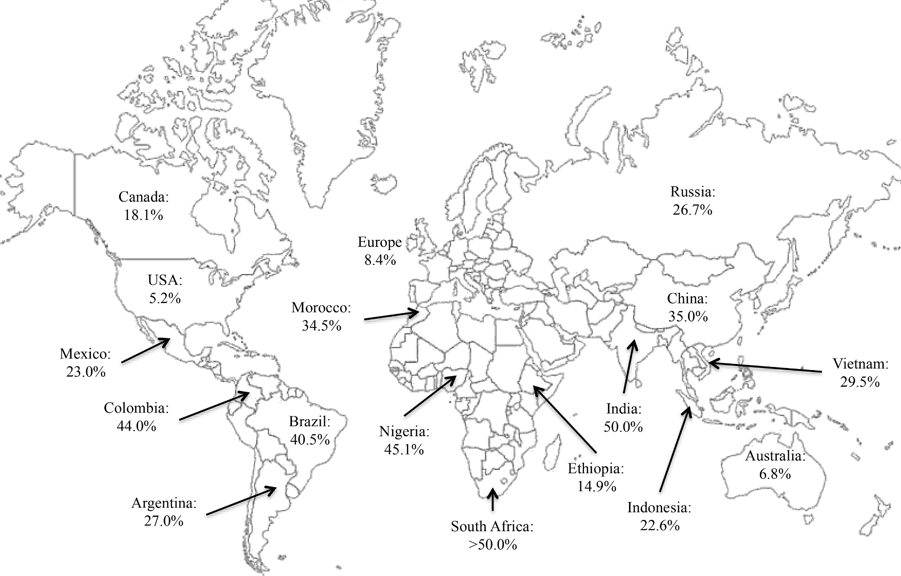
Fig. 1. Prevalence of ICU-acquired infections, 2000–2018 (ECDC, 2018; Ponce de Leo´n-Rosales et al. 2000; Rosenthal et al. 2003; Ortíz et al. 2014; Murni et al. 2015; Iwuafor et al. 2016; Mitharwal
et al. 2016; Phu et al. 2016; Taylor et al. 2016; Yakovlev et al. 2016; Yallew et al. 2016; Chiang et al. 2018; Braga et al. 2019).
АННОТАЦИЯ
Пациенты в отделениях интенсивной терапии
(ОИТ) подвергаются высокому риску развития инфекций, связанных с оказанием
медицинской помощи (ИСМП) из-за высокой распространенности инвазивных процедур
и использования устройств, индуцированной иммуносупрессии, сопутствующих
заболеваний, «хрупкости» и пожилого возраста. За
последнее десятилетие наблюдается
снижение заболеваемости ИСМП, связанных с инвазивными процедурами и
устройствами. Тем не менее,
уровень инфекций, приобретенных в ОИТ остается высоким.
В этом контексте появление новых патогенов еще больше усложняет лечение и угрожает его результатам.
Кроме того, пандемия SARS-CoV-2 (COVID-19)
высветила проблему, которую создает новый патоген для оптимизации мер профилактики как в отношении риска
воздействия на медицинский персонал, так и в отношении необходимости поддержания
качества медицинской помощи. Медсестры
ОИТ занимают особое место в профилактике и лечении ИСМП, поскольку они
участвуют в базовом гигиеническом уходе, реализации инициатив по улучшению качества оказания помощи, в том числе рационального использования антибиотиков, а
также обеспечивают адекватный забор материала для микробиологического исследования.
Появление более чувствительных
микробиологических методов и расширение наших знаний о взаимодействии больных в
критическом состоянии и их микробиоты заставляют
нас переосмыслить и определить лучшие стратегии диагностики, лечения и
профилактики ИСМП в ОИТ.
В этом междисциплинарном экспертном обзоре
обобщена недавняя эпидемиология ИСМП в ОИТ, обсуждено место современных
микробиологических методов в диагностике
данных инфекций, рассмотрены операционные и эпидемиологические определения и
переопределено место некоторых спорных профилактических мер, включая импрегнированные
противомикробными препаратами устройства, повязки для катетеров и жидкости для полоскания
рта на основе хлоргексидина. Наконец,
предлагаются рекомендации, которые могут
снизить заболеваемость и вспышки ИСМП в ОИТ.
Рекомендации для клинической практики
• Несмотря на усилия по профилактике, частота
ИСМП остается высокой в структуре заболеваемости и летальности.
•
COVID-19 может способствовать возникновению вторичных инфекций, таких как
инфекция кровотока и пневмония, предположительно из-за более высокой тяжести
заболевания и чрезмерной нагрузки на персонал.
• Доля предотвратимых ИСМП зависит от
популяции пациентов, соблюдения мер профилактики и типа инфекции, например, катетер-ассоциированных
инфекций кровотока, можно легко избежать
при использовании комплексных мер профилактики, основанных на доказательных данных.
• Губки, пропитанные хлоргексидином,
снижают риск грамположительной бактериемии, но их использование сопровождается риском
повышения устойчивости к этому антисептическому средству, особенно у грамотрицательных
бактерий. Поэтому их использование должно быть зарезервировано для вспышек.
• Использование хлоргексидина для ухода за
полостью рта должно быть ограничено группами пациентов с наличием показаний,
основанных на доказательствах, учитывая возможную связь с летальностью.
Введение
ИСМП представляют собой серьезное бремя для
общественного здравоохранения (WHO, 2012). Ежегодно
во всем мире от ИСМП умирают более 140 000 человек (WHO, 2011).
Опросы в США
показывают, что 30% ИСМП возникают в ОИТ (Magill et
al., 2014; CDC, 2016). Более
того, ИСМП продлевают пребывание в ОИТ и
общую длительность госпитализации, увеличивают потребление антибиотиков и стоимость лечения.
Возникновение ИСМП является результатом сложного
взаимодействия факторов патогена (вирулентность, устойчивость к антибиотикам),
факторов хозяина (сопутствующая патология, острое заболевание), факторов
лечения (инвазивные устройства, селективное давление антибиотиков), процессов
организации здравоохранения (кадровое
обеспечение, профилактические меры) и даже климатологических
условий (Myny et al., 2005; Depuydt et al., 2006a,
2006b; Guzmґan-Herrador et al., 2016; Blot et al., 2021).
Хотя большинство возбудителей ИСМП эндогенное происхождение, ряд патогенов могут быть приобретены в процессе лечения от
человека или из окружающей среды (Siegel et al.,
2007). Медицинские сестры ОИТ играют ключевую
роль в профилактике и лечении ИСМП, поскольку они
участвуют в базовом гигиеническом уходе, клиническом наблюдении за участками,
наиболее подверженными инфицированию (например, мест введения катетера или
хирургических ран), а также в мониторинге системных признаков инфекции, реализации
инициатив по улучшению мер профилактики, правильном заборе проб для микробиологического исследования и ряда аспектов рационального использования
антибиотиков.
Постоянные усилия по предотвращению
инфекций привели к значительному снижению ИСМП, связанных с устройствами.
Тем не менее, ожидается, что в ближайшие годы бремя ИСМП
будет увеличиваться в результате интенсификации лечения, старения населения,
роста распространенности тяжелых сопутствующих заболеваний у пациентов ОИТ и
продолжающегося распространения микроорганизмов с множественной лекарственной
устойчивостью (МЛУ) в ОИТ, стационарах и даже внебольничной популяции (Dimopoulos et al., 2013; Blot et al., 2019a).
Тем временем в
организации работы сказывается постоянная нехватка высококвалифицированных
медсестер (Anders, 2021).
Изменение
эпидемиологии инфекций, приобретенных в ОИТ
Понимание эпидемиологии и динамики
инфекции необходимо для быстрого выявления пациентов с высоким риском или потенциально
угрожающих ситуаций. Из-за
индивидуальных и коллективных последствий инфекции и антибиотикорезистентности
от всего коллектива ОИТ требуется высокий уровень бдительности и соблюдение
профилактических мер. Тем не менее, по
сравнению с врачами ОИТ, медсестры больше всего подвержены прямому контакту с
пациентом и имеют практические возможности для обеспечения эффективного
соблюдения мер профилактики.
Распространенность ИСМП различается в
разных госпиталях и странах (Fig. 1). Различия могут быть связаны с характеристиками
пациентов, эпидемиологическими особенностями и организационными факторами (Rodríguez-Acelas et al., 2017).
Факторы на уровне пациента включают возраст,
сопутствующие заболевания (особенно иммуносупрессию), тяжесть заболевания,
продолжительность госпитализации и воздействие инвазивных устройств и процедур.
Помимо факторов хозяина, организационные факторы,
такие как большая рабочая нагрузка и низкое качество инфекционного контроля связаны
с более высоким риском ИСМП и MDRO acquisition
(Penoyer, 2010; Kelly et al., 2013; Lee et al.,
2018; Jansson et al., 2019). Соблюдение мер
инфекционного контроля снижает как риск
ИСМП, так и риск инфицирования полирезистентными возбудителями (Rello et al.; 2013 Blot, 2008; Nseir et al., 2011).
Наиболее частыми инфекциями в ОИТ являются
пневмония (включая вентилятор-ассоциированную пневмонию (ВАП), инфекции области
хирургического вмешательства (ИОХВ), катетер-ассоциированные инфекции кровотока
(КАИК) и катетер-ассоциированные инфекции мочевыводящих путей (КАМВП) (Vincent et al., 2009; Vogelaers и др., 2010).
Внутрибольничная пневмония является
наиболее распространенной и тяжелой формой ИСМП (Walter
et al., 2018). В недавнем
многоцентровом международном проспективном обсервационном исследовании в 114 ОИТ
частота вентилятор-ассоциированного трахеобронхита и ВАП на исходном уровне
была одинаковой (320 [11%; 10,2/1000 дней на ИВЛ] и 369 [12%; 8,8/1000 на ИВЛ],
p = 0,48) (Martin-Loeches et al., 2015).
Из-за более широкого использования неинвазивной и
высокопоточной вентиляции недавние исследования подчеркивают важность внутрибольничной
пневмонии вне ИВЛ, обнаруживаемой у 4,5/1000 пациенто-дней (Saied et al., 2020).
Внутрибольничные интраабдоминальные
инфекции (ИАИ) (послеоперационный и
третичный перитонит) составляют до 65% всех абдоминальных инфекций, наблюдаемых
у пациентов ОИТ (WHO, 2012). ИАИ
у пациентов в ОИТ выдвигают на первый план проблему устойчивости к
антибиотикам, которая в равной степени проявляется как при внебольничной
инфекции, так и при ИСМП (Blot et al., 2019b;
Vogelaers et al., 2021), требующей раннего хирургического контроля
источника и соответствующей антимикробной терапии (Augustin et al., 2010; Blot et al.,
2012; De Waele et al., 2014; Blot et al., 2019b).
В отличие от глобальной заболеваемости
ИСМП, уровень КАИК, вызванной карбепенемрезистентыми возбудителями снизился в нескольких странах за последнее
десятилетие. Несколько авторов
сообщают о показателях 1,0/1000 катетер-дней или меньше благодаря
оптимизированным процессам сестринского ухода и техническим инновациям (Timsit et al., 2018; Eggimann et al., 2019).
Частота возникновения ИСМП в ОИТ, как
правило, выше, а полирезистентые микроорганизмы, особенно грамотрицательные (Fig. 2), более распространены в странах с низким и
средним уровнем экономического развития по сравнению со странами с высоким экономическим
уровнем (Sakr et al., 2018; WHO, 2011). В
настоящее время Klebsiella pneumoniae, продуцирующая карбапенемазы (KPC),
эндемична в Израиле, Греции, Италии, Польше, Китае, Бразилии, Аргентине и
Колумбии и встречается почти во всех странах Европы (Albiger
et al., 2015). Аналогичным
образом, Candida auris в настоящее время распространена в Индии и на Ближнем
Востоке, а многочисленные вспышки зарегистрированы в США, Европе, Азии и других
странах (Satoh et al., 2009; Jeffery-Smith et al.,
2018). Инфекции,
вызванные полирезистентыми возбудителями, могут увеличить смертность и
продолжительность пребывания в стационаре, возможно, из-за задержек с
назначением адекватной антибактериальной терапии, но это спорный вопрос (Tabah et al., 2012; Stewardson et al., 2016)
Полирезистетные бактерии и Candida — не
единственные патогены, приобретаемые в ОИТ. Недавние
усовершенствованные методы диагностики помогли диагностировать приобретенные
респираторные вирусы при госпитальной пневмонии.
В недавнем исследовании грипп (27%) и риновирус (27%)
были двумя наиболее распространенными респираторными вирусами, выделенными при
госпитальной пневмонии в ОИТ (Loubet et al., 2017).
ОИТ являются зонами потенциального высокого риска
передачи таких респираторных вирусов (Grund et al.,
2010). Наконец, из-за
наличия множественных факторов риска пациенты в ОИТ подвергаются более высокому
риску инфекций Clostridium difficile с распространенностью 2% и 11%
среди пациентов с диареей в ОИТ (Karanik et al.,
2016).
Влияние инфекций,
приобретенных в ОИТ, на долгосрочные исходы
Изменения врожденного и адаптивного
иммунитета в результате ИСМП сохраняются
в течение длительного периода после клинического выздоровления.
Такие изменения коррелируют с долгосрочной смертностью
(Delano and Ward, 2016).
Пациенты, перенесшие внутрибольничный сепсис, имеют
повышенный риск смерти на срок до двух лет (Winters
et al., 2010).
В тайваньской когорте из 3070 пациентов с ИСМП,
вызванными золотистым стафилококком, инфекция была связана с 20-процентным
увеличением смертности в течение года (Su et al., 2013). Инфекция
также была связана с повышенным риском зависимости от диализа на 2,6% и
избыточным риском зависимости от вентилятора на 7,3% в течение одного года.
Эти грубые пропорции очень похожи на наблюдаемые в
когортном исследовании в Европе (Stewardson et al.,
2016).
У 17 536 пожилых
пациентов, поступивших в ОИТ воздействие КАИК и ВАП, было сходно с таковым при
сепсисе и пневмонии (Dick et al., 2012).
Внутрибольничный сепсис и пневмония были связаны с
повышенным риском смерти в течение одного года. Пневмония
также была связана с увеличением частоты обращений за медицинской помощью,
длительной госпитализацией и смертностью в течение пяти лет.
Пациенты неврологических ОИТ являются еще одной
группой с особенно высоким риском ИСМП. В
большой проспективной когорте пациентов ОИТ с травмой спинного мозга частота
внутрибольничной пневмонии/раневых инфекций составила 47%, что было связано с
более низким приростом функциональной моторной автономии через пять лет и
повышенной смертностью через 10 лет (Kopp et al. ., 2017).
Точно так же пневмония у больных после инсульта была связана с 50-процентным
увеличением риска смерти в течение одного года среди выживших в ОИТ (de Montmollin et al., 2019).
Иммуносупрессия и
инфекции, приобретенные в ОИТ
Иммуносупрессия,
связанная с госпитализацией в ОИТ
Иммуносупрессия, связанная с критическим
состоянием, часто встречается у пациентов ОИТ, страдающих любыми острыми
заболеваниями (Deknuydt et al., 2013; Roquilly et
al., 2017). У пациентов в ОИТ обнаруживаются функциональные изменения
миелоидных клеток (дендритов, моноцитов и макрофагов), врожденных лимфоцитов
(естественные киллеры, натуральные киллеры Т-клетки) и обычных лимфоцитов (Т- и
В-клетки) (Hotchkiss et al., 2013b).
Пациенты ОИТ с внебольничной или госпитальной пневмонией демонстрируют различные реакции транскрипции (van Vught et al., 2016), соответствующие
функциональным изменениям их иммунной системы. Кроме того, критическое состояние
нарушает нормальный баланс между иммуногенными и толерогенными реакциями. Например,
легкие естественным образом толерантны к инородному материалу, чтобы свести к
минимуму острое воспаление в ответ на вдыхаемые частицы (Roquilly et al., 2019), но эта естественная толерантность
усугубляется иммунной дисфункцией при критических состояниях, что делает
пациентов особенно восприимчивыми к пневмонии (Fig. 3).
Интересно, что риск госпитальной
пневмонии прямо коррелирует с тяжестью иммунных изменений пациентов, включая:
(1) степень снижения экспрессия человеческого лейкоцитарного антигена-DR (HLA-DR) на циркулирующих моноцитах (Hotchkiss et al., 2013a); (2) увеличение продукции иммуносупрессивных цитокинов, таких
как IL-10 (Roquilly et al., 2014), и (3) истощение пула
Т-лимфоцитов (Venet et al., 2013).
Иммуносупрессия,
связанная с основным заболеванием
Пациенты с онкологическими и
гематологическими заболеваниями часто нуждаются в госпитализации в ОИТ в
результате инфекции, токсичности лечения и поражения органов в результате злокачественного новообразования (Schelenz et al., 2013; Marin et al., 2014; Taplitz et
al., 2018). Инфекционный риск
у онкологических больных связан с дефектами врожденного или адаптивного
иммунитета, обусловленного либо злокачественным
новообразованием как таковым, либо цитотоксическими эффектами лечения (Fig. 4) (Talcott
et al., 1988).
Нейтропения, особенно длительная (>7 дней), является основным фактором
риска инфекции и требует защитной изоляции (Freifeld
et al., 2011). Другие факторы
также могут играть важную роль (Table 1) (Freifeld
et al., 2011; Taplitz et al., 2018). Острые
гематологические и миелодиспластические синдромы имеют повышенный инфекционный
риск из-за инфильтрации костного мозга злокачественными новообразованиями.
Химиотерапия и реакция «трансплантат против хозяина»
способствуют оппортунистической инфекции за счет нарушения целостности
слизистой оболочки (Freifeld et al., 2011; Taplitz
et al., 2018).
Солидные опухоли в большей степени сопровождаются
локальными осложнениями, связанными или не связанными с операцией по удалению
опухоли, а не с недостаточностью костного мозга или цитотоксическими эффектами
лечения (Table 2)
(Talcott et al., 1988; Freifeld et al., 2011;
Taplitz et al. , 2018). Наконец,
пациенты с ослабленным иммунитетом, независимо от причины, нуждаются в
специальных мерах по контролю риска ИСМП (Table 2).
Роль инфекции
COVID-19 в риске ИСМП
COVID-19 высветила проблему профилактических мер для защиты лиц,
осуществляющих уход, и пациентов от заражения при сохранении оптимального
стандарта качества медицинской помощи (Jansson et
al., 2020). Любая вспышка ИСМП
будь то среди клиницистов или пациентов, должна потребовать расследования пути инфицирования
и причины возникновения (Mongin et al., 2021; Vuichard-Gysin et al., 2021).
Первоначально в основе профилактики лежит знание
способа заражения. Некоторые
действия, такие как процедуры с образованием аэрозолей, сопряжены с
неотъемлемым риском передачи инфекции и требуют более совершенных профилактических
мер (Tran et al., 2012; Lormans et al., 2021).
Как и для других респираторных вирусов,
для SARS-CoV-2, по-видимому, преобладает прямая передача, однако поверхности,
по-видимому, контаминированы в 27–45% случаев, что требует специальной очистки
(Mendes et al., 2021).
COVID-19 значительно увеличил заболеваемость ВАП с
совокупной оценочной заболеваемостью 45,4% (95% ДИ 37,8–53,2%) (Ippolito et al., 2021).
Острый респираторный дистресс-синдром (ОРДС),
связанный с COVID-19, связан с более глубокой гипоксией, чем ОРДС другого
происхождения, что приводит к увеличению продолжительности искусственной
вентиляции легких и более частому применению положения лежа на животе, что
является факторами риска ИСМП и КАИК (Luyt et al., 2020; Razazi et al., 2020;
Maes et al., 2021; Rouzґe et al., 2021).
COVID-19 увеличивает риск ИСМП из-за
множества факторов: менее строгого использования стандартных стратегий
профилактики, иммунных нарушений, связанных с заболеванием и терапией, более длительной
ИВЛ и седации, более частой вентиляции в прон-позиции и более высокому риску
инфаркта легкого, ассоциированного с суперинфекцией.
Переполненность ОИТ и их укомплектованность недостаточно
подготовленным медицинским персоналом может снизить качество соблюдения
программ профилактики ИСМП (Reper et al., 2020;
Arabi et al., 2021; Reper et al., 2021; Wicky et al., 2021).
Оценка роли
состава микробиоты в риске ИСМП
Недавние достижения в микробиологии и
метагеномике (т. е. секвенирование всех нуклеиновых кислот в образце) привели к
лучшему пониманию микробиоты пациентов, ее изменений во время пребывания в ОИТ
и того, как это может повлиять на вероятность и характер ИСМП в ОИТ.
Понимание микробиоты кожи и полости рта, особенно
когда речь идет об использовании антисептических средств, потенциально
снижающих резистентность к колонизации полирезистентными микроорганизмами,
особенно важно для сестринской практики. Тем не менее, мало
что известно о роли комменсальной флоры кожи и полости рта в динамике ИСМП в
ОИТ.
Микробиота кишечника и легких наиболее
изучена у пациентов в ОИТ. Микробиота
кишечника служит защитой от колонизации полирезистентными бактериями и их персистенции
и помогает предотвратить инфекции (Vollaard and
Clasener, 1994; Buffie and Pamer, 2013; Gosalbes et al., 2016; Caballero et
al., 2017; Leo et al., 2019). Желудочно-кишечный
тракт является основным резервуаром для большинства бактериальных патогенов,
связанных с ИСМП (Sommerstein et al., 2019).
Ректальная колонизация грамотрицательными бактериями
является независимым фактором риска как колонизации дыхательных путей, так и
новой грамотрицательной инфекции в ОИТ (Frencken et
al., 2018). Действительно,
грамотрицательные микроорганизмы из кишечника получают доступ к ротоглотке
после интубации и быстро «перерастают» комменсальные штаммы ротоглотки, что
увеличивает риск ВАП (Freedberg et al., 2018;
Sommerstein et al., 2019).
Нормальная микробиота легких варьирует в
зависимости от состояния здоровья и заболевания.
У пациентов с ИВЛ меньше различий в образцах нижних и
верхних дыхательных путей по сравнению со здоровыми субъектами, что может увеличивать
риск пневмонии (Kelly
et al., 2016; Langelier et al., 2018; Emonet et al., 2019).
Диагностика ИСМП:
оценка разрыва между эпидемиологическими и прикроватными определениями
Первый шаг в борьбе с ИСМП в ОИТ состоит
во внедрении надежной системы эпиднадзора для отслеживания инфекций и выявления
факторов риска, связанных с ИСМП. Для
всех ИСМП сосуществуют два определения, ориентированные на разные цели:
эпидемиологическое определение для целей эпиднадзора и клиническое определение
для принятия решений у постели больного.
Эпидемиологические данные разрабатываются для
информирования об эффективных программах профилактики инфекций и борьбы с ними.
Их также можно использовать в качестве самостоятельных
показателей качества для сравнительного анализа.
Клинические определения предназначены для быстрого и точного распознавания ИСМП для
принятия своевременных решений о лечении у постели больного.
Интеллектуальные информационные технологии могут
служить значимым инструментом для согласования ожиданий и требований для обоих
определений и удовлетворения потребностей различных пользователей.
Такие инструменты могут упростить и ограничить изменчивость
процесса наблюдения, а также повысить эффективность раннего выявления пациентов
с ИСМП. Однако
рассмотрение одного и того же объекта под разными углами может увековечить
продолжающуюся путаницу между наблюдением и клиническим диагнозом.
Диагностика вентилятор-ассоциированных
инфекций нижних дыхательных путей Вентилятор-ассоциированные
инфекции нижних дыхательных путей включают ВАП и вентилятор-ассоциированный
трахеобронхит (Timsit et al., 2017). ВАП определяется
как инфекция паренхимы легкого, возникшая, по крайней мере, через 48 часов
после начала ИВЛ. Вентилятор-ассоциированный трахеобронхит представляет собой
промежуточный процесс от колонизации до ВАП. Текущий диагноз вентилятор-ассоциированного
трахеобронхита основывается на отсутствии рентгенологических инфильтратов
грудной клетки и наличии признаков, соответствующих респираторному воспалению,
наряду с ,по крайней мере, одним микробиологическим критерием. Клинические
критерии ИВЛ-ассоциированных инфекций нижних дыхательных путей субъективны
(например, рентгенологические инфильтраты); как клинические, так и микробиологические
критерии плохо коррелируют с гистологическими изменениями, что приводит к
высоким показателям гипердиагностики и избыточного лечения (Tejerina et al., 2010; Nussenblatt et al., 2014; Kalil et
al., 2016).
Диагностика катетер-ассоциированных инфекций
кровотока
Окончательный диагноз КАИК требует
микробиологического подтверждения того, что внутрисосудистый катетер является
источником бактериемии, и исключения альтернативных очагов инфекции (Mermel et al., 2009).
Это определение делает упор на специфичность диагноза,
но сложно в использовании, поскольку требует
специализированного микробиологического тестирования, которое не всегда
доступно. У постели больного
диагноз КАИК часто омрачается неуверенностью в отношении того, действительно ли
сосудистый катетер является источником инфекции, и необходимостью различия между контаминацией и инфекцией,
вызванной комменсалами кожи (Tomlinson et al.,
2011; Cherifi et al., 2013).
Надлежащее наблюдение медсестрой за местом
введения катетера при его использовании имеет важное значение, поскольку
наличие ≥1 местного признака (покраснение, экссудация) повышает вероятность КАИК в первые семь дней после установки катетера
(Buetti et al., 2021). В целях
эпиднадзора CDC-NHSN США предложила упрощенную концепцию КАИК (CDC, 2019), которая, однако, приводит к
гипердиагностике и искажает истинную частоту КАИК (CDC,
2019; Woeltje et al., 2008; Tomlinson et al., 2011; Dixon-Woods et al. , 2012).
Диагностика
инфекций области хирургического вмешательства (ИОХВ)
Определения CDC-NHSN для ИОХВ (поверхностная
и глубокая инфекция разреза и инфекция орган/пространство) наиболее часто
используются в литературе (Horan et al., 1992).
Непосредственное наблюдение медсестры имеет решающее
значение. Критериями ИОХВ
являются локализованный отек или эритема, гнойное отделяемое из операционной
раны и микробиологическое подтверждение инфицирования.
ВОЗ заявила, что не существует единого объективного золотого
стандарта диагностики хирургической
раневой инфекции (Allegranzi et al., 2016).
ИОХВ также может указывать на
продолжающийся абдоминальный сепсис после операции на органах брюшной полости (Pusajґo et al., 1993).
Пациенты с инфекциями мягких тканей (включая ИОХВ) в ОИТ
подвержены высокому риску диагностических ошибок, в том числе гиподиагностике,
что приводит к удвоению внутрибольничной смертности (Abe
et al., 2019). Идеального
инструмента для ранней диагностики ИОХВ у пациентов ОИТ не существует.
Существуют ограниченные послеоперационные меры
профилактики ИОХВ, относящиеся к ОИТ. Ключевые
меры включают оптимальную антибиотикопрофилактику, ежедневный осмотр раны и
соответствующий уход за раной для предотвращения экзогенной контаминации.
Различие между
колонизацией и инфекцией
Наличие потенциально патогенных и полирезистентных
микроорганизмов в микробиологических образцах, особенно из нестерильных
участков тела, не является доказательством инфекции. Интерпретация
микробиологического результата будет зависеть от пяти факторов: (1)
клинического контекста (признаки инфекции?), (2) места отбора проб (стерильный участок?),
(3) микробного вида (патогенного или возможного контаминанта?) , (4)
предполагаемое место инфекции (часто колонизируемая зона?), (5) чувствительность
и специфичность микробных культур с учетом предшествующего воздействия
антибиотиков, источника образца и микробиологического метода. Увеличение числа
микробиологических проб без четко определенных клинических показаний может
привести к чрезмерному использованию антибиотиков (Tambyah
and Maki, 2000; Nussenblatt et al., 2014).
Однако при разумном использовании с
ограничением назначения антибиотиков регулярный отбор проб для целей
микробиологического надзора может дать актуальные и персонализированные данные
для руководства эмпирическим назначением антибиотиков (Table ) (Depuydt et al., 2008; Brusselaers et al., 2013; Zahar et
al , 2019).
Возрастающая роль
микробиологических лабораторий в диагностике и последующем наблюдении за ИСМП
Бактериологические лаборатории
претерпевают кардинальные изменения. Лабораторная
автоматизация позволяет считывать культуральные чашки в режиме реального времени:
пробы, приготовленные утром, могут дать жизнеспособные результаты к полудню, а
антибиотикограмма будет доступна на следующее утро.
Еще одной точкой эволюции являются мультиплексные,
автоматизированные и быстрые анализы полимеразной цепной реакции (ПЦР).
Теперь они доступны и называются
«синдромными тестами», поскольку нацелены не только на бактерии, но и на
вирусы, паразиты и грибки (Ramanan et al., 2018).
Эти тесты, как правило, требуют минимальной ручной
подготовки и позволяют получить результат в короткие сроки (Fig. 5), что дает возможность
тестирования по месту оказания медицинской помощи или синдромного тестирования
для раннего выявления ИСМП, а ранние результаты чувствительности позволяют
своевременно ввести соответствующие антибиотики.
Тем не менее, обилие целей поднимает вопрос о «нежелательных»
тестированиях. Например,
клиницисты должны ломать голову над тем, как интерпретировать присутствие
вирусов при первоначальном подозрении на бактериальную ВАП, особенно в свете
исследований, связывающих положительные тесты на вирусы с плохим исходом (Loubet et al., 2017).
Развертывание синдромных тестов должно сопровождаться
тесным диалогом между реаниматологами и микробиологами.
Еще более сложным будет появление клинической метагеномики.
Это относится к секвенированию нуклеиновых
кислот, присутствующих в клиническом образце, с целью выявления патогенов и
определения их чувствительности к противомикробным препаратам (Chiu and Miller, 2019).
Метагеномное секвенирование идентифицирует гораздо
больше бактерий, чем обычные культуральные методы, когда микробиологи сообщают
только о наиболее вероятных патогенах. Эти
незарегистрированные бактерии, а также реакция хозяина могут помочь улучшить
диагностику инфекций нижних дыхательных путей. Метагеномное
секвенирование в сочетании с инструментами машинного обучения, обеспечивающими
(1) наиболее вероятные патогенные бактерии, (2) разнообразие окружающего
бактериального сообщества и (3) реакцию хозяина (через транскриптом), может
точно предсказать возникновение пневмонии (Langelier
et al. др., 2018).
Вирусы в образцах:
патогены или «пассажиры»?
Выявление вирусов молекулярными методами
при подозрении на ИСМП является обычным явлением.
Однако определение их клинического значения
представляет собой сложную задачу. Из-за
иммунопаралича, следующего за начальной провоспалительной реакцией на агрессию,
латентные вирусы, такие как Herpesviridae, могут реактивироваться у пациентов в
ОИТ (Hotchkiss et al., 2013a).
Вирус простого герпеса, цитомегаловирус, а также вирус
Эпштейна-Барра часто обнаруживаются в легких или крови пациентов ОИТ (до 50%),
и их реактивация связана с повышенной заболеваемостью и смертностью (Luyt et al., 2007; Limaye et al. , 2008; Coisel et al., 2012;
Libert et al., 2015; Ong et al., 2017; Li et al., 2018).
Точное значение этих реактиваций
обсуждается. Эти вирусы могут
иметь истинную патогенность и вызывать повреждение органов, тем самым играя
непосредственную роль в заболеваемости и смертности, наблюдаемых при их
реактивации. Однако они также
могут быть «сторонними наблюдателями», а реактивация является вторичной по
отношению к тяжести заболевания. Вопрос
остается без ответа, поскольку данные о потенциальном преимуществе
противовирусного лечения неубедительны. Респираторные
вирусы (риновирус, грипп, аденовирус и другие) в последнее время вызывают ИСМП
у пациентов, находящихся или не находящихся на ИВЛ (Vincent
et al., 2009; Nseir et al., 2011; Loubet et al., 2017; Shorr et al. , 2017).
Присутствие вирусов при ВАП связано с
неблагоприятными исходами (Grund et al., 2010).
Перекрестная передача респираторных вирусов, таких как
грипп, в настоящее время хорошо выявляется с помощью ПЦР и может быть причиной
10 % госпитализаций в ОИТ по поводу гриппа (Alvarez-Lerma
et al., 2017) и растущего числа эпизодов тяжелого ОРДС, особенно
у пациентов с ослабленным иммунитетом.
Однако их глобальное влияние на заболеваемость и
смертность неизвестно.
Предотвратимость
ИСМП в ОИТ
Большинство экспертов сходятся во мнении,
что значительную долю инфекций, связанных с устройствами, можно предотвратить с
помощью рекомендаций, основанных на фактических данных, и комплексов профилактических
мер, оптимизирующих приверженность персонала к соблюдению рекомендаций (Blot et al., 2014; van der Kooi et al., 2018; Labeau,
2020). В
первом систематическом обзоре, охватывающем период с 1990 по 2002 г.,
оценивалась доля потенциально предотвратимых ИСМП по данным мультимодальных
интервенционных исследований (Harbarth et al., 2003).
Оценка 30 отчетов показала, что существует большой
потенциал для снижения показателей ИСМП, от минимального эффекта снижения в 10%
до максимального эффекта в 70%, в зависимости от условий, дизайна исследования,
исходных показателей инфицирования и типа инфекции.
Наиболее важный эффект снижения был
выявлен для КАИК.
Во втором систематическом обзоре, проведенном в 2011
г., утверждалось, что до 65–70 % случаев КАИК и КАИМВП и 55 % случаев ВАП и
ИОХВ можно предотвратить с помощью современных научно обоснованных стратегий,
оценки, которые вызвали некоторые споры (Umscheid
et al., 2011). Совсем недавно систематический обзор (Schreiber et al., 2018) исследований,
опубликованных в период с 2005 по 2016 год, показал несколько более низкую долю
предотвратимых инфекций. Ни в одном из упомянутых
систематических обзоров не проводилась стратификация анализа по типу
микроорганизмов; таким образом,
сохраняется неопределенность в отношении возможности предотвращения экзогенной
перекрестной инфекции различными полирезистентыми микроорганизмами.
Образовательные программы для медицинских
работников, встроенные в комплексную программу повышения качества, являются
краеугольным камнем любого подхода к профилактике (Fig. 6). Что
касается инфекций, связанных с устройствами, особое внимание следует уделять ограничению
их использования и времени пребывания инвазивных устройств (Buetti and Timsit, 2019), а их необходимость
необходимо оценивать ежедневно (Vazquez Guillamet
and Kollef, 2018).
Должны ли мы использовать активные
антисептики/антибиотики для профилактики ИСМП?
Многочисленные исследования связывают
возникновение ИСМП с предшествующей колонизацией и, в некоторых случаях, с
избыточным ростом эндогенных патогенных бактерий (Johanson
et al., 1979; Blot et al., 2005; Brusselaers et al., 2012; Frencken et al.,
2018).
Использование антисептиков (в основном
хлоргексидина) и антибиотиков для профилактики ИСМП в ОИТ показало
потенциальную пользу, несмотря на опасения по поводу повышения уровня
бактериальной резистентности. В
нескольких исследованиях рассматривалась роль кожной, пищеварительной и
ротоглоточной деколонизации в снижении риска ИСМП в ОИТ, и подчеркивалось, что
рациональное использование этих мероприятий в конкретных ситуациях может быть
полезным, если их применять продуманно.
Роль хлоргексидина
глюконата в профилактике ИСМП в ОИТ
Хлоргексидина глюконат (ХГГ) обладает
широким антимикробным действием и пролонгированным остаточным эффектом.
Он доступен в виде предварительно упакованных губок,
пропитанных ХГГ, в виде антисептического мыла или растворов и жидкостей для полоскания
рта. Губки, пропитанные ХГГ,
значительно снижают частоту грамположительной, но не грамотрицательной
бактериемии (Afonso et al., 2016; Eggimann et al.,
2019).
Их применение связано с повышенным риском
инфекций, вызванных бактериями с пониженной чувствительностью к ХГГ.
На сегодняшний день не было отмечено никаких
клинических последствий (Afonso et al., 2016),
но реализация универсальной деколонизации кожи на основе ХГГ требует тщательной
оценки. Необходимо
провести испытания, изучающие безопасность, экономическую эффективность и
последствия систематического использования губок для пациентов с высоким риском
грамотрицательных инфекций (Dray et al., 2019).
Учитывая угрозу роста устойчивости к ХГГ,
использование губок, пропитанных ХГГ, может быть зарезервировано для борьбы со
вспышками, а не в рутинной практике. Как
губки, пропитанные ХГГ, так и повязки с гелем ХГГ использовались для ухода за
постоянными внутрисосудистыми устройствами и привели к снижению риска
внутрисосудистых инфекций до 60% (Timsit et al.,
2009, 2012; Ульман и др., 2016; Эггиманн и др., 2019).
Их использование было рекомендовано у
взрослых пациентов группы высокого риска, когда вероятность инфекции остается высокой, несмотря на
применение соответствующих мероприятий ухода за катетером.
Уход за полостью рта ХГГ широко распространен в ОИТ для
интубированных пациентов, хотя его польза для снижения риска пневмонии была доказана
только у кардиохирургических пациентов (Labeau et
al., 2011; Klompas et al., 2014). Его
использование было недавно оспорено. Во-первых,
ополаскиватель для рта с 2% раствором ХГГ оказался триггером для обратимого
орального мукозита у 9,8% пациентов (Plantinga et
al., 2016). Во-вторых, метаанализы
показали, что использование ХГГ для
обработки полости рта увеличивает риск смерти (Klompas
et al., 2014; Price et al., 2014).
Кроме того, недавнее крупное
обсервационное когортное исследование показало, что уход за полостью рта с
помощью ХГГ был связан с повышенной смертностью (Deschepper
et al., 2018). В большой группе
пациентов ОИТ из 186 больниц уход за полостью рта ХГГ также оказался
независимым фактором риска сепсиса и смерти (Parreco
et al., 2020). Было высказано
предположение, что эрадикация микробиома полости рта с использованием
пероральных антисептиков приводит к нарушению биодоступности оксида азота, что
подвергает пациентов риску опасных для жизни осложнений, таких как ишемическая
болезнь сердца и сепсис. (Blot, 2021).
If this
hypothesis proves sound, the deleterious effect would be valid for all
antiseptic mouthwash solutions and not exclusively those based on CHG. While
awaiting more insights it seems wise to limit the use of CHG mouthwash to evidence-based
indications.
Moreover,
a recent study demonstrated that omitting CHG mouthwashes from the oral care
routine does not impact ICU mortality while improving oral health scores (Dale
et al., 2021).
Если эта гипотеза подтвердится, вредный
эффект будет предположен для всех антисептических растворов для полоскания рта,
а не только для тех, которые основаны на ХГГ. В
ожидании дополнительных сведений представляется разумным ограничить
использование растворов ХГГ для
полоскания рта CHG показаниями, основанными на фактических данных.
Более того, недавнее исследование показало, что
исключение ХГГ-содержащих средств из рутинной практики ухода за полостью рта не
влияет на смертность в ОИТ (Dale et al., 2021).
Какова роль материалов, импрегнированных антимикробными
средствами?
Для предотвращения ВАП, КАИК и КАИМВП были предложены материалы с антиинфекционной
пропиткой. Метаанализ 27
рандомизированных контролируемых клинических исследований, оценивающих клиническую
эффективность центральных венозных катетеров, обработанных противоинфекционными
агентами, показал значительное снижение КАИК по сравнению с катетерами без
покрытия (Hockenhull et al., 2009).
Катетеры, пропитанные противомикробными препаратами,
кажутся особенно подходящими, когда фоновая частота КАИК высока, несмотря на
соблюдение комплексной стратегии профилактики инфекций (Timsit et al., 2018).
A recent
meta-analysis based on studies performed in settings with a low prevalence of
antibiotic resistance, concluded that SOD and SDD with intravenous antimicrobials
was associated with lower mortality rates, fewer HAIs, and less carriage of
MDROs (Wittekamp
et al., 2018, 2020). These results appear to only apply in settings with
low baseline levels of MDROs. The use of SOD and SDD without intravenous antimicrobials
was not associated with decreases in neither the rate of bacteremia due to MDRO
nor 28-day ICU mortality in countries where the prevalence of MDRO was higher (Wittekamp
et al., 2018).
Роль селективной
пищеварительной и оральной деконтаминации (СПД и СОД)
Недавний метаанализ, основанный на
исследованиях, проведенных в условиях с низкой распространенностью
антибиотикорезистентности, пришел к выводу, что СПД и СОД при внутривенном
введении противомикробных препаратов были связаны с более низкими показателями
смертности, меньшим количеством ИСМП и меньшим количеством носительства полирезистентных
микроорганизмов (Wittekamp et al., 2018, 2020).
Эти результаты, по-видимому, применимы только в
условиях с низкими исходными уровнями полирезистентых возбудетелей.
Использование СПД и СОД без внутривенного введения
противомикробных препаратов не ассоциировалось ни со снижением частоты
бактериемии, вызванной полирезистентными
микроорганизмами, ни с 28-дневной смертностью в ОИТ в странах, где
распространенность полирезистентных бактерий была высокой (Wittekamp et al., 2018).
Использование противоинфекционных средств
для предотвращения инфекции требует тщательной оценки риска и пользы как для
пациента, так и для общества. На
Fig. 7 представлена оценка риска и пользы по
сравнению с программой профилактики и инфекционного контроля, которая считается
золотым стандартом в борьбе с инфекциями.
Вывод
ИСМП в ОИТ остаются причиной высокой
смертности, а их профилактика является основной задачей. Пожилой
возраст пациентов, сопутствующие заболевания и иммунодефицитное состояние обусловливают
постоянное увеличение частоты ИСМП, приобретенных в ОИТ, в некоторых центрах.
Хотя «Нулевой уровень ИСПМ» недостижим, наша цель
должна состоять в том, чтобы достичь самых низких пороговых значений, описанных
в литературе. Кроме того,
высокая распространенность резистентности к антибиотикам увековечивает персистенцию
ИСМП во всем мире. Их снижение
требует дальнейшего внедрения профилактических комплексов в сочетании с
программами рационального использования противомикробных препаратов.
Растущие знания о микробиоте, вероятно,
позволят в будущем внедрять новые профилактические меры, которые могут быть
основаны на внимании к комменсальной флоре (Hamilton
and Behal 2020), более четкого определения показаний для применения
пробиотиков или манипулировании микробиотой
(Young, 2016).
Новые диагностические инструменты помогут
нам лучше выявлять инфицированных пациентов. Однако
они потребуют тщательной оценки перед внедрением.
Наконец, стратегии обеззараживания и деколонизации,
вероятно, придется ограничить группами высокого риска, чтобы свести к минимуму
селекцию возбудителей, устойчивых к антисептикам.
Будущее профилактики в ОИТ, вероятно, будет основано
на нашей способности адаптировать политику и новые технологии к профилям риска конкретного
пациента.
References
Abe, T., Tokuda, Y., Shiraishi,
A., Fujishima, S., Mayumi, T., Sugiyama, T., et al., 2019. In-hospital mortality associated
with the misdiagnosis or unidentified site of infection at admission. Crit Care. BioMed Central 23 (1), 202–209.
Afonso, E., Blot, K., Blot, S., 2016. Prevention of hospital-acquired bloodstream infections through chlorhexidine gluconate-impregnated washcloth bathing
in intensive care units: a systematic review and meta-analysis of randomised crossover trials. Euro. Surveill.
21 (46), 30400.
Albiger, B., Glasner,
C., Struelens, M.J., Grundmann, H., Monnet, D.L., European Survey of Carbapenemase-Producing Enterobacteriaceae (EuSCAPE) working group, 2015. Carbapenemase-producing Enterobacteriaceae in Europe: assessment
by national experts from 38 countries, May 2015. Euro Surveill. European
Centre for Disease Prevention and Control 20 (45), 30062.
Allegranzi, B., Zayed,
B., Bischoff, P., Kubilay, N.Z., de Jonge,
S., de Vries, F., et al., 2016. New WHO recommendations on intraoperative and postoperative measures
for surgical site infection
prevention: an evidence-based global perspective. Lancet
Infect. Dis. 16 (12), e288–e303.
Alvarez-Lerma, F., Marín-Corral, J., Vil`a, C., Masclans, J.R., Loeches, I.M., Barbadillo, S., et al., 2017. Characteristics of patients with hospital-acquired influenza
A (H1N1) pdm09 virus admitted
to the intensive care unit.
J. Hosp. Infect. 95 (2), 200–206.
Anders, R.L., 2021. Patient safety time for federally mandated registered
nurse to patient ratios. Nurs. Forum. John Wiley & Sons Ltd.
Arabi, Y., Al-Shirawi, N., Memish, Z., Anzueto, A., 2008. Ventilator-associated pneumonia in adults in developing
countries: a systematic
review. Int. J. Infect. Dis. 12 (5), 505–512.
Arabi, Y.M., Azoulay, E´., Al-Dorzi, H.M., Phua, J., Salluh, J., Binnie, A., et al., 2021. How the COVID-19 pandemic
will change the future of critical care. Intensive Care Med. Springer Berlin Heidelberg 47, 282–291.
Augustin, P., Kermarrec,
N., Muller-Serieys, C., Lasocki, S., Chosidow, D., Marmuse, J.-P., et al., 2010. Risk factors
for multidrug resistant bacteria
and optimization of empirical antibiotic therapy in postoperative peritonitis. Crit. Care. BioMed Central Ltd 14 (1), R20.
Behari, A., Kalafatis, N., 2015. Incidence
and outcome of ventilator-associated
pneumonia in Inkosi Albert Luthuli and King Edward VIII Hospital surgical
intensive care units. South Afr. J. Crit. Care 31 (1), 16–18.
Blot, S., 2008. Limiting the attributable mortality
of nosocomial infection
and multidrug resistance in intensive
care units. Clin. Microbiol. Infect.
14 (1), 5–13.
Blot, S., 2021. Antiseptic mouthwash, the nitrate-nitrite-nitric oxide pathway, and
hospital mortality: a hypothesis generating review. Intensive Care Med. Springer Berlin Heidelberg 47, 28–38.
Blot, K., Bergs, J., Vogelaers, D., Blot, S., Vandijck,
D., 2014. Prevention of central line- associated bloodstream infections through quality improvement interventions: A systematic review and meta-analysis. Clin. Infect. Dis. Oxford University Press 59
(1), 96–105.
Blot, S., Depuydt,
P., Vogelaers, D., Decruyenaere, J., De Waele,
J., Hoste, E., et al., 2005. Colonization status and appropriate antibiotic
therapy for nosocomial
bacteremia
caused by antibiotic-resistant gram-negative bacteria in an intensive
care unit. Infect. Control Hosp. Epidemiol. 26 (6), 575–579.
Blot, S., De Waele, J.J., Vogelaers, D., 2012. Essentials for selecting antimicrobial
therapy for intra-abdominal infections. Drugs. Springer
International Publishing 72 (6), e17–e32.
Blot, S., Antonelli, M., Arvaniti, K., Blot, K., Creagh-Brown, B., de Lange, D., et al., 2019b.
Epidemiology of intra-abdominal infection and sepsis in critically ill
patients: “AbSeS”, a multinational observational cohort study and ESICM Trials
Group Project. Intensive Care Med. Springer
Berlin Heidelberg 45, 1703–1717.
Blot, K., Hammami,
N., Blot, S., Vogelaers, D., Lambert, M.-L., 2019a. Increasing
burden of Escherichia coli, Klebsiella pneumoniae, and Enterococcus faecium in hospital-acquired bloodstream infections (2000–2014): A national dynamic cohort
study. Infect. Control. Hosp. Epidemiol. Cambridge
University Press 40 (6), 705–709.
Blot, K., Hammami,
N., Blot, S., Vogelaers, D., Lambert, M.-L., 2021. Seasonal variation of hospital-acquired bloodstream
infections: A national cohort study. Infect. Control. Hosp. Epidemiol. Cambridge
University Press 1–7.
Braga IA, Campos
PA de,
Batista˜o DWDF,
Gontijo Filho
PP, Ribas
RM. Using
point prevalence survey to define burden of antimicrobial use among 35 adult intensive
care units in Brazil. Infect Dis (Lond).
Taylor & Francis; 2019;51(6):459–462.
Brusselaers, N., Logie, D., Vogelaers, D., Monstrey, S., Blot, S., 2012. Burns, inhalation injury and ventilator-associated pneumonia:
value of routine surveillance cultures. Burns 38 (3), 364–370.
Brusselaers, N., Labeau, S., Vogelaers,
D., Blot, S., 2013. Value of lower respiratory tract surveillance cultures to predict
bacterial pathogens in ventilator-associated pneumonia: systematic review and diagnostic test accuracy meta-analysis. Intensive
Care Med. Springer-Verlag 39 (3), 365–375.
Buetti, N., Timsit, J.-F., 2019. Management and prevention of central venous catheter-
related infections in the ICU. Semin. Respir. Crit. Care Med. 40 (4), 508–523.
Buetti, N., Ruckly,
S., Lucet, J.-C., Mimoz, O., Souweine, B., Timsit, J.-F., 2021. Factors influencing local signs at catheter
insertion site regardless of catheter-related
bloodstream infections. Crit. Care. BioMed Central 25 (1), 71–73.
Buffie, C.G., Pamer, E.G., 2013. Microbiota-mediated colonization resistance against
intestinal pathogens. Nat. Rev. Immunol.
Nature Publishing Group 13 (11), 790–801.
Caballero, S.,
Kim, S.,
Carter, R.A.,
Leiner, I.M.,
Suˇsac, B., Miller,
L., et
al., 2017. Cooperating commensals restore colonization resistance to vancomycin-resistant Enterococcus faecium. Cell Host Microbe
21 (5), 592–594.
Centers for Disease Control and Prevention. National and State Healthcare-associated Infections Progress Report, 2016. Available from: https://www.cdc.gov/HAI/pdfs/ progress-report/hai-progress-report.pdf. 2016.
Centers for Disease Control and Prevention. Bloodstream Infection Event (central
line- associated bloodstream infection and non-central line associated bloodstream infection). 2019. https://www.cdc.gov/nhsn/PDFs/pscManual/4PSC_CLABScurrent. pdf.
Charles, M.P., Easow, J.M., Joseph,
N.M., Ravishankar, M., Kumar, S., Umadevi, S., 2013. Incidence and risk factors
of ventilator associated pneumonia in a tertiary care hospital. Australas Med J. 6 (4), 178–182.
Cherifi, S., Mascart,
G., Dediste, A., Hallin, M., Gerard, M., Lambert, M.-L., et al., 2013. Variations in catheter-related bloodstream infections rates based on local practices. Antimicrob. Resist. Infect. Control. BioMed Central 2 (1), 10–14.
Chiang, C.-H., Pan, S.-C., Yang, T.-S., Matsuda,
K., Kim, H.B., Choi, Y.H., et al., 2018. Healthcare-associated infections in intensive care units in Taiwan, South Korea, and Japan: recent trends based on national surveillance reports. Antimicrob. Resist.Infect. Control. BioMed Central 7 (1), 129–212.
Chiu, C.Y., Miller,
S.A., 2019. Clinical
metagenomics. Nat. Rev. Genet. Nature Publishing Group 20 (6), 341–355.
Coisel, Y., Bousbia,
S., Forel, J.-M., Hraiech, S., Lascola, B., Roch, A., et al., 2012.Cytomegalovirus and herpes simplex virus effect on the prognosis
of mechanically ventilated patients suspected
to have ventilator-associated pneumonia. PLoS ONE Public Library of Science 7 (12), e51340.
Dale, C.M., Rose, L., Carbone,
S., Pinto, R., Smith, O.M., Burry, L., et al., 2021. Effect of oral chlorhexidine de-adoption and implementation of an oral care bundle on mortality for mechanically ventilated patients in the
intensive care unit (CHORAL): a multi-center stepped wedge cluster-randomized controlled trial. Intensive Care Med.Springer Berlin Heidelberg 47, 1295–1302.
Dancer, S.J., 2014. Controlling hospital-acquired infection: focus on the role of the
environment and new technologies for decontamination. Clin. Microbiol. Rev. American Society for Microbiology Journals
27 (4), 665–690.
Dasgupta, S., Das, S., Chawan,
N.S., Hazra, A., 2015. Nosocomial infections in the intensive care unit: Incidence, risk factors, outcome
and associated pathogens
in a public tertiary teaching
hospital of Eastern India. Indian J. Crit. Care Med. 19 (1),
14–20.
de Montmollin, E., Ruckly, S., Schwebel, C., Philippart, F., Adrie, C., Mariotte, E., et al., 2019. Pneumonia in acute ischemic
stroke patients requiring
invasive ventilation: Impact on short and long-term
outcomes. J. Infect. 79 (3), 220–227.
De Waele, J., Lipman, J., Sakr, Y., Marshall, J.C., Vanhems, P., Barrera Groba, C., et al., 2014. Abdominal infections in the intensive care unit: characteristics,
treatment and determinants of outcome.
BMC Infect. Dis. BioMed Central Ltd 14 (1), 420.
Deknuydt, F., Roquilly,
A., Cinotti, R., Altare, F., Asehnoune, K., 2013. An in vitro model of mycobacterial granuloma
to investigate the immune response
in brain-injured
patients. Crit. Care Med. 41 (1), 245–254.
Delano, M.J., Ward, P.A., 2016. The immune system’s role in sepsis progression, resolution, and long-term
outcome. Immunol. Rev. John Wiley & Sons, Ltd 274 (1),
330–353.
Depuydt, P., Benoit, D., Vogelaers,
D., Claeys, G., Verschraegen, G., Vandewoude, K., et al., 2006a. Outcome in bacteremia associated with nosocomial pneumonia and the impact of pathogen prediction by tracheal surveillance cultures.
Intensive Care Med. 32 (11), 1773–1781.
Depuydt, P., Benoit, D., Vogelaers, D., Decruyenaere, J., Vandijck, D., Claeys, G., et al., 2008. Systematic surveillance cultures as a tool to predict involvement
of multidrug antibiotic resistant bacteria
in ventilator-associated pneumonia. Intensive Care Med.34 (4), 675–682.
Depuydt, P.O., Blot, S.I., Benoit, D.D., Claeys, G.W., Verschraegen,
G.L., Vandewoude, K. H., et al., 2006b.
Antimicrobial resistance in nosocomial bloodstream infection associated with pneumonia and the value of systematic surveillance
cultures in an adult intensive care unit. Crit. Care Med. 34 (3), 653–659.
Deschepper, M., Waegeman,
W., Eeckloo, K., Vogelaers, D., Blot, S., 2018. Effects
of chlorhexidine gluconate oral care on hospital
mortality: a hospital-wide, observational cohort study. Intensive Care Med. Springer Berlin Heidelberg 44,1017–1026.
Dick, A., Liu, H., Zwanziger,
J., Perencevich, E., Furuya,
E.Y., Larson, E., et al., 2012.Long-term survival and healthcare utilization outcomes attributable to sepsis and pneumonia. BMC Health Serv. Res. BioMed Central 12 (1), 432–510.
Dimopoulos, G., Koulenti,
D., Blot, S., Sakr, Y., Anzueto, A., Spies, C., et al., 2013.Critically ill elderly adults with infection: analysis
of the extended prevalence of infection in intensive
care study. J. Am. Geriatr. Soc. 61 (12), 2065–2071.
Dixon-Woods, M., Leslie, M.,
Bion, J., Tarrant, C., 2012. What counts?
An ethnographic study of infection data reported
to a patient safety program.
Milbank Q. John Wiley& Sons, Ltd 90 (3), 548–591.
Dray, S., Forel, J.-M., Papazian,
L., 2019. What’s new in the prevention
of healthcare- associated infections using chlorhexidine gluconate-impregnated washcloths.Intensive Care Med. Springer Berlin Heidelberg 45, 249–251.
Dudeck, M.A., Horan, T.C., Peterson,
K.D., Allen-Bridson, K., Morrell, G., Anttila, A.,et al., 2013. National Healthcare
Safety Network report, data summary for 2011, device-associated module. Am. J. Infect. Control 41 (4), 286–300.
Eggimann, P.,
Pagani, J.-L.,
Dupuis-Lozeron, E., Ms,
B.E., Th´evenin, M.-J.,
Joseph, C.,et al., 2019. Sustained reduction
of catheter-associated bloodstream infections with enhancement of catheter bundle
by chlorhexidine dressings over 11 years. Intensive Care Med. Springer Berlin Heidelberg 45 (6), 823–833.
Elliott, D., Elliott,
R., Burrell, A., Harrigan, P., Murgo, M., Rolls, K., et al., 2015.
Incidence of ventilator-associated pneumonia
in Australasian intensive
care units: use of a consensus-developed clinical
surveillance checklist in a multisite prospective audit. BMJ Open British Medical
Journal Publishing Group 5 (10), e008924.
Emonet, S., Lazarevic,
V., Leemann Refondini, C., Gaïa, N., Leo, S., Girard, M., et al., 2019. Identification of respiratory microbiota markers in ventilator-associated
pneumonia. Intensive Care Med. Springer
Berlin Heidelberg 45, 1082–1092.
Entesari-Tatafi, D., Orford, N., Bailey, M.J., Chonghaile, M.N.I., Lamb-Jenkins, J.,
Athan, E., 2015. Effectiveness of a care bundle to reduce central line-associated bloodstream infections. Med. J. Aust. John Wiley & Sons, Ltd 202 (5), 247–250.
European Centre for Disease Prevention
and Control. Healthcare-associated infections
acquired in intensive
care units. In: ECDC. Annual epidemiological report for 2016. Stockholm: ECDC; 2018.
Freedberg, D.E., Zhou, M.J., Cohen, M.E., Annavajhala, M.K., Khan, S., Moscoso, D.I., et al., 2018. Pathogen colonization of the gastrointestinal microbiome at intensive care unit admission and risk for subsequent death or infection.
Intensive Care Med.
Springer Berlin Heidelberg
44 (8), 1203–1211.
Freifeld
A.G., Bow E.J.,
Sepkowitz K.A., Boeckh
M.J., Ito J.I., Mullen C.A., et al. Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer: 2010 update by the infectious diseases
Society of America. Vol. 52, Clinical Infectious
Diseases. 2011. pp. e56–93.
Frencken, J.F., Wittekamp, B.H.J.,
Plantinga, N.L., Spitoni, C., van de Groep, K., Cremer, O.L., et al., 2018. Associations between enteral colonization
with Gram- negative bacteria and intensive care unit-acquired infections and colonization of the
respiratory tract. Clin. Infect. Dis. 66 (4), 497–503.
Gosalbes, M.J.,
V´azquez-Castellanos, J.F., Angebault,
C., Woerther,
P.-L., Rupp´e, E., Ferrús, M.L., et al., 2016. Carriage of enterobacteria producing
extended-spectrum β-lactamases and composition of the gut microbiota in an Amerindian Community. Antimicrob. Agents Chemother. American Society for Microbiology Journals
60 (1), 507–514.
Grund, S., Roggendorf, M., Schweiger, B., 2010. Outbreak
of influenza virus A/H1N1 in a hospital ward for immunocompromised patients.
Arch. Virol. Springer
Vienna 155 (11), 1797–1802.
Guzm´an-Herrador, B., Molina,
C.D., Allam,
M.F., Navajas,
R.-F.-C., 2016.
Independent risk factors associated
with hospital-acquired pneumonia
in an adult ICU: 4-year prospective cohort study in a university reference
hospital. J. Public Health (Oxf) 38 (2), 378–383.
Hajdu, A., Samodova,
O.V., Carlsson, T.R., Voinova, L.V., Nazarenko, S.J., Tjurikov, A.V., et al., 2007. A point prevalence survey of hospital-acquired infections and antimicrobial use in a paediatric hospital in north-western Russia. J. Hosp. Infect. 66 (4), 378–384.
Hamilton, L.A., Behal, M.L., 2020. Altering routine intensive care unit practices
to
support commensalism. Nutr. Clin. Pract. John Wiley & Sons, Ltd 35 (3), 433–441.
Harbarth, S., Sax, H., Gastmeier, P., 2003. The preventable proportion of nosocomial infections: an overview of published reports. J. Hosp. Infect. 54 (4), 258–266 quiz321.
Hockenhull, J.C., Dwan, K.M., Smith, G.W., Gamble, C.L., Boland, A., Walley, T.J., et al., 2009. The clinical effectiveness of central venous catheters treated with
anti- infective agents in preventing catheter-related bloodstream infections: a systematic review. Crit. Care Med. 37 (2), 702–712.
Horan, T.C., Gaynes, R.P., Martone, W.J., Jarvis,
W.R., Emori, T.G., 1992. CDC definitions of nosocomial surgical site infections, 1992: a modification of CDC
definitions of surgical
wound infections. Infect. Control Hosp. Epidemiol. 13 (10), 606–608.
Hotchkiss, R.S., Monneret,
G., Payen, D., 2013a. Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic approach.
Lancet Infect. Dis. 13 (3), 260–268.
Hotchkiss, R.S., Monneret,
G., Payen, D., 2013b. Sepsis-induced immunosuppression:
from cellular dysfunctions to immunotherapy. Nat. Rev. Immunol.
Nature Publishing Group 13 (12), 862–874.
Ippolito, M., Misseri,
G., Catalisano, G., Marino, C., Ingoglia, G., Alessi, M., et al., 2021. Ventilator-associated pneumonia in patients
with COVID-19. A systematic review and meta-analysis. Antibiotics (Basel) 10 (5).
Iwuafor A.A., Ogunsola
F.T., Oladele R.O., Oduyebo O.O., Desalu I., Egwuatu C.C., et al. Incidence, clinical
outcome and risk factors of intensive care unit infections in the Lagos University Teaching
Hospital (LUTH), Lagos, Nigeria. PLoS ONE. Public Library of Science; 2016;11(10):e0165242.
Jansson, M., Liao, X., Rello, J., 2020. Strengthening ICU health security for a coronavirus epidemic. Intensive Crit. Care Nurs. 57, 102812.
Jansson, M.M.,
Syrja¨l¨a, H.P.,
Ala-Kokko, T.I.,
2019. Association
of nurse
staffing and nursing workload with ventilator-associated pneumonia
and mortality: a prospective, single-center cohort study. J. Hosp. Infect. 101 (3), 257–263.
Jeffery-Smith, A., Taori, S.K., Schelenz,
S., Jeffery, K., Johnson, E.M., Borman, A., et al., 2018. Candida auris: a Review of the Literature. Clin. Microbiol. Rev. American Society for Microbiology Journals 31 (1).
Johanson, W.G., Woods, D.E., Chaudhuri,
T., 1979. Association of respiratory tract colonization with adherence
of gram-negative bacilli to epithelial cells. J. Infect. Dis. 139 (6), 667–673.
Kalil A.C., Metersky
M.L., Klompas M., Muscedere J., Sweeney D.A., Palmer L.B., et al.Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American
Thoracic Society. Vol. 63, Clinical
Infectious Diseases.
2016. pp. e61–e111.
Karanika, S., Paudel,
S., Zervou, F.N., Grigoras, C., Zacharioudakis, I.M., Mylonakis, E., 2016. Prevalence and clinical outcomes
of Clostridium difficile
infection in the intensive care unit: A systematic
review and meta-analysis. Open Forum Infect.
Dis. 3 (1), ofv186.
Kelly, B.J., Imai, I., Bittinger, K., Laughlin, A., Fuchs, B.D., Bushman, F.D., et al., 2016. Composition and dynamics
of the respiratory tract microbiome in intubated patients. Microbiome BioMed Central
4 (1), 7–13.
Kelly, D., Kutney-Lee, A., Lake, E.T., Aiken, L.H., 2013. The critical care work
environment and nurse-reported health care-associated infections. Am. J. Crit. Care 22 (6), 482–488.
Klompas, M., Speck, K., Howell, M.D., Greene,
L.R., Berenholtz, S.M., 2014. Reappraisal of routine oral care with chlorhexidine gluconate for patients receiving
mechanical ventilation: systematic review and meta-analysis. JAMA Intern. Med. American Medical Association 174 (5), 751–761.
Kopp, M.A., Watzlawick, R., Martus, P., Failli, V., Finkenstaedt, F.W., Chen, Y., et al., 2017. Long-term functional
outcome in patients
with acquired infections
after acute
spinal cord injury. Neurology. Wolters Kluwer Health, Inc. on behalf of the American Academy of Neurology
88 (9), 892–900.
Korbkitjaroen, M., Vaithayapichet, S., Kachintorn, K., Jintanothaitavorn, D., Wiruchkul, N., Thamlikitkul, V., 2011. Effectiveness of comprehensive implementation of individualized bundling infection control measures for prevention of health care-associated infections
in general medical wards. Am. J. Infect. Control 39 (6), 471–476.
Labeau, S.O., 2020. Recommendation and protocol compliance: “Yes, I do” may not be true; the complexity of measuring
provider adherence. Intensive
Crit. Care Nurs. 60,
102890.
Labeau, S.O., Van de Vyver, K., Brusselaers, N., Vogelaers, D., Blot, S.I., 2011. Prevention of ventilator-associated pneumonia
with oral antiseptics: a systematic review and meta-analysis. Lancet Infect. Dis. 11 (11), 845–854.
Langelier, C., Kalantar,
K.L., Moazed, F., Wilson, M.R., Crawford, E.D., Deiss, T., et al., 2018. Integrating host response and unbiased microbe detection for lower respiratory tract infection
diagnosis in critically
ill adults. Proc. Natl. Acad. Sci. U.S. A. National Academy of Sciences
115 (52), E12353–E12362.
Leblebicioglu, H., Rosenthal, V.D.,
Arikan, O.A., Ozgültekin, A., Yalcin, A.N., Koksal, I., et al., 2007. Device-associated hospital-acquired infection rates in
Turkish intensive care units. Findings of the International Nosocomial
Infection Control Consortium (INICC). J. Hosp. Infect. 65 (3), 251–257.
Leblebicioglu, H.,
O¨ ztürk, R.,
Rosenthal, V.D.,
Akan, O¨ .A., Sirmatel,
F., Ozdemir,
D., et al., 2013a. Impact of a multidimensional infection control approach
on central line-associated bloodstream infections rates in adult intensive care units of 8 cities
of Turkey: findings of the International Nosocomial Infection Control
Consortium (INICC). Ann. Clin. Microbiol. Antimicrob. BioMed Central 12 (1), 10.
Leblebicioglu, H., Yalcin,
A.N., Rosenthal, V.D., Koksal, I., Sirmatel, F., Unal, S., et al., 2013b. Effectiveness of a multidimensional approach for prevention of ventilator- associated pneumonia in 11 adult intensive care units from 10 cities of Turkey: findings of the International Nosocomial Infection Control Consortium (INICC). Infection Springer-Verlag 41 (2), 447–456.
Lee, Y.S.H., Stone, P.W., Pogorzelska-Maziarz, M., Nembhard, I.M., 2018. Differences in work environment for staff as an explanation for variation in central line bundle compliance in intensive
care units. Health Care Manage. Rev. 43 (2), 138–147.
Leo, S., Lazarevic, V., Gaïa, N., Estellat, C., Girard, M., Matheron, S., et al., 2019. The intestinal microbiota predisposes to traveler’s diarrhea and to the
carriage of multidrug-resistant Enterobacteriaceae after traveling to tropical
regions. Gut Microbes. Taylor & Francis 10 (5), 631–641.
Li, X., Huang, Y., Xu, Z., Zhang, R., Liu, X., Li, Y., et al., 2018. Cytomegalovirus infection and outcome in immunocompetent patients
in the intensive care unit: a systematic review and meta-analysis. BMC Infect. Dis. BioMed Central 18 (1), 289–310.
Libert, N., Bigaillon,
C., Chargari, C., Bensalah, M., Muller, V., Merat, S., et al., 2015. Epstein-Barr virus reactivation in critically ill immunocompetent patients.
Biomed. J. 38 (1), 70–76.
Limaye, A.P., Kirby, K.A., Rubenfeld, G.D., Leisenring, W.M., Bulger, E.M., Neff, M.J., et al., 2008. Cytomegalovirus
reactivation in critically ill immunocompetent patients. JAMA. American
Medical Association 300 (4), 413–422.
Lobo, R.D., Levin, A.S., Gomes, L.M.B., Cursino, R., Park, M., Figueiredo, V.B., et al., 2005. Impact of an educational program and policy changes on decreasing catheter-
associated bloodstream infections
in a medical intensive care unit in Brazil. Am. J. Infect. Control 33 (2), 83–87.
Lormans, P., Blot, S., Amerlinck, S., Devriendt, Y., Dumoulin,
A., 2021. COVID-19 acquisition risk among ICU nursing
staff with patient-driven use of aerosol- generating respiratory procedures
and optimal use of personal
protective equipment. Intensive Crit. Care Nurs. 63, 102993.
Loubet, P., Voiriot,
G., Houhou-Fidouh, N., Neuville, M., Bouadma, L., Lescure, F.-X., et al., 2017. Impact of respiratory viruses
in hospital-acquired pneumonia
in the intensive care unit: A single-center retrospective study. J. Clin. Virol. 91, 52–57.
Luyt, C.-E., Combes,
A., Deback, C., Aubriot-Lorton, M.-H.,
Nieszkowska, A., Trouillet, J.- L., et al., 2007. Herpes simplex virus lung infection in patients
undergoing prolonged mechanical ventilation. Am. J. Respir. Crit. Care Med.
American Thoracic Society 175 (9), 935–942.
Luyt, C.-E., Sahnoun, T., Gautier,
M., Vidal, P., Burrel, S., Pineton de Chambrun, M., et al., 2020. Ventilator-associated pneumonia in patients with
SARS-CoV-2- associated acute respiratory distress syndrome requiring
ECMO: a retrospective cohort study. Ann. Intensive Care. SpringerOpen 10 (1), 158–210.
Maes, M., Higginson, E., Pereira-Dias, J., Curran, M.D., Parmar, S., Khokhar,
F., et al., 2021. Ventilator-associated pneumonia
in critically ill patients with COVID-19. Crit.Care. BioMed Central 25 (1), 25–111.
Magill, S.S., Edwards,
J.R., Bamberg, W., Beldavs, Z.G., Dumyati, G., Kainer, M.A., et al., 2014. Multistate point-prevalence survey of health care-associated infections. N. Engl. J.
Med. Massachusetts Medical
Society 370 (13), 1198–1208.
Malek, A.M., Abouseif,
H.A., Elaziz, K., Allam, M.F., Fahim, H.I., 2018. Incidence
of central line-associated bloodstream infections in intensive
care units in a private hospital (Cairo, Egypt). Open Public Health J. 11, 562–571.
Marin, M., Gudiol, C., Ardanuy,
C., Garcia-Vidal, C., Calvo, M., Arnan, M., et al., 2014. Bloodstream infections in neutropenic patients
with cancer: differences between
patients with haematological malignancies and solid tumours. J. Infect. 69 (5), 417–423.
Martin-Loeches, I.,
Po´voa, P., Rodriguez,
A., Curcio,
D., Sua´rez, D.,
Mira, J.-P.,
et al.,2015. Incidence and prognosis of ventilator-associated tracheobronchitis (TAVeM): a multicentre, prospective, observational study. Lancet Respir.
Med. 3 (11), 859–868.
Medell, M., Hart, M., Duquesne, A., Espinosa, F., Vald´es, R., 2013. Nosocomial ventilator-associated pneumonia in Cuban intensive care units: bacterial species and
antibiotic resistance. MEDICC Rev. 15 (2), 26–29.
Mehta, A., Rosenthal, V.D., Mehta, Y., Chakravarthy, M., Todi, S.K., Sen,
N., et al., 2007. Device-associated nosocomial infection rates in intensive care units of
seven Indian cities. Findings of the International Nosocomial Infection Control
Consortium
(INICC). J. Hosp. Infect. 67 (2), 168–174.
Mendes, M., Andrade Oliveira, A., Pires, O., Branca, F., Beira˜o, M., Santa-Cruz, A., et al., 2021. Sampling methods and risk stratification regarding
environmental contamination by SARS-CoV-2. Acta Med. Port. 34 (13).
Mermel L.A., Allon M., Bouza E., Craven D.E., Flynn P., O’Grady N.P., et al. Clinical practice guidelines for the diagnosis
and management of intravascular catheter-related infection: 2009 Update by the Infectious Diseases
Society of America.
Vol. 49, Clinical
infectious Diseases. Oxford University Press; 2009. pp. 1–45.
Mitchell, B.G., Dancer,
S.J., Anderson, M., Dehn, E., 2015. Risk of organism
acquisition from prior room occupants: a systematic review and meta-analysis. J. Hosp. Infect. 91 (3), 211–217.
Mitharwal, S.M., Yaddanapudi, S., Bhardwaj, N., Gautam, V., Biswal, M., Yaddanapudi, L., 2016. Intensive care unit-acquired infections in a
tertiary care hospital: An epidemiologic survey and influence
on patient outcomes.
Am. J. Infect.
Control 44 (7), e113–e117.
Mongin, D., Catho, G., Iten, A., Harbarth,
S., Courvoisier, D.S., 2021. Incidence
of
healthcare-associated coronavirus disease 2019 (COVID-19) in the state of Geneva. Infect. Control Hosp. Epidemiol. Cambridge
University Press 1–3.
Moreno, C.A., Rosenthal, V.D., Olarte,
N.,
Gomez,
W.V.,
Sussmann,
O.,
Agudelo,
J.G., et al., 2006. Device-associated infection
rate and mortality in intensive
care units of 9 Colombian hospitals:
findings of the International Nosocomial
Infection Control Consortium. Infect. Control Hosp. Epidemiol.
Cambridge University Press 27 (4), 349–356.
Murni, I.K., Duke, T.,
Kinney, S., Daley, A.J., Soenarto,
Y., 2015. Reducing hospital- acquired infections and improving the rational use of antibiotics in a developing country: an effectiveness study. Arch. Dis. Child. BMJ Publishing Group Ltd 100 (5),
454–459.
Myny, D., Depuydt, P., Colardyn,
F., Blot, S., 2005. Ventilator-associated pneumonia
in a tertiary care ICU: analysis of risk factors for acquisition and mortality. Acta Clin. Belg. 60 (3), 114–121.
Navoa-Ng, J.A., Berba, R., Galapia,
Y.A., Rosenthal, V.D., Villanueva, V.D., Tolentino, M. C.V., et al., 2011. Device-associated infections rates in adult, pediatric, and neonatal intensive care units of hospitals in the Philippines: International
Nosocomial Infection Control Consortium
(INICC) findings. Am. J. Infect. Control 39 (7), 548–554.
Ndegwa, L.K., Katz, M.A., McCormick, K., Nganga, Z., Mungai, A., Emukule, G., et al., 2014. Surveillance for respiratory health care-associated infections among inpatients in 3 Kenyan hospitals, 2010–2012.
Am. J. Infect. Control 42 (9), 985–990.
Nseir, S., Blazejewski, C., Lubret, R., Wallet, F., Courcol, R.,
Durocher, A., 2011. Risk of acquiring multidrug-resistant Gram-negative bacilli from prior room occupants
in the intensive care unit. Clin. Microbiol. Infect. 17 (8), 1201–1208.
Nussenblatt, V., Avdic, E., Berenholtz, S., Daugherty, E., Hadhazy, E.,
Lipsett, P.A., et al., 2014. Ventilator-associated pneumonia: overdiagnosis and treatment
are common in medical and surgical
intensive care units. Infect. Control Hosp. Epidemiol. Cambridge University Press 35 (3), 278–284.
Ong, D.S.Y., Bonten, M.J.M.,
Spitoni, C., Verduyn Lunel, F.M., Frencken, J.F., Horn, J.,et al., 2017. Epidemiology of multiple herpes viremia in previously immunocompetent patients with septic shock. Clin. Infect.
Dis. 64 (9), 1204–1210.
Ortíz, G., Duen˜as, C., Rodríguez, F., Barrera, L., Rosa, L.a., de, G,, Dennis, R,, et al., 2014. Epidemiology of sepsis in Colombian
intensive care units. Biomedica 34 (1), 40–47.
Parreco, J., Soe-Lin, H., Byerly,
S., Lu, N., Ruiz, G., Yeh, D.D., et al., 2020. Multi-center outcomes of chlorhexidine oral decontamination in intensive care units. Surg. Infect.(Larchmt) sur.2019.172.
Penoyer, D.A., 2010. Nurse staffing and patient outcomes in critical
care: a concise review. Crit. Care Med. 38 (7), 1521–1528
quiz1529.
Phu, V.D., Wertheim,
H.F.L., Larsson, M., Nadjm, B., Dinh,
Q.-D., Nilsson, L.E., et al., 2016. Burden of hospital acquired infections and antimicrobial use in
Vietnamese adult intensive care units. PLoS ONE. Public Library of Science 11 (1), e0147544.
Plantinga, N.L., Wittekamp, B.H.J., Leleu, K., Depuydt, P., Van den
Abeele, A.-M., Brun- Buisson, C., et al., 2016. Oral mucosal adverse events with chlorhexidine 2%
mouthwash in ICU. Intensive Care Med. Springer Berlin Heidelberg
42, 620–621.
Ponce de
Leo´n-Rosales,
S.P., Molinar-Ramos,
F., Domínguez-Cherit,
G., Rangel-
Frausto, M.S., Va´zquez-Ramos, V.G., 2000. Prevalence of infections in intensive care units in Mexico: a multicenter study. Crit. Care Med. 28 (5), 1316–1321.
Price R., MacLennan
G., Glen J.,
SuDDICU Collaboration. 2014. Selective digestive
or oropharyngeal decontamination and topical oropharyngeal chlorhexidine for prevention of death in general intensive
care: systematic review and network meta-analysis. BMJ. BMJ Publishing Group; 348(mar31 2):g2197–7.
Public Health Agency of Canada,
2014. Central Venous Catheter-Associated Blood Stream Infections in Intensive
Care units in Canadian Acute-Care Hospitals: Surveillance Report January 1, 2006 to December 31, 2006 and January 1, 2009 to December 31, 2011. Centre
for Communicable Diseases and Infection Control, Public Health Agency of Canada.
Pusajo´, J.F.,
Bumaschny, E.,
Doglio, G.R.,
Cherjovsky, M.R., Lipinszki,
A.I., Hern´andez, M.S., et
al., 1993.
Postoperative intra-abdominal sepsis
requiring reoperation. Value of a predictive index. Arch Surg. American Medical Association
128 (2), 218–222 discussion 223.
Ramanan, P., Bryson, A.L., Binnicker, M.J., Pritt, B.S., Patel, R., 2018. Syndromic
panel- based testing in clinical
microbiology. Clin. Microbiol. Rev. American Society
for Microbiology Journals 31 (1).
Ramirez, M., Fernandez,
B., Cruz, A., Jardines, E., Bermudez, Y., 2011. Comportamiento de las infecciones nosocomiales en Unidad de Cuidados Intensivos en un quinquenio (2005–2009). MediSur 9 (5), 467–473.
Razazi, K., Arrestier, R., Haudebourg, A.F., Benelli, B., Carteaux, G., Decousser, J.-W., et al., 2020. Risks of ventilator-associated pneumonia
and invasive pulmonary aspergillosis in patients
with viral acute respiratory distress
syndrome related or not
to Coronavirus 19 disease. Crit Care. BioMed Central 24 (1), 699–711.
Rello, J., Afonso, E., Lisboa, T., Ricart, M., Balsera,
B., Rovira, A., et al., 2013. A care bundle approach for prevention of ventilator-associated pneumonia. Clin. Microbiol. Infect. 19 (4), 363–369.
Reper, P., Bombart,
M.A., Leonard, I., Payen, B., Darquennes, O., Labrique, S., 2020.Nursing Activities Score is increased in COVID-19 patients.
Intensive Crit. Care Nurs. 60, 102891.
Reper, P., Delaere,
S., Yimbou, J.J., Labrique, S., Massaut, J., 2021. Not only intensive care unit workload and activities
but also quality indicators are influenced by the COVID-19 epidemic. Intensive
Crit. Care Nurs. 63, 103008.
Rodríguez-Acelas, A.L.,
de Abreu,
A.M., Engelman,
B., Can˜on-Montan˜ez, W.,
2017. Risk factors for health care-associated infection
in hospitalized adults:
Systematic review and meta-analysis. Am. J. Infect. Control 45 (12), e149–e156.
Roquilly, A., Broquet,
A., Jacqueline, C., Masson, D., Segain, J.P., Braudeau, C., et al., 2014. Hydrocortisone prevents immunosuppression
by
interleukin-10 natural
killer cells after trauma-hemorrhage. Crit. Care Med. 42 (12), e752–e761.
Roquilly, A., McWilliam,
H.E.G., Jacqueline, C., Tian, Z., Cinotti, R., Rimbert, M., et al., 2017. Local modulation of antigen-presenting cell development after resolution of pneumonia induces long-term
susceptibility to secondary
infections. Immunity 47 (1), 135–145.
Roquilly, A., Torres, A., Villadangos, J.A., Netea, M.G., Dickson, R., Becher, B., et al., 2019. Pathophysiological role of respiratory dysbiosis in hospital-acquired
pneumonia. Lancet Respir Med. 7 (8), 710–720.
Rosenthal, V.D., Guzman, S., Orellano, P.W., 2003. Nosocomial infections in medical-surgical intensive care units in Argentina: attributable mortality and length of stay. Am. J. Infect. Control 31 (5), 291–295.
Rosenthal, V.D., Guzman,
S., Crnich, C., 2006. Impact
of an infection control program
on rates of ventilator-associated pneumonia in intensive care units in 2 Argentinean hospitals. Am. J. Infect. Control
34 (2), 58–63.
Rouz´e, A.,
Martin-Loeches, I., Po´voa, P.,
Makris, D.,
Artigas, A.,
Bouchereau, M., et
al.,2021. Relationship between SARS-CoV-2 infection and the incidence of
ventilator- associated lower respiratory tract infections: a European multicenter
cohort study. Intensive Care Med. Springer Berlin Heidelberg 47 (2), 188–198.
Saied, W.I., Martin-Loeches, I., Timsit, J.-F., 2020. What is new in non-ventilated
ICU- acquired pneumonia? Intensive
Care Med. Springer
Berlin Heidelberg 46, 488–491.
Sakr, Y.,
Jaschinski, U., Wittebole,
X., Szakmany,
T., Lipman,
J., N˜amendys-Silva, S.A., et al., 2018. Sepsis in intensive care unit patients: worldwide data from
the intensive care over nations audit. Open Forum. Infect. Dis. Intensive Care Med.
Springer Berlin Heidelberg 5 (12), ofy313.
Satoh, K., Makimura, K., Hasumi, Y., Nishiyama, Y., Uchida, K.,
Yamaguchi, H., 2009. Candida auris sp. nov., a novel ascomycetous yeast isolated from the external
ear canal of an inpatient in a Japanese hospital. Microbiol. Immunol. John
Wiley & Sons, Ltd 53 (1), 41–44.
Schelenz, S., Nwaka, D., Hunter,
P.R., 2013. Longitudinal surveillance of bacteraemia in haematology and oncology
patients at a UK cancer centre and the impact of ciprofloxacin use on antimicrobial resistance. J. Antimicrob. Chemother. 68 (6),
1431–1438.
Schreiber, P.W., Sax, H., Wolfensberger, A., Clack, L., Kuster, S.P.,
Swissnoso, 2018. The preventable proportion of healthcare-associated infections 2005–2016:
Systematic review and meta-analysis. Infect. Control Hosp. Epidemiol. Cambridge
University Press 39 (11), 1277–1295.
Shorr, A.F., Zilberberg, M.D., Micek, S.T., Kollef, M.H.,
2017. Viruses are prevalent innon-ventilated hospital-acquired pneumonia. Respir. Med. 122, 76–80.
Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., Health Care Infection Control Practices Advisory Committee,
2007. Guideline for isolation precautions: preventing
transmission of infectious
agents in health care settings.
Am. J. Infect. Control 35, S65–S164.
Singh, S., Goyal, R., Ramesh,
G.S., Ravishankar, V., Sharma, R.M., Bhargava, D.V., et al., 2015. Control of hospital acquired
infections in the ICU: A service perspective. Med.J. Armed Forces India 71 (1),
28–32.
Smith T.J., Bohlke
K., Lyman G.H., Carson
K.R., Crawford J., Cross S.J., et al.
Recommendations for the use of WBC growth factors:
American Society of Clinical
Oncology Clinical Practice
Guideline Update. Vol. 33, Journal of Clinical
Oncology. American Society
of Clinical Oncology;
2015. pp. 3199–212.
Sommerstein, R., Merz, T.M., Berger, S., Kraemer,
J.G., Marschall, J., Hilty, M., 2019. Patterns in the longitudinal oropharyngeal microbiome evolution related
to ventilator-associated pneumonia. Antimicrob. Resist. Infect. Control.
BioMed Central
8 (1), 81–110.
Son, C.H., Daniels, T.L., Eagan, J.A., Edmond, M.B., Fishman,
N.O., Fraser, T.G., et al., 2012. Central line-associated bloodstream infection surveillance outside
the intensive care unit: a multicenter survey. Infect. Control Hosp. Epidemiol. Cambridge University Press 33 (9), 869–874.
Stewardson, A.J., Allignol,
A., Beyersmann, J., Graves, N., Schumacher, M., Meyer, R., et al., 2016. The health and economic
burden of bloodstream infections caused by antimicrobial-susceptible and non-susceptible Enterobacteriaceae and Staphylococcus aureus in European hospitals, 2010 and 2011: a multicentre retrospective cohort study. Euro Surveill.
European Centre for Disease Prevention and Control 21 (33), 30319.
Su, C.-H., Chang, S.-C., Yan, J.-J., Tseng, S.-H., Chien, L.-J., Fang, C.-T., 2013. Excess mortality and long-term
disability from healthcare-associated staphylococcus aureus infections: a population-based matched cohort study. PLoS ONE. Public Library of Science 8 (8), e71055.
Tabah, A., Koulenti, D., Laupland, K., Misset, B., Valles, J., Bruzzi de Carvalho, F., et al., 2012. Characteristics and determinants of outcome of hospital-acquired bloodstream infections in intensive care units: the EUROBACT International Cohort Study.Intensive Care Med. Springer-Verlag 38 (12), 1930–1945.
Talcott, J.A., Finberg,
R., Mayer, R.J., Goldman, L., 1988. The medical course of cancer patients with fever and neutropenia. Clinical identification of a low-risk subgroup at presentation. Arch. Intern. Med. 148 (12), 2561–2568.
Tambyah, P.A., Maki, D.G., 2000. Catheter-associated urinary tract infection
is rarely symptomatic: a prospective study of 1,497 catheterized patients.
Arch Intern Med.
American Medical Association 160 (5), 678–682.
Taplitz R.A., Kennedy
E.B., Bow E.J., Crews J., Gleason C., Hawley D.K., et al.
Antimicrobial Prophylaxis for Adult Patients With Cancer-Related Immunosuppression: ASCO and IDSA Clinical Practice Guideline Update. Vol. 36, Journal of Clinical Oncology.
American Society of Clinical Oncology;
2018. pp. 3043–54.
Taylor, G., Gravel, D., Matlow,
A., Embree, J., LeSaux, N., Johnston,
L., et al., 2016. Assessing the magnitude
and trends in hospital acquired
infections in Canadian
hospitals through sequential
point prevalence surveys.
Antimicrob. Resist. Infect. Control. BioMed Central 5 (1), 19–27.
Tejerina, E.,
Esteban, A.,
Fern´andez-Segoviano, P., Frutos-Vivar,
F., Aramburu,
J.,Ballesteros, D., et al., 2010. Accuracy of clinical definitions of ventilator-associated pneumonia: comparison with autopsy findings.
J. Crit. Care 25 (1), 62–68.
Timsit, J.-F., Schwebel,
C., Bouadma, L., Geffroy, A., Garrouste-Orgeas, M., Pease, S., et al., 2009. Chlorhexidine-impregnated sponges
and less frequent dressing changes for prevention of catheter-related infections
in critically ill adults: a randomized controlled trial. JAMA. American Medical Association 301 (12), 1231–1241.
Timsit, J.-F., Mimoz, O., Mourvillier, B., Souweine, B., Garrouste-Orgeas, M., Alfandari, S., et al., 2012. Randomized controlled trial of chlorhexidine dressing and highly adhesive dressing
for preventing catheter-related infections in critically ill adults. Am. J. Respir. Crit. Care Med. American Thoracic Society 186 (12),
1272–1278.
Timsit, J.-F., Esaied,
W., Neuville, M., Bouadma, L., Mourvllier, B., 2017. Update
on ventilator-associated pneumonia. F1000Res.
F1000 Research Limited
6 (2061), 2061.
Timsit, J.-F., Rupp, M., Bouza,
E., Chopra, V., Karpanen, T., Laupland, K., et al., 2018. A state of the art review on optimal practices
to prevent, recognize,
and manage complications associated with intravascular devices in the critically ill. Intensive Care Med. Springer Berlin Heidelberg 44, 742–759.
Tomlinson, D., Mermel, L.A., Ethier,
M.-C., Matlow, A., Gillmeister, B., Sung, L., 2011. Defining bloodstream infections related to central venous catheters
in patients with cancer: a systematic review. Clin. Infect. Dis. 53 (7), 697–710.
Tran, K., Cimon,
K., Severn, M., Pessoa-Silva, C.L.,
Conly, J., 2012. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PLoS ONE. Public Library
of Science 7 (4), e35797.
Ullman, A.J., Cooke, M.L., Mitchell,
M., Lin, F., New, K., Long, D.A., et al., 2016. Dressing and securement for central venous access devices (CVADs): A Cochrane systematic review. Int. J. Nurs. Stud. 59, 177–196.
Umscheid, C.A., Mitchell,
M.D., Doshi, J.A., Agarwal, R., Williams, K., Brennan, P.J., 2011. Estimating the proportion of healthcare-associated infections that are
reasonably preventable and the related mortality and costs. Infect. Control Hosp. Epidemiol. 32 (2), 101–114.
van der Kooi, T., Sax, H., Pittet, D., van Dissel, J., van Benthem,
B., Walder, B., et al., 2018. Prevention of hospital infections
by intervention and training (PROHIBIT): results of a pan-European cluster-randomized multicentre study to reduce central venous catheter-related bloodstream infections. Intensive Care Med. Springer Berlin
Heidelberg 44, 48–60.
van Vught, L.A.,
Scicluna, B.P., Wiewel, M.A., Hoogendijk, A.J., Klein Klouwenberg, P.M. C., Franitza, M., et al., 2016. Comparative analysis of the host response
to community-acquired and hospital-acquired pneumonia in critically
ill patients. Am. J. Respir. Crit. Care Med. American
Thoracic Society 194 (11), 1366–1374.
Vazquez Guillamet, C., Kollef, M.H., 2018. Is zero ventilator-associated pneumonia
achievable?: Practical approaches
to ventilator-associated pneumonia
prevention. Clin. Chest Med. 39 (4), 809–822.
Venet, F., Filipe-Santos, O., Lepape, A., Malcus, C., Poitevin-Later, F., Grives, A., et al., 2013. Decreased T-cell repertoire diversity
in sepsis: a preliminary study. Crit. Care Med. 41 (1), 111–119.
Vincent, J.L., Rello, J., Marshall, J., Silva, E., Anzueto, A., Martin, C.D., et al., 2009. International study of the prevalence
and outcomes of infection in intensive care
units. JAMA. American
Medical Association 302 (21), 2323–2329.
Vogelaers, D.,
De Bels,
D., Forˆet, F.,
Cran, S.,
Gilbert, E.,
Schoonheydt, K., et
al., 2010. Patterns of antimicrobial therapy in severe nosocomial infections:
empiric choices, proportion of appropriate therapy, and adaptation rates–a multicentre,
observational survey in critically ill patients.
Int. J. Antimicrob. Agents 35 (4), 375–381.
Vogelaers, D., Blot, S., Van den Berge, A., Montravers, P., 2021. Antimicrobial lessons from a large observational cohort on intra-abdominal infections in intensive
care units. Drugs. Springer International Publishing
1–14.
Vollaard, E.J., Clasener, H.A.,
1994. Colonization resistance.
Antimicrob. Agents
Chemother. American Society for Microbiology Journals 38 (3), 409–414.
Vuichard-Gysin, D., Abbas, M., Harbarth, S., 2021. In-hospital COVID-19 outbreak investigation: A practical
approach to root cause analysis.
Intensive Crit. Care Nurs. 67, 103132.
Walter, J.,
Haller, S.,
Quinten, C.,
Ka¨rki, T.,
Zacher, B.,
Eckmanns, T.,
et al.,
2018. Healthcare-associated pneumonia in acute care hospitals
in European Union/ European Economic Area countries: an analysis of data from a point prevalence survey, 2011 to 2012. Euro Surveill.. European
Centre for Disease
Prevention and Control 23 (32), 1700843.
WHO, 2011. Report on the Burden of Endemic Health Care-associated Infection Worldwide - Clean Care is Safer Care. Word Health Organization.
WHO (2012). WHO, Prevention of hospital-acquired infections - A practical
guide, 2nd edition,
in: W. H. Organization (Ed.).
Wicky, P.-H., Niedermann, M.S., Timsit, J.-F., 2021. Ventilator-associated pneumonia
in the era of COVID-19 pandemic:
How common and what is the impact? Crit. Care.
BioMed Central 25 (1), 153–163.
Winters, B.D., Eberlein,
M., Leung, J., Needham, D.M., Pronovost, P.J., Sevransky, J.E., 2010. Long-term mortality
and quality of life in sepsis: a systematic review. Crit. Care Med. 38 (5), 1276–1283.
Wittekamp, B.H.J., Oostdijk,
E.A.N., Cuthbertson, B.H.,
Brun-Buisson,
C.,
Bonten,
M.J. M., 2020. Selective
decontamination of the digestive tract (SDD) in critically ill patients: a narrative
review. Intensive Care Med. Springer
Berlin Heidelberg 46,343–349.
Wittekamp, B.H., Plantinga, N.L., Cooper, B.S., Lopez-Contreras, J., Coll, P., Mancebo, J., et al., 2018. Decontamination strategies and bloodstream infections with
antibiotic- resistant microorganisms in ventilated patients:
A randomized clinical
trial. JAMA. American Medical Association 320 (20), 2087–2098.
Woeltje, K.F., Butler,
A.M., Goris, A.J., Tutlam, N.T., Doherty, J.A., Westover, M.B., et al., 2008. Automated surveillance for central line-associated bloodstream infection in intensive care units. Infect. Control
Hosp. Epidemiol. Cambridge
University Press 29 (9), 842–846.
Yakovlev, S.V., Suvorova, M.P., Beloborodov,
V.B.,
Basin,
E.E.,
Eliseev,
E.V., Kovelenov, S.V., et al., 2016. Multicentre study of the prevalence and clinical value of hospital-acquired infections
in Emergency Hospitals
of Russia: ERGINI Study
Team. Antibiot Khimioter.
Antibiot. Khimioter. 61 (5–6), 32–42.
Yallew, W.W., Kumie, A., Yehuala, F.M., 2016. Point prevalence
of hospital-acquired infections in two teaching hospitals
of Amhara region in Ethiopia.
Drug Healthc. Patient Saf. Dove Press 8, 71–76.
Young, V.B., 2016. Therapeutic manipulation of the microbiota: past, present, and
considerations for the future. Clin. Microbiol. Infect.
22 (11), 905–909.
Zahar, J.-R., Blot,
S., Nordmann, P., Martischang, R., Timsit, J.-F., Harbarth, S., et al., 2019. Screening for intestinal carriage
of extended-spectrum beta-lactamase- producing enterobacteriaceae in critically ill patients: expected
benefits and evidence-based controversies. Clin. Infect. Dis. 68 (12), 2125–2130.
Источник фотоиллюстрации - www.freepik.com
[~DETAIL_TEXT] =>
Stijn
Blot , Etienne Ruppґe, Stephan Harbarth , Karim
Asehnoune , Garyphalia Poulakou , Charles-Edouard Luyt , Jordi Rello , Michael
Klompas , Pieter Depuydt , Christian Eckmann , Ignacio Martin-Loeches, Pedro
Povoa , Lila Bouadma , Jean-Francois Timsit , Jean-Ralph Zahar
Healthcare-associated
infections in adult intensive care unit patients:Changes in epidemiology,
diagnosis, prevention and contributions of new technologies
INTENS CRIT CARE NUR
70 (2022) 103227 https://doi.org/10.1016/j.iccn.2022.103227
Инфекции, связанные с оказанием
медицинской помощи, у взрослых пациентов отделений интенсивной терапии:
изменения в эпидемиологии, диагностике, профилактике и вкладе новых технологий

Fig. 1. Prevalence of ICU-acquired infections, 2000–2018 (ECDC, 2018; Ponce de Leo´n-Rosales et al. 2000; Rosenthal et al. 2003; Ortíz et al. 2014; Murni et al. 2015; Iwuafor et al. 2016; Mitharwal
et al. 2016; Phu et al. 2016; Taylor et al. 2016; Yakovlev et al. 2016; Yallew et al. 2016; Chiang et al. 2018; Braga et al. 2019).
АННОТАЦИЯ
Пациенты в отделениях интенсивной терапии
(ОИТ) подвергаются высокому риску развития инфекций, связанных с оказанием
медицинской помощи (ИСМП) из-за высокой распространенности инвазивных процедур
и использования устройств, индуцированной иммуносупрессии, сопутствующих
заболеваний, «хрупкости» и пожилого возраста. За
последнее десятилетие наблюдается
снижение заболеваемости ИСМП, связанных с инвазивными процедурами и
устройствами. Тем не менее,
уровень инфекций, приобретенных в ОИТ остается высоким.
В этом контексте появление новых патогенов еще больше усложняет лечение и угрожает его результатам.
Кроме того, пандемия SARS-CoV-2 (COVID-19)
высветила проблему, которую создает новый патоген для оптимизации мер профилактики как в отношении риска
воздействия на медицинский персонал, так и в отношении необходимости поддержания
качества медицинской помощи. Медсестры
ОИТ занимают особое место в профилактике и лечении ИСМП, поскольку они
участвуют в базовом гигиеническом уходе, реализации инициатив по улучшению качества оказания помощи, в том числе рационального использования антибиотиков, а
также обеспечивают адекватный забор материала для микробиологического исследования.
Появление более чувствительных
микробиологических методов и расширение наших знаний о взаимодействии больных в
критическом состоянии и их микробиоты заставляют
нас переосмыслить и определить лучшие стратегии диагностики, лечения и
профилактики ИСМП в ОИТ.
В этом междисциплинарном экспертном обзоре
обобщена недавняя эпидемиология ИСМП в ОИТ, обсуждено место современных
микробиологических методов в диагностике
данных инфекций, рассмотрены операционные и эпидемиологические определения и
переопределено место некоторых спорных профилактических мер, включая импрегнированные
противомикробными препаратами устройства, повязки для катетеров и жидкости для полоскания
рта на основе хлоргексидина. Наконец,
предлагаются рекомендации, которые могут
снизить заболеваемость и вспышки ИСМП в ОИТ.
Рекомендации для клинической практики
• Несмотря на усилия по профилактике, частота
ИСМП остается высокой в структуре заболеваемости и летальности.
•
COVID-19 может способствовать возникновению вторичных инфекций, таких как
инфекция кровотока и пневмония, предположительно из-за более высокой тяжести
заболевания и чрезмерной нагрузки на персонал.
• Доля предотвратимых ИСМП зависит от
популяции пациентов, соблюдения мер профилактики и типа инфекции, например, катетер-ассоциированных
инфекций кровотока, можно легко избежать
при использовании комплексных мер профилактики, основанных на доказательных данных.
• Губки, пропитанные хлоргексидином,
снижают риск грамположительной бактериемии, но их использование сопровождается риском
повышения устойчивости к этому антисептическому средству, особенно у грамотрицательных
бактерий. Поэтому их использование должно быть зарезервировано для вспышек.
• Использование хлоргексидина для ухода за
полостью рта должно быть ограничено группами пациентов с наличием показаний,
основанных на доказательствах, учитывая возможную связь с летальностью.
Введение
ИСМП представляют собой серьезное бремя для
общественного здравоохранения (WHO, 2012). Ежегодно
во всем мире от ИСМП умирают более 140 000 человек (WHO, 2011).
Опросы в США
показывают, что 30% ИСМП возникают в ОИТ (Magill et
al., 2014; CDC, 2016). Более
того, ИСМП продлевают пребывание в ОИТ и
общую длительность госпитализации, увеличивают потребление антибиотиков и стоимость лечения.
Возникновение ИСМП является результатом сложного
взаимодействия факторов патогена (вирулентность, устойчивость к антибиотикам),
факторов хозяина (сопутствующая патология, острое заболевание), факторов
лечения (инвазивные устройства, селективное давление антибиотиков), процессов
организации здравоохранения (кадровое
обеспечение, профилактические меры) и даже климатологических
условий (Myny et al., 2005; Depuydt et al., 2006a,
2006b; Guzmґan-Herrador et al., 2016; Blot et al., 2021).
Хотя большинство возбудителей ИСМП эндогенное происхождение, ряд патогенов могут быть приобретены в процессе лечения от
человека или из окружающей среды (Siegel et al.,
2007). Медицинские сестры ОИТ играют ключевую
роль в профилактике и лечении ИСМП, поскольку они
участвуют в базовом гигиеническом уходе, клиническом наблюдении за участками,
наиболее подверженными инфицированию (например, мест введения катетера или
хирургических ран), а также в мониторинге системных признаков инфекции, реализации
инициатив по улучшению мер профилактики, правильном заборе проб для микробиологического исследования и ряда аспектов рационального использования
антибиотиков.
Постоянные усилия по предотвращению
инфекций привели к значительному снижению ИСМП, связанных с устройствами.
Тем не менее, ожидается, что в ближайшие годы бремя ИСМП
будет увеличиваться в результате интенсификации лечения, старения населения,
роста распространенности тяжелых сопутствующих заболеваний у пациентов ОИТ и
продолжающегося распространения микроорганизмов с множественной лекарственной
устойчивостью (МЛУ) в ОИТ, стационарах и даже внебольничной популяции (Dimopoulos et al., 2013; Blot et al., 2019a).
Тем временем в
организации работы сказывается постоянная нехватка высококвалифицированных
медсестер (Anders, 2021).
Изменение
эпидемиологии инфекций, приобретенных в ОИТ
Понимание эпидемиологии и динамики
инфекции необходимо для быстрого выявления пациентов с высоким риском или потенциально
угрожающих ситуаций. Из-за
индивидуальных и коллективных последствий инфекции и антибиотикорезистентности
от всего коллектива ОИТ требуется высокий уровень бдительности и соблюдение
профилактических мер. Тем не менее, по
сравнению с врачами ОИТ, медсестры больше всего подвержены прямому контакту с
пациентом и имеют практические возможности для обеспечения эффективного
соблюдения мер профилактики.
Распространенность ИСМП различается в
разных госпиталях и странах (Fig. 1). Различия могут быть связаны с характеристиками
пациентов, эпидемиологическими особенностями и организационными факторами (Rodríguez-Acelas et al., 2017).
Факторы на уровне пациента включают возраст,
сопутствующие заболевания (особенно иммуносупрессию), тяжесть заболевания,
продолжительность госпитализации и воздействие инвазивных устройств и процедур.
Помимо факторов хозяина, организационные факторы,
такие как большая рабочая нагрузка и низкое качество инфекционного контроля связаны
с более высоким риском ИСМП и MDRO acquisition
(Penoyer, 2010; Kelly et al., 2013; Lee et al.,
2018; Jansson et al., 2019). Соблюдение мер
инфекционного контроля снижает как риск
ИСМП, так и риск инфицирования полирезистентными возбудителями (Rello et al.; 2013 Blot, 2008; Nseir et al., 2011).
Наиболее частыми инфекциями в ОИТ являются
пневмония (включая вентилятор-ассоциированную пневмонию (ВАП), инфекции области
хирургического вмешательства (ИОХВ), катетер-ассоциированные инфекции кровотока
(КАИК) и катетер-ассоциированные инфекции мочевыводящих путей (КАМВП) (Vincent et al., 2009; Vogelaers и др., 2010).
Внутрибольничная пневмония является
наиболее распространенной и тяжелой формой ИСМП (Walter
et al., 2018). В недавнем
многоцентровом международном проспективном обсервационном исследовании в 114 ОИТ
частота вентилятор-ассоциированного трахеобронхита и ВАП на исходном уровне
была одинаковой (320 [11%; 10,2/1000 дней на ИВЛ] и 369 [12%; 8,8/1000 на ИВЛ],
p = 0,48) (Martin-Loeches et al., 2015).
Из-за более широкого использования неинвазивной и
высокопоточной вентиляции недавние исследования подчеркивают важность внутрибольничной
пневмонии вне ИВЛ, обнаруживаемой у 4,5/1000 пациенто-дней (Saied et al., 2020).
Внутрибольничные интраабдоминальные
инфекции (ИАИ) (послеоперационный и
третичный перитонит) составляют до 65% всех абдоминальных инфекций, наблюдаемых
у пациентов ОИТ (WHO, 2012). ИАИ
у пациентов в ОИТ выдвигают на первый план проблему устойчивости к
антибиотикам, которая в равной степени проявляется как при внебольничной
инфекции, так и при ИСМП (Blot et al., 2019b;
Vogelaers et al., 2021), требующей раннего хирургического контроля
источника и соответствующей антимикробной терапии (Augustin et al., 2010; Blot et al.,
2012; De Waele et al., 2014; Blot et al., 2019b).
В отличие от глобальной заболеваемости
ИСМП, уровень КАИК, вызванной карбепенемрезистентыми возбудителями снизился в нескольких странах за последнее
десятилетие. Несколько авторов
сообщают о показателях 1,0/1000 катетер-дней или меньше благодаря
оптимизированным процессам сестринского ухода и техническим инновациям (Timsit et al., 2018; Eggimann et al., 2019).
Частота возникновения ИСМП в ОИТ, как
правило, выше, а полирезистентые микроорганизмы, особенно грамотрицательные (Fig. 2), более распространены в странах с низким и
средним уровнем экономического развития по сравнению со странами с высоким экономическим
уровнем (Sakr et al., 2018; WHO, 2011). В
настоящее время Klebsiella pneumoniae, продуцирующая карбапенемазы (KPC),
эндемична в Израиле, Греции, Италии, Польше, Китае, Бразилии, Аргентине и
Колумбии и встречается почти во всех странах Европы (Albiger
et al., 2015). Аналогичным
образом, Candida auris в настоящее время распространена в Индии и на Ближнем
Востоке, а многочисленные вспышки зарегистрированы в США, Европе, Азии и других
странах (Satoh et al., 2009; Jeffery-Smith et al.,
2018). Инфекции,
вызванные полирезистентыми возбудителями, могут увеличить смертность и
продолжительность пребывания в стационаре, возможно, из-за задержек с
назначением адекватной антибактериальной терапии, но это спорный вопрос (Tabah et al., 2012; Stewardson et al., 2016)
Полирезистетные бактерии и Candida — не
единственные патогены, приобретаемые в ОИТ. Недавние
усовершенствованные методы диагностики помогли диагностировать приобретенные
респираторные вирусы при госпитальной пневмонии.
В недавнем исследовании грипп (27%) и риновирус (27%)
были двумя наиболее распространенными респираторными вирусами, выделенными при
госпитальной пневмонии в ОИТ (Loubet et al., 2017).
ОИТ являются зонами потенциального высокого риска
передачи таких респираторных вирусов (Grund et al.,
2010). Наконец, из-за
наличия множественных факторов риска пациенты в ОИТ подвергаются более высокому
риску инфекций Clostridium difficile с распространенностью 2% и 11%
среди пациентов с диареей в ОИТ (Karanik et al.,
2016).
Влияние инфекций,
приобретенных в ОИТ, на долгосрочные исходы
Изменения врожденного и адаптивного
иммунитета в результате ИСМП сохраняются
в течение длительного периода после клинического выздоровления.
Такие изменения коррелируют с долгосрочной смертностью
(Delano and Ward, 2016).
Пациенты, перенесшие внутрибольничный сепсис, имеют
повышенный риск смерти на срок до двух лет (Winters
et al., 2010).
В тайваньской когорте из 3070 пациентов с ИСМП,
вызванными золотистым стафилококком, инфекция была связана с 20-процентным
увеличением смертности в течение года (Su et al., 2013). Инфекция
также была связана с повышенным риском зависимости от диализа на 2,6% и
избыточным риском зависимости от вентилятора на 7,3% в течение одного года.
Эти грубые пропорции очень похожи на наблюдаемые в
когортном исследовании в Европе (Stewardson et al.,
2016).
У 17 536 пожилых
пациентов, поступивших в ОИТ воздействие КАИК и ВАП, было сходно с таковым при
сепсисе и пневмонии (Dick et al., 2012).
Внутрибольничный сепсис и пневмония были связаны с
повышенным риском смерти в течение одного года. Пневмония
также была связана с увеличением частоты обращений за медицинской помощью,
длительной госпитализацией и смертностью в течение пяти лет.
Пациенты неврологических ОИТ являются еще одной
группой с особенно высоким риском ИСМП. В
большой проспективной когорте пациентов ОИТ с травмой спинного мозга частота
внутрибольничной пневмонии/раневых инфекций составила 47%, что было связано с
более низким приростом функциональной моторной автономии через пять лет и
повышенной смертностью через 10 лет (Kopp et al. ., 2017).
Точно так же пневмония у больных после инсульта была связана с 50-процентным
увеличением риска смерти в течение одного года среди выживших в ОИТ (de Montmollin et al., 2019).
Иммуносупрессия и
инфекции, приобретенные в ОИТ
Иммуносупрессия,
связанная с госпитализацией в ОИТ
Иммуносупрессия, связанная с критическим
состоянием, часто встречается у пациентов ОИТ, страдающих любыми острыми
заболеваниями (Deknuydt et al., 2013; Roquilly et
al., 2017). У пациентов в ОИТ обнаруживаются функциональные изменения
миелоидных клеток (дендритов, моноцитов и макрофагов), врожденных лимфоцитов
(естественные киллеры, натуральные киллеры Т-клетки) и обычных лимфоцитов (Т- и
В-клетки) (Hotchkiss et al., 2013b).
Пациенты ОИТ с внебольничной или госпитальной пневмонией демонстрируют различные реакции транскрипции (van Vught et al., 2016), соответствующие
функциональным изменениям их иммунной системы. Кроме того, критическое состояние
нарушает нормальный баланс между иммуногенными и толерогенными реакциями. Например,
легкие естественным образом толерантны к инородному материалу, чтобы свести к
минимуму острое воспаление в ответ на вдыхаемые частицы (Roquilly et al., 2019), но эта естественная толерантность
усугубляется иммунной дисфункцией при критических состояниях, что делает
пациентов особенно восприимчивыми к пневмонии (Fig. 3).
Интересно, что риск госпитальной
пневмонии прямо коррелирует с тяжестью иммунных изменений пациентов, включая:
(1) степень снижения экспрессия человеческого лейкоцитарного антигена-DR (HLA-DR) на циркулирующих моноцитах (Hotchkiss et al., 2013a); (2) увеличение продукции иммуносупрессивных цитокинов, таких
как IL-10 (Roquilly et al., 2014), и (3) истощение пула
Т-лимфоцитов (Venet et al., 2013).
Иммуносупрессия,
связанная с основным заболеванием
Пациенты с онкологическими и
гематологическими заболеваниями часто нуждаются в госпитализации в ОИТ в
результате инфекции, токсичности лечения и поражения органов в результате злокачественного новообразования (Schelenz et al., 2013; Marin et al., 2014; Taplitz et
al., 2018). Инфекционный риск
у онкологических больных связан с дефектами врожденного или адаптивного
иммунитета, обусловленного либо злокачественным
новообразованием как таковым, либо цитотоксическими эффектами лечения (Fig. 4) (Talcott
et al., 1988).
Нейтропения, особенно длительная (>7 дней), является основным фактором
риска инфекции и требует защитной изоляции (Freifeld
et al., 2011). Другие факторы
также могут играть важную роль (Table 1) (Freifeld
et al., 2011; Taplitz et al., 2018). Острые
гематологические и миелодиспластические синдромы имеют повышенный инфекционный
риск из-за инфильтрации костного мозга злокачественными новообразованиями.
Химиотерапия и реакция «трансплантат против хозяина»
способствуют оппортунистической инфекции за счет нарушения целостности
слизистой оболочки (Freifeld et al., 2011; Taplitz
et al., 2018).
Солидные опухоли в большей степени сопровождаются
локальными осложнениями, связанными или не связанными с операцией по удалению
опухоли, а не с недостаточностью костного мозга или цитотоксическими эффектами
лечения (Table 2)
(Talcott et al., 1988; Freifeld et al., 2011;
Taplitz et al. , 2018). Наконец,
пациенты с ослабленным иммунитетом, независимо от причины, нуждаются в
специальных мерах по контролю риска ИСМП (Table 2).
Роль инфекции
COVID-19 в риске ИСМП
COVID-19 высветила проблему профилактических мер для защиты лиц,
осуществляющих уход, и пациентов от заражения при сохранении оптимального
стандарта качества медицинской помощи (Jansson et
al., 2020). Любая вспышка ИСМП
будь то среди клиницистов или пациентов, должна потребовать расследования пути инфицирования
и причины возникновения (Mongin et al., 2021; Vuichard-Gysin et al., 2021).
Первоначально в основе профилактики лежит знание
способа заражения. Некоторые
действия, такие как процедуры с образованием аэрозолей, сопряжены с
неотъемлемым риском передачи инфекции и требуют более совершенных профилактических
мер (Tran et al., 2012; Lormans et al., 2021).
Как и для других респираторных вирусов,
для SARS-CoV-2, по-видимому, преобладает прямая передача, однако поверхности,
по-видимому, контаминированы в 27–45% случаев, что требует специальной очистки
(Mendes et al., 2021).
COVID-19 значительно увеличил заболеваемость ВАП с
совокупной оценочной заболеваемостью 45,4% (95% ДИ 37,8–53,2%) (Ippolito et al., 2021).
Острый респираторный дистресс-синдром (ОРДС),
связанный с COVID-19, связан с более глубокой гипоксией, чем ОРДС другого
происхождения, что приводит к увеличению продолжительности искусственной
вентиляции легких и более частому применению положения лежа на животе, что
является факторами риска ИСМП и КАИК (Luyt et al., 2020; Razazi et al., 2020;
Maes et al., 2021; Rouzґe et al., 2021).
COVID-19 увеличивает риск ИСМП из-за
множества факторов: менее строгого использования стандартных стратегий
профилактики, иммунных нарушений, связанных с заболеванием и терапией, более длительной
ИВЛ и седации, более частой вентиляции в прон-позиции и более высокому риску
инфаркта легкого, ассоциированного с суперинфекцией.
Переполненность ОИТ и их укомплектованность недостаточно
подготовленным медицинским персоналом может снизить качество соблюдения
программ профилактики ИСМП (Reper et al., 2020;
Arabi et al., 2021; Reper et al., 2021; Wicky et al., 2021).
Оценка роли
состава микробиоты в риске ИСМП
Недавние достижения в микробиологии и
метагеномике (т. е. секвенирование всех нуклеиновых кислот в образце) привели к
лучшему пониманию микробиоты пациентов, ее изменений во время пребывания в ОИТ
и того, как это может повлиять на вероятность и характер ИСМП в ОИТ.
Понимание микробиоты кожи и полости рта, особенно
когда речь идет об использовании антисептических средств, потенциально
снижающих резистентность к колонизации полирезистентными микроорганизмами,
особенно важно для сестринской практики. Тем не менее, мало
что известно о роли комменсальной флоры кожи и полости рта в динамике ИСМП в
ОИТ.
Микробиота кишечника и легких наиболее
изучена у пациентов в ОИТ. Микробиота
кишечника служит защитой от колонизации полирезистентными бактериями и их персистенции
и помогает предотвратить инфекции (Vollaard and
Clasener, 1994; Buffie and Pamer, 2013; Gosalbes et al., 2016; Caballero et
al., 2017; Leo et al., 2019). Желудочно-кишечный
тракт является основным резервуаром для большинства бактериальных патогенов,
связанных с ИСМП (Sommerstein et al., 2019).
Ректальная колонизация грамотрицательными бактериями
является независимым фактором риска как колонизации дыхательных путей, так и
новой грамотрицательной инфекции в ОИТ (Frencken et
al., 2018). Действительно,
грамотрицательные микроорганизмы из кишечника получают доступ к ротоглотке
после интубации и быстро «перерастают» комменсальные штаммы ротоглотки, что
увеличивает риск ВАП (Freedberg et al., 2018;
Sommerstein et al., 2019).
Нормальная микробиота легких варьирует в
зависимости от состояния здоровья и заболевания.
У пациентов с ИВЛ меньше различий в образцах нижних и
верхних дыхательных путей по сравнению со здоровыми субъектами, что может увеличивать
риск пневмонии (Kelly
et al., 2016; Langelier et al., 2018; Emonet et al., 2019).
Диагностика ИСМП:
оценка разрыва между эпидемиологическими и прикроватными определениями
Первый шаг в борьбе с ИСМП в ОИТ состоит
во внедрении надежной системы эпиднадзора для отслеживания инфекций и выявления
факторов риска, связанных с ИСМП. Для
всех ИСМП сосуществуют два определения, ориентированные на разные цели:
эпидемиологическое определение для целей эпиднадзора и клиническое определение
для принятия решений у постели больного.
Эпидемиологические данные разрабатываются для
информирования об эффективных программах профилактики инфекций и борьбы с ними.
Их также можно использовать в качестве самостоятельных
показателей качества для сравнительного анализа.
Клинические определения предназначены для быстрого и точного распознавания ИСМП для
принятия своевременных решений о лечении у постели больного.
Интеллектуальные информационные технологии могут
служить значимым инструментом для согласования ожиданий и требований для обоих
определений и удовлетворения потребностей различных пользователей.
Такие инструменты могут упростить и ограничить изменчивость
процесса наблюдения, а также повысить эффективность раннего выявления пациентов
с ИСМП. Однако
рассмотрение одного и того же объекта под разными углами может увековечить
продолжающуюся путаницу между наблюдением и клиническим диагнозом.
Диагностика вентилятор-ассоциированных
инфекций нижних дыхательных путей Вентилятор-ассоциированные
инфекции нижних дыхательных путей включают ВАП и вентилятор-ассоциированный
трахеобронхит (Timsit et al., 2017). ВАП определяется
как инфекция паренхимы легкого, возникшая, по крайней мере, через 48 часов
после начала ИВЛ. Вентилятор-ассоциированный трахеобронхит представляет собой
промежуточный процесс от колонизации до ВАП. Текущий диагноз вентилятор-ассоциированного
трахеобронхита основывается на отсутствии рентгенологических инфильтратов
грудной клетки и наличии признаков, соответствующих респираторному воспалению,
наряду с ,по крайней мере, одним микробиологическим критерием. Клинические
критерии ИВЛ-ассоциированных инфекций нижних дыхательных путей субъективны
(например, рентгенологические инфильтраты); как клинические, так и микробиологические
критерии плохо коррелируют с гистологическими изменениями, что приводит к
высоким показателям гипердиагностики и избыточного лечения (Tejerina et al., 2010; Nussenblatt et al., 2014; Kalil et
al., 2016).
Диагностика катетер-ассоциированных инфекций
кровотока
Окончательный диагноз КАИК требует
микробиологического подтверждения того, что внутрисосудистый катетер является
источником бактериемии, и исключения альтернативных очагов инфекции (Mermel et al., 2009).
Это определение делает упор на специфичность диагноза,
но сложно в использовании, поскольку требует
специализированного микробиологического тестирования, которое не всегда
доступно. У постели больного
диагноз КАИК часто омрачается неуверенностью в отношении того, действительно ли
сосудистый катетер является источником инфекции, и необходимостью различия между контаминацией и инфекцией,
вызванной комменсалами кожи (Tomlinson et al.,
2011; Cherifi et al., 2013).
Надлежащее наблюдение медсестрой за местом
введения катетера при его использовании имеет важное значение, поскольку
наличие ≥1 местного признака (покраснение, экссудация) повышает вероятность КАИК в первые семь дней после установки катетера
(Buetti et al., 2021). В целях
эпиднадзора CDC-NHSN США предложила упрощенную концепцию КАИК (CDC, 2019), которая, однако, приводит к
гипердиагностике и искажает истинную частоту КАИК (CDC,
2019; Woeltje et al., 2008; Tomlinson et al., 2011; Dixon-Woods et al. , 2012).
Диагностика
инфекций области хирургического вмешательства (ИОХВ)
Определения CDC-NHSN для ИОХВ (поверхностная
и глубокая инфекция разреза и инфекция орган/пространство) наиболее часто
используются в литературе (Horan et al., 1992).
Непосредственное наблюдение медсестры имеет решающее
значение. Критериями ИОХВ
являются локализованный отек или эритема, гнойное отделяемое из операционной
раны и микробиологическое подтверждение инфицирования.
ВОЗ заявила, что не существует единого объективного золотого
стандарта диагностики хирургической
раневой инфекции (Allegranzi et al., 2016).
ИОХВ также может указывать на
продолжающийся абдоминальный сепсис после операции на органах брюшной полости (Pusajґo et al., 1993).
Пациенты с инфекциями мягких тканей (включая ИОХВ) в ОИТ
подвержены высокому риску диагностических ошибок, в том числе гиподиагностике,
что приводит к удвоению внутрибольничной смертности (Abe
et al., 2019). Идеального
инструмента для ранней диагностики ИОХВ у пациентов ОИТ не существует.
Существуют ограниченные послеоперационные меры
профилактики ИОХВ, относящиеся к ОИТ. Ключевые
меры включают оптимальную антибиотикопрофилактику, ежедневный осмотр раны и
соответствующий уход за раной для предотвращения экзогенной контаминации.
Различие между
колонизацией и инфекцией
Наличие потенциально патогенных и полирезистентных
микроорганизмов в микробиологических образцах, особенно из нестерильных
участков тела, не является доказательством инфекции. Интерпретация
микробиологического результата будет зависеть от пяти факторов: (1)
клинического контекста (признаки инфекции?), (2) места отбора проб (стерильный участок?),
(3) микробного вида (патогенного или возможного контаминанта?) , (4)
предполагаемое место инфекции (часто колонизируемая зона?), (5) чувствительность
и специфичность микробных культур с учетом предшествующего воздействия
антибиотиков, источника образца и микробиологического метода. Увеличение числа
микробиологических проб без четко определенных клинических показаний может
привести к чрезмерному использованию антибиотиков (Tambyah
and Maki, 2000; Nussenblatt et al., 2014).
Однако при разумном использовании с
ограничением назначения антибиотиков регулярный отбор проб для целей
микробиологического надзора может дать актуальные и персонализированные данные
для руководства эмпирическим назначением антибиотиков (Table ) (Depuydt et al., 2008; Brusselaers et al., 2013; Zahar et
al , 2019).
Возрастающая роль
микробиологических лабораторий в диагностике и последующем наблюдении за ИСМП
Бактериологические лаборатории
претерпевают кардинальные изменения. Лабораторная
автоматизация позволяет считывать культуральные чашки в режиме реального времени:
пробы, приготовленные утром, могут дать жизнеспособные результаты к полудню, а
антибиотикограмма будет доступна на следующее утро.
Еще одной точкой эволюции являются мультиплексные,
автоматизированные и быстрые анализы полимеразной цепной реакции (ПЦР).
Теперь они доступны и называются
«синдромными тестами», поскольку нацелены не только на бактерии, но и на
вирусы, паразиты и грибки (Ramanan et al., 2018).
Эти тесты, как правило, требуют минимальной ручной
подготовки и позволяют получить результат в короткие сроки (Fig. 5), что дает возможность
тестирования по месту оказания медицинской помощи или синдромного тестирования
для раннего выявления ИСМП, а ранние результаты чувствительности позволяют
своевременно ввести соответствующие антибиотики.
Тем не менее, обилие целей поднимает вопрос о «нежелательных»
тестированиях. Например,
клиницисты должны ломать голову над тем, как интерпретировать присутствие
вирусов при первоначальном подозрении на бактериальную ВАП, особенно в свете
исследований, связывающих положительные тесты на вирусы с плохим исходом (Loubet et al., 2017).
Развертывание синдромных тестов должно сопровождаться
тесным диалогом между реаниматологами и микробиологами.
Еще более сложным будет появление клинической метагеномики.
Это относится к секвенированию нуклеиновых
кислот, присутствующих в клиническом образце, с целью выявления патогенов и
определения их чувствительности к противомикробным препаратам (Chiu and Miller, 2019).
Метагеномное секвенирование идентифицирует гораздо
больше бактерий, чем обычные культуральные методы, когда микробиологи сообщают
только о наиболее вероятных патогенах. Эти
незарегистрированные бактерии, а также реакция хозяина могут помочь улучшить
диагностику инфекций нижних дыхательных путей. Метагеномное
секвенирование в сочетании с инструментами машинного обучения, обеспечивающими
(1) наиболее вероятные патогенные бактерии, (2) разнообразие окружающего
бактериального сообщества и (3) реакцию хозяина (через транскриптом), может
точно предсказать возникновение пневмонии (Langelier
et al. др., 2018).
Вирусы в образцах:
патогены или «пассажиры»?
Выявление вирусов молекулярными методами
при подозрении на ИСМП является обычным явлением.
Однако определение их клинического значения
представляет собой сложную задачу. Из-за
иммунопаралича, следующего за начальной провоспалительной реакцией на агрессию,
латентные вирусы, такие как Herpesviridae, могут реактивироваться у пациентов в
ОИТ (Hotchkiss et al., 2013a).
Вирус простого герпеса, цитомегаловирус, а также вирус
Эпштейна-Барра часто обнаруживаются в легких или крови пациентов ОИТ (до 50%),
и их реактивация связана с повышенной заболеваемостью и смертностью (Luyt et al., 2007; Limaye et al. , 2008; Coisel et al., 2012;
Libert et al., 2015; Ong et al., 2017; Li et al., 2018).
Точное значение этих реактиваций
обсуждается. Эти вирусы могут
иметь истинную патогенность и вызывать повреждение органов, тем самым играя
непосредственную роль в заболеваемости и смертности, наблюдаемых при их
реактивации. Однако они также
могут быть «сторонними наблюдателями», а реактивация является вторичной по
отношению к тяжести заболевания. Вопрос
остается без ответа, поскольку данные о потенциальном преимуществе
противовирусного лечения неубедительны. Респираторные
вирусы (риновирус, грипп, аденовирус и другие) в последнее время вызывают ИСМП
у пациентов, находящихся или не находящихся на ИВЛ (Vincent
et al., 2009; Nseir et al., 2011; Loubet et al., 2017; Shorr et al. , 2017).
Присутствие вирусов при ВАП связано с
неблагоприятными исходами (Grund et al., 2010).
Перекрестная передача респираторных вирусов, таких как
грипп, в настоящее время хорошо выявляется с помощью ПЦР и может быть причиной
10 % госпитализаций в ОИТ по поводу гриппа (Alvarez-Lerma
et al., 2017) и растущего числа эпизодов тяжелого ОРДС, особенно
у пациентов с ослабленным иммунитетом.
Однако их глобальное влияние на заболеваемость и
смертность неизвестно.
Предотвратимость
ИСМП в ОИТ
Большинство экспертов сходятся во мнении,
что значительную долю инфекций, связанных с устройствами, можно предотвратить с
помощью рекомендаций, основанных на фактических данных, и комплексов профилактических
мер, оптимизирующих приверженность персонала к соблюдению рекомендаций (Blot et al., 2014; van der Kooi et al., 2018; Labeau,
2020). В
первом систематическом обзоре, охватывающем период с 1990 по 2002 г.,
оценивалась доля потенциально предотвратимых ИСМП по данным мультимодальных
интервенционных исследований (Harbarth et al., 2003).
Оценка 30 отчетов показала, что существует большой
потенциал для снижения показателей ИСМП, от минимального эффекта снижения в 10%
до максимального эффекта в 70%, в зависимости от условий, дизайна исследования,
исходных показателей инфицирования и типа инфекции.
Наиболее важный эффект снижения был
выявлен для КАИК.
Во втором систематическом обзоре, проведенном в 2011
г., утверждалось, что до 65–70 % случаев КАИК и КАИМВП и 55 % случаев ВАП и
ИОХВ можно предотвратить с помощью современных научно обоснованных стратегий,
оценки, которые вызвали некоторые споры (Umscheid
et al., 2011). Совсем недавно систематический обзор (Schreiber et al., 2018) исследований,
опубликованных в период с 2005 по 2016 год, показал несколько более низкую долю
предотвратимых инфекций. Ни в одном из упомянутых
систематических обзоров не проводилась стратификация анализа по типу
микроорганизмов; таким образом,
сохраняется неопределенность в отношении возможности предотвращения экзогенной
перекрестной инфекции различными полирезистентыми микроорганизмами.
Образовательные программы для медицинских
работников, встроенные в комплексную программу повышения качества, являются
краеугольным камнем любого подхода к профилактике (Fig. 6). Что
касается инфекций, связанных с устройствами, особое внимание следует уделять ограничению
их использования и времени пребывания инвазивных устройств (Buetti and Timsit, 2019), а их необходимость
необходимо оценивать ежедневно (Vazquez Guillamet
and Kollef, 2018).
Должны ли мы использовать активные
антисептики/антибиотики для профилактики ИСМП?
Многочисленные исследования связывают
возникновение ИСМП с предшествующей колонизацией и, в некоторых случаях, с
избыточным ростом эндогенных патогенных бактерий (Johanson
et al., 1979; Blot et al., 2005; Brusselaers et al., 2012; Frencken et al.,
2018).
Использование антисептиков (в основном
хлоргексидина) и антибиотиков для профилактики ИСМП в ОИТ показало
потенциальную пользу, несмотря на опасения по поводу повышения уровня
бактериальной резистентности. В
нескольких исследованиях рассматривалась роль кожной, пищеварительной и
ротоглоточной деколонизации в снижении риска ИСМП в ОИТ, и подчеркивалось, что
рациональное использование этих мероприятий в конкретных ситуациях может быть
полезным, если их применять продуманно.
Роль хлоргексидина
глюконата в профилактике ИСМП в ОИТ
Хлоргексидина глюконат (ХГГ) обладает
широким антимикробным действием и пролонгированным остаточным эффектом.
Он доступен в виде предварительно упакованных губок,
пропитанных ХГГ, в виде антисептического мыла или растворов и жидкостей для полоскания
рта. Губки, пропитанные ХГГ,
значительно снижают частоту грамположительной, но не грамотрицательной
бактериемии (Afonso et al., 2016; Eggimann et al.,
2019).
Их применение связано с повышенным риском
инфекций, вызванных бактериями с пониженной чувствительностью к ХГГ.
На сегодняшний день не было отмечено никаких
клинических последствий (Afonso et al., 2016),
но реализация универсальной деколонизации кожи на основе ХГГ требует тщательной
оценки. Необходимо
провести испытания, изучающие безопасность, экономическую эффективность и
последствия систематического использования губок для пациентов с высоким риском
грамотрицательных инфекций (Dray et al., 2019).
Учитывая угрозу роста устойчивости к ХГГ,
использование губок, пропитанных ХГГ, может быть зарезервировано для борьбы со
вспышками, а не в рутинной практике. Как
губки, пропитанные ХГГ, так и повязки с гелем ХГГ использовались для ухода за
постоянными внутрисосудистыми устройствами и привели к снижению риска
внутрисосудистых инфекций до 60% (Timsit et al.,
2009, 2012; Ульман и др., 2016; Эггиманн и др., 2019).
Их использование было рекомендовано у
взрослых пациентов группы высокого риска, когда вероятность инфекции остается высокой, несмотря на
применение соответствующих мероприятий ухода за катетером.
Уход за полостью рта ХГГ широко распространен в ОИТ для
интубированных пациентов, хотя его польза для снижения риска пневмонии была доказана
только у кардиохирургических пациентов (Labeau et
al., 2011; Klompas et al., 2014). Его
использование было недавно оспорено. Во-первых,
ополаскиватель для рта с 2% раствором ХГГ оказался триггером для обратимого
орального мукозита у 9,8% пациентов (Plantinga et
al., 2016). Во-вторых, метаанализы
показали, что использование ХГГ для
обработки полости рта увеличивает риск смерти (Klompas
et al., 2014; Price et al., 2014).
Кроме того, недавнее крупное
обсервационное когортное исследование показало, что уход за полостью рта с
помощью ХГГ был связан с повышенной смертностью (Deschepper
et al., 2018). В большой группе
пациентов ОИТ из 186 больниц уход за полостью рта ХГГ также оказался
независимым фактором риска сепсиса и смерти (Parreco
et al., 2020). Было высказано
предположение, что эрадикация микробиома полости рта с использованием
пероральных антисептиков приводит к нарушению биодоступности оксида азота, что
подвергает пациентов риску опасных для жизни осложнений, таких как ишемическая
болезнь сердца и сепсис. (Blot, 2021).
If this
hypothesis proves sound, the deleterious effect would be valid for all
antiseptic mouthwash solutions and not exclusively those based on CHG. While
awaiting more insights it seems wise to limit the use of CHG mouthwash to evidence-based
indications.
Moreover,
a recent study demonstrated that omitting CHG mouthwashes from the oral care
routine does not impact ICU mortality while improving oral health scores (Dale
et al., 2021).
Если эта гипотеза подтвердится, вредный
эффект будет предположен для всех антисептических растворов для полоскания рта,
а не только для тех, которые основаны на ХГГ. В
ожидании дополнительных сведений представляется разумным ограничить
использование растворов ХГГ для
полоскания рта CHG показаниями, основанными на фактических данных.
Более того, недавнее исследование показало, что
исключение ХГГ-содержащих средств из рутинной практики ухода за полостью рта не
влияет на смертность в ОИТ (Dale et al., 2021).
Какова роль материалов, импрегнированных антимикробными
средствами?
Для предотвращения ВАП, КАИК и КАИМВП были предложены материалы с антиинфекционной
пропиткой. Метаанализ 27
рандомизированных контролируемых клинических исследований, оценивающих клиническую
эффективность центральных венозных катетеров, обработанных противоинфекционными
агентами, показал значительное снижение КАИК по сравнению с катетерами без
покрытия (Hockenhull et al., 2009).
Катетеры, пропитанные противомикробными препаратами,
кажутся особенно подходящими, когда фоновая частота КАИК высока, несмотря на
соблюдение комплексной стратегии профилактики инфекций (Timsit et al., 2018).
A recent
meta-analysis based on studies performed in settings with a low prevalence of
antibiotic resistance, concluded that SOD and SDD with intravenous antimicrobials
was associated with lower mortality rates, fewer HAIs, and less carriage of
MDROs (Wittekamp
et al., 2018, 2020). These results appear to only apply in settings with
low baseline levels of MDROs. The use of SOD and SDD without intravenous antimicrobials
was not associated with decreases in neither the rate of bacteremia due to MDRO
nor 28-day ICU mortality in countries where the prevalence of MDRO was higher (Wittekamp
et al., 2018).
Роль селективной
пищеварительной и оральной деконтаминации (СПД и СОД)
Недавний метаанализ, основанный на
исследованиях, проведенных в условиях с низкой распространенностью
антибиотикорезистентности, пришел к выводу, что СПД и СОД при внутривенном
введении противомикробных препаратов были связаны с более низкими показателями
смертности, меньшим количеством ИСМП и меньшим количеством носительства полирезистентных
микроорганизмов (Wittekamp et al., 2018, 2020).
Эти результаты, по-видимому, применимы только в
условиях с низкими исходными уровнями полирезистентых возбудетелей.
Использование СПД и СОД без внутривенного введения
противомикробных препаратов не ассоциировалось ни со снижением частоты
бактериемии, вызванной полирезистентными
микроорганизмами, ни с 28-дневной смертностью в ОИТ в странах, где
распространенность полирезистентных бактерий была высокой (Wittekamp et al., 2018).
Использование противоинфекционных средств
для предотвращения инфекции требует тщательной оценки риска и пользы как для
пациента, так и для общества. На
Fig. 7 представлена оценка риска и пользы по
сравнению с программой профилактики и инфекционного контроля, которая считается
золотым стандартом в борьбе с инфекциями.
Вывод
ИСМП в ОИТ остаются причиной высокой
смертности, а их профилактика является основной задачей. Пожилой
возраст пациентов, сопутствующие заболевания и иммунодефицитное состояние обусловливают
постоянное увеличение частоты ИСМП, приобретенных в ОИТ, в некоторых центрах.
Хотя «Нулевой уровень ИСПМ» недостижим, наша цель
должна состоять в том, чтобы достичь самых низких пороговых значений, описанных
в литературе. Кроме того,
высокая распространенность резистентности к антибиотикам увековечивает персистенцию
ИСМП во всем мире. Их снижение
требует дальнейшего внедрения профилактических комплексов в сочетании с
программами рационального использования противомикробных препаратов.
Растущие знания о микробиоте, вероятно,
позволят в будущем внедрять новые профилактические меры, которые могут быть
основаны на внимании к комменсальной флоре (Hamilton
and Behal 2020), более четкого определения показаний для применения
пробиотиков или манипулировании микробиотой
(Young, 2016).
Новые диагностические инструменты помогут
нам лучше выявлять инфицированных пациентов. Однако
они потребуют тщательной оценки перед внедрением.
Наконец, стратегии обеззараживания и деколонизации,
вероятно, придется ограничить группами высокого риска, чтобы свести к минимуму
селекцию возбудителей, устойчивых к антисептикам.
Будущее профилактики в ОИТ, вероятно, будет основано
на нашей способности адаптировать политику и новые технологии к профилям риска конкретного
пациента.
References
Abe, T., Tokuda, Y., Shiraishi,
A., Fujishima, S., Mayumi, T., Sugiyama, T., et al., 2019. In-hospital mortality associated
with the misdiagnosis or unidentified site of infection at admission. Crit Care. BioMed Central 23 (1), 202–209.
Afonso, E., Blot, K., Blot, S., 2016. Prevention of hospital-acquired bloodstream infections through chlorhexidine gluconate-impregnated washcloth bathing
in intensive care units: a systematic review and meta-analysis of randomised crossover trials. Euro. Surveill.
21 (46), 30400.
Albiger, B., Glasner,
C., Struelens, M.J., Grundmann, H., Monnet, D.L., European Survey of Carbapenemase-Producing Enterobacteriaceae (EuSCAPE) working group, 2015. Carbapenemase-producing Enterobacteriaceae in Europe: assessment
by national experts from 38 countries, May 2015. Euro Surveill. European
Centre for Disease Prevention and Control 20 (45), 30062.
Allegranzi, B., Zayed,
B., Bischoff, P., Kubilay, N.Z., de Jonge,
S., de Vries, F., et al., 2016. New WHO recommendations on intraoperative and postoperative measures
for surgical site infection
prevention: an evidence-based global perspective. Lancet
Infect. Dis. 16 (12), e288–e303.
Alvarez-Lerma, F., Marín-Corral, J., Vil`a, C., Masclans, J.R., Loeches, I.M., Barbadillo, S., et al., 2017. Characteristics of patients with hospital-acquired influenza
A (H1N1) pdm09 virus admitted
to the intensive care unit.
J. Hosp. Infect. 95 (2), 200–206.
Anders, R.L., 2021. Patient safety time for federally mandated registered
nurse to patient ratios. Nurs. Forum. John Wiley & Sons Ltd.
Arabi, Y., Al-Shirawi, N., Memish, Z., Anzueto, A., 2008. Ventilator-associated pneumonia in adults in developing
countries: a systematic
review. Int. J. Infect. Dis. 12 (5), 505–512.
Arabi, Y.M., Azoulay, E´., Al-Dorzi, H.M., Phua, J., Salluh, J., Binnie, A., et al., 2021. How the COVID-19 pandemic
will change the future of critical care. Intensive Care Med. Springer Berlin Heidelberg 47, 282–291.
Augustin, P., Kermarrec,
N., Muller-Serieys, C., Lasocki, S., Chosidow, D., Marmuse, J.-P., et al., 2010. Risk factors
for multidrug resistant bacteria
and optimization of empirical antibiotic therapy in postoperative peritonitis. Crit. Care. BioMed Central Ltd 14 (1), R20.
Behari, A., Kalafatis, N., 2015. Incidence
and outcome of ventilator-associated
pneumonia in Inkosi Albert Luthuli and King Edward VIII Hospital surgical
intensive care units. South Afr. J. Crit. Care 31 (1), 16–18.
Blot, S., 2008. Limiting the attributable mortality
of nosocomial infection
and multidrug resistance in intensive
care units. Clin. Microbiol. Infect.
14 (1), 5–13.
Blot, S., 2021. Antiseptic mouthwash, the nitrate-nitrite-nitric oxide pathway, and
hospital mortality: a hypothesis generating review. Intensive Care Med. Springer Berlin Heidelberg 47, 28–38.
Blot, K., Bergs, J., Vogelaers, D., Blot, S., Vandijck,
D., 2014. Prevention of central line- associated bloodstream infections through quality improvement interventions: A systematic review and meta-analysis. Clin. Infect. Dis. Oxford University Press 59
(1), 96–105.
Blot, S., Depuydt,
P., Vogelaers, D., Decruyenaere, J., De Waele,
J., Hoste, E., et al., 2005. Colonization status and appropriate antibiotic
therapy for nosocomial
bacteremia
caused by antibiotic-resistant gram-negative bacteria in an intensive
care unit. Infect. Control Hosp. Epidemiol. 26 (6), 575–579.
Blot, S., De Waele, J.J., Vogelaers, D., 2012. Essentials for selecting antimicrobial
therapy for intra-abdominal infections. Drugs. Springer
International Publishing 72 (6), e17–e32.
Blot, S., Antonelli, M., Arvaniti, K., Blot, K., Creagh-Brown, B., de Lange, D., et al., 2019b.
Epidemiology of intra-abdominal infection and sepsis in critically ill
patients: “AbSeS”, a multinational observational cohort study and ESICM Trials
Group Project. Intensive Care Med. Springer
Berlin Heidelberg 45, 1703–1717.
Blot, K., Hammami,
N., Blot, S., Vogelaers, D., Lambert, M.-L., 2019a. Increasing
burden of Escherichia coli, Klebsiella pneumoniae, and Enterococcus faecium in hospital-acquired bloodstream infections (2000–2014): A national dynamic cohort
study. Infect. Control. Hosp. Epidemiol. Cambridge
University Press 40 (6), 705–709.
Blot, K., Hammami,
N., Blot, S., Vogelaers, D., Lambert, M.-L., 2021. Seasonal variation of hospital-acquired bloodstream
infections: A national cohort study. Infect. Control. Hosp. Epidemiol. Cambridge
University Press 1–7.
Braga IA, Campos
PA de,
Batista˜o DWDF,
Gontijo Filho
PP, Ribas
RM. Using
point prevalence survey to define burden of antimicrobial use among 35 adult intensive
care units in Brazil. Infect Dis (Lond).
Taylor & Francis; 2019;51(6):459–462.
Brusselaers, N., Logie, D., Vogelaers, D., Monstrey, S., Blot, S., 2012. Burns, inhalation injury and ventilator-associated pneumonia:
value of routine surveillance cultures. Burns 38 (3), 364–370.
Brusselaers, N., Labeau, S., Vogelaers,
D., Blot, S., 2013. Value of lower respiratory tract surveillance cultures to predict
bacterial pathogens in ventilator-associated pneumonia: systematic review and diagnostic test accuracy meta-analysis. Intensive
Care Med. Springer-Verlag 39 (3), 365–375.
Buetti, N., Timsit, J.-F., 2019. Management and prevention of central venous catheter-
related infections in the ICU. Semin. Respir. Crit. Care Med. 40 (4), 508–523.
Buetti, N., Ruckly,
S., Lucet, J.-C., Mimoz, O., Souweine, B., Timsit, J.-F., 2021. Factors influencing local signs at catheter
insertion site regardless of catheter-related
bloodstream infections. Crit. Care. BioMed Central 25 (1), 71–73.
Buffie, C.G., Pamer, E.G., 2013. Microbiota-mediated colonization resistance against
intestinal pathogens. Nat. Rev. Immunol.
Nature Publishing Group 13 (11), 790–801.
Caballero, S.,
Kim, S.,
Carter, R.A.,
Leiner, I.M.,
Suˇsac, B., Miller,
L., et
al., 2017. Cooperating commensals restore colonization resistance to vancomycin-resistant Enterococcus faecium. Cell Host Microbe
21 (5), 592–594.
Centers for Disease Control and Prevention. National and State Healthcare-associated Infections Progress Report, 2016. Available from: https://www.cdc.gov/HAI/pdfs/ progress-report/hai-progress-report.pdf. 2016.
Centers for Disease Control and Prevention. Bloodstream Infection Event (central
line- associated bloodstream infection and non-central line associated bloodstream infection). 2019. https://www.cdc.gov/nhsn/PDFs/pscManual/4PSC_CLABScurrent. pdf.
Charles, M.P., Easow, J.M., Joseph,
N.M., Ravishankar, M., Kumar, S., Umadevi, S., 2013. Incidence and risk factors
of ventilator associated pneumonia in a tertiary care hospital. Australas Med J. 6 (4), 178–182.
Cherifi, S., Mascart,
G., Dediste, A., Hallin, M., Gerard, M., Lambert, M.-L., et al., 2013. Variations in catheter-related bloodstream infections rates based on local practices. Antimicrob. Resist. Infect. Control. BioMed Central 2 (1), 10–14.
Chiang, C.-H., Pan, S.-C., Yang, T.-S., Matsuda,
K., Kim, H.B., Choi, Y.H., et al., 2018. Healthcare-associated infections in intensive care units in Taiwan, South Korea, and Japan: recent trends based on national surveillance reports. Antimicrob. Resist.Infect. Control. BioMed Central 7 (1), 129–212.
Chiu, C.Y., Miller,
S.A., 2019. Clinical
metagenomics. Nat. Rev. Genet. Nature Publishing Group 20 (6), 341–355.
Coisel, Y., Bousbia,
S., Forel, J.-M., Hraiech, S., Lascola, B., Roch, A., et al., 2012.Cytomegalovirus and herpes simplex virus effect on the prognosis
of mechanically ventilated patients suspected
to have ventilator-associated pneumonia. PLoS ONE Public Library of Science 7 (12), e51340.
Dale, C.M., Rose, L., Carbone,
S., Pinto, R., Smith, O.M., Burry, L., et al., 2021. Effect of oral chlorhexidine de-adoption and implementation of an oral care bundle on mortality for mechanically ventilated patients in the
intensive care unit (CHORAL): a multi-center stepped wedge cluster-randomized controlled trial. Intensive Care Med.Springer Berlin Heidelberg 47, 1295–1302.
Dancer, S.J., 2014. Controlling hospital-acquired infection: focus on the role of the
environment and new technologies for decontamination. Clin. Microbiol. Rev. American Society for Microbiology Journals
27 (4), 665–690.
Dasgupta, S., Das, S., Chawan,
N.S., Hazra, A., 2015. Nosocomial infections in the intensive care unit: Incidence, risk factors, outcome
and associated pathogens
in a public tertiary teaching
hospital of Eastern India. Indian J. Crit. Care Med. 19 (1),
14–20.
de Montmollin, E., Ruckly, S., Schwebel, C., Philippart, F., Adrie, C., Mariotte, E., et al., 2019. Pneumonia in acute ischemic
stroke patients requiring
invasive ventilation: Impact on short and long-term
outcomes. J. Infect. 79 (3), 220–227.
De Waele, J., Lipman, J., Sakr, Y., Marshall, J.C., Vanhems, P., Barrera Groba, C., et al., 2014. Abdominal infections in the intensive care unit: characteristics,
treatment and determinants of outcome.
BMC Infect. Dis. BioMed Central Ltd 14 (1), 420.
Deknuydt, F., Roquilly,
A., Cinotti, R., Altare, F., Asehnoune, K., 2013. An in vitro model of mycobacterial granuloma
to investigate the immune response
in brain-injured
patients. Crit. Care Med. 41 (1), 245–254.
Delano, M.J., Ward, P.A., 2016. The immune system’s role in sepsis progression, resolution, and long-term
outcome. Immunol. Rev. John Wiley & Sons, Ltd 274 (1),
330–353.
Depuydt, P., Benoit, D., Vogelaers,
D., Claeys, G., Verschraegen, G., Vandewoude, K., et al., 2006a. Outcome in bacteremia associated with nosocomial pneumonia and the impact of pathogen prediction by tracheal surveillance cultures.
Intensive Care Med. 32 (11), 1773–1781.
Depuydt, P., Benoit, D., Vogelaers, D., Decruyenaere, J., Vandijck, D., Claeys, G., et al., 2008. Systematic surveillance cultures as a tool to predict involvement
of multidrug antibiotic resistant bacteria
in ventilator-associated pneumonia. Intensive Care Med.34 (4), 675–682.
Depuydt, P.O., Blot, S.I., Benoit, D.D., Claeys, G.W., Verschraegen,
G.L., Vandewoude, K. H., et al., 2006b.
Antimicrobial resistance in nosocomial bloodstream infection associated with pneumonia and the value of systematic surveillance
cultures in an adult intensive care unit. Crit. Care Med. 34 (3), 653–659.
Deschepper, M., Waegeman,
W., Eeckloo, K., Vogelaers, D., Blot, S., 2018. Effects
of chlorhexidine gluconate oral care on hospital
mortality: a hospital-wide, observational cohort study. Intensive Care Med. Springer Berlin Heidelberg 44,1017–1026.
Dick, A., Liu, H., Zwanziger,
J., Perencevich, E., Furuya,
E.Y., Larson, E., et al., 2012.Long-term survival and healthcare utilization outcomes attributable to sepsis and pneumonia. BMC Health Serv. Res. BioMed Central 12 (1), 432–510.
Dimopoulos, G., Koulenti,
D., Blot, S., Sakr, Y., Anzueto, A., Spies, C., et al., 2013.Critically ill elderly adults with infection: analysis
of the extended prevalence of infection in intensive
care study. J. Am. Geriatr. Soc. 61 (12), 2065–2071.
Dixon-Woods, M., Leslie, M.,
Bion, J., Tarrant, C., 2012. What counts?
An ethnographic study of infection data reported
to a patient safety program.
Milbank Q. John Wiley& Sons, Ltd 90 (3), 548–591.
Dray, S., Forel, J.-M., Papazian,
L., 2019. What’s new in the prevention
of healthcare- associated infections using chlorhexidine gluconate-impregnated washcloths.Intensive Care Med. Springer Berlin Heidelberg 45, 249–251.
Dudeck, M.A., Horan, T.C., Peterson,
K.D., Allen-Bridson, K., Morrell, G., Anttila, A.,et al., 2013. National Healthcare
Safety Network report, data summary for 2011, device-associated module. Am. J. Infect. Control 41 (4), 286–300.
Eggimann, P.,
Pagani, J.-L.,
Dupuis-Lozeron, E., Ms,
B.E., Th´evenin, M.-J.,
Joseph, C.,et al., 2019. Sustained reduction
of catheter-associated bloodstream infections with enhancement of catheter bundle
by chlorhexidine dressings over 11 years. Intensive Care Med. Springer Berlin Heidelberg 45 (6), 823–833.
Elliott, D., Elliott,
R., Burrell, A., Harrigan, P., Murgo, M., Rolls, K., et al., 2015.
Incidence of ventilator-associated pneumonia
in Australasian intensive
care units: use of a consensus-developed clinical
surveillance checklist in a multisite prospective audit. BMJ Open British Medical
Journal Publishing Group 5 (10), e008924.
Emonet, S., Lazarevic,
V., Leemann Refondini, C., Gaïa, N., Leo, S., Girard, M., et al., 2019. Identification of respiratory microbiota markers in ventilator-associated
pneumonia. Intensive Care Med. Springer
Berlin Heidelberg 45, 1082–1092.
Entesari-Tatafi, D., Orford, N., Bailey, M.J., Chonghaile, M.N.I., Lamb-Jenkins, J.,
Athan, E., 2015. Effectiveness of a care bundle to reduce central line-associated bloodstream infections. Med. J. Aust. John Wiley & Sons, Ltd 202 (5), 247–250.
European Centre for Disease Prevention
and Control. Healthcare-associated infections
acquired in intensive
care units. In: ECDC. Annual epidemiological report for 2016. Stockholm: ECDC; 2018.
Freedberg, D.E., Zhou, M.J., Cohen, M.E., Annavajhala, M.K., Khan, S., Moscoso, D.I., et al., 2018. Pathogen colonization of the gastrointestinal microbiome at intensive care unit admission and risk for subsequent death or infection.
Intensive Care Med.
Springer Berlin Heidelberg
44 (8), 1203–1211.
Freifeld
A.G., Bow E.J.,
Sepkowitz K.A., Boeckh
M.J., Ito J.I., Mullen C.A., et al. Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer: 2010 update by the infectious diseases
Society of America. Vol. 52, Clinical Infectious
Diseases. 2011. pp. e56–93.
Frencken, J.F., Wittekamp, B.H.J.,
Plantinga, N.L., Spitoni, C., van de Groep, K., Cremer, O.L., et al., 2018. Associations between enteral colonization
with Gram- negative bacteria and intensive care unit-acquired infections and colonization of the
respiratory tract. Clin. Infect. Dis. 66 (4), 497–503.
Gosalbes, M.J.,
V´azquez-Castellanos, J.F., Angebault,
C., Woerther,
P.-L., Rupp´e, E., Ferrús, M.L., et al., 2016. Carriage of enterobacteria producing
extended-spectrum β-lactamases and composition of the gut microbiota in an Amerindian Community. Antimicrob. Agents Chemother. American Society for Microbiology Journals
60 (1), 507–514.
Grund, S., Roggendorf, M., Schweiger, B., 2010. Outbreak
of influenza virus A/H1N1 in a hospital ward for immunocompromised patients.
Arch. Virol. Springer
Vienna 155 (11), 1797–1802.
Guzm´an-Herrador, B., Molina,
C.D., Allam,
M.F., Navajas,
R.-F.-C., 2016.
Independent risk factors associated
with hospital-acquired pneumonia
in an adult ICU: 4-year prospective cohort study in a university reference
hospital. J. Public Health (Oxf) 38 (2), 378–383.
Hajdu, A., Samodova,
O.V., Carlsson, T.R., Voinova, L.V., Nazarenko, S.J., Tjurikov, A.V., et al., 2007. A point prevalence survey of hospital-acquired infections and antimicrobial use in a paediatric hospital in north-western Russia. J. Hosp. Infect. 66 (4), 378–384.
Hamilton, L.A., Behal, M.L., 2020. Altering routine intensive care unit practices
to
support commensalism. Nutr. Clin. Pract. John Wiley & Sons, Ltd 35 (3), 433–441.
Harbarth, S., Sax, H., Gastmeier, P., 2003. The preventable proportion of nosocomial infections: an overview of published reports. J. Hosp. Infect. 54 (4), 258–266 quiz321.
Hockenhull, J.C., Dwan, K.M., Smith, G.W., Gamble, C.L., Boland, A., Walley, T.J., et al., 2009. The clinical effectiveness of central venous catheters treated with
anti- infective agents in preventing catheter-related bloodstream infections: a systematic review. Crit. Care Med. 37 (2), 702–712.
Horan, T.C., Gaynes, R.P., Martone, W.J., Jarvis,
W.R., Emori, T.G., 1992. CDC definitions of nosocomial surgical site infections, 1992: a modification of CDC
definitions of surgical
wound infections. Infect. Control Hosp. Epidemiol. 13 (10), 606–608.
Hotchkiss, R.S., Monneret,
G., Payen, D., 2013a. Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic approach.
Lancet Infect. Dis. 13 (3), 260–268.
Hotchkiss, R.S., Monneret,
G., Payen, D., 2013b. Sepsis-induced immunosuppression:
from cellular dysfunctions to immunotherapy. Nat. Rev. Immunol.
Nature Publishing Group 13 (12), 862–874.
Ippolito, M., Misseri,
G., Catalisano, G., Marino, C., Ingoglia, G., Alessi, M., et al., 2021. Ventilator-associated pneumonia in patients
with COVID-19. A systematic review and meta-analysis. Antibiotics (Basel) 10 (5).
Iwuafor A.A., Ogunsola
F.T., Oladele R.O., Oduyebo O.O., Desalu I., Egwuatu C.C., et al. Incidence, clinical
outcome and risk factors of intensive care unit infections in the Lagos University Teaching
Hospital (LUTH), Lagos, Nigeria. PLoS ONE. Public Library of Science; 2016;11(10):e0165242.
Jansson, M., Liao, X., Rello, J., 2020. Strengthening ICU health security for a coronavirus epidemic. Intensive Crit. Care Nurs. 57, 102812.
Jansson, M.M.,
Syrja¨l¨a, H.P.,
Ala-Kokko, T.I.,
2019. Association
of nurse
staffing and nursing workload with ventilator-associated pneumonia
and mortality: a prospective, single-center cohort study. J. Hosp. Infect. 101 (3), 257–263.
Jeffery-Smith, A., Taori, S.K., Schelenz,
S., Jeffery, K., Johnson, E.M., Borman, A., et al., 2018. Candida auris: a Review of the Literature. Clin. Microbiol. Rev. American Society for Microbiology Journals 31 (1).
Johanson, W.G., Woods, D.E., Chaudhuri,
T., 1979. Association of respiratory tract colonization with adherence
of gram-negative bacilli to epithelial cells. J. Infect. Dis. 139 (6), 667–673.
Kalil A.C., Metersky
M.L., Klompas M., Muscedere J., Sweeney D.A., Palmer L.B., et al.Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American
Thoracic Society. Vol. 63, Clinical
Infectious Diseases.
2016. pp. e61–e111.
Karanika, S., Paudel,
S., Zervou, F.N., Grigoras, C., Zacharioudakis, I.M., Mylonakis, E., 2016. Prevalence and clinical outcomes
of Clostridium difficile
infection in the intensive care unit: A systematic
review and meta-analysis. Open Forum Infect.
Dis. 3 (1), ofv186.
Kelly, B.J., Imai, I., Bittinger, K., Laughlin, A., Fuchs, B.D., Bushman, F.D., et al., 2016. Composition and dynamics
of the respiratory tract microbiome in intubated patients. Microbiome BioMed Central
4 (1), 7–13.
Kelly, D., Kutney-Lee, A., Lake, E.T., Aiken, L.H., 2013. The critical care work
environment and nurse-reported health care-associated infections. Am. J. Crit. Care 22 (6), 482–488.
Klompas, M., Speck, K., Howell, M.D., Greene,
L.R., Berenholtz, S.M., 2014. Reappraisal of routine oral care with chlorhexidine gluconate for patients receiving
mechanical ventilation: systematic review and meta-analysis. JAMA Intern. Med. American Medical Association 174 (5), 751–761.
Kopp, M.A., Watzlawick, R., Martus, P., Failli, V., Finkenstaedt, F.W., Chen, Y., et al., 2017. Long-term functional
outcome in patients
with acquired infections
after acute
spinal cord injury. Neurology. Wolters Kluwer Health, Inc. on behalf of the American Academy of Neurology
88 (9), 892–900.
Korbkitjaroen, M., Vaithayapichet, S., Kachintorn, K., Jintanothaitavorn, D., Wiruchkul, N., Thamlikitkul, V., 2011. Effectiveness of comprehensive implementation of individualized bundling infection control measures for prevention of health care-associated infections
in general medical wards. Am. J. Infect. Control 39 (6), 471–476.
Labeau, S.O., 2020. Recommendation and protocol compliance: “Yes, I do” may not be true; the complexity of measuring
provider adherence. Intensive
Crit. Care Nurs. 60,
102890.
Labeau, S.O., Van de Vyver, K., Brusselaers, N., Vogelaers, D., Blot, S.I., 2011. Prevention of ventilator-associated pneumonia
with oral antiseptics: a systematic review and meta-analysis. Lancet Infect. Dis. 11 (11), 845–854.
Langelier, C., Kalantar,
K.L., Moazed, F., Wilson, M.R., Crawford, E.D., Deiss, T., et al., 2018. Integrating host response and unbiased microbe detection for lower respiratory tract infection
diagnosis in critically
ill adults. Proc. Natl. Acad. Sci. U.S. A. National Academy of Sciences
115 (52), E12353–E12362.
Leblebicioglu, H., Rosenthal, V.D.,
Arikan, O.A., Ozgültekin, A., Yalcin, A.N., Koksal, I., et al., 2007. Device-associated hospital-acquired infection rates in
Turkish intensive care units. Findings of the International Nosocomial
Infection Control Consortium (INICC). J. Hosp. Infect. 65 (3), 251–257.
Leblebicioglu, H.,
O¨ ztürk, R.,
Rosenthal, V.D.,
Akan, O¨ .A., Sirmatel,
F., Ozdemir,
D., et al., 2013a. Impact of a multidimensional infection control approach
on central line-associated bloodstream infections rates in adult intensive care units of 8 cities
of Turkey: findings of the International Nosocomial Infection Control
Consortium (INICC). Ann. Clin. Microbiol. Antimicrob. BioMed Central 12 (1), 10.
Leblebicioglu, H., Yalcin,
A.N., Rosenthal, V.D., Koksal, I., Sirmatel, F., Unal, S., et al., 2013b. Effectiveness of a multidimensional approach for prevention of ventilator- associated pneumonia in 11 adult intensive care units from 10 cities of Turkey: findings of the International Nosocomial Infection Control Consortium (INICC). Infection Springer-Verlag 41 (2), 447–456.
Lee, Y.S.H., Stone, P.W., Pogorzelska-Maziarz, M., Nembhard, I.M., 2018. Differences in work environment for staff as an explanation for variation in central line bundle compliance in intensive
care units. Health Care Manage. Rev. 43 (2), 138–147.
Leo, S., Lazarevic, V., Gaïa, N., Estellat, C., Girard, M., Matheron, S., et al., 2019. The intestinal microbiota predisposes to traveler’s diarrhea and to the
carriage of multidrug-resistant Enterobacteriaceae after traveling to tropical
regions. Gut Microbes. Taylor & Francis 10 (5), 631–641.
Li, X., Huang, Y., Xu, Z., Zhang, R., Liu, X., Li, Y., et al., 2018. Cytomegalovirus infection and outcome in immunocompetent patients
in the intensive care unit: a systematic review and meta-analysis. BMC Infect. Dis. BioMed Central 18 (1), 289–310.
Libert, N., Bigaillon,
C., Chargari, C., Bensalah, M., Muller, V., Merat, S., et al., 2015. Epstein-Barr virus reactivation in critically ill immunocompetent patients.
Biomed. J. 38 (1), 70–76.
Limaye, A.P., Kirby, K.A., Rubenfeld, G.D., Leisenring, W.M., Bulger, E.M., Neff, M.J., et al., 2008. Cytomegalovirus
reactivation in critically ill immunocompetent patients. JAMA. American
Medical Association 300 (4), 413–422.
Lobo, R.D., Levin, A.S., Gomes, L.M.B., Cursino, R., Park, M., Figueiredo, V.B., et al., 2005. Impact of an educational program and policy changes on decreasing catheter-
associated bloodstream infections
in a medical intensive care unit in Brazil. Am. J. Infect. Control 33 (2), 83–87.
Lormans, P., Blot, S., Amerlinck, S., Devriendt, Y., Dumoulin,
A., 2021. COVID-19 acquisition risk among ICU nursing
staff with patient-driven use of aerosol- generating respiratory procedures
and optimal use of personal
protective equipment. Intensive Crit. Care Nurs. 63, 102993.
Loubet, P., Voiriot,
G., Houhou-Fidouh, N., Neuville, M., Bouadma, L., Lescure, F.-X., et al., 2017. Impact of respiratory viruses
in hospital-acquired pneumonia
in the intensive care unit: A single-center retrospective study. J. Clin. Virol. 91, 52–57.
Luyt, C.-E., Combes,
A., Deback, C., Aubriot-Lorton, M.-H.,
Nieszkowska, A., Trouillet, J.- L., et al., 2007. Herpes simplex virus lung infection in patients
undergoing prolonged mechanical ventilation. Am. J. Respir. Crit. Care Med.
American Thoracic Society 175 (9), 935–942.
Luyt, C.-E., Sahnoun, T., Gautier,
M., Vidal, P., Burrel, S., Pineton de Chambrun, M., et al., 2020. Ventilator-associated pneumonia in patients with
SARS-CoV-2- associated acute respiratory distress syndrome requiring
ECMO: a retrospective cohort study. Ann. Intensive Care. SpringerOpen 10 (1), 158–210.
Maes, M., Higginson, E., Pereira-Dias, J., Curran, M.D., Parmar, S., Khokhar,
F., et al., 2021. Ventilator-associated pneumonia
in critically ill patients with COVID-19. Crit.Care. BioMed Central 25 (1), 25–111.
Magill, S.S., Edwards,
J.R., Bamberg, W., Beldavs, Z.G., Dumyati, G., Kainer, M.A., et al., 2014. Multistate point-prevalence survey of health care-associated infections. N. Engl. J.
Med. Massachusetts Medical
Society 370 (13), 1198–1208.
Malek, A.M., Abouseif,
H.A., Elaziz, K., Allam, M.F., Fahim, H.I., 2018. Incidence
of central line-associated bloodstream infections in intensive
care units in a private hospital (Cairo, Egypt). Open Public Health J. 11, 562–571.
Marin, M., Gudiol, C., Ardanuy,
C., Garcia-Vidal, C., Calvo, M., Arnan, M., et al., 2014. Bloodstream infections in neutropenic patients
with cancer: differences between
patients with haematological malignancies and solid tumours. J. Infect. 69 (5), 417–423.
Martin-Loeches, I.,
Po´voa, P., Rodriguez,
A., Curcio,
D., Sua´rez, D.,
Mira, J.-P.,
et al.,2015. Incidence and prognosis of ventilator-associated tracheobronchitis (TAVeM): a multicentre, prospective, observational study. Lancet Respir.
Med. 3 (11), 859–868.
Medell, M., Hart, M., Duquesne, A., Espinosa, F., Vald´es, R., 2013. Nosocomial ventilator-associated pneumonia in Cuban intensive care units: bacterial species and
antibiotic resistance. MEDICC Rev. 15 (2), 26–29.
Mehta, A., Rosenthal, V.D., Mehta, Y., Chakravarthy, M., Todi, S.K., Sen,
N., et al., 2007. Device-associated nosocomial infection rates in intensive care units of
seven Indian cities. Findings of the International Nosocomial Infection Control
Consortium
(INICC). J. Hosp. Infect. 67 (2), 168–174.
Mendes, M., Andrade Oliveira, A., Pires, O., Branca, F., Beira˜o, M., Santa-Cruz, A., et al., 2021. Sampling methods and risk stratification regarding
environmental contamination by SARS-CoV-2. Acta Med. Port. 34 (13).
Mermel L.A., Allon M., Bouza E., Craven D.E., Flynn P., O’Grady N.P., et al. Clinical practice guidelines for the diagnosis
and management of intravascular catheter-related infection: 2009 Update by the Infectious Diseases
Society of America.
Vol. 49, Clinical
infectious Diseases. Oxford University Press; 2009. pp. 1–45.
Mitchell, B.G., Dancer,
S.J., Anderson, M., Dehn, E., 2015. Risk of organism
acquisition from prior room occupants: a systematic review and meta-analysis. J. Hosp. Infect. 91 (3), 211–217.
Mitharwal, S.M., Yaddanapudi, S., Bhardwaj, N., Gautam, V., Biswal, M., Yaddanapudi, L., 2016. Intensive care unit-acquired infections in a
tertiary care hospital: An epidemiologic survey and influence
on patient outcomes.
Am. J. Infect.
Control 44 (7), e113–e117.
Mongin, D., Catho, G., Iten, A., Harbarth,
S., Courvoisier, D.S., 2021. Incidence
of
healthcare-associated coronavirus disease 2019 (COVID-19) in the state of Geneva. Infect. Control Hosp. Epidemiol. Cambridge
University Press 1–3.
Moreno, C.A., Rosenthal, V.D., Olarte,
N.,
Gomez,
W.V.,
Sussmann,
O.,
Agudelo,
J.G., et al., 2006. Device-associated infection
rate and mortality in intensive
care units of 9 Colombian hospitals:
findings of the International Nosocomial
Infection Control Consortium. Infect. Control Hosp. Epidemiol.
Cambridge University Press 27 (4), 349–356.
Murni, I.K., Duke, T.,
Kinney, S., Daley, A.J., Soenarto,
Y., 2015. Reducing hospital- acquired infections and improving the rational use of antibiotics in a developing country: an effectiveness study. Arch. Dis. Child. BMJ Publishing Group Ltd 100 (5),
454–459.
Myny, D., Depuydt, P., Colardyn,
F., Blot, S., 2005. Ventilator-associated pneumonia
in a tertiary care ICU: analysis of risk factors for acquisition and mortality. Acta Clin. Belg. 60 (3), 114–121.
Navoa-Ng, J.A., Berba, R., Galapia,
Y.A., Rosenthal, V.D., Villanueva, V.D., Tolentino, M. C.V., et al., 2011. Device-associated infections rates in adult, pediatric, and neonatal intensive care units of hospitals in the Philippines: International
Nosocomial Infection Control Consortium
(INICC) findings. Am. J. Infect. Control 39 (7), 548–554.
Ndegwa, L.K., Katz, M.A., McCormick, K., Nganga, Z., Mungai, A., Emukule, G., et al., 2014. Surveillance for respiratory health care-associated infections among inpatients in 3 Kenyan hospitals, 2010–2012.
Am. J. Infect. Control 42 (9), 985–990.
Nseir, S., Blazejewski, C., Lubret, R., Wallet, F., Courcol, R.,
Durocher, A., 2011. Risk of acquiring multidrug-resistant Gram-negative bacilli from prior room occupants
in the intensive care unit. Clin. Microbiol. Infect. 17 (8), 1201–1208.
Nussenblatt, V., Avdic, E., Berenholtz, S., Daugherty, E., Hadhazy, E.,
Lipsett, P.A., et al., 2014. Ventilator-associated pneumonia: overdiagnosis and treatment
are common in medical and surgical
intensive care units. Infect. Control Hosp. Epidemiol. Cambridge University Press 35 (3), 278–284.
Ong, D.S.Y., Bonten, M.J.M.,
Spitoni, C., Verduyn Lunel, F.M., Frencken, J.F., Horn, J.,et al., 2017. Epidemiology of multiple herpes viremia in previously immunocompetent patients with septic shock. Clin. Infect.
Dis. 64 (9), 1204–1210.
Ortíz, G., Duen˜as, C., Rodríguez, F., Barrera, L., Rosa, L.a., de, G,, Dennis, R,, et al., 2014. Epidemiology of sepsis in Colombian
intensive care units. Biomedica 34 (1), 40–47.
Parreco, J., Soe-Lin, H., Byerly,
S., Lu, N., Ruiz, G., Yeh, D.D., et al., 2020. Multi-center outcomes of chlorhexidine oral decontamination in intensive care units. Surg. Infect.(Larchmt) sur.2019.172.
Penoyer, D.A., 2010. Nurse staffing and patient outcomes in critical
care: a concise review. Crit. Care Med. 38 (7), 1521–1528
quiz1529.
Phu, V.D., Wertheim,
H.F.L., Larsson, M., Nadjm, B., Dinh,
Q.-D., Nilsson, L.E., et al., 2016. Burden of hospital acquired infections and antimicrobial use in
Vietnamese adult intensive care units. PLoS ONE. Public Library of Science 11 (1), e0147544.
Plantinga, N.L., Wittekamp, B.H.J., Leleu, K., Depuydt, P., Van den
Abeele, A.-M., Brun- Buisson, C., et al., 2016. Oral mucosal adverse events with chlorhexidine 2%
mouthwash in ICU. Intensive Care Med. Springer Berlin Heidelberg
42, 620–621.
Ponce de
Leo´n-Rosales,
S.P., Molinar-Ramos,
F., Domínguez-Cherit,
G., Rangel-
Frausto, M.S., Va´zquez-Ramos, V.G., 2000. Prevalence of infections in intensive care units in Mexico: a multicenter study. Crit. Care Med. 28 (5), 1316–1321.
Price R., MacLennan
G., Glen J.,
SuDDICU Collaboration. 2014. Selective digestive
or oropharyngeal decontamination and topical oropharyngeal chlorhexidine for prevention of death in general intensive
care: systematic review and network meta-analysis. BMJ. BMJ Publishing Group; 348(mar31 2):g2197–7.
Public Health Agency of Canada,
2014. Central Venous Catheter-Associated Blood Stream Infections in Intensive
Care units in Canadian Acute-Care Hospitals: Surveillance Report January 1, 2006 to December 31, 2006 and January 1, 2009 to December 31, 2011. Centre
for Communicable Diseases and Infection Control, Public Health Agency of Canada.
Pusajo´, J.F.,
Bumaschny, E.,
Doglio, G.R.,
Cherjovsky, M.R., Lipinszki,
A.I., Hern´andez, M.S., et
al., 1993.
Postoperative intra-abdominal sepsis
requiring reoperation. Value of a predictive index. Arch Surg. American Medical Association
128 (2), 218–222 discussion 223.
Ramanan, P., Bryson, A.L., Binnicker, M.J., Pritt, B.S., Patel, R., 2018. Syndromic
panel- based testing in clinical
microbiology. Clin. Microbiol. Rev. American Society
for Microbiology Journals 31 (1).
Ramirez, M., Fernandez,
B., Cruz, A., Jardines, E., Bermudez, Y., 2011. Comportamiento de las infecciones nosocomiales en Unidad de Cuidados Intensivos en un quinquenio (2005–2009). MediSur 9 (5), 467–473.
Razazi, K., Arrestier, R., Haudebourg, A.F., Benelli, B., Carteaux, G., Decousser, J.-W., et al., 2020. Risks of ventilator-associated pneumonia
and invasive pulmonary aspergillosis in patients
with viral acute respiratory distress
syndrome related or not
to Coronavirus 19 disease. Crit Care. BioMed Central 24 (1), 699–711.
Rello, J., Afonso, E., Lisboa, T., Ricart, M., Balsera,
B., Rovira, A., et al., 2013. A care bundle approach for prevention of ventilator-associated pneumonia. Clin. Microbiol. Infect. 19 (4), 363–369.
Reper, P., Bombart,
M.A., Leonard, I., Payen, B., Darquennes, O., Labrique, S., 2020.Nursing Activities Score is increased in COVID-19 patients.
Intensive Crit. Care Nurs. 60, 102891.
Reper, P., Delaere,
S., Yimbou, J.J., Labrique, S., Massaut, J., 2021. Not only intensive care unit workload and activities
but also quality indicators are influenced by the COVID-19 epidemic. Intensive
Crit. Care Nurs. 63, 103008.
Rodríguez-Acelas, A.L.,
de Abreu,
A.M., Engelman,
B., Can˜on-Montan˜ez, W.,
2017. Risk factors for health care-associated infection
in hospitalized adults:
Systematic review and meta-analysis. Am. J. Infect. Control 45 (12), e149–e156.
Roquilly, A., Broquet,
A., Jacqueline, C., Masson, D., Segain, J.P., Braudeau, C., et al., 2014. Hydrocortisone prevents immunosuppression
by
interleukin-10 natural
killer cells after trauma-hemorrhage. Crit. Care Med. 42 (12), e752–e761.
Roquilly, A., McWilliam,
H.E.G., Jacqueline, C., Tian, Z., Cinotti, R., Rimbert, M., et al., 2017. Local modulation of antigen-presenting cell development after resolution of pneumonia induces long-term
susceptibility to secondary
infections. Immunity 47 (1), 135–145.
Roquilly, A., Torres, A., Villadangos, J.A., Netea, M.G., Dickson, R., Becher, B., et al., 2019. Pathophysiological role of respiratory dysbiosis in hospital-acquired
pneumonia. Lancet Respir Med. 7 (8), 710–720.
Rosenthal, V.D., Guzman, S., Orellano, P.W., 2003. Nosocomial infections in medical-surgical intensive care units in Argentina: attributable mortality and length of stay. Am. J. Infect. Control 31 (5), 291–295.
Rosenthal, V.D., Guzman,
S., Crnich, C., 2006. Impact
of an infection control program
on rates of ventilator-associated pneumonia in intensive care units in 2 Argentinean hospitals. Am. J. Infect. Control
34 (2), 58–63.
Rouz´e, A.,
Martin-Loeches, I., Po´voa, P.,
Makris, D.,
Artigas, A.,
Bouchereau, M., et
al.,2021. Relationship between SARS-CoV-2 infection and the incidence of
ventilator- associated lower respiratory tract infections: a European multicenter
cohort study. Intensive Care Med. Springer Berlin Heidelberg 47 (2), 188–198.
Saied, W.I., Martin-Loeches, I., Timsit, J.-F., 2020. What is new in non-ventilated
ICU- acquired pneumonia? Intensive
Care Med. Springer
Berlin Heidelberg 46, 488–491.
Sakr, Y.,
Jaschinski, U., Wittebole,
X., Szakmany,
T., Lipman,
J., N˜amendys-Silva, S.A., et al., 2018. Sepsis in intensive care unit patients: worldwide data from
the intensive care over nations audit. Open Forum. Infect. Dis. Intensive Care Med.
Springer Berlin Heidelberg 5 (12), ofy313.
Satoh, K., Makimura, K., Hasumi, Y., Nishiyama, Y., Uchida, K.,
Yamaguchi, H., 2009. Candida auris sp. nov., a novel ascomycetous yeast isolated from the external
ear canal of an inpatient in a Japanese hospital. Microbiol. Immunol. John
Wiley & Sons, Ltd 53 (1), 41–44.
Schelenz, S., Nwaka, D., Hunter,
P.R., 2013. Longitudinal surveillance of bacteraemia in haematology and oncology
patients at a UK cancer centre and the impact of ciprofloxacin use on antimicrobial resistance. J. Antimicrob. Chemother. 68 (6),
1431–1438.
Schreiber, P.W., Sax, H., Wolfensberger, A., Clack, L., Kuster, S.P.,
Swissnoso, 2018. The preventable proportion of healthcare-associated infections 2005–2016:
Systematic review and meta-analysis. Infect. Control Hosp. Epidemiol. Cambridge
University Press 39 (11), 1277–1295.
Shorr, A.F., Zilberberg, M.D., Micek, S.T., Kollef, M.H.,
2017. Viruses are prevalent innon-ventilated hospital-acquired pneumonia. Respir. Med. 122, 76–80.
Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., Health Care Infection Control Practices Advisory Committee,
2007. Guideline for isolation precautions: preventing
transmission of infectious
agents in health care settings.
Am. J. Infect. Control 35, S65–S164.
Singh, S., Goyal, R., Ramesh,
G.S., Ravishankar, V., Sharma, R.M., Bhargava, D.V., et al., 2015. Control of hospital acquired
infections in the ICU: A service perspective. Med.J. Armed Forces India 71 (1),
28–32.
Smith T.J., Bohlke
K., Lyman G.H., Carson
K.R., Crawford J., Cross S.J., et al.
Recommendations for the use of WBC growth factors:
American Society of Clinical
Oncology Clinical Practice
Guideline Update. Vol. 33, Journal of Clinical
Oncology. American Society
of Clinical Oncology;
2015. pp. 3199–212.
Sommerstein, R., Merz, T.M., Berger, S., Kraemer,
J.G., Marschall, J., Hilty, M., 2019. Patterns in the longitudinal oropharyngeal microbiome evolution related
to ventilator-associated pneumonia. Antimicrob. Resist. Infect. Control.
BioMed Central
8 (1), 81–110.
Son, C.H., Daniels, T.L., Eagan, J.A., Edmond, M.B., Fishman,
N.O., Fraser, T.G., et al., 2012. Central line-associated bloodstream infection surveillance outside
the intensive care unit: a multicenter survey. Infect. Control Hosp. Epidemiol. Cambridge University Press 33 (9), 869–874.
Stewardson, A.J., Allignol,
A., Beyersmann, J., Graves, N., Schumacher, M., Meyer, R., et al., 2016. The health and economic
burden of bloodstream infections caused by antimicrobial-susceptible and non-susceptible Enterobacteriaceae and Staphylococcus aureus in European hospitals, 2010 and 2011: a multicentre retrospective cohort study. Euro Surveill.
European Centre for Disease Prevention and Control 21 (33), 30319.
Su, C.-H., Chang, S.-C., Yan, J.-J., Tseng, S.-H., Chien, L.-J., Fang, C.-T., 2013. Excess mortality and long-term
disability from healthcare-associated staphylococcus aureus infections: a population-based matched cohort study. PLoS ONE. Public Library of Science 8 (8), e71055.
Tabah, A., Koulenti, D., Laupland, K., Misset, B., Valles, J., Bruzzi de Carvalho, F., et al., 2012. Characteristics and determinants of outcome of hospital-acquired bloodstream infections in intensive care units: the EUROBACT International Cohort Study.Intensive Care Med. Springer-Verlag 38 (12), 1930–1945.
Talcott, J.A., Finberg,
R., Mayer, R.J., Goldman, L., 1988. The medical course of cancer patients with fever and neutropenia. Clinical identification of a low-risk subgroup at presentation. Arch. Intern. Med. 148 (12), 2561–2568.
Tambyah, P.A., Maki, D.G., 2000. Catheter-associated urinary tract infection
is rarely symptomatic: a prospective study of 1,497 catheterized patients.
Arch Intern Med.
American Medical Association 160 (5), 678–682.
Taplitz R.A., Kennedy
E.B., Bow E.J., Crews J., Gleason C., Hawley D.K., et al.
Antimicrobial Prophylaxis for Adult Patients With Cancer-Related Immunosuppression: ASCO and IDSA Clinical Practice Guideline Update. Vol. 36, Journal of Clinical Oncology.
American Society of Clinical Oncology;
2018. pp. 3043–54.
Taylor, G., Gravel, D., Matlow,
A., Embree, J., LeSaux, N., Johnston,
L., et al., 2016. Assessing the magnitude
and trends in hospital acquired
infections in Canadian
hospitals through sequential
point prevalence surveys.
Antimicrob. Resist. Infect. Control. BioMed Central 5 (1), 19–27.
Tejerina, E.,
Esteban, A.,
Fern´andez-Segoviano, P., Frutos-Vivar,
F., Aramburu,
J.,Ballesteros, D., et al., 2010. Accuracy of clinical definitions of ventilator-associated pneumonia: comparison with autopsy findings.
J. Crit. Care 25 (1), 62–68.
Timsit, J.-F., Schwebel,
C., Bouadma, L., Geffroy, A., Garrouste-Orgeas, M., Pease, S., et al., 2009. Chlorhexidine-impregnated sponges
and less frequent dressing changes for prevention of catheter-related infections
in critically ill adults: a randomized controlled trial. JAMA. American Medical Association 301 (12), 1231–1241.
Timsit, J.-F., Mimoz, O., Mourvillier, B., Souweine, B., Garrouste-Orgeas, M., Alfandari, S., et al., 2012. Randomized controlled trial of chlorhexidine dressing and highly adhesive dressing
for preventing catheter-related infections in critically ill adults. Am. J. Respir. Crit. Care Med. American Thoracic Society 186 (12),
1272–1278.
Timsit, J.-F., Esaied,
W., Neuville, M., Bouadma, L., Mourvllier, B., 2017. Update
on ventilator-associated pneumonia. F1000Res.
F1000 Research Limited
6 (2061), 2061.
Timsit, J.-F., Rupp, M., Bouza,
E., Chopra, V., Karpanen, T., Laupland, K., et al., 2018. A state of the art review on optimal practices
to prevent, recognize,
and manage complications associated with intravascular devices in the critically ill. Intensive Care Med. Springer Berlin Heidelberg 44, 742–759.
Tomlinson, D., Mermel, L.A., Ethier,
M.-C., Matlow, A., Gillmeister, B., Sung, L., 2011. Defining bloodstream infections related to central venous catheters
in patients with cancer: a systematic review. Clin. Infect. Dis. 53 (7), 697–710.
Tran, K., Cimon,
K., Severn, M., Pessoa-Silva, C.L.,
Conly, J., 2012. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PLoS ONE. Public Library
of Science 7 (4), e35797.
Ullman, A.J., Cooke, M.L., Mitchell,
M., Lin, F., New, K., Long, D.A., et al., 2016. Dressing and securement for central venous access devices (CVADs): A Cochrane systematic review. Int. J. Nurs. Stud. 59, 177–196.
Umscheid, C.A., Mitchell,
M.D., Doshi, J.A., Agarwal, R., Williams, K., Brennan, P.J., 2011. Estimating the proportion of healthcare-associated infections that are
reasonably preventable and the related mortality and costs. Infect. Control Hosp. Epidemiol. 32 (2), 101–114.
van der Kooi, T., Sax, H., Pittet, D., van Dissel, J., van Benthem,
B., Walder, B., et al., 2018. Prevention of hospital infections
by intervention and training (PROHIBIT): results of a pan-European cluster-randomized multicentre study to reduce central venous catheter-related bloodstream infections. Intensive Care Med. Springer Berlin
Heidelberg 44, 48–60.
van Vught, L.A.,
Scicluna, B.P., Wiewel, M.A., Hoogendijk, A.J., Klein Klouwenberg, P.M. C., Franitza, M., et al., 2016. Comparative analysis of the host response
to community-acquired and hospital-acquired pneumonia in critically
ill patients. Am. J. Respir. Crit. Care Med. American
Thoracic Society 194 (11), 1366–1374.
Vazquez Guillamet, C., Kollef, M.H., 2018. Is zero ventilator-associated pneumonia
achievable?: Practical approaches
to ventilator-associated pneumonia
prevention. Clin. Chest Med. 39 (4), 809–822.
Venet, F., Filipe-Santos, O., Lepape, A., Malcus, C., Poitevin-Later, F., Grives, A., et al., 2013. Decreased T-cell repertoire diversity
in sepsis: a preliminary study. Crit. Care Med. 41 (1), 111–119.
Vincent, J.L., Rello, J., Marshall, J., Silva, E., Anzueto, A., Martin, C.D., et al., 2009. International study of the prevalence
and outcomes of infection in intensive care
units. JAMA. American
Medical Association 302 (21), 2323–2329.
Vogelaers, D.,
De Bels,
D., Forˆet, F.,
Cran, S.,
Gilbert, E.,
Schoonheydt, K., et
al., 2010. Patterns of antimicrobial therapy in severe nosocomial infections:
empiric choices, proportion of appropriate therapy, and adaptation rates–a multicentre,
observational survey in critically ill patients.
Int. J. Antimicrob. Agents 35 (4), 375–381.
Vogelaers, D., Blot, S., Van den Berge, A., Montravers, P., 2021. Antimicrobial lessons from a large observational cohort on intra-abdominal infections in intensive
care units. Drugs. Springer International Publishing
1–14.
Vollaard, E.J., Clasener, H.A.,
1994. Colonization resistance.
Antimicrob. Agents
Chemother. American Society for Microbiology Journals 38 (3), 409–414.
Vuichard-Gysin, D., Abbas, M., Harbarth, S., 2021. In-hospital COVID-19 outbreak investigation: A practical
approach to root cause analysis.
Intensive Crit. Care Nurs. 67, 103132.
Walter, J.,
Haller, S.,
Quinten, C.,
Ka¨rki, T.,
Zacher, B.,
Eckmanns, T.,
et al.,
2018. Healthcare-associated pneumonia in acute care hospitals
in European Union/ European Economic Area countries: an analysis of data from a point prevalence survey, 2011 to 2012. Euro Surveill.. European
Centre for Disease
Prevention and Control 23 (32), 1700843.
WHO, 2011. Report on the Burden of Endemic Health Care-associated Infection Worldwide - Clean Care is Safer Care. Word Health Organization.
WHO (2012). WHO, Prevention of hospital-acquired infections - A practical
guide, 2nd edition,
in: W. H. Organization (Ed.).
Wicky, P.-H., Niedermann, M.S., Timsit, J.-F., 2021. Ventilator-associated pneumonia
in the era of COVID-19 pandemic:
How common and what is the impact? Crit. Care.
BioMed Central 25 (1), 153–163.
Winters, B.D., Eberlein,
M., Leung, J., Needham, D.M., Pronovost, P.J., Sevransky, J.E., 2010. Long-term mortality
and quality of life in sepsis: a systematic review. Crit. Care Med. 38 (5), 1276–1283.
Wittekamp, B.H.J., Oostdijk,
E.A.N., Cuthbertson, B.H.,
Brun-Buisson,
C.,
Bonten,
M.J. M., 2020. Selective
decontamination of the digestive tract (SDD) in critically ill patients: a narrative
review. Intensive Care Med. Springer
Berlin Heidelberg 46,343–349.
Wittekamp, B.H., Plantinga, N.L., Cooper, B.S., Lopez-Contreras, J., Coll, P., Mancebo, J., et al., 2018. Decontamination strategies and bloodstream infections with
antibiotic- resistant microorganisms in ventilated patients:
A randomized clinical
trial. JAMA. American Medical Association 320 (20), 2087–2098.
Woeltje, K.F., Butler,
A.M., Goris, A.J., Tutlam, N.T., Doherty, J.A., Westover, M.B., et al., 2008. Automated surveillance for central line-associated bloodstream infection in intensive care units. Infect. Control
Hosp. Epidemiol. Cambridge
University Press 29 (9), 842–846.
Yakovlev, S.V., Suvorova, M.P., Beloborodov,
V.B.,
Basin,
E.E.,
Eliseev,
E.V., Kovelenov, S.V., et al., 2016. Multicentre study of the prevalence and clinical value of hospital-acquired infections
in Emergency Hospitals
of Russia: ERGINI Study
Team. Antibiot Khimioter.
Antibiot. Khimioter. 61 (5–6), 32–42.
Yallew, W.W., Kumie, A., Yehuala, F.M., 2016. Point prevalence
of hospital-acquired infections in two teaching hospitals
of Amhara region in Ethiopia.
Drug Healthc. Patient Saf. Dove Press 8, 71–76.
Young, V.B., 2016. Therapeutic manipulation of the microbiota: past, present, and
considerations for the future. Clin. Microbiol. Infect.
22 (11), 905–909.
Zahar, J.-R., Blot,
S., Nordmann, P., Martischang, R., Timsit, J.-F., Harbarth, S., et al., 2019. Screening for intestinal carriage
of extended-spectrum beta-lactamase- producing enterobacteriaceae in critically ill patients: expected
benefits and evidence-based controversies. Clin. Infect. Dis. 68 (12), 2125–2130.
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 13.09.2022
[~DATE_ACTIVE_FROM] => 13.09.2022
[ACTIVE_FROM_X] => 2022-09-13 00:00:00
[~ACTIVE_FROM_X] => 2022-09-13 00:00:00
[ACTIVE_FROM] => 13.09.2022
[~ACTIVE_FROM] => 13.09.2022
[SHOW_COUNTER] => 2194
[~SHOW_COUNTER] => 2194
[ID] => 8310
[~ID] => 8310
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 11.11.2024 15:28:25
[~TIMESTAMP_X] => 11.11.2024 15:28:25
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/infektsii-svyazannye-s-okazaniem-meditsinskoy-pomoshchi-u-vzroslykh-patsientov-otdeleniy-intensivnoy/
[~DETAIL_PAGE_URL] => /library/articles/infektsii-svyazannye-s-okazaniem-meditsinskoy-pomoshchi-u-vzroslykh-patsientov-otdeleniy-intensivnoy/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => infektsii-svyazannye-s-okazaniem-meditsinskoy-pomoshchi-u-vzroslykh-patsientov-otdeleniy-intensivnoy
[~CODE] => infektsii-svyazannye-s-okazaniem-meditsinskoy-pomoshchi-u-vzroslykh-patsientov-otdeleniy-intensivnoy
[EXTERNAL_ID] => 8310
[~EXTERNAL_ID] => 8310
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 13 сентября 2022
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Инфекции, связанные с оказанием медицинской помощи, у взрослых пациентов отделений интенсивной терапии: изменения в эпидемиологии, диагностике, профилактике и вкладе новых технологий
[PREVIEW_PICTURE] => Array
(
[ID] => 5306
[TIMESTAMP_X] => 11.11.2024 15:28:25
[MODULE_ID] => iblock
[HEIGHT] => 624
[WIDTH] => 1000
[FILE_SIZE] => 95848
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/6ad/0362nqvdnm3v3ffz8lpuq5iw84743g9j
[FILE_NAME] => medical-banner-with-doctor-wearing-glove.jpg
[ORIGINAL_NAME] => medical-banner-with-doctor-wearing-glove.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 9517a014498797feece38deb6e4c6cd2
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/6ad/0362nqvdnm3v3ffz8lpuq5iw84743g9j/medical-banner-with-doctor-wearing-glove.jpg
[UNSAFE_SRC] => /upload/iblock/6ad/0362nqvdnm3v3ffz8lpuq5iw84743g9j/medical-banner-with-doctor-wearing-glove.jpg
[SAFE_SRC] => /upload/iblock/6ad/0362nqvdnm3v3ffz8lpuq5iw84743g9j/medical-banner-with-doctor-wearing-glove.jpg
[ALT] => Инфекции, связанные с оказанием медицинской помощи, у взрослых пациентов отделений интенсивной терапии: изменения в эпидемиологии, диагностике, профилактике и вкладе новых технологий
[TITLE] => Инфекции, связанные с оказанием медицинской помощи, у взрослых пациентов отделений интенсивной терапии: изменения в эпидемиологии, диагностике, профилактике и вкладе новых технологий
)
[DETAIL_TEXT] =>
Stijn
Blot , Etienne Ruppґe, Stephan Harbarth , Karim
Asehnoune , Garyphalia Poulakou , Charles-Edouard Luyt , Jordi Rello , Michael
Klompas , Pieter Depuydt , Christian Eckmann , Ignacio Martin-Loeches, Pedro
Povoa , Lila Bouadma , Jean-Francois Timsit , Jean-Ralph Zahar
Healthcare-associated
infections in adult intensive care unit patients:Changes in epidemiology,
diagnosis, prevention and contributions of new technologies
INTENS CRIT CARE NUR
70 (2022) 103227 https://doi.org/10.1016/j.iccn.2022.103227
Инфекции, связанные с оказанием
медицинской помощи, у взрослых пациентов отделений интенсивной терапии:
изменения в эпидемиологии, диагностике, профилактике и вкладе новых технологий

Fig. 1. Prevalence of ICU-acquired infections, 2000–2018 (ECDC, 2018; Ponce de Leo´n-Rosales et al. 2000; Rosenthal et al. 2003; Ortíz et al. 2014; Murni et al. 2015; Iwuafor et al. 2016; Mitharwal
et al. 2016; Phu et al. 2016; Taylor et al. 2016; Yakovlev et al. 2016; Yallew et al. 2016; Chiang et al. 2018; Braga et al. 2019).
АННОТАЦИЯ
Пациенты в отделениях интенсивной терапии
(ОИТ) подвергаются высокому риску развития инфекций, связанных с оказанием
медицинской помощи (ИСМП) из-за высокой распространенности инвазивных процедур
и использования устройств, индуцированной иммуносупрессии, сопутствующих
заболеваний, «хрупкости» и пожилого возраста. За
последнее десятилетие наблюдается
снижение заболеваемости ИСМП, связанных с инвазивными процедурами и
устройствами. Тем не менее,
уровень инфекций, приобретенных в ОИТ остается высоким.
В этом контексте появление новых патогенов еще больше усложняет лечение и угрожает его результатам.
Кроме того, пандемия SARS-CoV-2 (COVID-19)
высветила проблему, которую создает новый патоген для оптимизации мер профилактики как в отношении риска
воздействия на медицинский персонал, так и в отношении необходимости поддержания
качества медицинской помощи. Медсестры
ОИТ занимают особое место в профилактике и лечении ИСМП, поскольку они
участвуют в базовом гигиеническом уходе, реализации инициатив по улучшению качества оказания помощи, в том числе рационального использования антибиотиков, а
также обеспечивают адекватный забор материала для микробиологического исследования.
Появление более чувствительных
микробиологических методов и расширение наших знаний о взаимодействии больных в
критическом состоянии и их микробиоты заставляют
нас переосмыслить и определить лучшие стратегии диагностики, лечения и
профилактики ИСМП в ОИТ.
В этом междисциплинарном экспертном обзоре
обобщена недавняя эпидемиология ИСМП в ОИТ, обсуждено место современных
микробиологических методов в диагностике
данных инфекций, рассмотрены операционные и эпидемиологические определения и
переопределено место некоторых спорных профилактических мер, включая импрегнированные
противомикробными препаратами устройства, повязки для катетеров и жидкости для полоскания
рта на основе хлоргексидина. Наконец,
предлагаются рекомендации, которые могут
снизить заболеваемость и вспышки ИСМП в ОИТ.
Рекомендации для клинической практики
• Несмотря на усилия по профилактике, частота
ИСМП остается высокой в структуре заболеваемости и летальности.
•
COVID-19 может способствовать возникновению вторичных инфекций, таких как
инфекция кровотока и пневмония, предположительно из-за более высокой тяжести
заболевания и чрезмерной нагрузки на персонал.
• Доля предотвратимых ИСМП зависит от
популяции пациентов, соблюдения мер профилактики и типа инфекции, например, катетер-ассоциированных
инфекций кровотока, можно легко избежать
при использовании комплексных мер профилактики, основанных на доказательных данных.
• Губки, пропитанные хлоргексидином,
снижают риск грамположительной бактериемии, но их использование сопровождается риском
повышения устойчивости к этому антисептическому средству, особенно у грамотрицательных
бактерий. Поэтому их использование должно быть зарезервировано для вспышек.
• Использование хлоргексидина для ухода за
полостью рта должно быть ограничено группами пациентов с наличием показаний,
основанных на доказательствах, учитывая возможную связь с летальностью.
Введение
ИСМП представляют собой серьезное бремя для
общественного здравоохранения (WHO, 2012). Ежегодно
во всем мире от ИСМП умирают более 140 000 человек (WHO, 2011).
Опросы в США
показывают, что 30% ИСМП возникают в ОИТ (Magill et
al., 2014; CDC, 2016). Более
того, ИСМП продлевают пребывание в ОИТ и
общую длительность госпитализации, увеличивают потребление антибиотиков и стоимость лечения.
Возникновение ИСМП является результатом сложного
взаимодействия факторов патогена (вирулентность, устойчивость к антибиотикам),
факторов хозяина (сопутствующая патология, острое заболевание), факторов
лечения (инвазивные устройства, селективное давление антибиотиков), процессов
организации здравоохранения (кадровое
обеспечение, профилактические меры) и даже климатологических
условий (Myny et al., 2005; Depuydt et al., 2006a,
2006b; Guzmґan-Herrador et al., 2016; Blot et al., 2021).
Хотя большинство возбудителей ИСМП эндогенное происхождение, ряд патогенов могут быть приобретены в процессе лечения от
человека или из окружающей среды (Siegel et al.,
2007). Медицинские сестры ОИТ играют ключевую
роль в профилактике и лечении ИСМП, поскольку они
участвуют в базовом гигиеническом уходе, клиническом наблюдении за участками,
наиболее подверженными инфицированию (например, мест введения катетера или
хирургических ран), а также в мониторинге системных признаков инфекции, реализации
инициатив по улучшению мер профилактики, правильном заборе проб для микробиологического исследования и ряда аспектов рационального использования
антибиотиков.
Постоянные усилия по предотвращению
инфекций привели к значительному снижению ИСМП, связанных с устройствами.
Тем не менее, ожидается, что в ближайшие годы бремя ИСМП
будет увеличиваться в результате интенсификации лечения, старения населения,
роста распространенности тяжелых сопутствующих заболеваний у пациентов ОИТ и
продолжающегося распространения микроорганизмов с множественной лекарственной
устойчивостью (МЛУ) в ОИТ, стационарах и даже внебольничной популяции (Dimopoulos et al., 2013; Blot et al., 2019a).
Тем временем в
организации работы сказывается постоянная нехватка высококвалифицированных
медсестер (Anders, 2021).
Изменение
эпидемиологии инфекций, приобретенных в ОИТ
Понимание эпидемиологии и динамики
инфекции необходимо для быстрого выявления пациентов с высоким риском или потенциально
угрожающих ситуаций. Из-за
индивидуальных и коллективных последствий инфекции и антибиотикорезистентности
от всего коллектива ОИТ требуется высокий уровень бдительности и соблюдение
профилактических мер. Тем не менее, по
сравнению с врачами ОИТ, медсестры больше всего подвержены прямому контакту с
пациентом и имеют практические возможности для обеспечения эффективного
соблюдения мер профилактики.
Распространенность ИСМП различается в
разных госпиталях и странах (Fig. 1). Различия могут быть связаны с характеристиками
пациентов, эпидемиологическими особенностями и организационными факторами (Rodríguez-Acelas et al., 2017).
Факторы на уровне пациента включают возраст,
сопутствующие заболевания (особенно иммуносупрессию), тяжесть заболевания,
продолжительность госпитализации и воздействие инвазивных устройств и процедур.
Помимо факторов хозяина, организационные факторы,
такие как большая рабочая нагрузка и низкое качество инфекционного контроля связаны
с более высоким риском ИСМП и MDRO acquisition
(Penoyer, 2010; Kelly et al., 2013; Lee et al.,
2018; Jansson et al., 2019). Соблюдение мер
инфекционного контроля снижает как риск
ИСМП, так и риск инфицирования полирезистентными возбудителями (Rello et al.; 2013 Blot, 2008; Nseir et al., 2011).
Наиболее частыми инфекциями в ОИТ являются
пневмония (включая вентилятор-ассоциированную пневмонию (ВАП), инфекции области
хирургического вмешательства (ИОХВ), катетер-ассоциированные инфекции кровотока
(КАИК) и катетер-ассоциированные инфекции мочевыводящих путей (КАМВП) (Vincent et al., 2009; Vogelaers и др., 2010).
Внутрибольничная пневмония является
наиболее распространенной и тяжелой формой ИСМП (Walter
et al., 2018). В недавнем
многоцентровом международном проспективном обсервационном исследовании в 114 ОИТ
частота вентилятор-ассоциированного трахеобронхита и ВАП на исходном уровне
была одинаковой (320 [11%; 10,2/1000 дней на ИВЛ] и 369 [12%; 8,8/1000 на ИВЛ],
p = 0,48) (Martin-Loeches et al., 2015).
Из-за более широкого использования неинвазивной и
высокопоточной вентиляции недавние исследования подчеркивают важность внутрибольничной
пневмонии вне ИВЛ, обнаруживаемой у 4,5/1000 пациенто-дней (Saied et al., 2020).
Внутрибольничные интраабдоминальные
инфекции (ИАИ) (послеоперационный и
третичный перитонит) составляют до 65% всех абдоминальных инфекций, наблюдаемых
у пациентов ОИТ (WHO, 2012). ИАИ
у пациентов в ОИТ выдвигают на первый план проблему устойчивости к
антибиотикам, которая в равной степени проявляется как при внебольничной
инфекции, так и при ИСМП (Blot et al., 2019b;
Vogelaers et al., 2021), требующей раннего хирургического контроля
источника и соответствующей антимикробной терапии (Augustin et al., 2010; Blot et al.,
2012; De Waele et al., 2014; Blot et al., 2019b).
В отличие от глобальной заболеваемости
ИСМП, уровень КАИК, вызванной карбепенемрезистентыми возбудителями снизился в нескольких странах за последнее
десятилетие. Несколько авторов
сообщают о показателях 1,0/1000 катетер-дней или меньше благодаря
оптимизированным процессам сестринского ухода и техническим инновациям (Timsit et al., 2018; Eggimann et al., 2019).
Частота возникновения ИСМП в ОИТ, как
правило, выше, а полирезистентые микроорганизмы, особенно грамотрицательные (Fig. 2), более распространены в странах с низким и
средним уровнем экономического развития по сравнению со странами с высоким экономическим
уровнем (Sakr et al., 2018; WHO, 2011). В
настоящее время Klebsiella pneumoniae, продуцирующая карбапенемазы (KPC),
эндемична в Израиле, Греции, Италии, Польше, Китае, Бразилии, Аргентине и
Колумбии и встречается почти во всех странах Европы (Albiger
et al., 2015). Аналогичным
образом, Candida auris в настоящее время распространена в Индии и на Ближнем
Востоке, а многочисленные вспышки зарегистрированы в США, Европе, Азии и других
странах (Satoh et al., 2009; Jeffery-Smith et al.,
2018). Инфекции,
вызванные полирезистентыми возбудителями, могут увеличить смертность и
продолжительность пребывания в стационаре, возможно, из-за задержек с
назначением адекватной антибактериальной терапии, но это спорный вопрос (Tabah et al., 2012; Stewardson et al., 2016)
Полирезистетные бактерии и Candida — не
единственные патогены, приобретаемые в ОИТ. Недавние
усовершенствованные методы диагностики помогли диагностировать приобретенные
респираторные вирусы при госпитальной пневмонии.
В недавнем исследовании грипп (27%) и риновирус (27%)
были двумя наиболее распространенными респираторными вирусами, выделенными при
госпитальной пневмонии в ОИТ (Loubet et al., 2017).
ОИТ являются зонами потенциального высокого риска
передачи таких респираторных вирусов (Grund et al.,
2010). Наконец, из-за
наличия множественных факторов риска пациенты в ОИТ подвергаются более высокому
риску инфекций Clostridium difficile с распространенностью 2% и 11%
среди пациентов с диареей в ОИТ (Karanik et al.,
2016).
Влияние инфекций,
приобретенных в ОИТ, на долгосрочные исходы
Изменения врожденного и адаптивного
иммунитета в результате ИСМП сохраняются
в течение длительного периода после клинического выздоровления.
Такие изменения коррелируют с долгосрочной смертностью
(Delano and Ward, 2016).
Пациенты, перенесшие внутрибольничный сепсис, имеют
повышенный риск смерти на срок до двух лет (Winters
et al., 2010).
В тайваньской когорте из 3070 пациентов с ИСМП,
вызванными золотистым стафилококком, инфекция была связана с 20-процентным
увеличением смертности в течение года (Su et al., 2013). Инфекция
также была связана с повышенным риском зависимости от диализа на 2,6% и
избыточным риском зависимости от вентилятора на 7,3% в течение одного года.
Эти грубые пропорции очень похожи на наблюдаемые в
когортном исследовании в Европе (Stewardson et al.,
2016).
У 17 536 пожилых
пациентов, поступивших в ОИТ воздействие КАИК и ВАП, было сходно с таковым при
сепсисе и пневмонии (Dick et al., 2012).
Внутрибольничный сепсис и пневмония были связаны с
повышенным риском смерти в течение одного года. Пневмония
также была связана с увеличением частоты обращений за медицинской помощью,
длительной госпитализацией и смертностью в течение пяти лет.
Пациенты неврологических ОИТ являются еще одной
группой с особенно высоким риском ИСМП. В
большой проспективной когорте пациентов ОИТ с травмой спинного мозга частота
внутрибольничной пневмонии/раневых инфекций составила 47%, что было связано с
более низким приростом функциональной моторной автономии через пять лет и
повышенной смертностью через 10 лет (Kopp et al. ., 2017).
Точно так же пневмония у больных после инсульта была связана с 50-процентным
увеличением риска смерти в течение одного года среди выживших в ОИТ (de Montmollin et al., 2019).
Иммуносупрессия и
инфекции, приобретенные в ОИТ
Иммуносупрессия,
связанная с госпитализацией в ОИТ
Иммуносупрессия, связанная с критическим
состоянием, часто встречается у пациентов ОИТ, страдающих любыми острыми
заболеваниями (Deknuydt et al., 2013; Roquilly et
al., 2017). У пациентов в ОИТ обнаруживаются функциональные изменения
миелоидных клеток (дендритов, моноцитов и макрофагов), врожденных лимфоцитов
(естественные киллеры, натуральные киллеры Т-клетки) и обычных лимфоцитов (Т- и
В-клетки) (Hotchkiss et al., 2013b).
Пациенты ОИТ с внебольничной или госпитальной пневмонией демонстрируют различные реакции транскрипции (van Vught et al., 2016), соответствующие
функциональным изменениям их иммунной системы. Кроме того, критическое состояние
нарушает нормальный баланс между иммуногенными и толерогенными реакциями. Например,
легкие естественным образом толерантны к инородному материалу, чтобы свести к
минимуму острое воспаление в ответ на вдыхаемые частицы (Roquilly et al., 2019), но эта естественная толерантность
усугубляется иммунной дисфункцией при критических состояниях, что делает
пациентов особенно восприимчивыми к пневмонии (Fig. 3).
Интересно, что риск госпитальной
пневмонии прямо коррелирует с тяжестью иммунных изменений пациентов, включая:
(1) степень снижения экспрессия человеческого лейкоцитарного антигена-DR (HLA-DR) на циркулирующих моноцитах (Hotchkiss et al., 2013a); (2) увеличение продукции иммуносупрессивных цитокинов, таких
как IL-10 (Roquilly et al., 2014), и (3) истощение пула
Т-лимфоцитов (Venet et al., 2013).
Иммуносупрессия,
связанная с основным заболеванием
Пациенты с онкологическими и
гематологическими заболеваниями часто нуждаются в госпитализации в ОИТ в
результате инфекции, токсичности лечения и поражения органов в результате злокачественного новообразования (Schelenz et al., 2013; Marin et al., 2014; Taplitz et
al., 2018). Инфекционный риск
у онкологических больных связан с дефектами врожденного или адаптивного
иммунитета, обусловленного либо злокачественным
новообразованием как таковым, либо цитотоксическими эффектами лечения (Fig. 4) (Talcott
et al., 1988).
Нейтропения, особенно длительная (>7 дней), является основным фактором
риска инфекции и требует защитной изоляции (Freifeld
et al., 2011). Другие факторы
также могут играть важную роль (Table 1) (Freifeld
et al., 2011; Taplitz et al., 2018). Острые
гематологические и миелодиспластические синдромы имеют повышенный инфекционный
риск из-за инфильтрации костного мозга злокачественными новообразованиями.
Химиотерапия и реакция «трансплантат против хозяина»
способствуют оппортунистической инфекции за счет нарушения целостности
слизистой оболочки (Freifeld et al., 2011; Taplitz
et al., 2018).
Солидные опухоли в большей степени сопровождаются
локальными осложнениями, связанными или не связанными с операцией по удалению
опухоли, а не с недостаточностью костного мозга или цитотоксическими эффектами
лечения (Table 2)
(Talcott et al., 1988; Freifeld et al., 2011;
Taplitz et al. , 2018). Наконец,
пациенты с ослабленным иммунитетом, независимо от причины, нуждаются в
специальных мерах по контролю риска ИСМП (Table 2).
Роль инфекции
COVID-19 в риске ИСМП
COVID-19 высветила проблему профилактических мер для защиты лиц,
осуществляющих уход, и пациентов от заражения при сохранении оптимального
стандарта качества медицинской помощи (Jansson et
al., 2020). Любая вспышка ИСМП
будь то среди клиницистов или пациентов, должна потребовать расследования пути инфицирования
и причины возникновения (Mongin et al., 2021; Vuichard-Gysin et al., 2021).
Первоначально в основе профилактики лежит знание
способа заражения. Некоторые
действия, такие как процедуры с образованием аэрозолей, сопряжены с
неотъемлемым риском передачи инфекции и требуют более совершенных профилактических
мер (Tran et al., 2012; Lormans et al., 2021).
Как и для других респираторных вирусов,
для SARS-CoV-2, по-видимому, преобладает прямая передача, однако поверхности,
по-видимому, контаминированы в 27–45% случаев, что требует специальной очистки
(Mendes et al., 2021).
COVID-19 значительно увеличил заболеваемость ВАП с
совокупной оценочной заболеваемостью 45,4% (95% ДИ 37,8–53,2%) (Ippolito et al., 2021).
Острый респираторный дистресс-синдром (ОРДС),
связанный с COVID-19, связан с более глубокой гипоксией, чем ОРДС другого
происхождения, что приводит к увеличению продолжительности искусственной
вентиляции легких и более частому применению положения лежа на животе, что
является факторами риска ИСМП и КАИК (Luyt et al., 2020; Razazi et al., 2020;
Maes et al., 2021; Rouzґe et al., 2021).
COVID-19 увеличивает риск ИСМП из-за
множества факторов: менее строгого использования стандартных стратегий
профилактики, иммунных нарушений, связанных с заболеванием и терапией, более длительной
ИВЛ и седации, более частой вентиляции в прон-позиции и более высокому риску
инфаркта легкого, ассоциированного с суперинфекцией.
Переполненность ОИТ и их укомплектованность недостаточно
подготовленным медицинским персоналом может снизить качество соблюдения
программ профилактики ИСМП (Reper et al., 2020;
Arabi et al., 2021; Reper et al., 2021; Wicky et al., 2021).
Оценка роли
состава микробиоты в риске ИСМП
Недавние достижения в микробиологии и
метагеномике (т. е. секвенирование всех нуклеиновых кислот в образце) привели к
лучшему пониманию микробиоты пациентов, ее изменений во время пребывания в ОИТ
и того, как это может повлиять на вероятность и характер ИСМП в ОИТ.
Понимание микробиоты кожи и полости рта, особенно
когда речь идет об использовании антисептических средств, потенциально
снижающих резистентность к колонизации полирезистентными микроорганизмами,
особенно важно для сестринской практики. Тем не менее, мало
что известно о роли комменсальной флоры кожи и полости рта в динамике ИСМП в
ОИТ.
Микробиота кишечника и легких наиболее
изучена у пациентов в ОИТ. Микробиота
кишечника служит защитой от колонизации полирезистентными бактериями и их персистенции
и помогает предотвратить инфекции (Vollaard and
Clasener, 1994; Buffie and Pamer, 2013; Gosalbes et al., 2016; Caballero et
al., 2017; Leo et al., 2019). Желудочно-кишечный
тракт является основным резервуаром для большинства бактериальных патогенов,
связанных с ИСМП (Sommerstein et al., 2019).
Ректальная колонизация грамотрицательными бактериями
является независимым фактором риска как колонизации дыхательных путей, так и
новой грамотрицательной инфекции в ОИТ (Frencken et
al., 2018). Действительно,
грамотрицательные микроорганизмы из кишечника получают доступ к ротоглотке
после интубации и быстро «перерастают» комменсальные штаммы ротоглотки, что
увеличивает риск ВАП (Freedberg et al., 2018;
Sommerstein et al., 2019).
Нормальная микробиота легких варьирует в
зависимости от состояния здоровья и заболевания.
У пациентов с ИВЛ меньше различий в образцах нижних и
верхних дыхательных путей по сравнению со здоровыми субъектами, что может увеличивать
риск пневмонии (Kelly
et al., 2016; Langelier et al., 2018; Emonet et al., 2019).
Диагностика ИСМП:
оценка разрыва между эпидемиологическими и прикроватными определениями
Первый шаг в борьбе с ИСМП в ОИТ состоит
во внедрении надежной системы эпиднадзора для отслеживания инфекций и выявления
факторов риска, связанных с ИСМП. Для
всех ИСМП сосуществуют два определения, ориентированные на разные цели:
эпидемиологическое определение для целей эпиднадзора и клиническое определение
для принятия решений у постели больного.
Эпидемиологические данные разрабатываются для
информирования об эффективных программах профилактики инфекций и борьбы с ними.
Их также можно использовать в качестве самостоятельных
показателей качества для сравнительного анализа.
Клинические определения предназначены для быстрого и точного распознавания ИСМП для
принятия своевременных решений о лечении у постели больного.
Интеллектуальные информационные технологии могут
служить значимым инструментом для согласования ожиданий и требований для обоих
определений и удовлетворения потребностей различных пользователей.
Такие инструменты могут упростить и ограничить изменчивость
процесса наблюдения, а также повысить эффективность раннего выявления пациентов
с ИСМП. Однако
рассмотрение одного и того же объекта под разными углами может увековечить
продолжающуюся путаницу между наблюдением и клиническим диагнозом.
Диагностика вентилятор-ассоциированных
инфекций нижних дыхательных путей Вентилятор-ассоциированные
инфекции нижних дыхательных путей включают ВАП и вентилятор-ассоциированный
трахеобронхит (Timsit et al., 2017). ВАП определяется
как инфекция паренхимы легкого, возникшая, по крайней мере, через 48 часов
после начала ИВЛ. Вентилятор-ассоциированный трахеобронхит представляет собой
промежуточный процесс от колонизации до ВАП. Текущий диагноз вентилятор-ассоциированного
трахеобронхита основывается на отсутствии рентгенологических инфильтратов
грудной клетки и наличии признаков, соответствующих респираторному воспалению,
наряду с ,по крайней мере, одним микробиологическим критерием. Клинические
критерии ИВЛ-ассоциированных инфекций нижних дыхательных путей субъективны
(например, рентгенологические инфильтраты); как клинические, так и микробиологические
критерии плохо коррелируют с гистологическими изменениями, что приводит к
высоким показателям гипердиагностики и избыточного лечения (Tejerina et al., 2010; Nussenblatt et al., 2014; Kalil et
al., 2016).
Диагностика катетер-ассоциированных инфекций
кровотока
Окончательный диагноз КАИК требует
микробиологического подтверждения того, что внутрисосудистый катетер является
источником бактериемии, и исключения альтернативных очагов инфекции (Mermel et al., 2009).
Это определение делает упор на специфичность диагноза,
но сложно в использовании, поскольку требует
специализированного микробиологического тестирования, которое не всегда
доступно. У постели больного
диагноз КАИК часто омрачается неуверенностью в отношении того, действительно ли
сосудистый катетер является источником инфекции, и необходимостью различия между контаминацией и инфекцией,
вызванной комменсалами кожи (Tomlinson et al.,
2011; Cherifi et al., 2013).
Надлежащее наблюдение медсестрой за местом
введения катетера при его использовании имеет важное значение, поскольку
наличие ≥1 местного признака (покраснение, экссудация) повышает вероятность КАИК в первые семь дней после установки катетера
(Buetti et al., 2021). В целях
эпиднадзора CDC-NHSN США предложила упрощенную концепцию КАИК (CDC, 2019), которая, однако, приводит к
гипердиагностике и искажает истинную частоту КАИК (CDC,
2019; Woeltje et al., 2008; Tomlinson et al., 2011; Dixon-Woods et al. , 2012).
Диагностика
инфекций области хирургического вмешательства (ИОХВ)
Определения CDC-NHSN для ИОХВ (поверхностная
и глубокая инфекция разреза и инфекция орган/пространство) наиболее часто
используются в литературе (Horan et al., 1992).
Непосредственное наблюдение медсестры имеет решающее
значение. Критериями ИОХВ
являются локализованный отек или эритема, гнойное отделяемое из операционной
раны и микробиологическое подтверждение инфицирования.
ВОЗ заявила, что не существует единого объективного золотого
стандарта диагностики хирургической
раневой инфекции (Allegranzi et al., 2016).
ИОХВ также может указывать на
продолжающийся абдоминальный сепсис после операции на органах брюшной полости (Pusajґo et al., 1993).
Пациенты с инфекциями мягких тканей (включая ИОХВ) в ОИТ
подвержены высокому риску диагностических ошибок, в том числе гиподиагностике,
что приводит к удвоению внутрибольничной смертности (Abe
et al., 2019). Идеального
инструмента для ранней диагностики ИОХВ у пациентов ОИТ не существует.
Существуют ограниченные послеоперационные меры
профилактики ИОХВ, относящиеся к ОИТ. Ключевые
меры включают оптимальную антибиотикопрофилактику, ежедневный осмотр раны и
соответствующий уход за раной для предотвращения экзогенной контаминации.
Различие между
колонизацией и инфекцией
Наличие потенциально патогенных и полирезистентных
микроорганизмов в микробиологических образцах, особенно из нестерильных
участков тела, не является доказательством инфекции. Интерпретация
микробиологического результата будет зависеть от пяти факторов: (1)
клинического контекста (признаки инфекции?), (2) места отбора проб (стерильный участок?),
(3) микробного вида (патогенного или возможного контаминанта?) , (4)
предполагаемое место инфекции (часто колонизируемая зона?), (5) чувствительность
и специфичность микробных культур с учетом предшествующего воздействия
антибиотиков, источника образца и микробиологического метода. Увеличение числа
микробиологических проб без четко определенных клинических показаний может
привести к чрезмерному использованию антибиотиков (Tambyah
and Maki, 2000; Nussenblatt et al., 2014).
Однако при разумном использовании с
ограничением назначения антибиотиков регулярный отбор проб для целей
микробиологического надзора может дать актуальные и персонализированные данные
для руководства эмпирическим назначением антибиотиков (Table ) (Depuydt et al., 2008; Brusselaers et al., 2013; Zahar et
al , 2019).
Возрастающая роль
микробиологических лабораторий в диагностике и последующем наблюдении за ИСМП
Бактериологические лаборатории
претерпевают кардинальные изменения. Лабораторная
автоматизация позволяет считывать культуральные чашки в режиме реального времени:
пробы, приготовленные утром, могут дать жизнеспособные результаты к полудню, а
антибиотикограмма будет доступна на следующее утро.
Еще одной точкой эволюции являются мультиплексные,
автоматизированные и быстрые анализы полимеразной цепной реакции (ПЦР).
Теперь они доступны и называются
«синдромными тестами», поскольку нацелены не только на бактерии, но и на
вирусы, паразиты и грибки (Ramanan et al., 2018).
Эти тесты, как правило, требуют минимальной ручной
подготовки и позволяют получить результат в короткие сроки (Fig. 5), что дает возможность
тестирования по месту оказания медицинской помощи или синдромного тестирования
для раннего выявления ИСМП, а ранние результаты чувствительности позволяют
своевременно ввести соответствующие антибиотики.
Тем не менее, обилие целей поднимает вопрос о «нежелательных»
тестированиях. Например,
клиницисты должны ломать голову над тем, как интерпретировать присутствие
вирусов при первоначальном подозрении на бактериальную ВАП, особенно в свете
исследований, связывающих положительные тесты на вирусы с плохим исходом (Loubet et al., 2017).
Развертывание синдромных тестов должно сопровождаться
тесным диалогом между реаниматологами и микробиологами.
Еще более сложным будет появление клинической метагеномики.
Это относится к секвенированию нуклеиновых
кислот, присутствующих в клиническом образце, с целью выявления патогенов и
определения их чувствительности к противомикробным препаратам (Chiu and Miller, 2019).
Метагеномное секвенирование идентифицирует гораздо
больше бактерий, чем обычные культуральные методы, когда микробиологи сообщают
только о наиболее вероятных патогенах. Эти
незарегистрированные бактерии, а также реакция хозяина могут помочь улучшить
диагностику инфекций нижних дыхательных путей. Метагеномное
секвенирование в сочетании с инструментами машинного обучения, обеспечивающими
(1) наиболее вероятные патогенные бактерии, (2) разнообразие окружающего
бактериального сообщества и (3) реакцию хозяина (через транскриптом), может
точно предсказать возникновение пневмонии (Langelier
et al. др., 2018).
Вирусы в образцах:
патогены или «пассажиры»?
Выявление вирусов молекулярными методами
при подозрении на ИСМП является обычным явлением.
Однако определение их клинического значения
представляет собой сложную задачу. Из-за
иммунопаралича, следующего за начальной провоспалительной реакцией на агрессию,
латентные вирусы, такие как Herpesviridae, могут реактивироваться у пациентов в
ОИТ (Hotchkiss et al., 2013a).
Вирус простого герпеса, цитомегаловирус, а также вирус
Эпштейна-Барра часто обнаруживаются в легких или крови пациентов ОИТ (до 50%),
и их реактивация связана с повышенной заболеваемостью и смертностью (Luyt et al., 2007; Limaye et al. , 2008; Coisel et al., 2012;
Libert et al., 2015; Ong et al., 2017; Li et al., 2018).
Точное значение этих реактиваций
обсуждается. Эти вирусы могут
иметь истинную патогенность и вызывать повреждение органов, тем самым играя
непосредственную роль в заболеваемости и смертности, наблюдаемых при их
реактивации. Однако они также
могут быть «сторонними наблюдателями», а реактивация является вторичной по
отношению к тяжести заболевания. Вопрос
остается без ответа, поскольку данные о потенциальном преимуществе
противовирусного лечения неубедительны. Респираторные
вирусы (риновирус, грипп, аденовирус и другие) в последнее время вызывают ИСМП
у пациентов, находящихся или не находящихся на ИВЛ (Vincent
et al., 2009; Nseir et al., 2011; Loubet et al., 2017; Shorr et al. , 2017).
Присутствие вирусов при ВАП связано с
неблагоприятными исходами (Grund et al., 2010).
Перекрестная передача респираторных вирусов, таких как
грипп, в настоящее время хорошо выявляется с помощью ПЦР и может быть причиной
10 % госпитализаций в ОИТ по поводу гриппа (Alvarez-Lerma
et al., 2017) и растущего числа эпизодов тяжелого ОРДС, особенно
у пациентов с ослабленным иммунитетом.
Однако их глобальное влияние на заболеваемость и
смертность неизвестно.
Предотвратимость
ИСМП в ОИТ
Большинство экспертов сходятся во мнении,
что значительную долю инфекций, связанных с устройствами, можно предотвратить с
помощью рекомендаций, основанных на фактических данных, и комплексов профилактических
мер, оптимизирующих приверженность персонала к соблюдению рекомендаций (Blot et al., 2014; van der Kooi et al., 2018; Labeau,
2020). В
первом систематическом обзоре, охватывающем период с 1990 по 2002 г.,
оценивалась доля потенциально предотвратимых ИСМП по данным мультимодальных
интервенционных исследований (Harbarth et al., 2003).
Оценка 30 отчетов показала, что существует большой
потенциал для снижения показателей ИСМП, от минимального эффекта снижения в 10%
до максимального эффекта в 70%, в зависимости от условий, дизайна исследования,
исходных показателей инфицирования и типа инфекции.
Наиболее важный эффект снижения был
выявлен для КАИК.
Во втором систематическом обзоре, проведенном в 2011
г., утверждалось, что до 65–70 % случаев КАИК и КАИМВП и 55 % случаев ВАП и
ИОХВ можно предотвратить с помощью современных научно обоснованных стратегий,
оценки, которые вызвали некоторые споры (Umscheid
et al., 2011). Совсем недавно систематический обзор (Schreiber et al., 2018) исследований,
опубликованных в период с 2005 по 2016 год, показал несколько более низкую долю
предотвратимых инфекций. Ни в одном из упомянутых
систематических обзоров не проводилась стратификация анализа по типу
микроорганизмов; таким образом,
сохраняется неопределенность в отношении возможности предотвращения экзогенной
перекрестной инфекции различными полирезистентыми микроорганизмами.
Образовательные программы для медицинских
работников, встроенные в комплексную программу повышения качества, являются
краеугольным камнем любого подхода к профилактике (Fig. 6). Что
касается инфекций, связанных с устройствами, особое внимание следует уделять ограничению
их использования и времени пребывания инвазивных устройств (Buetti and Timsit, 2019), а их необходимость
необходимо оценивать ежедневно (Vazquez Guillamet
and Kollef, 2018).
Должны ли мы использовать активные
антисептики/антибиотики для профилактики ИСМП?
Многочисленные исследования связывают
возникновение ИСМП с предшествующей колонизацией и, в некоторых случаях, с
избыточным ростом эндогенных патогенных бактерий (Johanson
et al., 1979; Blot et al., 2005; Brusselaers et al., 2012; Frencken et al.,
2018).
Использование антисептиков (в основном
хлоргексидина) и антибиотиков для профилактики ИСМП в ОИТ показало
потенциальную пользу, несмотря на опасения по поводу повышения уровня
бактериальной резистентности. В
нескольких исследованиях рассматривалась роль кожной, пищеварительной и
ротоглоточной деколонизации в снижении риска ИСМП в ОИТ, и подчеркивалось, что
рациональное использование этих мероприятий в конкретных ситуациях может быть
полезным, если их применять продуманно.
Роль хлоргексидина
глюконата в профилактике ИСМП в ОИТ
Хлоргексидина глюконат (ХГГ) обладает
широким антимикробным действием и пролонгированным остаточным эффектом.
Он доступен в виде предварительно упакованных губок,
пропитанных ХГГ, в виде антисептического мыла или растворов и жидкостей для полоскания
рта. Губки, пропитанные ХГГ,
значительно снижают частоту грамположительной, но не грамотрицательной
бактериемии (Afonso et al., 2016; Eggimann et al.,
2019).
Их применение связано с повышенным риском
инфекций, вызванных бактериями с пониженной чувствительностью к ХГГ.
На сегодняшний день не было отмечено никаких
клинических последствий (Afonso et al., 2016),
но реализация универсальной деколонизации кожи на основе ХГГ требует тщательной
оценки. Необходимо
провести испытания, изучающие безопасность, экономическую эффективность и
последствия систематического использования губок для пациентов с высоким риском
грамотрицательных инфекций (Dray et al., 2019).
Учитывая угрозу роста устойчивости к ХГГ,
использование губок, пропитанных ХГГ, может быть зарезервировано для борьбы со
вспышками, а не в рутинной практике. Как
губки, пропитанные ХГГ, так и повязки с гелем ХГГ использовались для ухода за
постоянными внутрисосудистыми устройствами и привели к снижению риска
внутрисосудистых инфекций до 60% (Timsit et al.,
2009, 2012; Ульман и др., 2016; Эггиманн и др., 2019).
Их использование было рекомендовано у
взрослых пациентов группы высокого риска, когда вероятность инфекции остается высокой, несмотря на
применение соответствующих мероприятий ухода за катетером.
Уход за полостью рта ХГГ широко распространен в ОИТ для
интубированных пациентов, хотя его польза для снижения риска пневмонии была доказана
только у кардиохирургических пациентов (Labeau et
al., 2011; Klompas et al., 2014). Его
использование было недавно оспорено. Во-первых,
ополаскиватель для рта с 2% раствором ХГГ оказался триггером для обратимого
орального мукозита у 9,8% пациентов (Plantinga et
al., 2016). Во-вторых, метаанализы
показали, что использование ХГГ для
обработки полости рта увеличивает риск смерти (Klompas
et al., 2014; Price et al., 2014).
Кроме того, недавнее крупное
обсервационное когортное исследование показало, что уход за полостью рта с
помощью ХГГ был связан с повышенной смертностью (Deschepper
et al., 2018). В большой группе
пациентов ОИТ из 186 больниц уход за полостью рта ХГГ также оказался
независимым фактором риска сепсиса и смерти (Parreco
et al., 2020). Было высказано
предположение, что эрадикация микробиома полости рта с использованием
пероральных антисептиков приводит к нарушению биодоступности оксида азота, что
подвергает пациентов риску опасных для жизни осложнений, таких как ишемическая
болезнь сердца и сепсис. (Blot, 2021).
If this
hypothesis proves sound, the deleterious effect would be valid for all
antiseptic mouthwash solutions and not exclusively those based on CHG. While
awaiting more insights it seems wise to limit the use of CHG mouthwash to evidence-based
indications.
Moreover,
a recent study demonstrated that omitting CHG mouthwashes from the oral care
routine does not impact ICU mortality while improving oral health scores (Dale
et al., 2021).
Если эта гипотеза подтвердится, вредный
эффект будет предположен для всех антисептических растворов для полоскания рта,
а не только для тех, которые основаны на ХГГ. В
ожидании дополнительных сведений представляется разумным ограничить
использование растворов ХГГ для
полоскания рта CHG показаниями, основанными на фактических данных.
Более того, недавнее исследование показало, что
исключение ХГГ-содержащих средств из рутинной практики ухода за полостью рта не
влияет на смертность в ОИТ (Dale et al., 2021).
Какова роль материалов, импрегнированных антимикробными
средствами?
Для предотвращения ВАП, КАИК и КАИМВП были предложены материалы с антиинфекционной
пропиткой. Метаанализ 27
рандомизированных контролируемых клинических исследований, оценивающих клиническую
эффективность центральных венозных катетеров, обработанных противоинфекционными
агентами, показал значительное снижение КАИК по сравнению с катетерами без
покрытия (Hockenhull et al., 2009).
Катетеры, пропитанные противомикробными препаратами,
кажутся особенно подходящими, когда фоновая частота КАИК высока, несмотря на
соблюдение комплексной стратегии профилактики инфекций (Timsit et al., 2018).
A recent
meta-analysis based on studies performed in settings with a low prevalence of
antibiotic resistance, concluded that SOD and SDD with intravenous antimicrobials
was associated with lower mortality rates, fewer HAIs, and less carriage of
MDROs (Wittekamp
et al., 2018, 2020). These results appear to only apply in settings with
low baseline levels of MDROs. The use of SOD and SDD without intravenous antimicrobials
was not associated with decreases in neither the rate of bacteremia due to MDRO
nor 28-day ICU mortality in countries where the prevalence of MDRO was higher (Wittekamp
et al., 2018).
Роль селективной
пищеварительной и оральной деконтаминации (СПД и СОД)
Недавний метаанализ, основанный на
исследованиях, проведенных в условиях с низкой распространенностью
антибиотикорезистентности, пришел к выводу, что СПД и СОД при внутривенном
введении противомикробных препаратов были связаны с более низкими показателями
смертности, меньшим количеством ИСМП и меньшим количеством носительства полирезистентных
микроорганизмов (Wittekamp et al., 2018, 2020).
Эти результаты, по-видимому, применимы только в
условиях с низкими исходными уровнями полирезистентых возбудетелей.
Использование СПД и СОД без внутривенного введения
противомикробных препаратов не ассоциировалось ни со снижением частоты
бактериемии, вызванной полирезистентными
микроорганизмами, ни с 28-дневной смертностью в ОИТ в странах, где
распространенность полирезистентных бактерий была высокой (Wittekamp et al., 2018).
Использование противоинфекционных средств
для предотвращения инфекции требует тщательной оценки риска и пользы как для
пациента, так и для общества. На
Fig. 7 представлена оценка риска и пользы по
сравнению с программой профилактики и инфекционного контроля, которая считается
золотым стандартом в борьбе с инфекциями.
Вывод
ИСМП в ОИТ остаются причиной высокой
смертности, а их профилактика является основной задачей. Пожилой
возраст пациентов, сопутствующие заболевания и иммунодефицитное состояние обусловливают
постоянное увеличение частоты ИСМП, приобретенных в ОИТ, в некоторых центрах.
Хотя «Нулевой уровень ИСПМ» недостижим, наша цель
должна состоять в том, чтобы достичь самых низких пороговых значений, описанных
в литературе. Кроме того,
высокая распространенность резистентности к антибиотикам увековечивает персистенцию
ИСМП во всем мире. Их снижение
требует дальнейшего внедрения профилактических комплексов в сочетании с
программами рационального использования противомикробных препаратов.
Растущие знания о микробиоте, вероятно,
позволят в будущем внедрять новые профилактические меры, которые могут быть
основаны на внимании к комменсальной флоре (Hamilton
and Behal 2020), более четкого определения показаний для применения
пробиотиков или манипулировании микробиотой
(Young, 2016).
Новые диагностические инструменты помогут
нам лучше выявлять инфицированных пациентов. Однако
они потребуют тщательной оценки перед внедрением.
Наконец, стратегии обеззараживания и деколонизации,
вероятно, придется ограничить группами высокого риска, чтобы свести к минимуму
селекцию возбудителей, устойчивых к антисептикам.
Будущее профилактики в ОИТ, вероятно, будет основано
на нашей способности адаптировать политику и новые технологии к профилям риска конкретного
пациента.
References
Abe, T., Tokuda, Y., Shiraishi,
A., Fujishima, S., Mayumi, T., Sugiyama, T., et al., 2019. In-hospital mortality associated
with the misdiagnosis or unidentified site of infection at admission. Crit Care. BioMed Central 23 (1), 202–209.
Afonso, E., Blot, K., Blot, S., 2016. Prevention of hospital-acquired bloodstream infections through chlorhexidine gluconate-impregnated washcloth bathing
in intensive care units: a systematic review and meta-analysis of randomised crossover trials. Euro. Surveill.
21 (46), 30400.
Albiger, B., Glasner,
C., Struelens, M.J., Grundmann, H., Monnet, D.L., European Survey of Carbapenemase-Producing Enterobacteriaceae (EuSCAPE) working group, 2015. Carbapenemase-producing Enterobacteriaceae in Europe: assessment
by national experts from 38 countries, May 2015. Euro Surveill. European
Centre for Disease Prevention and Control 20 (45), 30062.
Allegranzi, B., Zayed,
B., Bischoff, P., Kubilay, N.Z., de Jonge,
S., de Vries, F., et al., 2016. New WHO recommendations on intraoperative and postoperative measures
for surgical site infection
prevention: an evidence-based global perspective. Lancet
Infect. Dis. 16 (12), e288–e303.
Alvarez-Lerma, F., Marín-Corral, J., Vil`a, C., Masclans, J.R., Loeches, I.M., Barbadillo, S., et al., 2017. Characteristics of patients with hospital-acquired influenza
A (H1N1) pdm09 virus admitted
to the intensive care unit.
J. Hosp. Infect. 95 (2), 200–206.
Anders, R.L., 2021. Patient safety time for federally mandated registered
nurse to patient ratios. Nurs. Forum. John Wiley & Sons Ltd.
Arabi, Y., Al-Shirawi, N., Memish, Z., Anzueto, A., 2008. Ventilator-associated pneumonia in adults in developing
countries: a systematic
review. Int. J. Infect. Dis. 12 (5), 505–512.
Arabi, Y.M., Azoulay, E´., Al-Dorzi, H.M., Phua, J., Salluh, J., Binnie, A., et al., 2021. How the COVID-19 pandemic
will change the future of critical care. Intensive Care Med. Springer Berlin Heidelberg 47, 282–291.
Augustin, P., Kermarrec,
N., Muller-Serieys, C., Lasocki, S., Chosidow, D., Marmuse, J.-P., et al., 2010. Risk factors
for multidrug resistant bacteria
and optimization of empirical antibiotic therapy in postoperative peritonitis. Crit. Care. BioMed Central Ltd 14 (1), R20.
Behari, A., Kalafatis, N., 2015. Incidence
and outcome of ventilator-associated
pneumonia in Inkosi Albert Luthuli and King Edward VIII Hospital surgical
intensive care units. South Afr. J. Crit. Care 31 (1), 16–18.
Blot, S., 2008. Limiting the attributable mortality
of nosocomial infection
and multidrug resistance in intensive
care units. Clin. Microbiol. Infect.
14 (1), 5–13.
Blot, S., 2021. Antiseptic mouthwash, the nitrate-nitrite-nitric oxide pathway, and
hospital mortality: a hypothesis generating review. Intensive Care Med. Springer Berlin Heidelberg 47, 28–38.
Blot, K., Bergs, J., Vogelaers, D., Blot, S., Vandijck,
D., 2014. Prevention of central line- associated bloodstream infections through quality improvement interventions: A systematic review and meta-analysis. Clin. Infect. Dis. Oxford University Press 59
(1), 96–105.
Blot, S., Depuydt,
P., Vogelaers, D., Decruyenaere, J., De Waele,
J., Hoste, E., et al., 2005. Colonization status and appropriate antibiotic
therapy for nosocomial
bacteremia
caused by antibiotic-resistant gram-negative bacteria in an intensive
care unit. Infect. Control Hosp. Epidemiol. 26 (6), 575–579.
Blot, S., De Waele, J.J., Vogelaers, D., 2012. Essentials for selecting antimicrobial
therapy for intra-abdominal infections. Drugs. Springer
International Publishing 72 (6), e17–e32.
Blot, S., Antonelli, M., Arvaniti, K., Blot, K., Creagh-Brown, B., de Lange, D., et al., 2019b.
Epidemiology of intra-abdominal infection and sepsis in critically ill
patients: “AbSeS”, a multinational observational cohort study and ESICM Trials
Group Project. Intensive Care Med. Springer
Berlin Heidelberg 45, 1703–1717.
Blot, K., Hammami,
N., Blot, S., Vogelaers, D., Lambert, M.-L., 2019a. Increasing
burden of Escherichia coli, Klebsiella pneumoniae, and Enterococcus faecium in hospital-acquired bloodstream infections (2000–2014): A national dynamic cohort
study. Infect. Control. Hosp. Epidemiol. Cambridge
University Press 40 (6), 705–709.
Blot, K., Hammami,
N., Blot, S., Vogelaers, D., Lambert, M.-L., 2021. Seasonal variation of hospital-acquired bloodstream
infections: A national cohort study. Infect. Control. Hosp. Epidemiol. Cambridge
University Press 1–7.
Braga IA, Campos
PA de,
Batista˜o DWDF,
Gontijo Filho
PP, Ribas
RM. Using
point prevalence survey to define burden of antimicrobial use among 35 adult intensive
care units in Brazil. Infect Dis (Lond).
Taylor & Francis; 2019;51(6):459–462.
Brusselaers, N., Logie, D., Vogelaers, D., Monstrey, S., Blot, S., 2012. Burns, inhalation injury and ventilator-associated pneumonia:
value of routine surveillance cultures. Burns 38 (3), 364–370.
Brusselaers, N., Labeau, S., Vogelaers,
D., Blot, S., 2013. Value of lower respiratory tract surveillance cultures to predict
bacterial pathogens in ventilator-associated pneumonia: systematic review and diagnostic test accuracy meta-analysis. Intensive
Care Med. Springer-Verlag 39 (3), 365–375.
Buetti, N., Timsit, J.-F., 2019. Management and prevention of central venous catheter-
related infections in the ICU. Semin. Respir. Crit. Care Med. 40 (4), 508–523.
Buetti, N., Ruckly,
S., Lucet, J.-C., Mimoz, O., Souweine, B., Timsit, J.-F., 2021. Factors influencing local signs at catheter
insertion site regardless of catheter-related
bloodstream infections. Crit. Care. BioMed Central 25 (1), 71–73.
Buffie, C.G., Pamer, E.G., 2013. Microbiota-mediated colonization resistance against
intestinal pathogens. Nat. Rev. Immunol.
Nature Publishing Group 13 (11), 790–801.
Caballero, S.,
Kim, S.,
Carter, R.A.,
Leiner, I.M.,
Suˇsac, B., Miller,
L., et
al., 2017. Cooperating commensals restore colonization resistance to vancomycin-resistant Enterococcus faecium. Cell Host Microbe
21 (5), 592–594.
Centers for Disease Control and Prevention. National and State Healthcare-associated Infections Progress Report, 2016. Available from: https://www.cdc.gov/HAI/pdfs/ progress-report/hai-progress-report.pdf. 2016.
Centers for Disease Control and Prevention. Bloodstream Infection Event (central
line- associated bloodstream infection and non-central line associated bloodstream infection). 2019. https://www.cdc.gov/nhsn/PDFs/pscManual/4PSC_CLABScurrent. pdf.
Charles, M.P., Easow, J.M., Joseph,
N.M., Ravishankar, M., Kumar, S., Umadevi, S., 2013. Incidence and risk factors
of ventilator associated pneumonia in a tertiary care hospital. Australas Med J. 6 (4), 178–182.
Cherifi, S., Mascart,
G., Dediste, A., Hallin, M., Gerard, M., Lambert, M.-L., et al., 2013. Variations in catheter-related bloodstream infections rates based on local practices. Antimicrob. Resist. Infect. Control. BioMed Central 2 (1), 10–14.
Chiang, C.-H., Pan, S.-C., Yang, T.-S., Matsuda,
K., Kim, H.B., Choi, Y.H., et al., 2018. Healthcare-associated infections in intensive care units in Taiwan, South Korea, and Japan: recent trends based on national surveillance reports. Antimicrob. Resist.Infect. Control. BioMed Central 7 (1), 129–212.
Chiu, C.Y., Miller,
S.A., 2019. Clinical
metagenomics. Nat. Rev. Genet. Nature Publishing Group 20 (6), 341–355.
Coisel, Y., Bousbia,
S., Forel, J.-M., Hraiech, S., Lascola, B., Roch, A., et al., 2012.Cytomegalovirus and herpes simplex virus effect on the prognosis
of mechanically ventilated patients suspected
to have ventilator-associated pneumonia. PLoS ONE Public Library of Science 7 (12), e51340.
Dale, C.M., Rose, L., Carbone,
S., Pinto, R., Smith, O.M., Burry, L., et al., 2021. Effect of oral chlorhexidine de-adoption and implementation of an oral care bundle on mortality for mechanically ventilated patients in the
intensive care unit (CHORAL): a multi-center stepped wedge cluster-randomized controlled trial. Intensive Care Med.Springer Berlin Heidelberg 47, 1295–1302.
Dancer, S.J., 2014. Controlling hospital-acquired infection: focus on the role of the
environment and new technologies for decontamination. Clin. Microbiol. Rev. American Society for Microbiology Journals
27 (4), 665–690.
Dasgupta, S., Das, S., Chawan,
N.S., Hazra, A., 2015. Nosocomial infections in the intensive care unit: Incidence, risk factors, outcome
and associated pathogens
in a public tertiary teaching
hospital of Eastern India. Indian J. Crit. Care Med. 19 (1),
14–20.
de Montmollin, E., Ruckly, S., Schwebel, C., Philippart, F., Adrie, C., Mariotte, E., et al., 2019. Pneumonia in acute ischemic
stroke patients requiring
invasive ventilation: Impact on short and long-term
outcomes. J. Infect. 79 (3), 220–227.
De Waele, J., Lipman, J., Sakr, Y., Marshall, J.C., Vanhems, P., Barrera Groba, C., et al., 2014. Abdominal infections in the intensive care unit: characteristics,
treatment and determinants of outcome.
BMC Infect. Dis. BioMed Central Ltd 14 (1), 420.
Deknuydt, F., Roquilly,
A., Cinotti, R., Altare, F., Asehnoune, K., 2013. An in vitro model of mycobacterial granuloma
to investigate the immune response
in brain-injured
patients. Crit. Care Med. 41 (1), 245–254.
Delano, M.J., Ward, P.A., 2016. The immune system’s role in sepsis progression, resolution, and long-term
outcome. Immunol. Rev. John Wiley & Sons, Ltd 274 (1),
330–353.
Depuydt, P., Benoit, D., Vogelaers,
D., Claeys, G., Verschraegen, G., Vandewoude, K., et al., 2006a. Outcome in bacteremia associated with nosocomial pneumonia and the impact of pathogen prediction by tracheal surveillance cultures.
Intensive Care Med. 32 (11), 1773–1781.
Depuydt, P., Benoit, D., Vogelaers, D., Decruyenaere, J., Vandijck, D., Claeys, G., et al., 2008. Systematic surveillance cultures as a tool to predict involvement
of multidrug antibiotic resistant bacteria
in ventilator-associated pneumonia. Intensive Care Med.34 (4), 675–682.
Depuydt, P.O., Blot, S.I., Benoit, D.D., Claeys, G.W., Verschraegen,
G.L., Vandewoude, K. H., et al., 2006b.
Antimicrobial resistance in nosocomial bloodstream infection associated with pneumonia and the value of systematic surveillance
cultures in an adult intensive care unit. Crit. Care Med. 34 (3), 653–659.
Deschepper, M., Waegeman,
W., Eeckloo, K., Vogelaers, D., Blot, S., 2018. Effects
of chlorhexidine gluconate oral care on hospital
mortality: a hospital-wide, observational cohort study. Intensive Care Med. Springer Berlin Heidelberg 44,1017–1026.
Dick, A., Liu, H., Zwanziger,
J., Perencevich, E., Furuya,
E.Y., Larson, E., et al., 2012.Long-term survival and healthcare utilization outcomes attributable to sepsis and pneumonia. BMC Health Serv. Res. BioMed Central 12 (1), 432–510.
Dimopoulos, G., Koulenti,
D., Blot, S., Sakr, Y., Anzueto, A., Spies, C., et al., 2013.Critically ill elderly adults with infection: analysis
of the extended prevalence of infection in intensive
care study. J. Am. Geriatr. Soc. 61 (12), 2065–2071.
Dixon-Woods, M., Leslie, M.,
Bion, J., Tarrant, C., 2012. What counts?
An ethnographic study of infection data reported
to a patient safety program.
Milbank Q. John Wiley& Sons, Ltd 90 (3), 548–591.
Dray, S., Forel, J.-M., Papazian,
L., 2019. What’s new in the prevention
of healthcare- associated infections using chlorhexidine gluconate-impregnated washcloths.Intensive Care Med. Springer Berlin Heidelberg 45, 249–251.
Dudeck, M.A., Horan, T.C., Peterson,
K.D., Allen-Bridson, K., Morrell, G., Anttila, A.,et al., 2013. National Healthcare
Safety Network report, data summary for 2011, device-associated module. Am. J. Infect. Control 41 (4), 286–300.
Eggimann, P.,
Pagani, J.-L.,
Dupuis-Lozeron, E., Ms,
B.E., Th´evenin, M.-J.,
Joseph, C.,et al., 2019. Sustained reduction
of catheter-associated bloodstream infections with enhancement of catheter bundle
by chlorhexidine dressings over 11 years. Intensive Care Med. Springer Berlin Heidelberg 45 (6), 823–833.
Elliott, D., Elliott,
R., Burrell, A., Harrigan, P., Murgo, M., Rolls, K., et al., 2015.
Incidence of ventilator-associated pneumonia
in Australasian intensive
care units: use of a consensus-developed clinical
surveillance checklist in a multisite prospective audit. BMJ Open British Medical
Journal Publishing Group 5 (10), e008924.
Emonet, S., Lazarevic,
V., Leemann Refondini, C., Gaïa, N., Leo, S., Girard, M., et al., 2019. Identification of respiratory microbiota markers in ventilator-associated
pneumonia. Intensive Care Med. Springer
Berlin Heidelberg 45, 1082–1092.
Entesari-Tatafi, D., Orford, N., Bailey, M.J., Chonghaile, M.N.I., Lamb-Jenkins, J.,
Athan, E., 2015. Effectiveness of a care bundle to reduce central line-associated bloodstream infections. Med. J. Aust. John Wiley & Sons, Ltd 202 (5), 247–250.
European Centre for Disease Prevention
and Control. Healthcare-associated infections
acquired in intensive
care units. In: ECDC. Annual epidemiological report for 2016. Stockholm: ECDC; 2018.
Freedberg, D.E., Zhou, M.J., Cohen, M.E., Annavajhala, M.K., Khan, S., Moscoso, D.I., et al., 2018. Pathogen colonization of the gastrointestinal microbiome at intensive care unit admission and risk for subsequent death or infection.
Intensive Care Med.
Springer Berlin Heidelberg
44 (8), 1203–1211.
Freifeld
A.G., Bow E.J.,
Sepkowitz K.A., Boeckh
M.J., Ito J.I., Mullen C.A., et al. Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer: 2010 update by the infectious diseases
Society of America. Vol. 52, Clinical Infectious
Diseases. 2011. pp. e56–93.
Frencken, J.F., Wittekamp, B.H.J.,
Plantinga, N.L., Spitoni, C., van de Groep, K., Cremer, O.L., et al., 2018. Associations between enteral colonization
with Gram- negative bacteria and intensive care unit-acquired infections and colonization of the
respiratory tract. Clin. Infect. Dis. 66 (4), 497–503.
Gosalbes, M.J.,
V´azquez-Castellanos, J.F., Angebault,
C., Woerther,
P.-L., Rupp´e, E., Ferrús, M.L., et al., 2016. Carriage of enterobacteria producing
extended-spectrum β-lactamases and composition of the gut microbiota in an Amerindian Community. Antimicrob. Agents Chemother. American Society for Microbiology Journals
60 (1), 507–514.
Grund, S., Roggendorf, M., Schweiger, B., 2010. Outbreak
of influenza virus A/H1N1 in a hospital ward for immunocompromised patients.
Arch. Virol. Springer
Vienna 155 (11), 1797–1802.
Guzm´an-Herrador, B., Molina,
C.D., Allam,
M.F., Navajas,
R.-F.-C., 2016.
Independent risk factors associated
with hospital-acquired pneumonia
in an adult ICU: 4-year prospective cohort study in a university reference
hospital. J. Public Health (Oxf) 38 (2), 378–383.
Hajdu, A., Samodova,
O.V., Carlsson, T.R., Voinova, L.V., Nazarenko, S.J., Tjurikov, A.V., et al., 2007. A point prevalence survey of hospital-acquired infections and antimicrobial use in a paediatric hospital in north-western Russia. J. Hosp. Infect. 66 (4), 378–384.
Hamilton, L.A., Behal, M.L., 2020. Altering routine intensive care unit practices
to
support commensalism. Nutr. Clin. Pract. John Wiley & Sons, Ltd 35 (3), 433–441.
Harbarth, S., Sax, H., Gastmeier, P., 2003. The preventable proportion of nosocomial infections: an overview of published reports. J. Hosp. Infect. 54 (4), 258–266 quiz321.
Hockenhull, J.C., Dwan, K.M., Smith, G.W., Gamble, C.L., Boland, A., Walley, T.J., et al., 2009. The clinical effectiveness of central venous catheters treated with
anti- infective agents in preventing catheter-related bloodstream infections: a systematic review. Crit. Care Med. 37 (2), 702–712.
Horan, T.C., Gaynes, R.P., Martone, W.J., Jarvis,
W.R., Emori, T.G., 1992. CDC definitions of nosocomial surgical site infections, 1992: a modification of CDC
definitions of surgical
wound infections. Infect. Control Hosp. Epidemiol. 13 (10), 606–608.
Hotchkiss, R.S., Monneret,
G., Payen, D., 2013a. Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic approach.
Lancet Infect. Dis. 13 (3), 260–268.
Hotchkiss, R.S., Monneret,
G., Payen, D., 2013b. Sepsis-induced immunosuppression:
from cellular dysfunctions to immunotherapy. Nat. Rev. Immunol.
Nature Publishing Group 13 (12), 862–874.
Ippolito, M., Misseri,
G., Catalisano, G., Marino, C., Ingoglia, G., Alessi, M., et al., 2021. Ventilator-associated pneumonia in patients
with COVID-19. A systematic review and meta-analysis. Antibiotics (Basel) 10 (5).
Iwuafor A.A., Ogunsola
F.T., Oladele R.O., Oduyebo O.O., Desalu I., Egwuatu C.C., et al. Incidence, clinical
outcome and risk factors of intensive care unit infections in the Lagos University Teaching
Hospital (LUTH), Lagos, Nigeria. PLoS ONE. Public Library of Science; 2016;11(10):e0165242.
Jansson, M., Liao, X., Rello, J., 2020. Strengthening ICU health security for a coronavirus epidemic. Intensive Crit. Care Nurs. 57, 102812.
Jansson, M.M.,
Syrja¨l¨a, H.P.,
Ala-Kokko, T.I.,
2019. Association
of nurse
staffing and nursing workload with ventilator-associated pneumonia
and mortality: a prospective, single-center cohort study. J. Hosp. Infect. 101 (3), 257–263.
Jeffery-Smith, A., Taori, S.K., Schelenz,
S., Jeffery, K., Johnson, E.M., Borman, A., et al., 2018. Candida auris: a Review of the Literature. Clin. Microbiol. Rev. American Society for Microbiology Journals 31 (1).
Johanson, W.G., Woods, D.E., Chaudhuri,
T., 1979. Association of respiratory tract colonization with adherence
of gram-negative bacilli to epithelial cells. J. Infect. Dis. 139 (6), 667–673.
Kalil A.C., Metersky
M.L., Klompas M., Muscedere J., Sweeney D.A., Palmer L.B., et al.Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American
Thoracic Society. Vol. 63, Clinical
Infectious Diseases.
2016. pp. e61–e111.
Karanika, S., Paudel,
S., Zervou, F.N., Grigoras, C., Zacharioudakis, I.M., Mylonakis, E., 2016. Prevalence and clinical outcomes
of Clostridium difficile
infection in the intensive care unit: A systematic
review and meta-analysis. Open Forum Infect.
Dis. 3 (1), ofv186.
Kelly, B.J., Imai, I., Bittinger, K., Laughlin, A., Fuchs, B.D., Bushman, F.D., et al., 2016. Composition and dynamics
of the respiratory tract microbiome in intubated patients. Microbiome BioMed Central
4 (1), 7–13.
Kelly, D., Kutney-Lee, A., Lake, E.T., Aiken, L.H., 2013. The critical care work
environment and nurse-reported health care-associated infections. Am. J. Crit. Care 22 (6), 482–488.
Klompas, M., Speck, K., Howell, M.D., Greene,
L.R., Berenholtz, S.M., 2014. Reappraisal of routine oral care with chlorhexidine gluconate for patients receiving
mechanical ventilation: systematic review and meta-analysis. JAMA Intern. Med. American Medical Association 174 (5), 751–761.
Kopp, M.A., Watzlawick, R., Martus, P., Failli, V., Finkenstaedt, F.W., Chen, Y., et al., 2017. Long-term functional
outcome in patients
with acquired infections
after acute
spinal cord injury. Neurology. Wolters Kluwer Health, Inc. on behalf of the American Academy of Neurology
88 (9), 892–900.
Korbkitjaroen, M., Vaithayapichet, S., Kachintorn, K., Jintanothaitavorn, D., Wiruchkul, N., Thamlikitkul, V., 2011. Effectiveness of comprehensive implementation of individualized bundling infection control measures for prevention of health care-associated infections
in general medical wards. Am. J. Infect. Control 39 (6), 471–476.
Labeau, S.O., 2020. Recommendation and protocol compliance: “Yes, I do” may not be true; the complexity of measuring
provider adherence. Intensive
Crit. Care Nurs. 60,
102890.
Labeau, S.O., Van de Vyver, K., Brusselaers, N., Vogelaers, D., Blot, S.I., 2011. Prevention of ventilator-associated pneumonia
with oral antiseptics: a systematic review and meta-analysis. Lancet Infect. Dis. 11 (11), 845–854.
Langelier, C., Kalantar,
K.L., Moazed, F., Wilson, M.R., Crawford, E.D., Deiss, T., et al., 2018. Integrating host response and unbiased microbe detection for lower respiratory tract infection
diagnosis in critically
ill adults. Proc. Natl. Acad. Sci. U.S. A. National Academy of Sciences
115 (52), E12353–E12362.
Leblebicioglu, H., Rosenthal, V.D.,
Arikan, O.A., Ozgültekin, A., Yalcin, A.N., Koksal, I., et al., 2007. Device-associated hospital-acquired infection rates in
Turkish intensive care units. Findings of the International Nosocomial
Infection Control Consortium (INICC). J. Hosp. Infect. 65 (3), 251–257.
Leblebicioglu, H.,
O¨ ztürk, R.,
Rosenthal, V.D.,
Akan, O¨ .A., Sirmatel,
F., Ozdemir,
D., et al., 2013a. Impact of a multidimensional infection control approach
on central line-associated bloodstream infections rates in adult intensive care units of 8 cities
of Turkey: findings of the International Nosocomial Infection Control
Consortium (INICC). Ann. Clin. Microbiol. Antimicrob. BioMed Central 12 (1), 10.
Leblebicioglu, H., Yalcin,
A.N., Rosenthal, V.D., Koksal, I., Sirmatel, F., Unal, S., et al., 2013b. Effectiveness of a multidimensional approach for prevention of ventilator- associated pneumonia in 11 adult intensive care units from 10 cities of Turkey: findings of the International Nosocomial Infection Control Consortium (INICC). Infection Springer-Verlag 41 (2), 447–456.
Lee, Y.S.H., Stone, P.W., Pogorzelska-Maziarz, M., Nembhard, I.M., 2018. Differences in work environment for staff as an explanation for variation in central line bundle compliance in intensive
care units. Health Care Manage. Rev. 43 (2), 138–147.
Leo, S., Lazarevic, V., Gaïa, N., Estellat, C., Girard, M., Matheron, S., et al., 2019. The intestinal microbiota predisposes to traveler’s diarrhea and to the
carriage of multidrug-resistant Enterobacteriaceae after traveling to tropical
regions. Gut Microbes. Taylor & Francis 10 (5), 631–641.
Li, X., Huang, Y., Xu, Z., Zhang, R., Liu, X., Li, Y., et al., 2018. Cytomegalovirus infection and outcome in immunocompetent patients
in the intensive care unit: a systematic review and meta-analysis. BMC Infect. Dis. BioMed Central 18 (1), 289–310.
Libert, N., Bigaillon,
C., Chargari, C., Bensalah, M., Muller, V., Merat, S., et al., 2015. Epstein-Barr virus reactivation in critically ill immunocompetent patients.
Biomed. J. 38 (1), 70–76.
Limaye, A.P., Kirby, K.A., Rubenfeld, G.D., Leisenring, W.M., Bulger, E.M., Neff, M.J., et al., 2008. Cytomegalovirus
reactivation in critically ill immunocompetent patients. JAMA. American
Medical Association 300 (4), 413–422.
Lobo, R.D., Levin, A.S., Gomes, L.M.B., Cursino, R., Park, M., Figueiredo, V.B., et al., 2005. Impact of an educational program and policy changes on decreasing catheter-
associated bloodstream infections
in a medical intensive care unit in Brazil. Am. J. Infect. Control 33 (2), 83–87.
Lormans, P., Blot, S., Amerlinck, S., Devriendt, Y., Dumoulin,
A., 2021. COVID-19 acquisition risk among ICU nursing
staff with patient-driven use of aerosol- generating respiratory procedures
and optimal use of personal
protective equipment. Intensive Crit. Care Nurs. 63, 102993.
Loubet, P., Voiriot,
G., Houhou-Fidouh, N., Neuville, M., Bouadma, L., Lescure, F.-X., et al., 2017. Impact of respiratory viruses
in hospital-acquired pneumonia
in the intensive care unit: A single-center retrospective study. J. Clin. Virol. 91, 52–57.
Luyt, C.-E., Combes,
A., Deback, C., Aubriot-Lorton, M.-H.,
Nieszkowska, A., Trouillet, J.- L., et al., 2007. Herpes simplex virus lung infection in patients
undergoing prolonged mechanical ventilation. Am. J. Respir. Crit. Care Med.
American Thoracic Society 175 (9), 935–942.
Luyt, C.-E., Sahnoun, T., Gautier,
M., Vidal, P., Burrel, S., Pineton de Chambrun, M., et al., 2020. Ventilator-associated pneumonia in patients with
SARS-CoV-2- associated acute respiratory distress syndrome requiring
ECMO: a retrospective cohort study. Ann. Intensive Care. SpringerOpen 10 (1), 158–210.
Maes, M., Higginson, E., Pereira-Dias, J., Curran, M.D., Parmar, S., Khokhar,
F., et al., 2021. Ventilator-associated pneumonia
in critically ill patients with COVID-19. Crit.Care. BioMed Central 25 (1), 25–111.
Magill, S.S., Edwards,
J.R., Bamberg, W., Beldavs, Z.G., Dumyati, G., Kainer, M.A., et al., 2014. Multistate point-prevalence survey of health care-associated infections. N. Engl. J.
Med. Massachusetts Medical
Society 370 (13), 1198–1208.
Malek, A.M., Abouseif,
H.A., Elaziz, K., Allam, M.F., Fahim, H.I., 2018. Incidence
of central line-associated bloodstream infections in intensive
care units in a private hospital (Cairo, Egypt). Open Public Health J. 11, 562–571.
Marin, M., Gudiol, C., Ardanuy,
C., Garcia-Vidal, C., Calvo, M., Arnan, M., et al., 2014. Bloodstream infections in neutropenic patients
with cancer: differences between
patients with haematological malignancies and solid tumours. J. Infect. 69 (5), 417–423.
Martin-Loeches, I.,
Po´voa, P., Rodriguez,
A., Curcio,
D., Sua´rez, D.,
Mira, J.-P.,
et al.,2015. Incidence and prognosis of ventilator-associated tracheobronchitis (TAVeM): a multicentre, prospective, observational study. Lancet Respir.
Med. 3 (11), 859–868.
Medell, M., Hart, M., Duquesne, A., Espinosa, F., Vald´es, R., 2013. Nosocomial ventilator-associated pneumonia in Cuban intensive care units: bacterial species and
antibiotic resistance. MEDICC Rev. 15 (2), 26–29.
Mehta, A., Rosenthal, V.D., Mehta, Y., Chakravarthy, M., Todi, S.K., Sen,
N., et al., 2007. Device-associated nosocomial infection rates in intensive care units of
seven Indian cities. Findings of the International Nosocomial Infection Control
Consortium
(INICC). J. Hosp. Infect. 67 (2), 168–174.
Mendes, M., Andrade Oliveira, A., Pires, O., Branca, F., Beira˜o, M., Santa-Cruz, A., et al., 2021. Sampling methods and risk stratification regarding
environmental contamination by SARS-CoV-2. Acta Med. Port. 34 (13).
Mermel L.A., Allon M., Bouza E., Craven D.E., Flynn P., O’Grady N.P., et al. Clinical practice guidelines for the diagnosis
and management of intravascular catheter-related infection: 2009 Update by the Infectious Diseases
Society of America.
Vol. 49, Clinical
infectious Diseases. Oxford University Press; 2009. pp. 1–45.
Mitchell, B.G., Dancer,
S.J., Anderson, M., Dehn, E., 2015. Risk of organism
acquisition from prior room occupants: a systematic review and meta-analysis. J. Hosp. Infect. 91 (3), 211–217.
Mitharwal, S.M., Yaddanapudi, S., Bhardwaj, N., Gautam, V., Biswal, M., Yaddanapudi, L., 2016. Intensive care unit-acquired infections in a
tertiary care hospital: An epidemiologic survey and influence
on patient outcomes.
Am. J. Infect.
Control 44 (7), e113–e117.
Mongin, D., Catho, G., Iten, A., Harbarth,
S., Courvoisier, D.S., 2021. Incidence
of
healthcare-associated coronavirus disease 2019 (COVID-19) in the state of Geneva. Infect. Control Hosp. Epidemiol. Cambridge
University Press 1–3.
Moreno, C.A., Rosenthal, V.D., Olarte,
N.,
Gomez,
W.V.,
Sussmann,
O.,
Agudelo,
J.G., et al., 2006. Device-associated infection
rate and mortality in intensive
care units of 9 Colombian hospitals:
findings of the International Nosocomial
Infection Control Consortium. Infect. Control Hosp. Epidemiol.
Cambridge University Press 27 (4), 349–356.
Murni, I.K., Duke, T.,
Kinney, S., Daley, A.J., Soenarto,
Y., 2015. Reducing hospital- acquired infections and improving the rational use of antibiotics in a developing country: an effectiveness study. Arch. Dis. Child. BMJ Publishing Group Ltd 100 (5),
454–459.
Myny, D., Depuydt, P., Colardyn,
F., Blot, S., 2005. Ventilator-associated pneumonia
in a tertiary care ICU: analysis of risk factors for acquisition and mortality. Acta Clin. Belg. 60 (3), 114–121.
Navoa-Ng, J.A., Berba, R., Galapia,
Y.A., Rosenthal, V.D., Villanueva, V.D., Tolentino, M. C.V., et al., 2011. Device-associated infections rates in adult, pediatric, and neonatal intensive care units of hospitals in the Philippines: International
Nosocomial Infection Control Consortium
(INICC) findings. Am. J. Infect. Control 39 (7), 548–554.
Ndegwa, L.K., Katz, M.A., McCormick, K., Nganga, Z., Mungai, A., Emukule, G., et al., 2014. Surveillance for respiratory health care-associated infections among inpatients in 3 Kenyan hospitals, 2010–2012.
Am. J. Infect. Control 42 (9), 985–990.
Nseir, S., Blazejewski, C., Lubret, R., Wallet, F., Courcol, R.,
Durocher, A., 2011. Risk of acquiring multidrug-resistant Gram-negative bacilli from prior room occupants
in the intensive care unit. Clin. Microbiol. Infect. 17 (8), 1201–1208.
Nussenblatt, V., Avdic, E., Berenholtz, S., Daugherty, E., Hadhazy, E.,
Lipsett, P.A., et al., 2014. Ventilator-associated pneumonia: overdiagnosis and treatment
are common in medical and surgical
intensive care units. Infect. Control Hosp. Epidemiol. Cambridge University Press 35 (3), 278–284.
Ong, D.S.Y., Bonten, M.J.M.,
Spitoni, C., Verduyn Lunel, F.M., Frencken, J.F., Horn, J.,et al., 2017. Epidemiology of multiple herpes viremia in previously immunocompetent patients with septic shock. Clin. Infect.
Dis. 64 (9), 1204–1210.
Ortíz, G., Duen˜as, C., Rodríguez, F., Barrera, L., Rosa, L.a., de, G,, Dennis, R,, et al., 2014. Epidemiology of sepsis in Colombian
intensive care units. Biomedica 34 (1), 40–47.
Parreco, J., Soe-Lin, H., Byerly,
S., Lu, N., Ruiz, G., Yeh, D.D., et al., 2020. Multi-center outcomes of chlorhexidine oral decontamination in intensive care units. Surg. Infect.(Larchmt) sur.2019.172.
Penoyer, D.A., 2010. Nurse staffing and patient outcomes in critical
care: a concise review. Crit. Care Med. 38 (7), 1521–1528
quiz1529.
Phu, V.D., Wertheim,
H.F.L., Larsson, M., Nadjm, B., Dinh,
Q.-D., Nilsson, L.E., et al., 2016. Burden of hospital acquired infections and antimicrobial use in
Vietnamese adult intensive care units. PLoS ONE. Public Library of Science 11 (1), e0147544.
Plantinga, N.L., Wittekamp, B.H.J., Leleu, K., Depuydt, P., Van den
Abeele, A.-M., Brun- Buisson, C., et al., 2016. Oral mucosal adverse events with chlorhexidine 2%
mouthwash in ICU. Intensive Care Med. Springer Berlin Heidelberg
42, 620–621.
Ponce de
Leo´n-Rosales,
S.P., Molinar-Ramos,
F., Domínguez-Cherit,
G., Rangel-
Frausto, M.S., Va´zquez-Ramos, V.G., 2000. Prevalence of infections in intensive care units in Mexico: a multicenter study. Crit. Care Med. 28 (5), 1316–1321.
Price R., MacLennan
G., Glen J.,
SuDDICU Collaboration. 2014. Selective digestive
or oropharyngeal decontamination and topical oropharyngeal chlorhexidine for prevention of death in general intensive
care: systematic review and network meta-analysis. BMJ. BMJ Publishing Group; 348(mar31 2):g2197–7.
Public Health Agency of Canada,
2014. Central Venous Catheter-Associated Blood Stream Infections in Intensive
Care units in Canadian Acute-Care Hospitals: Surveillance Report January 1, 2006 to December 31, 2006 and January 1, 2009 to December 31, 2011. Centre
for Communicable Diseases and Infection Control, Public Health Agency of Canada.
Pusajo´, J.F.,
Bumaschny, E.,
Doglio, G.R.,
Cherjovsky, M.R., Lipinszki,
A.I., Hern´andez, M.S., et
al., 1993.
Postoperative intra-abdominal sepsis
requiring reoperation. Value of a predictive index. Arch Surg. American Medical Association
128 (2), 218–222 discussion 223.
Ramanan, P., Bryson, A.L., Binnicker, M.J., Pritt, B.S., Patel, R., 2018. Syndromic
panel- based testing in clinical
microbiology. Clin. Microbiol. Rev. American Society
for Microbiology Journals 31 (1).
Ramirez, M., Fernandez,
B., Cruz, A., Jardines, E., Bermudez, Y., 2011. Comportamiento de las infecciones nosocomiales en Unidad de Cuidados Intensivos en un quinquenio (2005–2009). MediSur 9 (5), 467–473.
Razazi, K., Arrestier, R., Haudebourg, A.F., Benelli, B., Carteaux, G., Decousser, J.-W., et al., 2020. Risks of ventilator-associated pneumonia
and invasive pulmonary aspergillosis in patients
with viral acute respiratory distress
syndrome related or not
to Coronavirus 19 disease. Crit Care. BioMed Central 24 (1), 699–711.
Rello, J., Afonso, E., Lisboa, T., Ricart, M., Balsera,
B., Rovira, A., et al., 2013. A care bundle approach for prevention of ventilator-associated pneumonia. Clin. Microbiol. Infect. 19 (4), 363–369.
Reper, P., Bombart,
M.A., Leonard, I., Payen, B., Darquennes, O., Labrique, S., 2020.Nursing Activities Score is increased in COVID-19 patients.
Intensive Crit. Care Nurs. 60, 102891.
Reper, P., Delaere,
S., Yimbou, J.J., Labrique, S., Massaut, J., 2021. Not only intensive care unit workload and activities
but also quality indicators are influenced by the COVID-19 epidemic. Intensive
Crit. Care Nurs. 63, 103008.
Rodríguez-Acelas, A.L.,
de Abreu,
A.M., Engelman,
B., Can˜on-Montan˜ez, W.,
2017. Risk factors for health care-associated infection
in hospitalized adults:
Systematic review and meta-analysis. Am. J. Infect. Control 45 (12), e149–e156.
Roquilly, A., Broquet,
A., Jacqueline, C., Masson, D., Segain, J.P., Braudeau, C., et al., 2014. Hydrocortisone prevents immunosuppression
by
interleukin-10 natural
killer cells after trauma-hemorrhage. Crit. Care Med. 42 (12), e752–e761.
Roquilly, A., McWilliam,
H.E.G., Jacqueline, C., Tian, Z., Cinotti, R., Rimbert, M., et al., 2017. Local modulation of antigen-presenting cell development after resolution of pneumonia induces long-term
susceptibility to secondary
infections. Immunity 47 (1), 135–145.
Roquilly, A., Torres, A., Villadangos, J.A., Netea, M.G., Dickson, R., Becher, B., et al., 2019. Pathophysiological role of respiratory dysbiosis in hospital-acquired
pneumonia. Lancet Respir Med. 7 (8), 710–720.
Rosenthal, V.D., Guzman, S., Orellano, P.W., 2003. Nosocomial infections in medical-surgical intensive care units in Argentina: attributable mortality and length of stay. Am. J. Infect. Control 31 (5), 291–295.
Rosenthal, V.D., Guzman,
S., Crnich, C., 2006. Impact
of an infection control program
on rates of ventilator-associated pneumonia in intensive care units in 2 Argentinean hospitals. Am. J. Infect. Control
34 (2), 58–63.
Rouz´e, A.,
Martin-Loeches, I., Po´voa, P.,
Makris, D.,
Artigas, A.,
Bouchereau, M., et
al.,2021. Relationship between SARS-CoV-2 infection and the incidence of
ventilator- associated lower respiratory tract infections: a European multicenter
cohort study. Intensive Care Med. Springer Berlin Heidelberg 47 (2), 188–198.
Saied, W.I., Martin-Loeches, I., Timsit, J.-F., 2020. What is new in non-ventilated
ICU- acquired pneumonia? Intensive
Care Med. Springer
Berlin Heidelberg 46, 488–491.
Sakr, Y.,
Jaschinski, U., Wittebole,
X., Szakmany,
T., Lipman,
J., N˜amendys-Silva, S.A., et al., 2018. Sepsis in intensive care unit patients: worldwide data from
the intensive care over nations audit. Open Forum. Infect. Dis. Intensive Care Med.
Springer Berlin Heidelberg 5 (12), ofy313.
Satoh, K., Makimura, K., Hasumi, Y., Nishiyama, Y., Uchida, K.,
Yamaguchi, H., 2009. Candida auris sp. nov., a novel ascomycetous yeast isolated from the external
ear canal of an inpatient in a Japanese hospital. Microbiol. Immunol. John
Wiley & Sons, Ltd 53 (1), 41–44.
Schelenz, S., Nwaka, D., Hunter,
P.R., 2013. Longitudinal surveillance of bacteraemia in haematology and oncology
patients at a UK cancer centre and the impact of ciprofloxacin use on antimicrobial resistance. J. Antimicrob. Chemother. 68 (6),
1431–1438.
Schreiber, P.W., Sax, H., Wolfensberger, A., Clack, L., Kuster, S.P.,
Swissnoso, 2018. The preventable proportion of healthcare-associated infections 2005–2016:
Systematic review and meta-analysis. Infect. Control Hosp. Epidemiol. Cambridge
University Press 39 (11), 1277–1295.
Shorr, A.F., Zilberberg, M.D., Micek, S.T., Kollef, M.H.,
2017. Viruses are prevalent innon-ventilated hospital-acquired pneumonia. Respir. Med. 122, 76–80.
Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., Health Care Infection Control Practices Advisory Committee,
2007. Guideline for isolation precautions: preventing
transmission of infectious
agents in health care settings.
Am. J. Infect. Control 35, S65–S164.
Singh, S., Goyal, R., Ramesh,
G.S., Ravishankar, V., Sharma, R.M., Bhargava, D.V., et al., 2015. Control of hospital acquired
infections in the ICU: A service perspective. Med.J. Armed Forces India 71 (1),
28–32.
Smith T.J., Bohlke
K., Lyman G.H., Carson
K.R., Crawford J., Cross S.J., et al.
Recommendations for the use of WBC growth factors:
American Society of Clinical
Oncology Clinical Practice
Guideline Update. Vol. 33, Journal of Clinical
Oncology. American Society
of Clinical Oncology;
2015. pp. 3199–212.
Sommerstein, R., Merz, T.M., Berger, S., Kraemer,
J.G., Marschall, J., Hilty, M., 2019. Patterns in the longitudinal oropharyngeal microbiome evolution related
to ventilator-associated pneumonia. Antimicrob. Resist. Infect. Control.
BioMed Central
8 (1), 81–110.
Son, C.H., Daniels, T.L., Eagan, J.A., Edmond, M.B., Fishman,
N.O., Fraser, T.G., et al., 2012. Central line-associated bloodstream infection surveillance outside
the intensive care unit: a multicenter survey. Infect. Control Hosp. Epidemiol. Cambridge University Press 33 (9), 869–874.
Stewardson, A.J., Allignol,
A., Beyersmann, J., Graves, N., Schumacher, M., Meyer, R., et al., 2016. The health and economic
burden of bloodstream infections caused by antimicrobial-susceptible and non-susceptible Enterobacteriaceae and Staphylococcus aureus in European hospitals, 2010 and 2011: a multicentre retrospective cohort study. Euro Surveill.
European Centre for Disease Prevention and Control 21 (33), 30319.
Su, C.-H., Chang, S.-C., Yan, J.-J., Tseng, S.-H., Chien, L.-J., Fang, C.-T., 2013. Excess mortality and long-term
disability from healthcare-associated staphylococcus aureus infections: a population-based matched cohort study. PLoS ONE. Public Library of Science 8 (8), e71055.
Tabah, A., Koulenti, D., Laupland, K., Misset, B., Valles, J., Bruzzi de Carvalho, F., et al., 2012. Characteristics and determinants of outcome of hospital-acquired bloodstream infections in intensive care units: the EUROBACT International Cohort Study.Intensive Care Med. Springer-Verlag 38 (12), 1930–1945.
Talcott, J.A., Finberg,
R., Mayer, R.J., Goldman, L., 1988. The medical course of cancer patients with fever and neutropenia. Clinical identification of a low-risk subgroup at presentation. Arch. Intern. Med. 148 (12), 2561–2568.
Tambyah, P.A., Maki, D.G., 2000. Catheter-associated urinary tract infection
is rarely symptomatic: a prospective study of 1,497 catheterized patients.
Arch Intern Med.
American Medical Association 160 (5), 678–682.
Taplitz R.A., Kennedy
E.B., Bow E.J., Crews J., Gleason C., Hawley D.K., et al.
Antimicrobial Prophylaxis for Adult Patients With Cancer-Related Immunosuppression: ASCO and IDSA Clinical Practice Guideline Update. Vol. 36, Journal of Clinical Oncology.
American Society of Clinical Oncology;
2018. pp. 3043–54.
Taylor, G., Gravel, D., Matlow,
A., Embree, J., LeSaux, N., Johnston,
L., et al., 2016. Assessing the magnitude
and trends in hospital acquired
infections in Canadian
hospitals through sequential
point prevalence surveys.
Antimicrob. Resist. Infect. Control. BioMed Central 5 (1), 19–27.
Tejerina, E.,
Esteban, A.,
Fern´andez-Segoviano, P., Frutos-Vivar,
F., Aramburu,
J.,Ballesteros, D., et al., 2010. Accuracy of clinical definitions of ventilator-associated pneumonia: comparison with autopsy findings.
J. Crit. Care 25 (1), 62–68.
Timsit, J.-F., Schwebel,
C., Bouadma, L., Geffroy, A., Garrouste-Orgeas, M., Pease, S., et al., 2009. Chlorhexidine-impregnated sponges
and less frequent dressing changes for prevention of catheter-related infections
in critically ill adults: a randomized controlled trial. JAMA. American Medical Association 301 (12), 1231–1241.
Timsit, J.-F., Mimoz, O., Mourvillier, B., Souweine, B., Garrouste-Orgeas, M., Alfandari, S., et al., 2012. Randomized controlled trial of chlorhexidine dressing and highly adhesive dressing
for preventing catheter-related infections in critically ill adults. Am. J. Respir. Crit. Care Med. American Thoracic Society 186 (12),
1272–1278.
Timsit, J.-F., Esaied,
W., Neuville, M., Bouadma, L., Mourvllier, B., 2017. Update
on ventilator-associated pneumonia. F1000Res.
F1000 Research Limited
6 (2061), 2061.
Timsit, J.-F., Rupp, M., Bouza,
E., Chopra, V., Karpanen, T., Laupland, K., et al., 2018. A state of the art review on optimal practices
to prevent, recognize,
and manage complications associated with intravascular devices in the critically ill. Intensive Care Med. Springer Berlin Heidelberg 44, 742–759.
Tomlinson, D., Mermel, L.A., Ethier,
M.-C., Matlow, A., Gillmeister, B., Sung, L., 2011. Defining bloodstream infections related to central venous catheters
in patients with cancer: a systematic review. Clin. Infect. Dis. 53 (7), 697–710.
Tran, K., Cimon,
K., Severn, M., Pessoa-Silva, C.L.,
Conly, J., 2012. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PLoS ONE. Public Library
of Science 7 (4), e35797.
Ullman, A.J., Cooke, M.L., Mitchell,
M., Lin, F., New, K., Long, D.A., et al., 2016. Dressing and securement for central venous access devices (CVADs): A Cochrane systematic review. Int. J. Nurs. Stud. 59, 177–196.
Umscheid, C.A., Mitchell,
M.D., Doshi, J.A., Agarwal, R., Williams, K., Brennan, P.J., 2011. Estimating the proportion of healthcare-associated infections that are
reasonably preventable and the related mortality and costs. Infect. Control Hosp. Epidemiol. 32 (2), 101–114.
van der Kooi, T., Sax, H., Pittet, D., van Dissel, J., van Benthem,
B., Walder, B., et al., 2018. Prevention of hospital infections
by intervention and training (PROHIBIT): results of a pan-European cluster-randomized multicentre study to reduce central venous catheter-related bloodstream infections. Intensive Care Med. Springer Berlin
Heidelberg 44, 48–60.
van Vught, L.A.,
Scicluna, B.P., Wiewel, M.A., Hoogendijk, A.J., Klein Klouwenberg, P.M. C., Franitza, M., et al., 2016. Comparative analysis of the host response
to community-acquired and hospital-acquired pneumonia in critically
ill patients. Am. J. Respir. Crit. Care Med. American
Thoracic Society 194 (11), 1366–1374.
Vazquez Guillamet, C., Kollef, M.H., 2018. Is zero ventilator-associated pneumonia
achievable?: Practical approaches
to ventilator-associated pneumonia
prevention. Clin. Chest Med. 39 (4), 809–822.
Venet, F., Filipe-Santos, O., Lepape, A., Malcus, C., Poitevin-Later, F., Grives, A., et al., 2013. Decreased T-cell repertoire diversity
in sepsis: a preliminary study. Crit. Care Med. 41 (1), 111–119.
Vincent, J.L., Rello, J., Marshall, J., Silva, E., Anzueto, A., Martin, C.D., et al., 2009. International study of the prevalence
and outcomes of infection in intensive care
units. JAMA. American
Medical Association 302 (21), 2323–2329.
Vogelaers, D.,
De Bels,
D., Forˆet, F.,
Cran, S.,
Gilbert, E.,
Schoonheydt, K., et
al., 2010. Patterns of antimicrobial therapy in severe nosocomial infections:
empiric choices, proportion of appropriate therapy, and adaptation rates–a multicentre,
observational survey in critically ill patients.
Int. J. Antimicrob. Agents 35 (4), 375–381.
Vogelaers, D., Blot, S., Van den Berge, A., Montravers, P., 2021. Antimicrobial lessons from a large observational cohort on intra-abdominal infections in intensive
care units. Drugs. Springer International Publishing
1–14.
Vollaard, E.J., Clasener, H.A.,
1994. Colonization resistance.
Antimicrob. Agents
Chemother. American Society for Microbiology Journals 38 (3), 409–414.
Vuichard-Gysin, D., Abbas, M., Harbarth, S., 2021. In-hospital COVID-19 outbreak investigation: A practical
approach to root cause analysis.
Intensive Crit. Care Nurs. 67, 103132.
Walter, J.,
Haller, S.,
Quinten, C.,
Ka¨rki, T.,
Zacher, B.,
Eckmanns, T.,
et al.,
2018. Healthcare-associated pneumonia in acute care hospitals
in European Union/ European Economic Area countries: an analysis of data from a point prevalence survey, 2011 to 2012. Euro Surveill.. European
Centre for Disease
Prevention and Control 23 (32), 1700843.
WHO, 2011. Report on the Burden of Endemic Health Care-associated Infection Worldwide - Clean Care is Safer Care. Word Health Organization.
WHO (2012). WHO, Prevention of hospital-acquired infections - A practical
guide, 2nd edition,
in: W. H. Organization (Ed.).
Wicky, P.-H., Niedermann, M.S., Timsit, J.-F., 2021. Ventilator-associated pneumonia
in the era of COVID-19 pandemic:
How common and what is the impact? Crit. Care.
BioMed Central 25 (1), 153–163.
Winters, B.D., Eberlein,
M., Leung, J., Needham, D.M., Pronovost, P.J., Sevransky, J.E., 2010. Long-term mortality
and quality of life in sepsis: a systematic review. Crit. Care Med. 38 (5), 1276–1283.
Wittekamp, B.H.J., Oostdijk,
E.A.N., Cuthbertson, B.H.,
Brun-Buisson,
C.,
Bonten,
M.J. M., 2020. Selective
decontamination of the digestive tract (SDD) in critically ill patients: a narrative
review. Intensive Care Med. Springer
Berlin Heidelberg 46,343–349.
Wittekamp, B.H., Plantinga, N.L., Cooper, B.S., Lopez-Contreras, J., Coll, P., Mancebo, J., et al., 2018. Decontamination strategies and bloodstream infections with
antibiotic- resistant microorganisms in ventilated patients:
A randomized clinical
trial. JAMA. American Medical Association 320 (20), 2087–2098.
Woeltje, K.F., Butler,
A.M., Goris, A.J., Tutlam, N.T., Doherty, J.A., Westover, M.B., et al., 2008. Automated surveillance for central line-associated bloodstream infection in intensive care units. Infect. Control
Hosp. Epidemiol. Cambridge
University Press 29 (9), 842–846.
Yakovlev, S.V., Suvorova, M.P., Beloborodov,
V.B.,
Basin,
E.E.,
Eliseev,
E.V., Kovelenov, S.V., et al., 2016. Multicentre study of the prevalence and clinical value of hospital-acquired infections
in Emergency Hospitals
of Russia: ERGINI Study
Team. Antibiot Khimioter.
Antibiot. Khimioter. 61 (5–6), 32–42.
Yallew, W.W., Kumie, A., Yehuala, F.M., 2016. Point prevalence
of hospital-acquired infections in two teaching hospitals
of Amhara region in Ethiopia.
Drug Healthc. Patient Saf. Dove Press 8, 71–76.
Young, V.B., 2016. Therapeutic manipulation of the microbiota: past, present, and
considerations for the future. Clin. Microbiol. Infect.
22 (11), 905–909.
Zahar, J.-R., Blot,
S., Nordmann, P., Martischang, R., Timsit, J.-F., Harbarth, S., et al., 2019. Screening for intestinal carriage
of extended-spectrum beta-lactamase- producing enterobacteriaceae in critically ill patients: expected
benefits and evidence-based controversies. Clin. Infect. Dis. 68 (12), 2125–2130.
Источник фотоиллюстрации - www.freepik.com
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 13.09.2022
[ACTIVE_FROM] => 13.09.2022
[SHOW_COUNTER] => 2194
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[VALUE_ENUM_ID] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 827821
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 827820
)
[VALUE] => Array
(
[0] => sepsis
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] => a:0:{}
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 827821
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [
8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2025-07-03 10:45:52
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 827820
)
[VALUE] => Array
(
[0] => sepsis
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => sepsis
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Сепсис
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 03.07.2025 10:45:52
[~TIMESTAMP_X] => 03.07.2025 10:45:52
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[FULLTEXT_INDEX] => N
[~FULLTEXT_INDEX] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Инфекции, связанные с оказанием медицинской помощи, у взрослых пациентов отделений интенсивной терапии: изменения в эпидемиологии, диагностике, профилактике и вкладе новых технологий
[BROWSER_TITLE] =>
[KEYWORDS] =>
[DESCRIPTION] =>
)
)
