Эпидемиология инфекций кровотока, ассоциированных с летальностью: различия между внебольничными, связанными с медицинской помощью и внутрибольничными инфекциями
Mun et al. BMC Infectious Diseases (2022) 22:336
The epidemiology of bloodstream infection contributing to mortality: the difference between community‑acquired, healthcare‑associated, and hospital‑ acquired infections
Эпидемиология инфекций кровотока, ассоциированных с летальностью: различия между внебольничными, связанными с медицинской помощью и внутрибольничными инфекциями
Абстракт
Эпидемиология инфекции кровотока (BSI) хорошо известна; однако мало что известно о влиянии различных патогенов на летальность. Чтобы понять истинное бремя BSI, приводящих к смерти пациентов, изучена и проанализирована этиология заболевания в зависимости от условий возникновения.
Методы: были собраны данные об умерших пациентах в двух клинических больницах в Республике Корея. Смертность от BSI определяли при выявлении бактериемии в течение двух недель до смерти. Случаи были сгруппированы по условиям возникновения: внебольничные (CA)-, связанные с оказанием медицинской помощи (HCA)- и внутрибольничные (HA)-BSI. Также сравнивали лекарственную устойчивость, словия возникновения бактериемии и адекватность эмпирической противомикробной терапии.
Результаты. Среди 1849 умерших пациентов в стационарах у 280 (15,1%) пациентов в течение 2 недель до смерти выявлена BSI. Всего было проанализировано 71, 53 и 156 пациентов с CA-, HCA- и HA-BSI соответственно, вызванными 316 возбудителями. Тремя наиболее распространенными возбудителями были Klebsiella pneumoniae (17,1%), Escherichia coli (16,4%) и Staphylococcus aureus (11,4%). В то время как K. pneumoniae и E. coli были наиболее распространенными патогенами в CA- и HCA-BSI, виды Acinetobacter baumannii и Candida превалировали при HA-BSI. У 26,3% (41/156) пациентов наблюдали развитие инфекций кровотока при использовании карбапенема и/или ванкомицина.
Доля инфекций, связанных с центральным венозным катетером (0%, 3,4% и 28,3%), выявление резистентных к карбапенему грамотрицательных бактерий (0%, 6,9% и 21,9%), и неадекватная эмпирическая противомикробная терапия (21,1%, 37,7% и 51,9%). %; все P < 0,001) чаще встречались при HA-BSI.
Заключение. Эпидемиология BSI, ассоциированных с летальностью, имеет уникальные характеристики в зависимости от условия возникновения. Учитывая эпидемиологию HA-BSI, следует уделить особое внимание программам инфекционного контроля и рациональному использованию антибиотиков.
Инфекции кровотока (BSI) являются частой причиной смертности, несмотря на достижения в области противомикробных препаратов и лечении сепсиса [1–3]. Хотя краткосрочная смертность от BSI регистрируется от 12 до 34%, диапазон уровня летальности может существенно варьировать в зависимости от условия возникновения (будь то внебольничная или внутрибольничная BSI), конкретной популяции пациентов, патогенов, лекарственной устойчивости и географического региона [1–8].
В частности, внутрибольничная (HA)-BSI обычно характеризуется более высокой общей смертностью, чем внебольничная (CA)-BSI [2]. Хотя Escherichia coli является наиболее распространенным патогеном, вызывающим BSI во всем мире, сообщалось о более высокой смертности при бактериемии, вызванной другими грамотрицательными бактериемиями, отличными от E. coli [3, 9, 10]. Таким образом, эпидемиология патогенов, способствующих летальному исходу, может отличаться от фактической распространенности бактериемии для каждого конкретного возбудителя.
В Республике Корея кишечная палочка, золотистый стафилококк, и Klebsiella pneumoniae были тремя наиболее распространенными возбудители истинной инфекции кровотока; В отчетах после 2000-х годов лекарственная устойчивость грамотрицательных бацилл (GNB) была более распространенной проблемой, чем устойчивость грамположительных кокков (GPC) [10, 11]. Резистентность к карбапенемам часто наблюдалась у Acinetobacter baumannii и составляет более 90% по данным обзорного исследования 2017 г. [12]. Хотя имеются данные о доле каждого патогена, выделенного из крови, и их лекарственной устойчивости, редко сообщаются данные о патогенах, способствующих неблагоприятному и сходу и степени их вклада в уровень летальности
Мы считали, что знание эпидемиологии BSI в зависимости от условий возникновения, определение патогенов, способствующих летальности и их устойчивости к антибиотикам позволит определить роль инфекций кровотока для системы здравоохранения и установить приоритеты для инфекционного контроля, а также институциональной или национальной политики в отношении антибиотиков, что послужило обоснование для проведения данного ретроспективного исследования.
Методы
Дизайн исследования
В исследование были включены взрослые пациенты (старше 18 лет), находившиеся на лечении в двух клинических госпиталях (Samsung Changwon и Inje University Busan Paik )в период с января 2019 г. по декабрь 2019 г. Электронные медицинские карты были использованы для сбора данных лабораторных результатов и клинических характеристик пациентов.
Мы определили BSI, приводящие к летальному исходу, как BSI в течение 2 недель до смерти, поскольку в предыдущих исследованиях для представления краткосрочной смертности от BSI использовалась 14-дневная смертность [8]. Были собраны результаты посевов крови исследуемой популяции в течение 2 недель до смерти.Когда бактерии или грибы отличные от кожных комменсалов выделялись более, чем из двух отдельных образцов крови или из одного образца крови у пациентов с клиническими симптомами инфекции и очагами, их считали истинными BSI [13]. Мы рассматривали только возбудители, выделенные при истинной BSI как патогены, способствующие смертности.
Пациенты и выделенные от них патогены были классифицированы по условиям возникновения бактериемиия: внебольничные (CA), связанные с оказанием медицинской помощи (HCA) и госпитальные (HA-BSI).
Инфекцию, связанную с оказанием медицинской помощи, при наличии хотя бы одного из четырех признаков: (1) парентеральное лечение в течение 30 дней, (2) амбулаторная химиотерапия или гемодиализ в течение 30 дней, (3) госпитализация на ≥ 2 дней в предшествующие 90 дней и (4) нахождение в доме престарелых [14].
Чтобы сравнить исходные характеристики пациентов и возбудителей в группах CA-, HCA- и HA-BSI, были собраны следующие данные: возраст, пол, основное заболевание, предшествующая серьезная операция (в течение 4 недель), предшествующее использование антибиотиков (в течение 4 недель); очаг, приведший к развитию BSI и адекватность эмпирического назначения антибиотиков. Эмпирическое использование антибиотиков считали адекватным, когда препараты, к которым были чувствительны микробы, вводились в течение 48 часов после получения образца культуры крови.
Резистентность к противомикробным препаратам каждого возбудителя классифицировали по четырем основным моделям: устойчивые к цефотаксиму энтеробактерии (кроме устойчивости к карбапенемам), устойчивые к карбапенемам GNB (CRGNB), устойчивые к метициллину S. aureus (MRSA) и устойчивые к ванкомицину энтерококки (VRE).
Stenotrophomonas maltophilia, которая имеет природную устойчивость к карбапенемам, отнесена к CRGNB [15].Кроме того, среди CRGNB была выявлена трудноизлечимая резистентность (DTR), определяемая как нечувствительность ко всем протестированным β-лактамам и фторхинолонам [16, 17].
Посев крови и тест на лекарственную чувствительность
Кровь брали из периферической вену и/или центральной вены. Использовали два набора флаконов для культур крови (аэробных и анаэробных, по 8-10 см3 крови на каждый флакон), которые инкубировали в системе Bactec-9240 (Becton Dickinson, Sparks, MD) или в системе BacT/Alert 3D. (bioMérieux Inc., Марси л'Этуаль, Франция).).Все образцы культивировали на кровяном агаре и чашках с агаром Мак-Конки в инкубаторе при 35 °C в течение 24 часов и идентифицировали с помощью системы Vitek MS (BioMérieux, Хазелвуд, штат Мичиган, США). Все тесты на чувствительность к противомикробным препаратам (AST) проводились с использованием автоматизированной системы A Vitek II (bioMérieux Inc.) в соответствии с рекомендациями Института клинических и лабораторных стандартов (CLSI) от 2018 г. [18]. Все процедуры проводились в соответствии синструкциями производителя.
To compare characteristics between the CA-, HCA-, and HA-BSI groups, a Student’s t-test or Mann–Whitney test was used to compare continuous variables of two groups, and a one-way analysis of variance (ANOVA) or Kruskal–Wallis test was used to compare continuous variables of multiple groups. Categorical variables were compared by using the chi-square test or Fisher’s exact test. For post hoc analysis for multiple comparison, the Bonferroni method was used. All P values were two-tailed, and P values < 0.05 were considered statistically significant.
Cтатистический анализ
Все статистические анализы проводились с использованием SPSS 23.0 для Windows (IBM Corp. 2015, Чикаго, Иллинойс, США). Для сравнения характеристик между группами CA- HCA- и HA-BSI использовался t-критерий Стьюдента или критерий Манна-Уитни для сравнения непрерывных переменных двух групп, а также однофакторный дисперсионный анализ (ANOVA) или критерий Крускала-Уоллиса для сравнения непрерывных переменных нескольких групп. Категориальные переменные сравнивались с использованием критерия хи-квадрат или точного критерия Фишера. Для апостериорного анализа множественных сравнений использовали метод Бонферрони. Все значения P были двусторонними, а значения P <0,05 считались статистически значимыми
Полученные результаты
Исследуемая популяция
Всего за период исследования умерло 1849 пациентов. За две недели до смерти положительный посев крови был у 331 пациента. После исключения двух пациентов в возрасте до 18 лет и 49 пациентов с контаминированными культурами крови в исследование были включены 280 (15,1%) пациентов. Средний возраст исследуемой популяции составил 69,92 года, а соотношение мужчин и женщин было 3:2. Семьдесят один (25,4%), 53 (18,9%) и 156 (55,7%) пациентов были классифицированы как CA-, HCA- и HA-BSI соответственно. В то время как заболевания печени чаще наблюдались в группе внебольничных инфекций кровотока, сердечно-сосудистые заболевания чаще наблюдались в группе госпитальных инфекций. Злокачественные новообразования и предшествующее использование антибиотиков чаще выявляли в группах HCA- и HA-BSI, чем в группе CA-BSI (таблица 1).
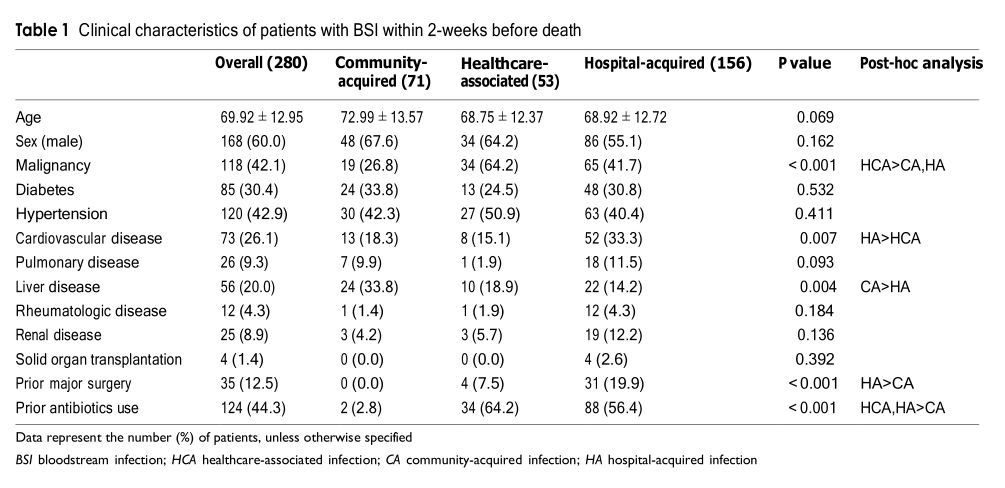
Таблица 1.
Выделенные возбудители
Всего из крови было выделено 316 возбудителей, в том числе в группах СА-, ГКА- и HA-BSI - 74 (23,4%), 58 (18,4%) и 184 (58,2%) возбудителя соответственно. Из 280 пациентов у 34 пациентов обнаружили полимикробную бактериемию однократно или в более, чем в двух последовательных случаях, из которых на группу госпитальных инфекций приходилось ~ 75% (26/34).
Пятью наиболее распространенными возбудителями были Klebsiella pneumonia (17,1%), Escherichia coli (16,4%), Staphylococcus aureus (11,4%), Acinetobacter baumannii (10,8%) и виды Candida (9,2%). Наиболее частым возбудителем в группах CA-, HCA- и HA-BSI были E. coli, K. pneumoniae и A. baumannii (таблица 2). В целом изолированные патогены в каждой больнице были относительно схожими и описаны в дополнительном файле 1: таблицы S1 и S2. Между группами возбудителей не наблюдалось различий в возрасте пациентов (дополнительный файл 1: таблица S3).
В целом, 54,5% (85/156) пациентов в группе госпитальной инфекции кровотока имели центральный венозный катетер, а 37,2% (58/156) пациентов были госпитализированы в отделение интенсивной терапии, когда возникла бактериемия (не показано в таблице).
Кроме того, у 26,3% (41/156) пациентов наблюдали развитие бактериемии во время введения карбапенема и/или ванкомицина. Наиболее часто выделяемым возбудителем во время терапии карбапенемами был A. baumannii (дополнительный файл 1: таблица S4).
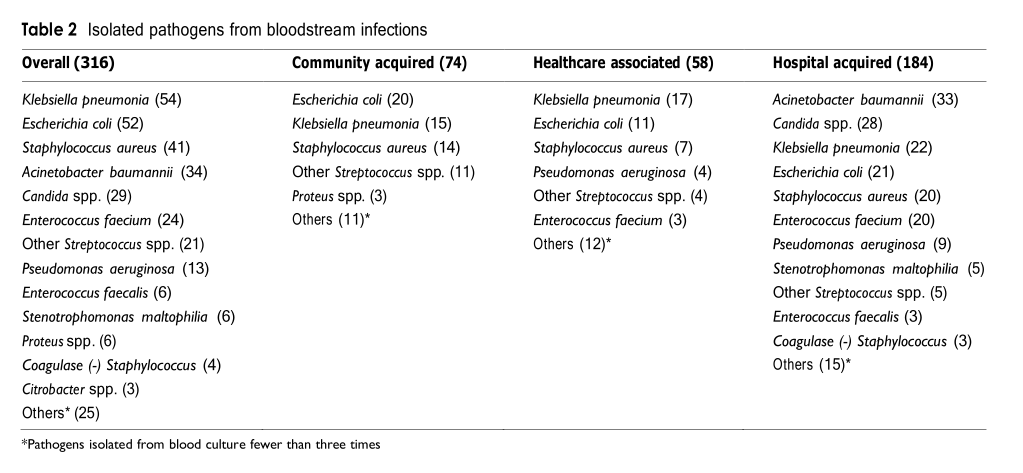
Таблица 2.
Сравнение характеристик между исследуемыми группами
На рис. 1 показаны характеристики каждой группы BSI. Почти все грибы были выделены у больных с госпитальными инфекциями. Виды Candida составляли 96,6% (28/29) изолятов грибов, и C. albicans был наиболее преобладающим (17 случаев 28 видов Candida) (рис. 1А). При этом чаще всего бактериемия была первичная или из неизвестного очага. Инфекция, связанная с центральным венозным катетером, чаще наблюдалась в группе HA-BSI (28,3%), чем в группе HCA-BSI (3,4%) или группе CA-BSI (0%) (рис. 1B).
Наиболее часто наблюдаемой лекарственной устойчивостью были устойчивые к цефотаксиму Enterobacteriaceae, которые относительно равномерно распределялись среди групп CA-BSI (21,6%), HCA-BSI (20,6%) и HA-BSI (17,9%) соответственно. Не было существенной разницы в пропорциях VRE и MRSA в трех группах BSI.
Однако CR-GNB были преобладающими лекарственно-устойчивыми патогенами в группе госпитальной бактериемии (21,9%) (рис. 1C). Паттерн DTR был идентифицирован в 81,8% (36/44) CRGNB. Наиболее распространенным видом CRGNB был A. baumannii (24 изолята), который редко или никогда не приводил к смертности при бактериемии, связанной с оказанием медицинской помощи (6,9%) или внебольничных BSI (0%).
Неадекватное эмпирическое антимикробное лечение чаще наблюдалось при HA-BSI (51,9%) по сравнению с HCA- (37,7%) и CA-BSI (21,1%) (рис. 1D). В нашей исследуемой популяции 65 случаев BSI эмпирически лечили карбапенемами 2 поколения и гликопептидами. Однако у 26,2% этих пациентов лечение по-прежнему было неадекватным из-за лекарственной устойчивости (данные не представлены).

Рисунок 1.
Обсуждение
Наше исследование выявило клинические характеристики пациентов и наиболее распространенные изоляты, которые способствовали смертности при BSI. Возбудители и характеристики госпитальных BSI, ассоциированные с летальностью имели различную эпидемиологию с внебольничными инфекциями кровотока с точки зрения видов, входных ворот, картины устойчивости к противомикробным препаратам и адекватности эмпирической противомикробной терапии.
HA-BSI вносят значительный вклад в уровень госпитальной смертности, а комбинация карбапенема и гликопептидов, которая представляется наиболее предпочтительной эмпирической схемой антибиотикотерапии для клиницистов, не предотвратила HA-BSI и не соответствовала критерию адекватной антимикробной терапии.
Г(-) бактерии бактериемия сопровождается большей летальностью, чем инфекции кровотока, вызванные Г(+) кокками. Постоянно сообщается о растущей резистентности ГНБ к противомикробным препаратам, что, наряду с отсутствием новых лицензированных антибиотиков, стало серьезной проблемой [10, 11, 19].
В этом исследовании устойчивые к цефотаксиму энтеробактерии продемонстрировали наиболее преобладающую резистентность в исследуемой популяции, особенно в группе внебольничных инфекций. Хотя Enterobacteriaceae, продуцирующие БЛРС, обычно связаны с госпитальными инфекциями, их распространение во внебольничной популяции увеличилось с середины 2000-х годов [20]. Данные наблюдения за устойчивостью к противомикробным препаратам в Южной Корее в 2011 г. показали, что только 18,3% E. coli были устойчивы к цефотаксиму; однако к 2017 г. уровень резистентности увеличился до 34,7% [10, 11]. Наше исследование подтвердило реальную взаимосвязь между увеличением числа энтеробактерий, продуцирующих БЛРС, и смертностью.
Г(-) отрицательные бактерии, резистентные к карбапенемам или возбудители с множественной лекарственной устойчивостью представляют жизнеугрожающую проблему при госпитальных инфекциях [11,16]. В числовом выражении 8,4% (156/1849) больных, умерших в больнице имели госпитальную инфекцию кровотока, и 25% (40/156) этих пациентов умерли в результате инфекции, вызванной карбапенемрезистентым возбудителем, чаще всего A. baumannii. Действительно, во всем мире сообщается о высокой резистентности A. baumannii к карбапенемам [12, 21]. Хотя колистин обычно является единственным вариантом лечения резистентных к карбапенемам Acinetobacter baumannii (CRAB), эффективность колистина при CRAB-бактериемии не очень надежна [22].
В одном многоцентровом исследовании из Южной Кореи сообщалось о 28-дневной смертности пациентов с CRAB-бактериемией, получавших лечение колистином, которая составила 61,4% [23]. Однако у пациентов с CRAB-бактериемией, даже не получавших соответствующих антибиотиков, летальность составила 69,8% [24].Высокая смертность, трудности с назначением соответствующих эмпирических антибиотиков и отсутствие надежных вариантов противомикробной терапии могут быть связаны с тем, что A. baumannii является наиболее преобладающим видом при госпитальной бактериемии, способствующим смертности в этом исследовании.Прежде чем внедрять эффективные варианты лечения против CRGNB, необходимо приложить усилия для соблюдения правил профилактики инфекций и контроля за назначением антибиотиков [25, 26].
В нашем исследовании виды Candida были отмечены как вторые, наиболее распространенные изоляты госпитальных инфекций кровотока, способствующие гибели пациентов. Адекватное эмпирическое лечение кандидемии является еще одной сложной проблемой, аналогичной бактериемии, вызванной возбудителями с множественной лекарственной устойчивостью. Хотя раннее соответствующее лечение связано с благоприятными исходами [27], только несколько пациентов получали соответствующие эмпирические противогрибковые препараты из-за трудностей ранней диагностики [28]. В нашем исследовании только 28,6% пациентов, умерших от кандидемии, получали соответствующие противогрибковые препараты. Для снижения смертности от кандидемии необходим более быстрый и надежный метод диагностики, чем посев крови, который мог бы быть использован в рутинной практике [29, 30].
In addition, in our study, we only considered short-term mortality of BSI. From this study, we cannot infer long-term mortality or changes in disability caused by BSI. Further studies are needed.
В нашем исследовании были некоторые ограничения. Несмотря на то, что наши данные были собраны в двух клинических больницах, эпидемиология BSI зависит как от демографических данных пациентов, так и от профиля каждой больницы. Например, в наше исследование было включено лишь небольшое количество пациентов, перенесших трансплантацию. Представляется, что медицинские центры, специализирующиеся на трансплантологии, могут иметь отличную от представленной в данной исследовании, эпидемиологию госпитальных инфекций кровотока. Кроме того, в нашем исследовании мы учитывали только краткосрочную смертность от BSI. Из этого исследования мы не можем сделать вывод о долгосрочной смертности или развитии инвалидности, вызванных инфекция ми кровотока. Необходимы дальнейшие исследования.
Выводы
В заключение, Г(-) бактериемия наиболее часто сопровождалась летальным исходом, чем при выявлении в крови Г(+) кокков K. pneumoniae и E. coli были преобладающими патогенами, ассоциированных с летальностью при внебольничных и инфекциях кровотока, связанных с оказанием медицинской помощи, тогда как виды A. baumannii и Candida были типичными для госпитальной бактериемии. Наряду с повышением лекарственной устойчивости Г(-) бактерий, неадекватная эмпирическая антибактериальная терапия в первую очередь наблюдалась в группе госпитальных инфекций кровотока из-за трудностей прогнозирования лекарственной устойчивости и идентификации грибковых патогенов. Наши данные показали, что в условиях стационара значительное число пациентов умирает от приобретенных инфекций кровотока, что делает меры инфекционного контроля доминирующими в профилактике данных осложнений. Комбинация карбапенема и гликопептида приводила к возникновению других патогенов с более высокой резистентностью или к грибковой инфекции.Следует подчеркнуть важность профилактики инфекций и программы рационального использования антибиотиков, особенно до тех пор, пока не будут внедрены более надежные варианты лечения Г(-) бактерий с множественной лекарственной устойчивостью и инструменты быстрой диагностики.
Литература
1. Goto M, Al-Hasan MN. Overall burden of bloodstream infection and nosocomial bloodstream infection in North America and Europe. Clin Microbiol Infect. 2013;19(6):501–9.
2. Diekema DJ, Beekmann SE, Chapin KC, Morel KA, Munson E, Doern GV. Epidemiology and outcome of nosocomial and community-onset bloodstream infection. J Clin Microbiol. 2003;41(8):3655–60.
3. Sogaard M, Norgaard M, Dethlefsen C, Schonheyder HC. Temporal changes in the incidence and 30-day mortality associated with bacteremia in hospitalized patients from 1992 through 2006: a population-based cohort study. Clin Infect Dis. 2011;52(1):61–9.
4. Seboxa T, Amogne W, Abebe W, Tsegaye T, Azazh A, Hailu W, et al. High mortality from blood stream infection in Addis Ababa, Ethiopia, is due to antimicrobial resistance. PLoS ONE. 2015;10(12):e0144944.
5. Koehler P, Stecher M, Cornely OA, Koehler D, Vehreschild M, Bohlius J,et al. Morbidity and mortality of candidaemia in Europe: an epidemiologic meta-analysis. Clin Microbiol Infect. 2019;25(10):1200–12.
6. Dickstein Y, Lellouche J, Ben Dalak Amar M, Schwartz D, Nutman A, Daitch V, et al. Treatment outcomes of colistin- and carbapenem-resistant Acinetobacter baumannii infections: an exploratory subgroup analysis of a randomized clinical trial. Clin Infect Dis. 2019;69(5):769–76.
7. Kim SH, Cha MK, Kang CI, Ko JH, Huh K, Cho SY, et al. Pathogenic significance of hemorrhagic pneumonia in hematologic malignancy patients with Stenotrophomonas maltophilia bacteremia: clinical and microbiological analysis. Eur J Clin Microbiol Infect Dis. 2019;38(2): 285–95.
8. Neuner EA, Yeh J-Y, Hall GS, Sekeres J, Endimiani A, Bonomo RA, et al. Treatment and outcomes in carbapenem-resistant Klebsiella pneumoniae bloodstream infections. Diagn Microbiol Infect Dis. 2011;69(4):357–62.
9. Kang CI, Song JH, Chung DR, Peck KR, Ko KS, Yeom JS, et al. Risk factors and pathogenic significance of severe sepsis and septic shock in 2286 patients with Gram-negative bacteremia. J Infect. 2011;62(1):26–33.
10. Huh K, Kim J, Cho SY, Ha YE, Joo E-J, Kang C-I, et al. Continuous increase of the antimicrobial resistance among Gram-negative pathogens causing bacteremia: a nationwide surveillance study by the Korean Network for Study on Infectious Diseases (KONSID). Diagn Microbiol Infect Dis. 2013;76(4):477–82.
11. Lee H, Yoon E-J, Kim D, Jeong SH, Won EJ, Shin JH, et al. Antimicrobial resistance of major clinical pathogens in South Korea, May 2016 to April 2017: first one-year report from Kor-GLASS. Eurosurveillance. 2018;23(42):1800047.
12. Liu C, Yoon E-J, Kim D, Shin JH, Shin JH, Shin KS, et al. Antimicrobial resistance in South Korea: a report from the Korean global antimicrobial resistance surveillance system (Kor-GLASS) for 2017. J Infect Chemother. 2019;25(11):845–59.
13. Seifert H. The clinical importance of microbiological findings in the diagnosis and management of bloodstream infections. Clin Infect Dis. 2009;48(Suppl 4):S238–45.
14. Friedman ND, Kaye KS, Stout JE, McGarry SA, Trivette SL, Briggs JP, et al. Health care-associated bloodstream infections in adults: a reason to change the accepted definition of community-acquired infections. Ann Intern Med. 2002;137(10):791–7.
15. Chang YT, Lin CY, Chen YH, Hsueh P-R. Update on infections caused by Stenotrophomonas maltophilia with particular attention to resistance mechanisms and therapeutic options. Front Microbiol. 2015. https:// doi.org/ 10. 3389/ fmicb. 2015. 00893.
16. Kadri SS, Adjemian J, Lai YL, Spaulding AB, Ricotta E, Prevots DR, et al. Difficult-to-treat resistance in Gram-negative bacteremia at 173 US hospitals: retrospective cohort analysis of prevalence, predictors, and outcomeof resistance to all first-line agents. Clin Infect Dis. 2018;67(12):1803–14.
17. Huh K, Chung DR, Ha YE, Ko JH, Kim SH, Kim MJ, et al. Impact of difficult-to-treat resistance in Gram-negative bacteremia on mortality: retrospective analysis of nationwide surveillance data. Clin Infect Dis. 2020;71(9):e487–96.
18. Clinical and Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing. 28th ed. CLSI supplement M100 Wayne. 2018.
19. Livermore DM. Current epidemiology and growing resistance of Gramnegative pathogens. Korean J Intern Med. 2012;27(2):128–42.
20. Doi Y, Park YS, Rivera JI, Adams-Haduch JM, Hingwe A, Sordillo EM, et al. Community-associated extended-spectrum β-lactamaseproducing Escherichia coli infection in the United States. Clin Infect Dis.2013;56(5):641–8.
21. Kamolvit W, Sidjabat HE, Paterson DL. Molecular epidemiology and mechanisms of carbapenem resistance of Acinetobacter spp. Asia and Oceania. Microb Drug Resist. 2015;21(4):424–34.
22. Garnacho-Montero J, Amaya-Villar R, Ferrandiz-Millon C, Diaz-Martin A, Lopez-Sanchez JM, Gutierrez-Pizarraya A. Optimum treatment strategies for carbapenem-resistant Acinetobacter baumannii bacteremia. Expert Rev Anti Infect Ther. 2015;13(6):769–77.
23. Kim T, Park KH, Yu SN, Park SY, Park SY, Lee YM, et al. Early intravenous colistin therapy as a favorable prognostic factor for 28-day mortality in patients with CRAB bacteremia: a multicenter propensity score-matching analysis. J Korean Med Sci. 2019;34(39):e256.
24. Kim T, Lee EJ, Park SY, Yu SN, Lee YM, Park KH, et al. Natural prognosis of
carbapenem-resistant Acinetobacter baumannii bacteremia in patients who did not receive appropriate antibiotic treatment: a retrospective multicenter study in Korea. Medicine (Baltimore). 2018;97(43):e12984.
25. Paterson DL, Isler B, Stewart A. New treatment options for multiresistant Gram negatives. Curr Opin Infect Dis. 2020;33(2):214–23.
26. Cheon S, Kim MJ, Yun SJ, Moon JY, Kim YS. Controlling endemic multidrug-resistant Acinetobacter baumannii in intensive care units using antimicrobial stewardship and infection control. Korean J Intern Med. 2016;31(2):367–74.
27. Morrell M, Fraser VJ, Kollef MH. Delaying the empiric treatment of candida bloodstream infection until positive blood culture results are obtained: a potential risk factor for hospital mortality. Antimicrob Agents Chemother. 2005;49(9):3640–5.
28. Zilberberg MD, Kollef MH, Arnold H, Labelle A, Micek ST, Kothari S, et al.
Inappropriate empiric antifungal therapy for candidemia in the ICU and hospital resource utilization: a retrospective cohort study. BMC Infect Dis.2010;10:150.
29. Pfaller MA, Wolk DM, Lowery TJ. T2MR and T2Candida: novel technology for the rapid diagnosis of candidemia and invasive candidiasis. Future Microbiol. 2016;11(1):103–17.
30. Arendrup MC, Andersen JS, Holten MK, Krarup KB, Reiter N, Schierbeck J, et al. Diagnostic performance of T2Candida among ICU patients with riskfactors for invasive candidiasis. Open Forum Infect Dis. 2019. https:// doi.org/ 10. 1093/ ofid/ ofz136.
Источник фотоиллюстрации - www.freepik.com
Mun et al. BMC Infectious Diseases (2022) 22:336