Эндотелиопатия при септических состояниях: механистический взгляд на внутрисосудистую коагуляцию
Ito et al. Crit Care (2021) 25:95
Обзор
Эндотелиопатия при септических состояниях: механистический взгляд на внутрисосудистую коагуляцию
Перевод оригинальной статьи «Endotheliopathy in septic conditions: mechanistic insight into intravascular coagulation»
Авторы Takashi Ito, Midori Kakuuchi и Ikuro Maruyama
Department of Systems Biology in Thromboregulation, Kagoshima University Graduate School of Medical and Dental Sciences, 8-35-1 Sakuragaoka, Kagoshima 890-8544, Japan
Keywords: Sepsis, Disseminated intravascular coagulation (DIC), Endotheliopathy, Extracellular histones, Lipopolysaccharide (LPS), Antithrombin, Thrombomodulin, COVID-19
Ключевые слова: сепсис, диссеминированное внутрисосудистое свертывание (ДВС), эндотелиопатия, экстраклеточные гистоны, липополисахарид (ЛПС), антитромбин, тромбомодулин, COVID-19
Кровь в жидком состоянии находится только в кровеносных сосудах. Вне сосудистого русла кровь сворачивается. Диссеминированное внутрисосудистая коагуляция (ДВК) или синдром диссеминированного внутрисосудистого свертывания крови (ДВС) является патофизиологическим состоянием, что характеризуется абберантной активацией коагуляции внутри кровеносных сосудов и недостаточной коагуляцией вне кровеносных сосудов [1]. При таком парадоксальном состоянии мы видим сложные клинические проявления как тромбоза, так и кровотечения.
Сепсис определяется как угрожающая жизни органная дисфункция, вызванная дисрегуляцией иммунного ответа на инфекцию [2]. Такая дисрегуляция приводит к избыточному воспалению, коагуляции, сосудистой утечке и гипоперфузии органов [3], в которой эндотелиопатия может играть центральную роль [4]. К примеру, нарушения гликокаликса эндотелия при септических состояниях приводят к избыточной адгезии лейкоцитов, внутрисосудистой коагуляции, отеку тканей и нарушенному тонусу сосудов (преимущественно к вазодилятации) [5, 6]. В этом обзоре мы обобщаем физиологическую роль клеток эндотелия в поддержании внутрисосудистого гомеостаза, патологическую роль активированных/поврежденных клеток эндотелия при септических состояниях и концепции исследований in vitro, показывающих роли клеток эндотелия.
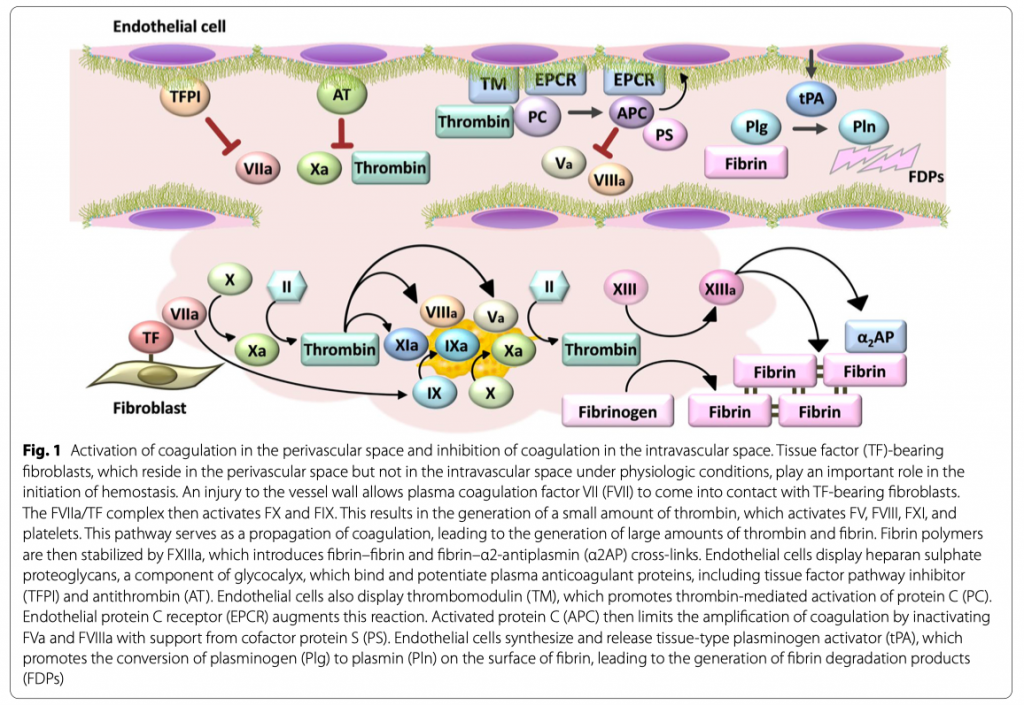
Тромбоз является частым осложнением при применении контактирующих с кровью медицинских устройств, таких как сосудистые шунты, стенты, клапаны сердца, центральные венозные катетеры и экстракорпоральные контуры [7]. При этом основной задачей эндотелиальных клеток является активное противодействие тромбозу [8]. Эндотелиальные клетки синтезируют гепаран сульфат протеогликаны, компоненты гликокаликса, которые связывают и потенциируют антикоагулянтные протеины плазмы, включая сюда ингибитор пути тканевого фактора (англ. tissue factor pathway inhibitor или TFPI) и антитромбин [9]. Эндотелиальные клетки также экспрессируют тромбомодулин, задачей которого является связывание тромбина и конвертация этих субстратов от прокоагулянтов к антикоагулянтам. Связываясь с тромбомодулином, тромбин теряет свою аффинность к фибриногену, коагуляционным факторам V (FV), FVIII, FXIII и рецепторам, активирующим протеазу, что все вместе приводит к активации антикоагулянтного протеина С [10]. Рецептор эндотелиального протеина С (англ. Endothelial protein C receptor или EPCR) усиливает эту реакцию, располагая протеин С таким образом, чтобы комплексы тромбин-тромбомодулин могли эффективно активировать его [11]. Активированный протеин С (англ. Activated protein C или APC) ограничивает усиление коагуляции путем инактивации FVa и FVIIIa при поддержке ко-факторного белка S (Рис. 1).
Комплексы EPCR–APC оказывают и цитопротективные эффекты на клетки эндотелия, включая сюда эффекты антиапоптоза и барьерные эффекты. Потеря своей функции антитромбином, протеином С, протеином S и тромбомодулином ведет к развитию тромбофилии с разнообразными клиническими проявлениями, что предполагает ведущую роль этих антикоагулянтных протеинов в противодействии внутрисосудистой коагуляции [12 - 16]. Более того, эндотелиальные клетки синтезируют активатор плазминогена тканевого типа (англ. tissue-type plasminogen activator или tPA), усиливая тем самым плазмин-опосредованный фибринолиз в кровеносных сосудах [17].
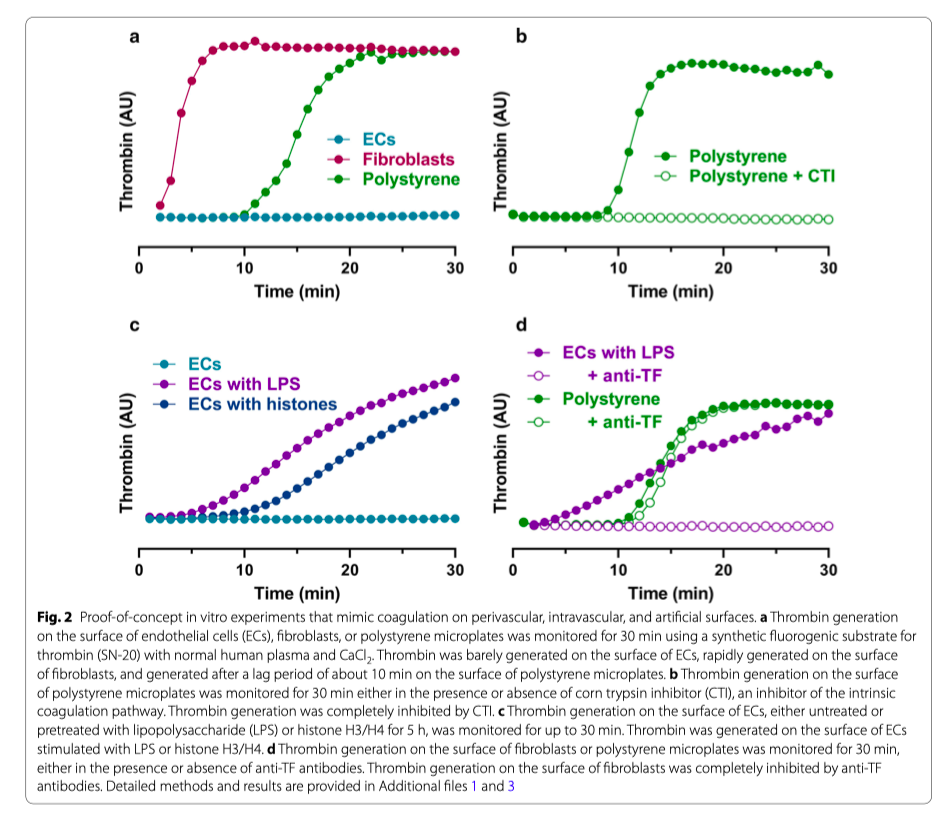
Для подтверждения концепции, в которой искусственная поверхность является прокоагулянтом, а поверхность эндотелия - антикоагулянтом, мы провели эксперименты in vitro. В этих экспериментах для мониторинга образования тромбина в нормальной плазме человека в присутствии кальция использовался синтетический флуорогенный субстрат SN-20. Когда плазму помещали на искусственную поверхность, тромбин образовывался после периода задержки около 10 минут (Рис. 2а, зеленый цвет). Эта реакция полностью подавлялась ингибитором кукурузного трипсина, мощным и специфическим ингибитором FXIIa (рис. 2b), и позволяет предположить, что образование тромбина на искусственной поверхности опосредуется внутренним путем коагуляции. И наоборот, образования тромбина не происходило (в течение 30 минут) тогда, когда плазма размещалась на поверхности с культурой эндотелиальных клеток (Рис7 2, голубой цвет). Данные результаты показывают, что именно эндотелиальные клетки оказывают сопротивление активации коагуляции.
Активация коагуляции в периваскулярном пространстве
Коагуляция контролируется не только факторами коагуляции, но и клеточными компонентами. В инициации гемостаза в периваскулярном пространстве, но не во внутрисосудистом пространстве, в физиологических условиях важную роль играют фибробласты, несущие на себе тканевой фактор (англ. Tissue factor или TF) [18]. Повреждение стенки сосуда позволяет плазменным факторам коагуляции, включая FVII, при выходе их в периваскулярное пространство контактировать с фибробластами с TF (Рис. 1). После чего комплекс FVIIa/TF активирует FX и FIX. Это приводит к образованию небольшого количества тромбина, что недостаточно для генерации фибрина, но достаточно для активации FV, FVIII, FXI и тромбоцитов. Именно этот путь лежит в основе распространения коагуляции с образованием большего количества тромбина, достаточного для образования фибрина [19]. Затем полимеры фибрина стабилизируются FXIIIa, который вводит поперечные связи фибрин-фибрин и фибрин-α2-антиплазмин (α2AP) [20]. В нашем in vitro эксперименте тромбин не образовывался на поверхности, покрытой эндотелиальными клетками (Рис. 2а, голубой цвет), но очень быстро образовывался на поверхности, покрытой фибробластами (Рис. 2а, красный цвет). Эти результаты показывают, что наши экспериментальные условия могут имитировать быструю коагуляцию в периваскулярном пространстве без коагуляции внутри сосудистой сети и постепенной коагуляции на искусственной поверхности.
Активация коагуляции во внутрисосудистом пространстве при септических состояниях
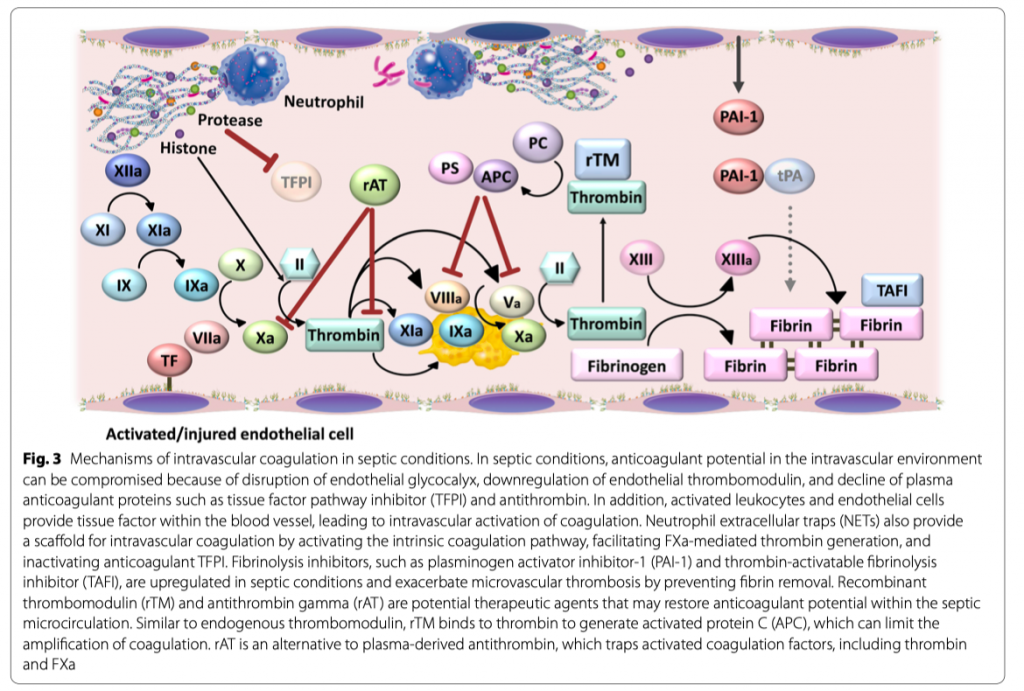
В нормальных условиях интраваскулярное пространство свободно от тромбоза, но этого не скажешь при септических состояниях [21, 22]. На мышиных моделях инфекции, вызванной Staphylococcus aureus, Escherichia coli или липополисахаридом (ЛПС), выраженное образование тромбина наблюдалось в микроциркуляции печени [22]. В соответствии с этим, уровень тромбин-антитромбинового комплекса в плазме, клинического биомаркера образования тромбина, увеличивается у большинства пациентов с сепсисом [23]. В патогенезе внутрисосудистой коагуляции, впрочем как и при избыточном воспалении, видное место занимают активированные лейкоциты [24, 25]. В ответ на бактериальный стимул, активированные лейкоциты высвобождают нейтрофильные экстрацеллюлярные ловушки (англ. neutrophil extracellular traps или NETs), что, возможно, и является основным стимулом для внутрисосудистого свертывания (Рис.3). NETs содержат ДНК, гистоны и сериновые протеазы и все они вовлечены в процессы активации коагуляции. Отрицательно заряженные поверхности ДНК служат, как промотеры внутреннего пути коагуляции путем контакта в FXII и FXI [26]. Сериновые протеазы нейтрофилов инактивируют антикоагулянт TFPI [27]. Экстрацеллюлярные гистоны связываются с протромбином, что облегчает опосредованное FXa расщепление протромбина с высвобождением активного тромбина [28]. Зависимый от TF наружный путь коагуляции также принимает участие во внутрисосудистом свертывании, которое происходит на поверхности активированных эндотелиальных клеток и микровезикул, образованных активированными моноцитами [26, 29, 30]. Еще больше усугубляет тромбоз микрососудов отключение при септических состояниях фибринолиза, что препятствует удалению фибрина [31]. Увеличение уровней ингибитора-1 активатора плазминогена (англ. plasminogen activator inhibitor-1 или PAI-1) и ингибитора тромбин-активированного фибринолиза (англ. thrombin-activatable fibrinolysis inhibitor или TAFI) ассоциируется с органным повреждением и неблагоприятными исходами у пациентов с тяжелым сепсисом [32]. Также свою фундаментальную роль в патогенезе сепсис-ассоциированного ДВС и нарушения эндотелиального гомеостаза играет ангиопоэтин-2 [4].
Для подтверждения того, что активированные/поврежденные клетки эндотелия могут быть прокоагулянтами, мы провели in vitro очередной эксперимент. Когда плазму помещали на поверхность эндотелиальных клеток, предварительно обработанных LPS или гистонами, тромбин генерировался постепенно (Рис. 2c, фиолетовый и синий). В отличие от искусственной поверхности, поверхность с активированными/поврежденными эндотелиальными клетками показывает более быстрое образование тромбина, но с более медленной скоростью (Рис. 2c, 2d), что позволяет предположить, что активированные/поврежденные эндотелиальные клетки могут предоставлять себя и как инициаторы, и как ингибиторы пути коагуляции. Иммуноблот анализ показал, что стимуляция ЛПС приводит к индукции экспрессии TF и небольшому снижению экспрессии тромбомодулина на эндотелиальных клетках (Дополнительный файл 1). Индукция TF несет ответственность за образование тромбина на поверхности эндотелиальных клеток, предварительно стимулированных ЛПС, поэтому лечение анти-TF антителами практически полностью останавливает образование тромбина (Рис.2d). Стимуляция гистонами приводит к глубокой редукции экспрессии тромбомодулина и воздействия фосфатидилсерина на внешний листок плазматической мембраны эндотелиальных клеток (Дополнительный файл 1).
Таким образом, механистически эффекты ЛПС и гистонов на эндотелиальные клетки имеют различия, но в общем и целом, и гистоны, и ЛПС нарушают антикоагулянтные свойства эндотелиальных клеток.
Влияние гемодилюции на баланс «прокоагуляция-антикоагуляция»
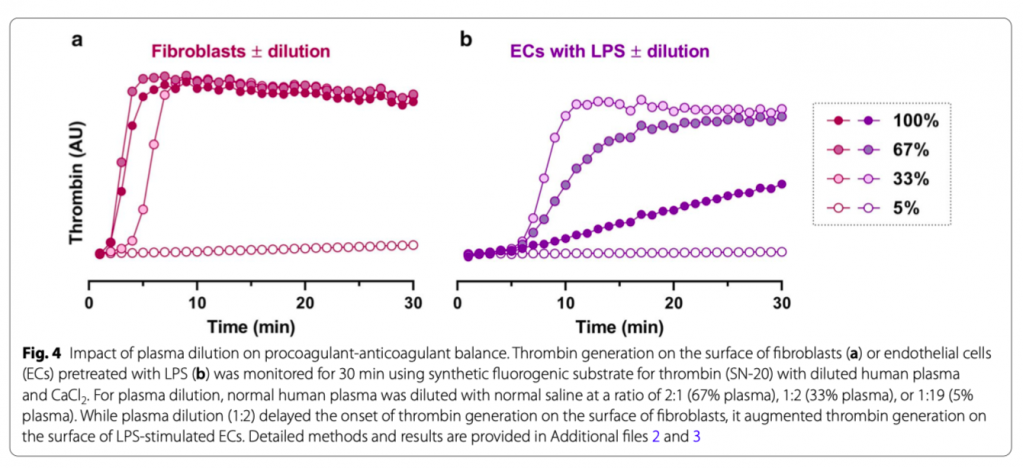
Интенсивная инфузионная терапия снижает уровень факторов коагуляции в плазме, что, в итоге, приводит к нарушениям гемостаза, называемого коагулопатией гемодилюции [33]. В нашем in vitro эксперименте с фибробластами, что представляют быструю коагуляцию в периваскулярном пространстве, разбавление плазмы в три раза приводило к задержке начала образования тромбина (Рис. 4а). И наоборот, в нашем in vitro эксперименте с эндотелиальными клетками, предварительно обработанными ЛПС, которые представляют последовательную коагуляцию во внутрисосудистом пространстве при патологических состояниях, разведение в три раза плазмы увеличивало образование тромбина (Рис. 4b и Дополнительный файл 2). Причиной этого может быть то, что активация коагуляции вызывается снижением антикоагулянтных белков плазмы. Пути антикоагулянта могут быть гораздо больше затронуты разведением, чем пути прокоагулянта, в ситуации, когда имеет место постепенная коагуляция [34, 35]. Эти данные показывают, что пациенты с гемодилюцией больше подвержены риску внутрисосудистого свертывания, а также периваскулярного кровотечения.
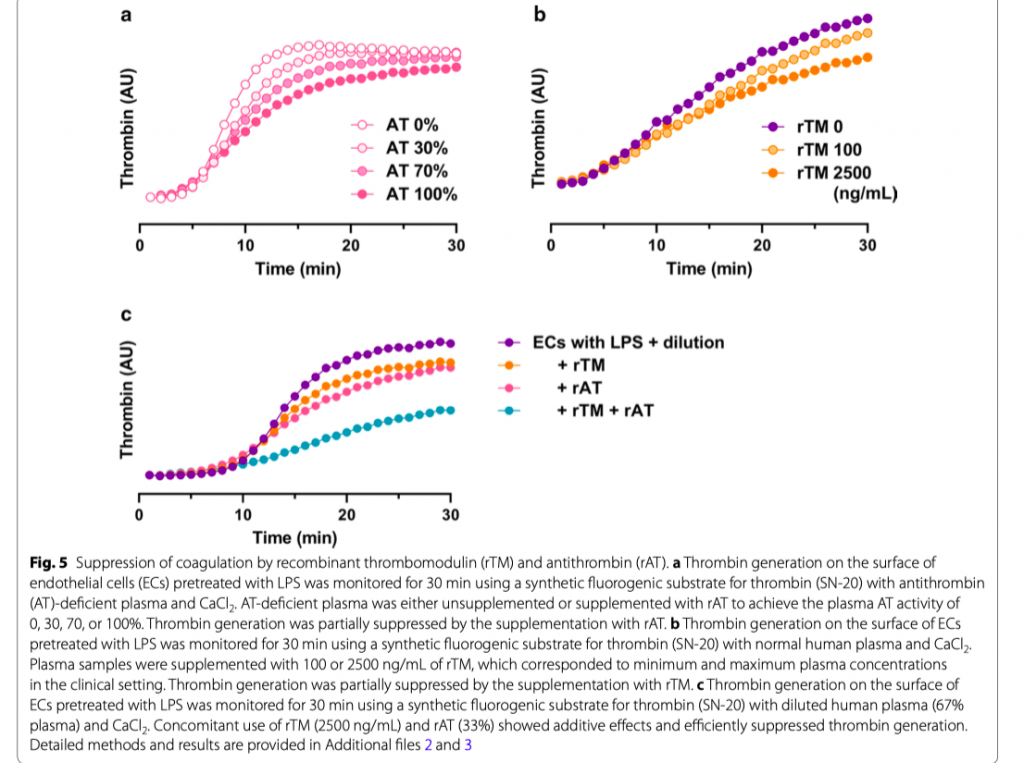
Супрессия коагуляции с помощью рекомбинантных тромбомодулина и антитромбина
При септических состояниях антикоагулянтный потенциал во внутрисосудистой среде может быть нарушен из-за повреждения эндотелиального гликокаликса, подавления эндотелиального тромбомодулина и снижения антикоагулянтных белков плазмы, таких как TFPI и антитромбин. Рекомбинантный тромбомодулин (rTM) и антитромбин гамма (rAT) являются потенциальными терапевтическими агентами, с помощью которых возможно восстановление антикоагулянтного потенциала в микроциркуляции при сепсисе (Рис. 3). Подобно эндогенному тромбомодулину, rTM связывается с тромбином с образованием APC, что может ограничивать усиление коагуляции без увеличения времени коагуляции [36]. При этом rAT оказывается альтернативой полученному из плазмы антитромбину, который улавливает активированные факторы свертывания крови, включая тромбин и FXa [37]. В наших экспериментах in vitro по подтверждению концепции с использованием эндотелиальных клеток, стимулированных ЛПС, образование тромбина было частично подавлено добавлением rAT (Рис. 5a) и rTM (Рис. 5b). Совместное использование rTM и rAT показало аддитивные эффекты и эффективное подавление образования тромбина на поверхности LPS-стимулированных эндотелиальных клеток (Рис. 5c и Дополнительный файл 2). Эти результаты предлагают ценную информацию о потенциале комбинированной терапии этими двумя препаратами, поскольку остается не совсем понятным, может ли rAT дополнять антикоагулянтные эффекты оси rTM-APC или может противодействовать оси rTMAPC посредством ингибирования опосредованного тромбином образования APC [38].
Перспективы антикоагулянтной терапии сепсис-ассоциированного ДВС
Масштабное, рандомизированное, двойное слепое плацебо контролируемое исследование 3 фазы, называемое KyberSept trial, было предпринято для установления клинической эффективности антитромбина у пациентов с тяжелым сепсисом [39]. В этом исследовании 2314 пациентов были случайным образом распределены в две группы, в одной из которых вводился внутривенно антитромбин (30000 Ед. за четверо суток), а в другой - плацебо (1% раствор альбумина). Несмотря на то, что введение больших доз антитромбина не привело к снижению летальности по сравнению со стандартной терапией сепсиса (38.9% vs. 38.7%, P = 0.94), был явно виден тренд на снижение 28-ми дневной (37.8% vs. 43.6%, P = 0.08) и 90-то дневной (44.9% vs. 52.5%, P = 0.03) летальности в заранее определенной подгруппе пациентов, в которой назначение антитромбина не сопровождалось одновременным введением гепарина. Более того, post hoc анализ показал снижение 28-ми дневной летальности у пациентов, которым антитромбин вводился на фоне ДВС (25.4% vs. 40.0%, P = 0.024), но этот эффект не был виден, при прочих равных условиях, у пациентов без ДВС (22.1% vs. 22.2%, P > 0.2) [40].
Эффективность и безопасность рекомбинантного человеческого АРС (rhAPC) у пациентов с тяжелым сепсисом были изучены в масштабном, рандомизированном, двойном слепом плацебо контролируемом клиническом исследовании 3 фазы, PROWESS trial [41]. В этом исследовании 1690 пациентов были случайным образом распределены в группы, в одной из которых внутривенно вводился rhAPC в виде продолженной инфузии в течение 96 часов, а в другой - плацебо. Введение rhAPC значительно снижало 28-ми дневную летальность от всех причин (24.7% vs. 30.8%, P = 0.005). Но все же последующие исследования не показали эффективности и безопасности rhAPC [42, 43], в большей степени из-за побочных эффектов в виде кровотечений, что привело к исключению rhAPC из клинического применения.
Эффективность и безопасность rTM у пациентов с тяжелым сепсисом и низким количеством тромбоцитов в сочетании с увеличенным протромбиновым временем изучали в рандомизированном двойном слепом плацебо-контролируемом клиническом исследовании фазы 3, названном SCARLET trial [44]. В этом исследовании в общей сложности 816 пациентов были рандомизированы в две группы для получения либо rTM внутривенно (один раз в день в течение 6 дней), либо плацебо. Введение rTM не привело к значительному снижению 28-дневной летальности от всех причин (26,8% против 29,4%, P = 0,32). Апостериорный анализ показал, что преимущество в выживаемости при применении rTM было больше в подгруппах с более высокими уровнями образования тромбина на исходном уровне [45]. Это может соответствовать предыдущему открытию высоких доз антитромбина, учитывая, что диагноз ДВС-синдрома основан на низком количестве тромбоцитов, увеличенном протромбиновом времени и повышенных уровнях биомаркеров коагуляции [46–48].
Мета-аанализ рандомизированных контролируемых исследований показал, что улучшение выживаемости при лечении антикоагулянтами не наблюдается в общей популяции сепсиса, но наблюдается в популяции пациентов с ДВС-синдромом, вызванным сепсисом [49]. Таким образом, наиболее важным вопросом, связанным с антикоагулянтной терапией у пациентов с сепсисом, является выбор мишени. На данный момент предполагается, что оптимальной мишенью для антикоагулянтной терапии могут быть пациенты с тяжелым сепсисом и ДВС-синдромом. Однако это не основано на окончательных доказательствах, и поэтому необходимы дальнейшие проспективные исследования [50].
Перспективы терапии эндотелиопатий, ассоциированных с COVID‑19
Клинические проявления COVID-19 очень различаются, от асимптоматических форм до угрожающих жизни состояний. Самым распространенным и потенциально летальным осложнением COVID-19 является тромбоз [51, 52]. При фатальных случаях COVID-19 определяются тяжело поврежденные эндотелиальные клетки в капиллярах альвеол, что предполагает их ключевую роль в патогенезе ассоциированного с COVID-19 тромбоза именно эндотелиопатий также, как и при сепсис-ассоциированном ДВС. Но имеются и различия. Во-первых, тромбоцитопения, увеличение протромбинового времени и элевация PAI-1, что типично для сепсис-ассоциированного ДВС-синдрома, редко встречается при тромбозе, ассоциированном с COVID-19, по крайней мере, на ранних и средних стадиях заболевания [54, 55]. Во-вторых, COVID-19 ассоциированный тромбоз развивается не только в микроциркуляции, но и в макроциркуляции, что приводит к инсультам, инфарктам миокарда и венозной тромбоэмболии [56].
Ключевым механизмом, вызывающим вторичную эндотелиопатию при SARS-CoV-2, включает в себя прямую вирусную токсичность и иммуно-опосредованное повреждение. Скорее всего здесь имеет место прямое воздействие вируса на эндотелиальные клетки, так как для проникновения в клетку SARS-CoV-2 в качестве инструментов использует ангиотензин-превращающий фермент 2 и трансмембранную сериновою протеазу 2, которые экспрессируются на эндотелиальных клетках [57]. Однако свою роль может играть и иммуно-опосредованный механизм, особенно в случаях, когда тромботическое повреждение органа развивается в отсутствие виремии SARS-CoV-2 или продолжает ухудшаться даже после того, как большая часть вируса была устранена. Так же как и при сепсисе, COVID-19 приводит к нарушению регуляции цитокинов, комплемента, тромбоцитов и нейтрофилов, обеспечивая полный развал системы регуляции тромбообразования [52, 58].
Помимо медиаторов врожденного иммунитета, в развитии потенциально летальных осложнений COVID-19 могут играть важную роль аутоантитела [59, 60]. По сравнению с не инфицированными людьми, у пациентов с COVID-19 наблюдается резкое увеличение аутоантител к компонентам их кровеносных сосудов, сердца, мозга и иммунной системы [61]. Некоторые из аутоантител нацелены на фосфолипиды и фосфолипид-связывающие белки, расположенные на поверхности эндотелиальных клеток, тромбоцитов и нейтрофилов, наклоняя поверхность раздела кровь-эндотелий в сторону тромбоза [59, 62]. Иммуноглобулин G, выделенный от пациентов с COVID-19, у мышей может вызывать высвобождение NETs и ускорять тромбоз. Учитывая, что развитие аутоантител обычно занимает 1-2 недели, теория аутоантител может объяснить некоторую задержку начала тяжелых осложнений COVID-19 [63]. Важно понять, могут ли аутоантитела и нейтрализующие антитела сохраняться в течение длительного периода после заражения, а также, имеют ли эти антитела прямую патогенную роль и имеют ли эти иммунные ответы значение для лечения COVID-19.
Выводы
Эндотелиальные клетки оказывают противодействие активации коагуляции. Однако в септических условиях антикоагулянтные свойства эндотелиальных клеток нарушаются, а активированные/поврежденные эндотелиальные клетки могут обеспечивать основу для внутрисосудистой коагуляции. Гемодилюция может сильнее влиять на антикоагулянтные, чем прокоагулянтные пути, чем дополнительно способствовать активации коагуляции на поверхности активированных/поврежденных эндотелиальных клеток. Аберрантную активацию коагуляции можно частично подавить добавлением rAT и rTM. Эти антикоагулянты могут обеспечить выживаемость в субпопуляции пациентов с сепсисом, страдающих ДВС-синдромом.
Список литературы
1. Gando S, Levi M, Toh CH. Disseminated intravascular coagulation. Nat Rev Dis Primers. 2016;2:16037.
2. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, Bellomo R, Bernard GR, Chiche JD, Coopersmith CM, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA. 2016;315(8):801–10.
3. van der Poll T, van de Veerdonk FL, Scicluna BP, Netea MG. The immunopathology of sepsis and potential therapeutic targets. Nat Rev Immunol. 2017;17(7):407–20.
4. Higgins SJ, De Ceunynck K, Kellum JA, Chen X, Gu X, Chaudhry SA, Schulman S, Libermann TA, Lu S, Shapiro NI, et al. Tie2 protects the vasculature against thrombus formation in systemic inflammation. J Clin Investig. 2018;128(4):1471–84.
5. Okada H, Takemura G, Suzuki K, Oda K, Takada C, Hotta Y, Miyazaki N, Tsujimoto A, Muraki I, Ando Y, et al. Three-dimensional ultrastructure of capillary endothelial glycocalyx under normal and experimental endotoxemic conditions. Crit Care. 2017;21(1):261.
6. Uchimido R, Schmidt EP, Shapiro NI. The glycocalyx: a novel diagnostic and therapeutic target in sepsis. Crit Care. 2019;23(1):16.
7. Jaffer IH, Fredenburgh JC, Hirsh J, Weitz JI. Medical device-induced thrombosis: what causes it and how can we prevent it? J Thromb Haemost. 2015;13(Suppl 1):S72-81.
8. Pober JS, Sessa WC. Evolving functions of endothelial cells in inflammation. Nat Rev Immunol. 2007;7(10):803–15.
9. Marcum JA, McKenney JB, Rosenberg RD. Acceleration of thrombinantithrombin complex formation in rat hindquarters via heparinlike molecules bound to the endothelium. J Clin Investig. 1984;74(2):341–50.
10. Ito T, Maruyama I. Thrombomodulin: protectorate God of the vasculature in thrombosis and inflammation. J Thromb Haemost. 2011;9(Suppl1):168–73.
11. Mohan Rao LV, Esmon CT, Pendurthi UR. Endothelial cell protein C receptor: a multiliganded and multifunctional receptor. Blood. 2014;124(10):1553–62.
12. Patnaik MM, Moll S. Inherited antithrombin deficiency: a review. Haemophilia. 2008;14(6):1229–39.
13. Stevens SM, Woller SC, Bauer KA, Kasthuri R, Cushman M, Streiff M, Lim W, Douketis JD. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis. 2016;41(1):154–64.
14. Okada M, Tominaga N, Honda G, Nishioka J, Akita N, Hayashi T, Suzuki K, Moriuchi H. A case of thrombomodulin mutation causing defective thrombin binding with absence of protein C and TAFI activation. Blood Adv. 2020;4(12):2631–9.
15. Isermann B, Hendrickson SB, Zogg M, Wing M, Cummiskey M, Kisanuki YY, Yanagisawa M, Weiler H. Endothelium-specific loss of murine thrombomodulin disrupts the protein C anticoagulant pathway and causes juvenile-onset thrombosis. J Clin Investig. 2001;108(4):537–46.
16. Manco-Johnson MJ, Bomgaars L, Palascak J, Shapiro A, Geil J, Fritsch S, Pavlova BG, Gelmont D. Efficacy and safety of protein C concentrate to treat purpura fulminans and thromboembolic events in severe congenital protein C deficiency. Thromb Haemost. 2016;116(1):58–68.
17. Urano T, Castellino FJ, Suzuki Y. Regulation of plasminogen activation on cell surfaces and fibrin. J Thromb Haemost. 2018;16:1487–97.
18. Hoffman M, Monroe DM 3rd. A cell-based model of hemostasis. Thromb Haemost. 2001;85(6):958–65.
19. Swieringa F, Spronk HMH, Heemskerk JWM, van der Meijden PEJ. Integrating platelet and coagulation activation in fibrin clot formation. Res Pract Thrombosis Haemostasis. 2018;2(3):450–60.
20. Pieters M, Wolberg AS. Fibrinogen and fibrin: An illustrated review. Res Pract Thrombosis Haemostasis. 2019;3(2):161–72.
21. Levi M, Ten Cate H. Disseminated intravascular coagulation. N Engl J Med. 1999;341(8):586–92.
22. McDonald B, Davis RP, Kim SJ, Tse M, Esmon CT, Kolaczkowska E, Jenne CN. Platelets and neutrophil extracellular traps collaborate to promote intravascular coagulation during sepsis in mice. Blood. 2017;129(10):1357–67.
23. Koyama K, Madoiwa S, Nunomiya S, Koinuma T, Wada M, Sakata A, Ohmori T, Mimuro J, Sakata Y. Combination of thrombin-antithrombin complex, plasminogen activator inhibitor-1, and protein C activity for early identification of severe coagulopathy in initial phase of sepsis: a prospective observational study. Crit Care. 2014;18(1):R13.
24. Ito T. PAMPs and DAMPs as triggers for DIC. J Intensive Care. 2014;2(1):67.
25. Bohn E, Muller-Berghaus G. The effect of leukocyte and platelet transfusion on the activation of intravascular coagulation by endotoxin in granulocytopenic and thrombocytopenic rabbits. Am J Pathol. 1976;84(2):239–58.
26. von Bruhl ML, Stark K, Steinhart A, Chandraratne S, Konrad I, Lorenz M, Khandoga A, Tirniceriu A, Coletti R, Kollnberger M, et al. Monocytes, neutrophils, and platelets cooperate to initiate and propagate venous thrombosis in mice in vivo. J Exp Med. 2012;209(4):819–35.
27. Massberg S, Grahl L, von Bruehl ML, Manukyan D, Pfeiler S, Goosmann C, Brinkmann V, Lorenz M, Bidzhekov K, Khandagale AB, et al. Reciprocal coupling of coagulation and innate immunity via neutrophil serine proteases. Nat Med. 2010;16(8):887–96.
28. Abrams ST, Su D, Sahraoui Y, Lin Z, Cheng Z, Nesbitt K, Alhamdi Y, Harrasser M, Du M, Foley JH, et al. Assembly of alternative prothrombinase by extracellular histones initiates and disseminates intravascular coagulation. Blood. 2021;137(1):103–14.
29. Lupu C, Westmuckett AD, Peer G, Ivanciu L, Zhu H, Taylor FB, Lupu F. Tissue factor-dependent coagulation is preferentially up-regulated within arterial branching areas in a baboon model of Escherichia coli Sepsis. Am J Pathol. 2005;167(4):1161–72.
30. Falati S, Liu Q, Gross P, Merrill-Skoloff G, Chou J, Vandendries E, Celi A, Croce K, Furie BC, Furie B. Accumulation of tissue factor into developing thrombi in vivo is dependent upon microparticle P-selectin glycoprotein ligand 1 and platelet P-selectin. J Exp Med. 2003;197(11):1585–98
31. Madoiwa S. Recent advances in disseminated intravascular coagulation: endothelial cells and fibrinolysis in sepsis-induced DIC. J Intensive Care. 2015;3(1):8.
32. Semeraro F, Colucci M, Caironi P, Masson S, Ammollo CT, Teli R, Semeraro N, Magnoli M, Salati G, Isetta M, et al. Platelet drop and fibrinolytic shutdown in patients with sepsis. Crit Care Med. 2018;46(3):e221–8.
33. Bolliger D, Görlinger K, Tanaka KA. Pathophysiology and treatment of coagulopathy in massive hemorrhage and hemodilution. Anesthesiology. 2010;113(5):1205–19.
34. De Smedt E, Wagenvoord R, Coen Hemker H. The technique of measuring thrombin generation with fluorogenic substrates: 3. The effects of sample dilution. Thrombosis Haemostasis. 2009;101(1):165–70.
35. Dunbar NM, Chandler WL. Thrombin generation in trauma patients. Transfusion. 2009;49(12):2652–60.
36. Ito T, Maruyama I, Shimazaki S, Yamamoto Y, Aikawa N, Hirayama A, Honda G, Saito H. Effects of thrombomodulin alfa on hemostatic parameters in disseminated intravascular coagulation: Post hoc analysis of a phase 3 randomized controlled trial. Res Pract Thromb Haemost. 2020;4(7):1141–9.
37. Endo S, Shimazaki R. An open-label, randomized, phase 3 study of the efficacy and safety of antithrombin gamma in patients with sepsisinduced disseminated intravascular coagulation syndrome. J Intensive Care. 2018;6:75.
38. Arishima T, Ito T, Yasuda T, Yashima N, Furubeppu H, Kamikokuryo C, Futatsuki T, Madokoro Y, Miyamoto S, Eguchi T, et al. Circulating activated protein C levels are not increased in septic patients treated with recombinant human soluble thrombomodulin. Thrombosis J. 2018;16:24.
39. Warren BL, Eid A, Singer P, Pillay SS, Carl P, Novak I, Chalupa P, Atherstone A, Penzes I, Kubler A, et al. Caring for the critically ill patient. High-dose antithrombin III in severe sepsis: a randomized controlled trial. JAMA. 2001;286(15):1869–78.
40. Kienast J, Juers M, Wiedermann CJ, Hoffmann JN, Ostermann H, Strauss R, Keinecke HO, Warren BL, Opal SM. Treatment effects of high-dose antithrombin without concomitant heparin in patients with severe sepsis with or without disseminated intravascular coagulation. J Thromb Haemost. 2006;4(1):90–7.
41. Bernard GR, Vincent J-L, Laterre P-F, LaRosa SP, Dhainaut J-F, Lopez-Rodriguez A, Steingrub JS, Garber GE, Helterbrand JD, Ely EW, et al. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med. 2001;344(10):699–709.
42. Abraham E, Laterre P-F, Garg R, Levy H, Talwar D, Trzaskoma BL, François B, Guy JS, Brückmann M, Rea-Neto Á, et al. Drotrecogin alfa (activated) for adults with severe sepsis and a low risk of death. N Engl J Med. 2005;353(13):1332–41.
43. Ranieri VM, Thompson BT, Barie PS, Dhainaut J-F, Douglas IS, Finfer S, Gårdlund B, Marshall JC, Rhodes A, Artigas A, et al. Drotrecogin alfa (activated) in adults with septic shock. N Engl J Med. 2012;366(22):2055–64.
44. Vincent JL, Francois B, Zabolotskikh I, Daga MK, Lascarrou JB, Kirov MY, Pettila V, Wittebole X, Meziani F, Mercier E, et al. Effect of a recombinant human soluble thrombomodulin on mortality in patients with sepsisassociated coagulopathy: the SCARLET randomized clinical trial. JAMA. 2019;321(20):1993–2002.
45. Levi M, Vincent J-L, Tanaka K, Radford AH, Kayanoki T, Fineberg DA, Hoppensteadt D, Fareed J. Effect of a recombinant human soluble thrombomodulin on baseline coagulation biomarker levels and mortality outcome in patients with sepsis-associated coagulopathy. Crit Care Med. 2020;48(8):1140–7.
46. Taylor FB Jr, Toh CH, Hoots WK, Wada H, Levi M. Scientific Subcommittee on Disseminated Intravascular Coagulation of the International Society on T, Haemostasis: Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost. 2001;86(5):1327–30.
47. Wada H, Gabazza EC, Asakura H, Koike K, Okamoto K, Maruyama I, Shiku H, Nobori T. Comparison of diagnostic criteria for disseminated intravascular coagulation (DIC): diagnostic criteria of the International Society of Thrombosis and Hemostasis and of the Japanese Ministry of Health and Welfare for overt DIC. Am J Hematol. 2003;74(1):17–22.
48. Asakura H, Takahashi H, Uchiyama T, Eguchi Y, Okamoto K, Kawasugi K, Madoiwa S, Wada H. Proposal for new diagnostic criteria for DIC from the Japanese Society on Thrombosis and Hemostasis. Thrombosis Journal. 2016;14:42.
49. Umemura Y, Yamakawa K, Ogura H, Yuhara H, Fujimi S. Efficacy and safety of anticoagulant therapy in three specific populations with sepsis: a meta-analysis of randomized controlled trials. J Thromb Haemost. 2016;14(3):518–30.
50. Umemura Y, Yamakawa K. Optimal patient selection for anticoagulant therapy in sepsis: an evidence-based proposal from Japan. J Thromb Haemost. 2018;16(3):462–4.
51. Wichmann D, Sperhake J-P, Lütgehetmann M, Steurer S, Edler C, Heinemann A, Heinrich F, Mushumba H, Kniep I, Schröder AS, et al. Autopsy findings and venous thromboembolism in patients with COVID-19. Ann Intern Med. 2020;173(4):268–77.
52. Aid M, Busman-Sahay K, Vidal SJ, Maliga Z, Bondoc S, Starke C, Terry M, Jacobson CA, Wrijil L, Ducat S, et al. Vascular disease and thrombosis in SARS-CoV-2-infected rhesus macaques. Cell. 2020;183(5):1354-1366. e1313.
53. Ackermann M, Verleden SE, Kuehnel M, Haverich A, Welte T, Laenger F, Vanstapel A, Werlein C, Stark H, Tzankov A, et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med. 2020;383(2):120–8.
54. McGonagle D, O’Donnell JS, Sharif K, Emery P, Bridgewood C. Immune mechanisms of pulmonary intravascular coagulopathy in COVID-19 pneumonia. Lancet Rheumatol. 2020;2(7):e437–45.
55. Umemura Y, Yamakawa K, Kiguchi T, Nishida T, Kawada M, Fujimi S. Hematological phenotype of COVID-19-induced coagulopathy: far from typical sepsis-induced coagulopathy. J Clin Med. 2020;9(9):2875.
56. Gupta A, Madhavan MV, Sehgal K, Nair N, Mahajan S, Sehrawat TS, Bikdeli B, Ahluwalia N, Ausiello JC, Wan EY, et al. Extrapulmonary manifestations of COVID-19. Nat Med. 2020;26(7):1017–32.
57. Pons S, Fodil S, Azoulay E, Zafrani L. The vascular endothelium: the cornerstone of organ dysfunction in severe SARS-CoV-2 infection. Crit Care. 2020;24(1):353.
58. Nicolai L, Leunig A, Brambs S, Kaiser R, Weinberger T, Weigand M, Muenchhoff M, Hellmuth JC, Ledderose S, Schulz H, et al. Immunothrombotic dysregulation in COVID-19 pneumonia is associated with respiratory failure and coagulopathy. Circulation. 2020;142(12):1176–89.
59. Zuo Y, Estes SK, Ali RA, Gandhi AA, Yalavarthi S, Shi H, Sule G, Gockman K, Madison JA, Zuo M, et al. Prothrombotic autoantibodies in serum from patients hospitalized with COVID-19. Sci Transl Med. 2020;12(570):eabd3876.
60. Bastard P, Rosen LB, Zhang Q, Michailidis E, Hoffmann H-H, Zhang Y, Dorgham K, Philippot Q, Rosain J, Béziat V, et al. Autoantibodies against type I IFNs in patients with life-threatening COVID-19. Science. 2020;370(6515):eabd4585.
61. Wang EY, Mao T, Klein J, Dai Y, Huck JD, Liu F, Zheng NS, Zhou T, Israelow B, Wong P, et al. Diverse functional autoantibodies in patients with COVID-19. medRxiv 2020:2020.2012.2010.20247205. (not yet peer reviewed)
62. Zuniga M, Gomes C, Carsons SE, Bender MT, Cotzia P, Miao QR, Lee DC, Rodriguez A. Autoimmunity to the lung protective phospholipid-binding protein Annexin A2 predicts mortality among hospitalized COVID-19 patients. medRxiv 2021:2020.2012.2028.20248807. (not yet peer reviewed)
63. Khamsi R. Rogue antibodies could be driving severe COVID-19. Nature. 2021;590(7844):29–31.
Ito et al. Crit Care (2021) 25:95