Эффекты вазопрессоров на венозный возврат у пациентов с сепсисом: обзор
European Journal of Anaesthesiology 2021, 38:659–663
DOI:10.1097/EJA.0000000000001508
Обзорная статья
Эффекты вазопрессоров на венозный возврат у пациентов с сепсисом: обзор
Перевод оригинальной статьи «Vasopressor effects on venous return in septic patients: a review».
Авторы: Aarne Feldheiser, Simon Gelman, Michelle Chew and Matthias Stopfkuchen-Evans
Department of Anesthesiology and Operative Intensive Care Medicine (CCM, CVK), Charite – Universita¨tsmedizin Berlin, corporate member of Freie Universita¨t Berlin, Humboldt-Universita¨t zu Berlin, and Berlin Institute of Health, Berlin (AF), Department of Anesthesiology, Intensive Care Medicine and Pain Therapy, Evang. Kliniken Essen-Mitte, Huyssens-Stiftung/Knappschaft, Essen, Germany (AF), Brigham and Women’s Hospital,
Department of Anesthesiology, Perioperative and Pain Medicine, Harvard Medical School, Boston, Massachusetts, United States of America (SG, M-SE)
Department of Anaesthesia and Intensive Care, Biomedical and Clinical Sciences, Link€oping University, Link€oping, Sweden (MC)
Ключевые слова: вазопрессоры, венозный возврат, сепсис, септический шок, расширенный мониторинг гемодинамики, норэпинефрин, вазопрессин, селепрессин
Данная работа направлена на обеспечение целостного физиологического обзора сердечно-сосудистой системы, что позволит более тщательно подходить к выбору вазопрессора при лечении пациентов с сепсисом. Здесь мы обсудим не только фармакологическое влияние вазопрессоров на артерии/артериолы, но и влияние вазопрессоров на другие компоненты циркуляции, такие как вены и микроциркуляция, что все вместе нарисует нам целостную картину для последующего принятия рационального решения. Рукопись базируется на литературном поиске в PubMed, при котором использовались следующие ключевые слова: сепсис, венозный возврат, венозное сопротивление, среднее давление циркуляции и среднее системное давление наполнения, вазопрессин, норэпинефрин, вазопрессор. Поиск был завершен в ноябре 2020 года. Цитируется библиография соответствующих публикаций, экспертное мнение авторов основано на их исследовательской деятельности в этой области.
У пациентов с сепсисом ключевым элементом начальной терапии является интенсивная инфузионная терапия (ресусцитация/реанимация жидкостью). Если инфузионная терапия не приводит к стабилизации гемодинамики и у пациента развивается септический шок, для сохранения органной перфузии требуется уже терапия вазопрессорами. На основании практически всех доступных исследований вазопрессором первой линии является норэпинефрин, и данная рекомендация закреплена в клиническом руководстве «Компании за выживание при сепсисе» (англ.the Surviving Sepsis Campaign) [1].
По сравнению с допамином, норэпинефрин обладает большим потенциалом в реверсии гипотензии у пациентов с септическим шоком, а его применение ассоциируется со снижением летальности и с более низкой частотой развития аритмий [2, 3]. Несмотря на то, что исследования, в которых сравнивались норэпинефрин и эпинефрин, не нашли разницы в летальности, применение эпинефрина связано с большей частотой осложнений – например, при сепсисе эпинефрин может оказывать неблагоприятное воздействие на циркуляцию в висцеральных органах и увеличивать продукцию лактата с развитием гиперлактатемии. Все эти нежелательные эффекты эпинефрина лишний раз свидетельствуют в пользу применения норэпинефрина [3,4]. Для фенилэфрина имеются очень ограниченные данные по его применению для лечения септического шока, но следует помнить о том, что фенилэфрин способен вызывать выраженную вазоконстрикцию в висцеральных органах [5].
Концентрации вазопрессина в плазме у пациентов с септическим шоком, согласно имеющимся сообщениям, растут в начальной фазе, но в последующем концентрация вазопрессина снижается до нормальных значений между 24 и 48 часами, что дает возможность предположения об относительном дефиците вазопрессина при тяжелой гипотензии [6]. Высокие дозы вазопрессина ассоциируются с развитием ишемии пальцев, висцеральных органов и сердца [7]. Тем не менее подобное не мешает некоторым исследователям полагать, что небольшие дозы вазопрессина могут быть эффективными тогда, когда вазопрессорная терапия норэпинефрином не приводит к увеличению среднего артериального давления и, таким образом, вазопрессин может применяться как терапия спасения у пациентов с рефрактерным септическим шоком [1].
Но нам следует знать, что помимо явных эффектов вазопрессина, реализующихся через рецептор V1, что приводит к снижению степени вазодилятации, снижению сосудистой утечки и снижению тканевого отека, имеются еще и V1b и V2 рецепторы, через которые реализуются уже другие эффекты вазопрессина в виде увеличения факторов прокоагуляции, задержки воды и соли, выпуска оксида азота и адренокортикотропного гормона (АКТГ) [8, 9]. Вследствие этого селективный агонист рецептора V1a, селепрессин, выглядел более физиологичным, по сравнению с вазопрессином, для пациентов с септическим шоком и вызывал большие надежды на то, что его применение приведет к снижению режима дозирования норэпинефрина, одновременно с этим снижая тканевые отеки. Но недавно опубликованное исследование, выполненное Laterre et al. [10], не показало никаких полезных эффектов от применения агониста V1a рецептора на свободные от вентилятора дни и на свободные дни от вазопрессоров, а также не показало никакого влияния на летальность, на свободные от почечно-заместительной терапии дни.
Для обсуждения причин, по которым это исследование селепрессина привело к отрицательным результатам, даже несмотря на обнадеживающие патофизиологические эффекты, нам следует рассмотреть и другие составные части циркуляции, вовлеченные в септический шок. Влияние вазопрессина на гемодинамику имеет такие явные эффекты, как увеличение среднего артериального давления и/или снижение дозы норэпинефрина. Все эти клинические параметры могут быть измерены в любых условиях, а улучшение артериального давления перфузии, предположительно, улучшает и клинические исходы у пациентов с септическим шоком.
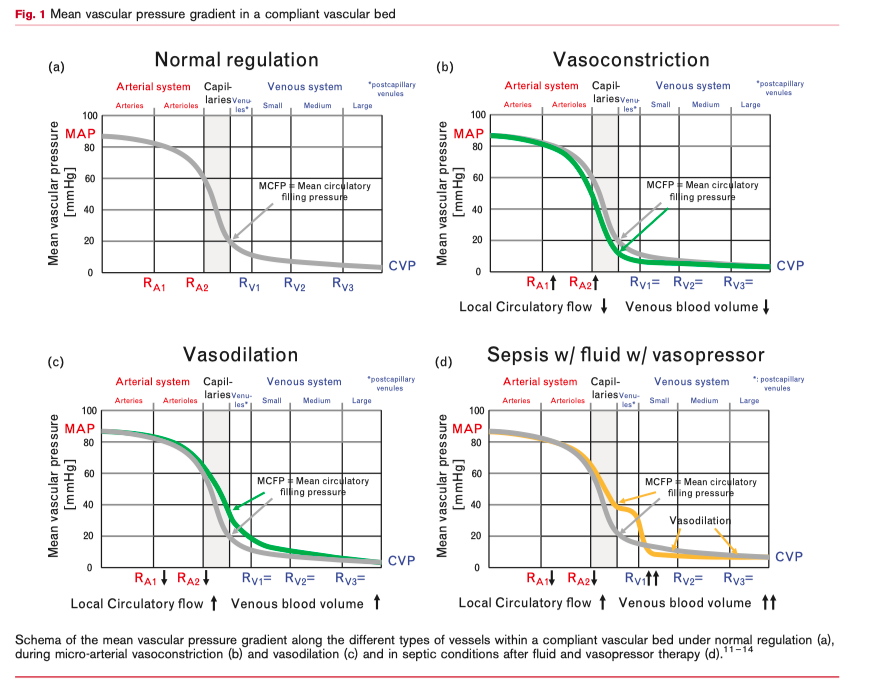
Но нам необходимо принимать во внимание и вторичные эффекты при применении вазопрессоров, отличные от увеличения артериального давления. Любая вазоконстрикция ведет к изменениям распределения сердечного выброса в органах и к перемещению объема крови из податливых венозных сосудов в неподатливые или наоборот (англ. compliant and noncompliant vascular beds) [11 — 13]. Этот эффект изменяет объем венозного возврата в правый желудочек и увеличивает соотношение стрессового венозного объема к не-стрессовому венозному объему. Для дальнейшего объяснения таких последствий артериальной вазоконстрикции на венозный возврат нам необходимо рассмотреть некоторые аспекты физиологии венозной системы. Внутрисосудистое давление на входе в посткапиллярные венулы, как это показано в эксперименте, равно среднему давлению наполнения циркуляции (англ. the mean circulatory filling pressure или MCFP) (Рис. 1а). MCFP определяет градиент давления в правом желудочке сердца, который необходим для поддержания венозного возврата. Градиент давления обычно низкий, но и сопротивление венозному возврату также низкое (Рис.1а).
На рисунке 1b показано, что артериальная вазоконстрикция, если она ассоциируется с небольшим подъемом артериального давления, снижает MCFP, тем самым снижая венозное давление и последующее венозное наполнение сосудистого русла, как результат эластической отдачи растянутой гладкой мускулатуры сосудистой стенки [14]. И наоборот, артериальная вазодилятация увеличивает MCFP и увеличивает заполнение податливых венозных сосудов (Рис. 1с) [14].
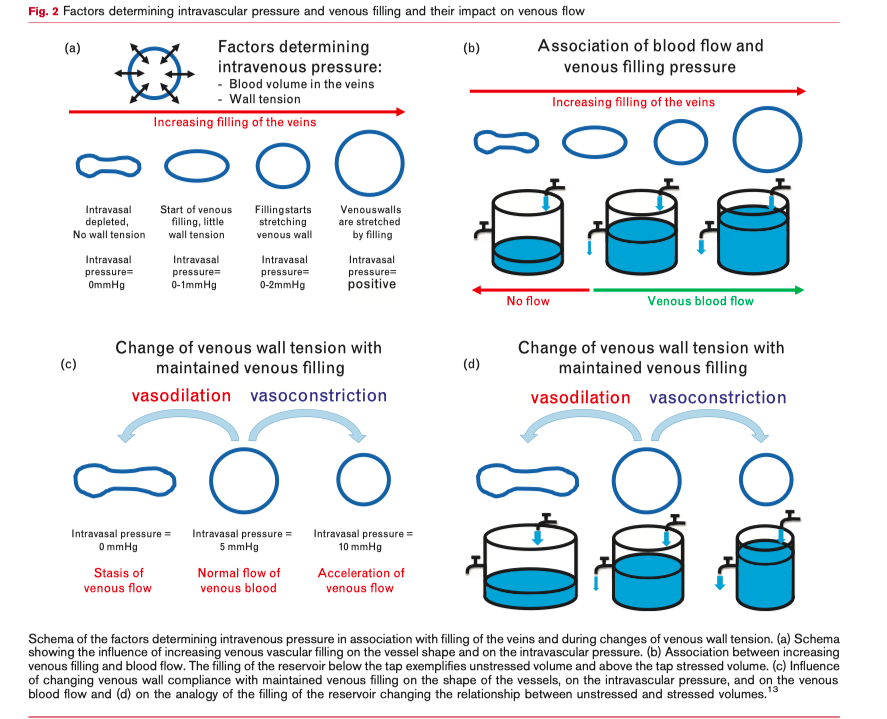
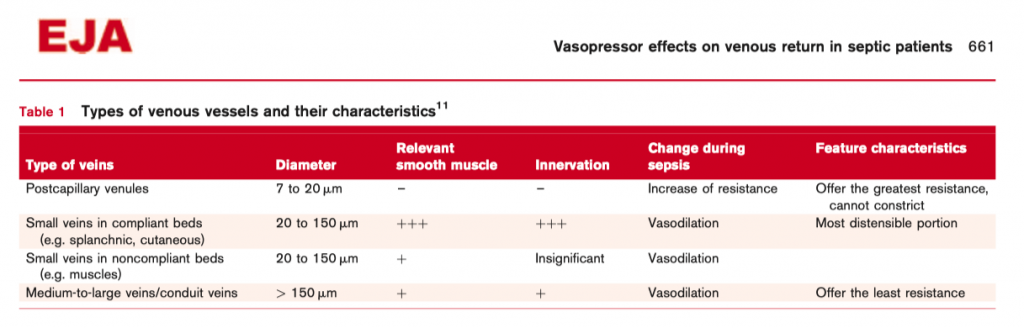
Но у пациента с септическим шоком представлена не только артериальная вазодилятация, но и увеличение венозного сопротивления в посткапиллярных венулах на фоне значительной вазодилятации небольших, средних и больших венозных сосудов (Таб. 1). Все это ведет к увеличению MCFP [11, 12, 14] вместе с увеличением венозного внутрисосудистого давления. А уже увеличение сопротивления в посткапиллярных венулах ведет к значительному падению внутрисосудистого давления между посткапиллярными венулами и небольшими венами [12] и, как результат, движущее давление для венозного возврата между небольшими венами и правым предсердием становится практически равным нулю, что еще больше усугубляется существующей при сепсисе венозной вазодилятацией (Рис. 1d, 2c и d). Небольшие вены являются самой растяжимой частью циркуляции (Таб. 1) [11]. Следствием является скопление венозной крови в податливых венах сосудистого русла с массивным снижение венозного возврата в правый желудочек. Увеличение венозного сопротивления в посткапиллярных венулах по причине эндотелиального и периваскулярного отека не может быть модифицировано вазопрессорной терапией (Таб. 1). Таким образом, идеальный вазопрессор для терапии септического шока должен противодействовать венозной вазодилятации, особенно в небольших венах для того, чтобы обеспечить градиент давления в венозной системе для сохранения венозного возврата. Норэпинефрин, подобно любому a-агонисту, обладает возможностью вызывать венозную вазоконстрикцию, тем самым увеличивая преднагрузку за счет увеличения как внутрисосудистого венозного давления, так и стрессового объема (как показано на Рис. 2с и d) [15, 16]. Норэпинефрин увеличивает венозный возврат и сердечный выброс как при энодотоксических [16], так и при не-эндотоксических состояниях, но здесь следует иметь в виду, что сама по себе эндотоксемия снижает реакцию артерий на норэпинефрин [17]. В дополнение к эффектам веноконстрикции было показано, что норэпинефрин также может увеличивать венозное сопротивление, но в меньшей степени [16]. Интересно, что ингибитор синтазы оксида азота, N⍵-нитро-L-аргинин метиловый эфир (L-NAME), может восстанавливать чувствительность артерий к норэпинефрину, но в венах такого эффекта не наблюдается [17].
В отличие от норэпинефрина, вазопрессин практически не оказывает своего влияния на венозный комплаэнс [18], и увеличивает венозное сопротивление [19] с увеличением не-стрессового венозного объема [20]. Понятия «стрессовый объем» и «не-стрессовый объем» подробно рассмотрены в других работах [13, 21], так что здесь мы не будем подробно на этом останавливаться. Кратко, не-стрессовый объем - объем крови в венах с трансмуральным давлением равным нулю, служит резервным объемом крови, который может быть мобилизован в циркуляцию в случае необходимости. Стрессовый объем - объем крови в венах, вызывающий увеличение трансмурального давления в венах, определяет MCFP и напрямую влияет на венозный возврат и сердечный выброс. Экспериментальные данные показывают, что инфузия вазопрессина способна увеличить среднее артериальное давление на 25%, но такой эффект сопровождается значительным снижением стрессового объема и сердечного выброса [22].
Снижение дозы норэпинефрина при применении вазопрессина может привести к снижению венозного возврата, изменениям в распределении объема крови между податливыми и не-податливыми венами и, тем самым, нести ответственность за снижение преднагрузки [16, 22, 23]. Расширенный мониторинг гемодинамики возможно и будет способен определить такие изменения, но в исследовании Laterre et al.[10] не было указаний на применение такого расширенного мониторинга гемодинамики.
Исследование должно поднимать вопрос о том, каким образом оценивать ответ на вазопрессорную терапию у пациентов с сепсисом. Идеальный вазопрессор должен влиять на сопротивление артериальных сосудов чтобы противодействовать септической микроартериальной вазоплегии и, тем самым, сохранять перфузионное артериальное давление. Применение идеального вазопрессора позволит избежать снижения сердечного выброса и поддержать перфузию основных органов, таких как органы брюшной полости и почек. Дополнительно, применение вазопрессоров должно приводить к противодействию значительной венозной дилятации, что позволит мобилизовать не-стрессовый объем для сохранения сердечно-сосудистого потока. Катехоламины способны оказывать подобные воздействия [22], но теряют эту способность при эндотоксемии [17]. Что же касается вазопрессина, то оказать подобное катехоламинам воздействие он не может ни при каких обстоятельствах [19, 20, 22].
Чрезмерное внимание, что уделяют клиницисты артериальному давлению, которое легко измерить и с помощью которого они пытаются оптимизировать работу сердечно-сосудистой системы, не оставляет времени на оценку эффектов от вазопрессоров на микроциркуляцию, на венозный возврат, на перфузию висцеральных органов, на производительность правого желудочка сердца и на циркуляцию в легких, что все вместе составляет более трех четвертей всего объема системы циркуляции [24, 25].
Таким образом, наш обзор может послужить хорошим примером того, как в будущем следует проводить исследования, в которых будет оцениваться эффективность вазопрессорной терапии у пациентов с сепсисом. Мы предлагаем проводить оценку вазопрессорной терапии путем измерения тех эффектов, что она оказывает на микроциркуляцию, венозный возврат, легочную перфузию и общую функцию сердца. Такой подход может быть более подходящим для целей оптимизации гемодинамического статуса, чем только лишь сосредоточение внимания на повышении среднего артериального давления или снижении режима дозирования норэпинефрина. Мы предлагаем, что бы все будущие исследования включали в себя:
• измерение сердечного выброса по методологии, независимой от артериального давления, для более точной оценки влияния на венозный возврат;
• переменные производительности сердца для избежания негативного влияния увеличения постнагрузки;
• маркеры состояния микроциркуляции для изучения ответной реакции на введение вазопрессоров.
Такое расширенное понимание состояния гемодинамики позволит нам «наполнить светом черный ящик» пациента с сепсисом и намного лучше оценивать предлагаемые сейчас и будущие варианты лечения.
References
1. Rhodes A, Evans LE, Alhazzani W, et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock. Crit Care Med 2017; 45:486–552.
2. Sakr Y, Reinhart K, Vincent J-L, et al. Does dopamine administration in shock influence outcome?Results of the Sepsis Occurrence in Acutely Ill Patients (SOAP) study. Crit Care Med 2006; 34:589–597.
3. Avni T, Lador A, Lev S, et al. Vasopressors for the treatment of septic shock: systematic review and meta-analysis. Plos One 2015; 10:e0129305. Myburgh JA, Higgins A, Jovanovska A, et al. A comparison of epinephrine and norepinephrine in critically ill patients. Intensive Care Med 2008; 34:2226–2234.
4. Myburgh JA, Higgins A, Jovanovska A, et al. A comparison of epinephrine and norepinephrine in critically ill patients. Intensive Care Med 2008; 34:2226–2234.
5. Zhou F, Mao Z, Zeng X-T, et al. Vasopressors in septic shock: a systematic review and network meta-analysis. Ther Clin Risk Manag 2015; 11:10471059.
6. Sharshar T, Blanchard A, Paillard M, et al. Circulating vasopressin levels in septic shock. Crit Care Med 2003; 31:1752–1758.
7. Dunser MW, Mayr AJ, Tu¨r A, et al. Ischemic skin lesions as a complication of continuous vasopressin infusion in catecholamine-resistant vasodilatory shock: incidence and risk factors. Crit Care Med 2003; 31:1394–1398.
8. Kortenoeven MLA, Pedersen NB, Rosenbaek LL, et al. Vasopressin regulation of sodium transport in the distal nephron and collecting duct. Am J of Physiol Renal Physiol 2015; 309:F280–F299.
9. Kaufmann JE, Oksche A, Wollheim CB, et al. Vasopressin-induced von Willebrand factor secretion from endothelial cells involves V2 receptors and cAMP. J Clin Invest 2000; 106:107–116.
10. Laterre P-F, Berry SM, Blemings A, et al., SEPSIS-ACT Investigators. Effect of selepressin vs placebo on ventilator- and vasopressor-free days in patients with septic shock: the SEPSIS-ACT randomized clinical trial. JAMA 2019; 322:1476–1485.
11. Rowell LB. Human circulation - regulation during physical stress, chapter 3: the venous system. Oxford, New York: Oxford University Press; 1986. Hiesmayr M, Jansen JR, Versprille A. Effects of endotoxin infusion on mean systemic filling pressure and flow resistance to venous return. Pflugers Arch 1996; 431:741–747.
12. Hiesmayr M, Jansen JR, Versprille A. Effects of endotoxin infusion on mean systemic filling pressure and flow resistance to venous return. Pflugers Arch 1996; 431:741–747.
13. Gelman S. Venous function and central venous pressure: a physiologic story. Anesthesiology 2008; 108:735–748.
14. Rowell LB. Human circulation - regulation during physical stress, chapter 2: general principles of vascular control. Oxford, New York: Oxford University Press; 1986.
15. Schwarz B, Hofst€otter H, Salak N, et al. Effects of norepinephrine and phenylephrine on intestinal oxygen supply and mucosal tissue oxygen tension. Intensive Care Med 2001; 27:593–601.
16. Persichini R, Silva S, Teboul J-L, et al. Effects of norepinephrine on mean systemic pressure and venous return in human septic shock. Crit Care Med 2012; 40:3146–3153.
17. Datta P, Magder S. Hemodynamic response to norepinephrine with and without inhibition of nitric oxide synthase in porcine endotoxemia. Am J Respir Crit Care Med 1999; 160:1987–1993.
18. Aldasoro M, Mauricio MD, Serna E, et al. Effects of aspirin, nimesulide, and SC-560 on vasopressin-induced contraction of human gastroepiploic artery and saphenous vein. Crit Care Med 2008; 36: 193–197.
19. Lee RW, Standaert S, Lancaster LD, et al. Cardiac and peripheral circulatory responses to angiotensin and vasopressin in dogs. J Clin Invest 1988; 82:413–419.
20. Martin DS, McNeill JR. Whole body vascular capacitance response to vasopressin is mediated by autonomic function. Am J Physiol 1991; 261 (2 pt 2):H493–H499.
21. Magder S. Volume and its relationship to cardiac output and venous return. Crit Care 2016; 20:271.
22. Emerson TE. Effects of angiotensin, epinephrine, norepinephrine, and vasopressin on venous return. Am J Physiol 1966; 210:933–942.
23. Tabrizchi R, Ford CA. A comparison between haemodynamic effects of vasopressin analogues. Naunyn-Schmiedeberg’s Arch Pharmacol 2004; 370:340–346.
24. Hainsworth R. The importance of vascular capacitance in cardiovascular control. Physiology 1990; 5:250–254.
25. Rothe CF. Reflex control of veins and vascular capacitance. Physiol Rev 1983; 63:1281–1342.
European Journal of Anaesthesiology 2021, 38:659–663