Эффекты от времени ре-заполнения капилляров против целевого значения лактата
Castro et al. Ann. Intensive Care (2020) 10:150
Исследование
Эффекты от времени ре-заполнения капилляров против целевого значения лактата при проведении интенсивной инфузионной терапии на региональные, микроциркуляторные и связанные с гипоксией параметры при септическом шоке: рандомизированное клиническое исследование
Перевод оригинальной статьи: «Effects of capillary refill time-vs. lactate-targeted fluid resuscitation on regional, microcirculatory and hypoxia-related perfusion parameters in septic shock: a randomized controlled trial»
Авторы: Ricardo Castro, Eduardo Kattan, Giorgio Ferri, Ronald Pairumani, Emilio Daniel Valenzuela, Leyla Alegría, Vanessa Oviedo, Nicolás Pavez, Dagoberto Soto, Magdalena Vera, César Santis, Brusela Astudillo, María Alicia Cid, Sebastian Bravo, Gustavo Ospina‑Tascón, Jan Bakker, Glenn Hernández
Departamento de Medicina Intensiva, Facultad de Medicina, Pontificia Universidad Católica de Chile, Diagonal Paraguay 362, Santiago, Chile.
Unidad de Cuidados Intensivos, Hospital Barros Luco‑Trudeau, Santiago, Chile.
Departamento de Medicina Interna, Facultad de Medicina, Universidad de Concepción, Concepción, Chile.
Department of Intensive Care Medicine, Fundación Valle del Lili, Universidad ICES, Cali, Colombia.
Division of Pulmonary, Allergy, and Critical Care Medicine, Columbia University Medical Center, New York, USA.
Department Intensive Care Adults, Erasmus MC University Medical Center, Rotterdam, CA, The Netherlands.
Division of Pulmonary, and Critical Care Medicine, New York University‑Langone, New York, USA.
Keywords: Sepsis, Septic shock, Lactate, Hypoxia, Capillary refill time
Ключевые слова: сепсис, септический шок, лактат, гипоксия, время ре-заполнения капилляра
Введение
Традиционно персистирующая гиперлактатемия у пациентов с септическим шоком рассматривается как сигнал гипоперфузии или гипоксии [1]. Более того, именно нормализация уровня лактата в недавних клинических рекомендациях рассматривается как цель интенсивной терапии [2]. В тоже время, гипрелактатемия не является специфическим маркером гипоперфузии, так в повышение уровня лактата значительную лепту вносят другие патогенетические механизмы, такие как длительная гиперадренэргия и нарушение печеночного клиренса [1, 3 , 4]. И это может иметь значительные клинические последствия в случае, когда источники повышения уровня лактата, не связанные с гипоперфузией, преобладают и, таким образом, следование рекомендациям по нормализации уровня лактата, как цели интенсивной инфузионной терапии, может привести к перегрузке жидкостью, что несет в себе риски увеличения летальности и заболеваемости [5—7]. В дополнение, кинетика восстановления уровня лактата достаточно медленная, что ограничивает применение этого показателя как цели интенсивной инфузионной терапии [4, 8].
В этом ключе, состояние периферической перфузии представляется обнадеживающей альтернативной целью [9, 10]. Прекрасная способность к прогнозу, что ассоциируется с нормализацией времени ре-заполнения капилляров (РЗК) [11], быстрый ответ при проведении нагрузки жидкостью [8], простота и возможность применения этого теста в условиях ограниченных ресурсов, составляют прочную основу для поддержки исследований, направленных на изучение его полезности как ориентира при проведении интенсивной инфузионной терапии. В исследовании The ANDROMEDA-SHOCK сравнивались две стратегии интенсивной терапии, одна из них основывалась на целевом уровне лактата, а вторая - на времени ре-заполнения капилляра, при этом все выполнялось в течение 4-х часов после поставленного диагноза септический шок [12—14]. Группа РЗК не показала значительного снижения летальности (34.9 vs. 43.4%, p = 0.06), однако в ней потребовался меньший объем жидкости в период вмешательства, а органная дисфункция в течение первых 72 часов развивалась реже. Последующий Байесовский анализ показал очень большую возможность интенсивной терапии, где целью служило время РЗК, в снижении летальности и более быстрое разрешение органной дисфункции по сравнению с интенсивной терапией, где целью служил уровень лактата [15]. Результаты исследования ANDROMEDA-SHOCK следует подтвердить в будущих больших испытаниях, но пока до них дело не дошло, многие не нашедшие своих ответов вопросы можно было бы решить в небольших рандомизированных контролируемых испытаниях, в которые бы включалось изучение эффектов на органную перфузию от обеих стратегий.
Настоящее исследование было разработано нами с целью изучения влияния двух стратегий инфузионной терапии, в одной из которых целью служило восстановление времени РЗК, а в другой - уровня лактата, обе начинались в течение 24 часов после диагностики септического шока, на управление интенсивной инфузионной терапией и на баланс жидкости. Кроме того, мы стремились провести сравнение эффектов от этих двух стратегий на органную дисфункцию, региональный и микроциркуляторный поток и на суррогатные маркеры тканевой гипоксии.
Материалы и методы
Дизайн исследования
Это было проспективное рандомизированное контролируемое исследование, проведенное в отделениях интенсивной терапии (ОИТ) двух учебных госпиталей (Hospital Clínico UC CHRISTUS and Hospital Barros Luco-Trudeau of Santiago, Chile). Исследование было одобрено the Institutional Review Board. Информационное согласие подписывалось либо самим пациентом, либо его ближайшими родственниками в случае, когда сам пациент сделать этого не мог.
Селекция пациентов и рандомизация
Взрослые пациенты ≥ 18 лет с септическим шоком, диагноз которого устанавливался на основании уровня сывороточного лактата более 2 ммоль/л и потребности в назначении норэпинефрина (НЭ) для достижения уровня среднего артериального давления (САД) равным или более 65 ммHg после проведения внутривенной нагрузки жидкостью в дозе не менее 20 мл/кг в течение 60 мин [16]. Положительный ответ на нагрузку жидкостью рассматривался, как критерий включения. Набор пациентов в исследование должен был происходить в течение первых 24 часов после установления диагноза септический шок. Критерии исключения: беременность, ожидаемое хирургическое вмешательство или процедура диализа в первые 6 часов после включения в исследование, активное кровотечение, цирроз печени Child B или C, тяжелый острый респираторный дистресс-синдром, состояние «отказ от реанимации».
Пациенты, включенные в исследование, были случайным образом распределены либо в группу CRT-T (Цель-Время РЗК), либо в группу LAC-T (Цель-лактат). Рандомизация 1:1 была генерировалась компьютерной программой. Сокрытие распределения поддерживали посредством централизованной рандомизации.
Изучаемые вмешательства
Период вмешательства составлял 6 часов. До начала исследования во всех центрах прошли тренинги по оценке времени РЗК с применением стандартной техники. Вкратце, время РЗК измеряли, прикладывая сильное давление к вентральной поверхности дистальной фаланги указательного пальца правой руки с помощью предметного стекла. Давление увеличивали до тех пор, пока кожа не становилась бледной, а затем поддерживали в течение 10 с. Время восстановления прежнего цвета кожи регистрировали с помощью хронометра, а время РЗК более 3 секунд определяли как отклонение от нормы [13].
Целевое значение перфузии для времени РЗК определили, как нормальное время РЗК, равное или менее 3 сек. Целевое значение перфузии для лактата определили, как уровень лактата в артериальной крови равный или менее 2 ммоль/л или снижение уровня лактата более, чем на 20% каждые 2 часа. Время РЗК оценивалось каждые 30 мин., а уровень лактата измерялся каждые два часа. Все измерения проводились во весь период вмешательства, после которого лечение для лечащих врачей лечение становилось более либеральным.
Ответная реакция на нагрузку жидкостью оценивалась с помощью разнообразных техник согласно обычной практике и клинической ситуации. Точки отсечения, которые позволяли делать вывод о том, что пациент отвечает на нагрузку жидкостью, приведены в дополнительном файле 1 [18].
Простым вмешательством данного исследования было введение повторяющихся болюсов жидкости. Жидкости, как правило это был раствор для инфузии в виде Рингер-лактата объемом 500 мл, который вводился с 30-ти минутным интервалом, а введение его повторялось до тех пор, пока не была достигнута целевая точка перфузии, либо ответ на введение жидкости становился отрицательным, либо тогда, когда уровень центрального венозного давления (ЦВД) на фоне инфузии болюса достигал верхнего безопасного уровня ≥ 5 мм Hg [19].
В случае, если перфузионная цель не была достигнута с помощью инфузионной терапии, предпринимались другие шаги, такие, как введение вазоактивных агентов, проведение терапии спасения на усмотрение лечащих врачей. Помимо агрессивного менеджмента источника сепсиса, все пациенты получали лечение согласно текущим клиническим рекомендациям [2].
Измерения и сбор данных
Клинические и демографические переменные регистрировались как базовая линия (Т0). Состояние всех пациентов отслеживалось до момента выписки из госпиталя. Все данные включали демографические аспекты, источник сепсиса и его менеджмент, биомаркеры воспаления, шкалы оценки тяжести состояния и исходы, и все это регистрировалось.
Согласно протоколу несколько специфичных для данного исследования переменных были либо измерены, либо рассчитаны как базовая линия, 2 (Т2), 6 (Т6), и 24 (Т24).
Гемодинамические и клинические перфузионные переменные включали fгемодинамику, а клинические переменные перфузии включали болюс жидкости вместе с общим введением/выведением жидкости и балансом жидкости. Переменные макроциркуляции, такие как САД, частота сердечных сокращений (ЧСС), ЦВД, доза НЭ, сердечный выброс (СВ) оценивались или с помощью неинвазивной техники пульсового контура (PiCCO device, Pulsion Medical Systems, Munich, Germany), или с помощью катетера легочной артерии. Переменные перфузии включали в себя уровень лактата в артериальной крови, сатурацию центральной венозной крови (ScvO2), венозно-артериальный градиент (P(cv-a) CO2) и время РЗК.
Дополнительно оценивались переменные, связанные с региональной и микроциркуляторной перфузией. Микроциркуляция в сублингвальной зоне изучалась с помощью спектроскопии темного поля (англ. the side dark field или SDF). При каждом измерении записывалось не менее пяти 10-20 секундных видеороликов. Последующий визуальный анализ проводил эксперт согласно недавним рекомендациям [20]. При анализе проводился расчёт индекса микроциркуляторного потока (англ. the microcirculatory flow index или MFI). MFI ≤ 2.5 рассматривался как ненормальный согласно предыдущим сообщениям [3, 21]. Скорость исчезновения из плазмы индоцианового зеленого (англ. Plasma-disappearance rate of indocyanine green или PDR-ICG) определялась неинвазивной чрескожной оценкой клиренса индоцианового зеленого (ИЦЗ) с непрямой оценкой потока крови в печени [22]. Пальцевая ИЦЗ-клипса применялась у каждого пациента вместе с монитором функции печени (LiMON; Pulsion Medical Systems, Munich, Germany). После подключения всех устройств пациенту в центральный венозный катетер вводился ИЦЗ в дозе 0.25 мг/кг. Нормальный клиренс PDR-ICG находится в пределах 18 — 25% в минуту, поэтому значение клиренса < 15% рассматривалось, как ненормальное [22, 23]. Спектроскопия в ближней инфракрасной области (англ.Near infrared spectroscopy или NIRS): сатурация кислородом мышц (StO2) оценивалась с помощью спектрометра тканей (InSpectra Model 325; Hutchinson Tc, Mn, USA). Датчик NIRS размещался на ладони у основания большого пальца. StO 2 < 70% рассматривался как ненормальный [24].
Также оценивались два показателя, связанные с гипоксией: (1) отношение центрального венозно-артериального градиента к артериально-венозной разнице по кислороду (P(cv-a)CO2/Da-vO) и это отношение рассчитывалось после взятия двух проб артериальной и центральной венозной крови. Отношение равное или превышающее 1.4 могло быть связано с анаэробной генерацией СО2 [25—17]; (2) Отношение лактат/пируват: отношение более 15 предполагало наличие тканевой гипоксии, как это показано в предыдущих работах [28]. Оба этих отношения могут представлять экспрессию анаэробного метаболизма на клеточном уровне и, таким образом, служить суррогатными маркерами гипоксии.
Измерения результатов
Первичным результатом был объем жидкости, введенной в первые шесть часов периода вмешательства. Вторичными результатами были баланс жидкости к 24 часу, оценка по шкале SOFA к 24 часу, региональный и микроциркуляторный потоки, суррогатные биомаркеры гипоксии.
Расчет размера выборки
После тщательного литературного поиска мы обнаружили только одно пилотное исследование, в котором проводилось сравнение стандартной терапии и терапии на основании данных о состоянии периферической перфузии у пациентов с септическим шоком [10] и в котором показано, что второе привело к значительному снижению объема интенсивной инфузионной терапии к 6 часу (4227 ± 1081 мл против 6069 ± 1715 мл). На основании этого мы решили, что разница в 1600 мл между изучаемыми группами и будет той критической точкой отсечения, в контексте первичного результата, которая позволит нам провести тестирование нашей гипотезы.
Если бы разницы между стандартным и экспериментальным лечением не было, то тогда потребовалось бы 46 пациентов (23 пациента на группу) для того, чтобы на 90% быть уверенным, что нижний предел двустороннего доверительного интервала превышает предел (1600 мл) при уровне альфа 0,05.
Статистический анализ
По причине того, что все переменные представляют не нормальное распределение, использовались непараметрические тесты.
Описательные статистики представлены как медиана (межквартильный диапазон) или как проценты. Когда было возможно применялись: тест Mann–Whitney U, chi-square или точный тест Фишера. Двустороннее значение р < 0.05 было признано значительным. Все данные анализировались с помощью программного обеспечения Minitab v17 (Minitab Inc, State College, PA) и Graphpad Prism (Graphpad Softwares, La Joya, CA).
Результаты
Характеристики пациентов
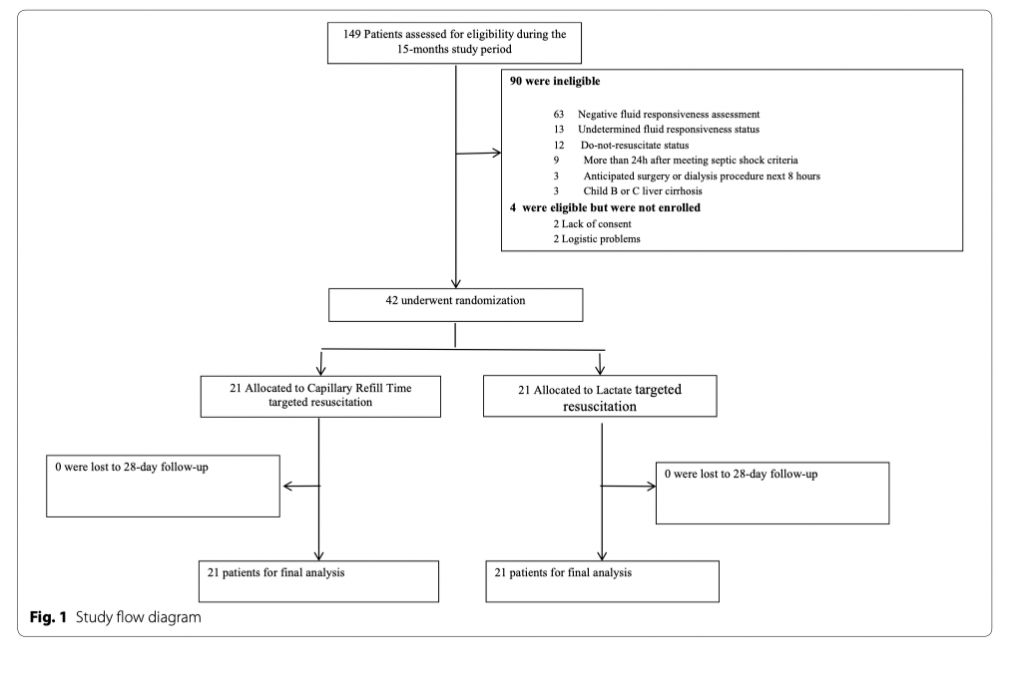
Данное исследование проведено в период между июнем 2018 года и октябрем 2019 года, когда исследование было остановлено еще до полного завершения запрограммированного размера выборки. Решение было принято из-за серьезного социального взрыва в Чили в октябре 2019, по причине которого дальнейший набор пациентов в исследование был остановлен. Всего в скрининг вошло 149 пациентов. Все случаи исключения представлены на рисунке 1. Общее количество пациентов, рандомизированых в обе группы, составило сорок два человека.
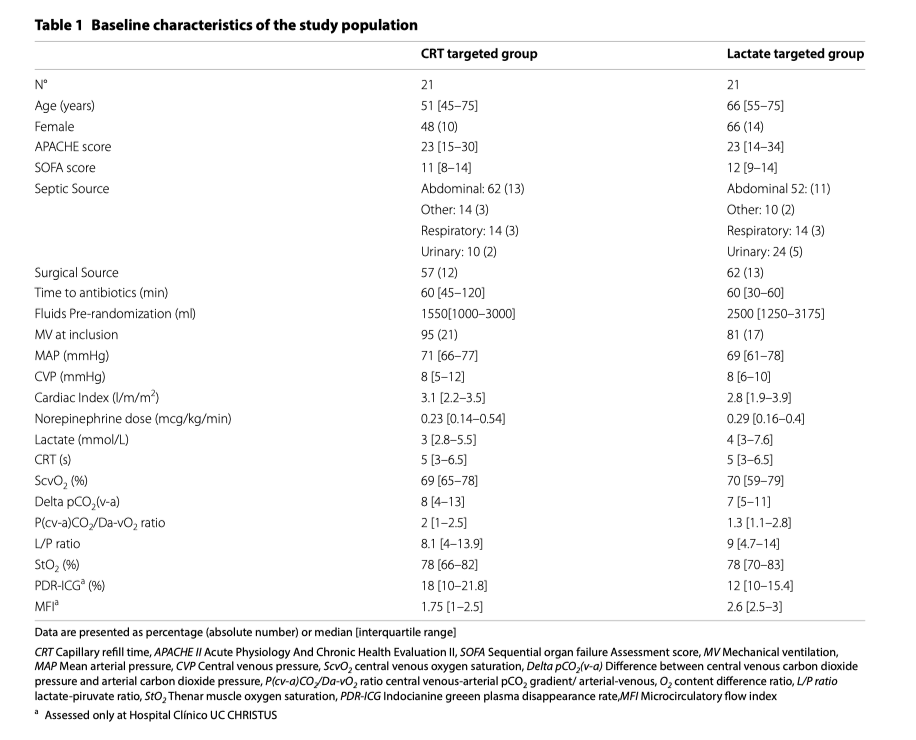
Исходные демографические данные, оценки тяжести состояния, характеристики гемодинамики и перфузии представлены в таблице 1. Время от момента диагностики септического шока до начала выполнения протокола исследования было одинаковым в обеих группах (CRT-T, 4 [2–9] часа против LAC-T, 5 [2–6] час; p = 0.9). Наиболее частыми тестами при оценке ответной реакции на нагрузку жидкостью оказались: вариация пульсового давления (CRT-T, 43% vs. LAC-T, 52%; p = 0.8), вариации нижней полой вены (CRT-T, 29% vs. LAC-T, 19%; p = 0.4) и тест пассивного поднятия нижних конечностей с интегралом скорость - время (CRT-T, 10% vs. LAC-T, 19%; p = 0.6).
Исходы
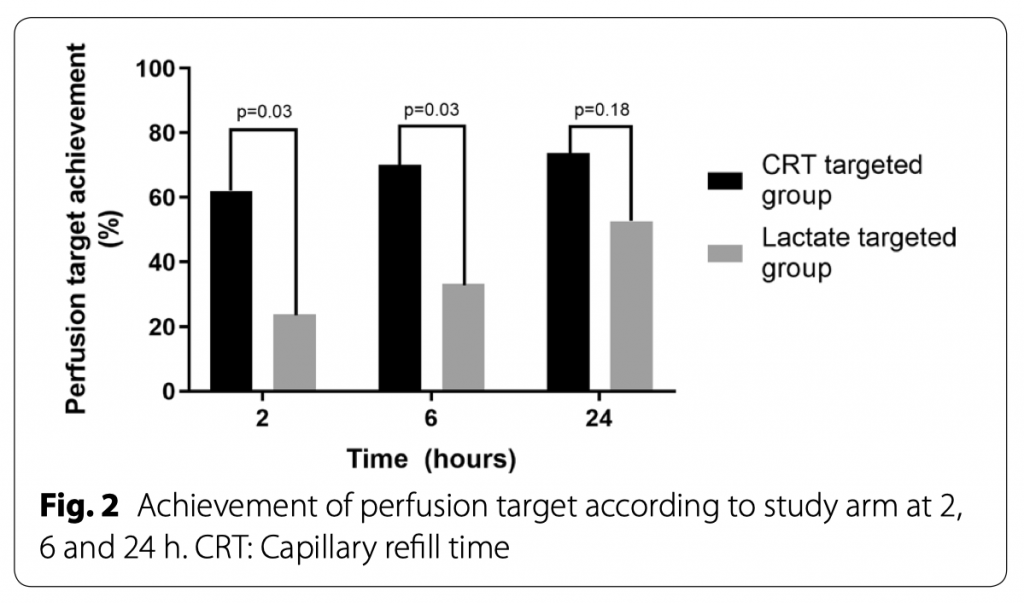
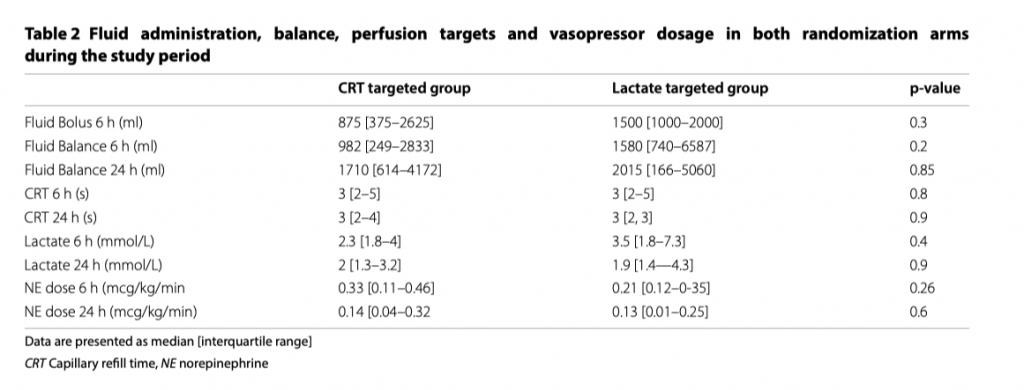
В таблице 2 показаны сравнения между обеими группами по объему и балансу жидкости к 6 часу, оценки по SOFA к 24 часу, перфузионные цели. Не наблюдалось значительных различий между группами в первичном результате «введение жидкости на 6 час интенсивной инфузионной терапии». В дополнение к этому, не было разницы между группами к 24 часу при оценке тяжести состояния по шкале SOFA (10 [5–13] vs. 11 [7–13], p = 0.8), 28-ми дневной летальности (24% vs. 19%, p = 0.8), длительности нахождения в ОИТ (6 [5–14] vs. 10 [4–20] дней, p = 0.8) и длительности нахождения в стационаре (17[6–58] vs. 26 [9–53] дней, p = 0.9). Касательно специфических целей интенсивной терапии на 6 час, то достижение их наблюдалось в большей пропорции пациентов из группы CRT-T (62 vs. 24, p = 0.03), как показно на рисунке 2.
Мультимодальная оценка перфузии
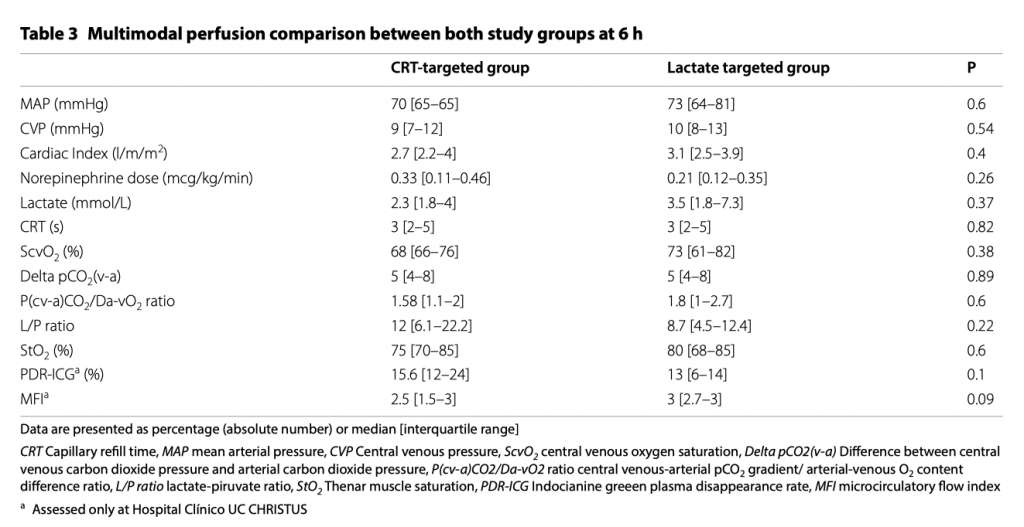
Если говорить об оценке региональных, микроциркуляторных параметров и параметров, связанных с гипоксией, то не было найдено разницы между группами к окончанию периода вмешательства и это показано в таблице 3. Дополнительный файл 2 показывает количество тестов, проведенных в каждой группе.
Обсуждение
Интенсивная инфузионная терапия (ИИТ), при которой целью служило время ре-заполнения капилляра, не показала своих преимуществ перед ИИТ, при которой целью служил уровень лактата как в контексте первичного результата «введение жидкости в первые шесть часов периода вмешательства», так и в контексте баланса жидкости и органной дисфункции к 24 часу интенсивной терапии. Однако, стратегия ИИТ, основанная на времени РЗК, ассоциируется с более быстрым достижением целевых показателей во время периода вмешательства и показала сравнимые эффекты с группой лактата на параметры регионального/микроциркуляторного потока и на суррогатные маркеры гипоксии.
Наши результаты противоречат результатам исследования ANDROMEDA-SHOCK [14], особенно в части объема введенного болюса жидкости во время периода вмешательства. С другой стороны, дизайны исследований заметно различаются. Во-первых, период времени для набора составлял максимум 4 часа с момента диагностики септического шока в ANDROMEDA-SHOCK и до 24 часов в настоящем исследовании. Объемы жидкости, вводимые в группе CRT-T, были почти вдвое меньше, чем в группе LAC-T и, хотя это различие не является значительным, можно предположить, что преимущества ИИТ под контролем времени РЗК могут распространяться на более длительные периоды, чем пределы, налагаемые в исследовании ANDROMEDA-SHOCK. Во-вторых, в настоящее исследование были включены только пациенты, отвечающие на нагрузку жидкостью, и даже более того, наше исследование включало введение жидкости в качестве единственного вмешательства. Несмотря на эти различия в дизайне, лактат, оспариваемый золотой стандарт, не превосходил ни в одной из исследуемых переменных, а у пациентов в группе CRT-T достижение целей ИИТ, в течение периода вмешательства, происходило в большей доле случаев.
Возможное объяснение наших результатов кроется в том, что время РЗК показывает более быстрый ответ в виде увеличения потока, а оценка времени РЗК происходит за 30 минут, что позволяет лечащим врачам своевременно прекращать проведение интенсивной инфузионной терапии. И наоборот, лактат показывает относительно медленную, а иногда и бифазную кинетику даже после успешной интенсивной терапии [3], что приводит к потенциальному риску перегрузки жидкостью. Этот факт лежал в основе рабочей гипотезы предыдущего исследования ANDROMEDA-SHOCK [14].
Касательно влияния обеих стратегий на региональный и микроциркуляторный потоки, то здесь в первую очередь необходимо указать на то, что наше исследование было первым, в котором для оценки состояния тканей применялся мультимодальный подход. В предыдущем исследовании Brunauer et al. [29] нашли значительную корреляцию между изменениями времени РЗК и индексом пульсации различных артерий в гепато-спланхнической области при интенсивной терапии септического шока. И это физиологически согласовано, поскольку на обе территории действует адренергический ответ на шок, который может быть разрешен, по крайней мере частично, за счет увеличения системного кровотока. В дополнение к этому, другое исследование сравнивало добутамин против плацебо на региональный и микроциркуляторные потоки при гипердинамическом септическом шоке и его результаты показали, что пациенты, у которых время РЗК нормализовалось, также показывали нормальную сатурацию кислородом мышц и хорошую скорость исчезновения индоцианового зеленого из плазмы [21]. Несмотря на недостаточную мощность нашего исследования касательно вторичных исходов, мы можем предположить, что ИИТ, основанная на времени РЗК, как минимум не ухудшает поток крови в печени, насыщение кислородом мышц, микроциркуляцию в подъязычной области по сравнению со стратегией ИИТ, основанной на уровне лактата. Фактически, обе стратегии ведут у улучшению этих показателей, но уже с новой информацией касательно безопасности выбора времени РЗК как цели при интенсивной терапии септического шока.
Другой метод оценки периферической перфузии - оценка пятнистости кожи (англ. the mottling score) [30]. Его прогностическая ценность, патофизиологические корреляция [31, 32] и наличие связи с состоянием тканевой перфузии были ясно показаны [29]. Шкала пятнистости может быть дополнением к времени РЗК в целях более тщательной оценки периферической перфузии, но данных о кинетике восстановления шкалы пятнистости после ИИТ еще не достаточно. Это основная причина, по которой в качестве мишени в исследовании ANDROMEDA-SHOCK и в настоящем исследовании было выбрано время РЗК.
Ни одни из классических параметров, связанных с перфузией, не отражает достоверно наличие или отсутствие гипоксии тканей. Гипоксия ткани должна затронуть идею нарушения критической доставки кислорода и/или неспособности митохондрий использовать O2 , что приводит к эксклюзивному анаэробному метаболизму на пораженных территориях [33]. И вследствие этого, как потребление О2, так и аэробная продукция СО2 снижается, а критическое количество СО2 приводит к массивной деградации АТФ с получением буфферизации свободного Н+ плазменным НСО3-. Как только есть тканевая гипоксия, снижение клеточного редокс-потенциала приводит к продукции АТФ по анаэробному пути, что увеличивает соотношение лактат/пируват [33] и в дальнейшем увеличивает анаэробную продукцию СО2. Такой сдвиг может увеличивать респираторный коэффициент и, следовательно, отношение P(cv-a)CO2/Da-vO2 [26]. Оба показателя теоретически могут быть использованы как суррогатные маркеры тканевой гипоксии и в нескольких более ранних исследованиях показано наличие связи с гиперлактатемией и прогрессированием шока [34], хотя эта тема остается спорной [26]. В нашем исследовании мы не наблюдали различий в этих суррогатных маркерах между группами, что снова нас приводит к мысли о том, что время РЗК представляется безопасной стратегией ИИТ по сравнению с золотым стандартом, коим является ИИТ, базирующаяся на уровне лактата.
Наше исследование имеет несколько ограничений. Во первых, имеются технические сложности в измерениях и проблемы в интерпретации для каждой из переменных, связанных с потоком, которые оценивались в данном исследовании. PDR-ICG зависти не только от потока крови в печени, но и от состояния печеночного метаболизма [22]. И, таким образом, предсуществующая или острая дисфункция печени мешала корректной интерпретации результатов. Мы исключали пациентов с выраженной дисфункцией печени, но нельзя исключить наличие какой либо субклинической дисфункции. К тому же, пальцевая клипса ICG в случае выраженной периферической вазоконстрикции могла потерять сигнал. Насыщение мышц кислородом очень зависит от потока [35], быстро снижается при сосудистой окклюзии и также быстро восстанавливается после снятия окклюзии [21, 24]. Однако, роль при гемодинамическом стрессе остается неизвестной. С момента первого описания, оценка состояния микроциркуляции все еще не вошла в рутинную клиническую практику, а находит свое применение исключительно на поле научных исследований [38]. Дальнейшему продвижению этого метода мешают технические аспекты, логистика, стоимость, отсутствие согласия между экспертами касательно анализа полученных изображений [20]. В нашем исследовании мы применили упрощенный анализ параметра MFI, связанного с потоком, который просто стандартизовать.
Во-вторых, в случае суррогатных маркеров гипоксии имеющуюся на сегодня литература скудна, а оба соотношения не имеют универсального одобрения. Дополнительным проблемами здесь также являются технические трудности при оценке пирувата и отсутствие ясного понимания точки отсечения, когда уже можно говорить о ненормальности данного параметра. В случае расчета P(cv-a)CO2/ Da-vO2 проблемой является использование центральной венозной крови, а не смешанной венозной крови, для получения СО2 [26]. Но все же, решение о применении более простого отношения с точки зрения практики поддерживается имеющейся литературой [25, 26].
В третьих, небольшой размер выборки может быть проблемой для исследования, сфокусированного на физиологии. Таким образом, мы согласились на то, что наши результаты подходят только для генерации новых гипотез, но все же полученные данные могут помочь в понимании механизмов, лежащих в основе прогностической ценности времени РЗК, ее нормализации при проведении интенсивной инфузионной терапии.
В четвертых, оценка времени РЗК может быть подвержена изменчивости между наблюдателями, но мы использовали стандартизированную технику оценки, что снижает вероятность смещения. В пятых, преждевременная остановка исследования могла внести систематическую ошибку, но независимый статистик проанализировал результаты и пришел к выводу, что набор еще 4-х пациентов не изменил бы значения p основных результатов. И наконец, мы могли выполнять методы SDF и PDRICG только в одном из двух медицинских центров по логистическим причинам, но мы полагаем, что это не отменяет наших выводов.
Выводы
Интенсивная инфузионная терапия при септическом шоке, где целью служило время ре-заполнения капилляра, не показала своих преимуществ перед лактат-ориентированной ИИТ по таким результатам, как раннее введение жидкости и баланс. В тоже время, такая стратегия ассоциировалась со сравнимыми эффектами на параметры регионального и микроциркуляционного потоков и на суррогатные маркеры гипоксии. В дополнение достижение поставленных перед ИИТ целей было быстрее тогда, когда ИИТ проводилось на основании времени РЗК. Все эти данные несмотря на то, что они годны только для генерации новых гипотез, расширяют результаты исследования ANDROMEDA-SHOCK, предполагая потенциальную пользу от ИИТ, когда целеполагание основывается на времени РЗК. Однако все это должно подвергнуться дальнейшей проверке в будущих исследованиях, которые не стали бы ограничиваться только лишь ранним септическим шоком.
Список литературы
1. Hernandez G, Bruhn A, Castro R, Regueira T. The holistic view on perfusion monitoring in septic shock. Curr Opin Crit Care. 2012;18:280–6.
2. Rhodes A, Evans L, Alhazzani W, Levy M, Antonelli M, Ferrer R, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Crit Care Med. 2017;45:486–552.
3. Hernandez G, Luengo C, Bruhn A, Kattan E, Friedman G, Ospina‑Tascon G, et al. When to stop septic shock resuscitation: clues from a dynamic perfusion monitoring. Ann Intensive Care. 2014;4:30.
4. Hernandez G, Bellomo R, Bakker J. The ten pitfalls of lactate clearance in sepsis. Intensive Care Med. 2019;45:82–5.
5. Payen D, de Pont AC, Sakr Y, Spies C, Reinhart K, Vincent JL. A positive fluid balance is associated with a worse outcome in patients with acute renal failure. Crit Care. 2008;12:1–7.
6. Boyd JH, Forbes J, Nakada TA, Walley KR, Russell JA, Frcp C, et al. Fluid resuscitation in septic shock: A positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med. 2011;39:259–65.
7. Bagshaw SM, Brophy PD, Cruz D, Ronco C. Fluid balance as a biomarker : impact of fluid overload on outcome in critically ill patients with acute kidney injury. Crit Care. 2008;12:1–3.
8. Hernandez G, Pedreros C, Veas E, Bruhn A, Romero C, Rovegno M, et al. Evolution of peripheral vs metabolic perfusion parameters during septic shock resuscitation A clinical‑physiologic study. J Crit Care. 2012;27:283–8.
9. Lima A, Jansen TC, Van Bommel J, Ince C, Bakker J. The prognostic value of the subjective assessment of peripheral perfusion in critically ill patients. Crit Care Med. 2009;37:934–8.
10. Van Genderen ME, Engels N, Van Der Valk RJP, Lima A, Klijn E, Bakker J, et al. Early peripheral perfusion‑guided fluid therapy in patients with septic shock. Am J Respir Crit Care Med. 2015;191:477–80.
11. Lara B, Enberg L, Ortega M, Leon P, Kripper C, Aguilera P, et al. Capillary refill time during fluid resuscitation in patients with sepsis‑related hyperlactatemia at the emergency department is related to mortality. PLoS ONE. 2017;12:e0188548.
12. Hernández G, Cavalcanti AB, Ospina‑Tascón G, Dubin A, Hurtado FJ, Damiani LP, et al. Statistical analysis plan for early goal‑directed therapy using aphysiological holistic view ‑ The andromeda‑shock: A randomized controlled trial. Rev Bras Ter Intensiva. 2018;30:253–63.
13. Hernández G, Cavalcanti AB, Ospina‑Tascón G, Zampieri FG, Dubin A, Hurtado FJ, et al. Early goal‑directed therapy using a physiological holistic view: the ANDROMEDA‑SHOCK—a randomized controlled trial. Ann Intensive Care. 2018;8:52.
14. Hernandez G, Ospina‑Tascon G, Petri Damiani L, Estenssoro E, Dubin A, Hurtado J, et al. Effect of a resuscitation strategy targeting peripheral perfusion status vs serum lactate levels on 28‑day mortality among patients with septic shock The andromeda‑shock randomized Clinical Trial. JAMA. 2019;321:654–64.
15. Zampieri FG, Damiani LP, Bakker J, Ospina‑Tascón GA, Castro R, Cavalcanti AB, et al. Effect of a resuscitation strategy targeting peripheral perfusion status vs serum lactate levels on 28‑day mortality among patients with septic shock: a bayesian reanalysis of the andromeda‑shock trial. Am J Respir Crit Care Med. 2019. https://doi.org/10.1164/rccm.201905‑0968OC.
16. Singer M, Deustchman C, Warren Seymour C, Shankar‑Hari M, Annane D, Bauer M, et al. The third international consensus definitions for sepsis and septic shock (Sepsis‑3). JAMA. 2016;315:801–10.
17. Monnet X, Teboul JL. Assessment of fluid responsiveness: recent advances. Curr Opin Crit Care. 2018;24:190–5.
18. Kattan E, Ospina‑Tascón GA, Teboul JL, Castro R, Cecconi M, Ferri G, et al. Systematic assessment of fluid responsiveness during early septic shock resuscitation: Secondary analysis of the ANDROMEDA‑SHOCK trial. Crit Care. 2020;24:23.
19. De Backer D, Vincent JL. Should we measure the central venous pressure to guide fluid management? Ten answers to 10 questions. Crit Care. 2018;22:43.
20. Vellinga NAR, Boerma EC, Koopmans M, Donati A, Dubin A, Shapiro NI, et al. International study on microcirculatory shock occurrence in acutely Ill patients*. Crit Care Med. 2015;43:48–56.
21. Hernandez G, Bruhn A, Luengo C, Regueira T, Kattan E, Fuentealba A, et al. Effects of dobutamine on systemic, regional and microcirculatory perfusion parameters in septic shock: A randomized, placebo‑controlled, double‑blind, crossover study. Intensive Care Med. 2013;39:1435–43.
22. Halle BM, Poulsen TD, Pedersen HP. Indocyanine green plasma disappearance rate as dynamic liver function test in critically ill patients. Acta Anaesthesiol Scand. 2014;58:1214–9.
23. Inal MT, Memiş D, Kargi M, Sut N. Prognostic value of indocyanine green elimination assessed with LiMON in septic patients. J Crit Care. 2009;24:329–34.
24. Lima A, Van Bommel J, Sikorska K, Van Genderen M, Klijn E, Lesaffre E, et al. The relation of near‑infrared spectroscopy with changes in peripheral circulation in critically ill patients. Crit Care Med. 2011;39:1649–54.
25. Ospina‑Tascón GA, Hernández G, Cecconi M. Understanding the venousarterial CO2 to arterial–venous O2 content difference ratio. Intensive Care Med. 2016;42:1801–4.
26. Ospina‑Tascón GA, Calderón Tapia LE. Venous‑arterial CO2 to arterialvenous O2 differences: A physiological meaning debate. J Crit Care. 2018;48:443–4.
27. Gavelli F, Teboul JL, Monnet X. How can CO2‑derived indices guide resuscitation in critically ill patients? J Thorac Dis. 2019;11:1528–37.
28. Rimachi R, Bruzzi De Carvahlo F, OrellanoJimenez C, Cotton F, Vincent JL, De Backer D. Lactate/pyruvate ratio as a marker of tissue hypoxia in circulatory and septic shock. Anaesth Intensive Care. 2012. 40:427–32.
29. Brunauer A, Koköfer A, Bataar O, Gradwohl‑Matis I, Dankl D, Bakker J, et al. Changes in peripheral perfusion relate to visceral organ perfusion in early septic shock: A pilot study. J Crit Care. 2016;35:105–9.
30. Ait‑Oufella H, Lemoinne S, Boelle PY, Galbois A, Baudel JL, Lemant J, et al. Mottling score predicts survival in septic shock. Intensive Care Med. 2011;37:801–7.
31. Ait‑Oufella H, Joffre J, Boelle PY, Galbois A, Bourcier S, Baudel JL, et al. Knee area tissue oxygen saturation is predictive of 14‑day mortality in septic shock. Intensive Care Med. 2012;38:976–83.
32. Bourcier S, Pichereau C, Boelle PY, Nemlaghi S, Dubée V, Lejour G, et al. Toe‑to‑room temperature gradient correlates with tissue perfusion and predicts outcome in selected critically ill patients with severe infections. Ann Intensive Care. 2016;6:63.
33. Macintyre NR. Tissue hypoxia: Implications for the respiratory clinician. Respir Care. 2014;59:1590–6.
34. Ospina‑Tascón GA, Umaña M, Bermúdez W, Bautista‑Rincón DF, Hernandez G, Bruhn A, et al. Combination of arterial lactate levels and venous‑arterial CO2 to arterial‑venous O2 content difference ratio as markers of resuscitation in patients with septic shock. Intensive Care Med. 2015;41:796–805.
35. McKinley B, Marvin R, Cocanour C, Moore F. Tissue Hemoglobin O2 Saturation during Resuscitation of Traumatic Shock Monitored Using Near Infrared Spectrometry. J Trauma Inj Infect Crit Care. 2000;48:637–42.
Castro et al. Ann. Intensive Care (2020) 10:150