Эффективность терапевтического плазмаобмена как адъювантного метода лечения септического шока
Keith et al. Critical Care (2020) 24:518
Исследование
Эффективность терапевтического плазмаобмена как адъювантного метода лечения септического шока при полиорганной недостаточности: одно-центровой эксперимент
Перевод оригинальной статьи «The therapeutic efficacy of adjunct therapeutic plasma exchange for septic shock with multiple organ failure: a singlecenter experience»
Philip D. Keith, Adam H. Wells, Jeremy Hodges, Stephen H. Fast, Amber Adamsan, L. Keith Scott
Critical Care Medicine, Lexington Medical Center, 2720 Sunset Boulevard, West Columbia, SC 29169, USA.
Critical Care Medicine, Novant Health Forsyth Medical Center, 3333 Silas Creek Parkway, Winston-Salem, NC 27103, USA.
Clinical Pharmacist, Novant Health Forsyth Medical Center, 3333 Silas Creek Parkway, Winston-Salem, NC 27103, USA.
Department of Mathematics, Limestone College, 1115 College Drive, Gaffney, SC 29340, USA.
Emergency Department Clinical Pharmacist, Cabell Huntington Hospital, 1340 Hal Greer Boulevard, Huntington, WV 25701, USA.
Division of Trauma and Surgical Critical Care, Louisiana State University Health Sciences Center, 1501 Kings Highway, Shreveport, LA 71103, USA.
Keywords: Septic shock, Sepsis, Multiple organ failure, MODS, Plasma exchange, Plasmapheresis
Ключевые слова: септический шок, сепсис, полиорганная недостаточность, СПОН, плазмаобмен, плазмаферезис.
Введение
Сепсис остается лидирующей причиной примерно около 1.3 миллионов госпитализаций в США, включая сюда 25% ежегодных госпитализаций в отделения интенсивной терапии (ОИТ) [1]. Несмотря на значительные успехи в лечении сепсиса, имея ввиду раннюю целе-направленную терапию, септический шок остается ведущей причиной смерти в ОИТ от некоронарных причин, а летальность при развитии септического шока с полиорганной недостаточностью достигает практически 70% [2].
Последние исследования расширили наше понимание сепсиса, как комплексного взаимодействия цитокинового шторма, системного воспаления, эндотелиальной дисфункции, капиллярной утечки на фоне патологии гемостаза, очень похожей на таковую при тромбоцитопенической пурпуре (англ.
thrombocytopenic purpura или TTP) [3–7]. Молниеносно развивается диссеминированный тромбоз микроциркуляции, что приводит к развитию тканевой гипоксии, полиорганной недостаточности и, в конечном итоге, к смерти [8]. Такие терапевтические вмешательства, как введение стероидов, активированного протеина С, аскорбиновой кислоты, тромбомодулина, проведение плазмафильтрации, гемоперфузии полимиксином В, направленные на определенные пути патофизиологии сепсиса, не оказали значимого влияния на улучшение клинических исходов [9 - 15].
Несмотря на то, что каждый из перечисленных видов вмешательства может оказать свое положительное воздействие на какого-либо пациента с сепсисом, гетерогенность самого сепсис-синдрома делает маловероятным то, что какое либо вмешательство, нацеленное только лишь на один компонент/путь патофизиологического процесса, принесет успех при повсеместном его применении.
Терапевтический плазмаобмен (англ.Therapeutic plasma exchange или TPE) может предложить уникальное лечение сепсиса, предполагая более широкое действие на несколько компонентов этого сложного пути. Изначально цитокиновый шторм приводит к глобальному воспалению и разрушению эндотелия, что, в свою очередь приводит к вазодилятации, капиллярной утечке и активации каскада коагуляции [3, 4, 7, 16, 17]. Несмотря на то, что фильтрация плазмы снижает уровни многих из этих медиаторов, циркулирующих в крови, как в экспериментальных, так и в клинических исследованиях [17–21], исследования по изучению выживаемости при применении разнообразных методов гемофильтрации и связывания цитокинов дали противоречивые результаты [18, 19, 21, 22 ].
Для успешного лечения сепсиса требуется много больше, чем просто достижение баланса медиаторов воспаления и здесь TPE может предложить дополнительную пользу при его применении в целях компенсации эффектов, вызванных дисфункций эндотелия. Эндотелий играет очень важную роль в механизмах развития сепсиса и все чаще и чаще становится мишенью терапевтических вмешательств. Гипотензия ведь не только результат вазодилятации при воспалении, но так же и результат повреждения эндотелия, что приводит к увеличенной сосудистой проницаемости [3–6, 17]. В ходе проведенных исследований сепсиса и геморрагического шока уже обнаружены маркеры повреждения эндотелия, уровень которых в циркуляции связан с изменениями в эндотелии, что показано при электронной микроскопии, и с летальностью [5, 17, 23]. Интенсивная терапия с применением свежезамороженной плазмы (СЗП) показала восстановление целостности эндотелия, определенное с помощью микроскопии, что приводило к улучшению уровней циркулирующих маркеров [17, 23]. В случае же массивной кровопотери, летальность снижается при применении трансфузионной стратегии, при которой используется СЗП [23].
Другим клиническим эффектом эндотелиальной дисфункции служит патологическая активация тромбообразования, что приводит к состоянию гиперкоагуляции в микроциркуляции. Снижение активности ADAMTS-13 с одновременным усилением активности ингибиторов ADAMTS-13, приводит к увеличению тромбогенных мультимеров сверхбольшого фактора фон Виллебранда (англ. thrombogenic ultra-large von Willebrand factor или ULvWF), результатом чего является диффузный тромбоз микроциркуляторного русла. Увеличение активности ингибитора-1 активатора плазминогена (англ. plasminogen activator inhibitor или PAI-1) ведет к снижению фибринолиза с накоплением в микроциркуляции фибрина. Для обращения вспять этого процесса предназначались активированный протеин С и тромбомодулин, но без особого успеха [9, 10, 15]. Плазмаферез уникален тем, что при его применении устраняется как патологический каскад свертывания, так и дисфункция тромбоцитов, и все это результат удаления мультимеров ULvWF, ингибиторов ADAMTS-13 и PAI-1. Все это ведет к восстановлению активности ADAMTS-13 [7].
Отчеты о случаях, серии случаев, мета-анализы и одно проспективное рандомизированное клиническое исследование у взрослых показали противоречивые результаты по эффективности TPE при сепсисе [16, 18, 22, 26, 27]. Основываясь на имеющихся данных, Американское общество афереза (англ. the American Society for Apheresis или ASFA) предлагает рекомендации категории III, 2B по применению TPE при сепсисе с полиорганной недостаточностью, что позволяет индивидуально применять TPE в каждом конкретном случае [2, 28].
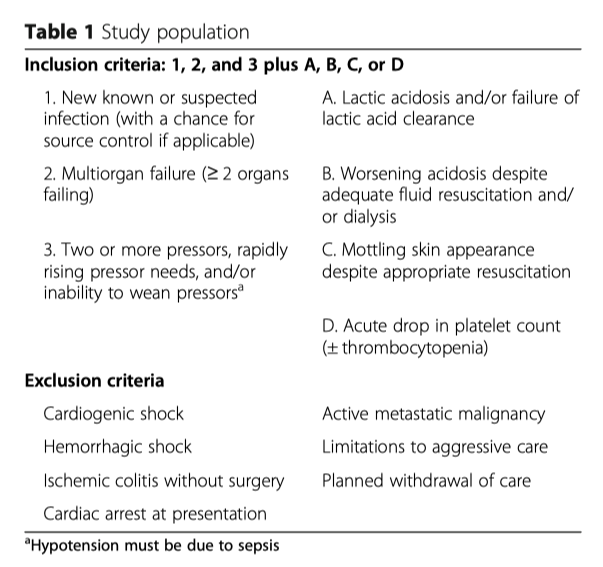
Руководствуясь этими рекомендациями, мы применяли TPE в отдельных случаях септического шока с полиорганной недостаточностью, рефрактерного к катехоламинам. Показаниями к проведению TPE служили маркеры неблагоприятного исхода [29–36], при этом мы стремились идентифицировать пациентов с таким клиническим фенотипом, при котором эти пациенты вряд ли выживут при проведении им стандартной терапии (Таблица 1). В нашем ретроспективном наблюдательном исследовании мы проанализировали данные, полученные из электронной медицинской карты, и сравнили результаты у пациентов, соответствующих этим критериям и которые получали TPE в качестве адъювантной терапии, с пациентами с подобной склонностью и отвечающими тем же критериям, но которые получали только стандартную терапию.
Методы
Дизайн исследования
Ретроспективное обсервационное исследование эффективности TPE, как адъювантной терапии септического шока с полиорганной недостаточностью, проведенное методом просмотра электронных историй болезни взрослых, 18 лет и старше, пациентов, поступивших на лечение в «Novant Health Forsyth Medical Center» в период августа 2015 года по март 2019 года. Исследование было одобрено «the Institutional Review Board at Novant Health Forsyth Medical Center».
Субъекты исследования
Группа вмешательства была идентифицирована путем анализа электронных историй болезни с указанием на первичную диагностику септического шока с кодом афереза в течение определенного временного интервала. Всего определенно 40 пациентов, которым был проведен как минимум один сеанс TPE и которые отвечали критериям включения (Таблица 1).
Контрольную группу составили пациенты, определенные с использованием фильтров, отвечающих нашим показаниям к проведению TPE при сепсисе и в тоже временное окно, что и пациенты из группы вмешательства. Скринингу подверглись пациенты с первичным диагнозом шока, у которых также наблюдались следующие проявления: 2 или более вазопрессора, уровень сывороточного лактата более 2 ммоль/л, уровень тромбоцитов менее 200 х 103, рН менее 7,3. Всего было идентифицировано 160 пациентов.
Вмешательство
Все пациенты в обеих группах получали терапию сепсиса на усмотрение интенсивиста. Всем пациентам было предписано вводить жидкость в дозе 30 мл/кг в качестве интенсивной инфузионной терапии и проводить своевременную эмпирическую антибиотикотерапию. Кроме протокола терапии сепсиса, в обеих группах врачами назначалась адъювантная терапия, включающая в себя стероиды, аскорбиновую кислоту, тиамин. У всех пациентов на ИВЛ проводилась стратегия защиты легких согласно протоколу лечения острого респираторного синдрома (ОРДС).
В нашем медицинском центре процедура TPE проводится нефрологами, решение по проведению TPE принимается на основании мультидисциплинарного подхода. Лечащий врач-реаниматолог мог выставить показания к проведению TPE в случае, если пациенты соответствовали критериям, указанным в таблице 1. Врач отделения нефрологии по запросу проводил консультацию в каждом конкретном случае. В случае согласия нефролога на проведение TPE при условии, что это принесет пользу пациенту, процедура TPE проводилась. В случае несогласия нефролога на проведение TPE, процедура не проводилась.
Сосудистый доступ, в случае проведения TPE, обеспечивался установкой двух-ходового катетера для гемодиализа размером 14F. TPE проводилась после из расчета 120% от циркулирующего объема плазмы с поправкой, при необходимости, на ожирение. В качестве замещающего раствора во всех случаях применялась СЗП. В случае, когда пациенту требовалось проведение почечно-заместительной терапии, процедура диализа прерывалась для того, что бы провести процедуру TPE. Количество процедур не было стандартизовано; скорее, ежедневное лечение проводилось до тех пор, пока лечащая бригада (а) не увидела, что процедура максимально улучшила состояние пациента, (б) количество процедур соответствовало предпочтениям лечащего врача или (в) у пациента наблюдалось клиническое ухудшение и лечащий врач считал, что дальнейшее лечение не было клинически оправданным/бесполезным с медицинской точки зрения, и/или лица, принимающие решения, были против продолжения лечения. В большинстве случаев лечащие врачи следовали протоколу Busund et al. [16], выполняя сначала одну процедуру, последующие процедуры выполнялись в случае отсутствия клинического улучшения.
Определения переменных
Первичной точкой исследования служила 28-ми дневная летальность от всех причин. Вторичными точками исследования были: госпитальная летальность, новая потребность в проведении почечно-заместительный терапии (ПЗТ) на момент поступления или при переводе, летальность, ассоциированная с необходимостью проведения нового сеанса ПЗТ, длительность нахождения пациента в ОИТ, длительность нахождения пациента в стационаре, ежедневный баланс жидкости, изменения при оценках по шкалам SOFA и кардио-SOFA в течение 48 часов после установки диагноза септический шок. Время «Ноль» для группы вмешательства определялось, как подтвержденные дата и время окончания первой процедуры TPE. Время «Ноль» для группы контроля определялось, как первая запись жизненно-важных показателей в ОИТ. Пациенты были подвергнуты подбору по индексу соответствия (англ. propensity-matched), при котором использовались такие данные, как возраст, пол, сопутствующая патология, оценки по шкалам APACHE II и SOFA, уровень лактата, режимы дозирования вазопрессоров в ОИТ.
Характеристика пациентов
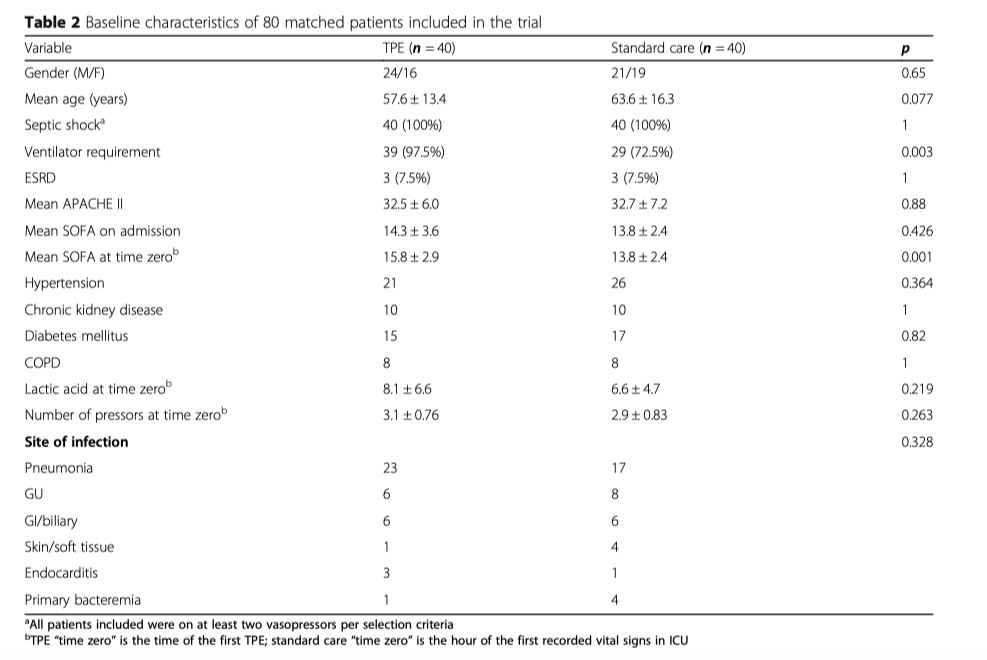
В исследование было включено 80 пациентов, по 40 человек в каждой группе. Исходные демографические данные приведены в Таблице 2. Пациенты в обеих группах имели высокий риск наступления летального исхода согласно оценок по шкалам APACHE II и SOFA. Все пациенты находились в состоянии септического шока, что требовало введения не менее двух вазопрессоров, большинству из них потребовалось проведение ПЗТ. Пациентам в группе вмешательства поведение ИВЛ требовалось чаще по сравнению с пациентами в группе контроля (p = 0.014). Мы также заметили, что в контрольной группе средний возраст пациентов оказался несколько выше (p = 0.077).
Статистический анализ
Статистический анализ был проведен независимым статистиком. Использовался XLSTAT by Addinsoft (Windows version) и Xrealstats from http://www.real-statistics.com/ (Windows version) add-ins for Microsoft Excel.
Одномерные сравнения исходных характеристик были выполнены: для непрерывных переменных с помощью непарного t-критерия, для категориальных переменных - с помощью точного критерия Фишера. Для проверки различий в инфекционном происхождении между двумя группами использовался chi-square test. Изменения APACHE 2 и SOFA от исходного уровня в группе оценивали с помощью парного t-критерия. Для проверки различий в выживаемости между группами использовался точный тест Фишера. Для анализа выживаемости предоставляется оценка Каплана-Мейера с использованием лог-рангового теста для сравнения совокупной выживаемости. Данные представлены как среднее ± стандартное отклонение.
Клинические исходы
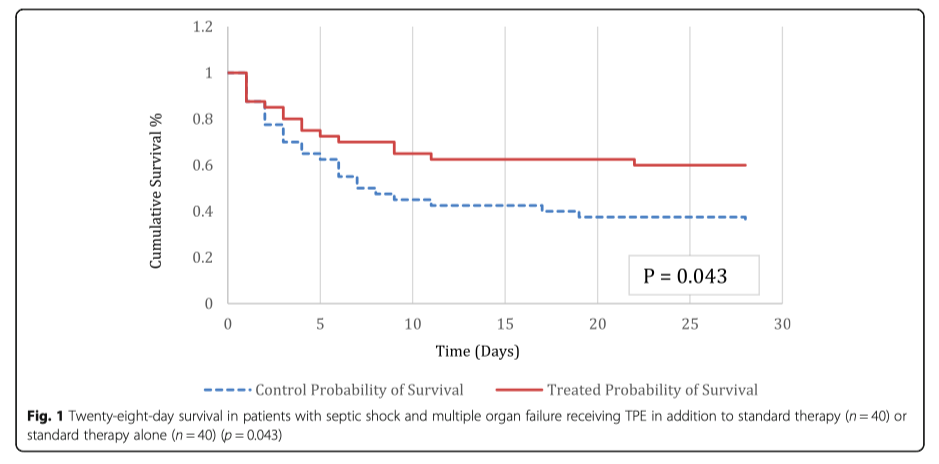
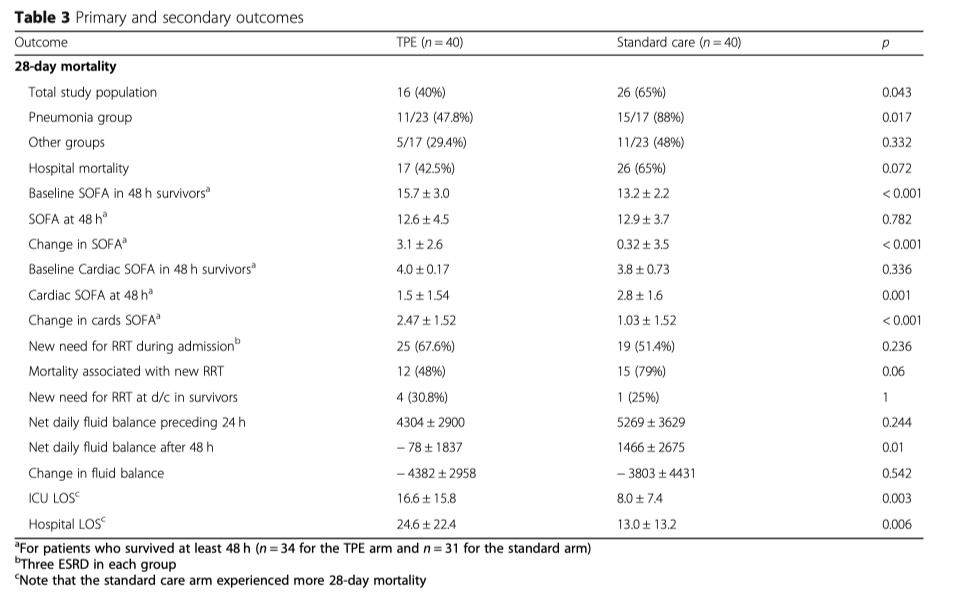
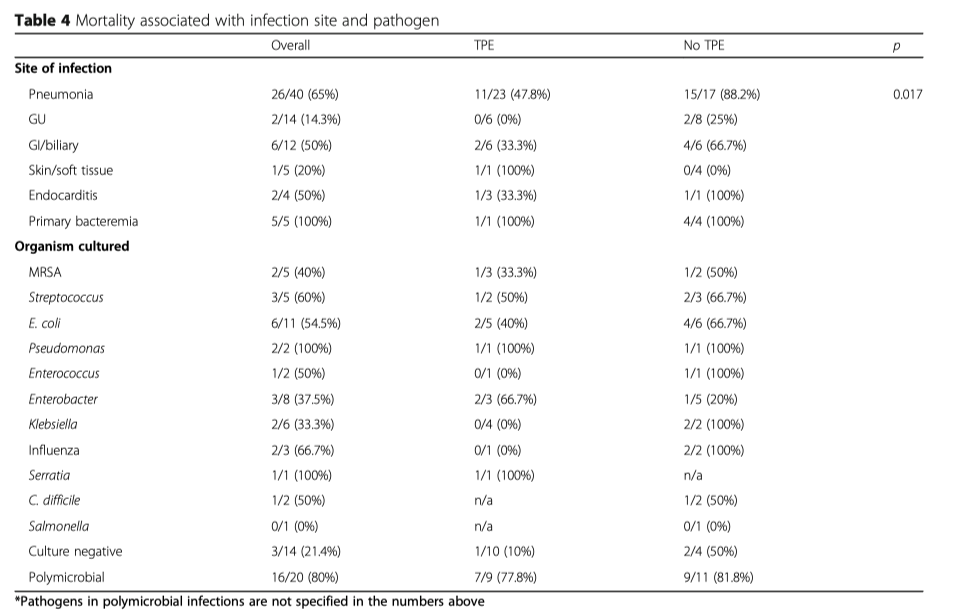
Клинические исходы представлены на Рисунке 1 и в Таблице 2. Общая летальность составила: в группе вмешательства 40%, в группе контроля 65% (p = 0.043). Снижение относительного риска летальности составило 38,5%. В популяции, что вошла в исследование, одна дополнительная жизнь была сохранена на каждые четыре пациента, которым был проведена процедура TPE. Госпитальная летальность составила: в группе вмешательства 42,5% по сравнению с 65% в группе контроля (p = 0.072). В таблице 4 показана летальность в зависимости от источника инфекции и вида патогена. Подгруппа пациентов с пневмонией, как первичного источника инфекции, которые получили TPE, показали наилучшее улучшение, по показателю 28-ми дневная летальность, по сравнению с пациентами с пневмонией, которым проводилась только стандартная терапия (47.8% vs. 88%, p = 0.017). При других источниках инфекции показатель летальности составил: в группе с TPE 29,4% по сравнению с 48% в группе только стандартной терапии (p = 0.332). Провести дополнительный анализ по подгруппам по признаку «источник инфекции» было невозможно из-за небольшого размера выборки. Изменения в оценках по шкале SOFA показали улучшение от исходных в группе с TPE у тех пациентов, кто оставался живым к исходу 48 часов (p < 0.001). У пациентов в группе TPE была более благоприятной ситуация с балансом жидкости (p = 0.01) (Таблица 3). Пациентам , которым проводился TPE, проведение ПЗТ потребовалось в 67,7% процентах случаев по сравнению с 51,4% в группе контроля. Летальность, ассоциированная с проведением ПЗТ, в группе TPE составила 48% по сравнению с 79% в группе контроля (p = 0.06), однако не было найдено никаких различий в необходимости проведения ПЗТ у переведенных (выживших) пациентов. Продолжительность нахождения в ОИТ и в стационаре была выше у пациентов, которым проводился TPE (p = 0.003, p = 0.006).
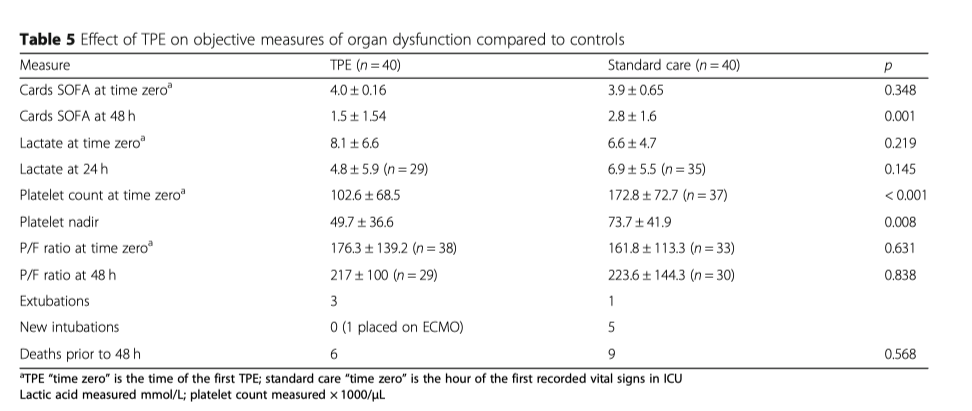
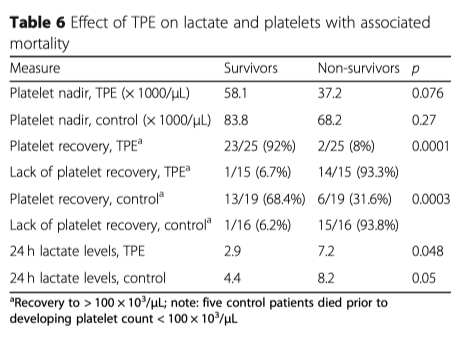
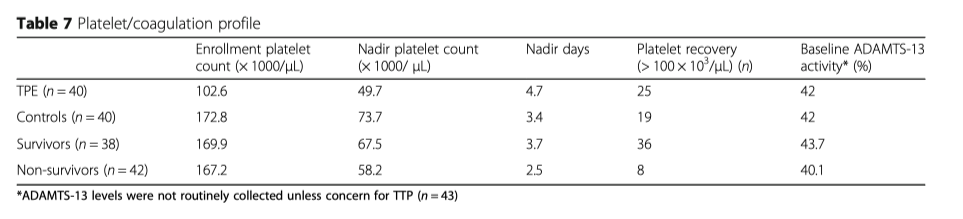
Лабораторные анализы назначались согласно протоколу проведения стандартной терапии и все они были подвергнуты ретроспективному анализу Таблицы 5, 6, 7). Начальный уровень лактата практически не отличался в обеих группах, 8.1 vs 6.6 (р = 0.219), но после 24 часов в группе ТРЕ уровень лактата был ниже (4.8 vs 6.9 p = 0.145), (Таблица 5). Более низкий уровень лактата ассоциировался со снижением летальности в обеих группах ((2.9 у выживших в группе TPE vs. 7.2 у умерших в группе TPE (p = 0.048); 4.4 у выживших в контрольной группе vs. 8.2 у умерших в контрольной группе (p = 0.05) (Таблица 6). Количество тромбоцитов - в группе с ТРЕ их количество было значительно ниже (102.6 vs. 172.8, p < 0.001), при этом наименьшее количество тромбоцитов также было зафиксировано в группе с ТРЕ (49.7 vs. 73.7, p = 0.008) (Талица 7).
В обеих группах низкий уровень тромбоцитов свидетельствовал в сторону увеличения летальности (Таблица 6). Разрешение тромбоцитопении в обеих группах было связано со снижением летальности, сохранение тромбоцитопении в обеих группах было связано с увеличением летальности (Таблица 7).
Уровни ADAMTS13 рутинно не оценивались, однако были практически одинаковыми в обеих группах. Также не было значительной разницы в уровнях у выживших и не-выживших (43.7% vs. 40.1%), Таблица 7.
Тридцать девять пациентов, которым проводился ТРЕ на момент включения в исследование требовалось проведение ИВЛ, при этом индекс оксигенации, PaO2/FiO 2, у них составлял в среднем 176.3 в то время, как в группе стандартной терапии таких пациентов было 29, а индекс оксигенации у них в среднем составлял 161.8. В первые 48 часов, 3 пациента на ИВЛ, которым проводился ТРЕ, были экстубированы, а в группе стандартной терапии в эти сроки был экстубирован только один пациент. Не было разницы между двумя группами по индексу оксигенации (217 vs. 223.6, p = 0.838). В группе стандартного лечения в течение первых 48 часов интубация потребовалась пяти пациентам, а в группе ТРЕ одному пациенту потребовалось проведение ЭКМО.
Не было зафиксировано ни одного осложнения, связанного с установкой и применением гемодиализного катетера или с самим проведением ТРЕ.
Обсуждение
Результаты нашего исследования предполагают потенциальную положительную роль TPE, как адъювантной терапии, в лечении сепсиса с полиорганной недостаточностью. Проспективные исследования по этой теме отсутствуют, и наши результаты становятся в ряд доказательств, в значительной степени основанных на отчетах об отдельных случаях и/или сериях случаев, но при этом являются одними из самых крупных. Абсолютное снижение на 25% летальности в нашем исследовании статистически значима, что убедительно свидетельствует о клинической пользе. Общая летальность в нашем исследовании высокая, но соответствует историческим показателям с поправкой на тяжесть заболевания (73–95.2%). Пациенты в обеих группах нашего исследования имели выраженную сопутствующую патологию, что независимо от сепсиса увеличивало риск смерти, включая сюда гипотензию, требующую введения вазопрессоров, острое повреждение почек и ОРДС.
Результаты и влияние проведения TPE на исходы очень похожи на результаты проспективного исследования, проведенного Busund et al. [16] в аналогичной популяции пациентов.
В дополнение, у пациентов, которым в нашем исследовании проводили TPE, показатели SOFA и кардио-SOFA в течение 48 часов улучшились, что указывает на улучшение функции органов и гемодинамики. Хотя прогнозируемая летальность, основанная на оценках SOFA, может быть завышена, тенденции в оценках SOFA служат ценными предикторами исходов [37–39]. Fortenberry and colleagues сообщили о разрешении органной дисфункции (что отображалось изменениями оценок по шкале PELOD от исхода) и снижении 28-ми дневной летальности у детей с сепсисом, которым проводился ТРЕ (критерии были подобными критериям в нашем исследовании) [37]. Также заслуживает внимания и более благоприятный баланс жидкости у пациентов, которым проводился ТРЕ. Такие результаты могут быть объяснены стабилизацией эндотелия, что ведет к улучшению гемодинамики и снижением потребности в объеме интенсивной инфузионной терапии. В ретроспективном исследовании, в котором не проводилась лабораторная диагностика маркеров состояния эндотелия, такой вывод не может быть доказан, что требует проведения проспективных исследований. Тем не менее, улучшения профиля гемодинамики, функции органов, благоприятный баланс жидкости - все это ассоциируется с улучшением клинических исходов и стимулирует дальнейшие исследования в этом направлении [40 - 43].
Патофизиология коагулопатия достаточно сложна, сочетает в себе дисфункцию тромбоцитов и нарушения коагуляционного каскада. Тромбоцитопения, ДВС-синдром и снижение активности ADAMTS-13, все они ассоциируются с неблагоприятными клиническими исходами сепсиса [25, 31, 33, 34, 44]. Мы придаем большое значение нашему предположению, что коагулопатия часто проявляется клинически еще до лабораторных данных/лабораторные данные не отражают тяжести коагулопатии. Поэтому, в нашем центре для определения кандидатуры на лечение или для мониторинга реакции на лечение абсолютные значения не использовались. Ретроспективный анализ количества тромбоцитов показал благоприятные исходы у тех пациентов, у которых количество тромбоцитов было более высоким или у тех, у кого тромбоцитопения разрешалась в то время, как низкое количество тромбоцитов и сохраняющаяся тромбоцитопения чаще ассоциировались со смертью пациента (Таблица 6). Мы рутинно маркеры состояния коагуляционного каскада не измеряли, исключая пациентов, которым проводилась антикоагуляция, поэтому оценить их ценность в рамках нашего исследования не представляется возможным. Интересно, что исходные уровни ADAMTS-13 были практически одинаковыми у всех пациентов в обеих группах, что возможно объясняется тяжестью течения сепсиса, о чем сообщалось в предыдущих исследованиях [8, 25]. Также мы не проводили серийные исследования уровней, поэтому не можем доказать, что ТРЕ может оказать помощь в восстановлении активности, но мы можем предположить, что такое восстановлении активности также связано с улучшением клинических исходов. Все эти данные/результаты могут быть полезны при проведении будущих клинических исследований.
Наше исследование имеет ограничения, и эти ограничения выходят за рамки ограничений, которые характерны для небольших ретроспективных одно-центровых исследований. Во-первых, разница в нулевом времени в двух группах потенциально вносит систематическую ошибку. В ретроспективном исследовании вмешательство легко определить, но, поскольку контрольная группа не получала лечения, нам пришлось определить нулевой момент времени произвольно. Время «Ноль» для группы вмешательства было определено, как время документирования завершения первого сеанса TPE (независимо от даты и времени поступления в ОИТ). Для контрольных пациентов время «Ноль» было определено, как время первой регистрации жизненно важных функций в ОИТ. Чтобы ограничить предвзятость, пациенты были сопоставлены по возрасту, полу, количеству вазопрессоров, по уровню лактата, по наличию хронических сопутствующих заболеваний и по оценкам по шкалам APACHE II и SOFA при поступлении в ОИТ. Баллы SOFA также были рассчитаны в нулевой момент времени и были выше в группе вмешательства по сравнению с контрольной группой, что предсказывало более высокую смертность в этой группе (Таблица 2) (p = 0,001).
Несмотря на то, что в нашем центре имеется протокол лечения сепсиса, мы допускаем, что также у врачей имеются различия в подходах к терапии. Такая вариабельность вряд ли повлияет на исходы, поскольку многочисленные исследования не показали различий в летальности при использовании различных стратегий интенсивной терапии [45, 46]. Кроме того, поскольку и контрольной группе, и группе вмешательства, лечение осуществлялось одними и теми же врачами в течение одного и того же периода времени, различий между группами может и не быть.
Решение применении TPE зависело от лечащего врача и предполагало междисциплинарный подход, лечащий врач-реаниматолог и нефролог. Были разработаны клинические рекомендации (Таблица 1), но TPE не рассматривался в случае, если лечащий врач не считал, что это может быть полезно. Поэтому некоторые пациенты, которые могли быть кандидатами на TPE, скорее всего, для такого лечения не рассматривались и, вероятно, попали в нашу контрольную группу. Более того, соответствие критериям не гарантирует проведение TPE. В конечном итоге, окончательное решение принимал нефролог-консультант в индивидуальном порядке. Такую предвзятость нельзя устранить в ретроспективном исследовании, в котором вмешательство не является рандомизированным, с использованием четко определенных, объективных требований включения и исключения, позволяющих проводить сопоставление и статистическое сравнение.
Еще одним ограничением нашего исследования было отсутствие единообразия в продолжительности лечения в группе вмешательства. Хотя большинство пациентов получали от одного до пяти курсов лечения (92,5%), в нашем центре не было установлено никаких объективных рекомендаций по стандартизации продолжительности TPE. Из трех пациентов, получивших более 5 курсов лечения, двое имели длительную госпитализацию и получили два отдельных курса TPE, с разными возбудителями инфекций. Третий получал лечение до нормализации количества тромбоцитов и здесь ярко проявилась предвзятость врача. Эффективность и продолжительность чаще всего определялись ответом гемодинамики и клиренсом лактата. Многие врачи прекращали проведение TPE после того, как была устранена потребность в вазопрессорах в то время, как другие врачи предпочитали проведение 3-х или 5-ти процедур. Уровни лактата снижались быстрее у пациентов, получавших TPE, и эти уровни через 24 часа были ниже у выживших пациентов в обеих группах (Таблицы 5 и 6).
Продолжительность пребывания в отделении интенсивной терапии и в стационаре была больше в группе вмешательства, но, возможно, не отражала истинную заболеваемость, поскольку в группе стандартной терапии было больше ранних смертей. Кроме того, большему количеству пациентов, получавших TPE, потребовалось новое начало ПЗТ, но летальность, связанная с ПЗТ, клинически была меньше в группе TPE (48% против 78%, p = 0,06). В нашем исследовании не было никакой разницы в новой потребности в ПЗТ при выписке у выживших. Для оценки реального воздействия на заболеваемость, ресурсы и долгосрочные системные затраты необходим больший размер выборки и более длительный интервал наблюдения.
Ретроспективный дизайн исследования не оптимален для выявления побочных эффектов, связанных с TPE. Все пациенты в нашем исследовании по определению были гемодинамически нестабильными. Невозможно приписать гемодинамическую нестабильность TPE или исключить TPE, как способствующий фактор только лишь на основании нашего обзора документации. Не было зарегистрировано осложнений, связанных с установкой временного диализного катетера и ни разу TPE не был прерван из-за клинического ухудшения. Однако мы не можем исключить другие потенциальные нежелательные явления, которые невозможно было отследить или идентифицировать. Потенциальные побочные эффекты TPE хорошо известны [47]. Тем не менее, недавнее пилотное исследование показало осуществимость и безопасность раннего TPE в аналогичной популяции пациентов [17]. Тем не менее, проспективное рандомизированное исследование могло бы послужить выявлению потенциальных нежелательных явлений, связанных с TPE, особенно у взрослых пациентов с сепсисом.
Результаты нашего исследования обнадеживают, но ограничены дизайном, и их нельзя использовать для изменения существующих стандартов лечения сепсиса. Информация, полученная из нашего опыта, предлагает ценную информацию, и ее следует использовать для помощи в разработке много-центрового рандомизированного контролируемого исследования для того, чтобы лучше оценить такое потенциально полезное вмешательство, как ТРЕ.
Выводы
TPE был предложен в качестве терапевтического варианта при сепсисе, но чтобы поддержать или опровергнуть его эффективность в этой популяции пациентов, полученных нами данных недостаточно. Наши результаты дополняют совокупность доказательств, подтверждающих полезность TPE у подгруппы взрослых пациентов с сепсисом. Для изучения эффективности TPE у взрослых пациентов с септическим шоком и полиорганной недостаточностью необходимо проведение многоцентрового проспективного рандомизированного контролируемого исследования.
Список литературы:
1. Torio CM, Moore BJ. National inpatient hospital costs: the most expensive conditions by payer, 2013. Statistical brief # 204. In: Healthcare Cost and Utilization Project (HCUP) Statistical Briefs (Internet). Rockville: Agency for Healthcare Research and Quality (US); 2006. Available from: https://www. ncbi.nlm.nih.gov/books/nbk368429/.
2. Schwartz J, Padmanabhan A, Aqui N, et al. Guidelines on the use of therapeutic apheresis in clinical practice- evidence-based approach from the writing committee of the American Society of Apheresis: the seventh special issue. J Clin Apher. 2016;31(3):149–62.
3. Chang JC. Sepsis and septic shock: endothelial molecular pathogenesis associated with vascular microthrombotic disease. Thromb J. 2019;17:10. https://doi.org/10.1186/s12959-019-0198-4.
4. Gyawali B, Ramakrishna K, Dhamoon AS. Sepsis: the evolution in definition, pathophysiology, and management. SAGE Open Med. 2019;7: 2050312119835043. Published 2019 Mar 21. https://doi.org/10.1177/ 2050312119835043.
5. Hou PC, Filbin MR, Wang H, et al. Endothelial permeability and hemostasis in septic shock: results from the ProCESS trial. Chest. 2017;152(1):22–31.
6. Johansson P, Stensballe J, Ostrowski SR. Shock induced endotheliopathy (SHINE) in acute critical illness – a unifying pathophysiologic mechanism. Crit Care. 2017;21:25. https://doi.org/10.1186/s13054-017-1605-5.
7. Nguyen T, Carcillo J. Bench-to-bedside review: thrombocytopenia-associated multiple organ failure - a newly appreciated syndrome in the critically ill. Crit Care. 2006;10(6):235. https://doi.org/10.1186/cc5064.
8. Nguyen TC, Han YY, Kiss JE, et al. Intensive plasma exchange increases a disintegrin and metalloprotease with thrombospondin motifs-13 activity and reverses organ dysfunction in children with thrombocytopeniaassociated multiple organ failure. Crit Care Med. 2008;36(10):2878–87.
9. Abraham E, Laterre PF, Garg R, et al. Drotrecogin alfa (activated) for adults with severe sepsis and a low risk of death. N Engl J Med. 2005;353(13): 1332–41.
10. Bernard G, Vincent JL, Laterre PF, et al. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med. 2001;344(10): 699–709.
11. Dellinger P, Bagshaw SM, Antonelli M, et al. Effect of targeted polymyxin B hemoperfusion on 28-day mortality in patients with septic shock and elevated endotoxin level: the EUPHRATES randomized clinical trial. JAMA. 2018;320(14):1455–63.
12. Fujii T, Luethi N, Young PJ, et al. Effect of vitamin C, hydrocortisone, and thiamine vs hydrocortisone alone on time alive and free of vasopressor support among patients with septic shock: the VITAMINS randomized clinical trial. JAMA. 2020. https://doi.org/10.1001/jama.2019.22176 [Epub ahead of print].
13. Marik PE, Khangoora V, Rivera R, et al. Hydrocortisone, vitamin C, and thiamine for the treatment of severe sepsis and septic shock: a retrospective before-after study. Chest. 2017;151(6):1229–38.
14. Venkatesh B, Finfer S, Cohen J, et al. Adjunctive glucocorticoid therapy in patients with septic shock. N Engl J Med. 2018;378(9):797–808.
15. Vincent JL, Francois B, Zabolotskikh I. Effect of a recombinant human soluble thrombomodulin on mortality in patients with sepsis-associated coagulopathy: the SCARLET randomized clinical trial. JAMA. 2019;321(20): 1993–2002.
16. Busund R, Koukline V, Utrobin U, et al. Plasmapheresis in severe sepsis and septic shock: a prospective, randomized, controlled trial. Intensive Care Med. 2002;28:1434–9.
17. Knaup H, Stahl K, Schmidt BMW, et al. Early therapeutic plasma exchange in septic shock: a prospective open-label nonrandomized pilot study focusing on safety, hemodynamics, vascular barrier function, and biologic markers. Crit Care. 2018;22:285. https://doi.org/10.1186/s13054-018-2220-9.
18. Reeves JH, Butt WW, Layton JE, et al. Continuous plasmafiltration in sepsis syndrome. Plasmafiltration in Sepsis Study Group. Crit Care Med. 1999; 27(10):2096–104.
19. Ankawi G, Neri M, Zhang J, et al. Extracorporeal techniques for the treatment of critically ill patients with sepsis beyond conventional blood purification therapy: the promises and the pitfalls. Crit Care. 2018;22(1):262. https://doi.org/10.1186/s13054-018-2181-z.
20. Busund R, Lindsetmo RO, Rasmussen LT, Røkke O, et al. Tumor necrosis factor and interleukin 1 appearance in experimental gram-negative septic shock. The effects of plasma exchange with albumin and plasma infusion. Arch Surg. 1991;126(5):591–7.
21. Janbon B, Vuillez JP, Carpentier F, et al. Removal of circulating tumor necrosis factor. Its role in septic shock treatment. Ann Med Interne (Paris). 1992;143(Suppl 1):13–6.
22. Long EJ, Taylor A, Delzoppo, et al. A randomized controlled trial of plasma filtration in severe pediatric sepsis. Crit Care Resusc 2013;15(3): 198–204.
23. Barelli S, Alberio L. The role of plasma transfusion in massive bleeding: protecting the endothelial glycocalyx? Front Med (Lausanne). 2018;5:91. https://doi.org/10.3389/fmed.2018.00091.
24. Fortenberry JD, Nguyen T, Grunwell JR, et al. Therapeutic plasma exchange in children with thrombocytopenia-assicaiated multiple organ failure: the thrombocytopenia-associated multiple organ failure network prospective experience. Crit Care Med. 2019;47(3):e173–81.
25. Stegmayr BG, Banga R, Berggren L, et al. Plasma exchange as rescue therapy in multiple organ failure including acute renal failure. Crit Care. 2003;31(6):1730–6.
26. Hadem J, Hafer C, Schneider AS, et al. Therapeutic plasma exchange as rescue therapy in severe sepsis and septic shock: retrospective observational single-centre study of 23 patients. BMC Anesthesiol. 2014;14:24. https://doi. org/10.1186/1471-2253-14-24.
27. Rimmer E, Houston BL, Kumar A, et al. The efficacy and safety of plasma exchange in patients with sepsis and septic shock: a systematic review and meta-analysis. Crit Care. 2014;18:699.
28. Padmanabhan A, Connelly-Smith L, Aqui N, et al. Guidelines on the use of therapeutic apheresis in clinical practice – evidence-based approach from the writing committee of the American Society for Apheresis: the eight special issue. J Clin Apher. 2019;34(3):171–354.
29. Bakker J, Gris P, Coffernils M, et al. Serial blood lactate levels can predict the development of multiple organ failure following septic shock. Am J Surg. 1996;171(2):221–6.
30. Haas SA, Lange T, Saugel B, et al. Severe hyperlactatemia, lactate clearance and mortality in unselected critically ill patients. Intensive Care Med. 2016; 42(2):202–10.
31. Khurana D, Deoke SA. Thrombocytopenia in critically ill patient: clinical and laboratorial behavior and its correlation with short-term outcome during hospitalization. Indian J Crit Care Med. 2017;21(12):861–4.
32. Medam S, Zieleskiewicz L, Duclos G, et al. Risk factors for death in septic shock: a retrospective cohort study comparing trauma and non-trauma patients. Medicine (Baltimore). 2017;96(50):e9241.
33. Menard CE, Kumar A, Houston DS, et al. Evolution and impact of thrombocytopenia in septic shock: a retrospective cohort study. Crit Care Med. 2019;47(4):558–65.
34. Parker RI. Etiology and significance of thrombocytopenia in critically ill patients. Crit Care Clin. 2012;28(3):399–411.
35. Sanderson M, Chikhani M, Blyth E, et al. Predicting 30-day mortality in patients with sepsis: an exploratory analysis of process of care and patient characteristics. J Intensive Care Soc. 2018;19(4):299–304. https://doi.org/10. 1177/1751143718758975.
36. Song JE, Kim MH, Jeong WY, et al. Mortality risk factors for patients with septic shock after implementation of the surviving sepsis campaign bundles. Infect Chemother. 2016;48(3):199–208.
37. Ferreira FL, Bota DP, Bross A, et al. Serial evaluation of the SOFA score to predict outcome in critically ill patients. JAMA. 2001;286(14):1754–8.
38. Iba T, Arakawa M, Mochizuki K, et al. Usefulness of measuring changes in SOFA score for the prediction of 28-day mortality in patients with sepsisassociated disseminated intravascular coagulation. Clin Appl Thromb Hemos. 2019;25:1076029618824044.
39. Soo A, Zuege DJ, Fick GH, et al. Describing organ dysfunction in the intensive care unit: a cohort study of 20,000 patients. Crit Care. 2019;23:186. https://doi.org/10.1186/s13054-019-2459-9.
40. Boyd JH, Forbes J, Nakada TA, et al. Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med. 2011;39(2):259–65.
41. Kelm DJ, Perrin JT, Cartin-Ceba R, et al. Fluid overload in patients with severe sepsis and septic shock treated with early goal-directed therapy is associated with increased acute need for fluid-related medical interventions and hospital death. Shock. 2015;43(1):68–73.
42. Acheampong A, Vincent JL. A positive fluid balance is an independent prognostic factor in patients with sepsis. Crit Care. 2015;19:251.
43. van Mourik N, Metske HA, Hofstra JJ, et al. Cumulative fluid balance predicts mortality and increases time on mechanical ventilation in ARDS patients: an observational cohort study. PLoS One. 2019;14(10):e0224563.
44. Martin K, Borgel D, Lerolle N, et al. Decreased ADAMTS-13 (a disintegrin-like and metalloprotease with thrombospondin type 1 repeats) is associated with a poor prognosis in sepsis-induced organ failure. Crit Care Med. 2007; 35(10):2375–82. https://doi.org/10.1097/01.ccm.0000284508.05247.b3.
45. Investigators A, Group ACT, Peake SL, Delaney A, Bailey M, Bellomo R, et al.
Goal-directed resuscitation for patients with early septic shock. N Engl J Med. 2014;371(16):1496–506.
46. Yealy DM, Kellum JA, Huang DT, et al. A randomized trial of protocol-based care for early septic shock. N Engl J Med. 2014;370(18):1683–93.
47. Basic-Jukic N, Kes P, Glavas-Boras S, et al. Complications of therapeutic plasma exchange: experience with 4857 patients. Ther Apher Dial. 2005;9(5): 391–5.
Keith et al. Critical Care (2020) 24:518
https://doi.org/10.1186/s13054-020-03241-6
Исследование
Эффективность терапевтического плазмаобмена как адъювантного метода лечения септического шока при полиорганной недостаточности: одно-центровой эксперимент
Перевод оригинальной статьи «The therapeutic efficacy of adjunct therapeutic plasma exchange for septic shock with multiple organ failure: a singlecenter experience»
Philip D. Keith, Adam H. Wells, Jeremy Hodges, Stephen H. Fast, Amber Adamsan, L. Keith Scott
Critical Care Medicine, Lexington Medical Center, 2720 Sunset Boulevard, West Columbia, SC 29169, USA.
Critical Care Medicine, Novant Health Forsyth Medical Center, 3333 Silas Creek Parkway, Winston-Salem, NC 27103, USA.
Clinical Pharmacist, Novant Health Forsyth Medical Center, 3333 Silas Creek Parkway, Winston-Salem, NC 27103, USA.
Department of Mathematics, Limestone College, 1115 College Drive, Gaffney, SC 29340, USA.
Emergency Department Clinical Pharmacist, Cabell Huntington Hospital, 1340 Hal Greer Boulevard, Huntington, WV 25701, USA.
Division of Trauma and Surgical Critical Care, Louisiana State University Health Sciences Center, 1501 Kings Highway, Shreveport, LA 71103, USA.
Keywords: Septic shock, Sepsis, Multiple organ failure, MODS, Plasma exchange, Plasmapheresis
Ключевые слова: септический шок, сепсис, полиорганная недостаточность, СПОН, плазмаобмен, плазмаферезис.
Введение
Сепсис остается лидирующей причиной примерно около 1.3 миллионов госпитализаций в США, включая сюда 25% ежегодных госпитализаций в отделения интенсивной терапии (ОИТ) [1]. Несмотря на значительные успехи в лечении сепсиса, имея ввиду раннюю целе-направленную терапию, септический шок остается ведущей причиной смерти в ОИТ от некоронарных причин, а летальность при развитии септического шока с полиорганной недостаточностью достигает практически 70% [2].
Последние исследования расширили наше понимание сепсиса, как комплексного взаимодействия цитокинового шторма, системного воспаления, эндотелиальной дисфункции, капиллярной утечки на фоне патологии гемостаза, очень похожей на таковую при тромбоцитопенической пурпуре (англ.
thrombocytopenic purpura или TTP) [3–7]. Молниеносно развивается диссеминированный тромбоз микроциркуляции, что приводит к развитию тканевой гипоксии, полиорганной недостаточности и, в конечном итоге, к смерти [8]. Такие терапевтические вмешательства, как введение стероидов, активированного протеина С, аскорбиновой кислоты, тромбомодулина, проведение плазмафильтрации, гемоперфузии полимиксином В, направленные на определенные пути патофизиологии сепсиса, не оказали значимого влияния на улучшение клинических исходов [9 - 15].
Несмотря на то, что каждый из перечисленных видов вмешательства может оказать свое положительное воздействие на какого-либо пациента с сепсисом, гетерогенность самого сепсис-синдрома делает маловероятным то, что какое либо вмешательство, нацеленное только лишь на один компонент/путь патофизиологического процесса, принесет успех при повсеместном его применении.
Терапевтический плазмаобмен (англ.Therapeutic plasma exchange или TPE) может предложить уникальное лечение сепсиса, предполагая более широкое действие на несколько компонентов этого сложного пути. Изначально цитокиновый шторм приводит к глобальному воспалению и разрушению эндотелия, что, в свою очередь приводит к вазодилятации, капиллярной утечке и активации каскада коагуляции [3, 4, 7, 16, 17]. Несмотря на то, что фильтрация плазмы снижает уровни многих из этих медиаторов, циркулирующих в крови, как в экспериментальных, так и в клинических исследованиях [17–21], исследования по изучению выживаемости при применении разнообразных методов гемофильтрации и связывания цитокинов дали противоречивые результаты [18, 19, 21, 22 ].
Для успешного лечения сепсиса требуется много больше, чем просто достижение баланса медиаторов воспаления и здесь TPE может предложить дополнительную пользу при его применении в целях компенсации эффектов, вызванных дисфункций эндотелия. Эндотелий играет очень важную роль в механизмах развития сепсиса и все чаще и чаще становится мишенью терапевтических вмешательств. Гипотензия ведь не только результат вазодилятации при воспалении, но так же и результат повреждения эндотелия, что приводит к увеличенной сосудистой проницаемости [3–6, 17]. В ходе проведенных исследований сепсиса и геморрагического шока уже обнаружены маркеры повреждения эндотелия, уровень которых в циркуляции связан с изменениями в эндотелии, что показано при электронной микроскопии, и с летальностью [5, 17, 23]. Интенсивная терапия с применением свежезамороженной плазмы (СЗП) показала восстановление целостности эндотелия, определенное с помощью микроскопии, что приводило к улучшению уровней циркулирующих маркеров [17, 23]. В случае же массивной кровопотери, летальность снижается при применении трансфузионной стратегии, при которой используется СЗП [23].
Другим клиническим эффектом эндотелиальной дисфункции служит патологическая активация тромбообразования, что приводит к состоянию гиперкоагуляции в микроциркуляции. Снижение активности ADAMTS-13 с одновременным усилением активности ингибиторов ADAMTS-13, приводит к увеличению тромбогенных мультимеров сверхбольшого фактора фон Виллебранда (англ. thrombogenic ultra-large von Willebrand factor или ULvWF), результатом чего является диффузный тромбоз микроциркуляторного русла. Увеличение активности ингибитора-1 активатора плазминогена (англ. plasminogen activator inhibitor или PAI-1) ведет к снижению фибринолиза с накоплением в микроциркуляции фибрина. Для обращения вспять этого процесса предназначались активированный протеин С и тромбомодулин, но без особого успеха [9, 10, 15]. Плазмаферез уникален тем, что при его применении устраняется как патологический каскад свертывания, так и дисфункция тромбоцитов, и все это результат удаления мультимеров ULvWF, ингибиторов ADAMTS-13 и PAI-1. Все это ведет к восстановлению активности ADAMTS-13 [7].
Отчеты о случаях, серии случаев, мета-анализы и одно проспективное рандомизированное клиническое исследование у взрослых показали противоречивые результаты по эффективности TPE при сепсисе [16, 18, 22, 26, 27]. Основываясь на имеющихся данных, Американское общество афереза (англ. the American Society for Apheresis или ASFA) предлагает рекомендации категории III, 2B по применению TPE при сепсисе с полиорганной недостаточностью, что позволяет индивидуально применять TPE в каждом конкретном случае [2, 28].
Руководствуясь этими рекомендациями, мы применяли TPE в отдельных случаях септического шока с полиорганной недостаточностью, рефрактерного к катехоламинам. Показаниями к проведению TPE служили маркеры неблагоприятного исхода [29–36], при этом мы стремились идентифицировать пациентов с таким клиническим фенотипом, при котором эти пациенты вряд ли выживут при проведении им стандартной терапии (Таблица 1). В нашем ретроспективном наблюдательном исследовании мы проанализировали данные, полученные из электронной медицинской карты, и сравнили результаты у пациентов, соответствующих этим критериям и которые получали TPE в качестве адъювантной терапии, с пациентами с подобной склонностью и отвечающими тем же критериям, но которые получали только стандартную терапию.
Методы
Дизайн исследования
Ретроспективное обсервационное исследование эффективности TPE, как адъювантной терапии септического шока с полиорганной недостаточностью, проведенное методом просмотра электронных историй болезни взрослых, 18 лет и старше, пациентов, поступивших на лечение в «Novant Health Forsyth Medical Center» в период августа 2015 года по март 2019 года. Исследование было одобрено «the Institutional Review Board at Novant Health Forsyth Medical Center».
Субъекты исследования
Группа вмешательства была идентифицирована путем анализа электронных историй болезни с указанием на первичную диагностику септического шока с кодом афереза в течение определенного временного интервала. Всего определенно 40 пациентов, которым был проведен как минимум один сеанс TPE и которые отвечали критериям включения (Таблица 1).
Контрольную группу составили пациенты, определенные с использованием фильтров, отвечающих нашим показаниям к проведению TPE при сепсисе и в тоже временное окно, что и пациенты из группы вмешательства. Скринингу подверглись пациенты с первичным диагнозом шока, у которых также наблюдались следующие проявления: 2 или более вазопрессора, уровень сывороточного лактата более 2 ммоль/л, уровень тромбоцитов менее 200 х 103, рН менее 7,3. Всего было идентифицировано 160 пациентов.
Вмешательство
Все пациенты в обеих группах получали терапию сепсиса на усмотрение интенсивиста. Всем пациентам было предписано вводить жидкость в дозе 30 мл/кг в качестве интенсивной инфузионной терапии и проводить своевременную эмпирическую антибиотикотерапию. Кроме протокола терапии сепсиса, в обеих группах врачами назначалась адъювантная терапия, включающая в себя стероиды, аскорбиновую кислоту, тиамин. У всех пациентов на ИВЛ проводилась стратегия защиты легких согласно протоколу лечения острого респираторного синдрома (ОРДС).
В нашем медицинском центре процедура TPE проводится нефрологами, решение по проведению TPE принимается на основании мультидисциплинарного подхода. Лечащий врач-реаниматолог мог выставить показания к проведению TPE в случае, если пациенты соответствовали критериям, указанным в таблице 1. Врач отделения нефрологии по запросу проводил консультацию в каждом конкретном случае. В случае согласия нефролога на проведение TPE при условии, что это принесет пользу пациенту, процедура TPE проводилась. В случае несогласия нефролога на проведение TPE, процедура не проводилась.
Сосудистый доступ, в случае проведения TPE, обеспечивался установкой двух-ходового катетера для гемодиализа размером 14F. TPE проводилась после из расчета 120% от циркулирующего объема плазмы с поправкой, при необходимости, на ожирение. В качестве замещающего раствора во всех случаях применялась СЗП. В случае, когда пациенту требовалось проведение почечно-заместительной терапии, процедура диализа прерывалась для того, что бы провести процедуру TPE. Количество процедур не было стандартизовано; скорее, ежедневное лечение проводилось до тех пор, пока лечащая бригада (а) не увидела, что процедура максимально улучшила состояние пациента, (б) количество процедур соответствовало предпочтениям лечащего врача или (в) у пациента наблюдалось клиническое ухудшение и лечащий врач считал, что дальнейшее лечение не было клинически оправданным/бесполезным с медицинской точки зрения, и/или лица, принимающие решения, были против продолжения лечения. В большинстве случаев лечащие врачи следовали протоколу Busund et al. [16], выполняя сначала одну процедуру, последующие процедуры выполнялись в случае отсутствия клинического улучшения.
Определения переменных
Первичной точкой исследования служила 28-ми дневная летальность от всех причин. Вторичными точками исследования были: госпитальная летальность, новая потребность в проведении почечно-заместительный терапии (ПЗТ) на момент поступления или при переводе, летальность, ассоциированная с необходимостью проведения нового сеанса ПЗТ, длительность нахождения пациента в ОИТ, длительность нахождения пациента в стационаре, ежедневный баланс жидкости, изменения при оценках по шкалам SOFA и кардио-SOFA в течение 48 часов после установки диагноза септический шок. Время «Ноль» для группы вмешательства определялось, как подтвержденные дата и время окончания первой процедуры TPE. Время «Ноль» для группы контроля определялось, как первая запись жизненно-важных показателей в ОИТ. Пациенты были подвергнуты подбору по индексу соответствия (англ. propensity-matched), при котором использовались такие данные, как возраст, пол, сопутствующая патология, оценки по шкалам APACHE II и SOFA, уровень лактата, режимы дозирования вазопрессоров в ОИТ.
Характеристика пациентов
В исследование было включено 80 пациентов, по 40 человек в каждой группе. Исходные демографические данные приведены в Таблице 2. Пациенты в обеих группах имели высокий риск наступления летального исхода согласно оценок по шкалам APACHE II и SOFA. Все пациенты находились в состоянии септического шока, что требовало введения не менее двух вазопрессоров, большинству из них потребовалось проведение ПЗТ. Пациентам в группе вмешательства поведение ИВЛ требовалось чаще по сравнению с пациентами в группе контроля (p = 0.014). Мы также заметили, что в контрольной группе средний возраст пациентов оказался несколько выше (p = 0.077).
Статистический анализ
Статистический анализ был проведен независимым статистиком. Использовался XLSTAT by Addinsoft (Windows version) и Xrealstats from http://www.real-statistics.com/ (Windows version) add-ins for Microsoft Excel.
Одномерные сравнения исходных характеристик были выполнены: для непрерывных переменных с помощью непарного t-критерия, для категориальных переменных - с помощью точного критерия Фишера. Для проверки различий в инфекционном происхождении между двумя группами использовался chi-square test. Изменения APACHE 2 и SOFA от исходного уровня в группе оценивали с помощью парного t-критерия. Для проверки различий в выживаемости между группами использовался точный тест Фишера. Для анализа выживаемости предоставляется оценка Каплана-Мейера с использованием лог-рангового теста для сравнения совокупной выживаемости. Данные представлены как среднее ± стандартное отклонение.
Клинические исходы
Клинические исходы представлены на Рисунке 1 и в Таблице 2. Общая летальность составила: в группе вмешательства 40%, в группе контроля 65% (p = 0.043). Снижение относительного риска летальности составило 38,5%. В популяции, что вошла в исследование, одна дополнительная жизнь была сохранена на каждые четыре пациента, которым был проведена процедура TPE. Госпитальная летальность составила: в группе вмешательства 42,5% по сравнению с 65% в группе контроля (p = 0.072). В таблице 4 показана летальность в зависимости от источника инфекции и вида патогена. Подгруппа пациентов с пневмонией, как первичного источника инфекции, которые получили TPE, показали наилучшее улучшение, по показателю 28-ми дневная летальность, по сравнению с пациентами с пневмонией, которым проводилась только стандартная терапия (47.8% vs. 88%, p = 0.017). При других источниках инфекции показатель летальности составил: в группе с TPE 29,4% по сравнению с 48% в группе только стандартной терапии (p = 0.332). Провести дополнительный анализ по подгруппам по признаку «источник инфекции» было невозможно из-за небольшого размера выборки. Изменения в оценках по шкале SOFA показали улучшение от исходных в группе с TPE у тех пациентов, кто оставался живым к исходу 48 часов (p < 0.001). У пациентов в группе TPE была более благоприятной ситуация с балансом жидкости (p = 0.01) (Таблица 3). Пациентам , которым проводился TPE, проведение ПЗТ потребовалось в 67,7% процентах случаев по сравнению с 51,4% в группе контроля. Летальность, ассоциированная с проведением ПЗТ, в группе TPE составила 48% по сравнению с 79% в группе контроля (p = 0.06), однако не было найдено никаких различий в необходимости проведения ПЗТ у переведенных (выживших) пациентов. Продолжительность нахождения в ОИТ и в стационаре была выше у пациентов, которым проводился TPE (p = 0.003, p = 0.006).
Лабораторные анализы назначались согласно протоколу проведения стандартной терапии и все они были подвергнуты ретроспективному анализу Таблицы 5, 6, 7). Начальный уровень лактата практически не отличался в обеих группах, 8.1 vs 6.6 (р = 0.219), но после 24 часов в группе ТРЕ уровень лактата был ниже (4.8 vs 6.9 p = 0.145), (Таблица 5). Более низкий уровень лактата ассоциировался со снижением летальности в обеих группах ((2.9 у выживших в группе TPE vs. 7.2 у умерших в группе TPE (p = 0.048); 4.4 у выживших в контрольной группе vs. 8.2 у умерших в контрольной группе (p = 0.05) (Таблица 6). Количество тромбоцитов - в группе с ТРЕ их количество было значительно ниже (102.6 vs. 172.8, p < 0.001), при этом наименьшее количество тромбоцитов также было зафиксировано в группе с ТРЕ (49.7 vs. 73.7, p = 0.008) (Талица 7).
В обеих группах низкий уровень тромбоцитов свидетельствовал в сторону увеличения летальности (Таблица 6). Разрешение тромбоцитопении в обеих группах было связано со снижением летальности, сохранение тромбоцитопении в обеих группах было связано с увеличением летальности (Таблица 7).
Уровни ADAMTS13 рутинно не оценивались, однако были практически одинаковыми в обеих группах. Также не было значительной разницы в уровнях у выживших и не-выживших (43.7% vs. 40.1%), Таблица 7.
Тридцать девять пациентов, которым проводился ТРЕ на момент включения в исследование требовалось проведение ИВЛ, при этом индекс оксигенации, PaO2/FiO 2, у них составлял в среднем 176.3 в то время, как в группе стандартной терапии таких пациентов было 29, а индекс оксигенации у них в среднем составлял 161.8. В первые 48 часов, 3 пациента на ИВЛ, которым проводился ТРЕ, были экстубированы, а в группе стандартной терапии в эти сроки был экстубирован только один пациент. Не было разницы между двумя группами по индексу оксигенации (217 vs. 223.6, p = 0.838). В группе стандартного лечения в течение первых 48 часов интубация потребовалась пяти пациентам, а в группе ТРЕ одному пациенту потребовалось проведение ЭКМО.
Не было зафиксировано ни одного осложнения, связанного с установкой и применением гемодиализного катетера или с самим проведением ТРЕ.
Обсуждение
Результаты нашего исследования предполагают потенциальную положительную роль TPE, как адъювантной терапии, в лечении сепсиса с полиорганной недостаточностью. Проспективные исследования по этой теме отсутствуют, и наши результаты становятся в ряд доказательств, в значительной степени основанных на отчетах об отдельных случаях и/или сериях случаев, но при этом являются одними из самых крупных. Абсолютное снижение на 25% летальности в нашем исследовании статистически значима, что убедительно свидетельствует о клинической пользе. Общая летальность в нашем исследовании высокая, но соответствует историческим показателям с поправкой на тяжесть заболевания (73–95.2%). Пациенты в обеих группах нашего исследования имели выраженную сопутствующую патологию, что независимо от сепсиса увеличивало риск смерти, включая сюда гипотензию, требующую введения вазопрессоров, острое повреждение почек и ОРДС.
Результаты и влияние проведения TPE на исходы очень похожи на результаты проспективного исследования, проведенного Busund et al. [16] в аналогичной популяции пациентов.
В дополнение, у пациентов, которым в нашем исследовании проводили TPE, показатели SOFA и кардио-SOFA в течение 48 часов улучшились, что указывает на улучшение функции органов и гемодинамики. Хотя прогнозируемая летальность, основанная на оценках SOFA, может быть завышена, тенденции в оценках SOFA служат ценными предикторами исходов [37–39]. Fortenberry and colleagues сообщили о разрешении органной дисфункции (что отображалось изменениями оценок по шкале PELOD от исхода) и снижении 28-ми дневной летальности у детей с сепсисом, которым проводился ТРЕ (критерии были подобными критериям в нашем исследовании) [37]. Также заслуживает внимания и более благоприятный баланс жидкости у пациентов, которым проводился ТРЕ. Такие результаты могут быть объяснены стабилизацией эндотелия, что ведет к улучшению гемодинамики и снижением потребности в объеме интенсивной инфузионной терапии. В ретроспективном исследовании, в котором не проводилась лабораторная диагностика маркеров состояния эндотелия, такой вывод не может быть доказан, что требует проведения проспективных исследований. Тем не менее, улучшения профиля гемодинамики, функции органов, благоприятный баланс жидкости - все это ассоциируется с улучшением клинических исходов и стимулирует дальнейшие исследования в этом направлении [40 - 43].
Патофизиология коагулопатия достаточно сложна, сочетает в себе дисфункцию тромбоцитов и нарушения коагуляционного каскада. Тромбоцитопения, ДВС-синдром и снижение активности ADAMTS-13, все они ассоциируются с неблагоприятными клиническими исходами сепсиса [25, 31, 33, 34, 44]. Мы придаем большое значение нашему предположению, что коагулопатия часто проявляется клинически еще до лабораторных данных/лабораторные данные не отражают тяжести коагулопатии. Поэтому, в нашем центре для определения кандидатуры на лечение или для мониторинга реакции на лечение абсолютные значения не использовались. Ретроспективный анализ количества тромбоцитов показал благоприятные исходы у тех пациентов, у которых количество тромбоцитов было более высоким или у тех, у кого тромбоцитопения разрешалась в то время, как низкое количество тромбоцитов и сохраняющаяся тромбоцитопения чаще ассоциировались со смертью пациента (Таблица 6). Мы рутинно маркеры состояния коагуляционного каскада не измеряли, исключая пациентов, которым проводилась антикоагуляция, поэтому оценить их ценность в рамках нашего исследования не представляется возможным. Интересно, что исходные уровни ADAMTS-13 были практически одинаковыми у всех пациентов в обеих группах, что возможно объясняется тяжестью течения сепсиса, о чем сообщалось в предыдущих исследованиях [8, 25]. Также мы не проводили серийные исследования уровней, поэтому не можем доказать, что ТРЕ может оказать помощь в восстановлении активности, но мы можем предположить, что такое восстановлении активности также связано с улучшением клинических исходов. Все эти данные/результаты могут быть полезны при проведении будущих клинических исследований.
Наше исследование имеет ограничения, и эти ограничения выходят за рамки ограничений, которые характерны для небольших ретроспективных одно-центровых исследований. Во-первых, разница в нулевом времени в двух группах потенциально вносит систематическую ошибку. В ретроспективном исследовании вмешательство легко определить, но, поскольку контрольная группа не получала лечения, нам пришлось определить нулевой момент времени произвольно. Время «Ноль» для группы вмешательства было определено, как время документирования завершения первого сеанса TPE (независимо от даты и времени поступления в ОИТ). Для контрольных пациентов время «Ноль» было определено, как время первой регистрации жизненно важных функций в ОИТ. Чтобы ограничить предвзятость, пациенты были сопоставлены по возрасту, полу, количеству вазопрессоров, по уровню лактата, по наличию хронических сопутствующих заболеваний и по оценкам по шкалам APACHE II и SOFA при поступлении в ОИТ. Баллы SOFA также были рассчитаны в нулевой момент времени и были выше в группе вмешательства по сравнению с контрольной группой, что предсказывало более высокую смертность в этой группе (Таблица 2) (p = 0,001).
Несмотря на то, что в нашем центре имеется протокол лечения сепсиса, мы допускаем, что также у врачей имеются различия в подходах к терапии. Такая вариабельность вряд ли повлияет на исходы, поскольку многочисленные исследования не показали различий в летальности при использовании различных стратегий интенсивной терапии [45, 46]. Кроме того, поскольку и контрольной группе, и группе вмешательства, лечение осуществлялось одними и теми же врачами в течение одного и того же периода времени, различий между группами может и не быть.
Решение применении TPE зависело от лечащего врача и предполагало междисциплинарный подход, лечащий врач-реаниматолог и нефролог. Были разработаны клинические рекомендации (Таблица 1), но TPE не рассматривался в случае, если лечащий врач не считал, что это может быть полезно. Поэтому некоторые пациенты, которые могли быть кандидатами на TPE, скорее всего, для такого лечения не рассматривались и, вероятно, попали в нашу контрольную группу. Более того, соответствие критериям не гарантирует проведение TPE. В конечном итоге, окончательное решение принимал нефролог-консультант в индивидуальном порядке. Такую предвзятость нельзя устранить в ретроспективном исследовании, в котором вмешательство не является рандомизированным, с использованием четко определенных, объективных требований включения и исключения, позволяющих проводить сопоставление и статистическое сравнение.
Еще одним ограничением нашего исследования было отсутствие единообразия в продолжительности лечения в группе вмешательства. Хотя большинство пациентов получали от одного до пяти курсов лечения (92,5%), в нашем центре не было установлено никаких объективных рекомендаций по стандартизации продолжительности TPE. Из трех пациентов, получивших более 5 курсов лечения, двое имели длительную госпитализацию и получили два отдельных курса TPE, с разными возбудителями инфекций. Третий получал лечение до нормализации количества тромбоцитов и здесь ярко проявилась предвзятость врача. Эффективность и продолжительность чаще всего определялись ответом гемодинамики и клиренсом лактата. Многие врачи прекращали проведение TPE после того, как была устранена потребность в вазопрессорах в то время, как другие врачи предпочитали проведение 3-х или 5-ти процедур. Уровни лактата снижались быстрее у пациентов, получавших TPE, и эти уровни через 24 часа были ниже у выживших пациентов в обеих группах (Таблицы 5 и 6).
Продолжительность пребывания в отделении интенсивной терапии и в стационаре была больше в группе вмешательства, но, возможно, не отражала истинную заболеваемость, поскольку в группе стандартной терапии было больше ранних смертей. Кроме того, большему количеству пациентов, получавших TPE, потребовалось новое начало ПЗТ, но летальность, связанная с ПЗТ, клинически была меньше в группе TPE (48% против 78%, p = 0,06). В нашем исследовании не было никакой разницы в новой потребности в ПЗТ при выписке у выживших. Для оценки реального воздействия на заболеваемость, ресурсы и долгосрочные системные затраты необходим больший размер выборки и более длительный интервал наблюдения.
Ретроспективный дизайн исследования не оптимален для выявления побочных эффектов, связанных с TPE. Все пациенты в нашем исследовании по определению были гемодинамически нестабильными. Невозможно приписать гемодинамическую нестабильность TPE или исключить TPE, как способствующий фактор только лишь на основании нашего обзора документации. Не было зарегистрировано осложнений, связанных с установкой временного диализного катетера и ни разу TPE не был прерван из-за клинического ухудшения. Однако мы не можем исключить другие потенциальные нежелательные явления, которые невозможно было отследить или идентифицировать. Потенциальные побочные эффекты TPE хорошо известны [47]. Тем не менее, недавнее пилотное исследование показало осуществимость и безопасность раннего TPE в аналогичной популяции пациентов [17]. Тем не менее, проспективное рандомизированное исследование могло бы послужить выявлению потенциальных нежелательных явлений, связанных с TPE, особенно у взрослых пациентов с сепсисом.
Результаты нашего исследования обнадеживают, но ограничены дизайном, и их нельзя использовать для изменения существующих стандартов лечения сепсиса. Информация, полученная из нашего опыта, предлагает ценную информацию, и ее следует использовать для помощи в разработке много-центрового рандомизированного контролируемого исследования для того, чтобы лучше оценить такое потенциально полезное вмешательство, как ТРЕ.
Выводы
TPE был предложен в качестве терапевтического варианта при сепсисе, но чтобы поддержать или опровергнуть его эффективность в этой популяции пациентов, полученных нами данных недостаточно. Наши результаты дополняют совокупность доказательств, подтверждающих полезность TPE у подгруппы взрослых пациентов с сепсисом. Для изучения эффективности TPE у взрослых пациентов с септическим шоком и полиорганной недостаточностью необходимо проведение многоцентрового проспективного рандомизированного контролируемого исследования.
Список литературы:
1. Torio CM, Moore BJ. National inpatient hospital costs: the most expensive conditions by payer, 2013. Statistical brief # 204. In: Healthcare Cost and Utilization Project (HCUP) Statistical Briefs (Internet). Rockville: Agency for Healthcare Research and Quality (US); 2006. Available from: https://www. ncbi.nlm.nih.gov/books/nbk368429/.
2. Schwartz J, Padmanabhan A, Aqui N, et al. Guidelines on the use of therapeutic apheresis in clinical practice- evidence-based approach from the writing committee of the American Society of Apheresis: the seventh special issue. J Clin Apher. 2016;31(3):149–62.
3. Chang JC. Sepsis and septic shock: endothelial molecular pathogenesis associated with vascular microthrombotic disease. Thromb J. 2019;17:10. https://doi.org/10.1186/s12959-019-0198-4.
4. Gyawali B, Ramakrishna K, Dhamoon AS. Sepsis: the evolution in definition, pathophysiology, and management. SAGE Open Med. 2019;7: 2050312119835043. Published 2019 Mar 21. https://doi.org/10.1177/ 2050312119835043.
5. Hou PC, Filbin MR, Wang H, et al. Endothelial permeability and hemostasis in septic shock: results from the ProCESS trial. Chest. 2017;152(1):22–31.
6. Johansson P, Stensballe J, Ostrowski SR. Shock induced endotheliopathy (SHINE) in acute critical illness – a unifying pathophysiologic mechanism. Crit Care. 2017;21:25. https://doi.org/10.1186/s13054-017-1605-5.
7. Nguyen T, Carcillo J. Bench-to-bedside review: thrombocytopenia-associated multiple organ failure - a newly appreciated syndrome in the critically ill. Crit Care. 2006;10(6):235. https://doi.org/10.1186/cc5064.
8. Nguyen TC, Han YY, Kiss JE, et al. Intensive plasma exchange increases a disintegrin and metalloprotease with thrombospondin motifs-13 activity and reverses organ dysfunction in children with thrombocytopeniaassociated multiple organ failure. Crit Care Med. 2008;36(10):2878–87.
9. Abraham E, Laterre PF, Garg R, et al. Drotrecogin alfa (activated) for adults with severe sepsis and a low risk of death. N Engl J Med. 2005;353(13): 1332–41.
10. Bernard G, Vincent JL, Laterre PF, et al. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med. 2001;344(10): 699–709.
11. Dellinger P, Bagshaw SM, Antonelli M, et al. Effect of targeted polymyxin B hemoperfusion on 28-day mortality in patients with septic shock and elevated endotoxin level: the EUPHRATES randomized clinical trial. JAMA. 2018;320(14):1455–63.
12. Fujii T, Luethi N, Young PJ, et al. Effect of vitamin C, hydrocortisone, and thiamine vs hydrocortisone alone on time alive and free of vasopressor support among patients with septic shock: the VITAMINS randomized clinical trial. JAMA. 2020. https://doi.org/10.1001/jama.2019.22176 [Epub ahead of print].
13. Marik PE, Khangoora V, Rivera R, et al. Hydrocortisone, vitamin C, and thiamine for the treatment of severe sepsis and septic shock: a retrospective before-after study. Chest. 2017;151(6):1229–38.
14. Venkatesh B, Finfer S, Cohen J, et al. Adjunctive glucocorticoid therapy in patients with septic shock. N Engl J Med. 2018;378(9):797–808.
15. Vincent JL, Francois B, Zabolotskikh I. Effect of a recombinant human soluble thrombomodulin on mortality in patients with sepsis-associated coagulopathy: the SCARLET randomized clinical trial. JAMA. 2019;321(20): 1993–2002.
16. Busund R, Koukline V, Utrobin U, et al. Plasmapheresis in severe sepsis and septic shock: a prospective, randomized, controlled trial. Intensive Care Med. 2002;28:1434–9.
17. Knaup H, Stahl K, Schmidt BMW, et al. Early therapeutic plasma exchange in septic shock: a prospective open-label nonrandomized pilot study focusing on safety, hemodynamics, vascular barrier function, and biologic markers. Crit Care. 2018;22:285. https://doi.org/10.1186/s13054-018-2220-9.
18. Reeves JH, Butt WW, Layton JE, et al. Continuous plasmafiltration in sepsis syndrome. Plasmafiltration in Sepsis Study Group. Crit Care Med. 1999; 27(10):2096–104.
19. Ankawi G, Neri M, Zhang J, et al. Extracorporeal techniques for the treatment of critically ill patients with sepsis beyond conventional blood purification therapy: the promises and the pitfalls. Crit Care. 2018;22(1):262. https://doi.org/10.1186/s13054-018-2181-z.
20. Busund R, Lindsetmo RO, Rasmussen LT, Røkke O, et al. Tumor necrosis factor and interleukin 1 appearance in experimental gram-negative septic shock. The effects of plasma exchange with albumin and plasma infusion. Arch Surg. 1991;126(5):591–7.
21. Janbon B, Vuillez JP, Carpentier F, et al. Removal of circulating tumor necrosis factor. Its role in septic shock treatment. Ann Med Interne (Paris). 1992;143(Suppl 1):13–6.
22. Long EJ, Taylor A, Delzoppo, et al. A randomized controlled trial of plasma filtration in severe pediatric sepsis. Crit Care Resusc 2013;15(3): 198–204.
23. Barelli S, Alberio L. The role of plasma transfusion in massive bleeding: protecting the endothelial glycocalyx? Front Med (Lausanne). 2018;5:91. https://doi.org/10.3389/fmed.2018.00091.
24. Fortenberry JD, Nguyen T, Grunwell JR, et al. Therapeutic plasma exchange in children with thrombocytopenia-assicaiated multiple organ failure: the thrombocytopenia-associated multiple organ failure network prospective experience. Crit Care Med. 2019;47(3):e173–81.
25. Stegmayr BG, Banga R, Berggren L, et al. Plasma exchange as rescue therapy in multiple organ failure including acute renal failure. Crit Care. 2003;31(6):1730–6.
26. Hadem J, Hafer C, Schneider AS, et al. Therapeutic plasma exchange as rescue therapy in severe sepsis and septic shock: retrospective observational single-centre study of 23 patients. BMC Anesthesiol. 2014;14:24. https://doi. org/10.1186/1471-2253-14-24.
27. Rimmer E, Houston BL, Kumar A, et al. The efficacy and safety of plasma exchange in patients with sepsis and septic shock: a systematic review and meta-analysis. Crit Care. 2014;18:699.
28. Padmanabhan A, Connelly-Smith L, Aqui N, et al. Guidelines on the use of therapeutic apheresis in clinical practice – evidence-based approach from the writing committee of the American Society for Apheresis: the eight special issue. J Clin Apher. 2019;34(3):171–354.
29. Bakker J, Gris P, Coffernils M, et al. Serial blood lactate levels can predict the development of multiple organ failure following septic shock. Am J Surg. 1996;171(2):221–6.
30. Haas SA, Lange T, Saugel B, et al. Severe hyperlactatemia, lactate clearance and mortality in unselected critically ill patients. Intensive Care Med. 2016; 42(2):202–10.
31. Khurana D, Deoke SA. Thrombocytopenia in critically ill patient: clinical and laboratorial behavior and its correlation with short-term outcome during hospitalization. Indian J Crit Care Med. 2017;21(12):861–4.
32. Medam S, Zieleskiewicz L, Duclos G, et al. Risk factors for death in septic shock: a retrospective cohort study comparing trauma and non-trauma patients. Medicine (Baltimore). 2017;96(50):e9241.
33. Menard CE, Kumar A, Houston DS, et al. Evolution and impact of thrombocytopenia in septic shock: a retrospective cohort study. Crit Care Med. 2019;47(4):558–65.
34. Parker RI. Etiology and significance of thrombocytopenia in critically ill patients. Crit Care Clin. 2012;28(3):399–411.
35. Sanderson M, Chikhani M, Blyth E, et al. Predicting 30-day mortality in patients with sepsis: an exploratory analysis of process of care and patient characteristics. J Intensive Care Soc. 2018;19(4):299–304. https://doi.org/10. 1177/1751143718758975.
36. Song JE, Kim MH, Jeong WY, et al. Mortality risk factors for patients with septic shock after implementation of the surviving sepsis campaign bundles. Infect Chemother. 2016;48(3):199–208.
37. Ferreira FL, Bota DP, Bross A, et al. Serial evaluation of the SOFA score to predict outcome in critically ill patients. JAMA. 2001;286(14):1754–8.
38. Iba T, Arakawa M, Mochizuki K, et al. Usefulness of measuring changes in SOFA score for the prediction of 28-day mortality in patients with sepsisassociated disseminated intravascular coagulation. Clin Appl Thromb Hemos. 2019;25:1076029618824044.
39. Soo A, Zuege DJ, Fick GH, et al. Describing organ dysfunction in the intensive care unit: a cohort study of 20,000 patients. Crit Care. 2019;23:186. https://doi.org/10.1186/s13054-019-2459-9.
40. Boyd JH, Forbes J, Nakada TA, et al. Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med. 2011;39(2):259–65.
41. Kelm DJ, Perrin JT, Cartin-Ceba R, et al. Fluid overload in patients with severe sepsis and septic shock treated with early goal-directed therapy is associated with increased acute need for fluid-related medical interventions and hospital death. Shock. 2015;43(1):68–73.
42. Acheampong A, Vincent JL. A positive fluid balance is an independent prognostic factor in patients with sepsis. Crit Care. 2015;19:251.
43. van Mourik N, Metske HA, Hofstra JJ, et al. Cumulative fluid balance predicts mortality and increases time on mechanical ventilation in ARDS patients: an observational cohort study. PLoS One. 2019;14(10):e0224563.
44. Martin K, Borgel D, Lerolle N, et al. Decreased ADAMTS-13 (a disintegrin-like and metalloprotease with thrombospondin type 1 repeats) is associated with a poor prognosis in sepsis-induced organ failure. Crit Care Med. 2007; 35(10):2375–82. https://doi.org/10.1097/01.ccm.0000284508.05247.b3.
45. Investigators A, Group ACT, Peake SL, Delaney A, Bailey M, Bellomo R, et al.
Goal-directed resuscitation for patients with early septic shock. N Engl J Med. 2014;371(16):1496–506.
46. Yealy DM, Kellum JA, Huang DT, et al. A randomized trial of protocol-based care for early septic shock. N Engl J Med. 2014;370(18):1683–93.
47. Basic-Jukic N, Kes P, Glavas-Boras S, et al. Complications of therapeutic plasma exchange: experience with 4857 patients. Ther Apher Dial. 2005;9(5): 391–5.