Дополнительные методы лечения при менеджменте септического шока
Anaesthesia 2021
doi:10.1111/anae.15369
Обзор
Дополнительные методы лечения при менеджменте септического шока: нарративный обзор текущих доказательств
Перевод оригинальной статьи «Adjunctive treatments for the management of septic shock – a narrative review of the current evidence»
Авторы K. Donovan, A. Shah, J. Day, S. R. McKechnie
Oxford University Hospitals NHS Foundation Trust, Oxford, UK
Radcliffe Department of Medicine, University of Oxford, Oxford, UK
Ключевые слова: кортикостероиды, иммуномодуляция, сепсис, шок, витамин С
Keywords: corticosteroids; immunomodulation; sepsis; shock; vitamin C
Введение
Сепсис, определяемый как «угрожающая жизни органная дисфункция, вызванная нарушениями иммунного ответа на инфекцию», остается в глобальном масштабе тяжелым вызовом для здравоохранения [1]. В 2017 году было выявлено около 49 миллионов случаев сепсиса, 11 миллионов из которых закончились смертью [2]. Несмотря на то, что за последние годы наблюдается улучшение в выживаемости пациентов с сепсисом [3], летальность остается высокой [4, 5]. Все больше и больше приковывает внимание к себе долгосрочная заболеваемость у пациентов, выживших от сепсиса, в виде более высокой вероятности повторной госпитализации, развития новых функциональных нарушений, увеличения когнитивных нарушений (от среднетяжелых до тяжелых) и проблем с ментальным здоровьем [6].
Эпидемиология сепсиса является комплексной [7] и, похоже, что большую часть смертей от сепсиса невозможно было предотвратить, а причинами этого являются коморбидность и дряхлость (англ. frail), что присуще пациентам пожилого и старческого возраста со сниженными физиологическими резервами и исходно тяжелым состоянием здоровья (старческая астения) [8, 9]. Текущая парадигма менеджмента сепсиса сосредоточена на лечении основной инфекции, на постоянном контроле источника инфекции, на надлежащем проведении антимикробной терапии с одновременной поддержкой нарушенной органной функции (систем органов) путем введения жидкостей, вазопрессоров, проведения механической вентиляции и/или почечно-заместительной терапии. При этом множество целевых показателей терапии нарушенного иммунного ответа (англ. Host response) на сегодня не имеют доказательств высокого качества. При этом, за последние несколько лет увеличилось количество исследований, в которых изучаются дополнительные методы терапии сепсиса. Фокус нашего обзора - три метода дополнительной терапии, - витамин С, кортикостероиды и бета-блокаторы, - с описанием предполагаемых механизмов действия и текущих доказательств.
Стратегия поиска
Мы провели поиск имеющихся доказательств для кортикостероидов, витамина С и бета-блокаторов в базах данных MEDLINE, PubMed, Cochrane Central Register of Controlled Trials, EMBASE и Google Scholar.
Были проверены заголовки и аннотации, а все выявленные систематические обзоры, рандомизированные контролируемые исследования (РКИ), обсервационные исследования, обзорные статьи и текущие руководства по лечению были проверены на предмет дальнейшей соответствующей литературы. Поиск литературы был ограничен январем 2000 года, но при этом мы не исключали часто упоминаемые и высоко ценимые более старые публикации. На темы, которые представляют потенциальный интерес, но выходят за рамки настоящего обзора, мы оставили ссылки. Примеры ключевых слов для поиска: сепсис, септический шок, критическое заболевание, интенсивная терапия, аскорбиновая кислота, витамин С, клиническое исследование, гидрокортизон, стероиды, кортикостероиды, флудрокортизон, бета-блокаторы, катехоламины. К основным исследованиям, которые будут обсуждаться в этом обзоре, мы отнесли те, что оказали влияние на текущие клинические руководства, или окажут такое влияние в недалеком будущем.
Нарушения регуляции иммунного ответа (или ответа хозяина Host Response)
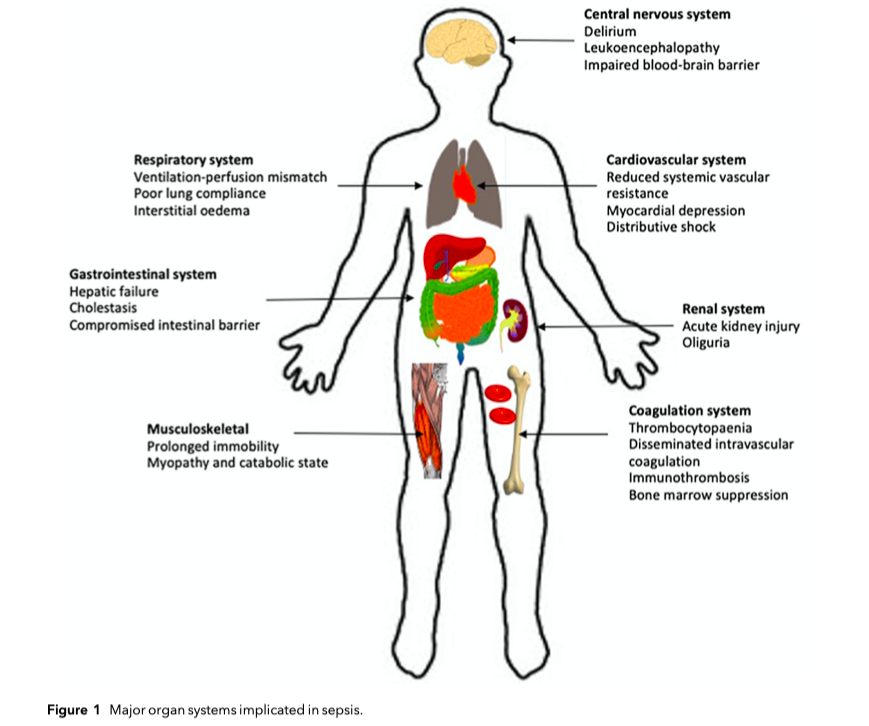
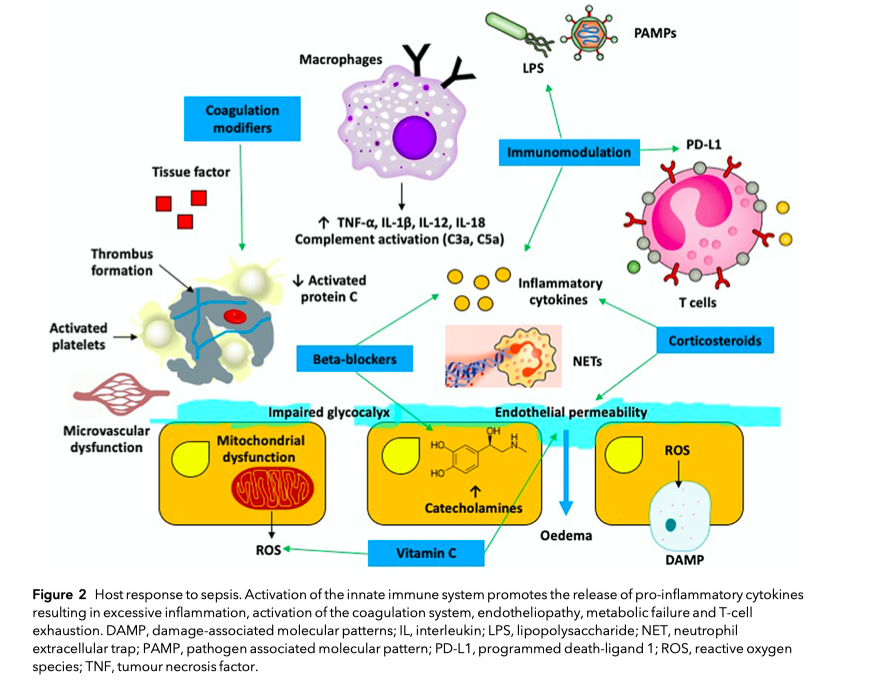
Органы и системы органов поражаются при сепсисе как показано на Рис.1. Принципы, лежащие в основе клеточных и молекулярных механизмов повреждения, что несут ответственность за органные нарушения, включают в себя иммунную дисфункцию, чрезмерное воспаление, метаболические нарушения и эндотелиопатию [10]. Все они сложны, динамичны по времени и зависят от факторов вирулентности вторгшегося патогена и факторов хозяина (к примеру, генетически обусловленная чувствительность). На Рис. 2 мы собрали все ключевые пути, которые могут служить целями дополнительной терапии, о которой мы будем говорить в этом обзоре. Для более детальной информации читатель может обратиться к обзорам, посвященным иммунопатологии при сепсисе (11—13].
Дисфункция иммунной системы и чрезмерный воспалительный ответ
Присутствие вторгшегося патогена вызывает ответ врожденной иммунной системы, опосредованный лейкоцитами и паренхиматозными клетками, такими как клетки эпителия и клетки эндотелия. Эти клетки определяют патоген-ассоциированные паттерны посредством расположенных на клеточной мембране паттерн-выявляющих рецепторов. Наиболее изученным из этих паттернов является липополисахарид, компонент внешней мембраны грамотрицательных бактерий. Другими примерами паттернов являются пептидогликаны, флагеллин и вирусная РНК [14]. Ответ врожденной иммунной системы, наряду с локальным высвобождением цитокинов и хемокинов, активирует систему коагуляции и восстановления тканей и часто этого достаточно для элиминации патогена без нарушения баланса нападения и защиты [15]. Но при определенных инфекциях происходит дисрегуляция ответа иммунной системы и этот ответ становится губительным. В этом случае целевые гены, кодирующие высвобождение таких цитокинов, как TNF-⍺, интерлейкины (IL)-1b, IL-12, Il-18, подвергаются избыточной регуляции. Все они могут вызывать программируемую воспалением смерть клетки, что, в свою очередь, приводит к высвобождению молекулярных паттернов (белков), связанных с повреждением - эндогенных молекул, высвобождаемых из поврежденных клеток. Все это еще больше активирует врожденную иммунную систему. Также провоспалительные цитокины несут ответственность за инициирование каскада других воспалительных цитокинов (к примеру, IL-6, IL-8) и хемокинов; за увеличение молекулярной адгезии и экспрессии хемокинами эндотелиальных клеток; за стимуляцию нейтрофилов к выпуску экстрацеллюлярных ловушек, что приводит к активации тромбоцитов [16]; за инициацию выпуска про-оксидантов и про-коагулянтов из микрочастиц [17]; за чрезмерную активацию тканевого фактора, что экспрессируется на моноцитах; и за активацию комплемента [18]. Сочетание активации тромбоцитов, чрезмерной активации тканевого фактора и высвобождения нейтрофилами экстрацеллюлярных ловушек приводит к формированию «иммунотромбозиса», когда патогены застревают в тромбах. Образуется порочный круг, при котором продолжается активация лейкоцитов и заканчивается все диссеминированной внутрисосудистой коагуляцией [19]. Сепсис также характеризуется истощением лимфоцитов с резким снижением CD4+ и CD8+ клеток, В-клеток и дендритных клеток [20]. Исследования показали, что CD4+ клетки, полученные от пациентов, умерших от сепсиса, способны увеличивать экспрессию мембранного белка программируемой смерти-1 (англ. programmed death-1 [PD-1]) [20] и его лиганд, PD-L1. Экспрессия PG-L1 независимо связана с увеличением 28-дневной летальности при септическом шоке [22].
Метаболические нарушения и эндотелиопатия
Метаболические нарушения характеризуются митохондриальной дисфункцией, чрезмерной генерацией активных форм кислорода, повреждением ДНК, резистентностью к инсулину и состоянием катаболизма [23—25]. Разрушение эндотелия также часто встречается при сепсисе, вызывается разрушением нормальных клеточных контактов (англ. cell-cell junctions), а результатом всего этого становится повреждение сосудов, вызываемое воспалением. Вовлеченные в этот процесс молекулы включают в себя тромбин, фактор роста эндотелия сосудов и матричную металлопротеиназу-1 [26]. Увеличение проницаемости вносит свой вклад в формирование отека и снижения микроваскулярной перфузии. Целостность эндотелия поддерживается тремя ключевыми путями антикоагуляции - протеином С, антитромбином и ингибитором пути тканевого фактора [27]. Активированный протеин С генерируется из протеина С на поверхности эндотелиальных клеток и способствует превращению тромбина в тромбомодулин [13]. При сепсисе уровень активированного протеина С снижается за счет нарушения синтеза протеина С в печени, увеличения его потребления и снижения экспрессии тромбомодулина.
Все большее признание получает мнение о том, что восстановление после инфекции является скоординированным набором активных процессов, а не только лишь нормализацией ответа иммунной системы. Пути противовоспалительных цитокинов, таких как IL-10, подавляют продукцию IL-6 и интерферона и было показано, что эти пути активируются уже в первые часы инфекции [10]. Аутофагия элиминирует молекулярные паттерны, связанные с патогеном и повреждением, что снижает активацию инфламмасом [28]. Однако, восстановление иммунной системы является сложным процессом и часто это восстановление занимает продолжительный период времени, так что большое количество пациентов после сепсиса продолжают испытывать воспаление, супрессию иммунной системы или оба этих явления вместе [29].
Витамин С
Витамин С является не только основным ко-фактором для множества ферментов, но и мощным внутриклеточным антиоксидантом, служа донором электрона во многих внутриклеточных реакциях [30]. Человек, как и другие приматы, потерял возможность эндогенного синтеза витамина С по причине мутации в гене GULO и, таким образом, полностью зависит от поступления витамина С извне, с приемом пищи [13]. В обычных условиях этого достаточно для удовлетворения физиологических потребностей в витамине С, а клинические проявления дефицита витамина С в нормальных условиях достаточно редки. Но у пациентов с критическими заболеваниями, особенно у пациентов с септическим шоком, обсервационные исследования показали острое снижение уровня витамина С [32, 33]. Несколько исследований показали, что степень дефицита витамина С прямо коррелирует с худшими клиническими исходами. Исследования на животных (витамин С при сепсисе), в которых использовались мыши линии GULO À/À, неспособные к эндогенному синтезу витамина С, показали, что дополнительное введение витамина С может улучшить функцию эндотелия и снизить летальность [34]. Но у человека только очень небольшое количество рандомизированных исследований показало, что дополнительное назначение витамина С в гетерогенной группе пациентов с критическими заболеваниями оказывает положительные эффекты на функцию лейкоцитов и сосудов, снижает длительность механической вентиляции легких и длительность вазопрессорной поддержки [35, 36].
Интерес к витамину С, как дополнения к стандартному лечению сепсиса, насчитывает несколько десятилетий, но только сейчас в преклинических исследованиях появляются доказательства биологической достоверности его применения [37, 38]. Предполагаемые механизмы воздействия: увеличение эндогенного синтеза норэпинефрина за счет воздействия на бета-гидроксилазу допамина [39]; ослабление окислительного стресса с последующим улучшением эндотелиальной функции, проницаемости и эффективности микроциркуляторного потока [40]; улучшение иммунной функции, что характеризуется пролиферацией лимфоцитов, усилением бактерицидного действия нейтрофилов и хемотаксисом [41]. На животных моделях (мыши) септического шока витамин С показал свою активность как бактериостатик [42]. Потенциальные дозозависимые неблагоприятные эффекты витамина С включают в себя почечное повреждение в виде нефропатии, вызванной оксалатом кальция, и снижение точности при измерении глюкозы в крови [40].
Широко растиражированные результаты одноцентрового обсервационного исследования 2017 года, проведенного Marik et al. [43], подстегнуло интерес к витамину С, в результате были проведены несколько больших рандомизированных контролируемых исследований, где тестированию подвергся «коктейль», восстанавливающий метаболизм (реанимирующий метаболизм), содержащий в себе витамин С, кортикостероиды и тиамин (витамин В1). Тиамин работает как важный ко-фактор клеточного метаболизма, облегчая конверсию пирувата в ацетилкоэнзим А для вхождения в цикл Кребса. Дополнительное введение тиамина показало улучшение клиренса лактата и сердечно-сосудистой стабильности в исследованиях на животных и человеке [44, 45]. Само исследование, проведенное Marik et al., было ретроспективным, «до-и после» исследованием, в котором пациентам, поступившим в отделение интенсивной терапии (ОИТ) с основным диагнозом тяжелый сепсис или септический шок, с уровнем прокальцитонина в сыворотке крови > 2 нг/мл, внутривенно вводились: витамин С (6 г/сутки), кортикостероиды (50 мг гидрокортизона каждые 6 часов) и тиамин (200 мг раза/сутки). В каждой группе, лечения и контроля, было по 47 пациентов. Частота смерти в группе лечения составила 8.5%, а в группе контроля - 40.4%, при этом не наблюдалось неблагоприятных событий. Другое исследование с аналогичным дизайном сообщило о подобных результатах у пациентов, находящихся в критическом состоянии с пневмонией [46]. Необходимо отметить, что исследование Marik et al. было одноцентровым, ретроспективным, обсервационным, а такой дизайн предполагает высокую подверженность систематической ошибке и завышению результатов терапии [47].
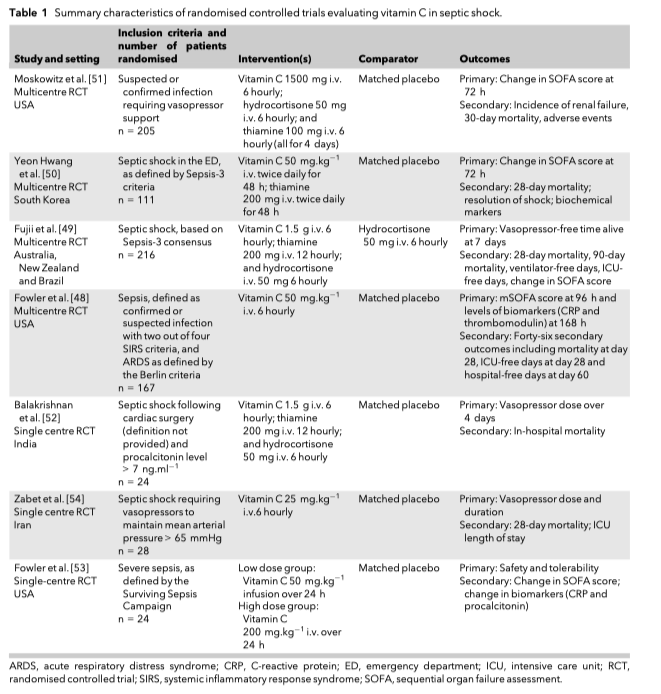
С того времени было проведено несколько рандомизированных контролируемых исследований витамина С при терапии сепсиса. Все результаты этих исследований показаны в Таблице 1 [48—54]. В этих исследованиях было показана безопасность и хорошая переносимость терапии витамином С, но не были показаны явные доказательства какой-либо пользы в отношении летальности. Два наиболее известных исследования, в которых изучалась роль витамина С при сепсисе, были многоцентровыми. Одно из них (CITRIS-ALI ) изучало эффекты от инфузии витамина С при сепсис-индуцированном повреждении легких [48], в другое - эффекты от комбинации витамина С, гидрокортизона и тиамина у пациентов с септическим шоком (VITAMINS) [49]. Исследование CITRIS-ALI было рандомизированным, двойным ослепленным, плацебо-контролируемым, всего 167 пациентов с сепсис-индуцированным острым респираторным дистресс-синдромом, которым проводилась инфузия витамина С (50 мг/кг в/в каждые шесть часов) или плацебо [48]. Не было найдено убедительных доказательств об эффективности витамина С как в контексте биохимических исходов (С-реактивный белок и тромбомодулин), так и в контексте клинических исходов (изменения при оценке по шкале последовательной оценки недостаточности органов [SOFA] на 96 час). Но вторичные исходы в этом исследовании были положительными. Пациенты в группе лечения витамином С имели меньшую 28-дневную летальность, большее количество свободных от вентилятора дней и более раннюю выписку из стационара по сравнению с группой плацебо, но мощность этого исследования не давала возможности более точно оценить эти изменения. Так что несмотря на то, что исследование было методологически надежным с низким риском систематической ошибки, результаты его следует интерпретировать с осторожностью. Исследование VITAMINS было открытым, в котором случайным образом 216 взрослых пациентов с септическим шоком распределялись в группу лечения комбинацией витамина С (1.5 г в/в каждые 6 часов), гидрокортизона (50 мг в/в каждые 6 часов) и тиамина (200 мг в/в каждые 12 часов) и в группу лечения только лишь гидрокортизоном [50 мг в/в каждые 6 часов) [55]. Не было явных доказательств эффекта от витамина С на первичные исходы в виде продолжительности жизни (англ. duration of time alive) и в свободных от вазопрессоров дней к седьмым суткам. Также не было найдено различий между группами в отношении 28-дневной и 90-дневной летальности. Несмотря на то, что открытый подход, использованный в этом исследовании, представляет риск смещения, маловероятно, что такое смещение будет в сторону нуля. Потенциал для критики этих двух исследований находится в относительно позднем начале интенсивной терапии сепсиса и в том, что более раннее начало лечения могло показать пользу.
Суммируя все вышесказанное, терапия витамином С имеет под собой биологическое обоснование, приемлемо в терминах простоты и стоимости, но доказательства эффективности здесь неубедительны [55]. Исследование VICTAS, в котором изучается витамин С, тиамин и стероиды при сепсисе (2000 пациентов), еще продолжается и, возможно, его результаты смогут изменить наше мнение [56]. Витамин С был добавлен в группе вмешательства продолжающегося рандомизированного, мультифакториального исследования внебольничной пневмонии (REMAP-CAP) у пациентов с тяжелой пневмонией, вызванной COVID-19 [57].
Важно заметить, что в проведенных исследованиях витамин С изучался как монотерапия, в разных дозах, так и как часть комбинации с тиамином и кортикостероидами. Комбинированный эффект и относительный вклад каждого из них не могут быть должным образом оценены с помощью обычного попарного мета-анализа, поэтому требуются альтернативные методы, такие как сетевой мета-анализ [58].
Кортикостероиды
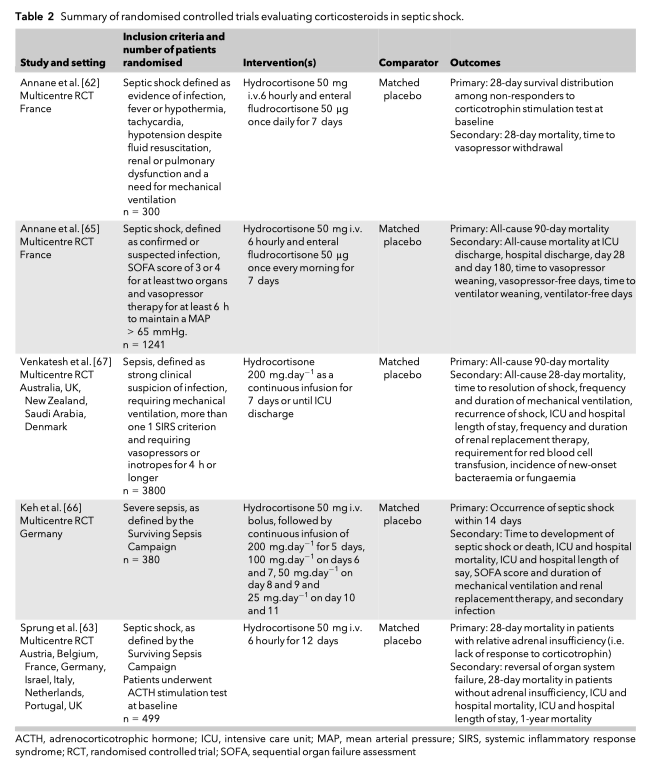
Существуют две основных причины для применения кортикостероидов при септическом шоке: иммуномодуляция и восстановление вазомоторного тонуса [59]. Также кортикостероиды могут снижать регуляцию провоспалительных цитокинов, включая сюда Il-6 и TNF-⍺, и подавлять активацию врожденной иммунной системы. Исследования высоких доз кортикостероидов как дополнительной терапии сепсиса, проведенные в 70-х и 80-х года прошлого столетия, показали и низкую эффективность такого подхода, и большой вред от него в контексте развития вторичных инфекций [60]. Но вот исследования последних двух десятилетий возродили интерес к низким дозам кортикостероидов. Активация гипоталамус-гипофиз-адреналовой системы при одновременной инактивации ферментов, расщепляющих кортизол, приводит к нормализации гиперкортизолемии, ассоциированной с ответом на стресс и на критическое состояние [61]. Существует гипотеза, что у части пациентов такой кортизоловый ответ может быть недостаточным для преодоления критического состояния и только экзогенное введение кортикостероидов может улучшить клинические исходы. Первым в современную эпоху большим рандомизированным исследованием кортикостероидов при сепсисе стала публикация Annane et al. [62] в 2002 году. В этом двойном-ослепленном, многоцентровом, контролируемом, рандомизированном исследовании случайным образом распределили участников, пациентов с септическим шоком, на две группы, в одной из которых вводился гидрокортизон 50 мг ежедневно каждые 6 часов с флудкортизоном 50 мг ежедневно, а в другой - плацебо. Для того, чтобы определить пациентов, у которых была относительная адреналовая недостаточность и которые могли получить лучший ответ на вмешательство, проводился кортикотропиновый тест. Это исследование показало улучшение распределения 28-дневной выживаемости (среднее время до смерти) и более быстрое разрешение шока среди пациентов, которые не ответили на кортикотропиновую стимуляцию, но которые оказались в группе вмешательства (которым проводили терапию кортикостероидами). Но не было показано разницы в 28-дневной летальности. Несмотря на хороший дизайн исследования и низкий риск систематической ошибки, применение в качестве исхода распределения выживаемости было подвергнуто критике, так выживаемость небольшого количества пациентов в течение небольшого количества дней могло генерировать существенную статистическую значимость, что не могло не иметь клинического значения. Исследование, проведенное Sprung et al. (терапия кортикостероидами септического шока — CORTICUS) [63] использовало ту же методологию при стратификации пациентов (ответ на кортикотропиновый тест). При этом данное исследование на показало какой-либо гетерогенности между респондерами и не-респондерами, да и пользы в контексте летальности в отношении применения стероидов также не показало. Недавние данные подняли вопрос о применимости кортикотропинового теста, учитывая большую вариабельность как между пациентами, так и между центрами [64]. Тем не менее, эти исследования подстегнули следующие шаги для изучения кортикостероидов при сепсисе и за последнее десятилетие несколько больших рандомизированных исследований внесли свой вклад в существенное увеличение доказательной базы применения кортикостероидов для лечения септического шока [63, 65–67]. Результаты этих исследований собраны в Таблице 2. Совсем недавно, в 2018 году, были опубликованы два больших исследования, одно из которых было посвящено дополнительной терапии критически больных пациентов с септическим шоком кортикостероидами (ADRENAL), проведенное Venkatesh et al. [67], а второе - активированному протеину С и кортикостероидам (APROCCHSS) и тоже при септическом шоке, которое проведено Annane et al.[65].
Annane et al. [65] опубликовали результаты двойного ослепленного, плацебо-контролируемого, многоцентрового рандомизированного контролируемого исследования APROCCHSS, в котором изучалась роль рекомбинантного активированного протеина С и кортикостероидов (гидрокортизон в сочетании с флудкортизоном) в лечении пациентов с септическим шоком. Исследование приостанавливалось дважды, сначала в период с октября 2011 года по май 2012 года по причине вывода с рынка активированного протеина С, а затем с июля 2014 года по октябрь 2014 года по запросу комиссии по мониторингу и безопасности для проверки качества применяемых в исследовании агентов. Авторы нашли, что кортикостероиды приводят к снижению 90-дневной летальности по сравнению с плацебо (264/614 (43.0%) против 308/627 (49.1%)). Количество свободных от вазопрессора дней так же было значительно больше в группе кортикостероидов по сравнению с группой плацебо (медиана (IQR) 23 дня (5–26) против 19 дней (1–26), p < 0.001), а также увеличивалось количество дней, свободных от органной недостаточности (19 дней (0–25) против 12 дней (0–24), p = 0.003).
Venkatesh et al. [67] провели двойное слепое плацебо-контролируемое, многоцентровое, рандомизированное контролируемое исследование ADRENAL, в которое было включено 3800 пациентов с септическим шоком из 69 отделений интенсивной терапии пяти стран. Пациенты случайным образом были распределены по группам, в одной из которых проводилась инфузия гидрокортизона, а в другой - плацебо. В отличие от исследования APROCCHSS, здесь не наблюдалось снижение 90-дневной летальности в группе гидрокортизона по сравнению с группой плацебо (511/1832 (27.9%) против 526/1826 (28.8%)). В тоже время, в этом исследовании удалось повторить результаты исследования APROCCHSS в виде более быстрого разрешения шока (медиана (IQR) 3 дня (2–5) против 4 дней (2–9); HR (95%CI), 1.32 (1.23–14.1), p < 0.001). Более того, у участников группы гидрокортизона наблюдалась более короткая медиана времени длительности механической вентиляции (6 дней (3–18) против 7 дней (3–24), HR (95%CI) 1.13 (1.05–1.22), p < 0.001), более короткая медиана времени до выписки из ОИТ (10 дней (5–30) против 12 дней (6–42); HR (95%CI) 1.14 (1.06–1.23), p < 0.001) и более низкие шансы к трансфузии (OR (95%CI) 0.82 (0.72–0.94), p = 0.004) по сравнению с группой плацебо.
Доступные доказательства из методологически корректных рандомизированных исследований показывают, что стероиды последовательно ускоряют разрешение шока, а результаты эти воспроизводимы [68]. Но вот более большого внимания требуют конфликтные результаты, касающиеся летальности [69]. К примеру, критерии включения в исследования в исследованиях Venkatesh et al. и Annane et al. различались. В исследовании Annane et al. пациенты имели больше баллов при оценке тяжести заболевания, требовали большего количества вазопрессоров и имели более высокие концентрации лактата. Возможно, что такие более тяжелые пациенты получали больше пользы и выгод от применения кортикостероидов, но post-hoc анализ чувствительности исследования Venkatesh et al, при котором использовались критерии включения из исследования Annane et al, не показал какого-либо эффекта от кортикостероидов в отношении 90-дневной летальности [70]. Выигрыш в летальности, показанный Annane et al. [65], может быть приписан одновременному с гидрокортизоном введению флюдкортизона. Флюдкортизон обладает свойствами как глюкортикоида, так и минералкортикоида, что превышает свойства гидрокортизона в 10 и в 125 раз соответственно, оказывая благоприятный эффект на регуляцию солевого и водного обмена, на состояние врожденной иммунной системы и на ослабление воспаления [71]. Другим возможным объяснением конфликтующих результатов в отношении летальности может послужить разный ответ на введение кортикостероидов среди пациентов с разными фенотипами сепсиса. При post-hoc анализе рандомизированного исследования VANISH, в котором оценивался вазопрессин против норэпинефрина при начальной терапии септического шока, исследователи Antcliffe et al. стратифицировали пациентов, основываясь на их траскриптомном фенотипе, и показали, что среди пациентов с сохраненным иммунным ответом на сепсис эндотип сигнатуры-2 была более высокая летальность при применении у них кортикостероидов по сравнению с теми пациентами, у которых наблюдалась относительная супрессия иммунного ответа на сепсис эндотипа сигнатуры-1 [72]. Более глубокий взгляд на фенотипирование показывает значительную гетерогенность среди пациентов, у которых применялись широко используемые и похожие критерии включения. Все это может поставить под сомнение валидность проведенных исследований за счет ослабления лечебного эффекта, делая само исследование недостаточно мощным (в контексте доказательств). Указанную выше проблему необходимо решить в будущих исследованиях, например, за счет использования «обогащенных» когорт. Исследование терапии COVID-19 «RECOVERY», проведенное Horby et al., показало впечатляющее снижение летальности при применении дексаметазона у пациентов с COVID-19 [73]. Это исследование имело две особенности, которые могут иметь отношение к разработке дизайна будущих исследований сепсиса. Во-первых, в силу самого заболевания группы вмешательства были относительно гомогенными (пациенты с вирусной пневмонией). Такая гомогенность в будущих исследованиях сепсиса может быть достигнута путем идентификации подгрупп пациентов на основании глубоких знаний фенотипирования. Во-вторых, пациенты включались в определенные группы исследования только в том случае, если они соответствовали критериям, что увеличивало вероятность увидеть лечебный эффект от этого лечения, тем самым максимизируя эффективность этих групп. Такой подход был назван «прогнозирующим обогащением».
Что же в итоге? Введение кортикостероидов может снизить риск смерти, но касательно выигрыша в отношении летальности результаты от исследования к исследованию продолжают конфликтовать. Похоже, что кортикостероиды последовательно ассоциируются с рядом клинически значимых вторичных исходов в виде более быстрого разрешения шока, снижения длительности механической вентиляции легких и более раннего перевода из ОИТ. Учитывая это,ишок, рефрактерный к интенсивной инфузионной терапии и начальному введению вазопрессоров, похоже является хорошим индикатором для принятия решения о лечении кортикостероидами, впрочем, такая рекомендация (правда слабая) уже существует в клиническом руководстве Surviving Sepsis Guidelines 2016 года [3]. Более свежие рекомендации, включившие в себя данные из исследований, проведенных Annane et al. и Venkatesh et al., предлагают слабые рекомендации для использования кортикостероидов у всех пациентов с сепсисом любой тяжести в целях снижения летальности [74].
Потенциальный вред, ассоциированный с применением кортикостероидов, включает в себя вторичные инфекции, гипернатриемию, гипергликемию, желудочно-кишечные кровотечения и нейромышечную слабость [68]. К примеру, Annane et al. сообщали о незначительной разнице между группами в частоте развития желудочно-кишечных кровотечений и вторичных инфекций, но было значительное повышение уровня глюкозы (высокая частота гиперглюкоземии с уровнем глюкозы> 8.3 ммоль/л) среди тех, кто получал стероиды (89%) против тех, кто стероиды не получал ((83%, OR (95%CI) 1.07 (1.03–1.12)). Venkatesh et al. сообщили о высокой частоте композитного неблагоприятного эффекта у тех, кто получал стероиды (1.1% vs. 0.3%), но серьезные неблагоприятные эффекты были редкими. В этом исследовании были описаны три инцидента с миопатией среди 1800 пациентов, получивших кортикостероиды. Частота развития новой бактериемии, фунгаемии, кровотечения была существенно между группами не различалась.
Бета-адреноблокаторы
Активация симпатической нервной системы — ключевая часть физиологического ответа на сепсис, обеспечивающая такой уровень сердечного выброса и системного сосудистого тонуса, который позволяет сохранить достаточную перфузию органов-мишеней. Чрезмерная же активация симпатической нервной системы ведет к развитию дисфункции сердечной деятельности, что проявляется либо как сепсис-индуцированная кардиомиопатия и диастолическая дисфункция [75, 76], либо как впервые выявленная фибрилляция предсердий [77], каждая из которых ассоциируется с увеличением летальности. Лежащие в основе развития этих осложнений патофизиологические механизмы включают в себя: митохондриальную дисфункцию, вторичную к активным формам кислорода и оксида азота; миокардиальную депрессию за счет прямого воздействия воспалительных цитокинов; нарушения потока крови в коронарных артериях; нарушения гомеостаза кальция [75] и развития бета-адренэргической дисфункции. Сохраняющаяся симпатическая стимуляция ведет к нарушениям бета-андренергических путей и к снижению регуляции бета-адренергических рецепторов миокарда [78, 79]. Все эти процессы часто сопровождаются системной органной дисфункцией и чрезмерной регуляцией путей воспаления и про-коагуляции [80], что еще больше усугубляется при экзогенном введении катехоламинов.
У пациентов с сепсисом и тахикардией, которая сохраняется несмотря на адекватную интенсивную инфузионную терапию, как правило очень неблагоприятный прогноз [81]. Это может быть связано с нарушениями диастолического заполнения, снижением времени коронарной перфузии и увеличением частоты развития аритмий. Все это делает тахикардию важной терапевтической целью при менеджменте сепсиса. Бета-блокаторы, и в первую очередь селективные бета-1-антагонисты, уже показали свою важную роль при менеджменте сердечной недостаточности со сниженной фракцией изгнания, когда снижение активности симпатических нервов с одновременным снижением частоты сердечных сокращений (ЧСС) приводит к улучшению диастолической функции и предупреждает увеличение уровня катехоламинов [82]. На животных моделях сепсис-индуцированной кардиальной дисфункции лечение инфузией есмолола показало улучшение сердечной функции, снижение ЧСС и артериального давления (АД) одновременно со снижением уровня воспалительных цитокинов [83, 84]. В исследованиях на человеке имеются доказательства того, что блокада бета-адренорецепторов может улучшить диастолическую функцию и снизить частоту развития аритмии среди пациентов, находящихся в критическом состоянии, а продолженная бета-блокада во время сепсиса ассоциировалась со снижением летальности [85]. Morelli et al. [86] первыми провели рандомизированное исследование терапии бета-блокаторами у пациентов с септическим шоком. Это было открытое, исследование 2 фазы, в котором первичной точкой служило снижение ЧСС ниже 95 ударов в минуту. Исследование было недостаточно мощным для оценки влияния терапии на заболеваемость и летальность. Сто пятьдесят четыре пациента с септическим шоком, которым требовались высокие дозы норадреналина для поддержания среднего артериального давления (САД) свыше 65 мм Hg и с сохраняющейся тахикардией (ЧСС> 95/мин), несмотря на адекватную интенсивную инфузионную терапию, были случайным образом распределены в группу эсмолола (постоянная инфузия) и в группу плацебо. Целевым значением стало ЧСС, равное 80—94 уд/мин. Инфузия эсмолола начиналась с 25 мг/час, с последующим титрованием дозы до 50 мг/час с интервалом 20 минут до достижения целевого значения ЧСС. Инфузия эсмолола продолжалась до перевода пациента из ОИТ, или смерти пациента, а ограничение по режиму дозирования составляло 2000 мг/час. У всех пациентов из группы эсмолола удалось достигнуть целевого значения ЧСС, при этом на фоне инфузии эсмолола увеличивался индекс ударного объема с одновременным снижением потребности в инфузионной терапии и потребности в норэпинефрине. Авторы сообщили о значительном снижении летальности у пациентов из группы эсмолола по сравнению с пациентами из группы плацебо (38/77 (49.4%) против 62/77 (80.5%), p <0.001), при этом не наблюдалось неблагоприятных эффектов и сомнений в безопасности терапии эсмололом. Несмотря на такие выгоды в отношении выживаемости, все-таки это было не ослепленное одноцентровое исследование, подверженное большому риску систематической ошибки. Внешняя валидация этого исследования ограничена высокой летальностью в контрольной группе и широким применением левосимендана в обеих группах.
С тех пор были проведено несколько рандомизированных исследований с физиологическими конечными точками, к примеру, исследование Kakihana et al. [87]. Все эти исследования, подкрепленные небольшими проспективными нерандомизированными исследованиями, показали, что бета-блокада при сепсисе успешно снижает частоту сердечных сокращений при сохранении сердечного индекса и систолической функции. Однако отсутствуют качественные рандомизированные данные о результатах, ориентированных на пациента, и все еще сохраняется неопределенность в отношении оптимальной целевой частоты сердечных сокращений.
Ключевой задачей при назначении бета-блокаторов пациентам, находящимся в критическом состоянии, является идентификация именно тех пациентов, у которых назначение бета-блокаторов вызовет декомпенсацию гемодинамики. Для минимизации риска бета-блокаторы следует применять только у пациентов, которым проведена адекватная интенсивная инфузионная терапия. Идентификация пациентов с фиксированным ударным объемом, при котором невозможно поддерживать сердечный выброс в контексте снижения ЧСС бета-блокаторами, является очень и очень сложной задачей. Использование в этих целях разницы систолическо-дикротического давления, что позволяет определить ту группу пациентов с риском декомпенсации, возможно и позволит решить задачу снижения риска при назначении бета-блокаторов, но этот метод еще не получил широкого распространения [88].
В дополнение к прямым кардиальным эффектам бета-блокаторы известны еще и своими не-кардиальными эффектами, которые могут принести пользу при сепсисе, и к ним можно отнести снижение продукции воспалительных цитокинов, улучшение гомеостаза глюкозы, снижение катаболизма и благоприятное влияние на коагуляцию [75].
В общем и целом, доказательств для рекомендаций к рутинному применению бета-блокаторов при септическом шоке явно недостаточно. Результаты четырех продолжающихся рандомизированных исследований (ESMOSEPSIS - эффекты эсмолола на сердце и воспаление при септическом шоке(NCT02068287); THANE - гемодинамическая толерантность и антивоспалительные эффекты есмолола при терапии септического шока (NCT02120404); STRESS-L - разрешение септического шока ландиололом (ISRCTN12600919); LANDI-SEP (EudraCT 2017002138-22)) возможно приведут к нашему лучшему пониманию эффектов от бета-блокаторов на гемодинамику, функцию иммунной системы и летальности.
Применение на практике
Главными принципами лечения сепсиса остаются интенсивная инфузионная терапия, своевременное назначение адекватной антимикробной терапии и контроль за источником инфекции [3]. На сегодня есть доказательства роли кортикостероидов как дополнительной терапии сепсиса и в современных клинических руководствах есть рекомендации по применению кортикостероидов, но уровень доказательств низкий [74]. Также нет на сегодня доказательств высокого качества по применению витамина С и бета-блокаторов при сепсисе, но мы все ждем результатов продолжающихся исследований.
Список литературы:
1. Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). Journal of the American Medical Association 2016; 315: 801–10.
2. Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990–2017: analysis for the Global Burden of Disease Study. Lancet 2020; 395: 200–11.
3. De Backer D, Dorman T. Surviving Sepsis Guidelines: a continuous move toward better care of patients with sepsis. Journal of the American Medical Association 2017; 317: 807–8.
4. Shankar-Hari M, Harrison DA, Rubenfeld GD, Rowan K. Epidemiology of sepsis and septic shock in critical care units: comparison between sepsis-2 and sepsis-3 populations using a national critical care database. British Journal of Anaesthesia 2017; 119: 626–36.
5. Szakmany T, Pugh R, Kopczynska M, et al. Defining sepsis on the wards: results of a multi-centre point-prevalence study comparing two sepsis definitions. Anaesthesia 2018; 73: 195–204.
6. Meyer N, Harhay MO, Small DS, et al. Temporal trends in incidence, sepsis-related mortality, and hospital-based acute care after sepsis. Critical Care Medicine 2018; 46: 354–60.
7. Angus DC, van der Poll T. Severe sepsis and septic shock. New England Journal of Medicine 2013; 369: 840–51.
8. Singer M, Inada-Kim M, Shankar-Hari M. Sepsis hysteria: excess hype and unrealistic expectations. Lancet 2019; 394: 1513–4.
9. Ferrante LE, Pisani MA, Murphy TE, Gahbauer EA, Leo-Summers LS, Gill TM. Factors associated with functional recovery among older intensive care unit survivors. American Journal of Respiratory and Critical Care Medicine 2016; 194: 299–307.
10. Gotts JE, Matthay MA. Sepsis: pathophysiology and clinical management. British Medical Journal 2016; 353: i1585.
11. Rittirsch D, Flierl MA, Ward PA. Harmful molecular mechanisms in sepsis. Nature Reviews Immunology 2008; 8: 776–87.
12. Lelubre C, Vincent JL. Mechanisms and treatment of organ failure in sepsis. Nature Reviews Nephrology 2018; 14: 417–27.
13. van der Poll T, van de Veerdonk FL, Scicluna BP, Netea MG. The immunopathology of sepsis and potential therapeutic targets. Nature Reviews Immunology. 2017; 17: 407–20.
14. Mogensen TH. Pathogen recognition and inflammatory signaling in innate immune defenses. Clinical Microbiology Reviews 2009; 22: 240–73.
15. Takeuchi O, Akira S. Pattern recognition receptors and inflammation. Cell 2010; 140: 805–20.
16. Martinod K, Wagner DD. Thrombosis: tangled up in NETs. Blood 2014; 123: 2768–76.
17. Reid VL, Webster NR. Role of microparticles in sepsis. British Journal of Anaesthesia 2012; 109: 503–13.
18. Ward PA, Gao H. Sepsis, complement and the dysregulated inflammatory response. Journal of Cellular and Molecular Medicine 2009; 13: 4154–60.
19. Engelmann B, Massberg S. Thrombosis as an intravascular effector of innate immunity. Nature Reviews Immunology 2013; 13: 34–45.
20. Hotchkiss RS, Monneret G, Payen D. Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy. Nature Reviews Immunology 2013; 13: 862–74.
21. Boomer JS, To K, Chang KC, et al. Immunosuppression in patients who die of sepsis and multiple organ failure. Journal of the American Medical Association 2011; 306: 2594–605.
22. Shao R, Fang Y, Yu H, Zhao L, Jiang Z, Li CS. Monocyte programmed death ligand-1 expression after 3–4 days of sepsis is associated with risk stratification and mortality in septic patients: a prospective cohort study. Critical Care 2016; 20:124.
23. Brealey D, Brand M, Hargreaves I, et al. Association between mitochondrial dysfunction and severity and outcome of septic shock. Lancet 2002; 360: 219–23.
24. Puthucheary ZA, Rawal J, McPhail M, et al. Acute skeletal muscle wasting in critical illness. Journal of the American Medical Association 2013; 310: 1591–600.
25. Nunnally ME. Sepsis for the anaesthetist. British Journal of Anaesthesia 2016; 117: iii44–51.
26. Tressel SL, Kaneider NC, Kasuda S, et al. A matrix metalloprotease-PAR1 system regulates vascular integrity, systemic inflammation and death in sepsis. EMBO Molecular Medicine 2011; 3: 370–84.
27. Kerschen EJ, Fernandez JA, Cooley BC, et al. Endotoxemia and sepsis mortality reduction by non-anticoagulant activated protein C. Journal of Experimental Medicine 2007; 204: 2439–48.
28. Deretic V, Saitoh T, Akira S. Autophagy in infection, inflammation and immunity. Nature Reviews Immunology 2013; 13: 722–37.
29. Carson WF, Cavassani KA, Dou Y, Kunkel SL. Epigenetic regulation of immune cell functions during post-septic immunosuppression. Epigenetic 2011; 6: 273–83.
30. May JM, Harrison FE. Role of vitamin C in the function of the vascular endothelium. Antioxidants and Redox Signaling 2013; 19: 2068–83.
31. Drouin G, Godin JR, Page B. The genetics of vitamin C loss in vertebrates. Current Genomics 2011; 12: 371–8.
32. Long CL, Maull KI, Krishnan RS, et al. Ascorbic acid dynamics in the seriously ill and injured. Journal of Surgical Research 2003; 109: 144–8.
33. Carr AC, Rosengrave PC, Bayer S, Chambers S, Mehrtens J, Shaw GM. Hypovitaminosis C and vitamin C deficiency in critically ill patients despite recommended enteral and parenteral intakes. Critical Care 2017; 21: 300.
34. Fisher BJ, Kraskauskas D, Martin EJ, et al. Attenuation of sepsisinduced organ injury in mice by vitamin C. Journal Parenteral and Enteral Nutrition 2014; 38: 825–39.
35. Ferron-Celma I, Mansilla A, Hassan L, et al. Effect of vitamin C administration on neutrophil apoptosis in septic patients after abdominal surgery. Journal of Surgical Research 2009; 153: 224–30.
36. Wang Y, Lin H, Lin BW, Lin JD. Effects of different ascorbic acid doses on the mortality of critically ill patients: a meta-analysis. Annals of Intensive Care 2019; 9: 58.
37. Fisher BJ, Kraskauskas D, Martin EJ, et al. Mechanisms of attenuation of abdominal sepsis induced acute lung injury by ascorbic acid. American Journal of Physiology-Lung Cellular and Molecular Physiology 2012; 303: L20–32.
38. Fisher BJ, Seropian IM, Kraskauskas D, et al. Ascorbic acid attenuates lipopolysaccharide-induced acute lung injury. Critical Care Medicine 2011; 39: 1454–60.
39. Carr AC, Shaw GM, Fowler AA, Natarajan R. Ascorbatedependent vasopressor synthesis: a rationale for vitamin C administration in severe sepsis and septic shock? Critical Care 2015; 19: 418.
40. Kuhn SO, Meissner K, Mayes LM, Bartels KC. Vitamin C in sepsis. Current Opinion in Anaesthesiology 2018; 31: 55–60.
41. Marik PE. Hydrocortisone, ascorbic acid and thiamine (HAT Therapy) for the treatment of sepsis. Focus on ascorbic acid. Nutrients 2018; 10: 11.
42. Armour J, Tyml K, Lidington D, Wilson JX. Ascorbate prevents microvascular dysfunction in the skeletal muscle of the septic rat. Journal of Applied Physiology 2001; 90: 795–803.
43. Marik PE, Khangoora V, Rivera R, Hooper MH, Catravas J. Hydrocortisone, vitamin C, and thiamine for the treatment of severe sepsis and septic shock: a retrospective before-after study. Chest 2017; 151: 1229–38.
44. Lindenbaum GA, Larrieu AJ, Carroll SF, Kapusnick RA. Effect of cocarboxylase in dogs subjected to experimental septic shock. Critical Care Medicine 1989; 17: 1036–40.
45. Donnino MW, Andersen LW, Chase M, et al. Randomized, double-blind, placebo-controlled trial of thiamine as a metabolic resuscitator in septic shock: a pilot study. Critical Care Medicine 2016; 44: 360–7.
46. Kim WY, Jo EJ, Eom JS, et al. Combined vitamin C, hydrocortisone, and thiamine therapy for patients with severe pneumonia who were admitted to the intensive care unit: propensity score-based analysis of a before-after cohort study. Journal of Critical Care 2018; 47: 211–8.
47. Bafeta A, Dechartres A, Trinquart L, Yavchitz A, Boutron I, Ravaud P. Impact of single centre status on estimates of intervention effects in trials with continuous outcomes: metaepidemiological study. British Medical Journal 2012; 344: e813.
48. Fowler AA 3rd, Truwit JD, Hite RD, et al. Effect of vitamin C infusion on organ failure and biomarkers of inflammation and vascular injury in patients with sepsis and severe acute respiratory failure: the CITRIS-ALI randomized clinical trial. Journal of the American Medical Association 2019; 322: 1261– 70.
49. Fujii T, Luethi N, Young PJ, et al. Effect of vitamin C, hydrocortisone, and thiamine vs hydrocortisone alone on time alive and free of vasopressor support among patients with septic shock: the VITAMINS randomized clinical trial. Journal of the American Medical Association 2020; 323: 423–31.
50. Hwang SY, Ryoo SM, Park JE, et al. Combination therapy of vitamin C and thiamine for septic shock: a multi-centre, doubleblinded randomized, controlled study. Intensive Care Medicine 2020; 46: 2015–25.
51. Moskowitz A, Huang DT, Hou PC, et al. Effect of ascorbic acid, corticosteroids, and thiamine on organ injury in septic shock: the ACTS randomized clinical trial. Journal of the American Medical Association 2020; 324: 642–50.
52. Balakrishnan M, Gandhi H, Shah K, et al. Hydrocortisone, Vitamin C and thiamine for the treatment of sepsis and septic shock following cardiac surgery. Indian Journal of Anaesthesia 2018; 62: 934–9.
53. Fowler AA 3rd, Syed AA, Knowlson S, et al. Phase I safety trial of intravenous ascorbic acid in patients with severe sepsis. Journal of Translational Medicine 2014; 12: 32.
54. Zabet MH, Mohammadi M, Ramezani M, Khalili H. Effect of highdose ascorbic acid on vasopressor’s requirement in septic shock. Journal of Pharmacy Research and Practice 2016; 5: 94–100.
55. Putzu A, Daems AM, Lopez-Delgado JC, Giordano VF, Landoni G. The effect of vitamin C on cinical outcome in critically ill patients: a systematic review with meta-analysis of randomized controlled trials. Critical Care Medicine 2019; 47: 774–83.
56. Hager DN, Hooper MH, Bernard GR, et al. The Vitamin C, Thiamine and Steroids in Sepsis (VICTAS) protocol: a prospective, multi-center, double-blind, adaptive sample size, randomized, placebo-controlled, clinical trial. Trials 2019; 20: 197.
57. Angus DC, Berry S, Lewis RJ, et al. The Randomized Embedded Multifactorial Adaptive Platform for Community-acquired Pneumonia (REMAP-CAP) Study: rationale and design. Annals of the American Thoracic Society 2020; 17: 879–91.
58. Fujii T, Belletti A, Carr A, et al. Vitamin C therapy for patients with sepsis or septic shock: a protocol for a systematic review and a network meta-analysis. British Medical Journal Open 2019; 9: e033458.
59. Grover V, Handy JM. The role of steroids in treating septic shock. Anaesthesia 2012; 67: 103–6.
60. Lefering R, Neugebauer EA. Steroid controversy in sepsis and septic shock: a meta-analysis. Critical Care Medicine 1995; 23: 1294–303.
61. Boonen E, Vervenne H, Meersseman P, et al. Reduced cortisol metabolism during critical illness. New England Journal of Medicine 2013; 368: 1477–88.
62. Annane D, Sebille V, Charpentier C, et al. Effect of treatment with low doses of hydrocortisone and fludrocortisone on mortality in patients with septic shock. Journal of the American Medical Association 2002; 288: 862–71.
63. Sprung CL, Annane D, Keh D, et al. Hydrocortisone therapy for patients with septic shock. New England Journal of Medicine 2008; 358: 111–24.
64. Cohen J, Ward G, Prins J, Jones M, Venkatesh B. Variability of cortisol assays can confound the diagnosis of adrenal insufficiency in the critically ill population. Intensive Care Medicine 2006; 32: 1901–5.
65. Annane D, Renault A, Brun-Buisson C, et al. Hydrocortisone plus fludrocortisone for adults with septic shock. New England Journal of Medicine 2018; 378: 809–18.
66. Keh D, Trips E, Marx G, et al. Effect of hydrocortisone on development of shock among patients with severe sepsis: the HYPRESS randomized clinical trial. Journal of the American Medical Association 2016; 316: 1775–85.
67. Venkatesh B, Finfer S, Cohen J, et al. Adjunctive glucocorticoid therapy in patients with septic shock. New England Journal of Medicine 2018; 378: 797–808.
68. Rochwerg B, Oczkowski SJ, Siemieniuk RAC, et al. Corticosteroids in sepsis: an updated systematic review and meta-analysis. Critical Care Medicine 2018; 46: 1411–20.
69. Annane D. Why my steroid trials in septic shock were "positive". Critical Care Medicine 2019; 47: 1789–93.
70. Venkatesh B, Finfer S, Cohen J, et al. Hydrocortisone compared with placebo in patients with septic shock satisfying the sepsis-3 diagnostic criteria and APROCCHSS study inclusion criteria: a post hoc analysis of the ADRENAL trial. Anesthesiology 2019; 131: 1292–300.
71. Heming N, Sivanandamoorthy S, Meng P, Bounab R, Annane D. Immune effects of corticosteroids in sepsis. Frontiers in Immunology 2018; 9: 1736.
72. Antcliffe DB, Burnham KL, Al-Beidh F, et al. Transcriptomic signatures in sepsis and a differential response to steroids. From the VANISH randomized trial. American Journal of Respiratory and Critical Care Medicine 2019; 199: 980–6.
73. RECOVERY Collaborative Group. Dexamethasone in hospitalized patients with Covid-19 – preliminary report. New England Journal of Medicine 2020. Epub 17 July. https://doi. org/10.1056/NEJMoa2021436.
74. Lamontagne F, Rochwerg B, Lytvyn L, et al. Corticosteroid therapy for sepsis: a clinical practice guideline. British Medical Journal 2019; 362: k3284.
75. Suzuki T, Suzuki Y, Okuda J, et al. Sepsis-induced cardiac dysfunction and beta-adrenergic blockade therapy for sepsis. Journal of Intensive Care 2017; 5: 22.
76. Sanfilippo F, Corredor C, Fletcher N, et al. Diastolic dysfunction and mortality in septic patients: a systematic review and metaanalysis. Intensive Care Medicine 2015; 41: 1004–13.
77. Kuipers S, Klein Klouwenberg PM, Cremer OL. Incidence, risk factors and outcomes of new-onset atrial fibrillation in patients with sepsis: a systematic review. Critical Care 2014; 18: 688.
78. Rudiger A, Singer M. Mechanisms of sepsis-induced cardiac dysfunction. Critical Care Medicine 2007; 35: 1599–608.
79. Tang C, Liu MS. Initial externalization followed by internalization of beta-adrenergic receptors in rat heart during sepsis. American Journal of Physiology 1996; 270: R254–263.
80. de Montmollin E, Aboab J, Mansart A, Annane D. Bench-tobedside review: beta-adrenergic modulation in sepsis. Critical Care 2009; 13: 230.
81. Domizi R, Calcinaro S, Harris S, et al. Relationship between norephinephrine dose, tachycardia and outcome in septic shock: a multicentre evaluation. Journal of Critical Care 2020; 57: 185–90.
82. Satwani S, Dec GW, Narula J. Beta-adrenergic blockers in heart failure: review of mechanisms of action and clinical outcomes. Journal of Cardiovascular Pharmacology and Therapeutics 2004; 9: 243–55.
83. Suzuki T, Morisaki H, Serita R, et al. Infusion of the betaadrenergic blocker esmolol attenuates myocardial dysfunction in septic rats. Critical Care Medicine 2005; 33: 2294–301.
84. Hagiwara S, Iwasaka H, Maeda H, Noguchi T. Landiolol, an ultrashort-acting beta1-adrenoceptor antagonist, has protective effects in an LPS-induced systemic inflammation model. Shock 2009; 31: 515–20.
85. Fuchs C, Wauschkuhn S, Scheer C, et al. Continuing chronic beta-blockade in the acute phase of severe sepsis and septic shock is associated with decreased mortality rates up to 90 days. British Journal of Anaesthesia 2017; 119: 616–25.
86. Morelli A, Ertmer C, Westphal M, et al. Effect of heart rate control with esmolol on hemodynamic and clinical outcomes in patients with septic shock: a randomized clinical trial. Journal of the American Medical Association 2013; 310: 1683–91.
87. Kakihana Y, Nishida O, Taniguchi T, et al. Efficacy and safety of landiolol, an ultra-short acting B1 -selective antagonist, for treatment of sepsis-related tachyarrhythmia (J-Land 3S): a multicentre, open-label, randomised controlled trial. Lancet Respiratory Medicine 2020; 8: 863–72.
88. Morelli A, Romano SM, Sanfilippo S, et al. Systolic-dicrotic notch pressure difference can identify patients with septic shock at risk of cardiovascular decompensation in case of heart rate reduction. British Journal of Anaesthesia 2020; 125: 1018–24.
89. National Heart L, Blood Institute PCTN, Ginde AA, et al. Early high-dose vitamin D3 for critically Ill, vitamin D-deficient patients. New England Journal of Medicine 2019; 381: 2529–40.
90. Rygard SL, Jonsson AB, Madsen MB, et al. Effects of shorter versus longer storage time of transfused red blood cells in adult ICU patients: a systematic review with meta-analysis and Trial Sequential Analysis. Intensive Care Medicine 2018; 44: 204–17.
91. Kalil AC. Lack of benefit of high-dose vitamin C, thiamine, and hydrocortisone combination for patients with sepsis. Journal of the American Medical Association 2020; 323: 419–20.
92. Davies R, O’Dea K, Gordon A. Immune therapy in sepsis: are we ready to try again? Journal of the Intensive Care Society 2018; 19: 326–44.
93. Yamakawa K, Murao S, Aihara M. Recombinant human soluble thrombomodulin in sepsis-induced coagulopathy: an updated systematic review and meta-analysis. Thrombosis and Haemostasis 2019; 119: 56–65.
94. Shankar-Hari M, Harrison DA, Rowan KM, Rubenfeld GD.Estimating attributable fraction of mortality from sepsis to inform clinical trials. Journal of Critical Care 2018; 45: 33–9.
95. Seymour CW, Kennedy JN, Wang S, et al. Derivation, validation, and potential treatment implications of novel clinical phenotypes for sepsis. Journal of the American Medical Association 2019; 321: 2003–17.
96. Stanski NL, Wong HR. Prognostic and predictive enrichment in sepsis. Nature Reviews Nephrology 2020; 16: 20–31.
97. Shankar-Hari M, Rubenfeld GD. The use of enrichment to reduce statistically indeterminate or negative trials in critical care. Anaesthesia 2017; 72: 560–5.
98. Perner A, Gordon AC, Angus DC, et al. The intensive care medicine research agenda on septic shock. Intensive Care Medicine 2017; 43: 1294–305.
Anaesthesia 2021