Бактерия и сепсис: микробиом во спасение?
Journal of Clinical Medicine
https://doi.org/10.3390/ jcm10163578
Обзор
Бактерия и сепсис: микробиом во спасение?
Перевод оригинальной статьи «Bacteria and Sepsis: Microbiome to the Rescue?»
Авторы: Hansol Kang, Ryan M. Thomas
University of Florida College of Medicine, Gainesville, FL 32610, USA;
Department of Surgery, University of Florida College of Medicine, Gainesville, FL 32610, USA
Department of Molecular Genetics and Microbiology,
University of Florida College of Medicine, Gainesville, FL 32610, USA North Florida/South Georgia Veterans Heath System, Gainesville, FL 32608, USA
1. Введение
Согласно оценкам, около 1.7 миллиона пациентов в США ежегодно становятся жертвами сепсиса, который определяется как угрожающая жизни органная дисфункция, вызываемая дисрегуляцией иммунного ответа (ответа хозяина) на инфекцию [1]. Лечение пациентов с сепсисом накладывает существенное финансовое бремя на систему здравоохранения и, в среднем, около 6.2% от всех затрат в США приходится на обеспечение лечения пациентов с сепсисом [2]. К тому же нельзя не учитывать и возраст пациентов с сепсисом, медиана которого составляет 67 лет [3], так что существует значительное количество людей, кто либо погибает от сепсиса, либо не имеет возможности вернуться к работе по причине долгосрочных осложнений сепсиса, что все вместе ведет к существенным социальным издержкам [4]. Несмотря на то, что достижения в терапии критических состояний и привели к улучшению выживаемости, остается большая пропорция пациентов, и в большей своей части это касается пациентов пожилого и старческого возраста, у которых клинические исходы не улучшаются [5—7]. Становится понятно, что критически важно определить те факторы, что оказывают влияние на наблюдения, указанные выше.
Микробиом можно охарактеризовать как сообщество микробов (и связанный с этим метагеном), содержащий в себе бактерии, вирусы, грибы, археи и простейшие, что которые создают симбиотические, патобионтные и комменсальные отношения со своим хозяином. Микробиота относится к конкретным видам микробов, которые создают структурированные сообщества. Исследования микробиома при различных болезненных состояниях открыли его важнейшую роль как в обеспечении здоровья, так и в развитие болезней [8, 9]. Совсем недавно стали появляться исследования, показывающие роль микробиома в модуляции клинических исходов у пациентов с сепсисом [10]. Принимая во внимание текущее плато в вариантах лечения пациентов с сепсисом, идентификация или модуляция факторов, связанных с хозяином, при развитии сепсиса, может помочь в выявлении пациентов с риском более худшего исхода и обеспечить необходимое клиническое преимущество при лечении данной группы пациентов.
В этом обзоре мы проливаем свет на результаты недавних исследований, что поддерживают роль микробиома при сепсисе и его осложнениях, и решаем вопросы использования микробиома хозяина в целях улучшения клинических исходов.
2. Микробиом при сепсисе
2.1. Взгляд назад и ассоциации
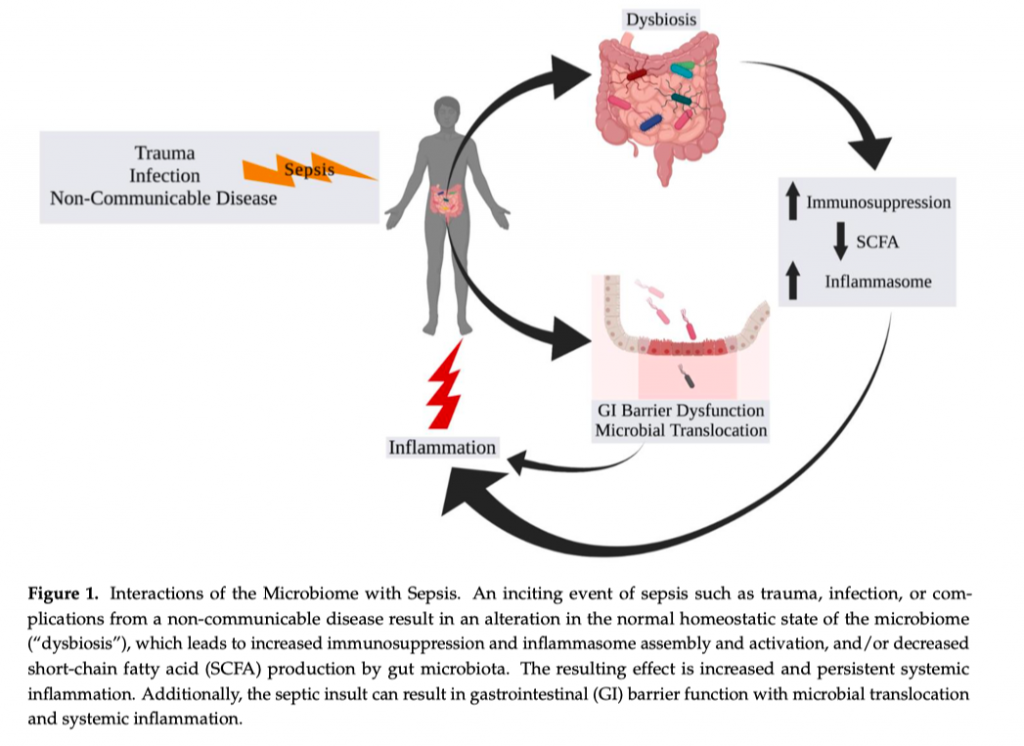
Этиология сепсиса варьируется от случая к случаю, а причиной его развития может послужить инфекция, травма/повреждение и неинфекционные заболевания желудочно-кишечного тракта и легких, несущих ответственность за большинство случаев сепсиса во всем мире за последние 30 лет [11]. Источники инфекции на сегодня следует разделять на вне больничные и нозокомиальные. Но несмотря на этиологию, физиологический ответ и пертурбации остаются аналогичными. Иммунная система человека в ходе эволюции научилась распознавать молекулярные паттерны, связанные с повреждением (англ. damage-associated molecular patterns [DAMPs]) и молекулярные паттерны, связанные с патогеном (англ. pathogen-associated molecular patterns [PAMPs]) [10]. Повреждение клеток хозяина приводит к высвобождению цитозоля, ядра, белков и метаболитов митохондрий [12, 13]. Далее все это связывается с различными паттерн-выявляющими рецепторами (англ. pattern recognition receptors [PRRs]), к примеру с рецепторами семейства Toll-like (англ. Toll-like receptors [TLRs]). TLRs играют значительную роль в модуляции врожденной иммунной системы. Например, TLRs распространяют пути передачи сигналов, что модулируют экспрессию генов, вовлеченных в продукцию цитокинов, хемокинов и интерферона I типа, что все вместе способствует воспалению [14]. PAMPs является низкомолекулярным мотивом, сохраняемым внутри микробов, что также могут связываться с рецепторами TLPs. Прототип PAMPs представляет собой липополисахарид (ЛПС, полученный из клеточной стенки грамотрицательных бактерий), флагеллин и липотейхоевую кислоту (полученная из клеточной стенки грамположительных бактерий), которые связываются с TLR4, TLR5 и TLR2, соответственно. Активация путей TLR приводит к избыточной регуляции врожденной иммунной системы, в особенности макрофагов, дендритных клеток и клеток-натуральных киллеров (NK cells) [15]. Активация этих клеток приводит многофакторному про- и противо-воспалительному иммунному ответу [16, 17]. Как правило, должен соблюдаться баланс, но процесс может стать неуправляемым, что приводит к бесконтрольной и постоянной активации про-воспалительных или иммунносупрессивных путей - состояние, которое может привести человека к смерти [18, 19]. Следовательно, выявление факторов, что приводят к такому бесконтрольному и постоянному отсутствию баланса в ответе иммунной системы, является критичным в контексте улучшения клинических исходов. Несколько факторов уже показали свои связи с различиями в выживании при сепсисе. К ним относятся возраст [5, 7, 23, 24], половая [20—23] и расовая принадлежность [22, 23, 25, 26]. К примеру, мужчины имеют более высокую частоту развития сепсиса по сравнению с женщинами со средним ежегодным относительным риском в 1.28 (95% confidence interval, 1.24–1.35) [20, 21, 23]. Пациенты более старшего возраста имеют тенденцию к худшему выживанию по сравнению с более молодыми пациентами с отношением шансов летальности в 2.26 (95% confidence interval, 2.17–2.36) [7, 24]. В то время как частота фатальных исходов для белых и черных пациентов практически не отличается, расовая принадлежность, похоже, ассоциируется с увеличением частоты сепсиса и тяжестью его течения. Например, у не-белых пациентов имеется большая вероятность развития сепсиса по сравнению с белыми пациентами со средним ежегодным относительным риском 1.90 (95% confidence interval, 1.81–2.00), а черные пациенты по сравнению с белыми пациентами с большей вероятностью будут иметь тяжелое течение сепсиса с частотой, после поправки на бедность, 1.44 (95% confidence interval, 1.42–1.46) [23, 25–27]. На все вышеуказанные различия могут оказывать свое влияние такие факторы, как эффект эстрогена на функцию иммунных клеток [28], сопутствующая патология (коморбиность), что часто сопровождает пожилой и старческий возрасти [24], расовые различия при оказании медицинской помощи [26, 27], так что более глубокое понимание роли микробиома может объединить все эти ассоциации (Figure 1).
Изменения в микробиоме могут быть связаны как со злокачественными, так и не со злокачественными заболеваниями [29—31]. У госпитализированных пациентов с сепсисом изменения микробиома могут быть вторичными по отношению к множеству терапевтических вмешательств, применяемых в госпитале. Введение антибиотиков, анальгетиков и анестетиков может оказать потенциальное влияние на целостность и разнообразие микробиоты с потенциально неблагоприятными эффектами, что в дальнейшем может сыграть своею роль в восстановлении пациента после сепсиса [32—34]. Наиболее известным клиническим примером может послужить индуцированный антибиотиками псевдомембранозный колит, который вызывается Clostridium difficile. Причина - применение антибиотиков широкого спектра действия, что приводит к неконтролируемому росту этого патогена в толстом кишечнике с последующим воспалением и развитием колита. Но есть и более тонкие изменения, что влекут за собой долгосрочные последствия. Недавние исследования показали, что снижение разнообразия микробиоты у пациентов, находящихся в критическом состоянии, приводит к росту микробов рода Enterococcus, что увеличивает риск развития сепсиса, но здесь требуются дополнительные исследования [35—39]. В исследовании, в котором приняли участие 24 пациента с продолжительным сроком пребывания в ОИТ, показало, что около двух третей из них имели снижение микробного разнообразия, что было установлено на основании секвенирования гена 16S rРНК в стуле пациентов. Более того, практически три четверти пациентов показали избыток таких патогенов, как Enterococcus faecium, Klebsiella pneumoniae, Enterobacter cloacae и E. coli [38]. Более специфичное для сепсиса исследование образцов стула 103 пациентов с сепсисом в отделениях интенсивной терапии и гематологии обнаружило более высокую численность Enterococcus на основании секвенирования гена 23S рРНК [39]. Дифференциальная сверхэкспрессия этих таксонов поддерживает гипотезу о том, что компоненты микробиоты хозяина могут либо снижать, либо увеличивать риск развития сепсиса. Также было отмечено, что летальность может увеличиваться у пациентов с сепсисом, у которых в толстом кишечнике снижается количество бутират-продуцирующих бактерий, которые превращают растительные волокна в короткоцепочечные жирные кислоты, имеющие значение для иммуномодуляции и защитного эффекта [40]. Насколько эти изменения ассоциируются с развитием сепсиса и с исходами пациентов нам еще предстоит узнать.
2.2. Движение за пределы ассоциаций
Для того, чтобы продвинуться в научном и клиническом плане за рамки вышеописанных ассоциативных изменений, требуются более механистические определения. Основным компонентом заболеваний, что показывают аналогичные ассоциативные изменения микробиома, является про-воспалительная природа каждого из них, что поддерживает уникальную точку входа для исследований микробиома, как причинного фактора не только развития сепсиса, но и успешного восстановления после него. Одним из наиболее изученных взаимодействий микробиома с воспалением относится к воспалительным заболеваниям кишечника [41]. К настоящему времени уже хорошо задокументировало, что слизистый барьер играет ключевую роль в предупреждении вызываемого микробиотой интестинального воспаления благодаря таким механизмам, как микроРНК, метаболиты и сигнальные пути различных TLR- и Nod-подобных (NLR) рецепторов [41]. Определяемая микробами дисфункция эпителиального и эндотелиального барьеров, которая вносит свой вклад в исходы сепсиса, в настоящий момент является ареной для изучения. Эпителиальный слой желудочно-кишечного тракта играет важную роль в ограничении воздействия люминальных токсинов, метаболитов и бактерий на подлежащие ткани. Это обеспечивается как физической возможностью межклеточного взаимодействия за счет плотных контактов и адгезии, так и за счет иммунного надзора, что осуществляют резидентные полиморфно-ядерные лейкоциты. Разрушение любого из этих компонентов приводит к бактериальной транслокации и активации каскада воспалительных процессов, что отвечают также и за иммунный ответ при сепсисе. Необходимо принять во внимание, что даже плановые оперативные вмешательства могут приводить к бактериальной транлокации [42, 43], что лишний раз показывает - любой стресс для хозяина может вызвать состояние, при котором его микробиота может создать условия, благоприятные для развития сепсиса. Наиболее изученными прямыми эффектами бактерий на функцию интестинального эпителиального барьера являются патогенные бактерии, что нарушают функцию эпителиального барьера с помощью либо продукции токсинов, например шига-токсин (энтерогеморрагическая Escherichia coli), энтеротоксин (Clostridium perfringens), холерный токсин, Zonula occludens toxin и гемагглютинины (Vibrio cholera), либо за счет прямой клеточной адгезии, например при энтеропатогенной E. coli. Механизмы воздействия, ведущие к разрушению барьера, для каждого из перечисленных токсинов строго индивидуальны, но все они вращаются вокруг деградации белков плотных контактов, что приводит к бактериальной транслокации, экструзии лейкоцитов и жидкостей и, наконец, к воспалению. Конечно же, такие внебольничные инфекции, как холера или другие острые кишечные инфекции, вряд ли будут диагностированы у пациентов с сепсисом, просто на их примере видно, как бактерии способны влиять на барьерную функцию кишечника и вызывать системный воспалительный ответ.
Также очень хорошо изучена бактериальная активация инфламмосом, что ведет к активации системного воспаления. Как часть врожденной иммунной системы для мониторинга и применения акций против потенциальных вредных стимулов, инфламмасомы действуют как посредники при распространении эффективных сигналов воспаления. «Сборка» инфламмасом начинается со стимулирующего сигнала, после чего уже начинается распространение эффекторных сигналов [44]. В то время как сигналы от хозяина (DAMPs) могут активировать сборку инфламмасомы, наибольший интерес представляет с точки зрения оси микробиом-сепсис представляет PAMPs. Именно сигналы PAMPs могут быть прямым взаимодействием с патогенами или с продуктами микробного происхождения, что активируют каноническую инфламмасому (как противоположность неканоническому пути, который активируются факторами хозяина, активными формами кислорода и митохондриальной дисфункцией). После внутриклеточной транслокации, сигналы активируют сенсоры NLRC4 или NLRP3/6/7, что приводит к про-каспазе 1 и активации IL-1 β и IL-18 с последующим снижением регуляции воспаления. Множество исследований сообщали об инфламмасомах и их активации более патогенными бактериями (например, Listeria), но эти сообщения не имеют отношения к сепсису [45]. Однако, NLRP3 может быть активирован грамположительными и грамотрицательными бактериями, такими как Staphylococcus aureus и Streptococcus pneumoniae, у пациентов с сепсисом [46—48]. Интересно, что полиморфизм гена NLPR3, с одной стороны, придает функции усиление, но это приводит к подавлению экспрессии и снижению воспалительной активации, что может оказать защитное действие у пациентов с прогрессированием сепсиса [49].
3. Манипуляции с микробиомом у пациентов с сепсисом
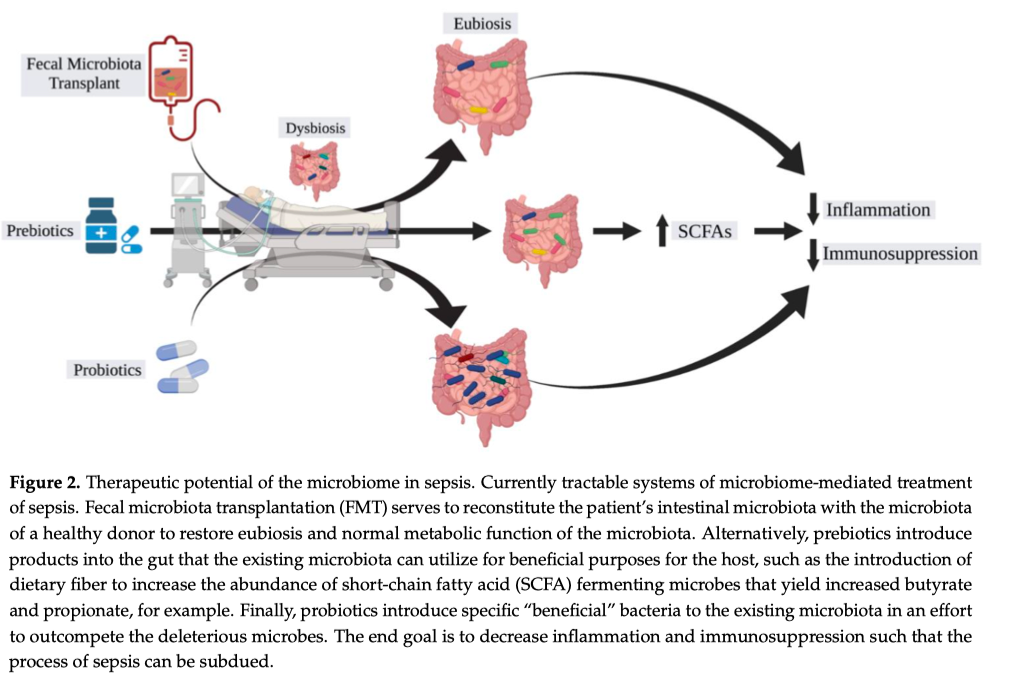
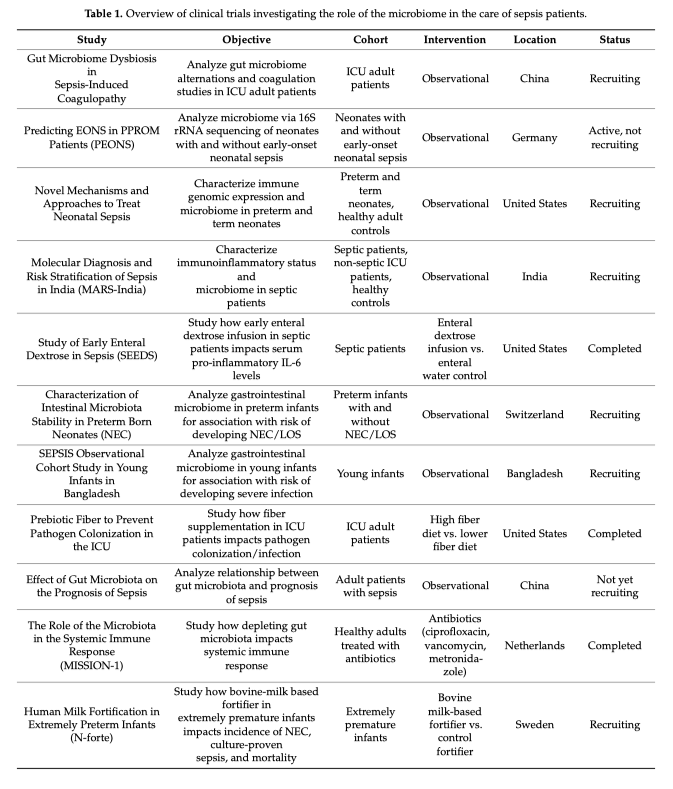
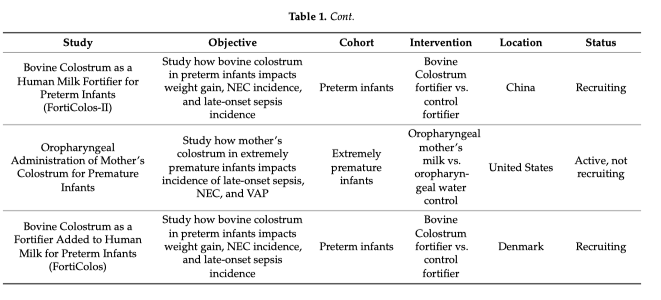
Одновременно с ростом интереса к той роли, которую играет микробиом в патогенезе заболеваний, растет интерес к микробиому и его роли как «магической пули» (Figure 2). Возможность изменения микробиома антибиотиками для контроля за течением заболевания показала обнадёживающие результаты при болезни Крона, но в целом такой подход имеет ограниченные возможности при лечении большинства заболеваний [50]. Данный подход, подобно терапии бактериофагами, больше направлен на элиминацию вредоносной микробиоты [51] в то время, как более рациональным подходом представляется восстановление нормальной микробиоты, что можно сделать с помощью пребиотиков или трансплантации фекальной микробиоты (ФМБ). Использование ФМБ показало ограниченный успех при такой стойкой с существующему на сегодня лечению инфекции, вызываемой Clostridium difficile [52], но и предыдущие исследования также показали фатальные исходы, вторичные к трансмиссии антибиотик-резистентных бактерий, что требует обязательной паузы в отношении единообразного применения данной лечебной стратегии при других инфекционных заболеваниях, включая сюда и сепсис [53]. Но терапевтический потенциал продолжает нас интриговать и ничто не мешает проведению дальнейших исследований у пациентов с сепсисом для изучения возможности в предотвращении сепсиса (Таблица 1) [54]. При сепсисе исследования фекальной трансплантации все еще находятся на ранней стадии и большинство из них являются сообщениями о случае [55, 56]. Когда мы говорим «Пробиотики», то это предполагает введение «полезных» бактерий, таких как лакто- или бифидобактерии, но вот полезен микроб или нет, может определятся как самим микробом, так и реципиентом [57]. Рандомизированное контролируемое исследование, проведенное в 2016 году, показало многообещающие результаты, когда терапия пробиотиками привела к снижению риска развития инфекций, включая сюда и вентилятор-ассоциированную пневмонию [58]. В тоже время применение пробиотиков было поставлено под сомнение после того, как недавние исследования выявили потенциальные неблагоприятные последствия в виде развития Lactobacillus бактериемии [59]. В целях снижения потенциального вредного воздействия ФМБ или прямого введения пробиотиков, стали применятся пребиотики, цель которых заключается в прямом введении в желудочно-кишечный тракт продуктов, что стимулируют рост необходимых для здоровья микробов. Наиболее примечательным из этих продуктов являются пищевые волокна, стимулирующие размножение бутират-продуцирующих бактерий. Пребиотики служат промежуточным звеном между диетой и прямым метаболическим эффектом.
С развитием технологий секвенирования и одновременным развитием инструментов вычисления наши возможности в анализе данных микробиома человека возрастают, а более глубокие знания о метаболическом воздействии микробиоты хозяина с помощью метаболомики дают надежду на то, то более целенаправленные терапевтические вмешательства позволят изменить риск развития и клинические исходы сепсиса [60—62]. К примеру, в экспериментальном исследовании (мыши) сепсиса, вызванного пневмонией, показало не только изменения микробиоты, но и важность короткоцепочечных жирных кислот для снижения уровней ацетата, пропионата и бутират [63].
Выводы
Несмотря на то, что достижения последних десятилетий в медицине критических состояний привели к улучшению выживаемости при сепсисе, все еще остается много нерешенных вопросов, особенно в части более высокой летальности в отдельных когортах пациентов. Микробиом начинает представляться, как основной игрок в патогенезе сепсиса и сепсис-индуцированной летальности. Все больше свидетельств тому, что микробиом человека не только связан с развитием сепсиса и несет ответственность за осложнения после сепсиса, но и вносит свой вклад в существование воспалительных путей, вовлеченных в септический процесс. Более глубокое понимание взаимодействий «микробиом-сепсис» приведет к идентификации новых терапевтических целей, что позволит клиницистам использовать возможности микробиома при менеджменте сепсиса. В настоящее время внимание должны привлекать исследования, направленные на изучение возможности стабилизации дисбиоза, вызванного сепсисом, или на доставке полезных бактерий и/или продуктов метаболизма этих бактерий. И наконец, большинство исследований микробиома и сепсиса сосредоточено вокруг кишечной микробиоты. При этом остается неисследованной роль вирома, фунгома (грибы) и других микробных метагеномов, впрочем, как и таких орган-специфичных для сепсиса сайтов, как почки, легкие и печень. Впереди много исследований в этой расширяющейся новой области знаний.
Список литературы:
1. Rhee, C.; Dantes, R.; Epstein, L.; Murphy, D.J.; Seymour, C.W.; Iwashyna, T.J.; Kadri, S.S.; Angus, D.C.; Danner, R.L.; Fiore, A.E.; et al. Incidence and Trends of Sepsis in US Hospitals Using Clinical vs Claims Data, 2009-2014. JAMA 2017, 318, 1241–1249.
2. Torio, C.; Moore, B. National Inpatient Hospital Costs: The Most Expensive Conditions by Payer, 2013; Agency for Healthcare Research and Quality: Rockville, MD, USA, 2016.
3. Paoli, C.J.; Reynolds, M.A.; Sinha, M.; Gitlin, M.; Crouser, E. Epidemiology and Costs of Sepsis in the United States—An Analysis Based on Timing of Diagnosis and Severity Level*. Crit. Care Med. 2018, 46, 1889–1897. [CrossRef]
4. Rudd, K.E.; Kissoon, N.; Limmathurotsakul, D.; Bory, S.; Mutahunga, B.; Seymour, C.W.; Angus, D.C.; West, T.E. The global burden of sepsis: Barriers and potential solutions. Crit. Care 2018, 22, 1–11. [CrossRef]
5. Nasa, P.; Juneja, D.; Singh, O.; Dang, R.; Arora, V. Severe Sepsis and its Impact on Outcome in Elderly and Very Elderly Patients Admitted in Intensive Care Unit. J. Intensiv. Care Med. 2011, 27, 179–183. [CrossRef]
6. Martin, A.B.; Hartman, M.; Benson, J.; Catlin, A. National health expenditure accounts team national health spending in 2014: Faster growth driven by coverage expansion and prescription drug spending. Health Aff. 2016, 35, 150–160. [CrossRef]
7. Martin, G.; Mannino, D.; Moss, M. The effect of age on the development and outcome of adult sepsis*. Crit. Care Med. 2006, 34, 15–21. [CrossRef] [PubMed]
8. Liang, D.; Leung, R.K.-K.; Guan, W.; Au, W.W. Involvement of gut microbiome in human health and disease: Brief overview, knowledge gaps and research opportunities. Gut Pathog. 2018, 10, 1–9. [CrossRef] [PubMed]
9. Thomas, R.M.; Jobin, C. The Microbiome and Cancer: Is the ‘Oncobiome’ Mirage Real? Trends Cancer 2015, 1, 24–35. [CrossRef] [PubMed]
10. Akira, S.; Uematsu, S.; Takeuchi, O. Pathogen Recognition and Innate Immunity. Cell 2006, 124, 783–801. [CrossRef] [PubMed]
11. Rudd, K.E.; Johnson, S.C.; Agesa, K.M.; Shackelford, K.A.; Tsoi, D.; Kievlan, D.R.; Colombara, D.V.; Ikuta, K.; Kissoon, N.; Finfer, S.; et al. Global, regional, and national sepsis incidence and mortality, 1990–2017: Analysis for the Global Burden of Disease Study. Lancet 2020, 395, 200–211. [CrossRef]
12. Chen, G.Y.; Nuñez, G. Sterile inflammation: Sensing and reacting to damage. Nat. Rev. Immunol. 2010, 10, 826–837. [CrossRef]
13. Seong, S.-Y.; Matzinger, P. Hydrophobicity: An ancient damage-associated molecular pattern that initiates innate immune responses. Nat. Rev. Immunol. 2004, 4, 469–478. [CrossRef] [PubMed]
14. Kawasaki, T.; Kawai, T. Toll-Like Receptor Signaling Pathways. Front. Immunol. 2014, 5, 461. [CrossRef]
15. Rivera, A.; Siracusa, M.C.; Yap, G.S.; Gause, W.C. Innate cell communication kick-starts pathogen-specific immunity. Nat. Immunol. 2016, 17, 356–363. [CrossRef]
16. Gotts, J.E.; Matthay, M.A. Sepsis: Pathophysiology and clinical management. BMJ 2016, 353, i1585. [CrossRef] [PubMed]
17. Mogensen, T.H. Pathogen Recognition and Inflammatory Signaling in Innate Immune Defenses. Clin. Microbiol. Rev. 2009, 22, 240–273. [CrossRef] [PubMed]
18. Wilson, I.B. Linking clinical variables with health-related quality of life. A conceptual model of patient outcomes. JAMA J. Am. Med. Assoc. 1995, 273, 59–65. [CrossRef]
19. Horiguchi, H.; Loftus, T.; Hawkins, R.B.; Raymond, S.L.; Stortz, J.A.; Hollen, M.K.; Weiss, B.P.; Miller, E.S.; Bihorac, A.; Larson, S.; et al. Innate Immunity in the Persistent Inflammation, Immunosuppression, and Catabolism Syndrome and Its Implications for Therapy. Front. Immunol. 2018, 9, 595. [CrossRef]
20. Sakr, Y.; Elia, C.; Mascia, L.; Barberis, B.; Cardellino, S.; Livigni, S.; Fiore, G.; Filippini, C.; Ranieri, V. The influence of gender on the epidemiology of and outcome from severe sepsis. Crit. Care 2013, 17, 9. [CrossRef]
21. Wichmann, M.W.; Inthorn, D.; Andress, H.-J.; Schildberg, F.W. Incidence and mortality of severe sepsis in surgical intensive care patients: The influence of patient gender on disease process and outcome. Intensiv. Care Med. 2000, 26, 167–172. [CrossRef]
22. Angus, D.C.; Linde-Zwirble, W.T.; Lidicker, J.; Clermont, G.; Carcillo, J.; Pinsky, M.R. Epidemiology of severe sepsis in the United States: Analysis of incidence, outcome, and associated costs of care. Crit. Care Med. 2001, 29, 1303–1310. [CrossRef] [PubMed]
23. Martin, G.S.; Mannino, D.; Eaton, S.; Moss, M. The Epidemiology of Sepsis in the United States from 1979 through 2000. N. Engl. J. Med. 2003, 348, 1546–1554. [CrossRef] [PubMed]
24. Lemay, A.C.; Anzueto, A.; Restrepo, M.I.; Mortensen, E.M. Predictors of Long-term Mortality After Severe Sepsis in the Elderly. Am. J. Med. Sci. 2014, 347, 282–288. [CrossRef]
25. Barnato, A.E.; Alexander, S.L.; Linde-Zwirble, W.T.; Angus, D.C. Racial Variation in the Incidence, Care, and Outcomes of Severe Sepsis. Am. J. Respir. Crit. Care Med. 2008, 177, 279–284. [CrossRef] [PubMed]
26. Jones, J.M.; Fingar, K.R.; Miller, M.A.; Coffey, R.; Barrett, M.; Flottemesch, T.; Moy, E. Racial disparities in sepsis-related in-hospital mortality: Using a broad case capture method and multivariate controls for clinical and hospital variables, 2004–2013. Crit. Care Med. 2017, 45, 9. [CrossRef]
27. Dombrovskiy, V.Y.; Martin, A.A.; Sunderram, J.; Paz, H.L. Occurrence and outcomes of sepsis: Influence of race*. Crit. Care Med. 2007, 35, 763–768. [CrossRef] [PubMed]
28. Angele, M.K.; Pratschke, S.; Hubbard, W.J.; Chaudry, I.H. Gender differences in sepsis: Cardiovascular and immunological aspects. Virulence 2013, 5, 12–19. [CrossRef]
29. Kostic, A.; Xavier, R.J.; Gevers, D. The Microbiome in Inflammatory Bowel Disease: Current Status and the Future Ahead. Gastroenterology 2014, 146, 1489–1499. [CrossRef]
30. Tang, W.W.; Hazen, S.L. The contributory role of gut microbiota in cardiovascular disease. J. Clin. Investig. 2014, 124, 4204–4211. [CrossRef]
31. Schwabe, R.F.; Jobin, C. The microbiome and cancer. Nat. Rev. Cancer 2013, 13, 800–812. [CrossRef]
32. Zimmermann, P.; Curtis, N. The effect of antibiotics on the composition of the intestinal microbiota—A systematic review. J. Infect. 2019, 79, 471–489. [CrossRef]
33. Wang, F.; Meng, J.; Zhang, L.; Johnson, T.; Chen, C.; Roy, S. Morphine induces changes in the gut microbiome and metabolome in a morphine dependence model. Sci. Rep. 2018, 8, 1–15. [CrossRef] [PubMed]
34. Han, C.; Zhang, Z.; Guo, N.; Li, X.; Yang, M.; Peng, Y.; Ma, X.; Yu, K.; Wang, C. Effects of Sevoflurane Inhalation Anesthesia on the Intestinal Microbiome in Mice. Front. Cell. Infect. Microbiol. 2021, 11, 217. [CrossRef]
35. Adelman, M.W.; Woodworth, M.H.; Langelier, C.; Busch, L.M.; Kempker, J.A.; Kraft, C.S.; Martin, G.S. The gut microbiome’s role in the development, maintenance, and outcomes of sepsis. Crit. Care 2020, 24, 1–10. [CrossRef] [PubMed]
36. Lankelma, J.M.; Van Vught, L.A.; Belzer, C.; Schultz, M.J.; Van Der Poll, T.; De Vos, W.M.; Wiersinga, W.J. Critically ill patients demonstrate large interpersonal variation in intestinal microbiota dysregulation: A pilot study. Intensiv. Care Med. 2016, 43, 59–68. [CrossRef] [PubMed]
37. Freedberg, D.E.; Zhou, M.J.; Cohen, M.E.; Annavajhala, M.; Khan, S.; Moscoso, D.I.; Brooks, C.; Whittier, S.; Chong, D.H.; Uhlemann, A.-C.; et al. Pathogen colonization of the gastrointestinal microbiome at intensive care unit admission and risk for subsequent death or infection. Intensiv. Care Med. 2018, 44, 1203–1211. [CrossRef] [PubMed]
38. Ravi, A.; Halstead, F.D.; Bamford, A.; Casey, A.; Thomson, N.M.; Van Schaik, W.; Snelson, C.; Goulden, R.; Foster-Nyarko, E.; Savva, G.M.; et al. Loss of microbial diversity and pathogen domination of the gut microbiota in critically ill patients. Microb. Genom. 2019, 5, e293. [CrossRef]
39. Rao, K.; Patel, A.; Seekatz, A.; Bassis, C.; Sun, Y.; Bachman, M. Gut microbiome features are associated with sepsis onset and outcomes. bioRxiv 2021. [CrossRef]
40. Valdés-Duque, B.E.; Giraldo-Giraldo, N.A.; Jaillier-Ramírez, A.M.; Giraldo-Villa, A.; Acevedo-Castaño, I.; Yepes-Molina, M.A.; Barbosa-Barbosa, J.; Barrera-Causil, C.J.; Agudelo-Ochoa, G.M. Stool Short-Chain Fatty Acids in Critically Ill Patients with Sepsis. J. Am. Coll. Nutr. 2020, 39, 706–712. [CrossRef]
41. Yang, Y.; Jobin, C. Novel insights into microbiome in colitis and colorectal cancer. Curr. Opin. Gastroenterol. 2017, 33, 422–427. [CrossRef] [PubMed]
42. MacFie, J.; Reddy, B.S.; Gatt, M.; Jain, P.K.; Sowdi, R.; Mitchell, C.J. Bacterial translocation studied in 927 patients over 13 years. Br. J. Surg. 2005, 93, 87–93. [CrossRef]
43. Woodcock, N.P.; Sudheer, V.; El-Barghouti, N.; Perry, E.P.; MacFie, J. Bacterial translocation in patients undergoing abdominal aortic aneurysm repair. Br. J. Surg. 2000, 87, 439–442. [CrossRef] [PubMed]
44. Zheng, D.; Liwinski, T.; Elinav, E. Inflammasome activation and regulation: Toward a better understanding of complex mechanisms. Cell Discov. 2020, 6, 1–22. [CrossRef] [PubMed]
45. Hara, H.; Seregin, S.S.; Yang, D.; Fukase, K.; Chamaillard, M.; Alnemri, E.S.; Inohara, N.; Chen, G.Y.; Núñez, G. The NLRP6 Inflammasome Recognizes Lipoteichoic Acid and Regulates Gram-Positive Pathogen Infection. Cell 2018, 175, 1651–1664.e14. [CrossRef] [PubMed]
46. Muñoz-Planillo, R.; Kuffa, P.; Martínez-Colón, G.; Smith, B.L.; Rajendiran, T.M.; Núñez, G. K+ Efflux Is the Common Trigger of NLRP3 Inflammasome Activation by Bacterial Toxins and Particulate Matter. Immunity 2013, 38, 1142–1153. [CrossRef] [PubMed]
47. Hayward, J.; Mathur, A.; Ngo, C.; Man, S.M. Cytosolic Recognition of Microbes and Pathogens: Inflammasomes in Action. Microbiol. Mol. Biol. Rev. 2018, 82, e15-18. [CrossRef] [PubMed]
48. Rathinam, V.A.; Vanaja, S.K.; Waggoner, L.; Sokolovska, A.; Becker, C.; Stuart, L.M.; Leong, J.M.; Fitzgerald, K.A. TRIF Licenses Caspase-11-Dependent NLRP3 Inflammasome Activation by Gram-Negative Bacteria. Cell 2012, 150, 606–619. [CrossRef]
49. Lu, F.; Chen, H.; Hong, Y.; Lin, Y.; Liu, L.; Wei, N.; Wu, Q.; Liao, S.; Yang, S.; He, J.; et al. A gain-of-function NLRP3 3 ′ -UTR polymorphism causes miR-146a-mediated suppression of NLRP3 expression and confers protection against sepsis progression. Sci. Rep. 2021, 11, 1–13. [CrossRef]
50. Townsend, C.M.; Parker, C.E.; Macdonald, J.K.; Nguyen, T.M.; Jairath, V.; Feagan, B.G.; Khanna, R. Antibiotics for induction and maintenance of remission in Crohn’s disease. Cochrane Database Syst. Rev. 2019, 2, CD012730. [CrossRef]
51. Febvre, H.P.; Rao, S.; Gindin, M.; Goodwin, N.D.M.; Finer, E.; Vivanco, J.S.; Lu, S.; Manter, D.K.; Wallace, T.C.; Weir, T.L. PHAGE Study: Effects of Supplemental Bacteriophage Intake on Inflammation and Gut Microbiota in Healthy Adults. Nutrients 2019, 11, 666. [CrossRef] [PubMed]
52. Van Nood, E.; Vrieze, A.; Nieuwdorp, M.; Fuentes, S.; Zoetendal, E.G.; De Vos, W.M.; Visser, C.E.; Kuijper, E.; Bartelsman, J.F.W.M.; Tijssen, J.G.P.; et al. Duodenal Infusion of Donor Feces for RecurrentClostridium difficile. N. Engl. J. Med. 2013, 368, 407–415. [CrossRef]
53. DeFilipp, Z.; Bloom, P.P.; Soto, M.T.; Mansour, M.K.; Sater, M.; Huntley, M.H.; Turbett, S.; Chung, R.T.; Chen, Y.-B.; Hohmann, E.L. Drug-Resistant E. coli Bacteremia Transmitted by Fecal Microbiota Transplant. N. Engl. J. Med. 2019, 381, 2043–2050. [CrossRef]
54. Haak, B.W.; Prescott, H.; Wiersinga, W.J.; Haak, B.W.; Prescott, H.; Wiersinga, W.J. Therapeutic Potential of the Gut Microbiota in the Prevention and Treatment of Sepsis. Front. Immunol. 2018, 9, 2042. [CrossRef]
55. Li, Q.; Wang, C.; Tang, C.; He, Q.; Zhao, X.; Li, N.; Li, J. Therapeutic Modulation and Reestablishment of the Intestinal Microbiota With Fecal Microbiota Transplantation Resolves Sepsis and Diarrhea in a Patient. Am. J. Gastroenterol. 2014, 109, 1832–1834. [CrossRef] [PubMed]
56. Wei, Y.; Yang, J.; Wang, J.; Yang, Y.; Huang, J.; Gong, H.; Cui, H.; Chen, D. Successful treatment with fecal microbiota transplantation in patients with multiple organ dysfunction syndrome and diarrhea following severe sepsis. Crit. Care 2016, 20, 1–9. [CrossRef] [PubMed]
57. Lukovic, E.; Moitra, V.K.; Freedberg, D.E. The microbiome: Implications for perioperative and critical care. Curr. Opin. Anaesthesiol. 2019, 32, 412–420. [CrossRef]
58. Manzanares, W.; Lemieux, M.; Langlois, P.L.; Wischmeyer, P.E. Probiotic and synbiotic therapy in critical illness: A systematic review and meta-analysis. Crit. Care 2016, 20, 1–19. [CrossRef]
59. Yelin, I.; Flett, K.B.; Merakou, C.; Mehrotra, P.; Stam, J.; Snesrud, E.; Hinkle, M.; Lesho, E.; McGann, P.; McAdam, A.J.; et al. Genomic and epidemiological evidence of bacterial transmission from probiotic capsule to blood in ICU patients. Nat. Med. 2019, 25, 1728–1732. [CrossRef] [PubMed]
60. Kuczynski, J.; Lauber, C.L.; Walters, W.A.; Parfrey, L.W.; Clemente, J.C.; Gevers, D.; Knight, R. Experimental and analytical tools for studying the human microbiome. Nat. Rev. Genet. 2011, 13, 47–58. [CrossRef]
61. Lee, J.; Banerjee, D. Metabolomics and the Microbiome as Biomarkers in Sepsis. Crit. Care Clin. 2020, 36, 105–113. [CrossRef]
62. Sun, Y.V.; Hu, Y.-J. Integrative Analysis of Multi-omics Data for Discovery and Functional Studies of Complex Human Diseases. Adv. Genet. 2016, 93, 147–190. [CrossRef] [PubMed]
63. Wu, T.; Xu, F.; Su, C.; Li, H.; Lv, N.; Liu, Y.; Gao, Y.; Lan, Y.; Li, J. Alterations in the Gut Microbiome and Cecal Metabolome During Klebsiella pneumoniae-Induced Pneumosepsis. Front. Immunol. 2020, 11, 1331. [CrossRef] [PubMed]
Journal of Clinical Medicine