Адъювантная иммунотерапия септического шока иммуноглобулинами, обогащенными поликлональными IgM
Front. Med. 8:616511.
doi: 10.3389/fmed.2021.616511
Обзор
Адъювантная иммунотерапия септического шока иммуноглобулинами, обогащенными поликлональными IgM: от теории к практике. Основные причины для персонализации протокола лечения.
Перевод оригинальной статьи «Adjunctive Immunotherapy With Polyclonal Ig-M Enriched Immunoglobulins for Septic Shock: From Bench to Bedside. The Rationale for a Personalized Treatment Protocol».
Авторы Busani S, Roat E, Tosi M, Biagioni E, Coloretti I, Meschiari M, Gelmini R, Brugioni L, De Biasi S and Girardis M
Keywords: immunoglobulins, septic shock, adjunctive treatment, sepsis, protocol
Ключевые слова: иммуноглобулины, септический шок, адъювантная терапия, сепсис, протокол лечения
Септический шок: история провалов адъювантной терапии
Септический шок - комплексный синдром, возникающий тогда, когда течение сепсиса осложняется развитием циркуляторных, клеточных и метаболических нарушений, что резко увеличивает риск наступления смерти. Клинические критерии для диагностики септического шока были недавно обновлены в целях лучшего его выявления [1]. Несмотря на то, что наши знания патогенеза сепсиса и септического шока существенно возросли, летальность за последние 10 лет практически не изменилась, оставаясь на очень высоком уровне. И тому примером проведенный недавно мета-анализ данных, полученных в 71 исследовании, что были проведены в Европе и Северной Америке, показавший госпитальную летальность равную практически 40% [2].
Другим аспектом, что вызывает беспокойство, является то, что во всех рандомизированных клинических исследованиях (РКИ), в которых проводилось тестирование дополнительных видов лечения септического шока, были получены разочаровывающие результаты. И это при том, что большая часть новых терапевтических стратегий были разработаны на основании новых знаний о патогенезе септического шока и на доклинических моделях показали обнадеживающие результаты.
Самой первой идентифицированной и изученной целью терапии был эндотоксин грамотрицательных бактерий, для блокирования которого были предложены разнообразные антитела к anti-lipid A, но РКИ не показали какой либо пользы от их применения [3, 4]. Подобным же образом применение антител к TNF-a или антител к IL-1, целью которых послужила попытка ограничения гиперактивации врожденной иммунной системы, несущей ответственность за тканевой повреждение, в больших РКИ не принесло ожидаемых результатов [5,6]. Попытки воздействовать на эндотелиальную дисфункцию, что часто наблюдается у пациентов с септическим шоком, с целью улучшения микроциркуляции и оксигенации тканей, путем введения антагониста фактора, активирующего тромбоциты [7] или активированного протеина С [8], также не принесли желаемых результатов в виде снижения летальности.
За последнее десятилетие были разработаны разнообразные технологии удаления воспалительных медиаторов с помощью экстракорпорального очищения крови. Но высокообъемная гемофильтрация, при всей ее безопасности для пациента, не привела к снижению летальности, что показал недавний мета-анализ [9]. Гемоперфузия, при которой используются фильтры, покрытые полимиксином В, нацеленная на удаление эндотоксинов, служащих триггерами воспалительного ответа, в РКИ показала разнонаправленные результаты [10, 11]. Что же касается сочетанной плазмафильрации и адсорбции (англ. coupled plasma filtration and adsorption или CPFA), то результаты, полученные в первом рандомизированном исследовании COMPACT 1 [12], были обнадеживающими, но вот второе исследование, COMPACT 2, было остановлено практически сразу в связи с нежелательными явлениями, связанными с CPFA, о чем было сообщено всем пользователям данного метода (доступно по ссылке http://www.salute.gov.it/imgs/C_17_AvvisiSicurezza_8135_azione_itemAzione0_files_itemFiles2_fileAzione.pdf)
Среди новых мембран можно отметить картридж для гемоперфузии Cytosorb, способный удалять широкий спектр цитокинов, который также не показал снижения уровня IL-6 в плазме [13], а пилотное исследование обратило внимание на значительное увеличение потребности в норадреналине [14]. Новая мембрана Oxyris с гепарином, разработанная для адсорбции цитокинов и эндотоксина, была протестирована у 16 пациентов, и, возможно, эта мембрана эффективно удаляет эндотоксин и TNF-α, IL-6, IL-8 и IFNγ у пациентов с острым почечным повреждением, вызванном септическим шоком [15].
Продолжая историю о провалах адъювантной терапии, нельзя не упомянуть иммуномодуляторы и антиоксиданты, применение которых было нацелено на снижение выраженного повреждения тканей, вызванного избыточной активацией иммунного ответа. Совсем недавние РКИ ACTS и ATESS не смогли показать улучшения органной функции при комбинации витаминов с кортикостероидами [16, 17]. Обнадеживающие результаты, полученные Meisel et al. [18], при применении ими колоние-стимулирующего фактора гранулоцитов-макрофагов, не получили подтверждения в других, более мощных исследованиях.
Вследствие всех этих отрицательных результатов, за последние годы количество рекомендаций по ведению пациентов с септическим шоком, содержащихся в клиническом руководстве the Surviving Sepsis Campaign (SSC), прогрессивно снижалось, большинство из них получили статус отрицательных (не делать этого), что ограничивает пространство для маневра у клиницистов. Понятно, что основной принцип клинического руководства определяется формулой «не навреди», но нельзя сбрасывать со счетов необходимость стратификации пациентов на уровне субпопуляции, что диктуется гетерогенностью популяции пациентов с сепсисом и септическим шоком.
Если нет одинаковых септических шоков, есть ли возможность в персонализации терапии?
К сожалению, до сегодняшнего дня мы не может с легкостью ответить на этот вопрос потому, что на течение сепсиса оказывает влияние множество факторов. Здесь и характеристики пациента, такие как возраст, сопутствующая патология, генетические факторы, иммунный ответ, а также и история приема антибиотиков, что все вместе оказывают влияние на эволюцию сепсиса в септический шок. Более того, влияние всех этих факторов может объяснить, почему же так трудно найти уникальное лечение, подходящее всем пациентам.
В свете всего вышеперечисленного некоторые авторы предложили свою систему клинического стадирования сепсиса, названную ими PIRO, основной целью которой является характеристика пациентов по четырем компонентам: P - Predisposition (Предрасположенность), I - Insult/Infection (Повреждение/Инфекция), R - Response (Ответ) и O - Organ dysfunction (Органная дисфункция). Модель PIRO несет в себе попытку снижения неоднородности (гетерогенности) пациентов, разделяя четыре стадии, определяемыми увеличением летальности, что может помочь в назначении более персонализированного лечения [20, 21]. Но несмотря на эту попытку, клинические исследования до сих пор игнорируют сложность и вариабельность, и продолжают включать в себя пациентов только на основании диагноза септического шока, без учета выбора конкретной и более однородной подгруппы. Именно такое отсутствие стратификации пациентов при разработке дизайна исследования может частично объяснить отрицательные результаты, полученные в проведенных уже РКИ.
Растущее понимание той важной роли, что играет иммунный ответ в патофизиологии септического шока, привела к разработке и тестированию некоторых видов адъювантной терапии, основанных на применении молекул с иммуномодулирующими возможностями. Для понимания этого фундаментального момента будет полезно вспомнить, что иммунный ответ при септическом шоке различается от пациента к пациенту.
Одни пациенты показывают избыточный иммунный ответ с массивной продукцией провоспалительных медиаторов, таких как цитокины, что ведет к повреждению тканей, органной дисфункции и ранней смерти [22]. Другие же пациенты показывают состояние иммунного паралича, который характеризуется снижением иммунного ответа, что ведет к развитию вторичной инфекции и летальности, но уже в долгосрочной перспективе [22, 23].
Как правило, летальность при септическом шоке имеет двухфазную кривую, когда одна часть пациентов с септическим шоком умирает в течение первых 3 дней из-за избыточного иммунного ответа, но у большинства пациентов с септическим шоком неблагоприятный исход наступает через несколько недель, что свидетельствует о глубоком нарушении иммунного ответа [24]. Подтверждают это тяжелые апоптозы клеток как врожденной, так и адаптивной иммунной системы, связанные с истощением, а также увеличение регуляторных Т-клеток и миелоидных супрессорных клеток, способных подавлять функцию эффекторных иммунных клеток [23, 25].
Несмотря на то, что показанные выше сценарии являются крайним упрощением того сложного дисбаланса между активацией и подавлением иммунного ответа, что характеризуют сепсис и септический шок, очевидно, что агенты, влияющие на иммунную функцию, могут быть новой стратегией лечения сепсиса, направленной на повышение выживаемости.
Обоснование адъювантной терапии поликлональными иммуноглобулинами для внутривенного введения
Все доказательства, что будут приведены ниже, были найдены в базах данных the Medline (PubMed) и Scopus в период с января 2000 года по сентябрь 2020 года. Мы подробно рассмотрели эффективность и механизмы действия иммуноглобулинов, используя для поиска ключевые слова «иммуноглобулины», «механизм действия», «эффективность» и «сепсис».
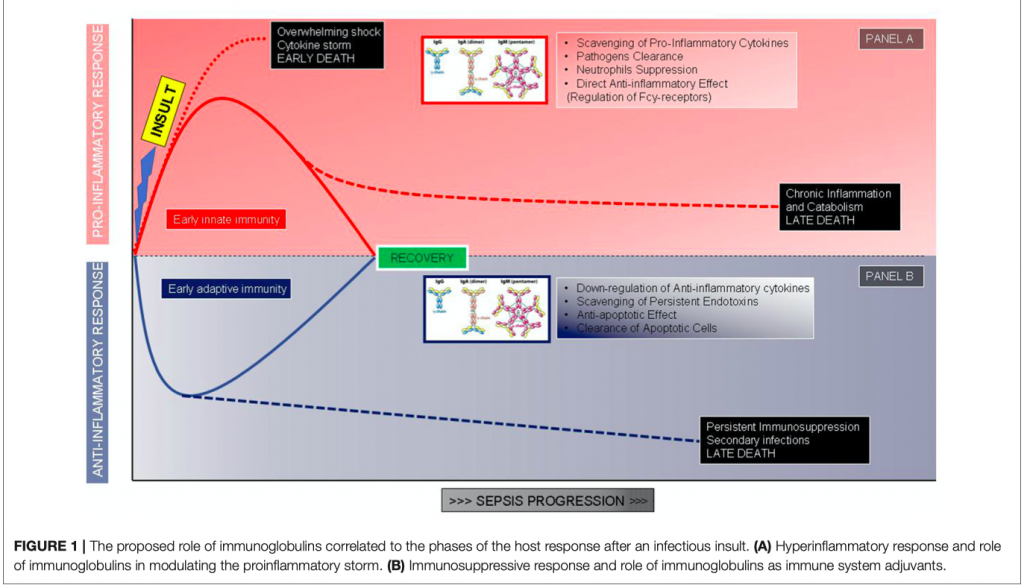
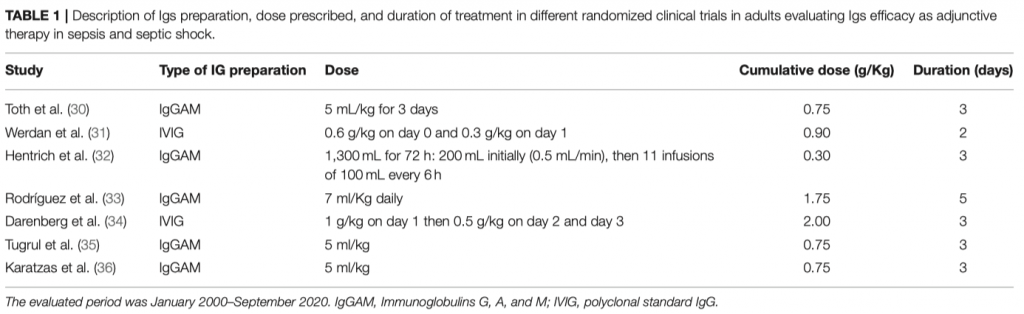
Среди всех видов лечения, направленных на иммуномодуляцию, именно иммуноглобулины (Igs) показывают самое многообещающие результаты. Обоснованием к применению Igs может служить как их плейотропное действие на иммунный ответ, так и изменение уровней Igs в сыворотке, наблюдаемые при сепсисе и септическом шоке. Потенциальную пользу от введения Igs можно извлечь из их иммуномодулирующих функций, воздействующих как на патогены, так и на клетки иммунной системы. IgG и IgM могут служить «мусорщиками» и удалять токсины, связывать патогены путем стимуляции фагоцитоза, опсонизации и бактерицидной активности CD8 + лимфоцитов, опосредованной антителозависимой клеточной цитотоксичностью [26] (Рисунок 1.) IgG и IgM также показывают прямые противовоспалительные эффекты, опосредованные рецептором Fc, и заключающиеся в модуляции функции дендритных клеток и снижении ответа на INF-γ [27], способствуя тем самым клиренсу апоптозных клеток, влияя на анти-апоптозные эффекты иммунных клеток, снижая активность классического пути комплемента, что больше характерно для IgM, стимулируя продукцию противовоспалительных цитокинов и приводя к балансу между активацией и супрессией иммунного ответа, который при сепсисе и септическом шоке, как правило, нарушен. Igs синергично повышают антибактериальную активность антибиотиков (Рисунок 1). Как дополнение к патофизиологическим обоснованиям необходимо сказать и о том, что в нескольких недавних исследованиях найдены корреляции между снижением уровня циркулирующих Igs при септическом шоке и неблагоприятными исходами. Venet et al. [28] измеряли уровни IgM и IgG у пациентов с септическим шоком и показали, что дефицит IgM может служить прогностическим фактором летальности [28]. В другом исследовании сообщалось о важности снижения уровней IgM тогда, когда состояние пациента ухудшалось от тяжелого сепсиса к септическому шоку, подчеркивая тем самым важность кинетики Igs для прогнозирования состояния пациента. Более того, стимуляция in vitro фитогемагглютинином лимфоцитов, выделенных пациентами с септическим шоком, показывает пониженную способность продуцировать IgM по сравнению со здоровыми субъектами [29]. Но все же, несмотря на относительное большое количество исследований, оценивающих адъювантную терапию Igs [30 - 36], значимость полученных в них результатов весьма низкая, что связно как с недостаточным количеством включенных в них пациентов, так и с неоднородностью самой терапии - тип препарата, режимы дозирования, продолжительность терапии, тяжесть состояния пациентов, вид контроля (Таблица 1). Тем не менее, два последних мета-анализа не только показали снижение летальности при применении поликлональных Igs по сравнению с контрольной группой, но и предположили, что более высокие дозы будут, вероятно, более эффективными [37, 38].
Клиническое руководство SSC [19] содержит рекомендацию против применения Igs у пациентов с сепсисом и септическим шоком. Такой вывод основан на результатах только одного РКИ по применению внутривенных Igs, признанных удовлетворительными в контексте количества участников, дизайна исследования и риска систематической ошибки. Это исследование не выявило разницы в выживаемости на 28 день, но множество ограничений снизило его мощность: длительность самого исследования с 1991 по 1995 гг., публикация на 12 лет позже и отсутствие детального описания тяжести пациентов [31]. В тоже время, в последней версии японских рекомендаций по ведению сепсиса [39] упоминается о внутривенном введени Igs, как возможной опции терапии септического шока, что лишний раз подчеркивает недостаточность доказательств и отсутствие согласия среди экспертов.
В настоящее время доступны два типа препаратов, полученных из плазмы здоровых доноров: поликлональный стандарт IgG (IVIG) и обогащенный IgM (IgM-enriched formulation IgGAM). IVIG содержит не менее 96% поликлональных IgG, а IgGAM содержит IgM 12%, IgA 12% и IgG 76%, что более точно соответствует физиологической выработке антител в ходе инфекции. Оба препарата могут индуцировать клиренс патогенов, но более высокую «киллерную» активность в отношении грамотрицательных бактерий показывает IgGAM [40]. Наличие IgM выглядит особенно важным по причине его специфической роли в иммунном ответе [29]. Характеристики IgM наряду с лучшими результатами, полученными при применении IgGAM с точки зрения снижения относительного риска летальности по сравнению с IVIG в проведенном мета-анализе (41), предполагают их предпочтительное использование при септическом шоке. И, наконец, в недавнем пилотном исследовании, в котором изучались эффекты от применения IgGAM у пациентов с сепсисом и/или септическим шоком, было обнаружено улучшение микроциркуляции в подъязычной области у пациентов в группе лечения [42], что позволяет предположить о возможном влиянии на восстановление функции клеток эндотелия, как ранее это было показано в доклинических исследованиях [43]. Авторы недавнего обзора, оценивающего использование Igs в качестве адъювантной терапии при тяжелых инфекциях в отделениях интенсивной терапии, предполагают, что пока имеется недостаточно доказательств в поддержку их использования, за исключением синдрома токсического шока, вызванного стрептококками. Вместе с тем, они подчеркивают важность не только определения правильного типа препарата Igs , но и режима дозирования, длительностью приема наряду с характеристиками пациентов [44]. Принимая во внимание важность временного фактора для получения максимального эффекта от проводимой иммуномодулирующей терапии, Berlot et al. [45] показали, что ранее введение IgGAM пациентам с септическим шоком ассоциируется со снижением риска летальности в ОИТ. Многоцентровое, двойное слепое, рандомизированное, контролируемое исследование применения гипериммунных Igs для лечения пациентов с тяжелой формой вирусной инфекции H1N1 показало, что раннее их применение в течение 5 суток сразу после начала заболевания (явная клиническая картина) ассоциируется со снижением вирусной нагрузки и снижением летальности [46]. И совсем недавно Yun et al. [47] показали, что введение пациентам с SARS-CoV2 пневмонией внутривенных Igs в течение 48 часов после госпитализации в ОИТ в качестве адъювантной терапии не только приводило к снижению показаний к искусственной вентиляции легких, но и снижало летальность и длительность нахождения пациента в стационаре [47]. Суммируя все вышесказанное, мы можем заключить, что все больше и больше нарастает необходимость точного применения Igs в терминах селекция пациентов, режим дозирования и длительность введения, а мы продолжаем заниматься простым исключением Igs из протоколов лечения сепсиса и септического шока.
Побочные эффекты иммуноглобулинов
Абсолютных противопоказаний к применению Igs нет. Необходимо учитывать, что каждый продукт, содержащий Igs, имеет свои отличия от других продуктов, поэтому у пациента с опасной для жизни реакцией на один продукт может не наблюдаться никаких реакций с другими. Таким образом, противопоказания связаны с конкретным компонентом продукта Igs [48].
Несмотря на то, что в большинстве своем инфузии Igs хорошо переносятся пациентами, сообщается и о тяжелых побочных эффектах [49]. Эти побочные эффекты часто преходящие, но в отдельных случаях могут быть тяжелыми и приводить к длительной нетрудоспособности. Идентифицировано два фактора риска наступления побочных эффектов, один из которых связан с изготовлением препарата, содержащего Igs, второй - с характеристиками пациентов. Если говорить о составе продукта с Igs, то высокие концентрации IgA, antiRh и anti-RhD увеличивают риски неблагоприятных реакций [50], а если говорить о пациентах, то высокий риск побочных эффектов наблюдается у тех из них, у которых уже имеются первичные дефекты антител, больше это касается пациентов с низким уровнем IgA [51]. Особое внимание заслуживают пациенты, имеющие в анамнезе аллергические реакции и тромбозы. В большей части клинические проявления побочных эффектов возникают незамедлительно и напоминают таковые при гриппе, затем следуют реакции со стороны кожных покровов, аритмии, гипотензия и связанное с трансфузией острое повреждение легких [52]. Отстроченные побочные явления, которые возникают у менее 1% пациентов, получающих препараты Igs, могут быть тяжелыми и в редких случаях приводить к летальному исходу. Сюда относятся повреждение почек, гематологические и неврологические нарушения, нарушения водно-электролитного баланса, инфекции, связанные с трансфузией, тромбозы [52]. Частота возникновения побочных эффектов напрямую связана со скоростью инфузии Igs, так что первое их введение должно начинаться с медленной скорости инфузии в течение 30 минут с последующим увеличением скорости инфузии [53].
От теории к практике: персонализированный протокол адъювантной терапии IGGAM
Исходя из необходимости выбора правильного фенотипа для лечения Igs, мы решили использовать «примеры из практики». Использование таких «клинических примеров» может быть полезным в целях и снижения сложности клинического применения, и определения категорий пациентов, несущих единообразие в контексте иммунного ответа.
Первым таким «клиническим примером» послужит молодой пациент без сопутствующей патологии, у которого развилась или менингококкцемия или тяжелая пневмония (вызванная Streptococcus pneumonia), или синдром токсического шока. У такого пациента мы вправе ожидать избыточный провоспалительный ответ, который не уравновешивается противовоспалительным ответом. Такой избыточный воспалительный ответ направлен на эрадикацию патогена, но он же на ранней фазе шока ведет к повреждению тканей и полиорганному повреждению (Рисунок 1А). В этом случае мы можем получить пользу от применения Igs в виде клиренса патогенов, токсинов и медиаторов наряду с антивоспалительными эффектами. Введение Igs здесь должно начинаться как можно раньше, высокими дозами, что позволит блокировать гиперактивацию еще эффективной иммунной системы, тем самым ограничивая повреждение органов [26, 54, 55]. Данные опроса, приведённого в Швеции, показали, что введение Igs при синдроме токсического шока значительно улучшает выживаемость [56]. Совсем недавнее проспективное многоцентровое исследование, проведенное в Швеции, определило фактор риска летального исхода у пациентов с некротизирующей инфекцией мягких тканей и этим фактором риска оказался отказ от назначения Igs [57].
Второй «клинический пример» - пациент с персистирующей или прогрессирующей инфекцией после первого эпизода сепсиса: кандидемия после операции на органах брюшной полости или вторичная полирезистентная инфекция (англ. multi-drug resistant или MDR). В этом контексте сниженный провоспалительный ответ сочетается с выраженным противовоспалительным состоянием. Благодаря антибактериальной терапии, мы можем ограничить рост патогенов, но мы не сможем достигнуть полной эрадикации патогена и, в таком случае, персистирующая инфекция рано или поздно приведет к смерти пациента (Рисунок 1В). Имеет значение здесь и появление вторичной инфекции, вызванной оппортунистическими условно-патогенными микроорганизмами, такими как Acinetobacter или Stenotrophomonas. При таких состояниях Igs могут быть полезны, благодаря их анти-апоптотическим эффектам на клетки иммунной системы и возможности очищения клеток, подвергнутых апоптозу, и такие эффекты превышают фагоцитоз патогена. Временное окно для начала введения Igs здесь достаточно широкое. Необходимо помнить, что инфекции, вызванные оппортунистическими патогенами, часто MDR, служат маркерами иммуносупрессивного состояния и существует небольшое количество доказательств пользы от применения Igs в этих случаях [26, 55]. Наш опыт лечения пациентов со злокачественными опухолями и с септическим шоком, вызванным MDR Acinetobacter baumanii, на фоне нарушений иммунного ответа независимо коррелирует с риском 30 дневной летальности, но применение IgGAM в таких случаях несет пользу для пациента [58]. Такие же результаты были получены в Греции, в стране, где чрезмерно превалирует MDR инфекция. Giamarellos-Bourboulis et al. [59] показали протективный эффект от введения IgGAM пациентам с тяжелой MDR грамотрицательной флорой в контексте 28 дневной летальности.
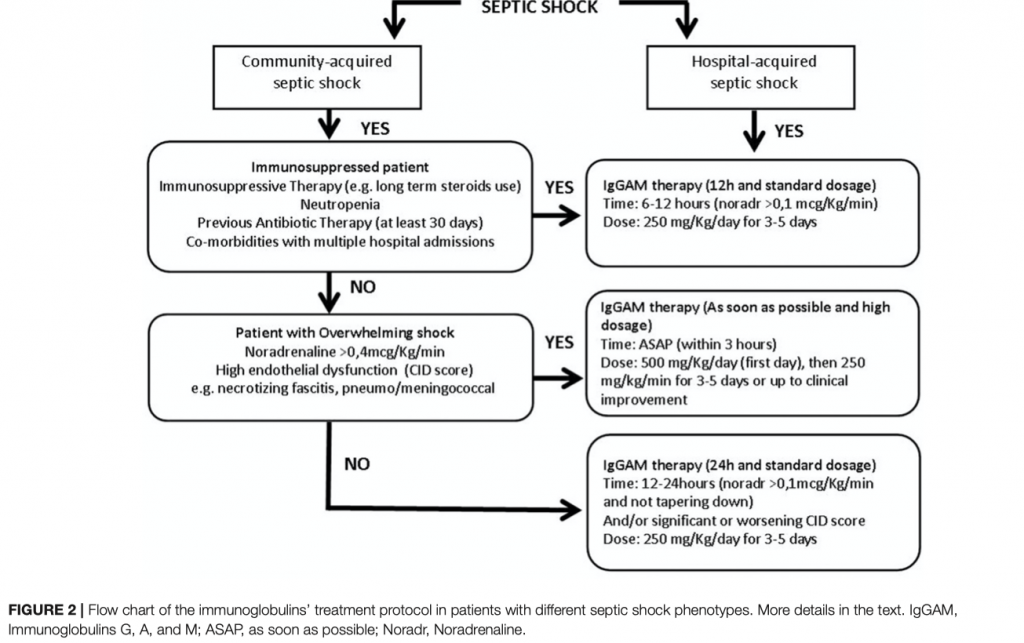
Для категоризации пациентов и дальнейшего движения вперед к персонализированной медицине мы разработали протокол применения IgGAM при септическом шоке (Рисунок 2), а целью этого протокола служит использование адъювантной терапии надлежащим образом - тем пациентам, которым она принесет пользу; в подходящий для этого момент времени и в правильной дозировке.
Необходимо разделять септические шоки на внебольничные и внутрибольничные. В контексте внебольничной инфекции краеугольным камнем является незамедлительное распознавание состояния тяжелого шока, как например, при некротизирующем фасцилите или при менингококкцемии. Септический шок, вызванный внебольничной инфекцией, развивается у пациентов с неповрежденной иммунной системой, характеризуется необходимостью в проведении вазопрессорной поддержки высокими, более 0.4 мкг/кг/мин, дозами норадреналина и выраженной эндотелиальной дисфункцией. Степень энодтелиальной дисфункции может быть установлена по шкале CID, очень простой шкале, основанной на таких лабораторных данных, как количество тромбоцитов, уровени фибриногена и маркеров фибрина (D-димер или продукты распада фибрина) в плазме, протромбиновое время, после чего можно говорить о рисках развития синдрома диссеминированного внутрисосудистого свертывания (ДВС) [60]. При таком состоянии терапию IgGAM следует начинать как можно скорее, в отдельных случаях в течение 3-х часов, при этом стартовая доза должна быть в два раза выше стандартной дозы, 500 мг/кг/сутки, а в последующие сутки применяется стандартная доза в 250 мг/кг/сутки в течение 3 - 5 суток или до момента клинического улучшения состояния пациента (Рисунок 2). Целями применения IgGAM служат: удаление токсинов и улучшение клиренса патогенов (бактерий) за счет усиления эффекта антибиотиков и стимуляции фагоцитоза.
В случае если у вновь поступившего в госпиталь пациента не наблюдается такой развернутой клинической картины септического шока, как это было описано выше, пациента необходимо оценить на предмет иммуносупрессии - предшествующая госпитализации антибактериальная терапия в течение последних 30 суток, нейтропения, определяемая как количество нейтрофилов ниже 1000/мл3, или сопутствующая иммуносупрессивная терапия, включая сюда длительное применение кортикостероидов. В этом случае применение Igs необходимо начинать в течение 6 -12 часов после начала шока, тогда, когда режим дозирования норадреналина свыше 0.1 мкг/кг/мин. Дозирование же IgGAM ограничивается стандартной дозой в 250 мг/кг/сутки в течение 3 - 5 дней (Рисунок 2). Такой режим дозирования объясняется тем, что в данном случае у нас нет необходимости контролировать избыточную продукцию цитокинов и/или в эрадикации патогенов. Но у нас есть необходимость в поддержке иммунной системы в условиях, когда уровень эндогенных Igs снижен. Таким образом здесь целью лечения является достижение баланса между противо- и провоспалительным ответом благодаря таким эффектам Igs, как модуляция рецепторов распознавания образов (инфламмасомы), сигнальных путей (NF-kB), эффекторных молекул (цитокины), а также эффектам анти-апоптоза клеток иммунной системы.
В случае когда у вновь поступившего пациента с септическим шоком нет клинических признаков развернутого шока и не имеется супрессии иммунной системы, введение Igs в стандартной дозе 250 мг/кг/сутки следует начинать после 12 - 24 часов (Рисунок 2) и тогда, когда режим дозирования норадреналина для достижения целевого значения среднего артериального давления становится превышает 0.1 мкг/кг/мин и/или тогда, когда оценка по шкале CID резко ухудшается [60], что свидетельствует об ухудшении состояния пациента.
У пациентов, находящиеся в госпитале, достаточно часто развивается нарушение функции иммунной системы, что связано с множеством предрасполагающих к этому факторов, а именно наличие сопутствующей патологии, антибактериальная терапия, высокий риск колонизации/инфекции MDR патогенами. Следовательно такие пациенты изначально должны рассматриваться, как пациенты с иммуносупрессией, а лечение септического шока у таких пациентов должно быть аналогичным лечению септического шока у пациентов с иммуносупрессией, впервые поступившим в госпиталь - начало введения стандартной дозы Igs в течение 6 -12 часов после диагностики септического шока и тогда, когда режим дозирования норадреналина превышает 0.1 мкг/кг/мин. Длительность введения Igs 3 - 5 суток или до клинического улучшения течения заболевания (Рисунок 2).
Наряду с этим предлагаемым клиническим протоколом мы проводим многоцентровое РКИ «Efficacy and Safety of Adjunctive IgM enriched Immunoglobulin Therapy with a Personalized Dose Based on Serum IgM-titers vs. Standard Dose in Patients with Septic Shock» (Эффективность и безопасность адъювантной терапии иммуноглобулином, обогащенном IgM, с персонализированной дозой, основанной на титрах сывороточного IgM, по сравнению со стандартной дозой, у пациентов с септическим шоком), целью которого является сравнение персонализированного режима дозирования IgGAM для достижения и поддержания титров в сыворотке выше 100 мг/дл, что может оказать иное влияние на 28-ми дневную летальность, чем стандартная доза (250 мг/кг в течение 3 дней) (NCT04182737).
Выводы
Септический шок требует дальнейших исследований эффективности применения адъювантной терапии. На сегодня, процесс выбора, или селекции, пациентов, в терминах персонализированной медицины становится очень важным, так именно такой подход к лечению может принести наибольшую пользу. Мы полагаем, что протокол лечения Igs пациентов с септическим шоком может быть одним из вариантов их лечения, не забывая при этом то, что
любой тип протокола, прежде чем рекомендовать его для широкого клинического применения, должен быть утвержден в рандомизированных контролируемых исследованиях.
Список литературы
1. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. (2016) 315:801–10. doi: 10.1001/jama.2016.0287
2. Vincent JL, Jones G, David S, Olariu E, Cadwell KK. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis. Crit Care. (2019) 23:196. doi: 10.1186/s13054-019-2478-6
3. The National Committee for the Evaluation of Centoxin. The French national registry of HA-1A (Centoxin) in septic shock: a cohort study of 600 patients. Arch Intern Med. (1994) 154:2484–91. doi: 10.1001/archinte.154.21.2484
4. McCloskey RV, Straube RC, Sanders C, Smith SM, Smith CR. Treatment of septic shock with human monoclonal antibody HA-1A. A randomized, double-blind, placebo-controlled trial. CHESS trial study group. Ann Intern Med. (1994) 121:11–21. doi: 10.7326/0003-4819-121-1199407010-00001
5. Abraham E, Anzueto A, Gutierrez G, Tessler S, San Pedro G, Wunderink R, et al. Double-blind randomised controlled trial of monoclonal antibody to human tumour necrosis factor in treatment of septic shock. NORASEPT II study group. Lancet. (1998) 351:929–33. doi: 10.1016/S0140-6736(05)60602-2
6. Opal SM, Fisher CJ Jr, Dhainaut JF, Vincent JL, Brase R, Lowry SF, et al. Confirmatory interleukin-1 receptor antagonist trial in severe sepsis: a phase III, randomized, double-blind, placebo-controlled, multicenter trial. The interleukin-1 receptor antagonist sepsis investigator group. Crit Care Med. (1997) 25:1115–24. doi: 10.1097/00003246-199707000-00010
7. Opal S, Laterre PF, Abraham E, Francois B, Wittebole X, Lowry S, et al. Recombinant human platelet-activating factor acetylhydrolase for treatment of severe sepsis: results of a phase III, multicenter, randomized, double-blind, placebo-controlled, clinical trial. Crit Care Med. (2004) 32:332–41. doi: 10.1097/01.CCM.0000108867.87890.6D
8. Annane D, Timsit JF, Megarbane B, Martin C, Misset B, Mourvillier B, et al. Recombinant human activated protein C for adults with septic shock: a randomized controlled trial. Am J Respir Crit Care Med. (2013) 187:1091–7. doi: 10.1164/rccm.201211-2020OC
9. Borthwick EM, Hill CJ, Rabindranath KS, Maxwell AP, McAuley DF, Blackwood B. High-volume haemofiltration for sepsis in adults. Cochrane Database Syst Rev. (2017) 1:CD008075. doi: 10.1002/14651858.CD008075.pub3
10. Payen DM, Guilhot J, Launey Y, Lukaszewicz AC, Kaaki M, Veber B, et al. Early use of polymyxin B hemoperfusion in patients with septic shock due to peritonitis: a multicenter randomized control trial. Intensive Care Med. (2015) 41:975–84. doi: 10.1007/s00134-015-3751-z
11. Dellinger RP, Bagshaw SM, Antonelli M, Foster DM, Klein DJ, Marshall JC, et al. Effect of targeted polymyxin B hemoperfusion on 28-day mortality in patients with septic shock and elevated endotoxin level: the EUPHRATES randomized clinical trial. JAMA. (2018) 320:1455– 63. doi: 10.1001/jama.2018.14618
12. Livigni S, Bertolini G, Rossi C, Ferrari F, Giardino M, Pozzato M, et al. Efficacy of coupled plasma filtration adsorption (CPFA) in patients with septic shock: a multicenter randomised controlled clinical trial. BMJ Open. (2014). 4:e003536. doi: 10.1136/bmjopen-2013-003536
13. Schädler D, Pausch C, Heise D, Meier-Hellmann A, Brederlau J, Weiler N, et al. The effect of a novel extracorporeal cytokine hemoadsorption device on IL-6 elimination in septic patients: A randomized controlled trial. PLoS ONE. (2017) 12:e0187015. doi: 10.1371/journal.pone.0187015
14. Hawchar F, László I, Öveges N, Trásy D, Ondrik Z, Molnar Z. Extracorporeal cytokine adsorption in septic shock: a proof of concept randomized, controlled pilot study. J Crit Care. (2019) 49:172–8. doi: 10.1016/j.jcrc.2018.11.003
15. Broman ME, Hansson F, Vincent JL, Bodelsson M. Endotoxin and cytokine reducing properties of the oXiris membrane in patients with septic shock: a randomized crossover double-blind study. PLoS ONE. (2019) 14:e0220444. doi: 10.1371/journal.pone.0220444
16. Moskowitz A, Huang DT, Hou PC, Gong J, Doshi PB, Grossestreuer AV, et al. Effect of ascorbic acid, corticosteroids, and thiamine on organ injury in septic shock: the ACTS randomized clinical trial. JAMA. (2020) 324:642– 50. doi: 10.1001/jama.2020.11946
17. Hwang SY, Ryoo SM, Park JE, Jo YH, Jang DH, Suh GJ, et al. Combination therapy of vitamin C and thiamine for septic shock: a multi-centre, doubleblinded randomized, controlled study. Intensive Care Med. (2020) 46:2015– 25. doi: 10.1007/s00134-020-06191-3
18. Meisel C, Schefold JC, Pschowski R, Baumann T, Hetzger K, Gregor J, et al. Granulocyte-macrophage colony-stimulating factor to reverse sepsis-associated immunosuppression: a double-blind, randomized, placebocontrolled multicenter trial. Am J Respir Crit Care Med. (2009) 180:640– 8. doi: 10.1164/rccm.200903-0363OC
19. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. (2017) 43:304– 77. doi: 10.1007/s00134-017-4683-6
20. Marshall JC. The PIRO (predisposition, insult, response, organ dysfunction) model: toward a staging system for acute illness. Virulence. (2014) 5:27–35. doi: 10.4161/viru.26908
21. Cardoso T, Teixeira-Pinto A, Rodrigues PP, Aragão I, CostaPereira A, Sarmento AE. Predisposition, insult/infection, response and organ dysfunction (PIRO): a pilot clinical staging system for hospital mortality in patients with infection. PLoS ONE. (2013) 8:e70806. doi: 10.1371/journal.pone.0070806
22. Rubio I, Osuchowski MF, Shankar-Hari M, Skirecki T, Winkler MS, Lachmann G, et al. Current gaps in sepsis immunology: new opportunities for translational research. Lancet Infect Dis. (2019) 19:e422–36. doi: 10.1016/S1473-3099(19)30567-5
23. Cao C, Yu M, Chai Y. Pathological alteration and therapeutic implications of sepsis-induced immune cell apoptosis. Cell Death Dis. (2019) 10:782. doi: 10.1038/s41419-019-2015-1
24. Daviaud F, Grimaldi D, Dechartres A, Charpentier J, Geri G, Marin N, et al. Timing and causes of death in septic shock. Ann Intensive Care. (2015) 5:16. doi: 10.1186/s13613-015-0058-8
25. Hotchkiss RS, Monneret G, Payen D. Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic approach. Lancet Infect Dis. (2013) 13:260–8. doi: 10.1016/S1473-3099(13)70001-X
26. Jarczak D, Kluge S, Nierhaus A. Use of intravenous immunoglobulins in sepsis therapy-a clinical view. Int J Mol Sci. (2020) 21:5543. doi: 10.3390/ijms21155543
27. Nagelkerke SQ, Kuijpers TW. Immunomodulation by IVIg and the role of Fc-gamma receptors: classic mechanisms of action after all? Front Immunol. (2014) 5:674. doi: 10.3389/fimmu.2014.00674
28. Venet F, Gebeile R, Bancel J, Guignant C, Poitevin-Later F, Malcus C, et al. Assessment of plasmatic immunoglobulin G, A and M levels in septic shock patients. Int Immunopharmacol. (2011) 11:2086–90. doi: 10.1016/j.intimp.2011.08.024
29. Giamarellos-Bourboulis EJ, Apostolidou E, Lada M, Perdios I, Gatselis NK, Tsangaris I, et al. Kinetics of circulating immunoglobulin M in sepsis: relationship with final outcome. Crit Care. (2013). 17:R247. doi: 10.1186/cc13073
30. Toth I, Mikor A, Leiner T, Molnar Z, Bogar L, Szakmany T. Effects of IgM-enriched immunoglobulin therapy in septic-shockinduced multiple organ failure: pilot study. J Anesth. (2013) 27:618–22. doi: 10.1007/s00540-012-1553-9
31. Werdan K, Pilz G, Bujdoso O, Fraunberger P, Neeser G, Schmieder RE, et al. Score-based immunoglobulin G therapy of patients with sepsis: the SBITS study. Crit Care Med. (2007) 35:2693–701. doi: 10.1097/00003246-200712000-00003
32. Hentrich M, Fehnle K, Ostermann H, Kienast J, Cornely O, Salat C, et al. IgMA-enriched immunoglobulin in neutropenic patients with sepsis syndrome and septic shock: a randomized, controlled, multiple-center trial. Crit Care Med. (2006) 34:1319–25. doi: 10.1097/01.CCM.0000215452.84291.C6
33. Rodríguez A, Rello J, Neira J, Maskin B, Ceraso D, Vasta L, et al. Effects of high-dose of intravenous immunoglobulin and antibiotics on survival for severe sepsis undergoing surgery. Shock. (2005) 23:298–304. doi: 10.1097/01.shk.0000157302.69125.f8
34. Darenberg J, Ihendyane N, Sjölin J, Aufwerber E, Haidl S, Follin P, et al. Intravenous immunoglobulin G therapy in streptococcal toxic shock syndrome: a European randomized, double-blind, placebo-controlled trial. Clin Infect Dis. (2003) 37:333–40. doi: 10.1086/376630
35. Tugrul S, Ozcan PE, Akinci O, Seyhun Y, Cagatay A, Cakar N, et al. The effects of IgM-enriched immunoglobulin preparations in patients with severe sepsis [ISRCTN28863830]. Crit Care. (2002) 6:357–62. doi: 10.1186/cc1523
36. Karatzas S, Boutzouka E, Venetsanou K, Myrianthefs P, Fildisis G, Baltopoulos G. The effects of IgM-enriched immunoglobulin preparations in patients with severe sepsis: another point of view. Crit Care. (2002) 6:543- 4. doi: 10.1186/cc1837
37. Busani S, Damiani E, Cavazzuti I, Donati A, Girardis M. Intravenous immunoglobulin in septic shock: review of the mechanisms of action and meta-analysis of the clinical effectiveness. Minerva Anestesiol. (2016) 82:559–72. Available online at: https://www.minervamedica.it
38. Yang Y, Yu X, Zhang F, Xia Y. Evaluation of the effect of intravenous immunoglobulin dosing on mortality in patients with sepsis: a network metaanalysis. Clin Ther. (2019) 41:1823–38.e4. doi: 10.1016/j.clinthera.2019.06.010
39. Nishida O, Ogura H, Egi M, Fujishima S, Hayashi Y, Iba T, et al. The Japanese clinical practice guidelines for management of sepsis and septic shock 2016 (J-SSCG 2016). J Intensive Care. (2018) 6:7. doi: 10.1186/s40560-017-0270-8
40. Rossmann FS, Kropec A, Laverde D, Saaverda FR, Wobser D, Huebner J. In vitro and in vivo activity of hyperimmune globulin preparations against multiresistant nosocomial pathogens. Infection. (2015) 43:16 75. doi: 10.1007/s15010-014-0706-1
41. Soares MO, Welton NJ, Harrison DA, Peura P, Shankar-Hari M, Harvey SE, et al. An evaluation of the feasibility, cost and value of information of a multicentre randomised controlled trial of intravenous immunoglobulin for sepsis (severe sepsis and septic shock): incorporating a systematic review, meta-analysis and value of information analysis. Health Technol Assess. (2012) 16:1–186. doi: 10.3310/hta16070
42. Domizi R, Adrario E, Damiani E, Scorcella C, Carsetti A, Giaccaglia P, et al. IgM-enriched immunoglobulins (pentaglobin) may improve the microcirculation in sepsis: a pilot randomized trial. Ann Intensive Care. (2019) 9:135. doi: 10.1186/s13613-019-0609-5
43. Hoffman JN, Fertmann JM, Vollmar B, Laschke MW, Jauch KW, Menger
MD. Immunoglobulin M-enriched human intravenous immunoglobulins reduce leukocyte-endothelial cell interactions and attenuate microvascular perfusion failure in normotensive endotoxemia. Shock. (2008) 29:133– 9. doi: 10.1097/SHK.0b013e318123e5a6
44. Aubron C, Berteau F, Sparrow R L. Intravenous immunoglobulin for adjunctive treatment of severe infections in ICUs. Curr Opin Crit Care. (2019) 25:417–22. doi: 10.1097/MCC.0000000000000639
45. Berlot G, Vassallo MC, Busetto N, Nieto Yabar M, Istrati T, Baronio S, et al. Effects of the timing of administration of IgM- and IgA-enriched intravenous polyclonal immunoglobulins on the outcome of septic shock patients. Ann Intensive Care. (2018) 8:122. doi: 10.1186/s13613-018-0466-7
46. Hung IFN, To KKW, Lee CK, Lee KL, Yan WW, Chan K, et al. Hyperimmune IV immunoglobulin treatment: a multicenter double-blind randomized controlled trial for patients with severe 2009 influenza A(H1N1) infection. Chest. (2013) 144:464–73. doi: 10.1378/chest.12-2907
47. Xie Y, Cao S, Dong H, Li Q, Chen E, Zhang W, et al. Effect of regular intravenous immunoglobulin therapy on prognosis of severe pneumonia in patients with COVID-19. J Infect. (2020) 81:318–56. doi: 10.1016/j.jinf.2020.03.044
48. Arumugham VB, Rayi A. Intravenous immunoglobulin (IVIG). In: StatPearls. Treasure Island, FL: StatPearls Publishing (2020).
49. Seidling V, Hoffmann JH, Enk AH, Hadaschik EN. Analysis of highdose intravenous immunoglobulin therapy in 16 patients with refractory autoimmune blistering skin disease: high efficacy and no serious adverse events. Acta Derm Venereol. (2013) 93:346–9. doi: 10.2340/00015555-1471
50. Manlhiot C, Tyrrell PN, Liang L, Atkinson AR, Lau W, Feldman BM. Safety of intravenous immunoglobulin in the treatment of juvenile dermatomyositis: adverse reactions are associated with immunoglobulin A content. Pediatrics. (2008) 121:e626–30. doi: 10.1542/peds.2007-1218
51. Dashti-Khavidaki S, Aghamohammadi A, Farshadi F, Movahedi M, Parvaneh N, Pouladi N, et al. Adverse reactions of prophylactic intravenous immunoglobulin; a 13-year experience with 3004 infusions in Iranian patients with primary immunodeficiency diseases. J Investig Allergol Clin Immunol. (2009) 19:139–45. Available online at: http://www.jiaci.org
52. Guo Y, Tian X, Wang X, Xiao Z. Adverse effects of immunoglobulin therapy.
Front Immunol. (2018) 9:1299. doi: 10.3389/fimmu.2018.01299
53. Thornby KA, Henneman A, Brown DA. Evidence-based strategies to reduce intravenous immunoglobulin-induced headaches. Ann Pharmacother. (2015) 49:715–26. doi: 10.1177/1060028015576362
54. Peetermans M, Wan RYY, Camporota L, Barrett NA, Retter A. Use of intravenous immunoglobulins in patients with suspected toxin-mediated shock requiring extracorporeal membrane oxygenation. Shock. (2020) 54:209–12. doi: 10.1097/SHK.0000000000001519
55. Nierhaus A, Berlot G, Kindgen-Milles D, Müller E, Girardis M. Best-practice IgM-and IgA-enriched immunoglobulin use in patients with sepsis. Ann Intensive Care. (2020) 10:132. doi: 10.1186/s13613-020-00740-1
56. Linnér A, Darenberg J, Sjölin J, Henriques-Normark B, Norrby-Teglund A. Clinical efficacy of polyspecific intravenous immunoglobulin therapy in patients with streptococcal toxic shock syndrome: a comparative observational study. Clin Infect Dis. (2014) 59:851–7. doi: 10.1093/cid/ciu449
57. Bruun T, Rath E, Bruun Madsen M, Oppegaard O, Nekludov M, Arnell P, et al. Risk factors and predictors of mortality in streptococcal necrotizing soft-tissue infections: a multicenter prospective study. Clin Infect Dis. (2020) 10:ciaa027. doi: 10.1093/cid/ciaa027
58. Busani S, Serafini G, Mantovani E, Venturelli C, Giannella M, Viale P, et al. Mortality in patients with septic shock by multidrug resistant bacteria: risk factors and impact of sepsis treatments. J Intensive Care Med. (2019) 34:48–54. doi: 10.1177/0885066616688165
59. Giamarellos-Bourboulis EJ, Tziolos N, Routsi C, Katsenos C, Tsangaris I, Pneumatikos I, et al. Improving outcomes of severe infections by multidrugresistant pathogens with polyclonal IgM-enriched immunoglobulins. Clin Microbiol Infect. (2016) 22:499–506. doi: 10.1016/j.cmi.2016.01.021
60. Taylor FB Jr, Toh CH, Hoots WK, Wada H, Levi M, Scientific Subcommittee on Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost. (2001). 86:1327–30. doi: 10.1055/s-0037-1616068