Array
(
[NAME] => Сепсис-ассоциированное острое почечное повреждение в отделении интенсивной терапии: частота, характеристики пациентов, сроки развития, лечение и ассоциированные исходы: многоцентровое, обсервационное исследование
[~NAME] => Сепсис-ассоциированное острое почечное повреждение в отделении интенсивной терапии: частота, характеристики пациентов, сроки развития, лечение и ассоциированные исходы: многоцентровое, обсервационное исследование
[PREVIEW_PICTURE] => Array
(
[ID] => 5426
[TIMESTAMP_X] => 08.11.2023 16:42:29
[MODULE_ID] => iblock
[HEIGHT] => 563
[WIDTH] => 1001
[FILE_SIZE] => 143438
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/343/80htj0vxzn20bj11ki3ansjqx7ncpyrw
[FILE_NAME] => abstract-motion-design-backpain-kidneys.jpg
[ORIGINAL_NAME] => abstract-motion-design-backpain-kidneys.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 68e9b67c6e9cb555fabd52df51ee498e
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/343/80htj0vxzn20bj11ki3ansjqx7ncpyrw/abstract-motion-design-backpain-kidneys.jpg
[UNSAFE_SRC] => /upload/iblock/343/80htj0vxzn20bj11ki3ansjqx7ncpyrw/abstract-motion-design-backpain-kidneys.jpg
[SAFE_SRC] => /upload/iblock/343/80htj0vxzn20bj11ki3ansjqx7ncpyrw/abstract-motion-design-backpain-kidneys.jpg
[ALT] => Сепсис-ассоциированное острое почечное повреждение в отделении интенсивной терапии: частота, характеристики пациентов, сроки развития, лечение и ассоциированные исходы: многоцентровое, обсервационное исследование
[TITLE] => Сепсис-ассоциированное острое почечное повреждение в отделении интенсивной терапии: частота, характеристики пациентов, сроки развития, лечение и ассоциированные исходы: многоцентровое, обсервационное исследование
)
[~PREVIEW_PICTURE] => 5426
[DETAIL_TEXT] =>
Intensive Care Med
https://doi.org/10.1007/s00134-023-07138-0
Оригинальное исследование
Сепсис-ассоциированное острое почечное повреждение в отделении интенсивной терапии: частота, характеристики пациентов, сроки развития, лечение и ассоциированные исходы: многоцентровое, обсервационное исследование
Перевод оригинальной статьи «Sepsis-associated acute kidney injury in the intensive care unit: incidence, patient characteristics, timing, trajectory, treatment, and associated outcomes. A multicenter, observational study»
Авторы: Kyle C. White 1,2,3, Ary Serpa‑Neto 4,5 , Rod Hurford 1, Pierre Clement 6, Kevin B. Laupland 3,6, Emily See 7,8,9,10,11, James McCullough 12, Hayden White 13,14, Kiran Shekar 2,3,15, Alexis Tabah 2,3,16, Mahesh Ramanan 2,17,18, Peter Garrett 5,19, Antony G. Attokaran 2,20, Stephen Luke 21,22, Siva Senthuran22,23, Philippa McIlroy 24 and Rinaldo Bellomo 4,8,9,25 по поручению the Queensland Critical Care Research Network (QCCRN)
Информация об авторах:
1 Intensive Care Unit, Princess Alexandra Hospital, 199 Ipswich Road, Woolloongabba, Brisbane, QLD 4102, Australia.
2 Faculty of Medicine, University of Queensland, Brisbane, QLD, Australia.
3 Queensland University of Technology (QUT), Brisbane, QLD, Australia.
4 Australian and New Zealand Intensive Care Research Centre (ANZIC‑RC), School of Public Health and Preventive Medicine, Monash University, Melbourne, Australia. 5 Department of Critical Care Medicine, Hospital Israelita Albert Einstein, São Paulo, Brazil.
6 Department of Intensive Care Services, Royal Brisbane and Women’s Hospital, Brisbane, QLD, Australia.
7 School of Medicine, University of Melbourne, Melbourne, Australia.
8 Department of Critical Care, University of Melbourne, Melbourne, Australia.
9 Department of Intensive Care, Austin Hospital, Heidelberg, Australia.
10 Department of Nephrology, The Royal Melbourne Hospital, Parkville, Australia. 11 Department of Nephrology, The Royal Children’s Hospital, Parkville, Australia. 12 Intensive Care Unit, Gold Coast University Hospital, Southport, QLD, Australia. 13 Intensive Care Unit, Logan Hospital, Logan, QLD, Australia.
14 School of Medicine and Dentistry, Griffith University, Mount Gravatt, QLD, Australia.
15 Adult Intensive Care Services, The Prince Charles Hospital, Brisbane, QLD, Australia.
16 Intensive Care Unit, Redcliffe Hospital, Brisbane, QLD, Australia.
17 Intensive Care Unit, Caboolture Hospital, Caboolture, QLD, Australia.
18 Critical Care Division, The George Institute for Global Health, University of New South Wales, Sydney, Australia.
19 Intensive Care Unit, Sunshine Coast University Hospital, Birtinya, QLD, Australia.
20 Intensive Care Unit, Rockhampton Hospital, The Range, QLD, Australia.
21 Intensive Care Services, Mackay Base Hospital, Mackay, QLD, Australia.
22 College of Medicine and Dentistry, James Cook University, Townsville, QLD, Australia.
23 Intensive Care Unit, Townsville Hospital, Townsville, QLD, Australia.
24 Intensive Care Unit, Cairns Hospital, Cairns, QLD, Australia.
25 Department of Intensive Care,, Royal Melbourne Hospital, Melbourne, Australia.
Keywords: Critical care, Acute kidney injury, Sepsis, Sepsis‑associated acute kidney injury
Ключевые слова: критическая терапия, острое почечное повреждение, сепсис, сепсис-ассоциированное острое почечное повреждение
Введение
Сепсис — распространенная причина критического заболевания, что ассоциируется с высокой заболеваемостью и летальностью [1—3] и часто сопровождается острым почечным повреждением (ОПП). Когда ОПП развивается на фоне сепсиса, это рассматривается как сепсис-ассоциированное острое почечное повреждение (СА-ОПП) [4, 5]. Ассоциация между сепсисом и ОПП и ранее подвергалась изучению [6, 7], но отсутствие до недавнего времени воспроизводимых и стандартизированных консенсусных определений ограничивало интерпретацию доступных на сегодня знаний.
Недавно 28 рабочей группой the Acute Disease Quality Initiative (ADQI) было разработано определение СА-ОПП [8]. Это сочетание сепсиса, определенного по критериям Сепсис-3 [9], с ОПП, определенного по критериям the Kidney Disease Improving Global Outcomes (KDIGO), и что произошло в течение 7 дней с момента диагностики сепсиса.
Эпидемиология СА-ОПП при критических заболеваниях на основании этого стандартизованного консенсусного определения остается неизвестной. Более того, распространенность СА-ОПП, характеристики пациентов, сроки развития, траектория, лечение и ассоциированные исходы до настоящего времени не изучались. В целях оценки СА-ОПП мы, ведомые консенсусным определением 28 рабочей группы ADQI и приоритетами исследований, подвергли анализу большую, детализированную, многоцентровую базу данных, в которой в рутинном порядке собирались электронные истории болезни. Нашей целью было подвергнуть тестированию гипотезу, что СА-ОПП распространена у пациентов, поступивших в отделение интенсивной терапии (ОИТ). Мы также намеревались протестировать вторую гипотезу о том, что большая часть СА-ОПП не является заболеванием интенсивной терапии, а чаще развивается за пределами ОИТ, а также и то, что именно развитие СА-ОПП побуждает к переводу пациента в ОИТ. Еще одной гипотезой для тестирования стало то, что пациенты с СА-ОПП имеют худшие почечные и не-почечные исходы по сравнению с пациентами без СА-ОПП.
Методы
Дизайн исследования
Большое, многоцентровое, ретроспективное, когортное исследование детализированной базы клинических данных, собранной рутинно из электронных историй болезни.
Месторасположение
12 ОИТ, расположенных в Квинсленде, Австралия, из них 5 ОИТ третичного уровня, 3 ОИТ за пределами столицы и 4 региональных ОИТ. Все они представляют такие направления оказания медицинской помощи, как кардиоторакальное, нейрохирургическое, акушерское и травму. Мы изучили всех взрослых пациентов, поступивших в период с 1 января 2015 года по 31 декабря 2021 года. Следует отметить, что Квинсленд, Австралия, не имел в сообществе распространения коронавирусного заболевания 2019 (COVID-19) на момент проведения исследования и, тем самым, глобальная пандемия не оказала существенного влияния на результаты исследования. Все пациенты расценивались как годные к исследованию, если была доступна их электронная история болезни. Мы исключили пациентов с прогрессирующим хроническим заболеванием почек, которые требовали постоянного диализа, пациентов, госпитализированных для паллиативной терапии, и пациентов, переведенных из других ОИТ, участвующих в этом исследовании. Мы не исключали эпизоды повторной госпитализации с тем же самым заболеванием.
Источники данных
Рутинно собираемые данные были получены из всех центров, использующих клиническую информационную систему «the eCritical MetaVision™» (iMDsoft, Boston, MA, USA). Сюда были включены ежедневные лабораторные данные, медикаментозная терапия, микробиология, почасовые гемодинамические данные и почасовые данные о балансе жидкости. Информация об исходных демографических данных, причинах поступления, тяжести заболевания и исходах были извлечены из the Australia and Zealand Intensive Care Society (ANZICS) Centre for Outcomeand Resource Evaluation (CORE) Adult Patient Database (APD) [11–14]. Количество утерянных данных в отношении ключевых переменных показаны в Дополнительной таблице S1.
Идентификация сепсиса
Сепсис определялся согласно третьему международному консенсусному определению сепсиса и септического шока [9]. Согласно Сепсис-3 определению, мы идентифицировали пациентов с увеличением баллов по шкале последовательной оценки органного повреждения (SequentialOrgan Failure Assessment [SOFA]) до двух баллов и с подтвержденной инфекцией, либо с подозрением на инфекцию [9]. Мы предполагали, что SOFA была равна нулю до момента поступления в ОИТ. Когда индивидуальные компоненты SOFA были утеряны, то общая оценка не учитывалась [12]. Ежедневно рассчитывалась оценка по SOFA с идентификацией случаев повышения оценки до двух баллов в течение 24 часов. Принимая во внимание трудности при интерпретации неврологической SOFA при седации, эти оценки не включались в общую SOFA[15]. Подтверждение инфекции или подозрение на инфекцию определялось, как начале антимикробной терапии или ее эскалации, а также при наличии микробиологических проб, взятых в течение первого дня с момента увеличения баллов по SOFA [16]. Эскалация антимикробной терапии определялась как увеличение «рейтинга» антимикробного препарата в течение 1 дня с момента диагностики сепсиса [17, 18]. Как показано в Дополнительной таблице 2S, рейтинг соответствовал спектру активности, при котором оценка в один балл указывала на меньший спектр активности (к примеру, первое поколение цефалоспоринов), а оценка в четыре балла указывала на наивысший спектр (к примеру, карбапенемы или тигециклин) [18].
Пациенты, поступившие после плановых хирургических вмешательств, после травмы или по причине внезапной остановки сердечной деятельности, рассматривались как получающие антибиотикопрофилактику в первые 2 дня после поступления. Тем самым, эти пациенты не классифицировались как имеющие сепсис, независимо от оценок по шкале SOFA. Септический шок определялся при введении вазопрессоров и при повышении, хотя бы однократном, уровня лактата крови более чем на 2 ммоль/л на момент диагностики сепсиса [19]. При этом дозировки вазопрессоров конвертировались в эквивалент норэпинефрина, а метод конверсии показан в Дополнительной таблице S3 [20].
Идентификация острого почечного повреждения
Диагноз ОПП ставился согласно определению KDIGO при ежедневном контроле за уровнем сывороточного креатинина и почасовым темпом диуреза (urine output [UO]) [10]. Для управления отсутствующими данным по измерению темпа диуреза, вызванными отсутствием мочевого катетера или переводом за пределы ОИТ, мы выполняли условное вычисление, что описано в Дополнительной таблице S4. Почасовое измерение темпа диуреза на килограмм массы тела оценивалось на предмет идентификации пациентов, кто отвечал критериям ОПП по темпу диуреза. Каждые 6, 12 и 24 час оценивался темп диуреза в сравнении с пороговыми точками ОПП. Мы провели множественный анализ чувствительности с оценкой систематической разницы, связанной с условным вычислением темпа диуреза (Дополнительные таблицы S5, S6). Наш набор данных не содержал информации об уровне креатинина до момента поступления в ОИТ, поэтому исходные значения креатинина были рассчитаны, исходя из формулы the Chronic Kidney Disease–Epidemiology Collaboration (CKD-EPI), предполагающую расчетную формулу скорости гломерулярной фильтрации (glomerular filtrationrate [eGFR]), равную 75 мл/мин/1.73 м2 [21, 22]. Ежедневный уровень креатинина сравнивался с расчетным исходным уровнем креатинина и регистрировались значения, отвечающие определению ОПП. Был проведен множественные анализ чувствительности, сравнивающий различные методы расчета исходных уровней креатинина (Дополнительная таблица S7). Для идентификации того, отвечает ли пациент критериям ОПП по KDIGO, использовались либо темп диуреза, либо уровень креатинина, либо оба этих критерия.
Идентификация сепсис-ассоциированного острого почечного повреждения
После идентификации в индивидуальном порядке эпизодов сепсиса и ОПП, мы применили определение СА-ОПП, разработанное 28 рабочей группой ADQI. Мы сравнили день диагностики сепсиса с днем диагностики ОПП. Если ОПП случилось между 1 и 7 днями диагностики сепсиса, пациенты были классифицированы как СА-ОПП согласно критерию ADQI. Пациенты не отвечали определению СА-ОПП, если ОПП предшествовало эпизоду сепсиса. Был проведен анализ чувствительности, сравнивающий пациентов с диагнозом сепсис или ОПП, но не отвечающих критериям СА-ОПП (Дополнительный рисунок S8).
Исходы
Первичным исходом стала частота развития СА-ОПП. Вторичным исходом стали сроки развития СА-ОПП по отношению к поступлению в ОИТ. Дополнительными вторичными исходами стали: функция почек, тяжесть ОПП, статус восстановления функции почек и большие неблагоприятные почечные события к 30 дню (major adverse kidney events[MAKE-30]), а также не-почечные события, длительность пребывания в ОИТ и в госпитале, госпитальная летальность и летальность в ОИТ. Определения исходов предоставлены на дополнительном рисунке S11.
Статистический анализ
Описательная статистика была выражена в виде частот и пропорций для категориальных переменных и медиан с межквартильными диапазонами (IQR) или средних значений со стандартными отклонениями в зависимости от их параметрического или непараметрического распределения. Точный критерий Фишера был использован для сравнения категориальных данных. Для изучения факторов, связанных с госпитальной летальностью и большими нежелательными явлениями со стороны почек на 30-й день (MAKE-30), была разработана модель логистической регрессии со смешанным эффектом, включающая госпитали в качестве случайного эффекта. Переменные, использованные для анализа, были определены априори и отражали клиническую полезность имеющихся данных. Результаты многофакторного анализа были представлены в виде отношения шансов (odds ratios [OR]) с 95% доверительными интервалами (95% confidence intervals CI). Учитывая большой набор данных, двустороннее значение p <0,01 считалось статистически значимым. Статистический анализ проводился с использованием программного обеспечения R v.4.0.3.
Этические соображения
Это исследование было одобрено the Metro South Hospital and Health Service Human Research Ethics Committee (HREC/2022/QMS/82024).
Результаты
Частота развития СА-ОПП
С 1 января 2015 года по 31 декабря 2021 года 89 466 пациентов поступили в ОИТ, участвующие в исследовании. Мы исключили 1950 пациентов с терминальной стадией заболевания почек, 544 пациента, поступивших на паллиативное лечение и 2503 пациентов, переведенных из других отделений. Среди оставшихся 84 528 пациентов, 13 451 отвечали критериям СА-ОПП во время их поступления в ОИТ. Как показано на дополнительном рисунке S1, процентное соотношение поступивших в ОИТ пациентов, отвечающих критериям СА-ОПП, с течением времени выросло с 14% в 2015 году до почти 18% в 2021 году.
Характеристики пациентов
Характеристики пациентов как без СА-ОПП, так и с СА-ОПП, показаны в Таблице 1. В общей когорте медиана возраста составила 61 год, 39% были женщинами, а медиана индекса массы тела (ИМТ) составила 27.8. Медиана оценок тяжести заболевания по шкале APACHE III (AcutePhysiology and Chronic Health Evaluation) составила 50, а наиболее частым путем поступления стали операционные, далее следовало отделение неотложной помощи.
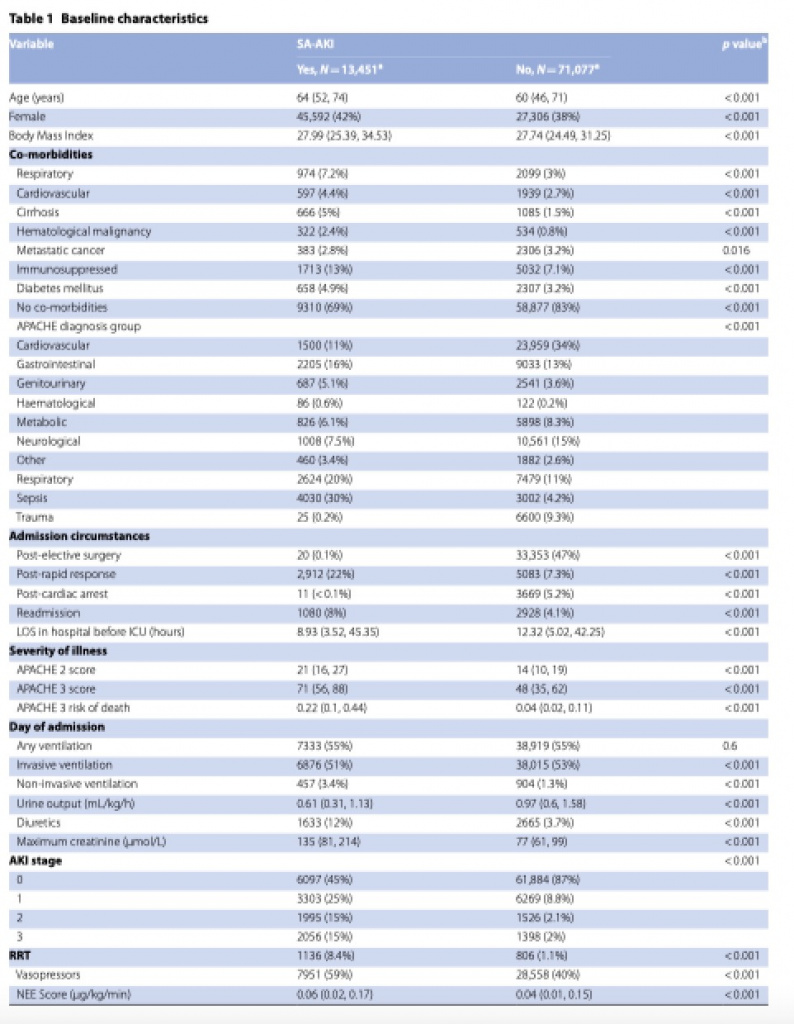
По сравнению с общей когортой, пациенты с СА-ОПП имели более высокие оценки по шкале APACHE III, с большей вероятностью поступление было из отделения неотложной помощи или из общей палаты госпиталя, имели более высокий риск смерти. При имеющейся статистической разнице возраст пациентов из группы СА-ОПП, в численном отношении, был аналогичен возрасту общей когорты, и аналогичное распределение по полу и индексу массы тела.
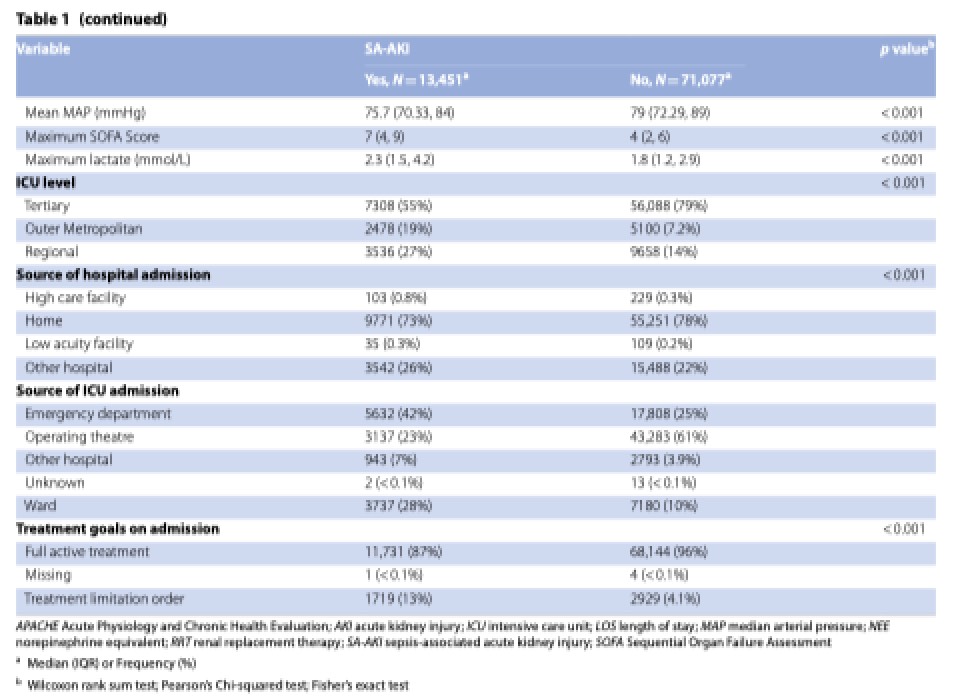
При поступлении в ОИТ большинству пациентов с СА-ОПП требовалось проведение механической вентиляции, что не отличалось от пациентов без СА-ОПП. Почти половина пациентов с СА-ОПП получала терапию вазопрессорами по меньшей мере в течение 1 часа, а одному из десяти пациентов требовалось проведение ПЗТ, что было намного чаще, чем у пациентов без СА-ОПП. Стоить отметить, что терапия диуретиками использовалась редко.
Сроки развития и характеристики СА-ОПП
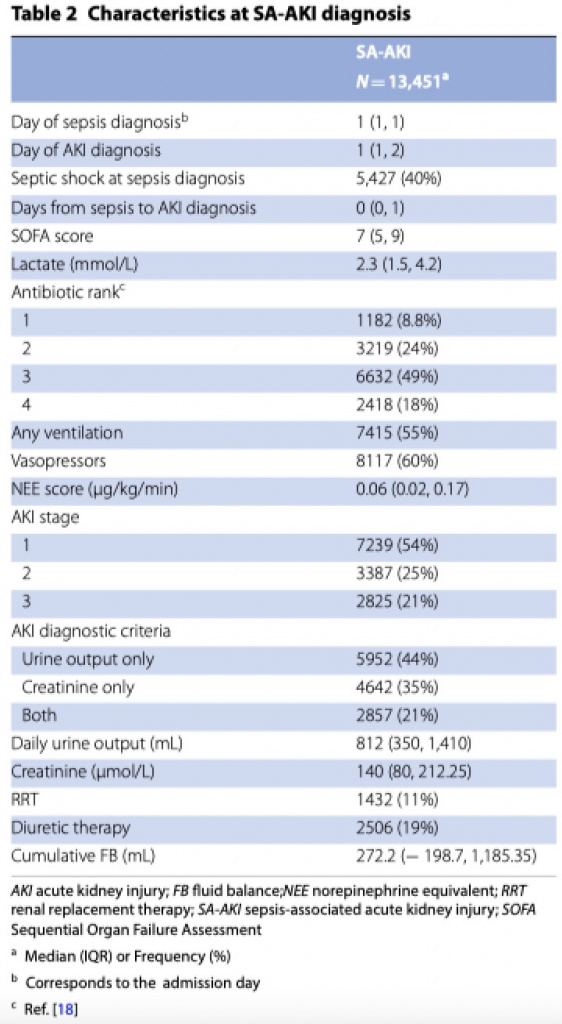
Как показано в Таблице 2, медиана дней установки диагноза сепсиса составила день поступления в ОИТ или день 1 [IQR 1–1]. На момент постановки диагноза СА-ОПП более трети пациентов (40%) имели септический шок и медиану оценок по шкале SOFA 7 (IQR 5–9). Большинство пациентов отвечали критериям ОПП в тот же день, что и критериям сепсиса, с медианой времени от сепсиса до ОПП равной 0 (IQR 0–1). У большинства пациентов (44%) диагноз ОПП основывался на данных темпа диуреза, в то время как 35% и 21% отвечали критериям креатинина (только) или обоим критериям (темп диуреза и креатинин), соответственно. На момент диагностики ОПП большинство пациентов имели 1 стадию ОПП в то время, как только 25% и 21% имели стадию 2 или 3, соответственно. Только 11% пациентов получили ПЗТ в день диагностики СА-ОПП. Как показано в дополнительной Таблице S4, у 65% (5 700) пациентов с СА-ОПП 1 стадии диагноз был установлено только по темпу диуреза, что представляет 35% от всех когорты пациентов с СА-ОПП.
Траектория СА-ОПП
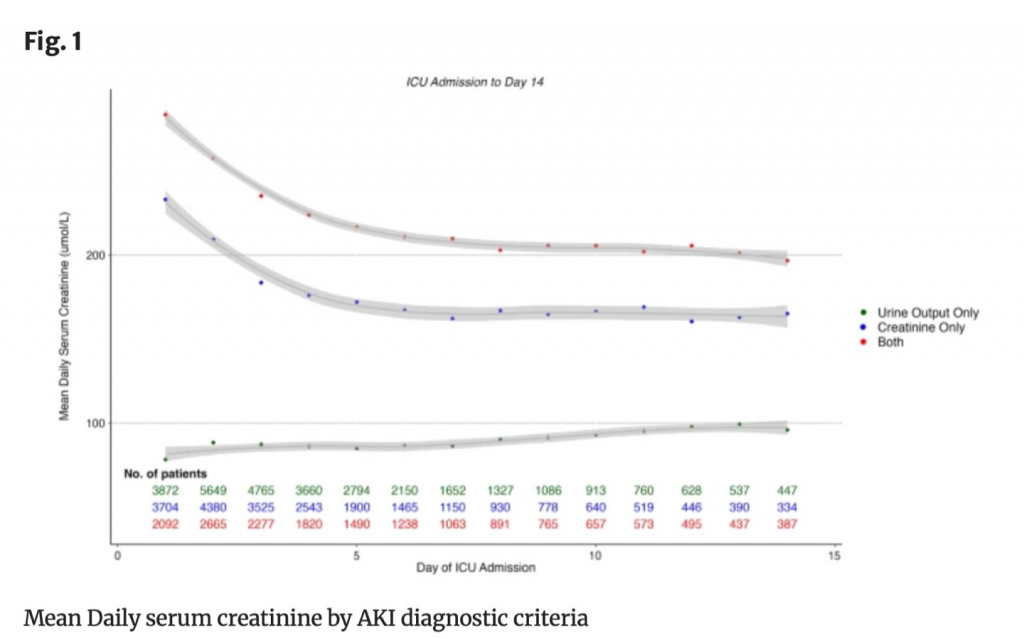
Мы изучили траекторию СА-ОПП путем ежедневного измерения сывороточного креатинина и почасового диуреза вплоть до 14 дня. Средний уровень сывороточного креатинина у у выживших пациентов с СА-ОПП стабилизировался к шестому дню от поступления в ОИТ со средним значением 130 мкмоль/л и с пиковыми значениями 170 мкмоль/л, а у не выживших (умерших в госпитале) пациентов средние значения сывороточного креатинина составили 155 мкмоль/л, а пиковые — 180 мкмоль/л (Дополнительный Рис. S2). Пациенты со стадиями 1 и 2 ОПП не имели больших колебаний средних значений сывороточного креатинина за все время наблюдения. Средние значения сывороточного креатинина у пациентов с 3 стадией ОПП снижались от пиковых значений около 400 мкмоль/л на первый день, а с шестого дня значения оставались на уровне 200 мкмоль/л (Дополнительный Рис. S3). Поскольку у большинства пациентов диагноз ОПП основывался только на темпе диуреза, мы изучили сывороточный креатинин, как критерий ОПП, за все время. У пациентов с диагнозом ОПП только лишь по темпу диуреза, средние уровни сывороточного креатинина оставались без изменения и в нормальных значениях во время всего периода пребывания в ОИТ (Рис.1). Эти результаты находятся в соответствии с каждой стадией ОПП (Рис. S4, S6). Более того, среди пациентов, которым диагноз ОПП ставился только лишь по темпу диуреза, почасовой темп диуреза при всех стадиях ОПП показывал, что нормализация темпа диуреза типична и случается в течение 24—48 часов после поступления в ОИТ (Дополнительные Рис. S7, S9). И наоборот, пациенты, которым диагноз ОПП ставился на основании темпа диуреза и креатинина, имели постоянно низкий темп диуреза, увеличенные уровни сывороточного креатинина, при этом почасовой диурез никогда не превышал 1 мл/кг/час (Дополнительный Рис. S10), а уровни сывороточного креатинина оставались высокими ≥ 200 мкмоль/л (Рис.1).
Резюме по траектории стадий ОПП с течением времени для всей когорты пациентов с СА-ОПП показано на дополнительном Рис. S11, когда количество пациентов с ОПП стадий 1 или 2 снижалось, в то время как у пациентов с ОПП 3 стадии такого не наблюдалось и 3 стадия ОПП сохранялась на протяжении всего времени пребывания пациентов в ОИТ. Траектория СА-ОПП, диагноз которого поставлен на основании темпа диуреза, показана на дополнительном Рис. S12, где видно быстрое разрешение ОПП у большинства пациентов.
Лечение в первые семь дней после поступления в ОИТ
Лечение в ОИТ изучалось в первые 7 дней после поступления в ОИТ, временной промежуток, что находится в верхнем квартиле длительности пребывания пациентов в ОИТ. По сравнению с пациентами, у которых диагноз СА-ОПП поставлен на основании креатинина (только) или креатинина и темпа диуреза, пациенты, у которых диагноз СА-ОПП был поставлен на основании только лишь темпа диуреза, с большей вероятностью получали механическую вентиляцию, но существенно меньшую вероятность получения вазопрессоров и ПЗТ (Таблица 3). Исключая механическую вентиляцию у пациентов с СА-ОПП 3 стадии, все выше показанные результаты были последовательными для всех стадий тяжести ОПП (Дополнительные Таблицы S11–S13).

При сравнении пациентов с СА-ОПП 1 и 2 стадии, пациенты со стадией 3 с меньшей вероятностью получали механическую вентиляцию, меньше дней получали вазопрессоры и имели большую вероятность получения ПЗТ (Дополнительная Таблица S14), что может свидетельствовать о дополнительном взаимодействии с хронической болезнью почек (ХБП), но данные были недоступны. Для всей когорты исследования пациенты с СА-ОПП имели большую вероятность в получении механической вентиляции, вазопрессоров и ПЗТ (Дополнительная Таблица S15).
Ассоциированные исходы
Как показано на Таблице 4, мы изучали исходы, основываясь на критериях диагностики ОПП (темп диуреза [только], креатинин [только], оба критерия). Пациенты, у которых диагноз ОПП был установлен на основании только лишь сниженного темпа диуреза, имели менее тяжелое ОПП, меньше нуждались в ПЗТ, имели более высокую частоту восстановления функции почек и более низкую летальность по сравнению с пациентами, у которых диагноз ОПП устанавливался на основании уровня сывороточного креатинина и темпа диуреза или только лишь на основании уровня сывороточного креатинина. Для дальнейшего определения влияния тяжести ОПП на диагноз мы сравнили исходы по критериям диагностики ОПП в каждой группе, определенной по тяжести ОПП. При ОПП 1 стадии, по сравнению с креатинином (только) или с креатинином и темпом диуреза, только лишь сниженный темп диуреза указывал на меньшую тяжесть ОПП с более низкой потребностью в ПЗТ, с более низкой летальностью и низкому показателю MAKE-30 (Дополнительная таблица S16). Относительно низкая потребность в ПЗТ, меньшая летальность и почти полное отсутствие неблагоприятных почечных исходов у пациентов, у которых диагноз ОПП устанавливался только лишь на сниженном темпе диуреза, находились в соответствии с стадиями 2 и 3 (Дополнительные таблицы S17, S18). При всех стадиях ОПП пациенты, у которых диагноз ОПП устанавливался только лишь на основании темпа диуреза, имели в три раза большие шансы полного восстановления функции почек по сравнению с пациентами, у которых диагноз ОПП устанавливался на основании креатинина (только) или креатинина и темпа диуреза. По сравнению со всей когортой пациенты с СА-ОПП имели более длительное время пребывания в ОИТ и в госпитале, а также более высокую летальность в ОИТ и в госпитале (Дополнительная Таблица S19).
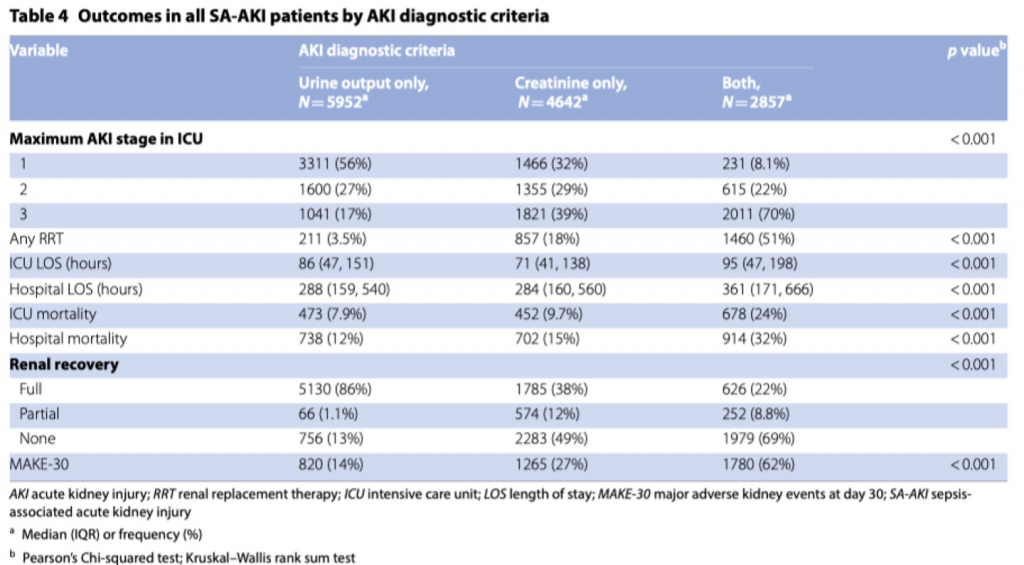
Для пациентов с СА-ОПП мы разработали модель многовариантной логистической регрессии для MAKE-30 (Дополнительная Таблица S20). При условии контроля за характеристиками пациента, возрастом, полом, ИМТ и тяжестью заболевания (APACHE III), а также за потребностью в механической вентиляции и вазопрессорах, диагноз ОПП только по критерию темпа диуреза (OR 0.34; 95% CI 0.32–0.36; p < 0.001) был ассоциирован со значительно меньшим развитием MAKE-30, когда сравнение проводилось с диагностикой ОПП на основании креатинина (только) или креатинина и темпа диуреза.
Обсуждение
Ключевые выводы
В этом многоцентровом исследовании мы изучили около 90 000 критически больных пациентов и нашли, что СА-ОПП случается в одном из шести случаев поступления в ОИТ, а также то, то в четырех из десяти случаев экстренное поступление осуществлялось из дома (from thecommunity), а одно поступление из четырех - из палаты госпиталя. Обращает внимание то, что пропорция пациентов, поступающих в ОИТ с диагнозом СА-ОПП за последние годы увеличивается. При сравнении с другими причинами поступления в ОИТ пациенты с СА-ОПП имеют более тяжелое состояние и получают больше органной поддержки.
СА-ОПП преимущественно развивается в течение первых 24 часов после поступления в ОИТ, а диагноз сепсиса и ОПП устанавливаются практически одновременно. На момент диагностики у большинства пациентов ОПП имеет 1 стадию и характеризуется снижением темпа диуреза и относительно низкими уровнями креатинина. Эта когорта, как правило, имела раннюю нормализацию темпа диуреза с разрешением ОПП. В общем и целом, пациенты с СА-ОПП, что отвечали критериям ОПП только лишь по снижению темпа диуреза, имели более короткое время пребывания в ОИТ и в госпитале, как и более низкую летальность по сравнению с оставшимися пациентами с СА-ОПП. И, наконец, после корректировки на исходные характеристики и тяжесть заболевания, пациенты с СА-ОПП, диагноз которого был установлен на основании темпа диуреза, имели значительно меньше MAKE-30 событий.
Взаимосвязь с литературой
Насколько нам известно, нет и на было других исследований, изучающих эпидемиологию СА-ОПП в большой многоцентровой когорте пациентов, поступивших в ОИТ, в которых использовались недавние согласованные определения ADQI. До появления этих определений предыдущие исследования показывали значительную гетерогенность в популяции пациентов с различной частотой и летальностью [8]. При этом в двух недавно опубликованных исследованиях для выявления СА-ОПП использовались критерии Сепсис-3 и KDIGO [23, 24]. Одно из них было одноцентровым ретроспективным исследованием, что включило в себя 351 пациентов с СА-ОПП, и авторы сообщили об очень низкой частоте развития СА-ОПП на уровне 2.8%, что ограничивает внешнюю валидность [23]. Другое исследование также было одноцентровым и ретроспективным, в котором изучалась ассоциация между ожирением и ОПП в когорте из 456 пациентов, что не позволило уделить внимание эпидемиологии СА-ОПП [24]. Ни в одном исследовании детально не изучались частота развития, характеристики, сроки, траектория, лечение и исходы СА-ОПП в большой многоцентровой популяции. Ни в одном предыдущем исследовании не оценивалась взаимосвязь между диагностическими критериями ОПП и исходами у пациентов с СА-ОПП.
Значение результатов исследования
Наши результаты подразумевают, что СА-ОПП становится все более распространенным состоянием в ОИТ. Более того, мы предполагаем, что СА-ОПП развивается у пациентов, поступающих в ОИТ из дома и у которых уже в ОИТ имеется сочетание сепсиса и ОПП. В другой большой пропорции СА-ОПП развивалась в палате госпиталя, что, таким образом, может стать целью для более ранних вмешательств.
Далее, быстрое восстановление и редко наблюдаемое ухудшение почечной функции у пациентов с СА-ОПП, диагноз которого установлен только лишь по снижение темпа диуреза, позволяет предположить, что более чем у половины пациентов наличие СА-ОПП имеет очень ограниченное клиническое значение. Результаты наши исследования ясно показывают очень высокую частоту восстановления почечной функции у пациентов с СА-ОПП, диагноз которого поставлен на основании только лишь снижения темпа диуреза. Тем самым, низкий темп диуреза может представлять собой физиологический ответ на сепсис больше, чем патофизиологический маркер начинающегося органного повреждения. Результаты нашего исследования могут иметь значительные терапевтические и исследовательские последствия в будущем, поскольку нынешний стандарт медицинской помощи может быть достаточным для лечения большинства случаев 1 стадии СА-ОПП и предотвращения неблагоприятных исходов. Более того, будущие исследования лечения SA-AKI вряд ли будут обладать достаточной мощностью при выявлении эффектов ПЗТ, MAKE-30 или летальности, когда в исследование будут включаться пациенты с СА-ОПП, диагноз которого установлен только лишь на сниженном темпе диуреза.
Сильные стороны и ограничения
Наше исследование имеет несколько сильных сторон. Во-первых, исследование проведено в большой когорте пациентов, представляющих собой максимальный спектр госпитализаций в отделения интенсивной терапии общегосударственной системы здравоохранения. Популяция исследования представляет общую популяцию Австралии и, вероятно, аналогичную популяцию стран с высоким уровнем дохода. Во-вторых, в нашем исследовании использовался большой массив детальных данных, что извлекались из широко применяемой клинической электронной информационной системы. Все данные были клинически подтверждены, а потери данных были минимальны. В-третьих, даже несмотря на то, что мы использовали новейшее стандартизованное определение СА-ОПП, это определение включает в себе определения ОПП Сепсис-3 и KDIGO, которые уже хорошо зарекомендовали себя в литературе. Следовательно, мы воспользовались возможностью применить хорошо известную технологию при анализе большой базы данных в целях идентификации сепсиса и ОПП.
Мы признаем некоторые ограничения. Первое, выявление сепсиса и ОПП и, тем самым СА-ОПП, было сделано электронным путем, так что в классификации пациентов могли быть сделаны ошибки. Органная дисфункция, выявленная с помощью анализа, могла быть и не вызвана инфекцией. В то же время, наша большая когорта пациентов, вероятно, смогла ограничить влияние такого необычного обстоятельства. Второе, мы не классифицировали СА-ОПП на фенотипы, как это предложено 28 рабочей группой ADQI [8]. Тем самым, наша когорта пациентов с СА-ОПП может представлять различающиеся группы с расходящимися факторами риска и исходами. В плане у нас проведение исследования, в котором основное внимание будет уделено фенотипам. Третье, так как мы не смогли идентифицировать пациентов, которые страдали ХБП до момента госпитализации, это могло привести к завышению оценки ОПП при использовании расчетного уровня креатинина [25]. Это серьезный вопрос, поскольку пациенты с ХБП имеют специфические характеристики и отличающиеся исходы по сравнению с пациентами без ХБП [26]. Но предыдущее исследование, в котором изучались более 3500 аналогичных пациентов из четырех госпиталей, которые вошли в наше исследование, сообщило, что распространение ХБП составило около 13.5% [27]. Изучение пациентов с ХБП потребует сбора дополнительных данных в будущих исследованиях. Четвертое, проверка таких компонентов, как ПЗТ и сывороточный креатинин при MAKE-30 на момент перевода из ОИТ, потенциально могла привести к предвзятости в оценке. И, наконец, условный расчет темпа диуреза мог привести к ошибочной классификации пациентов с ОПП. Но при этом анализ чувствительности показал отсутствие системных различий между группами, а также снижение, а не повышение, диагностики ОПП при условном расчете.
Выводы
В большой когорте критически больных пациентов мы нашли, что СА-ОПП имеет большое распространение у пациентов, поступающих в ОИТ из отделения неотложной помощи и чаще всего диагностируется на день поступления в ОИТ, а также и то, что диагноз сепсиса и ОПП очень часто ставится в один день. Более того, у большинства пациентов с СА-ОПП диагноз ставился на фоне 1 стадии ОПП на основании только низкого темпа диуреза, что редко было ассоциировано со значительным ухудшением почечной функции, как это определяется согласно MAKE-30. Все эти наблюдения предоставляют необходимую эпидемиологическую основу для последующих интервенционных исследований, одновременно подчеркивая необходимость уделять особое внимание специфическим подгруппам пациентов с СА-ОПП.
Список литературы:
1. Finfer S, Machado FR (2016) The global epidemiology of sepsis. Does it matter that we know so little? Am J Resp Crit Care 193(3):228–230
2. Vincent JL, Sakr Y, Sprung CL, Ranieri VM, Reinhart K, Gerlach H et al (2006) Sepsis in European intensive care units and colon; results of the SOAP study and ast. Crit Care Med 34(2):344–353
3. Chiu C, Legrand M (2021) Epidemiology of sepsis and septic shock. Curr Opin Anaesthesiol 34(2):71–76
4. Poston JT, Koyner JL (2019) Sepsis associated acute kidney injury. BMJ 364:k4891
5. Peerapornratana S, Manrique‑Caballero CL, Gómez H, Kellum JA (2019) Acute kidney injury from sepsis: current concepts, epidemiology, pathophysiology, prevention and treatment. Kidney Int 96(5):1083–1099
6. Bagshaw SM, George C, Bellomo R, Committee ADM (2008) Early acute kidney injury and sepsis: a multicentre evaluation. Crit Care 12(2):R47
7. Bagshaw SM, Uchino S, Bellomo R, Morimatsu H, Morgera S, Schetz M et al (2007) Septic acute kidney injury in critically ill patients: clinical characteristics and outcomes. Clin J Am Soc Nephro 2(3):431–439
8. Zarbock A, Nadim MK, Pickkers P, Gomez H, Bell S, Joannidis M et al (2023) Sepsis‑associated acute kidney injury: consensus report of the 28th Acute Disease Quality Initiative workgroup. Nat Rev Nephrol. https://doi.org/10. 1038/s41581‑023‑00683‑3
9. Singer M, Deutschman CS, Seymour CW, Shankar‑Hari M, Annane D, Bauer M et al (2016) The third international consensus definitions for sepsis and septic shock (Sepsis‑3). JAMA 315(8):801–810
10. Khwaja A (2012) KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract 120(4):c179–c184
11. Bagshaw SM, George C, Bellomo R, Committe ADM (2008) A comparison of the RIFLE and AKIN criteria for acute kidney injury in critically ill patients. Nephrol Dial Transpl 23(5):1569–1574
12. Raith EP, Udy AA, Bailey M, McGloughlin S, MacIsaac C, Bellomo R et al (2017) Prognostic accuracy of the SOFA score, SIRS criteria, and qSOFA score for in‑hospital mortality among adults with suspected infection admitted to the intensive care unit. JAMA 317(3):290–300
13. Corrigan C, Duke G, Millar J, Paul E, Butt W, Gordon M et al (2022) Admissions of children and adolescents with deliberate self‑harm to intensive care during the SARS‑CoV‑2 outbreak in australia. Jama Netw Open 5(5):e2211692
14. Kirsi‑Maija K, Michael B, David P, Jamie CD, Rinaldo B (2015) Systemic inflammatory response syndrome criteria in defining severe sepsis. New Engl J Med 372(17):1629–1638
15. Lambden S, Laterre PF, Levy MM, Francois B (2019) The SOFA scoredevelopment, utility and challenges of accurate assessment in clinical trials. Crit Care 23(1):374
16. Seymour CW, Liu VX, Iwashyna TJ, Brunkhorst FM, Rea TD, Scherag A et al (2016) Assessment of clinical criteria for sepsis: for the third international consensus definitions for sepsis and septic shock (Sepsis‑3). JAMA 315(8):762–774
17. Shah AD, MacCallum NS, Harris S, Brealey DA, Palmer E, Hetherington J et al (2021) Descriptors of sepsis using the sepsis‑3 criteria: a cohort study in critical care units within the UK National Institute for Health Research critical care health informatics collaborative. Crit Care Med 49(11):1883–1894
18. Braykov NP, Morgan DJ, Schweizer ML, Uslan DZ, Kelesidis T, Weisenberg SA et al (2014) Assessment of empirical antibiotic therapy optimisation in six hospitals: an observational cohort study. Lancet Infect Dis 14(12):1220–1227
19. Shankar‑Hari M, Phillips GS, Levy ML, Seymour CW, Liu VX, Deutschman CS et al (2016) Developing a new definition and assessing new clinical criteria for septic shock: for the third international consensus definitions for sepsis and septic shock (sepsis‑3). JAMA 315(8):775–787
20. Khanna A, English SW, Wang XS, Ham K, Tumlin J, Szerlip H et al (2017) Angiotensin II for the treatment of vasodilatory shock. New Engl J Medicine 377(5):419–430
21. Inker LA, Eneanya ND, Coresh J, Tighiouart H, Wang D, Sang Y et al (2021) New creatinine‑ and cystatin C‑based equations to estimate GFR without race. New Engl J Med 385(19):1737–1749
22. Cooper DJ, Plewes K, Grigg MJ, Patel A, Rajahram GS, William T et al (2021) An evaluation of commonly used surrogate baseline creatinine values to classify AKI during acute infection. Kidney Int Rep 6(3):645–656
23. Katayama S, Nunomiya S, Koyama K, Wada M, Koinuma T, Goto Y et al (2017) Markers of acute kidney injury in patients with sepsis: the role of soluble thrombomodulin. Crit Care 21(1):229
24. Gameiro J, Gonçalves M, Pereira M, Rodrigues N, Godinho I, Neves M et al (2018) Obesity, acute kidney injury and mortality in patients with sepsis: a cohort analysis. Ren Fail 40(1):120–126
25. Bernier‑Jean A, Beaubien‑Souligny W, Goupil R, Madore F, Paquette F, Troyanov S et al (2017) Diagnosis and outcomes of acute kidney injury using surrogate and imputation methods for missing preadmission creatinine values. Bmc Nephrol 18(1):141
26. Bagshaw SM, Neto AS, Smith O, Weir M, Qiu H, Du B et al (2022) Impact of renal‑replacement therapy strategies on outcomes for patients with chronic kidney disease: a secondary analysis of the STARRT‑AKI trial. Intensive Care Med 48:1736
27. White K, Tabah A, Ramanan M, Shekar K, Edwards F, Laupland KB (2023) 90‑day case‑fatality in critically ill patients with chronic liver disease influenced by presence of portal hypertension, results from a multicentre retrospective cohort study. J Crit Care 1(38):5–10
[~DETAIL_TEXT] =>
Intensive Care Med
https://doi.org/10.1007/s00134-023-07138-0
Оригинальное исследование
Сепсис-ассоциированное острое почечное повреждение в отделении интенсивной терапии: частота, характеристики пациентов, сроки развития, лечение и ассоциированные исходы: многоцентровое, обсервационное исследование
Перевод оригинальной статьи «Sepsis-associated acute kidney injury in the intensive care unit: incidence, patient characteristics, timing, trajectory, treatment, and associated outcomes. A multicenter, observational study»
Авторы: Kyle C. White 1,2,3, Ary Serpa‑Neto 4,5 , Rod Hurford 1, Pierre Clement 6, Kevin B. Laupland 3,6, Emily See 7,8,9,10,11, James McCullough 12, Hayden White 13,14, Kiran Shekar 2,3,15, Alexis Tabah 2,3,16, Mahesh Ramanan 2,17,18, Peter Garrett 5,19, Antony G. Attokaran 2,20, Stephen Luke 21,22, Siva Senthuran22,23, Philippa McIlroy 24 and Rinaldo Bellomo 4,8,9,25 по поручению the Queensland Critical Care Research Network (QCCRN)
Информация об авторах:
1 Intensive Care Unit, Princess Alexandra Hospital, 199 Ipswich Road, Woolloongabba, Brisbane, QLD 4102, Australia.
2 Faculty of Medicine, University of Queensland, Brisbane, QLD, Australia.
3 Queensland University of Technology (QUT), Brisbane, QLD, Australia.
4 Australian and New Zealand Intensive Care Research Centre (ANZIC‑RC), School of Public Health and Preventive Medicine, Monash University, Melbourne, Australia. 5 Department of Critical Care Medicine, Hospital Israelita Albert Einstein, São Paulo, Brazil.
6 Department of Intensive Care Services, Royal Brisbane and Women’s Hospital, Brisbane, QLD, Australia.
7 School of Medicine, University of Melbourne, Melbourne, Australia.
8 Department of Critical Care, University of Melbourne, Melbourne, Australia.
9 Department of Intensive Care, Austin Hospital, Heidelberg, Australia.
10 Department of Nephrology, The Royal Melbourne Hospital, Parkville, Australia. 11 Department of Nephrology, The Royal Children’s Hospital, Parkville, Australia. 12 Intensive Care Unit, Gold Coast University Hospital, Southport, QLD, Australia. 13 Intensive Care Unit, Logan Hospital, Logan, QLD, Australia.
14 School of Medicine and Dentistry, Griffith University, Mount Gravatt, QLD, Australia.
15 Adult Intensive Care Services, The Prince Charles Hospital, Brisbane, QLD, Australia.
16 Intensive Care Unit, Redcliffe Hospital, Brisbane, QLD, Australia.
17 Intensive Care Unit, Caboolture Hospital, Caboolture, QLD, Australia.
18 Critical Care Division, The George Institute for Global Health, University of New South Wales, Sydney, Australia.
19 Intensive Care Unit, Sunshine Coast University Hospital, Birtinya, QLD, Australia.
20 Intensive Care Unit, Rockhampton Hospital, The Range, QLD, Australia.
21 Intensive Care Services, Mackay Base Hospital, Mackay, QLD, Australia.
22 College of Medicine and Dentistry, James Cook University, Townsville, QLD, Australia.
23 Intensive Care Unit, Townsville Hospital, Townsville, QLD, Australia.
24 Intensive Care Unit, Cairns Hospital, Cairns, QLD, Australia.
25 Department of Intensive Care,, Royal Melbourne Hospital, Melbourne, Australia.
Keywords: Critical care, Acute kidney injury, Sepsis, Sepsis‑associated acute kidney injury
Ключевые слова: критическая терапия, острое почечное повреждение, сепсис, сепсис-ассоциированное острое почечное повреждение
Введение
Сепсис — распространенная причина критического заболевания, что ассоциируется с высокой заболеваемостью и летальностью [1—3] и часто сопровождается острым почечным повреждением (ОПП). Когда ОПП развивается на фоне сепсиса, это рассматривается как сепсис-ассоциированное острое почечное повреждение (СА-ОПП) [4, 5]. Ассоциация между сепсисом и ОПП и ранее подвергалась изучению [6, 7], но отсутствие до недавнего времени воспроизводимых и стандартизированных консенсусных определений ограничивало интерпретацию доступных на сегодня знаний.
Недавно 28 рабочей группой the Acute Disease Quality Initiative (ADQI) было разработано определение СА-ОПП [8]. Это сочетание сепсиса, определенного по критериям Сепсис-3 [9], с ОПП, определенного по критериям the Kidney Disease Improving Global Outcomes (KDIGO), и что произошло в течение 7 дней с момента диагностики сепсиса.
Эпидемиология СА-ОПП при критических заболеваниях на основании этого стандартизованного консенсусного определения остается неизвестной. Более того, распространенность СА-ОПП, характеристики пациентов, сроки развития, траектория, лечение и ассоциированные исходы до настоящего времени не изучались. В целях оценки СА-ОПП мы, ведомые консенсусным определением 28 рабочей группы ADQI и приоритетами исследований, подвергли анализу большую, детализированную, многоцентровую базу данных, в которой в рутинном порядке собирались электронные истории болезни. Нашей целью было подвергнуть тестированию гипотезу, что СА-ОПП распространена у пациентов, поступивших в отделение интенсивной терапии (ОИТ). Мы также намеревались протестировать вторую гипотезу о том, что большая часть СА-ОПП не является заболеванием интенсивной терапии, а чаще развивается за пределами ОИТ, а также и то, что именно развитие СА-ОПП побуждает к переводу пациента в ОИТ. Еще одной гипотезой для тестирования стало то, что пациенты с СА-ОПП имеют худшие почечные и не-почечные исходы по сравнению с пациентами без СА-ОПП.
Методы
Дизайн исследования
Большое, многоцентровое, ретроспективное, когортное исследование детализированной базы клинических данных, собранной рутинно из электронных историй болезни.
Месторасположение
12 ОИТ, расположенных в Квинсленде, Австралия, из них 5 ОИТ третичного уровня, 3 ОИТ за пределами столицы и 4 региональных ОИТ. Все они представляют такие направления оказания медицинской помощи, как кардиоторакальное, нейрохирургическое, акушерское и травму. Мы изучили всех взрослых пациентов, поступивших в период с 1 января 2015 года по 31 декабря 2021 года. Следует отметить, что Квинсленд, Австралия, не имел в сообществе распространения коронавирусного заболевания 2019 (COVID-19) на момент проведения исследования и, тем самым, глобальная пандемия не оказала существенного влияния на результаты исследования. Все пациенты расценивались как годные к исследованию, если была доступна их электронная история болезни. Мы исключили пациентов с прогрессирующим хроническим заболеванием почек, которые требовали постоянного диализа, пациентов, госпитализированных для паллиативной терапии, и пациентов, переведенных из других ОИТ, участвующих в этом исследовании. Мы не исключали эпизоды повторной госпитализации с тем же самым заболеванием.
Источники данных
Рутинно собираемые данные были получены из всех центров, использующих клиническую информационную систему «the eCritical MetaVision™» (iMDsoft, Boston, MA, USA). Сюда были включены ежедневные лабораторные данные, медикаментозная терапия, микробиология, почасовые гемодинамические данные и почасовые данные о балансе жидкости. Информация об исходных демографических данных, причинах поступления, тяжести заболевания и исходах были извлечены из the Australia and Zealand Intensive Care Society (ANZICS) Centre for Outcomeand Resource Evaluation (CORE) Adult Patient Database (APD) [11–14]. Количество утерянных данных в отношении ключевых переменных показаны в Дополнительной таблице S1.
Идентификация сепсиса
Сепсис определялся согласно третьему международному консенсусному определению сепсиса и септического шока [9]. Согласно Сепсис-3 определению, мы идентифицировали пациентов с увеличением баллов по шкале последовательной оценки органного повреждения (SequentialOrgan Failure Assessment [SOFA]) до двух баллов и с подтвержденной инфекцией, либо с подозрением на инфекцию [9]. Мы предполагали, что SOFA была равна нулю до момента поступления в ОИТ. Когда индивидуальные компоненты SOFA были утеряны, то общая оценка не учитывалась [12]. Ежедневно рассчитывалась оценка по SOFA с идентификацией случаев повышения оценки до двух баллов в течение 24 часов. Принимая во внимание трудности при интерпретации неврологической SOFA при седации, эти оценки не включались в общую SOFA[15]. Подтверждение инфекции или подозрение на инфекцию определялось, как начале антимикробной терапии или ее эскалации, а также при наличии микробиологических проб, взятых в течение первого дня с момента увеличения баллов по SOFA [16]. Эскалация антимикробной терапии определялась как увеличение «рейтинга» антимикробного препарата в течение 1 дня с момента диагностики сепсиса [17, 18]. Как показано в Дополнительной таблице 2S, рейтинг соответствовал спектру активности, при котором оценка в один балл указывала на меньший спектр активности (к примеру, первое поколение цефалоспоринов), а оценка в четыре балла указывала на наивысший спектр (к примеру, карбапенемы или тигециклин) [18].
Пациенты, поступившие после плановых хирургических вмешательств, после травмы или по причине внезапной остановки сердечной деятельности, рассматривались как получающие антибиотикопрофилактику в первые 2 дня после поступления. Тем самым, эти пациенты не классифицировались как имеющие сепсис, независимо от оценок по шкале SOFA. Септический шок определялся при введении вазопрессоров и при повышении, хотя бы однократном, уровня лактата крови более чем на 2 ммоль/л на момент диагностики сепсиса [19]. При этом дозировки вазопрессоров конвертировались в эквивалент норэпинефрина, а метод конверсии показан в Дополнительной таблице S3 [20].
Идентификация острого почечного повреждения
Диагноз ОПП ставился согласно определению KDIGO при ежедневном контроле за уровнем сывороточного креатинина и почасовым темпом диуреза (urine output [UO]) [10]. Для управления отсутствующими данным по измерению темпа диуреза, вызванными отсутствием мочевого катетера или переводом за пределы ОИТ, мы выполняли условное вычисление, что описано в Дополнительной таблице S4. Почасовое измерение темпа диуреза на килограмм массы тела оценивалось на предмет идентификации пациентов, кто отвечал критериям ОПП по темпу диуреза. Каждые 6, 12 и 24 час оценивался темп диуреза в сравнении с пороговыми точками ОПП. Мы провели множественный анализ чувствительности с оценкой систематической разницы, связанной с условным вычислением темпа диуреза (Дополнительные таблицы S5, S6). Наш набор данных не содержал информации об уровне креатинина до момента поступления в ОИТ, поэтому исходные значения креатинина были рассчитаны, исходя из формулы the Chronic Kidney Disease–Epidemiology Collaboration (CKD-EPI), предполагающую расчетную формулу скорости гломерулярной фильтрации (glomerular filtrationrate [eGFR]), равную 75 мл/мин/1.73 м2 [21, 22]. Ежедневный уровень креатинина сравнивался с расчетным исходным уровнем креатинина и регистрировались значения, отвечающие определению ОПП. Был проведен множественные анализ чувствительности, сравнивающий различные методы расчета исходных уровней креатинина (Дополнительная таблица S7). Для идентификации того, отвечает ли пациент критериям ОПП по KDIGO, использовались либо темп диуреза, либо уровень креатинина, либо оба этих критерия.
Идентификация сепсис-ассоциированного острого почечного повреждения
После идентификации в индивидуальном порядке эпизодов сепсиса и ОПП, мы применили определение СА-ОПП, разработанное 28 рабочей группой ADQI. Мы сравнили день диагностики сепсиса с днем диагностики ОПП. Если ОПП случилось между 1 и 7 днями диагностики сепсиса, пациенты были классифицированы как СА-ОПП согласно критерию ADQI. Пациенты не отвечали определению СА-ОПП, если ОПП предшествовало эпизоду сепсиса. Был проведен анализ чувствительности, сравнивающий пациентов с диагнозом сепсис или ОПП, но не отвечающих критериям СА-ОПП (Дополнительный рисунок S8).
Исходы
Первичным исходом стала частота развития СА-ОПП. Вторичным исходом стали сроки развития СА-ОПП по отношению к поступлению в ОИТ. Дополнительными вторичными исходами стали: функция почек, тяжесть ОПП, статус восстановления функции почек и большие неблагоприятные почечные события к 30 дню (major adverse kidney events[MAKE-30]), а также не-почечные события, длительность пребывания в ОИТ и в госпитале, госпитальная летальность и летальность в ОИТ. Определения исходов предоставлены на дополнительном рисунке S11.
Статистический анализ
Описательная статистика была выражена в виде частот и пропорций для категориальных переменных и медиан с межквартильными диапазонами (IQR) или средних значений со стандартными отклонениями в зависимости от их параметрического или непараметрического распределения. Точный критерий Фишера был использован для сравнения категориальных данных. Для изучения факторов, связанных с госпитальной летальностью и большими нежелательными явлениями со стороны почек на 30-й день (MAKE-30), была разработана модель логистической регрессии со смешанным эффектом, включающая госпитали в качестве случайного эффекта. Переменные, использованные для анализа, были определены априори и отражали клиническую полезность имеющихся данных. Результаты многофакторного анализа были представлены в виде отношения шансов (odds ratios [OR]) с 95% доверительными интервалами (95% confidence intervals CI). Учитывая большой набор данных, двустороннее значение p <0,01 считалось статистически значимым. Статистический анализ проводился с использованием программного обеспечения R v.4.0.3.
Этические соображения
Это исследование было одобрено the Metro South Hospital and Health Service Human Research Ethics Committee (HREC/2022/QMS/82024).
Результаты
Частота развития СА-ОПП
С 1 января 2015 года по 31 декабря 2021 года 89 466 пациентов поступили в ОИТ, участвующие в исследовании. Мы исключили 1950 пациентов с терминальной стадией заболевания почек, 544 пациента, поступивших на паллиативное лечение и 2503 пациентов, переведенных из других отделений. Среди оставшихся 84 528 пациентов, 13 451 отвечали критериям СА-ОПП во время их поступления в ОИТ. Как показано на дополнительном рисунке S1, процентное соотношение поступивших в ОИТ пациентов, отвечающих критериям СА-ОПП, с течением времени выросло с 14% в 2015 году до почти 18% в 2021 году.
Характеристики пациентов
Характеристики пациентов как без СА-ОПП, так и с СА-ОПП, показаны в Таблице 1. В общей когорте медиана возраста составила 61 год, 39% были женщинами, а медиана индекса массы тела (ИМТ) составила 27.8. Медиана оценок тяжести заболевания по шкале APACHE III (AcutePhysiology and Chronic Health Evaluation) составила 50, а наиболее частым путем поступления стали операционные, далее следовало отделение неотложной помощи.

По сравнению с общей когортой, пациенты с СА-ОПП имели более высокие оценки по шкале APACHE III, с большей вероятностью поступление было из отделения неотложной помощи или из общей палаты госпиталя, имели более высокий риск смерти. При имеющейся статистической разнице возраст пациентов из группы СА-ОПП, в численном отношении, был аналогичен возрасту общей когорты, и аналогичное распределение по полу и индексу массы тела.

При поступлении в ОИТ большинству пациентов с СА-ОПП требовалось проведение механической вентиляции, что не отличалось от пациентов без СА-ОПП. Почти половина пациентов с СА-ОПП получала терапию вазопрессорами по меньшей мере в течение 1 часа, а одному из десяти пациентов требовалось проведение ПЗТ, что было намного чаще, чем у пациентов без СА-ОПП. Стоить отметить, что терапия диуретиками использовалась редко.
Сроки развития и характеристики СА-ОПП
Как показано в Таблице 2, медиана дней установки диагноза сепсиса составила день поступления в ОИТ или день 1 [IQR 1–1]. На момент постановки диагноза СА-ОПП более трети пациентов (40%) имели септический шок и медиану оценок по шкале SOFA 7 (IQR 5–9). Большинство пациентов отвечали критериям ОПП в тот же день, что и критериям сепсиса, с медианой времени от сепсиса до ОПП равной 0 (IQR 0–1). У большинства пациентов (44%) диагноз ОПП основывался на данных темпа диуреза, в то время как 35% и 21% отвечали критериям креатинина (только) или обоим критериям (темп диуреза и креатинин), соответственно. На момент диагностики ОПП большинство пациентов имели 1 стадию ОПП в то время, как только 25% и 21% имели стадию 2 или 3, соответственно. Только 11% пациентов получили ПЗТ в день диагностики СА-ОПП. Как показано в дополнительной Таблице S4, у 65% (5 700) пациентов с СА-ОПП 1 стадии диагноз был установлено только по темпу диуреза, что представляет 35% от всех когорты пациентов с СА-ОПП.

Траектория СА-ОПП
Мы изучили траекторию СА-ОПП путем ежедневного измерения сывороточного креатинина и почасового диуреза вплоть до 14 дня. Средний уровень сывороточного креатинина у у выживших пациентов с СА-ОПП стабилизировался к шестому дню от поступления в ОИТ со средним значением 130 мкмоль/л и с пиковыми значениями 170 мкмоль/л, а у не выживших (умерших в госпитале) пациентов средние значения сывороточного креатинина составили 155 мкмоль/л, а пиковые — 180 мкмоль/л (Дополнительный Рис. S2). Пациенты со стадиями 1 и 2 ОПП не имели больших колебаний средних значений сывороточного креатинина за все время наблюдения. Средние значения сывороточного креатинина у пациентов с 3 стадией ОПП снижались от пиковых значений около 400 мкмоль/л на первый день, а с шестого дня значения оставались на уровне 200 мкмоль/л (Дополнительный Рис. S3). Поскольку у большинства пациентов диагноз ОПП основывался только на темпе диуреза, мы изучили сывороточный креатинин, как критерий ОПП, за все время. У пациентов с диагнозом ОПП только лишь по темпу диуреза, средние уровни сывороточного креатинина оставались без изменения и в нормальных значениях во время всего периода пребывания в ОИТ (Рис.1). Эти результаты находятся в соответствии с каждой стадией ОПП (Рис. S4, S6). Более того, среди пациентов, которым диагноз ОПП ставился только лишь по темпу диуреза, почасовой темп диуреза при всех стадиях ОПП показывал, что нормализация темпа диуреза типична и случается в течение 24—48 часов после поступления в ОИТ (Дополнительные Рис. S7, S9). И наоборот, пациенты, которым диагноз ОПП ставился на основании темпа диуреза и креатинина, имели постоянно низкий темп диуреза, увеличенные уровни сывороточного креатинина, при этом почасовой диурез никогда не превышал 1 мл/кг/час (Дополнительный Рис. S10), а уровни сывороточного креатинина оставались высокими ≥ 200 мкмоль/л (Рис.1).

Резюме по траектории стадий ОПП с течением времени для всей когорты пациентов с СА-ОПП показано на дополнительном Рис. S11, когда количество пациентов с ОПП стадий 1 или 2 снижалось, в то время как у пациентов с ОПП 3 стадии такого не наблюдалось и 3 стадия ОПП сохранялась на протяжении всего времени пребывания пациентов в ОИТ. Траектория СА-ОПП, диагноз которого поставлен на основании темпа диуреза, показана на дополнительном Рис. S12, где видно быстрое разрешение ОПП у большинства пациентов.
Лечение в первые семь дней после поступления в ОИТ
Лечение в ОИТ изучалось в первые 7 дней после поступления в ОИТ, временной промежуток, что находится в верхнем квартиле длительности пребывания пациентов в ОИТ. По сравнению с пациентами, у которых диагноз СА-ОПП поставлен на основании креатинина (только) или креатинина и темпа диуреза, пациенты, у которых диагноз СА-ОПП был поставлен на основании только лишь темпа диуреза, с большей вероятностью получали механическую вентиляцию, но существенно меньшую вероятность получения вазопрессоров и ПЗТ (Таблица 3). Исключая механическую вентиляцию у пациентов с СА-ОПП 3 стадии, все выше показанные результаты были последовательными для всех стадий тяжести ОПП (Дополнительные Таблицы S11–S13).

При сравнении пациентов с СА-ОПП 1 и 2 стадии, пациенты со стадией 3 с меньшей вероятностью получали механическую вентиляцию, меньше дней получали вазопрессоры и имели большую вероятность получения ПЗТ (Дополнительная Таблица S14), что может свидетельствовать о дополнительном взаимодействии с хронической болезнью почек (ХБП), но данные были недоступны. Для всей когорты исследования пациенты с СА-ОПП имели большую вероятность в получении механической вентиляции, вазопрессоров и ПЗТ (Дополнительная Таблица S15).
Ассоциированные исходы
Как показано на Таблице 4, мы изучали исходы, основываясь на критериях диагностики ОПП (темп диуреза [только], креатинин [только], оба критерия). Пациенты, у которых диагноз ОПП был установлен на основании только лишь сниженного темпа диуреза, имели менее тяжелое ОПП, меньше нуждались в ПЗТ, имели более высокую частоту восстановления функции почек и более низкую летальность по сравнению с пациентами, у которых диагноз ОПП устанавливался на основании уровня сывороточного креатинина и темпа диуреза или только лишь на основании уровня сывороточного креатинина. Для дальнейшего определения влияния тяжести ОПП на диагноз мы сравнили исходы по критериям диагностики ОПП в каждой группе, определенной по тяжести ОПП. При ОПП 1 стадии, по сравнению с креатинином (только) или с креатинином и темпом диуреза, только лишь сниженный темп диуреза указывал на меньшую тяжесть ОПП с более низкой потребностью в ПЗТ, с более низкой летальностью и низкому показателю MAKE-30 (Дополнительная таблица S16). Относительно низкая потребность в ПЗТ, меньшая летальность и почти полное отсутствие неблагоприятных почечных исходов у пациентов, у которых диагноз ОПП устанавливался только лишь на сниженном темпе диуреза, находились в соответствии с стадиями 2 и 3 (Дополнительные таблицы S17, S18). При всех стадиях ОПП пациенты, у которых диагноз ОПП устанавливался только лишь на основании темпа диуреза, имели в три раза большие шансы полного восстановления функции почек по сравнению с пациентами, у которых диагноз ОПП устанавливался на основании креатинина (только) или креатинина и темпа диуреза. По сравнению со всей когортой пациенты с СА-ОПП имели более длительное время пребывания в ОИТ и в госпитале, а также более высокую летальность в ОИТ и в госпитале (Дополнительная Таблица S19).

Для пациентов с СА-ОПП мы разработали модель многовариантной логистической регрессии для MAKE-30 (Дополнительная Таблица S20). При условии контроля за характеристиками пациента, возрастом, полом, ИМТ и тяжестью заболевания (APACHE III), а также за потребностью в механической вентиляции и вазопрессорах, диагноз ОПП только по критерию темпа диуреза (OR 0.34; 95% CI 0.32–0.36; p < 0.001) был ассоциирован со значительно меньшим развитием MAKE-30, когда сравнение проводилось с диагностикой ОПП на основании креатинина (только) или креатинина и темпа диуреза.
Обсуждение
Ключевые выводы
В этом многоцентровом исследовании мы изучили около 90 000 критически больных пациентов и нашли, что СА-ОПП случается в одном из шести случаев поступления в ОИТ, а также то, то в четырех из десяти случаев экстренное поступление осуществлялось из дома (from thecommunity), а одно поступление из четырех - из палаты госпиталя. Обращает внимание то, что пропорция пациентов, поступающих в ОИТ с диагнозом СА-ОПП за последние годы увеличивается. При сравнении с другими причинами поступления в ОИТ пациенты с СА-ОПП имеют более тяжелое состояние и получают больше органной поддержки.
СА-ОПП преимущественно развивается в течение первых 24 часов после поступления в ОИТ, а диагноз сепсиса и ОПП устанавливаются практически одновременно. На момент диагностики у большинства пациентов ОПП имеет 1 стадию и характеризуется снижением темпа диуреза и относительно низкими уровнями креатинина. Эта когорта, как правило, имела раннюю нормализацию темпа диуреза с разрешением ОПП. В общем и целом, пациенты с СА-ОПП, что отвечали критериям ОПП только лишь по снижению темпа диуреза, имели более короткое время пребывания в ОИТ и в госпитале, как и более низкую летальность по сравнению с оставшимися пациентами с СА-ОПП. И, наконец, после корректировки на исходные характеристики и тяжесть заболевания, пациенты с СА-ОПП, диагноз которого был установлен на основании темпа диуреза, имели значительно меньше MAKE-30 событий.
Взаимосвязь с литературой
Насколько нам известно, нет и на было других исследований, изучающих эпидемиологию СА-ОПП в большой многоцентровой когорте пациентов, поступивших в ОИТ, в которых использовались недавние согласованные определения ADQI. До появления этих определений предыдущие исследования показывали значительную гетерогенность в популяции пациентов с различной частотой и летальностью [8]. При этом в двух недавно опубликованных исследованиях для выявления СА-ОПП использовались критерии Сепсис-3 и KDIGO [23, 24]. Одно из них было одноцентровым ретроспективным исследованием, что включило в себя 351 пациентов с СА-ОПП, и авторы сообщили об очень низкой частоте развития СА-ОПП на уровне 2.8%, что ограничивает внешнюю валидность [23]. Другое исследование также было одноцентровым и ретроспективным, в котором изучалась ассоциация между ожирением и ОПП в когорте из 456 пациентов, что не позволило уделить внимание эпидемиологии СА-ОПП [24]. Ни в одном исследовании детально не изучались частота развития, характеристики, сроки, траектория, лечение и исходы СА-ОПП в большой многоцентровой популяции. Ни в одном предыдущем исследовании не оценивалась взаимосвязь между диагностическими критериями ОПП и исходами у пациентов с СА-ОПП.
Значение результатов исследования
Наши результаты подразумевают, что СА-ОПП становится все более распространенным состоянием в ОИТ. Более того, мы предполагаем, что СА-ОПП развивается у пациентов, поступающих в ОИТ из дома и у которых уже в ОИТ имеется сочетание сепсиса и ОПП. В другой большой пропорции СА-ОПП развивалась в палате госпиталя, что, таким образом, может стать целью для более ранних вмешательств.
Далее, быстрое восстановление и редко наблюдаемое ухудшение почечной функции у пациентов с СА-ОПП, диагноз которого установлен только лишь по снижение темпа диуреза, позволяет предположить, что более чем у половины пациентов наличие СА-ОПП имеет очень ограниченное клиническое значение. Результаты наши исследования ясно показывают очень высокую частоту восстановления почечной функции у пациентов с СА-ОПП, диагноз которого поставлен на основании только лишь снижения темпа диуреза. Тем самым, низкий темп диуреза может представлять собой физиологический ответ на сепсис больше, чем патофизиологический маркер начинающегося органного повреждения. Результаты нашего исследования могут иметь значительные терапевтические и исследовательские последствия в будущем, поскольку нынешний стандарт медицинской помощи может быть достаточным для лечения большинства случаев 1 стадии СА-ОПП и предотвращения неблагоприятных исходов. Более того, будущие исследования лечения SA-AKI вряд ли будут обладать достаточной мощностью при выявлении эффектов ПЗТ, MAKE-30 или летальности, когда в исследование будут включаться пациенты с СА-ОПП, диагноз которого установлен только лишь на сниженном темпе диуреза.
Сильные стороны и ограничения
Наше исследование имеет несколько сильных сторон. Во-первых, исследование проведено в большой когорте пациентов, представляющих собой максимальный спектр госпитализаций в отделения интенсивной терапии общегосударственной системы здравоохранения. Популяция исследования представляет общую популяцию Австралии и, вероятно, аналогичную популяцию стран с высоким уровнем дохода. Во-вторых, в нашем исследовании использовался большой массив детальных данных, что извлекались из широко применяемой клинической электронной информационной системы. Все данные были клинически подтверждены, а потери данных были минимальны. В-третьих, даже несмотря на то, что мы использовали новейшее стандартизованное определение СА-ОПП, это определение включает в себе определения ОПП Сепсис-3 и KDIGO, которые уже хорошо зарекомендовали себя в литературе. Следовательно, мы воспользовались возможностью применить хорошо известную технологию при анализе большой базы данных в целях идентификации сепсиса и ОПП.
Мы признаем некоторые ограничения. Первое, выявление сепсиса и ОПП и, тем самым СА-ОПП, было сделано электронным путем, так что в классификации пациентов могли быть сделаны ошибки. Органная дисфункция, выявленная с помощью анализа, могла быть и не вызвана инфекцией. В то же время, наша большая когорта пациентов, вероятно, смогла ограничить влияние такого необычного обстоятельства. Второе, мы не классифицировали СА-ОПП на фенотипы, как это предложено 28 рабочей группой ADQI [8]. Тем самым, наша когорта пациентов с СА-ОПП может представлять различающиеся группы с расходящимися факторами риска и исходами. В плане у нас проведение исследования, в котором основное внимание будет уделено фенотипам. Третье, так как мы не смогли идентифицировать пациентов, которые страдали ХБП до момента госпитализации, это могло привести к завышению оценки ОПП при использовании расчетного уровня креатинина [25]. Это серьезный вопрос, поскольку пациенты с ХБП имеют специфические характеристики и отличающиеся исходы по сравнению с пациентами без ХБП [26]. Но предыдущее исследование, в котором изучались более 3500 аналогичных пациентов из четырех госпиталей, которые вошли в наше исследование, сообщило, что распространение ХБП составило около 13.5% [27]. Изучение пациентов с ХБП потребует сбора дополнительных данных в будущих исследованиях. Четвертое, проверка таких компонентов, как ПЗТ и сывороточный креатинин при MAKE-30 на момент перевода из ОИТ, потенциально могла привести к предвзятости в оценке. И, наконец, условный расчет темпа диуреза мог привести к ошибочной классификации пациентов с ОПП. Но при этом анализ чувствительности показал отсутствие системных различий между группами, а также снижение, а не повышение, диагностики ОПП при условном расчете.
Выводы
В большой когорте критически больных пациентов мы нашли, что СА-ОПП имеет большое распространение у пациентов, поступающих в ОИТ из отделения неотложной помощи и чаще всего диагностируется на день поступления в ОИТ, а также и то, что диагноз сепсиса и ОПП очень часто ставится в один день. Более того, у большинства пациентов с СА-ОПП диагноз ставился на фоне 1 стадии ОПП на основании только низкого темпа диуреза, что редко было ассоциировано со значительным ухудшением почечной функции, как это определяется согласно MAKE-30. Все эти наблюдения предоставляют необходимую эпидемиологическую основу для последующих интервенционных исследований, одновременно подчеркивая необходимость уделять особое внимание специфическим подгруппам пациентов с СА-ОПП.
Список литературы:
1. Finfer S, Machado FR (2016) The global epidemiology of sepsis. Does it matter that we know so little? Am J Resp Crit Care 193(3):228–230
2. Vincent JL, Sakr Y, Sprung CL, Ranieri VM, Reinhart K, Gerlach H et al (2006) Sepsis in European intensive care units and colon; results of the SOAP study and ast. Crit Care Med 34(2):344–353
3. Chiu C, Legrand M (2021) Epidemiology of sepsis and septic shock. Curr Opin Anaesthesiol 34(2):71–76
4. Poston JT, Koyner JL (2019) Sepsis associated acute kidney injury. BMJ 364:k4891
5. Peerapornratana S, Manrique‑Caballero CL, Gómez H, Kellum JA (2019) Acute kidney injury from sepsis: current concepts, epidemiology, pathophysiology, prevention and treatment. Kidney Int 96(5):1083–1099
6. Bagshaw SM, George C, Bellomo R, Committee ADM (2008) Early acute kidney injury and sepsis: a multicentre evaluation. Crit Care 12(2):R47
7. Bagshaw SM, Uchino S, Bellomo R, Morimatsu H, Morgera S, Schetz M et al (2007) Septic acute kidney injury in critically ill patients: clinical characteristics and outcomes. Clin J Am Soc Nephro 2(3):431–439
8. Zarbock A, Nadim MK, Pickkers P, Gomez H, Bell S, Joannidis M et al (2023) Sepsis‑associated acute kidney injury: consensus report of the 28th Acute Disease Quality Initiative workgroup. Nat Rev Nephrol. https://doi.org/10. 1038/s41581‑023‑00683‑3
9. Singer M, Deutschman CS, Seymour CW, Shankar‑Hari M, Annane D, Bauer M et al (2016) The third international consensus definitions for sepsis and septic shock (Sepsis‑3). JAMA 315(8):801–810
10. Khwaja A (2012) KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract 120(4):c179–c184
11. Bagshaw SM, George C, Bellomo R, Committe ADM (2008) A comparison of the RIFLE and AKIN criteria for acute kidney injury in critically ill patients. Nephrol Dial Transpl 23(5):1569–1574
12. Raith EP, Udy AA, Bailey M, McGloughlin S, MacIsaac C, Bellomo R et al (2017) Prognostic accuracy of the SOFA score, SIRS criteria, and qSOFA score for in‑hospital mortality among adults with suspected infection admitted to the intensive care unit. JAMA 317(3):290–300
13. Corrigan C, Duke G, Millar J, Paul E, Butt W, Gordon M et al (2022) Admissions of children and adolescents with deliberate self‑harm to intensive care during the SARS‑CoV‑2 outbreak in australia. Jama Netw Open 5(5):e2211692
14. Kirsi‑Maija K, Michael B, David P, Jamie CD, Rinaldo B (2015) Systemic inflammatory response syndrome criteria in defining severe sepsis. New Engl J Med 372(17):1629–1638
15. Lambden S, Laterre PF, Levy MM, Francois B (2019) The SOFA scoredevelopment, utility and challenges of accurate assessment in clinical trials. Crit Care 23(1):374
16. Seymour CW, Liu VX, Iwashyna TJ, Brunkhorst FM, Rea TD, Scherag A et al (2016) Assessment of clinical criteria for sepsis: for the third international consensus definitions for sepsis and septic shock (Sepsis‑3). JAMA 315(8):762–774
17. Shah AD, MacCallum NS, Harris S, Brealey DA, Palmer E, Hetherington J et al (2021) Descriptors of sepsis using the sepsis‑3 criteria: a cohort study in critical care units within the UK National Institute for Health Research critical care health informatics collaborative. Crit Care Med 49(11):1883–1894
18. Braykov NP, Morgan DJ, Schweizer ML, Uslan DZ, Kelesidis T, Weisenberg SA et al (2014) Assessment of empirical antibiotic therapy optimisation in six hospitals: an observational cohort study. Lancet Infect Dis 14(12):1220–1227
19. Shankar‑Hari M, Phillips GS, Levy ML, Seymour CW, Liu VX, Deutschman CS et al (2016) Developing a new definition and assessing new clinical criteria for septic shock: for the third international consensus definitions for sepsis and septic shock (sepsis‑3). JAMA 315(8):775–787
20. Khanna A, English SW, Wang XS, Ham K, Tumlin J, Szerlip H et al (2017) Angiotensin II for the treatment of vasodilatory shock. New Engl J Medicine 377(5):419–430
21. Inker LA, Eneanya ND, Coresh J, Tighiouart H, Wang D, Sang Y et al (2021) New creatinine‑ and cystatin C‑based equations to estimate GFR without race. New Engl J Med 385(19):1737–1749
22. Cooper DJ, Plewes K, Grigg MJ, Patel A, Rajahram GS, William T et al (2021) An evaluation of commonly used surrogate baseline creatinine values to classify AKI during acute infection. Kidney Int Rep 6(3):645–656
23. Katayama S, Nunomiya S, Koyama K, Wada M, Koinuma T, Goto Y et al (2017) Markers of acute kidney injury in patients with sepsis: the role of soluble thrombomodulin. Crit Care 21(1):229
24. Gameiro J, Gonçalves M, Pereira M, Rodrigues N, Godinho I, Neves M et al (2018) Obesity, acute kidney injury and mortality in patients with sepsis: a cohort analysis. Ren Fail 40(1):120–126
25. Bernier‑Jean A, Beaubien‑Souligny W, Goupil R, Madore F, Paquette F, Troyanov S et al (2017) Diagnosis and outcomes of acute kidney injury using surrogate and imputation methods for missing preadmission creatinine values. Bmc Nephrol 18(1):141
26. Bagshaw SM, Neto AS, Smith O, Weir M, Qiu H, Du B et al (2022) Impact of renal‑replacement therapy strategies on outcomes for patients with chronic kidney disease: a secondary analysis of the STARRT‑AKI trial. Intensive Care Med 48:1736
27. White K, Tabah A, Ramanan M, Shekar K, Edwards F, Laupland KB (2023) 90‑day case‑fatality in critically ill patients with chronic liver disease influenced by presence of portal hypertension, results from a multicentre retrospective cohort study. J Crit Care 1(38):5–10
[DETAIL_PICTURE] =>
[~DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 08.11.2023
[~DATE_ACTIVE_FROM] => 08.11.2023
[ACTIVE_FROM] => 08.11.2023
[~ACTIVE_FROM] => 08.11.2023
[SHOW_COUNTER] => 1274
[~SHOW_COUNTER] => 1274
[ID] => 8387
[~ID] => 8387
[IBLOCK_ID] => 2
[~IBLOCK_ID] => 2
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[TIMESTAMP_X] => 08.11.2023 16:42:29
[~TIMESTAMP_X] => 08.11.2023 16:42:29
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/sepsis-assotsiirovannoe-ostroe-pochechnoe-povrezhdenie-v-otdelenii-intensivnoy-terapii-chastota-khar/
[~DETAIL_PAGE_URL] => /library/articles/sepsis-assotsiirovannoe-ostroe-pochechnoe-povrezhdenie-v-otdelenii-intensivnoy-terapii-chastota-khar/
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] => sepsis-assotsiirovannoe-ostroe-pochechnoe-povrezhdenie-v-otdelenii-intensivnoy-terapii-chastota-khar
[~CODE] => sepsis-assotsiirovannoe-ostroe-pochechnoe-povrezhdenie-v-otdelenii-intensivnoy-terapii-chastota-khar
[EXTERNAL_ID] => 8387
[~EXTERNAL_ID] => 8387
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[IBLOCK_CODE] => articles
[~IBLOCK_CODE] => articles
[IBLOCK_EXTERNAL_ID] => content-articles
[~IBLOCK_EXTERNAL_ID] => content-articles
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 8 ноября 2023
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
[NAME] => Сепсис-ассоциированное острое почечное повреждение в отделении интенсивной терапии: частота, характеристики пациентов, сроки развития, лечение и ассоциированные исходы: многоцентровое, обсервационное исследование
[PREVIEW_PICTURE] => Array
(
[ID] => 5426
[TIMESTAMP_X] => 08.11.2023 16:42:29
[MODULE_ID] => iblock
[HEIGHT] => 563
[WIDTH] => 1001
[FILE_SIZE] => 143438
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/343/80htj0vxzn20bj11ki3ansjqx7ncpyrw
[FILE_NAME] => abstract-motion-design-backpain-kidneys.jpg
[ORIGINAL_NAME] => abstract-motion-design-backpain-kidneys.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 68e9b67c6e9cb555fabd52df51ee498e
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/343/80htj0vxzn20bj11ki3ansjqx7ncpyrw/abstract-motion-design-backpain-kidneys.jpg
[UNSAFE_SRC] => /upload/iblock/343/80htj0vxzn20bj11ki3ansjqx7ncpyrw/abstract-motion-design-backpain-kidneys.jpg
[SAFE_SRC] => /upload/iblock/343/80htj0vxzn20bj11ki3ansjqx7ncpyrw/abstract-motion-design-backpain-kidneys.jpg
[ALT] => Сепсис-ассоциированное острое почечное повреждение в отделении интенсивной терапии: частота, характеристики пациентов, сроки развития, лечение и ассоциированные исходы: многоцентровое, обсервационное исследование
[TITLE] => Сепсис-ассоциированное острое почечное повреждение в отделении интенсивной терапии: частота, характеристики пациентов, сроки развития, лечение и ассоциированные исходы: многоцентровое, обсервационное исследование
)
[DETAIL_TEXT] =>
Intensive Care Med
https://doi.org/10.1007/s00134-023-07138-0
Оригинальное исследование
Сепсис-ассоциированное острое почечное повреждение в отделении интенсивной терапии: частота, характеристики пациентов, сроки развития, лечение и ассоциированные исходы: многоцентровое, обсервационное исследование
Перевод оригинальной статьи «Sepsis-associated acute kidney injury in the intensive care unit: incidence, patient characteristics, timing, trajectory, treatment, and associated outcomes. A multicenter, observational study»
Авторы: Kyle C. White 1,2,3, Ary Serpa‑Neto 4,5 , Rod Hurford 1, Pierre Clement 6, Kevin B. Laupland 3,6, Emily See 7,8,9,10,11, James McCullough 12, Hayden White 13,14, Kiran Shekar 2,3,15, Alexis Tabah 2,3,16, Mahesh Ramanan 2,17,18, Peter Garrett 5,19, Antony G. Attokaran 2,20, Stephen Luke 21,22, Siva Senthuran22,23, Philippa McIlroy 24 and Rinaldo Bellomo 4,8,9,25 по поручению the Queensland Critical Care Research Network (QCCRN)
Информация об авторах:
1 Intensive Care Unit, Princess Alexandra Hospital, 199 Ipswich Road, Woolloongabba, Brisbane, QLD 4102, Australia.
2 Faculty of Medicine, University of Queensland, Brisbane, QLD, Australia.
3 Queensland University of Technology (QUT), Brisbane, QLD, Australia.
4 Australian and New Zealand Intensive Care Research Centre (ANZIC‑RC), School of Public Health and Preventive Medicine, Monash University, Melbourne, Australia. 5 Department of Critical Care Medicine, Hospital Israelita Albert Einstein, São Paulo, Brazil.
6 Department of Intensive Care Services, Royal Brisbane and Women’s Hospital, Brisbane, QLD, Australia.
7 School of Medicine, University of Melbourne, Melbourne, Australia.
8 Department of Critical Care, University of Melbourne, Melbourne, Australia.
9 Department of Intensive Care, Austin Hospital, Heidelberg, Australia.
10 Department of Nephrology, The Royal Melbourne Hospital, Parkville, Australia. 11 Department of Nephrology, The Royal Children’s Hospital, Parkville, Australia. 12 Intensive Care Unit, Gold Coast University Hospital, Southport, QLD, Australia. 13 Intensive Care Unit, Logan Hospital, Logan, QLD, Australia.
14 School of Medicine and Dentistry, Griffith University, Mount Gravatt, QLD, Australia.
15 Adult Intensive Care Services, The Prince Charles Hospital, Brisbane, QLD, Australia.
16 Intensive Care Unit, Redcliffe Hospital, Brisbane, QLD, Australia.
17 Intensive Care Unit, Caboolture Hospital, Caboolture, QLD, Australia.
18 Critical Care Division, The George Institute for Global Health, University of New South Wales, Sydney, Australia.
19 Intensive Care Unit, Sunshine Coast University Hospital, Birtinya, QLD, Australia.
20 Intensive Care Unit, Rockhampton Hospital, The Range, QLD, Australia.
21 Intensive Care Services, Mackay Base Hospital, Mackay, QLD, Australia.
22 College of Medicine and Dentistry, James Cook University, Townsville, QLD, Australia.
23 Intensive Care Unit, Townsville Hospital, Townsville, QLD, Australia.
24 Intensive Care Unit, Cairns Hospital, Cairns, QLD, Australia.
25 Department of Intensive Care,, Royal Melbourne Hospital, Melbourne, Australia.
Keywords: Critical care, Acute kidney injury, Sepsis, Sepsis‑associated acute kidney injury
Ключевые слова: критическая терапия, острое почечное повреждение, сепсис, сепсис-ассоциированное острое почечное повреждение
Введение
Сепсис — распространенная причина критического заболевания, что ассоциируется с высокой заболеваемостью и летальностью [1—3] и часто сопровождается острым почечным повреждением (ОПП). Когда ОПП развивается на фоне сепсиса, это рассматривается как сепсис-ассоциированное острое почечное повреждение (СА-ОПП) [4, 5]. Ассоциация между сепсисом и ОПП и ранее подвергалась изучению [6, 7], но отсутствие до недавнего времени воспроизводимых и стандартизированных консенсусных определений ограничивало интерпретацию доступных на сегодня знаний.
Недавно 28 рабочей группой the Acute Disease Quality Initiative (ADQI) было разработано определение СА-ОПП [8]. Это сочетание сепсиса, определенного по критериям Сепсис-3 [9], с ОПП, определенного по критериям the Kidney Disease Improving Global Outcomes (KDIGO), и что произошло в течение 7 дней с момента диагностики сепсиса.
Эпидемиология СА-ОПП при критических заболеваниях на основании этого стандартизованного консенсусного определения остается неизвестной. Более того, распространенность СА-ОПП, характеристики пациентов, сроки развития, траектория, лечение и ассоциированные исходы до настоящего времени не изучались. В целях оценки СА-ОПП мы, ведомые консенсусным определением 28 рабочей группы ADQI и приоритетами исследований, подвергли анализу большую, детализированную, многоцентровую базу данных, в которой в рутинном порядке собирались электронные истории болезни. Нашей целью было подвергнуть тестированию гипотезу, что СА-ОПП распространена у пациентов, поступивших в отделение интенсивной терапии (ОИТ). Мы также намеревались протестировать вторую гипотезу о том, что большая часть СА-ОПП не является заболеванием интенсивной терапии, а чаще развивается за пределами ОИТ, а также и то, что именно развитие СА-ОПП побуждает к переводу пациента в ОИТ. Еще одной гипотезой для тестирования стало то, что пациенты с СА-ОПП имеют худшие почечные и не-почечные исходы по сравнению с пациентами без СА-ОПП.
Методы
Дизайн исследования
Большое, многоцентровое, ретроспективное, когортное исследование детализированной базы клинических данных, собранной рутинно из электронных историй болезни.
Месторасположение
12 ОИТ, расположенных в Квинсленде, Австралия, из них 5 ОИТ третичного уровня, 3 ОИТ за пределами столицы и 4 региональных ОИТ. Все они представляют такие направления оказания медицинской помощи, как кардиоторакальное, нейрохирургическое, акушерское и травму. Мы изучили всех взрослых пациентов, поступивших в период с 1 января 2015 года по 31 декабря 2021 года. Следует отметить, что Квинсленд, Австралия, не имел в сообществе распространения коронавирусного заболевания 2019 (COVID-19) на момент проведения исследования и, тем самым, глобальная пандемия не оказала существенного влияния на результаты исследования. Все пациенты расценивались как годные к исследованию, если была доступна их электронная история болезни. Мы исключили пациентов с прогрессирующим хроническим заболеванием почек, которые требовали постоянного диализа, пациентов, госпитализированных для паллиативной терапии, и пациентов, переведенных из других ОИТ, участвующих в этом исследовании. Мы не исключали эпизоды повторной госпитализации с тем же самым заболеванием.
Источники данных
Рутинно собираемые данные были получены из всех центров, использующих клиническую информационную систему «the eCritical MetaVision™» (iMDsoft, Boston, MA, USA). Сюда были включены ежедневные лабораторные данные, медикаментозная терапия, микробиология, почасовые гемодинамические данные и почасовые данные о балансе жидкости. Информация об исходных демографических данных, причинах поступления, тяжести заболевания и исходах были извлечены из the Australia and Zealand Intensive Care Society (ANZICS) Centre for Outcomeand Resource Evaluation (CORE) Adult Patient Database (APD) [11–14]. Количество утерянных данных в отношении ключевых переменных показаны в Дополнительной таблице S1.
Идентификация сепсиса
Сепсис определялся согласно третьему международному консенсусному определению сепсиса и септического шока [9]. Согласно Сепсис-3 определению, мы идентифицировали пациентов с увеличением баллов по шкале последовательной оценки органного повреждения (SequentialOrgan Failure Assessment [SOFA]) до двух баллов и с подтвержденной инфекцией, либо с подозрением на инфекцию [9]. Мы предполагали, что SOFA была равна нулю до момента поступления в ОИТ. Когда индивидуальные компоненты SOFA были утеряны, то общая оценка не учитывалась [12]. Ежедневно рассчитывалась оценка по SOFA с идентификацией случаев повышения оценки до двух баллов в течение 24 часов. Принимая во внимание трудности при интерпретации неврологической SOFA при седации, эти оценки не включались в общую SOFA[15]. Подтверждение инфекции или подозрение на инфекцию определялось, как начале антимикробной терапии или ее эскалации, а также при наличии микробиологических проб, взятых в течение первого дня с момента увеличения баллов по SOFA [16]. Эскалация антимикробной терапии определялась как увеличение «рейтинга» антимикробного препарата в течение 1 дня с момента диагностики сепсиса [17, 18]. Как показано в Дополнительной таблице 2S, рейтинг соответствовал спектру активности, при котором оценка в один балл указывала на меньший спектр активности (к примеру, первое поколение цефалоспоринов), а оценка в четыре балла указывала на наивысший спектр (к примеру, карбапенемы или тигециклин) [18].
Пациенты, поступившие после плановых хирургических вмешательств, после травмы или по причине внезапной остановки сердечной деятельности, рассматривались как получающие антибиотикопрофилактику в первые 2 дня после поступления. Тем самым, эти пациенты не классифицировались как имеющие сепсис, независимо от оценок по шкале SOFA. Септический шок определялся при введении вазопрессоров и при повышении, хотя бы однократном, уровня лактата крови более чем на 2 ммоль/л на момент диагностики сепсиса [19]. При этом дозировки вазопрессоров конвертировались в эквивалент норэпинефрина, а метод конверсии показан в Дополнительной таблице S3 [20].
Идентификация острого почечного повреждения
Диагноз ОПП ставился согласно определению KDIGO при ежедневном контроле за уровнем сывороточного креатинина и почасовым темпом диуреза (urine output [UO]) [10]. Для управления отсутствующими данным по измерению темпа диуреза, вызванными отсутствием мочевого катетера или переводом за пределы ОИТ, мы выполняли условное вычисление, что описано в Дополнительной таблице S4. Почасовое измерение темпа диуреза на килограмм массы тела оценивалось на предмет идентификации пациентов, кто отвечал критериям ОПП по темпу диуреза. Каждые 6, 12 и 24 час оценивался темп диуреза в сравнении с пороговыми точками ОПП. Мы провели множественный анализ чувствительности с оценкой систематической разницы, связанной с условным вычислением темпа диуреза (Дополнительные таблицы S5, S6). Наш набор данных не содержал информации об уровне креатинина до момента поступления в ОИТ, поэтому исходные значения креатинина были рассчитаны, исходя из формулы the Chronic Kidney Disease–Epidemiology Collaboration (CKD-EPI), предполагающую расчетную формулу скорости гломерулярной фильтрации (glomerular filtrationrate [eGFR]), равную 75 мл/мин/1.73 м2 [21, 22]. Ежедневный уровень креатинина сравнивался с расчетным исходным уровнем креатинина и регистрировались значения, отвечающие определению ОПП. Был проведен множественные анализ чувствительности, сравнивающий различные методы расчета исходных уровней креатинина (Дополнительная таблица S7). Для идентификации того, отвечает ли пациент критериям ОПП по KDIGO, использовались либо темп диуреза, либо уровень креатинина, либо оба этих критерия.
Идентификация сепсис-ассоциированного острого почечного повреждения
После идентификации в индивидуальном порядке эпизодов сепсиса и ОПП, мы применили определение СА-ОПП, разработанное 28 рабочей группой ADQI. Мы сравнили день диагностики сепсиса с днем диагностики ОПП. Если ОПП случилось между 1 и 7 днями диагностики сепсиса, пациенты были классифицированы как СА-ОПП согласно критерию ADQI. Пациенты не отвечали определению СА-ОПП, если ОПП предшествовало эпизоду сепсиса. Был проведен анализ чувствительности, сравнивающий пациентов с диагнозом сепсис или ОПП, но не отвечающих критериям СА-ОПП (Дополнительный рисунок S8).
Исходы
Первичным исходом стала частота развития СА-ОПП. Вторичным исходом стали сроки развития СА-ОПП по отношению к поступлению в ОИТ. Дополнительными вторичными исходами стали: функция почек, тяжесть ОПП, статус восстановления функции почек и большие неблагоприятные почечные события к 30 дню (major adverse kidney events[MAKE-30]), а также не-почечные события, длительность пребывания в ОИТ и в госпитале, госпитальная летальность и летальность в ОИТ. Определения исходов предоставлены на дополнительном рисунке S11.
Статистический анализ
Описательная статистика была выражена в виде частот и пропорций для категориальных переменных и медиан с межквартильными диапазонами (IQR) или средних значений со стандартными отклонениями в зависимости от их параметрического или непараметрического распределения. Точный критерий Фишера был использован для сравнения категориальных данных. Для изучения факторов, связанных с госпитальной летальностью и большими нежелательными явлениями со стороны почек на 30-й день (MAKE-30), была разработана модель логистической регрессии со смешанным эффектом, включающая госпитали в качестве случайного эффекта. Переменные, использованные для анализа, были определены априори и отражали клиническую полезность имеющихся данных. Результаты многофакторного анализа были представлены в виде отношения шансов (odds ratios [OR]) с 95% доверительными интервалами (95% confidence intervals CI). Учитывая большой набор данных, двустороннее значение p <0,01 считалось статистически значимым. Статистический анализ проводился с использованием программного обеспечения R v.4.0.3.
Этические соображения
Это исследование было одобрено the Metro South Hospital and Health Service Human Research Ethics Committee (HREC/2022/QMS/82024).
Результаты
Частота развития СА-ОПП
С 1 января 2015 года по 31 декабря 2021 года 89 466 пациентов поступили в ОИТ, участвующие в исследовании. Мы исключили 1950 пациентов с терминальной стадией заболевания почек, 544 пациента, поступивших на паллиативное лечение и 2503 пациентов, переведенных из других отделений. Среди оставшихся 84 528 пациентов, 13 451 отвечали критериям СА-ОПП во время их поступления в ОИТ. Как показано на дополнительном рисунке S1, процентное соотношение поступивших в ОИТ пациентов, отвечающих критериям СА-ОПП, с течением времени выросло с 14% в 2015 году до почти 18% в 2021 году.
Характеристики пациентов
Характеристики пациентов как без СА-ОПП, так и с СА-ОПП, показаны в Таблице 1. В общей когорте медиана возраста составила 61 год, 39% были женщинами, а медиана индекса массы тела (ИМТ) составила 27.8. Медиана оценок тяжести заболевания по шкале APACHE III (AcutePhysiology and Chronic Health Evaluation) составила 50, а наиболее частым путем поступления стали операционные, далее следовало отделение неотложной помощи.

По сравнению с общей когортой, пациенты с СА-ОПП имели более высокие оценки по шкале APACHE III, с большей вероятностью поступление было из отделения неотложной помощи или из общей палаты госпиталя, имели более высокий риск смерти. При имеющейся статистической разнице возраст пациентов из группы СА-ОПП, в численном отношении, был аналогичен возрасту общей когорты, и аналогичное распределение по полу и индексу массы тела.

При поступлении в ОИТ большинству пациентов с СА-ОПП требовалось проведение механической вентиляции, что не отличалось от пациентов без СА-ОПП. Почти половина пациентов с СА-ОПП получала терапию вазопрессорами по меньшей мере в течение 1 часа, а одному из десяти пациентов требовалось проведение ПЗТ, что было намного чаще, чем у пациентов без СА-ОПП. Стоить отметить, что терапия диуретиками использовалась редко.
Сроки развития и характеристики СА-ОПП
Как показано в Таблице 2, медиана дней установки диагноза сепсиса составила день поступления в ОИТ или день 1 [IQR 1–1]. На момент постановки диагноза СА-ОПП более трети пациентов (40%) имели септический шок и медиану оценок по шкале SOFA 7 (IQR 5–9). Большинство пациентов отвечали критериям ОПП в тот же день, что и критериям сепсиса, с медианой времени от сепсиса до ОПП равной 0 (IQR 0–1). У большинства пациентов (44%) диагноз ОПП основывался на данных темпа диуреза, в то время как 35% и 21% отвечали критериям креатинина (только) или обоим критериям (темп диуреза и креатинин), соответственно. На момент диагностики ОПП большинство пациентов имели 1 стадию ОПП в то время, как только 25% и 21% имели стадию 2 или 3, соответственно. Только 11% пациентов получили ПЗТ в день диагностики СА-ОПП. Как показано в дополнительной Таблице S4, у 65% (5 700) пациентов с СА-ОПП 1 стадии диагноз был установлено только по темпу диуреза, что представляет 35% от всех когорты пациентов с СА-ОПП.

Траектория СА-ОПП
Мы изучили траекторию СА-ОПП путем ежедневного измерения сывороточного креатинина и почасового диуреза вплоть до 14 дня. Средний уровень сывороточного креатинина у у выживших пациентов с СА-ОПП стабилизировался к шестому дню от поступления в ОИТ со средним значением 130 мкмоль/л и с пиковыми значениями 170 мкмоль/л, а у не выживших (умерших в госпитале) пациентов средние значения сывороточного креатинина составили 155 мкмоль/л, а пиковые — 180 мкмоль/л (Дополнительный Рис. S2). Пациенты со стадиями 1 и 2 ОПП не имели больших колебаний средних значений сывороточного креатинина за все время наблюдения. Средние значения сывороточного креатинина у пациентов с 3 стадией ОПП снижались от пиковых значений около 400 мкмоль/л на первый день, а с шестого дня значения оставались на уровне 200 мкмоль/л (Дополнительный Рис. S3). Поскольку у большинства пациентов диагноз ОПП основывался только на темпе диуреза, мы изучили сывороточный креатинин, как критерий ОПП, за все время. У пациентов с диагнозом ОПП только лишь по темпу диуреза, средние уровни сывороточного креатинина оставались без изменения и в нормальных значениях во время всего периода пребывания в ОИТ (Рис.1). Эти результаты находятся в соответствии с каждой стадией ОПП (Рис. S4, S6). Более того, среди пациентов, которым диагноз ОПП ставился только лишь по темпу диуреза, почасовой темп диуреза при всех стадиях ОПП показывал, что нормализация темпа диуреза типична и случается в течение 24—48 часов после поступления в ОИТ (Дополнительные Рис. S7, S9). И наоборот, пациенты, которым диагноз ОПП ставился на основании темпа диуреза и креатинина, имели постоянно низкий темп диуреза, увеличенные уровни сывороточного креатинина, при этом почасовой диурез никогда не превышал 1 мл/кг/час (Дополнительный Рис. S10), а уровни сывороточного креатинина оставались высокими ≥ 200 мкмоль/л (Рис.1).

Резюме по траектории стадий ОПП с течением времени для всей когорты пациентов с СА-ОПП показано на дополнительном Рис. S11, когда количество пациентов с ОПП стадий 1 или 2 снижалось, в то время как у пациентов с ОПП 3 стадии такого не наблюдалось и 3 стадия ОПП сохранялась на протяжении всего времени пребывания пациентов в ОИТ. Траектория СА-ОПП, диагноз которого поставлен на основании темпа диуреза, показана на дополнительном Рис. S12, где видно быстрое разрешение ОПП у большинства пациентов.
Лечение в первые семь дней после поступления в ОИТ
Лечение в ОИТ изучалось в первые 7 дней после поступления в ОИТ, временной промежуток, что находится в верхнем квартиле длительности пребывания пациентов в ОИТ. По сравнению с пациентами, у которых диагноз СА-ОПП поставлен на основании креатинина (только) или креатинина и темпа диуреза, пациенты, у которых диагноз СА-ОПП был поставлен на основании только лишь темпа диуреза, с большей вероятностью получали механическую вентиляцию, но существенно меньшую вероятность получения вазопрессоров и ПЗТ (Таблица 3). Исключая механическую вентиляцию у пациентов с СА-ОПП 3 стадии, все выше показанные результаты были последовательными для всех стадий тяжести ОПП (Дополнительные Таблицы S11–S13).

При сравнении пациентов с СА-ОПП 1 и 2 стадии, пациенты со стадией 3 с меньшей вероятностью получали механическую вентиляцию, меньше дней получали вазопрессоры и имели большую вероятность получения ПЗТ (Дополнительная Таблица S14), что может свидетельствовать о дополнительном взаимодействии с хронической болезнью почек (ХБП), но данные были недоступны. Для всей когорты исследования пациенты с СА-ОПП имели большую вероятность в получении механической вентиляции, вазопрессоров и ПЗТ (Дополнительная Таблица S15).
Ассоциированные исходы
Как показано на Таблице 4, мы изучали исходы, основываясь на критериях диагностики ОПП (темп диуреза [только], креатинин [только], оба критерия). Пациенты, у которых диагноз ОПП был установлен на основании только лишь сниженного темпа диуреза, имели менее тяжелое ОПП, меньше нуждались в ПЗТ, имели более высокую частоту восстановления функции почек и более низкую летальность по сравнению с пациентами, у которых диагноз ОПП устанавливался на основании уровня сывороточного креатинина и темпа диуреза или только лишь на основании уровня сывороточного креатинина. Для дальнейшего определения влияния тяжести ОПП на диагноз мы сравнили исходы по критериям диагностики ОПП в каждой группе, определенной по тяжести ОПП. При ОПП 1 стадии, по сравнению с креатинином (только) или с креатинином и темпом диуреза, только лишь сниженный темп диуреза указывал на меньшую тяжесть ОПП с более низкой потребностью в ПЗТ, с более низкой летальностью и низкому показателю MAKE-30 (Дополнительная таблица S16). Относительно низкая потребность в ПЗТ, меньшая летальность и почти полное отсутствие неблагоприятных почечных исходов у пациентов, у которых диагноз ОПП устанавливался только лишь на сниженном темпе диуреза, находились в соответствии с стадиями 2 и 3 (Дополнительные таблицы S17, S18). При всех стадиях ОПП пациенты, у которых диагноз ОПП устанавливался только лишь на основании темпа диуреза, имели в три раза большие шансы полного восстановления функции почек по сравнению с пациентами, у которых диагноз ОПП устанавливался на основании креатинина (только) или креатинина и темпа диуреза. По сравнению со всей когортой пациенты с СА-ОПП имели более длительное время пребывания в ОИТ и в госпитале, а также более высокую летальность в ОИТ и в госпитале (Дополнительная Таблица S19).

Для пациентов с СА-ОПП мы разработали модель многовариантной логистической регрессии для MAKE-30 (Дополнительная Таблица S20). При условии контроля за характеристиками пациента, возрастом, полом, ИМТ и тяжестью заболевания (APACHE III), а также за потребностью в механической вентиляции и вазопрессорах, диагноз ОПП только по критерию темпа диуреза (OR 0.34; 95% CI 0.32–0.36; p < 0.001) был ассоциирован со значительно меньшим развитием MAKE-30, когда сравнение проводилось с диагностикой ОПП на основании креатинина (только) или креатинина и темпа диуреза.
Обсуждение
Ключевые выводы
В этом многоцентровом исследовании мы изучили около 90 000 критически больных пациентов и нашли, что СА-ОПП случается в одном из шести случаев поступления в ОИТ, а также то, то в четырех из десяти случаев экстренное поступление осуществлялось из дома (from thecommunity), а одно поступление из четырех - из палаты госпиталя. Обращает внимание то, что пропорция пациентов, поступающих в ОИТ с диагнозом СА-ОПП за последние годы увеличивается. При сравнении с другими причинами поступления в ОИТ пациенты с СА-ОПП имеют более тяжелое состояние и получают больше органной поддержки.
СА-ОПП преимущественно развивается в течение первых 24 часов после поступления в ОИТ, а диагноз сепсиса и ОПП устанавливаются практически одновременно. На момент диагностики у большинства пациентов ОПП имеет 1 стадию и характеризуется снижением темпа диуреза и относительно низкими уровнями креатинина. Эта когорта, как правило, имела раннюю нормализацию темпа диуреза с разрешением ОПП. В общем и целом, пациенты с СА-ОПП, что отвечали критериям ОПП только лишь по снижению темпа диуреза, имели более короткое время пребывания в ОИТ и в госпитале, как и более низкую летальность по сравнению с оставшимися пациентами с СА-ОПП. И, наконец, после корректировки на исходные характеристики и тяжесть заболевания, пациенты с СА-ОПП, диагноз которого был установлен на основании темпа диуреза, имели значительно меньше MAKE-30 событий.
Взаимосвязь с литературой
Насколько нам известно, нет и на было других исследований, изучающих эпидемиологию СА-ОПП в большой многоцентровой когорте пациентов, поступивших в ОИТ, в которых использовались недавние согласованные определения ADQI. До появления этих определений предыдущие исследования показывали значительную гетерогенность в популяции пациентов с различной частотой и летальностью [8]. При этом в двух недавно опубликованных исследованиях для выявления СА-ОПП использовались критерии Сепсис-3 и KDIGO [23, 24]. Одно из них было одноцентровым ретроспективным исследованием, что включило в себя 351 пациентов с СА-ОПП, и авторы сообщили об очень низкой частоте развития СА-ОПП на уровне 2.8%, что ограничивает внешнюю валидность [23]. Другое исследование также было одноцентровым и ретроспективным, в котором изучалась ассоциация между ожирением и ОПП в когорте из 456 пациентов, что не позволило уделить внимание эпидемиологии СА-ОПП [24]. Ни в одном исследовании детально не изучались частота развития, характеристики, сроки, траектория, лечение и исходы СА-ОПП в большой многоцентровой популяции. Ни в одном предыдущем исследовании не оценивалась взаимосвязь между диагностическими критериями ОПП и исходами у пациентов с СА-ОПП.
Значение результатов исследования
Наши результаты подразумевают, что СА-ОПП становится все более распространенным состоянием в ОИТ. Более того, мы предполагаем, что СА-ОПП развивается у пациентов, поступающих в ОИТ из дома и у которых уже в ОИТ имеется сочетание сепсиса и ОПП. В другой большой пропорции СА-ОПП развивалась в палате госпиталя, что, таким образом, может стать целью для более ранних вмешательств.
Далее, быстрое восстановление и редко наблюдаемое ухудшение почечной функции у пациентов с СА-ОПП, диагноз которого установлен только лишь по снижение темпа диуреза, позволяет предположить, что более чем у половины пациентов наличие СА-ОПП имеет очень ограниченное клиническое значение. Результаты наши исследования ясно показывают очень высокую частоту восстановления почечной функции у пациентов с СА-ОПП, диагноз которого поставлен на основании только лишь снижения темпа диуреза. Тем самым, низкий темп диуреза может представлять собой физиологический ответ на сепсис больше, чем патофизиологический маркер начинающегося органного повреждения. Результаты нашего исследования могут иметь значительные терапевтические и исследовательские последствия в будущем, поскольку нынешний стандарт медицинской помощи может быть достаточным для лечения большинства случаев 1 стадии СА-ОПП и предотвращения неблагоприятных исходов. Более того, будущие исследования лечения SA-AKI вряд ли будут обладать достаточной мощностью при выявлении эффектов ПЗТ, MAKE-30 или летальности, когда в исследование будут включаться пациенты с СА-ОПП, диагноз которого установлен только лишь на сниженном темпе диуреза.
Сильные стороны и ограничения
Наше исследование имеет несколько сильных сторон. Во-первых, исследование проведено в большой когорте пациентов, представляющих собой максимальный спектр госпитализаций в отделения интенсивной терапии общегосударственной системы здравоохранения. Популяция исследования представляет общую популяцию Австралии и, вероятно, аналогичную популяцию стран с высоким уровнем дохода. Во-вторых, в нашем исследовании использовался большой массив детальных данных, что извлекались из широко применяемой клинической электронной информационной системы. Все данные были клинически подтверждены, а потери данных были минимальны. В-третьих, даже несмотря на то, что мы использовали новейшее стандартизованное определение СА-ОПП, это определение включает в себе определения ОПП Сепсис-3 и KDIGO, которые уже хорошо зарекомендовали себя в литературе. Следовательно, мы воспользовались возможностью применить хорошо известную технологию при анализе большой базы данных в целях идентификации сепсиса и ОПП.
Мы признаем некоторые ограничения. Первое, выявление сепсиса и ОПП и, тем самым СА-ОПП, было сделано электронным путем, так что в классификации пациентов могли быть сделаны ошибки. Органная дисфункция, выявленная с помощью анализа, могла быть и не вызвана инфекцией. В то же время, наша большая когорта пациентов, вероятно, смогла ограничить влияние такого необычного обстоятельства. Второе, мы не классифицировали СА-ОПП на фенотипы, как это предложено 28 рабочей группой ADQI [8]. Тем самым, наша когорта пациентов с СА-ОПП может представлять различающиеся группы с расходящимися факторами риска и исходами. В плане у нас проведение исследования, в котором основное внимание будет уделено фенотипам. Третье, так как мы не смогли идентифицировать пациентов, которые страдали ХБП до момента госпитализации, это могло привести к завышению оценки ОПП при использовании расчетного уровня креатинина [25]. Это серьезный вопрос, поскольку пациенты с ХБП имеют специфические характеристики и отличающиеся исходы по сравнению с пациентами без ХБП [26]. Но предыдущее исследование, в котором изучались более 3500 аналогичных пациентов из четырех госпиталей, которые вошли в наше исследование, сообщило, что распространение ХБП составило около 13.5% [27]. Изучение пациентов с ХБП потребует сбора дополнительных данных в будущих исследованиях. Четвертое, проверка таких компонентов, как ПЗТ и сывороточный креатинин при MAKE-30 на момент перевода из ОИТ, потенциально могла привести к предвзятости в оценке. И, наконец, условный расчет темпа диуреза мог привести к ошибочной классификации пациентов с ОПП. Но при этом анализ чувствительности показал отсутствие системных различий между группами, а также снижение, а не повышение, диагностики ОПП при условном расчете.
Выводы
В большой когорте критически больных пациентов мы нашли, что СА-ОПП имеет большое распространение у пациентов, поступающих в ОИТ из отделения неотложной помощи и чаще всего диагностируется на день поступления в ОИТ, а также и то, что диагноз сепсиса и ОПП очень часто ставится в один день. Более того, у большинства пациентов с СА-ОПП диагноз ставился на фоне 1 стадии ОПП на основании только низкого темпа диуреза, что редко было ассоциировано со значительным ухудшением почечной функции, как это определяется согласно MAKE-30. Все эти наблюдения предоставляют необходимую эпидемиологическую основу для последующих интервенционных исследований, одновременно подчеркивая необходимость уделять особое внимание специфическим подгруппам пациентов с СА-ОПП.
Список литературы:
1. Finfer S, Machado FR (2016) The global epidemiology of sepsis. Does it matter that we know so little? Am J Resp Crit Care 193(3):228–230
2. Vincent JL, Sakr Y, Sprung CL, Ranieri VM, Reinhart K, Gerlach H et al (2006) Sepsis in European intensive care units and colon; results of the SOAP study and ast. Crit Care Med 34(2):344–353
3. Chiu C, Legrand M (2021) Epidemiology of sepsis and septic shock. Curr Opin Anaesthesiol 34(2):71–76
4. Poston JT, Koyner JL (2019) Sepsis associated acute kidney injury. BMJ 364:k4891
5. Peerapornratana S, Manrique‑Caballero CL, Gómez H, Kellum JA (2019) Acute kidney injury from sepsis: current concepts, epidemiology, pathophysiology, prevention and treatment. Kidney Int 96(5):1083–1099
6. Bagshaw SM, George C, Bellomo R, Committee ADM (2008) Early acute kidney injury and sepsis: a multicentre evaluation. Crit Care 12(2):R47
7. Bagshaw SM, Uchino S, Bellomo R, Morimatsu H, Morgera S, Schetz M et al (2007) Septic acute kidney injury in critically ill patients: clinical characteristics and outcomes. Clin J Am Soc Nephro 2(3):431–439
8. Zarbock A, Nadim MK, Pickkers P, Gomez H, Bell S, Joannidis M et al (2023) Sepsis‑associated acute kidney injury: consensus report of the 28th Acute Disease Quality Initiative workgroup. Nat Rev Nephrol. https://doi.org/10. 1038/s41581‑023‑00683‑3
9. Singer M, Deutschman CS, Seymour CW, Shankar‑Hari M, Annane D, Bauer M et al (2016) The third international consensus definitions for sepsis and septic shock (Sepsis‑3). JAMA 315(8):801–810
10. Khwaja A (2012) KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract 120(4):c179–c184
11. Bagshaw SM, George C, Bellomo R, Committe ADM (2008) A comparison of the RIFLE and AKIN criteria for acute kidney injury in critically ill patients. Nephrol Dial Transpl 23(5):1569–1574
12. Raith EP, Udy AA, Bailey M, McGloughlin S, MacIsaac C, Bellomo R et al (2017) Prognostic accuracy of the SOFA score, SIRS criteria, and qSOFA score for in‑hospital mortality among adults with suspected infection admitted to the intensive care unit. JAMA 317(3):290–300
13. Corrigan C, Duke G, Millar J, Paul E, Butt W, Gordon M et al (2022) Admissions of children and adolescents with deliberate self‑harm to intensive care during the SARS‑CoV‑2 outbreak in australia. Jama Netw Open 5(5):e2211692
14. Kirsi‑Maija K, Michael B, David P, Jamie CD, Rinaldo B (2015) Systemic inflammatory response syndrome criteria in defining severe sepsis. New Engl J Med 372(17):1629–1638
15. Lambden S, Laterre PF, Levy MM, Francois B (2019) The SOFA scoredevelopment, utility and challenges of accurate assessment in clinical trials. Crit Care 23(1):374
16. Seymour CW, Liu VX, Iwashyna TJ, Brunkhorst FM, Rea TD, Scherag A et al (2016) Assessment of clinical criteria for sepsis: for the third international consensus definitions for sepsis and septic shock (Sepsis‑3). JAMA 315(8):762–774
17. Shah AD, MacCallum NS, Harris S, Brealey DA, Palmer E, Hetherington J et al (2021) Descriptors of sepsis using the sepsis‑3 criteria: a cohort study in critical care units within the UK National Institute for Health Research critical care health informatics collaborative. Crit Care Med 49(11):1883–1894
18. Braykov NP, Morgan DJ, Schweizer ML, Uslan DZ, Kelesidis T, Weisenberg SA et al (2014) Assessment of empirical antibiotic therapy optimisation in six hospitals: an observational cohort study. Lancet Infect Dis 14(12):1220–1227
19. Shankar‑Hari M, Phillips GS, Levy ML, Seymour CW, Liu VX, Deutschman CS et al (2016) Developing a new definition and assessing new clinical criteria for septic shock: for the third international consensus definitions for sepsis and septic shock (sepsis‑3). JAMA 315(8):775–787
20. Khanna A, English SW, Wang XS, Ham K, Tumlin J, Szerlip H et al (2017) Angiotensin II for the treatment of vasodilatory shock. New Engl J Medicine 377(5):419–430
21. Inker LA, Eneanya ND, Coresh J, Tighiouart H, Wang D, Sang Y et al (2021) New creatinine‑ and cystatin C‑based equations to estimate GFR without race. New Engl J Med 385(19):1737–1749
22. Cooper DJ, Plewes K, Grigg MJ, Patel A, Rajahram GS, William T et al (2021) An evaluation of commonly used surrogate baseline creatinine values to classify AKI during acute infection. Kidney Int Rep 6(3):645–656
23. Katayama S, Nunomiya S, Koyama K, Wada M, Koinuma T, Goto Y et al (2017) Markers of acute kidney injury in patients with sepsis: the role of soluble thrombomodulin. Crit Care 21(1):229
24. Gameiro J, Gonçalves M, Pereira M, Rodrigues N, Godinho I, Neves M et al (2018) Obesity, acute kidney injury and mortality in patients with sepsis: a cohort analysis. Ren Fail 40(1):120–126
25. Bernier‑Jean A, Beaubien‑Souligny W, Goupil R, Madore F, Paquette F, Troyanov S et al (2017) Diagnosis and outcomes of acute kidney injury using surrogate and imputation methods for missing preadmission creatinine values. Bmc Nephrol 18(1):141
26. Bagshaw SM, Neto AS, Smith O, Weir M, Qiu H, Du B et al (2022) Impact of renal‑replacement therapy strategies on outcomes for patients with chronic kidney disease: a secondary analysis of the STARRT‑AKI trial. Intensive Care Med 48:1736
27. White K, Tabah A, Ramanan M, Shekar K, Edwards F, Laupland KB (2023) 90‑day case‑fatality in critically ill patients with chronic liver disease influenced by presence of portal hypertension, results from a multicentre retrospective cohort study. J Crit Care 1(38):5–10
[DETAIL_PICTURE] =>
[DATE_ACTIVE_FROM] => 08.11.2023
[ACTIVE_FROM] => 08.11.2023
[SHOW_COUNTER] => 1274
)
[PROPERTIES] => Array
(
[KEYWORDS] => Array
(
[ID] => 1
[TIMESTAMP_X] => 2017-07-31 16:04:44
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 100
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 102
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829146
[VALUE] => Сепсис-ассоциированное острое почечное повреждение
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Сепсис-ассоциированное острое почечное повреждение
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[DESCRIPTION] => Array
(
[ID] => 64
[TIMESTAMP_X] => 2017-08-02 11:16:15
[IBLOCK_ID] => 2
[NAME] => Описание
[ACTIVE] => Y
[SORT] => 200
[CODE] => DESCRIPTION
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829148
[VALUE] => Сепсис-ассоциированное острое почечное повреждение
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Сепсис-ассоциированное острое почечное повреждение
[~DESCRIPTION] =>
[~NAME] => Описание
[~DEFAULT_VALUE] =>
)
[BROWSER_TITLE] => Array
(
[ID] => 9
[TIMESTAMP_X] => 2017-08-02 11:18:27
[IBLOCK_ID] => 2
[NAME] => Заголовок окна браузера
[ACTIVE] => Y
[SORT] => 300
[CODE] => BROWSER_TITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => content-articles-property-browser_title
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => Y
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829147
[VALUE] => Сепсис-ассоциированное острое почечное повреждение
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Сепсис-ассоциированное острое почечное повреждение
[~DESCRIPTION] =>
[~NAME] => Заголовок окна браузера
[~DEFAULT_VALUE] =>
)
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829187
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
)
[vote_count] => Array
(
[ID] => 100
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество проголосовавших
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_count
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество проголосовавших
[~DEFAULT_VALUE] =>
)
[vote_sum] => Array
(
[ID] => 101
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Сумма оценок
[ACTIVE] => Y
[SORT] => 500
[CODE] => vote_sum
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Сумма оценок
[~DEFAULT_VALUE] =>
)
[rating] => Array
(
[ID] => 102
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Рейтинг
[ACTIVE] => Y
[SORT] => 500
[CODE] => rating
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => N
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Рейтинг
[~DEFAULT_VALUE] =>
)
[FAVORITES] => Array
(
[ID] => 148
[TIMESTAMP_X] => 2017-09-15 12:05:50
[IBLOCK_ID] => 2
[NAME] => Избранное
[ACTIVE] => Y
[SORT] => 500
[CODE] => FAVORITES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Избранное
[~DEFAULT_VALUE] =>
)
[LIKE] => Array
(
[ID] => 153
[TIMESTAMP_X] => 2017-09-19 10:40:01
[IBLOCK_ID] => 2
[NAME] => Понравилось
[ACTIVE] => Y
[SORT] => 500
[CODE] => LIKE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Понравилось
[~DEFAULT_VALUE] =>
)
[SUBTITLE] => Array
(
[ID] => 93
[TIMESTAMP_X] => 2017-08-22 15:43:39
[IBLOCK_ID] => 2
[NAME] => Подзаголовок
[ACTIVE] => Y
[SORT] => 501
[CODE] => SUBTITLE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Подзаголовок
[~DEFAULT_VALUE] =>
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829155
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
)
[QUOTE] => Array
(
[ID] => 95
[TIMESTAMP_X] => 2017-08-22 16:30:23
[IBLOCK_ID] => 2
[NAME] => Цитата
[ACTIVE] => Y
[SORT] => 503
[CODE] => QUOTE
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Цитата
[~DEFAULT_VALUE] =>
)
[SLIDER] => Array
(
[ID] => 98
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] => jpg, gif, bmp, png, jpeg
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер
[~DEFAULT_VALUE] =>
)
[SLIDER_DESC] => Array
(
[ID] => 99
[TIMESTAMP_X] => 2017-08-23 13:50:37
[IBLOCK_ID] => 2
[NAME] => Слайдер описание
[ACTIVE] => Y
[SORT] => 503
[CODE] => SLIDER_DESC
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Слайдер описание
[~DEFAULT_VALUE] =>
)
[INFO_SOURCES] => Array
(
[ID] => 96
[TIMESTAMP_X] => 2017-08-23 10:51:22
[IBLOCK_ID] => 2
[NAME] => Информация и источники
[ACTIVE] => Y
[SORT] => 504
[CODE] => INFO_SOURCES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Информация и источники
[~DEFAULT_VALUE] =>
)
[MATERIALS] => Array
(
[ID] => 97
[TIMESTAMP_X] => 2017-08-23 11:05:12
[IBLOCK_ID] => 2
[NAME] => Материалы к статье
[ACTIVE] => Y
[SORT] => 505
[CODE] => MATERIALS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => Y
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Материалы к статье
[~DEFAULT_VALUE] =>
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829150
[1] => 829151
[2] => 829152
[3] => 829153
[4] => 829154
)
[VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => 45645645
[3] => intensivnayaterapiya
[4] => Острое повреждение почек
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => 45645645
[3] => intensivnayaterapiya
[4] => Острое повреждение почек
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
)
[COMMENTS_COUNT] => Array
(
[ID] => 103
[TIMESTAMP_X] => 2017-08-29 13:04:27
[IBLOCK_ID] => 2
[NAME] => Количество комментариев
[ACTIVE] => Y
[SORT] => 5010
[CODE] => COMMENTS_COUNT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Количество комментариев
[~DEFAULT_VALUE] =>
)
[FB2] => Array
(
[ID] => 173
[TIMESTAMP_X] => 2017-10-12 14:43:36
[IBLOCK_ID] => 2
[NAME] => FB2
[ACTIVE] => Y
[SORT] => 5020
[CODE] => FB2
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] => fb2
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => FB2
[~DEFAULT_VALUE] =>
)
[ADD_DATES] => Array
(
[ID] => 207
[TIMESTAMP_X] => 2018-05-11 11:01:14
[IBLOCK_ID] => 2
[NAME] => Дата добавления материалов
[ACTIVE] => Y
[SORT] => 5030
[CODE] => ADD_DATES
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => Date
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата добавления материалов
[~DEFAULT_VALUE] =>
)
[LENGHT] =>
[VIDEO_PREVIEW] =>
[VIDEO_FULL] =>
)
[DISPLAY_PROPERTIES] => Array
(
[MAIN] => Array
(
[ID] => 65
[TIMESTAMP_X] => 2017-08-02 11:18:51
[IBLOCK_ID] => 2
[NAME] => Показывать на главной странице
[ACTIVE] => Y
[SORT] => 500
[CODE] => MAIN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => L
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => C
[MULTIPLE] => N
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 829187
[VALUE] => да
[DESCRIPTION] =>
[VALUE_ENUM] => да
[VALUE_XML_ID] => Y
[VALUE_SORT] => 500
[VALUE_ENUM_ID] => 1
[~VALUE] => да
[~DESCRIPTION] =>
[~NAME] => Показывать на главной странице
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => да
)
[AUTHOR] => Array
(
[ID] => 94
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Автор
[ACTIVE] => Y
[SORT] => 502
[CODE] => AUTHOR
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 1
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => UserID
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829155
)
[VALUE] => Array
(
[0] => 8
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 8
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Автор
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => [8] (info@sepsisforum.ru) Команда Сепсис Форума
)
[SUBJECTS] => Array
(
[ID] => 66
[TIMESTAMP_X] => 2017-09-07 12:12:40
[IBLOCK_ID] => 2
[NAME] => Тематика
[ACTIVE] => Y
[SORT] => 1000
[CODE] => SUBJECTS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] =>
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => directory
[USER_TYPE_SETTINGS] => Array
(
[size] => 1
[width] => 0
[group] => N
[multiple] => N
[TABLE_NAME] => b_hlbd_subjects
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 829150
[1] => 829151
[2] => 829152
[3] => 829153
[4] => 829154
)
[VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => 45645645
[3] => intensivnayaterapiya
[4] => Острое повреждение почек
)
[DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => statia
[1] => sepsis
[2] => 45645645
[3] => intensivnayaterapiya
[4] => Острое повреждение почек
)
[~DESCRIPTION] => Array
(
[0] =>
[1] =>
[2] =>
[3] =>
[4] =>
)
[~NAME] => Тематика
[~DEFAULT_VALUE] =>
[DISPLAY_VALUE] => Array
(
[0] => Статья
[1] => Сепсис
[2] => Функция почек
[3] => Интенсивная терапия
[4] => Острое повреждение почек
)
)
)
[IBLOCK] => Array
(
[ID] => 2
[~ID] => 2
[TIMESTAMP_X] => 26.08.2022 14:38:28
[~TIMESTAMP_X] => 26.08.2022 14:38:28
[IBLOCK_TYPE_ID] => articles
[~IBLOCK_TYPE_ID] => articles
[LID] => s1
[~LID] => s1
[CODE] => articles
[~CODE] => articles
[API_CODE] =>
[~API_CODE] =>
[NAME] => Статьи
[~NAME] => Статьи
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 200
[~SORT] => 200
[LIST_PAGE_URL] => /library/articles/
[~LIST_PAGE_URL] => /library/articles/
[DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[~DETAIL_PAGE_URL] => /library/articles/#ELEMENT_CODE#/
[SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[~SECTION_PAGE_URL] => /articles/#SECTION_CODE#/
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] => Статьи
[~DESCRIPTION] => Статьи
[DESCRIPTION_TYPE] => html
[~DESCRIPTION_TYPE] => html
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] => content-articles
[~XML_ID] => content-articles
[TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[~TMP_ID] => 79a4a50658ff380feeea3c1c690acaa8
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => Y
[~INDEX_SECTION] => Y
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => Y
[~SECTION_PROPERTY] => Y
[PROPERTY_INDEX] => I
[~PROPERTY_INDEX] => I
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] => Разделы статей
[~SECTIONS_NAME] => Разделы статей
[SECTION_NAME] => Раздел статей
[~SECTION_NAME] => Раздел статей
[ELEMENTS_NAME] => Статьи
[~ELEMENTS_NAME] => Статьи
[ELEMENT_NAME] => Статья
[~ELEMENT_NAME] => Статья
[REST_ON] => N
[~REST_ON] => N
[EXTERNAL_ID] => content-articles
[~EXTERNAL_ID] => content-articles
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => sepsisforum.ru
[~SERVER_NAME] => sepsisforum.ru
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Сепсис-ассоциированное острое почечное повреждение в отделении интенсивной терапии: частота, характеристики пациентов, сроки развития, лечение и ассоциированные исходы: многоцентровое, обсервационное исследование
[BROWSER_TITLE] => Сепсис-ассоциированное острое почечное повреждение
[KEYWORDS] => Сепсис-ассоциированное острое почечное повреждение
[DESCRIPTION] => Сепсис-ассоциированное острое почечное повреждение
)
)





